Предлагаемое изобретение относится к области экспериментальной медицины, а именно к травматологии и нейрохирургии. Главным предназначением предлагаемого гидрогеля является замещение им посттрепанационного дефекта черепа различного генеза, с последующим развитием собственной костной ткани пациента на основе имплантата.
В настоящее время в медицине остро стоит проблема лечения больных с посттрепанационными дефектами черепа. Ежедневно во всем мире выполняют тысячи резекционных и костно-пластических трепанаций черепа. Показаниями для данного вида оперативного вмешательства являются: операции по поводу вдавленных переломов костей черепа, ликвидация последствий черепно-мозговых травм, инсультов, удаление гематом и устранение источников кровотечения, операбельные опухоли головного мозга, мозговые грыжи, гидроцефалия и другая патология (А.А. Потапов, В.Н. Корниенко, А.Д. Кравчук, Л.Б. Лихтерман. Современные технологии в хирургическом лечении последствий травмы черепа и головного мозга // Вестник РАМН. 2012. №9. С. 31-32.).
Многие клиники мира накопили большой опыт в устранении дефектов костей черепа. Однако до сих пор существуют определенные сложности в оперативном лечении. Трудности возникают при подборе метода реконструкции дефекта черепа, оптимальных сроков проведения операции, особенно при выборе имплантата для трансплантации (А.А. Потапов, В.Н. Корниенко, А.Д. Кравчук, Л.Б. Лихтерман. Современные технологии в хирургическом лечении последствий травмы черепа и головного мозга // Вестник РАМН. 2012. №9 С.31-32.). На данный момент в хирургии для пластики посттрепанационного дефекта черепа (краниопластики) используют следующие материалы (С.Е. Тихомиров, С.Н. Цыбусов, Л.Я. Кравец, А.П. Фраерман. Пластика дефектов свода черепа и твердой мозговой оболочки новым полимерным материалом Реперен // СТМ. 2010 - 2 С. 7-8):
1. Биологического происхождения:
а) аутогенные ткани - собственный, удаленный во время операции костный материал пациента;
б) аллогенные ткани («гомоткань») - материалы биологической природы, прошедшие специальную обработку: трупная кость и твердая мозговая оболочка;
в) ксеногенные ткани - материалы, взятые от животных других видов, используются крайне редко, что обусловлено высокой антигенностью и риском отторжения.
2. Небиологического происхождения органической и неорганической природы - эксплантаты («аллопластический материал», «имплантаты»):
а) полимеры («Реперен» и другие);
б) металлы (никелид титана);
в) керамика («Протакрил-М», «Palacos»).
Однако традиционные материалы имеют ряд существенных недостатков. Краниопластика аутогенным или аллогенным костным лоскутом имеет ограниченное применение в связи со сложностями интраоперационной модуляции трансплантата по форме дефекта, трудностями в хранении и консервации кости.
Полимеры, не подверженные резорбции, вполне могут стать «укромным местом» для инфекции, что может привести к возникновению гнойно-воспалительного процесса в области имплантата и повышенному риску воспалительных осложнений.
Металлические пластины обладают высокой теплопроводностью и электропроводимостью, инициируют электролитические процессы в окружающих тканях; имеют высокую стоимость (С.Е. Тихомиров, С.Н. Цыбусов, Л.Я. Кравец, А.П. Фраерман. Пластика дефектов свода черепа и твердой мозговой оболочки новым полимерным материалом Реперен // СТМ. 2010 - №2. - С. 7-8.).
В конечном керамическом имплантате остаются непрореагировавшие вещества, которые после имплантации постепенно выходят в окружающие ткани, оказывая специфическое воздействие; керамика имеет микропоры, при попадании в которые бактерий возможно возникновение очагов хронической инфекции (Пятикоп В.А., Мороз И.С., Тарасенко В.И., Бабалян Ю.А. Краниопластика дефектов костей с дифференцированным применением имплантатов // Украинский нейрохирургический журнал. №3. 2011. С.23-24).
В настоящее время в травматологии и ортопедии наблюдается тенденция к росту использования биодеградируемых материалов (БДМ), история применения имплантатов из которых насчитывает более 25 лет. Специалисты широко обсуждают перспективы использования БДМ в стабилизации переломов, трансплантации и фиксации костей и других анатомических структур. В качестве БДМ в настоящее время используют полигликолевую кислоту (PGA), полимолочную кислоту (PLA), а также их комбинации (А.В. Волков. Синтетические материалы на основе полимеров органических кислот в тканевой инженерии// Клеточная трансплантология и тканевая инженерия. №2. 2005. С.43-45). Свое применение PGA и PLA нашли как синтетический биодеградируемый шовный материал, также их используют в качестве пинов, винтов и пластин для травматологии и ортопедии. (Б.В. Хонинов, О.Н. Сергунин, П.А. Скороглядов. Возможности применения биодеградируемых материалов в травматологии и ортопедии (обзор литературы) // Вестник РГМУ. 2014. №1. С.20-21).
За ближайший аналог принята барьерная мембрана на основе альгината натрия и октакальциевого фосфата (А.Н. Гурин, А.Ю. Федотов, Р.В. Деев, B.C. Комлев. Направленная регенерация костной ткани с использованием барьерной мембраны на основе альгината натрия и октакальциевого фосфата // Клеточная трансплантология и тканевая инженерия. Том VIII. №4. 2013. С. 1-8). Ее недостатками являются: сложность технологии получения, хрупкость получившегося имплантата, трудности с колонизацией клетками пластинок имплантата толщиной более 3 мм.
Задачи:
1) Получение гидрогеля, пригодного для регенерации собственной костной ткани;
2) Упростить технологию получения материала для краниопластики;
3) Повышение эффективности лечения посттрепанационных дефектов черепа.
Сущностью предлагаемого изобретения является гидрогель для коррекции посттрепанационного дефекта черепа, содержащий альгинат натрия, отличающийся тем, что дополнительно содержит поливиниловый спирт, силикат натрия или калия, полимеризующийся под влиянием глюконата кальция, D-аспарагин и воду, при следующем соотношении компонентов, масс. %:
- Альгинат натрия -5-10,
- Поливиниловый спирт - 0,5-5,0,
- D-аспарагин - 0,01-1,0,
- Силикат натрия или силикат калия - 0,01-0,5,
- Глюконат кальция - 1,0,
- Высокоочищенная вода - остальное.
Разброс массовых долей компонентов препарата обусловлен различием требований, предъявляемых к структурным и механическим характеристикам имплантата, зависящим преимущественно от требуемой площади закрытия дефекта черепа. Повышение содержания альгината натрия в пределах предложенных масс. % позволяет увеличить плотность, прочность и время рассасывания имплантата. Повышение содержания поливинилового спирта в пределах предложенных масс. % позволяет увеличить плотность, прочность, упруго-эластические свойства, время рассасывания, сократить ячеистость имплантата.
4
С ростом содержания D-аспарагина, обладающего антипролиферативными свойствами, увеличивается временной отрезок от имплантации гидрогелевого имплантата до заселения его клетками, что предотвращает его инкапсуляцию соединительнотканной оболочкой.
С ростом содержания силиката натрия (или силиката калия) в имплантате, увеличивается содержание кремниевых кислот, которые повышают прочность и значительно продлевают время существования скаффолда.
По мере увеличения содержания глюконата кальция, по отношению к альгинату натрия, в пределах предложенных масс. %, растет степень полимеризации альгината натрия, при этом увеличивается плотность, прочность и время рассасывания имплантата.
Увеличение содержания высокоочищенной воды от до 93,48 масс. % повышает текучесть смеси полимеров состоящей из альгината натрия и поливинилового спирта, что упрощает технологию получения геля и введение в его состав модифицирующих добавок (силиката натрия или калия, D-аспарагина и глюконата кальция).
Преимуществом изобретения являются простота приготовления; легкость модуляции пластинки геля под имеющийся дефект черепа; мелкоячеистая структура геля, в связи с которой клетки могут проникать и заселяться на глубину 3 мм и более, что делает возможным использование имплантатов большей толщины; структура пластинки геля упруго-эластичная, прочная. Комбинация именно таких ингридиентов позволяет расширить объем решаемых задач.
Техническим результатом изобретения является также коррекция посттрепанационного дефекта черепа гидрогелевым имплантатом на основе альгината натрия, поливинилового спирта, D-аспарагина, силиката натрия (или силиката калия) и глюконата кальция, что проявляется на 40-е сутки появлением признаков регенерации клеточных элементов костной ткани.
Таким образом, применение имплантатов на основе предлагаемой комбинации компонентов, на основе альгината натрия и поливинилового спирта модифицированного силикатом натрия (или силикатом калия) с добавкой D-аспарагина и глюконата кальция перспективно для разработки нового способа лечения посттрепанационных дефектов черепа.
Основными компонентами гидрогеля являются альгинат натрия, поливиниловый спирт, силикат натрия (или силикат калия), глюконат кальция и D-аспарагин.
Натрия альгинат - Химическая формула: (C6H7O6Na)n. Представляет собой соль альгиновой кислоты, натуральный полисахарид, добываемый из красных и бурых морских водорослей. В готовом виде он выглядит как светло-бежевый порошок, прекрасно впитывающий воду. Именно гигроскопичность натрия альгината позволяет эффективно использовать его в качестве удерживающего влагу агента, а также гелеобразователя, стабилизатора и вещества для капсулирования лекарств.
Поливиниловый спирт - искусственный, водорастворимый, термопластичный полимер. Химическая формула: (С2Н4O)х. Повышает эластические, прочностные свойства, снижает размер ячеек в имплантате.
Силикат натрия - Химическая формула: Na2SiO3. Представляет собой белый мелкодисперсный порошок без определенного вкуса и запаха. Растворяясь в воде, образует вязкий раствор. В разбавленных растворах силикат натрия распадается на анионы кремниевой кислоты и катионы натрия. Под действием на силикат натрия кислот образуются кремниевые кислоты, степень полимеризации которых зависит от условий протекания химической реакции.
Силикат калия - Химическая формула: K2SiO3. Представляет собой белый мелкодисперсный гигроскопичный порошок без определенного вкуса и запаха. Растворяясь в воде, образует вязкий раствор. В разбавленных растворах силикат калия распадается на анионы кремниевой кислоты и катионы калия. Под действием на силикат калия кислот образуются кремниевые кислоты, степень полимеризации которых зависит от условий протекания химической реакции.
Глюконат кальция - Химическая формула: С12Н22СаO14, кальциевая соль глюконовой кислоты. Представляет собой белый мелкодисперсный кристаллический порошок без определенного вкуса и запаха, хорошо растворимый в воде. При взаимодействии с растворами альгината натрия вызывает его полимеризацию и образование геля.
D - аспарагин - Химическая формула D-аспарагина: C4H8N2O3. D-аспарагин представляет собой белый кристаллический порошок без запаха, растворимый в воде, химическое название - правовращающий изомер моноамида аспарагиновой кислоты. Является антипролиферативной добавкой, предотвращающей формирование фиброзной капсулы вокруг имплантированного скаффолда (Читанава Т.В. Влияние D-аспарагина на формирование глиального рубца при экспериментальном спинальном инсульте // В сборнике: Медицинская наука и здравоохранение. - 2016. - С.37-39). После имплантации спустя 2 недели D-аспарагин выводится из имплантата и гидрогель начинает заселяться клетками близлежащей ткани.
Высокоочищенная вода является растворителем для гелеобразователей (альгината натрия и поливинилового спирта), а также модифицирующих добавок (силиката натрия (калия), D-аспарагина и глюконата кальция).
Препарат получают путем прибавления к смеси из порошков 5-10 г альгината натрия, 0,5-5,0 г поливинилового спирта и 0,5-1 г D-аспарагина, высокоочищенной воды с тем, чтобы довести массу получившейся смеси до 60 г. Процесс проводят при 50°С и постоянном помешивании в стакане верхнеприводной мешалки в течение часа, затем полученную мутную вязкую жидкость выдерживают в термостате при 50°С в течение суток (до просветления). К полученной смеси, при комнатной температуре и постоянном перемешивании, добавляют 30 г 0,05-1% (по массе) раствора силиката натрия (или силиката калия) на высокоочищенной воде. Затем разливают полученную жидкость в чашки Петри слоем толщиной в 3 мм и охлаждают до 4°C. Поверх слоя охлажденной смеси, осторожно наслаивают 10 г 1% (по массе) раствора глюконата кальция на высокоочищенной воде, выдерживают сутки при 4°C, затем - в морозильной камере 12 часов при -25°C, после разморозки препарат готов к использованию.
Препарат апробирован на 20 нелинейных крысах средней массой -282±25 гр. Все потенциально болезненные оперативные вмешательства сопровождались использованием золетил-ксилазинового наркоза по следующей схеме: золетил 0,3 мг в/м («Virbac» Франция), ксиланит 0,8 мг в/м (ЗАО «НИТА-ФАРМ, Россия, г. Саратов), атропина сульфат 0,1% раствор -0.01 мл п/к из расчета на 100 гр. массы тела животного (Трофименко А.И. Моделирование церебральной ишемии посредством коагуляции средней мозговой артерии у крыс / А.И. Трофименко, А.Х. Каде, В.П. Лебедев [и соавт.] // Фундаментальные исследования. - 2012. - №2. - Ч. 1. - С. 215-218). Имплантацию гидрогеля проводили в форме пластинок размером 5-8 мм в диаметре и 3 мм в толщину.
Описание техники операции: кпереди от ушных раковин, вдоль срединной линии проводят разрез кожи длиной 20 мм. Поверхность теменной кости черепа зачищают вплоть до надкостницы. С использованием микромотора с прямым наконечником и шаровидного бора, в теменной кости, латерально от сагиттального шва черепа, высверливают отверстие диаметром 5-8 мм, на поверхность твердой мозговой оболочки помещают пластинку исследуемого, подготовленного заранее, гидрогеля (имплантат). Раневую поверхность ушивают монофиламентной атравматической шелковой нитью (USP 5-0). После проведения эвтаназии на 40 сутки, вырезанный фрагмент теменной кости черепа помещают в 10% нейтральный забуференный фосфатами раствор параформальдегида. Декальцинацию проводят в течение 5 суток с использованием смеси цитрата натрия и муравьиной кислоты по Evans&Krajian. По завершении декальцинации проводят вырезку образцов, проводку через изопропанол-минеральное масло с последующей заливкой в парафин. Парафиновые блоки нарезают на срезы толщиной 10 мкм на микротоме МПС-2 (СССР). Окрашивание микропрепаратов проводят гематоксилином и эозином. Для фотографии микропрепаратов использовали микроскоп Микмед-5 (Россия) и окулярную камеру Levenhuk-230 (США). На полученных микропрепаратах провели оценку результатов.
При исследовании микропрепаратов образцов черепа с зоной имплантата, забранных на 40 сутки после имплантации, по периферии образца выявлено строение, характерное для кости черепа крысы в поперечном срезе, в центре располагается эозинофильное вещество имплантата с врастающими в него из зоны близлежащей кости клетками, морфологически сходными с клетками костной ткани (см. рис. 1 при увеличении Х10, окраска гематоксилин - эозином).
Пример 1. Нелинейный самец крысы массой - 302 гр. был прооперирован с использованием золетил-ксилазинового наркоза следующим образом: кпереди от ушных раковин, вдоль срединной линии проведен разрез кожи длиной 20 мм. Обнажившуюся поверхность теменной кости черепа зачистили вплоть до надкостницы. Затем, отступя латеральнее от сагиттального шва в теменной кости, высверливали отверстие диаметром 5-8 мм, куда имплантировали пластинку гидрогеля размером 8 мм в диаметре и 3 мм в толщину. После эвтаназии на 40 сутки, вырезанный фрагмент теменной кости черепа с имплантатом поместили в 10% нейтральный забуференный фосфатами раствор параформальдегида. Затем провели декальцинацию в течение 5 суток по Evans&Krajian, после - вырезку образцов, проводку через изопропанол-минеральное масло с последующей заливкой в парафин. Парафиновые блоки нарезали на срезы толщиной 10 мкм на микротоме МПС-2 (СССР). Окрашивание микропрепаратов проводили гематоксилином и эозином. Для фотографии микропрепаратов использовали микроскоп Микмед-5 (Россия) и окулярную камеру Levenhuk-230 (США).
При исследовании микропрепаратов образцов черепа забранных на 40 сутки после имплантации по периферии образца выявлено строение, характерное для кости черепа крысы в поперечном срезе, в центре видно эозинофильное вещество имплантата с врастающими в него из зоны близлежащей кости клетками, морфологически сходными с клетками костной ткани (см. рис. 1 при увеличении Х10, окраска гематоксилин - эозином).
Использование имплантата, изготовленного из геля на основе альгината натрия, поливинилового спирта и силиката натрия (калия) с добавками глюконата кальция и D-аспарагина для закрытия посттрепанационного дефекта черепа к 40 суткам эксперимента сопровождается прорастанием в область имплантата клеток морфологически сходных с клетками костной ткани.
| название | год | авторы | номер документа |
|---|---|---|---|
| Гидрогель для замещения дефектов биологических тканей | 2017 |
|
RU2643922C1 |
| Способ профилактики пролиферативной витриоретинопатии, развивающейся при отслойке сетчатки в эксперименте на крысах | 2018 |
|
RU2689324C1 |
| Препарат для предотвращения образования глиальных рубцов | 2017 |
|
RU2651756C1 |
| Способ коррекции гипогонадизма у животных при моделировании острого повреждения спинного мозга | 2017 |
|
RU2689114C2 |
| Композиция для профилактики и лечения воспалительных заболеваний полости рта | 2019 |
|
RU2716501C1 |
| Гидрогель для регенерации пульпы зуба и периодонта | 2019 |
|
RU2700933C1 |
| ФИКСАТОР ПРОБ ДЛЯ ЦИТОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ | 2016 |
|
RU2630983C1 |
| Средство для профилактики образования патологических кожных рубцов | 2018 |
|
RU2691647C1 |
| Способ создания модели для изучения физиологии и патологии пренатального периода онтогенеза на курином эмбрионе | 2018 |
|
RU2701387C1 |
| Регенеративный материал соединительных тканей, способ получения регенеративного материала, применение регенеративного материала, имплантат | 2018 |
|
RU2788658C2 |
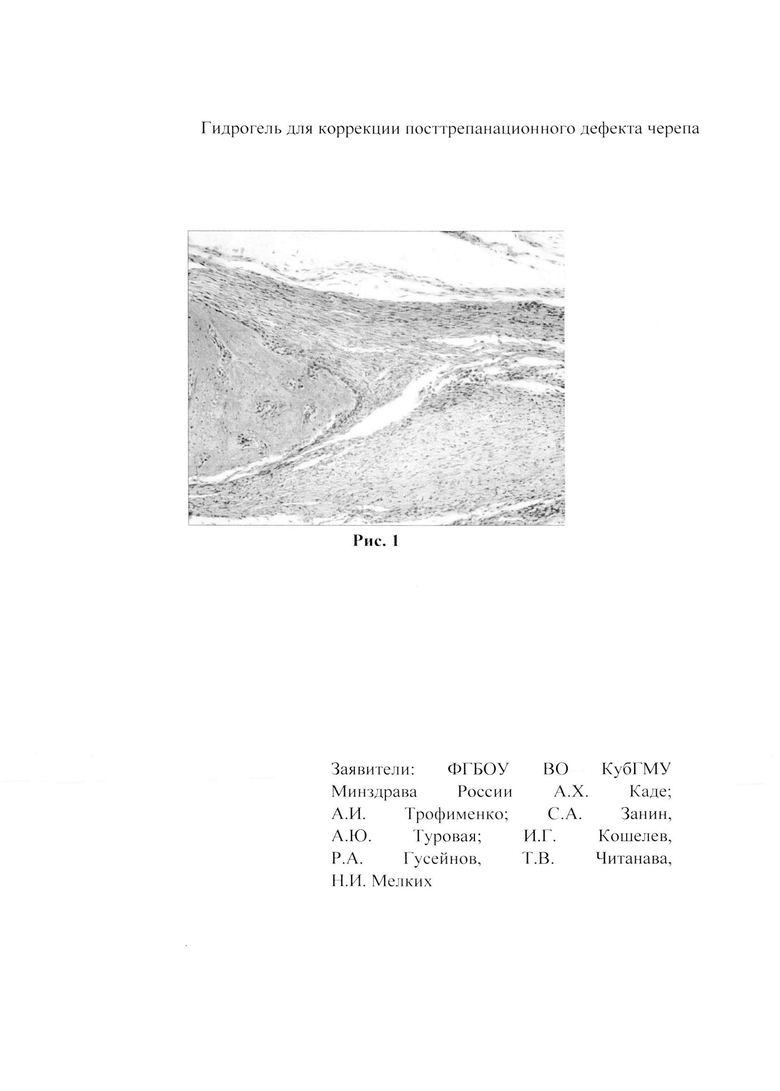
Изобретение относится к области экспериментальной медицины, а именно к тканевой инженерии, и может быть использовано в нейрохирургии и травматологии. Описан гидрогель, содержащий, масс. %: альгинат натрия - 5-10; поливиниловый спирт - 0,5-5; D-аспарагин - 0,01-1,0; силикат натрия или силикат калия - 0,05-1,0; глюконат кальция - 1,0; высокоочищенная вода - доводят до 100% смеси по массе. Препарат позволяет получить на 40-е сутки после имплантации в область трепанационного дефекта теменной кости крысы биодеградируемый каркас, в котором отмечаются признаки врастания клеточных элементов костной ткани. 1 ил., 1 пр.
Гидрогель для коррекции посттрепанационного дефекта черепа, содержащий альгинат натрия, отличающийся тем, что дополнительно содержит поливиниловый спирт, силикат натрия или калия, полимеризующийся под влиянием глюконата кальция, D-аспарагин и воду, при следующем соотношении компонентов, масс. %:
| А.Н | |||
| ГУРИН и др | |||
| Направленная регенерация костной ткани с использованием барьерной мембраны на основе альгината натрия и октакальциевого фосфата, Клеточная трансплантология и тканевая инженерия, т | |||
| VIII, N 4, 2013, с | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| СПОСОБ РЕГЕНЕРАЦИИ ТКАНИ | 2004 |
|
RU2392314C2 |
| БИОАКТИВНЫЙ РЕЗОРБИРУЕМЫЙ ПОРИСТЫХ 3D-МАТРИКС ДЛЯ РЕГЕНЕРАТИВНОЙ МЕДИЦИНЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2533457C1 |
Авторы
Даты
2018-09-11—Публикация
2017-09-26—Подача