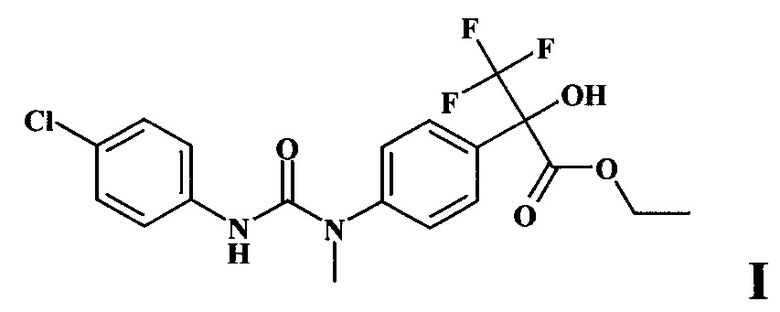
Изобретение относится к биологически активному производному диарилмочевины для использования в сельском хозяйстве, а именно к этиловому эфиру 2-{4-[3-(4-хлорфенил)-1-метилуреидо]фенил}-2-гидрокси-3,3,3-трифторпропионовой кислоты формулы I:
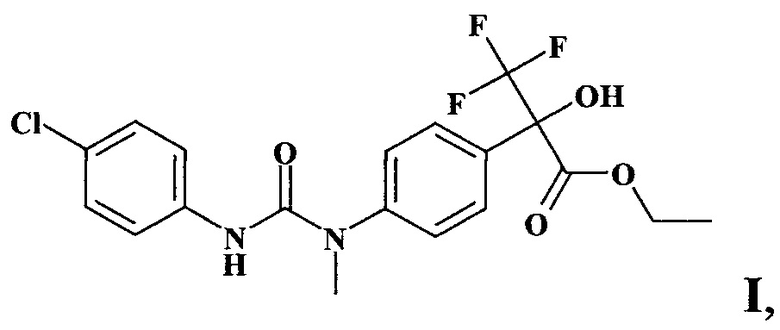
которое применимо в качестве антидота по отношению к гербициду метсульфуронметилу для защиты сельскохозяйственных растений от токсического действия его остатков в почве.
Наиболее эффективно изобретение может быть использовано для защиты рапса, путем предпосевной обработки семян заявляемым соединением.
Соединение формулы I, его химические, физические и биологические свойства в патентной и научно-технической литературе не описаны.
В сельскохозяйственном производстве России широко используются гербициды нового поколения - производные сульфонилмочевины, которые обладают уникальной фитотоксичностью и сохраняют гербицидную активность в почве в течение длительного времени. Эти гербициды более 20 лет используются для борьбы с сорняками в посевах практически всех основных сельскохозяйственных культур во многих регионах РФ, их широкое применение привело к возникновению в растениеводстве новой проблемы - экологических последствий их использования. Систематическое применение таких гербицидов привело к загрязнению их остатками до 22% почв сельскохозяйственных регионов, что составляет более 17 млн га. Ежегодный ущерб урожаю таких культур, как рапс, с особенно высокой чувствительностью к остаткам сульфонилмочевин в почве, достигает 20% и более [Спиридонов Ю.Я. Научно-практическое обоснование успешной борьбы с сорняками на современном этапе. Мат. Междунар. научно-практической конференции «Современные проблемы гербологии и оздоровления почв», посвященной 85-летию со дня рождения Д.И. Чканикова (21-23 июня 2016 г., Московская обл., Большие Вяземы, ВНИИ фитопатологии): 2016, с. 118-136]. Современные гербициды не обладают высокой избирательностью по отношению к культурным растениям и сорнякам и могут оказывать токсическое действие на культурные растения. Применение антидотов (сейфнеров) гербицидов устраняет или снижает токсическое действие гербицидов на культурное растение [Спиридонов В.Я., Хохлов П.С., Шестаков В.Г. Антидоты гербицидов. Агрохимия, 2009, №5, с. 81-91].
В настоящее время в рекомендациях по выращиванию рапса отсутствуют данные о применении каких-либо антидотов, способных эффективно снижать токсическое действие гербицидов из ряда сульфонилмочевин, содержащихся в почве.
Известен антидот, представляющий собой 1,8-нафталевый ангидрид (НА), который проявляет антидотную активность по отношению к некоторым производным сульфонилмочевин на кукурузе, яровой пшенице и рапсе [Патент РФ №2585858, 2016; Питана М.Р., Познанская Н.Л. Использование антидотов как путь экологически безопасного применения гербицидов на основе сульфонилмочевин. Агрохимия, 1994, №4, с. 114-120]. Однако доза 1,8-нафталевого ангидрида, при которой он проявляет антидотную активность, существенно выше 100 г/т семян. Такая доза приводит к загрязнению посевов и почвы.
Известен антидот фурилазол - (RS)-3-дихлорацетил-5-(2-фурил)-2,2-диметилоксазолидин, который производит компания Monsanto [ЕР №0435840 А2]. Фурилазол (ФА) используется в смеси с гербицидами при опрыскивании посевов кукурузы. Кроме того, показано, что ФА обладает заметной антидотной активностью в отношении гербицидов класса сульфонилмочевин, находящихся в почве, и может использоваться для обработки семян кукурузы [Голубев А.С., Коротов Н.А., Федоровский О.Ю., Спиридонов Ю.Я., Чкаников Н.Д., Агрохимия, 2017, №4, с. 26-31].
Известен препарат Альбит, который в сочетании с гербицидами и/или инсектицидами проявляет антидотную активность на рапсе, при этом прибавка урожая составляет от 15,5 до 28,3% [Злотников А.К. Земледелие, 2009, №2, с. 40-41].
Наиболее близким по структуре к заявляемому соединению I является производное диарилмочевины формулы II (этиловый эфир 2-{4-[3-(3-хлорфенил)-1-метилуреидо]фенил}-2-гидрокси-3,3,3-трифтор-пропионовой кислоты) [Патент РФ №1804056, 1996].
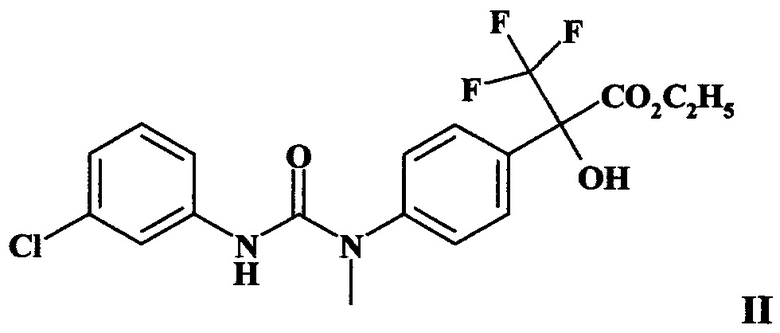
Соединение II проявляет антидотную активность по отношению к гербициду хлорсульфурону только на посевах льна, и его можно применять для защиты посевов льна от повреждения остаточными количествами указанного гербицида. Показано, что обработка семян льна соединением II в дозе 100 г/т семян ослабляет токсическое действие хлорсульфорона на растения и приводит к увеличению массы растений на 60% [Патент РФ №1804056, 1996]. Данных о проявлении антидотной активности соединения II на других культурах, например на рапсе, и для защиты растений от действия других гербицидов в литературе не имеется.
Задача изобретения - создание нового высокоэффективного антидота, способного в минимальных дозах защищать рапс от токсического действия остатков гербицидов класса сульфонилмочевин в почве.
Задача решается новым антидотом - этиловым эфиром 2-{4-[3-(4-хлорфенил)-1-метилуреидо]фенил}-2-гидрокси-3,3,3-трифторпропионовой кислоты формулы I
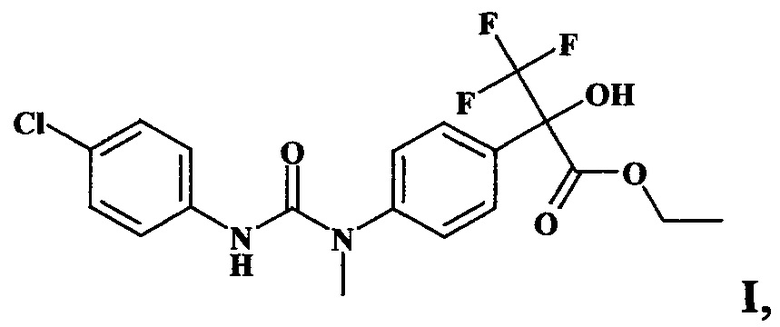
обладающим антидотной активностью в отношении метсульфуронметила (гербицид из ряда сульфонилмочевин) на рапсе, способом получения заявляемого соединения и применением его в качестве антидота метсульфуронметила путем предпосевной обработки семян рапса в дозе 1 г/т семян.
Способ получения соединения I включает взаимодействие гидрохлорида этилового эфира 2-гидрокси-3,3,3-трифторметил-2-(4-метиламинофенил)пропионовой кислоты (торговое название «флороксан» [Патент РФ 2369094, 2009]) с пара-хлорфенилизоцианатом в присутствии пиридина в дихлорметане (ДХМ) при температуре 20-25°C.
Соединение I получают по следующей схеме:
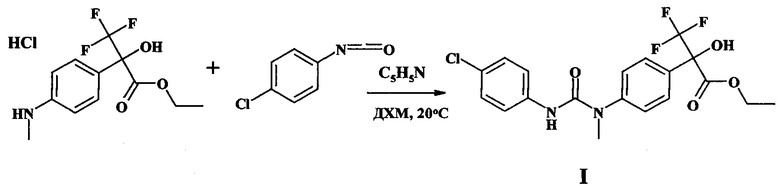
Реакцию проводят в сухом дихлорметане в течение двух часов, соединение I получают с выходом 69%. Структура соединения I доказана ЯМР-спектроскопией и масс-спектрометрией. Заявляемое соединение I представляет собой белый кристаллический порошок, устойчивый при хранении при 20-25°C, ограниченно растворимый в воде, хорошо растворимый в спирте, ацетоне, хлороформе.
Изучено антидотное действие соединения I по отношению к гербициду «Зингер СП» (АО Щелково-Агрохим) - действующее вещество метсульфуронметил. Оценку антидотной активности соединения I проводили в лаборатории искусственного климата в камерах «Фетч» (ГДР) на загрязненных почвах в посевах ярового рапса сорта «Ратник» (см. таблицу). Исследования проводили при дозе антидотов 1 г/т семян при загрязнении почвы гербицидом в дозе 1 г/га. В контрольном опыте семена, не обработанные антидотом, высевали в почву, зараженную гербицидом в дозе 1 г/га.
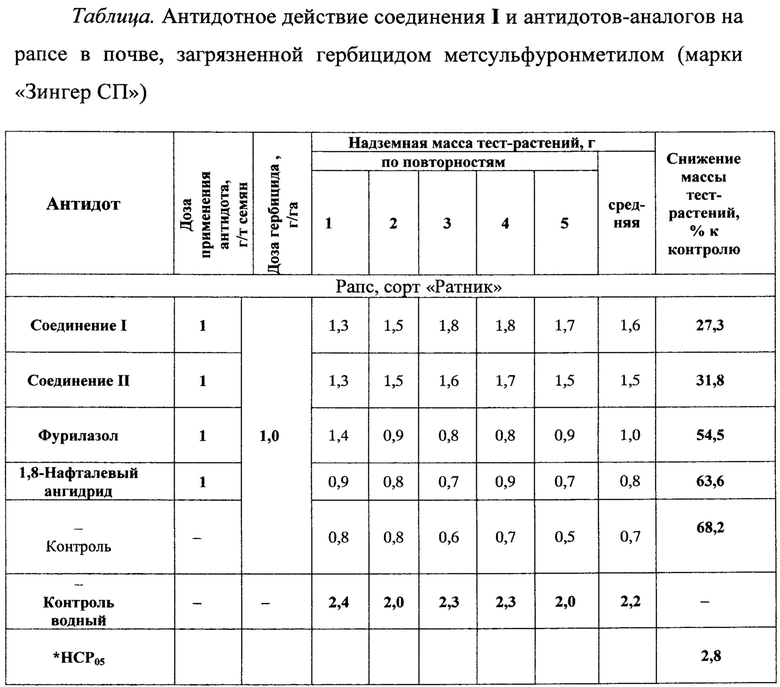
* НСР05 - наименьшая существенная разность.
Оказалось, что предпосевная обработка семян рапса соединением формулы I в дозе 1 г/т семян эффективно ослабляет токсическое действие гербицида и приводит к увеличению надземной массы растений на 40,9% по сравнению с контрольным опытом. Антидоты-аналоги (фурилазол и 1,8-нафталевый ангидрид) в дозе 1 г/т лишь незначительно подавляют действие гербицида, что выражается в увеличении надземной массы растений на 5-14% по сравнению с контролем. Соединение II также проявляет антидотную активность на рапсе, но уступает соединению I на 4,5%.
Соединение I в дозе 1 г/т семян рапса обладает более высокой антидотной активностью, чем известные антидоты фурилазол и 1,8-нафталевый ангидрид, защищая рапс от действия метсульфуронметила при предпосевной обработке семян на почве, загрязненной остаточным количеством гербицида.
Технический результат - создание нового антидота, способного в минимальных дозах защищать рапс от фитотоксического действия остатков гербицидов класса сульфонилмочевин в почве, и расширение ассортимента высокоэффективных антидотов для применения в сельском хозяйстве.
Изобретение иллюстрируется приведенными ниже примерами. Пример 1
Получение этилового эфира 2-{4-[3-(4-хлорфенил)-1-метилуреидо]фенил}-2-гидрокси-3,3,3-трифторпропионовой кислоты (I).
К суспензии 2,8 г (0,009 моль) гидрохлорида солянокислого этилового эфира 2-гидрокси-3,3,3-трифторметил-2-(4-метиламино-фенил)пропионовой кислоты [Патент РФ 2369094, 2009]) в 50 мл сухого дихлорметана добавляют 0,7 г (0,009 моль) пиридина при интенсивном перемешивании. Через 10 минут прибавляют раствор 1,37 г (0,009 моль) пара-хлорфенилизоцианата в 7 мл дихлорметана и перемешивают в течение 2 ч без доступа влаги воздуха при 20-25°C. Завершение реакции контролируют методом ТСХ. Затем дихлорметан отгоняют, остаток растворяют в 30 мл эфира и отмывают гидрохлорид пиридина водой (2 раза по 50 мл). Эфирный слой сушат сульфатом натрия, фильтруют и фильтрат упаривают на роторном испарителе при пониженном давлении до образования твердого остатка. Полученный продукт-сырец кристаллизуют из смеси дихлорметан/петролейный эфир (т. кип. 40-70°C) в соотношении 1:2 и получают 2,7 г (выход 69%) соединения I в виде белого кристаллического вещества, т. пл. 121-123°C. Вещество хорошо растворимо в спирте, ацетоне, хлороформе и умеренно - в воде. Соединение I стабильно при хранении при 20-25°C.
Строение заявляемого соединения I подтверждено 1Н и 19F ЯМР-спектроскопией и масс-спектрометрией. Спектр ЯМР 1Н (400 МГц, DMSO-d6, стандарт ТМС), δ: 1.23 (т, 3Н, J=1 Гц, СН3); 3.30 (с, 3Н, NCH3); 4.27 (к, 2Н, J=7 Гц, СН2); 7.27-7.58 (м, 8Н, Ar); 7.81 (с, 1Н, ОН); 8.65 (уш. с, 1H, NH). Спектр ЯМР 19F (400 МГц, DMSO-d6, стандарт CCl3F), δ: -75.22 (с, CF3). Масс-спектр (электронный удар, 70 эВ), m/z (Iотн, %): 430 [М]+ (12); 204 [C9H9F3NO]+ (100); 134 [C8H8NO]+ (93); 107 [C7H9N]+ (14).
Приготовление препаративной формы соединения I для нанесения на семена. В фарфоровую ступку помещают 105 мг соединения I (с учетом 95%-го содержания основного вещества), добавляют 10,5 г полипропиленгликоля и растирают массу до образования опалесцирующей суспензии. Затем при постоянном перемешивании добавляют 105 мг ПАВ (Тренд-90) и 6,2 г 1%-го раствора Na-КМЦ и получают суспензионную массу кремовато-молочного цвета. Аликвоту этой суспензии в количестве 20 мг используют для приготовления рабочих растворов путем ее разбавления дистиллированной водой в 5 раз (100 г/т) и в 500 раз (1 г/т). Полученные растворы используют для обработки семян рапса: 0,1 г раствора на 5 г семян.
Препаративные формы других антидотов готовят аналогично.
Пример 2
Методика определения антидотного действия соединений формулы I по отношению к гербициду метсульфуронметилу (марки «Зингер СП») на рапсе (сорт «Ратник»).
В модельном опыте, проведенном в лаборатории искусственного климата, использовали черноземную почву, в которую до посадки ярового рапса вносили гербицид «Зингер СП» в дозе 1 г/га. Семена рапса за 3 суток до посева обрабатывали антидотами (таблица) в дозе 1 г/га, высевали в вегетационные сосуды с образцами черноземной почвы, загрязненными гербицидами, и помещали в камеру искусственного климата фирмы «Фетч» (ГДР) при следующих гидротермических условиях: долгота светового дня - 16 ч при 22 тыс. лк, ночи - 8 ч; температура воздуха в камере днем - 25°C, ночью - 20°C; влажность - 75%; влажность почвы (после ежедневного полива обессоленной водой) - 60%.
В указанных условиях эксперимент проводили в течение 25 суток, затем определяли надземную массу растений ярового рапса. Повторность опыта пятикратная, по три растения в каждом сосуде.
Установлено, что предпосевная обработка семян рапса заявляемым соединением формулы I в дозе 1 г/т семян эффективно ослабляет токсическое действие гербицида и приводит к увеличению надземной массы растений на 40,9% по сравнению с контрольным опытом. Антидоты-аналоги (фурилазол и 1,8-нафталевый ангидрид) в дозе 1 г/т лишь незначительно подавляют действие гербицида, что выражается в увеличении надземной массы растений на 5-14% по сравнению с контролем. Соединение II также проявляет антидотную активность по отношению к метсульфуронметилу на рапсе, но уступает соединению I на 4,5%.
Таким образом, соединение I представляет собой первый пример субстанции, эффективно защищающей рапс от токсического действия сульфонилмочевин при предпосевной обработке семян, причем в чрезвычайно низкой дозе - 1 г/т семян.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ ДЛЯ ПРЕДПОСЕВНОЙ ОБРАБОТКИ СЕМЯН | 2015 |
|
RU2585858C1 |
| ЗАМЕЩЁННЫЕ СИДНОНИМИНЫ В КАЧЕСТВЕ АНТИДОТОВ ГЕРБИЦИДОВ | 2021 |
|
RU2772224C1 |
| СПОСОБ ДЕТОКСИКАЦИИ ПОЧВ, ЗАГРЯЗНЕННЫХ ГЕРБИЦИДАМИ | 2021 |
|
RU2759603C1 |
| ПРОИЗВОДНЫЕ N-[4-(1-ГИДРОКСИ-1-ТРИФТОРМЕТИЛ-2,2,2-ТРИФТОРЭТИЛ)ФЕНИЛ]МОЧЕВИНЫ, ОБЛАДАЮЩИЕ АНТИДОТНОЙ АКТИВНОСТЬЮ К 2-ХЛОР-N-[(4-МЕТОКСИ-6-МЕТИЛ-1,3,5-ТРИАЗИН-2-ИЛ)АМИНОКАРБОНИЛ] БЕНЗОЛСУЛЬФАМИДУ В ПОСЕВАХ ЛЬНА | 1991 |
|
SU1825496A3 |
| ОРГАНОМИНЕРАЛЬНЫЙ КОМПЛЕКС ДЛЯ ДЕТОКСИКАЦИИ ПОЧВ, ЗАГРЯЗНЕННЫХ ГЕРБИЦИДАМИ | 2021 |
|
RU2787140C1 |
| АНТИДОТНЫЕ ГЕРБИЦИДНЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ 4-АМИНО-3-ХЛОР-5-ФТОР-6-(4-ХЛОР-2-ФТОР-3-МЕТОКСИФЕНИЛ)ПИРИДИН-2-КАРБОНОВУЮ КИСЛОТУ | 2013 |
|
RU2634925C2 |
| КОМПОЗИЦИЯ ДЛЯ ОБРАБОТКИ СЕМЯН, ОБЛАДАЮЩАЯ РОСТРЕГУЛИРУЮЩИМ ДЕЙСТВИЕМ | 2008 |
|
RU2369094C1 |
| ПРИМЕНЕНИЕ МОНТМОРИЛЛОНИТА ДЛЯ ДЕТОКСИКАЦИИ ПОЧВ, ЗАГРЯЗНЕННЫХ ГЕРБИЦИДАМИ | 2022 |
|
RU2794171C1 |
| ГЕРБИЦИДНО-АНТИДОТНЫЕ КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ 4-АМИНО-3-ХЛОР-5-ФТОР-6-(4-ХЛОР-2-ФТОР-3-МЕТОКСИФЕНИЛ)ПИРИДИН-2-КАРБОНОВУЮ КИСЛОТУ ИЛИ ЕЕ ПРОИЗВОДНОЕ, ДЛЯ ПРИМЕНЕНИЯ В КУКУРУЗЕ (МАИСЕ) | 2014 |
|
RU2658667C2 |
| (2E,2'E)-2,2'-(1,2,4-Тиадиазол-3,5-диил)бис(3-(4-хлорфенил)акрилонитрил) в качестве антидота 2,4-Д на подсолнечнике | 2022 |
|
RU2795307C1 |
Изобретение относится к применению этилового эфира 2-{4-[3-(4-хлорфенил)-1-метилуреидо]фенил}-2-гидрокси-3,3,3-трифторпропионовой кислоты формулы I в сельском хозяйстве в качестве антидота метсульфуронметила на рапсе для предпосевной обработки семян. Соединение формулы I применяют в дозе 1 г/т семян. Обработка семян рапса указанным антидотом эффективно ослабляет токсическое действие гербицида и приводит к увеличению надземной массы растений. 1 з.п. ф-лы, 1 табл., 2 пр.
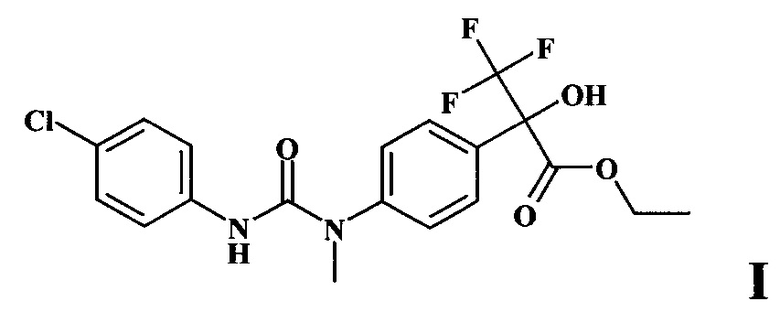
1. Применение этилового эфира 2-{4-[3-(4-хлорфенил)-1-метилуреидо]фенил}-2-гидрокси-3,3,3-трифторпропионовой кислоты формулы I
в качестве антидота метсульфуронметила на рапсе для предпосевной обработки семян.
2. Применение по п.1, отличающееся тем, что используемая доза антидота формулы I составляет 1 г/т семян.
| CAS RN 292854-58-1 (опубл | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Способ получения порошка магнетита | 2023 |
|
RU2817877C1 |
| SU 1804056 A1, 20.11.1996 | |||
| ГОРИЗОНТАЛЬНЫЙ АБСОРБЕР | 1972 |
|
SU435840A1 |
Авторы
Даты
2018-09-12—Публикация
2017-07-17—Подача