Изобретение относится к новым химическим соединениям, а именно производным N-[4-(1-гидрокси-1-трифторметил-2,2,2- -трифторэтил)фенил] мочевины общей формулы I
HO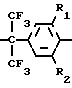 N
N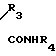 где R1, R2, R3=H, CH3; R4=CH3, C6H4CH3-n, при R1=H R2= H, R3= CH3; R4= C6H4CH3-n (а); при R1=CH3 R2=CH3, R3=H, R4=CH3 (б), проявляющим свойства антидота хлорсульфурона - (N-[4-метил-6-метокси-1,3,5-триазинил-2)-аминокарбонил]-2-хлорбензолсуль- фонамида) - на культуре льна.
где R1, R2, R3=H, CH3; R4=CH3, C6H4CH3-n, при R1=H R2= H, R3= CH3; R4= C6H4CH3-n (а); при R1=CH3 R2=CH3, R3=H, R4=CH3 (б), проявляющим свойства антидота хлорсульфурона - (N-[4-метил-6-метокси-1,3,5-триазинил-2)-аминокарбонил]-2-хлорбензолсуль- фонамида) - на культуре льна.
Хлорсульфурон в дозах 10-50 г/га эффективен против большинства широколистных и некоторых злаковых сорняков. Он применяется для послевсходовой обработки ржи, ячменя, овса и льна. Известно, что для снижения гербицидного действия хлорсульфурона на чувствительные к нему культуры используется ангидрид 1,8-нафталиндикарбоновой кислоты (1,8-НА).
1,8-НА эффективен для защиты ряда культур: кукурузы, сорго, злаков и других от повреждения остаточными количествами хлорсульфурона в почве, но не защищает лен. Кроме того, 1,8-НА не эффективен при применении методом опрыскивания, а для внесения в почву вместе с семенами используется в больших дозах (2 кг/га).
Целью изобретения является изыскание эффективных антидотов хлорсульфурона на культуре льна.
Поставленная цель достигается производными N-[4-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)фенил]мочевины общей формулы I.
Предложенные соединения получают взаимодействием соответствующих производных 4-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)анилина с метил-, n-толилизоцианатами (соответственно продукты Ia и Iб общей формулы I по схеме
HO NHR3+ R4NCO _→ HO
NHR3+ R4NCO _→ HO N
N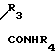 где R1, R2, R3=H, CH3; R4= CH3, C6H4CH3-n, при R1=H, R2=H, R3=CH3, R4=C6H4CH3-n (a); при R1=CH3, R2=CH3; R3=H, R4=CH3 (б).
где R1, R2, R3=H, CH3; R4= CH3, C6H4CH3-n, при R1=H, R2=H, R3=CH3, R4=C6H4CH3-n (a); при R1=CH3, R2=CH3; R3=H, R4=CH3 (б).
Процесс проводят в органическом растворителе (диэтиловый эфир, бензол, хлороформ) при комнатной температуре либо кипячении в течение 7-48 ч.
Состав и строение полученных соединений доказаны данными элементного анализа и методом ИК-спектроскопии.
Соединения I представляют собой устойчивые кристаллические вещества белого (Ia) и сиреневого (Iб) цвета, хорошо растворимые в этаноле, ацетоне и умеренно в диэтиловом эфире, этилацетате, бензоле.
Предлагаемые соединения I проявили высокую активность в качестве антидотов хлорсульфурона и могут найти практическое применение при обработке семян льна с целью снижения токсического действия гербицида хлорсульфурона.
Соединения I малотоксичны для теплокровных, ЛД50 для мышей пероральнно более 1000 мг/кг.
П р и м е р 1. К раствору 1 г (0,0036 моль) N-[4-(1-гидрокси-1-трифторметил-2,2,2-три- фторэтил)фенил]-N-метиламина в 10 мл диэтилового эфира добавляют при перемешивании по каплям в течение 5 мин 0,6 г (0,0045 моль) n-толилизоцианата. Реакционную смесь перемешивают 24 ч при 20оС. Выпавший осадок отфильтровывают. Эфир упаривают, оставшееся светло-сиреневое масло заливают охлажденным гексаном, выпавшие сиреневые кристаллы отфильтровывают. Оба осадка промывают сначала горячим, затем охлажденным гексаном. Выделяют 1,35 г кристаллической N-[4-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)фенил] -N-метил-N1-n-толилм очевины, выход 90,7%, т.пл. 178-179оС (соединение Ia).
Найдено, %: С 53,70; Н 3,47; N 6,91.
С18Н16F6N2O2
Вычислено, %: С 53,21; Н 3,96; N 6,89.
ИК-спектр (ССl4, ν, см-1): 3580 (ОН); 3440 (NH); (КBr, ν, см-1); 1660 (СО), 1610 (скелетные колебания бензольного кольца), 1100-1300 (СF3).
Б. К раствору 0,0018 моль N-[4-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)фе- нил] -N-метиламина в 5 мл бензола добавляют при перемешивании 0,002 моль n-толилизоцианата. Реакционную массу переме- шивают 48 ч при 20оС. По окончании реакции бензол упаривают, оставшееся темное масло промывают кипящим гексаном (3 раза по 15 мл), затем посветлевшее масло растирают с 15 мл охлажденного гексана, выделяют 0,53 г темно-сиреневых кристаллов соединения Iа, выход 71,6%, т.пл. 177-179оС.
В. К раствору 0,001 моль N-[4-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)фе- нил]-N-метиламина в 5 мл хлороформа добавляют при перемешивании 0,0012 моль n-толилизоцианата. Реакционную массу кипятят 3 ч, затем перемешивают еще 4 ч при 20оС.
После упаривания хлороформа остается темно-сиреневое масло, его растворяют в 15 мл бензола и кипятят 10 мин с активированным углем, затем черный осадок отфильтровывают, бензол упаривают, оставшееся посветлевшее масло растирают в охлажденном гексане (20 мл) до образования светло-сиреневых кристаллов, выделяют 0,24 г вещества Iа, выход 60,0%, т.пл. 178-179оС.
Г. N-[4-(1-Гидрокси-1-трифторметил-2,2,2-трифторэтил)-2,6-диметилфенил] -N- метилмочевину получают из 0,3 г (0,001 моль) 4-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)-2,6-диметиланилина и 0,15 г (0,0026 моль) метилизоцианата по методике А. Выделяют 0,28 г белого кристаллического вещества, выход 77,8%, т.пл. 198-199оС (соединение Iб).
Найдено, %: С 45,62; Н 4,30; N 8,31.
С13Н14F6N2О2
Вычислено, %: С 45,35; Н 4,09; N 8,13.
ИК-спектр (ССl4, ν, см-1: 3580 (ОН), 3440 (NH); (КВr, ν, см-1):1630 (СО), 1605 (скелетнные колебания бензольного кольца), 1100-1300 (СF3).
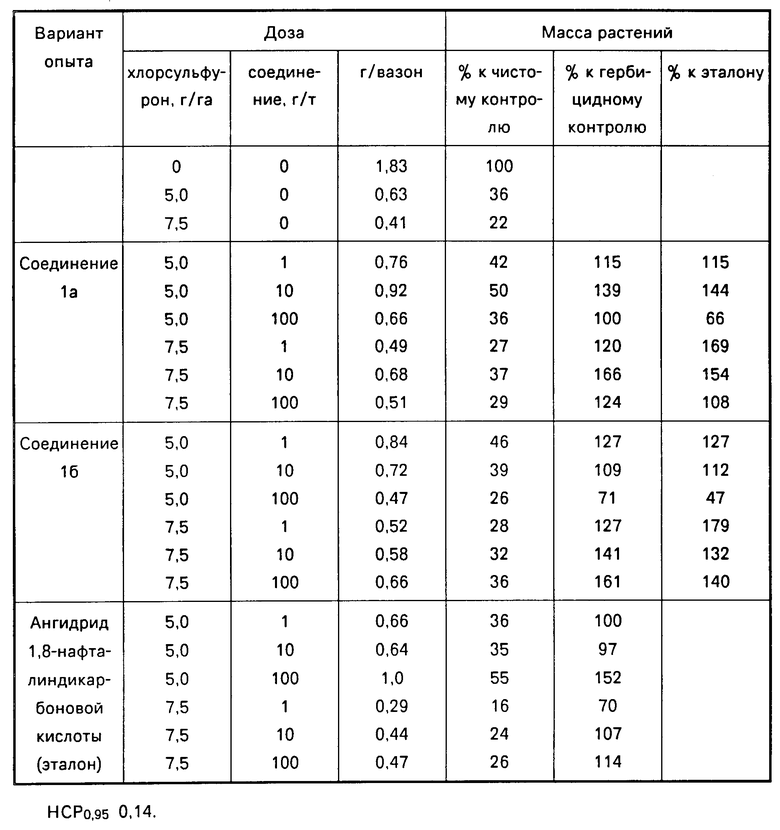
П р и м е р 2. Испытания препаратов на антидотную активность (тепличный опыт).
Испытания соединений на антидотную активность проводили в условиях теплицы для растений льна (сорт Торжокский 4). В качестве эталона сравнения использовали известный промышленный антидот протект (1,8-НА). В работе применяли широко используемый метод обработки семян. Обработку проводили непосредственно перед посевом. Для этого образец семян (5 г) помещали в колбу роторного испарителя, куда добавляли 0,5 мл ацетонового раствора соединений I различной концентрации из расчета 1, 10 или 100 г/т семян. Семена вынимали из колбы после испарения растворителя.
Чистые и обработанные семена высевали в бумажные стаканчики, вмещающие 600 г дерново-подзолистой почвы, содержащей хлорсульфурон (5-7,5 г/га). Через 4 недели растения срезали и взвешивали. Антидотный эффект определяли по увеличению массы опытных растений в сравнении с массой растений, выращенных из необработанных антидотом. Результаты учета растений представлены в таблице.
Данные опыта показывают, что при наличии в почве 5 г/га хлорсульфурона масса растений льна снижалась на 64%, а 7,5 г/га - на 78%. Обработка семян соединениями Ia и Iб позволила снизить фитотоксическое действие гербицида. Причем наибольшая прибавка массы растений отмечена при использовании антидота Iа в дозе 10 г/т; на фоне 64%-ного снижения массы растений от действия хлорсульфурона прибавка массы растений при предварительной обработке семян антидотом Iа составляла 39% , а на фоне 78%-ного снижения массы растений прибавка составляла 66%.
Следует отметить, что эталон 1,8-НА в дозах 1 и 10 г/т семян антидотных свойств не проявляет.
Преимущество антидотов I в сравнении с эталоном более ярко выражено на высоком гербицидном фоне: при применении антидота Iа прибавка массы растений составляла 20-66%, антидота Iб 27-61%; в то время как при использовании антидота 1,8-НА прибавка массы растений составляла 7-14%, т.е. была статистически недостоверна.
Таким образом, на основании представленного материала можно сделать вывод, что производные N-[4-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)фенил] мочевины (I), являющиеся антидотами хлорсульфурона, превосходят по своей активности эталон 1,8-НА.
Соединения I проявили высокую антидотную активность и могут найти практическое применение при обработке семян льна с целью снижения токсического действия гербицида хлорсульфурона и повышения урожайности льда.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-[4-2'-ГИДРОКСИГЕКСАФТОРИЗОПРОПИЛ)ФЕНИЛ] -N-ЭТИЛ-N'-ФЕНИЛМОЧЕВИНА, ОБЛАДАЮЩАЯ РОСТРЕГУЛИРУЮЩИМ И АНТИДОТНЫМ ДЕЙСТВИЕМ | 1990 |
|
RU1743153C |
| N-4-(1-ОКСИ-1-АМИНО)- ИЛИ ЭТОКСИ(КАРБОНИЛ)-2,2,2-ТРИФТОРЭТИЛ)ФЕНИЛ-N-АЛКИЛ- N' -АЛКИЛ( α -НАФТИЛ)МОЧЕВИНЫ, ПРОЯВЛЯЮЩИЕ РОСТОРЕГУЛИРУЮЩУЮ АКТИВНОСТЬ | 1991 |
|
SU1822133A1 |
| 2-АЛКОКСИ-2-ТИО-5-(N-ФЕНИЛКАРБАМОИЛ)-6-МЕТИЛ-1,4,2-ОКСАТИАФОСФОРИНЫ | 1996 |
|
RU2105771C1 |
| ДИЭТИЛЭТАНОЛАММОНИЕВАЯ СОЛЬ 2-МЕТОКСИКАРБОНИЛ -N-[(4-МЕТОКСИ -6-ФТОР- 1,3- ПИРИМИДИН-2-ИЛ) АМИНОКАРБОНИЛ] -БЕНЗОЛСУЛЬФАМИДА, ОБЛАДАЮЩАЯ ГЕРБИЦИДНОЙ АКТИВНОСТЬЮ, И ГЕРБИЦИДНЫЙ СОСТАВ НА ЕЕ ОСНОВЕ | 1992 |
|
RU2043345C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЩЕЛОЧНЫХ СОЛЕЙ N- (ГЕТЕРОЦИКЛИЛАМИНОКАРБОНИЛ)АРИЛСУЛЬФОНАМИДОВ В ВИДЕ ВОДОРАСТВОРИМЫХ ГРАНУЛ | 1998 |
|
RU2135480C1 |
| ДИЭТИЛЭТАНОЛАММОНИЕВАЯ СОЛЬ 2-МЕТОКСИКАРБОНИЛ-N- {[(4-МЕТОКСИ -6-МЕТИЛ)-1,3,5 -ТРИАЗИН-2-ИЛ] -АМИНОКАРБОНИЛ} -БЕНЗОЛСУЛЬФАМИДА, ОБЛАДАЮЩАЯ ГЕРБИЦИДНОЙ АКТИВНОСТЬЮ И ГЕРБИЦИДНЫЙ СОСТАВ НА ЕЕ ОСНОВЕ | 1992 |
|
RU2030404C1 |
| АНТИДОТ ГЕРБИЦИДОВ ГОРМОНАЛЬНОГО ДЕЙСТВИЯ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ И 4-АМИНО-3,5,6-ТРИХЛОРПИКОЛИНОВОЙ КИСЛОТ | 1992 |
|
RU2043021C1 |
| СПОСОБ БОРЬБЫ С ГРИБНЫМИ БОЛЕЗНЯМИ РАСТЕНИЙ | 1991 |
|
RU2028052C1 |
| Замещенные N-4-/1-окси-1-гидразинокарбонил-2,2,2-трифторэтил)анилины, обладающие свойствами регуляторов роста растений | 1991 |
|
SU1806132A3 |
| ЭТИЛОВЫЙ ЭФИР 2-{ 4-[3-(4-ХЛОРФЕНИЛ)-1-МЕТИЛУРЕИДО]ФЕНИЛ} -2-ГИДРОКСИ-3,3,3-ТРИФТОРПРОПИОНОВОЙ КИСЛОТЫ: ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТИДОТА ГЕРБИЦИДОВ И СПОСОБ ПОЛУЧЕНИЯ | 2017 |
|
RU2666732C1 |
Использование: в сельском хозяйстве, так как продукт обладает антидотным действием к 2-хлор-N- [(4-метокси-6-метил-1,3,5-триазин-2-ил) бензосульфамиду]хлорсульфурону формулы I 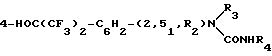 Сущность: продукт - производные N-[4-(1-гидрокси-1-трифторметил-2,2,2-трифторметил)фенил]мочевины формулы 1.
Сущность: продукт - производные N-[4-(1-гидрокси-1-трифторметил-2,2,2-трифторметил)фенил]мочевины формулы 1. 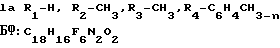
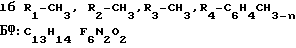 Реагент 1: соответствующие производные 4-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)анилина. Реагент 2: метил- или n-толилизоцианат. Условия реакции: органический растворитель (диэтиловый эфир, бензол, хлороформ), при комнатной температуре или кипячении в течение 7 - 48 ч. 1 табл.
Реагент 1: соответствующие производные 4-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)анилина. Реагент 2: метил- или n-толилизоцианат. Условия реакции: органический растворитель (диэтиловый эфир, бензол, хлороформ), при комнатной температуре или кипячении в течение 7 - 48 ч. 1 табл.
Производные N-[4-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)фенил]мочевины общей формулы
где R1, R2, R3 = H, CH3, R4 = CH3, C6H4CH3-n, при этом если R1 = H, R2 = H, R3 = CH3, R4 = C6H4CH3-n или если R1 = CH3, R2 = CH3, R3 = H, R4= CH3,
обладающие антидотной активностью к 2-хлор-N- [(4-метокси-6-метил-1,3,5-триазин-2-ил) аминокарбонил] бензолсульфамиду в посевах льна.
| Патент США N 4343649, кл | |||
| Контрольный стрелочный замок | 1920 |
|
SU71A1 |
Авторы
Даты
1994-12-30—Публикация
1991-04-04—Подача