ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым производным имидазо[1,2-b]пиридазина и имидазо[1,2-a]-пиразина, которые являются ингибиторами фермента фосфодиэстеразы 10 (PDE10) и которые могут быть применимы для лечения или предупреждения неврологических, психических и метаболических расстройств, в которые вовлечен фермент PDE10. Настоящее изобретение также направлено на фармацевтические композиции, содержащие такие соединения, на способы получения таких соединений и композиций, на применение таких соединений или фармацевтических композиций для предупреждения или лечения неврологических, психических и метаболических расстройств и заболеваний.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Фосфодиэстеразы (PDE) представляют собой семейство ферментов, кодируемых 21 геном и подразделенных на 11 отдельных семейств согласно структурным и функциональным свойствам. Эти ферменты осуществляют метаболическую инактивацию широко распространенных внутриклеточных вторичных мессенджеров, циклического 3′,5′-аденозинмонофосфата (cAMP) и циклического 3′,5′-гуанозинмонофосфата (cGMP). Эти два мессенджера регулируют большое разнообразие биологических процессов, в том числе выработку и действие провоспалительных медиаторов, функционирование ионных каналов, сокращение мышц, коммитирование, дифференцировку, апоптоз, липогенез, гликогенолиз и глюконеогенез. Они осуществляют это посредством активации протеинкиназы A (PKA) и протеинкиназы G (PKG), которые, в свою очередь, фосфорилируют большое разнообразие субстратов, в том числе факторы транскрипции и ионные каналы, которые регулируют многочисленные физиологические реакции. В случае нейронов предусматриваются активация cAMP- и cGMP-зависимых киназ и последующее фосфорилирование белков, вовлеченных в быструю регуляцию синаптической передачи, а также в дифференцировку и выживаемость нейронов. Внутриклеточные концентрации cAMP и cGMP точно регулируются скоростью биосинтеза с помощью циклаз и скоростью расщепления с помощью PDE. PDE представляют собой гидролазы, которые инактивируют cAMP и cGMP посредством каталитического гидролиза 3′-сложноэфирной связи с образованием неактивного 5′-монофосфата (схема A).
Схема A
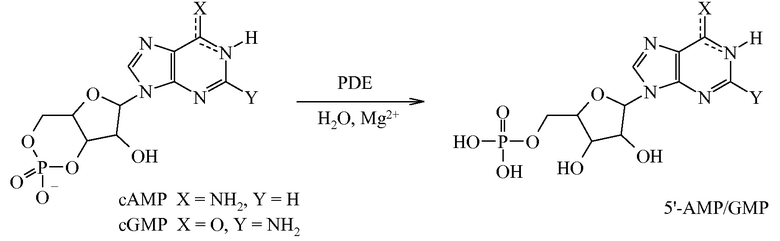
На основании субстратной специфичности семейства PDE можно разделить на три группы: i) cAMP-специфические PDE, которые включают PDE4, 7 и 8; ii) cGMP-селективные ферменты PDE5, 6 и 9 и iii) PDE, действующие на два субстрата, PDE1, 2 и 3, а также PDE10 и 11.
Кроме того, для PDE характерна дифференциальная экспрессия во всем организме, в том числе в центральной нервной системе. Вследствие этого разные изоферменты PDE могут иметь разные физиологические функции. Соединения, которые селективно ингибируют семейства или изоферменты PDE, могут проявлять особую терапевтическую активность, меньшее количество побочных эффектов или и то, и другое.
Об обнаружении фосфодиэстеразы 10A (PDE10A) сообщалось в 1999 г. Из всех 11 известных семейств PDE PDE10 характеризуется наиболее ограниченным распределением с высоким уровнем экспрессии только в головном мозге и яичках.
В головном мозге мРНК и белок PDE10A экспрессируются на высоком уровне в большинстве стриарных средних шипиковых нейронов (MSN). Такое своеобразное распределение PDE10A в головном мозге вместе с увеличением числа ее фармакологических исследований указывает на потенциальное применение ингибиторов PDE10A в лечении неврологических и психических расстройств, таких как шизофрения.
В базальных ганглиях MSN представляют собой основное место получения и интеграции глутаматергического входа от коры больших полушарий и дофаминергического входа от среднего мозга и формируют ключевые исходящие пути, которые способствуют проведению различий между уместными и неуместными когнитивными и двигательными паттернами и воздействию на них.
MSN представляют собой GABA-ергические проекционные нейроны, равномерно распределенные между двумя различными путями. Стрионигральные MSN (в прямом пути) экспрессируют дофаминовый рецептор D1 и нейропептиды динорфин и вещество P; стриопаллидарные MSN (в непрямом пути) экспрессируют дофаминовые рецепторы D2 и нейропептид энкефалин. Дофаминовые рецепторы D1 положительно связаны с выработкой cAMP, тогда как дофаминовые рецепторы D2 отрицательно связаны с выработкой cAMP. Эти пути воздействуют на концентрацию внеклеточного дофамина и модулируют двигательные и поведенческие реакции.
Ингибиторы PDE10 и шизофрения
В связи с преимущественной локализацией PDE10 в MSN в большинстве исследований ингибиторов PDE10 внимание было сосредоточено на моделях для доклинического исследования психоза.
На основании исследований, проводимых на мышах с нокаутом, эффекты ингибирования PDE10 в отношении экспрессии генов в стриарных нейронах сравнивали с эффектами, индуцированными агонистом D1 и антагонистом D2.
Шизофрения является тяжелой и хронической психической болезнью, которая поражает приблизительно 1% населения. Клинические симптомы становятся очевидными в относительно раннем возрасте, обычно появляясь в юности или в раннем взрослом возрасте. Симптомы шизофрении обычно подразделяются на описываемые как позитивные, в том числе галлюцинации, эпизоды бреда и нарушения мышления, и называемые негативными, включающие социальное отчуждение, ослабление эмоциональных реакций, бедность речи и неспособность испытывать удовольствие. Кроме того, пациенты с шизофренией страдают от когнитивных расстройств, таких как ухудшение внимания и памяти. Этиология заболевания все еще является неизвестной, однако была выдвинута гипотеза, что в основе симптомов шизофрении лежат нарушения действия нейромедиаторов. Одной из наиболее часто обсуждаемых является дофаминергическая гипотеза, которая предполагает, что гиперактивность дофаминовой передачи обуславливает позитивные симптомы, наблюдаемые у пациентов с шизофренией.
Эффективность антипсихотических средств, реализуемых в настоящее время на рынке, коррелирует с их способностью к блокированию дофаминовых рецепторов D2. Однократное и постоянное введение антипсихотических средств, таких как галоперидол, имеет характерные эффекты в отношении экспрессии генов в стриарных нейронах. Также наблюдали, что ингибирование PDE10A вызывало изменения экспрессии генов в стриарных нейронах, подобные таковым, вызываемым галоперидолом.
Атипичные антипсихотические средства, такие как клозапин, оланзапин, рисперидон и палиперидон, проявляют более благоприятный профиль экстрапирамидных побочных эффектов (EPS) и поздней дискинезии, ассоциированных с кратковременной и долговременной блокадой рецепторов D2. Однако все еще существует необходимость в разработке новых антипсихотических средств с профилем пролонгированного терапевтического действия и меньшим количеством побочных эффектов, например, путем применения подходов за рамками блокады дофаминового рецептора D2.
Таким образом, ингибиторы PDE10 могут обладать фармакологическим профилем, аналогичным таковому современных антипсихотических средств, которые в основном лечат позитивные симптомы шизофрении, но также обладают потенциалом для устранения негативных и когнитивных симптомов шизофрении, при этом не имеют нецелевых связанных побочных эффектов, таких как EPS или высвобождение пролактина, которые часто наблюдаются при применении существующих антипсихотических средств.
Поскольку ингибиторы PDE10 можно применять для повышения уровней cAMP и/или cGMP в клетках, которые экспрессируют фермент PDE10, например, в нейронах, которые входят в состав базальных ганглиев, ингибиторы PDE10 могут быть применимыми в лечении шизофрении и, кроме того, ряда состояний, описываемых в данном документе, таких как болезнь Паркинсона, болезнь Хантингтона, аддикция и депрессия. Ингибиторы PDE10 также могут быть применимыми при других состояниях, таких как ожирение, инсулинонезависимый сахарный диабет, биполярное расстройство, обсессивно-компульсивное расстройство и боль.
Эффективность ингибирования PDE10A в моделях когнитивной деятельности и в отношении негативных симптомов шизофрении также предполагалась в недавно опубликованных in vivo исследованиях, в которых этот механизм связывали с повышением общительности в анализе социального приближения/социального избегания, обратным эффектом длительного лечения с помощью MK-801 в тесте принудительного плавания, улучшением распознавания социально значимых запахов у мышей и улучшением распознавания новых объектов у крыс.
Документы из уровня техники
В WO 2011/051342, опубликованной 5 мая 2011 г., раскрываются соединения имидазо[1,2-b]пиридазина и их активность в качестве ингибиторов фермента фосфодиэстеразы 10.
В WO 2011/110545, опубликованной 15 сентября 2011 г., раскрываются производные имидазо[1,2-a]пиразина и их активность в качестве ингибиторов фермента фосфодиэстеразы 10.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является обеспечение новых гидроксилзамещенных соединений, которые являются ингибиторами PDE10.
Таким образом, в одном аспекте настоящее изобретение относится к соединению формулы (I):
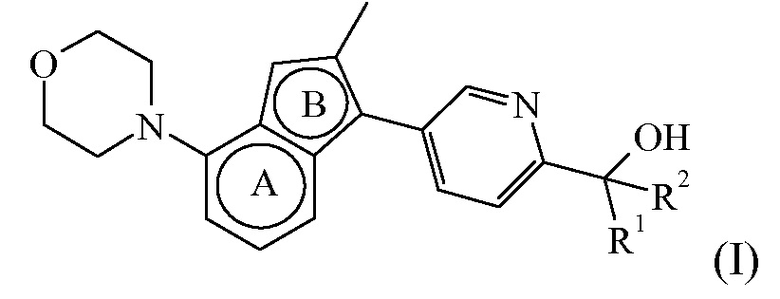
или к его стереоизомерной форме, где
R1 представляет собой H, а R2 представляет собой 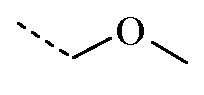 ;
;
или где R1 и R2, взятые вместе с атомом углерода, к которому они присоединены, образуют радикал формулы
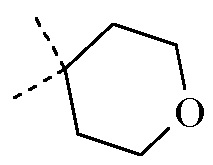 ; и
; и
бицикл 
представляет собой бицикл формулы a) 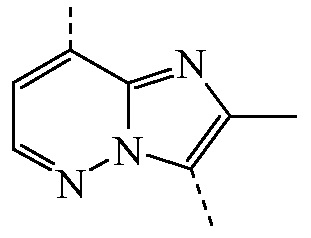 или формулы b)
или формулы b) 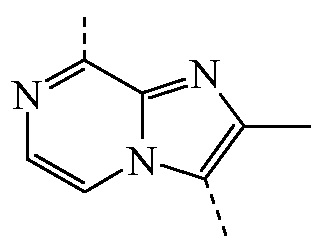 ;
;
или к его фармацевтически приемлемой соли или сольвату.
Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I), или его стереоизомерной формы, или его фармацевтически приемлемой соли или сольвата и фармацевтически приемлемый носитель или наполнитель.
Дополнительно, настоящее изобретение относится к соединению формулы (I), или к его стереоизомерной форме, или к его фармацевтически приемлемой соли или сольвату для применения в качестве лекарственного препарата и к соединению формулы (I), или его стереоизомерной форме, или его фармацевтически приемлемой соли или сольвату для применения в лечении или в предупреждении неврологических, психических или метаболических расстройств и заболеваний.
Дополнительно, настоящее изобретение относится к применению соединения формулы (I), или его стереоизомерной формы, или его фармацевтически приемлемой соли или сольвата в комбинации с дополнительным фармацевтическим средством для применения в лечении или предупреждении неврологических, психических или метаболических расстройств и заболеваний.
Дополнительно, настоящее изобретение относится к способу получения фармацевтической композиции согласно настоящему изобретению, предусматривающему, что фармацевтически приемлемый носитель тщательно перемешивают с терапевтически эффективным количеством соединения формулы (I), или его стереоизомерной формы, или его фармацевтически приемлемой соли или сольвата.
Настоящее изобретение также относится к продукту, содержащему соединение формулы (I), или его стереоизомерную форму, или его фармацевтически приемлемую соль или сольват, и дополнительное фармацевтическое средство, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении или предупреждении неврологических, психических или метаболических расстройств и заболеваний.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Химические названия соединений согласно настоящему изобретению были образованы согласно правилам номенклатуры, принятым Химической реферативной службой (CAS), с использованием программного обеспечения Advanced Chemical Development, Inc. (продукт ACD/Name, версия 10.01; текущая сборка 15494, 1 декабря 2006 г.).
Определения
Выражение “C1-4алкил”, применяемое в данном документе отдельно или в качестве части другой группы, означает насыщенный углеводородный радикал с прямой или разветвленной цепью, имеющий, если не указано иное, от 1 до 4 атомов углерода, такой как метил, этил, 1-пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метил-1-пропил, 1,1-диметилэтил и т.п.
Выражение “галоген” или “галогенид”, применяемое в данном документе отдельно или в качестве части другой группы, относится к фтору, хлору, брому или йоду, при этом фтор или хлор являются предпочтительными.
Выражение “субъект”, применяемое в данном документе, относится к животному, предпочтительно млекопитающему (например, кошке, собаке, примату или человеку), более предпочтительно человеку, которое является или являлось объектом лечения, наблюдения или эксперимента.
Выражение “терапевтически эффективное количество”, применяемое в данном документе, означает такое количество активного соединения или фармацевтического средства, которое вызывает биологический или медицинский эффект в системе тканей у животного или человека, желаемый исследователем, ветеринаром, врачом или другим клиницистом, что включает облегчение или нивелирование симптомов заболевания или расстройства, лечение которого осуществляют.
Подразумевается, что выражение “композиция”, применяемое в данном документе, охватывает продукт, содержащий определенные ингредиенты в определенных количествах, а также любой продукт, который получают прямо или непрямо в результате комбинаций определенных ингредиентов в определенных количествах.
Подразумевается, что выражение “лечение”, применяемое в данном документе, обозначает все способы, которые могут предусматривать замедление, нарушение, подавление или прекращение прогрессирования заболевания, но необязательно означает полное устранение всех симптомов.
Выражение “соединения по настоящему изобретению” обозначает соединения формулы (I), их стереоизомерные формы, а также соли и сольваты.
Что касается применения в медицине, соли соединений по настоящему изобретению относятся к нетоксичным "фармацевтически приемлемым солям". Однако при получении соединений согласно настоящему изобретению или их фармацевтически приемлемых солей могут быть применимыми другие соли. Подходящие фармацевтически приемлемые соли соединений включают соли присоединения кислоты, которые можно образовывать, например, путем смешивания раствора соединения с раствором фармацевтически приемлемой кислоты, такой как хлористоводородная кислота, серная кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, лимонная кислота, винная кислота, угольная кислота или фосфорная кислота.
И наоборот, упомянутые формы солей можно превратить в форму свободного основания путем обработки соответствующим основанием.
Кроме того, если соединения по настоящему изобретению имеют кислотный фрагмент, их подходящие фармацевтически приемлемые соли могут включать соли щелочных металлов, например, соли натрия или калия; соли щелочноземельных металлов, например, соли кальция или магния; и соли, образованные с подходящими органическими лигандами, например, соли четвертичного аммония.
Иллюстративные кислоты, которые можно применять при получении фармацевтически приемлемых солей, включают без ограничения следующие: уксусную кислоту, 2,2-дихлоруксусную кислоту, ацилированные аминокислоты, адипиновую кислоту, альгиновую кислоту, аскорбиновую кислоту, L-аспарагиновую кислоту, бензолсульфоновую кислоту, бензойную кислоту, 4-ацетамидобензойную кислоту, (+)-камфорную кислоту, камфорсульфоновую кислоту, каприновую кислоту, капроновую кислоту, каприловую кислоту, коричную кислоту, лимонную кислоту, цикламовую кислоту, этан-1,2-дисульфоновую кислоту, этансульфоновую кислоту, 2-гидроксиэтансульфоновую кислоту, муравьиную кислоту, фумаровую кислоту, галактаровую кислоту, гентизиновую кислоту, глюкогептоновую кислоту, D-глюконовую кислоту, D-глюкуроновую кислоту, L-глутаминовую кислоту, бета-оксоглутаровую кислоту, гликолевую кислоту, гиппуровую кислоту, бромистоводородную кислоту, хлористоводородную кислоту, (+)-L-молочную кислоту, (±)-DL-молочную кислоту, лактобионовую кислоту, малеиновую кислоту, (-)-L-яблочную кислоту, малоновую кислоту, (±)-DL-миндальную кислоту, метансульфоновую кислоту, нафталин-2-сульфоновую кислоту, нафталин-1,5-дисульфоновую кислоту, 1-гидрокси-2-нафтойную кислоту, никотиновую кислоту, азотную кислоту, олеиновую кислоту, оротовую кислоту, щавелевую кислоту, пальмитиновую кислоту, памовую кислоту, фосфорную кислоту, L-пироглутаминовую кислоту, салициловую кислоту, 4-аминосалициловую кислоту, себациновую кислоту, стеариновую кислоту, янтарную кислоту, серную кислоту, дубильную кислоту, (+)-L-винную кислоту, тиоциановую кислоту, п-толуолсульфоновую кислоту, трифторметилсульфоновую кислоту и ундециленовую кислоту.
Иллюстративные основания, которые можно применять в получении фармацевтически приемлемых солей, включают без ограничения следующие: аммиак, L-аргинин, бенетамин, бензатин, гидроксид кальция, холин, диметилэтаноламин, диэтаноламин, диэтиламин, 2-(диэтиламино)этанол, этаноламин, этилендиамин, N-метилглюкамин, гидрабамин,
1H-имидазол, L-лизин, гидроксид магния, 4-(2-гидроксиэтил)морфолин, пиперазин, гидроксид калия, 1-(2-гидроксиэтил)пирролидин, вторичный амин, гидроксид натрия, триэтаноламин, трометамин и гидроксид цинка.
И наоборот, упомянутые формы солей можно превратить в формы свободных кислот путем обработки соответствующей кислотой.
Выражение “сольват” включает формы присоединения растворителя, а также их соли, которые могут образовывать соединения формулы (I). Примерами таких форм присоединения растворителя являются, например, гидраты, алкоголяты и т.п.
В рамках данной заявки элемент, в частности, при упоминании в отношении соединения формулы (I), включает все изотопы и смеси изотопов этого элемента, либо встречающиеся в природе, либо полученные синтетическим путем, либо с природным изотопным составом, либо в изотопно-обогащенной форме. Меченные радиоактивным изотопом соединения формулы (I) могут содержать радиоактивный изотоп, выбранный из группы 3H, 11C, 18F, 122I, 123I, 125I, 131I, 75Br, 76Br, 77Br и 82Br. Предпочтительно, радиоактивный изотоп выбран из группы 3H, 11C и 18F.
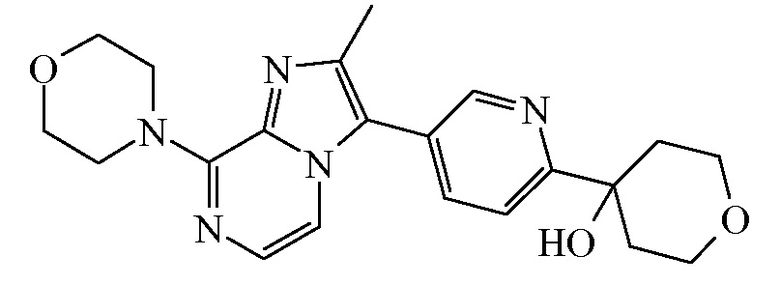
Соединение формулы (I), определенное в данном документе, где R1 представляет собой H, а R2 представляет собой  , называемое в данном документе соединением формулы (I’), имеет один асимметрический атом углерода, как проиллюстрировано ниже, где асимметрический атом углерода обозначен *:
, называемое в данном документе соединением формулы (I’), имеет один асимметрический атом углерода, как проиллюстрировано ниже, где асимметрический атом углерода обозначен *:
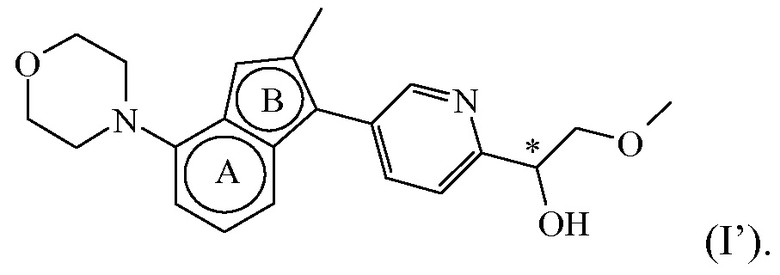
Таким образом, соединение формулы (I), определенное в данном документе, где R1 представляет собой H, а R2 представляет собой 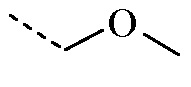 , называемое в данном документе соединением формулы (I’), может образовывать два различных энантиомера, т.е. стереоизомеры, которые представляют собой несовпадающие при наложении зеркальные отображения друг друга, и может существовать либо в качестве чистого энантиомера, либо в качестве его смесей.
, называемое в данном документе соединением формулы (I’), может образовывать два различных энантиомера, т.е. стереоизомеры, которые представляют собой несовпадающие при наложении зеркальные отображения друг друга, и может существовать либо в качестве чистого энантиомера, либо в качестве его смесей.
Соответственно, определение “соединение формулы (I)” включает энантиомеры соединения формулы (I) либо в качестве чистого энантиомера, либо в качестве смеси двух энантиомеров. Конкретная смесь согласно настоящему изобретению представляет собой смесь 1:1 пары энантиомеров, также называемая рацематом или рацемической смесью.
Абсолютная конфигурация определяется согласно системе Кана-Ингольда-Прелога. Конфигурация при асимметрическом атоме определяется или как R, или как S. Выделенные соединения, абсолютная конфигурация которых неизвестна, могут быть обозначены как (+) или (-) в зависимости от направления, в котором они вращают плоскость поляризации света. Если указан конкретный энантиомер, это означает, что указанный энантиомер практически свободен от другого энантиомера, т.е. связан с менее 50%, предпочтительно менее 20%, более предпочтительно менее 10%, еще более предпочтительно менее 5%, в частности, менее 2% и наиболее предпочтительно менее 1% этого энантиомера.
Таким образом, если соединение формулы (I) указано, например, как (R), это означает, что соединение практически не содержит энантиомер (S); если соединение формулы (I) указано, например, как (+), это означает, что соединение практически не содержит энантиомер (-).
Специалисты в данной области могут определить абсолютную стереохимическую конфигурацию соединений формулы (I) и промежуточных соединений, применяемых в их получении, при использовании хорошо известных способов, таких как, например, рентгеновская дифракция.
Применяемое в данном документе обозначение “RS” означает рацемическую смесь, если не указано иное; обозначения “*R” или “*S” применяют, если абсолютная стереохимическая конфигурация не определена, хотя само соединение было выделено в качестве отдельного стереоизомера и является энантиомерно чистым.
Таким образом, в конкретном варианте осуществления настоящее изобретение относится к соединению формулы (I’):
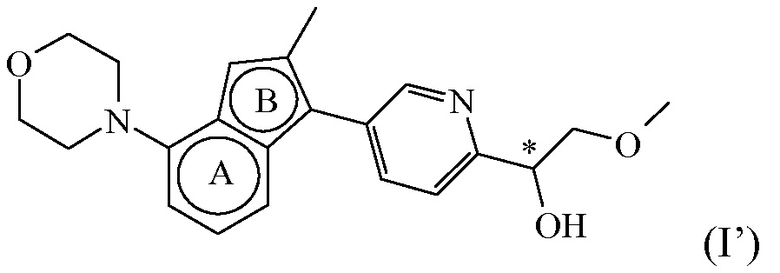 ,
,
или к его стереоизомерной форме, где
бицикл 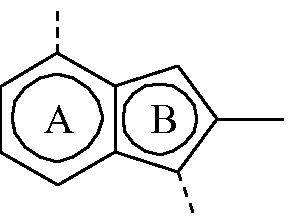
представляет собой бицикл формулы a) 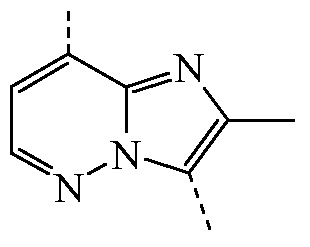 или формулы b)
или формулы b) 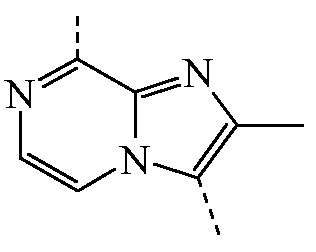 ; или к его фармацевтически приемлемой соли или сольвату.
; или к его фармацевтически приемлемой соли или сольвату.
Таким образом, в дополнительном конкретном варианте осуществления настоящее изобретение относится к соединению формулы (I’), выбранному из соединений формул (I’-a) и (I’-b), определенных ниже:
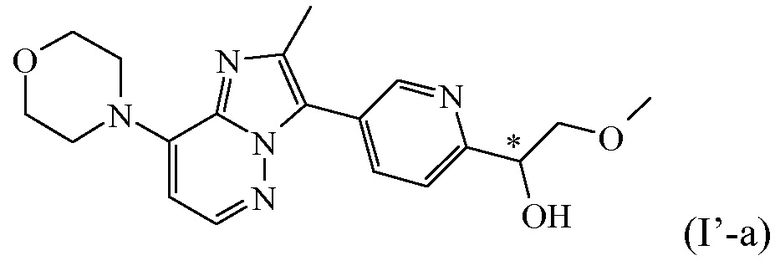 ,
,
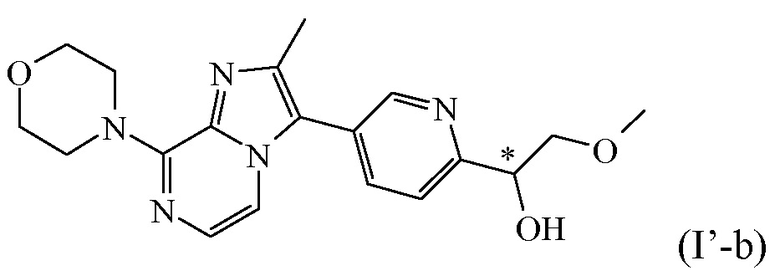
или к его стереоизомерной форме, или к его фармацевтически приемлемой соли или сольвату.
В дополнительном варианте осуществления настоящее изобретение относится к соединению формулы (I’-a) в виде практически чистого энантиомера (+)-(I’-a) ([α]20D=+40,8° (c=0,5, DMF)) или в виде практически чистого энантиомера (-)-(I’-a) ([α]20D=-44,7° (c=0,5, DMF)) или к его фармацевтически приемлемой соли или сольвату. Альтернативным обозначением каждого из энантиомеров является
*R-(I’-a) или *S-(I’-a):
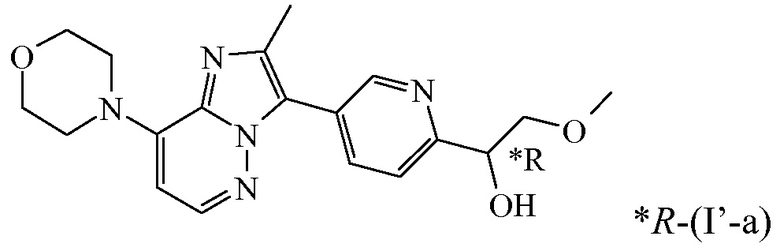 ,
,
имеющий угол оптического вращения [α]=-44,7° (589 нм, c=0,5 г/100 мл, DMF, 20°C); или
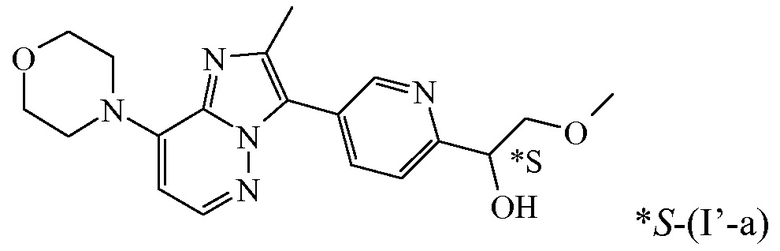 ,
,
имеющий угол оптического вращения [α]=+40,8° (589 нм, c=0,5 г/100 мл, DMF, 20°C).
Согласно дополнительному варианту осуществления настоящее изобретение относится к соединению формулы (I), определенному в данном документе, где R1 и R2 взяты вместе с атомом углерода, к которому они присоединены, с образованием радикала формулы 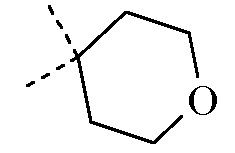 , называемому в данном документе соединением формулы (I”), представленному ниже:
, называемому в данном документе соединением формулы (I”), представленному ниже:
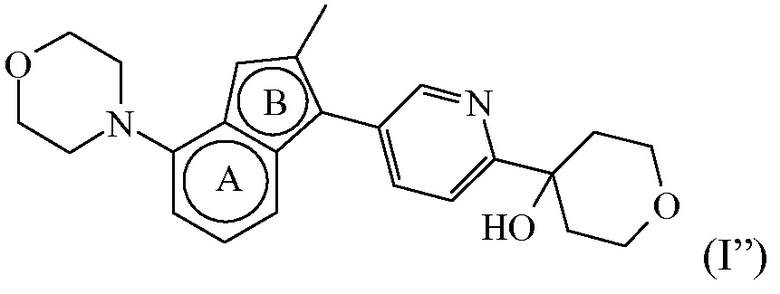 ,
,
где бицикл 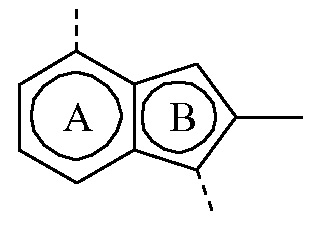
представляет собой бицикл формулы a) 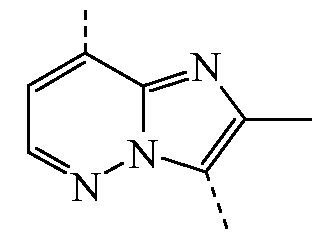 или формулы b)
или формулы b) 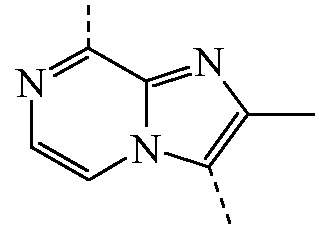 , или к его фармацевтически приемлемой соли или сольвату.
, или к его фармацевтически приемлемой соли или сольвату.
Таким образом, в дополнительном конкретном варианте осуществления настоящее изобретение относится к соединению формулы (I”), выбранному из соединений формул (I”-a) и (I”-b), определенных ниже:
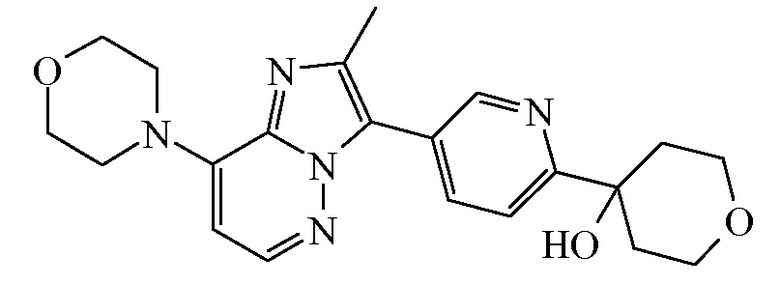
или к его фармацевтически приемлемой соли или сольвату.
Получение
Соединения по настоящему изобретению в большинстве случаев можно получать при помощи последовательности стадий, каждая из которых известна специалисту в данной области. В частности, соединения можно получать согласно следующим способам синтеза.
Соединение формулы (I) во всех соответствующих случаях можно синтезировать в виде рацемической смеси энантиомеров, которые можно отделить друг от друга согласно известным из уровня техники процедурам разделения. Рацемические соединения формулы (I) можно превращать в соответствующие формы диастереомерных солей посредством реакции с подходящей хиральной кислотой. Указанные формы диастереомерных солей можно затем разделять, например, с помощью селективной или фракционной кристаллизации, а энантиомеры выделяют оттуда с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с применением хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы также можно получить из соответствующих чистых стереохимически изомерных форм подходящих исходных материалов при условии, что реакция протекает стереоспецифично.
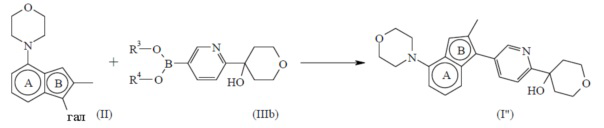
Экспериментальная процедура 1
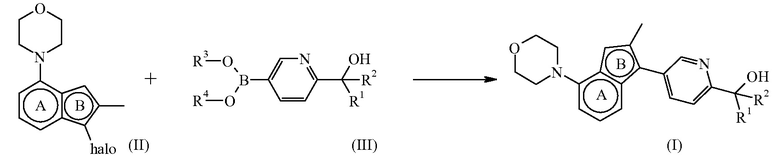
Конечное соединение формулы (I) можно получить посредством сочетания Сузуки путем введения промежуточного соединения формулы (II), где галоген представляет бром или йод, в реакцию с бороновой кислотой или сложным эфиром бороновой кислоты формулы (III), где каждый из R3 и R4 можно независимо выбрать из водорода или C1-4алкила или можно взять вместе с образованием, например, двухвалентного радикала формулы -CH2-CH2-, -CH2-CH2-CH2- или -C(CH3)2C(CH3)2-, в присутствии подходящего катализатора, такого как тетракис(трифенилфосфин)палладий(0), в присутствии подходящего основания, такого как карбонат натрия, в подходящем инертном растворителе, таком как смесь 1,4-диоксана и воды, в подходящих условиях реакции, таких как нагревание при приемлемой температуре, путем традиционного нагревания или под действием микроволнового излучения в течение периода времени, обеспечивающего завершение реакции.
Схема реакций 1
Экспериментальная процедура 1a
Конечное соединение формулы (I), где заместитель -CR1R2(OH) представляет собой
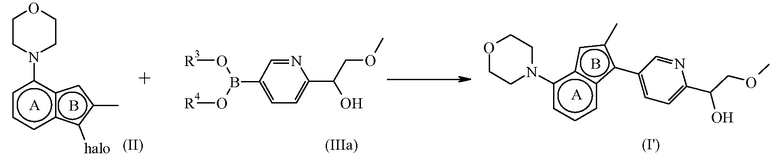
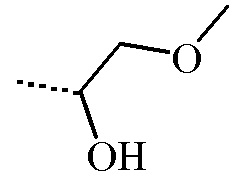 , настоящим называемое соединением формулы (I’), можно получить согласно общей процедуре, описанной в разделе Экспериментальная процедура 1, где соединение формулы (III) имеет формулу (IIIa), где R3 и R4 определены для соединения формулы (III) выше.
, настоящим называемое соединением формулы (I’), можно получить согласно общей процедуре, описанной в разделе Экспериментальная процедура 1, где соединение формулы (III) имеет формулу (IIIa), где R3 и R4 определены для соединения формулы (III) выше.
Схема реакций 1a
Экспериментальная процедура 1b
Конечное соединение формулы (I), где заместитель -CR1R2(OH) представляет собой
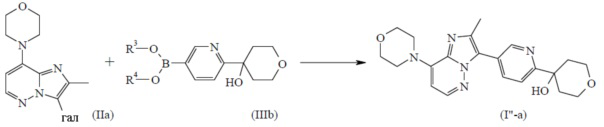
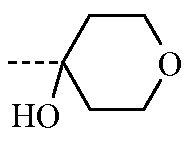 , настоящим называемое соединением формулы (I”), можно получить согласно общей процедуре, описанной в разделе Экспериментальная процедура 1, где соединение формулы (III) имеет формулу (IIIb), где R3 и R4 определены для соединения формулы (III) выше.
, настоящим называемое соединением формулы (I”), можно получить согласно общей процедуре, описанной в разделе Экспериментальная процедура 1, где соединение формулы (III) имеет формулу (IIIb), где R3 и R4 определены для соединения формулы (III) выше.
Схема реакций 1b
Экспериментальная процедура 2a
Промежуточное соединение формулы (II), где
 представляет собой бицикл формулы a)
представляет собой бицикл формулы a)  , называемое в данном документе (IIa), можно получить согласно стадиям реакции, описанным в WO 2011/051342, показанным на схеме реакций (2a) ниже.
, называемое в данном документе (IIa), можно получить согласно стадиям реакции, описанным в WO 2011/051342, показанным на схеме реакций (2a) ниже.
Схема реакций 2a
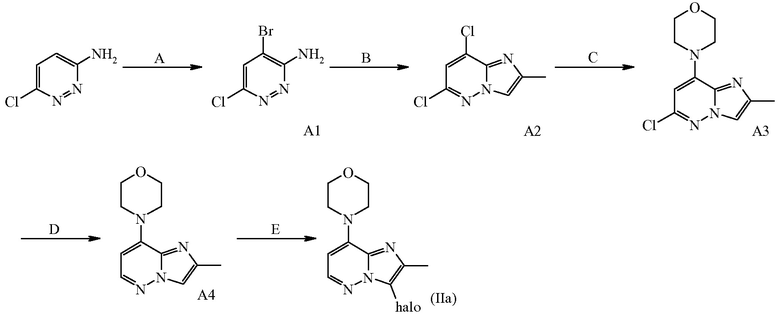
A: бромирование
B: реакция с 2-хлорпропаноном
C: реакция с морфолином
D: дегалогенирование
E: галогенирование
Соединения формулы (II) можно получить согласно вышеописанной схеме реакций (2a) из коммерчески доступных материалов посредством процедуры из пяти стадий (стадии A-E).
На стадии E соединение формулы (IIa) можно получить путем введения промежуточного соединения формулы A4 в реакцию с N-бром- или N-йодсукцинимидом в подходящем инертном растворителе, таком как дихлорметан, в присутствии подходящего кислотного катализатора, такого как уксусная кислота, в подходящих условиях реакции, таких как приемлемая температура, обычно варьирующая в диапазоне от -10°C до 40°C. Конкретный пример стадии E описан в данном документе ниже в отношении синтеза промежуточного соединения A5.
Экспериментальная процедура 2b
Промежуточное соединение формулы (II), где
 представляет собой бицикл формулы b)
представляет собой бицикл формулы b)  , называемое в данном документе (IIb), можно получить согласно стадиям реакции, описанным в WO 2011/110545, показанным на схеме реакций (2b) ниже.
, называемое в данном документе (IIb), можно получить согласно стадиям реакции, описанным в WO 2011/110545, показанным на схеме реакций (2b) ниже.
Схема реакций 2b
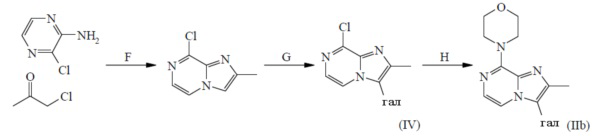
F: реакция с 2-хлорпропаноном
G: галогенирование
H: реакция с морфолином
Соединения формулы (IIb) можно получить согласно вышеописанной схеме реакций (2b) из коммерчески доступных материалов посредством процедуры из трех стадий (стадии F-H).
Стадии F-H можно осуществлять в условиях реакции, подробно описываемых в WO 2011/051342. На стадии G 8-хлор-2-метилимидазо[1,2-a]пиразин вводят в реакцию с N-бром- или N-йодсукцинимидом в подходящем инертном растворителе, таком как DCM, в подходящих условиях реакции, таких как приемлемая температура, обычно варьирующая в диапазоне от -10°C до 60°C, в течение периода времени, обеспечивающего завершение реакции. Стадию H можно осуществлять путем введения соединения формулы (IV) в реакцию с морфолином в подходящем инертном растворителе, таком как CH3CN, в подходящих условиях реакции, таких как нагревание при приемлемой температуре, путем традиционного нагревания или под действием микроволнового излучения в течение периода времени, обеспечивающего завершение реакции. Конкретный пример стадии H описан в данном документе ниже в отношении синтеза промежуточного соединения A8.
Экспериментальная процедура 3
Промежуточное соединение формулы (IIIa) можно получить согласно стадиям реакции, показанным на схеме реакций (3) ниже.
Схема реакций 3
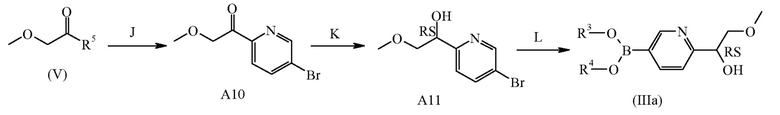
J: образование кетона
K: восстановление кетона
L: образование бороновой кислоты или сложного эфира бороновой кислоты
Соединения формулы (IIIa) можно получить согласно вышеописанной схеме реакций (3), где R3 и R4 могут представлять собой водород или C1-4алкил или могут быть взяты вместе с образованием, например, двухвалентного радикала формулы -CH2-CH2-, -CH2-CH2-CH2- или -C(CH3)2C(CH3)2-, из коммерчески доступных материалов посредством процедуры из трех стадий (стадии J, K, L), описанной в данном документе ниже.
На стадии J соединение формулы A10 можно получить путем введения соединения формулы (V) в реакцию с подходящим реагентом, таким как реактив Гриньяра, полученный из 5-бром-2-йодпиридина, и, например, реагент C1-4алкилмагнийгалогенид, такой как, например, изопропилмагнийхлорид, в условиях реакции, известных специалисту в данной области, как, например, в THF при 0°C в инертной атмосфере. Соединения формулы (V), где R5 может быть выбран, например, из необязательно замещенных -O-C1-4алкила, -N(C1-4алкил)(O-C1-4алкила), -O-арила и образует вместе с группой (C=O) активированное карбонильное соединение, такое как, например, сложный эфир или амид, такой как, например, амид Вайнреба, можно получить коммерчески или получить в соответствии с условиями реакции, известными специалисту в данной области, такими как описанные ниже в отношении синтеза промежуточного соединения A9.
На стадии K соединение формулы A11 можно получить путем введения промежуточного соединения формулы A10 в реакцию с восстановителем, таким как борогидрид натрия, в подходящем инертном растворителе, таком как метанол, в подходящих условиях реакции, таких как приемлемая температура, обычно варьирующая в диапазоне от -10°C до 25°C. Конкретный пример стадии K описан в данном документе ниже в отношении синтеза промежуточного соединения A11.
На стадии L соединение формулы (IIIa) можно получить путем введения промежуточного соединения формулы A11 в реакцию с подходящим три-C1-4алкилборатом, таким как триизопропилборат, в присутствии подходящего основания, такого как н-бутиллитий, в подходящем инертном растворителе, таком как Et2O, в подходящих условиях реакции, таких как приемлемая температура, обычно варьирующая в диапазоне от -78°C до 25°C, альтернативно, соединение формулы (IIIa) можно получить путем введения промежуточного соединения формулы A8 в реакцию с подходящим производным диоксаборолана, таким как, например, 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-бис-1,3,2-диоксаборолан, в присутствии подходящего основания, такого как ацетат калия, в подходящем растворителе, таком как 1,4-диоксан, в присутствии палладиевого катализатора, такого как [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), в подходящих условиях реакции, таких как приемлемая температура, варьирующая от 60 до 100°C. Конкретный пример стадии L описан в данном документе ниже в отношении синтеза промежуточного соединения A12.
Экспериментальная процедура 4
Промежуточное соединение формулы (IIIb) можно получить согласно стадиям реакции, показанным на схеме реакций (4) ниже.
Схема реакций 4
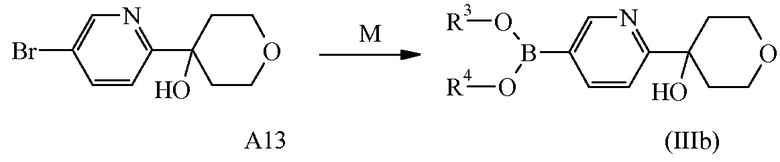
M: образование бороновой кислоты или сложного эфира бороновой кислоты
Соединения формулы (IIIb) можно получить согласно вышеописанной схеме реакций (4), где R3 и R4 могут представлять собой водород или C1-4алкил или могут быть взяты вместе с образованием, например, двухвалентного радикала формулы -CH2-CH2-, -CH2-CH2-CH2- или -C(CH3)2C(CH3)2-, из коммерчески доступных материалов посредством процедуры из одной стадии, описанной в данном документе ниже.
На стадии M соединение формулы (IIIb) можно получить путем введения промежуточного соединения формулы A13 в реакцию с подходящим три-C1-4алкилборатом, таким как триизопропилборат, в присутствии подходящего основания, такого как н-бутиллитий, в подходящем инертном растворителе, таком как Et2O, в подходящих условиях реакции, таких как приемлемая температура, обычно варьирующая в диапазоне от -78°C до 25°C, альтернативно, соединение формулы (IIIb) можно получить путем введения промежуточного соединения формулы A13 в реакцию с подходящим производным диоксаборолана, таким как, например, 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-бис-1,3,2-диоксаборолан, в присутствии подходящего основания, такого как ацетат калия, в подходящем растворителе, таком как 1,4-диоксан, в присутствии палладиевого катализатора, такого как [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), в подходящих условиях реакции, таких как приемлемая температура, варьирующая от 60 до 100°C. Конкретный пример стадии L описан в данном документе ниже в отношении синтеза промежуточного соединения A14.
Соединение формулы A13 [CAS 1206912-74-4] и бороновая кислота на его основе [CAS 1207759-01-0] известны из уровня техники. Типичная процедура синтеза A13 посредством реакции 2,5-дибромпиридина с тетрагидро-4H-пиран-4-оном описана в данном документе ниже.
Экспериментальная процедура 5a
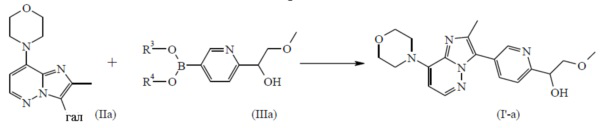
Из вышеописанного следует, что конкретные соединения формулы (I), где
заместитель -CR1R2(OH) представляет собой
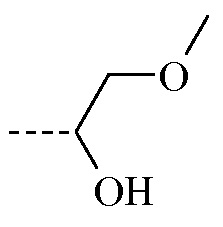 , и
, и  является бициклом формулы a)
является бициклом формулы a) 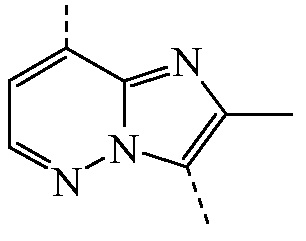 , называемые в данном документе (I’-a), можно получить посредством реакции соединения формулы (IIa) и соединения формулы (IIIa) в условиях реакции, описанных в данном документе выше в разделе Экспериментальная процедура 1.
, называемые в данном документе (I’-a), можно получить посредством реакции соединения формулы (IIa) и соединения формулы (IIIa) в условиях реакции, описанных в данном документе выше в разделе Экспериментальная процедура 1.
Схема реакций 5a
Экспериментальная процедура 5b
Аналогично, соединение формулы (I), где заместитель -CR1R2(OH) представляет собой
 , и
, и 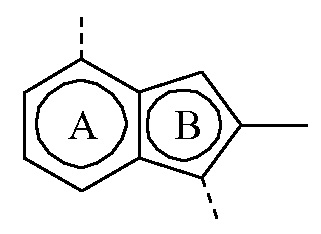 является бициклом формулы b)
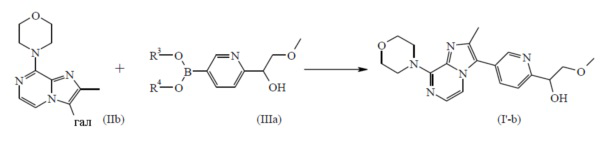
является бициклом формулы b) 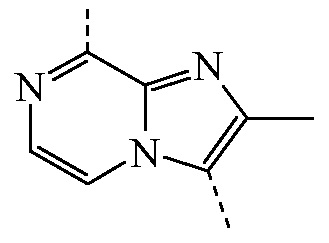 , называемое в данном документе (I’-b), можно получить посредством реакции соединения формулы (IIb) и соединения формулы (IIIa) в условиях реакции, описанных в данном документе выше в разделе Экспериментальная процедура 1.
, называемое в данном документе (I’-b), можно получить посредством реакции соединения формулы (IIb) и соединения формулы (IIIa) в условиях реакции, описанных в данном документе выше в разделе Экспериментальная процедура 1.
Схема реакций 5b
Экспериментальная процедура 5c
Из вышеописанного следует, что конкретные соединения формулы (I), где заместитель -CR1R2(OH) представляет собой 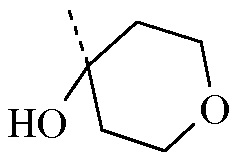 , и
, и  является бициклом формулы a)
является бициклом формулы a) 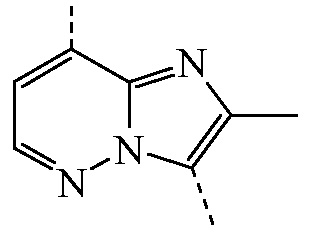 , называемые в данном документе (I”-a), можно получить посредством реакции соединения формулы (IIa) и соединения формулы (IIIb) в условиях реакции, описанных в данном документе выше в разделе Экспериментальная процедура 1.
, называемые в данном документе (I”-a), можно получить посредством реакции соединения формулы (IIa) и соединения формулы (IIIb) в условиях реакции, описанных в данном документе выше в разделе Экспериментальная процедура 1.
Схема реакций 5c
Экспериментальная процедура 5d
Из вышеописанного следует, что конкретные соединения формулы (I), где заместитель -CR1R2(OH) представляет собой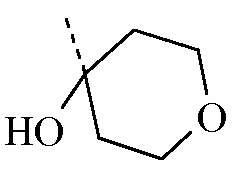 , и
, и 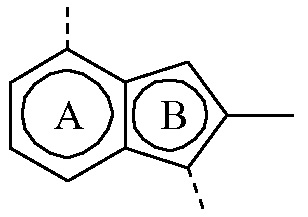 является бициклом формулы a)
является бициклом формулы a) 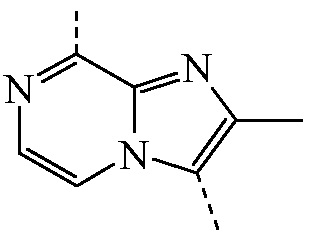 , называемые в данном документе (I”-b), можно получить посредством реакции соединения формулы (IIb) и соединения формулы (IIIb) в условиях реакции, описанных в данном документе выше в разделе Экспериментальная процедура 1.
, называемые в данном документе (I”-b), можно получить посредством реакции соединения формулы (IIb) и соединения формулы (IIIb) в условиях реакции, описанных в данном документе выше в разделе Экспериментальная процедура 1.
Схема реакций 5d
Фармакология
Соединения согласно настоящему изобретению ингибируют активность фермента PDE10, в частности, активность фермента PDE10A, и, следовательно, повышают уровни cAMP или cGMP в клетках, экспрессирующих PDE10. Соответственно, ингибирование активности фермента PDE10 может быть применимым в лечении заболеваний, обусловленных недостаточными количествами cAMP или cGMP в клетках. Ингибиторы PDE10 также могут быть полезны в тех случаях, когда повышение количества cAMP или cGMP выше нормальных уровней приводит в результате к терапевтическому эффекту. Таким образом, ингибиторы PDE10 можно применять для лечения расстройств периферической и центральной нервной системы, сердечно-сосудистых заболеваний, рака, гастроэнтерологических заболеваний, эндокринологических или метаболических заболеваний и урологических заболеваний.
Следовательно, настоящее изобретение относится к соединению согласно настоящему изобретению для применения в качестве медикамента, а также к применению соединения согласно настоящему изобретению или фармацевтической композиции согласно настоящему изобретению для изготовления лекарственного препарата. Настоящее изобретение также относится к соединению согласно настоящему изобретению или к фармацевтической композиции согласно настоящему изобретению для применения в лечении или предупреждении, в частности, в лечении, состояния у млекопитающего, в том числе человека, лечение или предупреждение которого зависит от ингибирования фермента фосфодиэстеразы 10 или облегчается им. Настоящее изобретение также относится к применению соединения согласно настоящему изобретению или фармацевтической композиции согласно настоящему изобретению для изготовления лекарственного препарата для лечения или предупреждения, в частности, для лечения, состояния у млекопитающего, в том числе человека, лечение или предупреждение которого зависит от ингибирования фермента фосфодиэстеразы 10 или облегчается им.
Настоящее изобретение также относится к соединению согласно настоящему изобретению или фармацевтической композиции согласно настоящему изобретению для применения в лечении, предупреждении, уменьшении интенсивности, контроле или снижении риска развития различных неврологических, психических и метаболических расстройств, ассоциированных с дисфункцией фосфодиэстеразы 10, у млекопитающего, в том числе у человека, лечение или предупреждение которых зависит от ингибирования фосфодиэстеразы 10 или облегчается им.
Кроме того, настоящее изобретение относится к применению соединения согласно настоящему изобретению или фармацевтической композиции согласно настоящему изобретению для изготовления лекарственного препарата для лечения, предупреждения, уменьшения интенсивности, контроля или снижения риска развития различных неврологических и психических расстройств, ассоциированных с дисфункцией фосфодиэстеразы 10, у млекопитающего, в том числе у человека, лечение или предупреждение которых зависит от ингибирования фосфодиэстеразы 10 или облегчается им.
Если говорится, что настоящее изобретение относится к применению соединения или композиции согласно настоящему изобретению для изготовления лекарственного препарата для, например, лечения субъекта, такого как млекопитающее, в частности человек, то понимают, что такое применение следует толковать в определенных областях как способ, например, лечения субъекта, такого как млекопитающее, в частности человек, включающий введение субъекту, нуждающемуся в таком, например, лечении, эффективного количества соединения или композиции согласно настоящему изобретению.
В частности, показания, которые можно лечить с помощью ингибиторов PDE10 в отдельности либо в комбинации с другими лекарственными средствами, включают без ограничения такие заболевания, которые, как полагают, частично опосредованы базальными ганглиями, префронтальной корой и гиппокампом.
Эти показания включают неврологические и психические расстройства, выбранные из психотических расстройств и состояний; тревожных расстройств; двигательных расстройств; наркомании; аффективных расстройств; нейродегенеративных расстройств; когнитивных расстройств; боли; аутических расстройств и метаболических расстройств.
В частности, психотические расстройства и состояния, ассоциированные с дисфункцией PDE10, включают одно или несколько из следующих состояний или заболеваний: шизофрения, например, параноидального, дезорганизованного, кататонического, недифференцированного или резидуального типа; шизофреноформное расстройство; шизоаффективное расстройство, как, например, бредового или депрессивного типа; бредовое расстройство; психотическое расстройство, вызванное употреблением химических веществ, такое как психоз, вызванный употреблением алкоголя, амфетамина, марихуаны, кокаина, галлюциногенных веществ, летучих веществ наркотического действия, опиоидов или фенциклидина; расстройства личности параноидального типа и расстройство личности шизоидного типа.
В частности, тревожные расстройства включают паническое расстройство; агорафобию; специфическую фобию, социофобию; обсессивно-компульсивное расстройство; посттравматическое стрессовое расстройство, острое стрессовое расстройство и генерализованное тревожное расстройство.
В частности, двигательные расстройства включают болезнь Хантингтона и дискинезию; болезнь Паркинсона; синдром усталых ног и эссенциальное дрожание. Кроме того, могут быть включены синдром Туретта и другие тиковые расстройства.
В частности, расстройство центральной нервной системы представляет собой расстройство, связанное с химическими веществами, выбранное из группы злоупотребления алкоголем, алкогольной зависимости, алкогольного абстинентного синдрома, алкогольного абстинентного синдрома с делирием, психотического расстройства, вызванного употреблением алкоголя, амфетаминовой зависимости, амфетаминового абстинентного синдрома, кокаиновой зависимости, кокаинового абстинентного синдрома, никотиновой зависимости, никотинового абстинентного синдрома, опиоидной зависимости и опиоидного абстинентного синдрома.
В частности, аффективные расстройства и аффективные эпизоды включают депрессию, манию и биполярные расстройства. Предпочтительно, аффективное расстройство выбрано из группы биполярных расстройств (I и II типа), циклотимического расстройства, депрессии, дистимического расстройства, большого депрессивного расстройства, терапевтически резистентной депрессии и аффективного расстройства, вызванного употреблением химических веществ.
В частности, нейродегенеративные расстройства включают болезнь Паркинсона; болезнь Хантингтона; деменцию, такую как, например, болезнь Альцгеймера; мультиинфарктную деменцию; СПИД-ассоциированную деменцию или лобно-височную деменцию. Нейродегенеративное расстройство или состояние включает дисфункцию реакций стриарных средних шипиковых нейронов.
В частности, расстройство центральной нервной системы представляет собой когнитивное расстройство, выбранное из группы делирия, персистирующего делирия, вызванного употреблением химических веществ, деменции, деменции альцгеймеровского типа, сосудистой деменции, деменции, обусловленной заболеванием, вызываемым HIV, деменции, обусловленной внутричерепными опухолями, черепно-мозговой травмой или травмой головы, деменции, обусловленной инсультом, деменции, обусловленной болезнью Паркинсона, деменции, обусловленной болезнью Хантингтона, деменции, обусловленной болезнью Пика, деменции, обусловленной болезнью Крейтцфельда-Якоба, деменции, обусловленной болезнью телец Леви, персистирующей деменции, вызванной употреблением химических веществ, деменции, обусловленной несколькими этиологическими факторами, деменции без дополнительных уточнений, умеренного когнитивного нарушения, возрастного когнитивного нарушения, угасания, амнестического расстройства, посттравматического стрессового расстройства, олигофрении, нарушения способности к обучению, синдрома дефицита внимания и гиперактивности (ADHD) и синдрома Дауна.
В частности, боль включает острые и хронические состояния, сильную боль, неустранимую боль, нейропатическую боль и посттравматическую боль.
В частности, расстройство центральной нервной системы представляет собой аутическое расстройство или аутизм.
В частности, метаболические расстройства включают сахарный диабет, в частности, сахарный диабет 1-го типа или 2-го типа, и связанные нарушения, такие как ожирение. Дополнительные связанные нарушения включают синдром X, нарушение толерантности к глюкозе, нарушение содержания глюкозы в крови натощак, гестационный сахарный диабет, сахарный диабет взрослого типа у молодых (MODY), латентный аутоиммунный сахарный диабет у взрослых (LADA), дислипидемию, ассоциированную с сахарным диабетом, гипергликемию, гиперинсулинемию, дислипидемию, гипертриглицеридемию и инсулинорезистентность.
Дополнительно, поскольку рост некоторых раковых клеток ингибируется с помощью cAMP и cGMP, соединения по настоящему изобретению могут быть применимыми в лечении рака, такого как рак почки и рак молочной железы.
Предпочтительно, психотическое расстройство выбрано из группы шизофрении, бредового расстройства, шизоаффективного расстройства, шизофреноформного расстройства и психотического расстройства, вызванного употреблением химических веществ.
Предпочтительно, расстройство центральной нервной системы представляет собой расстройство личности, выбранное из группы обсессивно-компульсивного расстройства личности и шизоидного, шизотипического расстройства.
Предпочтительно, расстройство центральной нервной системы представляет собой аффективное расстройство, выбранное из группы биполярных расстройств (I и II типа), циклотимического расстройства, депрессии, дистимического расстройства, большого депрессивного расстройства, терапевтически резистентной депрессии и аффективного расстройства, вызванного употреблением химических веществ.
Предпочтительно, расстройство центральной нервной системы представляет собой синдром дефицита внимания и гиперактивности.
Предпочтительно, расстройство центральной нервной системы представляет собой когнитивное расстройство, выбранное из группы делирия, персистирующего делирия, вызванного употреблением химических веществ, деменции, деменции альцгеймеровского типа, сосудистой деменции, деменции, обусловленной заболеванием, вызываемым HIV, деменции, обусловленной травмой головы, деменции, обусловленной инсультом, деменции, обусловленной болезнью Паркинсона, деменции, обусловленной болезнью Хантингтона, деменции, обусловленной болезнью Пика, деменции, обусловленной болезнью Крейтцфельда-Якоба, деменции, обусловленной болезнью телец Леви, персистирующей деменции, вызванной употреблением химических веществ, деменции, обусловленной несколькими этиологическими факторами, деменции без дополнительных уточнений, умеренного когнитивного нарушения, угасания и синдрома Дауна.
Другие расстройства центральной нервной системы включают тревожное расстройство, ассоциированное с шизофренией, и коморбидные депрессию и тревожность, в частности, большое депрессивное расстройство с коморбидным генерализованным тревожным расстройством, социальным тревожным расстройством или паническим расстройством; при этом следует понимать, что коморбидные депрессия и тревожность также могут обозначаться выражениями “депрессия, сопровождающаяся тревожностью”, “смешанные тревожность и депрессия”, “смешанное тревожное и депрессивное расстройство” или “большое депрессивное расстройство с симптомами тревожности”, которые применяются в данном документе без разграничения.
Предпочтительно, расстройства, которые лечат с помощью соединений по настоящему изобретению, выбраны из шизофрении, обсессивно-компульсивного расстройства, генерализованного тревожного расстройства, болезни Хантингтона, дискинезии, болезни Паркинсона, депрессии, биполярных расстройств, деменции, такой как болезнь Альцгеймера, синдрома дефицита внимания и гиперактивности, наркомании, боли, сахарного диабета и ожирения.
Среди упомянутых выше расстройств особое значение имеет лечение тревожности, обсессивно-компульсивного расстройства, шизофрении, депрессии, синдрома дефицита внимания и гиперактивности, болезни Альцгеймера, болезни Хантингтона и сахарного диабета.
Предпочтительно, расстройства, которые лечат с помощью соединений по настоящему изобретению, представляют собой шизофрению, в том числе ее позитивные и негативные симптомы, а также нарушения познавательных способностей, такие как ухудшение внимания или памяти.
На сегодняшний день четвертое издание Руководства по диагностике и статистике психических расстройств (DSM-IV) Американской психиатрической ассоциации обеспечивает средства диагностики для идентификации расстройств, описанных в данном документе. Специалист в данной области будет осознавать, что для неврологических и психических расстройств, описанных в данном документе, существуют альтернативные номенклатуры, нозологические подходы и системы классификации, и что они видоизменяются вместе с прогрессом в области медицины и научным прогрессом.
Вследствие этого настоящее изобретение также относится к соединению согласно настоящему изобретению для применения в лечении любого из заболеваний, упомянутых выше в данном документе.
Настоящее изобретение также относится к соединению согласно настоящему изобретению для применения в лечении любого из заболеваний, упомянутых выше в данном документе.
Настоящее изобретение также относится к соединению согласно настоящему изобретению для лечения или предупреждения, в частности, для лечения, любого из заболеваний, упомянутых выше в данном документе.
Настоящее изобретение также относится к применению соединения согласно настоящему изобретению для изготовления лекарственного препарата для лечения или предупреждения любого из болезненных состояний, упомянутых выше в данном документе.
Настоящее изобретение также относится к применению соединения согласно настоящему изобретению для изготовления лекарственного препарата для лечения любого из болезненных состояний, упомянутых выше в данном документе.
Соединения по настоящему изобретению можно вводить млекопитающим, предпочтительно людям, для лечения или предупреждения любого из заболеваний, упомянутых выше в данном документе.
Ввиду полезности соединений согласно настоящему изобретению обеспечивается способ лечения теплокровных животных, включая людей, страдающих любым из заболеваний, упомянутых выше в данном документе, и способ предупреждения у теплокровных животных, в том числе у людей, любого из заболеваний, упомянутых выше в данном документе.
Указанные способы включают введение, т.е. системное или местное введение, предпочтительно пероральное введение, терапевтически эффективного количества соединения согласно настоящему изобретению теплокровным животным, в том числе людям.
Таким образом, настоящее изобретение также относится к способу лечения или предупреждения расстройства, упомянутого выше в данном документе, включающему введение субъекту, нуждающемуся в этом, терапевтически эффективного количества любого из соединений или терапевтически эффективного количества фармацевтических композиций, описанных в данном документе.
Соединения согласно настоящему изобретению, описанные в данном документе, можно применять в отдельности, в комбинации или в комбинации с другими фармацевтическими средствами, такими как другие средства, применяемые в лечении психозов, таких как шизофрения и биполярное расстройство, обсессивно-компульсивное расстройство, болезнь Паркинсона, когнитивное нарушение и/или потеря памяти, например, агонисты и положительные аллостерические модуляторы никотиновых ацетилхолиновых рецепторов α-7, ингибиторы PDE4, другие ингибиторы PDE10, блокаторы кальциевых каналов, модуляторы мускариновых ацетилхолиновых рецепторов M1 и M2, модуляторы аденозиновых рецепторов, ампакины, модуляторы NMDA-R, модуляторы mGluR, модуляторы дофаминовых рецепторов, модуляторы серотониновых рецепторов, модуляторы каннабиноидных рецепторов и ингибиторы холинэстеразы (например, донепезил, ривастигмин и галантамин). В таких комбинациях соединения по настоящему изобретению могут использоваться в комбинации с одним или несколькими другими лекарственными средствами в лечении, предупреждении, контроле, уменьшении интенсивности или снижении риска развития заболеваний или состояний, для которых соединения формулы (I) и их стереоизомерные формы, а также их фармацевтически приемлемые соли и сольваты или другие лекарственные средства, могут быть полезными, если комбинация лекарственных средств, применяемых совместно, является более безопасной или более эффективной, чем каждое из лекарственных средств в отдельности.
Специалисту в данной области будет понятно, что терапевтически эффективным количеством соединений по настоящему изобретению является количество, достаточное для ингибирования фермента PDE10, и что это количество варьирует inter alia в зависимости от типа заболевания, концентрации соединения в терапевтическом составе и состояния пациента. Обычно количество ингибитора PDE10, подлежащего введению в качестве терапевтического средства для лечения заболеваний, при которых ингибирование фермента PDE10 является целесообразным, таких как расстройства, описанные в данном документе, будет определяться в каждом конкретном случае лечащим врачом.
Подходящей дозой обычно является доза, которая дает в результате концентрацию ингибитора PDE10 в обрабатываемом участке в диапазоне от 0,5 нM до 200 мкM и в более типичном случае от 5 нM до 50 мкM.
Специалисты в области лечения таких заболеваний смогут определить эффективное суточное терапевтическое количество из результатов испытаний, представленных ниже в данном документе. Эффективное суточное терапевтическое количество будет составлять от приблизительно 0,005 мг/кг до 50 мг/кг, в частности, от 0,01 мг/кг до 50 мг/кг веса тела, более конкретно от 0,01 мг/кг до 25 мг/кг веса тела, предпочтительно от приблизительно 0,01 мг/кг до приблизительно 15 мг/кг, более предпочтительно от приблизительно 0,01 мг/кг до приблизительно 10 мг/кг, более предпочтительно от приблизительно 0,01 мг/кг до приблизительно 2,50 мг/кг, еще более предпочтительно от приблизительно 0,01 мг/кг до приблизительно 1 мг/кг, более предпочтительно от приблизительно 0,05 мг/кг до приблизительно 1 мг/кг веса тела и наиболее предпочтительно от приблизительно 0,1 мг/кг до приблизительно 0,5 мг/кг веса тела. Количество соединения согласно настоящему изобретению, также называемого в данном документе активным ингредиентом, необходимое для достижения терапевтического эффекта, будет конечно же изменяться в каждом конкретном случае, изменяться в зависимости от конкретного соединения, пути введения, возраста и состояния пациента, получающего лечение, и конкретного расстройства или заболевания, подлежащего лечению. Способ лечения может также включать введение активного ингредиента в режиме от одного до четырех раз в день. В таких способах лечения соединения согласно настоящему изобретению предпочтительно составляют перед введением. Как описано в данном документе ниже, подходящие фармацевтические составы получают с помощью известных процедур с применением широко известных и общедоступных ингредиентов.
Фармацевтические композиции
Настоящее изобретение также обеспечивает композиции для предупреждения или лечения заболеваний, при которых ингибирование фермента PDE10 может быть целесообразным, таких как расстройства, описанные в данном документе. Хотя активный ингредиент можно вводить в отдельности, предпочтительно обеспечивать его в виде фармацевтической композиции. Соответственно, настоящее изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или разбавитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения согласно настоящему изобретению, в частности, соединения формулы (I), его фармацевтически приемлемой соли, его сольвата или его стереохимически изомерной формы. Носитель или разбавитель должны быть "приемлемыми" в том смысле, что они должны быть совместимы с другими ингредиентами композиции и не быть вредными для пациентов, их получающих.
Соединения согласно настоящему изобретению, в частности, соединения формулы (I), их фармацевтически приемлемые соли, их сольваты и стереохимически изомерные формы или какая-либо их подгруппа или комбинация могут быть составлены в различные фармацевтические формы для целей введения. В качестве подходящих композиций могут быть упомянуты все композиции, обычно используемые для системного введения лекарственных средств.
Фармацевтические композиции по настоящему изобретению могут быть получены любыми способами, хорошо известными в области фармации, например, при помощи таких способов, как описанные в Gennaro et al. Remington’s Pharmaceutical Sciences (18th ed., Mack Publishing Company, 1990, см. в частности Part 8: Pharmaceutical preparations and their Manufacture). Для получения фармацевтических композиций по настоящему изобретению терапевтически эффективное количество конкретного соединения, необязательно в форме соли, в качестве активного ингредиента объединяют в однородную смесь с фармацевтически приемлемым носителем или разбавителем, при этом носитель или разбавитель может принимать широкое разнообразие форм в зависимости от формы препарата, требуемого для введения. Желательно, чтобы эти фармацевтические композиции находились в единичной лекарственной форме, подходящей, в частности, для перорального, местного (например, с помощью спрея для носа, глазных капель или с помощью крема, геля, шампуня и т.п.), ректального или подкожного введения, введения посредством парентеральной инъекции или посредством ингаляции, как, например, с помощью спрея для носа. Например, при получении композиций в лекарственной форме для перорального применения можно использовать любую из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты и т.п., в случае жидких препаратов для перорального применения, таких как, например, суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как, например, крахмалы, сахара, каолин, разбавители, смазывающие средства, связующие вещества, разрыхлители и т.п., в случае порошков, пилюль, капсул и таблеток. Благодаря простоте введения пероральное введение является предпочтительным, а таблетки и капсулы представляют наиболее предпочтительные единичные лекарственные формы для перорального применения, в случае которых используются твердые фармацевтические носители. В случае композиций для парентерального введения носитель будет, как правило, по меньшей мере в значительной степени содержать стерильную воду, хотя могут быть включены и другие ингредиенты, например, поверхностно-активные вещества, для улучшения растворимости. Например, могут быть получены растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть получены суспензии для инъекций, в случае которых можно использовать подходящие жидкие носители, суспендирующие средства и т.п. Также включены препараты в твердой форме, которые предназначены для преобразования, непосредственно перед применением, в препараты в жидкой форме. В композициях, подходящих для подкожного введения, носитель необязательно включает средство, способствующее проникновению, и/или подходящее смачивающее средство, необязательно в комбинации с подходящими добавками любой природы в незначительных относительных количествах, при этом указанные добавки не оказывают значительного вредного воздействия на кожу. Указанные добавки могут облегчать нанесение на кожу и/или могут быть полезными при получении желаемых композиций. Данные композиции можно вводить различными путями, например, в виде трансдермального пластыря, путем точечной обработки, в виде мази.
Особенно предпочтительным является составление вышеуказанных фармацевтических композиций в единичной лекарственной форме для простоты введения и равномерности дозирования. Единичная лекарственная форма, применяемая в данном документе, относится к физически отдельным единицам, подходящим в качестве единичных доз, при этом каждая единица содержит предварительно установленное количество активного ингредиента, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Примерами таких единичных лекарственных форм являются таблетки (в том числе делимые таблетки или таблетки, покрытые оболочкой), капсулы, пилюли, пакетики с порошком, облатки, суппозитории, растворы или суспензии для инъекций и т.п., чайные ложки с верхом, столовые ложки с верхом, а также их отдельные множества.
Поскольку соединения согласно настоящему изобретению являются соединениями, эффективными при пероральном введении, фармацевтические композиции, содержащие указанные соединения для перорального введения, являются особенно предпочтительными.
Для повышения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях может быть предпочтительным использование α-, β- или γ-циклодекстринов или их производных, в частности, замещенных гидроксиалкилом циклодекстринов, например, 2-гидроксипропил-β-циклодекстрина или сульфобутил-β-циклодекстрина. Также сорастворители, такие как спирты, могут улучшать растворимость и/или стабильность соединений в соответствии с настоящим изобретением в фармацевтических композициях.
Точная дозировка и частота введения зависит от конкретного применяемого соединения формулы (I), или его стереоизомерной формы, или его фармацевтически приемлемых соли или сольвата, конкретного состояния, лечение которого осуществляют, тяжести состояния, лечение которого осуществляют, возраста, веса, пола, степени расстройства и общего физического состояния конкретного пациента, а также другого лекарства, которое индивидуум может принимать, что хорошо известно специалистам в данной области. Более того, очевидно, что указанное эффективное суточное количество можно уменьшать или увеличивать в зависимости от реакции субъекта, подвергаемого лечению, и/или в зависимости от оценки врача, назначающего соединения по настоящему изобретению.
В зависимости от способа введения фармацевтическая композиция будет содержать от 0,05 до 99% по весу, предпочтительно от 0,1 до 70% по весу, более предпочтительно от 0,1 до 50% по весу активного ингредиента и от 1 до 99,95% по весу, предпочтительно от 30 до 99,9% по весу, более предпочтительно от 50 до 99,9% по весу фармацевтически приемлемого носителя, при этом все процентные содержания основываются на общем весе композиции.
Количество соединения формулы (I), или его стереоизомерной формы, или его фармацевтически приемлемых соли или сольвата, которое можно объединять с материалом носителя для получения лекарственной формы с однократной дозировкой, будет варьировать в зависимости от заболевания, лечение которого осуществляют, вида млекопитающего и конкретного способа введения. Однако, в качестве общего руководства, подходящие стандартные дозы соединений по настоящему изобретению могут, например, предпочтительно содержать от 0,1 мг до приблизительно 1000 мг активного соединения. Предпочтительная стандартная доза составляет от 1 мг до 500 мг. Более предпочтительная стандартная доза составляет от 1 мг до приблизительно 300 мг. Еще более предпочтительная стандартная доза составляет от 1 мг до приблизительно 100 мг. Такие стандартные дозы можно вводить более одного раза в день, например, 2, 3, 4, 5 или 6 раз в день, но предпочтительно 1 или 2 раза в день, с тем, чтобы общая дозировка для взрослого человека весом 70 кг находилась в диапазоне от 0,001 до приблизительно 15 мг на кг веса субъекта в расчете на одно введение. Предпочтительная дозировка составляет от 0,01 до приблизительно 1,5 мг на кг веса субъекта в расчете на одно введение, и такая терапия может продолжаться в течение нескольких недель или месяцев, а в некоторых случаях в течение нескольких лет. Однако следует понимать, что определенный уровень дозы для любого конкретного пациента будет зависеть от ряда факторов, включающих активность определенного используемого соединения; возраст, вес тела, общее состояние здоровья, пол и режим питания индивидуума, подвергаемого лечению; время и путь введения; скорость экскреции; другие лекарственные средства, которые были введены ранее; и тяжесть конкретного заболевания, подвергаемого терапии, что хорошо понятно специалистам в данной области.
Типичной дозой может быть одна таблетка от 1 мг до приблизительно 100 мг или от 1 мг до приблизительно 300 мг, принимаемая один раз в день или несколько раз в день, или одна капсула или таблетка пролонгированного действия, принимаемая один раз в день и содержащая пропорционально более высокое содержание активного ингредиента. Эффекта пролонгированного действия можно добиться с помощью материалов капсулы, которые растворяются при различных значениях pH, с помощью капсул, которые медленно высвобождают лекарственное средство при осмотическом давлении, или с помощью любых иных известных средств, обеспечивающих контролируемое высвобождение.
В некоторых случаях может понадобиться применение дозировок вне этих диапазонов, что будет очевидно специалистам в данной области. Кроме того, следует отметить, что клиницист или лечащий врач будут знать, как и когда начинать, прерывать, корректировать или завершать терапию в соответствии с реакцией отдельного пациента.
Как уже отмечалось выше, настоящее изобретение также относится к фармацевтической композиции, содержащей соединения согласно настоящему изобретению и одно или несколько других лекарственных средств, для применения в качестве лекарственного препарата или для применения в лечении, предупреждении, контроле, уменьшении интенсивности или снижении риска развития заболеваний или состояний, при которых соединения формулы (I) и их стереоизомерные формы, а также их фармацевтически приемлемые соли и сольваты или другие лекарственные средства могут также быть полезными. Предполагается применение такой композиции для изготовления лекарственного препарата, а также применение такой композиции для изготовления лекарственного препарата для лечения, предупреждения, контроля, уменьшения интенсивности или снижения риска развития заболеваний или состояний, при которых соединения формулы (I) и их стереоизомерные формы, а также их фармацевтически приемлемые соли и сольваты или другие лекарственные средства могут быть полезными. Настоящее изобретение также относится к комбинации соединения согласно настоящему изобретению и дополнительного фармацевтического средства. Настоящее изобретение также относится к такой комбинации для применения в качестве медикамента. Настоящее изобретение также относится к продукту, содержащему (a) соединение согласно настоящему изобретению, его фармацевтически приемлемую соль или его сольват и (b) дополнительное фармацевтическое средство, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении или предупреждении состояния у млекопитающего, в том числе у человека, лечение или предупреждение которого зависит от эффекта ингибиторов PDE10, в частности, ингибиторов PDE10A, или облегчается им. Различные лекарственные средства в таких комбинации или продукте могут быть объединены в одном препарате вместе с фармацевтически приемлемыми носителями или разбавителями, или каждое из них может присутствовать в отдельном препарате вместе с фармацевтически приемлемыми носителями или разбавителями.
Следующие примеры предназначены для иллюстрации, а не для ограничения объема настоящего изобретения.
Химия
Некоторые способы получения соединений по настоящему изобретению иллюстрируются в следующих примерах. Если не указано иное, все исходные материалы получали от частных поставщиков и применяли без дополнительной очистки.
В дальнейшем в данном документе “DCM” означает дихлорметан, “DIPE” означает диизопропиловый эфир, “DMF” означает N,N-диметилформамид, “Et2O” означает диэтиловый эфир, “ч” означает час(часы), “LCMS” означает жидкостную хроматографию/масс-спектрометрию, “MeCN” означает ацетонитрил, “MeOH” означает метанол, “мин” означает минуту(минуты), “т. пл.” означает температуру плавления, “MS” означает масс-спектрометрию, “Pd(PPh3)4” означает тетракис(трифенилфосфин)палладий(0), “RT” или “к. т.” означает комнатную температуру, “насыщ.” означает насыщенный, “SFC” означает сверхкритическую жидкостную хроматографию, “THF” означает тетрагидрофуран.
Тонкослойную хроматографию (TLC) проводили на пластинках со слоем силикагеля 60 F254 (Merck) с применением растворителей, чистых для анализа. Хроматографию на открытых колонках осуществляли на силикагеле с размером частиц 230-400 меш (Merck) при 60 Ǻ с применением стандартных методик. Автоматизированную колоночную флэш-хроматографию проводили с применением готовых к присоединению картриджей от Merck на силикагеле с частицами неправильной формы с размером частиц 15-40 мкм (одноразовые колонки для нормально-фазовой флэш-хроматографии) в системе SPOT от Armen Instrument.
A. Получение промежуточных соединений
Пример A1
Промежуточное соединение 1
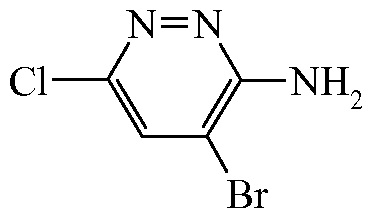
К раствору 3-амино-6-хлорпиридазина ([CAS 5469-69-2] (200 г, 1538 ммоль) и NaHCO3 (258 г, 3076 ммоль) в CH3OH (2000 мл) по каплям добавляли Br2 ([CAS 7726-95-6], 369 г, 2308 ммоль) при 0°C, и смесь перемешивали в течение ночи при комнатной температуре.
Затем добавляли воду (2000 мл), и твердый осадок отфильтровывали и промывали водой. Твердое вещество высушивали под действием вакуума с получением промежуточного соединения 1 (260 г, 81,7%).
Пример A2
Промежуточное соединение 2
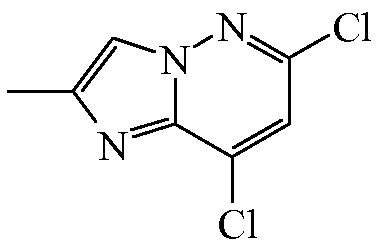
Промежуточное соединение 1 (225 г, 1082 ммоль) и хлор-2-пропанон ([CAS 78-95-5], 478 г, 5410 ммоль) добавляли в DMF (1500 мл) и перемешивали в течение 2 ч при 100°C. Затем реакционную смесь концентрировали под пониженным давлением. Добавляли воду (2000 мл), и смесь экстрагировали с помощью CH2Cl2 (3×2000 мл). Органический слой высушивали над Na2SO4, отфильтровывали, и растворитель выпаривали под пониженным давлением с получением 250 г промежуточного соединения 2, которое применяли без дополнительной очистки.
Пример A3
Промежуточное соединение 3
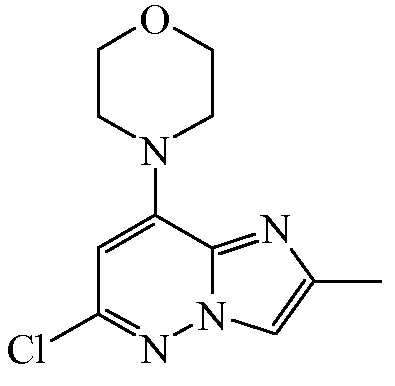
Смесь промежуточного соединения 2 (250 г), морфолина ([CAS 110-91-8], 103 г, 1190 ммоль) и N,N-диизопропилэтиламина ([CAS 7087-68-5], 208,7 г, 1623 ммоль) в CH3CN (2000 мл) нагревали с обратным холодильником в течение 5 ч. Затем реакционную смесь концентрировали под пониженным давлением, и остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат, 3/1) с получением 70 г (22,4%) промежуточного соединения 3 в виде желтого твердого вещества.
Пример A4
Промежуточное соединение 4
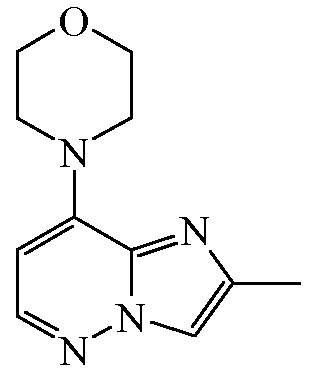
К раствору промежуточного соединения 3 (70 г, 277 ммоль) в CH3OH (1000 мл) добавляли палладий на угле (7 г), и смесь перемешивали при комнатной температуре в атмосфере водорода (30 фунт/кв.дюйм; 206,84 кПа) в течение 10 ч. После поглощения водорода (1 экв.) катализатор отфильтровывали, и растворитель выпаривали под пониженным давлением. Затем остаток растворяли в CH2Cl2 (500 мл) и промывали насыщенным водным раствором NaHCO3. Органический слой отделяли, высушивали над Na2SO4 и выпаривали под пониженным давлением с получением 49 г (81%) промежуточного соединения 4.
Т.пл.=137,2-138,3°C.
Пример A5
Промежуточное соединение 5
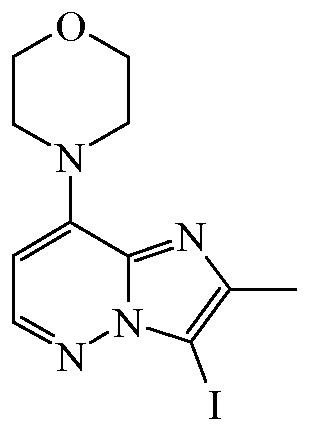
N-йодсукцинимид ([CAS 516-12-1], 97,413 г, 432,973 ммоля) добавляли порциями в смесь промежуточного соединения 4 (90 г, 412,355 ммоля), CH2Cl2 (3840 мл) и уксусной кислоты (153 мл) при 0°C, и полученную в результате смесь перемешивали при 0°C в течение 1 ч. Полученную в результате смесь промывали водным раствором Na2S2O3 (10%) и насыщенным водным раствором Na2CO3, и водный слой дополнительно экстрагировали с помощью CH2Cl2. Объединенный органический слой высушивали (Na2SO4), отфильтровывали и выпаривали in vacuo. Неочищенный продукт растирали в порошок с MeOH, и осадок отфильтровывали и промывали с помощью Et2O с получением 108,279 г (76,3%) промежуточного соединения 5 в виде белого твердого вещества.
Пример A6
Промежуточное соединение 6
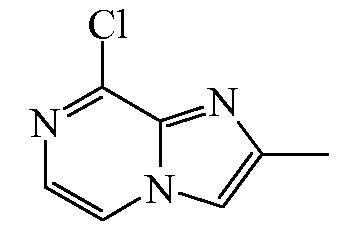
Смесь 3-хлорпиразин-2-иламина (48,7 г, 375,8 ммоля) и хлорацетона (120 мл, 1504,5 ммоля) перемешивали при 90ºC в течение 16 ч в закупоренной пробирке, защищенной от воздействия света. После охлаждения до RT добавляли Et2O, и образующееся твердое вещество отфильтровывали, промывали дополнительным количеством Et2O, суспендировали в насыщенном растворе карбоната натрия и экстрагировали с помощью DCM. Органический слой отделяли, высушивали (Na2SO4), отфильтровывали, и растворители выпаривали in vacuo. Неочищенный продукт осаждали из Et2O с получением промежуточного соединения 6 (43,2 г, 68%) в виде белого твердого вещества, которое применяли на следующей стадии без дополнительной очистки. Т. пл. 133,5-138,6ºC (WRS-2A).
Пример A7
Промежуточное соединение 7
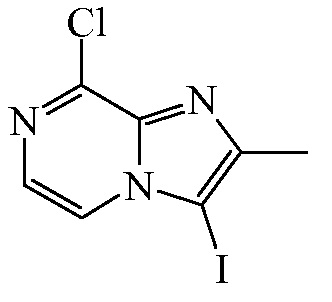
N-йодсукцинимид (14,1 г, 62 ммоль) добавляли в перемешанный раствор промежуточного соединения 6 (9,58 г, 57 ммоль) в смеси DCM и уксусной кислоты при 0oC. Смеси позволяли нагреться до RT, и затем ее перемешивали в течение 16 ч. Смесь разбавляли дополнительным количеством DCM и промывали насыщенным раствором карбоната натрия и тиосульфита натрия. Органический слой отделяли, высушивали (Na2SO4), отфильтровывали, и растворители выпаривали in vacuo. Неочищенный продукт осаждали из диизопропилового эфира с получением промежуточного соединения 7 (16 г, 97%) в виде светло-коричневого твердого вещества, которое применяли на следующей стадии без дополнительной очистки.
Пример A8
Промежуточное соединение 8
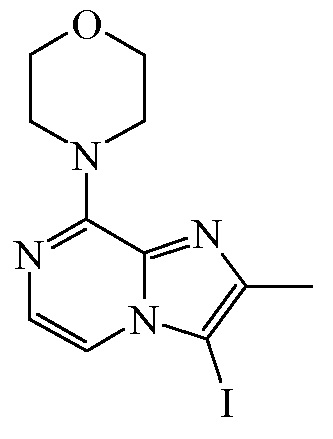
Морфолин (19,79 мл, 224,877 ммоля) добавляли в раствор промежуточного соединения 7 (33 г, 112,439 ммоля) и DIPEA (48,963 мл, 281,097 ммоля) в ацетонитриле (300 мл), и реакционную смесь перемешивали с обратным холодильником (100ºC, нагреватель DrySynTM) в течение ночи. Затем смесь охлаждали на ледяной бане, выпавший в осадок продукт отфильтровывали, прополаскивали ацетонитрилом и высушивали с получением 33,8 г (87%) промежуточного соединения 8. Т.пл. 135,3-136,7ºC (WRS-2A).
Пример A9
Промежуточное соединение 9
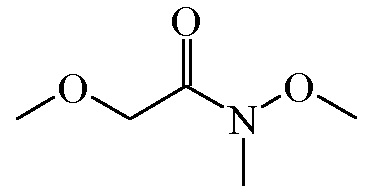
Смесь метоксиуксусной кислоты ([CAS 625-45-6], 200 г, 2220,30 ммоля), гидрохлорида N-метоксиметанамина ([CAS 6638-79-5], 216,577 г, 2220,30 ммоля), 1-гидрокси-1H-бензотриазола (300,014 г, 2220,30 ммоля), гидрохлорида N-(3-диметиламинопропил)-N′-этилкарбодиимида (344,682 г, 2220,300 ммоля) и Et3N (336,742 г, 3330,450 ммоля) в CH2Cl2 (6000 мл) перемешивали при комнатной температуре в течение ночи. Смесь затем промывали насыщенным водным раствором NaHCO3 и 10% водным раствором лимонной кислоты.
Органический слой высушивали (Na2SO4) и концентрировали под действием вакуума с получением 150 г (50,1%) промежуточного соединения 9.
Пример A10
Промежуточное соединение 10
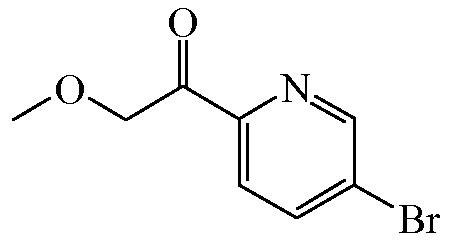
Смесь 5-бром-2-йодпиридина ([CAS 223463-13-6], 140 г, 493,145 ммоля) и THF (2500 мл) перемешивали при 0°C в атмосфере N2. Затем при 0°C добавляли раствор изопропилмагнийхлорида (2,0 M в THF, [CAS 1068-55-9], 246,572 мл, 493,145 ммоля), и полученную в результате смесь перемешивали при 0°C в течение 0,5 ч. Затем по каплям добавляли промежуточное соединение 9 (72,226 г, 542,460 ммоля), и смесь перемешивали при 0°C в течение 1 ч. Реакционную смесь гасили путем добавления HCl (1 M) до pH 2 и перемешивали в течение 0,5 ч. Затем в эту смесь добавляли NaOH (1 M) до pH 11, и смесь экстрагировали этилацетатом. Органический слой концентрировали под действием вакуума, и остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: петролейный эфир/этилацетат, 8/1). Желаемые фракции собирали, и растворитель выпаривали с получением 49 г (43,2%) промежуточного соединения 10.
Пример A11
Промежуточное соединение 11
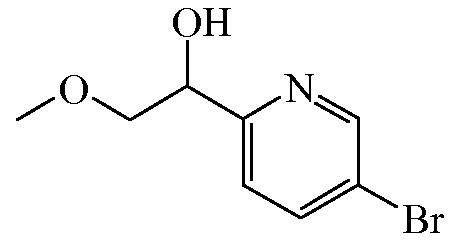
В перемешанный раствор промежуточного соединения 10 (98 г, 425,978 ммоля) в CH3OH (700 мл) при 0°C порциями добавляли NaBH4 (16,200 г, 425,978 ммоля), и смесь перемешивали при 0°C в течение 20 мин. Реакционную смесь затем гасили этилацетатом, растворитель удаляли под действием вакуума, и к полученному в результате остатку добавляли насыщенный водный хлорид аммония. Смесь экстрагировали этилацетатом, и органический слой концентрировали под действием вакуума с получением 87,9 г (87,5%) промежуточного соединения 11.
Пример A12
Промежуточное соединение 12
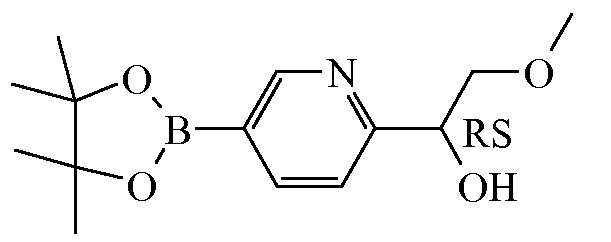
Смесь промежуточного соединения 11 (37,5 г, 161,584 ммоля), 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-бис-1,3,2-диоксаборолана ([CAS 73183-34-3], 65,653 г, 258,535 ммоля) и ацетата калия (55,504 г, 565,545 ммоля) в 1,4-диоксане (750,532 мл) продували с помощью N2 в течение нескольких минут. Затем добавляли [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (11,823 г, 16,158 ммоля), и реакционную смесь перемешивали при 85°C в течение 55 мин. Полученную в результате смесь применяли без дополнительной обработки на последующей стадии реакции.
Пример A13
Промежуточное соединение 13
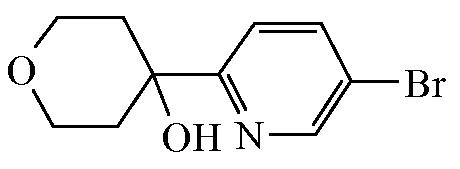
Бутиллитий (2,5 M в гексанах, 20,262 мл, 50,656 ммоля) по каплям добавляли в перемешанный раствор 2,5-дибромпиридина ([CAS 624-28-2], 10 г, 42,213 ммоля) в толуоле (400 мл) в атмосфере азота при -78ºC. Смесь перемешивали при -78ºC в течение 2 ч. Затем по каплям добавляли тетрагидро-4H-пиран-4-он ([CAS 29943-42-8], 4,869 мл, 52,766 ммоля), и смесь перемешивали при -78ºC в течение 1 ч. Смесь гасили насыщ. водным NH4Cl, и ей позволяли нагреться до к.т. Органический слой отделяли, промывали насыщ. NaHCO3, насыщ. NaCl, высушивали (Na2SO4), отфильтровывали и концентрировали in vacuo. Остаток очищали с помощью колоночной флэш-хроматографии (кремнезем; EtOAc в гептане от 0/100 до 30/70) в двух различных партиях. Желаемые фракции собирали, и растворители концентрировали in vacuo с получением 5,21 г (48%) промежуточного соединения 13 в виде белого твердого вещества.
Пример A14
Промежуточное соединение 14
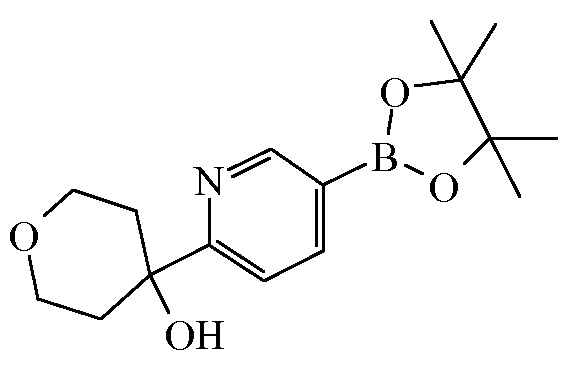
[1,1′-Бис(дифенилфосфино)ферроцен]дихлорпалладий(II) ([CAS 72287-26-4], 70,871 мг, 0,0969 ммоля) добавляли в перемешанную суспензию промежуточного соединения 13, 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-бис-1,3,2-диоксаборолана ([CAS 73183-34-3], 639,492 мг, 2,518 ммоль) и ацетата калия (570,3 мг, 5,8 ммоль) в 1,4-диоксане (4,47 мл) в атмосфере азота. Смесь перемешивали при 85ºC в течение 30 мин с получением промежуточного соединения 14, которое применяли на следующей стадии без дополнительной очистки.
B. Получение конечных соединений
Пример B1
2-Метокси-1-[5-(2-метил-8-морфолин-4-илимидазо[1,2-b]пиридазин-3-ил)пиридин-2-ил]этанол (соединение 1)
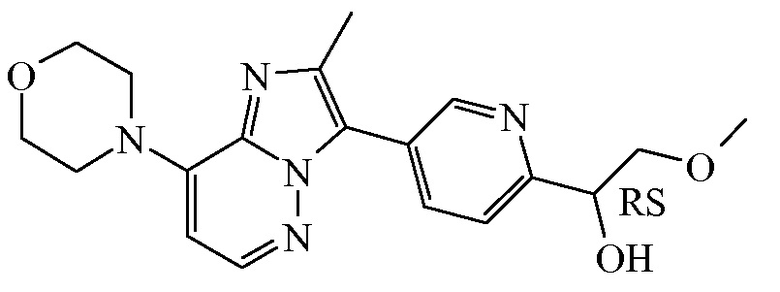
К смеси неочищенного промежуточного соединения 12 (45 г, 161,207 ммоля) в 1,4-диоксане (750 мл) (смеси, полученной в примере A12) добавляли промежуточное соединение 5 (66,576 г, 193,449 ммоля) и насыщенный водный раствор Na2CO3 (52 мл), и ее продували с помощью N2 в течение нескольких минут. Добавляли Pd(PPh3)4 (0,03 экв.), и реакционную смесь перемешивали при 85ºC в течение 24 ч. Затем добавляли дополнительное количество Pd(PPh3)4 (0,01 экв.) и насыщенный водный раствор Na2CO3 (20 мл), и реакционную смесь перемешивали при 85ºC в течение 24 ч. Смесь затем разделяли между CH2Cl2 и водой и экстрагировали. Органические слои высушивали (Na2SO4), отфильтровывали и выпаривали. Неочищенный продукт очищали с помощью колоночной флэш-хроматографии (кремнезем; 7 M раствор аммиака в метаноле в CH2Cl2 (10%) и EtOAc от 0/100 до 80/20). Желаемые фракции собирали, и растворители выпаривали in vacuo. Продукт растирали в порошок с CH3CN и отфильтровывали с получением 37,3 г (62,6%) соединения 1.
Пример B2
2-Метокси-1-[5-(2-метил-8-морфолин-4-илимидазо[1,2-a]пиразин-3-ил)пиридин-2-ил]этанол (соединение 2)

Смесь промежуточного соединения 8 (295,894 мг, 0,86 ммоля) и промежуточного соединения 12 (240 мг, 0,86 ммоля) в 1,4-диоксане (4 мл) и насыщ. Na2CO3 (0,85 мл) продували с помощью N2 в течение нескольких минут. Затем добавляли Pd(PPh3)4 (29,806 мг, 0,0258 ммоля), и смесь перемешивали при 85ºC в течение 16 ч. Смесь разбавляли водой и экстрагировали с помощью CH2Cl2. Органический слой отделяли, высушивали (Na2SO4), отфильтровывали и концентрировали in vacuo. Остаток очищали с помощью колоночной флэш-хроматографии (кремнезем; EtOAc 100% и затем 7 M раствор аммиака в метаноле в CH2Cl2 10/90). Желаемые фракции собирали и концентрировали in vacuo. Неочищенный продукт растирали в порошок с Et2O с получением 95 мг (30%) соединения 2 в виде светло-коричневого твердого вещества.
Пример B3
4-[5-(2-Метил-8-морфолин-4-илимидазо[1,2-b]пиридазин-3-ил)пиридин-2-ил]тетрагидро-2H-пиран-4-ол (соединение 3)
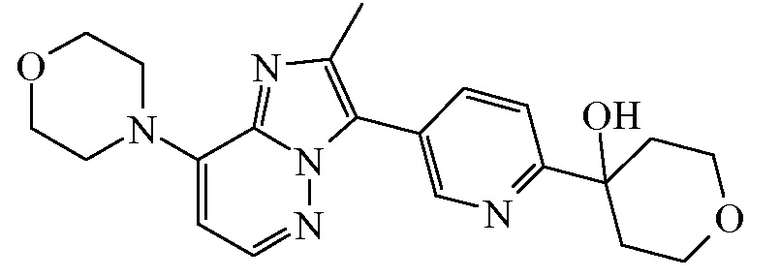
Смесь промежуточного соединения 5 (733,12 мг, 2,13 ммоля) и промежуточного соединения 14 (591 мг, 1,937 ммоль) в 1,4-диоксане (4,5 мл) и насыщ. водном Na2CO3 (2 мл) продували с помощью N2 в течение нескольких минут. Затем добавляли Pd(PPh3)4 (40,293 мг, 0,0349 ммоля), и смесь перемешивали при 85ºC в течение 16 ч. Смесь разбавляли водой и экстрагировали с помощью CH2Cl2. Органический слой отделяли, высушивали (Na2SO4), отфильтровывали и концентрировали in vacuo. Остаток очищали с помощью колоночной флэш-хроматографии (кремнезем; 7 M раствор аммиака в метаноле в CH2Cl2 от 0/100 до 4/96). Желаемые фракции собирали и концентрировали in vacuo. Неочищенный продукт растирали в порошок с DIPE с получением 334 мг (44%) соединения 3 в виде белого твердого вещества.
Пример B4
4-[5-(2-Метил-8-морфолин-4-илимидазо[1,2-a]пиразин-3-ил)пиридин-2-ил]тетрагидро-2H-пиран-4-ол (соединение 4)
Смесь промежуточного соединения 8 (400 мг, 1,162 ммоля) и промежуточного соединения 14 (591 мг, 1,937 ммоля) в 1,4-диоксане (4,5 мл) и насыщ. водном Na2CO3 (1 мл) продували с помощью N2 в течение нескольких минут. Затем добавляли Pd(PPh3)4 (40,293 мг, 0,0349 ммоля), и смесь перемешивали при 85ºC в течение 16 ч. Смесь разбавляли водой и экстрагировали с помощью CH2Cl2. Органический слой отделяли, высушивали (Na2SO4), отфильтровывали и концентрировали in vacuo. Остаток очищали с помощью колоночной флэш-хроматографии (кремнезем; 7 M раствор аммиака в метаноле в CH2Cl2 от 0/100 до 5/95). Желаемые фракции собирали и концентрировали in vacuo. Неочищенный продукт растирали в порошок с MeCN с получением 202 мг (44%) соединения 4 в виде светло-серого твердого вещества.
Аналитическая часть
LCMS:
Для получения характеристик соединений по настоящему изобретению с помощью (LC)MS применяли следующие способы.
Общая процедура A
Измерение в ходе UPLC (сверхэффективной жидкостной хроматографии) проводили с применением системы Acquity UPLC (Waters), включающей поддон для образцов, насос для двухкомпонентных смесей с дегазатором, термостат для четырех колонок, детектор на диодной матрице (DAD) и колонку, указанные в соответствующих способах. Поток из колонки направляли на MS-спектрометр. MS-детектор был оснащен источником электрораспылительной ионизации. Масс-спектры получали на одноквадрупольном SQD-детекторе путем сканирования от 100 до 1000 за 0,1 секунды с применением межканальной задержки 0,08 секунды. Напряжение на капиллярной игле составляло 3,0 кВ. Напряжение на конусе составляло 25 В для режима положительной ионизации и 30 В для режима отрицательной ионизации. Температуру источника поддерживали при 140°C. В качестве газа-распылителя применяли азот. Сбор и обработку данных проводили с помощью программного обеспечения MassLynx-Openlynx.
Способ 1
В дополнение к общей процедуре A: обращенно-фазовую UPLC проводили на RRHD Eclipse Plus-C18 (1,8 мкм, 2,1×50 мм) от Agilent со скоростью потока 1,0 мл/мин при 50ºC. Применяемые условия градиента были следующими: от 95% A (6,5 мМ NH4AcO в H2O/MeCN 95/5), 5% B (MeCN) до 40% A, 60% B через 3,8 минуты, до 5% A, 95% B через 4,6 минуты с удерживанием до 5,0 минуты. Объем вводимой пробы составлял 2 мкл.
Общая процедура B
Измерение в ходе HPLC осуществляли с применением системы HP 1100 (Agilent Technologies), включающей насос для двухкомпонентных смесей с дегазатором, автодозатор, термостат для колонок, детектор на диодной матрице (DAD) и колонку, указанные в соответствующих способах ниже. Поток из колонки разделяли для MS-спектрометра. MS-детектор (TOF) был оснащен источником электрораспылительной ионизации. Масс-спектры получали на времяпролетном (TOF, Waters) детекторе путем сканирования от 100 до 750 за 0,5 секунды с применением времени выдержки 0,3 секунды. Напряжение на капиллярной игле составляло 2,5 кВ для режима положительной ионизации и 2,9 кВ для режима отрицательной ионизации. Напряжение на конусе составляло 20 В как для режима положительной, так и для режима отрицательной ионизации. Температуру источника поддерживали при 140°C. В качестве газа-распылителя применяли азот. Сбор и обработку данных проводили с помощью программного обеспечения MassLynx-Openlynx.
Способ 2
В дополнение к общей процедуре B: обращенно-фазовую HPLC проводили на колонке Eclipse Plus-C18 (3,5 мкм, 2,1×30 мм) от Agilent со скоростью потока 1,0 мл/мин при 60ºC. Применяемые условия градиента были следующими: от 95% A (6,5 мМ NH4AcO в H2O/MeCN 95/5), 5% B (MeCN/MeOH, 1/1) до 100% B через 5,0 мин с удерживанием до 5,15 мин и уравновешиванием до начальных условий с 5,3 мин до 7,0 мин. Объем вводимой пробы составлял 2 мкл.
Температуры плавления
Значения представляют собой максимальные значения либо диапазоны температур плавления, и их получают с экспериментальными погрешностями, которые обычно связаны с данным аналитическим способом.
Для ряда соединений температуры плавления определяли в открытых капиллярных трубках на приборах Mettler FP62 либо Mettler FP81HT-FP90. Температуры плавления измеряли при температурном градиенте 3 или 10°C /мин. Максимальная температура составляла 300°C. Температуру плавления считывали с цифрового дисплея.
Для ряда соединений температуры плавления (т. пл.) определяли с помощью прибора для определения температуры плавления WRS-2A (Shanghai Precision and Scientific Instrument Co. Ltd.). Температуры плавления измеряли при скорости линейного нагревания 0,2-5,0°C /минута. Представленные значения являются диапазонами температур плавления. Максимальная температура составляла 300°C (определенная с помощью WRS-2A).
Аналитические данные
Время удерживания (Rt) в мин, пик [M+H]+ (протонированная молекула), способ LCMS и т. пл. (температура плавления в °C)
Способ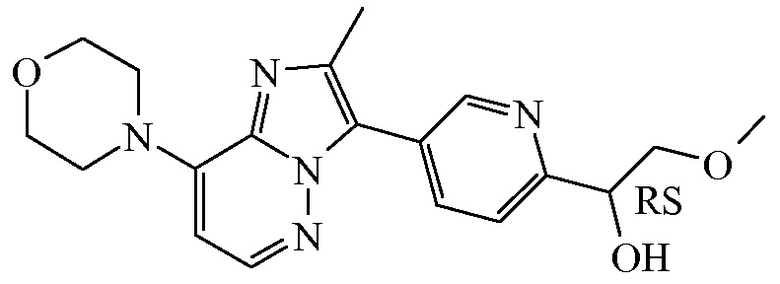
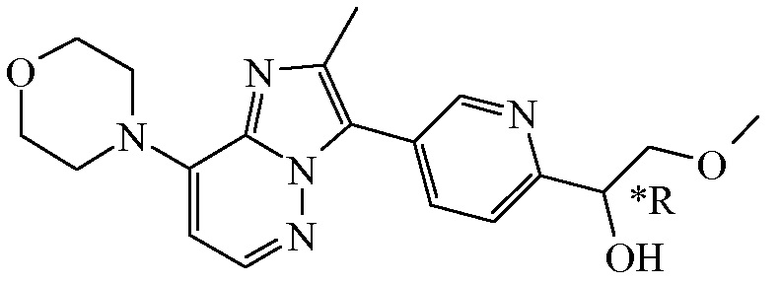
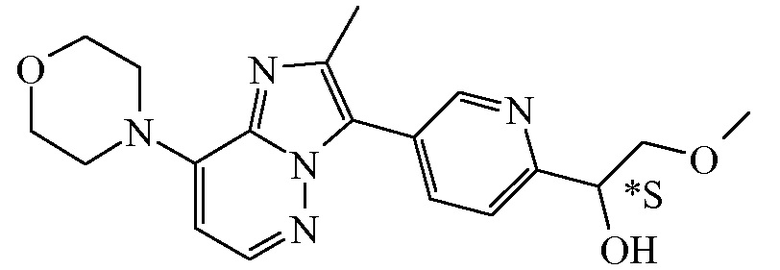
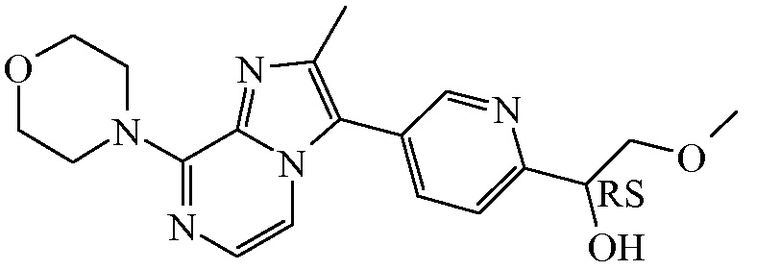
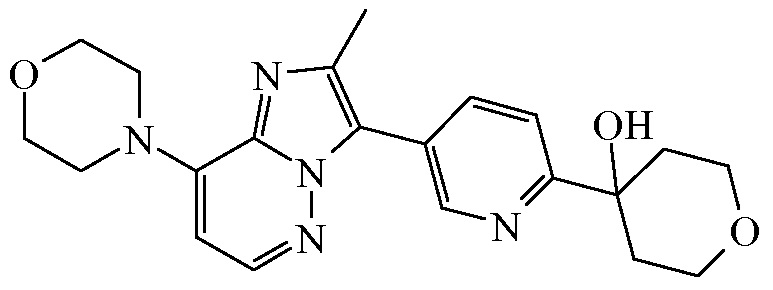
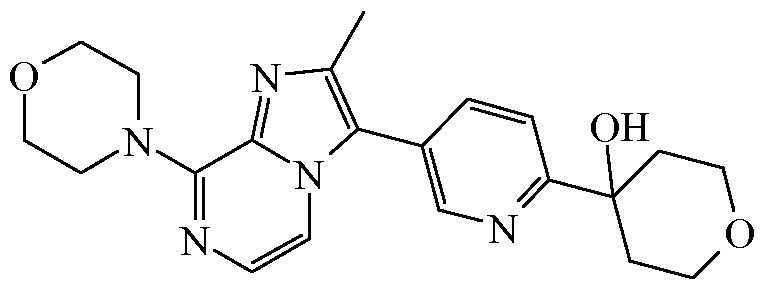
Способы SFC-MS
Общая процедура
Измерение в ходе SFC проводили с применением аналитической системы SFC от Berger Instrument, включающей гидравлический модуль контроля насоса для двухкомпонентных смесей FCM-1200 для доставки диоксида углерода (CO2) и модификатора, автоматический дозатор для жидкости CTC Analytics, модуль контроля температуры TCM-20000 для нагревания колонки от комнатной температуры до 80°C. Применяли UV-детектор на фотодиодной матрице Agilent 1100, оснащенный проточной кюветой для работы под высоким давлением, выдерживающей значения до 400 бар. Поток из колонки разделяли для MS-спектрометра. MS-детектор был оснащен источником ионизации при атмосферном давлении. Параметры ионизации для масс-спектрометра Waters ZQ были следующими: ток коронного разряда: 9 мкА, температура источника: 140°C, напряжение на конусе: 30 В, температура зонда 450°C, напряжение на экстракторе 3 В, поток газа для десольватации 400 л/ч, поток газа через конус 70 л/ч. В качестве газа-распылителя применяли азот. Сбор и обработку данных проводили с помощью системы обработки данных MassLynx-Openlynx от Waters-Micromass.
Способ 1
В дополнение к общей процедуре: хиральное разделение в ходе SFC проводили на колонке CHIRALCEL OD-H DAICEL (5 мкм, 4,6×250 мм) при 35°C со скоростью потока
3,0 мл/мин. Подвижная фаза представляет собой 70% CO2, 30% iPrOH (+0,3% iPrNH2) при выдерживании в течение 7 мин в изократическом режиме.
Аналитические данные SFC - Rt означает время удерживания (в мин), [M+H]+ означает массу протонированного соединения, способ относится к способу, применяемому для анализа энантиомерно чистых соединений с помощью SFC/MS
B означает, что элюируется второй изомер.
Углы оптического вращения
Углы оптического вращения измеряли на поляриметре Perkin-Elmer 341 с натриевой лампой и обозначали следующим образом: [α]º (λ, c г/100 мл, растворитель, TºC).
[α]λT=(100α)/(l×c): здесь l означает длину пробега в дм, а c означает концентрацию в г/100 мл для образца при температуре T (°C) и длине волны λ (в нм). Если применяемая длина волны света составляет 589 нм (D-линия натрия), то вместо этого можно применять символ D. Всегда следует приводить знак направления вращения (+ или -). В случае применения данного уравнения концентрацию и растворитель всегда приводят в круглых скобках после угла вращения. Угол вращения указывают в градусах, а единицы концентрации не приводят (полагают, что они представляют собой г/100 мл).
Аналитические данные - значения угла вращения для энантиомерно чистых соединений
Ядерный магнитный резонанс (ЯМР)
Для ряда соединений 1H-ЯМР-спектры регистрировали на спектрометрах Bruker DPX-400 или Bruker AV-500 со стандартными последовательностями импульсов, работающих при 400 МГц и 500 МГц, соответственно. Химические сдвиги (δ) указаны в частях на миллион (м.д.) для слабопольного сдвига от тетраметилсилана (TMS), который применяли в качестве внутреннего стандарта.
Соединение 1
1H-ЯМР (400 МГц, CDCl3) δ м.д. 2,55 (с, 3 H), 3,45 (с, 3 H), 3,67 (дд, J=9,7, 6,7 Гц, 1 H), 3,75 (дд, J=9,9, 4,4 Гц, 1 H), 3,89-4,02 (м, 8 H), 4,06 (д, J=4,9 Гц, 1 H), 4,98 (дт, J=6,7, 4,6 Гц, 1 H), 6,11 (д, J=5,5 Гц, 1 H), 7,57 (д, J=8,3 Гц, 1 H), 7,99 (д, J=5,5 Гц, 1 H), 8,08 (дд, J=8,1, 2,3 Гц, 1 H), 8,83 (дд, J=2,1, 0,7 Гц, 1 H).
Соединение 1a
1H-ЯМР (500 МГц, CDCl3) δ м.д. 2,54 (с, 3 H), 3,45 (с, 3 H), 3,67 (дд, J=9,8, 6,9 Гц, 1 H), 3,75 (дд, J=9,8, 4,3 Гц, 1 H), 3,87-4,00 (м, 8 H), 4,04 (уш.с, 1 H), 4,98 (дд, J=6,1, 4,6 Гц, 1 H), 6,11 (д, J=5,8 Гц, 1 H), 7,57 (д, J=8,1 Гц, 1 H), 7,99 (д, J=5,5 Гц, 1 H), 8,08 (дд, J=8,1, 2,0 Гц, 1 H), 8,83 (д, J=1,4 Гц, 1 H).
Соединение 1b
1H-ЯМР (500 МГц, CDCl3) δ м.д. 2,55 (с, 3 H), 3,45 (с, 3 H), 3,67 (дд, J=9,5, 6,6 Гц, 1 H), 3,75 (дд, J=9,8, 4,3 Гц, 1 H), 3,88-4,00 (м, 8 H), 4,03 (уш.с, 1 H), 4,98 (дд, J=6,5, 4,5 Гц, 1 H), 6,11 (д, J=5,5 Гц, 1 H), 7,57 (д, J=8,1 Гц, 1 H), 7,99 (д, J=5,5 Гц, 1 H), 8,08 (дд, J=8,1, 2,0 Гц, 1 H), 8,83 (д, J=1,7 Гц, 1 H).
Соединение 2
1H-ЯМР (400 МГц, CDCl3) δ м.д. 1,71 (уш.с, 1 H), 2,45 (с, 3 H), 3,47 (с, 3 H), 3,71 (дд, J=9,7, 6,5 Гц, 1 H), 3,79 (дд, J=9,7, 4,2 Гц, 1 H), 3,90 (т, J=4,9 Гц, 4 H), 4,28 (т, J=4,6 Гц, 4 H), 5,01 (дд, J=6,5, 4,6 Гц, 1 H), 7,36 (д, J=4,6 Гц, 1 H), 7,39 (д, J=4,9 Гц, 1 H), 7,64 (д, J=7,9 Гц, 1 H), 7,80 (дд, J=8,1, 2,3 Гц, 1 H), 8,65 (д, J=1,6 Гц, 1 H).
Соединение 3
1H-ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,54 (д, J=12,4 Гц, 2 H), 2,25 (тд, J=12,6, 5,2 Гц, 2 H), 2,46 (с, 3 H), 3,72-3,87 (м, 8 H), 3,91-4,06 (м, 4 H), 5,34 (с, 1 H), 6,37 (д, J=5,5 Гц, 1 H), 7,82 (д, J=8,1 Гц, 1 H), 8,05-8,15 (м, 2 H), 8,81 (д, J=1,7 Гц, 1 H).
Соединение 4
1H-ЯМР (400 МГц, CDCl3) δ м.д. 1,65 (br. d, J=12,0 Гц, 2 H), 2,21 (тд, J=12,6, 5,5 Гц, 2 H), 2,46 (с, 3 H), 3,90 (дд, J=5,1, 4,6 Гц, 4 H), 3,94-4,09 (м, 4 H), 4,28 (т, J=4,6 Гц, 4 H), 4,99 (с, 1 H), 7,36 (д, J=4,4 Гц, 1 H), 7,39 (д, J=4,6 Гц, 1 H), 7,57 (дд, J=8,2, 0,8 Гц, 1 H), 7,83 (дд, J=8,2, 2,2 Гц, 1 H), 8,64 (дд, J=2,1, 0,9 Гц, 1 H).
Фармакологические примеры
Соединения, обеспечиваемые в настоящем изобретении, являются ингибиторами PDE10, в частности, PDE10A. Поведение ингибиторов PDE10 формулы (I) in vitro и применение модели индуцированной апоморфином стереотипии in vivo показано в таблице 4.
A) Анализ PDE10A in vitro
Рекомбинантную PDE10A человека или крысы (hPDE10A2 или rPDE10A2) экспрессировали в клетках Sf9 с применением рекомбинантной конструкции hPDE10A или rPDE10A на основе бакуловируса. Клетки собирали через 48 ч после инфицирования, и белок hPDE10A или rPDE10A очищали с помощью металл-хелатной хроматографии на Ni-сефарозе 6FF. Тестируемые соединения растворяли и разбавляли в 100% DMSO до 100-кратной концентрации относительно конечной концентрации в анализе. Разведения соединения (0,4 мкл) добавляли в 384-луночные планшеты к 20 мкл буфера для инкубации (50 мМ Tris, pH 7,8, 8,3 мМ MgCl2, 1,7 мМ EGTA). В буфер для инкубации добавляли 10 мкл фермента hPDE10A или rPDE10A, и реакцию начинали путем добавления 10 мкл субстрата до конечной концентрации 60 нМ cAMP и 0,008 мкКи 3H-cAMP. Реакционную смесь инкубировали в течение 60 мин при RT. После инкубации реакцию останавливали с помощью 20 мкл стоп-реагента, состоящего из гранул с PDE для SPA (сцинтилляционного анализа сближения) при концентрации 17,8 мг/мл. После осаждения гранул в течение 30 мин измеряли радиоактивность с помощью сцинтилляционного счетчика Perkin Elmer Topcount, и результаты выражали в имп./мин. Для получения значений для холостой пробы фермент не включали в реакционную смесь и замещали буфером для инкубации. Контрольные значения получали путем добавления DMSO в конечной концентрации 1% вместо соединения. Кривую наилучшего приближения вычерчивали по точкам с помощью способа наименьшей суммы квадратов на графике зависимости % контрольного значения с вычтенным значением для холостой пробы от концентрации соединения, и на основании этой кривой получали значение концентрации полумаксимального ингибирования (IC50). Обзор результатов показан в таблице 4 ниже.
B) Индуцированная апоморфином стереотипия у крыс (APO)
Индуцированную апоморфином (1,0 мг/кг, i.v.) стереотипию (навязчивое обнюхивание, облизывание, жевание) оценивали в баллах каждые 5 мин в течение первого часа после инъекции апоморфина, выполненной по прошествии 1-часового интервала после предварительной обработки тестируемым соединением. Система подсчета баллов была следующей: (3) явно выраженное, (2) умеренное, (1) слабое и (0) отсутствующее. Критерии индуцированного лекарственным средством ингибирования стереотипии: менее 6 оценок в 3 балла (0,16% ложноположительных результатов), менее 6 оценок в ≥2 балла (0,0% ложноположительных результатов) или менее 7 оценок в ≥1 балл (0,81% ложноположительных результатов). Результаты этого теста показаны в таблице 4 ниже.
Фармакологические данные для соединений по настоящему изобретению in vitro и при ингибировании индуцированной апоморфином стереотипии у крыс (APO). pIC50 соответствует -log IC50, выраженному в моль/л. ED50 представляет собой дозу (мг/кг массы тела), при которой 50% тестируемых животных демонстрируют эффект.
pIC50 - фермент человека
pIC50 - фермент крысы
ED50 (мг/кг)
* означает, что соединение дозировали перорально;
‡ ED50 не определяли (соединение тестировали в дозах до 2,5 мг/кг);
(a) обновленные значения представлены после того, как было проведено дополнительное тестирование соединения.
C) Связывание соединений 1a и 1b согласно настоящему изобретению с белками плазмы крови
Система тестирования
Связывание с белками плазмы крови и распределение в крови исследовали на здоровых субъектах-людях. Свежезаготовленную кровь забирали и центрифугировали (приблизительно 1700 g в течение 10 мин, комнатная температура, центрифуга Hettich Rotixa AP). Эксперимент начинали в течение 4 часов после взятия крови.
Меченые растворы и конечные концентрации
Применяли следующие меченые растворы.
Меченые растворы и конечные концентрации
Эксперимент по связыванию с белками плазмы крови
Отдельные холостые образцы плазмы крови от трех здоровых субъектов-мужчин, тестируемые в двух повторностях, обогащали соединением 1a или соединением 1b при различных концентрациях (см. таблицу 5). В образцы плазмы крови добавляли 10 мкл меченого раствора на мл образца (1% этанол (об./об.)).
Обогащенную плазму крови подвергали равновесному диализу (ED) в течение 4 ч против 0,067 M фосфатного буфера с pH 7,17 при 37°C в системе Dianorm с одинаковыми тефлоновыми макроячейками 1 типа и диализными мембранами Spectra/Por®RC 2 (отсечение по MW 12-14 кДа). После диализа содержимое двух отсеков диализных ячеек собирали по отдельности. Образцы буферного раствора разбавляли с помощью 1 мл 5% бычьего сывороточного альбумина в фосфатном буфере при 0,05 M, pH 7,5.
Образцы плазмы крови (до и после равновесного диализа) и образцы буферного раствора анализировали в отношении соединения 1a или соединения 1b при помощи квалифицированного хирального анализа по методу LC-MS/MS на масс-спектрометре API4000 (Applied Biosystems).
Анализ данных
Долю несвязанного тестируемого соединения (fu) рассчитывали как соотношение концентрации несвязанного соединения (Cu) в отсеке с буферным раствором и общей концентрации (CED) в отсеке с белком в диализных ячейках. Процентное содержание свободного тестируемого соединения рассчитывали как
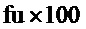
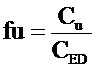
Результаты и обсуждение
Связывание соединения 1a и соединения 1b при 0,1 и 13 мкг/мл с белками плазмы крови изучали посредством равновесного диализа (таблица 6).
Связывание соединений 1a и 1b при 0,1 и 13 мкг/мл соединений 1a или 1b с белками плазмы крови, полученными от людей
Для связывания соединения 1a и соединения 1b с белками плазмы крови в пределах тестируемого диапазона концентраций (от 0,1 до 13 мкг/мл) не было выявлено значимой зависимости от концентрации.
Процентное содержание свободного соединения в плазме крови в среднем было следующим (таблица 7).
Среднее процентное содержание свободного соединения в плазме крови
D) Фармакокинетические характеристики пероральной микродозы соединения 1 согласно настоящему изобретению и соединения 1 из WO2011/051342
Способы
Фармакокинетические характеристики пероральной микродозы соединения 1 согласно настоящему изобретению и соединения 1 из WO2011/051342 изучали в однодозовом открытом рандомизированном фармакокинетическом исследовании (PK) в параллельных группах. Каждая группа лечения состояла из 6 субъектов (здоровых мужчин в возрасте от 18 до 55 лет с индексом массы тела (BMI) от 18 до 30 кг/м2 (включительно) и массой тела не менее 50 кг). Субъектов рандомизировали для получения лечения соединением 1 из WO2011/051342 или соединением 1 (согласно настоящему изобретению).
Соединение 1 из WO2011/051342 и соединение 1 согласно настоящему изобретению поставляли в виде 0,1 мг/мл раствора для перорального применения, содержащего HP-β-CD и лимонную кислоту в очищенной воде. pH раствора доводили до pH 2,0 путем применения хлористоводородной кислоты.
Субъекты поступали в исследовательский центр в день -1. После ночного голодания продолжительностью по меньшей мере 10 часов субъекты получали однократную дозу 100 мкг/мл водного раствора соединения 1 из WO2011/051342 или соединения 1 согласно настоящему изобретению для перорального применения с 240 мл негазированной воды в соответствии с рандомизацией утром в день 1 между 7:00 утра и 10:30 утра. В период от 1 часа до введения лекарственного средства до 1 часа после этого запрещалось пить. Образцы крови забирали в определенные моменты времени для измерения концентраций соединения 1 из WO2011/051342 или соединения 1 (согласно настоящему изобретению) в плазме крови. Субъектов выписывали в день 3 после взятия образца для определения 48-часовых PK-характеристик. Субъекты возвращались в клиническое отделение утром в день 4 для взятия образцов крови для определения 72-часовых PK-характеристик.
Образец крови для фармакогеномного тестирования (9 мл) собирали от всех субъектов, включенных в исследование, в день 1, на что каждый из субъектов давал отдельное согласие.
Все субъекты возвращались в клиническое отделение для визита последующего наблюдения (в течение 7 дней после использования препарата или досрочного завершения участия в исследовании).
Общая продолжительность исследования для каждого субъекта составляла приблизительно 4 недели (включая 21-дневную фазу скрининга и 7-дневную открытую фазу лечения, которая включала визит последующего наблюдения).
Определение фармакокинетических характеристик
Образцы крови из вены на 6 мл для измерения концентраций соединения 1 из WO2011/051342 или соединения 1 согласно настоящему изобретению в плазме крови собирали в определенные моменты времени.
Образцы плазмы крови анализировали с целью определения концентраций соединения 1 из WO2011/051342 или соединения 1 согласно настоящему изобретению при помощи квалифицированного способа жидкостной хроматографии/тандемной масс-спектрометрии (LC-MS/MS).
Определение размера выборки
В случае данного поискового исследования определение размера выборки не было основано на формально-статистических расчетах. Количество субъектов в расчете на вид лечения было обычным размером выборки, используемым в ранних исследованиях по разработке препарата, и оно, как ожидалось, позволяло проводить оценку PK-профиля. На основании предыдущих исследований предположили, что точечная оценка конечного периода полувыведения находится в пределах 71-140% истинного значения с 90% доверительным интервалом.
Фармакокинетический анализ
Фармакокинетические анализы выполняли для данных по всем субъектам, которые получали дозу соединения 1 из WO2011/051342 и соединения 1 согласно настоящему изобретению. Для каждого субъекта на графике откладывали профили зависимости концентраций в плазме крови от времени. Для каждого соединения на графике откладывали профили зависимости средней концентрации от времени, исходя из моментов запланированного взятия образцов крови. Для концентраций в плазме крови в каждый момент взятия образцов и для всех PK-параметров соединения 1 из WO2011/051342 и соединения 1 согласно настоящему изобретению рассчитывали описательные статистические показатели, в том числе среднее арифметическое, стандартное отклонение, CV, среднее геометрическое, медианное значение, минимальное значение и максимальное значение.
Результаты фармакокинетического анализа
Наблюдали двухфазную кривую зависимости концентрации от времени. Всасывание было быстрым при отдельных значениях tmax, варьирующих в диапазоне от 0,5 до 1 часа.
PK-параметры соединения 1 из WO2011/051342 и соединения 1 согласно настоящему изобретению в плазме крови после введения однократной пероральной дозы 100 мкг здоровым субъектам в условиях приема натощак. В таблице Cmax означает пиковую концентрацию соединения в плазме крови после введения, tmax означает время, необходимое для достижения Cmax, AUC означает площадь под кривой зависимости концентрации от времени, λz означает константу скорости терминальной элиминации, t1/2 представляет период полуэлиминации, Vd представляет объем распределения, F представляет биодоступность, CL означает объем плазмы крови, очищающейся от соединения за единицу времени
100 мкг соединения 1 из WO2011/051342
100 мкг соединения 1 согласно настоящему изобретению
b Отдельные значения, указанные для n=2
Vd/F было приблизительно в 3,5 раза ниже для соединения 1 согласно настоящему изобретению (333±117 л) по сравнению с соединением 1 из WO2011/051342 (1181±174 л), и Cl/F было приблизительно в 3,8 раза ниже для соединения 1 согласно настоящему изобретению (47,9±24,6 л/ч) по сравнению с соединением 1 из WO2011/051342 (183±90,8 л/ч).
Примеры возможных композиций
“Активный ингредиент”, как применяется во всех данных примерах, относится к конечному соединению формулы (I), его фармацевтически приемлемым солям, его сольватам и стереохимически изомерным формам.
Типичные примеры прописей состава по настоящему изобретению являются следующими.
1. Таблетки
В данном примере активный ингредиент можно заменять таким же количеством любого из соединений согласно настоящему изобретению, в частности, таким же количеством любого из приведенных в качестве примера соединений.
2. Суспензия
Водную суспензию для перорального введения получают таким образом, что каждый 1 миллилитр содержит от 1 до 5 мг одного из активных соединений, 50 мг карбоксиметилцеллюлозы натрия, 1 мг бензоата натрия, 500 мг сорбита и до 1 мл воды.
3. Инъецируемые композиции
Композицию для парентерального введения получают путем перемешивания 1,5% по весу активного ингредиента по настоящему изобретению в 10% по объему пропиленгликоля в воде.
4. Мазь
В данном примере активный ингредиент можно заменять таким же количеством любого из соединений согласно настоящему изобретению, в частности, таким же количеством любого из приведенных в качестве примера соединений.
Допустимые варианты не следует рассматривать как отклонение от объема настоящего изобретения. Будет очевидно, что специалисты в данной области могут изменять описанное таким образом изобретение различными способами.
Изобретение относится к новым производным формулы (I), также к фармацевтическим композициям, содержащим такие соединения, к способам получения таких соединений и композиций, к применению таких соединений или фармацевтических композиций для предупреждения или лечения неврологических, психических и метаболических расстройств и заболеваний. Технический результат: получены новые соединения, которые являются ингибиторами фермента фосфодиэстеразы 10 (PDE10) и которые могут быть применимы для лечения или предупреждения неврологических, психических и метаболических расстройств, в которые вовлечен фермент PDE10. 5 н. и 8 з.п. ф-лы, 8 табл.
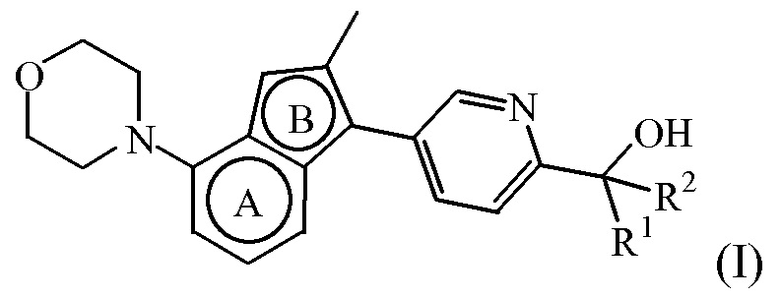
1. Соединение формулы (I)
 ,
,
или его стереоизомерная форма, где
R1 представляет собой H, и R2 представляет собой 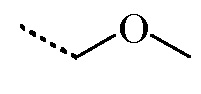 ;
;
или где R1 и R2, взятые вместе с атомом углерода, к которому они присоединены, образуют радикал формулы
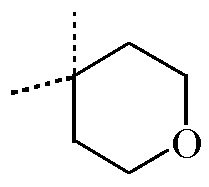 ; и
; и
бицикл 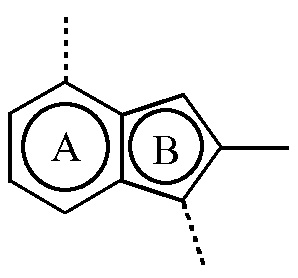
представляет собой бицикл формулы a) 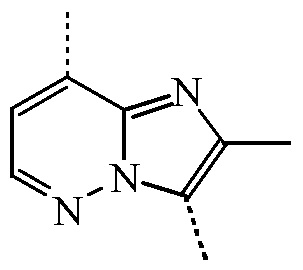 или бицикл формулы b)
или бицикл формулы b) 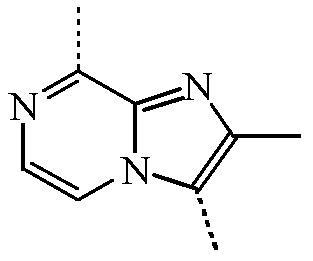 ;
;
или его фармацевтически приемлемая соль или сольват.
2. Соединение по п.1, имеющее формулу (I’)
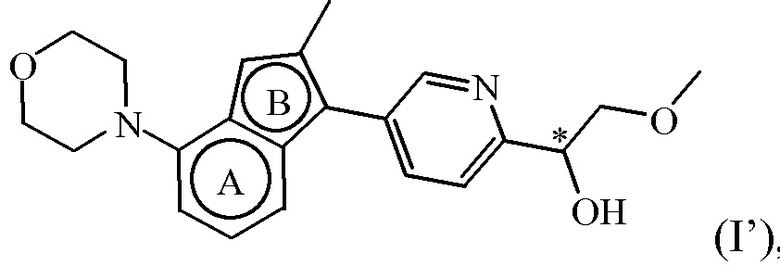 , или его стереоизомерная форма, или его соль или сольват.
, или его стереоизомерная форма, или его соль или сольват.
3. Соединение по п.1, имеющее формулу (I”)
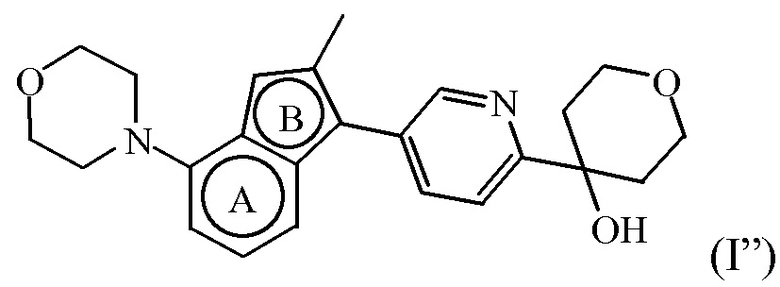 , или его стереоизомерная форма, или его соль или сольват.
, или его стереоизомерная форма, или его соль или сольват.
4. Соединение по п.1, выбранное из группы, состоящей из
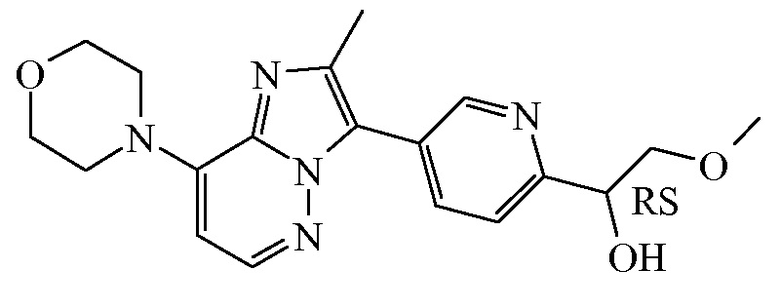 ,
,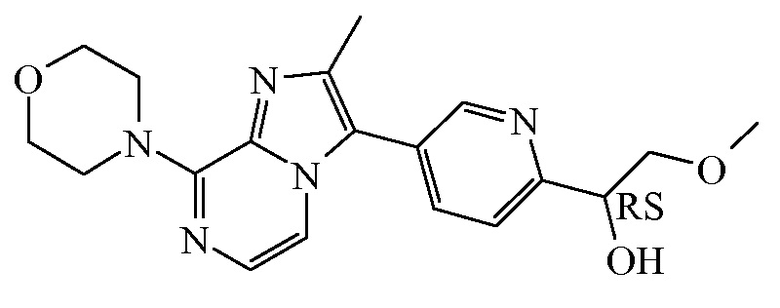
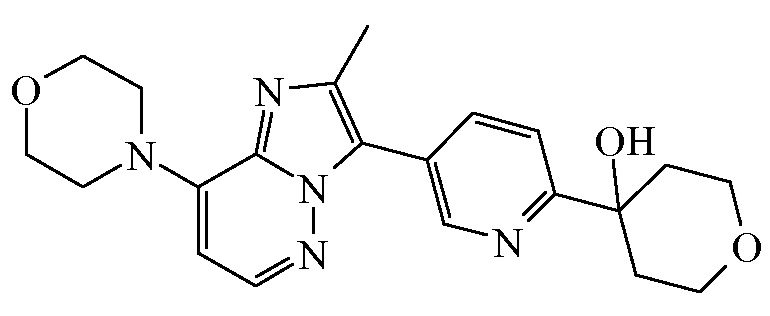 и
и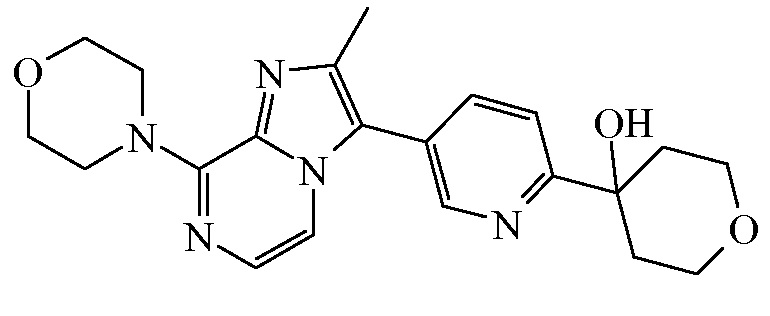
или его стереоизомерная форма, или его фармацевтически приемлемая соль или сольват.
5. Соединение по п.1, выбранное из
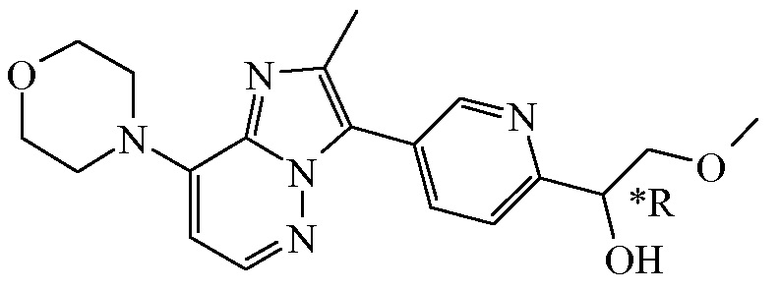
имеющего оптическое вращение [α]=-44,7° (589 нм, c 0,5 г/100 мл, DMF, 20°C); или
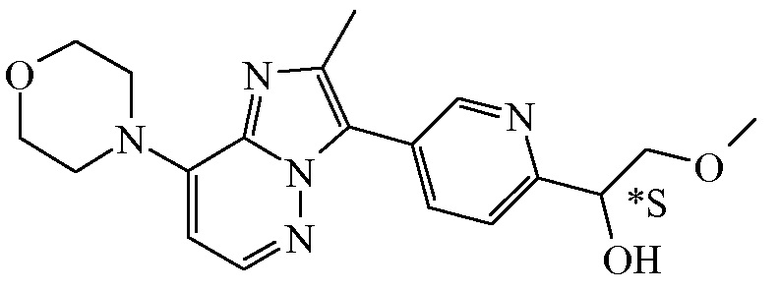
имеющего оптическое вращение [α]=+40,8° (589 нм, c 0,5 г/100мл, DMF, 20°C);
или его фармацевтически приемлемая соль или сольват.
6. Фармацевтическая композиция для ингибирования фермента PDE10, содержащая терапевтически эффективное количество соединения по любому из пп.1-5 и фармацевтически приемлемый носитель или наполнитель.
7. Соединение по любому из пп.1-5 или фармацевтическая композиция по п.6 для применения в качестве лекарственного средства для ингибирования фермента PDE10.
8. Соединение по любому из пп.1-5 или фармацевтическая композиция по п.6 для применения в лечении или предупреждении расстройства центральной нервной системы, выбранного из группы психотических расстройств и состояний, двигательных расстройств, наркомании, нейродегенеративных расстройств и когнитивных расстройств.
9. Соединение или фармацевтическая композиция по п.8, где
психотические расстройства и состояния выбраны из группы шизофрении, шизофреноформного расстройства, шизоаффективного расстройства, бредового расстройства, психотического расстройства, вызванного употреблением химических веществ, расстройств личности параноидального типа и расстройства личности шизоидного типа;
двигательные расстройства выбраны из группы болезни Хантингтона, дискинезии, болезни Паркинсона, синдрома усталых ног, эссенциального дрожания, синдрома Туретта и других тиковых расстройств;
расстройства, связанные с химическими веществами, выбраны из группы злоупотребления алкоголем, алкогольной зависимости, алкогольного абстинентного синдрома, алкогольного абстинентного синдрома с делирием, психотического расстройства, вызванного употреблением алкоголя, амфетаминовой зависимости, амфетаминового абстинентного синдрома, кокаиновой зависимости, кокаинового абстинентного синдрома, никотиновой зависимости, никотинового абстинентного синдрома, опиоидной зависимости и опиоидного абстинентного синдрома;
нейродегенеративные расстройства выбраны из группы болезни Паркинсона, болезни Хантингтона, болезни Альцгеймера, мультиинфарктной деменции, СПИД-ассоциированной деменции или лобно-височной деменции; и
когнитивные расстройства выбраны из группы делирия, персистирующего делирия, вызванного употреблением химических веществ, деменции, деменции альцгеймеровского типа, сосудистой деменции, деменции, обусловленной заболеванием, вызываемым HIV, деменции, обусловленной внутричерепными опухолями, черепно-мозговой травмой или травмой головы, деменции, обусловленной инсультом, деменции, обусловленной болезнью Паркинсона, деменции, обусловленной болезнью Хантингтона, деменции, обусловленной болезнью Пика, деменции, обусловленной болезнью Крейтцфельда-Якоба, деменции, обусловленной болезнью телец Леви, персистирующей деменции, вызванной употреблением химических веществ, деменции, обусловленной несколькими этиологическими факторами, деменции без дополнительных уточнений, умеренного когнитивного нарушения, возрастного когнитивного нарушения, угасания, амнестического расстройства, посттравматического стрессового расстройства, олигофрении, нарушения способности к обучению, синдрома дефицита внимания и гиперактивности (ADHD) и синдрома Дауна.
10. Способ получения фармацевтической композиции по п. 6, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по любому из пп.1-5.
11. Способ получения соединения по любому из пп.1-5, где R1 и R2 определены в любом из пп.1-5, включающий стадию
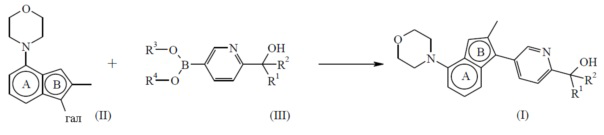
взаимодействия соединения формулы (II), где галоген представляет собой бром или йод, с бороновой кислотой или соединением формулы (III), где каждый из R3 и R4 можно независимо выбрать из водорода или C1-4алкила или можно взять вместе с образованием двухвалентного радикала формулы -CH2-CH2-, -CH2-CH2-CH2- или -C(CH3)2C(CH3)2- в присутствии подходящего катализатора и подходящего основания в подходящем инертном растворителе при нагревании.
12. Способ лечения или предупреждения расстройства центральной нервной системы, выбранного из группы психотических расстройств и состояний, двигательных расстройств, наркомании, нейродегенеративных расстройств и когнитивных расстройств, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп.1-5 или терапевтически эффективного количества фармацевтической композиции по п.6.
13. Способ по п.12, отличающийся тем, что
психотические расстройства и состояния выбраны из группы шизофрении, шизофреноформного расстройства, шизоаффективного расстройства, бредового расстройства, психотического расстройства, вызванного употреблением химических веществ, расстройств личности параноидального типа и расстройства личности шизоидного типа;
двигательные расстройства выбраны из группы болезни Хантингтона, дискинезии, болезни Паркинсона, синдрома усталых ног, эссенциального дрожания, синдрома Туретта и других тиковых расстройств;
расстройства, связанные с химическими веществами, выбраны из группы злоупотребления алкоголем, алкогольной зависимости, алкогольного абстинентного синдрома, алкогольного абстинентного синдрома с делирием, психотического расстройства, вызванного употреблением алкоголя, амфетаминовой зависимости, амфетаминового абстинентного синдрома, кокаиновой зависимости, кокаинового абстинентного синдрома, никотиновой зависимости, никотинового абстинентного синдрома, опиоидной зависимости и опиоидного абстинентного синдрома;
нейродегенеративные расстройства выбраны из группы болезни Паркинсона, болезни Хантингтона, болезни Альцгеймера, мультиинфарктной деменции, СПИД-ассоциированной деменции или лобно-височной деменции; и
когнитивные расстройства выбраны из группы делирия, персистирующего делирия, вызванного употреблением химических веществ, деменции, деменции альцгеймеровского типа, сосудистой деменции, деменции, обусловленной заболеванием, вызываемым HIV, деменции, обусловленной внутричерепными опухолями, черепно-мозговой травмой или травмой головы, деменции, обусловленной инсультом, деменции, обусловленной болезнью Паркинсона, деменции, обусловленной болезнью Хантингтона, деменции, обусловленной болезнью Пика, деменции, обусловленной болезнью Крейтцфельда-Якоба, деменции, обусловленной болезнью телец Леви, персистирующей деменции, вызванной употреблением химических веществ, деменции, обусловленной несколькими этиологическими факторами, деменции без дополнительных уточнений, умеренного когнитивного нарушения, возрастного когнитивного нарушения, угасания, амнестического расстройства, посттравматического стрессового расстройства, олигофрении, нарушения способности к обучению, синдрома дефицита внимания и гиперактивности (ADHD) и синдрома Дауна.
| WO 2011051342 A1, 05.05.2011 | |||
| EA 201290878 A1, 29.03.2013 | |||
| СОЕДИНЕНИЯ 7-ФЕНИЛПИРАЗОЛОПИРИДИНА | 2003 |
|
RU2327699C2 |
Авторы
Даты
2018-09-14—Публикация
2013-07-08—Подача