ОБЛАСТЬ ТЕХНИКИ
[0001] В целом настоящее изобретение относится к области лекарственных соединений и фармацевтических композиций. Более конкретно, настоящее изобретение относится к лекарственным амидным соединениям. Указанные амидные соединения могут лучше распределяться в центральной нервной системе.
РОДСТВЕННЫЕ ЗАЯВКИ
[0002] Данная заявка испрашивает приоритет на основании предварительной заявки на патент США №62/374657, поданной 12 августа 2017 года.
[0003] Родственные заявки: US 62/119001, поданная 20 февраля 2015 г.; PCT/US 16/18732, поданная 19 февраля 2016 г.; US 15/048672, поданная 19 февраля 2016 г.; US 62/338178, поданная 18 мая 2016 г.; US 61/819467, поданная 3 мая 2013 г.; PCT/US 13/53640, поданная 5 августа 2013 г.; PCT/US 14/14943, поданная 5 февраля 2014 г. и US 14/888577, поданная 2 ноября 2015 г. Все перечисленные выше заявки включены в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0004] Растет интерес к активации специфических сигнальных путей гормонов щитовидной железы в головном мозге для лечения некоторых заболеваний ЦНС, в частности, связанных с дефектами миелинизации(Fourcade S et al., Mol Pharmacol 63, 1296-1303 (2003) и Baxi EG et al, Glia 62, 1513-1529 (2014); оба документа включены в настоящее описание посредством ссылки). Гормоны щитовидной железы T4 и T3 не подходят в качестве терапевтических средств для этих показаний, так как для них не существует терапевтического окна, в котором желаемый терапевтический эффект был бы отделен от неблагоприятных эффектов, связанных с гипертиреозом, таких как тахикардия, истощение мышц и остеопороз (Yen PM et al, Physiol Rev 81, 1097-1142 (2001); Yen PM et al, Mol Cell Endocrinol 246, 121-127 (2006); Biondi B and Klein I, Endocrine 24, 1-13 (2004); и Klein I and Ojamaa K, Endocrinol Metab Clin North Am 27, 51-62 (1998); все эти документы включены в настоящее описание посредством ссылки). Эту проблему потенциально можно решить за счет определенных синтетических агонистов Т3, которые проявляют селективное к тканям действие гормонов щитовидной железы (Joharapurkar AA et al, J Med Chem 55, 5649-5675 (2012); документ включен в настоящее описание посредством ссылки).
[0005] Примером является собетиром (также известный как GC-1), который интенсивно изучали в течение последних 15 лет (Scanlan TS, Heart Fail Rev 15, 177-182 (2010); документ включен в настоящее описание посредством ссылки). Считается, что собетиром и Т3 влияют на снижение уровня холестерина ЛПНП, стимулируя механизмы вывода холестерина в печени. Преимущество собетирома состоит в том, что его влияние по существу не сопровождается вредным воздействием на сердце, мышцы или кости (Grover GJ et al., Endocrinology 145, 1656-1661 (2004); документ включен в настоящее описание посредством ссылки). Применение собетирома для лечения нейродегенеративных заболеваний было описано ранее (WO 2014/178931). Для терапевтических агентов, нацеленных на нейродегенеративные заболевания, часто желательна улучшенная эффективность распределения в ЦНС. Существует потребность в соединениях с улучшенным распределением в ЦНС для лечения нейродегенеративных заболеваний (например, демиелинизирующих заболеваний).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0006] В одном аспекте настоящее изобретение относится к соединению формулы I:
 формула I, или его фармацевтически приемлемой соли, где R1 представляет собой амид.
формула I, или его фармацевтически приемлемой соли, где R1 представляет собой амид.
[0007] Некоторые варианты реализации этого аспекта относятся к соединению формулы II:
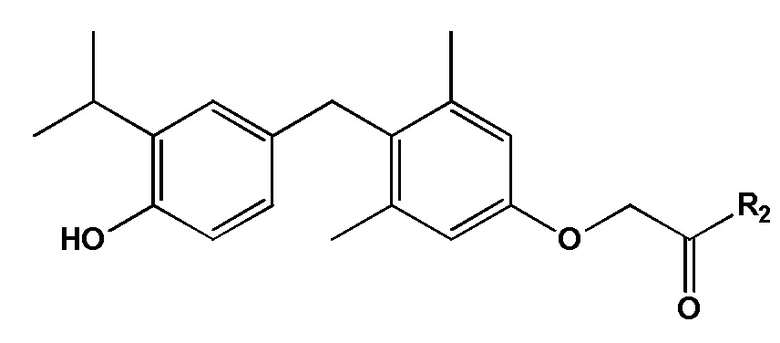 формула II, или его фармацевтически приемлемой соли, где R2 представляет собой алкиламино.
формула II, или его фармацевтически приемлемой соли, где R2 представляет собой алкиламино.
[0008] Некоторые варианты реализации этого аспекта относятся к соединению формулы II:
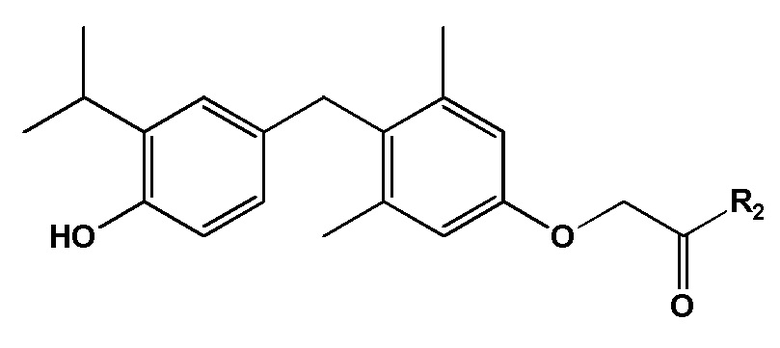 формула II, или его фармацевтически приемлемой соли, где R2 представляет собой амино.
формула II, или его фармацевтически приемлемой соли, где R2 представляет собой амино.
[0009] Некоторые варианты реализации относятся к соединению формулы III:
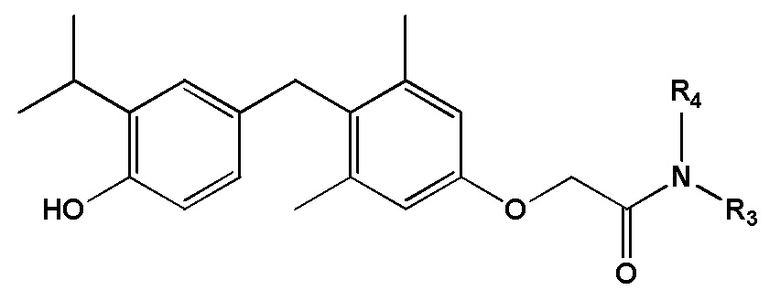 формула III, или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо представляет собой H, алкил, циклоалкил, замещенный алкил, незамещенный алкил, гетероалкил, насыщенный алкил, ненасыщенный алкил, арил, амино или этокси. В некоторых определенных вариантах реализации настоящего изобретения R3 представляет собой метил и R4 представляет собой метил.
формула III, или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо представляет собой H, алкил, циклоалкил, замещенный алкил, незамещенный алкил, гетероалкил, насыщенный алкил, ненасыщенный алкил, арил, амино или этокси. В некоторых определенных вариантах реализации настоящего изобретения R3 представляет собой метил и R4 представляет собой метил.
[0010] Некоторые варианты реализации относятся к соединению формулы IV:
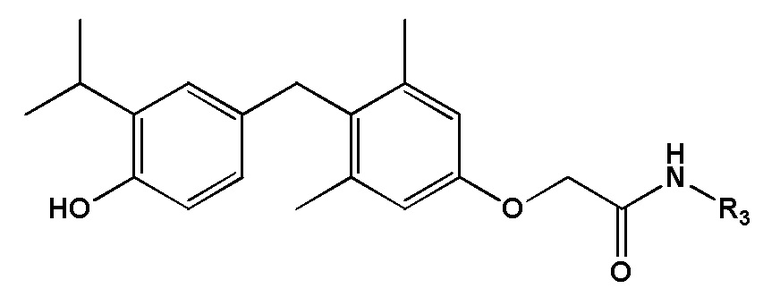 формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой Н, гидроксил, амино, метил, этил, пропил, циклопропил, 2-гидроксиэтил, 1-гидроксипропан-2-ил, 2-гидроксипропил, 2-аминоэтилацетат, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, фенил, (4-нитро)фенил, 2-фенилэтил 2-(2-гидроксифенил)этил, 2-(3-гидроксифенил)этил, 2-(3,4-дигидроксифенил)этил, 3-фторэтил; S-метилсульфонил, 1-(2-гидроксиэтил)-2-гидроксиэтил, 2-пропенил, 2-пропинил, метокси, 2-этилсульфонат натрия, цианометил или оксетанил.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой Н, гидроксил, амино, метил, этил, пропил, циклопропил, 2-гидроксиэтил, 1-гидроксипропан-2-ил, 2-гидроксипропил, 2-аминоэтилацетат, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, фенил, (4-нитро)фенил, 2-фенилэтил 2-(2-гидроксифенил)этил, 2-(3-гидроксифенил)этил, 2-(3,4-дигидроксифенил)этил, 3-фторэтил; S-метилсульфонил, 1-(2-гидроксиэтил)-2-гидроксиэтил, 2-пропенил, 2-пропинил, метокси, 2-этилсульфонат натрия, цианометил или оксетанил.
[0011] Некоторые варианты реализации относятся к соединению формулы III:
 формула III, или его фармацевтически приемлемой соли, где R4 выбран из H и C1-6 алкила; и R3 представляет собой: (а) Н, ОН, NH2, -NH(С1-6 алкил), -N(С1-6 алкил)2, -SO2H, -SO2(С1-6 алкил), С2-6 алкенил, С2-6 алкинил, С3-6 циклоалкил или 3-6-членное гетероциклильное кольцо, содержащее один гетероатом, выбранный из О, N и S; или (b) C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена; или (c) -О-C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена; или (d) фенильную группу, необязательно замещенную 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена.
формула III, или его фармацевтически приемлемой соли, где R4 выбран из H и C1-6 алкила; и R3 представляет собой: (а) Н, ОН, NH2, -NH(С1-6 алкил), -N(С1-6 алкил)2, -SO2H, -SO2(С1-6 алкил), С2-6 алкенил, С2-6 алкинил, С3-6 циклоалкил или 3-6-членное гетероциклильное кольцо, содержащее один гетероатом, выбранный из О, N и S; или (b) C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена; или (c) -О-C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена; или (d) фенильную группу, необязательно замещенную 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена.
[0012] Некоторые варианты реализации относятся к соединению формулы IV:
 формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой: (а) Н, ОН, NH2, -NH(С1-6 алкил), -N(С1-6 алкил)2, -SO2H, -SO2(С1-6 алкил), С2- 6 алкенил, С2-6 алкинил, С3-6 циклоалкил или 3-6-членное гетероциклильное кольцо, содержащее один гетероатом, выбранный из О, N и S; или (b) C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена; или (c) -О-C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена; или (d) фенильную группу, необязательно замещенную 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой: (а) Н, ОН, NH2, -NH(С1-6 алкил), -N(С1-6 алкил)2, -SO2H, -SO2(С1-6 алкил), С2- 6 алкенил, С2-6 алкинил, С3-6 циклоалкил или 3-6-членное гетероциклильное кольцо, содержащее один гетероатом, выбранный из О, N и S; или (b) C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена; или (c) -О-C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена; или (d) фенильную группу, необязательно замещенную 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена.
[0013] В определенных вариантах реализации соединения формулы IV R3 представляет собой: (а) Н, ОН, NH2, -SO2H, -SO2(С1-3 алкил), С2-3 алкенил, С2-3 алкинил, С3-6 циклоалкил, 3-6-членное гетероциклильное кольцо, содержащее один гетероатом, выбранный из О, N и S; или (b) C1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-3 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена; или (c) -О-C1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена; и (d) фенильную группу, необязательно замещенную 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена.
[0014] В определенных вариантах реализации соединения формулы IV R3 представляет собой: (а) Н, ОН, NH2, -SO2H, -SO2(СН3), С2-3 алкенил, С2-3 алкинил, С3-6 циклоалкил, 3-6-членное гетероциклильное кольцо, содержащий один гетероатом кислорода; или (b) С1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, F, NH2, -SO2H, SO2(CH3), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом кислорода, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и F; или (c) -О-С1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, F, NH2, -SO2H, -SO2(CH3), CN, С3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом кислорода, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и F; или (d) фенильную группу, необязательно замещенную 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и F.
[0015] Некоторые варианты реализации относятся к соединению формулы IV:
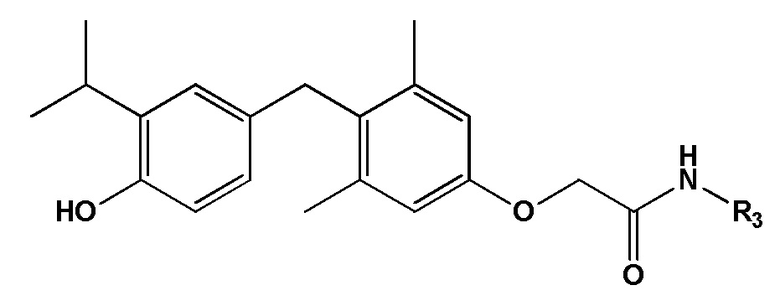 формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -(CH2)n1-фенил, и где n1 представляет собой целое число, выбранное из 0, 1, 2, 3 или 4, и указанное фенильное кольцо необязательно замещено 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -(CH2)n1-фенил, и где n1 представляет собой целое число, выбранное из 0, 1, 2, 3 или 4, и указанное фенильное кольцо необязательно замещено 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена.
[0016] Некоторые варианты реализации относятся к соединению формулы IV:  формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -(CH2)n2-фенил, где n2 представляет собой целое число, выбранное из 0, 1 или 2, и указанное фенильное кольцо необязательно замещено 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -(CH2)n2-фенил, где n2 представляет собой целое число, выбранное из 0, 1 или 2, и указанное фенильное кольцо необязательно замещено 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена.
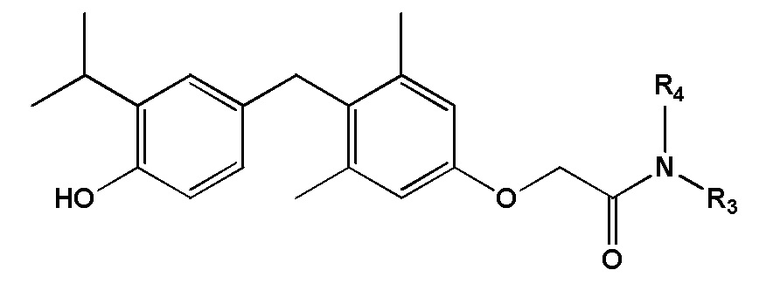
[0017] Некоторые варианте реализации относятся к соединению формулы IV: 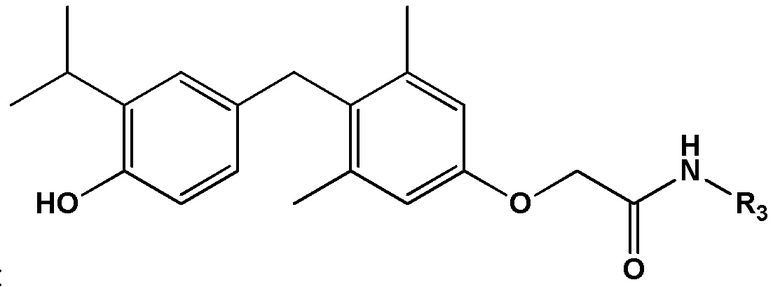 формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -(CH2)n2-фенил, где n2 представляет собой целое число, выбранное из 0, 1 или 2, и указанное фенильное кольцо необязательно замещено 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и F.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -(CH2)n2-фенил, где n2 представляет собой целое число, выбранное из 0, 1 или 2, и указанное фенильное кольцо необязательно замещено 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и F.
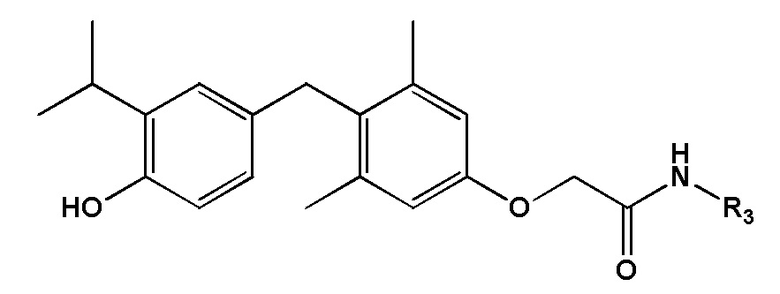
[0018] Некоторые варианты реализации относятся к соединению формулы IV:  формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -(CH2)-фенил, где указанное фенильное кольцо необязательно замещено 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и F.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -(CH2)-фенил, где указанное фенильное кольцо необязательно замещено 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и F.
[0019] Некоторые варианты реализации относятся к соединению формулы IV:  формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой С1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, F, NH2, -SO2H, -SO2(СН3), CN, C3-6 циклоалкила и 3-6-членного гетероциклильного кольца, содержащего один гетероатом кислорода.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой С1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, F, NH2, -SO2H, -SO2(СН3), CN, C3-6 циклоалкила и 3-6-членного гетероциклильного кольца, содержащего один гетероатом кислорода.
[0020] Некоторые варианты реализации относятся к соединению формулы IV: 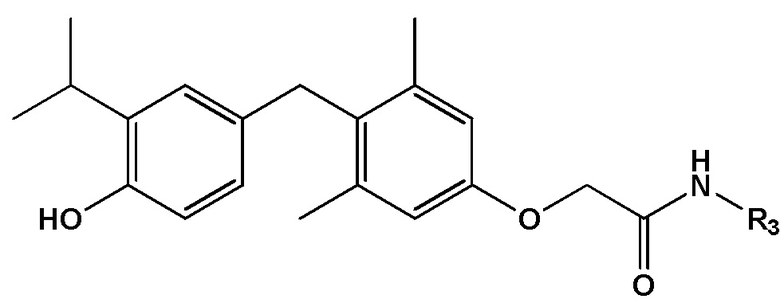 формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой С1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, F, NH2, -SO2H, -SO2(СН3), CN, C3-6 циклоалкила и 3-6-членного гетероциклильного кольца, содержащего один гетероатом кислорода.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой С1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, F, NH2, -SO2H, -SO2(СН3), CN, C3-6 циклоалкила и 3-6-членного гетероциклильного кольца, содержащего один гетероатом кислорода.
[0021] Некоторые варианты реализации относятся к соединению формулы IV:
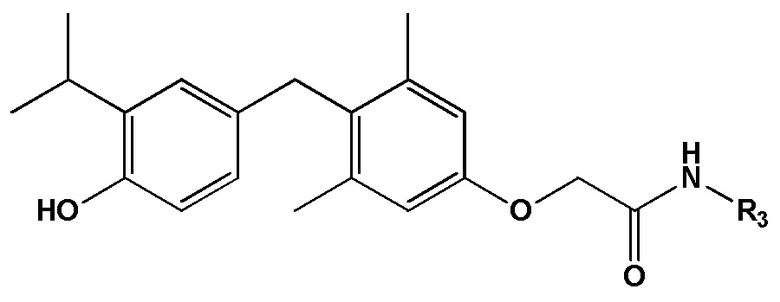 формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из OH, F, NH2, CN, -SO2H и -SO2(C1-6 алкил).
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из OH, F, NH2, CN, -SO2H и -SO2(C1-6 алкил).
[0022] Некоторые варианты реализации относятся к соединению формулы IV: 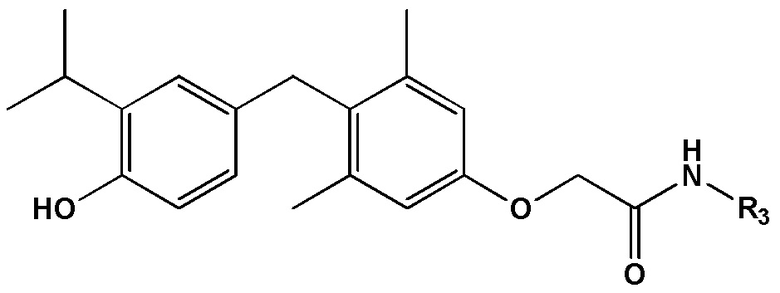 формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями OH.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями OH.
[0023] Некоторые варианты реализации относятся к соединению формулы IV: 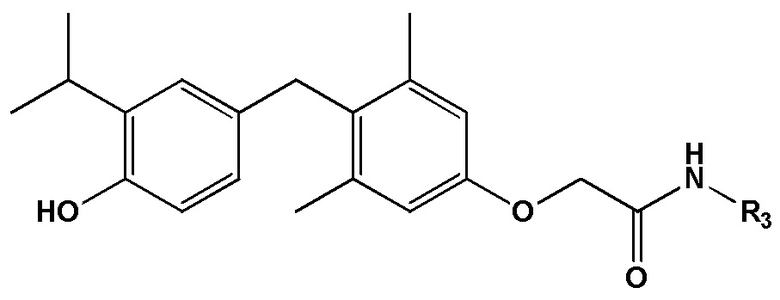 формула IV
формула IV
или его фармацевтически приемлемой соли, где R3 представляет собой C1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями OH.
[0024] Некоторые варианты реализации относятся к соединению формулы IV:  формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями F.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями F.
[0025] Некоторые варианты реализации относятся к соединению формулы IV:  формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой C1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями F.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой C1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями F.
[0026] Некоторые варианты реализации относятся к соединению формулы IV:  формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -О-C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями F.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -О-C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями F.
[0027] Некоторые варианты реализации относятся к соединению формулы IV:  формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -О-C1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями F.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -О-C1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями F.
[0028] Некоторые варианты реализации относятся к соединению формулы IV:  формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -О-C1-6 алкил.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -О-C1-6 алкил.
[0029] Некоторые варианты реализации относятся к соединению формулы IV: 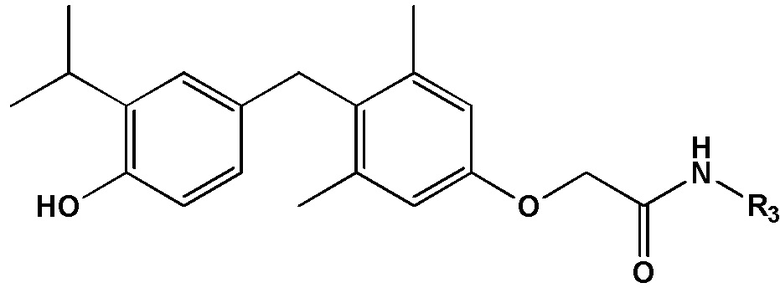 формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -О-C1-4 алкил.
формула IV, или его фармацевтически приемлемой соли, где R3 представляет собой -О-C1-4 алкил.
[0030] Некоторые варианты реализации относятся к соединению формулы III: 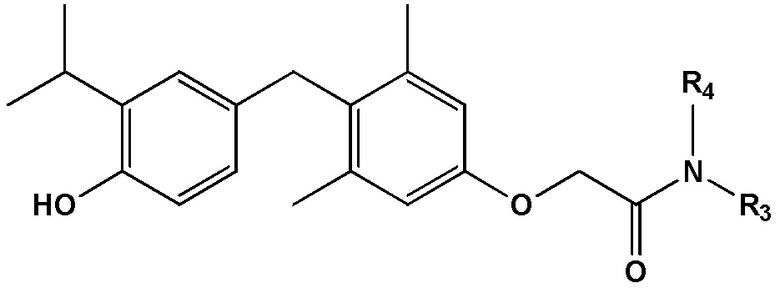 формула III, или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо представляет собой H, замещенную алифатическую группу, незамещенную алифатическую группу, замещенный фенил, незамещенный фенил, ORN1, -N(RN1)2 или -SO2(RN2), где каждый RN1 независимо представляет собой Н, замещенную алифатическую группу или незамещенную алифатическую группу, и RN2 представляет собой ОН, незамещенную алифатическую группу или замещенную алифатическую группу; при условии, что, если один RN представляет собой ORN1, -N(RN1)2 или -SO2(RN2), то другой RN представляет собой H, замещенную алифатическую группу, незамещенную алифатическую группу, замещенный фенил или незамещенный фенил. В определенных вариантах реализации R3 представляет собой H или незамещенную алифатическую группу. В определенных вариантах реализации R4 представляет собой H, замещенную алифатическую группу или незамещенную алифатическую группу. В определенных вариантах реализации настоящего изобретения R3 представляет собой метил. В определенных вариантах реализации настоящего изобретения R4 представляет собой метил.
формула III, или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо представляет собой H, замещенную алифатическую группу, незамещенную алифатическую группу, замещенный фенил, незамещенный фенил, ORN1, -N(RN1)2 или -SO2(RN2), где каждый RN1 независимо представляет собой Н, замещенную алифатическую группу или незамещенную алифатическую группу, и RN2 представляет собой ОН, незамещенную алифатическую группу или замещенную алифатическую группу; при условии, что, если один RN представляет собой ORN1, -N(RN1)2 или -SO2(RN2), то другой RN представляет собой H, замещенную алифатическую группу, незамещенную алифатическую группу, замещенный фенил или незамещенный фенил. В определенных вариантах реализации R3 представляет собой H или незамещенную алифатическую группу. В определенных вариантах реализации R4 представляет собой H, замещенную алифатическую группу или незамещенную алифатическую группу. В определенных вариантах реализации настоящего изобретения R3 представляет собой метил. В определенных вариантах реализации настоящего изобретения R4 представляет собой метил.
[0031] В другом аспекте настоящее изобретение относится к соединению, выбранному из группы, состоящей из:
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
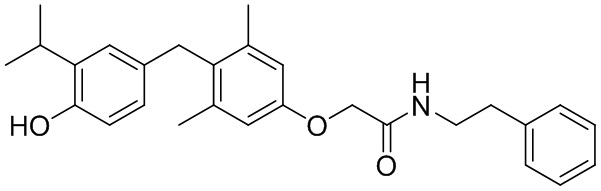
,  ,
,
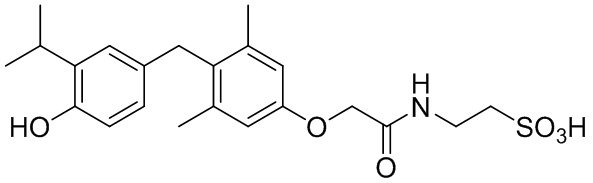
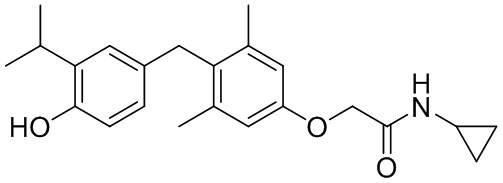 ,
, 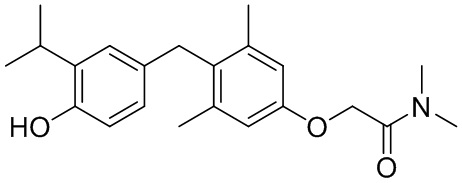 ,
,
 ,
,  ,
,
 ,
,  и
и 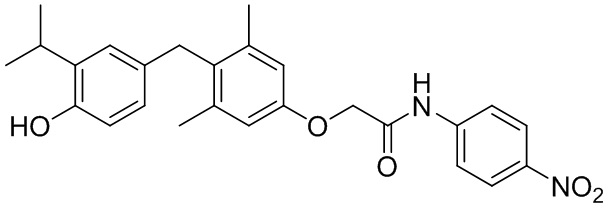 или фармацевтически приемлемых солей указанных соединений.
или фармацевтически приемлемых солей указанных соединений.
[0032] В некоторых вариантах реализации первого аспекта настоящего изобретения указанное соединение выбрано из группы, состоящей из:
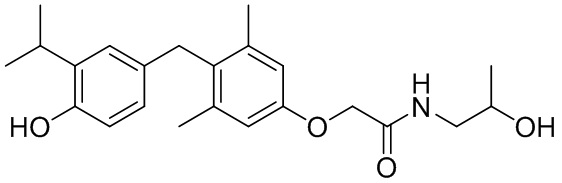
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2-гидроксиэтил)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(1-гидроксипропан-2-ил)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2-гидроксипропил)ацетамида;
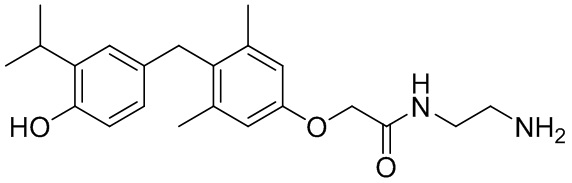
2-(2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамидо)этан-1-аминийацетата;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
N-(2,2-дифторэтил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2,2,2-трифторэтил)ацетамида;
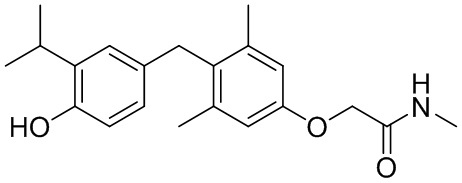
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-метилацетамида;
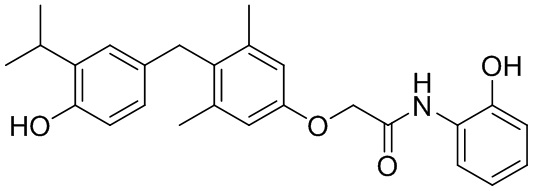
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2-гидроксифенил)ацетамида;
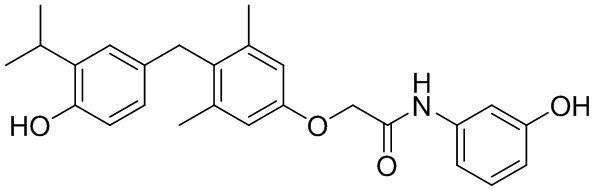
2-(4-(4-гидрокси-3-изопропилбензил)-N-(3-гидроксифенил)ацетамида;
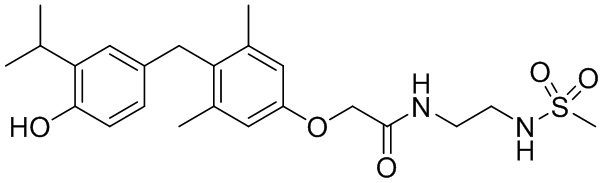
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2-метилсульфонамидо)этил)ацетамида;
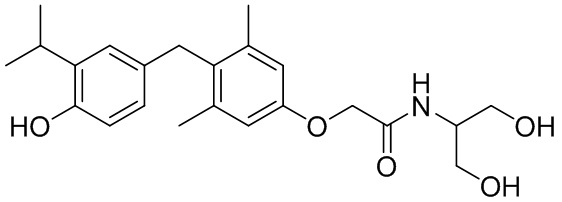
N-(1,3-дигидроксипроран-2-ил)-2-(4-(4-гидрокси-3-изопропилбензил) -3,5-диметилфенокси)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-пропилацетамида;
N-(2-фторэтил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
N-аллил-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
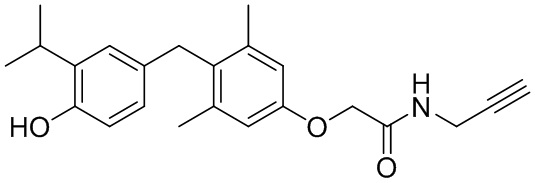
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(проп-2-ин-1-ил)ацетамида;
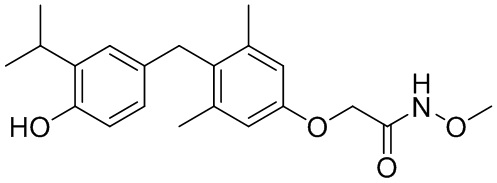
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-метоксиацетамида;
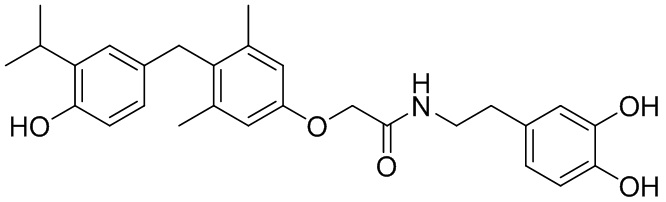
N-(3,4-дигидроксифенэтил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-фенэнилацетамида;
N-гидрокси-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетогидразида;
2-(2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамидо)этан-1-сульфоната;
N-циклопропил-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N, N-диметилацетамида;
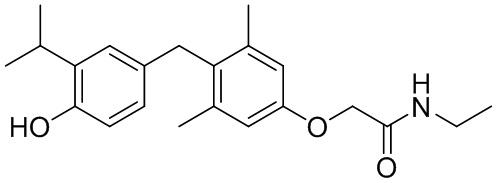
N-этил-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
N-(цианометил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
N-(3-фторфенил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
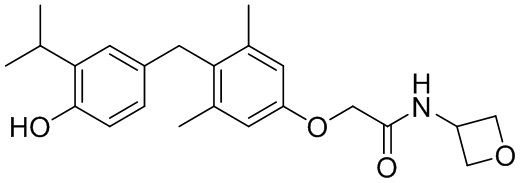
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(оксетан-3-ил)ацетамида и
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(4-нитрофенил)ацетамида или фармацевтически приемлемых солей указанных соединений.
[0033] В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически эффективное количество соединения, описанного в настоящем документе (например, соединения по любому из предыдущих аспектов), или его фармацевтически приемлемой соли, и один или более фармацевтически приемлемых носителей.
[0034] В другом аспекте настоящее изобретение относится к способу лечения субъекта, страдающего нейродегенеративным заболеванием, путем введения указанному субъекту фармацевтически эффективного количества соединения, описанного в настоящем документе (например, соединения по любому из предыдущих аспектов), или его фармацевтически приемлемой соли, или фармацевтической композиции, описанной в настоящем документе, с лечением указанного нейродегенеративного заболевания.
[0035] В некоторых вариантах реализации этого аспекта указанное нейродегенеративное заболевание представляет собой демиелинизирующее заболевание. В некоторых вариантах реализации этого аспекта указанное нейродегенеративное заболевание представляет собой адренолейкодистрофию, сцепленную с Х-хромосомой, или рассеянный склероз.
[0036] В некоторых вариантах реализации этого аспекта указанное нейродегенеративное заболевание выбрано из группы, состоящей из острого рассеянного энцефаломиелита, острого геморрагического лейкоэнцефалита, болезни Рефсума у взрослых, болезни Александера, болезни Альцгеймера, концентрического склероза Бало, болезни Канавана, центрального понтинного миелинолиза, церебрального паралича, церебротендинального ксантоматоза, хронической воспалительной демиелинизирующей полинейропатии, синдрома Девика, диффузного миелинокластического склероза, синдрома Гийена-Барре, идиопатического воспалительного демиелинизирующего заболевания, болезни Рефсума у детей, болезни Краббе, наследственной оптической нейропатии Лебера, болезни Марбурга, болезни Маркиафавы-Биньями, метахроматической лейкодистрофии, мультифокальной двигательной нейропатии, парапротеинемической демиелинизирующей полинейропатии, болезни Пелицеуса-Мерцбахера, перонеальной мышечной атрофии, прогрессирующей мультифокальной лейкоэнцефалопатии, поперечного миелита, тропического спастического парапареза, болезни Ван-дер-Кнаапа, адренолейкодистрофии, сцепленной с Х-хромосомой, и синдрома Цельвегера.
[0037] В другом аспекте настоящее изобретение относится к способу лечения субъекта, страдающим болезнью Альцгеймера, путем введения указанному субъекту фармацевтически эффективного количества соединения, описанного в настоящем документе (например, соединения по любому из предыдущих аспектов), или его фармацевтически приемлемой соли, или фармацевтической композиции, описанной в настоящем документе, с лечением указанной болезни Альцгеймера.
[0038] В другом аспекте настоящее изобретение относится к способу лечения субъекта, страдающего заболеванием или состоянием, выбранным из группы, состоящей из острого рассеянного энцефаломиелита (ОРЭМ), острого геморрагического лейкоэнцефалита (AHL или AHLE), болезни Рефсума у взрослых, болезни Рефсума у детей, болезни Александера, болезни Альцгеймера, концентрического склероза Бало, болезни Канавана, центрального понтинного миелинолиза (CPM), церебрального паралича, церебротендинального ксантоматоза, хронической воспалительной демиелинизирующей полинейропатии (CIDP), синдрома Девика, диффузного миелинокластического склероза, энцефаломиелита, синдрома Гийена-Барре, идиопатического воспалительного демиелинизирующего заболевания (ИВДЗ), болезни Краббе, наследственной оптической нейропатии Лебера, лейкодистрофии, болезни Марбурга, болезни Маркиафавы-Биньями, метахроматической лейкодистрофии (MLD), мультифокальной двигательной нейропатии (MMN), рассеянного склероза (РС), парапротеинемической демиелинизирующей полинейропатии, болезни Пелицеуса-Мерцбахера (БПМ), прогрессирующей мультифокальной лейкоэнцефалопатии (PML), тропического спастического парапареза (TSP), адренолейкодистрофии, сцепленной с Х-хромосомой (X-ALD, ALD или X-сцепленной ALD), и синдромом Цельвегера, при этом указанный способ включает введение указанному субъекту фармацевтически эффективного количества соединения, описанного в настоящем документе (например, соединения по любому из предыдущих аспектов) или его фармацевтически приемлемой соли или фармацевтической композиции, описанной в настоящем документе, с лечением указанного заболевания или состояния.
[0039] В другом аспекте настоящее изобретение относится к соединению, описанному в настоящем документе (например, к соединению по любому из предыдущих аспектов), или к его фармацевтически приемлемой соли, или к фармацевтической композиции, описанной в настоящем документе, для применения для лечения нейродегенеративного заболевания (например, демиелинизирующего заболевания, адренолейкодистрофии, сцепленной с Х-хромосомой, или рассеянного склероза).
[0040] В некоторых вариантах реализации указанное соединение или его фармацевтически приемлемая соль или фармацевтическая композиция предназначены для применения для лечения нейродегенеративного заболевания, выбранного из группы, состоящей из острого рассеянного энцефаломиелита, острого геморрагического лейкоэнцефалита, болезни Рефсума у взрослых, болезни Александера, болезни Альцгеймера, концентрического склероза Бало, болезни Канавана, центрального понтинного миелинолиза, церебрального паралича, церебротендинального ксантоматоза, хронической воспалительной демиелинизирующей полинейропатии, синдрома Девика, диффузного миелинокластического склероза, синдрома Гийена-Барре, идиопатического воспалительного демиелинизирующего заболевания, болезни Рефсума у детей, болезни Краббе, наследственной оптической нейропатии Лебера, болезни Марбурга, болезни Маркиафавы-Биньями, метахроматической лейкодистрофии, мультифокальной двигательной нейропатии, парапротеинемической демиелинизирующей полинейропатии, болезни Пелицеуса-Мерцбахера, перонеальной мышечной атрофии, прогрессирующей мультифокальной лейкоэнцефалопатии, поперечного миелита, тропического спастического парапареза, болезни Ван-дер-Кнаапа, адренолейкодистрофии, сцепленной с Х-хромосомой, и синдрома Цельвегера.
[0041] В другом аспекте настоящее изобретение относится к соединению, описанному в настоящем документе (например, к соединению по любому из предыдущих аспектов), или к его фармацевтически приемлемой соли, или к фармацевтической композиции, описанной в настоящем документе, для применения для лечения болезни Альцгеймера.
[0042] В другом аспекте настоящее изобретение относится к соединению, описанному в настоящем документе (т.е. к соединению согласно любому из перечисленных выше аспектов) или его фармацевтически приемлемой соли или фармацевтической композиции, описанной в настоящем документе, для применения для лечения заболевания или состояния, выбранного из группы, состоящей из острого рассеянного энцефаломиелита (ОРЭМ), острого геморрагического лейкоэнцефалита (AHL или AHLE), болезни Рефсума у взрослых, болезни Рефсума у детей, болезни Александера, болезни Альцгеймера, концентрического склероза Бало, болезни Канавана, центрального понтинного миелинолиза (CPM), церебрального паралича, церебротендинального ксантоматоза, хронической воспалительной демиелинизирующей полинейропатии (CIDP), синдрома Девика, диффузного миелинокластического склероза, энцефаломиелита, синдрома Гийена-Барре, идиопатического воспалительного демиелинизирующего заболевания (ИВДЗ), болезни Краббе, наследственной оптической нейропатии Лебера, лейкодистрофии, болезни Марбурга, болезни Маркиафавы-Биньями, метахроматической лейкодистрофии (MLD), мультифокальной двигательной нейропатии (MMN), рассеянного склероза (РС), парапротеинемической демиелинизирующей полинейропатии, болезни Пелицеуса-Мерцбахера (БПМ), прогрессирующей мультифокальной лейкоэнцефалопатии (PML), тропического спастического парапареза (TSP), адренолейкодистрофии, сцепленной с Х-хромосомой (X-ALD, ALD или X-сцепленной ALD), и синдрома Цельвегера.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0043] На фиг. 1 представлен общая схема воздействия соединений, нацеленных на ЦНС, описанных в данном документе.
[0044] На фиг. 2А представлен график концентрации собетирома (GC-1) или описанных в настоящем документе соединений в мозге мыши после внутрибрюшинного введения.
[0045] На фиг. 2B представлен график концентрации собетирома (GC-1) или описанных в настоящем документе соединений в сыворотке крови мыши после внутрибрюшинного введения.
[0046] На фиг. 2C представлен график отношения концентрации в мозге мыши к концентрации в сыворотке крови мыши для собетирома (GC-1) или описанных в настоящем документе соединений после внутрибрюшинного введения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0047] Если специально не указано иное, технические термины, используемые в данном документе, имеют свое обычное значение, принятое в данной области техники. Следующие объяснения, касающиеся терминов и способов, предоставлены для того, чтобы лучше описать настоящие соединения, композиции и способы, а также для того, чтобы специалисты в данной области техники могли руководствоваться ими при практическом применении настоящего изобретения. Также следует понимать, что терминология, используемая в настоящем описании, предназначена только для описания конкретных вариантов реализации и примеров и не предназначена для того, чтобы ограничивать настоящее изобретение.
[0048] Используемые в настоящем документе термины в единственном числе включают множественное число, если в контексте ясно не указано иначе. Точно так же союз «или» включает и союз «и», если контекст явно не указывает на иное. Кроме того, используемый в настоящем документе термин «содержит» означает «включает». Следовательно, «содержащий А или В» означает включающий А, В или А и В.
[0049] Переменные, такие как R, включая все их варианты (такие как R1, R2 и т.д.), используемые в настоящем описании, являются теми же переменными, что и ранее определенные, если не указано иное.
[0050] Введение: Относится к предоставлению соединения, пролекарства соединения или фармацевтической композиции, содержащей соединение или пролекарство, описанные в настоящем документе. Соединение или композиция могут быть введены субъекту другим человеком или субъект может осуществить введение самостоятельно. Неограничивающими примерами путей введения являются пероральный, парентеральный (например, внутривенный) или местный.
[0051] Алифатическая (группа): разветвленная, линейная или циклическая неароматическая углеводородная группа, содержащая 1-6 атомов углерода. Алифатическая группа может быть насыщенной или ненасыщенной. Ненасыщенная алифатическая группа содержит одну углерод-углеродную двойную или тройную связь. Замещенная алифатическая группа представляет собой алифатическую группу, замещенную 1-5 заместителями, если позволяет валентность. Каждый заместитель в замещенной алифатической группе независимо выбран из группы, состоящей из галогена, -ORA, -N(RB)2, -SO2(RC), циано, замещенного фенила и незамещенного фенила; где RA представляет собой H, незамещенную алифатическую группу, незамещенный фенил или замещенный фенил; каждый RB независимо представляет собой незамещенную алифатическую группу, незамещенный фенил, замещенный фенил или SO2(RC); и RC независимо представляет собой -ОН, незамещенную алифатическую группу или незамещенный фенил, замещенный фенил.
[0052] Алкил: разветвленная или неразветвленная насыщенная углеводородная группа, такая как, без ограничения, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, тетрадецил, гексадецил, эйкозил, тетракозил и т.д. Низшая алкильная группа представляет собой насыщенный разветвленный или неразветвленный углеводород, содержащий от 1 до 6 атомов углерода (С1-6 алкил). Термин «алкил» также охватывает циклоалкилы. Ненасыщенный алкил может представлять собой алкенил (например, группа, содержащая одну или более углерод-углеродных двойных связей) или алкинил (например, группа, содержащая одну или более углерод-углеродных тройных связей). Алкил также включает замещенные алкилы, которые представляют собой алкильные группы, в которых один или более атомов водорода заменены на заместители, такие как, без ограничения, алкил, алкинил, алкенил, арил, галогенид, нитро, амино, сложный эфир, простой эфир, кетон, альдегид, гидроксил, карбоксил, циано, амидо, галогеналкил, галогеналкокси или алкокси. Термин «алкил» также охватывает гетероалкилы. Гетероалкил содержит по меньшей мере один гетероатом, такой как азот, кислород, сера или фосфор, замещающий один или более атомов углерода. Термин «алкил» также охватывает замещенные гетероалкилы.
[0053] В некоторых вариантах реализации настоящего изобретения необязательно замещенный алкил может содержать, например, 1-20, 1-18, 1-16, 1-14, 1-12, 1-10, 1-8, 1-6, 1-4 или 1-2 атома углерода, не включая атомы углерода, присутствующие в заместителях, если указанный алкил является замещенным. В некоторых вариантах реализации настоящего изобретения необязательно замещенный алкенил или необязательно замещенный алкинил может содержать, например, 2-20, 2-18, 2-16, 2-14, 2-12, 2-10, 2-8, 2-6 или 2-4 атома углерода, не включая атомы углерода, присутствующие в заместителях, если указанные алкинил или алкенил являются замещенными.
[0054] Алкиламино: гетероалкил, в котором один или более атомов углерода замещены азотом. Алкиламино может представлять собой линейный, разветвленный или циклоалкиламино. Алкиламино обычно имеет структуру NX1X2 или NX1X2X3+, где каждый из X1, X2 и X3 независимо выбран из, например, H, необязательно замещенного алкила (например, замещенного алкила или незамещенного алкила, как выше определено термином), необязательно замещенного алкенила (например, необязательно замещенного C2-6 алкенила), необязательно замещенного алкинила (например, необязательно замещенного C2-6 алкинила), необязательно замещенного циклоалкила (например, необязательно замещенного C3-6 циклоалкила), необязательно замещенного гетероциклильного кольца (например, необязательно замещенного 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S), необязательно замещенного арила (например, фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена), необязательно замещенного -O-C1-6 алкила (например, -O-C1-6 алкила, необязательно замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена), ацила, ОН, NH2, NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H или -SO2(C1-6 алкил).
[0055] В некоторых вариантах реализации настоящего изобретения алкиламино имеет структуру NX1X2, где X1 представляет собой H или необязательно замещенный C1-6 алкил, и Х2 представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена.
[0056] В некоторых вариантах реализации настоящего изобретения алкиламино имеет структуру NX1X2, где X1 представляет собой H или необязательно замещенный C1-6 алкил, и Х2 представляет собой -О-C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена.
[0057] В некоторых вариантах реализации алкиламино имеет структуру NX1X2, где X1 представляет собой H или необязательно замещенный C1-6 алкил и X2 представляет собой фенильную группу, необязательно замещенную 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из OH, NO2 и галогена.
[0058] В некоторых вариантах реализации настоящего изобретения алкиламино имеет структуру NX1X2, где каждый из X1 и X2 независимо выбран из H, замещенной алифатической группы, незамещенной алифатической группы, замещенного фенила, незамещенного фенила, ORN1, -N(RN1)2 или -SO2(RN2), где каждый RN1 независимо представляет собой Н, замещенную алифатическую группу или незамещенную алифатическую группу и RN2 представляет собой OH, незамещенную алифатическую группу или замещенную алифатическую группу. В других вариантах реализации настоящего изобретения если один RN представляет собой ORN1, -N(RN1)2 или -SO2(RN2), другой RN представляет собой H, замещенную алифатическую группу, незамещенную алифатическую группу, замещенный фенил или незамещенный фенил.
[0059] В некоторых вариантах реализации настоящего изобретения алкиламино имеет структуру NX1X2, где X1 представляет собой H и X2 представляет собой H, гидроксил, амино, метил, этил, пропил, циклопропил, 2-гидроксиэтил, 1-гидроксипропан-2-ил, 2-гидроксипропил, 2-аминоэтилацетат, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, фенил, (4-нитро)фенил, 2-фенилэтил 2-(2-гидроксифенил)этил, 2-(3-гидроксифенил)этил, 2-(3,4-дигидроксифенил)этил, 3-фторэтил; S-метилсульфонил, 1-(2-гидроксиэтил)-2-гидроксиэтил, 2-пропенил, 2-пропинил, метокси, 2-этилсульфонат натрия, цианометил или оксетанил.
[0060] Примеры алкиламино групп включают, но не ограничиваются ими, следующие структуры: NHCH3, N(CH3)2, NH(CH3)2+, N(CH3)3+, NHCH2CH3, NH2CH2CH3+, NCH3CH2CH3, N(CH2CH3)2 и NHCH3CH2CH3+. Алкиламино также включает гетероалкилы, в которых один или более атомов углерода заменены азотом и/или дополнительно один или более других атомов углерода заменены другим гетероатомом, таким как кислород, сера или фосфор.
[0061] Термин «алкиламино» также относится к алкильным группам, связанным с азотом с образованием связи с неконцевыми атомами углерода с образованием циклоалкиламинной структуры, например, X1NHX3, где X1 и X3 представляют собой алкильные группы, которые образуют ковалентную связь друг с другом. Они включают 4-членные структуры с одним атомом азота (азетидинил), 5-членные структуры с одним атомом азота (пирролидинил) или 6-членные структуры с одним атомом азота (пиперидинил), а также структуры с двумя атомами азота, замещенные циклоалкиламинные структуры, включая X1NX2X3, где Х1 и Х3 образуют ковалентную связь, а Х2 представляет собой алкил. Дополнительным примером алкиламиногрупп является структура CH2CH2-NHR2, где R2 представляет собой этил и образует ковалентную связь с первым атомом углерода с образованием 4-членного кольца.
[0062] Амид: группа структуры -CH2-CONX1X2, где X1 и X2 каждый независимо представляют собой H или органическую группу, такую как необязательно замещенная алкильная группа или необязательно замещенная арильная группа. В некоторых вариантах реализации настоящего изобретения амид имеет структуру -CH2-CONX1X2, где каждый из X1 и X2 независимо представляет собой H, необязательно замещенный алкил (например, замещенный алкил или незамещенный алкил, как выше определено термином), необязательно замещенный алкенил (например, необязательно замещенный C2-6 алкенил), необязательно замещенный алкинил (например, необязательно замещенный C2-6 алкинил), необязательно замещенный циклоалкил (например, необязательно замещенный C3-6 циклоалкил), необязательно замещенное гетероциклильное кольцо (например, необязательно замещенное 3-6-членное гетероциклильное кольцо, содержащее один гетероатом, выбранный из O, N и S), необязательно замещенный арил (например, фенильную группу, необязательно замещенную 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена), необязательно замещенный -O-C1-6 алкил (например, -O-C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H, -SO2(C1-6 алкил), CN, C3-6 циклоалкила, 3-6-членного гетероциклильного кольца, содержащего один гетероатом, выбранный из O, N и S, или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена), ацил, ОН, NH2, NH(C1-6 алкил), -N(C1-6 алкил)2, -SO2H или -SO2(C1-6 алкил).
[0063] Амино: группа структуры -N(RN)2, где каждый RN независимо представляет собой Н, замещенную алифатическую группу, незамещенную алифатическую группу, замещенный фенил, незамещенный фенил, ORN1, -N(RN1)2 или -SO2(RN2), где каждый RN1 независимо представляет собой H, замещенную алифатическую группу или незамещенную алифатическую группу и RN2 представляет собой -OH, незамещенную алифатическую группу или замещенную алифатическую группу; при условии, что, если один RN представляет собой ORN1, -N(RN1)2 или -SO2(RN2), другой RN представляет собой H, замещенную алифатическую группу, незамещенную алифатическую группу, замещенный фенил или незамещенный фенил.
[0064] Арил: любая ароматическая группа на основе углерода, включая, но не ограничиваясь ими, бензол, нафталин и фенил. Термин арил также включает замещенные арилы, в которых один или более атомов водорода замещены одной или несколькими группами, включая, но не ограничиваясь ими, алкил, алкинил, алкенил, арил, галогенид, нитро, амино, сложный эфир, простой эфир, кетон, альдегид, гидрокси, карбоновую кислоту, циано, амидо, галогеналкил, галогеналкокси или алкокси. Термин арил также включает гетероарилы, в которых один или более атомов углерода заменены на гетероатом. Примеры гетероатомов включают, но не ограничиваются ими, азот, кислород, серу и фосфор. Термин «арил» также охватывает замещенные гетероарилы. Замещенный фенил представляет собой фенильную группу, замещенную 1, 2, 3, 4 или 5 заместителями, независимо выбранными из -OR, -NO2, незамещенной алифатической группы и галогена, где R представляет собой H или незамещенную алифатическую группу. Арил относится к любой моноциклической или конденсированной бициклической или трициклической системе, которая обладает характеристиками ароматичности с точки зрения распределения электронов по всей кольцевой системе, например, фенил, нафтил или фенантрен. В некоторых вариантах реализации настоящего изобретения кольцевая система содержит 5-15 атомов-членов кольца или 5-10 атомов-членов кольца. Арильная группа может содержать, например, от пяти до пятнадцати атомов углерода (например, С5-6, С5-7, С5-8, С5-9, С5-10, С5-11, С5- 12, C5-13, C5-14 или C5-15 арил).
[0065] Ацил: группа, имеющая структуру: 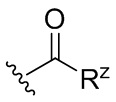 где Rz представляет собой необязательно замещенный алкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероалкил, гетероалкенил, гетероалкинил, гетероциклоалкил, гетероциклоалкенил, гетероциклоалкинил или гетероарил.
где Rz представляет собой необязательно замещенный алкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероалкил, гетероалкенил, гетероалкинил, гетероциклоалкил, гетероциклоалкенил, гетероциклоалкинил или гетероарил.
[0066] Циклоалкил: неароматическое кольцо на основе углерода, состоящее по меньшей мере из трех атомов углерода. Примеры циклоалкильных групп включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил и циклогексил. Циклоалкилы также включают замещенные циклоалкилы и гетероциклоалкилы (также называемые «гетероциклильными» группами), в которых по меньшей мере один из атомов углерода заменен на гетероатом, такой как азот, сера или фосфор. Гетероциклоалкил, в котором один или более атомов углерода заменены на азот, в настоящем документе называют также циклоалкиламино. Термин также охватывает замещенные гетероциклоалкилы. Кислородсодержащие гетероциклоалкильные группы для применения в способах реализации в настоящем документе включают, но не ограничиваются ими, группы оксиранила, оксетанила, тетрагидрофуранила и тетрагидропиранила.
[0067] Необязательно замещенный(-ая, -ое): группа (например, алкил, алкенил, алкинил, циклоалкил или арил) с 0, 1 или более заместителями, например, 0-25, 0-20, 0-10 или 0-5 заместителей. Заместители включают, но не ограничиваются ими, алкил, алкенил, алкинил, арил, алкарил, ацил, гетероарил, гетероалкил, гетероалкенил, гетероалкинил, гетероалкарил, галоген, оксо, циано, нитро, амино, алкамино, гидрокси, алкокси, алканоил, карбонил, карбамоил, гуанидинил, амидинил, уреидо, любые из групп или фрагментов, описанных выше, и гетеро-варианты любой из групп или фрагментов, описанных выше. Заместители включают, но не ограничиваются ими, F, Cl, метил, фенил, бензил, OR, NR2, SR, SOR, SO2R, OCOR, NRCOR, NRCONR2, NRCOOR, OCONR2, RCO, COOR, алкил-OOCR, SO3R, CONR2, SO2NR2, NRSO2NR2, CN, CF3, OCF3, R3Si и NO2, где каждый R независимо представляет собой H, алкил, алкенил, арил, гетероалкил, гетероалкенил или гетероарил, и где два из необязательных заместителей на одном и том же атоме или на соседних атомах могут быть соединены с образованием конденсированного, необязательно замещенного ароматического или неароматического, насыщенного или ненасыщенного кольца, содержащего 3-8 членов кольца.
[0068] Эффективное количество, терапевтически эффективное количество или фармацевтически эффективное количество: количество указанного агента, достаточное для достижения желаемого эффекта у субъекта, которого лечат указанным агентом. В идеале эффективное количество агента представляет собой количество, достаточное для ингибирования или лечения заболевания, не вызывая существенной токсичности у субъекта. Эффективное количество агента будет зависеть от субъекта, подлежащего лечению, тяжести поражения и способа введения фармацевтической композиции. Из настоящего описания специалистам в данной области техники будут понятны способы определения эффективного количества описанного соединения, достаточного для достижения желаемого эффекта у субъекта.
[0069] Производное: соединение или часть соединения, полученное из или теоретически получаемое из исходного соединения.
[0070] Кровоизлияние: кровотечение или выделение крови из сосуда.
[0071] Гипоксия: недостаток кислорода в тканях организма ниже нормального уровня.
[0072] Гетероцикл: группа, которая включает как гетероарилы, так и гетероциклоалкилы. Гетероциклы могут представлять собой моноциклические или полициклические кольца. Типичные гетероциклы включают, но не ограничиваются ими, азепинильную группу, азиридинильную группу, азетильную группу, азетидинильную группу, диазепинильную группу, дитиадиазинильную группу, диоксазепинильную группу, диоксоланильную группу, дитиазолильную группу, фуранильную группу, изоксазолильную группу, изотиазолильную группу, имидазолильную группу, морфолинильную группу, оксетанильную группу, оксадиазолильную группу, оксиранильную группу, оксазинильную группу, оксазолильную группу, пиперазинильную группу, пиразинильную группу, пиридазинильную группу, пиримидинильную группу, пиперидильную группу, группу пиперидино, пиридильную группу, пиранильную группу, пиразолильную группу, пирролильную группу, пирролидинильную группу, тиатриазолильную группу, тетразолильную группу, тиадиазолильную группу, триазолильную группу, тиазолильную группу, тиенильную группу, тетразинильную группу, тиадиазинильную группу, триазинильную группу, тиазинильную группу, тиопиранильную группу, фуроизоксазолильную группу, имидазотиазолильную группу, тиеноизотиазолильную группу, тиенотиазолильную группу, имидазопиразолильную группу, циклопентапиразолильную группу, пирролопирролильную группу, тиенотиенильную группу, тиадиазолопиримидинильную группу, тиазолотиазинильную группу, тиазолопиримидинильную группу, тиазолопиридинильную группу, оксазолопиримидинильную группу, оксазолопиридильную группу, бензоксазолильную группу, бензизотиазолильную группу, бензотиазолильную группу, имидазопиразинильную группу, пуринильную группу, пиразолопиримидинильную группу, имидазопиридинильную группу, бензимидазолильную группу, индазолильную группу, бензоксатиолильную группу, бензодиоксолильную группу, бензодитиолильную группу, индолизинильную группу, индолинильную группу, изоиндолинильную группу, фуропиримидинильную группу, фуропиридильную группу, бензофуранильную группу, изобензофуранильную группу, тиенопиримидинильную группу, тиенопиридильную группу, бензотиенильную группу, циклопентаоксазинильную группу, циклопентафуранильную группу, бензоксазинильную группу, бензотиазинильную группу, хиназолинильную группу, нафтиридинильную группу, хинолинильную группу, изохинолинильную группу, бензопиранильную группу, пиридопиридазинильную группу и пиридопиримидинильную группу. Термин также охватывает замещенные гетероциклы, включая замещенные формы всех вышеуказанных групп.
[0073] Повреждение: относится к любому типу физического повреждения клеток, тканей или организма. В некоторых случаях повреждение нервной системы (например, ЦНС или ПНС) приводит к демиелинизации и/или демиелинизирующему заболеванию.
[0074] Ишемия: сосудистое явление, при котором уменьшение кровоснабжения тела, органа или части тела вызвано, например, сужением или закупоркой одного или нескольких кровеносных сосудов. Ишемия иногда возникает в результате сужения сосудов, тромбоза или эмболии. Ишемия может привести к прямому ишемическому повреждению, повреждению тканей из-за гибели клеток, вызванной сниженным поступлением кислорода. В некоторых случаях ишемия может привести к демиелинизации.
[0075] Миелин: липидное вещество, образующее оболочку (известна как миелиновая оболочка) вокруг аксонов определенных нервных волокон. Миелин - это электрический изолятор, который служит для ускорения проведения нервных импульсов в нервных волокнах. Термин «миелинизация» относится к развитию или образованию миелиновой оболочки вокруг нервного волокна. Аналогично, термин «ремиелинизация» относится к восстановлению или преобразованию миелиновой оболочки, например, после повреждения, воздействия токсического агента или воспалительного ответа, или в течение демиелинизирующего заболевания.
[0076] Фармацевтическая композиция: композиция, содержащая фармацевтически эффективное количество одного или более соединений, описанных в настоящем документе, или их фармацевтически приемлемую соль, составленная с фармацевтически приемлемым носителем, которая также может содержать другие добавки, и изготовленная или продаваемая с разрешения государственного регулирующего органа как часть терапевтического режима для лечения заболевания у млекопитающего. Фармацевтические композиции могут быть составлены, например, для перорального введения в виде единичной лекарственной формы (например, таблетка, капсула, каплета, гелевая капсула или сироп); для местного применения (например, в виде крема, геля, лосьона или мази); для внутривенного введения (например, в виде стерильного раствора, не содержащего эмболов, и в системе растворителей, подходящей для внутривенного применения); или в виде любой другой композиции, описанной в настоящем документе. Обычные процедуры и ингредиенты для выбора и приготовления подходящих составов описаны, например, в Remington: The Science and Practice of Pharmacy, 21st Ed., Gennaro, Ed., Lippencott Williams & Wilkins (2005) и в The United States Pharmacopeia: The National Formulary (USP 36 NF31), опубликовано в 2013 г.
[0077] Фармацевтически приемлемый носитель: любой ингредиент, отличный от описанных в настоящем документе соединений или их фармацевтически приемлемых солей (например, носитель, способный суспендировать или растворять активное соединение), нетоксичный и не вызывающий воспаления у пациента. Вспомогательные вещества могут включать, например: антиадгезивы, антиоксиданты, связующие вещества, покрытия, добавки для прессования, дезинтегранты, красители (окрашивающие вещества), смягчающие вещества, эмульгаторы, наполнители (разбавители), пленкообразователи или покрытия, вкусоароматические добавки, ароматизаторы, скользящие вещества (вещества, препятствующие слеживанию и комкованию), смазки, консерванты, печатные краски, сорбенты, суспендирующие или диспергирующие агенты, подсластители или гидратационную воду. Примеры вспомогательных веществ включают, но не ограничиваются ими: бутилированный гидрокситолуол (BHT), карбонат кальция, фосфат кальция (двухосновный), стеарат кальция, кроскармеллозу, поперечно-сшитый поливинилпирролидон, лимонную кислоту, кроссповидон, цистеин, этилцеллюлозу, желатин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, лактозу, стеарат магния, мальтит, маннит, метионин, метилцеллюлозу, метилпарабен, микрокристаллическую целлюлозу, полиэтиленгликоль, поливинилпирролидон, повидон, прежелатинизированный крахмал, пропилпарабен, ретинилпальмитат, шеллак, диоксид кремния, карбоксиметилцеллюлозу натрия, цитрат натрия, натрий крахмалгликолят, сорбит, крахмал (кукурузный), стеариновую кислоту, стеариновую кислоту, сахарозу, тальк, диоксид титана, витамин А, витамин Е, витамин С и ксилит.
[0078] Фармацевтически приемлемая соль: соль, полученная общепринятыми методами. К ним относятся основные соли неорганических и органических кислот, таких как, без ограничения, соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, метансульфоновая кислота, этансульфоновая кислота, яблочная кислота, уксусная кислота, щавелевая кислота, винная кислота, лимонная кислота, молочная кислота, фумаровая кислота, янтарная кислота, малеиновая кислота, салициловая кислота, бензойная кислота, фенилуксусная кислота и миндальная кислота. «Фармацевтически приемлемые соли» соединений, описанных в настоящем документе, также включают соли, образованные из катионов, таких как, без ограничения, натрий, калий, алюминий, кальций, литий, магний, цинк, и из оснований, таких как аммиак, этилендиамин, N-метилглютамин, лизин, аргинин, орнитин, холин, N,N'-дибензилэтилендиамин, хлорпрокаин, диэтаноламин, прокаин, N-бензилфенетиламин, диэтиламин, пиперазин, трис(гидроксиметил)аминометан и гидроксид тетраметиламмония. Эти соли можно получать при помощи стандартных процедур, например, при взаимодействии свободной кислоты с подходящим органическим или неорганическим основанием. Любое химическое соединение, указанное в данном описании, альтернативно можно вводить в виде его фармацевтически приемлемой соли. Фармацевтически приемлемые соли также включают описанные соединения в форме свободной кислоты, основания и в цвиттерионной форме. Описания типичных фармацевтически приемлемых солей можно найти в Stahl and Wermuth, Eds., Handbook of Pharmaceutical Salts; Properties, Selection and Use, Wiley VCH (2008). Когда соединения, описанные в настоящем документе, содержат кислотную группу, такую как карбоксигруппа, тогда подходящие фармацевтически приемлемые катионы для карбоксигруппы хорошо известны специалистам в данной области техники и включают, без ограничения, щелочные, щелочноземельные, аммониевые и четвертичные аммониевые катионы. Такие соли известны специалистам в данной области техники. Подобным образом, когда соединения, описанные в настоящем документе, содержат основную группу, такую как аминогруппа, тогда подходящие фармацевтически приемлемые анионы для основной группы также хорошо известны и включают галогенид, гидроксид, пергалат, галит, гипогалит, сульфат, сульфит, фосфат, фосфит, нитрат, нитрит и другие, известные специалистам в данной области техники. Дополнительные примеры фармакологически приемлемых солей см. в Berge et al, J. Pharm. Sci. 66, 1 (1977).
[0079] Собетиром: синтетическое соединение диарилметана, которое было клинически исследовано в качестве потенциального терапевтического средства при гиперхолестеринемии (см. патент США №5883294, который включен в настоящий документ посредством ссылки). Собетиром представляет собой 2-[4-[[4-гидрокси-3-(1-метилэтил)фенил]метил]3,5-диметилфеноксиуксусную кислоту. В литературе и нормативных документах также найдены другие названия для собетирома: QRX-431 и GC-1.
[0080] Субъект: животное (например, млекопитающее, такое как человек). Субъект, подлежащий лечению в соответствии с описанными в настоящем документе способами, может представлять собой субъект, у которого диагностировано нейродегенеративное заболевание, включающее демиелинизацию, недостаточную миелинизацию или недоразвитие миелиновой оболочки, например, субъект, у которого диагностирован рассеянный склероз или церебральный паралич, или субъект с риском развития указанного состояния. Диагностика может быть выполнена любым способом или методом, известным в данной области техники. Специалист в данной области техники поймет, что субъект, подлежащий лечению в соответствии с настоящим описанием, мог пройти стандартные исследования или нахождение субъекта в зоне риска установлено по наличию одного или нескольких факторов риска, связанных с болезнью или состоянием.
[0081] Лечение: вмешательство, которое облегчает признак или симптом заболевания или патологического состояния. Используемые в настоящем документе термины «лечение», «лечить» применительно к заболеванию, патологическому состоянию или симптому также относятся к любому наблюдаемому полезному эффекту лечения. О положительном эффекте может свидетельствовать, например, отсроченное появление клинических симптомов заболевания у подверженного ему субъекта, снижение тяжести некоторых или всех клинических симптомов заболевания, более медленное прогрессирование заболевания, уменьшение числа рецидивов заболевания, улучшение общего состояния здоровья или самочувствия субъекта или другие параметры, хорошо известные в данной области, которые специфичны для конкретного заболевания. Профилактическое лечение представляет собой лечение, назначаемое субъекту, который не проявляет признаков заболевания или проявляет только ранние признаки, с целью снижения риска развития патологии. Терапевтическое лечение представляет собой лечение, назначаемое субъекту после развития признаков и симптомов заболевания.
Нейродегенеративные заболевания
[0082] Острый рассеянный энцефаломиелит (ОРЭМ): иммуноопосредованная демиелинизирующая болезнь центральной нервной системы. ОРЭМ обычно возникает после вирусной инфекции, но может также появиться после вакцинации или после бактериальной или паразитарной инфекции. В некоторых случаях ОРЭМ развивается спонтанно. Указанное заболевание включает аутоиммунную демиелинизацию, сходную с рассеянным склерозом, и поэтому считается пограничным заболеванием рассеянного склероза. ОРЭМ вызывает множественные воспалительные поражения в головном и спинном мозге, особенно в белом веществе. Поражения, как правило, обнаруживаются в подкорковом и центральном белом веществе и на границе серого и белого вещества обоих полушарий головного мозга, мозжечка, ствола головного мозга и спинного мозга, но могут также затрагивать перивентрикулярное белое вещество и серое вещество коры, таламуса и базальных ганглиев. Когда пациент перенес более одного демиелинизирующего эпизода, заболевание называют рецидивирующим рассеянным энцефаломиелитом или многофазным рассеянным энцефаломиелитом.
[0083] Острый геморрагический лейкоэнцефалит (AHL или AHLE): сверхострая и часто смертельная форма ОРЭМ. Это заболевание также известно как острая некротическая энцефалопатия (ANE), острый геморрагический энцефаломиелит (ОХЭМ), острый некротический геморрагический лейкоэнцефалит (АНХЛЕ), синдром Уэстона-Херста или болезнь Херста.
[0084] Болезнь Рефсума у взрослых: аутосомно-рецессивное неврологическое заболевание, которое связано с избыточным накоплением фитановой кислоты в клетках и тканях. Болезнь Рефсума у взрослых подразделяется на болезнь Рефсума 1 у взрослых и болезнь Рефсума 2 у взрослых. Люди с болезнью Рефсума страдают неврологическими повреждениями, мозжечковой дегенерацией и периферической нейропатией. Болезнь начинается чаще всего в детстве/подростковом возрасте и имеет прогрессирующее течение, хотя бывают периоды застоя или ремиссии. Симптомы также включают атаксию, шелушащиеся высыпания на коже (ихтиоз), проблемы со слухом и проблемы с глазами, включая катаракту и ночную слепоту.
[0085] Болезнь Александера: очень редкое врожденное демиелинизирующее заболевание. Болезнь в основном поражает младенцев и детей, вызывая задержку развития и изменения физических характеристик. Болезнь Александера является типом лейкодистрофии.
[0086] Болезнь Альцгеймера: наиболее распространенная форма деменции. Симптомы болезни Альцгеймера включают потерю памяти, спутанность сознания, раздражительность, агрессию, перепады настроения и проблемы с языком. Это заболевание характеризуется потерей нейронов и синапсов в коре головного мозга и некоторых подкорковых областях. Такая потеря приводит к полной атрофии пораженных областей, включая дегенерацию в височной доле и в частях лобной коры и поясной извилины. В мозге людей, пораженных этим заболеванием под микроскопом видны амилоидные бляшки и нейрофибриллярные клубки. Причина болезни Альцгеймера неизвестна; однако существует несколько гипотез, в том числе о том, что данное заболевание вызвано возрастным распадом миелина в мозге.
[0087] Концентрический склероз Бало: демиелинизирующее заболевание, сходное со стандартным рассеянным склерозом, но с той особенностью, что демиелинизированные ткани образуют концентрические слои. Пациенты с этим заболеванием могут выжить и/или может произойти спонтанная ремиссия. Обычно клиническое течение является в основном прогрессирующим, но есть сообщения о рецидивирующем течении.
[0088] Болезнь Канавана: аутосомно-рецессивное дегенеративное заболевание, которое вызывает прогрессирующее повреждение нервных клеток в головном мозге. Болезнь Канавана представляет собой лейкодистрофию и является одним из наиболее распространенных дегенеративных заболеваний головного мозга у младенцев. Эта болезнь также называется болезнью Канавана-ван-Богарта-Бертрана, дефицитом аспартоацилазы и дефицитом аминоацилазы 2.
[0089] Центральный понтинный миелинолиз (CPM): неврологическое заболевание, вызванное серьезным повреждением миелиновой оболочки нервных клеток в стволе головного мозга, точнее, в области, называемой варолиев мост. Наиболее частой причиной является быстрая коррекция низкого уровня натрия в крови (гипонатриемия). Часто наблюдаемыми симптомами этого расстройства являются внезапный пара- или квадрапарез, дисфагия, дизартрия, диплопия и потеря сознания. Пациент может испытывать синдром «запертого человека», при котором когнитивная функция не нарушена, но все мышцы парализованы, сохраняется только моргание глаз.
[0090] Церебральный паралич: термин, используемый для обозначения группы постоянных непрогрессирующих двигательных расстройств, которые вызывают инвалидность вследствие физических причин. Церебральный паралич вызван повреждением центров регуляции моторики в развивающемся мозге и может возникнуть во время беременности, во время родов или после рождения до трех лет. У пациентов с церебральным параличом обнаруживаются повреждения миелиновых оболочек.
[0091] Церебротендинальный ксантоматоз: наследственное заболевание, связанное с отложением формы холестерина (холестанола) в мозге и других тканях, а также с повышенным уровнем холестерина в плазме, но с нормальным уровнем общего холестерина. Оно характеризуется прогрессирующей атаксией мозжечка, начинающейся после полового созревания, и ювенильными катарактами, хронической диареей с манифестацией в младенческом или детском возрасте, неврологическим расстройством у детей и сухожильными или туберозными ксантомами. Это расстройство является аутосомно-рецессивной формой ксантоматоза и попадает в группу генетических нарушений, называемых лейкодистрофиями.
[0092] Хроническая воспалительная демиелинизирующая полинейропатия (CIDP): приобретенное иммуноопосредованное воспалительное заболевание периферической нервной системы. Это расстройство иногда называют хронической рецидивирующей полинейропатией (ХВП) или хронической воспалительной демиелинизирующей полирадикулонейропатией (поскольку она затрагивает нервные корешки). CIDP тесно связана с синдромом Гийена-Барре и считается хроническим аналогом этого острого заболевания. Его симптомы также похожи на прогрессирующую воспалительную нейропатию. Асимметричный вариант CIDP известен как синдром Льюиса-Самнера. Патологическим признаком заболевания является потеря миелиновой оболочки.
[0093] Демиелинизирующее заболевание: включает в себя любое заболевание нервной системы, при котором поврежден или утерян миелин или при котором рост или развитие миелиновой оболочки нарушается. Демиелинизация препятствует передаче сигналов в пораженные нервы, вызывая ухудшение чувствительности, движения, когнитивных или других функций, в которых задействованы нервы. Демиелинизирующие заболевания имеют ряд различных причин и могут быть наследственными или приобретенными. В некоторых случаях демиелинизирующее заболевание вызвано инфекционным агентом, аутоиммунным ответом, токсическим агентом или травматическим повреждением. В других случаях причина демиелинизирующего заболевания неизвестна («идиопатическая») или обусловлена комбинацией факторов.
[0094] Синдром Девика: аутоиммунное воспалительное заболевание, при котором иммунная система человека атакует зрительные нервы и спинной мозг, что приводит к воспалению зрительного нерва (неврит зрительного нерва) и спинного мозга (миелит). Повреждения спинного мозга приводят слабости или параличу рук или ног различной степени, потере чувствительности и/или дисфункции мочевого пузыря и кишечника. Хотя воспаление также может повлиять на мозг, поражения отличаются от тех, которые наблюдаются при РС. Синдром Девика похож на РС в том, что иммунная система организма атакует миелин, окружающий нервные клетки. В отличие от стандартного РС, атаки, как полагают, опосредуются не Т-клетками иммунной системы, а антителами, называемыми NMO-IgG. Эти антитела нацелены на белок под названием аквапорин 4 в клеточных мембранах астроцитов, который действует как канал для транспорта воды через клеточную мембрану. Синдром Девика также известен как болезнь Девика или оптиконейромиелит (NMO).
[0095] Диффузный миелинокластический склероз: нечастое нейродегенеративное заболевание, которое клинически проявляется как псевдоопухолевые демиелинизирующие поражения. Данное заболевание обычно начинается в детстве, затрагивая детей от 5 до 14 лет; однако возможны случаи у взрослых. Это заболевание считается одной из пограничных форм рассеянного склероза и иногда называется болезнью Шильдера.
[0096] Энцефаломиелит: воспаление головного и спинного мозга.
[0097] Экспериментальный аутоиммунный энцефаломиелит (ЭАЭ): модель РС на животных (например, см. Gold et al, Brain 129, 1953-1971 (2006). У животных с ЭАЭ характерны бляшки повреждения тканей, распространенные по всей центральной нервной системе. Бляшки показывают инфильтрацию нервной ткани лимфоцитами, плазматическими клетками и макрофагами, которые вызывают разрушение миелиновых оболочек, которые окружают аксоны нервных клеток в головном и спинном мозге. В некоторых случаях ЭАЭ индуцируется иммунизацией восприимчивых животных, таких как мыши, крысы, морские свинки или отличных от человека приматов, миелином или различными компонентами миелина. Например, ЭАЭ можно индуцировать путем иммунизации компонентами миелиновой оболочки, такими как основной миелиновый белок, протеолипидный белок или миелиновый олигодендроцитарный гликопротеин (MOG). ЭАЭ представляет собой пригодную и широко распространенную модель для изучения механизмов аутоиммунного повреждения тканей ЦНС и для тестирования потенциальных методов лечения РС. ЭАЭ также включает «пассивный ЭАЭ», который индуцируется таким же образом у животных-доноров, но включает передачу активированных Т-клеток, отобранных из лимфатических узлов животного-донора, животным-реципиентам, не подвергавшимся экспериментам.
[0098] Синдром Гийена-Барре: острая полинейропатия, расстройство, поражающее периферическую нервную систему. Восходящий паралич, слабость, начинающаяся в ступнях ног и кистях рук и переходящая в корпус, является наиболее типичным симптомом, а некоторые подтипы вызывают изменение в чувствительности или боли, а также дисфункцию вегетативной нервной системы. Указанный синдром может вызвать опасные для жизни осложнения, особенно если поражены дыхательные мышцы или задействована вегетативная нервная система. Это заболевание обычно вызывается инфекцией. Наиболее распространенным подтипом этого заболевания является острая воспалительная демиелинизирующая полинейропатия (AIDP). Другие подтипы синдрома Гийена-Барре включают синдром Миллера Фишера, острую моторную аксональную нейропатию (китайский паралитический синдром), острую моторную сенсорную аксональную нейропатию, острую панавтономную нейропатию и энцефалит головного мозга Бикерстаффа.
[0099] Идиопатическое воспалительное демиелинизирующее заболевание (ИВДЗ): широкий спектр расстройств центральной нервной системы, которые обычно можно дифференцировать, основываясь на клинических, визуальных, лабораторных и патологических результатах. Идиопатические воспалительные демиелинизирующие заболевания иногда называют пограничными формами рассеянного склероза. ИВДЗ обычно относится к вариантам рассеянного склероза, включая, но не ограничиваясь ими, зрительно-спинальная форма РС, болезнь Девика, ОРЭМ, острый геморрагический лейкоэнцефалит, концентрический склероз Бало, болезнь Шильдера, болезни Марбурга, опухолеподобный рассеянный склероз и солитарный склероз.
[0100] Болезнь Рефсума у детей: нарушение биогенеза пероксисом, связанное с недостаточностью катаболизма жирных кислот с очень длинной цепью и жирных кислот с разветвленной цепью (таких как фитановая кислота) и биосинтеза плазминогена. Болезнь Рефсума у детей является редким аутосомно-рецессивным врожденным заболеванием и одним из трех расстройств биогенеза пероксисом, которые относятся к нарушениям биогенеза пероксисом спектра синдрома Цельвегера.
[0101] Болезнь Краббе: редкое, часто смертельное дегенеративное заболевание, которое поражает миелиновую оболочку нервной системы. Является формой сфинголипидоза, поскольку связан с дисфункциональным метаболизмом сфинголипидов. Это состояние наследуется по аутосомно-рецессивному типу. Болезнь Краббе также известна как глобоидно-клеточная лейкодистрофия или галактозилцерамидный липидоз.
[0102] Наследственная оптическая нейропатия Лебера: митохондриально наследуемая (передаваемая от матери к потомству) дегенерация ганглиозных клеток сетчатки (ГКС) и их аксонов, которая приводит к острой или подострой потере центрального зрения; затрагивает преимущественно молодых взрослых мужчин.
[0103] Лейкодистрофия: относится к группе заболеваний, которые влияют на рост или развитие миелиновой оболочки.
[0104] Лейкоэнцефалопатия: любое из группы заболеваний, затрагивающих белое вещество мозга; конкретно может относиться к нескольким заболеваниям, включая, например, «лейкоэнцефалопатию с «исчезающим белым веществом» и «токсическую лейкоэнцефалопатию». Лейкоэнцефалопатии являются заболеваниями, подобными лейкодистрофии.
[0105] Болезнь Марбурга: состояние, при котором центральная нервная система имеет множественные демиелинизирующие поражения с атипичными характеристиками по сравнению со стандартным рассеянным склерозом. Это заболевание является пограничной формой рассеянного склероза и также известно как опухолеподобный рассеянный склероз или фульминатная форма рассеянного склероза. Заболевание называется опухолеподобным, поскольку поражения являются «опухолевидными» и имитируют опухоли клинически, рентгенологически и иногда патологически.
[0106] Болезнь Маркиафавы-Биньями: прогрессирующее неврологическое заболевание, характеризующееся демиелинизацией мозолистого тела, его некрозом и последующей атрофией. Данная болезнь классически связана с хроническими алкоголиками.
[0107] Метахроматическая лейкодистрофия (MLD): лизосомная болезнь накопления, которая обычно входит в семейство лейкодистрофий, а также в сфинголипидозы, поскольку она влияет на метаболизм сфинголипидов. MLD напрямую вызывается дефицитом фермента арилсульфатазы А.
[0108] Мультифокальная двигательная нейропатия (ММН): прогрессирующее состояние, при котором постепенно ослабевают мышцы конечностей. Это расстройство, синдром двигательной нейропатии, иногда ошибочно принимают за боковой амиотрофический склероз (БАС) из-за сходства в клинической картине, особенно при наличии мышечных фасцикуляций. MMN обычно асимметрична и считается аутоиммунным заболеванием.
[0109] Рассеянный склероз (РС): медленно прогрессирующее заболевание ЦНС, характеризующееся диссеминированными пятнами демиелинизации в головном и спинном мозге, что приводит к множественным и различным неврологическим симптомам и признакам, обычно с ремиссиями и обострением. Причина РС неизвестна, но подозревается иммунологическая аномалия. Увеличение заболеваемости в семье свидетельствует о генетической восприимчивости, и женщины страдают от этого заболевания несколько чаще, чем мужчины. Симптомы РС включают слабость, нарушение координации, парестезии, нарушения речи и нарушения зрения, чаще всего, диплопию. Более конкретные признаки и симптомы зависят от расположения очагов поражения, а также от тяжести и разрушительности воспалительных и склеротических процессов. Рецидивирующе-ремиттирующий рассеянный склероз (РРРС) - это клиническое течение РС, которое характеризуется четко выраженными острыми приступами с полным или частичным выздоровлением и отсутствием прогрессирования заболевания между приступами. Вторично-прогрессирующий рассеянный склероз (ВПРС) - это клиническое течение РС, которое первоначально является рецидивирующе-ремиттирующим, а затем становится прогрессирующим с переменной скоростью, возможно, со случайным рецидивом и незначительной ремиссией. Первично-прогрессирующий рассеянный склероз (ППРС) первоначально представлен в прогрессирующей форме. Клинически изолированный синдром - это первый неврологический эпизод, вызванный воспалением/демиелинизацией в одном или нескольких участках ЦНС. Прогрессивно-рецидивирующий рассеянный склероз (ПРРС) является редкой формой рассеянного склероза (~5%), характеризующейся неуклонно ухудшающимся болезненным состоянием с самого начала, с острыми рецидивами, при этом без ремиссий.
[0110] Нейродегенеративное заболевание: относится к любому типу заболевания, которое характеризуется прогрессирующим повреждением нервной системы.
[0111] Нейропатия: функциональное нарушение или патологическое изменение в периферической нервной системе. Аксональная нейропатия относится к расстройству, нарушающему нормальное функционирование аксонов.
[0112] Парапротеинемическая демиелинизирующая полинейропатия: тип периферической нейропатии, при которой аутоантитела направлены против миелин-ассоциированных гликопротеинов (MAG). Антитела к MAG ингибируют выработку миелина, что приводит к нейропатии.
[0113] Болезнь Пелицеуса-Мерцбахера (ПМД): редкое расстройство центральной нервной системы, при котором наблюдаются задержки разной степени в координации, двигательных способностях и интеллектуальных функциях. Заболевание входит в группу генетических заболеваний, известных под общим названием лейкодистрофии.
[0114] Перонеальная мышечная атрофия (ПМА): генетически и клинически гетерогенная группа наследственных расстройств периферической нервной системы, характеризующаяся прогрессирующей потерей мышечной ткани и осязания в различных частях тела. Это заболевание также известно как болезнь Шарко-Мари-Тута (CMT), нейропатия Шарко-Мари-Тута и наследственная двигательная и сенсорная нейропатия (HMSN).
[0115] Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ): редкое и обычно смертельное вирусное заболевание, которое характеризуется прогрессирующим повреждением или воспалением белого вещества головного мозга во многих местах. ПМЛ встречается почти исключительно у людей с тяжелым иммунодефицитом. Причиной ПМЛ является тип полиомавируса, называемый вирусом JC. Вирус широко распространен: у 86% населения представлены антитела, но обычно вирус остается латентным, вызывая заболевание только тогда, когда иммунная система сильно ослаблена. ПМЛ представляет собой демиелинизирующее заболевание, при котором миелиновая оболочка, покрывающая аксоны нервных клеток, постепенно разрушается, нарушая передачу нервных импульсов. Заболевание может возникать у субъектов (например, людей) с тяжелым иммунодефицитом, таких как пациенты с трансплантатами, принимающие иммуносупрессивные лекарственные средства, или пациенты, получающие определенные виды лекарственных средств. Например, ПМЛ ассоциируется с введением ритуксимаба (применение лекарственного препарата не в соответствии с инструкцией по медицинскому применению при лечении рассеянного склероза). Это влияет на белое вещество, которое в основном состоит из аксонов из самых удаленных частей мозга (коры). Симптомы включают слабость или паралич, потерю зрения, нарушение речи и ухудшение когнитивных функций.
[0116] Поперечный миелит: неврологическое расстройство, вызванное воспалительным процессом серого и белого вещества спинного мозга, что приводит к демиелинизации аксонов. Демиелинизация возникает идиопатически после инфекций или вакцинации или вследствие рассеянного склероза. Симптомы включают слабость и онемение конечностей, а также двигательные, сенсорные и сфинктерные недостаточности. У некоторых пациентов в начале заболевания могут возникнуть сильные боли в спине.
[0117] Тропический спастический парапарез (TSP): инфекция спинного мозга T-лимфотропным вирусом человека, приводящая к парапарезу, слабости ног. TSP также известен как миелопатия, ассоциированная с HTLV (Т-лимфотропным вирусом человека), или хроническая прогрессирующая миелопатия. Как следует из названия, эта болезнь наиболее распространена в тропических регионах, в том числе в Карибском бассейне и Африке.
[0118] Болезнь Ван-дер-Кнаапа: форма наследственного демиелинизирующего заболевания ЦНС. Это заболевание представляет собой тип лейкодистрофии и также известно как мегалэнцефалическая лейкоэнцефалопатия с подкорковыми кистами (MLC).
[0119] Адренолейкодистрофия, сцепленная с Х-хромосомой (Х-ALD, ALD или Х-сцепленная ALD): редкое наследственное расстройство обмена веществ, которое приводит к прогрессирующему повреждению головного мозга, ухудшению умственного развития, недостаточности надпочечников, мышечным спазмам, слепоте и, в конечном итоге, смерти. ALD является одним из заболеваний в группе наследственных заболеваний, называемых лейкодистрофиями. Адренолейкодистрофия постепенно повреждает миелин. Мужчин с Х-сцепленной ALD можно разделить на 7 фенотипов: детский церебральный (прогрессирующее нейродегенеративное ухудшение, приводящее к вегетативному состоянию), подростковый (похож на детскую церебральную форму, но с более медленным прогрессированием), адреномиелонейропатия (прогрессирующая нейропатия, парапарез, может прогрессировать до церебрального поражения), церебральный у взрослых (деменция, прогрессия, сходная с церебральной формой у детей), оливомостомозжечковый (поражение головного мозга и ствола головного мозга), болезнь Аддисона (недостаточность надпочечников), бессимптомный фенотип (без клинических проявлений, субклиническая недостаточность надпочечников или фенотип AMN). Женщин с Х-сцепленной ALD можно разделить на 5 фенотипов: бессимптомный (без неврологических поражений или поражений надпочечников), миелопатия легкой степени, миелопатия средней и тяжелой степени (сходная с фенотипом AMN у мужчин), церебральный (прогрессирующая деменция и ухудшение) и надпочечный (первичная недостаточность надпочечников). Пациенты с Х-сцепленной ALD могут прогрессировать от одного фенотипа к другому в течение жизни. ALD также известна как болезнь Аддисона-Шильдера или болезнь Зимерлинга-Крейцфельда.
[0120] Синдром Цельвегера: редкое врожденное расстройство, характеризующееся снижением или отсутствием функциональных пероксисом в клетках индивидуума. Это заболевание классифицируется как лейкодистрофия и является одним из трех расстройств биогенеза пероксисом, которые относятся к нарушениям биогенеза пероксисом спектра синдрома Цельвегера.
Амидные соединения согласно настоящему изобретению
[0121] Системно вводимый собетиром распределяется преимущественно в печени. Имеются косвенные данные, полученные в нескольких предыдущих исследованиях, указывающих на то, что собетиром распространяется в ЦНС (Takahashi N et al, Biol Pharm Bull 37, 1103-1108 (2014); Trost S et al, Endocrinology 141, 3057-3064 (2000), Bernal J, Nat Clin Pract Endrocrinol Metab 3, 249-259 (2007); Oppenheimer JH and Schwartz HL, Endocr Rev 18, 462-475 (1997); и Bernal J, J Endocrinol Invest 25, 268-288 (2002); все эти источники включены в настоящее описание посредством ссылки).
[0122] В целом соотношение концентраций в мозге/в сыворотке крови в диапазоне 0,3-1,0 часто является предпочтительным для лекарственных средств для ЦНС (Doran A et al, Drug Metab Dispos 33, 165-174 (2005) и Reichel A, Curr Drug Metab 7, 183-203 (2006); оба источника включены в настоящее описание посредством ссылки). Соединение согласно настоящему изобретению может демонстрировать улучшенное проникновение через гематоэнцефалический барьер (ГЭБ) при измерении по соотношению мозг/сыворотка крови. В неограничивающем примере соединение согласно настоящему изобретению может обеспечивать соотношение концентрации мозг/сыворотка крови по меньшей мере 0,3 (например, по меньшей мере 0,4 или по меньшей мере 0,5). Эти соединения могут проявлять пониженную или отсутствующую GC-1-подобную активность в периферической ткани. Не желая быть связанными какой-либо теорией, полагают, что соединение согласно настоящему изобретению может быть немаскировано в ЦНС резидентными гидролазами с получением GC-1, что приводит к высоким концентрациям GC-1 в ЦНС (фиг. 1). GC-1 может быть захвачен ионами в ЦНС, создавая тем самым терапевтический эффект в ЦНС (например, ремиелинизацию). Более высокое соотношение концентрации мозг/сыворотка для соединений согласно настоящему изобретению может обеспечивать преимущество, состоящее в пониженном периферическом действии или его отсутствии.
[0123] В заявке на патент США №15/048672, включенной в настоящее описание в качестве ссылки, описаны сложноэфирные соединения, при гидролизе которых может образовываться собетиром (GC-1). Было обнаружено, что сложноэфирные соединения, содержащие фрагмент сложного эфира 2-аминоэтанола, эффективно проникают через гематоэнцефалический барьер. При определенных физиологических условиях эти соединения могут подвергаться перегруппировке в соответствующий амидный продукт (схема 1). Анализ амидных продуктов показал, что повышенные уровни GC-1 в головном мозге были обусловлены этим продуктом превращения амида, а не исходными сложноэфирными соединениями. Были разработаны соединения согласно настоящему изобретению, которые описаны в настоящем документе.
[0124] Схема 1 - Сложный эфир аминоэтанола превращается в амид in vivo.
[0125] Соединения согласно настоящему изобретению могут проявлять повышенную химическую и биологическую стабильность относительно сложных эфиров. Вероятно, они менее склонны к самопроизвольному гидролизу, что было продемонстрировано водным гидролизом (обсуждение скоростей гидролиза см. в Mabey W & Mill T, J Phys Chem Ref Data 7, 383-415 (1978)). Кроме того, другие соединения могут подвергаться действию больших семейств ферментов in vivo (Fukami T and Yokoi T, Drug Metab Pharmacokinet 27, 466-477 (2012); Casey Laizure S et al, Pharmacotherapy 33, 210-222 (2013); оба источника включены в настоящее описание в качестве ссылки), что может привести к преждевременному гидролизу. Гидролиз соединений согласно настоящему изобретению может быть специфичным для определенных резидентных амидаз мозга. Не желая быть связанными теорией, полагают, что ферментативное расщепление непептидных амидов может быть более ограниченным, чем для других соединений.
[0126] В настоящем документе описаны соединения формулы I:
 формула I, или его фармацевтически приемлемая соль, где R1 представляет собой амид.
формула I, или его фармацевтически приемлемая соль, где R1 представляет собой амид.
[0127] Также описаны соединения формулы II:
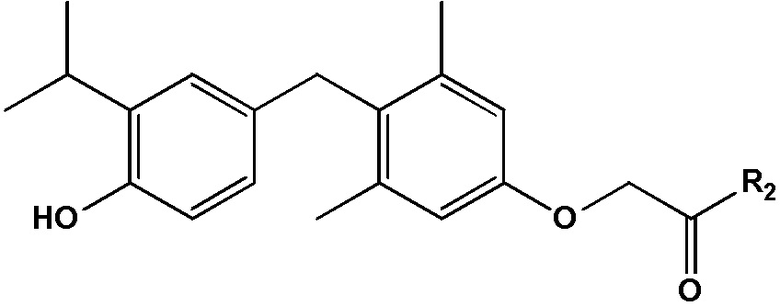 формула II, или его фармацевтически приемлемая соль, где R2 представляет собой алкиламино.
формула II, или его фармацевтически приемлемая соль, где R2 представляет собой алкиламино.
[0128] Также в настоящем документе описаны соединения формулы III:
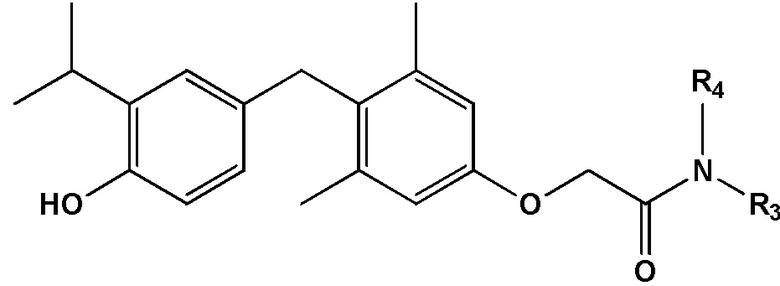 формула III, или его фармацевтически приемлемая соль, где каждый из R3 и R4 такой, как подробно описано в настоящем документе.
формула III, или его фармацевтически приемлемая соль, где каждый из R3 и R4 такой, как подробно описано в настоящем документе.
[0129] Также описаны соединения формулы IV:
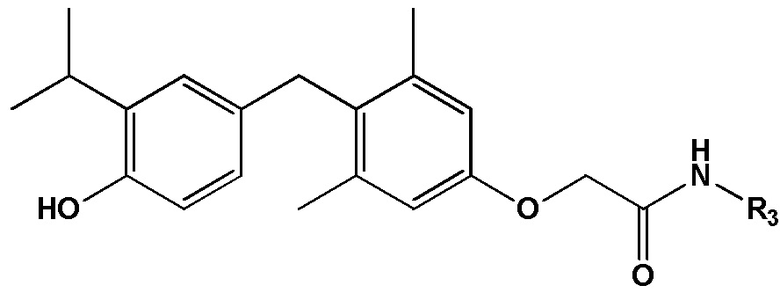 формула IV, или его фармацевтически приемлемая соль, где R3 такой, как подробно описано в настоящем документе.
формула IV, или его фармацевтически приемлемая соль, где R3 такой, как подробно описано в настоящем документе.
[0130] Кроме того, настоящее описание включает фармацевтическую композицию, содержащую фармацевтически эффективное количество соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли, и один или более фармацевтически приемлемых носителей.
Способы лечения
[0131] Следует понимать, что каждое из соединений, описанных в настоящем документе, или его фармацевтически приемлемую соль можно применять в способе лечения каждого из заболеваний или недугов, упомянутых в настоящем документе. Каждый способ лечения включает введение субъекту, нуждающемуся в этом, такому как человек, нуждающийся в этом, фармацевтически эффективного количества соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли.
[0132] Например, описан способ лечения нейродегенеративного заболевания у субъекта, такого как человек, включающий введение указанному субъекту фармацевтически эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли.
[0133] Также описан способ лечения демиелинизирующего заболевания у субъекта, такого как человек, включающий введение указанному субъекту фармацевтически эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли.
[0134] Кроме того, описан способ лечения адренолейкодистрофии, сцепленной с Х-хромосомой, у субъекта, такого как человек, включающий введение указанному субъекту фармацевтически эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли.
[0135] Также описан способ лечения рассеянного склероза у субъекта, такого как человек, включающий введение указанному субъекту фармацевтически эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли.
[0136] Также описан способ лечения болезни Альцгеймера у субъекта, такого как человек, включающий введение указанному субъекту фармацевтически эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли.
[0137] Также в настоящем документе описан способ лечения заболевания или состояния, выбранного из группы, состоящей из острого рассеянного энцефаломиелита (ОРЭМ), острого геморрагического лейкоэнцефалита (AHL или AHLE), болезни Рефсума у взрослых, болезни Рефсума у детей, болезни Александера, болезни Альцгеймера, концентрического склероза Бало, болезни Канавана, центрального понтинного миелинолиза (CPM), церебрального паралича, церебротендинального ксантоматоза, хронической воспалительной демиелинизирующей полинейропатии (CIDP), синдрома Девика, диффузного миелинокластического склероза, энцефаломиелита, синдрома Гийена-Барре, идиопатического воспалительного демиелинизирующего заболевания (ИВДЗ), болезни Краббе, наследственной оптической нейропатии Лебера, лейкодистрофии, болезни Марбурга, болезни Маркиафавы-Биньями, метахроматической лейкодистрофии (MLD), мультифокальной двигательной нейропатии (MMN), рассеянного склероза (РС), парапротеинемической демиелинизирующей полинейропатии, болезни Пелицеуса-Мерцбахера (БПМ), прогрессирующей мультифокальной лейкоэнцефалопатии (PML), тропического спастического парапареза (TSP), адренолейкодистрофии, сцепленной с Х-хромосомой (X-ALD, ALD или X-сцепленной ALD), и синдрома Цельвегера. Указанный способ включает введение субъекту, нуждающемуся в этом, такому как человек, фармацевтически эффективного количества соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли.
[0138] Также следует понимать, что каждое из соединений, описанных в настоящем документе, или его фармацевтически приемлемую соль можно применять при приготовлении лекарственного средства, подходящего для лечения каждого из заболеваний или недугов, упомянутых в настоящем документе. Каждый способ лечения включает введение субъекту, нуждающемуся в этом, такому как человек, нуждающийся в этом, фармацевтически эффективного количества соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли.
[0139] Например, описано применение соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли для приготовления лекарственного средства, подходящего для лечения нейродегенеративного заболевания у субъекта, такого как человек.
[0140] Например, описано применение соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли для приготовления лекарственного средства, подходящего для лечения демиелинизирующего заболевания у субъекта, такого как человек.
[0141] Например, описано применение соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли для приготовления лекарственного средства, подходящего для лечения адренолейкодистрофии у субъекта, такого как человек.
[0142] Например, описано применение соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли для приготовления лекарственного средства, подходящего для лечения рассеянного склероза у субъекта, такого как человек.
[0143] Например, описано применение соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли для приготовления лекарственного средства, подходящего для лечения болезни Альцгеймера у субъекта, такого как человек.
[0144] Также описано применение соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли, для приготовления лекарственного средства, подходящего для лечения заболевания или состояния у субъекта, такого как человек, выбранного из группы, состоящей из острого рассеянного энцефаломиелита (ADEM), острого геморрагического лейкоэнцефалита (AHL или AHLE), болезни Рефсума у взрослых, болезни Рефсума у детей, болезни Александера, болезни Альцгеймера, концентрического склероза Бало, болезни Канавана, центрального понтинного миелинолиза (CPM), церебрального паралича, церебротендинального ксантоматоза, хронической воспалительной демиелинизирующей полинейропатии (CIDP), синдрома Девика, диффузного миелинокластического склероза, энцефаломиелита, синдрома Гийена-Барре, идиопатического воспалительного демиелинизирующего заболевания (ИВДЗ), болезни Краббе, наследственной оптической нейропатии Лебера, лейкодистрофии, болезни Марбурга, болезни Маркиафавы-Биньями, метахроматической лейкодистрофии (MLD), мультифокальной двигательной нейропатии (MMN), рассеянного склероза (РС), парапротеинемической демиелинизирующей полинейропатии, болезни Пелицеуса-Мерцбахера (БПМ), прогрессирующей мультифокальной лейкоэнцефалопатии (PML), тропического спастического парапареза (TSP), адренолейкодистрофии, сцепленной с Х-хромосомой (X-ALD, ALD или X-сцепленной ALD), и синдрома Цельвегера.
ПРИМЕРЫ
[0145] Следующие примеры приведены только для иллюстрации. В свете настоящего описания специалистам в данной области техники будет понятно, что без чрезмерных экспериментов будут возможны варианты этих примеров и других примеров описанного изобретения.
Пример 1 - Исследования на животных
[0146] Протоколы экспериментов соответствовали руководству по уходу и использованию лабораторных животных Национального института здравоохранения и были одобрены Комитетом по уходу и использованию животных Университета науки и здоровья штата Орегон (США). Самцов мышей C57Bl/6 дикого типа в возрасте 8-10 недель содержали в помещении с контролируемой атмосферой с 12-часовыми циклами день-ночь и с предоставлением свободного доступа к пище и воде (ad libitum). Для проведения анализа концентраций GC-1 в одной точке in vivo мышам однократно внутрибрюшинно (в/б) вводили собетиром и пролекарства в дозе 3,05 мкмоль/кг. Через 1 час трех мышей умерщвляли и собирали ткани и кровь. Ткани немедленно замораживали, кровь держали на льду в течение как минимум 30 минут, а затем центрифугировали при 7500 × G в течение 15 минут. Собирали сыворотку (100 мкл) и хранили с тканями при температуре -80°С до обработки образцов. Обработка сыворотки: Образцы сыворотки нагревали до комнатной температуры и добавляли к ним 10 мкл 2,99 мкМ внутреннего стандарта (d6-собетиром). Добавляли ацетонитрил (500 мкл) и образец перемешивали вихревым способом в течение 20 секунд. Затем образец центрифугировали при 10000 × G в течение 15 минут при температуре 4°С. Затем 90% верхнего супернатанта переносили в стеклянную пробирку и концентрировали при помощи SpeedVac в течение 1,5 часов при температуре 45°C. Затем высушенный образец растворяли в 400 мкл смеси 50:50 ацетонитрил:H2O и перемешивали вихревым способом в течение 20 секунд. Полученную смесь переносили в центрифугу Eppendorf и центрифугировали при 10000 × G в течение 15 минут. Супернатант фильтровали при помощи 0,22 мкМ центробежных фильтров и при помощи анализа ЖХ-МС/МС проводили количественное определение свободного собетирома. Стандартная кривая была получена на 100 мкл сыворотки от мыши возраста 8-10 недель, которой сделали инъекцию только носителя. Обработку проводили точно так же, за исключением того, что после фильтрации образец разделяли на 6 ампул. К 5 из 6 ампулам добавляли собетиром с получением конечных концентраций в матрице (0,1 пг/мкл, 1 пг/мкл, 10 пг/мкл, 100 пг/мкл и 1000 пг/мкл).
[0147] Обработка мозга: Образцы мозга нагревали до комнатной температуры и переносили в гомогенизирующую пробирку с шариками из хромистой стали GoldSpec 1/8 (Applied Industrial Technologies). Полученную пробирку взвешивали и добавляли 1 мл H2O, а затем 10 мкл 2,99 мкМ внутреннего стандарта (d6-собетиром). Пробирку гомогенизировали при помощи Bead Bug® в течение 30 секунд и затем переносили в пробирку Falcon, содержащую 3 мл ацетонитрила. Для промывки гомогенизирующей пробирки использовали ацетонитрил (1 мл), раствор переносили обратно в пробирку Falcon. Затем образец обрабатывали, используя тот же метод, что и для обработки сыворотки, за исключением того, что образец концентрировали в стеклянной пробирке при помощи SpeedVac в течение 4 часов при температуре 45°C. Затем образцы были обработаны с использованием метода обработки сыворотки для анализа ЖХ-МС/МС.
[0148] Результаты приведены в таблице 1.
Таблица 1
Пример 2 - Общая химия
[0149] Спектр 1Н ЯМР получали при помощи Bruker 400®. Все 1Н ЯМР были откалиброваны с референсными пиками растворителя (ДМСО-d6, хлороформ-d, метанол-d4). Масс-спектрометрию высокого разрешения (МСВР) с электрораспылительной ионизацией была выполнена в Лаборатории биоаналитической масс-спектрометрии в Университете штата Портленд (США). Взаимодействия, проводимые в инертной атмосфере, проводили в аргоне, пропускаемом через небольшую колонку с драйеритом и были проведены в колбах с круглым дном, высушенных в пламени. Безводный тетрагидрофуран (ТГФ), дихлорметан (ДХМ) и диметилформамид (ДМФА) были получены от компании Seca Solvent System. Все остальные используемые растворители были приобретены у компаний Sigma- Aldrich или Fisher. Синтез собетирома (GC-1) был описан ранее (Chiellini G et al, Bioorg Med Chem Lett 10, 2607-2611 (2000) и Placzek AT et al, Tetrahedron 71, 5946-5951 (2015); оба документа включены в настоящее описание посредством ссылки). Синтез O-бензил GC-1 (2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты) был описан ранее. Все остальные реагенты были приобретены у компаний Fisher, Sigma или TCI и использовались в том виде, в котором они были получены. Чистота конечных соединений была определена как > 95% с помощью ВЭЖХ. Аналитический анализ ВЭЖХ проводили на Varian ProStar HPLC с колонкой Grace Alltima C18, 5 мкм (4,6 × 250 мм) с градиентом (растворитель A: 95:5 вода:MeCN, 0,2% Et3NH3PO4, pH 2,5; растворитель B: MeCN) для B от 40% до 100% в течение 20 минут со скоростью потока 1 мл/мин. Препаративную ВЭЖХ проводили на Varian Dynamax Microscrob 100-5 мкМ C18, 21,4 × 250 мм (растворитель A: вода + 0,1% муравьиная кислота; растворитель B: MeCN + 0,1% муравьиная кислота) с использованием градиента B 20-100% в течение 20 минут со скоростью потока 25 мл/мин.
Пример 3. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2-гидроксиэтил)ацетамид (соединение 1)

[0150] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 130 мг, 0,31 ммоль, 1 экв.) в ДХМ (2 мл) при температуре 0°C обрабатывали оксалилхлоридом (110 мкл, 1,23 ммоль, 4 экв.). Добавляли ДМФА (1 капля) и указанную реакционную смесь перемешивали в течение 3 часов при нагревании до комнатной температуры. Растворитель удаляли при пониженном давлении и неочищенное промежуточное соединение обрабатывали ДХМ (5 мл), который затем удаляли при пониженном давлении. Указанное неочищенное промежуточное соединение обрабатывали 1,5 мл ДХМ с последующим добавлением по каплям этаноламина (114 мг, 1,87 ммоль, 6 экв.). Указанную реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь очищали флэш-хроматографией (25-100% EtOAc в гексанах) с получением промежуточного продукта в виде белого твердого вещества (48 мг, 0,1 ммоль, 33%). Бензилзащищенное промежуточное соединение (48 мг, 0,104 ммоль, 1 экв.) обрабатывали смесью MeOH:EtOAc 1:1 (1 мл) в атмосфере аргона. В реакцию добавляли палладий на угле (10 мас. %, 22 мг) и по каплям добавляли триэтилсилан (132 мкл, 0,83 ммоль, 8 экв.). Реакционную смесь перемешивали в течение ночи. Добавляли дополнительную аликвоту триэтилсилана (50 мкл, 0,31 ммоль, 3 экв.) и реакционную смесь перемешивали в течение 1 часа. Реакционную смесь выливали через пробку из целита и промывали МеОН. Концентрированный реакционный раствор очищали флэш-хроматографией (1-10% МеОН в ДХМ) с получением продукта в виде твердого вещества белого цвета (29 мг, 0,076 ммоль, 73%). 1H ЯМР (400 МГц, хлороформ-d) δ 7,11 (b, 1H), 6,93 (d, J=2 Гц, 1H), 6,64-6,55 (m, 4H), 5,36 (b, 1H), 4,52 (s, 2H), 3,91 (s, 2H), 3,79 (t, J=4,8 Гц, 2H), 3,55 (q, J=5,5 Гц, 2H), 3,19 (септ., J=6,9, 1H), 2,22 (s, 6H), 1,25 (d, J=6,8 Гц, 6H). МСВР (ИЭР) m/z [M+H+] C22H30NO4+ требуется 372,2169, обнаружено 372,2182.
Пример 4. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(1-гидроксипропан-2-ил)ацетамид (соединение 3)
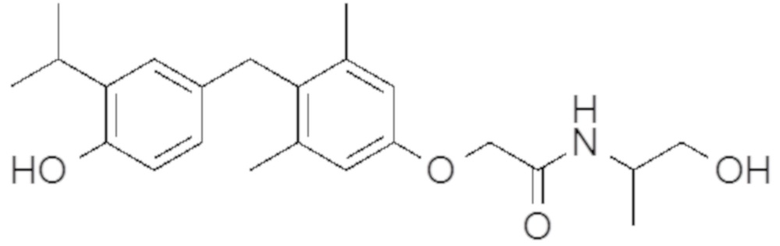
[0151] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 87 мг, 0,207 ммоль, 1 экв.) в ДХМ (1,3 мл) при температуре 0°C обрабатывали оксалилхлоридом (73 мкл, 0,83 ммоль, 4 экв.). Добавляли ДМФА (1 капля) и указанную реакционную смесь перемешивали в течение 3 часов при нагревании до комнатной температуры. Растворитель удаляли при пониженном давлении и неочищенное промежуточное соединение обрабатывали ДХМ (5 мл), который затем удаляли при пониженном давлении. Указанное неочищенное промежуточное соединение обрабатывали 1,5 мл ДХМ с последующим добавлением по каплям (+/-)-аланинола (93 мг, 1,24 ммоль, 6 экв.). Указанную реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь очищали флэш-хроматографией (25-100% EtOAc в гексанах) с получением промежуточного продукта в виде белого твердого вещества (48 мг, 0,1 ммоль, 48%). Бензилзащищенное промежуточное соединение (40 мг, 0,085 ммоль, 1 экв.) обрабатывали смесью MeOH:EtOAc 1:1 (1 мл) в атмосфере аргона. В реакцию добавляли палладий на угле (10 мас. %, 22 мг) и по каплям добавляли триэтилсилан (108 мкл, 0,68 ммоль, 8 экв.). Реакционную смесь перемешивали в течение ночи. Добавляли дополнительную аликвоту триэтилсилана (50 мкл, 0,31 ммоль, 3,7 экв.) и реакционную смесь перемешивали в течение 1 часа. Реакционную смесь выливали через пробку из целита и промывали МеОН. Концентрированный реакционный раствор очищали флэш-хроматографией (1-10% МеОН в ДХМ) с получением продукта в виде твердого вещества белого цвета (21 мг, 0,055 ммоль, 64%). 1H ЯМР (400 МГц, хлороформ-d) δ 7,28 (b, 1H), 6,93 (d, J=2 Гц), 6,73-6,53 (m, 4H), 5,04 (b, 1H), 4,50 (s, 2H), 4,19 (m, 1H), 3,92 (s, 2H), 3,72-3,61 (m 2H), 3,19 (s, J=6,9 Гц, 1H), 2,65 (s, 1H), 2,24 (s, 6H), 1,23 (m, 9H). МСВР (ИЭР) m/z [M+H+] C23H32NO4+ требуется 386,2326, обнаружено 386,2335.
Пример 5. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2-гидроксипропил)ацетамид (соединение 3)

[0152] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 87 мг, 0,207 ммоль, 1 экв.) в ДХМ (1,3 мл) при температуре 0°C обрабатывали оксалилхлоридом (73 мкл, 0,83 ммоль, 4 экв.). Добавляли ДМФА (1 капля) и указанную реакционную смесь перемешивали в течение 3 часов при нагревании до комнатной температуры. Растворитель удаляли при пониженном давлении и неочищенное промежуточное соединение обрабатывали ДХМ (5 мл), который затем удаляли при пониженном давлении. Указанное неочищенное промежуточное соединение обрабатывали 1,5 мл ДХМ с последующим добавлением по каплям 1-амино-2-пропанола (93 мг, 1,24 ммоль, 6 экв.). Указанную реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь очищали флэш-хроматографией (25-100% EtOAc в гексанах) с получением промежуточного продукта в виде белого твердого вещества (66 мг, 0,14 ммоль, 68%). Бензилзащищенное промежуточное соединение (40 мг, 0,085 ммоль, 1 экв.) обрабатывали смесью MeOH:EtOAc 1:1 (1 мл) в атмосфере аргона. В реакцию добавляли палладий на угле (10 мас. %, 22 мг) и по каплям добавляли триэтилсилан (108 мкл, 0,68 ммоль, 8 экв.). Реакционную смесь перемешивали в течение ночи. Добавляли дополнительную аликвоту триэтилсилана (50 мкл, 0,31 ммоль, 3,7 экв.) и реакционную смесь перемешивали в течение 1 часа. Реакционную смесь выливали через пробку из целита и промывали МеОН. Концентрированный реакционный раствор очищали флэш-хроматографией (1-10% МеОН в ДХМ) с получением продукта в виде твердого вещества белого цвета (43 мг, 0,11 ммоль, 73%). 1H ЯМР (400 МГЦ, хлороформ-d) δ 7,11 (b, 1H), 6,93 (d, J=2 Гц), 6,61-6,51 (m, 4H), 5,84 (b, 1H), 4,49 (s, 2H), 3,96 (m, 1H), 3,91 (s, 2H), 3,51 (m, 1H), 3,19 (m, 2H), 2,27 (s, 6H), 1,20 (m, 9H). МСВР (ИЭР) m/z [M+H+] C23H32NO4+ требуется 386,2326, обнаружено 386,2335.
Пример 6. 2-(2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамидо)этан-1-аминийацетат (Соединение 4)
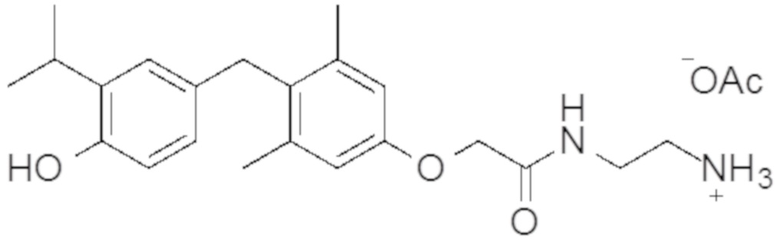
[0153] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 441 мг, 1,05 ммоль, 1 экв.) в ДХМ (7 мл) при температуре 0°C обрабатывали оксалилхлоридом (542 мкл, 6,3 ммоль, 6 экв.). Добавляли ДМФА (1 капля) и указанную реакционную смесь перемешивали в течение 3 часов при нагревании до комнатной температуры. Растворитель удаляли при пониженном давлении и неочищенное промежуточное соединение обрабатывали ДХМ (10 мл), который затем удаляли при пониженном давлении. Указанное неочищенное промежуточное соединение обрабатывали 3 мл ДХМ с последующим добавлением по каплям 2-аминоэтилбензилкарбамата (408 мг, 2,1 ммоль, 2 экв.). Указанную реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь очищали флэш-хроматографией (0-50% EtOAc в гексанах) с получением промежуточного продукта в виде белого твердого вещества (380 мг, 0,643 ммоль, 61%). Бензилзащищенное промежуточное соединение (380 мг, 0,64 ммоль, 1 экв.) обрабатывали ТГФ (2 мл) и уксусной кислотой (0,2 мл) в атмосфере аргона. В реакцию добавляли палладий на угле (10 мас. %, 270 мг) и по каплям добавляли триэтилсилан (818 мкл, 5,11 ммоль, 8 экв.). Реакционную смесь перемешивали в течение ночи. Реакционную смесь выливали через пробку из целита и промывали МеОН. Раствор концентрировали и затем растворяли в минимальном количестве ДХМ и MeOH и повторно концентрируют при пониженном давлении. Неочищенный продукт повторно обрабатывают ДХМ (0,25 мл) с несколькими каплями MeOH. Гексаны (3 мл) медленно добавляют к раствору, что приводит к осаждению продукта. Надосадочный слой гексанов удаляли пипеткой, а белый продукт промывали гексанами и тщательно сушили при пониженном давлении с получением белого вязкого твердого продукта (57 мг, 0,132 ммоль, 21%). 1H ЯМР (400 МГц, d6-ДМСО) δ 8,40 (b, 1H), 6,83 (d, J=2 Гц, 1H), 6,82-6,44 (m, 4H), 4,42 (s, 2H), 3,71 (s, 2H), 3,31 (t, J=6 Гц, 2H), 3,19 (септ., J=6,9 Гц, 1H), 2,79 (m, 2H), 2,16 (s, 6H), 1,83 (s, 3H), 1,09 (d, J=6,9 Гц, 6H). МСВР (ИЭР) m/z [M+H+] C22H31N2O3+ требуется 371,2335, обнаружено 371,2329.
Пример 7. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамид (соединение 5)

[0154] GC-1 (250 мг, 0,76 ммоль, 1 экв.) обрабатывали МеОН (3 мл) в герметичной пробирке. Добавляли серную кислоту (1 капля), реакцию герметизировали и затем нагревали до температуры 65°C в течение 1 часа при перемешивании. Реакцию оставляли нагреваться до комнатной температуры. Анализ ТСХ (1:30 MeOH:ДХМ) показал полное превращение в промежуточное соединение метиловый эфир. К реакционной смеси добавляли аммиак (7 н. в МеОН, 0,76 мл, 7 экв.). Реакцию повторно герметизировали и снова нагревали до температуры 65°C в течение 1 часа. Реакционную колбу выдерживали до достижения комнатной температуры, добавляли 0,5 н. NaOH (20 мл) в делительной воронке и затем экстрагировали ДХМ (3×100 мл). Органические слои объединяли, сушили над Na2SO4 и концентрировали. Проведение очистки с помощью флэш-хроматографии (0-6% МеОН в ДХМ) привело к получению продукта в виде твердого вещества белого цвета (157 мг, 0,48 ммоль, 63%). 1H ЯМР (400 МГц, хлороформ-d) δ 6,93 (b, 1H), 6,65-6,56 (m, 5H), 5,85 (b, 1H), 5,19 (s, 1H), 4,51 (s, 2H), 3,92 (s, 2H), 3,19 (септ., J=6,9, 1H), 2,24 (s, 6H), 1,23 (d, J=6,9 Гц, 6H). МСВР (ИЭР) m/z [M+Na+] C20H25NNaO3+ требуется 350,1727, обнаружено 350,1737.
Пример 8. N-(2,2-дифторэтил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамид (соединение 6)
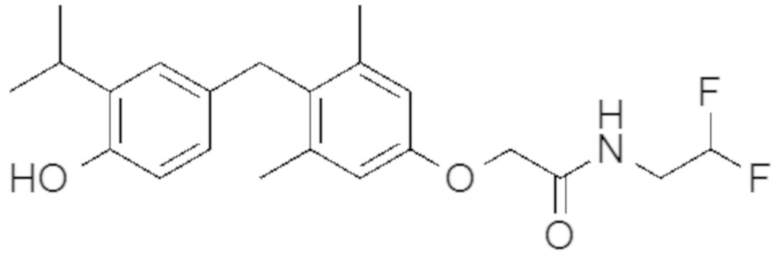
[0155] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 300 мг, 0,72 ммоль, 2 экв.) обрабатывали сухим ТГФ (5 мл) и CDI (140 мг, 0,86 ммоль, 2,4 экв.) с последующим нагреванием до температуры 45°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и растворяли в ТГФ (5 мл). Половину реакционной смеси переносили на следующую стадию (0,36 ммоль, 1 экв.) и обрабатывали ТГФ (2,5 мл). Дифторэтиламин (87 мг, 1,075 ммоль, 3 экв.) добавляли в виде раствора в ТГФ (0,2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор разбавляли диэтиловым эфиром (20 мл) и промывали 0,5 н. HCl (2×20 мл), а затем насыщенным солевым раствором (20 мл). Органический слой сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Неочищенное промежуточное соединение растворяли в ДХМ (3 мл) и помещали в атмосферу аргона. Добавляли пентаметилбензол (106 мг, 0,72 ммоль, 2 экв.) и реакционную смесь охлаждали до температуры -78 oC. Медленно добавляли раствор BCl3 (1 М ДХМ, 0,72 мл, 2 экв.) и указанную реакционную смесь перемешивали в течение 15 минут. Реакцию гасили добавлением насыщенного раствора NaHCO3 (2 мл) и колбу оставляли нагреваться до комнатной температуры. Указанную реакционную смесь разбавляли водой (10 мл) и экстрагировали ДХМ (2×20 мл). Органические слои объединяли, сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Проведение очистки с помощью флэш-хроматографии (2-40% EtOAc в гексанах) привело к получению продукта в виде прозрачного кристаллического твердого вещества (79 мг, 0,2 ммоль, 56%). 1H ЯМР (400 МГц, хлороформ-d) δ 6,94 (m, 2H), 6,65-6,55 (m, 4H), 5,91 (tt, J=55,8, 4,1 Гц, 1H), 5,19 (s, 1H), 4,55 (s, 2H), 3,93 (s, 2H), 3,77 (m, 2H), 3,20 (септ., J=6,9, 1H), 2,24 (s, 6H), 1,23 (d, J=6,9 Гц, 6H). МСВР (ИЭР) m/z [M+H+] C22H28F2NO3+ требуется = 392,2032, обнаружено 392,2040.
Пример 9. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2,2,2-трифторэтил)ацетамид (соединение 7)

[0156] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 300 мг, 0,72 ммоль, 2 экв.) обрабатывали сухим ТГФ (5 мл) и CDI (140 мг, 0,86 ммоль, 2,4 экв.) с последующим нагреванием до температуры 45°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и растворяли в ТГФ (5 мл). Половину реакции переносили на следующую стадию (0,36 ммоль, 1 экв.). Трифторэтиламин гидрохлорид (87 мг, 1,075 ммоль, 3 экв.) и DMAP (13 мг, 0,11 ммоль, 0,3 экв.) добавляли в виде раствора в ТГФ (0,2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор разбавляли диэтиловым эфиром (20 мл) и промывали 0,5 н. HCl (2×20 мл), а затем насыщенным солевым раствором (20 мл). Органический слой сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Неочищенное промежуточное соединение растворяли в ДХМ (3 мл) и помещали в атмосферу аргона. Добавляли пентаметилбензол (106 мг, 0,72 ммоль, 2 экв.) и реакционную смесь охлаждали до температуры -78°C. Медленно добавляли раствор BCl3 (1 М ДХМ, 0,72 мл, 2 экв.) и указанную реакционную смесь перемешивали в течение 15 минут. Реакцию гасили добавлением насыщенного раствора NaHCO3 (2 мл) и колбу оставляли нагреваться до комнатной температуры. Указанную реакционную смесь разбавляли водой (10 мл) и экстрагировали ДХМ (2×20 мл). Органические слои объединяли, сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Проведение очистки с помощью флэш-хроматографии (2-40% EtOAc в гексанах) привело к получению продукта в виде белого твердого вещества (89 мг, 0,22 ммоль, 61%). 1H ЯМР (400 МГц, хлороформ-d) δ 6,93 (m, 2H), 6,65-6,57 (m, 4H), 4,80 (s, 1H), 4,58 (s, 2H), 4,05 (m, 2H), 3,93 (s, 2H), 3,18 (септ., J=6,8, 1H), 2,24 (s, 6H), 1,23 (d, J=6,8 Гц, 6H). МСВР (ИЭР) m/z [M+Na+] C22H26F3NNaO3+ требуется = 432,1757, обнаружено 432,1762.
Пример 10. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-метилацетамид (соединение 8)

[0157] 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)уксусную кислоту (GC-1, 155 мг, 0,47 ммоль) растворяли в 3 мл МеОН и 1 капле серной кислоты в герметичной пробирке. Затем герметизированную реакционную смесь нагревали до температуры 65°C при перемешивании в течение 1 часа. При охлаждении до комнатной температуры ТСХ смеси показало полное превращение в промежуточное соединение метиловый эфир. Затем к раствору промежуточного соединения добавляли 610 мкл (7,05 ммоль, 15 экв.) 40% метиламина в воде и указанную реакционную смесь снова нагревали до температуры 65°С в течение 1 часа в герметизированной пробирке. Реакционную смесь экстрагировали из 200 мл 0,5 н. NaOH в 3×50 мл ДХМ. Органические слои объединяли, сушили над Na2SO4, фильтровали и концентрировали, затем очищали на диоксиде кремния (10% MeOH в ДХМ) с получением продукта в виде белого твердого вещества (144 мг, 90%). 1H ЯМР (400 МГц, CD3CN): 6,98 (шир., 1 H), 6,89 (s, 1 H), 6,68 (s, 2 H), 6,62 (d, 1 H, J=8,6 Гц), 6,54 (dd, 1 H, J=8,4, 2,4 Гц), 4,37 (s, 2 H), 3,87 (s, 2 H), 3,16 (септет, 1 H, J=6,9 Гц), 2,75 (d, 3 H, J=4,9 Гц), 2,20 (s, 6 H), 1,12 (d, 6 H, J=6,9 Гц). МСВР, точная масса, рассчитанная для C21H27NO3 [M+Na-]+: m/z 364,18831. Обнаружено m/z 364,18904.
Пример 11. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2-гидроксифенил)ацетамид (соединение 9)
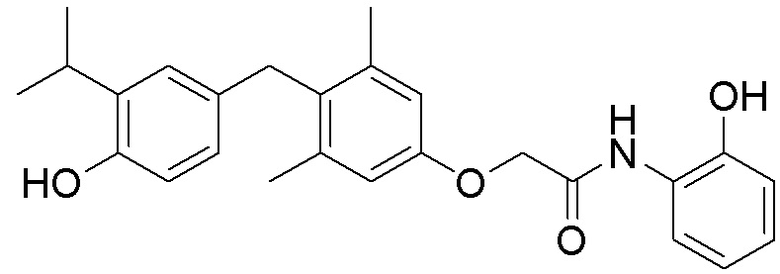
[0158] 2-[4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусную кислоту (250 мг, 0,6 ммоль) растворяли в 6 мл сухого ДМФ в круглодонной колбе. Добавляли 1-этил-(3-диметиламинопропил)карбодиимида гидрохлорид (EDC) (230 мг, 1,2 ммоль), 1-гидроксибензотриазол (HOBt) (162 мг, 1,2 ммоль) и диизопропилэтиламин (DIEA) (418 мкл, 2,4 ммоль) и перемешивали в течение 1 часа при комнатной температуре. Затем одной порцией добавляли 2-аминофенол (130 мг, 1,2 ммоль) и указанную реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем добавляли этилацетат (15 мл) и указанную реакционную смесь последовательно промывали 0,5 н. HCl (2×5 мл), насыщенным раствором NaHCO3 (2×5 мл) и насыщенным раствором NaCl (1×10 мл). Затем смесь сушили на безводном MgSO4 и растворитель удаляли в вакууме. Неочищенный продукт очищали флэш-хроматографией Biotage, элюируя при помощи от 10 до 40% этилацетата в гексане, с получением чистого бензилзащищенного ацетамида GC-1 (154 мг, 0,3 ммоль). 1H ЯМР (400 МГц, CDCl3): δ 8,72(s, 1H), 8,573 (s, 1H), 7,38-6,61 (m, 14H), 5,30 (s, 2H), 4,68 (s, 2H), 3,95 (s, 2H), 3,37 (m, 1H), 2,25 (s, 6H), 1,22 (d, J=6,57 Гц, 6H).
[0159] К перемешиваемой суспензии указанного защищенного ацетамида (150 мг, 0,29 ммоль) и 10% Pd-C, смоченному прим. 55% воды (60 мг) в 5 мл метанола по каплям добавляли триэтилсилан (441 мкл, 2,9 ммоль) в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. После завершения реакции (ТСХ) ее фильтровали через целит и растворитель удаляли в вакууме. Неочищенный продукт очищали флэш-хроматографией Biotage, элюируя 10-40% этилацетатом в гексане с получением конечного ацетамида (79 мг, 0,18 ммоль, выход 64%, чистота 98,9% по ВЭЖХ). 1H ЯМР (400 МГц, CDCl3): δ 8,70(s, 1H), 8,57 (s, 1H), 7,16 (m, 1H), 7,08 (m, 1H), 6,92 (m, 2H), 6,72 (s, 2H), 6,59 (m, 2H), 4,68 (s, 2H), 3,93 (s, 2H), 3,13 (m, 1H), 2,26 (s, 6H), 1,22 (d, J=6,98 Гц, 6H). МСВР (M+Na) рассчитано для C26H29NO4 442,19888, обнаружено 442,19903.
Пример 12. 2-(4-(4-гидрокси-3-изопропилбензил)-N-(3-гидроксифенил)ацетамид (соединение 10)
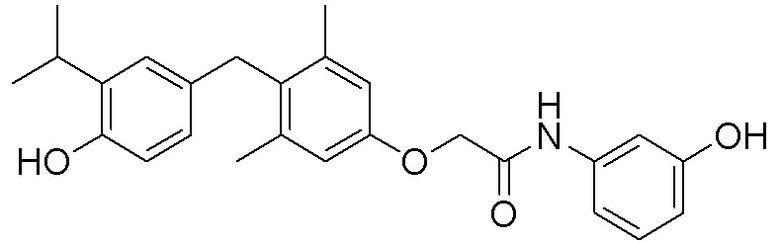
[0160] 2-[4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусную кислоту (250 мг, 0,6 ммоль) растворяли в 6 мл сухого ДМФ. Добавляли 1-этил-(3-диметиламинопропил)карбодиимида гидрохлорид (EDC) (230 мг, 1,2 ммоль), 1-гидроксибензотриазол (HOBt) (162 мг, 1,2 ммоль) и диизопропилэтиламин (DIEA) (418 мкл, 2,4 ммоль) и перемешивали в течение 1 часа при комнатной температуре. К этому раствору одной порцией добавляли 2-аминофенол (130 мг, 1,2 ммоль) одной порцией и перемешивали в течение ночи при комнатной температуре. Затем к смеси добавляли этилацетат (15 мл) и указанную реакционную смесь промывали 0,5 н. HCl (2× 10 мл), насыщенным раствором NaHCO3 (2×10 мл) и насыщенным раствором NaCl (1×10 мл). Затем смесь сушили на безводном MgSO4 и растворитель удаляли в вакууме. Неочищенный продукт очищали флэш-хроматографией Biotage, элюируя при помощи от 10 до 40% этилацетата в гексане, с получением чистого бензилзащищенного ацетамида GC-1 (186 мг, 0,36 ммоль). 1H ЯМР (400 МГц, CDCl3): δ 8,35 (s, 1H), 7,64 (s, 1H), 7,43-7,33 (m, 5H), 7,21-6,85 (m, 4H), 6,76-6,61 (m, 5H), 5,0 (s, 2H), 4,6 (s, 2H), 3,97 (s, 2H), 3,36 (m, 1H), 2,25 (s, 6H), 1,19 (d, J=6,94 Гц, 6H)
[0161] Защищенный ацетамид (180 мг, 0,35 ммоль) растворяли в смеси метанола и ТГФ (5 мл + 6 мл) (11 мл), поскольку только в метаноле он полностью не растворяется. К перемешиваемой суспензии в атмосфере аргона добавляли 10% Pd-C, смоченный прим. 55% воды (72 мг,,035 ммоль), и по каплям добавляли триэтилсилан (532 мкл, 3,5 ммоль). После завершения реакции через 2 часа (ТСХ) ее фильтровали через целит и растворитель удаляли в вакууме. Неочищенный продукт очищали флэш-хроматографией Biotage, элюируя 20-60% этилацетатом в гексане, с получением конечного ацетамида (75 мг, 0,17 ммоль, выход 61%). 1H ЯМР (400 МГц, CDCl3): δ 7,28 (m, 1H), 7,16 (t, J=7,89 Гц, 1H), 6,88 (m, 1H), 6,83 (m, 1H), 6,67 (s, 1H), 6,63 (m, 1H), 6,59 (d, J=7,89 Гц, 1H), 6,49 (m, 1H), 4,56 (s, 2H), 3,88 (s, 2H), 3,12 (m, 1H), 2,22 (s, 6H), 1,16 (d, J=6,85 Гц, 6H). МСВР (M+Na) рассчитано для C26H29NO4 442,19888, обнаружено 442,19939.
Пример 13. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2-метилсульфонамидо)этил)ацетамид (соединение 11)

[0162] 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусную кислоту (бензилированный GC-1, 250 мг, 0,66 ммоль) растворяли в 1 мл сухого ДМФ. К указанному раствору карбоновой кислоты добавляли DIEA (686 мкл, 3,94 ммоль), EDC HCl (253 мг, 1,31 ммоль) и HOBt (178 мг, 1,31 ммоль), и этот раствор перемешивали в течение 1 часа при комнатной температуре. Затем добавляли амин, N-(2-аминоэтил)метансульфонамид (160 мг, 1,16 ммоль) и указанную реакционную смесь перемешивали при комнатной температуре в течение 18 часов. После разбавления указанной реакционной смеси 10 мл EtOAc ее промывали 1 н. HCl 2×5 мл, насыщенным водным раствором бикарбоната натрия 1×5 мл и насыщенным солевым раствором 2×5 мл. Полученный органический слой сушили над MgSO4, фильтровали и концентрировали с получением неочищенного промежуточного продукта (319 мг, 90%). Неочищенный продукт был достаточно чистым по 1H ЯМР для того, чтобы использовать его без дополнительной очистки.
[0163] Бензилированное промежуточное соединение, 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)-N-(2-метилсульфонамио)этил)ацетамид (139 мг, 0,592 ммоль) и пентаметилбензол (292 мг, 1,97 ммоль) растворяли в 10 мл сухого ДХМ при температуре -78°С. К указанному перемешиваемому раствору при температуре -78°С добавляли BCl3 (3,3 мл, 3,3 ммоль) и указанную реакционную смесь перемешивали в течение 2 часов, затем ее гасили 10 мл смеси 9:1 CHCl3:MeOH и упаривали до остатка. Этот остаток промывали гексаном с получением неочищенного белого твердого вещества, которое очищали при помощи хроматографии на диоксиде кремния (10% МеОН в ДХМ). Конечный продукт представлял собой беловатое твердое вещество (244 мг, 92%). 1H ЯМР (400 МГц, CD3CN): 7,29 (шир., 1 H), 6,89 (s, 1 H), 6,69 (s, 2 H), 6,62 (d, 1 H, J=8,2 Гц), 6,54 (d, 1 H, J=8,4, 2,0 Гц), 4,43 (s, 2 H), 3,88 (s, 2 H), 3,39 (m, 2 H), 3,16 (m, 3 H), 2,88 (s, 3 H), 2,20 (s, 6 H), 1,12 (d, 6 H, J=6,9 Гц). МСВР точная масса, рассчитанная для C23H32N2O5S [M+Na]+: m/z 471,19241. Обнаружено m/z 471,19335.
Пример 14. N-(1,3-дигидроксипропан-2-ил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамид (соединение 12)
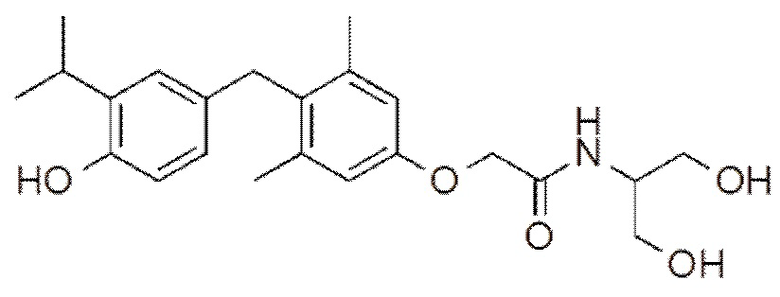
[0164] Перемешиваемый раствор GC-1 (411 мг, 1,25 ммоль, 1 экв.) обрабатывали ДХМ (6 мл), а затем добавляли DCC (283 мг, 1,34 ммоль, 1,1 экв.) и N-гидроксисукцинимид (158 мг, 1,34 ммоль, 1,1 экв.). Указанную реакционную смесь перемешивали в течение 4 часов, в это время образовался белый осадок. Побочный продукт мочевины отфильтровывали и промежуточное соединение эфир NHS очищали флэш-хроматографией (0-80% EtOAc в гексанах) с получением белого продукта (323 мг, 0,76 моль, 60%). Промежуточное соединение эфир NHS (55 мг, 0,129 ммоль, 1 экв.) обрабатывали ТГФ (1 мл) и триэтиламином (27 мкл, 0,19 ммоль, 1,5 экв.). Реакционную смесь обрабатывали (+/-)-серинолом (17 мг, 0,19 ммоль, 1,5 экв.) и перемешивали в течение 30 мин. Реакционную смесь непосредственно очищали флэш-хроматографией с получением продукта в виде белого твердого вещества (14 мг, 0,035 ммоль, 27%). 1H ЯМР (400 МГц, хлороформ-d) δ 6,87 (s, 1H), 6,60-6,45 (m, 4H), 4,45 (s, 2H), 3,94 (m, 1H), 3,85 (s, 2H), 3,72-3,61 (m 2H), 3,19 (s, J=6,9 Гц, 1H), 2,65 (s, 1H), 2,24 (s, 6H), 1,23 (b, 8H). МСВР (ИЭР) m/z [M+Na+] C23H31NNaO5+ требуется = 424,2094, обнаружено 424,2099.
Пример 15. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-пропилацетамид (соединение 13)

[0165] 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)уксусную кислоту (GC-1) (100 мг, 0,3 ммоль) растворяли в метаноле в герметичной пробирке. К смеси добавляли концентрированную H2SO4 (1 капля) и смесь нагревали при температуре 65°C. Полную конверсию в метиловый эфир наблюдали через 1 час (ТСХ). К смеси добавляли пропиламин (246 мкл, 3 ммоль) и затем смесь снова нагревали при температуре 65°С в течение 1 часа. Реакция не была завершена, поэтому к смеси добавили еще 100 мкл пропиламина, и реакция завершилась через 30 минут (ТСХ). Реакцию охлаждали до температуры 0°С на ледяной бане, добавляли 0,5 н. NaOH (10 мл) и реакционную смесь экстрагировали дихлорметаном (3×50 мл). Органические слои объединяли и сушили на безводном MgSO4. Неочищенный продукт очищали флэш-хроматографией Biotage, элюируя 20-60% этилацетатом, с получением чистого ацетамида (46 мг, 0,12 ммоль, выход 41%, чистота 99,3% по ВЭЖХ). 1H ЯМР (400 МГц, CDCl3): δ 6,91(s, 1H), 6,63-6,53 (m, 5H), 4,48 (s, 2H), 3,90 (s, 2H), 3,31 (m, 2H), 3,15 (m, 1H), 2,22 (s, 6H), 1,59 (m, 2H), 1,21 (d, J=6,94 Гц, 6H), 0,94 (t, J=7,5 Гц, 3H). МСВР (M+Na) рассчитано для C23H31NO3 392,21962, обнаружено 392,22036.
Пример 16. N-(2-фторэтил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамид (соединение 14)
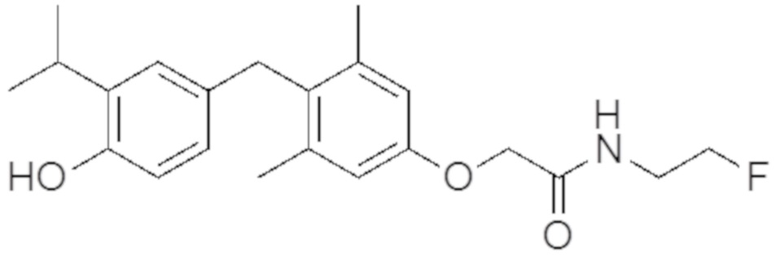
[0166] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 150 мг, 0,36 ммоль, 1 экв.) обрабатывали сухим ТГФ (5 мл) и CDI (140 мг, 0,86 ммоль, 2,4 экв.) с последующим нагреванием до температуры 45°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и растворяли в ТГФ (2,5 мл). Реакционный раствор обрабатывали 2-фторэтиламин гидрохлоридом (87 мг, 1,075 ммоль, 3 экв.) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор разбавляли диэтиловым эфиром (20 мл) и промывали 0,5 н. HCl (2×20 мл), а затем насыщенным солевым раствором (20 мл). Органический слой сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Неочищенное промежуточное соединение растворяли в ДХМ (3 мл) и помещали в атмосферу аргона. Добавляли пентаметилбензол (106 мг, 0,72 ммоль, 2 экв.) и реакционную смесь охлаждали до температуры -78°C. Медленно добавляли раствор BCl3 (1 М ДХМ, 0,72 мл, 2 экв.) и указанную реакционную смесь перемешивали в течение 15 минут. Реакцию гасили добавлением насыщенного раствора NaHCO3 (2 мл) и колбу оставляли нагреваться до комнатной температуры. Указанную реакционную смесь разбавляли водой (10 мл) и экстрагировали ДХМ (2×20 мл). Органические слои объединяли, сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Проведение очистки с помощью флэш-хроматографии (2-40% EtOAc в гексанах) привело к получению продукта в виде белого твердого вещества (70 мг, 0,19 ммоль, 52%). 1H ЯМР (400 МГц, хлороформ-d) δ 7,03 (s, 1H), 6,94 (d, J=2,1 Гц, 1H), 6,68-6,52 (m, 4H), 4,76 (s, 1H), 4,62 (dt, J=47,4, 4,8 Гц, 1H), 4,53 (s, 2H), 3,93 (s, 2H), 3,71 (dq, J=27,8, 5,0 Гц, 2H), 3,17 (гепт., J=7,0 Гц, 1H), 2,24 (s, 6H), 1,23 (d, J=6,9 Гц, 6H).
Пример 17. N-аллил-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамид (соединение 15)

[0167] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 300 мг, 0,72 ммоль, 2 экв.) обрабатывали сухим ТГФ (5 мл) и CDI (140 мг, 0,86 ммоль, 2,4 экв.) с последующим нагреванием до температуры 45°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и растворяли в ТГФ (5 мл). Половину реакционной смеси переносили на следующую стадию (0,36 ммоль, 1 экв.) и обрабатывали ТГФ (2,5 мл). После этого к раствору добавляли аллиламин гидрохлорид (90 мг, 1,075 ммоль, 3 экв.) и перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли диэтиловым эфиром (20 мл) и промывали 0,5 н. HCl (2×20 мл), а затем насыщенным солевым раствором (20 мл). Органический слой сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Неочищенное промежуточное соединение растворяли в ДХМ (3 мл) и помещали в атмосферу аргона. Добавляли пентаметилбензол (106 мг, 0,72 ммоль, 2 экв.) и реакционную смесь охлаждали до температуры -78°C. Медленно добавляли раствор BCl3 (1 М ДХМ, 0,72 мл, 2 экв.) и указанную реакционную смесь перемешивали в течение 15 минут. Реакцию гасили добавлением насыщенного раствора NaHCO3 (2 мл) и колбу оставляли нагреваться до комнатной температуры. Указанную реакционную смесь разбавляли водой (10 мл) и экстрагировали ДХМ (2×20 мл). Органические слои объединяли, сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Проведение очистки с помощью флэш-хроматографии (2-40% EtOAc в гексанах) привело к получению продукта в виде белого твердого вещества (70 мг, 0,2 ммоль, 55%). 1H ЯМР (400 МГц, хлороформ-d) δ 6,94 (d, J=2,1 Гц, 1H), 6,75 (s, 1H), 6,68-6,52 (m, 4H), 5,96-5,81 (m, 1H), 5,27-5,14 (m, 2H), 4,96 (s, 1H), 4,54 (s, 2H), 4,02 (tt, J=5,8, 1,6 Гц, 2H), 3,93 (s, 2H), 3,19 (гепт., J=6,9 Гц, 1H), 2,24 (s, 6H), 1,23 (d, J=6,9 Гц, 6H).
Пример 18. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(проп-2-ин-1-ил)ацетамид (соединение 16)

[0168] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 300 мг, 0,72 ммоль, 2 экв.) обрабатывали сухим ТГФ (5 мл) и CDI (140 мг, 0,86 ммоль, 2,4 экв.) с последующим нагреванием до температуры 45°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и растворяли в ТГФ (5 мл). Половину реакционной смеси переносили на следующую стадию (0,36 ммоль, 1 экв.) и обрабатывали ТГФ (2,5 мл). Пропиларгинин (90 мг, 1,075 ммоль, 3 экв.) добавляли в виде раствора в ТГФ (0,2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор разбавляли диэтиловым эфиром (20 мл) и промывали 0,5 н. HCl (2×20 мл), а затем насыщенным солевым раствором (20 мл). Органический слой сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Неочищенное промежуточное соединение растворяли в ДХМ (3 мл) и помещали в атмосферу аргона. Добавляли пентаметилбензол (106 мг, 0,72 ммоль, 2 экв.) и реакционную смесь охлаждали до температуры -78 oC. Медленно добавляли раствор BCl3 (1 М ДХМ, 0,72 мл, 2 экв.) и указанную реакционную смесь перемешивали в течение 15 минут. Реакцию гасили добавлением насыщенного раствора NaHCO3 (2 мл) и колбу оставляли нагреваться до комнатной температуры. Указанную реакционную смесь разбавляли водой (10 мл) и экстрагировали ДХМ (2× 20 мл). Органические слои объединяли, сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Проведение очистки с помощью флэш-хроматографии (2-40% EtOAc в гексанах) привело к получению продукта в виде беловатого твердого вещества (88 мг, 0,24 ммоль, 67%). 1H ЯМР (400 МГц, хлороформ-d) δ 6,92 (t, J=3,5 Гц, 2H), 6,63 (d, J=8,1 Гц, 1H), 6,63 (s, 2H), 6,53 (dd, J=8,2, 2,2 Гц, 1H), 5,69 (s, 1H), 4,51 (s, 2H), 4,16 (dd, J=5,5, 2,6 Гц, 2H), 3,90 (s, 2H), 3,20 (гепт., J=6,9 Гц, 1H), 2,22 (s, 6H), 1,21 (d, J=6,9 Гц, 6H).
Пример 19. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-метоксиацетамид (Соединение 17)
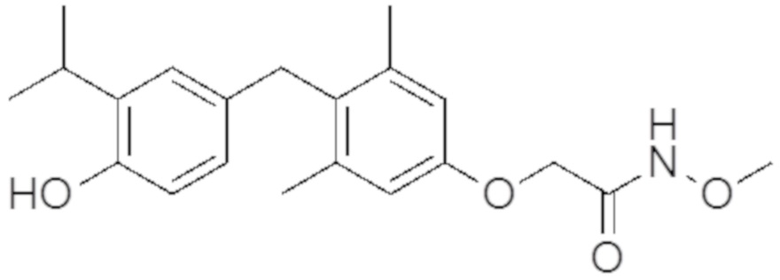
[0169] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 300 мг, 0,72 ммоль, 2 экв.) обрабатывали сухим ТГФ (5 мл) и CDI (140 мг, 0,86 ммоль, 2,4 экв.) с последующим нагреванием до температуры 45°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и растворяли в ТГФ (5 мл). Половину реакционной смеси переносили на следующую стадию (0,36 ммоль, 1 экв.) и обрабатывали ТГФ (2,5 мл). После этого к раствору добавляли метоксиламин гидрохлорид (83 мг, 1,075 ммоль, 3 экв.) и перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли диэтиловым эфиром (20 мл) и промывали 0,5 н. HCl (2×20 мл), а затем насыщенным солевым раствором (20 мл). Органический слой сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Неочищенное промежуточное соединение растворяли в ДХМ (3 мл) и помещали в атмосферу аргона. Добавляли пентаметилбензол (106 мг, 0,72 ммоль, 2 экв.) и реакционную смесь охлаждали до температуры -78°C. Медленно добавляли раствор BCl3 (1 М ДХМ, 0,72 мл, 2 экв.) и указанную реакционную смесь перемешивали в течение 15 минут. Реакцию гасили добавлением насыщенного раствора NaHCO3 (2 мл) и колбу оставляли нагреваться до комнатной температуры. Указанную реакционную смесь разбавляли водой (10 мл) и экстрагировали ДХМ (2×20 мл). Органические слои объединяли, сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Проведение очистки с помощью флэш-хроматографии (2-40% EtOAc в гексанах) привело к получению продукта в виде белого твердого вещества (94,5 мг, 0,26 ммоль, 72%). 1H ЯМР (400 МГц, хлороформ-d) δ 9,06 (s, 1H), 6,93 (d, J=2,1 Гц, 1H), 6,66-6,52 (m, 4H), 4,74 (s, 1H), 4,59 (s, 2H), 3,92 (s, 2H), 3,86 (s, 3H), 3,18 (гепт., J=6,9 Гц, 1H), 2,24 (s, 6H), 1,23 (d, J=6,9 Гц, 6H).
Пример 20. N-(3,4-дигидроксифенэтил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамид (соединение 18)

[0170] 2-[4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусную кислоту (200 мг, 0,48 ммоль) растворяли в 10 мл сухого ДМФ в круглодонной колбе. Добавляли 1,1'-карбонилдиимидазол (CDI) (78 мг, 0,48 ммоль) и перемешивали при температуре 45°C в течение 3 часов. Реакцию контролировали с помощью ТСХ, и, когда наблюдали полное превращение в ацилимидазолид, смесь концентрировали досуха в вакууме с удалением всего CO2. Затем его растворяли в сухом ТГФ (8 мл) и к нему медленно добавляли раствор дофамина гидрохлорида (118,33 мг, 0,624 ммоль, 1,3 экв.) в 2 мл сухого МеОН. Реакционную смесь перемешивали при температуре 45°С в течение ночи. Затем реакционную смесь охлаждали и растворитель выпаривали в вакууме. К смеси добавляли этилацетат (25 мл) и указанную реакционную смесь последовательно промывали 0,5 н. HCl (2×5 мл) и насыщенным раствором NaCl (1×10 мл). Смесь сушили на безводном MgSO4 и растворитель удаляли в вакууме. Неочищенный продукт очищали флэш-хроматографией Biotage, элюируя 10-40% этилацетатом в гексане. Бензилзащищенный ацетамид GC-1 кристаллизовали из хлороформа (100 мг, 0,17 ммоль). 1H ЯМР (400 МГц, метанол-d4): δ 7,48-7,26 (m, 3H), 6,93 (d, J=2,3 Гц, 1H), 6,82 (dd, J=8,5, 1,3 Гц, 1H), 6,71-6,62 (m, 3H), 6,51 (dd, J=8,1, 2,0 Гц, 1H), 5,03 (s, 1H), 4,47 (d, J=1,4 Гц, 1H), 3,95 (s, 1H), 3,45 (dd, J=8,1, 6,7 Гц, 1H), 3,38-3,26 (m, 1H), 2,67 (t, J=7,4 Гц, 1H), 2,22 (s, 3H), 1,16 (dd, J=6,9, 1,3 Гц, 3H).
[0171] К перемешиваемому раствору указанного защищенного ацетамида (75 мг, 0,13 ммоль) и 10% Pd-C, смоченному прим. 55% воды (27,6 мг) в 5 мл метанола по каплям добавляли триэтилсилан (198 мкл, 1,3 ммоль) в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. После завершения реакции (ТСХ) ее фильтровали через целит и растворитель удаляли в вакууме. Неочищенный продукт очищали флэш-хроматографией Biotage, элюируя 30-80% дихлорметаном в этилацетате, с получением конечного ацетамида (42 мг, 0,18 ммоль, выход 67%, чистота 99% по ВЭЖХ). 1H ЯМР (400 МГц, CDCl3): δ 6,84 (d, J=2,1 Гц, 1 H), 6,69 (d, J=6,8 Гц, 4H), 6,63-6,49 (m, 3H), 4,48 (s, 2H), 3,92 (s, 2H), 3,47 (t, J=7,4 Гц, 2H), 3,22 (гепт., J=6,9 Гц, 1H), 2,69 (t, J=7,4 Гц, 2H), 2,23 (s, 6H), 1,32 (s, 1H), 1,15 (d, J=6,9 Гц, 6H), 0,93 (t, J=7,0 Гц, 2H).
Пример 21. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-фенэтилацетамид (соединение 19)
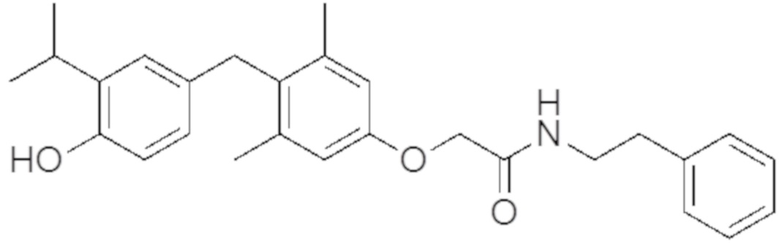
[0172] 2-[4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусную кислоту (200 мг, 0,48 ммоль) растворяли в 10 мл сухого ДМФ в круглодонной колбе. Добавляли 1,1'-карбонилдиимидазол (78 мг, 0,48 ммоль) и перемешивали при температуре 45°C в течение 3 часов. Реакцию контролировали с помощью ТСХ, и, когда наблюдали полное превращение в ацилимидазолид, смесь концентрировали досуха в вакууме с удалением всего CO2. Затем реакцию растворяли в сухом ТГФ (8 мл) и по каплям добавляли раствор 2-фенилэтиламина (157,5 мг, 1,44 ммоль, 1,33 экв.) в 2 мл сухого ТГФ. Реакционную смесь перемешивали при температуре 45°С в течение ночи. Затем реакционную смесь охлаждали и растворитель выпаривали в вакууме. Смесь растворяли в этилацетате (25 мл) и последовательно промывали 0,5 н. HCl (2×5 мл) и насыщенным раствором NaCl (1×10 мл). Затем смесь сушили на безводном MgSO4 и растворитель удаляли в вакууме. Неочищенный продукт очищали флэш-хроматографией Biotage, элюируя 10-40% этилацетатом в гексане. 1H ЯМР (400 МГц, хлороформ-d) δ 7,46-7,14 (m, 11 H), 6,98 (d, J=2,1 Гц, 1 H), 6,73 (dd, J=8,4, 1,2 Гц, 1H), 6,70-6,55 (m, 4H), 5,02 (s, 2H), 4,47 (s, 2H), 3,93 (s, 2H), 3,66-3,56 (m, 2H), 3,35 (гепт., J=6,9 Гц, 1H), 2,85 (t, J=7,0 Гц, 2H), 2,23 (s, 6H), 1,20 (dd, J=7,0, 1,2 Гц, 6H).
[0173] Снятие защиты с бензильной группы полученного таким образом ацетамида осуществляли с помощью BCl3. Ацетамид (220 мг, 0,42 ммоль) растворяли в сухом дихлорметане (10 мл) и добавляли к нему пентаметилбензол (125 мг, 0,84 ммоль). Затем раствор охлаждали до температуры -78°C при помощи бани с сухим льдом/ацетоном, и к нему очень медленно добавляли 1 мл 1 М раствора BCl3 в дихлорметане (117 мг, 1 ммоль). Смесь перемешивали при температуре -78°C в течение 20 минут, по ТСХ наблюдали полную конверсию в продукт. Затем добавляли насыщенный раствор бикарбоната натрия (5 мл) при температуре -78°C. Смесь подогревали до комнатной температуры. Затем к смеси добавляли дихлорметан (25 мл) и воду (5 мл) и собирали органический слой. Водный слой экстрагировали дихлорметаном (2×10 мл) и объединенный органический слой сушили над безводным сульфатом магния. Неочищенный продукт очищали флэш-хроматографией Biotage, элюируя 20-60% этилацетатом в гексане, с получением конечного ацетамида (134 мг, 0,31 ммоль, выход 74%, чистота 99,6% по ВЭЖХ). 1H ЯМР (400 МГц, CDCl3): δ 7,34-7,12 (m, 5H), 6,92 (d, J=2,1 Гц, 1 H), 6,67 (s, 1H), 6,62-6,50 (m, 4H), 4,67 (s, 1 H), 4,46 (s, 2H), 3,90 (s, 2H), 3,61 (q, J=6,8 Гц, 2H), 3,15 (гепт., J=6,9 Гц, 1 H), 2,84 (t, J=7,0 Гц, 2H), 2,22 (5, 6H), 1,21 (d, J=6,9 Гц, 6H).
Пример 22. N-гидрокси-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамид (соединение 20)
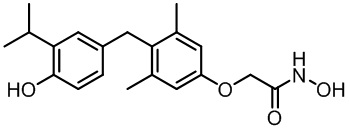
[0174] 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусную кислоту (бензилированный GC-1, 150 мг, 0,36 ммоль) растворяли в 6 мл сухого ТГФ. К этому раствору карбоновой кислоты добавляли 1,1'-карбонилдиимидазол (70 мг, 0,43 ммоль) в атмосфере аргона и этот раствор перемешивали в течение 2 часов при температуре 50°C. Затем добавляли гидроксиламина гидрохлорид (30 мг, 0,43 ммоль) в 3 мл МеОН и реакционную смесь перемешивали при температуре 50°С в течение 18 часов. Затем реакционную смесь упаривали в вакууме досуха, растворяли в 10 мл ДХМ и промывали 2×5 мл 1 н. HCl и 2×5 мл насыщенным солевым раствором. Полученный органический слой сушили над MgSO4, фильтровали и концентрировали с получением неочищенного промежуточного продукта (139 мг, 90%). Неочищенный продукт был достаточно чистым по 1H ЯМР для того, чтобы использовать его без дополнительной очистки.
[0175] Бензилированное промежуточное соединение, 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)-N-гидроксиацетамид (139 мг, 0,321 ммоль) и пентаметилбензол (160 мг, 1,07 ммоль) растворяли в 10 мл сухого ДХМ при температуре -78°С. К указанному перемешиваемому раствору при температуре -78°С добавляли BCl3 (1,1 мл, 1,1 ммоль) и указанную реакционную смесь перемешивали в течение 2 часов, затем ее гасили 10 мл смеси 9:1 CHCl3:MeOH и упаривали до остатка. Этот остаток промывали гексаном с получением неочищенного белого твердого вещества, которое очищали при помощи хроматографии на диоксиде кремния (10% МеОН в ДХМ). Конечный продукт представлял собой беловатое твердое вещество (51 мг, 46%). Продукт дает положительный результат (красно-оранжевое окрашивание) с хлоридом железа (III) по ТСХ. 1H ЯМР (400 МГц, MeOD): 6,78 (s, 1 H), 6,65 (s, 2 H), 6,54 (d, 1 H, J=8,3 Гц), 6,48 (dd, 1 H, J=8,3, 2 Гц), 4,48 (s, 2 H), 3,85 (s, 2 H), 3,15 (септ., 1 H), 2,16 (s, 6 H), 1,08 (d, 6 H, J=6,9 Гц).
Пример 23. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетогидразид (соединение 21)
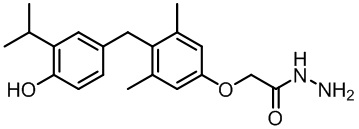
[0176] 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)уксусную кислоту (собетиром, 50 мг, 0,15 ммоль) растворяли в 3 мл МеОН и 1 капле серной кислоты в герметичной пробирке. Затем герметизированную реакционную смесь нагревали до температуры 65°С при перемешивании в течение 1 часа. При охлаждении до комнатной температуры ТСХ смеси показало полное превращение в промежуточное соединение метиловый эфир. Затем к раствору промежуточного соединения добавляли 44 мкл (0,9 ммоль, 6 экв.) гидразина моногидрата и указанную реакционную смесь перемешивали в течение 1 часа в герметизированной пробирке. Реакционную смесь экстрагировали из 50 мл воды в ДХМ 3×20 мл. Органические слои объединяли, сушили над Na2SO4, фильтровали и концентрировали, затем очищали на диоксиде кремния (10% MeOH в ДХМ) с получением продукта в виде белого твердого вещества (44 мг, 86%). Продукт дает положительный результат с нингидрином по ТСХ. 1H ЯМР (400 МГц, MeOD): 6,77 (s, 1 H), 6,64 (s, 2 H), 6,53 (d, 1 H, J=8,2 Гц), 6,46 (dd, 1 H, J=8,3, 2 Гц), 4,48 (s, 2 H), 3,83 (s, 2 H), 3,16 (септ., 1 H), 2,16 (s, 6 H), 1,08 (d, 6 H, J=6,9 Гц.
Пример 25. 2-(2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамидо)этан-1-сульфонат натрия (соединение 23)

[0177] GC-1 (100 мг, 0,3 ммоль, 1 экв.) обрабатывали МеОН (5 мл) в герметичной пробирке. Добавляли серную кислоту (1 капля), реакцию герметизировали и затем нагревали до температуры 65°C в течение 1 часа при перемешивании. Реакцию оставляли нагреваться до комнатной температуры. Анализ ТСХ (1:30 MeOH:ДХМ) показал полное превращение в промежуточное соединение метиловый эфир. К реакционной смеси промежуточного соединения добавляли таурин (229 мг, 1,83 ммоль, 6 экв.) в виде раствора с гидроксидом натрия (73 мг, 1,83 ммоль, 6 экв.) в воде (2 мл). Реакцию повторно герметизировали и снова нагревали до температуры 65°C в течение ночи. Часть растворителя удаляли при пониженном давлении и общий объем раствора доводили до примерно 5 мл с помощью дополнительной воды. Раствор фильтровали через фильтр 0,22 мкм и очищали препаративной ВЭЖХ. Объединенные фракции продукта объединяли и концентрировали постоянным потоком воздуха с последующим пониженным давлением с получением белого твердого вещества (7,8 мг, 0,02 ммоль, 5%). 1H ЯМР (400 МГц, 9:1 хлороформ-d: метанол-d4) δ 6,85 (d, J=2,2 Гц, 1H), 6,61-6,52 (m, 3H), 6,43 (dd, J=8,2, 2,3 Гц, 1H), 4,40 (s, 2H), 3,83 (s, 2H), 3,72 (t, J=6,0 Гц, 2H), 3,37 (s, 6H), 3,17 (гепт., J=6,9 Гц, 1H), 3,02 (t, J=6,0 Гц, 2H), 2,15 (s, 6H), 1,13 (d, J=6,9 Гц, 6H).
Пример 26. N-циклопропил-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамид (соединение 24)

[0178] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 300 мг, 0,72 ммоль, 2 экв.) обрабатывали сухим ТГФ (5 мл) и CDI (140 мг, 0,86 ммоль, 2,4 экв.) с последующим нагреванием до температуры 45°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и растворяли в ТГФ (5 мл). Половину реакционной смеси переносили на следующую стадию (0,36 ммоль, 1 экв.) и обрабатывали ТГФ (2,5 мл). После этого к раствору реакции добавляли циклопропиламин (60 мг, 1,075 ммоль, 3 экв.) и перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли диэтиловым эфиром (20 мл) и промывали 0,5 н. HCl (2×20 мл), а затем насыщенным солевым раствором (20 мл). Органический слой сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Неочищенное промежуточное соединение растворяли в ДХМ (3 мл) и помещали в атмосферу аргона. Добавляли пентаметилбензол (106 мг, 0,72 ммоль, 2 экв.) и реакционную смесь охлаждали до температуры -78 oC. Медленно добавляли раствор BCl3 (1 М ДХМ, 0,72 мл, 2 экв.) и указанную реакционную смесь перемешивали в течение 15 минут. Реакцию гасили добавлением насыщенного раствора NaHCO3 (2 мл) и колбу оставляли нагреваться до комнатной температуры. Указанную реакционную смесь разбавляли водой (10 мл) и экстрагировали ДХМ (2×20 мл). Органические слои объединяли, сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Проведение очистки с помощью флэш-хроматографии (2-40% EtOAc в гексанах) привело к получению продукта в виде белого твердого вещества (63 мг, 0,17 ммоль, 48%). 1H ЯМР (400 МГц, хлороформ-d) δ 6,93 (d, J=2,1 Гц, 1H), 6,76 (s, 1H), 6,67 (d, J=8,1 Гц, 1H), 6,62 (s, 2H), 6,54 (dd, J=8,2, 2,2 Гц, 1H), 5,94 (s, 1H), 4,48 (s, 2H), 3,92 (s, 2H), 3,23 (гепт., J=6,9 Гц, 1H), 2,82 (tq, J=7,2, 3,7 Гц, 1H), 2,23 (s, 6H), 1,23 (d, J=6,9 Гц, 6H), 0,95-0,80 (m, 2H), 0,71-0,56 (m, 2H).
Пример 27. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N,N-диметилацетамид
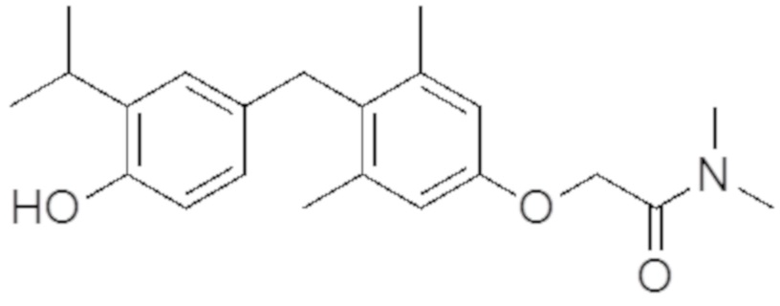
[0179] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 300 мг, 0,72 ммоль, 2 экв.) обрабатывали сухим ТГФ (5 мл) и CDI (140 мг, 0,86 ммоль, 2,4 экв.) с последующим нагреванием до температуры 45°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и растворяли в ТГФ (5 мл). Половину реакционной смеси переносили на следующую стадию (0,36 ммоль, 1 экв.) и обрабатывали ТГФ (2,5 мл). После этого к раствору добавляли диметиламин гидрохлорид (88 мг, 1,075 ммоль, 3 экв.) и перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли диэтиловым эфиром (20 мл) и промывали 0,5 н. HCl (2×20 мл), а затем насыщенным солевым раствором (20 мл). Органический слой сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Неочищенное промежуточное соединение растворяли в ДХМ (3 мл) и помещали в атмосферу аргона. Добавляли пентаметилбензол (106 мг, 0,72 ммоль, 2 экв.) и реакционную смесь охлаждали до температуры -78 oC. Медленно добавляли раствор BCl3 (1 М ДХМ, 0,72 мл, 2 экв.) и указанную реакционную смесь перемешивали в течение 15 минут. Реакцию гасили добавлением насыщенного раствора NaHCO3 (2 мл) и колбу оставляли нагреваться до комнатной температуры. Указанную реакционную смесь разбавляли водой (10 мл) и экстрагировали ДХМ (2×20 мл). Органические слои объединяли, сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Проведение очистки с помощью флэш-хроматографии (2-40% EtOAc в гексанах) привело к получению продукта в виде белого твердого вещества (38 мг, 0,11 ммоль, 30%). 1H ЯМР (400 МГц, хлороформ-d) δ 6,95 (d, J=2,1 Гц, 1H), 6,65 (d, J=9,9 Гц, 3H), 6,53 (dd, J=8,2, 2,2 Гц, 1H), 5,58 (s, 1H), 4,68 (s, 2H), 3,90 (s, 2H), 3,21 (h, J=6,9 Гц, 1H), 3,13 (s, 3H), 3,02 (s, 3H), 2,20 (s, 6H), 1,23 (d, J=6,8 Гц, 6H).
Пример 28. N-этил-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамид
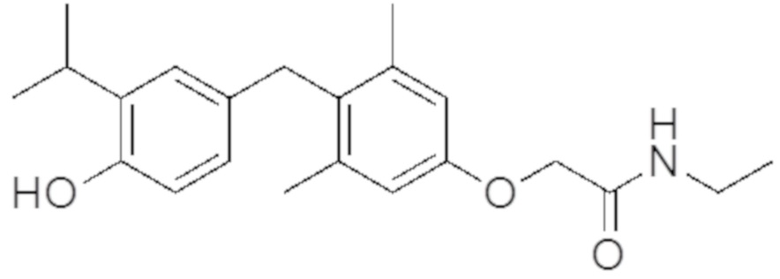
[0180] GC-1 (100 мг, 0,304 ммоль, 1 экв.) обрабатывали МеОН (3 мл) в герметичной пробирке. Добавляли серную кислоту (1 капля), реакцию герметизировали и затем нагревали до температуры 65°C в течение 1 часа при перемешивании. Реакцию оставляли нагреваться до комнатной температуры. Анализ ТСХ (1:30 MeOH:ДХМ) показал полное превращение в промежуточное соединение метиловый эфир. К реакционной смеси промежуточного соединения добавляли этиламин (33% в воде, 0,25 мл, 1,84 ммоль, 6 экв.). Реакцию повторно герметизировали и снова нагревали до температуры 65°C в течение 1 часа. Реакционную колбу выдерживали до достижения комнатной температуры, добавляли 0,5 н. NaOH (20 мл) в делительной воронке и затем экстрагировали ДХМ (3×100 мл). Органические слои объединяли, сушили над Na2SO4 и концентрировали. Проведение очистки с помощью флэш-хроматографии (0-6% МеОН в ДХМ) привело к получению продукта в виде твердого вещества белого цвета (82 мг, 0,23 ммоль, 76%). 1H ЯМР (400 МГц, хлороформ-d) δ 6,94 (d, J=2,2 Гц, 1H), 6,72-6,61 (m, 4H), 6,55 (dd, J=8,1, 2,2 Гц, 1H), 5,77 (d, J=17,7 Гц, 1H), 4,50 (s, 2H), 3,92 (s, 2H), 3,43 (qd, J=7,3, 5,8 Гц, 2H), 3,22 (гепт., J=6,8 Гц, 1H), 2,24 (s, 6H), 1,32-1,15 (m, 9H).
Пример 29. N-(цианометил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамид (соединение 27)

[0181] 2-[4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусную кислоту (200 мг, 0,48 ммоль) растворяли в 10 мл сухого ДМФ в круглодонной колбе, высушенной пламенем. Добавляли 1,1'-карбонилдиимидазол (85 мг, 0,52 ммоль, 1, 1 экв.) и перемешивали при температуре 45°C в течение 3 часов. Реакцию контролировали с помощью ТСХ, и, когда наблюдали полное превращение в ацилимидазолид, смесь концентрировали досуха в вакууме с удалением всего CO2. Затем смесь растворяли в сухом ТГФ (8 мл) и добавляли аминоацетонитрила гидрохлорид (133 мг, 1,44 ммоль, 3 экв.) одной порцией. Реакционную смесь перемешивали при температуре 45°С в течение ночи. Из реакционной смеси выпало в осадок белое твердое вещество. Смесь охлаждали и ТГФ удаляли в вакууме. Твердое вещество растворяли в этилацетате (25 мл) и реакционную смесь последовательно промывали 0,5 н. HCl (2×5 мл) и насыщенным раствором NaCl (1×10 мл). Затем смесь сушили на безводном MgSO4 и растворитель удаляли в вакууме. Полученная смесь затвердела при хранении в холодильнике, затем ее промыли гексаном, и ЯМР показал чистоту более 90%. 1H ЯМР (400 МГц, метанол-d4) δ 7,50-7,27 (m, 5H), 6,94 (d, J=2,3 Гц, 1H), 6,85 (d, J=8,3 Гц, 1H), 6,74 (s, 2H), 6,69 (dd, J=8,4, 2,3 Гц, 1H), 5,06 (s, 2H), 4,59 (s, 1H), 4,27 (s, 2H), 3,96 (s, 2H), 2,31 (s, 1H), 2,24 (s, 6H), 1,18 (dd, J=6,9, 1,5 Гц, 6H), 0,95 (d, J=6,7 Гц, 1H).
[0182] Бензилзащищенную группу отщепляли при помощи BCl3. Ацетамид (175 мг, 0,38 ммоль) растворяли в сухом дихлорметане (10 мл) и добавляли к нему пентаметилбензол (113 мг, 0,76 ммоль). Затем раствор охлаждали до температуры -78°C при помощи бани с сухим льдом/ацетоном, и к нему очень медленно добавляли 1 М раствор BCl3 в дихлорметане (789 мкл, 89 мг, 0,76 ммоль). ТСХ показала значительное превращение в продукт за 25 минут перемешивания при температуре -78°C. Затем добавляли насыщенный раствор бикарбоната натрия (5 мл) при температуре -78°C. Смесь подогревали до комнатной температуры. Затем к смеси добавляли дихлорметан (25 мл) и воду (5 мл) и собирали органический слой. Водный слой экстрагировали дихлорметаном (2×10 мл) и объединенный органический слой сушили над безводным сульфатом магния. Неочищенный продукт очищали флэш-хроматографией Biotage, элюируя 10-50% этилацетатом в гексане с получением конечного ацетамида (85 мг, 0,23 ммоль, выход 60%, чистота 99,6% по ВЭЖХ). 1H ЯМР (400 МГц, метанол-d4) δ 6,83 (d, J=2,2 Гц, 1H), 6,72 (s, 2H), 6,62-6,49 (m, 2H), 4,57 (d, J=1,6 Гц, 2H), 4,25 (d, J= 1,6 Гц, 2H), 3,90 (s, 2H), 3,21 (гепт., 1H), 2,22 (d, J=1,5 Гц, 6H), 1,14 (dd, J=7,0, 1,7 Гц, 6H).
Пример 30. N-(3-фторфенил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамид (соединение 28)
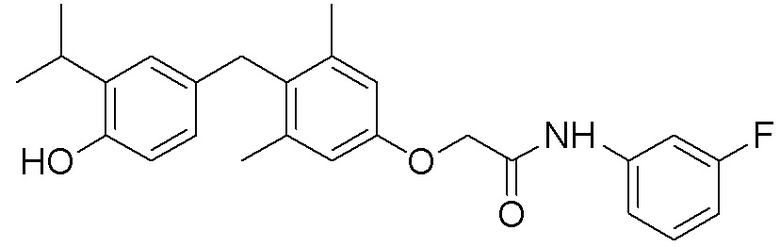
[0183] 2-[4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусную кислоту (200 мг, 0,48 ммоль) растворяли в 10 мл сухого ДМФ в круглодонной колбе. Добавляли 1,1'-карбонилдиимидазол (78 мг, 0,48 ммоль) и перемешивали при температуре 45°C в течение 3 часов. Реакцию контролировали с помощью ТСХ, и, когда наблюдали полное превращение в ацилимидазолеид, смесь концентрировали досуха в вакууме с удалением всего CO2. Затем реакцию растворяли в сухом ТГФ (8 мл) и по каплям добавляли раствор 3-фторанилина (144,4 мг, 1,44 ммоль, 1,33 экв.) в 2 мл сухого ТГФ. Затем реакционную смесь перемешивали при температуре 45°С в течение ночи. Реакционную смесь охлаждали и растворитель удаляли в вакууме. К смеси добавляли этилацетат (25 мл) и указанную реакционную смесь последовательно промывали 0,5 н. HCl (2×5 мл) и насыщенным раствором NaCl (1×10 мл). Затем смесь сушили на безводном MgSO4 и растворитель удаляли в вакууме. Неочищенный продукт очищали флэш-хроматографией Biotage, элюируя 10-40% этилацетатом в гексане. 1H ЯМР (400 МГц, хлороформ-d) δ 8,34 (s, 1 H), 7,56 (dt, J=10,7, 2,3 Гц, 1 H), 7,44-7,18 (m, 7H), 6,95 (d, J=2,3 Гц, 1 H), 6,84 (tdd, J=8,2, 2,5, 1,1 Гц, 1 H), 6,73 (d, J=8,4 Гц, 1 H), 6,68 (s, 2H), 6,60 (dd, J=8,4, 2,3 Гц, 1 H), 5,00 (s, 2H), 4,59 (s, 2H), 3,92 (s, 2H), 3,34 (гепт., J=6,9 Гц, 1 H), 2,23 (s, 6H), 1, 18 (d, J=6,9 Гц, 6H).
[0184] Ацетамид (200 мг, 0,39 ммоль) растворяли в сухом дихлорметане (10 мл) и добавляли к нему пентаметилбензол (116 мг, 0,78 ммоль). Затем раствор охлаждали до температуры -78°C при помощи бани с сухим льдом/ацетоном, и к нему очень медленно добавляли 1 М раствор BCl3 в дихлорметане (777 мкл, 91 мг, 0,78 ммоль). ТСХ показала полное превращение в продукт за 15 минут перемешивания при температуре -78°C. Затем добавляли насыщенный раствор бикарбоната натрия (5 мл) при температуре -78°C. Указанную реакционную смесь подогревали до комнатной температуры. Затем к смеси добавляли дихлорметан (25 мл) и воду (5 мл) и собирали органический слой. Водный слой экстрагировали дихлорметаном (2×10 мл) и объединенный органический слой сушили над безводным сульфатом магния. Неочищенный продукт очищали флэш-хроматографией Biotage, элюируя 10-50% этилацетатом в гексане с получением конечного ацетамида (150 мг, 0,35 ммоль, выход 91%, чистота 96,8% по ВЭЖХ). 1H ЯМР (400 МГц, хлороформ-d) δ 8,34 (s, 1 H), 7,34-7,17 (m, 2H), 6,92-6,79 (m, 2H), 6,68 (s, 2H), 6,61-6,49 (m, 2H), 4,58 (s, 3H), 3,90 (s, 2H), 3,13 (гепт., J=6,8 Гц, 1H), 1,19 (d, J=6,9 Гц, 6H).
Пример 31. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(оксетан-3-ил)ацетамид (соединение 29)

[0185] 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусную кислоту (бензилированный GC-1, 200 мг, 0,48 ммоль) растворяли в 6 мл сухого ТГФ. К этому раствору карбоновой кислоты добавляли 1,1'-карбонилдиимидазол (93 мг, 0,57 ммоль) в атмосфере аргона и этот раствор перемешивали в течение 2 часов при температуре 50°C. Затем добавляли оксетан-3-амин (30 мг, 0,43 ммоль) в 3 мл ТГФ и указанную реакционную смесь нагревали с обратным холодильником в течение 2 часов. Затем реакционную смесь упаривали в вакууме досуха, растворяли в 10 мл ДХМ и промывали 2×5 мл 1 н. HCl и 2×5 мл насыщенным солевым раствором. Полученный органический слой сушили над MgSO4, фильтровали и концентрировали с получением неочищенного промежуточного продукта (196 мг, 86%). Неочищенный продукт был достаточно чистым по 1H ЯМР для того, чтобы использовать его без дополнительной очистки.
[0186] Бензилированное промежуточное соединение 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)-N-(оксетан-3-ил)ацетамид (196 мг, 0,41 ммоль) растворяли в 5 мл сухого метанола с 1 мл ТГФ и добавляли 10% Pd/C (100 мг) для получения суспензии. Реакционную смесь выдерживали в вакууме в течение приблизительно 1 минуты, затем помещали под аргон в течение приблизительно 1 минуты. Этот процесс повторяли три раза, чтобы гарантировать, что смесь была должным образом дегазирована. Затем к суспензии по каплям добавляли триэтилсилан (1 мл, 6,3 ммоль) и реакционную смесь перемешивали в течение 4 часов при комнатной температуре. Фильтрование через слой целита с метанолом, концентрирование в вакууме и очистка флэш-хроматографией (диоксид кремния, 10% МеОН в ДХМ) позволяли получить желаемый продукт в виде белого твердого вещества (121 мг, выход 77%). 1H ЯМР (400 МГц, CDCl3): 7,14 (d, J=8,0 Гц, 1 H), 6,92 (s, 1 H), 6,65 (s, 2 H), 6,60 (d, 1 H, J=8,2 Гц), 6,54 (dd, 1 H, J=8,1, 2,2 Гц), 5,18 (секст., 1 H, J=7,6 Гц), 4,97 (t, 2 H, J=7,2 Гц), 4,68 (s, 0 H), 4,57 (t, 2 H, J=7,0 Гц), 4,49 (s, 2 H), 3,91 (s, 2 H), 3,15 (септ., 1 H, J=6,9 Гц), 2,23 (s, 6 H), 1,21 (d, 6 H, J=6,9 Гц).
Пример 32. 2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(4-нитрофенил)ацетамид (соединение 30)

[0187] Перемешиваемый раствор 2-(4-(4-(бензилокси)-3-изопропилбензил)-3,5-диметилфенокси)уксусной кислоты (O-бензил GC1, 150 мг, 0,36 ммоль, 1 экв.) обрабатывали сухим ТГФ (5 мл) и CDI (140 мг, 0,86 ммоль, 2,4 экв.) с последующим нагреванием до температуры 45°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и растворяли в ТГФ (2,5 мл). Реакционный раствор обрабатывали 4-нитроанилином (150 мг, 1,075 ммоль, 3 экв.) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор разбавляли диэтиловым эфиром (20 мл) и промывали 0,5 н. HCl (2×20 мл), а затем насыщенным солевым раствором (20 мл). Органический слой сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Неочищенное промежуточное соединение очищали флэш-хроматографией (0-40% EtOAc в гексанах), чтобы обеспечить удаление избытка 4-нитроанилина. Очищенное промежуточное соединение растворяли в ДХМ (3 мл) и помещали в атмосферу аргона. Добавляли пентаметилбензол (106 мг, 0,72 ммоль, 2 экв.) и реакционную смесь охлаждали до температуры -78°C. Медленно добавляли раствор BCl3 (1 М ДХМ, 0,72 мл, 2 экв.) и указанную реакционную смесь перемешивали в течение 15 минут. Реакцию гасили добавлением насыщенного раствора NaHCO3 (2 мл) и колбу оставляли нагреваться до комнатной температуры. Указанную реакционную смесь разбавляли водой (10 мл) и экстрагировали ДХМ (2×20 мл). Органические слои объединяли, сушили при помощи Na2SO4 и концентрировали при пониженном давлении. Проведение очистки с помощью флэш-хроматографии (7-60% EtOAc в гексанах) привело к получению продукта в виде твердого вещества светло-желтого цвета (22 мг, 0,05 ммоль, 14%). 1H ЯМР (400 МГц, хлороформ-d) δ 8,30-8,21 (m, 2H), 7,87-7,78 (m, 2H), 6,90 (d, J=2,2 Гц, 1H), 6,71 (s, 2H), 6,66-6,49 (m, 2H), 4,64 (s, 2H), 3,91 (s, 2H), 3,20 (p, J=6,9 Гц, 1H), 2,25 (s, 6H), 1,28-1,16 (m, 6H).
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕНИЛЬНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИММУНОМОДУЛЯТОРОВ | 2007 |
|
RU2442780C2 |
| ПРОИЗВОДНЫЕ СОБЕТИРОМА | 2017 |
|
RU2776372C2 |
| ЗАМЕЩЕННЫЕ N-ФЕНИЛБИПИРРОЛИДИНКАРБОКСАМИДЫ И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕБНЫХ ЦЕЛЯХ | 2008 |
|
RU2477720C2 |
| БОРСОДЕРЖАЩИЕ ДИАЦИЛГИДРАЗИНЫ | 2014 |
|
RU2637946C2 |
| ИНГИБИТОРЫ RAD51 | 2018 |
|
RU2795882C2 |
| ИМИДАЗОПИРИМИДИНЫ КАК ИНГИБИТОРЫ EED И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2836176C2 |
| НОВЫЕ ИНГИБИТОРЫ МЕПРИНА АЛЬФА И БЕТА | 2017 |
|
RU2746850C2 |
| МОДУЛЯТОРЫ ИНТЕГРИРОВАННОГО СИГНАЛЬНОГО ПУТИ СТРЕССА | 2017 |
|
RU2769327C2 |
| ИНГИБИТОРЫ ТРАНСГЛУТАМИНАЗЫ 2 (TG2) | 2019 |
|
RU2781370C2 |
| СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ПОВЫШЕНИЯ АКТИВНОСТИ CFTR | 2015 |
|
RU2767460C2 |


Изобретение относится к соединению формулы III или его фармацевтически приемлемой соли, которые могут найти применение для лечения нейродегенеративных заболеваний. В формуле III R4 выбран из H и C1-6 алкила и R3 представляет собой: (а) Н, ОН, NH2, С2-6 алкенил, С2-6 алкинил, С3-6 циклоалкил или 3-6-членное гетероциклильное кольцо, содержащее один гетероатом, выбранный из О; или (b) C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -SO2H, -SO2(C1-6 алкил), CN или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН; или (c) -О-C1-6 алкил; или (d) фенильную группу, необязательно замещенную 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена. Предлагаемые соединения обладают улучшенным проникновением через гематоэнцефалический барьер. Изобретение относится также к конкретным соединениям и фармацевтической композиции, содержащей указанные соединения. 3 н. и 22 з.п. ф-лы, 2 ил., 1 табл., 32 пр.

формула III
1. Соединение формулы III

формула III
или его фармацевтически приемлемая соль,
где R4 выбран из H и C1-6 алкила и
R3 представляет собой:
(а) Н, ОН, NH2, С2-6 алкенил, С2-6 алкинил, С3-6 циклоалкил или 3-6-членное гетероциклильное кольцо, содержащее один гетероатом, выбранный из О; или
(b) C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из ОН, галогена, NH2, -SO2H, -SO2(C1-6 алкил), CN или фенильной группы, необязательно замещенной 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН; или
(c) -О-C1-6 алкил; или
(d) фенильную группу, необязательно замещенную 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и галогена.
2. Соединение по п. 1, отличающееся тем, что указанное соединение имеет формулу IV
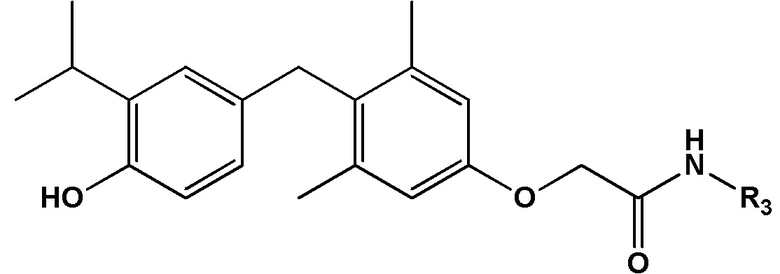
формула IV,
или его фармацевтически приемлемая соль.
3. Соединение по п. 1 или 2 или его фармацевтически приемлемая соль, где R3 представляет собой:
(а) Н, ОН, NH2, С2-3 алкенил, С2-3 алкинил, С3-6 циклоалкил, 3-6-членное гетероциклильное кольцо, содержащее один гетероатом, выбранный из О.
4. Соединение по п. 1 или 2 или его фармацевтически приемлемая соль, где R3 представляет собой фенильную группу, необязательно замещенную 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, NO2 и F.
5. Соединение по п. 1 или 2, отличающееся тем, что указанное соединение имеет формулу IV
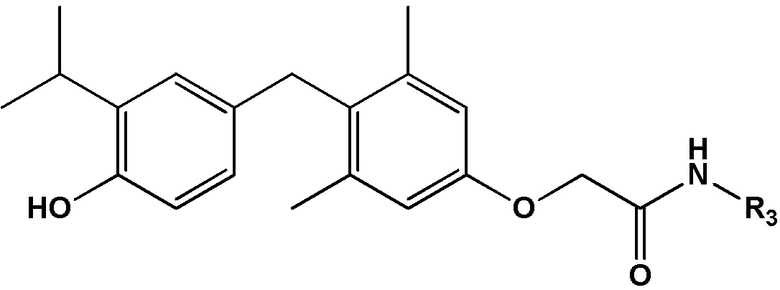
формула IV,
или его фармацевтически приемлемая соль,
где R3 представляет собой -(CH2)n1-фенил, где n1 представляет собой целое число, выбранное из 1, 2, 3 или 4, и указанное фенильное кольцо необязательно замещено 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН.
6. Соединение по п. 1 или 2, отличающееся тем, что указанное соединение имеет формулу IV
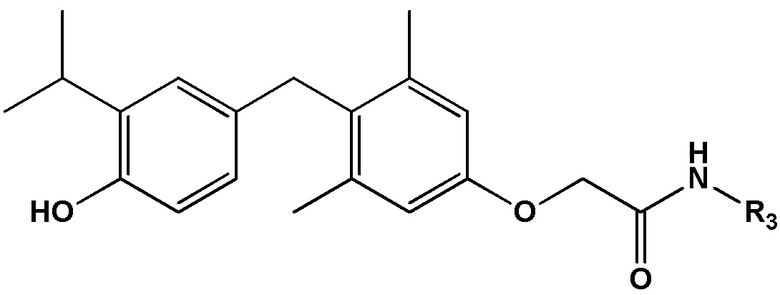
формула IV,
или его фармацевтически приемлемая соль,
где R3 представляет собой -(CH2)n2-фенил, где n2 представляет собой целое число, выбранное из 1 или 2, и указанное фенильное кольцо необязательно замещено 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН.
7. Соединение по п. 1 или 2, отличающееся тем, что указанное соединение имеет формулу IV

формула IV,
или его фармацевтически приемлемая соль,
где R3 представляет собой -(CH2)-фенил, где указанное фенильное кольцо необязательно замещено 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН.
8. Соединение по любому из пп. 1, 2, 4 и 7, отличающееся тем, что указанное соединение имеет формулу IV
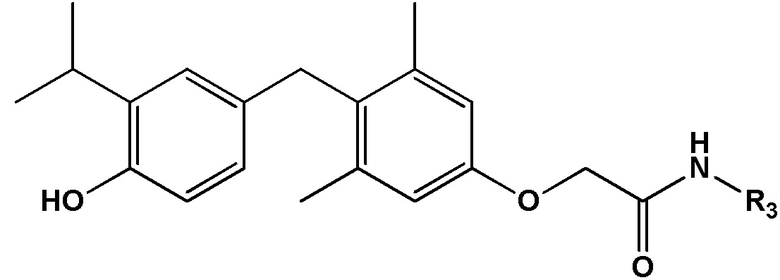
формула IV,
или его фармацевтически приемлемая соль,
где R3 представляет собой С1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, F, NH2, -SO2H, -SO2(СН3) и CN.
9. Соединение по п. 1 или 2, отличающееся тем, что указанное соединение имеет формулу IV

формула IV,
или его фармацевтически приемлемая соль,
где R3 представляет собой С1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, F, NH2, -SO2H, -SO2(СН3) и CN.
10. Соединение по п. 1 или 2, отличающееся тем, что указанное соединение имеет формулу IV

формула IV,
или его фармацевтически приемлемая соль,
где R3 представляет собой С1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из ОН, F, NH2, CN, -SO2H и -SO2(C1-6 алкил).
11. Соединение по п. 1 или 2, отличающееся тем, что указанное соединение имеет формулу IV
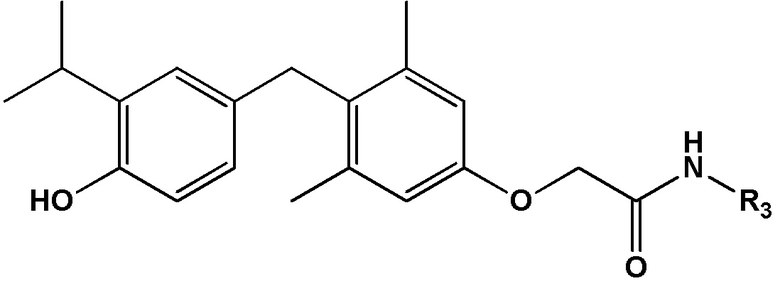
формула IV,
или его фармацевтически приемлемая соль,
где R3 представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями OH.
12. Соединение по п. 1 или 2, отличающееся тем, что указанное соединение имеет формулу IV
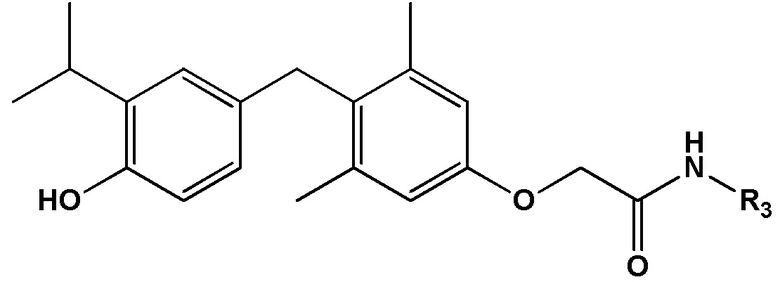
формула IV,
или его фармацевтически приемлемая соль,
где R3 представляет собой C1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями OH.
13. Соединение по п. 1 или 2, отличающееся тем, что указанное соединение имеет формулу IV
формула IV,
или его фармацевтически приемлемая соль,
где R3 представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями F.
14. Соединение по п. 1 или 2, отличающееся тем, что указанное соединение имеет формулу IV
формула IV,
или его фармацевтически приемлемая соль,
где R3 представляет собой C1-4 алкил, необязательно замещенный 1, 2 или 3 заместителями F.
15. Соединение по п. 1 или 2, отличающееся тем, что указанное соединение имеет формулу IV
формула IV,
или его фармацевтически приемлемая соль,
при этом R3 представляет собой -О-С1-6 алкил.
16. Соединение по п. 1 или 2, отличающееся тем, что указанное соединение имеет формулу IV
формула IV,
или его фармацевтически приемлемая соль,
при этом R3 представляет собой -О-С1-4 алкил.
17. Соединение, выбранное из группы, состоящей из
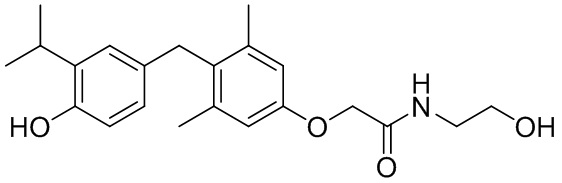 ,
, 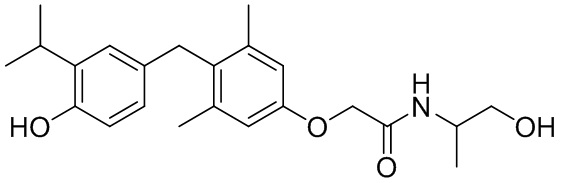 ,
,  ,
, 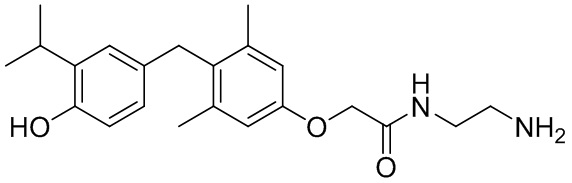 ,
,  ,
, 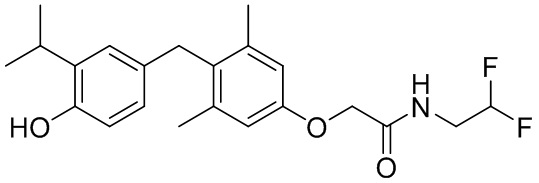 ,
, 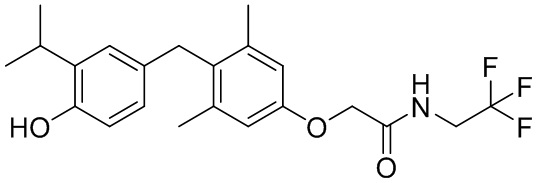 ,
, 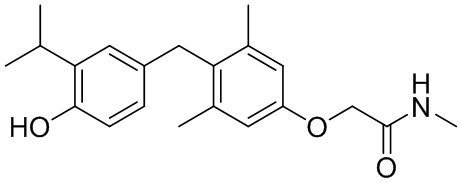 ,
,  ,
,  ,
, 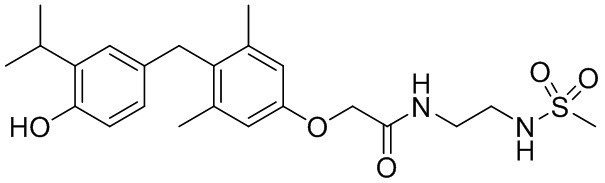 ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 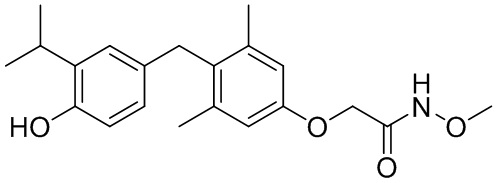 ,
,  ,
, 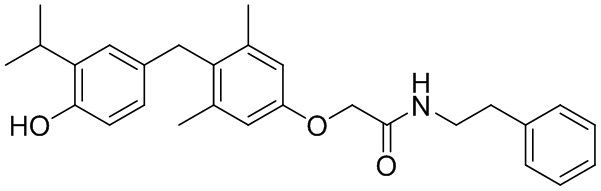 ,
, 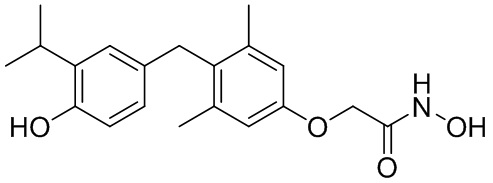 ,
, 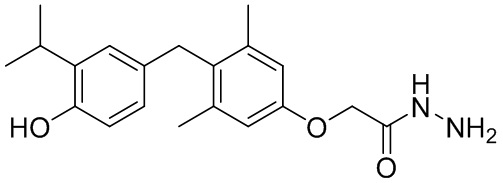 ,
, 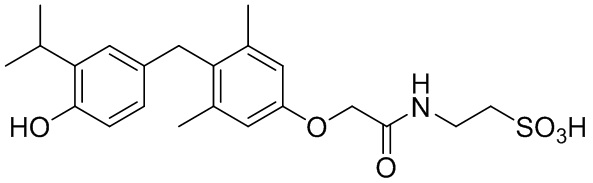 ,
, 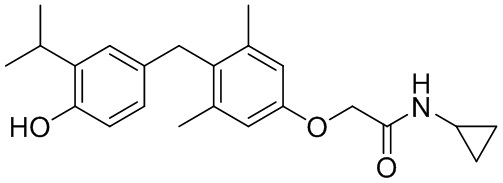 ,
, 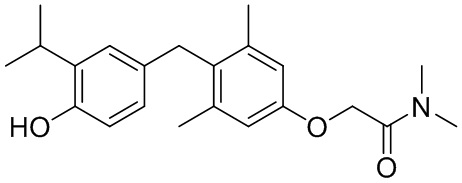 ,
, 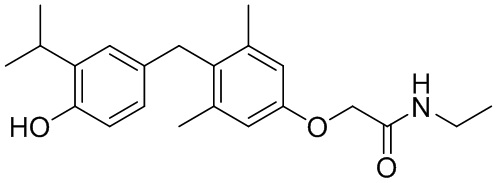 ,
, 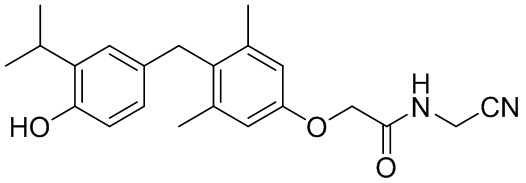 ,
,  ,
, 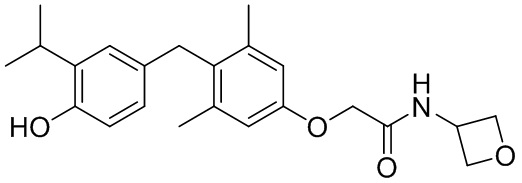 и
и 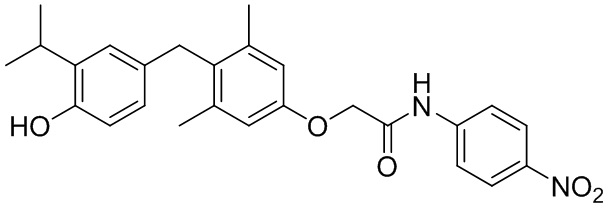
или фармацевтически приемлемых солей указанных соединений.
18. Соединение по п. 1, отличающееся тем, что указанное соединение выбрано из группы, состоящей из
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2-гидроксиэтил)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(1-гидроксипропан-2-ил)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2-гидроксипропил)ацетамида;
2-(2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамидо)этан-1-аминийацетата;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
N-(2,2-дифторэтил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2,2,2-трифторэтил)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-метилацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(2-гидроксифенил)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил))-N-(3-гидроксифенил)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-((2-метилсульфонамидо)этил)ацетамида;
N-(1,3-дигидроксипропан-2-ил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-пропилацетамида;
N-(2-фторэтил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
N-аллил-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(проп-2-ин-1-ил)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-метоксиацетамида;
N-(3,4-дигидроксифенэтил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-фенэтилацетамида;
N-гидрокси-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетогидразида;
2-(2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамидо)этан-1-сульфоната;
N-циклопропил-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N,N-диметилацетамида;
N-этил-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
N-(цианометил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
N-(3-фторфенил)-2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)ацетамида;
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(оксетан-3-ил)ацетамида и
2-(4-(4-гидрокси-3-изопропилбензил)-3,5-диметилфенокси)-N-(4-нитрофенил)ацетамида или фармацевтически приемлемых солей указанных соединений.
19. Фармацевтическая композиция для лечения нейродегенеративного заболевания, содержащая фармацевтически эффективное количество соединения по любому из пп. 1-18 или его фармацевтически приемлемой соли и один или более фармацевтически приемлемых носителей.
20. Соединение или его фармацевтически приемлемая соль по любому из пп. 1-18 или фармацевтическая композиция по п. 19 для применения для лечения нейродегенеративного заболевания.
21. Соединение или его фармацевтически приемлемая соль или фармацевтическая композиция для применения по п. 20, отличающиеся тем, что указанное нейродегенеративное заболевание представляет собой демиелинизирующее заболевание.
22. Соединение или его фармацевтически приемлемая соль или фармацевтическая композиция для применения по п. 20 или 21, отличающиеся тем, что указанное нейродегенеративное заболевание представляет собой адренолейкодистрофию, сцепленную с Х-хромосомой, или рассеянный склероз.
23. Соединение или его фармацевтически приемлемая соль или фармацевтическая композиция для применения по п. 20, отличающиеся тем, что указанное нейродегенеративное заболевание выбрано из группы, состоящей из острого рассеянного энцефаломиелита, острого геморрагического лейкоэнцефалита, болезни Рефсума у взрослых, болезни Александера, болезни Альцгеймера, концентрического склероза Бало, болезни Канавана, центрального понтинного миелинолиза, церебрального паралича, церебротендинального ксантоматоза, хронической воспалительной демиелинизирующей полинейропатии, синдрома Девика, диффузного миелинокластического склероза, синдрома Гийена-Барре, идиопатического воспалительного демиелинизирующего заболевания, болезни Рефсума у детей, болезни Краббе, наследственной оптической нейропатии Лебера, болезни Марбурга, болезни Маркиафавы-Биньями, метахроматической лейкодистрофии, мультифокальной двигательной нейропатии, парапротеинемической демиелинизирующей полинейропатии, болезни Пелицеуса-Мерцбахера, перонеальной мышечной атрофии, прогрессирующей мультифокальной лейкоэнцефалопатии, поперечного миелита, тропического спастического парапареза, болезни Ван-дер-Кнаапа, адренолейкодистрофии, сцепленной с Х-хромосомой, и синдрома Цельвегера.
24. Соединение или его фармацевтически приемлемая соль по любому из пп. 1-18 или фармацевтическая композиция по п. 19 для применения для лечения болезни Альцгеймера.
25. Соединение или его фармацевтически приемлемая соль по любому из пп. 1-18 или фармацевтическая композиция по п. 19 для применения для лечения заболевания или состояния, выбранного из группы, состоящей из острого рассеянного энцефаломиелита (ОРЭМ), острого геморрагического лейкоэнцефалита (AHL или AHLE), болезни Рефсума у взрослых, болезни Рефсума у детей, болезни Александера, болезни Альцгеймера, концентрического склероза Бало, болезни Канавана, центрального понтинного миелинолиза (CPM), церебрального паралича, церебротендинального ксантоматоза, хронической воспалительной демиелинизирующей полинейропатии (CIDP), синдрома Девика, диффузного миелинокластического склероза, энцефаломиелита, синдрома Гийена-Барре, идиопатического воспалительного демиелинизирующего заболевания (ИВДЗ), болезни Краббе, наследственной оптической нейропатии Лебера, лейкодистрофии, болезни Марбурга, болезни Маркиафавы-Биньями, метахроматической лейкодистрофии (MLD), мультифокальной двигательной нейропатии (MMN), рассеянного склероза (РС), парапротеинемической демиелинизирующей полинейропатии, болезни Пелицеуса-Мерцбахера (БПМ), прогрессирующей мультифокальной лейкоэнцефалопатии (PML), тропического спастического парапареза (TSP), адренолейкодистрофии, сцепленной с Х-хромосомой (X-ALD, ALD или X-сцепленной ALD), и синдрома Цельвегера.
| WO 00/39077 А2, 06.07.2000 | |||
| A | |||
| T | |||
| PLACZEK ET AL., New synthetic routes to thyroid hormone analogs: d6-sobetirome, 3H-sobetirome, and the antagonist NH-3, TETRAHEDRON, 2015, vol | |||
| Контрольный стрелочный замок | 1920 |
|
SU71A1 |
| Скоропечатный станок для печатания со стеклянных пластинок | 1922 |
|
SU35A1 |
| Гидравлическая трубка двойного действия с перемещением жидкости внутри трубки | 1926 |
|
SU5946A1 |
| RU 2007148927 A, 10.07.2009 | |||
| ZAMAN ASHRAF ET AL., Synthesis, characterization and in vitro hydrolysis studies | |||
Авторы
Даты
2021-11-18—Публикация
2017-08-14—Подача