Настоящее изобретение относится к области биотехнологии и, в частности, к генетической инженерии и может быть использовано в медицинских исследованиях для получения фактора роста тромбоцитов ВВ человека.
Фактор роста тромбоцитов (ФРТ) является основным фактором, способствующим делению и росту клеток фибробластов и гладкой мускулатуры. Несмотря на то, что на сегодняшний день не имеется четкого представления о молекулярных механизмах действия данного регуляторного белка, известно, что ФРТ ведет к повышению уровня биосинтеза специфических белков и обладает митогенным эффектом. Кроме того, при механическом повреждении клеток сосудистого эндотелия, они способны выделять в окружающую среду ФРТ, что приводит к закрытию повреждения в сосудистой стенке и остановке кровотечения. Фактор роста тромбоцитов, даже в концентрации 1÷2 нг/мл, индуцирует направленное перемещение клеток иммунной системы, таких как лейкоциты, гранулоциты, макрофаги, способствуя возникновению защитного иммунного ответа. ФРТ ответственен за активацию клеток соединительной ткани, ответственных за образование рубца и синтез коллагенов. По последним данным установлено, что ФРТ косвенно влияет на образование капилляров и клеток сосудов.
Фактор роста тромбоцитов PDGF-BB является уникальным регуляторным белком, проявляющим высокую биологическую активность в отношении регенерации клеток. Именно по этой причине, к нему проявляется интерес на биофармацевтическом рынке. На сегодняшний день существует единственный препарат рекомбинантного фактора роста тромбоцитов, выпускающегося под торговой маркой «Regranex». Основным показанием к применению данного препарата являются трофические язвы и поражения кожных покровов, возникающие в результате осложнений сахарного диабета. Поэтому существует острая потребность в разработке более эффективной, отечественной технологии получения фактора роста тромбоцитов при помощи методов молекулярного клонирования и гетерологичных систем экспрессии генов.
Использование бактериальной системы экспрессии Е. coli позволяет получить высокие количества фактора роста, однако, сложная пространственная структура белка, с образованием активной димерной формы через экстрамолекулярную дисульфидную связь является причиной агрегации гетерологичного белка и накопления преимущественно в тельцах включения; длительность, трудоемкость и дороговизна методов - характерная черта экспрессии при использовании клеточных линий млекопитающих. Клетки дрожжей, в частности P. pastoris, сочетают в себе преимущества данных систем. Эти низшие эукариоты обладают развитой системой ЭПР для осуществления разнообразных посттрансляционных модификаций протеинов, а также просты и удобны в культивировании. Следует отметить тот факт, что биосинтез рекомбинантного фермента осуществляется в виде зрелого белка, который секретируется в культуральную жидкость.
Аналогом-прототипом получаемого рекомбинантного белка является бекаплермин, являющийся активным компонентом препарата «Regranex». В данном случае, фактор роста тромбоцитов ВВ получают при помощи дрожжевой системы экспрессии на основе S. cerevisiae [патенты US 4766073, опубл. 23.08.1988, C12N 15/67, A61K 38/00, C12N 15/78, A61K 35/16 и US 4845075, опубл. 04.08.1989, A61K 38/00, C07K 14/49, C12N 15/81, A61K 35/16, C12N 15/62, C07K 14/15, C12N 15/18]. На наш взгляд, по системе экспрессии на основе клеток метилотрофных дрожжей P. pastoris, которые способны к производству большего количества белков, по получению фактора роста тромбоцитов в клетках P. pastoris на сегодняшний день имеется 3 работы. В первой был получен фактор роста тромбоцитов А, который не имеет высокой терапевтической актуальности [Н. Li, et al. High level expression, efficient purification and bioactivity assay of recombinant human platelet-derived growth factor AA dimer (PDGF-AA) from methylotrophic yeast Pichia pastoris, 2013]. В данной работе была получена рекомбинантная плазмидная ДНК содержала ген искусственного предшественника PDGF-AA человека, который состоит из последовательности, кодирующей сигнальный пептид α-фактора Saccharomyces сеге-visiae, кДНК гена PDGFA, под контролем индуцибельного промотора АОХ1. Продуцент был получен путем электропорации экспрессионного вектора в штамм GS115 и при последующей «зеоциновой» селекции. Биосинтез рекомбинантного белка осуществляли при культивировании клеток на среде BMMY, содержащей 1% (v/v) метанола. Культивирование проводили в течение 120 часов, целевой продукт секретируется в культуральную жидкость. Анализ уровня экспрессии белка проводили при помощи ПААГ-электрофо-реза в неденатурирующих условиях.
Второй работой является патент «Штамм дрожжей Pichia pastoris 2-2-продуцент тромбоцитоврного фактора роста человека (pdgf-bb) и способ получения тромбоцитоврного фактора роста человека» [RU 2290434, опубл. 27.12.2006, С12Р 21/02, C12N 15/12, C12N 1/19]. Однако в данном патенте описан способ получения ФРТ с дополнительной синтетической последовательностью, способствующей димеризации, и последовательностью, содержащей 6 остатков гистидина. Следовательно, данный белок не является биоаналогом ФРТ. К тому же при конструировании экспрессионного вектора используется промотор глицеральдегид-3-фосфат гидрогеназы, который является недостаточно сильным.
Наиболее близким к заявляемому техническому решению (прототипом) является способ, описанный в работе [М. Dai et al, Identification and Functional Characterization of Glycosylation of Recombinant Human Platelet-Derived Growth Factor-BB in Pichia pastoris, 2015]. В данной работе была получена рекомбинантная плазмидная ДНК содержала ген искусственного предшественника PDGF-BB человека, который состоит из последовательности, кодирующей сигнальный пептид α-фактора Saccharomyces cerevisiae, кДНК гена PDGFB, под контролем индуцибельного промотора АОХ1. Продуцент был получен путем электропорации экспрессионного вектора в штамм GS115 и при последующей «зеоциновой» селекции. Биосинтез рекомбинантного белка осуществляли при культивировании клеток на среде BMMY, содержащей 0,5% (v/v) метанола. Культивирование проводили в течение 72 часов, целевой продукт секретируется в культуральную жидкость. Анализ уровня экспрессии белка проводили при помощи ПААГ-электрофореза в неденатурирующих условиях. Недостатком способа-прототипа является относительно низкий уровень синтеза и секреции рекомбинантного ФРТ, а также клонирование и экспрессия неоптимизированной нуклеотидной последовательности, что может также существенно негативно повлиять на выход целевого продукта.
Изобретение решает задачу получения полипептида со свойствами фактора роста тромбоцитов ВВ человека путем биосинтеза, а также увеличение выхода секретированного целевого белка в культуральной жидкости.
В настоящем изобретении была поставлена задача получения плазмиды с геном фактора роста тромбоцитов В человека, а также штамма-продуцента фактора роста тромбоцитов ВВ.
Поставленная задача решается путем конструирования рекомбинантной плазмидной ДНК pPDGFB, кодирующей синтез полипептида со свойствами фактора роста тромбоцитов-ВВ человека, обеспечивающей биосинтез с уровнем порядка 40÷60 мг рекомбинантного белка/л культуры. Высокоэффективный синтез целевого полипептида обеспечивается тем, что целевой ген находится под контролем сильного индуцибельного промотора АОХ1.
Рекомбинантная плазмидная ДНК pPDGFB, кодирующая полипептид со свойствами фактора роста тромбоцитов-ВВ, характеризуется следующими признаками:
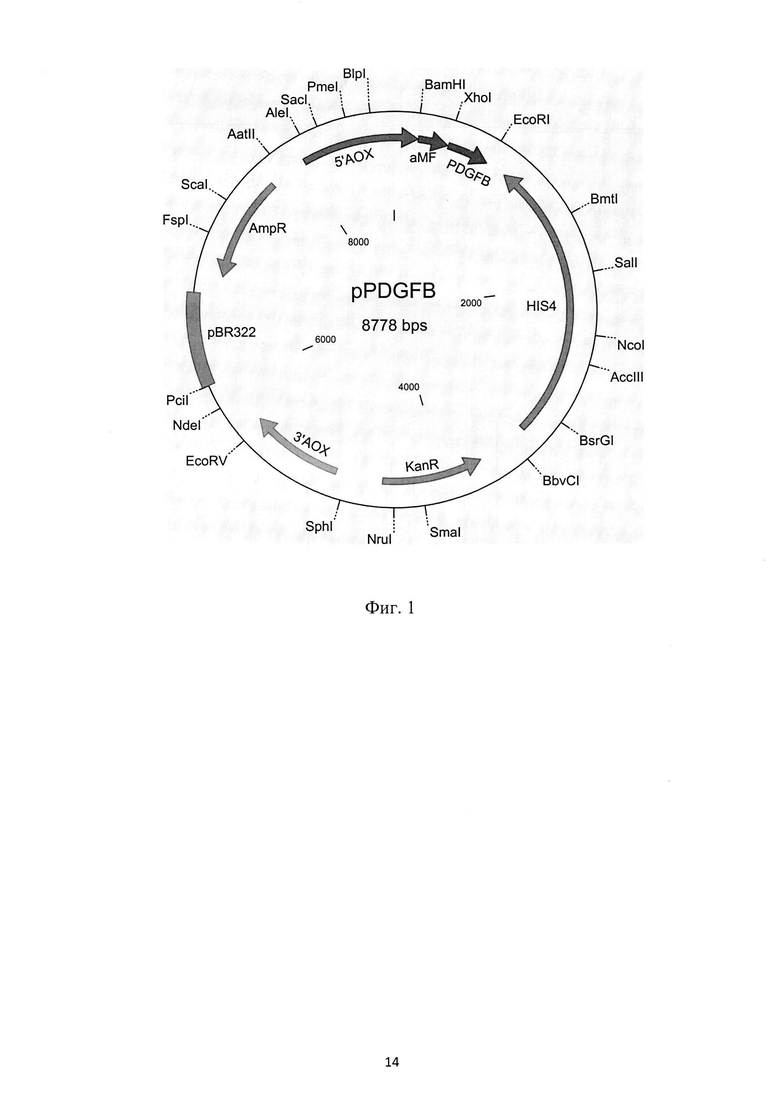
имеет молекулярную массу 6,52 MDa (8,778 т.п.о.);
кодирует аминокислотную последовательность гена фактора роста тромбоцитов-В человека;
состоит из XhoI lEcoRI - фрагмента ДНК плазмиды pPIC9K длиной 9,246 т.п.о., содержащего ген Kan, определяющий устойчивость трансформированных плазмидой pPDGFB клеток к генетицину, ген AmpR β-лактамазы, определяющий устойчивость трансформированных плазмидой pPDGFB клеток к ампициллину, АОХ1-промотор P. pastoris, ген гистидинол дегидрогеназы His4; а также из XhoI /EcoRI фрагмента длиной 342. п.о., включающей и синтетический ген фактора роста тромбоцитов-ВВ человека. Уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: AleI - 8096, Nco I - 2380, PmeI - 8434, XhoI - 438, EcoRI - 780.
Особенностью предложенной плазмидной конструкции является то, что нуклеотидная последовательность фактора роста тромбоцитов-В человека сконструирована с учетом частоты встречаемости кодонов P. pastoris с оптимальным процентным соотношением GC-пар и содержит на N-конце prepro сигнальный пептид α-фактора Saccharomyces cerevisiae.
Для получения штамма-продуцента полипептида со структурой и свойствами фактора роста тромбоцитов-В человека трансформируют клетки Pichia pastoris штамма GS115 (his4, mut+) рекомбинантной плазмидой pPDGFB. Полученный штамм GS115PDGFB характеризуется следующими признаками.
Морфологические признаки. Клетки крупные округлой формы, почкующиеся, 1×4-7 мкм, подвижные.
Культуральные признаки. При росте на плотной среде YPD колонии круглые, гладкие, блестящие, кремовые, край ровный, диаметр колоний 3-6 мм; консистенция пастообразная. Рост в жидкой среде YPD характеризуется ровным помутнением с образованием легкого осадка.
Физико-биохимические признаки. Клетки растут при температуре 4-30°С при оптимуме рН 4,0-6,2. В качестве источника азота используют как минеральные соли в виде смеси, так и органические соединения в виде пептона, дрожжевого экстракта, аминокислот. В качестве источника углерода используют глицерин, глюкоза, метанол. В отличие от исходного штамма не является ауксотрофом по гистидину.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл), обусловленную наличием в плазмиде гена бета-лактамазы, а также к генетицину (до 500 мкг/мл), обусловленную наличием в плазмиде гена Kan.
Штамм Pichia pastoris GS115PDGFB обеспечивает синтез полипептида со свойствами фактора роста тромбоцитов-ВВ человека в количестве не менее 40 мг целевого белка на литр культуры. Совокупность перечисленных свойств штамма обусловливает большую технологичность процесса получения рекомбинантного фермента.
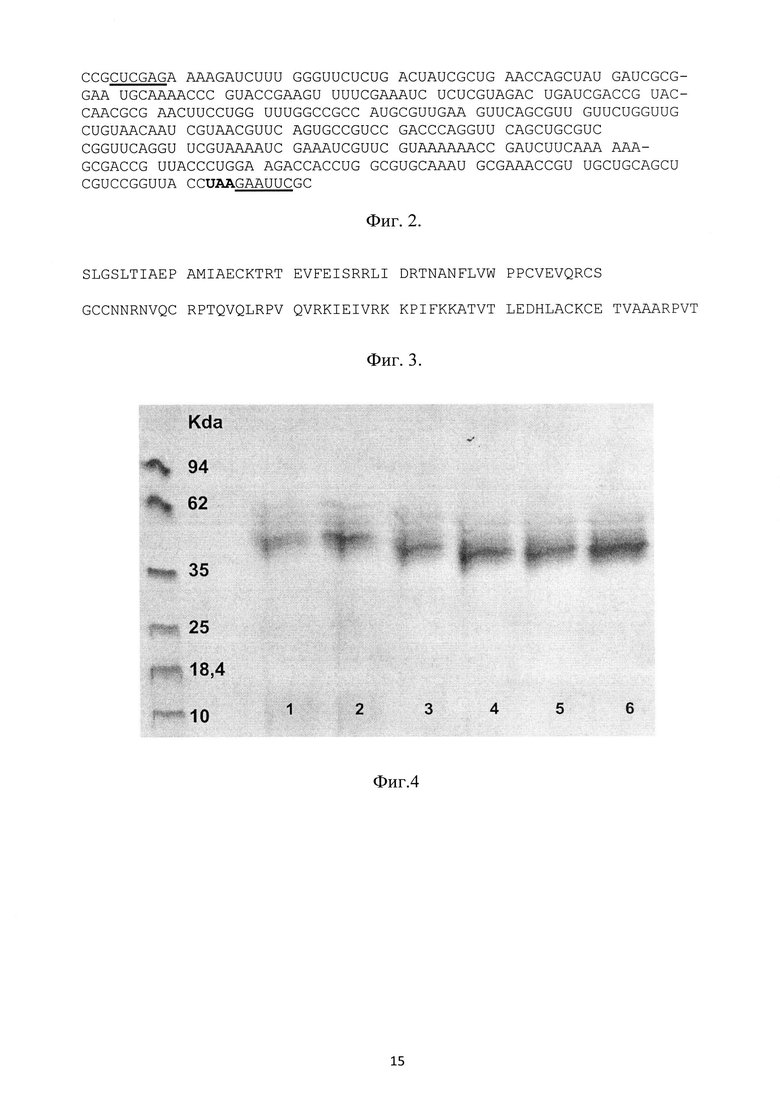
На фиг. 1 представлена физическая карта рекомбинантной плазмиды pPDGFB, где указаны уникальные сайты эндонуклеаз рестрикции, AmpR - ген β-лактамазы, KanR - ген фермента, обуславливающего устойчивость к генетицину, PDGFB- синтетический ген фактора роста тромбоцитов-В человека, aMF - prepro сигнальный пептид α-фактора Saccharomyces cerevisiae, регуляторные последовательности отмечены как 5'АОХ1 и 3'АОХ - фрагменты промотора P. pastoris, HIS4 - регуляторная последовательность и кДНК гистидинолдегидрогеназы; на фиг. 2 - нуклеотидная последовательность синтетического гена искусственного предшественника фактора роста тромбоцитов-В человека. Жирной линией подчеркнут сайт рестриктазы EcoRI, терминирующий кодон выделен жирным шрифтом; на фиг. 3 - аминокислотная последовательность полипептида, кодируемого рекомбинантной плазмидой pPDGFB.; на фиг. 4 - результаты денатурирующего ПААГ-гель электрофореза образцов культуральной жидкости трансформантов при определении уровня экспрессии и штамма-продуцента. Слева расположен маркер молекулярных весов (10; 18,4; 25; 35; 62; 90 КДа), далее трансформанты (номер подписан снизу).
Изобретение иллюстрируется следующими примерами.
При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, использовали хорошо известные специалистам методики, описанные в руководствах по молекулярной биологии и генетической инженерии [Sambrook, J., Fritsch, E,F„ and Maniatis, T. Molecular Cloning; A Laboratory Manual, 1989, 2nd ed. Cold Spring Harbor Laboratory Press, New York; Ausubel, F.M., Brent, R., Kingston, R. E., Moore, D.D., Seidman, J.G., Smith, J.A., & Struhl, K. Current Protocols in Molecular Biology, 1997, John Wiley and Sons, New York; Cregg J.M, Higgins D.R. Production of foreign proteins in the yeast Pichia pastoris, 1995, Canadian J. Botany Supp. 73, 5981-5987].
Пример 1. Создание экспрессионного вектора рСРВН В качестве исходного материала служил вектор pPIC9K (Invitrogen, США). С целью накопления плазмиды, проводили трансформацию компетентных клеткок штамма Escherichia coli XL1-Blue recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [F'proAB laclqZ M15 Tn10 (Tetr)] (Stratagene, США), затем из полученных ампициллин-устойчивых трансформантов выделяли препараты плазмидной ДНК с использованием набора QIAprep Spin Miniprep Kit (QIAGEN, Германия) в соответствии с инструкцией изготовителя. Исходя из известной нуклеотидной последовательности плазмиды и гена фермента, были с конструированы олигонуклеотидные последовательности для наработки искусственного гена со свойствами фактора роста тромбоцитов-В человека с необходимыми концевыми сайтами рестрикции. ПЦР-амплификацию проводили в два этапа. В реакцию вносили эквимолярную смесь (5 мкМ каждого) олигонуклеотидных праймеров (всех, кроме крайних), составляющих ген, взаимно перекрывающихся между собой на 15-20 нуклеотидов, 0.2 мкМ раствора dNTP, 1/10 часть реакционного 10х буфера и 1 и термостабильной ДНК-полимеразы PƒuI. Температуру отжига праймеров рассчитывали по стандартной формуле: Tm(°C)=2⋅[NA+NT]+4⋅[NC+NG]-10,
где Nx - количество соответствующих оснований. Реакцию проводили по следующей схеме: денатурация ДНК при 95°С, 5 минут; затем 10 циклов: денатурация ДНК при 95°С, 1 минута; отжиг праймеров при 55°С, 1 минута; синтез ДНК при 74°С, 2,5 минуты. Вторую амплификацию проводили, используя в качестве матрицы, раствор первой реакции и крайние праймеры, обеспечивающие синтез гена с необходимыми сайтами рестриктаз, по следующей схеме: денатурация ДНК при 95°С, 5 минут; затем 30 циклов: денатурация ДНК при 95°С, 1 минута; отжиг праймеров при 55°С, 1 минута; синтез ДНК при 74°С, 2,5 минуты.
Смесь для ПЦР (50 мкл):
5 мкл 10-кратного буфера для РƒuI-полимеразы («Евроген»);
5 мкл реакции 1;
0,5 мкл 100 мкМ праймера PDGF_f;
0,5 мкл 100 мкМ праймера PDGF_r;
1 мкл 10 мМ dNTP каждого вида («Fermentas»);
43 мкл деионизованной воды;
0,5 мкл PƒuI ДНК-полимеразы («Fermentas»).
После амплификации 5 мкл ПЦР смеси анализировали электрофорезом в 1%-ном агарозном геле и выявляли гомогенный фрагмент размером около 1230 пн. Фрагмент выделяли из геля с помощью набора GelElute Plasmid Miniprep Kit (Sigma, США) в соответствии с инструкцией производителя.
200 нг исходной плазмиды и 100 нг фрагмента (гена proPDGF) гидро-лизовали 20 единицами рестриктаз XhoI (New England Biolabs, США) и EcoRI (New England Biolabs, США). Выделенный из агарозного геля XhoI/EcoRI фрагмент клонировали в XhoI/EcoRI вектор pPIC9K - лигировали с помощью Т4 ДНК лигазы (на 20 нг вектора 1,5 нг фрагмента). Полученной лигазной смесью трансформировали компетентные клетки штамма Escherichia coli XL1-Blue, затем из полученных ампициллин-устойчивых трансформантов выделяли препараты плазмидной ДНК с использованием набора QIAprep Spin Miniprep Kit (QIAGEN, Германия) в соответствии с инструкцией изготовителя. Полученные образцы ДНК анализировали совместным гидролизом рестриктазами EcoRI/XhoI, NotI/NcoI, и отбирали «положительные» клоны, содержащие EcoRI/XhoI фрагменты размером 372 и 8406 п.н., AleI/NcoI фрагменты размером 2397 и 6381 п.н, а плазмиды анализировали на наличие мутаций методом секвенирования ДНК (ЦКП центра «Биоинженерия» РАН). В конечном счете, отбирают экспрессионный вектор, который обозначали как pPDGFB.
Пример 2. Создание экспрессионных кассет и отбор трансформантов для синтеза GPCR в клетках метилотрофных дрожжей Pichia Pastoris.
Необходимым условием стабильной экспрессии генов является создание экспрессионной кассеты. Для этого необходимо линеаризовать векторную молекулу по 5'-участку алкогольоксидазного промотора. После электропорации, в результате гомологичной рекомбинации идентичных участков промотора генома дрожжей и линеаризованного вектора, происходит включением интересующего гена в геном Pichia pastoris.
Для электропорации получали 5 мкл раствора ДНК (pPDGFB), предварительно линеаризованной путем гидролитического расщепления рестриктазой PmeI (Fermentas, Литва), с рабочей концентрацией не менее 2 мкг/мкл. 20 мкг плазмиды гидролизовали 100 единицами рестриктазы PmeI в течение 3 часов. К 1 объему реакционной смеси добавляли равный объем фенол-хлороформа (1:1). Перемешивали 30 сек на вортексе. Центрифугировали в течение 3 мин. Отбирали водную фазу и переносили в новую пробирку. Добавляли в пробирку с фенолхлороформом 100 мкл ТЕ-буфера, затем перемешивали 30 сек на вортексе и центрифугируют в течение 3 мин. Отбирали водную фазу при помощи пипетки и объединяли с той частью раствора, которая была отобрана ранее. Добавляли к раствору ДНК 1/10 объема 3М раствора ацетата Na, рН 6.0 и 3 объема этанола. Перемешивают, переворачивая пробирку несколько раз, и оставляют на 10 минут. Затем центрифугировали в течение 15 мин. Супернатант сливали, пробирку с осадком ДНК центрифугировали в течение 2 мин. Супернатант тщательно удаляли и добавляли 1 мл 70%-го этанола. Центрифугировали в течение 2 мин. Супернатант сливали. Снова повторяли центрифугирование в течение 2 мин и отбирали оставшуюся жидкость. Осадок высушивали в течение 5 мин и растворяют в 5 мкл ТЕ-буфера.
Культуру дрожжей штамма GS115 (his 4, mut+) растили на среде YPD в колбах Эйрленмейера на 500 мл до оптической плотности 1-2 единицы. Центрифугируют при 3000 х g в течение 5 минут.Биомассу суспендировали в 1 мМ DTT и 0,1 М HEPES, инкубировали на шейкере, в течение 30 минут. Затем культуру снова центрифугировали. Биомассу промывли холодной деи-онизированной водой 2 раза и суспендируют в 1 мл 1М сорбитола. Полученные клетки разливали по эппендорфам (по 40 мкл в каждый) и хранили при -70°С. Электропорацию проводили на электропораторе 2510 (Eppendorf, Германия) в специальных кюветах с зазором 2 мм. Рабочие характеристики -напряжение: 1500 В; емкость: 25 мкФ; сопротивление: 600 Ом. После электропорации быстро добавляли 1 мл холодного раствора 1М сорбитола и ставили в термостат на 1 час при температуре 30°С.
Для отбора трансформантов проводили на минимальной среде, не содержащей гистидин. После электропорации культуру клеток рассевали на чашки с плотной питательной средой MD agar. Полученные трансформанты переносили на плотный питательный агар YPD, содержащей генетицин в концентрациях 0,01; 0,02; 0,05; 0,1; 0,5 мг/мл. Полученные клоны проверяли с помощью ПЦР-скрининга. Готовили ПЦР-смесь объемом 20 мкл по следующей схеме:
2 мкл 10-кратного буфера для Taq-полимеразы («Евроген»);
0,15 мкл 120 мкМ праймера AOX1_f;
0,15 мкл 150 мкМ праймера YCl_r;
0,4 мкл 10 мМ dNTP каждого вида («Fermentas»);
17 мкл деионизованной воды;
0,2 мкл Taq ДНК-полимеразы («Евроген»).
В каждую пробирку добавляли клетки трансформантов с плотной среды. Тщательно суспендировали и амплифицировали по следующей схеме: 95°, 5' (денатурация), 95°, 30”; 45°, 30”; 74°, 1’30” (амплификация).
«Положительные» клоны отбирали для определения уровня экспрессии рекомбинантного белка.
Пример 3. Культивирование трансформантов и определение уровня экспрессии гена PDGFB.
Трансформанты с чашек переносили на среду YPD (10 мл) и растили при 30°С до оптической плотности 2-4 единицы. Затем культурой клеток инокулировали среду BMGY (25 мл) (разведение в 100 раз) и инкубировали в течение 48 часов при 30°С в колбах объемом 250 мл. Полученную биомассу собирали центрифугированием при 2000×g в течение 5 минут и переносили в среду BMMY (10 мл), содержащей 1% (v/v) метанола. Выращивание проводили в колбах на 100 мл в течение 72 часов, добавляя каждые 24 часа в среду 1% (v/v) метанола. После выращивания культуральную жидкость отделяли от биомассы центрифугированием при 3000×g в течение 5 минут при 4°С. Полученные образцы смешивали с 1/6 объема «Sample Loading Buffer 6×» и анализировали при помощи денатурирующего ПААГ-электрофореза в стандартном режиме. Клон с максимальным уровнем экспрессии обозначили как GS115PDGFBB.
Настоящее изобретение относится к области биотехнологии и, в частности, к генетической инженерии и может быть использовано в медицинских исследованиях для получения фактора роста тромбоцитов ВВ человека. Представлена рекомбинантная плазмидная ДНК pPDGFB, кодирующая синтез полипептида со свойствами фактора роста тромбоцитов-ВВ человека, которая обеспечивает биосинтез с уровнем порядка 40÷60 мг рекомбинантного белка/л культуры. Высокоэффективный синтез целевого полипептида обеспечивается тем, что целевой ген находится под контролем сильного индуцибельного промотора АОХ1. Представленный штамм Pichia pastoris GS115PDGFB обеспечивает синтез полипептида со свойствами фактора роста тромбоцитов-ВВ человека в количестве не менее 40 мг целевого белка на литр культуры. 2 н.п. ф-лы, 4 ил., 3 пр.
1. Рекомбинантная плазмида pPDGFB, характеризующаяся конструктивным выполнением, представленным на фиг. 1, имеющая нуклеотидную последовательность, представленную на фиг. 2, кодирущая полную аминокислотную последовательность полипептида фактора роста тромбоцитов ВВ человека, обеспечивающая стабильную рекомбинацию экспрессионных кассет в геноме Pichia pastoris, а также высокий уровень экспрессии целевого белка в культуральной жидкости.
2. Рекомбинантный штамм Pichia pastoris: GS115PDGFBB - продуцент фактора роста тромбоцитов ВВ человека, полученный путем трансформации клеток штамма Pichia pastoris GS115(his4, mut+) рекомбинантной плазмидой pPDGFB по п. 1.
| ШТАММ ДРОЖЖЕЙ PICHIA PASTORIS 2-2 - ПРОДУЦЕНТ ТРОМБОЦИТАРНОГО ФАКТОРА РОСТА ЧЕЛОВЕКА (PDGF-BB) И СПОСОБ ПОЛУЧЕНИЯ ТРОМБОЦИТАРНОГО ФАКТОРА РОСТА ЧЕЛОВЕКА | 2005 |
|
RU2290434C1 |
| M | |||
| DAI et al | |||
| Identification and Functional Characterization of Glycosylation of Recombinant Human Platelet-Derived Growth Factor-BB in Pichia pastoris, PLoS One | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2018-10-02—Публикация
2017-09-12—Подача