Изобретение относится к биотехнологии, к генной инженерии, микробиологической и медицинской промышленности и представляет собой дрожжевой штамм - продуцент лейкоцитарного интерферона-16 человека, содержащий сконструированную in vitro плазмиду, которая обеспечивает синтез и секрецию лейкоцитарного интерферона-16 человека.
Лейкоцитарный интерферон человека, альфа-интерферон-16, относится к обширной группе эволюционно родственных белков, получивших название интерферонов. В настоящее время выделено и охарактеризовано 23 вида альфа-интерферонов человека, различающихся по аминокислотному составу, но обладающих общими функциональными признаками. Образование интерферонов стимулируется воздействием вирусов на различные группы клеток. Интерфероны способны активировать противовирусные защитные механизмы клетки. Клинические испытания показали возможность использования альфа-интерферонов для лечения ряда вирусных заболеваний, таких как гепатит В, С, D, герпетическая инфекция, кератиты, грипп (Guo J. T. et al. J.Virol., 2000, v.75, p.8516-8523; Prescrire Int., 2001, v.10, p.17-21). Помимо этого, в настоящее время альфа-интерфероны совместно с другими препаратами активно используются в лечении различных онкологических заболеваний (рак простаты, почечно-клеточный рак, рак молочной железы, лейкозы, злокачественные заболевания кожи) и аутоиммунных заболеваний человека (Молчанов О.Е. и др. Современные тенденции иммунотерапии злокачественных опухолей, 2001; Ершов Ф.И. Система интерферона в норме и патологии, 1996; Kramer G. et al. J.Interferon Cytokine Res., 2001, v.21, p. 475-484). Видоспецифичность интерферонов не позволяет использовать в клинических испытаниях препараты альфа-интерферонов других млекопитающих. Использование в качестве источника альфа-интерферонов донорской крови или культуры лейкоцитов не дает нужных количеств препарата, а кроме того, несет опасность заражения гепатитом В, С и ВИЧ.
Перспективным подходом для получения альфа-интерферона-16 человека в значительных количествах является использование микроорганизмов в качестве продуцентов этого препарата. Существует ряд штаммов Escherichia coli, Pseudomorias putida, Sacharomyces cerevisiae, продуцирующих различные типы альфа-интерферонов человека. Наиболее распространенными являются продуценты рекомбинантного альфа-интерферона-2, полученные на основе прокаритических микрооганизмов. Но Escherichiacoli и Pseudomonas putida являются условно патогенными для человека и препараты альфа-интерферона, полученные из бактериальных клеток, могут содержать эндотоксины. Полное освобождение альфа-интерферона от примеси эндотоксинов, являющееся обязательным условием применения его в клинической практике, значительно затрудняет процедуру очистки рекомбинантного белка. В настоящее время отечественный препарат рекомбинантного альфа-интерферона-2b человека, синтезируемого клетками Pseudomonas putida и производимый ЗАО "Вектор-Медика", зарегистрирован и разрешен к применению. Однако длительное применение его может приводить к нежелательным побочным эффектам, обусловленным условной патогенностью штамма-продуцента (Ершов Ф.И. Система интерферона в норме и патологии, 1996).
Все вышеизложенное свидетельствует о перспективности создания штаммов-продуцентов альфа-интерферона-16 человека на основе других микроорганизмов, в частности дрожжей. Применение непатогенных микроорганизмов (дрожжей), не содержащих токсических и пирогенных факторов, в качестве продуцентов белков человека позволяет использовать рекомбинантные белки в клинической практике. Созданные ранее в лаборатории биохимической генетики БиНИИ СПбГУ штаммы дрожжей Saccharomyces cerevisiae - продуценты лейкоцитарного интерферона-16 человека отличались низкой продуктивностью. Уровень продукции составлял от 0,1 мг до 1 мг биологически активного альфа-интерферона-16 на литр культуры (Мясников А. Н. и др. SU 1573577, 1988; Мясников А.Н. и др. SU 1584188, 1988). Кроме того, углеводный компонент белков, экскретируемых дрожжами-сахаромицетами, существенно отличается от такового гликопротеинов высших эукариота (Kukuruzinska M. A. et al. Ann.Rev.Biochem., 1987, v.56, p.915-944). Углеводная часть гликопротеинов является сильной антигенной детерминантой, поэтому рекомбинантный альфа-интерферон-16 человека, секретируемый дрожжами Saccharomyces cerevisiae, может применяться только для лабораторных исследований (Ballou C.E. J.Biol.Chem, 1970, v.245, p.1197-1203).
Использование для гетерологичной экспрессии метилотрофных дрожжей Pichia pastoris представляет особый интерес. Это, во-первых, дает возможность существенно повысить выход рекомбинантных белков. Во-вторых, гликопротеины, секретируемые дрожжами Pichia pastoris, не содержат маннозных остатков, связанных α1-3 связями и являющихся сильными антигенными детерминантами, что позволяет получать наряду с внутриклеточными аутентичные секреторные формы рекомбинантных белков (Montesino R. et al. Protein Expr. Purif., 1998, v.l4, p.197-207).
Получение секреторного продуцента альфа-интерферона-16 человека особенно актуально. Белок является гликопротеином и только в процессе секреции он претерпевает гликозилирование и приобретает правильную конформацию. Накопление рекомбинантного белка в культуральной жидкости значительно упрощает процедуру его очистки.
Задачей, на решение которой направлены предлагаемые объекты изобретения, является создание штамма дрожжей Pichia pastoris, синтезирующего альфа-интерферон-16 человека и секретирующего его в культуральную жидкость, создание рекомбинантной плазмидной ДНК pHIN, обеспечивающей синтез и секрецию лейкоцитарного интерферона-16 человека, и разработка способа ее конструирования.
Для решения поставленной задачи разработан способ конструирования рекомбинантной плазмидной ДНК pHIN, обеспечивающей синтез и секрецию лейкоцитарного интерферона, в результате создан штамм дрожжей Pichia pastoris, синтезирующего альфа-интерферон-16 человека и секретирующего его в культуральную жидкость.
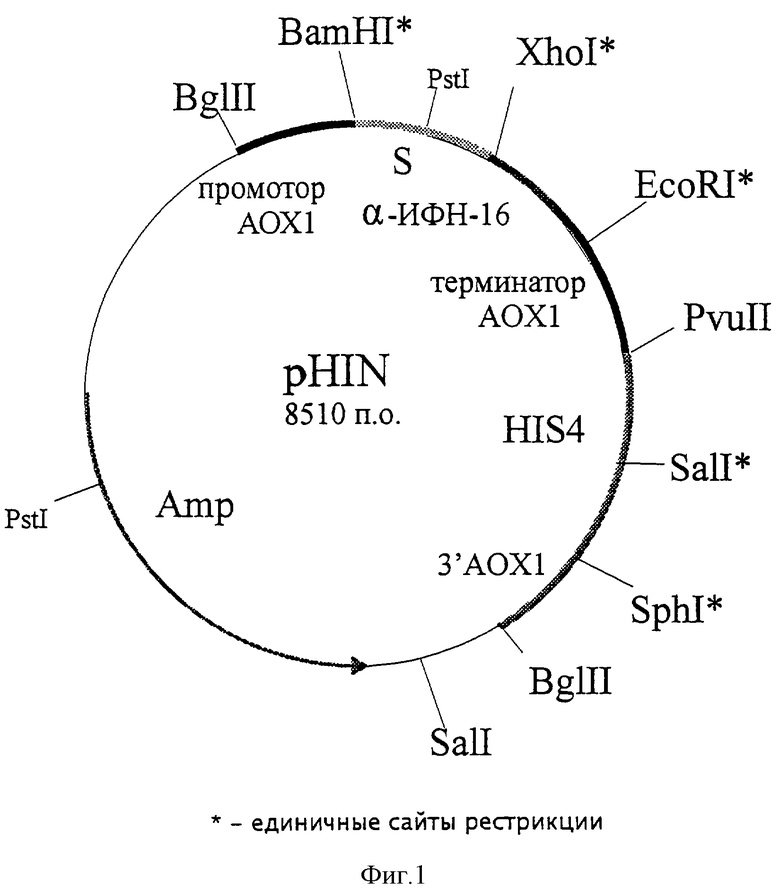
Плазмидная ДНК pHIN, обеспечивающая синтез и секрецию альфа-интерферона-16 человека трансформированными ею клетками дрожжей, имеет общий размер 8,51 т.п.о., (5,6 молекулярная масса Mдa), состоит из следующих элементов:
- EcoRl-Xhol - фрагмент плазмидной ДНК бифункционального бактериально-дрожжевого вектора рРIС9 размером 8,00 т.п.о., включающий бактериальный ген устойчивости к ампициллину, бактериальную область инициации репликации, ген HIS4 дрожжей; фрагмент 5'-некодирующей области дрожжевого гена АОХ1 размером 0, 95 т.п.о., содержащий область, обеспечивающую активацию транскрипции этого гена в присутствии метанола в качестве источника углерода в культуральной среде; препрообласть гена MFα дрожжей Saccharomyces cerevisiae размером 0,27 т.п.о., обеспечивающую секрецию бета-интерферона в культуральную среду; фрагмент гена АОХ1 размером 0,33 т.п.о., содержащий область терминации транскрипции этого гена; фрагмент 3'-нетранслируемой области гена АОХ1 размером 0,76 т.п.о.;
- Xhol-EcoRI - фрагмент размером 0,51 т.п.о., содержащий кодирующую часть гена альфа-интерферона-16 человека за исключением области, кодирующей сигнальный пептид;
- уникальные сайты распознования следующих рестриктаз: BamH1 - 0,94 т.п. о. ; Xho1 - 1,19 т.п.о.; EcoR1 - 1,71 т.п.о.; Sall - 3,70 т.п.о; Sphl - 5,31 т.п.о.
Схема плазмидной ДНК pHIN с рестрикционной картой изображена на фиг.1.
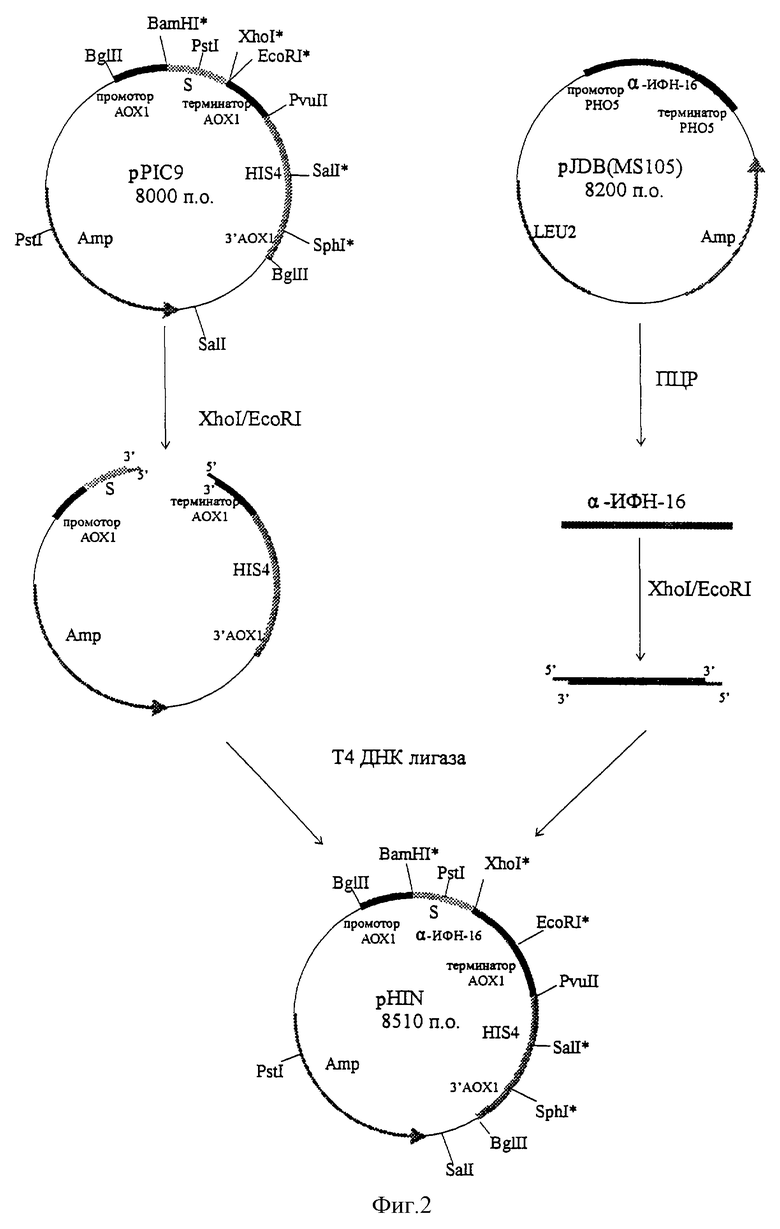
Схема конструирования плазмиды pHIN приведена на фиг.2.
Плазмиду pJDB(MS105) (Мясников А.Н. и др. SU 1584188, 1988) используют в качестве матрицы для синтеза гена альфа-интерферона-16 человека при помощи ПЦР. В качестве прямого праймера служит олигонуклеотид 5'-ccgctcgagaaaagatgtgatctgcctcag, содержащий сайт для рестриктазы Xhol. В качестве обратного праймера используют олигонуклеотид 5'-ggaattcctcaatccttccttcttaatcct, который содержит сайт для рестриктазы EcoRl. Синтезированный ген альфа-интерферона-16 человека размером 0,51 т.п.о. выделяют при помощи электрофореза в 0,7% агарозном геле, обрабатывают рестриктазами Xhol и EcoRl и лигируют с плазмидой pPIC9 ("Invitrogen"), предварительно обработанной этими же рестриктазами.
Полученную лигазную смесь вводят в клетки штамма DH5α Escherichia coli (FVendAl hsdR17 (rk - mk +) supE44 thi-1 recAl gyrA (Nalr) relAl Δ(lacZYA-argF)U169 deoR (φ80dlacΔ(lacZ)M15), с помощью рестрикционного анализа отбирают трансформанты, содержащие плазмиду pHIN. Для доказательства идентичности гена альфа-интерферона-16, синтезированного при помощи ПЦР, нативному гену альфа-интерферона-16 человека проводят определение его нуклеотидной последовательности (Sanger F.S. et al. Proc. Natl. Acad. Sci., 1977, v.74, p. 5463-546).
Выбор конструкции плазмиды для продукции альфа-интерферона-16 обусловлен следующими причинами. Плазмида pHIN получена на основе челночного бактериально-дрожжевого интегративного вектора pPIC9. В результате трансформации линеаризованной плазмидой и последующей гомологичной рекомбинации происходит встраивание экспрессионной кассеты в хромосому дрожжей Pichia pastoris, что обеспечивает стабильное поддержание клонированного гена альфа-интерферона-16. В состав плазмиды входит ген HIS4 дрожжей, что позволяет селективно отбирать трансформантов при использовании в качестве реципиентов штаммы дрожжей с мутациями в этом гене.
Экспрессия гена альфа-интерферона-16 человека в составе плазмиды pHIN находится под контролем промотора гена АОХ1, содержащим области, обеспечивающие активацию транскрипции в присутствии метанола в культуральной среде, а также область инициации транскрипции. Промотор гена АОХ1 относится к числу наиболее сильных дрожжевых промоторов. Уровень экспрессии генов, находящихся под контролем АОХ1 промотора, эффективно регулируется источниками углерода. Транскрипция гена АОХ1 полностью блокирована при выращивании дрожжей на среде с глюкозой, на среде с глицерином наблюдается только базальный уровень экспрессии гена. Использование метанола в качестве единственного источника углерода значительно усиливает экспрессию гена АОХ1 и, следовательно, генов, находящихся под контролем АОХ1 промотора. Это позволяет регулировать синтез альфа-интерферона-16 в клетках дрожжей. Регулируемая экспрессия клонированного гена позволяет существенно снизить метаболическую нагрузку на клетку дрожжей. Наличие в составе плазмиды препрообласти гена MFα дрожжей Saccharomyces cerevisiae обеспечивает секрецию синтезированного альфа-интерферона-16 человека в культуральную жидкость.
В качестве продуцента альфа-интерферона-16 используют штамм PS104(pHIN). Штамм PS104(pHIN) получен при трансформации штамма дрожжей PS99 (his4 рер4:: РН085) плазмидой pHIN. Штамм PS99 несет мутацию в гене HIS4, что позволяет селективно отбирать трансформантов, несущих плазмиду pHIN. Мутация в гене РЕР4 приводит к отсутствию активности протеаз А и В, а также карбоксипептидазы Y в клетках дрожжей, что сопровождается повышением стабильности гетерологичных рекомбинантных белков (Hisch H.H. et al. In: Walton E.F., Yarranton G.T., Eds., Molecular and Cell Biology of Yeast, 1989, p.134-200).
Штамм дрожжей Pichia pastoris PS104(pHIN) характеризуется следующими признаками.
Морфологические признаки
Клетки округлой, слегка овальной формы, размером 5-10 мкм, часть клеток имеет на поверхности почки или соединена с дочерними клетками.
Культуральные признаки
Клетки хорошо растут на полной органической среде YEPD - 2% пептона, 1% дрожжевого экстракта, 2% глюкозы или 1% глицерина.
Кроме того, клетки хорошо растут на минеральной среде SC: 1,34% Yeast Nitrogen Base ("Difco", США), 2% глюкозы (1% глицерина, 0,5% метанола), а также на других синтетических средах для дрожжей.
При росте на твердых средах клетки образуют гладкие, круглые колонии с матовой поверхностью, светло-кремового цвета, край неровный.
При росте в жидких средах образуют интенсивную ровную суспензию. Культура имеет характерный запах метилотрофных дрожжей.
Физиолого-биохимические признаки
Клетки растут в пределах от 4 до 37oС. Оптимальной температурой выращивания является 30oС. При росте в аэробных условиях клетки незначительно защелачивают среду. Оптимум рН для роста составляет 4,5-6,5.
В качестве источника углерода клетки могут использовать многие простые соединения, такие как глюкоза, глицерин, метанол.
В качестве источника азота клетки могут использовать минеральные соли в аммонийной форме, аминокислоты, мочевину.
Клетки способны к аэробному и анаэробному росту.
Существенными признаками штамма является отсутствие потребности в гистидине.
Способ получения плазмиды pHIN проиллюстрирован следующим примером.
ПРИМЕР 1.
Клетки бактерий Escherichia coli, содержащие плазмиду pJDB(MS105), выращивают при 37oС в течение ночи в 1 л питательной среды LB (1% пептона, 0,5% дрожжевого экстракта, 1% хлористого натрия), содержащей ампициллин в концентрации 50 мг/л. Клетки собирают центрифугированием при 5000об/мин в течение 10 мин при 4oС, суспендируют в 20 мл 25 мМ трис-хлоридного буфера (рН 8,0), содержащего 10 мМ ЭДТА и 50 мМ глюкозы, добавляют 30 мг лизоцима и инкубируют 10 мин при комнатной температуре. Далее добавляют 40 мл 0,2 М гидроокиси натрия, содержащей 1% додецилсульфата натрия, осторожно перемешивают и инкубируют в течение 10 мин при 4oС. Раствор нейтрализуют добавлением 30 мл 3 М ацетата натрия (рН 5,0) и выдерживают в течение 10 мин при 4oС. После этого центрифугируют при 14000 об/мин в течение 40 мин при 4oС. К супернатанту добавляют 0,6 объема изопропилового спирта, выдерживают 20 мин при комнатной температуре и центрифугируют при 14000 об/мин в течение 20 мин при 20oС. Полученный осадок промывают 70% этиловым спиртом, высушивают в вакууме и растворяют в 4 мл дистиллированной воды. Далее добавляют 4,2 г хлористого цезия и 0,36 мл раствора бромистого этидия (10 мг/мл). Полученный раствор выдерживают в течение 1 часа при 4oС, затем центрифугируют при 15000 об/мин в течение 15 мин. Супернатант центрифугируют при 70000 об/мин в течение 16 часов в центрифуге TL100 ("Beckman"). После центрифугирования отбирают полосу плазмидной ДНК (нижнюю из двух флюоресцирующих в ультрафиолетовом свете полос), дважды экстрагируют бромистый этидий равным объемом изоамилового спирта, разбавляют в два раза дистиллированной водой и осаждают плазмидную ДНК двумя объемами этилового спирта и 1/15 объема 3 М ацетата натрия (рН 5,0). Осадок собирают центрифугированием при 10000 об/мин в течение 10 мин, промывают 70% этиловым спиртом и растворяют в 0,5-1 мл буфера ТЕ (10 мМ трис-хлоридный буфер, рН 8,0, содержащий 1 мМ ЭДТА). Концентрацию плазмидной ДНК определяют по поглощению раствора при длине волны 260 нм. Чистоту препарата контролируют при помощи электрофореза в 0,7% агарозном геле в буфере ТВЕ (0,1М трис-боратный буфер, рН 8,3, содержащий 1 мМ ЭДТА).
Полученную плазмиду pJDB(MS105) используют в качестве матрицы для синтеза гена альфа-интерферона-16 человека при помощи ПЦР.
К 0,1 мкг плазмидной ДНК, растворенной в 5 мкл буфера ТЕ, добавляют 1 мкл 0,5 М NaOH и нагревают при 85oС в течение 3 мин. Затем пробу быстро переносят в лед, добавляют 1 мкл 0,5 М НСl и далее используют в ПЦР.
В качестве прямого праймера служит олигонуклеотид 5'-ccgctcgagaaaagatgtgatctgcctcag, содержащий сайт для рестриктазы Xhol. В качестве обратного праймера используют олигонуклеотид 5'- ggaattcctcaatccttccttcttaatcct, который содержит сайт для рестриктазы EcoRl.
Проба для ПЦР содержит 5 мкл матрицы, 30 рМ каждого праймера (по 2 мкл), 10 мкл 10-кратного раствора дезоксинуклеотидтрифосфатов (дНТФ), содержащего 1,25 мМ каждого дНТФ (дАТФ, дТТФ, дГТФ, дЦТФ), 10 мкл 10-кратного буфера для ПЦР (100 mM КСl, 100 тМ (NH4)2SО4, 200 тМ Трис-HCl, рН 8,8, 20 mM MgSO4, 1% тритон Х-100). В пробу добавляется дистиллированная Н2О до конечного объема 100 мкл.
Далее пробу прогревают 5 мин при 95oС, охлаждают, добавляют 2,5 ед. (2,5 мкл) Вент-ДНК-полимеразы ("BioLabs") и проводят 50 циклов ПЦР в следующих условиях: 1 мин при 95oC (плавление цепей ДНК), 1 мин при 46oС (отжиг праймеров), 1 мин при 72oC (полимеразная реакция). После окончания ПЦР пробу инкубируют при 72oC 5 мин.
Для доказательства того, что в ходе ПЦР синтезируется ген альфа-интерферона-16 человека, проводят электрофорез в 0,7% агарозном геле в буфере ТВЕ. Реакционную смесь вносят в лунки агарозного геля и проводят разделение фрагментов ДНК в течение 1-2 часов в условиях, описанных выше. По окончании разделения вырезают полоску геля, содержащую фрагмент ДНК размером 0,51 т.п. о. , соответствующий гену альфа-интерферона-16 человека. Выделение ДНК из агарозного геля проводят по методике, разработанной фирмой QIAGEN, используя выпускаемые фирмой специальные наборы. Полоску геля с фрагментом ДНК помещают в пробирку и добавляют раствор QX1 (300 мкл на 100 мг геля). Пробу нагревают до 50oC, добавляют реактив QIAEX (10 мкл на 5 мкг ДНК) и инкубируют при 50oC в течение 10 мин, периодически перемешивая. Далее центрифугируют 30 с при 15000 об/мин, супернатант отбрасывают, осадок дважды экстрагируют растворами QX2 и QX3, удаляют супернатант центрифугированием при 15000 об/мин в течение 30 с. Осадок высушивают на воздухе, растворяют в 20 мкл буфера ТЕ, центрифугируют 30 с при 15000 об/мин супернатант переносят в новую пробирку.
Гидролиз фрагмента ДНК, содержащего синтезированный ген альфа-интерферона-16 человека, рестриктазами Xhol и EcoRI проводят в 10 мМ трис-хлоридном буфере (рН 7,5), содержащем 50 мМ хлористого натрия, 10 мМ хлористого магния и 1 мМ дитиотреитол. К 5 мкг плазмидной ДНК в объеме 20 мкл добавляют по 5 ед. каждой рестриктазы, после чего пробу инкубируют в течение 25 часов при 37oC.
Выделение плазмиды рРIС9 проводят в условиях, аналогичных для плазмиды pJDB(MS105). Гидролиз ее рестриктазами Xhol и EcoRI осуществляют в условиях, описанных для расщепления синтезированного при помощи ПЦР гена альфа-интерферона-16 человека. Линеаризованную плазмидную ДНК выделяют по описанной выше методике фирмы QIAGEN, исключая стадию нагревания.
Для получения плазмиды pHIN проводят лигирование плазмиды рРIС9, гидролизованной рестриктазами Xhol и EcoRI, и XhoI/EcoRI фрагмента гена альфа-интерферона-16 человека, синтезированного при помощи ПЦР. Для этого смешивают 0,5 мкг ДНК вектора и 0,1 мкг ДНК встройки в 10 мкл 70 мМ трис-хлоридного буфера (рН 7,6), содержащего 5 мМ дитиотреитола, 5 мМ хлористого магния, 1 мМ АТФ, добавляют 10 ед. ДНК-лигазы фага Т4 и инкубируют при 14oC в течение ночи.
Полученной лигазной смесью трансформируют клетки штамма DH5 α Escherichia coli (F'/endAl hsdR17 (rk - mk +) supE44 thi-1 recAl gyrA (Nalr) relAl Δ(lacZYA-argF)U169 deoR (φ80dlacΔ(lасZ)М15) Escherichia coli. Для этого клетки Escherichia coli выращивают в 100 мл среды LB при 37oC до достижения культурой густоты клеточной суспензии, соответствующей 0,4-0,6 ед. оптической плотности при длине волны 550 нм. Клеточную суспензию охлаждают в ледяной бане, центрифугируют при 5000 об/мин в течение 10 мин при 4oC. Клетки супендируют в 100 мл 10 мМ хлористого натрия, собирают центрифугированием в тех же условиях. Далее клетки суспендируют в 50 мл 75 мМ хлористого кальция, выдерживают в ледяной бане в течение 40 мин, осаждают центрифугированием в тех же условиях и суспендируют в 1 мл 75 мМ хлористого кальция. К суспензии компетентных клеток добавляют глицерин до конечной концентрации 15%, разделяют на аликвоты и хранят при -70oC. Перед трансформацией суспензию компетентных клеток размораживают в ледяной бане, добавляют лигазную смесь и инкубируют в ледяной бане в течение 40 мин. Далее клетки подвергают действию теплового шока при 42oC в течение 2 мин, после чего инкубируют в 1,5 мл среды LB при 37oC в течение 1 часа. Клетки собирают центрифугированием при 5000 об/мин в течение 10 мин и высевают на чашки Петри со средой LB, содержащей 2% агара и 50 мг/л ампициллина. Чашки инкубируют при 37oC в течение 12-16 часов.
Из выросших отдельных клонов трансформантов выделяют плазмидную ДНК при помощи методики, использованной для получения плазмиды pJDB(MS105), за исключением того, что клетки Escherichia coli выращивают в 10 мл LB, и соответственно объемы всех растворов уменьшают в 100 раз. Кроме того, вместо стадии центрифугирования в градиенте плотности хлористого цезия проводят обработку ДНК панкреатической РНKазой. Для этого нуклеиновые кислоты, осажденные изопропиловым спиртом, растворяют в 100 мкл буфера ТЕ, добавляют 10 мкл раствора РНКазы (1 мг/мл) и инкубируют 30 мин при 37oC.
Далее проводят гидролиз полученной плазмидной ДНК рестриктазами EcoRI и Xhol. При рестрикции искомой плазмиды pHIN и последующем электрофорезе в 0,7% агарозном геле обнаруживаются фрагменты 0,51 и 8,00 т.п.о. Из выявленного таким образом клона препаративно выделяют плазмиду pHIN так же, как описано для плазмиды pJDB(MS105), и гидролизуют рестриктазой BglII в 50 мМ трис-хлоридном буфере (рН 7,5), содержащем 100 мМ хлористого натрия, 10 мМ хлористого магния. BglII-фрагмент плазмиды рР1С9, размером 5,63 т.п.о., выделяют по описанной выше методике фирмы QIAGEN, исключая стадию нагревания, и используют его для трансформации клеток дрожжей, как описано в примере 2.
ПРИМЕР 2.
Для получения штамма дрожжей Pichia pastoris - продуцента альфа-интерферона-16 человека, клетки дрожжей штамма PS99 трансформируют плазмидой pHIN.
Клетки дрожжей выращивают в 100 мл среды YEPD при 30oC до достижения культурой оптической плотности, соответствующей 2-4 ед поглощения при длине волны 600 нм. Клетки дважды промывают стерильной водой, после чего суспендируют в 0,3 мл 100 мМ раствора ацетата лития и инкубируют при 30oC в течение 30 мин. К 50 мкл полученной суспензии клеток добавляют 0,1-1 мкг плазмидной ДНК, 50 мкг ДНК спермы лосося, предварительно денатурированной нагреванием (10 мин при 100oС) и 0,3 мл раствора 100 мМ ацетата лития, содержащего 40% полиэтиленгликоля 4000. Далее пробу инкубируют 30 мин при 30oC и 20 мин при 42oC, помещают на 15 с в ледяную баню и центрифугируют 10 с при 10000 об/мин. Клетки суспендируют в 1 мл стерильной воды и высевают на твердую среду SC. Клоны трансформантов вырастают через 2-3 суток. Выросшие клоны пересевают на чашки со средой SC, содержащей 2% глюкозу, отдельными колониями, затем перепечатывают на среду ММ (1,34% Yeast Nitrogen Base ("Difco", США), 0,5% метанола, 2% агара ("Difco", США) для отбора трансформантов, не растущих на среде с метанолом, что свидетельствует об интеграции чужеродного гена в локус AOXI (фенотип Met-).
Для анализа продукции альфа-интерферона-16 клетками трансформантов фенотипа Met - их выращивают при 30oC в 100 мл жидкой среды BMGY (2% пептона, 1% дрожжевого экстракта, 1% глицерина, 10 мл 1М калий-фосфатного буфера, рН 6,0, 1,34% Yeast Nitrogen Base ("Difco", США) до стационарной фазы роста в течение 2 суток. Клетки собирают центрифугированием при 5000 об/мин в течение 10 мин, супернатант сливают и переносят всю биомассу в 20 мл жидкой среды BMMY (2% пептона, 1% дрожжевого экстракта, 0,5%метанола, 10 мл 1М калий-фосфатного буфера, рН 6,0, 1,34% Yeast Nitrogen Base ("Difco", США) для индукции экспрессии альфа-интерферона-16. Индукцию проводят при 30oC в течение 4 суток. По окончании индукции культуральную среду отделяют от клеточной биомассы центрифугированием при 5000 об/мин в течение 10 мин. В культуральной среде определяют содержание альфа-интерферона-16 при помощи электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия и последующей гибридизации со специфическими антителами к альфа-интерферону-человека. Разделение белков проводят в 15% полиакриламидном геле в стандартной системе буферов (электродный буфер: 25 мМ трис, 192 мМ глицин, 0,1% додецилсульфат натрия, рН 8,3; буфер для геля: 375 мМ трис-хлоридный буфер, рН 8,8). Параллельно проводят разделение белков контрольного штамма, выращенного в идентичных условиях. В качестве стандартов молекулярной массы используют карбоангидразу, ингибитор трипсина, миоглобин, лизоцим. По окончании электрофореза белки ренатурируют, выдерживая гели 15 мин в 10 мМ трис-хлоридном буфере (рН 7,5), содержащем 4М мочевину, 20 мМ ЭДТА, и переносят на нитроцеллюлозную мембрану в 25 мМ трис-192 мМ глициновом буфере (рН 8,3), содержащем 20% метилового спирта, при 30-40 В, в течение 1,5 часов. Далее мембрану выдерживают в буфере TBST (10 мМ трис-хлоридный буфер (рН 8,0), 150 мМ хлористого натрия, 0,05% твин-20, 1% бычьего сывороточного альбумина) в течение 2 часов при 37oC. Затем помещают мембрану в тот же буфер, содержащий разведенные в 1000 раз мышиные поликлональные антитела к альфа-интерферону человека ("Протеиновый контур"), и инкубируют 2 часа при 37oC. Далее трижды промывают мембрану буфером TBST и инкубируют 1 час при 37oC с разбавленным в 7000 раз конъюгатом видоспецифических антител к иммуноглобулинам мыши пероксидазы хрена ("Протеиновый контур"). После отмывки мембраны буфером PBST (58 мМ двузамещенного фосфата натрия, 17 мМ однозамещенного фосфата натрия, 68 мМ хлористого натрия, 0,1% твин-20) добавляют раствор субстратов для пероксидазы: 0,02% DAB(3,'3-диаминобензидин тетрагидрохлорид), 0,006% перекись водорода в 10 мМ трис-хлоридном буфере, рН 7,5. Параллельно окрашивают гели 0,15% раствором кумасси G250 в 25% изопропаноле и 10% уксусной кислоте и отмывают в 10% уксусной кислоте. При сравнении спектра белков двух штаммов у штамма PS104(pHIN) обнаруживают появление двух дополнительных белковых полос, дающих четкую положительную реакцию с антителами к альфа-интерферону человека: основной - с молекулярной массой 20 КДа, что соответствует молекулярной массе гликозилированного альфа-интерферона-16, и минорной - 22 КДа. Оба белка являются гликопротеинами, о чем свидетельствует прокрашивание реактивом Шиффа. Появление минорной фракции альфа-интерферона-16 с молекулярной массой 22 КДа можно объяснить различной степенью гликозилирования белковой молекулы. Уровень синтеза альфа-интерферона-16 определяют, сравнивая интенсивность окрашивания полосы рекомбинантного белка с полосой стандартного альфа-интерферона.
Согласно полученным данным, клетки дрожжей штамма PS104(pHIN) синтезируют и секретируют около 15 мг альфа-интерферона-16 на литр культуры дрожжей.
Суммируя вышесказанное можно заключить, что полученный штамм дрожжей Pichia pastoris PS104(pHIN) синтезирует и секретирует альфа-интерферон-16 человека в количестве, достаточном для его очистки в лабораторном масштабе. В результате такой очистки могут быть получены препараты альфа-интерферона-16, пригодные для исследования его биологических свойств и терапевтической ценности. Преимуществом данного продуцента по сравнению с прототипами ВКМП Y-789 и ВКМП Y-790 является более высокий уровень продукции альфа-интерферона-16 и большая стабильность рекомбинантного белка. Так же, как штамм ВКМП Y-790, полученный штамм дрожжей Pichia pastoris PS104(pHIN) обеспечивает секрецию альфа-интерферона-16, что значительно упрощает процедуру очистки рекомбинантного белка. Рекомбинантный альфа-интерферон-16, синтезируемый и секретируемый штаммом PS104(pHIN), является гликопротеином, как и альфа-интерферон-16 человека, и в то же время не содержит дополнительных маннозных остатков, характерных для белков, секретируемых дрожжами-сахаромицетами.
Штамм дрожжей Pichia pastoris PS104(pHIN) - секреторный продуцент альфа-интерферона-16 интерферона человека депонирован во Всероссийской коллекции промышленных микроорганизмов под номером BKПM-Y2949.
Изобретение относится к области генной инженерии и может быть использовано в микробиологической и медицинской промышленности. Сконструирована рекомбинантная плазмидная ДНК pHIN, представляющая собой ЕсоRI-Xho I фрагмент бифункционального бактериально-дрожжевого вектора рРIC19, с которым лигирована кодирующая часть гена альфа-интерферона-16 человека без области, кодирующей сигнальный пептид. В результате трансформации штамма дрожжей Pichia pastoris PS 99 плазмидной рНIN получен рекомбинантный штамм Pichia pastoris PS 104(рНIN), который обеспечивает не только эффективный (15 мг на 1 л культуры) синтез альфа-интерферона-16 человека, но и секрецию клетками целевого продукта. 3 с.п. ф-лы, 2 ил.
| Прибор для сличения низких частот | 1959 |
|
SU124874A1 |
| US 4680260, 14.07.1987 | |||
| СПОСОБ ПРОМЫШЛЕННОГО ПОЛУЧЕНИЯ ЧЕЛОВЕЧЕСКОГО ЛЕЙКОЦИТАРНОГО ИНТЕРФЕРОНА-АЛЬФА-2 | 1996 |
|
RU2118366C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PIF16, КОДИРУЮЩАЯ ЗРЕЛЫЙ ЛЕЙКОЦИТАРНЫЙ ИНТЕРФЕРОН α ЧЕЛОВЕКА, ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ ЗРЕЛОГО ЛЕЙКОЦИТАРНОГО ИНТЕРФЕРОНА α ЧЕЛОВЕКА | 1992 |
|
RU2054041C1 |
Авторы
Даты
2003-05-10—Публикация
2002-01-15—Подача