Изобретение относится к области биотехнологии и генетической инженерии и может быть использовано при производстве препаратов на основе человеческого тромбоцитарного фактора роста (PDGF-BB).
Тромбоцитарный фактор роста человека представляет собой сильноосновной белок с подвижностью в ПААГ-SDS, соответствующей молекулярной массе 28-39 kDa. Белок состоит из двух идентичных полипептидных цепей (В-цепь), соединенных дисульфидными связями. Синтез и процессинг PDGF-BB осуществляется в мегакариоцитах - клетках костного мозга, предшественниках тромбоцитов - и запасается в альфа-гранулах кровяных пластинок. Пока тромбоцитарный фактор роста находится внутри тромбоцитов, он недоступен для других клеток, однако при взаимодействии с тромбином происходит активация кровяных пластинок с последующим высвобождением содержимого в сыворотку. Кровяные пластинки являются главным источником тромбоцитарного фактора роста в организме, но вместе с тем показано, что некоторые другие клетки, в основном клетки мезенхимального происхождения, также могут синтезировать и секретировать этот фактор (Heldin С.Н., Westermark В. 1999, 79(4): 1283-1316). Секретируемый PDGF-BB индуцирует направленное перемещение (хемотаксис) лейкоцитов полиморфноядерных нейтрофилов (осуществляющих защиту от гноеродных бактерий), гранулоцитов, макрофагов. Для стимуляции их направленного движений достаточно внешней концентрации PDGF 1-2 нг/мл (Siegbahn A. Et al., J.Clin. Invest., 1990, 85(3):916-920). Далее в процесс вовлекаются клетки соединительной ткани, ответственные за образование рубца: стимулируются пролиферация фибробластов и их направленное перемещение, а также синтез и секреция белков внеклеточного матрикса.
В настоящее время препараты тромбоцитарного фактора роста человека (Becaplermin = 0.01% Regranex gel) применяются для ранозаживления (Nagai & Embil, Expert. Opin. Biol. Ther., 2002, Feb; 2 (2):211-218). Ограничительным моментом использования препаратов, содержащих PDGF-BB, является их высокая цена, обусловленная дорогостоящими технологиями. Поэтому разработка оптимальных методов получения тромбоцитарного фактора роста является приоритетной задачей в настоящее время. Важными проблемами при создании эффективного способа получения PDGF-BB являются недостаточно высокий уровень экспрессии биологически активного белка и низкая степень димеризации синтезируемых полипептидных В-цепей. На решение этих задач и направлено предложенное изобретение.
Предшествующий уровень техники
Как уже было сказано, молекула тромбоцитарного фактора роста человека состоит из двух идентичных полипептидных цепей (В-цепей), соединенных дисульфидными связями. Как было установлено, PDGF-B-цепь подвергается протеолитическому процессингу в процессе созревания, образуя конечный продукт, состоящий из 109 аминокислот. В настоящее время известны способы получения тромбоцитарного фактора роста человека в бактериальных и дрожжевых экспрессионных системах. В клетках E.coli удалось достичь высоких уровней экспрессии белка - предшественника PDGF-BB, однако в указанных бактериальных клетках отсутствуют протеазы, участвующие в процессе созревания белка. Поэтому для получения зрелой формы белка тромбоцитарного фактора роста появляется необходимость в проведении дополнительных стадий способа, что приводит к значительному повышению стоимости конечного продукта. В клетках дрожжей, в отличие от E.coli, имеются протеазы, способные расщеплять рекомбинантный белок и приводить, таким образом, к появлению зрелого белка. Поэтому использование клеток дрожжей для экспрессии и секреции PDGF-BB вполне оправдано. В настоящий момент предложены способы получения рекомбинантных аналогов PDGF в клетках дрожжей S.cereviside (патенты US 4766073, опубл. 23.08.1989, и US 4845075, опубл. 04.07.1989). В патенте US 4766073 описывается способ получения в дрожжах рекомбинантного димерного белка, гомологичного А- и В- цепям PDGF. В патентном документе US 4845075 раскрывается получение в дрожжевых клетках димерного полипептида, гомологичного PDGF-BB. Вместе с тем было обнаружено, что в дрожжевых системах протеазы могут расщеплять рекомбинантный PDGF-B не только в нужных сайтах, обусловливающих созревание белка, но и в других участках аминокислотной последовательности. В связи с чем встают проблемы оптимизации кодонов и возможности использования укороченных последовательностей В-цепи. Кроме того, уровни экспрессии рекомбинантных белков в дрожжах заметно ниже, чем в клетках E.coli. В связи с этим возникает необходимость разработать стратегию, обеспечивающую высокий уровень экспрессии биологически активной зрелой формы белка человеческого тромбоцитарного фактора роста.
Раскрытие изобретения
Настоящее изобретение направлено на создание штамма Pichia pastoris - суперпродуцента тромбоцитарного фактора роста человека и на способ получения рекомбинантного PDGF-BB с использованием этого штамма. Использование для гетерологичной экспрессии метилотрофных дрожжей Pichia pastoris представляет особый интерес. Достоинствами этих дрожжей является накопление значительной биомассы при культивировании на недорогих минеральных питательных средах и более высокий уровень синтеза рекомбинантных белков (Sreekrishna К. et al., J.Basic.Microbiol, 1988, v.28, р.265-278).
Задачей настоящего изобретения является разработка эффективного способа получения зрелой димерной формы PDGF-BB с высоким выходом во внеклеточную среду в дрожжевой экспрессионной системе.
Технический результат состоит в получении устойчивого штамма Р.pastoris 2-2 - суперпродуцента димерной формы PDGF-BB и в создании высокоэффективного, упрощенного способа получения PDGF-BBC чистотой свыше 95% и удельной активностью в 3-5 ED50/НГ.
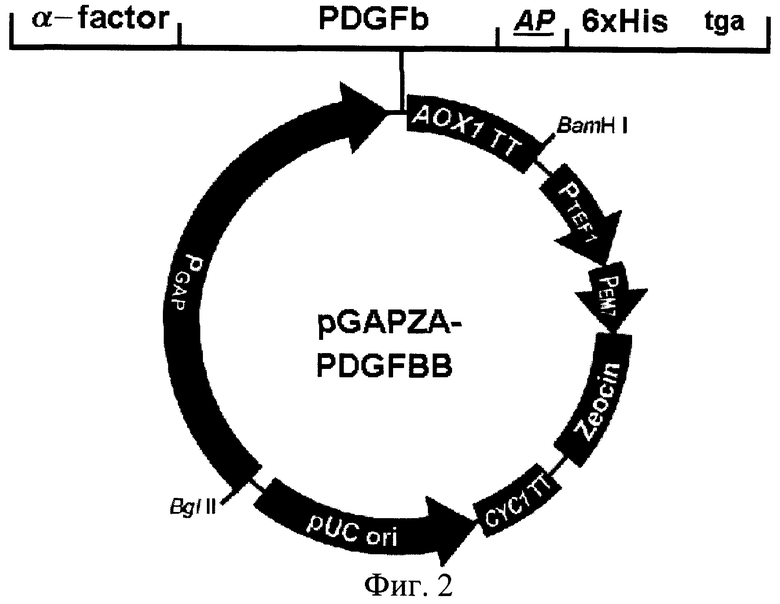
Поставленная задача решается путем создания ДНК-конструкции, pGAPZA-PDGFbb, следующего состава:
5' - P-SP-PDGFb-AP-6xHis - 3', где
Р - промоторная последовательность гена глицеральдегид-3-фосфат дегидрогеназы или гена алкоголь оксидазы;
SP - нуклеотидная последовательность, кодирующая сигнальный пептид Saccharomyces cerevisiae, α-фактор;
PDGFb - нуклеотидная последовательность гена тромбоцитарного фактора роста-b человека;
АР - синтетическая последовательность, кодирующая пептид, способствующий димеризации полипептидов;
6xHis - последовательность, кодирующая 6 остатков гистидина, формирующих металл-связывающий сайт, которую используют для получения штамма Р.pastoris 2-2 суперпродуцента PDGF-BB.
Последовательность PDGFB получали путем реакции обратной транскрипции и последующей ПЦР. В качестве матрицы использовали мРНК человеческих диплоидных фибробластов. Амплифицированный фрагмент клонировали в вектор pUC 128 и секвенировали (фиг.1). кДНК PDGF-B в pUC128 использовали для последующего клонирования в дрожжевые экспрессионные вектора рР1С9К и pGAPZA, несущие синтетическую последовательность, кодирующую домен димеризации полипептидов (АР), и последовательность, кодирующую 6 остатков гистидина (6xHis) (фиг.2). Затем отбирались конструкции, кодирующие аминокислотную последовательность зрелого белка и отличающиеся присутствием или отсутствием AP-6xHis доменов в составе конечного продукта. Для получения штамма-продуцента PDGF-BB созданными ДНК-конструкциями трансформировали компетентные клетки штаммов Pichia pastories X33 (дикий тип), GS115 (his4 генотип) и КМ71 (his4, aox1:arg4 генотип) и проводили их тестирование на способность к эффективной экспрессии зрелой димерной формы PDGF-BB.
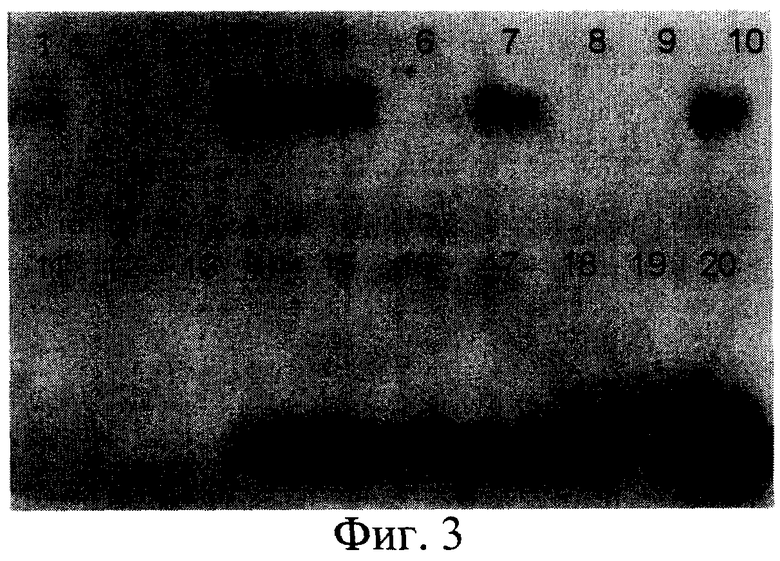
Контроль экспрессии тромбоцитарного фактора роста человека осуществляли путем электрофоретического разделения белков в полиакриламидном геле (SDS-PAGE) с последующим переносом их на нитроцеллюлозную мембрану (Western blot) и селективным окрашиванием рекомбинантного белка с помощью антител к PDGF-BB (фиг.3). По результатам тестирования был отобран штамм Pichia pastoris 2-2 - суперпродуцент PDGF-BB, который экспрессировал в культуральную среду тромбоцитарный фактор роста с образованием димерной формы, при этом выход белка составлял 70-100 мкг/л.
Полученный штамм Pichia pastoris 2-2 - продуцент человеческого рекомбинантного тромбоцитарного фактора роста человека характеризуется следующими признаками.
Морфологические признаки. Клетки округлой, слегка овальной формы, размером около 5 мкм, часть клеток имеет на поверхности почки или соединена с дочерними клетками.
Культуральные признаки.
Клетки хорошо растут на полной органической среде YEPD - 2% пептона, 1% дрожжевого экстракта, 2% глюкозы или 1% глицерина.
Кроме того, клетки хорошо растут на минеральной среде SC: 1,34% Yeast Nitrogen Base ("Difco", США), 2% глюкозы (1% глицерина, 0,5% метанола), а также на других синтетических средах для дрожжей.
При росте на твердых средах клетки образуют гладкие, круглые колонии с матовой поверхностью, белого цвета, край ровный.
При росте в жидких средах образуют интенсивную ровную суспензию. Культура имеет характерный запах метилотрофных дрожжей.
Время удвоения числа клеток в процессе их роста в суспензии в среде YPD составляет 2 часа. Культура клеток в среде YPD без подпитки вырастает до плотности 35-40 OD600.
Физиолого-биохимические признаки.
Клетки растут в пределах от 4 до 37°C. Оптимальной температурой выращивания является 28-30°C. Температуры выше 32°C неблагоприятны для продуктивности. При росте в аэробных условиях клетки незначительно защелачивают среду. Оптимум рН для роста составляет 4,5-7,0.
В качестве источника углерода клетки могут использовать многие простые соединения, такие как: глюкоза, глицерин, метанол.
В качестве источника азота клетки могут использовать минеральные соли в аммонийной форме, аминокислоты, мочевину.
Клетки способны к аэробному и анаэробному росту. Продуктивность зависит от содержания кислорода в среде.
В качестве источника углерода клетки могут использовать многие простые соединения, такие как: глюкоза, глицерин, метанол.
Клетки способны к аэробному и анаэробному росту.
Полученные клетки штамма дрожжей Pichia pastoris 2-2 продуцируют PDGF-BB в количестве 70-100 мкг/л культуральной среды.
Полученный штамм хранится в коллекции ООО «Биогениус»
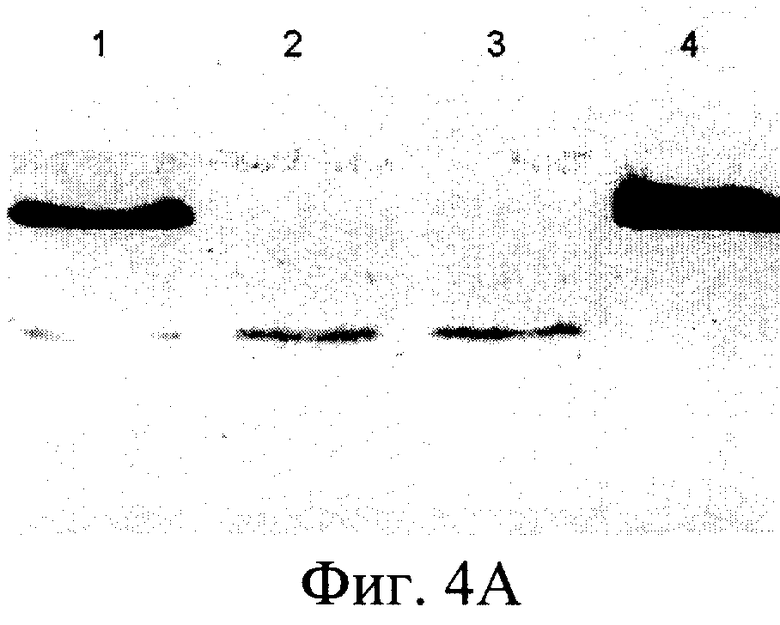
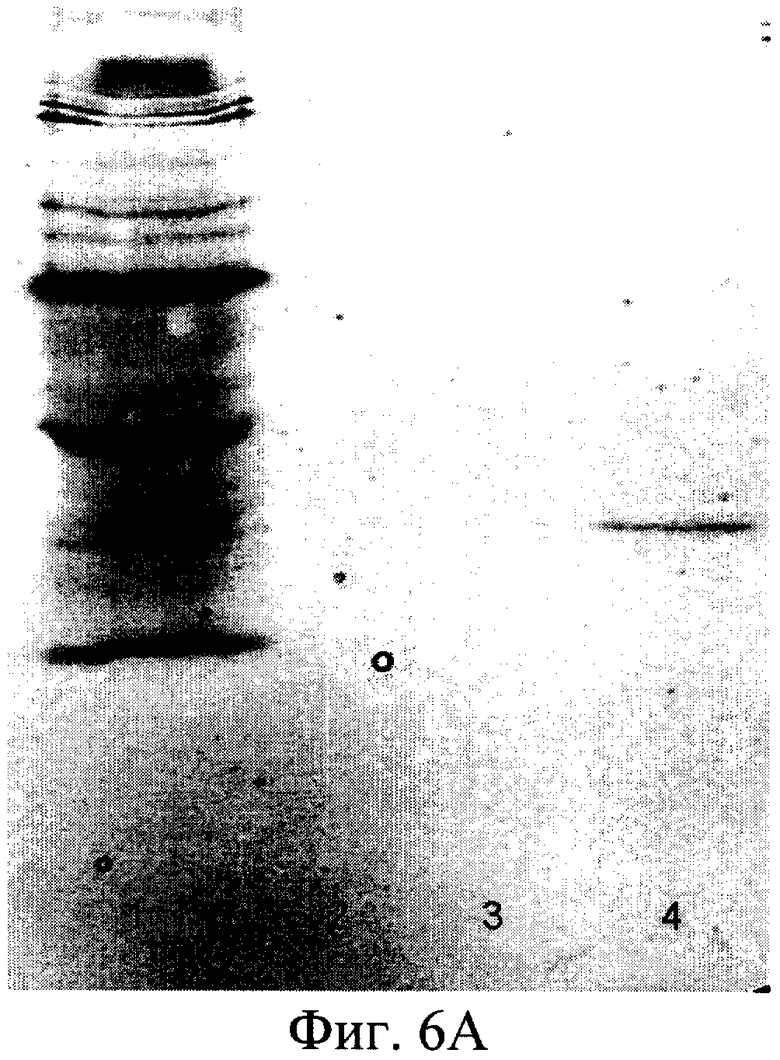
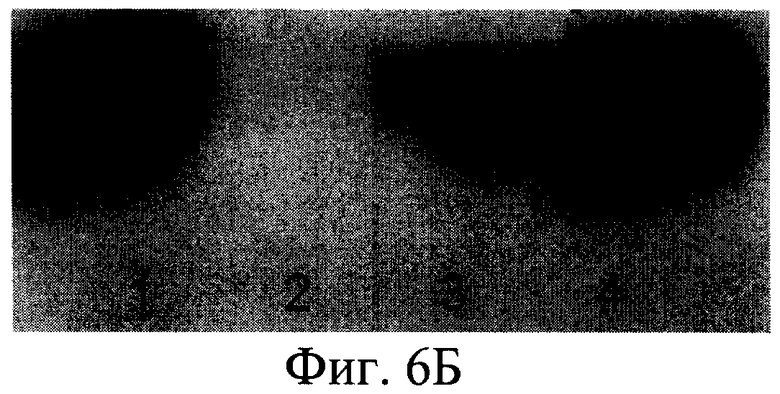
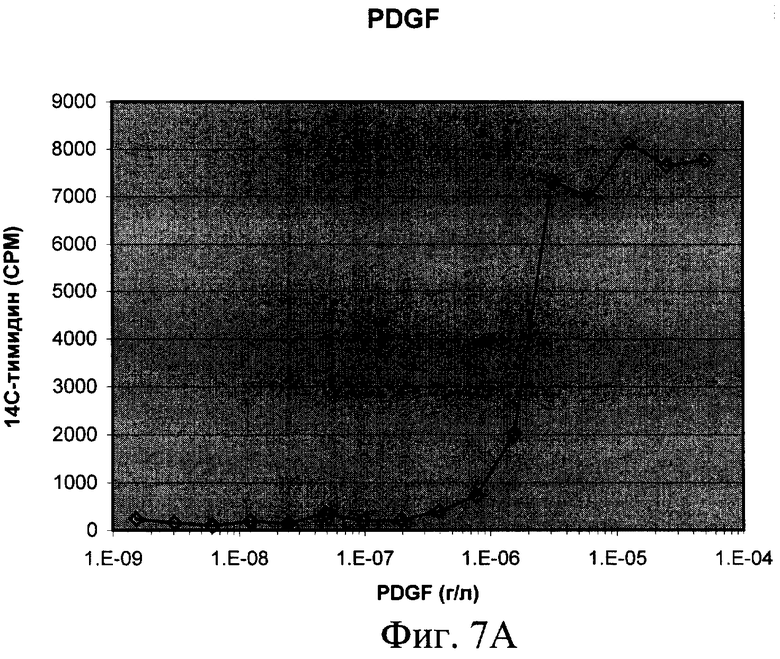
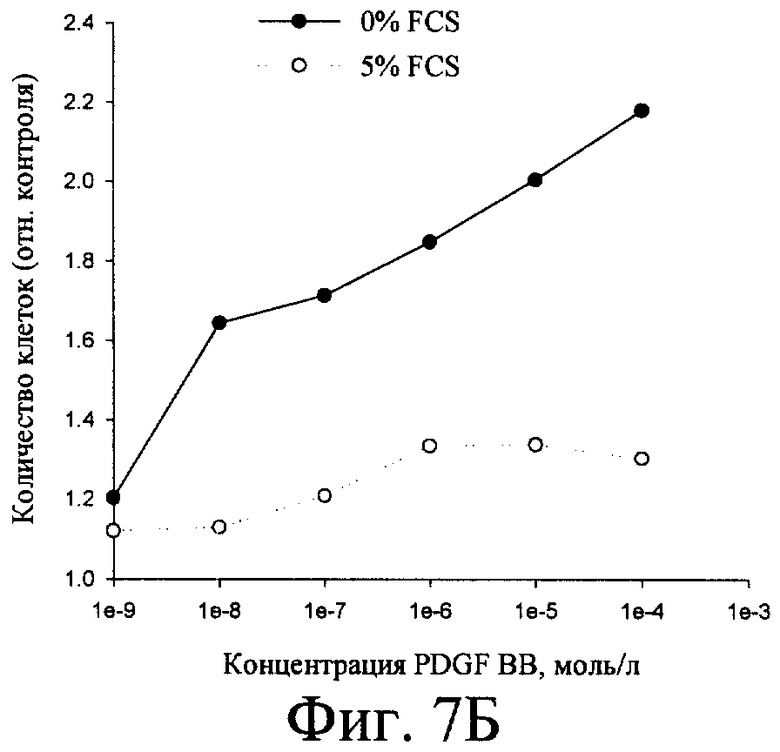
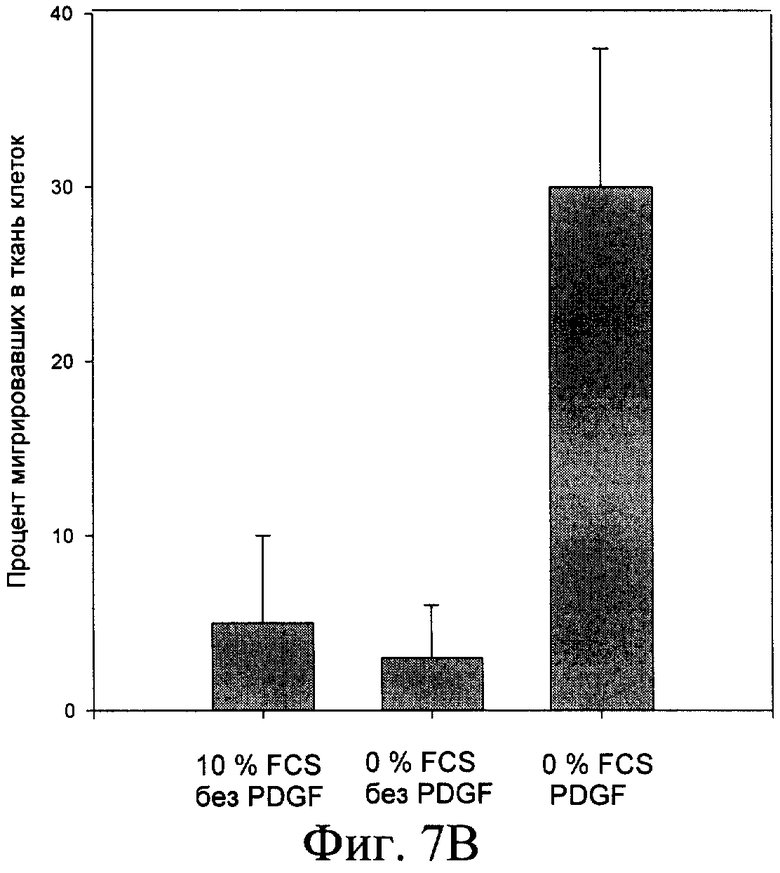
Согласно изобретению штамм дрожжей Pichia pastoris 2-2, трансформированный вышеописанной ДНК-конструкцией, использовали в способе получения человеческого рекомбинантного тромбоцитарного фактора роста. Предложенный способ предусматривает стадию культивирования штамма дрожжей Pichia pastoris 2-2 в условиях, обеспечивающих экспрессию белка PDGF-BB в культуральную среду. Клетки из выросших на селективной среде колоний переносили в колбы и культивировали в 5 мл среды YPD на качалке (250 rpm) в течение 3 суток до OD600 30-35. После этого клетки осаждали центрифугированием при 3000 g 10 мин. Супернатант отбирали и 10 мкл смешивали с sample-буфером и проводили электрофорез в SDS-PAAG для анализа экспрессии PDGF-BB. Затем производили извлечение белка PDGF-BB из культуральной среды и его очистку известными способами (концетрирование, аффинной хроматографией и т.п.). Для упрощения выделения и очистки рекомбинантного белка в его состав были введены гексагистидиновые последовательности, позволяющие очистить его в одну стадию с помощью аффинной хроматографии на металлохелатном сорбенте (фиг.4). Полученный PDGF-BB очищали путем концентрирования и проведения колоночной хроматографии - ионообменной на КМ-сефарозе и/или аффинной хроматографии на металлохелатном сорбенте. Аффинную храмотографию проводили с сорбентом на основе нитрилуксусной кислоты, заряженным ионами Ni 2+ (смола His-bind (Novagen Inc., USA)), который используется для связывания белков, имеющих рядом расположенные гистидиновые остатки. Для увеличения времени жизни (работоспособности) ионообменной и/или аффинной смолы, а также повышения степени очистки, в процесс очистки PDGF-BB после концентрирования включают стадию тепловой денатурации белка путем прогревания концентрированного препарата PDGF-BB на водяной бане при 100°С в течение 2-х минут (фиг.5). Активность полученной рекомбинантной формы PDGF-BB проверяли несколькими способами (Raines E.W., Ross R.J. Biol. Chem., 1982, 257(9):5154-5160) (фиг.6). В первом варианте клетки высевали в 96 луночные планшеты (плотность посева 10 тыс./см2) в среде с 10% сыворотки, культивировали 5 сут до истощения ростфакторов в среде, затем добавляли образцы, либо 10% сыворотки. Через 20 ч сменяли среду на свежую с 5% FCS и 14С-тимидином, еще через 2 ч клетки фиксировали ТХУ и определяли радиоактивность образцов. Другой способ заключался в том, что клетки высевали в 96 луночные планшеты (плотность посева 10 тыс./см2, OD 0.15-0.2) в среде с 10% сыворотки, через сутки делали замену среды на свежую с различным содержанием сыворотки, культивировали 2 суток, фиксировали и окрашивали кристаллическим фиолетовым, заливали 1% раствором ДМСО и фотометрировали (570 нм). Для оценки хемотаксической активности культуру гладкомышечных клеток, полученную из аорты крысы линии Wistar, высевали на девитализированные стенки аорты свиньи, предварительно инкубированные в среде ДМЕ с 2% супернатанта культуры трансформированных дрожжевых клеток Pichia pastoris, продуцирующих PDGF ВВ. После культивирования ткани с посеянными клетками окрашивали смесью красителей Hoechst 33342 и этидиум бромид, и на люминесцентном микроскопе оценивали число живых клеток, мигрировавших в тканевой матрикс.
Таким образом, согласно изобретению, созданная ДНК-конструкция в составе штамма Pichia pastoris 2-2 позволяет получать димерную форму рекомбинантого PDGF-BB с чистотой выше 95% и удельной активностью в 3-5 ED50/нг, в сочетании с высоким уровнем экспрессии в дрожжах (до 0.1 г/л культуры). Дополнительно включение АР-и 6xHis-доменов в использованную ДНК-конструкцию привело к значительному упрощению выделения рекомбинантного белка за счет использования высокотехнологичной аффинной хроматографии на металлохелатном носителе.
На фиг.1 представлена нуклеотидная последовательность PDGF-B; на фиг.2 - физическая карта плазмиды, содержащей полученную ДНК-конструкцию; на фиг.3 - результаты анализа белков, полученных от различных штаммов; на фиг.4 - результаты электрофореза и иммунохимического анализа PDGF-BB, очищенного с помощью металло-аффинной смолы; на фиг.5 - эффект тепловой денатурации концентрированной культуральной среды, содержащей PDGF-BB; на фиг.6 - результаты электрофореза и иммунохимического анализа PDGF-BB, очищенного с помощью ионообменной хроматографии на КМ-сефарозе; на фиг.7 - результаты определения активности PDGF-BB, полученного из заявленного штамма.
Изобретение иллюстрируется следующими примерами.
Пример 1. Клонирование кДНК-PDGFB
Последовательность PDGFB была получена с помощью реакции обратной транскрипции и последующей ПЦР в присутствии праймеров PDGFB-1 (5'-ATA GGA ТСС ATG ААТ CGC TGC TGG GC 3') и PDGFB-2 (5'- TAT CTC GAG GGC ТСС AAG GGT CTC С 3'). В качестве матрицы использовали мРНК человеческих диплоидных фибробластов. Амплифицированный фрагмент клонировали в вектор pUC 128 (Invitrigene) и секвенировали. Полученная последовательность имела следующий состав:
GGATCCATGAATCGCTGCTGGGCGCTCTTCCTGTCTCTCTGCTGCT ACCTGCGTCTGGTCAGCGCCGAGGGGGACCCCATTCCCGAGGAGCTTTATG AGATGCTGAGTGACCACTCGATCCGCTCCTTTGATGATCTCCAACGCCTGC TGCACGGAGACCCCGGAGAGGAAGATGGGGCCGAGTTGGACCTGAACATG ACCCGCTCCCACTCTGGAGGCGAGCTGGAGAGCTTGGCTCGTGGAAGAAG GAGCCTGGGTTCCCTGACCATTGCTGAGCCGGCCATGATCGCCGAGTGCAA GACGCGCACCGAGGTGTTCGAGATCTCCCGGCGCCTCATAGACCGCACCA ACGCCAACTTCCTGGTGTGGCCGCCCTGTGTGGAGGTGCAGCGCTGCTCCG GCTGCTGCAACAACCGCAACGTGCAGTGCCGCCCCACCCAGGTGCAGCTG CGACCTGTCCAGGTGAGAAAGATCGAGATTGTGCGGAAGAAGCCAATCTT TAAGAAGGCCACGGTGACGCTGGAAGACCACCTGGCATGCAAGTGTGAGA CAGTGGCAGCTGCACGGCCTGTGACCCGAAGCCCGGGGGGTTCCCAGGAG CAGCGAGCCAAAACGCCCCAAACTCGGGTGACCATTCGGACGGTGCGAGT CCGCCGGCCCCCCAAGGGCAAGCACCGGAAATTCAAGCACACGCATGACA AGACGGCACTGAAGGAGACCCTTGGAGCCCTCGAG
(жирным шрифтом выделены последовательности праймеров)
кДНК PDGF-B в pUC 128 использовали для последующего клонирования в дрожжевые экспрессионные вектора рР1С9К и pGAPZA (Invitrogene), несущие синтетическую последовательность, кодирующую домен димеризации полипептидов (АР), и последовательность, кодирующую 6 остатков гистидина (6xHis): -CATCATCATCATCATCAT-. Были выбраны конструкции, кодирующие аминокислотную последовательность зрелого белка и отличающиеся присутствием или отсутствием AP-6xHis доменов в составе конечного продукта. Были использованы праймеры PDGFBB-1 (5'-АТА GAA TTC AGC CTG GGT ТСС СТО АСС 3'), PDGFBB-2 (5'-ATA GCG GCC GCG GTC ACT CGA GTT TGG 3') в одном случае (AP-6xHis домены) и PDGFBB-1 (5'-АТА GAA TTC AGC CTG GGT ТСС CTG АСС 3'), PDGFBBS-2 (5'-ATA GCG GCC GCC TAG GTC ACT CGA G 3') в другом (без AP-6xHis доменов).
Пример 2. Подготовка клеток к трансформации
Были проведены культивирование и заморозка 3 штаммов клеток Pichia pastoris, дикий тип ХЗЗ, GS115 (his4 генотип), КМ71 (his4, aox1:arg4 генотип). Клетки высевали в стерильных условиях на агар в среде YPD (1%-ный дрожжевой экстракт, 2%-ный пептон, 2%-ная глюкоза, 1 мМ дитиотрейтол), культивировали при 30°С, затем пересевали в суспензию и культивировали ночь. Время удвоения числа в среде YPD всех клонов составляло 2 часа. Часть клеток суспендировали в YPD среде с добавлением 15% глицерина и замораживали при -86°С. Для получения компетентных клеток предварительно выращивали колонии клеток в чашке с агаром в YPD среде при 30°С в течение 2 дней. Затем содержимое одной колонии выращивали в 10 мл YPD среды при 30°С в течение ночи. Разбавляли суспензию в YPD до плотности ОД600 0.2 и конечного объема 10 мл и выращивали культуру до ОД600 0-8 в течение 4 часов. Суспензию клеток центрифугировали 5 мин при 500 g, выливали супернатант, суспендировали в 10 мл раствора I из указанного ниже набора для трансформации, вновь центрифугировали и суспендировали осадок в растворе I, после чего клетки были компетентны к трансформации. Аликвоты компетентных клеток по 50-200 μ1 разливали в стерильные пробирки объемом 1.5 мл, которые хранили при температуре -86°С до использования.
Пример 3. Трансформация компетентных клеток.
Для трансформации использовали EasyComp Transformation Kit, входящий в состав Pichia Easy Select Kit (Invitrogen).
К 50 μ1 компетентных клеток добавляли 3 μg (в 4 μ1) ДНК-конструкции, 1 мл раствора II из набора, перемешивали встряхиванием, инкубировали в течение 1 часа при 30°С, перемешивая раствор каждые 15 мин. Затем раствор инкубировали 10 мин при 42°С, разделяли на 2 микропробирки по 525 μ1, добавляли в каждую по 1 мл среды YPD и инкубировали 60 мин при 30°С для приобретения клетками резистентности к зеоцину. После этого клетки центрифугировали 5 мин при 3000g, ресуспендировали в растворе III, добавляя его в каждую пробирку по 500 μ1, сливали суспензию из 2 пробирок в одну, вновь центрифугировали и ресуспендировали осадок в 150 мл раствора III. Полученную суспензию клеток рассевали в стерильную чашку (80 мм) на агаровый гель, приготовленный на среде YPD с добавлением 1М сорбитола (YPDS) и антибиотика зеоцина в конечной концентрации 100 мкг/мл. Через 3 суток получали несколько десятков колоний на чашку. Клетки из колоний, а также клетки Х33, трансформированные «пустым», т.е. не содержащим вставку вектором, переносили на чашку с MMD (minimal medium dextrose)-агаром, расчерченную на 50 пронумерованных квадратов, и культивировали чашку 2 дня при 30°C. После этого чашку с культурами использовали для выращивания клеток в суспензии и их последующего тестирования.
Пример 4. Контроль экспрессии рекомбинантного белка в полученных штаммах.
Контроль экспрессии PDGF осуществляли путем электрофоретического разделения белков в полиакриламидном геле (SDS-PAGE) с последующим переносом их на нитроцеллюлозную мембрану (Western blot) и селективным окрашиванием рекомбинантного белка с помощью антител к PDGF-BB. Для этого клетки из выросших на селективной среде колоний переносили в колбы и культивировали в 5 мл среды MGY на качалке (250 rpm) в течение 1 суток до OD600 5. После этого клетки осаждали центрифугированием при 3000 g 10 мин. Для электрофореза использовали оборудование фирмы Bio-Rad и реактивы ICN. Супернатант и внутриклеточные белки (лизат клеток) смешивали с буфером для нанесения и вносили по 10 мкл в лунки концентрирующего геля. Разделение осуществлялось при напряжении 150В в течение часа. Затем гель аккуратно извлекали и осуществляли перенос белковых полос из геля на нитроцеллюлозную мембрану с помощью аппарата фирмы Bio-Rad по стандартному протоколу. После окончания переноса мембрану окрашивали с помощью антител согласно рекомендациям производителя (Amersham Biosciences). Были отобраны штаммы, для которых выявлено наличие на электрофореграммах полос, соответствующих молекулярной массе PDGF-B и окрашенных антителами к PDGF-BB, что указывает на продукцию PDGF-BB. Уровень синтеза белка PDGF-BB определяют, сравнивая интенсивность окрашивания полосы рекомбинантного белка с полосой соответствующего белка - стандарта молекулярной массы. В результате из 20 штаммов-продуцентов, согласно полученным данным (см. фиг.3), был отобран штамм Pichia pastoris 2-2, клетки которого синтезируют 70-100 мг белка на литр культуры дрожжей.
Пример 5. Очистка рекомбинантного PDGF-BB и оценка биологической активности.
1) Концентрирование. После осаждения клеток среду культивирования фильтровали через фильтр с диаметром пор 45 мкм, затем добавляли Трис-HCl рН 6.0 до конечной концентрации 20 мМ. Среду культивирования, содержащую белок PDGF-BB, концентрировали в 5-10 раз, используя концентраторы для белков с молекулярной массой более 10 кДа фирмы "Millipore".
2) Тепловая денатурация. После концентрирования препарат PDGF-ВВ нагревали на водяной бане до кипения (t=100°C) и кипятили 2 минуты, после чего центрифугировали при 4°С, 15000×g 15 минут.
3) Ионообменная хроматография на КМ-сефарозе. Колонку с КМ-сефарозой уравновешивали буфером, содержащим 20 мМ Трис-HCl рН 6.0. Препарат PDGF-BB наносили со скоростью 60 мл/час. Колонку промывали 20 мМ Трис-HCl рН 6.0; 20 мМ Трис-HCl рН 6.0, 200 мМ NaCl. Элюцию проводили 20 мМ Трис-HCl рН 6.0, 1 М NaCl и собирали фракции по 1 мл.
4) Аффинная хроматография на колонке со смолой His-bindR. Колонку с носителем промывали буфером, содержащим 50 мМ фосфат рН 8.0, 500 mM NaCl. Препарат PDGF-BB, полученный после концентрирования или ионообменной хроматографии, разбавляли в 2 раза, добавляли фосфат рН 8.0 до концентрации 50 мМ и наносили на колонку. После промывки колонки буфером нанесения балластные белки удаляли промывкой раствором 20 мМ имидазола в том же буфере. PDGF-BB элюировали раствором, содержащим 200 мМ имидазола.
5) Оценка биологиченской активности
А) Клетки высевали в 96 луночные планшеты (плотность посева 10 тыс./см2) в среде с 10% сыворотки, культивировали 5 сут до истощения ростфакторов в среде, затем добавляли образцы, либо 10% сыворотки. Через 20 ч сменяли среду на свежую с 5% FCS и 14С-тимидином, еще через 2 ч клетки фиксировали ТХУ и определяли радиоактивность образцов.
Б) Клетки высевали в 96 луночные планшеты (плотность посева 10 тыс./см2, OD 0.15-0.2) в среде с 10% сыворотки, через сутки делали замену среды на свежую с различным содержанием сыворотки, культивировали 2 суток, фиксировали и окрашивали кристаллическим фиолетовым, заливали 1% раствором ДМСО и фотометрировали (570 нм).
В) В результате был получен припарат человеческого рекомбинантного тромбоцитарного фактора роста (PDGF ВВ) с чистотой свыше 95% и удельной активностью 3-5 ED50/нг. Для оценки хемотаксической активности культуру гладкомышечных клеток, полученную из аорты крысы линии Wistar, высевали на девитализированные стенки аорты свиньи, предварительно инкубированные в среде ДМЕ с 2% супернатанта культуры трансформированных дрожжевых клеток Pichia pastoris, продуцирующих PDGF ВВ. После культивирования ткани с посеянными клетками окрашивали смесью красителей Hoechst 33342 и этидиум бромид, и на люминесцентном микроскопе оценивали число живых клеток, мигрировавших в тканевой матрикс.
Одним из преимуществ предлагаемого способа получения рекомбинантного PDGF-BB является также высокая технологичность процесса очистки белка, обусловленная простыми процедурами выделения, относительно невысокой стоимостью используемых смол и высоким выходом активного белка в результате очистки.
Суммируя вышесказанное можно заключить, что полученный штамм дрожжей Pichia pastoris 2-2 синтезирует PDGF-BB в количестве, достаточном для его выделения в промышленном масштабе. В результате полученный высококачественный рекомбинантный PDGF-BB, может быть пригоден в качестве фармацевтического препарата для лечения дефектов мягких тканей и кожных покровов любой локализации и любого происхождения (инфекционные, травматические, ожоговые, последствия хирургического вмешательства и т.д.).


Изобретение относится к области генной инженерии, конкретно к получению препарата на основе тромбоцитарного фактора роста человека (PDGF-BB), и может быть использовано в терапевтических, ветеринарных целях, в диагностике, для получения реагентов, для культивирования тканей. Штамм Pichia pastoris 2-2 - продуцент тромбоцитарного фактора роста человека используют в способе получения PDGF-BB. Изобретение позволяет получать димерную форму PDGF-BB с чистотой свыше 95% и удельной активностью в 3-5 ED50/нг, в сочетании с высоким уровнем экспрессии в дрожжах (до 0.1 г/л культуры). 2 н. и 3 з.п. ф-лы, 11 ил.
| US 4845075, 04.07.1989 | |||
| US 4766073, 23.08.1988 | |||
| А..И.ЛО- ,! '^ Г!:х;:,и.::скл>&г ^^ | 0 |
|
SU183070A1 |
| WITTRUP K.D., Existence of an optimum expression level for secretion of foreign proteins in yeast, Ann | |||
| N | |||
| Y | |||
| Acad | |||
| Sci., 1994, 745, p.321-330 | |||
| NAGAI M.K | |||
| et al., Becaplermin: recombinant platelet derived growth factor, a new treatment for healing diabetic foot ulcers, Expert | |||
Авторы
Даты
2006-12-27—Публикация
2005-06-02—Подача