Область техники
Изобретение относится к биотехнологии, в частности к средствам для доставки активного агента, содержащим стабилизатор липосомальных суспензий. Стабилизатор представляет собой хитозан молекулярной массы 15-120 кДа, модифицированный цепями полиэтиленгликоля или остатками фолиевой кислоты. Изобретение может быть использовано в системах фармацевтического назначения, как стабилизатор липосом, загруженных различными лекарственными препаратами. Комплексы липосом с данным стабилизатором могут быть использованы как системы доставки лекарственных препаратов.
Уровень техники
Липосомы представляют собой частицы, которые образованы одним или несколькими концентрическими замкнутыми липидными бислоями, внутренний объем которых изолирован от внешней среды. В зависимости от размера частиц и числа образующих их липидных слоев различают следующие липосомы: 1) малые моноламеллярные, образованные одиночным липидным бислоем (диаметр 20-50 нм); 2) крупные моноламеллярные (макровезикулярные), образованные также одиночным бислоем (диаметр 50-200 нм и выше); 3) многослойные (мультиламеллярные), насчитывающие до несколько десятков и даже сотен липидных бислоев (диаметр до 5000-10000 нм).
Липосомы представляются перспективными системами для доставки лекарственных средств. Липосомы обладают рядом значительных преимуществ, таких как биосовместимость, низкая имунногенность [Yasuda, Т., Dancey, G.F., Kinsky, S.С. Immunogenicity of liposomal model membranes in mice: Dependence on phospholipid composition. // Proc. Natl. Acad. Sci USA: Immunology 1977, V. 74, p. 1234-1236]. Размер липосом позволяет им более эффективно проникать в опухоли. При этом опухоль не имеет собственной лимфатической системы, что приводит к накоплению лекарственного препарата. Схожесть по химическому составу липосом с клеточными мембранами обеспечивает эффективную внутриклеточную доставку. Следует также отметить, что липосомы могут служить системами доставки как гидрофобных веществ, так и гидрофильных лекарств в виду амфифильной природы липидов.
Однако до сих пор применение липосом в медицине ограничено вследствие низкой термодинамической стабильности липосом, склонности к агрегации и окислению. Было установлено, что включение лекарственных препаратов в липосомы может ускорить процесс разрушения мембраны [Fonseca М, van Winden Е., Crommelin D. Doxorubicin induces aggregation of small negatively charged liposomes. // Eur. J. Pharm and Biopharm. 1997, V. 43, p. 9-17]. Более того, ряд препаратов, часто использующихся в химиотерапии, характеризуется низкой эффективностью загрузки [Abraham S., Waterhouse D.N., Mayer L.D, Cullis P.R, Madden T.D., Bally M.B. The liposomal formulation of doxorubicin. // Methods in enzymology 2005, V. 331, p. 71-97].
Липосомы как коллоидные системы с термодинамической точки зрения нестабильны и находятся под влиянием кинетического контроля [Ulrich A. Biophysical aspects of using liposomes as delivery vehicles. // Bioscience reports 2002, V. 22, p. 129-150.]. Таким образом, липосомальные системы стабильны при разбавлении, в отличие от мицеллярных систем или микроэмульсий [Chung Н., Kim T.W., Kwon М., Kwon I.C., Jeong S.Y. Oil components modulate physical characteristics and function of the natural oil emulsions as drug or gene delivery system. // J. Control. Release 2001, V. 71, p. 339-350]. Согласно теории Дерягина - Ландау - Фервея - Овербека (ДЛФО) стабильность системы в растворе электролитов достигается, когда электростатическое отталкивание между двумя заряженными частицами превышает по модулю значение силы Ван-дер-Ваальса. Заряженные липосомы медленнее агрегируют в растворах с низкой ионной силой [Ulrich A. Biophysical aspects of using liposomes as delivery vehicles. // Bioscience reports 2002, V. 22, p. 129-150], в то время как в растворах с высокой концентрацией липидов или в присутствии многозарядных ионов, например Са2+ наблюдается агрегация [Lasic D.D. Liposomes in Gene Delivery. Boca Raton: CRC Press, 1997, 303 р]. Таким образом, на стабильность липосом влияют два основных процесса: агрегация и слияние [Riaz М. Review article: stability and uses of liposomes. // Pakistan j pharm sci 1995, V. 8, p. 69-79].
С другой стороны, при хранении липиды могут подвергаться окислению. Липосомы могут храниться замороженными в форме лиофилизованного порошка, однако для предупреждения фазовых переходов и повреждения мембраны необходимо использовать криопротекторы, такие как мочевина. Даже при условии использования криопротекторов каждую новую порцию липосом, полученных из подобного порошка, необходимо изучать для определения размера и морфологии, что делает такой метод хранения удобным только при редком использовании липосом.
Следует учитывать влияние среды на стабильность липосом. Если in silica и in vitro основными факторами, влияющими на стабильность липосом, являются липидный состав и температура, то в системах in vivo обнаруживается множество факторов, способных также оказывать влияние на стабильность липосом. Так, было показано, что в крови липиды из липосом способны переходить к липопротеинам плазмы. Особенно этот эффект был заметен для липидов с одной углеводородной цепью или содержащих короткие цепи и липосом в жидкокристаллической фазе.
Из уровня техники известен способ стабилизации липосомальных систем на основе так называемых Stealth липосом [Immordino М., Dosio F., Cartel L. Stealth liposomes: review of the basic science, rationale, and clinical applications, existing and potential. // Int. J. Nanomed. 2006, V. 1, p. 297-315]. Суть данного подхода заключается в использовании липидов, модифицированных с помощью цепей PEG. Липосомы, содержащие в себе модифицированные липиды, получили название Stealth и хорошо себя зарекомендовали в терапии рака молочной железы и яичников.
Однако, лекарственные препараты на основе Stealth-липосом, такие как Doxil и Caelyx вызывают в качестве побочного эффекта так называемый hand-foot синдром, проявляющийся в повреждении кожных покровов стоп и ладоней пациентов. Установлено, что причиной hand-foot синдрома являются РЕGилированные липиды [Yokomichi, N., Nagasawa, Т., Coler-Reilly, A., Suzuki, Н., Kubota, Y., Yoshioka, R., Tozawa, A., Suzuki, N., Yamaguchi, Y. Pathogenesis of Hand-Foot Syndrome induced by PEG-modified liposomal Doxorubicin. // Human Cell 2013, V. 26, p. 8-18.]. Более того, из-за гидрофильной поверхности Stealth-липосомы не могут эффективно взаимодействовать с клеточной мембраной. Следует также отметить, что биораспределение Stealth липосом основано только на эффекте пассивного нацеливания.
Таким образом, несмотря на повышение времени циркуляции в крови, подход, связанный с использованием РЕGилированных липидов имеет ряд существенных недостатков.
Из уровня техники также известен подход, заключающийся в использовании полимерных оболочек для липосом [Watanabe K., Kaneko М., Maitani Y. Functional coating of liposomes using a folate-polymer conjugate to target folate receptors. // Int. J. Nanomed. 2012, V. 7, p. 3679-3688]. Полимерные оболочки привлекают внимание исследователей как перспективные и удобные стабилизирующие добавки, открывающие широкие возможности для модификации поверхности липосом. Полимерные оболочки должны отвечать ряду требований, помимо стабилизации, а именно: эффективное взаимодействие с липосомальной мембраной, биосовместимость, отсутствие иммунного ответа, возможность химической модификации и ковалентной сшивки с адресными метками.
Среди исследуемых полимеров встречаются как полимеры синтетические, так и природного происхождения. На протяжении длительного времени исследователи проявляют значительный интерес к хитозану, как к перспективному лиганду для стабилизации липосом.
Однако широко известно, что хитозан образует гели в нейтральных и щелочных средах [Варламов В.П., Немцев С.В., Тихонов В.Е. Хитин и хитозан: природа, получение и применение. М.: Российское Хитиновское Общество, 2010.]. Поэтому в последнее десятилетие применяются производные хитозана, например [Khameneh В., Momen-nejad М., Tafaghodi М. In vivo evaluation of mucoadhesive properties of nanoliposomal formulations upon coating with trimethylchitosan polymer. // Nanomed. J. 2014, V. 1, p. 147-154]. В работе [Prabaharan M. Review paper: chitosan derivatives as promising materials for controlled drug delivery. // J biomaterials app 2008, V. 23, p. 5-36.] приведен широкий спектр производных хитозана, которые нашли свое применение в системах доставки лекарств, например, N-аминоалкилхитозан, тиолхитозан, сополимеры хитозана с полиакриловой кислотой. В ряде работ предложено получение РЕGилированного хитозана. РЕGилирование позволяет существенно повысить растворимость хитозана. РЕGилирование позволяет получать большое количество различных полимеров для биомедицинского применения с разветвленной архитектурой и варьируемыми свойствами. Следует отметить, что получаемые сополимеры растворимы в широком интервале рН и обладают существенно более низкой вязкостью по сравнению с немодифицированным хитозаном.
Из уровня техники известен способ получения липосомальной суспензии, стабилизированной хитозаном и PEG [CN 102772802 «Chitosan and polyethylene glycol-modified oleanolic acid joint nanoliposomes»]. Однако, простая смесь полимеров не позволяет добиться однородности системы, что важно для биомедицинского применения. Ключевым отличием заявляемого изобретения от данного аналога является наличие ковалентной сшивки PEG с хитозаном, а не использование простой смеси. Ковалентная сшивка позволяет добиться большей однородности системы, что важно для биомедицинского применения.
Из уровня техники известен способ стабилизация липосомальных систем (US 2011118200 (А1) «А pegylated and fatty acid grafted chitosan olygosaccharide, synthesis method and application for drug delivery systemʺ) за счет комплексообразования с хитозаном, модицированным одновременно PEG и остатком жирной кислоты. Однако, подобный подход может приводить к нарушению структуры бислоя и неконтролируемому высвобождению лекарственного препарата за счет интеграции остатка жирной кислоты в бислой.
Метод получения ПЭГ-хитозана описан в патенте CN 103524750 (A) ʺPolyethylene glycol chitosan self-assembled nanoparticlesʺ. Однако, авторами предложен иной, менее эффективный способ синтеза PEG-хитозана. Синтез отличается большим числом стадий и нагреванием реакционной смеси до 60 С. Более того, не обсуждается возможность применения полученного конъюгата для стабилизации липосом
Из уровня техники известны способы синтеза конъюгата хитозана с фолиевой кислотой.
В патенте CN 103520720 A ʺPreparation method of folic acid coupled carboxymethyl chitosan nanoparticle serving as photo-release NO carrierʺ используется не сам хитозан, а его производное карбоксиметилхитозан. Данный факт усложняет использование изобретения в промышленности. Более того, в синтезе не используется предварительная активация фолиевой кислоты, что уменьшает выход реакции.
В патенте ЕР 2706988 А2 ʺLiposomes comprising polymer-conjugated lipids and related usesʺ предлагается ковалентная модификация липида хитозаном и фолиевой кислотой. Подобный подход может привести к нарушению структуры липосомы, вплоть до разрушения.
Наиболее близким к заявляемому изобретению является решение по патенту RU 2529179. Согласно данному патенту, предложенный средство включает стабилизатор, представляющий собой модифицированный хитозан, который получают путем модификации частиц хитозана, находящихся в эмульсии органический растворитель - вода с рН 6,0-6,5, путем воздействия сначала смесью, состоящей из карбоновой кислоты в органическом растворителе и конденсирующего агента, а затем органическим основанием, при этом в качестве карбоновых кислот используют или пальмитиновую, или стеариновую, или додекановую кислоту, в качестве конденсирующего агента - смесь из гидроксисукцинимида и алифатического карбодиимида или формальдегида и алифатического изоцианида, а в качестве органического основания - триэтиламин. Таким образом, вместо PEG используются остатки жирных кислот.
Однако, подобный стабилизатор не придает системе эффект активного нацеливания, способен изменять структурные свойства бислоя за счет взаимодействия жирных остатков стабилизатора и липидов. За счет изменения гидрофобно-гидрофильного баланса может уменьшиться растворимость хитозана, что приводит к образованию неравномерной суспензии и агрегатов. Синтез занимает длительное время и осложнен дополнительной очисткой.
Раскрытие изобретения
Задачей изобретения является создание средства для доставки активного агента, содержащего комплекс липосомальной суспензии с конъюгатом хитозана, и обладающего улучшенными свойствами.
Техническим результатом, на достижение которого направлено заявленное изобретение, является повышение стабильности липосомальных суспензий за счет эффективного связывания с липосомами. Структура и размер комплекса липосом со стабилизатором остается неизменной, по крайней мере, в течение 30 дней, за счет улучшения электростатического взаимодействия стабилизатора с поверхностью липосом. Кроме того, получаемый стабилизатор легко растворим в нейтральных и щелочных средах, включая физиологические растворы, что обеспечивает однородность получаемых систем. Кроме того, получаемые средства доставки - липосомы, покрытые конъюгатом хитозан - PEG не обнаруживаются ретикуло-эндетелиальной системой, а липосомы, покрытые конъюгатом хитозан - фолиевая кислота, обнаруживают эффект активного нацеливания. При этом упрощается процесс получения стабилизатора, а именно, стабилизатор получают из хитозана через минимальное число стадий, причем значения рН реакционной смеси находится в интервале от 4 до 9, время протекания реакции варьируется от 1 до 4 часов. Очистку производят путем диализа против дистиллированной воды, буферного раствора или хроматографически. Полученный стабилизатор нековалентно связывается с липосомами, образуя комплекс, стабильный в течение не менее 30 дней.
Поставленная задача решается тем, что средство для доставки активного агента включает комплекс липосомальной суспензии с конъюгатом хитозана, представляющим собой соединение формулы (C6O4H9NH2)m(C6O4H9NHX)n, где в качестве заместителя по аминогруппе X выступает остаток производного полиэтиленгликоля, представляющего собой монометокси-ПЭГ-сукцинат, хитозан использован с молекулярой массой от 15 до 120 тысяч Дальтон, a m и n - количество звеньев в молекуле, где соотношение m/n составляет от 6 до 19, при этом липосомы связаны с конъюгатом хитозана нековалентно.
Кроме того, в липосомальной суспензии основомольное соотношение фосфатных липидов на поверхности липосом к немодицифированным аминогруппам может составлять от 1:0,25 до 1:20.
Стабилизатор для липосомальных суспензий может быть получен посредством смешения раствора, модифицирующего аминогруппу хитозана агента с кислым раствором хитозана и доведение полученной смеси до рН 7,5-8,0. При этом в качестве раствора агента, модифицирующего аминогруппу хитозана (или модифицирующего агента), может быть использован раствор N-гидроксисукцинимидного эфира ПЭГ5000-гемисукцината в диметилформамиде или диметилсульфоксиде, или раствор фолиевой кислоты, предварительно активированной раствором карбодиимида.
Наилучший результат достигается при использовании раствора модифицирующего агента в концентрации от 0,08 М до 0,8 М, а также при использовании в качестве карбодиимида 1-этил-3-(3-диметиламинопропил)карбодиимида в мольном соотношении 1-1. В кислом растворе хитозан используют с молекулярной массой 15-120 кДа.
Краткое описание чертежей
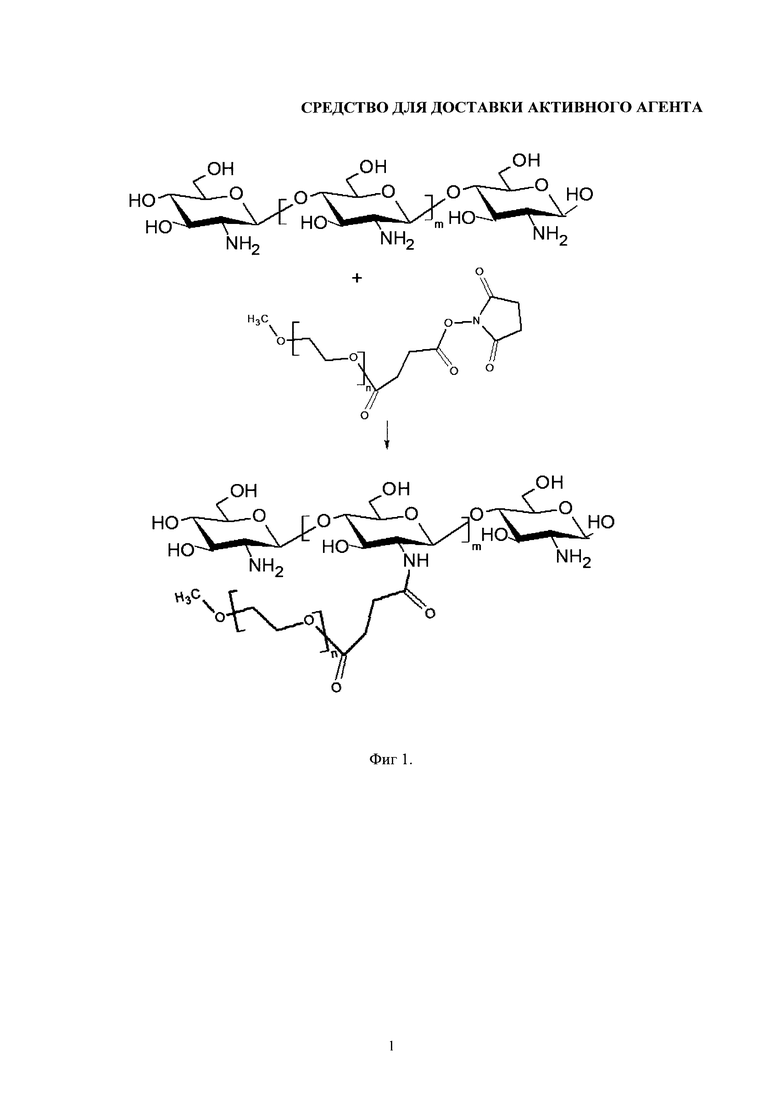
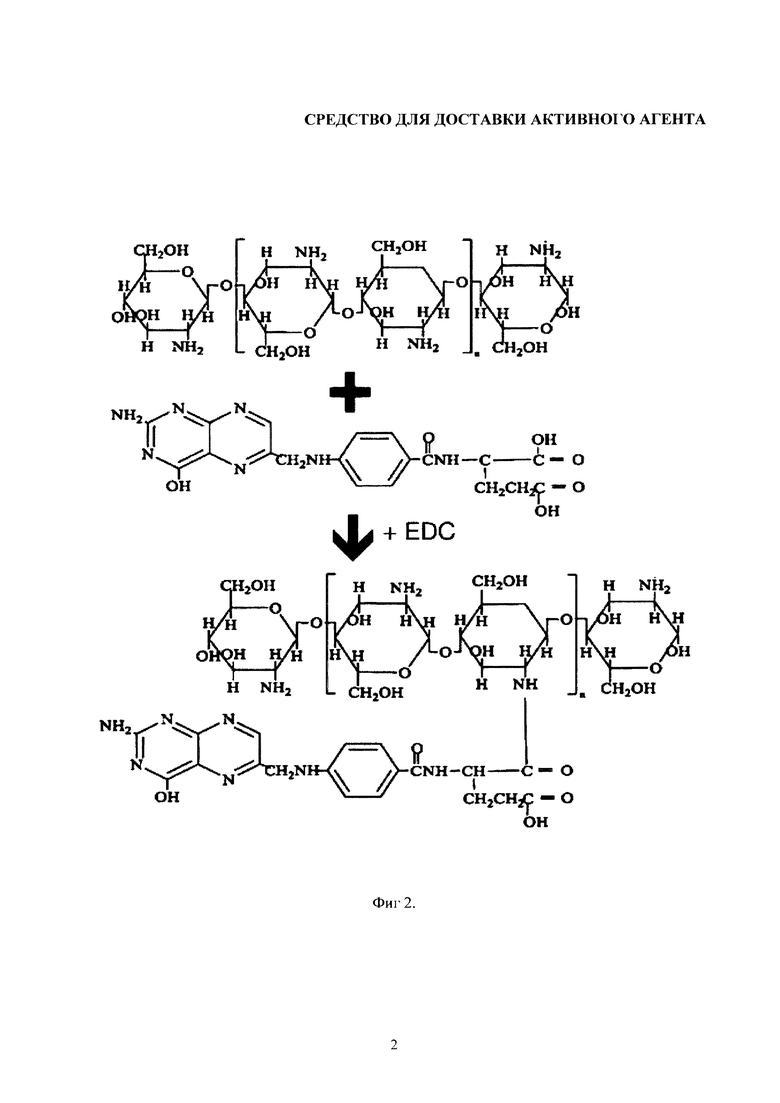
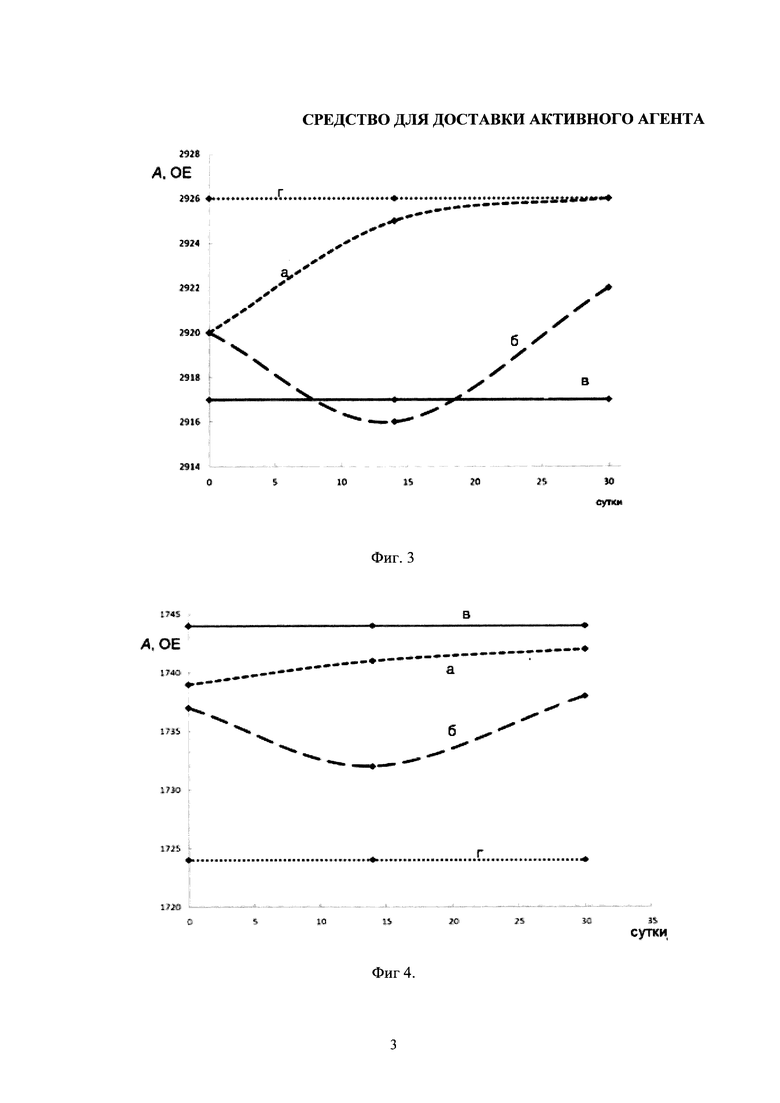
Изобретение поясняется чертежами, где на фиг. 1 представлена схема синтеза PEG-хитозана, на фиг. 2 представлена схема синтеза конъюгата хитозана с фолиевой кислотой, на фиг. 3 и на фиг. 4 представлены графики стабильности липосомальных суспензий. Позициями на фигуре 3 обозначены: а - смещение полос поглощения νCH2as при хранении свободных липосом, б - липосом в комплексе с хитозаном, в - в комплексе с РЕG-хитозаном-25. Положение соответствующих полос поглощения для свободных липосом в агрегированном состоянии (г). Позициями на фигуре 4 обозначены: а - Смещение полос поглощения νCO при хранении свободных липосом, б - липосом в комплексе с хитозаном, в - в комплексе с РЕG-хитозаном-25. Положение соответствующих полос поглощения для свободных липосом в агрегированном состоянии (г).
Осуществление изобретения
Для стабилизации липосомальных суспензий, согласно настоящего изобретения, предложено использование производных хитозана, в качестве которых может выступать конъюгат хитозана формулы (C6O4H9NH2)m(C6O4H9NHX)n, где в качестве заместителя по аминогруппе X выступает ПЭГ или фолиевая кислота, где m и n - количество звеньев в молекуле.
Для разработки стабилизированной липосомальной системы предложено использовать разветвленные сополимеры на основе хитозана, модифицированного полиэтиленгликолем (PEG-хитозан). Синтез сополимеров хитозана проводят с активированным производным PEG, монометокси-PEG-N-гидроксисукцинимидилсукцинатом (mPEG-suc-NHS, М 5 кДа), которое отличается высокой реакционной способностью и в мягких условиях ацилирует аминогруппы биомолекул с высоким выходом.
Преимущества предложенной методики синтеза по сравнению с уже известными - мягкие условия проведения реакции за счет высокой реакционной способности mPEG-suc-NHS и возможность получать сополимеры с широким диапазоном степеней модификации. Следует отметить также методическую простоту получения сополимера без необходимости проведения предварительных стадий длительного синтеза.
Синтез конъюгата хитозан-фолиевая кислота проводили с предварительной активацией карбоксильной группы с помощью N-(3-Диметиламинопропил)-N'-этилкарбодиимида. Следует отметить экспрессность данной методики и высокий выход реакции.
Комплексообразование происходит простым смешением анионных липосом и модифицированного хитозана в основомольном соотношении от 1:0,25 до 1:20, в пересчете на фосфатные группы анионного липида на поверхности липосом и немодифицированные аминогруппы хитозана. Причем насыщение обнаруживается при изначальном основомольном соотношении 1:7. После смешения комплексы в течение получаса инкубируются при температуре 37 С, затем несвязанный полимер отделяют хроматографически или с помощью центрифугирования. Подобный подход выгодно отличается простой и эффективностью.
Структура получаемых комплексов определяется с помощью метода ИК-спектрокопии Фурье и метода динамического светорассеяния. По смещению основных полос поглощения на ИК-спектре делается вывод о состоянии и микроокружении основных функциональных группы липидов: карбонильных, фосфатных групп в полярной головной части и метиленовых групп в жирном хвосте. Изменения в области поглощения карбонильной и фосфатной групп могут свидетельствовать о электростатическом взаимодействии с лигандом, изменения в области поглощения метиленовых групп указывают на существенные изменения в укладке жирных хвостов в бислое, возможное изменение фазового состояния липосом.
Увеличение размера везикул после добавления полимера указывает на образование комплекса липосома - конъюгат хитозана. Данные о изменении ζ - потенциала поверхности везикул также могут свидетельствовать об образовании комплекса. Данные методы вкупе с результатами анализа ИК-спектров позволяют судить о структуре и стабильности липосомальных систем во времени.
Примеры осуществления
Синтез сополимеров PEG-хитозан. Хитозан растворяли в 3% уксусной кислоте при интенсивном перемешивании. После получения прозрачного раствора его рН доводили до 6.5 добавлением 5 мМ натрий-фосфатного буфера; финальная концентрация хитозана составила 3 мг/мл. В него по каплям при перемешивании вводили 5-20-кратный молярный избыток раствора mPEG-suc-NHS (М 5 кДа) в ДМСО в пересчете на моль дезацилированных аминогрупп хитозана, при этом рН раствора доводили до рН 7.5 натрий-фосфатным буфером. Смесь интенсивно перемешивали в течение 1-4 ч. Очистку производили путем диализа против буферного раствора. Полноту очистки контролировали ИК- и УФ-спектроскопией.
Синтез конъюгата Хитозан-Фолиевая кислота. 10 мг хитозана 90-120 кДа растворяли в 2 мл 0,2 М ацетатного буфера с рН 4,5 в течение часа при перемешивании. 5 мг фолиевой кислоты и 2 мг N-(3-диметеиламинопропил)-N'-этилкарбодимиид гидрохлорида растворяли в 2 мл ДМСО в темноте. Растворы объединяли, полученную реакционную смесь перемешивали в течение 15 часов при комнатной температуре в темноте. В реакционную смесь вводили 0,7 мл буфера PBS, 0,3 мл NaOH 0,2 М до рН 9. Раствор очищали диализом против дистиллированной воды в течение суток, против раствора PBS в течение 2 суток. Итоговая концентрация составила 3 мг\мл.
Приготовление комплексов липосом с хитозаном, PEG-хитозаном, хитозан-фолиевой кислотой. К раствору требуемых липосом в боратном буфере, рН 9.0, (5 мг/мл) добавляли по каплям при перемешивании раствор полимера в 5 мМ натрий-фосфатном буфере, рН 7.0-7.5 в соотношении липосомы - полимер от 1:0,25 до 1:20 основомоль. После смешения комплексы в течение часа инкубируются при температуре 37 С, затем несвязанный полимер отделяют хроматографически или с помощью центрифугирования.
Исследование
Синтез и характеризация PEG-хитозана
Для разработки стабилизированной липосомальной системы в представленной работе предложено использовать разветвленные сополимеры на основе хитозана, модифицированного полиэтиленгликолем (PEG-хитозан). Был проведен синтез сополимеров хитозана (М 90-100 кДа и 5 кДа) с активированным производным PEG, монометокси-PEG-N-гидроксисукцинимидилсукцинатом (mPEG-suc-NHS, М 5 кДа), которое отличается высокой реакционной способностью и в мягких условиях ацилирует аминогруппы биомолекул с высоким выходом.
Преимущества предложенной методики синтеза по сравнению с уже известными - мягкие условия проведения реакции за счет высокой реакционной способности mPEG-suc-NHS и возможность получать сополимеры с широким диапазоном степеней модификации. Следует отметить также методическую простоту получения сополимера без необходимости проведения предварительных стадий длительного синтеза.
Следует ожидать, что свойства сополимеров PEG-хитозан будут существенным образом зависеть от их состава и структуры. Так, при повышении содержания PEG-цепей в сополимере, с одной стороны, повышается растворимость продукта, а с другой стороны - уменьшается число свободных аминогрупп хитозана, доступных для электростатического взаимодействия с фосфолипидами липосом. Для выбора сополимера с оптимальным стабилизирующими свойствами в отношении липосом, мы синтезировали образцы PEG-хитозана с различным содержанием PEG-цепей (фигура 1)
Для характеристики полученных сополимеров использовали ИК-спектроскопию Фурье (FTIR). Метод позволяет определять содержание характеристических функциональных групп в структуре изучаемых молекул и, соответственно, степень модификации биополимеров.
Из анализа ИК-спектра PEG-хитозана следует, что в результате модификации хитозана активированным производным PEG (mPEG-suc-NHS) наблюдается появление высокоинтенсивной полосы поглощения при 1089 см-1, которая соответствует валентным колебаниям С-О-С-связи и является основной характеристической полосой поглощения молекулы PEG. Следует отметить, что полоса поглощения хитозана в области 1200-950 см-1 существенно менее интенсивна по сравнению с полосой поглощения С-О-С-связи в PEG и вносит лишь незначительный вклад в общую интенсивность поглощения при 1089 см-1 в PEG-хитозане. Наблюдаемое увеличение интенсивности данной полосы в спектре PEG-хитозана по сравнению с исходным хитозаном подтверждает прошедшую модификацию.
Степени РЕGилирования синтезированных в работе сополимеров были определены как 5, 15 и 25% по отношению к исходному числу дезацилированных аминогрупп в хитозане (соответственно, РЕG-хитозан-5, -15, -25), что соответствует 25(±2), 40(±5) и 60(±5) остатков молекулы PEG-5000 на каждую молекулу хитозана М 90-100 кДа.
Для контроля полученных результатов независимым методом было проведено титрование свободных аминогрупп хитозана в препаратах сополимеров с использованием TNBS. Степень модификации, определенная данным методом составила 18±3, 45±5 и 57±5 остатков PEG-5000 в пересчете на молекулу хитозана, что показывает хорошую сходимость результатов, полученных двумя методами.
Синтез и характеризация конъюгата хитозан-фолиевая кислота.
Синтез конъюгата хитозан-фолиевая кислота проводили с предварительной активацией карбоксильной группы с помощью N-(3-Диметиламинопропил)-]-N'-этилкарбодиимида. Следует отметить экспрессность данной методики и высокий выход реакции. Схема синтеза приведена на фигуре 2.
Степень модификации определяли спектрофотометрически по поглощению А217. На спектре выделяется ряд выраженных пиков: 360 нм, 280 нм, 253 нм и 217 нм. Для аналитических целей выбрали полосу поглощения 217 нм, как наиболее интенсивную и узкую.
В независимом эксперименте получали калибровочную кривую зависимости оптической плотности раствора А217 фолиевой кислоты от концентрации. По полученной калибровочной кривой степень модификации конъюгата хитозан-фолиевая кислота была определена как 15%.
Анализ структуры и свойств комплексов липосом с конъюгатами хитозана
Из анализа ИК-спектров следует, что образование комплексов между липосомами и конъюгатами хитозана, как и с немодифицированным хитозаном, приводит к смещению основных полос поглощения липосом, а именно, полос поглощения ацильных цепей, а также карбонильной и фосфатной групп липидов.
Обнаружено, что в области поглощения ацильных цепей липосом (3000-2800 см-1) при образовании комплекса липосом с сополимером РЕG-хитозан-25 наблюдался существенный сдвиг полос поглощения в область меньших волновых чисел (рис. 24а). Так, для свободных липосом полосы поглощения νCH2as и νCH2s расположены соответственно при 2920 см-1 и 2851 см-1, тогда как в комплексе с PEG-хитозаном соответствующие частоты составили 2917 и 2849 см-1. Отметим, что наблюдаемые различия являются статистически значимыми, так как точность определения частот валентных колебаний липосом, соответствующих симметричным и асимметричным валентным колебаниям СН2-групп νCH2as и νCH2s), составляет не более 1 см-1. Комплексообразование с немодифицированным хитозаном также приводит к низкочастотным сдвигам полос поглощения νCH2as и νCH2s в спектре липосом. Но наблюдаемые сдвиги менее существенны: полосы поглощения для комплекса липосом с хитозаном расположены соответственно на 2919 см-1 и 2850 см-1.
Низкочастотные сдвиги полос поглощения в гидрофобной области соответствуют о снижении подвижности ацильных цепей в липосомах. По-видимому, образование комплексов с хитозаном и его сополимерами приводит к ограничению подвижности ацильных цепей в структуре бислоя.
На основе анализа величин наблюдаемых низкочастотных сдвигов полос поглощения ацильных цепей в ИК-спектре липосом можно заключить, что в случае сополимера PEG-хитозан взаимодействие с липосомами более эффективно сравнительно со случаем свободного аминополисахарида. Данный результат является несколько неожиданным ввиду того, что PEG-хитозан имеет меньше свободных аминогрупп, способных взаимодействовать с анионными группами липосом. Для выяснения молекулярных причин наблюдаемых эффектов нами было изучено влияние хитозана и PEG-хитозана на потенциальные сайты связывания липидов с аминогруппами (анионными группами липидов).
Необходимо отметить, что конъюгат хитозана с фолиевой кислотой не влияет на состояние ацильных цепей.
Влияние хитозана и его производных на положение полосы поглощения фосфатной группы в ИК-спектре липидов.
Основным потенциальным сайтом связывания анионных липосом (DPPC/CL) с аминополисахаридами (хитозаном и его производными) по электростатическому механизму являются фосфатные группы кардиолипина. Действительно, нами было обнаружено, что наиболее существенные смещения полос поглощения при образовании комплексов наблюдаются для фосфатных групп липосом. Полоса поглощения фосфатной группы в свободных липосомах расположена при 1225 см-1, что соответствует высокой степени ее гидратации. Взаимодействие с хитозаном, конъюгатом хитозан с фолиевой кислотой и PEG-хитозаном приводит к значительному смещению полосы поглощения в высокочастотную область к 1244, 1258, 1263 см-1, соответственно.
Заметим, что в максимально высушенных пленках липосом данная полоса расположена на 1265 см-1. Это означает, что взаимодействие с полимерными лигандами приводит к дегидратации фосфатных групп, и в случае взаимодействия с PEG-хитозаном состояние гидратации липосом приближается к состоянию в высушенной пленке. По-видимому, это связано с разрывом большей части водородных связей фосфатной группы за счет образования электростатических связей с полимерами.
Таким образом, фосфатные группы кардиолипина выступают основными сайтами связывания как в случае хитозана, так и в случае его конъюгатов. При этом наиболее существенное смещение полосы поглощения наблюдается в случае комплекса с конъюгатами хитозана. Это указывает, что в случае комплексообразования с конъюгатами хитозана реализуется более эффективное электростатическое взаимодействие между фосфатными группами липосом и полимером по сравнению с немодифицированным хитозаном.
Влияние хитозана и его производных на положение полосы поглощения карбонильной группы в ИК-спектре липидов.
Другим потенциальным сайтом связывания производных хитозана с липосомами является карбонильная группа, несущая частично отрицательный заряд на кислороде. Обнаружено, что образование комплекса как с немодифицированным хитозаном, так и с конъюгатами приводит к существенным изменениям в области поглощения карбонильной групп. В исследуемых липосомах полоса поглощения карбонильной группы расположена при 1739 см-1. Известно, что полоса поглощения карбонильной группы в липосомах является чувствительной к степени гидратации на поверхности раздела фаз липид-вода. Так, из независимого эксперимента было установлено, что при максимальной гидратации липосом полоса поглощения карбонильной группы наблюдается при 1725 см-1. В максимально обезвоженных липосомах (в высушенной пленке) полоса поглощения карбонильной группы смещается в сторону  волновых чисел и составляет 1745 см-1.
волновых чисел и составляет 1745 см-1.
Нами было найдено, что взаимодействие липосом с PEG-хитозаном и конъюгатом хитозан-фолиевая кислота приводит к заметному сдвигу полосы поглощения в область  волновых чисел (до 1744 см-1). Такое положение полосы поглощения указывает на существенное снижение степени гидратации данных групп. Данный факт указывает на разрушение части водородных связей карбонильной группы за счет взаимодействия с катионными группами полимера, как это наблюдалось и в случае фосфатных групп липосом. Полученные данные свидетельствуют, что карбонильная группа, как и фосфатная, служит сайтом связывания стабилизатора.
волновых чисел (до 1744 см-1). Такое положение полосы поглощения указывает на существенное снижение степени гидратации данных групп. Данный факт указывает на разрушение части водородных связей карбонильной группы за счет взаимодействия с катионными группами полимера, как это наблюдалось и в случае фосфатных групп липосом. Полученные данные свидетельствуют, что карбонильная группа, как и фосфатная, служит сайтом связывания стабилизатора.
Следует отметить, что взаимодействие с хитозаном, в отличие от его конъюгатов, приводит к низкочастотному сдвигу полосы поглощения от 1740 к 1735 см-1, что соответствует повышению степени гидратации карбонильных групп липидов. Можно также отметить, что рассматриваемая полоса в случае комплексов липосом с хитозаном, а также свободных липосом включает в себя несколько компонентов, соответствующих различному состоянию карбоксильных групп. Для более детального анализа данной полосы поглощения было проведено разложение пика на компоненты. Для определения позиций индивидуальных компонентов в составе полосы поглощения С=O-групп использовали метод второй производной.
Анализ интегральных интенсивностей индивидуальных компонентов показывает, что в случае свободных липосом полоса карбонильной группы раскладывается на два компонента (1742-1 и 1730 см-1), вклады которых составляют соответственно 56% и 44%. В результате взаимодействия с хитозаном происходит изменение в распределении карбонильных групп по степеням гидратации в сторону возрастания доли низкочастотных компонентов: вклад полосы при 1718 см-1, соответствующей высокогидрагированным С=O-группам, составляет 26%, а также наблюдается появление компонента при 1730 см-1, доля которого составляет 45%. При этом происходит уменьшение доли высокочастотного компонента (1742 см-1) от 81 до 28% по сравнению со свободными липосомами (1739 см-1). Следует отметить, что в случае конъюгатов хитозана полоса карбонильной группы удовлетворительно описывается одним компонентом, соответствующим низкогидратированному состоянию С=O групп (1744 см-1). Данный результат указывает на однородность комплексов липосом с PEG-хитозаном в отличие от комплексов с хитозаном.
По-видимому, структура и равновесное состояние комплекса липосом с немодифицированным хитозаном отличается от структуры комплекса с конъюгатами хитозана. Последние комплексы характеризуется более высокой подвижностью цепей полимера, что проявляется, в частности, в резком уменьшении вязкости раствора при модификации хитозана. Это приводит к более эффективному электростатическому многоточечному взаимодействию между карбонильными группами и аминогруппами конъюгата, основная масса зарядов на полиэлектролите становится компенсированной, в результате чего наблюдается снижение степени гидратации С=O-группы. В случае комплексов с немодифицированным хитозаном эффективного многоточечного электростатического взаимодействия с карбонильными группами липосом, по-видимому, не происходит: за счет низкой подвижности цепей хитозан образует неравновесные комплексы с большим числом петель и большая часть зарядов нескомпенсирована, что обуславливает высокую степень гидратации вблизи поверхности липосом.
Таким образом, взаимодействие липосом с хитозаном и его производными влияет на состояние гидратации электростатических сайтов связывания в липосомах - фосфатных и карбонильных групп, - за счет взаимодействия с дезацилированными аминогруппами хитозана. Важно, что связывание липидной мембраны с конъюгатами хитоазан происходит более эффективно, чем с немодифицированным хитозаном.
Для установления молекулярных деталей взаимодействия хитозана и его конъюгатов с липосомами была изучена роль электростатических и адсорбционных взаимодействий в комплексообразовании, а также исследованы структурные особенности полученных комплексов.
Механизм взаимодействия лиганда с липосомами.
Выше было высказано предположение, что основными сайтами связывания полимера на липосомах являются карбонильные и фосфатные группы, которые способны электростатически взаимодействовать с аминогруппами хитозана и его конъюгатов. Нельзя также исключать вклад неспецифической адсорбции в данное взаимодействие.
Если основной вклад вносят электростатические взаимодействия, то данные комплексы будут неустойчивы при увеличении ионной силы. Напротив, если основную роль играет адсорбция, можно полагать, что комплексы будут стабильны и в растворах с высокой ионной силой. Для выяснения роли электростатического взаимодействия методом ИК-спектроскопии было изучено, как изменяется состояние функциональных групп липидов, ответственных за электростатические взаимодействия с аминополисахаридами, в растворах с высокой ионной силой.
Было установлено, что в присутствии хитозана или его конъюгатов в условиях ослабленного электростатического взаимодействия (I=0.2 М) полосы поглощения карбонильной и фосфатной группы в липосомах не претерпели никаких изменений по сравнению с исходным состоянием липосом при низкой ионной силе. Более того, существенных изменений не претерпела и область спектра, соответствующая поглощению ацильных цепей. Полученные данные указывают на то, что обсуждаемые выше сдвиги полос поглощения при взаимодействии бислоя с хитозаном и его производными в растворах со слабой ионной силой вызваны именно электростатическими взаимодействиями.
Для выяснения роли адсорбционных взаимодействий в образовании комплексов нами было исследовано, взаимодействуют ли полимеры с липосомами в растворах с высокой ионной силой. Для этого влияние комплексообразования с хитозаном и его конъюгатами на размеры липосом при низкой и высокой ионной силе было изучено методом динамического светорассеяния.
Определение размеров частиц в липосомальных препаратах методом динамического светорассеяния (DLS).
Метод DLS позволяет оценить толщину слоя, образуемого полимером на поверхности липосом, исходя из полученных значений радиусов свободных липосом и липосом в комплексе с полимером. Обнаружено, что радиус несвязанных в комплекс липосом при низкой ионной силе составляет 60±2 нм. Комплексообразование с PEG-хитозаном и конъюгатом хитозана с фолиевой кислотой приводит к увеличению размера частиц до 85±4 и 120±6 нм.
Нами было обнаружено, что конъюгаты хитозана способны взаимодействовать с липосомами как при низкой, так и при высокой ионной силе - за счет неспецифической адсорбции, так как размер частиц достоверно превышает таковой, определенный для свободных липосом в тех же условиях. Так, включение в систему PEG-хитозана при ионной силе 0.2 М приводит к увеличению радиуса липосом с 64±2 нм до 72±2 нм. Прирост размера липосом при высокой ионной силе составляет 8±2 нм, что, хотя и существенно ниже прироста, наблюдаемого при низкой ионной силе, является значимой величиной, так как заметно превышает ошибку измерения. Таким образом, неспецифическая адсорбция вносит вклад в образование и стабилизацию комплекса липосом с конъюгатами хитозана.
Влияние комплексообразования с конъюгатами хитозана на фазовый переход липосом.
Для разработки стабилизированных липосомальных систем медицинского назначения важно, чтобы получаемые комплексы были устойчивы при температуре человеческого тела. Еще более важным явялется тот факт, что в интервале фазового перехода происходит высвобождение лекарственного средства. Таким образом, сами комплексы должны были устойчивыми, но претерпевать фазовый переход в области физиологических температур. Отдельно стоит отметить, что важным является определение условий оптимального образования комплексов.
Было обнаружено, что комплексообразование с производными хитозана приводит к повышению температуры фазового перехода липосом до 38 С. Напротив, нагрев комплексов липосом с хитозаном до температуры человеческого тела приводил к образованию неравновесных систем.
Влияние комплексообразования с конъюгатами хитозана на стабильность липосом.
Как уже обсуждалось выше, липосомы недостаточно стабильны при хранении, склонны к образованию дефектов в бислое, к агрегации и окислению, что ограничивает их применение в медицине в качестве носителя для доставки лекарственных средств. Как было продемонстрировано выше, липосомы образуют прочные комплексы с аминополисахаридами в широком интервале значений ионной силы. Мы предположили, что применение PEG-хитозана может существенно повысить стабильность липосом при хранении и предотвратить их агрегацию за счет электростатического отталкивания полимерных цепей связанного с липосомами полиэлектролита. В качестве критерия стабильности использовали величину частот асимметричных валентных колебаний связи С-Н (νCH2as) как «сенсор» состояния гидрофобной части бислоя, а также величину частот валентных колебаний связи С=O карбонильной группы липидов, микроокружение которых существенным образом изменяется при нарушении структурной целостности липосом. Известно, что данные полосы весьма чувствительны также к состоянию агрегации и окислению липосом. В качестве предельного агрегированного состояния липосом нами были использованы липосомы, хранившиеся в течение 6 мес при охлаждении. В независимом эксперименте методом DLS были определены размеры частиц данного препарата липосом. Было установлено, что препарат характеризовался широким разбросом частиц по размерам (от 30 до 600 нм), что свидетельствует о высокой степени агрегации липосом.
Было найдено, что при длительном хранении липосом полоса поглощения νCH2as претерпевает существенные изменения: наблюдается сдвиг с 2920 см-1 к 2926 см-1, что свидетельствует об агрегации и разрушении структуры липидных мембран.
Из фигуры 3 и фигуры 4 следует, что при хранении свободных липосом серьезные изменения в структуре бислоя наблюдаются через 10-14 сут. За это время положение полосы поглощения ацильных групп достигает 2925 см-1 и приближается к состоянию, характерному для агрегированных липосом.
В случае липосом в комплексе с хитозаном наблюдается иная ситуация. Полоса поглощения претерпевает сначала низкочастотный сдвиг - с 2920 см-1 к 2916 см-1, но далее характеристическое волновое число повышается до 2921 см-1. Нестабильность положения полосы поглощения указывает на изменения в структуре и нарушении целостности комплекса липосом с хитозаном.
Наибольшую стабильность продемонстрировал препарат комплекса липосом с PEG-хитозаном. В этом случае положение полосы поглощения νCH2-групп оставалось неизменным в течение как минимум 1 месяца хранения, что указывает на образование равновесного комплекса и его стабильность при дальнейшем хранении.
Любопытными представляются данные о смещении полосы поглощения связи С=O в липосомах при хранении изучаемых образцов (фигура 4). В случае свободных липосом полоса поглощения С=O-групп претерпевает плавный сдвиг в область больших волновых чисел в течение 3-5 дней, что свидетельствует о понижении степени гидратации данной группы. Наиболее вероятно, что это связано с образованием дефектов, слипанием липосом и агрегации при хранении. Отметим, что для модельных агрегированных липосом частота валентных колебаний С=O-групп расположена в районе 1725 см-1, что соответствует максимально высокой степени гидратации; данный результат объясняется разрушением структуры липосом в процессе длительного хранения.
При хранении комплекса липосом с хитозаном в течение 3-4 дней наблюдалось снижение характеристического волнового числа С=O-групп, что указывает на повышение степени их гидратации. Данный факт может отражать процесс гелеобразования системы, которое характерно для препаратов высокомолекулярного хитозана и которое наблюдалось визуально. Изменение состояния препарата липосом в комплексе с немодифицированным хитозаном при хранении указывает на сложность его использования в медицинских целях. Напротив, в случае комплекса липосом с PEG-хитозаном положение полосы поглощения карбонильной группы оставалось неизменным, что в совокупности с неизменностью состояния -СН2-групп в бислое, указывает на образование квази-равновесного комплекса липосом с PEG-хитозаном и его структурную стабильность при хранении как минимум в течение 30 дней.
Аналогичные данные по стабильности липосом были получены для комплексов с конъюгатом хитозан-фолиевая кислота. По данным ИК-спектроскопии, полученная система доставки сохраняла свои физико-химические и структурные свойства в течение как минимум 30 дней.
Оценка цитотоксичности in vitro
Для определения противоопухолевой активности in vitro были выбраны две клеточные линии. Клеточная линия А549 немелкоклеточной карциномы легкого человека характеризуется нормальным уровнем фолтаных рецепторов и представляется удобной системой для оценки противоопухолевой активности. Клеточная линия Сасо-2 колоректальной аденокарциномы человека характеризуется избытком фолатных рецепторов на поверхности и позволяет оценить эффект активного нацеливания для систем с фолатной адресной меткой.
МТТ-тест - удобный способ оценки токсичности препарата. В работе изучали цитотоксичность несвязанных в комплекс с конъюгатами липосом, загруженных доксорубицином, и комплексов липосом, загруженных доксорубицином, с конъюгатами хитозана. Концентрация доксорубицина была равна 1 микромоль/литр.
Было установлено, что для клеточной линии А 549 активность комплексов с PEG-хитозаном-25 примерно равна активности липосом, несвязанных в комплекс. Это означает, что комплексообразование не приводит к потере противоопухолевой активности и не препятствует высвобождению препарата в клетках. При этом стабильность комплексов превышает стабильность несвязанных липосом при хранении в несколько раз. Совокупность данных фактов указывает на значительные преимущества разрабатываемой системы по сравнению с несвязанными липосомами.
С другой стороны, для клеточной линии Сасо-2 с избытком фолатных рецепторов на поверхности было обнаружно, что наибольшую цитотоксическую активность проявляют комплексы с конъюгатом хитозан-фолиевая кислота, что указывает на эффект активного нацеливания.
| название | год | авторы | номер документа |
|---|---|---|---|
| Стабилизатор липосомальных суспензий | 2015 |
|
RU2642786C2 |
| ЛИПИДНО-ПОЛИМЕРНАЯ СИСТЕМА ОДНОВРЕМЕННОЙ ДОСТАВКИ ДВУХ АНТИБАКТЕРИАЛЬНЫХ СОЕДИНЕНИЙ | 2023 |
|
RU2838145C1 |
| ЛИПОСОМАЛЬНЫЕ КОМПОЗИЦИИ И СОДЕРЖАЩИЕ ИХ ТВЕРДЫЕ ПЕРОРАЛЬНЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ | 2018 |
|
RU2751192C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2015 |
|
RU2757110C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2005 |
|
RU2574926C2 |
| ТРАНСЛЕГОЧНАЯ ЛИПОСОМА ДЛЯ РЕГУЛИРОВАНИЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2008 |
|
RU2493874C2 |
| СТАБИЛИЗАТОР ЛИПОСОМАЛЬНЫХ СУСПЕНЗИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2529179C1 |
| ОДНОРАЗОВАЯ СИСТЕМА ДЛЯ СТЕРИЛЬНОГО ПОЛУЧЕНИЯ ЧАСТИЦ ИЗ ЛИПИДОВ И НУКЛЕИНОВЫХ КИСЛОТ | 2012 |
|
RU2642640C2 |
| УСОВЕРШЕНСТВОВАННЫЕ ЛИПОСОМЫ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2482837C2 |
| НАЦЕЛИВАЮЩИЕ АМИНОКИСЛОТНЫЕ ЛИПИДЫ | 2013 |
|
RU2654210C2 |
Изобретение относится к области фармацевтической промышленности и биотехнологии, а именно к средству для доставки активного агента, включающему комплекс липосомальной суспензии с конъюгатом хитозана, который представляет собой соединение формулы (С6O4Н9NН2)m(С6O4Н9NHХ)n, где заместитель по аминогруппе X представляет собой монометокси-ПЭГ-сукцинат, m и n – количество звеньев в молекуле, причем соотношение m/n составляет от 6 до 19, а хитозан использован с молекулярной массой от 15000 до 120000 Да, при этом липосомы связаны с конъюгатом хитозана нековалентно. Изобретение обеспечивает повышение стабильности липосомальных суспензий. 1 з.п. ф-лы, 4 ил.
1. Средство для доставки активного агента, включающее комплекс липосомальной суспензии с конъюгатом хитозана, представляющим собой соединение формулы (C6O4H9NH2)m(C6O4H9NHX)n, где в качестве заместителя по аминогруппе X выступает остаток производного полиэтиленгликоля, представляющего собой монометокси-ПЭГ-сукцинат, хитозан использован с молекулярной массой от 15000 до 120000 Да, а m и n - количество звеньев в молекуле, где соотношение m/n составляет от 6 до 19, при этом липосомы связаны с конъюгатом хитозана нековалентно.
2. Средство п.1, характеризующееся тем, что в липосомальной суспензии основомольное соотношение фосфатных липидов на поверхности липосом и немодицифированных аминогрупп составляет от 1:0,25 до 1:20.
| СТАБИЛИЗАТОР ЛИПОСОМАЛЬНЫХ СУСПЕНЗИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2529179C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОБОЛОЧЕК НА ОСНОВЕ ХИТОЗАНА И СОЛЕЙ АЛЬГИНОВОЙ КИСЛОТЫ ДЛЯ МИКРОКАПСУЛ, СОДЕРЖАЩИХ ФОСФОЛИПИДНЫЕ МИЦЕЛЛЫ | 2009 |
|
RU2411077C1 |
| Sugimoto Masatoshi et al | |||
| Preparation and characterization of water-soluble chitin and chitosan derivatives / Carbohydrate Polymers, 1998, Vol.36, N.1, pp.49-59 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИЭТИЛЕНГЛИКОЛЕВОГО ЭФИРА ХИТОЗАНА | 2004 |
|
RU2266915C1 |
Авторы
Даты
2018-10-10—Публикация
2017-09-08—Подача