ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к препарату для перорального введения жвачным животным, в частности препарату для перорального введения, который достигает нижней части пищеварительного тракта, не подвергаясь разрушению в результате жевания жвачки, и содержащему этот препарат корму для жвачных животных.
УРОВЕНЬ ТЕХНИКИ
В области ветеринарии/животноводства в рамках профилактики и/или лечения болезней домашних жвачных животных, таких как крупный рогатый скот, осуществлялось введение витаминных препаратов и/или препаратов на основе сахаридов. Однако, например, у крупного рогатого скота имеется от десяти миллиардов до ста миллиардов микроорганизмов на 1 г содержимого желудка в рубце, который является одним из четырех отделов желудка. Следовательно, если витамин B1 и/или препараты на основе сахаридов часто используемые, например, при нарушении пищеварения, лечебно-профилактические и/или быстродействующие пищевые добавки вводят перорально, то микроорганизмы разлагают их, и эти компоненты не могут эффективно всасываться и использоваться в организме крупного рогатого скота. Таким образом, для эффективного всасывания и использования этих компонентов в организме крупного рогатого скота не существует никакого другого пути, кроме их внутривенной инъекции или подкожной инъекции. Однако для данных способов введения требуются опыт и большие затраты.
С другой стороны, существует возможность того, что микроорганизмы, имеющиеся в организме крупного рогатого скота, могут загрязнить пищу путем использования мясных продуктов и/или незрелого компоста и тому подобного. Например, часто происходил случай пищевого отравления, вызванного патогенной бактерией E. Coli O157, полученной от крупного рогатого скота, и тому подобное. Существуют случаи, когда пищевое отравление, если оно серьезное, может привести к смерти пациентов, и это является одним из основных пищевых рисков в современном обществе.
С целью снижения риска была предпринята разработка способа предупреждения выделения патогенных микроорганизмов, вызывающих пищевое отравление, введением молочнокислых бактерий крупному рогатому скоту. Для маслянокислых бактерий и некоторых молочнокислых бактерий результаты ингибирования роста E. Coli, продуцирующих шига-токсин, были подтверждены экспериментальным путем. Однако результаты не могут быть в достаточной степени достигнуты только введением молочнокислых бактерий крупному рогатому скоту через рот, так как молочнокислые бактерии ослабевают или погибают в рубце, и это до сих пор не стало практическим способом для крупного рогатого скота. В целях решения этой проблемы молочнокислые бактерии должны проходить через четыре отдела желудка в живом состоянии.
В заявке на патент Японии JP 2011-125217 А (патентный документ 1) раскрывается композиция добавки в корм для жвачных животных, содержащая, по меньшей мере, одно защитное вещество, выбранное из гидрогенизированного растительного масла или гидрогенизированного масла животного происхождения, имеющего температуру плавления от 50°С до 90°С, лецитин, кислую или нейтральную аминокислоту и воду. В данном способе смесь масел и жиров, лецитина и аминокислот формуется с помощью гранулятора и затем подвергается затвердеванию в воде для ее гранулирования. Гранулированный продукт обладает способностью прохождения через рубец без разрушений и может повысить продукцию молока лактирующих коров.
В композиции добавки по патентному документу 1 масла и жиры используются в качестве защитного вещества, благодаря чему аминокислота и тому подобное не разлагаются в рубце. Кроме того, значение содержания функционального компонента находится в диапазоне от 40 до 60 вес.%. Однако функциональный компонент пропускается в рубце вследствие разрушения за счет «жевания жвачки», то есть, пережевывания содержимого рубца. Следовательно, он должен поступать в организм в большом количестве для получения ожидаемых результатов. Композиции также требуют сложных способов обработки в зависимости от химических свойств индивидуального функционального вещества, а также способ обработки сам по себе обладает низкой универсальностью. Следовательно, необходима разработка новых способов обработки в зависимости от индивидуального функционального вещества с целью разработки новых проходящих через желудок без разрушений масел и жиров корма, требующая много времени и больших затрат, перед его разработкой.
В заявке на патент Японии JP 2009-159934 А (патентный документ 2) раскрывается кормовая добавка для предоставления жвачным животным, в которой витамин С защищен первичным инкапсулирующим витамин С связующим покрывающим веществом и затем вторичными инкапсулирующими его очень отвержденными маслами и жирами. В патентном документе 2 раскрывается, что добавка имеет высокую скорость прохождения через рубец без разрушений. Первичный инкапсулированный материал получают добавлением такой фруктозы и/или пропиленгликоля в кремнезем и гидрогенизированные масла, вторичный инкапсулированный материал является гидрогенизированным стеарином пальмового масла (смотри примеры в патентном документе 2). Данный способ применяется только для витамина С, и его трудно применить для других функциональных компонентов. Кроме того, существует высокий риск разрушения за счет пищеварения в рубце в результате пережевывания.
В заявке на патент Японии JP 2009-535056 А (патентный документ 3) раскрывается способ получения защищенного от распада в рубце холина для обеспечения холина (вещества для водорастворимого витамина) лактирующим коровам, при этом способ включает стадии нанесение холина на носитель, покрытие гидрогенизированным маслом, затем выбор материала, имеющего небольшой размер частиц, из этого, и двукратное покрытие маслом и жиром. Данный способ также применяется только для холина, и его трудно применить для других веществ. Кроме того, существует высокий риск разрушения за счет пищеварения в рубце в результате пережевывания.
В заявке на патент Японии JP 2001-120189 А (патентный документ 4) раскрывается композиция для обеспечения жирной кислоты жвачным животным. При пероральном введении соли кальция жирной кислоты из рыбьего жира, например, скумбрии и тунца, жвачным животным с использованием композиции можно получить молоко и мясо, содержащие большие количества DHA или EPA рыбьего жира, повышением удельного веса соли кальция жирной кислоты из рыбьего жира и регулированием размера частиц не более 3 мм. Данный способ также применяется только для рыбьего жира, и его трудно применить для других веществ. Кроме того, удельный вес и размер частиц композиции ограничены, а прочность на разрыв не определяется.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Патентные документы
Патентный документ 1: JP 2011-125217 A
Патентный документ 2: JP 2009-159934 A
Патентный документ 3: JP 2009-535056 A
Патентный документ 4: JP 2001-120189 A
ЦЕЛИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к препарату для перорального введения жвачным животным, который достигает нижней части пищеварительного тракта без разложения в рубце, не подвергаясь разрушению в результате жевания жвачки, и распадается и растворяется in vivo.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В целях решения проблем настоящее изобретение обеспечивает следующие варианты осуществления.
[1] Препарат для перорального введения жвачным животным, при этом удельный вес находится в диапазоне от 1,17 до 2,00, максимальный размер частиц находится в диапазоне от 4 до 10 мм, и минимальный размер частиц находится в диапазоне от 4 до 10 мм, и прочность на разрыв части, имеющей минимальный размер частиц, в условиях температуры тела жвачных животных находится в диапазоне от 0,5 до 5,0 Н.
[2] Препарат для перорального введения жвачным животным, при этом препарат для перорального введения представляет собой бесшовную капсулу, содержащую ядро, и, по меньшей мере, один слой поверхностной пленочной оболочки, покрывающей ядро, при этом и ядро и поверхностная пленочная оболочка содержат регулятор удельного веса, и при этом ядро дополнительно содержит носитель и лекарственное средство для жвачных животных.
[3] Препарат для перорального введения жвачным животным, при этом поверхностная пленочная оболочка состоит из двух слоев: внутренней пленочной оболочки, непосредственно контактирующей с ядром, и наружной пленочной оболочки в качестве внешнего слоя,
при этом ядро дополнительно содержит регулятор удельного веса,
при этом внутренняя пленочная оболочка содержит регулятор удельного веса и маслянистое вещество, имеющее температуру плавления от 45°С до 90°С, и
при этом внешняя пленочная оболочка формируется из композиции пленочной оболочки, содержащей полисахарид, регулятор удельного веса и пластификатор.
[4] Препарат для перорального введения жвачным животным, при этом ядро имеет температуру плавления от 32°С до 44°С.
[5] Препарат для перорального введения жвачным животным, при этом лекарственное средство для жвачных животных выбирают из группы, состоящей из экстракта лекарственного растения, настойки, лекарственного средства, растительного экстракта, экстракта животного происхождения, экстракта из микроорганизма, экстракта микробиологического производства, фруктового сока, функциональных полисахаридов, полифенолов, витамина С, витамина из группы В, аминокислот, микроорганизмов, бактерий, эфирного масла, ω-3 жирных кислот, ω-6 жирных кислот, ω-9 жирных кислот и их комбинаций.
[6] Способ получения препарата для перорального введения жвачным животным, включающий стадии:
с помощью первой форсунки, второй форсунки и третьей форсунки при условии, что они концентрически расположены и имеют радиус, последовательно возрастающий от первой форсунки до третьей форсунки, эжектирование композиции для приготовления ядра через первую форсунку, эжектирование композиции для приготовления внутренней пленочной оболочки через вторую форсунку и эжектирование композиции пленочной оболочки через третью форсунку одновременно с формированием комбинированного потока, и
выброс комбинированного потока в раствор масла,
при этом композиция для приготовления ядра содержит регулятор удельного веса, носитель и лекарственное средство для жвачных животных,
при этом композиция для приготовления внутренней пленочной оболочки содержит регулятор удельного веса и маслянистое вещество, имеющее температуру плавления от 45°С до 90°С, и
при этом композиция пленочной оболочки содержит полисахарид, регулятор удельного веса, и пластификатор.
[7] Препарат для перорального введения жвачным животным, полученный данным способом, при этом удельный вес находится в диапазоне от 1,17 до 2,00, максимальный размер частиц находится в диапазоне от 4 до 10 мм, и минимальный размер частиц находится в диапазоне от 4 до 10 мм, и прочность на разрыв части, имеющей минимальный размер частиц, в условиях температуры тела жвачных животных находится в диапазоне от 0,5 до 5,0 Н.
[8] Корм для жвачных животных, содержащий препарат для перорального введения жвачным животным.
[9] Способ введения жвачным животным лекарственного средства для жвачных животных, при этом препарат для перорального введения перорально вводят жвачным животным.
РЕЗУЛЬТАТЫ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения получали частицы, имеющие различный удельный вес и различный размер, и частицы для перорального введения жвачным животным. В результате авторы настоящего изобретения экспериментально установили, что существуют значения удельного веса и размера частиц такие, при которых большое количество макрочастиц выводится из организма жвачных животных в виде перорально введенных макрочастиц. На основе полученных экспериментальных результатов, которые описаны выше, дополнительно получали макрочастицы, имеющие различную прочность на разрыв (прочность на разрыв части, имеющей минимальный размер частиц) и перорально вводили жвачным животным, и оптимальное значение прочности на разрыв выбирали измерением концентрации лекарственного средства, содержащегося в макрочастицах, в крови. На основе этих экспериментов были установлены удельный вес, размер частиц и прочность на разрыв, которые являются оптимальными для препарата для перорального введения. Затем посредством получения препарата для перорального введения, удовлетворяющего экспериментально установленным условиям, было экспериментально подтверждено, что функциональный компонент не разлагается в рубце жвачных животных, проходит через рубец в сычуг, чтобы достигнуть нижней части пищеварительного тракта в и после тонкого кишечника, и препарат для перорального введения распадается в результате перистальтического движения.
То есть в настоящем изобретении, были установлены удельный вес, размер частиц и прочность на разрыв, которые являются оптимальными относительно препарата для перорального введения. Если функциональный компонент включен в препарат для перорального введения, удовлетворяющий этим условиям, и его перорально вводят жвачным животным, то функциональный компонент может достоверно и эффективно усваиваться жвачными животными.
При использовании препарата для перорального введения по настоящему изобретению лекарственные средства для жвачных животных, которые раньше могли быть введены только способом, таким как инъекция, могут достигать нижней части пищеварительного тракта и поступать в организм исключительно добавлением его, например, в корм для жвачных животных и тому подобное. Следовательно, введение и поступление внутрь лекарственного средства для жвачных животных становится очень легким по сравнению с традиционными методами.
Кроме того, на основании препарата для перорального введения по настоящему изобретению можно вводить лекарственное средство для жвачных животных простым изменением типа лекарственного средства для включения в ядро препарата для перорального введения. Следовательно, можно легко получить препарат для перорального введения в зависимости от различных лекарственных средств, а также технологичность и универсальность являются очень высокими, в связи с этим существует преимущество возможности применения к различным типам лекарственных средств.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
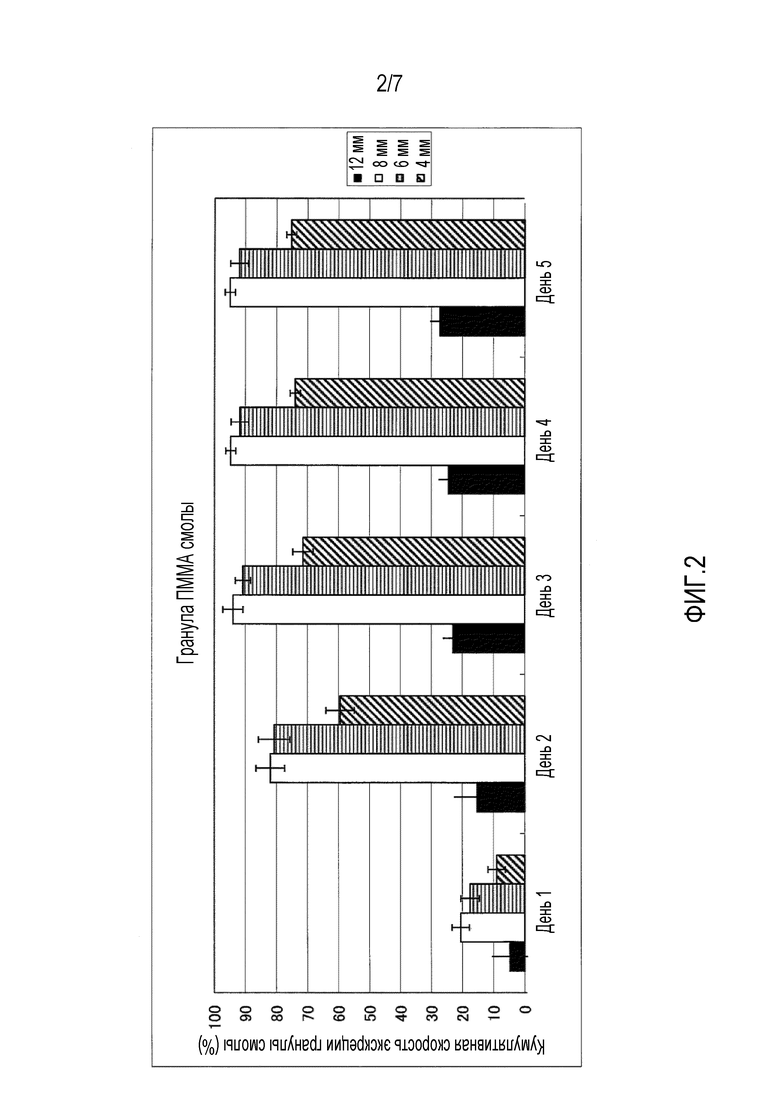
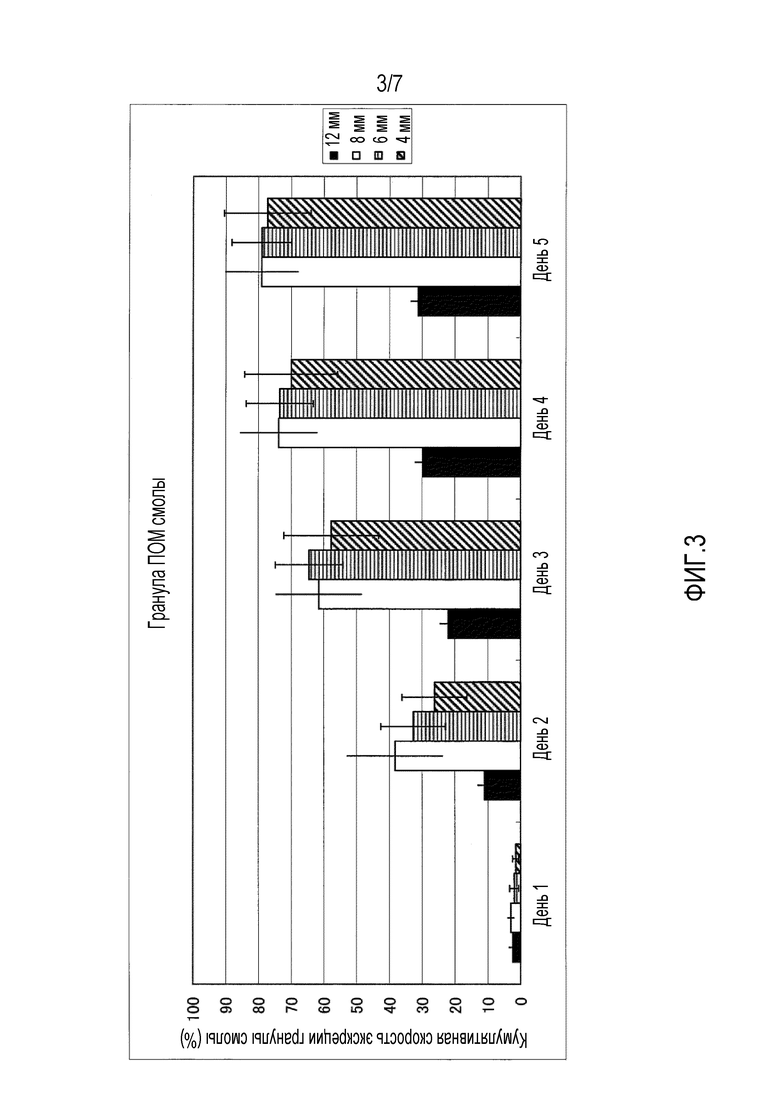
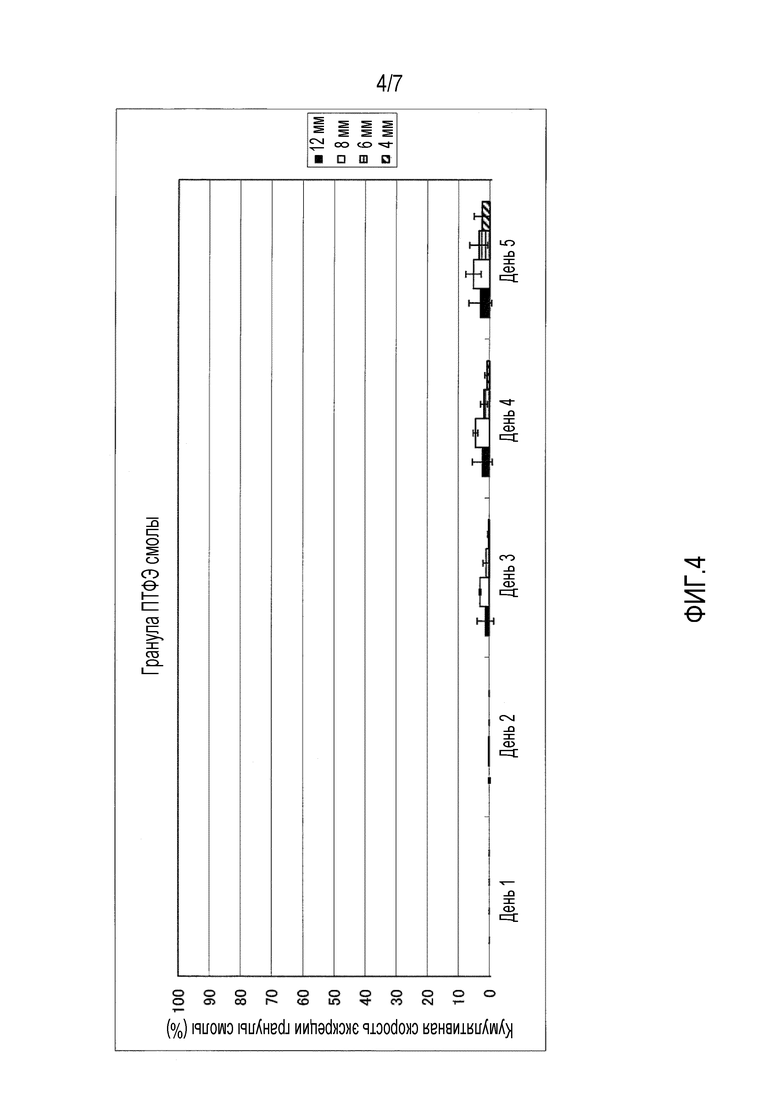
На фиг.1-фиг.4 представлены графики, иллюстрирующие кумулятивную скорость экскреции гранул с каждым диаметром в случае введения гранул разного типа смолы, то есть, гранул, имеющих различный удельный вес, для крупного рогатого скота.
На фиг.1 представлен график, иллюстрирующий измеренные параметры гранул полиэтилена (ПЭ) высокой плотности.
На фиг.2 представлен график, иллюстрирующий измеренные параметры гранул поли(метилметакрилата) (ПММА).
На фиг.3 представлен график, иллюстрирующий измеренные параметры гранул полиоксиметилена (ПОМ).
На фиг.4 представлен график, иллюстрирующий измеренные параметры гранул политетрафторэтилена (ПТФЭ).
На фиг.5 представлен график, иллюстрирующий сравнение гранул четырех типов смол, имеющих размер частиц 6 мм, то есть сравнительные данные в отношении удельного веса.
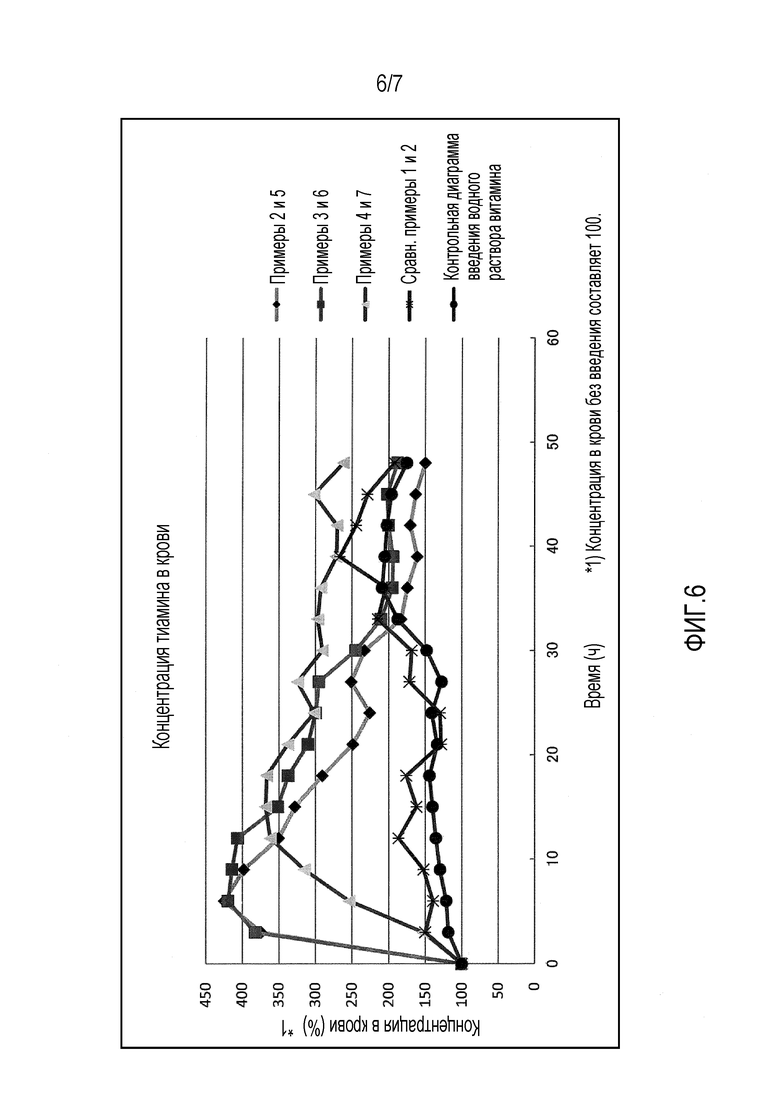
На фиг.6 представлен график, иллюстрирующий зависящее от времени изменение концентрации тиамина в крови, если капсулы, содержащие витамин В1, из примеров 2-7 и сравнительных примеров 1 и 2, перорально вводят шести взрослым особям крупного рогатого скота принудительно с использованием устройства для перорального введения. В качестве контроля также представлен график, иллюстрирующий зависящее от времени изменение концентрации тиамина в крови, если перорально вводят водный раствор витамина В1.
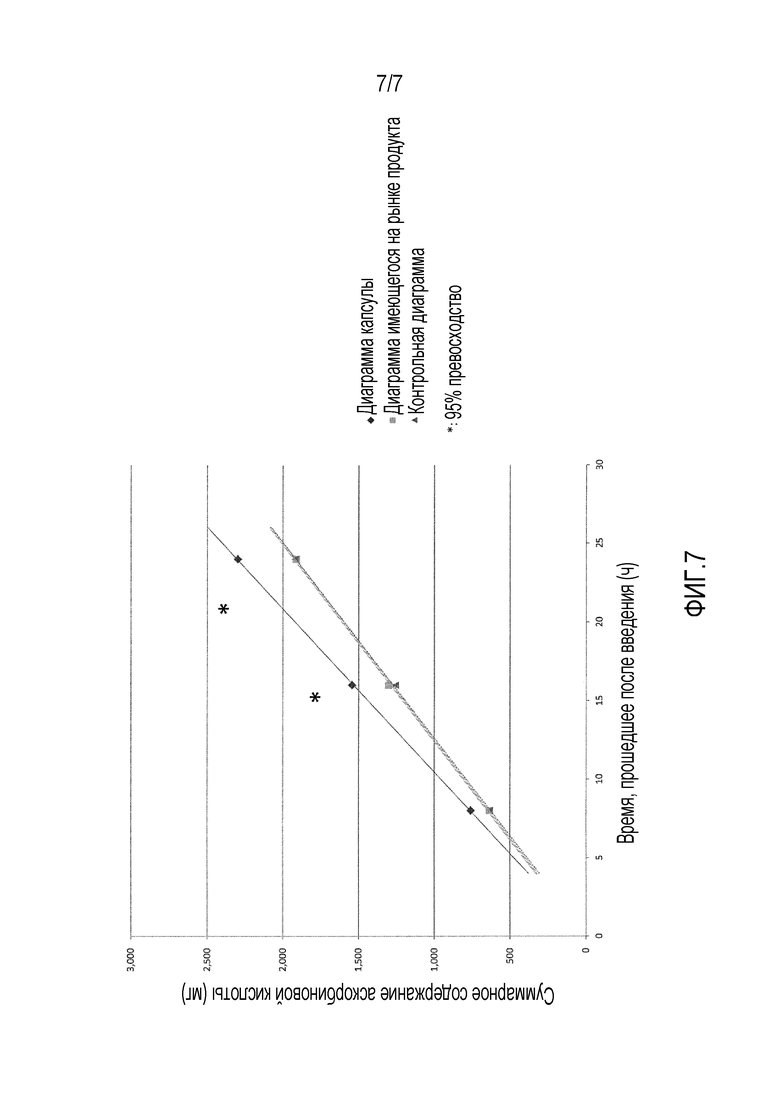
На фиг.7 представлен график, иллюстрирующий кумулятивную экскрецию аскорбиновой кислоты с мочой, если витамин С 30% Bypass (производства YPTECH Co., Ltd) и капсулу из примера 8 перорально вводят шести взрослым особям крупного рогатого скота в таком количестве, что витамин С составляет 30 г, принудительно с использованием устройства для перорального введения.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
В настоящем изобретении было экспериментально установлено, что существует гранула смолы такая, которую очень трудно пережевывать и которая быстро достигает нижней части пищеварительного тракта введением гранул смолы, имеющих различный удельный вес и/или размер частиц, домашнему скоту, такому как крупный рогатый скот, и определением их скорости прохождения. На основе экспериментальных результатов было экспериментально подтверждено, что существуют значения удельной плотности и размера частиц эффективные относительно препарата для перорального введения жвачным животным. Размер частиц, в частности, означает как максимальный размер частиц, так и минимальный размер частиц. Препарат для перорального введения по настоящему изобретению может иметь различные формы, но и максимальный размер частиц, и минимальный размер частиц должен быть в пределах указанного диапазона.
Затем в настоящем изобретении было подтверждено поступление и всасывание лекарственного средства в желудочно-кишечном тракте включением лекарственного средства в капсулы, имеющие различную прочность на разрыв части, имеющей минимальный размер частиц, и определением зависимого от времени изменения концентрации лекарственного средства в крови после введения скоту, такому как крупный рогатый скот, по сравнению со случаем перорального введения лекарственного средства без включения в капсулу. Посредством этого эксперимента была установлена прочность на разрыв части, имеющей минимальный размер частиц, такая, которая может наиболее эффективно отражаться на концентрации в крови. В качестве причины определения прочности на разрыв части, имеющей минимальный размер частиц капсулы, это вызвано тем, что формирование структуры такой, что лекарственное средство, включенное в капсулу, высвобождается разрушением капсулы за счет перистальтических движений нижней части пищеварительного тракта, происходит на основе минимального размера частиц, так что прочность на разрыв капсулы является самой низкой. В частности, прочность на разрыв в настоящем изобретении относится к прочности на разрыв при условиях окружающей среды 39°C, что является температурой тела крупного рогатого скота.
В результате этих экспериментов было установлено, что для препарата для перорального введения жвачным животным по настоящему изобретению требуется соблюдение следующих условий: удельный вес находится в диапазоне от 1,17 до 2,00, максимальный размер частиц находится в диапазоне от 4 до 10 мм, и минимальный размер частиц находится в диапазоне от 4 до 10 мм, и прочность на разрыв части, имеющей минимальный размер частиц, находится в диапазоне от 0,5 до 5,0 Н. Удельный вес буквально означает удельный вес препарата для перорального введения целиком, который определяется делением веса препарата для перорального введения на его объем. Удельный вес препарата для перорального введения по настоящему изобретению находится в диапазоне предпочтительно от 1,20 до 1,70, более предпочтительно от 1,25 до 1,45. Если удельный вес менее 1,17, то существует низкая вероятность того, что препарат для перорального введения выводится из организма в неизмененном виде при введении жвачным животным. Поскольку удельный вес является низким, то препарат для перорального введения флотирует в желудке жвачных животных, и это вероятно вследствие того, что оно многократно подвергается пережевыванию. С другой стороны если удельный вес превышает 2,00, то эффективность выведения снижается, или препарат для перорального введения не выводится из организма при введении жвачным животным. Поскольку удельный вес является высоким, то препарат для перорального введения локализуется в желудке жвачных животных, и это вероятно вследствие того, что труднее осуществить активный транспорт в нижнюю часть пищеварительного тракта, чем в желудок жвачных.
Для препарата для перорального введения по настоящему изобретению требуется, что максимальный размер частиц находится в диапазоне от 4 до 10 мм, и минимальный размер частиц находится в диапазоне от 4 до 10 мм. Оба и максимальный размер частиц, и минимальный размер частиц находятся в диапазоне предпочтительно от 5 до 9 мм, более предпочтительно от 6 до 8 мм. Препарат для перорального введения может иметь любую форму (макрочастицы), но предпочтительно он имеет сферическую форму, так как лекарственное средство для жвачных животных включается в него, а внутренний объем увеличивается до максимума. Если он имеет сферическую форму, то максимальный размер частиц и минимальный размер частиц имеют приблизительно одинаковые значения относительно друг друга, которые являются диаметром сферы. Препарат для перорального введения по настоящему изобретению может иметь кубическую форму, форму прямоугольного параллелепипеда, коническую форму, цилиндрическую форму и тому подобное, но и максимальный размер частиц, и минимальный размер частиц должны быть в пределах вышеуказанного диапазона.
В контексте данного документа максимальный размер частиц и минимальный размер частиц препарата для перорального введения являются значениями, измеренными проведением цифровой обработки с использованием микроскопа, такого как цифровой микроскоп. Примеры цифрового микроскопа включают, например, серии VHX (такие, как VHX-2000, VHX-5000) производства KEYENCE Corporation и тому подобное.
Препарат для перорального введения по настоящему изобретению обладает прочностью на разрыв его части, имеющей минимальный размер частиц, от 0,5 до 5,0 Н. Прочность на разрыв находится в диапазоне предпочтительно от 0,6 до 4,8 Н, более предпочтительно от 0,7 до 4,7 Н. Прочность на разрыв части, имеющей минимальный размер частиц, представляет собой легкость расщепления препарата для перорального введения и может быть определена с использованием обычного устройства для измерения физических свойств, такого как комплексное устройство для измерения физических свойств (реометр, производства Sun Scientific Co., Ltd), вдавливанием цилиндрического поршня, имеющего диаметр 10 мм, против препарата для перорального введения в направлении минимального размера частиц (при скорости подачи 20 мм/мин) и измерением нагрузки, необходимой для разрушения препарата для перорального введения. Если прочность на разрыв части, имеющей минимальный размер частиц, составляет менее 0,5 Н, то препарат для перорального введения легко распадается в результате пережевывания жвачными животными; или распадается прежде, чем достигает нижней части пищеварительного тракта в результате конвекции, вызванной в рубце и ретикулуме во время жевания жвачки, или нагрузки, вызванной активным транспортированием в нижнюю часть пищеварительного тракта, чем в рубец; и лекарственное средство, включенное в препарат для перорального введения, пропускается и разлагается микроорганизмами в рубце. С другой стороны, если прочность на разрыв части, имеющей минимальный размер частиц, превышает 5,0 Н, то препарат для перорального введения не распадается в результате перистальтического движения в нижней части пищеварительного тракта жвачных животных и выводится из организма в неизмененном виде, и невозможно высвобождение лекарственного средства в организме жвачных животных.
В настоящем изобретении если препарат для перорального введения удовлетворяет требованиям к удельному весу, максимальному размеру частиц, минимальному размеру частиц и прочности на разрыв части, имеющей минимальный размер частиц, то он достигает нижней части пищеварительного тракта жвачных животных из желудка, включая рубец у жвачных животных, без особых повреждений, и легко вводится лекарственное средство, включенное в препарат для перорального введения жвачным животным. Препарат для перорального введения может представлять собой таблетку, пилюлю, гранулу или капсулу, но особенно предпочтительной является сферическая капсула, в частности бесшовная капсула, так как внутренний объем увеличивается до максимума.
Далее будет подробно описан случай, когда препарат для перорального введения является бесшовной капсулой. Желательно препарат для перорального введения по настоящему изобретению представляет собой бесшовную капсулу, содержащую ядро, и, по меньшей мере, один слой поверхностной пленочной оболочки, покрывающей ядро; и носитель, и лекарственное средство для жвачных животных содержатся в композиции хотя бы ядра.
Поверхностная пленочная оболочка бесшовной капсулы состоит из одного или более слоев пленочной оболочки. Поверхностная пленочная оболочка предпочтительно имеет двухслойную структуру, и предпочтительно состоит из внутренней пленочной оболочки, непосредственно контактирующей с ядром, и наружной пленочной оболочки в качестве внешнего слоя. Внутренняя пленочная оболочка предпочтительно содержит регулятор удельного веса и маслянистое вещество, имеющее температуру плавления от 45°С до 90°С. Кроме того, внешняя пленочная оболочка формируется из композиции пленочной оболочки, содержащей полисахарид, регулятор удельного веса и пластификатор.
Ядро
Ядро содержит носитель и лекарственное средство. Носитель, используемый для ядра, не имеет особых ограничений до тех пор, пока он является веществом для разбавления, захвата и удерживания лекарственного средства для жвачных животных без разложения лекарственного средства. Носитель предпочтительно имеет температуру плавления от 10°С до 45°С, более предпочтительно от 15°С до 40°С, и может представлять собой гидрофильный растворитель или негидрофильный растворитель. С точки зрения производства носитель предпочтительно представляет собой жидкость во время производства бесшовных капсул. Кроме того, с точки зрения стабильности при хранении носитель предпочтительно представляет собой твердое вещество во время хранения или перорального введения бесшовной капсулы. Тип вещества, используемого для носителя, может быть соответственно определен в зависимости от температуры при производстве и температуры хранения. В качестве носителя соответственно используется, например, такое вещество, которое представляет собой жидкость при температуре от 15°С до 45°С, предпочтительно от 15°С до 44°С, более предпочтительно от 20°С до 44°С. С другой стороны, в качестве носителя для препарата для перорального введения, используемого в местности с холодным климатом, соответственно используется такое вещество, которое представляет собой жидкость при температуре от 4°С до 20°С. Кроме того, в качестве носителя для препарата для перорального введения, используемого в тропических регионах, соответственно используется такое вещество, которое представляет собой жидкость при температуре от 25°С до 60°С.
Примеры носителей включают, например, масла и жиры и их производные, сложные эфиры жирных кислот, углеводороды (такие как алифатические углеводороды, ароматические углеводороды и тому подобное), простые эфиры, высшие спирты, терпены, стеролы, силиконы, пчелиный воск и его производные, и аналогичные фосфолипиды и тому подобное. Данные вещества можно использовать отдельно или можно использовать в комбинации двух или более из них.
Примеры масел и жиров и их производных включают соевое масло, рисовое масло, кунжутное масло, пальмовое масло, пальмоядровое масло, кукурузное масло, арахисовое масло, хлопковое масло, кокосовое масло, рапсовое масло, оливковое масло, какао-масло, говяжий жир, свиной жир, лошадиный жир, китовый жир, маргарин, шортенинг и гидрогенизированные масла и тому подобное.
Примеры сложных эфиров жирных кислот включают сложные эфиры глицерина и жирных кислот (такие как моноглицериды жирных кислот, диглицериды жирных кислот, триглицериды жирных кислот и тому подобное), сложные эфиры жирных кислот и сахаров (такие как сложные эфиры сахарозы и жирных кислот, сложные эфиры сорбита и жирных кислот) и тому подобное. В качестве жирной кислоты, используемой в сложных эфирах жирных кислот или сложных эфирах жирных кислот и сахаров, предпочтительно используют среднецепочечные жирные кислоты (в частности, жирные кислоты, содержащие от 8 до 12 атомов углерода) и длинноцепочечные жирные кислоты (в частности, жирные кислоты, содержащие от 14 до 18 атомов углерода), но не ограничиваются ими.
Примеры углеводородов включают алифатические углеводороды, такие как петролейный эфир, пентан, гексан, гептан, октан и их производные (такие как галогеналканы); и ароматические углеводороды, такие как бензол, толуол, ксилол и их производные.
Примеры простых эфиров включают дипропиловый эфир, этил-трет-бутиловый эфир и тому подобное.
Примеры высших спиртов включают дециловый спирт, додециловый спирт, миристиловый спирт, цетиловый спирт и тому подобное.
Примеры терпенов включают камфорное масло, масло мяты перечной, α-пинен, D-лимонен и тому подобное.
Среди носителей, в частности производных жиров и масел (в частности гидрогенизированных маслянистых веществ жиров и масел), соответственно используются среднецепочечные жирные кислоты или длинноцепочечные, такие как триглицериды или диглицериды среднецепочечных жирных кислот или длинноцепочечных жирных кислот, и тому подобное с точки зрения стабильности при хранении лекарственного средства, включенного в состав для жвачных животных, и удобной лекарственной формы.
При необходимости ядро может дополнительно содержать эмульгирующие вещества, такие как сложные эфиры глицерина и жирных кислот, сложные эфиры полиглицерина и жирных кислот, сложные эфиры глицерина с янтарной кислотой и жирной кислотой, сложные эфиры сахарозы и жирных кислот, сложные эфиры сорбита и жирных кислот, лецитин. Данные эмульгирующие вещества можно использовать отдельно или можно использовать в комбинации двух или более из них.
Лекарственное средство для жвачных животных, включенное в ядро, может представлять собой любое лекарственное средство до тех пор, пока оно обеспечивает эффект улучшения на рост, состояние при болезни, питание, регуляцию кишечной секреции и тому подобное у жвачных животных. Лекарственное средство может представлять собой или растворимые в воде вещества, или нерастворимые в воде вещества. Примеры лекарственных средств для жвачных животных включают, например, лекарственные экстракты, такие как экстракт Kakkonto, экстракт Shosaikoto; настойки, такие как горькая настойка, настойка корней соссюреи; ацетаминофен, мексилетина гидрохлорид, акарбозу, кромолин натрия, правастатин натрия и тому подобное.
Другие примеры лекарственных средств для жвачных животных по настоящему изобретению включают, например, растительные экстракты, такие как экстракт из мякоти сливы, экстракт Momordica grosvenori, экстракт граната, экстракт черники; экстракты животного происхождения, такие как экстракт пресноводного моллюска; экстракты из микроорганизмов, такие как дрожжевой экстракт; вещества микробиологического производства; фруктовый сок, такой как лимонный сок, яблочный сок, виноградный сок, персиковый сок; функциональные полисахариды, такие как мукополисахарид; хлорелла; пептид; полифенолы; витамин С; витамин из группы В; аминокислота; полезные микроорганизмы или бактерии, такие как молочнокислые бактерии, дрожжи, фототрофные бактерии, актиномицеты; эфирное масло, полученное из сассафраса, гвоздики, шалфея, эвкалипта, дамасской розы, Mayorama, корицы, лимона, лайма, грейпфрута и апельсина; ω-3 жирные кислоты, такие как α-линоленовая кислота, стеаридоновая кислота, эйкозатриеновая кислота, эйкозатетраеновая кислота, эйкозапентаеновая кислота, докозапентаеновая кислота, докозагексаеновая кислота, тетракозапентаеновая кислота, тетракозагексаеновая кислота; ω-6 жирные кислоты, такие как линолевая кислота, γ-линоленовая кислота, эйкозадиеновая кислота, дигомо-γ-линоленовая кислота, арахидоновая кислота, докозадиеновая кислота, докозатетраеновая кислота, докозапентаеновая кислота, календовая кислота и тому подобное; ω-9 жирные кислоты, такие как олеиновая кислота и тому подобное.
Ядро формируется смешиванием носителя и лекарственного средства для жвачных животных. Весовое соотношение лекарственного средства и носителя составляет не более 400 весовых частей, предпочтительно 100 весовых частей лекарственного средства в пересчете на 100 весовых частей носителя. Если количество лекарственного средства составляет более 400 весовых частей, то растекаемость композиции для приготовления ядра во время производства бесшовной капсулы снижается, и существует вероятность затруднения при производстве бесшовной капсулы.
Ядро, являющееся составной частью препарата для перорального введения по настоящему изобретению, необязательно может содержать регулятор удельного веса с целью регулирования удельного веса капсулы. Регулятор удельного веса предпочтительно представляет собой пигмент, более предпочтительно неорганический пигмент, красочный пигмент, неорганический люминофор и тому подобное, в частности предпочтительны неорганические пигменты, такие как диоксид титана, оксид цинка, оксид железа (полуторная окись железа), диоксид кремния, карбонат кальция, тальк и слюда, но не ограничивается ими. Регулятор удельного веса можно использовать отдельно или можно использовать в комбинации двух или более из них. При использовании регулятора удельного веса его содержание находится в диапазоне предпочтительно от 0,1 до 60 вес.%, более предпочтительно от 0,1 до 50 вес.% в пересчете на общее содержание твердых веществ ядра.
В препарате для перорального введения по настоящему изобретению ядро имеет температуру плавления предпочтительно от 32°С до 44°С, более предпочтительно от 34°С до 42°С. Если температура плавления ядра ниже 32°С, то прочность на разрыв части, имеющей минимальный размер частиц, препарата для перорального введения составляет менее 0,5 Н, при введении жвачным животным капсула распадается до достижения нижней части пищеварительного кишечного тракта в результате конвекции, вызванной в рубце и ретикулуме во время жевания жвачки или нагрузки, вызванной активным транспортированием в нижнюю часть пищеварительного тракта, чем в рубец, и лекарственное средство, включенное в капсулу, пропускается и существует низкая вероятность, что лекарственное средство отражается в концентрации в крови. С другой стороны если температура плавления ядра превышает 44°С, то прочность на разрыв части, имеющей минимальный размер частиц, препарата для перорального введения превышает 5,0 Н, при введении жвачным животным капсула не распадается в результате перистальтического движения в нижней части пищеварительного тракта жвачных животных, и существует вероятность того, что капсула выводится из организма вместе с фекалиями, в то время как лекарственное средство, включенное в капсулу, не отражается в концентрации в крови.
Внутренняя пленочная оболочка
Препарат для перорального введения по настоящему изобретению предпочтительно имеет внутреннюю пленочную оболочку между ядром и наружной пленочной оболочки, которая является внешним слоем. Внутренняя пленочная оболочка предпочтительно содержит маслянистое вещество, имеющее температуру плавления от 45°С до 90°С. Внутренняя пленочная оболочка может дополнительно содержать необязательный регулятор удельного веса. Маслянистое вещество, являющееся составной частью внутренней пленочной оболочки, имеет температуру плавления более предпочтительно от 45°С до 80°С, еще более предпочтительно от 50°С до 70°С. Для препарата для перорального введения по настоящему изобретению можно соответственно проектировать получаемую прочность на разрыв препарата для перорального введения в диапазоне от 0,5 до 5,0 Н, обеспечивая внутреннюю пленочную оболочку, содержащую маслянистое вещество между ядром и наружной пленочной оболочки. Примеры маслянистых веществ включают, например, жиры и масла, жирные кислоты, воски, сложные эфиры жирных кислот, высшие спирты, стерины, силиконы, парафины, пчелиный воск, фосфолипиды и их производные (такие как гидрогенизированные масла или частично гидрогенизированные масла и тому подобное), которые имеют температуру плавления от 45°С до 90°С. Данные вещества можно использовать отдельно или можно использовать в комбинации двух или более из них. Среди них один или более компонентов, выбранных из группы, состоящей из жиров и масел и их производных, жирных кислот и восков, предпочтительно используются в качестве маслянистого вещества.
Примеры жиров и масел и их производных включают, например, какао-масло, говяжий жир, свиной жир, лошадиный жир, китовый жир, маргарин, шортенинг, отвержденное рисовое масло (такое как сильно отвержденное рисовое масла и неполностью отвержденное рисовое масла и тому подобное), гидрогенизированное касторовое масло, гидрогенизированное рапсовое масло, гидрогенизированное пальмовое масло, гидрогенизированное пальмоядровое масло, гидрогенизированный рыбий жир и тому подобное.
Примеры жирных кислот включают, например, пальмитиновую кислоту, стеариновую кислоту, миристиновую кислоту и тому подобное.
Примеры восков включают, например, рисовый воск, карнаубский воск, канделильский воск, парафин и тому подобное.
Жиры и масла, описанные в вышеуказанном носителе, такие как сложные эфиры жирных кислот или высшие спирты, необязательно можно смешивать с маслянистым веществом. Однако необходимо использовать жиры и масла в таком количестве, что температура плавления внутренней пленочной оболочки находится в диапазоне от 45°С до 90°C.
Необязательно внутренняя пленочная оболочка может дополнительно содержать эмульгирующие вещества, такие как сложные эфиры глицерина и жирных кислот, сложные эфиры полиглицерина и жирных кислот, сложные эфиры сахарозы и жирных кислот, сложные эфиры сорбита и жирных кислот, лецитин и тому подобное. Данные эмульгирующие вещества можно использовать отдельно или можно использовать в комбинации двух или более из них.
Внутренняя пленочная оболочка может дополнительно содержать регулятор удельного веса. В качестве регулятора удельного веса соответственно используется те, которые описаны в объяснении ядра. При использовании регулятора удельного веса его содержание находится в диапазоне предпочтительно от 0,1 до 60 вес.%, более предпочтительно от 0,1 до 50 вес.% в пересчете на общее содержание твердых веществ внутренней пленочной оболочки.
Наружная пленочная оболочка
В качестве наружной пленочной оболочки можно использовать ту, которую используют обычно как верхний слой бесшовной капсулы. Примеры наружных пленочных оболочек включают, например, наружную пленочную оболочку, сформированную из композиции пленочной оболочки, содержащей полисахариды, регулятор удельного веса и пластификатор.
Примеры полисахаридов, которые не ограничиваются ими, включают, например, декстрин, крахмал, агар, каррагинан, аравийскую камедь, геллановую камедь, ксантановую камедь, пектин, альгиновую кислоту и их производные. Полисахариды являются компонентами, формирующими пленочную оболочку. Содержание полисахаридов находится в диапазоне предпочтительно от 50 до 95 вес.%, более предпочтительно от 50 до 90 вес.% в пересчете на общее содержание твердых веществ в композиции пленочной оболочки капсулы.
Пластификаторы обычно используют с целью изменения свойств получаемой пленочной оболочки. Примеры пластификаторов, которые соответственно используются, включают многоатомные спирты, такие как глицерин, этиленгликоль, полиэтиленгликоль, пропиленгликоль, полипропиленгликоль; сахарные спирты, такие как мальтит, маннит, сорбит, эритрит; или трегалозу. Пластификаторы можно использовать отдельно или можно использовать в комбинации двух или более из них. При использовании пластификатора его содержание находится в диапазоне предпочтительно от 1 до 40 вес.%, более предпочтительно от 5 до 30 вес.% в пересчете на общее содержание твердых веществ в композиции пленочной оболочки капсулы.
Регулятор удельного веса используют с целью регулирования удельного веса капсулы. Регулятор удельного веса предпочтительно представляет собой пигмент, более предпочтительно неорганический пигмент, красочный пигмент, неорганический люминофор, в частности предпочтительны неорганические пигменты, такие как диоксид титана, оксид цинка, оксид железа (полуторная окись железа), диоксид кремния, карбонат кальция, тальк и слюда, но не ограничивается ими. Регулятор удельного веса можно использовать отдельно или можно использовать в комбинации двух или более из них. Регулятор удельного веса можно использовать в количестве в диапазоне предпочтительно от 0,1 до 60 вес.%, более предпочтительно от 0,1 до 50 вес.% в пересчете на общее содержание твердых веществ в композиции пленочной оболочки капсулы.
Наружная пленочная оболочка по настоящему изобретению может необязательно содержать различные добавки, обычно используемые в данной области техники, которые включают отдушки, подсластители, красители, консерванты, такие как парабен, в дополнение к вышеуказанной композиции. При использовании таких добавок общее содержание всех добавок находится в диапазоне, например, от 0,01 до 10 вес.%, предпочтительно от 0,1 до 5 вес.% в пересчете на общее содержание твердых веществ в композиции пленочной оболочки капсулы.
Бесшовная капсула
Препарат для перорального введения жвачным животным по настоящему изобретению предпочтительно представляет собой бесшовную капсулу. Примеры способов получения бесшовной капсулы включают, например, способ непрерывного получения бесшовной капсулы капельным методом с использованием многоструйной насадки, такой как способы, описанные, например, в заявках на патент Японии JP 58-22062 А, JP 59-131355 А, JP 3-52639 А, JP 5-031352 А, JP 7-069867 А, но не обязательно ограничиваются данными способами.
Бесшовные капсулы можно получить, например, капельным методом с использованием многоструйной насадки. В качестве многоструйной насадки можно использовать концентрическую многоструйную насадку, имеющую двойную или более форсунку, и можно соответственно использовать концентрическую многоструйную насадку, имеющую тройную форсунку. В конкретном примере капельного метода с использованием концентрической многоструйной насадки, имеющей тройную форсунку, бесшовные капсулы можно непрерывно получать за счет межфазного натяжения, действующего между раствором масла и композицией пленочной оболочки, эжектированием композиции для приготовления ядра с получением ядра из наиболее близкой к центру форсунки концентрической многоструйной насадки, имеющей тройную форсунку, эжектированием композиции для приготовления внутренней пленочной оболочки, содержащей маслянистое вещество, из средней форсунки и эжектированием композиции пленочной оболочки из наиболее удаленной от центра форсунки одновременно с постоянной скоростью в раствор масла, непрерывно движущийся вниз при скорости в установленном режиме, для формирования комбинированного потока; и выбросом сплошного потока в раствор масла.
В данном способе получения предпочтительно композиция для приготовления ядра содержит регулятор удельного веса, носитель и лекарственное средство для жвачных животных; композиция для приготовления внутренней пленочной оболочки содержит регулятор удельного веса и маслянистое вещество, имеющее температуру плавления от 45°С до 90°C; и композиция пленочной оболочки содержит полисахарид, регулятор удельного веса и пластификатор.
В способе получения более предпочтительно нагревать концентрическую многоструйную насадку для выброса композиции для приготовления ядра, композиции для приготовления внутренней пленочной оболочки и композиции пленочной оболочки до такой температуры, при которой композиция для приготовления ядра, композиция для приготовления внутренней пленочной оболочки и композиция пленочной оболочки имеют вязкость от 10 до 300 мПа⋅с. Данная температура нагревания составляет, например, предпочтительно от 10°С до 90°С, более предпочтительно от 35°С до 90°С.
В такой бесшовной капсуле наружный слой пленочной оболочки предпочтительно имеет толщину от 30 до 400 мкм.
В бесшовной капсуле относительно препарата для перорального введения жвачным животным по настоящему изобретению удельный вес, размер частиц и прочность на разрыв части, имеющей минимальный размер частиц, должны устанавливаться в указанных диапазонах. Например, в случае бесшовной капсулы трехслойной структуры, состоящей из ядра, внутренней пленочной оболочки и наружной пленочной оболочки, удельный вес можно регулировать добавлением регулятора удельного веса для увеличения веса, по меньшей мере, одного слоя из трех слоев. В качестве регулятора удельного веса можно соответственно использовать те, которые описаны в объяснении ядра. Например, можно регулировать удельный вес полученных бесшовных капсул добавлением регулятора удельного веса, по меньшей мере, в одну из следующих композиций: композицию для приготовления ядра, композицию для приготовления внутренней пленочной оболочки и композицию пленочной оболочки. Здесь более предпочтительным является вариант осуществления бесшовной капсулы по настоящему изобретению, в котором удельный вес регулируется добавлением регулятора удельного веса в каждую из композиций: композицию для приготовления ядра, композицию для приготовления внутренней пленочной оболочки и композицию пленочной оболочки.
В случае формирования бесшовной капсулы капельным методом размер частиц можно легко регулировать установлением скорости потока охлаждающей жидкости и объема экструзии через форсунку.
Прочность на разрыв бесшовной капсулы можно регулировать, например, соответствующим выбором компонента и количеством композиции пленочной оболочки для формирования наружной пленочной оболочки. Кроме того, можно повысить прочность на разрыв выбором каждого компонента таким образом, что температура плавления находится в пределах относительно большого диапазона в ядре и маслянистом веществе внутренней пленочной оболочки. Кроме того, можно уменьшить прочность на разрыв выбором каждого компонента таким образом, что температура плавления находится в пределах относительно небольшого диапазона. Можно получить прочность на разрыв, подходящую для использования относительно препарата для перорального введения жвачным животным, регулируя температуру плавления ядра в диапазоне от 32°С до 44°С и используя маслянистое вещество, имеющее температуру плавления от 45°С до 90°С, в качестве маслянистого вещества внутренней пленочной оболочки при вышеописанном выборе.
ПРИМЕРЫ
Настоящее изобретение описано более подробно на основе следующих примеров и сравнительных примеров. Однако настоящее изобретение не должно быть истолковано как ограниченное этими примерами. В примерах части и проценты являются весовыми, если не указано иное.
ПРИМЕР 1
Четырем лактирующим коровам перорально вводили всю сотню имеющихся на рынке гранул полиэтилена (ПЭ) высокой плотности (удельный вес 0,95), поли(метилметакрилата) (ПММА) (удельный вес 1,19), полиоксиметилена (ПОМ) (удельный вес 1,41) и политетрафторэтилена (ПТФЭ) (удельный вес 2,20) с учетом каждого размера частиц 4 мм, 6 мм, 8 мм и 12 мм соответственно. На фиг.1-фиг.5 приведена кумулятивная скорость множества гранул в неизмененном виде, которые выделялись с фекалиями. На фиг.1-фиг.4 представлена кумулятивная скорость экскреции в отношении гранул из разного типа смолы, то есть кумулятивная скорость экскреции для каждого диаметра в отношении гранул, имеющих различный удельный вес. Кроме того, на фиг.1 представлены измеренные параметры гранул полиэтилена (ПЭ) высокой плотности, на фиг.2 представлены измеренные параметры гранул поли(метилметакрилата) (ПММА), на фиг.3 представлены измеренные параметры гранул полиоксиметилена (ПОМ), и на фиг.4 представлены измеренные параметры гранул политетрафторэтилена (ПТФЭ). На фиг.5 представлено сравнение четырех типов смол в гранулах, имеющих размер частиц 6 мм, то есть сравнительные данные по удельному весу.
Здесь диаметр этих гранул определяли проведением цифровой обработки с использованием цифрового микроскопа VHX-2000 (KEYENCE Corporation).
В результате гранулы поли(метилметакрилата) (ПММА), имеющие диаметр 6 мм, показывают самую высокую кумулятивную скорость экскреции, при этом подразумевается, что она превышает 90%. Кроме того, кумулятивную скорость экскреции гранул, имеющих размер частиц 6 мм и 8 мм, выше, чем у гранул, имеющих размер частиц 4 мм и 12 мм. Кумулятивная скорость экскреции гранул, имеющих удельный вес 0,95 и 2,20, является низкой, а гранулы, имеющие удельный вес 1,19 и 1,41, выделяются с более высокой скоростью.
ПРИМЕР 2
Получение бесшовной капсулы
В подогретом растворе 60 частей MELANO H1000S (гидрогенизированного пальмоядрового масла, имеющего температуру плавления 34°C (от 32°C до 36°C), производства Fuji Oil Co., Ltd.) диспергировали 20 частей тиамина гидрохлорида (производства Tokyo Kasei Kogyo Co., Ltd.) и 20 частей диоксида титана с получением композиции для приготовления ядра (дисперсии для приготовления ядра).
В подогретом растворе 70 частей сильно отвержденного рисового масла (температура плавления 53°C (от 52°C до 54°C), производства Boso oil and fat Co., Ltd.) диспергировали 30 частей диоксида титана с получением композиции для приготовления внутренней пленочной оболочки, содержащей маслянистое вещество, являющееся составной частью внутренней пленочной оболочки.
В качестве композиции пленочной оболочки, использованной для формирования наружной пленочной оболочки, 15 частей каррагинана (производства Sansho Co., Ltd.), 50,9 частей декстрина (производства Nippon Starch Chemical Co., Ltd.; показатель ДЭ менее 10), 3 части сорбита (производства Mitsubishi Shoji Foodtech Co., Ltd.), 10 частей пектина (производства Unitec Foods Co., Ltd.), 1 часть хлорида калия и 0,1 части хлорида кальция растворяли в 400 частях очищенной воды, а затем 10 частей диоксида титана диспергировали в этом с получением композиции пленочной оболочки.
Бесшовную капсулу трехслойной структуры, имеющую средний диаметр 6 мм, получали:
эжектированием композиции для приготовления ядра из первой форсунки (наиболее близкой к центру форсунки) концентрической тройной насадки, эжектированием композиции для приготовления внутренней пленочной оболочки из второй форсунки с внешней стороны первой форсунки (средней форсунки) и эжектированием композиции пленочной оболочки из третьей форсунки концентрической тройной насадки (наиболее удаленной от центра форсунки) одновременно в рапсовое масло, движущееся при нормальной температуре (20°С) в условиях температуры концентрической насадки 50°С с формированием комбинированного потока; и
выбросом комбинированного потока в раствор масла. Высушенные бесшовные капсулы получали обычной сушкой сквозным потоком полученных капсул.
Полученные высушенные бесшовные капсулы разделяли с использованием контрольных сит JIS (JIS Z 8801-1).
Максимальный размер частиц и минимальный размер частиц бесшовных капсул, полученных, как описано выше, определяли проведением цифровой обработки с использованием цифрового микроскопа VHX-2000 (производства KEYENCE Corporation). Результаты представлены в нижеследующей таблице 1.
ПРИМЕРЫ С 3 ПО 8 И СРАВНИТЕЛЬНЫЕ ПРИМЕРЫ С 1 ПО 6
В примерах с 3 по 8 и сравнительных примеров с 1 по 6 высушенные бесшовные капсулы получали в соответствии с процедурой, описанной в примере 2, за исключением того, что соотношения композиций ядра, промежуточного слоя и пленочной оболочки были изменены, как показано в таблице 1.
Таблица 1-1.
Таблица 1-2.
L-аскорбиновая кислота: производства Wako Pure Chemical Industries, Ltd.
Melano Н1000: гидрогенизированное пальмоядровое масло производства Fuji Oil Co., Ltd., температура плавления 38°С (от 36°С до 40°С).
Melano H3000: гидрогенизированное пальмоядровое масло производства Fuji Oil Co., Ltd., температура плавления 42°С (от 40°С до 44°С).
Permel 45: среднеплавкая фракция из фракций пальмового масла производства Fuji Oil Co., Ltd., температура плавления 45°С (от 43°С до 47°С).
Для каждой из полученных высушенных бесшовных капсул определяли удельный вес бесшовной капсулы с использованием изооктана в качестве стандартного раствора известного удельного веса на основе метода Архимеда:
помещением 5 мл изооктана в мерный цилиндр вместимостью 10 мл,
помещением в него десяти бесшовных капсул,
снятием показаний объема изооктана, увеличенного по сравнению с 5 мл, и
определением произведения объема и удельного веса изооктана. Стадию повторяли 10 раз, и его среднее значение представлено в таблице 1 в виде значения удельного веса полученных бесшовных капсул.
Для каждой из полученных высушенных бесшовных капсул определяли прочность на разрыв (Н) части, имеющей минимальный размер ее частиц, с использованием комплексного устройства для измерения физических свойств (реометра, производства ВС Scientific Co., Ltd):
вдавливанием цилиндрического поршня против бесшовной капсулы (при скорости подачи 20 мм/мин) при условии температуры окружающей среды 39°C, которая является почти такой же, как температура тела крупного рогатого скота, и
измерением нагрузки, необходимой для разрушения бесшовной капсулы. Среднее значение прочности на разрыв, измеренной для 20 капсул с одинаковыми характеристиками, представлено в таблице 1 в виде прочности на разрыв.
Полученные капсулы из примеров со 2 по 7 и сравнительных примеров с 1 по 6 перорально вводили шести взрослым особям крупного рогатого скота в таком количестве, что витамин С составляет 30 г, принудительно с использованием устройства для перорального введения. Затем отбирали кровь из яремной вены с течением времени каждые три часа, добавляли 1800 мкл 5% трихлоруксусной кислоты (полученной растворением 10 г трихлоруксусной кислоты в 100 мл сверхчистой воды и доведением сверхчистой водой в мерном цилиндре до объема 200 мл) в 900 мкл цельной крови, и раствор смеси центрифугировали при 14000×g в течение 5 минут (4°С). Полученный супернатант примерно 1,5 мл фильтровали через фильтр с размером пор 0,45 мкм и переносили в пробирку для получения измеряемого образца. После этого определяли зависящее от времени изменение концентрации тиамина в крови высокоэффективной жидкостной хроматографией (ВЭЖХ) при условиях, указанных в таблице 2. Результаты приведены на фиг.6 в виде графика с использованием время в качестве абсциссы и концентрации тиамина в крови в качестве ординаты.
Таблица 2.
температура колонки: 45°С
Скорость потока: 1,0 мл/мин
Скорость потока: 0,5 мл/мин
Скорость потока: 0,5 мл/мин
Температура реакции: 45°С
Ex. 375 нм, Em. 450 нм
В качестве контрольной диаграммы проводили аналогичное измерение в отношении 5 взрослых особей крупного рогатого скота, которых заставляли пить водный раствор таким образом, чтобы тиамина гидрохлорид в таком же количестве, как вводимое количество, растворялся в воде.
Для капсул из сравнительных примеров с 3 по 6 собранный сок рубца крупного рогатого скота встряхивали в течение 24 ч при 39°С в колбе и наблюдали флотацию. Поскольку маловероятно избежать жевания жвачки, то это не применялось для испытания с введением.
Так как флотация не наблюдалась в вышеуказанном исследовании в отношении примеров со 2 по 8 и сравнительных примеров с 1 по 2, то испытание с введением проводили для капсул из примеров со 2 по 7 и сравнительных примеров с 1 по 2, включая витамин B1. Результаты испытания с введением представлены на фиг.6.
Как видно из фиг.6, в отношении капсул, для которых прочность на разрыв части, имеющей минимальный размер частиц, находится в диапазоне от 0,5 до 4,7 Н, имелось значительное изменение концентрации тиамина в крови на начальной стадии измерения (примерно через 2 ч) при условии, что это удовлетворяет удельному весу, и было показано, что введение витамина оказывает эффективное действие на нее. С другой стороны, в отношении сравнительных примеров с 1 по 2 и контроля имелось незначительное изменение, но оно не учитывалось, потому что она быстро реагирует на введение витамина.
Сравнение с имеющимися на рынке продуктами
Для сравнения витамина C 30% Bypass (производства YPTECH Co., Ltd.; далее по тексту указывается как существующий продукт) с настоящим изобретением, каждую полученную капсулу в примере 8 таблицы 1 и существующий продукт перорально вводили шести лактирующих коровам в таком количестве, что витамин С составляет 30 г, принудительно с использованием устройства для перорального введения. Затем собирали всю мочу, выделяемую за 24 часа, 9 мл мочи в каждый момент сбора перемешивали в Spitz пробирке, содержащей 1 мл 1 М соляной кислоты, после переворачивания ее разливали в две криопробирки (для анализа и хранения), а затем замораживали с криопротектором (общий образец VC). Разведенную мочу около 1,5 мл фильтровали через фильтр с размером пор 0,45 мкм и переносили в пробирку для получения измеряемого образца. После этого проводили определение методом ВЭЖХ при следующих условиях.
В качестве контрольной диаграммы проводили аналогичное измерение в отношении шести лактирующих коров, которых заставляли пить водный раствор таким образом, чтобы витамин С в таком же количестве, как вводимое количество, растворялся в воде.
Условия
Колонка: Tosoh ODS 120T (средний диаметр частиц 5 мкм, внутренний диаметр 4,6 мм×150 мм, производства Tosoh Corporation),
Температура колонки: 35°С
Элюент (подвижная фаза): 10 мМ водный раствор формиата аммония/70 мМ водный раствор бромида додецилтриметиламмония/ вода/метанол (1/1/4/4),
Скорость потока: 0,9 мл/мин.
Объем инжектируемой пробы: 10 мкл
Детектор: детектор ультрафиолетового и видимого диапазонов (производства Hitachi High-Technologies Corporation) 265 нм
На фиг.7 представлен график, иллюстрирующий кумулятивную экскрецию аскорбиновой кислоты с мочой (суммарное количество аскорбиновой кислоты), определенную с использованием измеряемого образца. Она показана на графике.
В отношении существующего продукта определяли размер частиц, удельный вес и прочность на разрыв части, имеющей минимальный размер частиц, и как результат размер частиц составлял 1,0 мм, удельный вес составлял 1,12, и прочность на разрыв части, имеющей минимальный размер частиц, составляла 2,0 Н. Здесь при измерении удельного веса существующего продукта в качестве стандартного раствора известного удельного веса использовали чистую воду.
Как видно из фиг.7, кумулятивная экскреция витамина С значительно увеличивалась в случае использования бесшовной капсулы из примера 8. С другой стороны, кумулятивная экскреция витамина С была примерно такой же, как и на контрольной диаграмме в случае использования существующего продукта.
ПРИМЕР 9
Получение бесшовной капсулы
Получали бесшовные капсулы, содержащие лиофилизированный порошок молочнокислых бактерий (Lactobacillus coryniformis JCM 1099) и крахмал в качестве ядра бесшовной капсулы.
Десять частей лиофилизированного продукта L. coryniformis (6,9×1010 КОЕ/г), 10 частей крахмала и 20 частей диоксида титана диспергировали в подогретом растворе 60 частей Melano H3000 (производства Fuji Oil Co., Ltd.; гидрогенизированного пальмоядрового масла, имеющего температуру плавления 42°C (от 40°C до 44°C)) для получения композиции для приготовления ядра (дисперсии для приготовления ядра).
Высушенную бесшовную капсулу получали, как описано в примере 4, за исключением того, что использовали композицию для приготовления ядра, полученную как описано выше.
В отношении полученной высушенной бесшовной капсулы определяли максимальный размер частиц, минимальный размер частиц, прочность на разрыв и удельный вес, как описано в примере 1. Получили следующие результаты.
Максимальный размер частиц: 7,47 мм.
Минимальный размер частиц: 5,76 мм.
Прочность на разрыв: 4,7 Н.
Удельный вес: 1,33.
Пероральное введение взрослым дойным коровам
Бесшовные капсулы, полученные, как описано выше, перорально вводили двум взрослым лактирующим коровам в таком количестве, что количество живых бактерий среди молочнокислых бактерий составляет 3,0×1011 КОЕ на одну корову, принудительно с использованием устройства для перорального введения один раз в день в определенное время в течение семи дней. Фекалии собирали из прямой кишки через 24 часа после каждого введения, и ДНК экстрагировали с использованием PowerSoil DNA Isolation Kit (производства MO BIO Laboratories, Inc.). В отношении фрагмента гена, кодирующего 16S рРНК лактобацилл, ПЦР проводили с использованием следующих праймеров, и амплифицированный продукт фракционировали методом DGGE (денатурирующего градиентного гель-электрофореза).
f: (5'- GTC GTC AGC TCG TGT CGT GAG A -3'),
r: (5'- CGC CCG CCG CGC CCC GCG CCC GGC CCG CCG CCC CCG CCC CCC CGG GAA CGT ATT CAC CGC -3')
Фрагмент, полученный вышеописанным фракционированием, экстрагировали с использованием набора для экстракции из геля QIAEX II (Qiagen), в отношении фрагмента гена, кодирующего 16S рРНК L. coryniformis SPP, ПЦР далее проводили с использованием следующих праймеров.
f: (5'- GGG TTC GCA CGA GCG CAC -3')
r: (5'- CGC CCG CCG CGC CCC GCG CCC GGC CCG CCG CCC CCG CCC CCC CGG GAA CGT ATT CAC CGC -3')
Продукт, амплифицированный методом ПЦР, фракционировали методом DGGE.
В результате в электрофоретических паттернах ДНК, выделенной из фекалий, собранных через 24 часа после шестидневного введения, наблюдали совпадение полос ДНК введенных молочнокислых бактерий (L. coryniformis JCM 1099). Таким образом, было подтверждено, что капсула не распадается от рубца до сычуга взрослой дойной коровы; а распадается в и после тонкого кишечника с высвобождением молочнокислых бактерий из капсулы.
ПРОМЫШЛЕННОЕ ПРИМЕНЕНИЕ
На основании препарата для перорального введения жвачным животным по настоящему изобретению лекарственное средство может достигать нижней части пищеварительного тракта жвачных животных, и может быть обеспечено всасывание в ней исключительно включением препарата для перорального введения в корм для жвачных животных и тому подобное. Используя препарат для перорального введения жвачным животным по настоящему изобретению, можно очень легко вводить лекарственное средство для жвачных животных. Настоящее изобретение также относится к корму для жвачных животных, содержащему препарат для перорального введения жвачным животным. Кроме того, согласно настоящему изобретению введением жвачным животным препарата для перорального введения можно лечить заболевания жвачных животных, повышать усвояемость или вводить им витамины.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ ДЛЯ УЛУЧШЕНИЯ УСВОЕНИЯ АЗОТА У ЖВАЧНОГО ЖИВОТНОГО | 2016 |
|
RU2695683C1 |
| КОМПОЗИЦИИ И СПОСОБЫ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ УЛУЧШЕНИЯ УСВОЕНИЯ АЗОТА У ЖВАЧНОГО ЖИВОТНОГО | 2018 |
|
RU2770924C2 |
| КОМПОЗИЦИИ ПИЩЕВЫХ ДОБАВОК ДЛЯ ЖВАЧНЫХ ЖИВОТНЫХ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2011 |
|
RU2543819C2 |
| КАПСУЛА ПРОЛОНГИРОВАННОГО ВЫДЕЛЕНИЯ И СПОСОБ УВЕЛИЧЕНИЯ ПРИРОСТА МАССЫ И/ИЛИ ПРЕДОТВРАЩЕНИЯ БОЛЕЗНЕННОГО СОСТОЯНИЯ У ЖВАЧНЫХ ЖИВОТНЫХ, СПОСОБ УВЕЛИЧЕНИЯ ПОГЛОЩЕНИЯ СЕЛЕНА У ЖВАЧНЫХ ЖИВОТНЫХ | 1995 |
|
RU2145845C1 |
| ГРАНУЛИРОВАННАЯ КОМПОЗИЦИЯ ДЛЯ ЖВАЧНЫХ ЖИВОТНЫХ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1992 |
|
RU2109460C1 |
| КОРМОВАЯ ИЛИ МЕДИКАМЕНТОЗНАЯ КОМПОЗИЦИЯ ДЛЯ ЖВАЧНЫХ ЖИВОТНЫХ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1993 |
|
RU2106096C1 |
| Корм для жвачных животных | 1975 |
|
SU578833A3 |
| СПОСОБ СНИЖЕНИЯ МЕТАНОГЕНЕЗА У ЖВАЧНЫХ ЖИВОТНЫХ | 2013 |
|
RU2576195C1 |
| КАПСУЛА ТИПА ЗАМЕДЛЕННОГО РАЗЛОЖЕНИЯ И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2020 |
|
RU2817051C2 |
| ТВЕРДОЕ ИНСУЛИНСОДЕРЖАЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1997 |
|
RU2117488C1 |


Изобретения относятся к сельскому хозяйству. Разработан препарат для перорального введения жвачным животным, удельный вес которого находится в диапазоне от 1,17 до 2,00, максимальный размер частиц которого находится в диапазоне от 4 до 10 мм, и минимальный размер частиц которого находится в диапазоне от 4 до 10 мм, и прочность на разрыв, части которого, имеющей минимальный размер частиц, в условиях температуры тела жвачных животных находится в диапазоне от 0,5 до 5,0 Н, где препарат для перорального введения представляет собой бесшовную капсулу. Способ получения препарата для перорального введения жвачным животным. Препарат для перорального введения жвачным животным, полученный данным способом. Корм для жвачных животных содержит препарат для перорального введения жвачным животным. Представлен способ введения жвачным животным лекарственного средства для жвачных животных, согласно которому препарат для перорального введения перорально вводят жвачным животным. Изобретения позволяют получить препарат для перорального введения жвачным животным, который достигает нижней части пищеварительного тракта без разложения в рубце, не подвергаясь разрушению в результате жевания жвачки, и распадается и растворяется in vivo. 5 н. и 3 з.п. ф-лы, 7 ил., 3 табл., 15 пр.
1. Препарат для перорального введения жвачным животным, удельный вес которого находится в диапазоне от 1,17 до 2,00, максимальный размер частиц которого находится в диапазоне от 4 до 10 мм, и минимальный размер частиц которого находится в диапазоне от 4 до 10 мм, и прочность на разрыв части которого, имеющей минимальный размер частиц, в условиях температуры тела жвачных животных находится в диапазоне от 0,5 до 5,0 Н,
где препарат для перорального введения представляет собой бесшовную капсулу, полученную капельным методом с использованием концентрической многоструйной насадки, и содержит ядро, которое содержит носитель и лекарственное средство для жвачных животных, и слой поверхностной пленочной оболочки, покрывающей ядро.
2. Препарат для перорального введения жвачным животным по п.1, в котором поверхностная пленочная оболочка состоит из двух слоев: внутренней пленочной оболочки, непосредственно контактирующей с ядром, и наружной пленочной оболочки в качестве внешнего слоя,
при этом ядро дополнительно содержит регулятор удельного веса,
при этом внутренняя пленочная оболочка содержит регулятор удельного веса и маслянистое вещество, имеющее температуру плавления от 45 до 90°С, и
при этом внешняя пленочная оболочка формируется из композиции пленочной оболочки, содержащей полисахарид, регулятор удельного веса и пластификатор.
3. Препарат для перорального введения жвачным животным по п.1 или 2, в котором ядро имеет температуру плавления от 32 до 44°С.
4. Препарат для перорального введения жвачным животным по п.1, в котором лекарственное средство для жвачных животных выбирают из группы, состоящей из экстракта лекарственного растения, настойки, лекарственного средства, растительного экстракта, экстракта животного происхождения, экстракта из микроорганизма, экстракта микробиологического производства, фруктового сока, функциональных полисахаридов, полифенолов, витамина С, витамина из группы В, аминокислот, микроорганизмов, бактерий, эфирного масла, ω-3 жирных кислот, ω-6 жирных кислот, ω-9 жирных кислот и их комбинаций.
5. Способ получения препарата для перорального введения жвачным животным, включающий стадии:
с помощью первой форсунки, второй форсунки и третьей форсунки при условии, что они концентрически расположены и имеют радиус, последовательно возрастающий от первой форсунки до третьей форсунки, эжектирование композиции для приготовления ядра через первую форсунку, эжектирование композиции для приготовления внутренней пленочной оболочки через вторую форсунку и эжектирование композиции пленочной оболочки через третью форсунку одновременно с формированием комбинированного потока, и
выброс комбинированного потока в раствор масла,
где композиция для приготовления ядра содержит регулятор удельного веса, носитель и лекарственное средство для жвачных животных,
где композиция для приготовления внутренней пленочной оболочки содержит регулятор удельного веса и маслянистое вещество, имеющее температуру плавления от 45 до 90°С, и
где композиция пленочной оболочки содержит полисахарид, регулятор удельного веса и пластификатор.
6. Препарат для перорального введения жвачным животным, полученный способом по п.5, удельный вес которого находится в диапазоне от 1,17 до 2,00, максимальный размер частиц которого находится в диапазоне от 4 до 10 мм, и минимальный размер частиц которого находится в диапазоне от 4 до 10 мм, и прочность на разрыв части которого, имеющей минимальный размер частиц, в условиях температуры тела жвачных животных находится в диапазоне от 0,5 до 5,0 Н.
7. Корм для жвачных животных, содержащий препарат для перорального введения жвачным животным по п.1 или 6.
8. Способ введения жвачным животным лекарственного средства для жвачных животных, согласно которому препарат для перорального введения по п. 1 или 6 перорально вводят жвачным животным.
| JP 2000060440 A, 29.02.2000 | |||
| JPH 0531352 A, 09.02.1993 | |||
| МАГНИТОУПРАВЛЯЕМЫЙ СОРБЕНТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2003 |
|
RU2255800C1 |
Авторы
Даты
2018-10-25—Публикация
2015-01-30—Подача