Изобретение относится к области медицинской микробиологии, в частности к идентификации токсигенных эпидемически опасных штаммов Vibrio cholerae биовара Эль Тор, выявлению нетоксигенных штаммов и их дифференциации на имеющих потенциальную эпидемическую опасность и эпидемически безопасных.
Холера - особо опасная инфекционная болезнь с тяжелым диарейным синдромом. Седьмая пандемия холеры, начавшаяся в 1961 г. и продолжающаяся по настоящее время, была вызвана токсигенными штаммами V.cholerae O1 серогруппы биовара Эль Тор. Постоянно регистрируемые эпидемии холеры в эндемичных по этой инфекции странах Юго-Восточной Азии, Африки и Южной Америки создают высокий риск ее заноса на территорию Российской Федерации за счет интенсивной миграции населения [1, 2, 3].
Патогенный и эпидемический потенциал возбудителя холеры Эль Тор обусловлен присутствием в его геноме набора различных генов, определяющих его молекулярно-биологические свойства, ассоциированные не только с развитием инфекционного процесса, но и с эпидемическим распространением болезни. К генам, абсолютно необходимым для развития инфекционного процесса, относятся гены tcpA-F и ctxAB, кодирующие токсин-корегулируемые пили (TCP) и холерный токсин (СТ), продукты которых ответственны за колонизацию тонкого кишечника вибрионами и развитие основного клинического симптома холеры - профузной диареи, соответственно. Эти гены размещены на двух мобильных генетических элементах - на острове патогенности VPI-1 (tcpA-F) и профаге СТХϕ (ctxAB). Эпидемический потенциал штаммов связан с присутствием в геноме возбудителя двух островов пандемичности VSP-I и VSP-II, имеющихся у всех эпидемически опасных штаммов V.cholerae биовара Эль Тор, выделенных во время 7-й пандемии. Токсигенные штаммы, выделенные до начала 7-ой пандемии, в геноме которых имелся профаг СТХϕ и ОП VPI-1, но отсутствовали острова пандемичности VSP-I и VSP-II, были неспособны к эпидемическому распространению. На этом основании в современный период генотип эпидемически опасных штаммов обозначается как ctxA+tcpA+VSP+ [4, 5, 6].
Между тем результаты ежегодных мониторинговых исследований на холеру свидетельствуют о выделении на территории России не только занесенных эпидемически опасных штаммов. Эпидемиологическая обстановка по холере в настоящее время характеризуется выделением из поверхностных водоемов, а также от людей значительного числа нетоксигенных штаммов. Так, за 2007-2016 гг. [7] было изолировано более 700 таких штаммов. Нетоксигенные штаммы с генотипом ctxA-tcpA-, в геноме которых отсутствуют все ключевые гены патогенности и пандемичности, согласно МУК 4.2.2218 - 07 [8], относят к эпидемически безопасным. Наряду со штаммами ctxA-tcpA- нередко в водных объектах окружающей среды обнаруживаются также нетоксигенные штаммы с другим генотипом, а именно ctxA-tcpA+, которые заслуживают особого внимания. Такие нетоксигенные штаммы способны не только колонизировать тонкий кишечник за счет присутствия TCP, кодируемых генами tcpA, но и приобретать профаг СТXϕ с генами СТ от токсигенных штаммов, поскольку эти пили служат также в качестве рецептора для этого фага. Потенциальная способность к реверсии таких нетоксигенных штаммов в токсигенные через фаговую конверсию долгое время служила основанием считать все выделенные штаммы ctxA-tcpA+ потенциально эпидемически опасными, что, согласно действующим Санитарным правилам [9], требует проведения определенного объема профилактических мер при их выделении. Однако недавно стало известно, что штаммы ctxA-tcpA+ генетически неоднородны и разделяются на две группы, отличающиеся друг от друга по эпидемиологической значимости. В геноме 1-ой группы штаммов (ctxA-tcpA+VSP+) присутствуют острова пандемичности VSP-I и VSP-II, тогда как штаммы второй группы (ctxA-tcpA+VSP-) лишены VSP-I и VSP-II. Более того, изучение их филогении на основе SNP-анализа показало, что штаммы ctxA-tcpA+VSP+ генетически близки к эпидемически опасным и являются их производными, утратившими гены холерного токсина. В то же время штаммы с генотипом ctxA-tcpA+VSP- генетически значительно удалены от эпидемически опасных штаммов и имеют видимо независимое происхождение [10]. Это означает, что штаммы ctxA-tcpA+VSP+ действительно могут представлять потенциальную эпидемическую опасность, обусловленную как возможностью реверсии их в токсигенные, так и присутствием в их геноме двух островов пандемичности, обеспечивающих их способность к эпидемическому распространению. Штаммы 2-ой группы с генотипом ctxA-tcpA+VSP- - эпидемически безопасны, поскольку их реверсия в эпидемически опасные штаммы путем одновременного приобретения 3-х различных участков ДНК, содержащих не только профаг СТХϕ, но и VSP-I и VSP-II, невозможна.
Циркуляция в водоемах и выделение от людей различных штаммов V.cholerae O1 биовара Эль Top ctxA+tcpA+VSP+, ctxA-tcpA+VSP+ и ctxA-tcpA+VSP-, способных в разной степени нанести ущерб здоровью населения и экономике страны, указывают на очевидную потребность в разработке информативного и быстрого способа и тест-системы для одновременной идентификации токсигенных эпидемически опасных штаммов и дифференциации нетоксигенных штаммов на потенциально эпидемически опасные и эпидемически безопасные.
Из источников научно-технической информации известен способ определения серогруппы и биовара холерных вибрионов на основе выявления гена wbeO, входящего в кластер генов gmd-wbeO, встречающихся только у холерных вибрионов O1 серогруппы, и фрагмента гена hlyА, типичного для холерных вибрионов биовара Эль Тор [11].
Известна комплексная гено- и иммунодиагностическая тест-система для идентификации холерных вибрионов O1 и O139 серогрупп и оценки их вирулентности, позволяющая осуществлять идентификацию природных штаммов холерного вибриона O1 и O139 серогрупп на основе проведения ПЦР со специфическими праймерами к участкам диагностически значимых генов (wbeW, wbfR) и генов вирулентности (ctxA, tcpA), а также оценивать экспрессию генов вирулентности с помощью иммуноферментной тест-системы [12].
Известна ПЦР тест-система с использованием праймеров на видоспецифический ген hapA и основные гены вирулентности ctxA, tcpA, toxR, позволяющая одновременно проводить идентификацию штаммов холерных вибрионов и выявлять эпидемически опасные штаммы [13].
Также известен способ детекции и определения биовара, серогруппы и токсигенности возбудителя холеры с использованием метода мультилокусной ПЦР, которую проводят с использованием трех пар праймеров к генам wbeN, hlyА и ctxA, а также набор для его осуществления [14].
Известен также способ и тест-система для идентификации токсигенных штаммов V.cholerae 01, определения их биовара и дифференциации холерных вибрионов биовара Эль Тор на типичные и измененные варианты методом ПЦР, согласно которому мультиплексную ПЦР проводят в один прием в двух реакционных смесях, каждая из которых содержит подобранные сочетания праймеров: одна - к генам rfbO1, cas3 и ctxBClass, вторая - к генам rfbO1, rtxC и ctxBEt. Изобретение позволяет выявлять биовар холерных вибрионов O1 серогруппы, определять их токсигенность и проводить дифференциацию выявленных токсигенных штаммов V. cholerae биовара Эль Тор на типичные и изменные варианты [15].
Существует способ дифференциации токсигенных генетически изменных штаммов V.cholerae биовара Эль Тор с разным эпидемическим потенциалом с помощью мультиплексной ПЦР [14]. Согласно этому способу мультиплексную ПЦР проводят в один прием в одной реакционной смеси, содержащей три пары праймеров к генам vc0497, vc0502 и vc0514. Дифференциацию проводят по структуре VSP-II путем сравнения амплифицированных фрагментов генов исследуемых и контрольных штаммов. Изобретение позволяет в короткие сроки достоверно дифференцировать изоляты V. cholerae биовара Эль Тор по их эпидемическому потенциалу на основе структуры острова пандемичности VSP-II [16].
Описан способ одновременной идентификации токсигенных штаммов геновариантов возбудителя холеры Эль Тор и их дифференциации по эпидемическому потенциалу методом мультиплексной полимеразной цепной реакции и тест-система для его осуществления. Согласно этому способу, ПЦР проводят в один прием в двух реакционных смесях, каждая из которых содержит определенное сочетание праймеров. Использование этого способа позволяет определять O1 или O139 серогруппу штаммов (по наличию генов rfbO или rfbR), биовар (по наличию или отсутствию гена rstC), токсигенность (ctxA), принадлежность к геновариантам возбудителя (ctxBclass), а также их эпидемический потенциал (vc0502 и vc0514) [17].
Недостатком всех указанных выше тест-систем является отсутствие возможности одновременно выявлять штаммы с различной эпидемиологической значимостью, так как все предыдущие изобретения предназначены для идентификации и дифференциации по эпидемическому потенциалу только токсигенных штаммов холерных вибрионов. Таким образом, в данной области существует очевидная потребность в разработке быстрого и информативного способа для одновременной идентификации токсигенных эпидемически опасных штаммов V. cholerae биовара Эль Тор и дифференциации нетоксигенных штаммов на потенциально эпидемически опасные и эпидемически безопасные.
Техническим результатом изобретения является возможность дифференциации штаммов V. cholerae биовара Эль Тор на токсигенные эпидемически опасные, нетоксигенные потенциально эпидемически опасные и нетоксигенные эпидемически безопасные по наличию или отсутствию генов, входящих в состав профага СТХϕ (ген ctxA), острова патогенности VPI-1 (ген tcpA) и островов пандемичности VSP-I и VSP-II (гены vc0180, vc0514).
Технический результат достигается способом дифференциации штаммов V.cholerae биовара Эль Тор по их эпидемической опасности методом мультиплексной полимеразной цепной реакции, характеризующимся тем, что ПЦР проводят в один прием в двух реакционных смесях, каждая из которых содержит специально подобранное сочетание праймеров SEQ ID NO: 1, 2 к генам из vc0180 и vc0514 (из островов пандемичности VSP-I и VSP-II) в первой, SEQ ID NO: 3 к гену ctxA (из профага СТХ) и SEQ ID NO: 4 к гену tcpA (из острова патогенности VPI-1) во второй. Дифференциацию проводят путем сравнения амплифицированных фрагментов генов исследуемых и контрольных штаммов. Для токсигенных эпидемически опасных штаммов ctxA+tcpA+VSP+ характерно образование четырех амплифицированных фрагментов, соответствующих генам vc0180, vc0514, ctxA и tcpA. Для нетоксигенных ctxA-tcpA+VSP+ штаммов холерных вибрионов, несущих потенциальную эпидемическую опасность, характерно наличие трех ампликонов, соответствующих генам vc0180, vc0514 и tcpA, а для нетоксигенных эпидемически безопасных ctxA-tcpA+VSP- или ctxA-tcpA-VSP- характерно наличие только одного ампликона, соответствующего гену tcpA, или отсутствие всех ампликонов, соответственно.
Праймеры к участку гена vc0180 (VSP-I), кодирующего гипотетический белок
SEQ ID NO: 1
- vc0180s-F - 5'-CCCGCTAAACAAATGCCTAAAG-3',
- vc0180s-R - 5'-TTGGCCATCAAGAGAGTAACC-3',
обеспечивающие образование фрагмента размером 719 пн.;
к участку гена vc0514 (VSP-II), кодирующего метил-акцепторный белок хемотаксиса
SEQ ID NO: 2
- vc0514s-F - 5'-CTTGATGGAGCGGAGAAAAC-3',
- vc0514s-R - 5'-CGATGAATAGCCTGTTGAAC-3',
обеспечивающие образование фрагмента размером 604 пн.;
к участку гена ctxA, кодирующего А-субъединицу холерного токсина
SEQ ID NO: 3
- ctxA-Fs - 5'-GCAGATTCTAGACCTCCTGATG-3',
- ctxA-Rs - 5'-ATGATGAATCCACGGCTCTT-3',
обеспечивающие образование фрагмента размером 525 пн.;
к участку гена tcpA(VPI-1), кодирующего основную субъединицу токсин-корегулируемых пилей адгезии
SEQ ID NO: 4
- tcpAs-F - 5'-TGACTAAGGCTGCGCAAA-3',
- tcpAs-R - 5'-GCTTCTCAACATGCGTGATATTAG-3',
обеспечивающие образование фрагмента размером 456 пн.
Выбор ДНК-мишеней осуществляли на основании анализа полногеномных нуклеотидных последовательностей токсигенных эпидемически опасных, нетоксигенных потенциально эпидемически опасных и эпидемически безопасных штаммов, выделенных на территории Российской Федерации и стран бывшего СССР из объектов окружающей среды и от человека в разные годы, а также представленных в международной базе данных GenBank. В качестве первой мишени был выбран ген vc0180, кодирующий гипотетический белок и входящий в состав острова пандемичности VSP-I. Второй мишенью служил ген vc0514, кодирующий метил-акцепторный белок хемотаксиса и входящий в состав острова пандемичности VSP-II. Наличие данных генов характерно для всех типов островов пандемичности. В качестве третьей мишени был выбран ген ctxA, кодирующий А-субъединицу холерного токсина и размещенный на профаге СТХϕ. Для четвертой мишени выбран был ген tcpA, ответственный за синтез основной субъединицы токсин-корегулируемых пилей адгезии и локализованный на ОП VPI-1. Праймеры рассчитаны авторами с использованием программ IntegratedDNATechnologies (http://eu.idtdna.com/site) и OligoAnalyzer 1.0.2.
Праймеры на гены vc0180, vc0514, ctxA, tcpA обеспечивают образование фрагментов размерами 719 пн, 604 пн, 525 пн, и 456 пн, соответственно, и подобраны таким образом, чтобы минимизировать вероятность их неспецифического отжига. Праймеры были проверены на возможность образования шпилечных структур с высокими температурами плавления, а так же образования димерных соединений как одноименных праймеров, так и разноименных праймеров между собой.
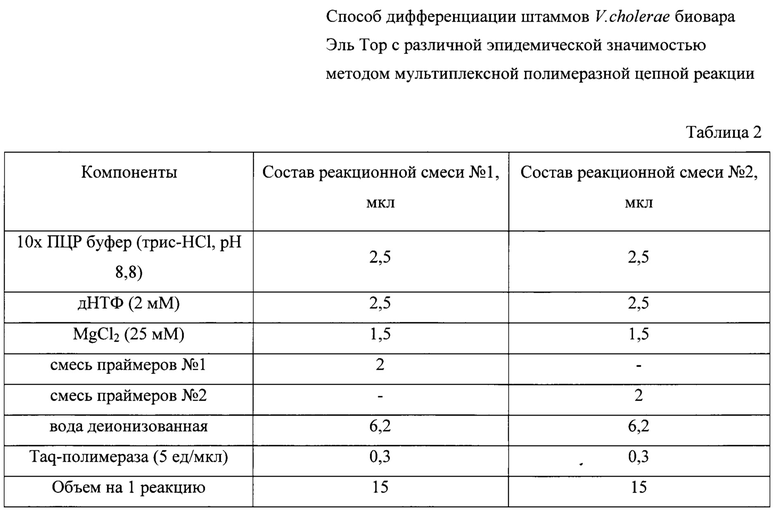
Экспериментально установлен оптимальный состав реакционной смеси для проведения мультиплексной цепной реакции, подобрано сочетание праймеров, необходимое и достаточное соотношение компонентов реакционной смеси и определен режим постановки ПЦР.
Способ дифференциации включает следующие этапы:
1) Выделение ДНК;
2) Проведение ПЦР;
3) Анализ результатов.
Выделение ДНК исследуемых штаммов холерного вибриона проводят с использованием комплекта реагентов для выделения ДНК. Комплект для выделения ДНК извлекают из холодильника и выдерживают при комнатной температуре. Выделение ДНК проводят согласно инструкции к набору.
ПЦР проводят в один этап в двух реакционных смесях по следующей программе: предварительная денатурация при 95°С - 5 мин; 32 цикла из 94°C - 30 с, 56,7°C - 30 с, 72°C - 1 мин, заключительный синтез комплиментарной цепи при температуре 72°С в течение 3 мин.
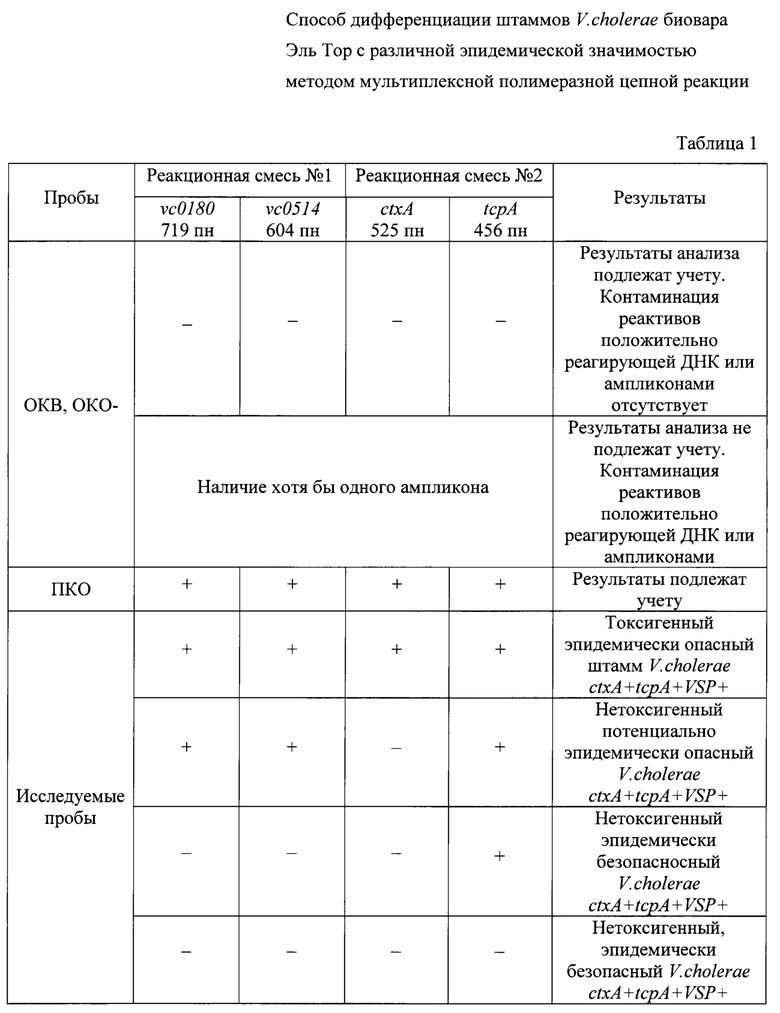
Детекцию амплифицированной ДНК после ПЦР проводят методом горизонтального электрофореза в 1,5% агарозном геле. Учет результатов ПЦР проводят путем сравнения полученных ампликонов с контрольными образцами в соответствии с идентификационной таблицей 1.
Способ осуществляют следующим образом.
1) Подготовку проб проводят согласно МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности» в боксе биологической безопасности II класса в противочумном костюме IV типа в резиновых или латексных перчатках. Бактериальные взвеси клеток холерного вибриона, выросших на питательной среде, готовят в 2 мл 0,9% стерильного физиологического раствора по стандартному образцу мутности 5 единиц (ОСО 42-28-86), что соответствует 1×109 микробных клеток в 1 мл для холерного вибриона. Взвеси гетерологичных микроорганизмов готовят в 2 мл 0,9% стерильного физиологического раствора по отраслевому стандартному образцу мутности 10 единиц (ОСО 42-28-85), что соответствует 1×109 м.к./мл для кишечной палочки. Затем 10-кратными разведениями в 0,9% стерильного физиологического раствора доводят до концентрации 1×103 м.к./мл.
Подготовленные для исследования пробы обеззараживают в соответствии с МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности». В пробирки с тестируемыми микробными взвесями (1×109 м.к./мл) в объеме 4,5 мл добавляют 0,5 мл 0,1% натрия мертиолята (разведение 1:1000) до конечной концентрации 0,01% (разведение 1:10000) и прогревают при (56±1)°C в течение 30 мин. Далее отбирают по 0,1 мл микробной взвеси с мертиолятоми переносят в микроцентрифужные пробирки объемом 1,5 мл. После выполнения данного этапа материал считается обеззараженным.
Выделение ДНК исследуемых штаммов холерного вибриона проводят с использованием комплекта реагентов для выделения ДНК. Комплект для выделения ДНК извлекают из холодильника и выдерживают при комнатной температуре. Выделение ДНК проводят согласно инструкции к набору. Выделенную и очищенную ДНК хранят при +4°C.
2) Проведение ПЦР.
Для проведения ПЦР отбирают необходимое количество микропробирок, соответствующе числу исследуемых проб, а также еще по две для каждой реакционной смеси для положительного и отрицательного контролей.
ПЦР проводят в объеме 25 мкл реакционной смеси на 1 пробу исследуемой ДНК. Состав реакционной смеси №1 и №2 представлены в таблице 2. В подготовленную смесь вносят по 10 мкл пробы. В пробирки, обозначенные как отрицательный контроль, вносят по 10 мкл деионизованной воды, а в пробирки с положительным контролем соответственно по 10 мкл ДНК контрольного штамма. В качестве положительного контроля используют ДНК токсигенного штамма V.cholerae Р18899 O1 серогруппы биовара Эль Top (ctxA+tcpA+vc0180+vc0514+).
Амплификацию ДНК осуществляют на программируемом амплификаторе с прогреваемой крышкой с матричным способом регулирования (например, «Mastercycler Gradient», (Eppendorf, Германия) при следующих температурных режимах: температура денатурации - 95°С в течение 5 мин; 32 цикла - денатурация ДНК при температуре 94°С в течение 30 с, отжиг праймеров 56,7°С - 30 с, синтез комплиментарной цепи при температуре 72°С - 1 мин, заключительный синтез комплиментарной цепи при температуре 72°С в течение 3 мин.
3) Анализ результатов.
Для анализа результатов готовят 1,5% агарозный гель. Для приготовления 30 мл 1,5% агарозного геля к 0,45 г агарозы добавляют 30 мл 1×TAE буфера. Агарозу доводят до кипения, охлаждают до 50°С, вносят 0,5 мкг/мл этидия бромида и заливают в специальную ванночку, устанавливают гребенку и оставляют застывать. После полимеризации осторожно извлекают гребенку и переносят гель в камеру для проведения электрофореза. К ПЦР-продукту добавляют 5 мкл буфера для нанесения проб, перемешивают и вносят в лунки геля. Камеру подключают к источнику тока и задают напряжение 10 В/см. Разделение амплифицированных фрагментов ДНК проводят в течение 25-30 мин до прохождения лидирующим красителем около 2/3 длины трека.
Оценивают результаты анализа по наличию или отсутствию на электрофореграмме специфических полос амплифицированной ДНК. Учет результатов проводят в соответствии с идентификационной таблицей 1.
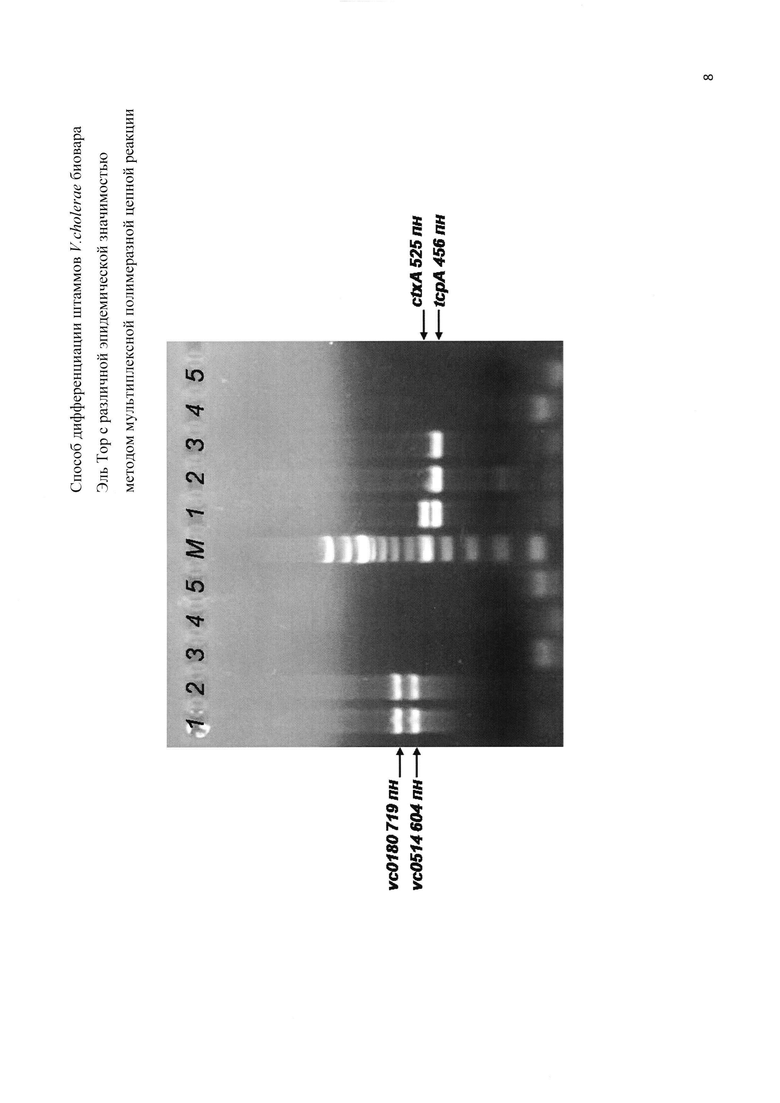
На фигуре приведена электрофореграмма ампликонов, образованных при постановке мультиплексной ПЦР с праймерами на исследуемые гены-мишени контрольных штаммов V.cholerae биовара Эль Тор, имеющих разную эпидемическую опасность. На дорожке 1 показано положение четырех ампликонов, соответствующих фрагментам генов ctxA, tcpA, vc0180 и vc0514, характерных для токсигенных эпидемически опасных штаммов (ctxA+tcpA+VSP+). На дорожке 2 регистрируются три ампликона, соответствующие фрагментам генов tcpA, vc0180 и vc0514, характерных для нетоксигенных потенциально эпидемически опасных штаммов (ctxA-tcpA+VSP+). На дорожках 3-4 показано положение одного ампликона, соответствующего фрагменту гена tcpA, или отсутствие ампликонов, соответствующих всем исследуемым фрагментов генов-мишеней, что характерно для нетоксигенных эпидемически безопасных штаммов (ctxA-tcpA+VSP- или ctxA-tcpA-VSP-).
Одновременная амплификация в ПЦР фрагментов четырех генов с образованием ампликонов размером 719, 604, 525 и 456 пн указывает на то, что изучаемый штамм содержит в геноме оба острова пандемичности VSP-I и VSP-II, а также профаг СТХс генами холерного токсина и остров патогенности VPI-1 с генами токсин-корегулирумых пилей. Это означает наличие в пробе токсигенного эпидемически опасного штамма. При амплификации трех фрагментов размером 719, 604 и 456 пн следует говорить о присутствии в геноме только VSP-I и VSP-II, a также VPI-1, что указывает на наличие в пробе нетоксигенного потенциально эпидемически опасного штамма. Образование лишь одного ампликона размером 456 пн, соответствующего фрагменту гена tcpA из VPI-1, или отсутствие всех четырех исследуемых маркерных участков генома размером 719, 604, 525 и 456 пн свидетельствует о наличие в пробе нетоксигенного эпидемически безопасного штамма.
Специфичность заявляемого способа подтверждена на основе использования штаммов близкородственных видов - V. parahaemolyticus, V. albensis, V. vulnificus, V. anguillarum, V. alginolyticus, а также энтеробактерий - E.coli, S. enteritidis, Sh.sonnei. Кроме того, в анализ были взяты нетоксигенные штаммы V. cholerae не 01/не 0139 серогрупп, не имеющие эпидемической значимости. Результаты ПЦР-тестирования указанных штаммов были отрицательными. Результаты специфичности представлены в таблице 3.
Изобретение иллюстрируется следующим примером.
Пример 1. Для оценки эффективности ПЦР тест-системы использовали 51 штамм V. cholerae биовара Эль Тор. При дифференциации штаммов по эпидемической опасности было установлено, что они разделяются на 4 группы по наличию или отсутствию идентифицируемых генов. К первой группе относятся 5 токсигенных штаммов (ctxA+tcpA+vc0180+vc0514+), имеющие весь набор генетических маркеров эпидемически опасных штаммов (ctxA+tcpA+VSP+). Это означает, что эти штаммы эпидемически опасны. Во вторую группу входят 9 нетоксигенных штаммов ctxA-tcpA+vc0180+vc0574+, которые по составу генов патогенности и эпидемичности относятся к потенциально эпидемически опасным (ctxA-tcpA+VSP+). Третья (24 изолята) и четвертая (13 изолятов) группы состоят из нетоксигенных штаммов ctxA-tcpA+vc0180-vc0514- и ctxA-tcpA-vc0180-vc0514-, которые в отличие от нетоксигенных штаммов второй группы, являются эпидемически безопасными (ctxA-tcpA+VSP- и ctxA-tcpA-VSP-) вследствие отсутствия в их геноме различных протяженных участков ДНК, необходимых для проявления вирулентных и эпидемических свойств возбудителя, приобретение которых в природных условиях невозможно. Результаты оценки эффективности приведены в таблице 4.
Таким образом, разработанный способ для дифференциации штаммов V. cholerae биовара Эль Тор с различной эпидемиологической значимостью, специфичен и эффективен. Показанная возможность быстрой идентификации токсигенных эпидемически опасных штаммов и дифференциация обнаруженных нетоксигенных штаммов холерных вибрионов на потенциально эпидемически опасные и эпидемически безопасные, позволяет рекомендовать этот способ для использования при проведении мониторинговых исследований окружающей среды и определении объема противоэпидемических мероприятий.
Список литературы
1. Титова С.В., Москвитина Э.А., Крутиков В.Д., Самородова А.В., Тюленева Е.Г., Монахова Е.В., Писанов Р.В., Водопьянов А.С., Архангельская И.В., Иванова С.М., Ковалева Т.В., Водопьянов С.О. Холера: Оценка эпидемиологической обстановки в мире и России в 2006-2015 гг. Прогноз на 2016 г. Пробл. особо опасных инф. 2016; 1:20-27.DOI: 10.21055/0370-1069-2016-1 -20-27.
2. Онищенко Г.Г., Ломов Ю.М., Москвитина Э.А., Федоров Ю.М., Подосинникова Л.С, Горобец А.В. Холера в начале ХХIвека. Прогноз. Журн. микробиол., эпидемиол., иммунобиол. 2005; 3:44-48.
3. Москвитина Э.А., Адаменко О.Л., Кругликов В.Д., Титова С.В., Монахова Е.В., Писанов Р.В., Иванова С.М., Анисимова Г.Б. Холера: эпидемиологическая обстановка в мире в 2005-2014 гг., прогноз на 2015 г. Пробл. особо опасных инф. 2015; 1:18-25.
4. Heidelberg J.F., Eisen J.A., Nelson W.C, Clayton R.A., Gwinn M.L., Dodson R.J., Haft D.H., Hickey E.K., Peterson J.D., Umayam L., Gill S.R., Nelson K.E., Read T.D., Tettelin H. ., Richardson D., Ermolaeva M.D., Vamathevan J., Bass S., Qin H., Dragoi I.. Sellers P., McDonald L., Utterback Т., Fleishmann R.D., Nierman W.C, White O., Salzberg S.L., Smith H.O., Colwell R.R., Mekalanos J.J., Venter J.C, Fraser С.M. DNA sequence of both chromosomes of the cholera pathogen Vibrio cholera. Nature. 2000; 406(6795): 477-483.
., Richardson D., Ermolaeva M.D., Vamathevan J., Bass S., Qin H., Dragoi I.. Sellers P., McDonald L., Utterback Т., Fleishmann R.D., Nierman W.C, White O., Salzberg S.L., Smith H.O., Colwell R.R., Mekalanos J.J., Venter J.C, Fraser С.M. DNA sequence of both chromosomes of the cholera pathogen Vibrio cholera. Nature. 2000; 406(6795): 477-483.
5. O'shea Y.A., Reen F.J., Quirke A.M., Boyd E.F. Evolutionary genetic analysis of the emergence of epidemic Vibrio cholerae isolates on the basis of comparative nucleotide sequence analysis and multilocus virulence gene profiles../ Clin. Microbiol. 2004; 42(10):4657-4671. DOI: 10.1128/JCM.42.10.4657-4671.2004.
6. Waldor M.K., Makalanos J.J. Lysogenic conversion by a filamentous bacteriophage encoding cholera toxin. Science. 1996; V 272 (5270):5819-5825. DOI: 10.1126/science272.5270.1910.
7. Методические указания «Лабораторная диагностика холеры» (ЬУК 4.2.2218 - 07). Москва, 2007.
8. Москвитина Э.А., Тюленева Е.Г., Самородова А.В., Кругликов В.Д., Титова С.В., Иванова С.М., Ковалева Т.В., Анисимова Г.Б. Эпидемиологическая обстановка по холере в мире и в России в 2007-2016 гг.Прогноз на 2017 г. Пробл. особо опасных инф. 2017; 1:13-20. DOI: 10.21055/0370-1069-2017-1-13-20.
9. «Профилактика холеры. Общие требования к эпидемиологическому надзору за холерой на территории Российской Федерации». СП 3.1.1.2521-09 от 9.06.2009 г. №43.
10. Смирнова Н.И., Кульшань Т.А., Баранихина Е.Ю., Краснов Я.М., Агафонов Д.А., Кутырев В.В. Структура генома и происхождение нетоксигенных штаммов Vibrio cholerae биовара Эль Тор с различной эпидемиологической значимостью. Генетика. 2016; 52(9): 1029-1041. DOI: 10.7868/S0016675816060126.
11. Осина Н.А., Бугоркова Т.В., Казакова Е.С., Шарова И.Н. Грачева И.В., Валова Т.В., Куличенко А.Н. Разработка метода биотипирования холерных вибрионов с помощью полимеразной цепной реакции. Сборник материалов проблемной комиссии «Холера и патогенные для человека вибрионы». 2002; 15:59-61.
12. Комплексная гено- и иммуноди агностическая тест-система для идентификации холерных вибрионов O1 и O139 серогруппы и оценки их вирулентности. Патент РФ №2404257, опубликован 20.11.10 г.
13. Смирнова Н.И., Кириллина О.А., Челдышова Н.Б., Кутырев В.В. Дифференциация штаммов Vibrio cholerae elror по их эпидемической значимости с помощью новых диагностических холерных бактериофагов эльтор ctx- и ctx+ и полимеразной цепной реакции. Журнал эпидемиол., микробиол. и иммунологии. 2001. 6:11-16.
14. Способ детекции и определения биотипа, серогруппы и токсигенности возбудителя холеры и набор для его осуществления. Патент РФ 2360972, опубликован 10.07.10 г.
15. Способ идентификации токсигенных штаммов V. cholerae 01, определения их биовара и дифференциации штаммов биовара Эль Тор на типичные и измененные методом мультиплексной полимеразной цепной реакции и тест-система для его осуществления. Патент РФ 2458141, опубликован 10.08.12 г.
16. Способ дифференциации токсигенных генетически измененных штаммов Vibrio cholerae биовара эль тор с разным эпидемическим потенциалом методом мультиплексной полимеразной цепной реакции и тест-система для его осуществления. Патент РФ 2556127, опубликован 10.07.2015.
17. Способ одновременной идентификации токсигенных штаммов геновариантов возбудителя холеры Эль Тор и их дифференциации по эпидемическому потенциалу методом мультиплексной полимеразной цепной реакции. Патент №2560280, опубликован 20.08.2015.
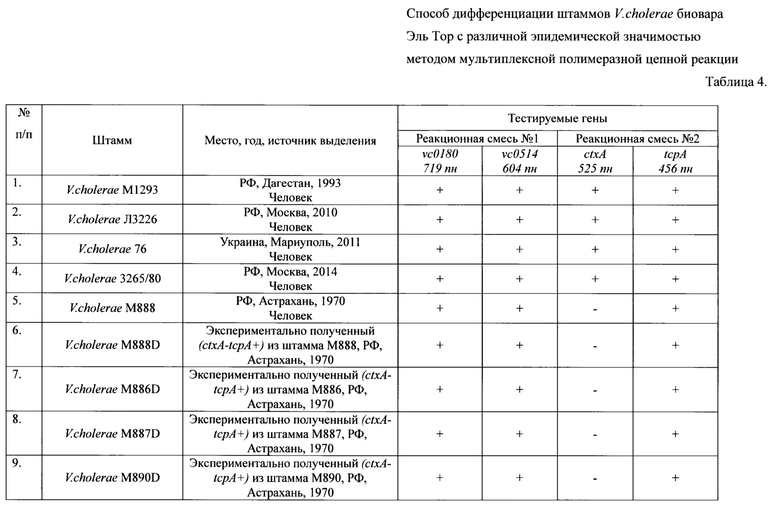
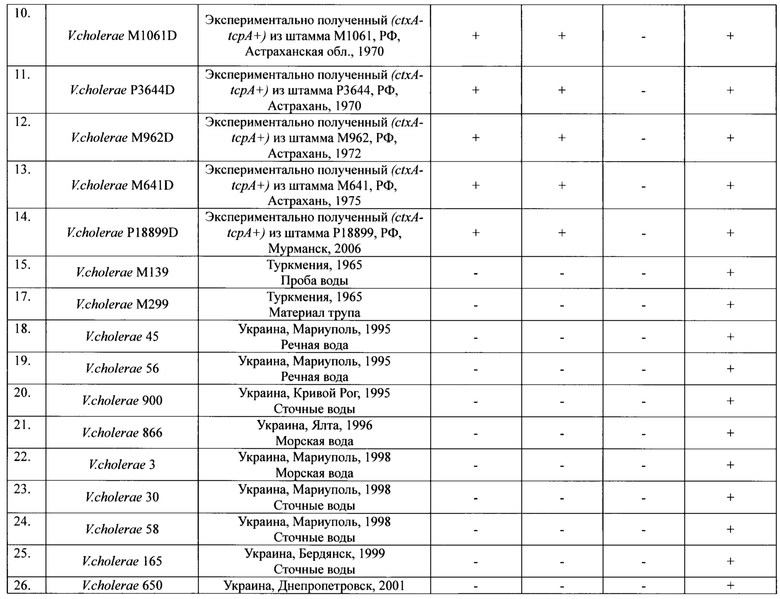
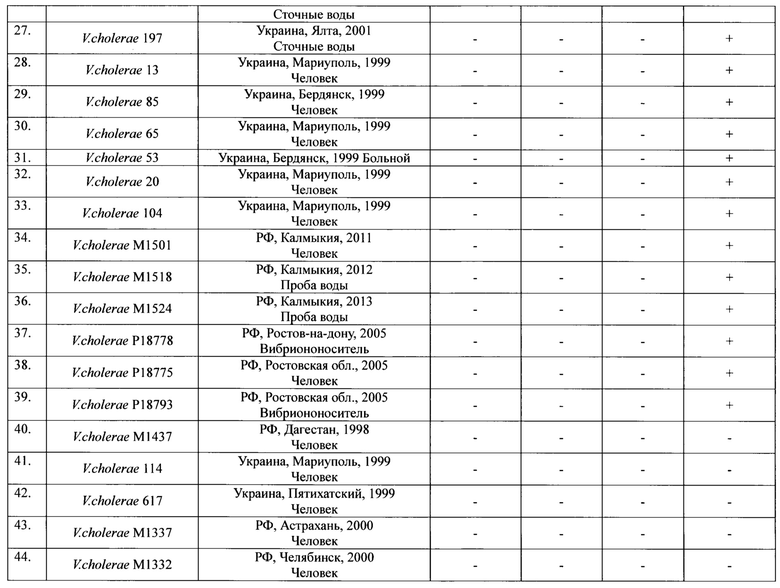
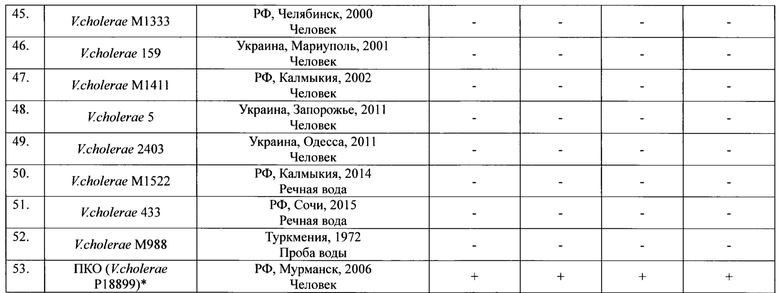
ПКО(Положительный контрольный образец): Токсигенный эпидемически опасный штамм с ранее установленным набором генов.

Изобретение относится к области медицинской микробиологии и предназначено для дифференциации штаммов V. cholerae биовара Эль Тор. Проводят ПЦР в один прием в двух реакционных смесях, каждая из которых содержит праймеры к генам vc0180, vc0514, ctxA и tcpA. Для токсигенных эпидемически опасных штаммов ctxA+tcpA+VSP+ характерно образование амплифицированных фрагментов, соответствующих генам vc0180, vc0514, ctxA и tcpA. Для нетоксигенных ctxA-tcpA+VSP+ штаммов, несущих потенциальную эпидемическую опасность, характерно наличие ампликонов, соответствующих генам vc0180, vc0514 и tcpA. Для нетоксигенных эпидемически безопасных штаммов ctxA-tcpA+VSP- или ctxA-tcpA-VSP- характерно наличие ампликона, соответствующего гену tcpA, или отсутствие всех ампликонов. Изобретение обеспечивает возможность дифференциации штаммов V. cholerae биовара Эль Тор на токсигенные эпидемически опасные, нетоксигенные потенциально эпидемически опасные и нетоксигенные эпидемически безопасные. 1 ил., 4 табл., 1 пр.
Способ дифференциации штаммов V.cholerae биовара Эль Тор с различной эпидемической значимостью методом мультиплексной полимеразной цепной реакции, характеризующийся тем, что ПЦР проводят в один прием в двух реакционных смесях, каждая из которых содержит специально подобранное сочетание праймеров - SEQ ID NO:1,2 к генам vc0180 и vc0514 в первой, SEQ ID NO: 3 к гену ctxA и SEQ ID NO:4 к гену tcpA во второй, дифференциацию проводят путем сравнения амплифицированных фрагментов генов исследуемых и контрольных штаммов, при этом для токсигенных эпидемически опасных штаммов ctxA+tcpA+ VSP+ характерно образование четырех амплифицированных фрагментов, соответствующих генам vc0180, vc0514, ctxA и tcpA, для нетоксигенных ctxA-tcpA+VSP+ штаммов холерных вибрионов, несущих потенциальную эпидемическую опасность, характерно наличие трех ампликонов, соответствующих генам vc0180, vc0514 и tcpA, а для нетоксигенных эпидемически безопасных ctxA-tcpA+VSP- или ctxA-tcpA-VSP- характерно наличие одного ампликона, соответствующего гену tcpA, или отсутствие всех ампликонов, соответственно.
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ТОКСИГЕННЫХ ГЕНЕТИЧЕСКИ ИЗМЕНЕННЫХ ШТАММОВ VIBRIO CHOLERAE БИОВАРА ЭЛЬ ТОР С РАЗНЫМ ЭПИДЕМИЧЕСКИМ ПОТЕНЦИАЛОМ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ И ТЕСТ-СИСТЕМА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2014 |
|
RU2556127C2 |
| СПОСОБ ОДНОВРЕМЕННОЙ ИДЕНТИФИКАЦИИ ТОКСИГЕННЫХ ШТАММОВ ГЕНОВАРИАНТОВ ВОЗБУДИТЕЛЯ ХОЛЕРЫ ЭЛЬ ТОР И ИХ ДИФФЕРЕНЦИАЦИИ ПО ЭПИДЕМИЧЕСКОМУ ПОТЕНЦИАЛУ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2014 |
|
RU2560280C2 |
| СМИРНОВА Н.И | |||
| и др | |||
| Дифференциация штаммов Vibrio cholerae eltor по их эпидемической значимости с помощью новых диагностических холерных бактериофагов эльтор ctx- и ctx+ и полимеразной цепной реакции | |||
| Журнал эпидемиол., микробиол | |||
| и иммунологии | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| HEIDELBERG J.F | |||
| et al | |||
| DNA sequence of both chromosomes of the cholera pathogen Vibrio cholerae | |||
| Nature | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
Авторы
Даты
2018-10-31—Публикация
2018-01-10—Подача