Изобретение относится к области медицинской микробиологии, в частности к идентификации токсигенных штаммов Vibrio cholerae O1, определению их биовара (классического или Эль Тор) и дифференциации V. cholerae O1 биовара Эль Тор на типичные изоляты и измененные варианты, и предназначено для идентификации холерных вибрионов O1 серологической группы, выделенных от человека или из объектов окружающей среды, на уровне генома с помощью полимеразной цепной реакции в режиме «реального времени» в специализированных лабораториях лечебно-профилактических и санитарно-эпидемиологических учреждений в Российской Федерации.
Область применения - клиническая лабораторная диагностика, научные исследования, эпидемиологический надзор.
Типичные токсигенные вибрионы Эль-Тор (Vibrio cholerae O1 biotype El Tor, Hly-, ctxA+), устойчивые к воздействию неблагоприятных факторов окружающей среды за счет присутствия в геноме дополнительных блоков генов, обеспечивающих высокий уровень адаптации к меняющимся условиям окружающей среды: островков патогенности (VPI-I,II) и пандемичности (VSP-I, II) [1, 2, 3], явились этиологическим фактором холеры в Азии (1961-1969 гг.), в (Азии, Африке, Европе, США, Океании (1970-1980 гг.), в Азии, Африке, Европе, США, Океании, Австралии (1981-1990 гг.).
В начале 90-х годов прошлого столетия появились штаммы холерного вибриона O1 серологической группы с типичными фенотипическими признаками биовара Эль-Тор, но продуцирующие классический тип энтеротоксина (СТ1) и с фенотипическими признаками биоваров Эль-Тор и классического, также с продукцией энтеротоксина классического типа (СТ-1). Изоляты V. cholerae O1 с генотипическими признаками обоих биоваров получили название «генетически измененные» (геноварианты) или «гибридные варианты биовара Эль-Тор» [4, 5], и они являются доминантными этиологическими агентами современного этапа развития седьмой пандемии холеры Эль-Тор, начавшегося в 90-е годы XX столетия, а в первые два десятилетия XXI века - получили глобальное распространение.
Эволюционные преобразования типичного токсигенного биовара Эль-Тор в гибридный вариант сопровождались изменениями структуры генов коровой области профага СТХϕ и профага RSIϕ [6]. В результате горизонтального переноса генов образовались генотипы с различными комбинациями генов патогенности типичного Эль-Тор и классического биовара: ctxBСl, rstREl, rstC, rstRCl (III генотип); ctxBCl rstREl, rstC (IV генотип); ctxBCl, rstREl, rstC (V генотип); ctxBCl, rstRCl, rstREl (VI генотип); ctxBCl, rstRCl, rtxC (VII генотип) Следует отметить, что геномы названных вариантов биовара Эль-Тор обязательно содержат ген ctxBCl, кодирующий биосинтез энтеротоксина классического типа (СТ-1) [8.]. Вместе с тем эволюционные преобразования в гибридный вариант не затронули гены «домашнего хозяйства», в частности, гена rtxC, специфичного для типичного токсигенного биовара Эль Тор. При этом в реакции полимеразной цепной реакции типичные токсигенные штаммы биовара Эль Тор образуют ампликоны к генам ctxBEl и rtxC, а генетически измененные варианты биовара Эль Тор образуют ампликоны к генам ctxBCL и rtxC.
Холера, обусловленная генетически измененными холерными вибрионами биовара Эль Тор, продуцирующие XT классического типа, наносит значительный вред здоровью населения и экономический ущерб той стране, где эта инфекция возникает [1, 3, 6, 7]. Поэтому для повышения эффективности системы эпидемиологического надзора за холерой и проведения противоэпидемических мероприятий в случае ее завоза необходима разработка способа быстрой и достоверной диагностики этиологического фактора болезни, основанной на дифференциации типичных токсигенных и генетически измененных вариантов V. cholerae биовара Эль Тор с использованием полимеразной цепной реакции.
Известно выявление измененных токсигенных штаммов V. cholerae биовара Эль Тор методом ПЦР с использованием аллельспецифических праймеров для детекции классического или Эль Тор биовара гена ctxB [9]. Однако данный метод применим только для штаммов холерных вибрионов с предварительно установленными серогруппой и биоваром.
В то же время при мониторинговых исследованиях необходима не только идентификация токсигенных штаммов V. cholerae O1 серогруппы и определение их биовара, но и своевременная и быстрая дифференциация V. cholerae биовара Эль Тор по структуре гена ctxB с целью выявления измененных вариантов возбудителя холеры Эль Тор для повышения эффективности проводимых противоэпидемических мероприятий.
Из источников научно-технической информации известен способ идентификации токсигенных штаммов V. cholerae Ol, определения их биовара и дифференциации штаммов биовара Эль Тор на типичные и измененные методом мультиплексной полимеразной цепной реакции и тест-система для его осуществления с электрофоретическим учетом результатов [10]. Согласно изобретению мультиплексную полимеразную цепную реакцию (ПЦР) проводят в один прием в двух реакционных смесях, где каждая из смесей содержит специально подобранное сочетание праймеров: одна - к генам rfbO1, cas3 и ctxBCL, вторая - к генам rfbO1, rtxC и ctxBEL. Тест-система для осуществления способа включает компоненты для выделения ДНК, компоненты для проведения ПЦР и компоненты для анализа результатов. Компоненты для проведения ПЦР содержат: 10-кратный буферный раствор, рН 8,4, минеральное масло, деионизированную стерильную воду, два положительных контроля, фермент Taq-полимеразу, смесь дНТФ, смесь праймеров 1 - rfbO1-F - rfbO1-R, cas3-F - cas3-R, ctxBCL -F-ctxBCL-R и смесь праймеров 2 - rfbO1-F - rfbO1-R, rtxC-F - rtxC-R, ctxBEL-F -ctxBEL -R.
Заявленный способ позволяет быстро и достоверно выявлять биовар холерных вибрионов O1 серогруппы, определять их токсигенность и проводить дифференциацию выявленных токсигенных штаммов V.cholerae биовара Эль Тор на типичные изоляты и измененные варианты.
Для осуществления способа идентификации токсигенных штаммов Vibrio cholerae O1, определения их биовара и дифференциации биовара Эль Тор на типичные и генетически измененные варианты методом мультиплексной полимеразной цепной реакции предложена тест-система с форезным методом учета результатов «Ген Vibrio cholerae вариант ctxB-РЭФ)» [7]. С помощью указанного «Набора…» при идентификации выделенной культуры холерного вибриона определяется O1 серогруппа (по гену rfbO1, 638 п.н.), биовар (классический по гену cas3, 415 п. н.; Эль Тор по гену rtxC, 265 п.н.), токсигенность (по генам ctxBCl, 189 п.н. или ctxBEl, 189 п.н.), типичность (типичный биовар Эль Тор - по сочетанию генов rfbO1,638 п.н. + rtxC, 265 п.н. + ctxBEl, 189 п.н.); измененный биовар Эль Тор - ctxBCl, 189 п.н. + rfbO1, 638 п.н. + rtxC, 265 п.н.).
Таким образом, данная мультилокусная ПЦР, используемая для идентификации выделенной культуры возбудителя холеры, обеспечивает определение серогруппы, токсигенности, биовара и дифференциацию биовара Эль Тор на типичные токсигенные и генетически измененные (гибридные) варианты электрофоретическим методом учета результатов, что удлиняет время данного способа идентификации штаммов Vibrio cholerae O1.
Вместе с тем, в данной области существует очевидная потребность в разработке более информативного и быстрого способа идентификации токсигенных штаммов Vibrio cholerae O1, определения их биовара и дифференциации биовара Эль Тор на типичные и генетически измененные варианты, а также тест-системы для реализации указанного способа идентификации токсигенных штаммов холерного вибриона O1 серогруппы.
Техническим результатом изобретения является обеспечение возможности осуществления одновременной идентификации штаммов V. cholereae O1 серогруппы классического и Эль Тор биоваров (на основе присутствия в их геноме биовароспецифических генов ctxBCL, ctxBEL и гена rtxC, специфичного для биовара Эль Тор), определения их токсигенности (на основе тестирования гена ctxB) и дифференциации V. cholerae биовара Эль Тор на типичные изоляты и измененные варианты по присутствию в их геноме одновремннно генов ctxBEL + rtxC или ctxBCL+rtxC.
Технический результат достигается способом идентификации и дифференциации типичных и измененных токсигенных штаммов V. cholerae O1 методом мультиплексной полимеразной цепной реакции, характеризующимся тем, что ПЦР проводят в один прием в двух реакционных смесях, каждая из которых содержит специально подобранную смесь праймеров SEQ ID NO: 1 к генам ctxBCL и ctxBEL с зондами G-FAM и A-VIC, соответственно, в первой, и праймеров SEQ ID NO: 2 F+R к гену rtxC с зондом ROX во второй, с температурой отжига праймеров 57°С в течение 30 с при числе циклов амплификации, равном 40, с последующим анализом путем сравнения амплифицированных фрагментов генов исследуемых и контрольных штаммов. Для штаммов V. cholerae классического биовара характерно наличие ампликона гена ctxBCL, идентичных контрольному образцу. Для типичных токсигенных штаммов V. cholerae O1 биовара Эль Тор характерно наличие ампликонов генов ctxBEL и rtxC, идентичных контрольному образцу, а для измененных вариантов V. cholereae O1 биовара Эль Тор характерно наличие ампликонов генов ctxBCL и rtxC, идентичных контрольному образцу.
В качестве контроля используют ДНК типичных токсигенных штаммов V. cholerae классического и Эль Тор биоваров.
Технический результат также достигается тест-системой для идентификации и дифференциации типичных и измененных токсигенных штаммов V. cholerae O1 биовара Эль Тор методом мультиплексной полимеразной цепной реакции, включающей компоненты для выделения ДНК и компоненты для проведения ПЦР в режиме Real Time: 10х буфер для TaqPol, MgCL2 (50 мМ), деионизованную стерильную воду, два положительных контроля (ПКО+Эль Тор и ПКО + Classical), фермент TaqPol (5 ед/мкл), смесь dNTPs (5 мМ), смесь 1, содержащую праймеры SEQ ID NO:l к F+R ctxBCL (10 мМ) и F+R ctxBEL(10 мМ), зонды G -FAM (10 мМ), A-VIC (10 мМ) и смесь 2, содержащую праймеры SEQ ID NO: 2, к гену rtxC (10 мМ) и зонд ROX (10 мМ).
При разработке способа особое значение придавали конструированию смеси праймеров и зондов, специфичных к генам классического и Эль Тор биоварам. В качестве мишений были выбраны гены ctxB и rtxC. Наша разработка набора зондов, оказавшихся высоко специфичными, позволила сконструировать тест-систему для проведения ПЦР в «реальном времени».
При этом накопление продукта амплификации с зондом, специфичным к соответствующей аллели (ctxBCL или ctxBEL) гена ctxB свидетельствует о наличии в пробе ДНК гена ctxB классического или Эль Тор биоваров. Накопление продукта амплификации с двумя зондами одновременно (в двух каналах) свидетельствует о наличии в пробе ДНК двух генов одновременно. Накопление продукта амплификации с зондом ROX, специфичным к гену rtxC в канале Orange, свидетельствует о наличии в пробе ДНК гена rtxC.
Экспериментально установлен оптимальный состав реакционной смеси для проведения мультиплексной цепной реакции в режиме «реального времени», подобрано сочетание праймеров и зондов, необходимое и достаточное соотношение компонентов реакционной смеси и определен режим постановки ПЦР, что является важным при проведении ПЦР анализа.
Заявляемая ПЦР-тест-система «Гены Vibrio cholerae O1 вариант ctxB - rtxC, FL» разделена на 3 комплекта:
Комплект 1 содержит компоненты для выделения ДНК, упакованные в шесть пластиковых флаконов, содержащих раствор 1 (6 М раствор гуанидинтиоционата), раствор 2 (4 М раствор гуанидинтиоционата), раствор 3 (спиртосолевой раствор), ацетон, элюент для ДНК (ТЕ-буфер), 2 пластиковые пробирки с нуклеосорбентом;
Комплект 2 состоит из компонентов для проведения ПЦР со смесью 1: 1 пластиковая пробирка, содержащая F+R ctxB праймеры (10 мМ), зонд G -FAM (10 мМ), зонд A-VIC (10 мкМ), 10х буфер для TaqPol, MgCL2 (50 мМ), смесь dNTPs (5 мМ), TaqPol (5 ед/мкл), Н2O или РНК элюэнт; 1 пластиковая пробирка, содержащая контрольный положительный образец с ДНК типичного токсигенного штамма V. cholerae O1 классического биовара, и 1 пластиковая пробирка, содержащая контрольный положительный образец с ДНК типичного токсигенного штамма V. cholerae O1 биовара Эль Тор;
Комплект 3 состоит из компонентов для проведения ПЦР со смесью №2: 1 пластиковая пробирка, содержащая F+R rtxC праймеры (10 мкМ), зонд на rtxC (10 мкМ), 10х буфер для TaqPol, MgCL2 (50 мМ), смесь dNTPs (5 мМ), TaqPol (5 ед/мкл), Н2O или РНК элюэнт;1 пластиковая пробирка, содержащая контрольный положительный образец с ДНК типичного токсигенного штамма V. cholerae O1 классического биовара, и 1 пластиковая пробирка, содержащая контрольный положительный образец с ДНК типичного токсигенного штамма V. cholerae O1 биовара Эль Тор;
ПЦР-тест-система «Гены Vibrio cholerae O1 вариант ctxB - rtxC, FL» рассчитана на проведение 50 определений, включая контрольные образцы.
Заявляемый способ идентификации включает следующие этапы.
а) Выделение ДНК с использованием реагентов для экстракции ДНК «АмплиПрайм ДНК-сорб-АМ» (комплект 1).
б) Проведение ПЦР в «реальном времени»: (комплект 2, 3). Полимеразную цепную реакцию двух реакционных смесей различного состава с гибридизационно-флуоресцентной детекцией в режиме «реального времени» проводят в объеме 25 мкл. в один этап по следующей программе:
предварительная денатурация 1 цикл 95°С - 3 мин, 40 циклов 95°С -20 сек, 57°С - 30 сек (измерение флуоресценции), пролонгация 72°С - 20 сек.
в) Анализ и интерпретация результатов:
Способ осуществляют следующим образом.
1. Подготовку проб проводят согласно МУ 1.3. 2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности» в боксе биологической безопасности II класса в противочумном костюме IV типа в резиновых или латексных перчатках. Клетки холерных вибрионов, выращенные на щелочном агаре (рН 7,8) в течение 18 часов, ресуспендируют в 0,85% растворе натрия хлорида до концентрации 109 микробных клеток в 1 мл и последующим разведением в деионизованной воде доводят до концентрации 1×107 м.к./мл. Затем к суспензии добавляют мертиолят натрия до конечной концентрации 1:10000 (0,01%) и прогревают его при 56°С в течение 30 мин. Далее, 100 мкл образца переносят в микроцентрифужные пробирки объемом 1,5 мл, добавляют лизирующий раствор, приготовленный на основе 6 М гуанидинизотиоцианата, и инкубируют 15 мин при 65°С. После выполнения данных процедур материал считается обеззараженным.
Выделение ДНК осуществляют с использованием комплекта 1. - комплект 1 (Комплект реагентов для экстракции ДНК «АмплиПрайм ДНК-сорб-АМ») включает упакованные в двух пластиковых флаконов, содержащих соответственно раствор 1 (6 М раствор гуанидинтиоционата), раствор 2 (4 М раствор гуанидинтиоционата), раствор 3 (спиртосолевой раствор), ацетон, элюент для ДНК (ТЕ-буфер), 2 пластиковые пробирки с нуклеосорбентом.
Комплект для выделения ДНК извлекают из холодильника и выдерживают при комнатной температуре. Все реагенты комплекта добавляют отдельными наконечниками с помощью автоматических микропипеток. Раствор 1 прогревают при температуре 60-65°С до полного растворения кристаллов, после чего добавляют к обеззараженным пробам в объеме 300 мкл. Пробы тщательно перемешивают на микроцентрифуге/встряхиватиле и инкубируют при температуре 65°С. Сорбент тщательно ресуспендируют на микроцентрифуге/встряхиватиле. В каждую пробирку вносят 25 мкл подготовленного сорбента, перемешивают на микроцентрифуге/встряхиватиле 30 с и оставляют в штативе на 2 минуты.
Процедуру повторяют дважды. Затем пробирки центрифугируют при 12000 g в течение 30 с, супернатант удаляют. К осадку добавляют 300 мкл раствора 2. Содержимое пробирки перемешивают на микроцентрифуге/встряхивателе до гомогенного состояния, центрифугируют при 12000 g в течение 30 с, супернатант удаляют.
Затем к осадку добавляют 500 мкл раствора 3. Содержимое пробирки перемешивают на микроцентрифуге/встряхивателе до гомогенного состояния и центрифугируют при 12000 g в течение 30 с. Супернатант удаляют, отмывку раствором 3 повторяют.К осадку добавляют 400 мкл ацетона. Содержимое перемешивают на микроцентрифуге/встряхивателе, затем центрифугируют при 12000 g в течение 30 с, супернатант удаляют. Осадок высушивают при температуре 65°С в течение 5-7 мин. К осадку добавляют 50 мкл ТЕ-буфера и выдерживают при температуре 65°С в течение 10 мин, встряхивая на микроцентрифуге/встряхивателе 2-3 раза. По окончании взвесь центрифугируют при 12000 g в течение 1 мин. Супернатант содержит очищенную ДНК.
2. Проведение ПЦР в «реальном времени»: (комплект 2, 3). Из морозильной камеры извлекают, размораживают содержимое пробирок комплектов 2, 3 и готовят реакционные смеси для проведения ПЦР: из комплекта 2 готовят необходимое количество микропробирок (соответствующее числу исследуемых проб) со смесью 1, а из комплекта 3 готовят такое же количество пробирок со смесью 2.
Смесь 1 состоит из следующих компонентов:
Контроли:
Смесь 2 состоит из следующих компонентов:
Режим амплификации: 1 цикл 95°С-3 мин; 40 циклов 95°С - 20 сек; 57°С - 30 сек; 72°С - 20 сек. Накопление продукта амплификации только с зондом специфичным к гену ctxBCL (G-FAM) в канале Green свидетельствует о наличии в пробе ctxBCL (В1). Накопление продукта амплификации только с зондом, специфичного к гену ctxBEL (A-VIC) в канале HEX/VIC (Yellow)- о наличии в пробе гена ctxBEL (В3). Накопление продукта амплификации с двумя зондами одновременно (в двух каналах) свидетельствует о наличии в пробе ДНК двух генов одновременно. Накопление продукта амплификации только с зондом ROX, специфичного к гену rtxC в канале Orange, свидетельствует о наличии в пробе ДНК гена rtxC.
3. Анализ результатов амплификации ДНК исследуемых штаммов микроорганизмов с ПЦР-смесью №1 - анализируют кривые накопления флуоресцентного сигнала по двум каналам:
- по каналу для флуорофлора G-FAM регистрируется сигнал, свидетельствующий о накоплении продукта амплификации фрагмента ДНК гена ctxBCL (Вl) на канале Green;
- по каналу для флуорофлора A-VIC регистрируется сигнал, свидетельствующий о накоплении продукта амплификации фрагмента ДНК гена ctxBEL (B3) на канале Yellou.
- Анализ результатов амплификации ДНК исследуемых штаммов микроорганизмов с ПЦР-смесью №2. - по каналу для флуорофлора ROX регистрируется сигнал, свидетельствующий о накоплении продукта амплификации фрагмента ДНК гена rtxC на канале Orange.
Уровень пороговой линии (Порог) на всех каналах учета - 0,05. Ct (не ≥25).
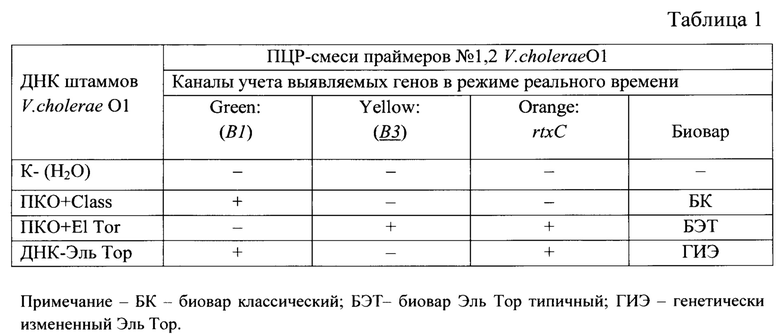
Учет результатов ПНР-анализа проводят путем сравнения полученных ампликонов с контрольными образцами в соответствие с результатами амплификации по таблице 1.
Изобретение иллюстрируется следующим примером.
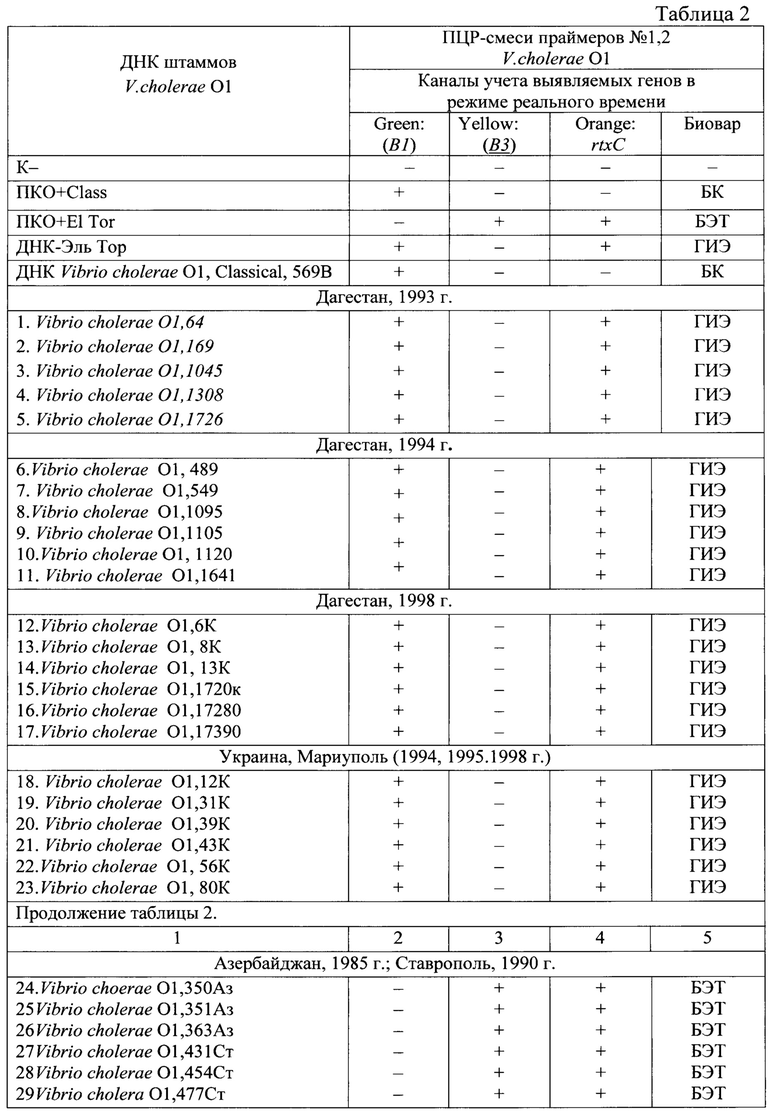
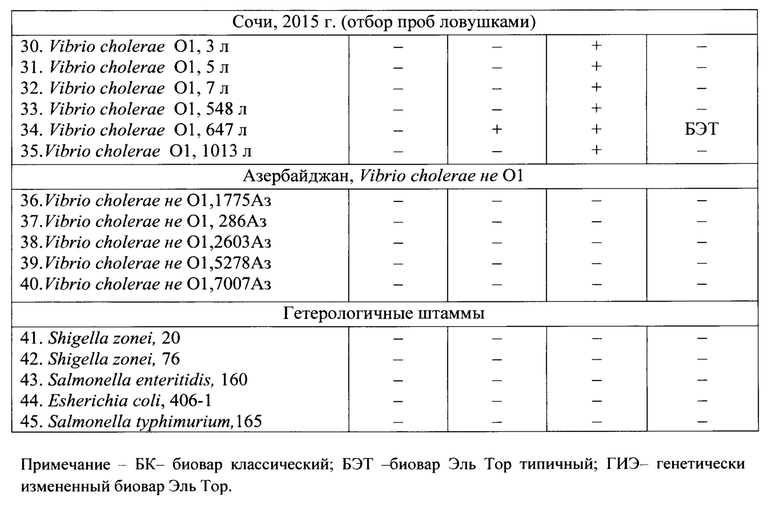
Пример 1. Для определения эффективности заявляемого способа и тест-системы проведен ПЦР-анализ штаммов Vibrio cholerae O1, non 01/139 и гетерологичных микроорганизмов, выделенных на различных территориях и в разные годы таблица 2.
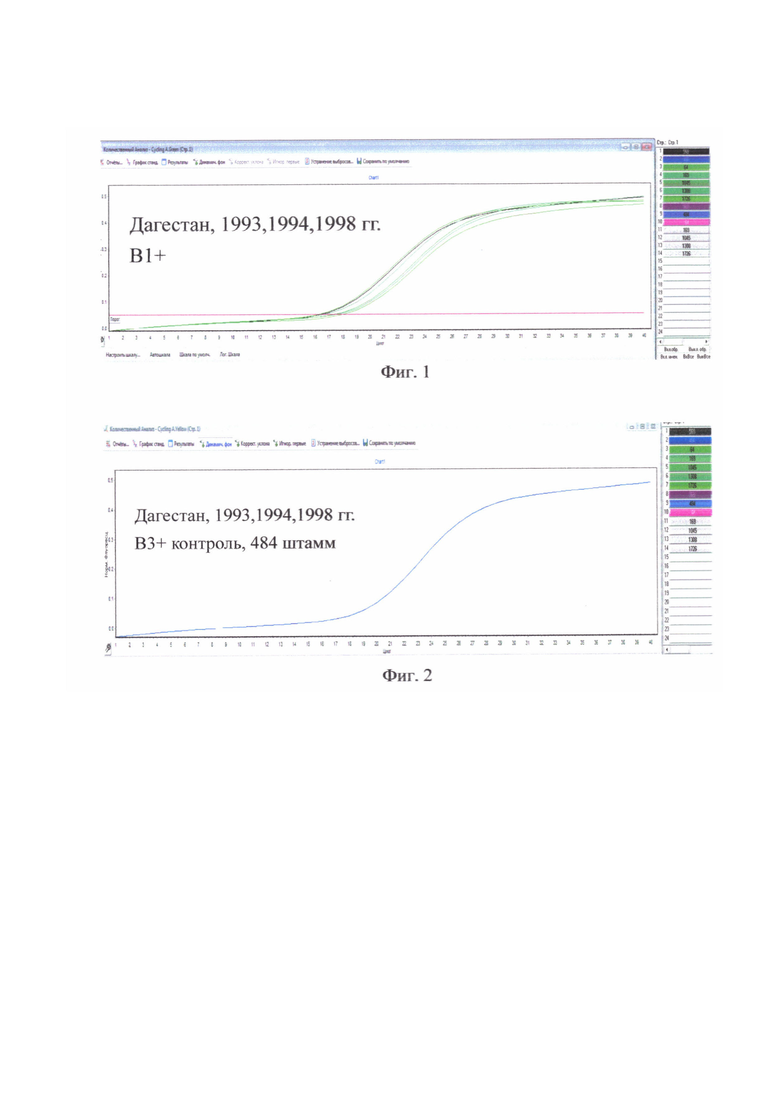
Протоколы результатов ПЦР-анализа ДНК штаммов V.cholerae O1, nonO1/O139 и гетерологичных микроорганизмов представлены на фиг. 1-18,
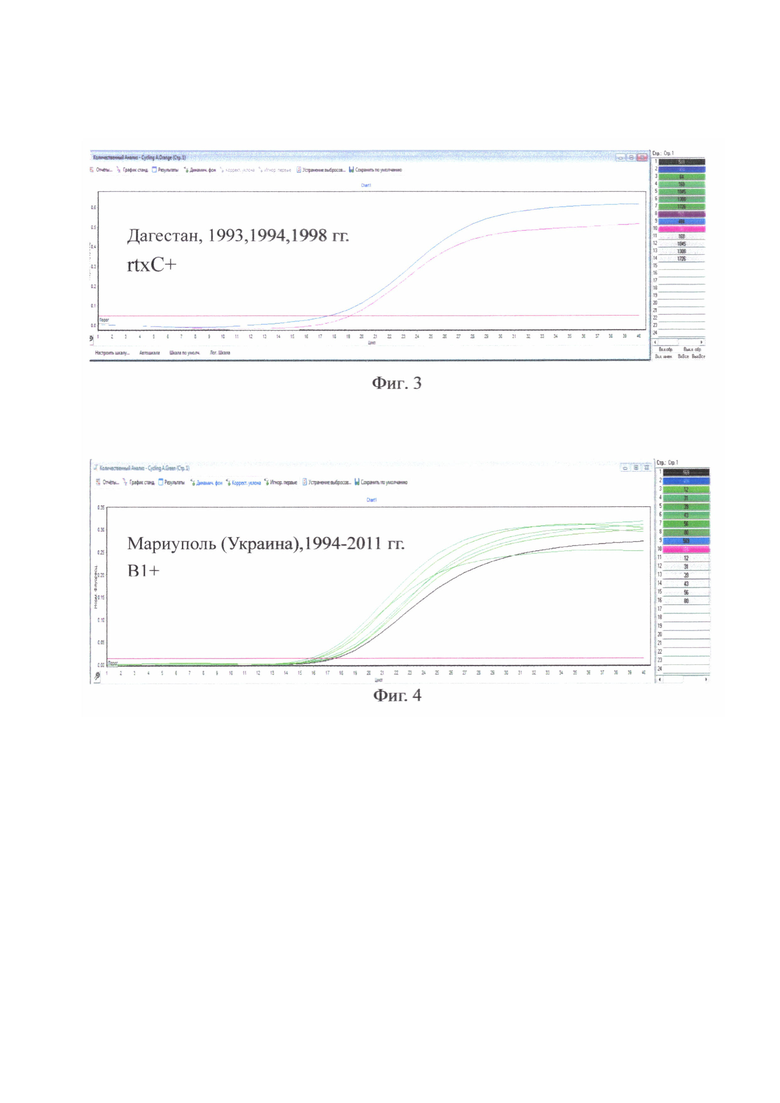
где на фиг. 1 - Дагестан, 1993, 1994, 1998 гг., В1+;
на фиг. 2 - Дагестан, 1993, 1994, 1998 гг. В3+ контроль, 484 штамм;
на фиг. 3 - Дагестан, 1993, 1994, 1998 гг., rtxC+ у всех исследованных штаммов;
на фиг. 4 - Мариуполь (Украина), 1994-2011 гг. В1+ у всех исследованных штаммов;
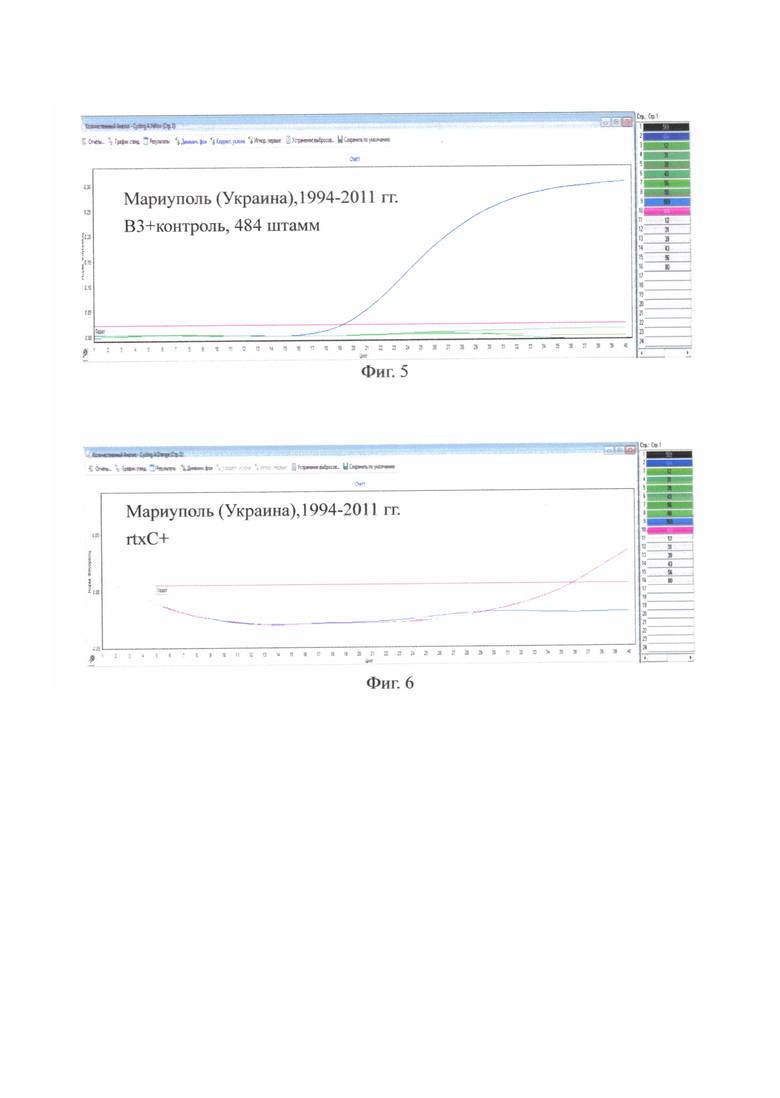
на фиг. 5 - Мариуполь (Украина), 1994-2011 гг. ВЗ3т олько у контрольного штамма;
на фиг. 6 - Мариуполь (Украина), 1994-2011 гг. rtxC+ у всех исследованных штаммов;
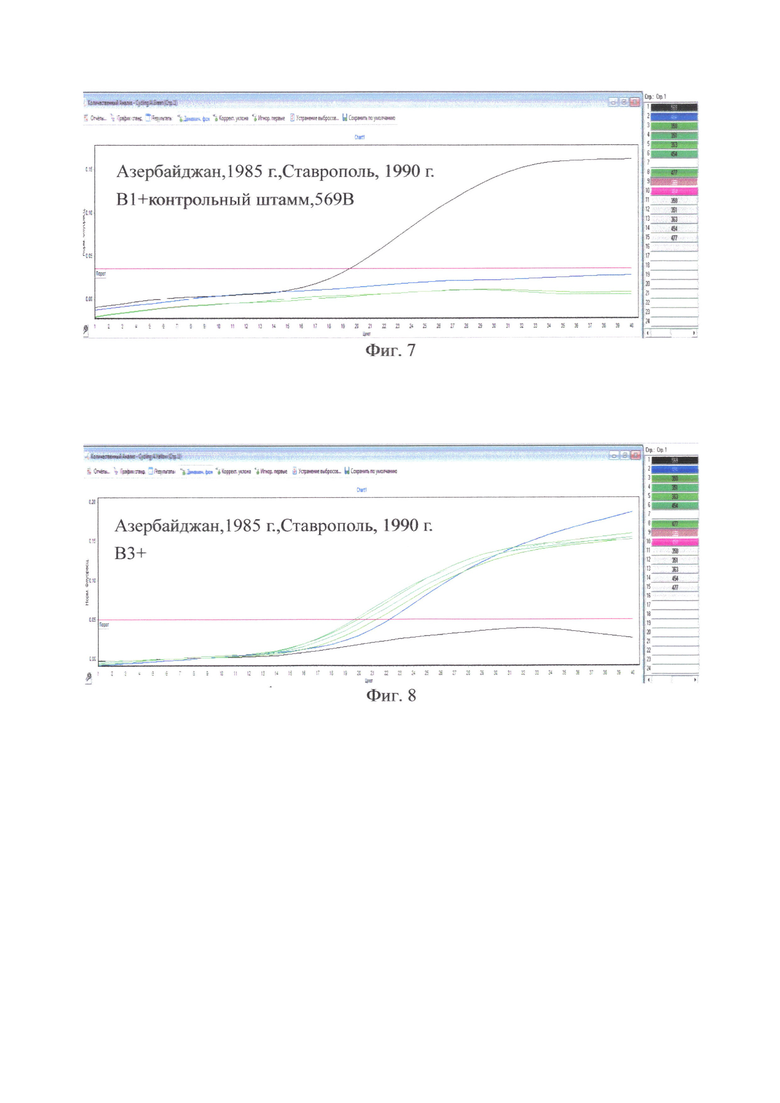
на фиг. 7 - Азербайджан, 1985 г., Ставрополь, 1990 г. В1+ только у контрольного штамма, 569В;
на фиг. 8 - Азербайджан, 1985 г., Ставрополь, 1990 г. В3 у всех исследованных штаммов;
на фиг. 9 - Азербайджан, 1985 г., Ставрополь, 1990 г. rtxC+ у всех исследованных штаммов;
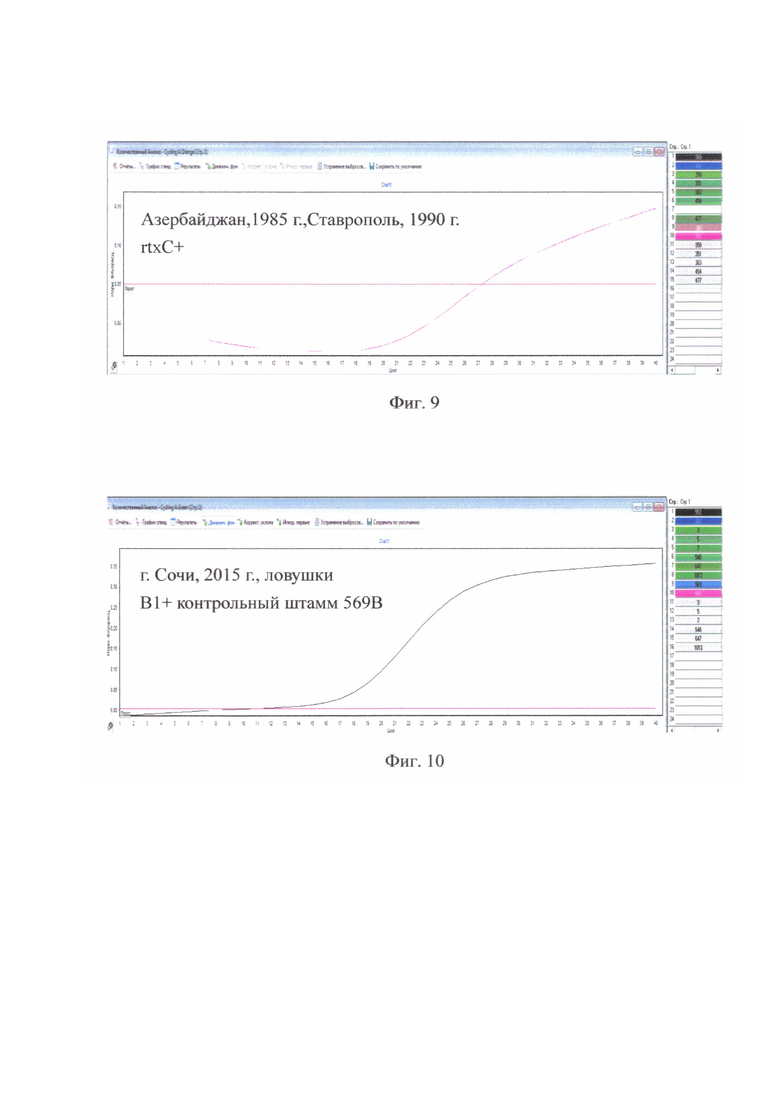
на фиг. 10 - г. Сочи, 2015 г., ловушки В1+ только у контрольного штамма 569В;
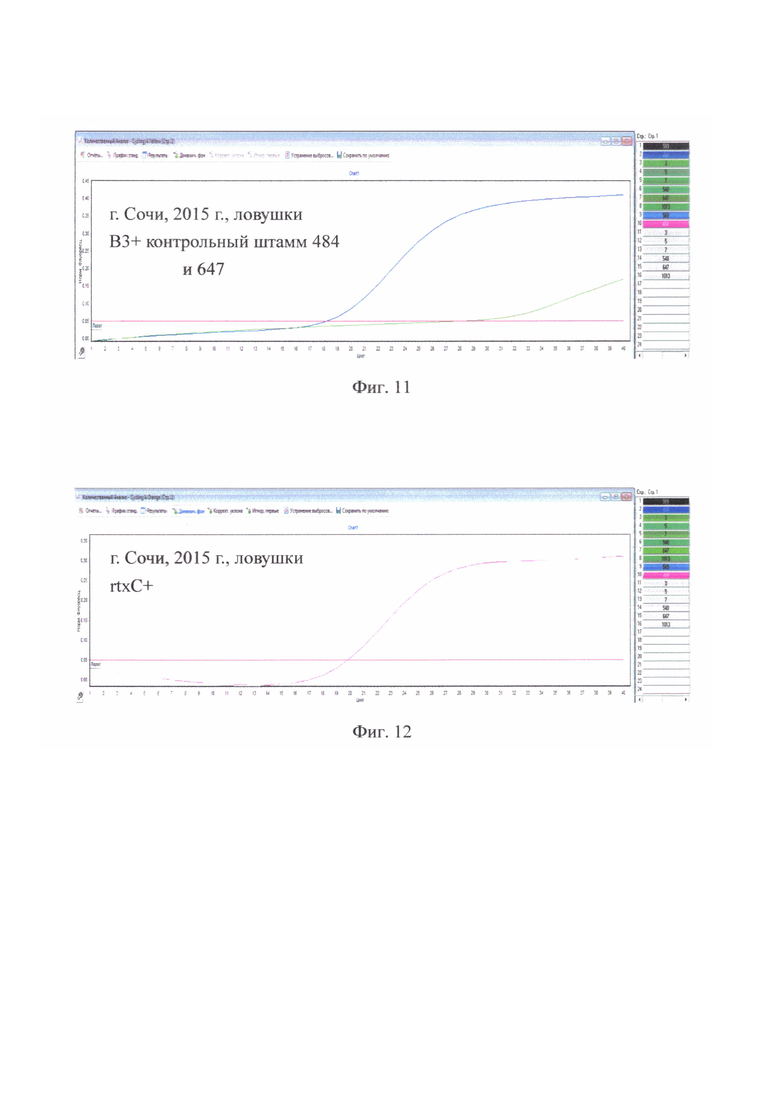
на фиг. 11 - г. Сочи, 2015 г., ловушки В3+ у контрольного штамма 484 и штамма 647;
на фиг. 12 - г. Сочи, 2015 г., ловушки rtxC+ у всех исследованных штаммов;
на фиг. 13. - Азербайджан, V. choleraenonO1, В1+ только у контрольного штамма 569В;
на фиг. 14 - Азербайджан, V. choleraenonO1, В3+ только у контрольного штамма 484;
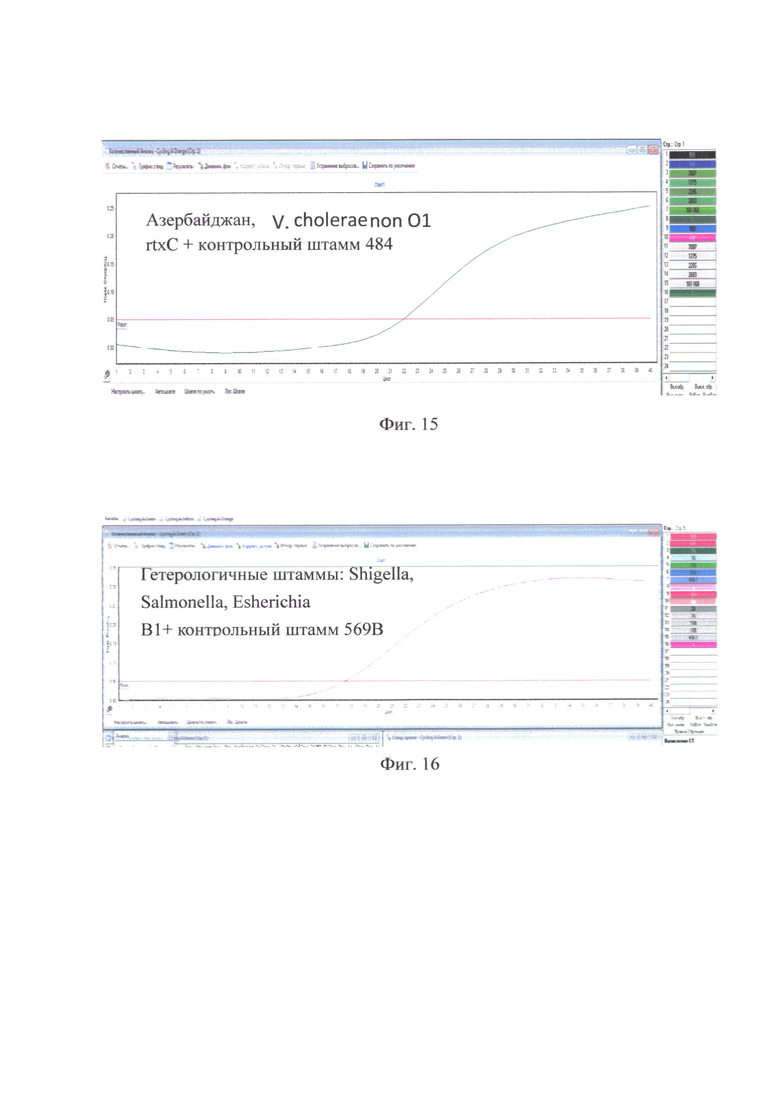
на фиг. 15 - Азербайджан, V. cholera поп O1, rtxC+ только у контрольного штамма 484;
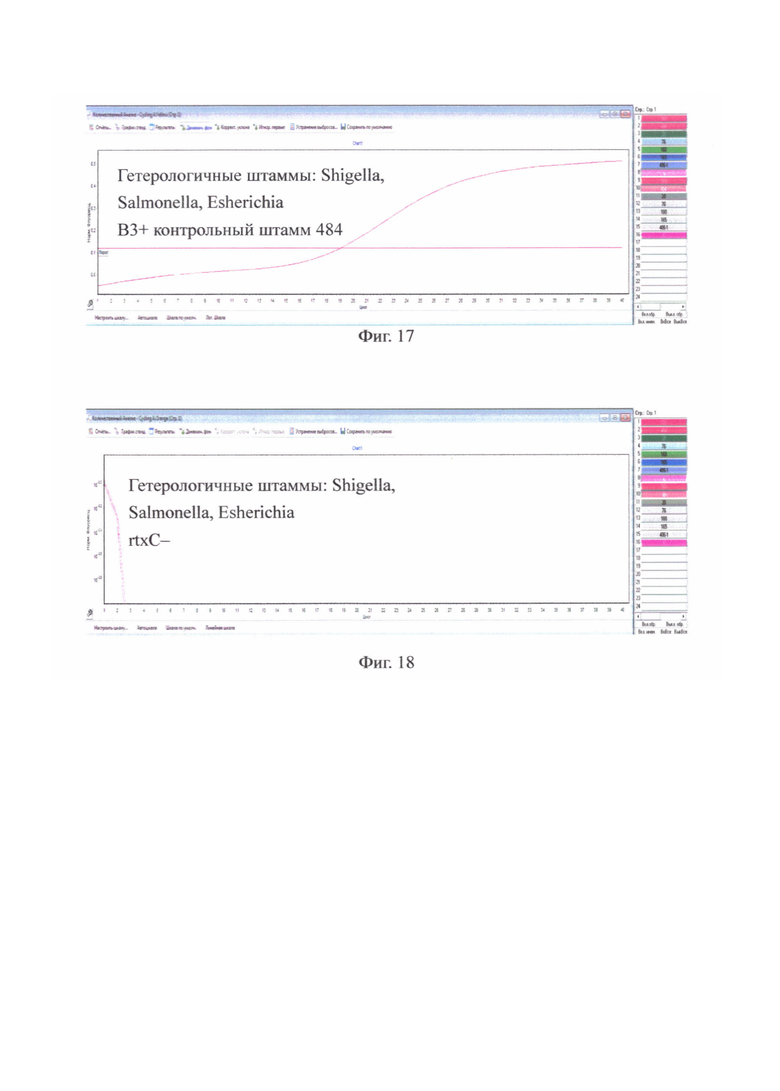
на фиг. 16 - Гетерологичные штаммы: Shigella, Salmonella, Esherichia В1+ только у контрольного штамма 569В;
на фиг. 17 - Гетерологичные штаммы: Shigella, Salmonella, Esherichia В3+ только у контрольного штамма 484;
на фиг. 18 - Гетерологичные штаммы: Shigella, Salmonella, Esherichia ген rtxC - не содержат.
Результаты, представленные в таблице 2 и на фигурах 1-18, показали, что «Набор реагентов ПЦР-тест-системы Гены Vibrio cholerae вариант ctxB - rtxC, FL)» выявляет в геноме токсигенных V. cholera O1 фрагменты ДНК генов ctxBCl, ctxBEl, rtxC (обладает специфической активностью), и не выявляет данные гены у нетоксигенных V. cholera O1 и поп O1, а также у гетерологичных штаммах микроорганизмов - Shigella zonnei 20, 76; Salmonella typhimurium 160; Salmonella enteritidis165; Esherichia coli 406-1) (обладает специфичностью).
Таким образом, предлагаемый способ и мультиплексная ПЦР тест-система «Гены Vibrio cholerae вариант ctxB - rtxC, FL)» позволяют быстро и достоверно идентифицировать холерные вибрионы O1 серогруппы классического или Эль Тор биовара, определять их токсигенность и дифференцировать выявленные токсигенные штаммы V cholerae биовара Эль Тор на типичные изоляты и измененные варианты.
СПИСОК ЛИТЕРАТУРЫ
1. De Haan L. Cholera toxin: a paradigm for multi-functional engagement of cellular mechanisms. / L. De Haan, T.R. Hirst // Mol. Membr. Biol. - 2004. - Vol. 21, N2. - P. 77-92.
2. Comparative genomicanalysis of Vibrio cholerae: genes that correlate with cholera endemic and handemic disease. / Dziejman M., Balon E., Boyd D. [et al.] // Proc. Natl. Acad. Sci. USA. - 2002. - Vol. 99, N 3. - P. 1556-1561.
3. The El Tor biotype of Vibrio cholerae exhibits Vibrio cholerae a growth advantage in the stationary phase in mixt cultures with the classical biotype. / S. Pradhan, A.K. Baidya, A. Ghosh [et al.] // J. Bacteriol. - 2010. - Vol. 192, N 4. - P. 955-963.
4. Development and validation of a mismatch amplification mutation PCA assay to monitor tht dissemination of an emerging variant of Vibrio cholerae O1 biotype El Tor. / Morita M., Ohnishi M., Arakava E. [et al.] // Microbiol. Immunol. - 2008. - Vol. 52. - P. 314-317.
5. Vibrio cholera O1 Hybrid El Tor strains Asia and Africa / G.B. Nair, F. `Qadri, J. Holmgren [et al.] / G.B. Nair // J. Clin. Microbiol.- 2006. - Vol.44. - P. 3296-3299.
6. Смирнова Н.И., Челдышова Н.Б., Горяев A.A. и др. Эволюция генома Vibrio cholerae: пути формирования атипичных штаммов. Пробл. особо опасных инф. 2008, 3(97): 3-12
7. Эволюция генома холерного вибриона биовара Эль Тор и разработка ПЦР-тест-системы для идентификации штаммов возбудителя холеры / Савельева И.В., Куличенко А.Н., Ковалев Д.А. [и др.] // Холера и патогенные для человека вибрионы: материалы проблемной комиссии- Ростов-на-Дону, 2017. Вып. 30 - С. 172-177.
8. Шашкова А.В. Фенотипический и молекулярно-генетический анализ измененных вариантов Vibrio cholerae биовара эльтор: автореф. дисс.… канд. биол. наук / А.В. Шашкова - Саратов, 2012. - 21 с.
9. Morita М., Ohnishi М., Arakawa Е. et al. Development and validation of a mismatch amplification mutation PCR assay to monitor the dissemination of an emerging variant of Vibrio cholerae O1 biotype El Tor. Microbiol. Immunol. 2008, 52(6): 314-317.
10. Смирнова Н.И., Горяев А.А., Шубина А.В.,Заднова С.П., Кутырев B.B. Патент РФ №2458141, опубликован 10.08.2012.
Способ идентификации штаммов VIBRIOCHOLERAEO1,
определения их токсичности и биовара с дифференциацией
биовара Эль Тор на типичные и генетически измененные
варианты методом мультиплексной полимеразной цепной
реакции и тест-система для его осуществления с учетом
результатов в режиме «реального времени»
Перечень последовательностей праймеров и зондов 5’– 3’
SEQ ID NO: 1
ctxB-F = TGTGAATCTATATGTTGACTACCTGG
ctxB-R = CTCTAGCTGGAAAAAGAGAGATGG
ctxB-FAM-G = FAM-TCTACTTGAAAAGTTGCACC BHQ1
ctxBCL= G(FAM), канал Green
ctxB-VIC-A = VIC-TCTACTTGAAAAATTGCACC-BHQ
ctxBEL= A(VIC), каналYellou
SEQ ID NO: 2
rtxC-F = GCTCAAACGCAGGCAGAATG
rtxC-R = GATAGGTGGTGTGATGCTGCTC
rtxC-Probe = FAM/ROXCAGCCATTCTGCAACCACA AACGAC-BHQ1/2
rtxC-Probe = FAM/ROX,канал Orange

Изобретение относится к области биотехнологии. Изобретение представляет собой способ идентификации штаммов Vibrio cholerae O1, определения их токсигенности и биовара с дифференциацией биовара Эль Тор на типичные и генетически измененные варианты методом мультиплексной полимеразной цепной реакции (ПЦР) в режиме «реального времени», включает: выделение ДНК из исследуемой культуры Vibrio cholerae O1; компоненты для проведения ПЦР: 10х буфер для TaqPol, MgCL2 (50 мМ), смесь dNTPs (5 мМ), TaqPol (5 ед/мкл), деионизированную стерильную воду, смесь праймеров 1 - (F+R) ctxB праймеры (10 мМ), зонд G -FAM (10 мМ) и зонд A-VIC (10 мМ), смесь праймеров 2 - (F+R) rtxC праймеры (10 мкМ), зонд ROX на ген rtxC (10 мМ), два положительных (ПКО+Classical и ПКО+Е1 Tor) и один отрицательный (Н2О) контроли; проведение полимеразной цепной реакции в один прием в двух реакционных смесях различного состава в объеме 25 мкл в режиме «реального времени»: 1 цикл 95°С - 3 мин, 40 циклов 95°С - 20 с, 57°С - 30 с (измерение флуоресценции), 72°С - 20 с; учет результатов по специфическим кривым полосам в каналах Green (ген ctxBCL), Yellow (ген ctxBEL), Orange (ген rtxC) при уровне пороговой линии на данных каналах учета - 0,05; Ct≤30. Способ с использованием набора обеспечивает возможность быстро и достоверно идентифицировать холерные вибрионы классического биовара или биовара Эльтор и дифференцировать выявленные токсигенные штаммы V. cholerae биовара Эль Тор на типичные и измененные варианты. 2 н.п. ф-лы, 2 табл., 18 ил.
1. Способ идентификации штаммов V. cholerae O1, определения их токсигенности и биовара с дифференциацией штаммов биовара Эль Тор на типичные и измененные методом мультиплексной полимеразной цепной реакции с гибридизационно-флуоресцентным учетом результатов, характеризующийся тем, что полимеразную цепную реакцию проводят в один прием в двух реакционных смесях, каждая из которых содержит специально подобранное сочетание праймеров SEQ ID NO: 1 к генам ctxBCL и ctxBEL с зондами G-FAM и A-VIC в первой; и праймеров SEQ ID NO: 2 F+R к гену rtxC с зондом ROX во второй, с температурой отжига праймеров 57°С в течение 30 с при числе циклов амплификации, равном 40, с последующим анализом путем сравнения амплифицированных фрагментов генов исследуемых и контрольных штаммов; для типичных токсигенных штаммов V. cholerae O1 классического биовара характерно наличие ампликонов гена ctxBCL, идентичных контрольному образцу; для типичных токсигенных штаммов V. cholerae O1 биовара Эль Тор характерно наличие ампликонов генов ctxBEL и rtxC, идентичных контрольному образцу; для измененных вариантов V. cholerae биовара Эль Тор характерно наличие ампликонов к генам ctxBCL и rtxC.
2. Тест-система «Гены Vibrio cholerae O1 вариант ctxB - rtxC, FL» для осуществления способа по п. 1 методом мультиплексной полимеразной цепной реакции (ПЦР) в режиме «реального времени» включает: выделение ДНК из исследуемой культуры Vibrio cholerae O1; компоненты для проведения ПЦР: 10х буфер для TaqPol, MgCL2 (50 мМ), смесь dNTPs (5 мМ), TaqPol (5 ед/мкл), деионизированную стерильную воду, смесь праймеров SEQ ID NO: 1 к генам ctxBCL и ctxBEL с зондами G-FAM (10 мМ) и A-VIC (10 мМ), смесь праймеров SEQ ID NO: 2 F+R к гену rtxC с зондом ROX (10 мМ), два положительных ПКО+Classical (ДНК V. cholerae Classical 569В) и ПКО+El Tor (ДНК V. cholerae El Tor, 484Ст) и один отрицательный (Н2О) контроли; проведение полимеразной цепной реакции в один прием в двух реакционных смесях различного состава в объеме 25 мкл в режиме «реального времени»: 1 цикл 95°С - 3 мин, 40 циклов 95°С - 20 с, 57°С - 30 с, 72°С - 20 с; учет результатов по специфическим кривым полосам в каналах Green (ген ctxBCL), Yellow (ген ctxBEL), Orange (ген rtxC) при уровне пороговой линии на данных каналах учета - 0,05; Ct≤30.
| СПОСОБ ИДЕНТИФИКАЦИИ ТОКСИГЕННЫХ ШТАММОВ V. CHOLERAE O1, ОПРЕДЕЛЕНИЯ ИХ БИОВАРА И ДИФФЕРЕНЦИАЦИИ ШТАММОВ БИОВАРА ЭЛЬТОР НА ТИПИЧНЫЕ И ИЗМЕНЕННЫЕ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ И ТЕСТ-СИСТЕМА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2458141C1 |
| ШАШКОВА А.В., и др., Конструирование ПЦР Тест-системы для идентификации токсигенных штаммов Vibrio cholera 01, определения их биовара и дифференциации штаммов эльтор вибрионов на типичные и измененные, Проблемы особо опасных инфекций, вып.110, 2011, с | |||
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| ШАШКОВА А.В., Фенотипический и молекулярно-генетический | |||
Авторы
Даты
2020-09-16—Публикация
2019-07-30—Подача