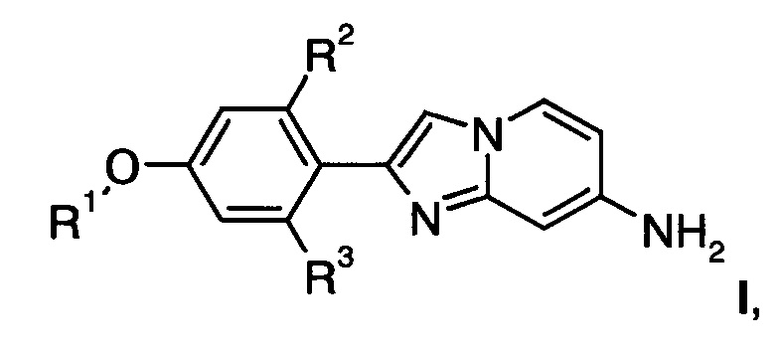
Настоящее изобретение относится к соединениям общей формулы
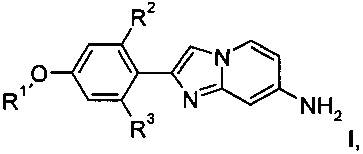
где
R1 представляет собой низший алкил или низший алкил, замещенный галогеном;
R2, R3 представляет собой водород или тритий;
или их фармацевтически приемлемым кислотно-аддитивным солям.
Аналогичные соединения описаны, например, в WO 2011/117264 в качестве модуляторов фосфодиэстеразы 10А (PDE10A) для лечения заболеваний центральной нервной системы и в WO 2010/068453 и WO 2010/068452 в качестве модуляторов гидролазы амидов жирных кислот.
2-Арил-3-(гетероарил)-имидазо(1,2-а)пиримидины описаны в WO 0134605 для лечения состояний, облегчаемых снижением воспалительных цитокинов.
Было показано, что соединения по настоящему изобретению могут применяться для связывания и визуализации агрегатов белка tau и ассоциированных бета-складчатых агрегатов, включая среди прочих агрегаты бета-амилоида или агрегаты альфа-синуклеина, особенно для применения для связывания и визуализации агрегатов белка tau у пациентов с болезнью Альцгеймера.
Болезнь Альцгеймера (БА) представляет собой прогрессирующее нейродегенеративное заболевание, характеризующееся снижением когнитивных способностей, необратимой потерей памяти, дезориентацией и нарушением речи (Arch. Neurol. 1985, 42(11), 1097-1105). Аутопсия разделов мозга пациентов с БА выявила обильные сенильные бляшки (SPs), состоящие из бета-амилоидных (Аβ) пептидов, и присутствие нейрофибриллярных клубков (NFT) образованных из филаментов гиперфосфорилированного белка tau.
Tau относится к семейству ассоциированных с микротрубочками белков и экспрессируется главным образом в нейронах, играя в них важную роль в сборке тубулиновых мономеров в микротрубочки для образования нейрональной сети микротрубочек в качестве пути для аксонального транспорта (Brain Res. Rev. 2000, 33(1), 95-130). Tau транслируется с единственного гена, расположенного на 17 хромосоме и его экспрессия в процессе развития контролируется механизмом альтернативного сплайсинга, дающим 6 различных изоформ в мозге взрослого человека, которые могут быть дифференцированы по количеству связывающих доменов. Механизмы, лежащие в основе гиперфосфорилирования, неправильного фолдинга и агрегирования tau до сих пор неясны, однако отложение агрегатов tau происходит по стандартному пространственно-временному пути, как на внутриклеточных уровнях, так и на уровне топографии мозга.
Недавнее открытие мутаций гена tau, ведущих к лобно-височной деменции (FTD) с паркинсонизмом связанных с хромосомой 17 усилила доминирующую роль приписываемую tau в патогенезе нейродегенеративных расстройств и подчеркнуло тот факт, что различные наборы изоформ tau, экспрессируемые в различных нейронных популяциях могут привести к различным патологиям (Biochim. Biophys. Acta 2005, 1739(2) 240-250). Нейродегенеративные заболевания, характеризующиеся патологическим накоплением белка tau называются "тауопатиями" (Ann. Rev. Neurosci. 2001, 24, 1121-1159). Помимо БА и FTD, другие тауопатии включают прогрессивный супрануклеарный паралич (PSP), слабоумие с преобладающими клубками, болезнь Пика, лобно-височную лобарную дегенерацию (FTLD), синдром Дауна и другие.
Между постепенным вовлечением районов неокортекса и увеличением тяжести деменции была установлена прямая корреляция, предполагая, что патологические агрегаты tau, такие как NFT, являются надежным маркером нейродегенеративного процесса. Степень участия NFT в БА определяется стадиями этапов по Брааку (Acta Neuropathol. 1991, 82, 239-259). Стадии Браака I и II определяются, когда участие NFT приурочено в основном к трансэнторинальным областям мозга, стадии III и IV диагностируется, когда затронуты лимбические регионы, такие как гиппокамп, и стадии V и VI, когда устанавливают обширное участие неокортекса.
В настоящее время обнаружение агрегатов tau возможно только гистологическим анализом материалов биопсии или аутопсии. Визуализация in vivo патологии tau обеспечит новый взгляд на отложения агрегатов tau в головном мозге человека и позволит неинвазивно исследовать степень патологии tau, количественную оценку изменений отложения tau с течением времени, оценку ее взаимосвязи с когнитивными способностями и анализ эффективности анти-tau терапии. Потенциальные лиганды для обнаружения агрегатов tau в живом мозге должны проходить через гематоэнцефалический барьер и обладать высоким сродством и специфичностью к агрегатам tau. Для этого, эффективные нейровизаулизирующие радиотрейсеры должны иметь соответствующую липофильность (logD 1-3) и низкую молекулярную массу (<450), проявлять быстрый клиренс из крови и низкое неспецифическое связывание.
Объектом настоящего изобретения является нахождение средства визуализации, которое позволит улучшить диагноз посредством выявления потенциальных пациентов с избытком агрегатов tau в головном мозге, которые могут быть склонны к развитию болезни Альцгеймера. Оно также будет полезно для мониторинга прогрессирования заболевания. Когда станет доступным лекарство против агрегатов tau, визуализация клубков tau в головном мозге может обеспечить необходимый инструмент для контроля лечения.
Дополнительным объектом настоящего изобретения является способ визуализации отложений агрегатов tau, содержащий
- введение млекопитающему детектируемого количества композиции
- выдержку в течение времени, достаточного для связывания соединения формулы I с отложениями агрегатов белка tau, и
- детекция соединения, связанного с одним или более отложениями агрегатов белка tau.
Дополнительным объектом настоящего изобретения является фармацевтическая композиция, содержащая соединения формулы I и фармацевтически приемлемые носители, которая может применяться для идентификации потенциальных пациентов.
Следующие определения общих терминов, используемых в настоящем описании применяются независимо от того, используются ли указанные термины самостоятельно или в комбинации.
Как здесь используется, термин "низший алкил" обозначает насыщенную, т.е. алифатическую углеводородную группу, включающую линейную или разветвленную углеродную цепочку из 1-7 атомов углерода. Примерами для "алкила" являются метил, этил, н-пропил, и изопропил.
Термин "галоген" обозначает хлор, бром, фтор или йод.
Термин "низший алкил, замещенный галогеном" обозначает алкильную группу, как определено выше, где по меньшей мере один атом водорода замещен на атом галогена.
3H обозначает атом трития.
Термин "уходящая группа" обозначает галоген или сульфонат. Примерами сульфоната являются тозилат, мезилат, трифлат, нозилат или брозилат.
Термин "фармацевтически приемлемая соль" или "фармацевтически приемлемая кислотно-аддитивная соль" охватывает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.д.
Было установлено, что соединения формулы I или II могут применяться для связывания и визуализации агрегатов tau и связанных b-складчатых агрегатов, включая среди прочих агрегаты бета-амилоида или агрегаты альфа-синуклеина.
Одним воплощением настоящего изобретения являются соединения формулы I, где R1 представляет собой низший алкил, например следующие соединения
2-(4-метоксифенил)имидазо[1,2-а]пиридин-7-амин
[3H]-2-(4-метоксифенил)имидазо[1,2-а]пиридин-7-амин.
Одним воплощением настоящего изобретения являются дополнительные соединения формулы I, где R1 представляет собой низший алкил, замещенный галогеном, например следующие соединения
2-(4-(фторметокси)фенил)имидазо[1,2-а]пиридин-7-амин
2-[4-(3-фторпропокси)фенил]имидазо[1,2-а]пиридин-7-амин
2-[4-(2-фторэтокси)фенил]имидазо[1,2-а]пиридин-7-амин
[3H]-2-[4-(2-фторэтокси)фенил]имидазо[1,2-а]пиридин-7-амин.
Одним воплощением настоящего изобретения являются дополнительные соединения формулы I, где R2 и R3 представляют собой тритий, например следующие соединения
[3H]-2-(4-метоксифенил)имидазо[1,2-а]пиридин-7-амин
[3H]-2-[4-(2-фторэтокси)фенил]имидазо[1,2-а]пиридин-7-амин.
Соединения формул I могут применяться для связывания и визуализации агрегатов белка tau, агрегатов бета-амилоида, агрегатов альфа-синуклеина или агрегатов хантингтина. Предпочтительным применением соединений формулы I является применение для связывания и визуализации агрегатов белка tau у пациентов с болезнью Альцгеймера.
Более того, соединения формулы I могут применяться в исследованиях связывания с белком tau.
Соединения формулы I являются подходящими для диагностической визуализации агрегатов белка tau в мозге млекопитающего.
Настоящее изобретение также применяют для диагностической визуализации отложений агрегатов белка tau в головном мозге млекопитающих.
Соединения настоящего изобретения формулы I
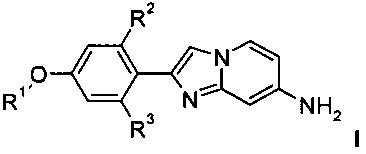
и их фармацевтически приемлемые соли могут быть получены способами, описанными далее, которые содержат
a) аминирование соединения формулы 2 (X=Cl, Br)
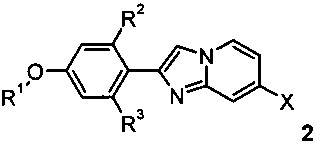
с помощью NH4OH
с получением соединения формулы I
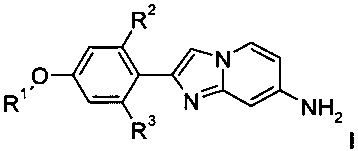
где R1 является таким, как определено выше, a R2 и R3 представляют собой водород, и, если необходимо, превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли, или
b) связывание соединения формулы 4
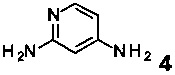
с соответствующим α-активированным кетоном формулы 3 (X представляет собой уходящую группу, например Br)
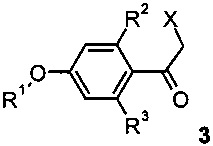
с получением соединения формулы I
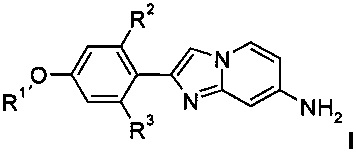
где R1 является таким, как определено выше, a R2 и R3 представляют собой водород, и, если необходимо, превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли, или
c) взаимодействие соединения формулы 5
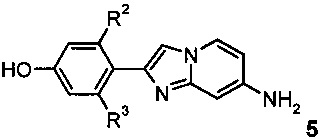
с подходящим алкилирующим реагентом R1-X (X представляет собой галоген или сульфонат)
с получением соединения формулы I
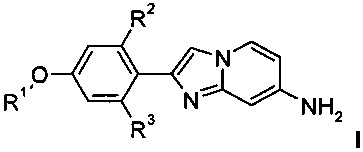
где R1 является таким, как определено выше, a R2 и R3 представляют собой водород, и, если необходимо, превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли, и
d) взаимодействие соединения формулы I
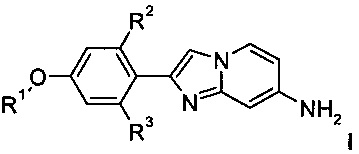
где R2 и R3 представляют собой водород,
с газообразным тритием в присутствии катализатора, например, иридий, рутений, родий или палладий содержащего комплекса, в подходящем растворителе, например дихлорметане, хлоробензоле, ДМФ, ДМСО или их смеси, при комнатной температуре или повышенной температуре
с получением соединения формулы I
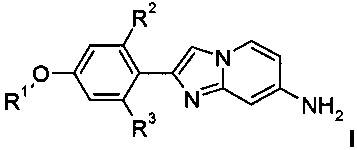
где R1 является таким, как определено выше, a R2 и R3 представляют собой тритий, и, если необходимо, превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли.
Следующие схемы 1-3 описывают способы получения соединений формулы I более детально.
Получение соединений формулы I по настоящему изобретению может проводиться последовательным или конвергентным синтезом. Навыки, необходимые для проведения реакций и очистки полученных продуктов, известны специалистам в данной области. Заместители и индексы, используемые в следующем описании методик, имеют значения, указанные здесь ранее, если не указано иного.
Более конкретно, соединения формулы I могут быть получены способами, приведенными ниже, способами, приведенными в примерах, или аналогичными способами. Подходящие условия реакции для отдельных стадий реакции известны специалисту в данной области. Последовательность реакций не ограничивается той, которая изображена на схемах 1-3, однако, в зависимости от исходных материалов и их реакционной способности, последовательность стадий реакции могут быть свободно изменены. Исходные вещества являются либо коммерчески доступными, либо могут быть получены способами, аналогичными способам, приведенным ниже, способами, описанными в ссылках, приведенных в описании или в примерах, или способами, известными в данной области техники.
Схема 1
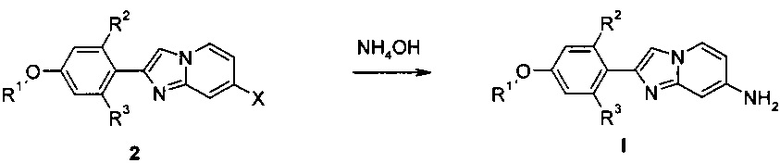
В соответствии со схемой 1, производные имидазопиридина I, где заместитель R1 является таким, как определено выше, a R2 и R3 представляют собой водород, получают с помощью реакции аминирования соединения формулы 2 подходящим аммониевым реагентом, например, гидроксидом аммония, в присутствии подходящего катализатора, например, оксида меди (I), в подходящем растворителе, например, N-метил-2-пирролидинона при повышенной или комнатной температуре.
Схема 2
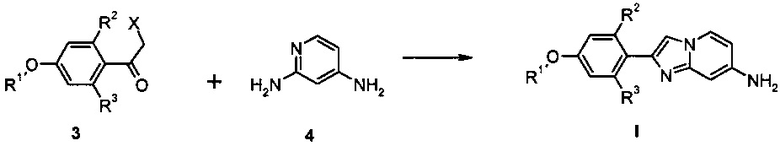
В соответствии со схемой 2, активированный кетон 3, где заместитель R1 является таким, как определено выше, R2 и R3 представляют собой водород и X представляет собой галоген, взаимодействует с аминопиридином 4 в подходящем растворителе, например, ацетоне или этаноле, при повышенной температуре на масляной бане или в микроволновой печи с получением производных соединения I.
Схема 3
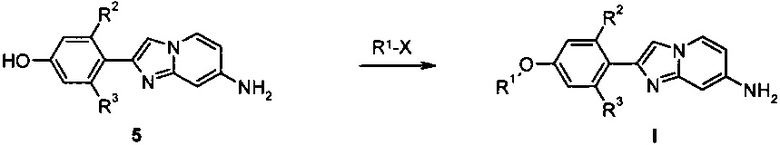
В соответствии со схемой 3, дополнительные производные имидазопиридинов I, где заместитель R1 является таким, как определено выше, синтезируют посредством алкилирования фенолов 5 с использованием подходящего алкилирующего реагента R1-X, например, алкилгалогенида, такого как 1-фторэтилбромид, или алкилтозилата, такого как фторметилтозилат, в присутствии подходящего основания, например карбоната цезия или гидрида натрия, в подходящем растворителе, например ДМФ, при комнатной температуре или повышенной температуре.
Выделение и очистка соединений
Выделение и очистка соединений и промежуточных соединений, описанных здесь, может быть осуществлена, если необходимо, с помощью любым подходящим способом разделения или очистки, таких как, например, фильтрации, экстракции, кристаллизации, колоночной хроматографии, тонкослойной хроматографии, хроматография в толстом слое, препаративная жидкостная хроматография низкого или высокого давления или комбинации этих способов. Конкретные иллюстрации подходящих методик разделения и выделения могут быть найдены по ссылке на способы и примеры, изложенные ниже. Тем не менее, другие эквивалентные процедуры разделения или выделения, конечно, также могут быть использованы.
Соли соединений формулы I
Соединения формулы I являются основными и могут быть превращены в соответствующие кислотно-аддитивные соли. Превращение осуществляют путем обработки по меньшей мере стехиометрическим количеством соответствующей неорганической кислоты, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., или органической кислоты, такой как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п.. Как правило, свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и добавляют кислоту в аналогичном растворителе. Температуру поддерживают в пределах от 0°C до 50°C. Полученная соль выпадает в осадок самопроизвольно или может быть преципитирована с помощью добавления менее полярного растворителя.
Кислотно-аддитивные соли основных соединений формулы I могут быть превращены в соответствующие свободные основания обработкой по меньшей мере стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак, и т.д.
Соединения были исследованы в соответствии с тестом, приведенным далее.
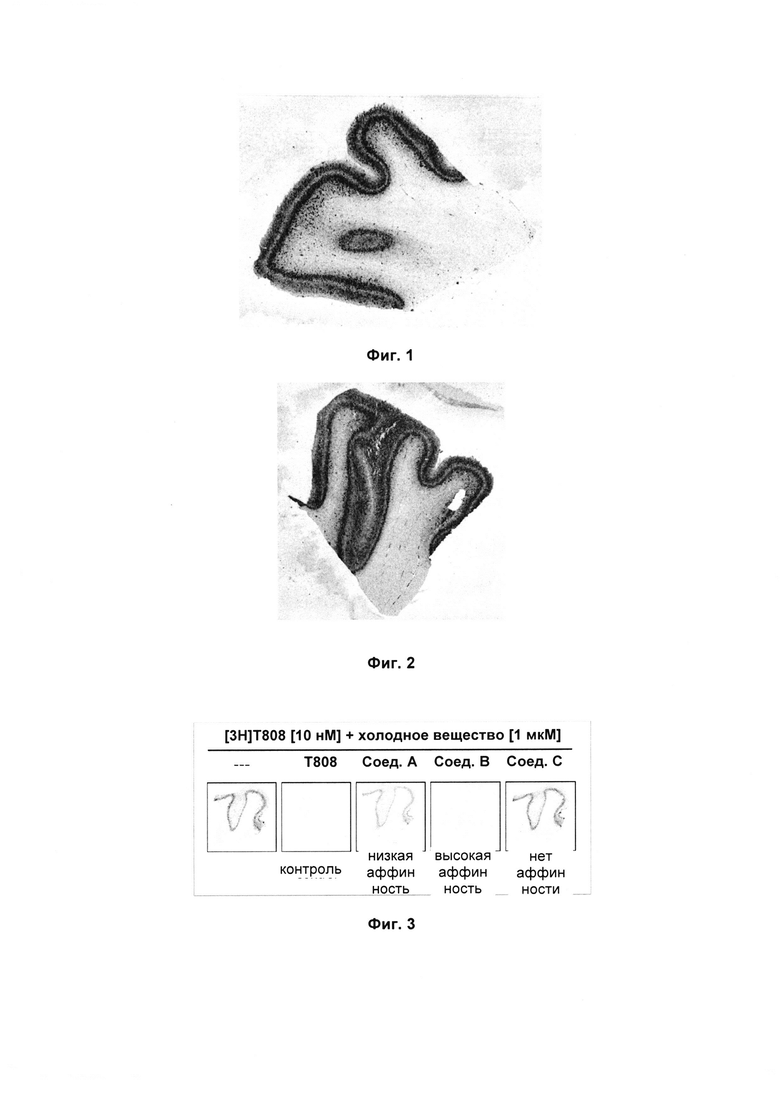
In vitro анализ замещения радиолиганда TAU
Данный анализ связывания in vitro оценивает аффинность соединений по отношению к нативным агрегатам tau. Соединения инкубируются совместно с хорошо исследованным специфическим к tau радиолигандом [3H]Т808, а эффективность замещения соединениями связывания [3H]Т808 определяется с помощью авторадиографии in vitro с использованием секторов мозга человека с болезнью Альцгеймера (БА) (см. Фиг. 3).
Материалы
Срезы мозга человека с БА получали из Института Banner Sun Health Research Institute (Sun City, AZ, USA). Диагноз патологии БА ставился в соответствии со стандартным критерием NIA-Reagan Institute на основе нейропатологических данных. Радиолиганд [3H]Т808 синтезировали самостоятельно ([3H]-2-[4-(2-фтор-этил)-пиперидин-1-ил]-диметил[4,5]имидазо[1,2-а]пиримидин, радиохимическая чистота 99.0%). В качестве референса использовали холодный Т808 (2-[4-(2-фтор-этил)-пиперидин-1-ил]-диметил[4,5]имидазо[1,2-а]пиримидин). Для авторадиографии планшеты для визуализации FujiFilm Imaging Plates (BAS-IP TR 2025) подвергали действию срезов и считывали на ридере FujiFilm IP (BAS-5000).
Способ
Десять срезов человеческого мозга с БА микрометровой толщины получали на криостате (Leica СМ3050) при -17°C в камере и -15°C температуре объекта. Срезы переносили на предметные стекла Histobond+ (Marienfeld Laboratory Glasware). После сушки в течение 3 часов при комнатной температуре срезы хранили при -20°C. Срезы инкубировались с радиолигандом (10 нМ) и соответствующим холодным соединением (с различными концентрациями) в 50 мМ Трис буфере, pH 7.4 при комнатной температуре в течение 30 мин. После промывки 3х 10 мин при 4°C в 50 мМ Трис буфере, pH 7.4 и 3 быстрых погружений в дистиллированную воду при 4°C срезы высушивали при 4°C в течение 3 ч. Срезы поместили в FujiFilm Cassette (BAS 2025), подвергали воздействию планшеты для визуализации в течение пяти дней и после этого сканировали с разрешением 25 мкМ на пиксель.
Анализ данных
Интенсивность сигнала (Плотность - фотостимулированная люминесценция/мм2) в интересующем участке (ROI) авторадиограммы подсчитывалась с помощью программного анализа MCID (версия 7.0, Imaging Research Inc.). Специфичность связывания (SB) соединения [3H]Т808 связывания в отсутствии или в присутствии соединения подсчитывалась посредством вычитания сигнала неспецифического связывания в неокрашенном веществе, таким образом давая SB[3H]T808 только и SBсоединения. % замещения различными соединениями подсчитывался следующим образом:
% замещения=100-(SBсоединения/SB[3H]Т808 только)*100.
Валидация данных
В каждом эксперименте использовали холодный Т808 в качестве положительного внутреннего контроля. Совместная инкубация эквимолярных количеств горячего и холодного Т808 как ожидается снижает специфическое связывание на приблизительно 50%.
Ссылки
A.K. Szardenings et al. 'Imaging agents for detecting neurological disorders'. US Patent Application US 20110182812
W. Zhang et al., 'A highly selective and specific PET tracer for imaging of tau pathologies'. Journal of Alzheimer's Disease 31 (2012) 601-612.

На Фиг. 1 и 2 представлены авторадиограммы соответственно [[3H]-2-(4-метоксифенил)имидазо[1,2-а]пиридин-7-амина (Пример 5) и [3H]-2-[4-(2-фторэтокси)фенил]имидазо[1,2-а]пиридин-7-амина (Пример 6), инкубированных со срезом коры мозга человека, полученного от пациента с болезнью Альцгеймера на V стадии по Брааку. Концентрация радиолигандов составляла 2.6 и 2.5 нМ, соответственно. Оба радиолиганда показали точечную окраску агрегатов tau в паттернах послойного распределения и различную степень неспецифического связывания в белом веществе мозга.
Соединения формулы I и их фармацевтически приемлемые соли могут быть использованы в виде фармацевтических препаратов. Фармацевтические препараты могут вводиться в виде инъекционных растворов.
Соединения формулы I и их фармацевтически приемлемые соли могут быть обработаны с фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических препаратов. Подходящими носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.д. Адъюванты, такие как спирты, полиолы, глицерин, растительные масла и т.д., могут быть использованы для водных инъекционных растворов водорастворимых солей соединений формулы I, но, как правило, не являются необходимыми. Подходящими носителями для суппозиториев являются, например, природные или гидрогенизированные масла, воски, жиры, полутвердые или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать и другие терапевтически ценные вещества.
Дозировка может варьироваться в широких пределах и будет, конечно, адаптирована к индивидуальным требованиям в каждом конкретном случае.
Примеры
Используемые аббревиатуры:
ч - час(-ы)
мин - минута(-ы)
Пример 1
2-(4-метоксифенил)имидазо[1,2-а]пиридин-7-амин
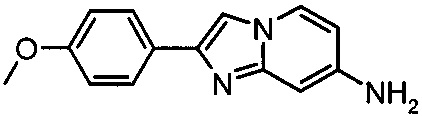
Пробирку для микроволновой печи заполнили пиридин-2,4-диамином (400 мг, 3.67 ммоль), 2-бромо-1-(4-метоксифенил)этаноном (882 мг, 3.85 ммоль), бикарбонатом натрия (329 мг, 3.92 ммоль) и метанолом (3.5 мл). Реакционную смесь перемешивали при кипении с обратным холодильником в течение 4 ч. Реакционную смесь охладили до комнатной температуры, разбавили водой и этилацетатом, подвергли ультразвуковому воздействию и перемешивали при комнатной температуре в течение ~15 мин. Суспензию отфильтровали, промыли водой и этилацетатом. Получившийся бледно-желтый осадок поместили в глубокий вакуум с получением 2-(4-метоксифенил)имидазо[1,2-а]пиридин-7-амина гидробромида. Его суспендировали в ~5 мл насыщенного водного раствора NaHCO3, подвергли ультразвуковому воздействию, отфильтровали и промыли водой. Остаток суспендировали в ~5 мл водного 2М раствора NaOH, подвергли ультразвуковому воздействию, отфильтровали и промыли водой. Получившийся остаток поместили в глубокий вакуум с получением соединения, указанного в заголовке, в виде светло-коричневого осадка (310 мг, 1.3 ммоль, 35% выход). MS m/z: 240.1 [М+Н]+.
Пример 2
2-(4-(Фторметокси)фенил)имидазо[1,2-а]пиридин-7-амин
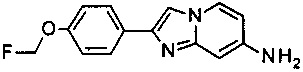
а) 7-бромо-2-(4-(гидроксифенил)имидазо[1,2-а]пиридин
По аналогии с примером 1, 4-бромпиидин-2-амин вместо пиридин-2,4-диамина и 2-бромо-1-(4-гидроксифенил)этанон вместо бром-1-(4-метоксифенил)этанона конвертировали в соединение, указанное в заголовке (2.34 г, 80%), которое получили в виде серого осадка. MS m/z: 289.3 [М]+.
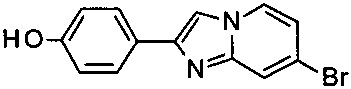
b) 7-бромо-2-(4-(фторметокси)фенил)имидазо[1,2-а]пиридин
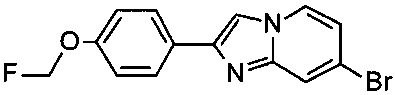
К раствору 4-(7-бромимидазо[1,2-а]пиридин-2-ил)фенола (2.37 г, 6.56 ммоль) и фторметил-4-метилбензолсульфоната (1.34 г, 6.56 ммоль) в ДМФ (10.00 мл) добавили карбонат цезия (2.78 г, 8.52 ммоль) и нагревали до 70°C в течение 18 ч и затем облучали в течение 30 минут при 100°C в микроволновой печи. Его влили в воду и экстрагировали два раза дихлорметаном. Органические слои объединили, высушили над сульфатом натрия, отфильтровали и сконцентрировали. К получившемуся маслу добавили толуол (~200 мл) и растворитель эвапорировали для удаления оставшегося ДМФ. Добавили некоторое количество 1 н NaOHводн и перемешивание продолжили в течение 15 минут. Его отфильтровали и высушили в глубоком вакууме с получением соединения, указанного в заголовке (1.69 г, чистота ~60%), в виде светло-коричневого масла, которое использовали без дополнительной очистки. MS m/z: 321.3 [М+Н]+.
c) 2-(4-(Фторметокси)фенил)имидазо[1,2-а]пиридин-7-амин
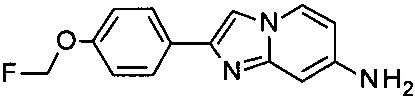
К раствору 7-бромо-2-(4-(фторметокси)фенил)имидазо[1,2-а]пиридина (112 мг, 349 мкмоль) в N-метил-2-пирролидиноне (2 мл) добавили оксид меди (I) (9.98 мг, 69.8 мкмоль) и гидроксид аммония (733 мг, 5.23 ммоль). Затем пробирку закрыли и реакционную смесь перемешивали при 110°C в течение 3 ч. Ее разбавили дихлорметаном (15 мл) и промыли дважды водой (15 мл). Водные слои экстрагировали дихлорметаном (15 мл). Объединенные органические слои высушили над сульфатом магния, отфильтровали и сконцентрировали. Флеш-хроматография с использованием градиента дихлорметан : дихлорметан : метанол : аммоний (90:9:1 об. %) 85:15 до 50:50 дала соединение, указанное в заголовке (17 мг, 19% выход), в виде светло-коричневого осадка. MS m/z: 258.6 [М+Н]+.
Пример 3
2-[4-(3-Fluoropropoxy)фенил]имидазо[1,2-а]пиридин-7-амин
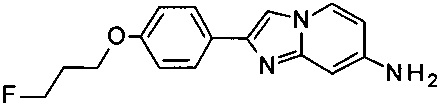
а) 4-(7-Аминоимидазо[1,2-а]пиридин-2-ил)фенола гидробромид
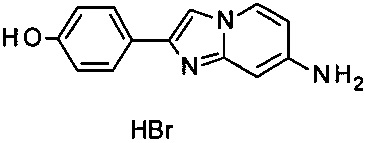
В 5 мл пробирке для микроволновой печи пиридин-2,4-диамин (500 мг, 4.58 ммоль) и 2-бромо-1-(4-гидроксифенил)этанон (1.03 г, 4.81 ммоль) объединили с ацетоном (8.0 мл) с получением серо-белой суспензии. Пробирку продули аргоном и закрыли. Реакционную смесь перемешивали при 65°C (температура масляной бани) в течение ночи. Серо-белую суспензию отфильтровали и промыли ацетоном. Получившийся серо-белый осадок высушили в глубоком вакууме в течение ночи с получением соединения, указанного в заголовке (363 мг, 18% выход), в виде серо-белого осадка. MS m/z: 226.1 [М+Н]+.
b) 2-[4-(3-фторпропокси)фенил]имидазо[1,2-а]пиридин-7-амин
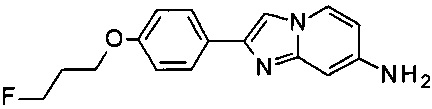
В 5 мл пробирке для микроволновой печи 4-(7-аминоимидазо[1,2-а]пиридин-2-ил)фенола гидробромид (150 мг, 343 мкмоль) объединили с ДМФ (2.5 мл) с получением бесцветного раствора. Добавили карбонат цезия (335 мг, 1.03 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч (наблюдалось выделение газа; реакционная смесь превратилась в темно-коричневую суспензию). Добавили 1-бромо-3-фторпропан (48.4 мг, 343 мкмоль), растворенный в ДМФ (0.5 мл). Пробирку продули аргоном и закрыли. Реакционную смесь перемешивали при 90°C (температура масляной бани) в течение ночи. Реакционную смесь охладили до комнатной температуры и экстрагировали дихлорметаном и водой. Водный слой (pH ~9) экстрагировали дихлорметаном. Органические слои промыли три раза водой и один раз солевым раствором. Органические слои объединили, высушили над сульфатом магния, отфильтровали и сконцентрировали. Остаток (коричневое масло) высушили в глубоком вакууме в течение 4 ч. Коричневый осадок тритурировали с этилацетатом с получением соединения, указанного в заголовке (53 мг, 48% выход), в виде коричневого осадка. MS m/z: 286.1 [М+Н]+.
Пример 4
2-[4-(2-Фторэтокси)фенил]имидазо[1,2-а]пиридин-7-амин
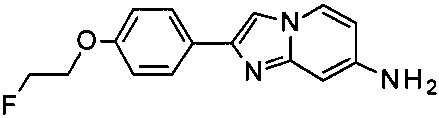
К раствору 4-(7-аминоимидазо[1,2-а]пиридин-2-ил)фенола гидробромида (156 мг, 510 мкмоль) в ДМФ (2 мл) добавили в атмосфере азота при 0°C гидрид натрия 60% (81.5 мг, 2.04 ммоль). После перемешивания при комнатной температуре в течение 30 мин добавили 1-бромо-2-фторэтан (71.2 мг, 560 мкмоль) в течение 1 мин. Затем реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Ее влили в воду (15 мл) и экстрагировали дважды этилацетатом (15 мл). Органические слои промыли водой (15 мл) и солевым раствором (10 мл). Объединенные органические слои высушили над сульфатом магния, отфильтровали и сконцентрировали. Флеш-хроматография с использованием градиента дихлорметан : дихлорметан : метанол : аммоний (90:9:1 об. %) 80:20 до 40:60 дала соединение, указанное в заголовке (80 мг, 58% выход), в виде серо-белого осадка. MS m/z: 272.5 [М+Н]+.
Пример 5
[3H]-2-(4-метоксифенил)имидазо[1,2-а]пиридин-7-амин
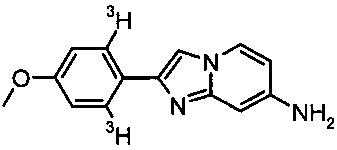
В 2 мл колбе для тритирования, 2-(4-метоксифенил)имидазо[1,2-а]пиридин-7-амин (2.0 мг, 8.4 мкмоль) и катализатор Крэбтри (10.1 мг, 15.5 мкмоль) растворили в дихлорметане (1.0 мл). Колбу присоединили к трубопроводу для трития (RC-TRITEC) и дегазировали с помощью заморозки-прокачки-оттаивания. Ввели газообразный тритий и светло-оранжевый раствор энергично перемешивали в течение 4 часов в атмосфере трития при давлении 1050 мбар. Раствор охладили с помощью жидкого азота и избыток тритиевого газа в реакционном сосуде снова абсорбировали на урановой ловушке для неиспользованного трития. Растворитель удалили лиофилизированием и нестабильный тритий удалили лиофилизацией со смесью 9:1 этанола и воды (3×1 мл) и толуола (2×1 мл). Оставшееся коричневатое масло растворили в дихлорметане (25 мл) и поместили на катионный обменник SCX-3. Оставшийся катализатор элюировали дихлорметаном (15 мл) и отбросили, продукт элюировали с помощью NH3 в MeOH (1 н, 25 мл), собрали отдельно, и сконцентрировали при пониженном давлении. Неочищенный продукт очистили с помощью препаративной ВЭЖХ (XBridge С-18 Prep, 5 мкм, 10×250 мм) с использованием ацетонитрила, воды и буфера pH 7 в качестве элюента. Получили 833 МБк (22.5 мКи) соединения, указанного в заголовке, с радиохимической чистотой 99% и специфической активностью 1.02 ТБк/ммоль (27.6 Ки/ммоль) по данным МС спектроскопии. Соединение хранили в виде этанолового раствора. MS m/z: 240.2 [М+Н]+ (48%), 242.2 [М(Т)+Н]+ (10%), 244.2 [М(Т2)+Н]+ (40%), 246.2 [М(Т3)+Н]+ (2%).
Пример 6
[3H]-2-[4-(2-Фторэтокси)фенил]имидазо[1,2-а]пиридин-7-амин
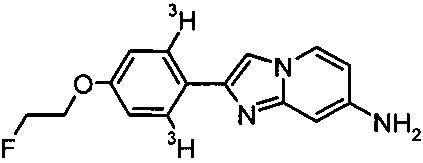
В 2 мл колбе для тритирования, 2-[4-(2-фторэтокси)фенил]имидазо[1,2-а]пиридин-7-амин (2.0 мг, 7.4 мкмоль) и катализатор Крэбтри (5.9 мг, 7.4 мкмоль) растворили в ДМФ (1.0 мл). Колбу присоединили к трубопроводу для трития (RC-TRITEC) и дегазировали с помощью заморозки-прокачки-оттаивания. Ввели газообразный тритий и светло-оранжевый раствор энергично перемешивали в течение 4 часов в атмосфере трития при давлении 550 мбар. Раствор охладили с помощью жидкого азота и избыток тритиевого газа в реакционном сосуде снова абсорбировали на урановой ловушке для неиспользованного трития. Растворитель удалили лиофилизированием и нестабильный тритий удалили лиофилизацией со смесью 9:1 этанола и воды (3×1 мл) и толуола (2×1 мл). Оставшееся коричневатое масло растворили в дихлорметане (10 мл) и поместили на катионный обменник SCX-3. Оставшийся катализатор элюировали MeOH (5 мл) и отбросили, продукт элюировали с помощью NH3 в MeOH (3.5 н, 5 мл) и MeOH (35 мл), собрали отдельно, и сконцентрировали при пониженном давлении. Неочищенный продукт очистили с помощью препаративной ВЭЖХ (XBridge С-18 Prep, 5 мкм, 10×250 мм) с использованием ацетонитрила, воды и буфера pH 7 в качестве элюента. Получили 833 МБк (22.5 мКи) соединения, указанного в заголовке, с радиохимической чистотой 98% и специфической активностью 1.58 ТБк/ммоль (42.6 Ки/ммоль) по данным МС спектроскопии. Соединение хранили в виде метанолового раствора. MS m/z: 272.2 [М+Н]+ (7%), 274.2 [М(Т)+Н]+ (39%), 276.2 [М(Т2)+Н]+ (54%).
| название | год | авторы | номер документа |
|---|---|---|---|
| 2-ФЕНИЛИМИДАЗО[1,2-А]ПИРИМИДИНЫ В КАЧЕСТВЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ | 2014 |
|
RU2665580C2 |
| ФТОРСОДЕРЖАЩИЕ ЛИГАНДЫ ДЛЯ НАЦЕЛИВАНИЯ ПЕРИФЕРИЧЕСКИХ БЕНЗОДИАЗЕПИНОВЫХ РЕЦЕПТОРОВ | 2007 |
|
RU2468014C2 |
| ПРОИЗВОДНЫЕ N-(ИМИДАЗОПИРИМИДИН-7-ИЛ)-ГЕТЕРОАРИЛАМИДОВ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE10A | 2011 |
|
RU2562066C2 |
| ЗОНДЫ ВИЗУАЛИЗАЦИИ БЕЛКА ГЕНТИНГТИНА | 2016 |
|
RU2721419C2 |
| [1,3]ОКСАЗИНЫ | 2012 |
|
RU2599256C2 |
| 4-ЗАМЕЩЕННЫЕ-2-ФЕНОКСИФЕНИЛАМИНОВЫЕ МОДУЛЯТОРЫ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2553453C2 |
| ПРОИЗВОДНЫЕ 2-БЕНЗОИЛ-ИМИДАЗО[1,2-a]ПИРИДИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2008 |
|
RU2442785C1 |
| ФЕНОКСИЗАМЕЩЕННЫЕ ПИРИМИДИНЫ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2554870C2 |
| ПИРАЗИНЫ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2543484C2 |
| СОЕДИНЕНИЯ ДЛЯ ИНГИБИРОВАНИЯ КИНАЗЫ EGFR, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2020 |
|
RU2832925C2 |
Изобретение относится к области органической химии, а именно к гетероциклическому соединению формулы I или к его фармацевтически приемлемой кислотно-аддитивной соли, где R1 представляет собой низший алкил или низший алкил, замещенный галогеном; R2, R3 представляет собой водород или тритий. Изобретение также относится к конкретным соединениям, фармацевтической композиции на основе соединения формулы I и его применению, а также к способу визуализации отложений агрегатов белка tau, основанному на использовании соединения формулы I. Технический результат: получены новые гетероциклические соединения, которые могут применяться для связывания и визуализации агрегатов белка tau и ассоциированных бета-складчатых агрегатов, включая среди прочих агрегаты бета-амилоида или агрегаты альфа-синуклеина. 5 н. и 7 з.п. ф-лы, 3 ил., 1 табл., 6 пр.
1. Соединение формулы
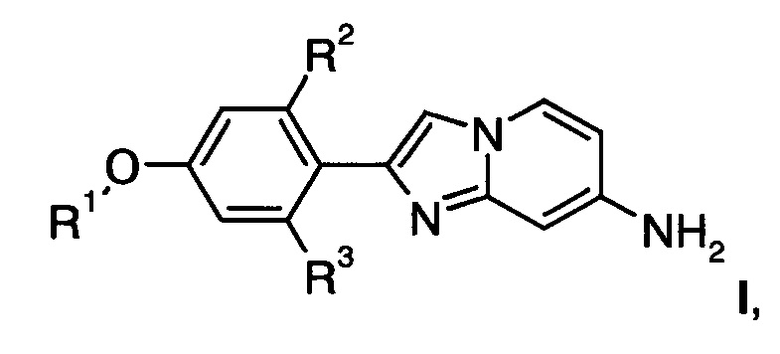
где
R1 представляет собой низший алкил или низший алкил, замещенный галогеном;
R2, R3 представляет собой водород или тритий;
или его фармацевтически приемлемая кислотно-аддитивная соль.
2. Соединение формулы I по п. 1, где R1 представляет собой низший алкил, a R2 и R3 являются такими, как определено в п. 1.
3. Соединение формулы I по п. 1, где R1 представляет собой низший алкил, замещенный галогеном, a R2 и R3 являются такими, как определено в п. 1.
4. Соединение формулы I по п. 1, где R2 и R3 представляют собой тритий, а R1 является таким, как определено в п. 1.
5. Соединение, выбранное из:
2-(4-метоксифенил)имидазо[1,2-а]пиридин-7-амин
[3Н]-2-(4-метоксифенил)имидазо[1,2-а]пиридин-7-амин
2-(4-(фторметокси)фенил)имидазо[1,2-а]пиридин-7-амин
2-[4-(3-фторпропокси)фенил]имидазо[1,2-а]пиридин-7-амин
2-[4-(2-фторэтокси)фенил]имидазо[1,2-а]пиридин-7-амин
[3Н]-2-[4-(2-фторэтокси)фенил]имидазо[1,2-а]пиридин-7-амин.
6. Соединение по любому из пп. 1-5 для применения для связывания и визуализации агрегатов белка tau, агрегатов бета-амилоида или агрегатов альфа-синуклеина.
7. Соединение по любому из пп. 1-5 для применения для связывания и визуализации агрегатов белка tau у пациентов с болезнью Альцгеймера.
8. Соединение по любому из пп. 1-5 для применения в исследованиях, включающих связывание белка tau.
9. Соединение по любому из пп. 1-5 для применения в диагностической визуализации агрегатов белка tau в мозге млекопитающих.
10. Фармацевтическая композиция, обладающая активностью связывания белка tau, содержащая соединение по любому из пп. 1-5 в эффективном количестве и фармацевтически приемлемый носитель.
11. Способ визуализации отложений агрегатов белка tau, содержащий
- введение млекопитающему детектируемого количества композиции по п. 10;
- выдержку в течение времени, достаточного для связывания соединения формулы I с отложениями агрегатов белка tau, и
- детекцию соединения, связанного с одним или более отложениями агрегатов белка tau.
12. Применение соединения по любому из пп. 1-5 для диагностической визуализации отложений агрегатов белка tau в мозге млекопитающих.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| ИМИДАЗОПИРИМИДИНЫ И ИМИДАЗОПИРИДИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ НАРУШЕНИЙ | 1998 |
|
RU2201929C2 |
Авторы
Даты
2018-11-01—Публикация
2014-09-23—Подача