2420-168568RU/019
ПРОИЗВОДНЫЕ 2-БЕНЗОИЛ-ИМИДАЗО[1,2-a]ПИРИДИНА,
ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ
ОПИСАНИЕ
Настоящее изобретение относится к производным 2-бензоил-имидазо[1,2-a]пиридина, их получению и их применению в терапии для лечения или профилактики заболеваний, в которых участвуют ядерные рецепторы Nurr-1, называемые также NR4A2, NOT, TINUR, RNR-1 и HZF3.
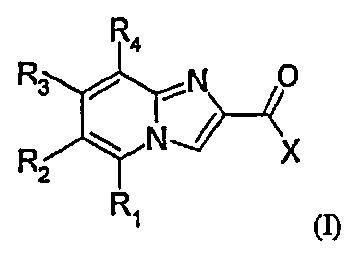
Объектом настоящего изобретения являются соединения формулы (I):
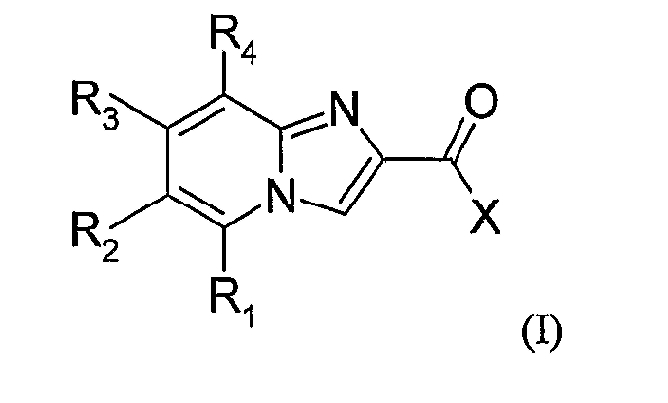
в которой:
X означает фенильную группу, возможно замещенную одним или несколькими атомами или группами, выбранными независимо друг от друга из следующих атомов или групп: галоген, (C1-C6)алкил, (C1-C6)алкокси, гидрокси, амино, NRaRb; причем (C1-C6)алкильная и (C1-C6)алкоксигруппа возможно замещены одним или несколькими атомами галогена;
R2 означает гетероциклическую группу, возможно замещенную одной или несколькими группами, выбранными независимо друг от друга из следующих атомов или групп: гидрокси, галоген, (C1-C6)алкокси, (C1-C6)алкил, возможно замещенный одним или несколькими гидрокси, NRcRd, -CO-R5, -CO-NR6R7, -CO-O-R8, -NR9-CO-R10, циано, группой оксидо;
R1 означает атом водорода, галоген, (C1-C6)алкоксигруппу, (C1-C6)алкильную группу, гидрокси, амино; причем (C1-C6)алкильная и (C1-C6)алкоксигруппа при необходимости могут быть замещены одним или несколькими атомами или группами галоген, гидрокси, амино, (C1-C6)алкокси;
R3 означает атом водорода, атом галогена, (C1-C6)алкильную группу или гидроксигруппу;
R4 означает атом водорода или атом галогена;
R5 означает атом водорода или (C1-C6)алкильную группу;
R6 и R7, одинаковые или разные, означают атом водорода или (C1-C6)алкильную группу или вместе с атомом азота, с которым они связаны, образуют 4-7-звенный цикл, возможно включающий другой гетероатом, выбранный из N, O или S;
R8 означает (C1-C6)алкильную группу;
R9 и R10, одинаковые или разные, означают атом водорода или (C1-C6)алкильную группу;
Ra означает (C1-C6)алкил;
Rb, Rc и Rd означают водород или (C1-C6)алкил;
в форме основания или кислотно-аддитивной соли.
Соединения формулы (I) могут содержать один или несколько асимметрических атомов углерода. Таким образом, они могут существовать в виде энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, в том числе рацемические смеси, составляют часть изобретения.
Соединения формулы (I) могут существовать в состоянии оснований или кислотно-аддитивных солей. Такие аддитивные соли составляют часть изобретения.
Эти соли могут быть получены с фармацевтически приемлемыми кислотами, но соли других кислот, подходящих, например, для очистки или для выделения соединений формулы (I), также являются частью изобретения.
Соединения формулы (I) могут существовать также в виде гидратов или сольватов, а именно, в виде ассоциаций или комбинаций с одной или несколькими молекулами воды или растворителя. Такие гидраты и сольваты также составляют часть изобретения.
В рамках настоящего изобретения:
- под атомом галогена понимают фтор, хлор, бром или йод;
- под алкильной группой понимают насыщенную алифатическую группу, линейную, разветвленную или циклическую, возможно замещенную линейной, разветвленной или циклической насыщенной алкильной группой. В качестве примеров можно назвать метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную, циклопропильную, циклобутильную, циклопентильную, циклогексильную, метилциклопропильную группу и т.д.;
- под (C1-C6)алкоксигруппой понимают -O-алкильный радикал, где алкильная группа такова, как определено ранее;
- под гетероциклической группой понимают моно- или бициклическую группу, насыщенную, ненасыщенную или частично ненасыщенную, содержащую от 5 до 10 атомов, из которых 1-4 гетероатома выбраны из N, O и S. В качестве примеров гетероциклических групп можно назвать, без ограничений: пиррол, фуран, тиофен, пиразол, имидазол, триазол, тетразол, оксазол, изоксазол, оксадиазол, тиазол, изотиазол, тиадиазол, пиридин, пиримидин, пиразин, пиридазин, триазин, фурофуран, тиенотиофен, пирролопиррол, пирролоимидазол, пирролопиразол, пирролотриазол, имидазоимидазол, имидазопиразол, фуропиррол, фуроимидазол, фуропиразол, фуротриазол, пирролооксазол, имидазооксазол, пиразолооксазол, фурооксазол, оксазолооксазол, оксазолоизоксазол, пирролоизоксазол, имидазоизоксазол, пиразолоизоксазол, изоксазоло-изоксазол, фуроизоксазол, изоксазолооксадиазол, пирроло-оксадиазол, фурооксадиазол, изоксазолооксадиазол, тиенопиррол, тиеноимидазол, тиенопиразол, тиенотриазол, пирролотиазол, имидазо-тиазол, пиразолотиазол, триазолотиазол, фуротиазол, оксазоло-тиазол, оксазолоизотиазол, пирролоизотиазол, имидазоизотиазол, пиразолоизотиазол, изоксазолоизотиазол, фуроизотиазол, пирроло-тиадиазол, имидазотиадиазол, фуротиадиазол, изоксазолотиадиазол, оксазолотиадиазол, изотиазолотиадиазол, индол, изоиндол, бензимидазол, индазол, индолизин, бензофуран, изобензофуран, бензотиофен, бензо[c]тиофен, пирролопиридин, имидазопиридин, пиразолопиридин, триазолопиридин, тетразолопиридин, пирролопиримидин, имидазопиримидин, пиразолопиримидин, пирролопиразин, имидазопиразин, пиразолопиразин, пирролопиридазин, имидазопиридазин, пиразолопиридазин, триазолопиридазин, пирролотриазин, фуропиридин, фуропиримидин, фуропиразин, фуропиридазин, фуротриазин, оксазолопиридин, оксазолопиримидин, оксазолопиразин, оксазолопиридазин, изоксазолопиридин, изоксазолопиримидин, изоксазолопиразин, изоксазолопиридазин, оксодиазолопиридин, бензоксазол, бензизоксазол, бензоксадиазол, тиенопиридин, тиенопиримидин, тиенопиразин, тиенопиридазин, тиенотриазин, тиазолопиридин, тиазолопиримидин, тиазолопиразин, тиазолопиридазин, изотиазолопиридин, изотиазолопиримидин, изотиазолопиразин, изотиазолопиридазин, тиадиазолопиридин, тиадиазолопиримидин, бензотиазол, бензоизотиазол, бензотиадиазол, хинолин, изохинолин, циннолин, фталазин, хиноксалин, хиназолин, нафтиридин, бензотриазин, пиридопиримидин, пиридопиразин, пиридопиридазин, пиридотриазин, пиримидопиримидин, пиримидопиразин, пиримидопиридазин, пиразинопиразин, пиразинопиридазин, пиразинотриазин, пиридазинопиридазин; причем эти группы могут быть насыщенными или частично ненасыщенными; за исключением моноциклических 4-7-звенных гетероциклов, содержащих один атом азота, возможно содержащих другой гетероатом, выбранный из N, S, O и связанный с азотом.
Из соединений формулы (I), являющихся объектами изобретения, первую группу соединений образуют соединения, в которых:
X означает фенильную группу;
R1, R3 и R4 означают атомы водорода;
R2 означает ненасыщенную моноциклическую гетероциклическую группу, содержащую 5 или 6 атомов, в том числе 1-2 гетероатома, выбранных из N или O, причем указанная гетероциклическая группа при необходимости замещена группой -NRcRd, где Rc и Rd означают водород или (C1-C6)алкил.
Из соединений формулы (I), являющихся объектами изобретения, вторую группу соединений образуют соединения, в которых:
X означает фенильную группу;
R1, R3 и R4 представляют собой атомы водорода;
R2 означает пиридин, пиррол, пиразол, имидазол или фуран, возможно замещенную группой NH2,
в форме основания или кислотно-аддитивной соли.
Из соединений формулы (I), являющихся объектами изобретения, третью группу соединений образуют соединения, в которых R2 означает моно- или бициклическую, насыщенную, ненасыщенную или частично ненасыщенную гетероциклическую группу, содержащую от 5 до 10 атомов, в том числе 1-4 гетероатома, выбранные из N, O и S, за исключением моноциклических 4-7-звенных гетероциклов, содержащих один атом азота, возможно содержащих другой гетероатом, выбранный из N, S, O и связанный с азотом.
Из соединений формулы (I), являющихся объектами изобретения, четвертую группу соединений образуют соединения, в которых R2 означает моноциклическую гетероциклическую группу, насыщенную, ненасыщенную или частично ненасыщенную, содержащую от 5 до 7 атомов, в том числе 1-3, в частности 1-2 гетероатома, выбранные из O, N, S, в частности N или O.
Из соединений формулы (I), являющихся объектами изобретения, пятую группу соединений образуют соединения, в которых R2 означает группу пиррол, фуран, тиофен, пиразол, имидазол, триазол, тетразол, оксазол, изоксазол, оксадиазол, тиазол, изотиазол, тиадиазол, пиридин, пиримидин, пиразин, пиридазин, триазин, в частности группу пиридин, пиррол, пиразол, имидазол, фуран.
Из соединений формулы (I), являющихся объектами изобретения, можно назвать, в частности, следующие соединения:
• [6-(6-аминопиридин-2-ил)имидазо[1,2-a]пиридин-2-ил](фенил)метанон,
• фенил(6-пиридин-2-илимидазо[1,2-a]пиридин-2-ил)метанон и его дигидрохлорид,
• фенил[6-(1H-пиррол-3-ил)имидазо[1,2-a]пиридин-2-ил]метанон,
• фенил[6-(1H-пиразол-4-ил)имидазо[1,2-ил]пиридин-2-ил]метанон,
• [6-(1H-имидазол-4-ил)имидазо[1,2-c]пиридин-2-ил](фенил)метанон,
• [(6-фуран-2-ил)имидазо[1,2-a]пиридин-2-ил](фенил)метанон,
• фенил[(6-пиридин-3-ил)имидазо[1,2-a]пиридин-2-ил]метанон,
или соль присоединения этих соединений с фармацевтически приемлемой кислотой.
Согласно изобретению соединения общей формулы (I) можно получить по способу, описанному в схеме 1.

Схема 1
Первый способ синтеза (превращение A2) состоит в конденсации 2-аминопиридина формулы (II), в которой R1, R2, R3 и R4 такие, как определено ранее, с производным 3-галогено-1-арилпропан-1,2-диона общей формулы (III), в которой Hal означает атом хлора, брома или йода, и X такой, как определено ранее, чтобы получить имидазо[1,2-a]пиридиновый цикл, например, по методу, описанному J-J. Bourguignon и сотр. в Aust. J. Chem., 50, 719 (1997).
Второй способ синтеза (превращение B3 или B4) состоит в проведении реакции металлоорганического производного общей формулы (IV), в которой X такой, как определено ранее, и M означает атом лития или группу Mg-Hal, с:
- амидом Вайнреба (или N-алкокси-N-алкиламидом) общей формулы (V), в которой R1, R2, R3 и R4 такие как определено ранее, и отличны от брома или йода, и R и R', одинаковые или разные, означают алкильную группу, по известным специалисту способам, таким, как описанные Weinreb, S.M. и др. в Tetrahedron Letters (1981), 22(39), 3815-18, и Sibi, M.P. в Organic Préparations and Procédures Int. 1993, 25, 15-40 (превращение B3), или
- с имидазо[1,2-a]пиридине-2-карбоновой кислотой общей формулы (VI), в которой R1, R2, R3 и R4 такие, как определено ранее и отличны от брома или йода, и Y означает гидрокси, или с одной из ее реакционноспособных солей или производных, таких как сложный эфир, галогенид кислоты, ангидрид или амид, по способам, известным специалисту как описанные в J. March, Advanced Organic Chemistry (Wiley, 5th Ed. 2001) p 567, 1213, или в приведенных ссылках (превращение B4).
Альтернативно, превращение B4 можно реализовать, приводя в реакцию реакционноспособное производное, такое как смешанный ангидрид (который может быть образован in situ) имидазо[1,2-a]пиридин-2-карбоновой кислоты формулы (VI), в которой Y означает гидрокси, и R1, R2, R3 и R4 такие, как определено ранее, и отличаются от брома или йода, с металлоорганическим производным формулы (IV), в которой X такое, как определено выше, и M означает группу борной кислоты, в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий.
Третий способ синтеза (превращение C2) состоит в проведении каталитического связывания производного общей формулы (VII), в которой R1, R3 и R4 такие, как определено ранее, и Z означает борильную, станнильную или силильную группу, с производным R2-Z' формулы (VIII), в которой Z' означает атом галогена, такой как бром или йод, или сульфонилоксигруппу, и R2 представляет собой 1-алкенильную, 1-алкинильную, арильную или гетероарильную группу, возможно замещенную. Альтернативно, связывание может быть проведено между производным общей формулы (VII), в которой R1, R3 и R4 такие, как определено ранее, и Z означает атом галогена, как бром или йод, и производным R2-Z' (VIII), в котором Z' означает реакционноспособную группу, такую как борильная, станнильная или силильная группа, или атом водорода, и R2 представляет собой 1-алкенильную, 1-алкинильную, арильную или гетероарильную группу, возможно замещенную.
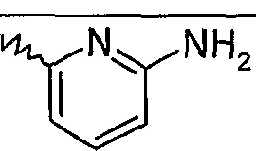
2-Аминопиридины формулы (II) могут быть получены в соответствии со способами, описанными в литературе и известными специалисту. В частности, 2-аминопиридины формулы (II), в которой R1, R3 и R4 такие, как определено ранее, и R2 является 1-алкенильной, 1-алкинильной, арильной или гетероарильной группой, возможно замещенной, могут быть получены превращением A1, то есть по реакции каталитического связывания:
- либо производного 2-аминопиридина формулы (IX), в которой R1, R3 и R4 такие, как определено ранее, и Z означает борильную, станнильную или силильную группу, с производным R2-Z' (VIÏÏ), где Z' означает атом галогена, такой как бром или йод, или сульфонилоксигруппу, и R2 представляет собой 1-алкенильную, 1-алкинильную, арильную или гетероарильную группу, возможно замещенную,
- либо производного 2-аминопиридина формулы (IX), в которой R1, R3 и R4 такие, как определено ранее, и Z означает атом галогена, такой как бром или йод, с производным R2-Z' (VÏÏI), где Z' означает реакционноспособную группу, такую как борильная, станнильная или силильная группа, или атом водорода, и R2 представляет собой 1-алкенильную, 1-алкинильную, арильную или гетероарильную группу, возможно замещенную.
Производные 3-галогено-1-арил-пропан-1,2-диона формулы (III) могут быть получены галогенированием соответствующих l-арилпропан-1,2-дионов по известным специалисту способам.
Амиды Вайнреба формулы (V) могут быть получены (превращение B2) связыванием кислоты формулы (VI), в которой Y означает гидроксигруппу, или одного из ее реакционноспособных производных, с N,O-диалкиламином по известным специалисту способам. Связывание может проводиться в присутствии агента связывания, такого как CDI, EDCI, HATU или HBTU, и основания, такого как диизопропилэтиламин, триэтиламин или пиридин, в инертном растворителе, таком как ТГФ, ДМФ или дихлорметан. Альтернативно, можно привести в реакцию N',O-диалкиламин со сложным эфиром формулы (VI), в которой Y означает алкоксигруппу, в присутствии катализатора, такого как триметилалюминий (Weinreb. S.M. et al, Synth. Commun. 1982, 12, 989).
Производные имидазопиридин-2-карбоновых кислот формулы (VI), в которой R1, R2, R3 и R4 такие, как определено ранее, и Y означает группу (C1-C6)алкокси, гидрокси или атом галогена, могут быть получены конденсацией 2-аминопиридина формулы (II), в которой R1, R2, R3 и R4 такие, как определено ранее, со сложным эфиром 3-галогено-2-оксопропионовой кислоты формулы (VIII), в которой Hal означает атом хлора, брома или йода, и Y означает (C1-C6)алкоксигруппу, в условиях, описанных J.G. Lombardino в J. Org. Chem., 30, 2403 (1965), например, при необходимости с последующей конверсией эфира в кислоту, затем в хлорид кислоты или другое реакционноспособное производное (превращение B1).
Производные имидазо[1,2-a]пиридина формулы (VII), в которой X, R1, R3 и R4 такие, как определено ранее, и Z означает атом галогена, борильную, станнильную или силильную группу, могут быть получены (превращение C1) конденсацией 2-аминопиридина формулы (II), в которой Z, R1, R3 и R4 такие, как определено выше, с производным 3-галогено-1-арилпропан-1,2-диона общей формулы (III), в которой Hal означает атом хлора, брома или йода, в условиях, описанных выше для получения продуктов общей формулы (I) по превращению A2.
Альтернативно, производные имидазо[1,2-a]пиридина формулы (VII), в которой X, R1, R3 и R4 такие, как определено ранее, и Z означает атом галогена, борильную, станнильную или силильную группу, могут быть получены реакцией металлоорганического производного общей формулы (IV), в которой X таково, как определено ранее, и M означает атом лития или группу Mg-Hal, с имидазо[1,2-a]пиридин-2-карбоновой кислотой формулы (XI), в которой R1, R2, R3, R4 и Z такие, как определено выше, и отличны от брома или йода, и Y означает гидроксигруппу, или с одним из ее реакционноспособных производных, таким как хлорид кислоты (превращение D4), или с амидом Вайнреба, соответствующим формуле (X) (превращение D3), защищая при необходимости другие реакционноспособные группы, в условиях, описанных выше для получения продуктов общей формулы (I) согласно превращениям B3 или B4.
Производные имидазопиридин-2-карбоновых кислот формул (X) и (XI) могут быть получены конденсацией 2-аминопиридина формулы (IX), в которой Z, R1, R3 и R4 такие, как определено ранее, со сложным эфиром 3-галогено-2-оксопропионовой кислоты формулы (VIII), в которой Hal означает атом хлора, брома или йода, и Y означает (C1-C6)алкоксигруппу, по способам, описанным выше для получения производных формул (V) и (VI) (превращение D1).
Связывание производных формул (VII), (IX) или (X) с продуктами формулы (VIII) может быть реализовано любыми способами, известными специалисту, в частности, работая в присутствии катализаторов на основе меди или палладия, лигандов, таких как фосфины, в соответствии или по аналогии с методами, описанными, например, в следующих ссылках и цитированных в них ссылках:
- для реакций типа Suzuki: N. Miyaura, A. Suzuki, Chem. Rev., 95. 2457, (1995),
- для реакций типа Stille: V.Farina и сотр., Org. React, 50,1 (1997),
- для реакций типа Hiyama: T.Hiyama и сотр., Top. Curr. Chem., 2002, 219, 61 (2002),
- для реакций типа Negishi: E.Negishi и сотр., Chem. Rev., 103, 1979 (2003),
- для реакций типа Bellina: M.Miura и сотр., Chem. Lett., 200 (2007).
Для осуществления связывания можно также образовать в промежутке, но без их выделения, металлоорганические производные, такие как цинковые производные.
Согласно изобретению соединения общей формулы (I), (II) и (VI) можно получить также способами, описанными в схеме 2, то есть конверсией соединений общих формул (XII), (XIII) или (XIV), где R1, R3, R4 и X такие, как определено ранее, Y означает группу гидрокси, алкокси или N-алкокси-N-алкиламино, и W означает группу-предшественника, позволяющей преобразовать гетероцикл формулы R2 соответственно в соединения общей формулы (I), (VI) и (II), по способам, известным специалисту (превращения G1, G2 и G3).
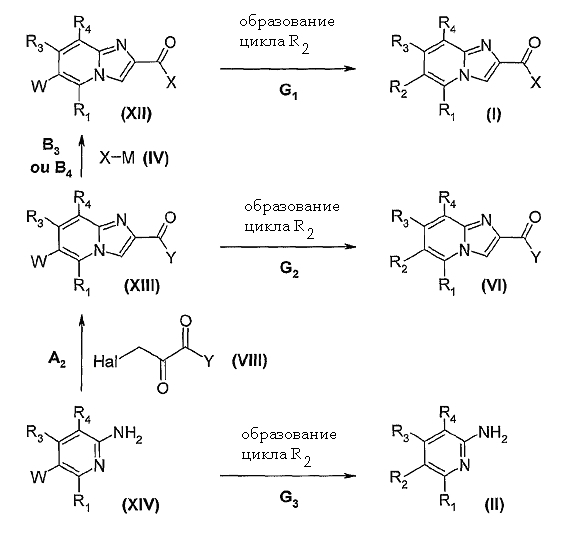
Схема 2
Например, W может означать:
- 2-галогеноацильную группу, такую как бромацетил, или 1-гало-2-оксоалкильную группу, как 1-бромо-2-оксоэтил, которая может быть превращена, например, в тиазолильную, имидазолильную, оксазолильную группу путем обработки производными тиомочевины, тиоамида, гуанидина, мочевины или амида,
- алкинильную группу, такую как этинильная, которая может быть превращена в 1,2,3-триазол-4-ильную группу,
- группу циано, которая может быть превращена, например, в дигидроимидазолильную (2) или 1,3,4-триазол-2-ильную группу.
Соединения общей формулы (XII) могут быть получены из соединений формулы (XIII) в условиях, описанных для получения соединения (I), исходя из производных имидазопиридин-2-карбоновых кислот формул (V) или (VI), по превращениям B2 или B4.
Производные имидазопиридин-2-карбоновых кислот общей формулы (XIII) могут быть получены из аминопиридинов формулы (XIV) в условиях, описанных для конверсии аминопиридинов формулы (II) в соединения общей формулы (I) (превращение A2).
Продукты формулы (I) и их предшественники формул (II), (V) или (VI), при желании и при необходимости, чтобы получить продукты формулы (I) или превратить в другие продукты формулы (I), могут подвергаться одной или нескольким следующим реакциям превращения, в произвольном порядке:
a) реакция этерификации или амидификации кислотной группы,
b) реакция гидролиза сложноэфирной группы в кислотную группу,
c) реакция превращение гидроксильной группы в алкоксигруппу,
d) реакция окисления спиртовой группы в альдегидную или кетоновую группу,
e) реакция окисления алкенильной группы в альдегидную или кетоновую группы,
f) реакция дегидратации гидроксиалкильной группы в алкенильную группу,
g) реакция полного или парциального гидрирования алкенильной или алкинильной группы в алкенильную или алкильную группу,
h) реакция каталитического связывания галогенового производного и металлоорганического производного, такого как производное, содержащее четырехвалентное олово, или борное производное, чтобы ввести алкильный, алкенильный, алкинильный, арильный или гетероарильный заместитель,
i) реакция конверсии галогенового производного, чтобы ввести борильный, станнильный или силильный заместитель,
j) реакция защиты реакционноспособных функциональных групп,
k) реакция удаления защитных групп, которые могут нести защищенные реакционноспособные функциональные группы,
l) реакция солеобразования с помощью неорганической или органической кислоты или основания, чтобы получить соответствующую соль,
m) реакция расщепления рацемических форм на энантиомеры, причем полученные в результате указанные продукты формулы (I) при необходимости находятся во всех возможных рацемических, энантиомерных и диастереомерных изомерных формах.
В схеме 1 исходные соединения и реагенты, когда способ их получения не описан, имеются в продаже или описаны в литературе, или же могут быть получены согласно методом, которые описаны в литературе или которые известны специалисту.
Следующие примеры описывают получение некоторых соединений по изобретению. Эти примеры не являются ограничительными и всего лишь иллюстрируют настоящее изобретение. Номера примеров отсылают к номерам, приведенным ниже в таблицах, иллюстрирующих химические структуры и спектроскопические характеристики некоторых соединений согласно изобретению.
Пример 1: [6-(6-аминопиридин-2-ил)имидазо[1,2-a]пиридин-2-ил](фенил)метанон
В микроволновую трубку помещают 300 мг фенил[6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-a]пиридин-2-ил]метанона, 123 мг 2-амино-6-бромопиридина, 30 мг тетракис(трифенилфосфин)палладия, 2 мл раствора 2M карбоната натрия, 4 мл толуола и 4 мл ацетонитрила. Реакционную смесь греют 20 минут в микроволновом устройстве, установленном на 150°C, затем охлаждают, фильтруют через целит, разбавляют этилацетатом, сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток очищают хроматографически на картридже с окисью кремния, элюируя смесью дихлорметана и этилацетата (50/50). Фракции, содержащие ожидаемый продукт, соединяют и концентрируют досуха при пониженном давлении. Твердую фазу растирают в смеси дихлорметана и изопропилового эфира, затем сушат, получая 57 мг [6-(6-аминопиридин-2-ил)имидазо[1,2-a]пиридин-2-ил](фенил)метанона в виде коричневой твердой субстанции.
Пример 2: гидрохлорид (2:1) фенил[(6-пиридин-2-ил)имидазо[1,2-a]пиридин-2-ил]метанона
2.1: фенил[6-(пиридин-2-ил)имидазо[1,2-a]пиридин-2-ил]метанон
В микроволновую трубку помещают 200 мг фенил[6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-a]пиридин-2-ил]метанона, 130 мг 2-йодопиридина, 26 мг тетракис(трифенилфосфин)палладия, 2 мл раствора 2M карбоната натрия, 4 мл толуола и 4 мл ацетонитрила. Реакционную смесь греют 20 минут в микроволновом устройстве, установленном на 150°C, затем охлаждают, фильтруют через целит и концентрируют при пониженном давлении. Остаток очищают хроматографически на картридже с окисью кремния, элюируя смесью дихлорметана и этилацетата (75/25). Фракции, содержащие ожидаемый продукт, соединяют и концентрируют досуха при пониженном давлении. Твердую фазу растирают в метаноле, затем фильтруют, получая 95 мг фенил(6-пиридин-2-илимидазо[1,2-a]пиридин-2-ил)метанона в виде твердой субстанции цвета сурового полотна.
2.2: Гидрохлорид (2:1) фенил[6-(пиридин-2-ил)имидазо[1,2-a]пиридин-2-ил]метанона
К раствору 95 мг фенил[6-(пиридин-2-ил)имидазо[1,2-a]пиридин-2-ил]метанона в минимальном количестве диоксана добавляют 200 мкл раствора 4M соляной кислоты в диоксане. Образованный осадок обезвоживают, промывают этиловым эфиром и сушат, получая 94 мг дигидрохлорида фенил(6-пиридин-2-имидазо[1,2-a]пиридин-2-ил)метанона в виде бежевой твердой субстанции.
Пример 3: фенил[6-(1H-пиррол-3-ил)имидазо[1,2-a]пиридин-2-ил]метанон
3.1: фенил[6-(1-триизопропилсилилпиррол-3-ил)имидазо[1,2-a]пиридин-2-ил]метанон
В микроволновую трубку помещают 225 мг (6-йодоимидазо[1,2-a]пиридин-2-ил)(фенил)метанона, 225 мг 1-триизопропилсилилпиррол-3-борной кислоты, 30 мг тетракис(трифенилфосфин)палладия, 2 мл раствора 2M карбоната натрия, 4 мл толуола и 4 мл ацетонитрила. Реакционную смесь греют 20 минут в микроволновом устройстве, установленном на 150°C, затем охлаждают, разбавляют этилацетатом, фильтруют через целит, сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток очищают хроматографически на картридже с окисью кремния, элюируя смесью дихлорметана и этилацетата (90/10). Фракции, содержащие ожидаемый продукт, соединяют и концентрируют досуха при пониженном давлении, получая 110 мг фенил[6-(1-триизопропилсилил-пиррол-3-ил)имидазо[1,2-a]пиридин-2-ил]метанона в виде зеленого масла.
1H-ЯМР спектр (DMSO-d6, δ в ppm): 1,09 (д, J=7,5 Гц, 18H), 1,56 (м, 3H), 6,67 (дв.д, J=1,5 и 2,0 Гц, 1H), 6,94 (т, J=2,0 Гц, 1H), 7,40 (шир.с, 1H), 7,58 (т, J=7,5 Гц, 2H), 7,67 (м, 2H), 7,78 (дв.д, J=1,5 и 9,5 Гц, 1H), 8,33 (шир.д, J=7,5 Гц, 2H), 8,51 (с, 1H), 8,82 (шир.с, 1H).
Масс-спектр (LC-MS-DAD-ELSD): m/z 444 [M+H]+.
3.2: фенил[6-(1H-пиррол-3-ил)имидазо[1,2-a]пиридин-2-ил]метанон
Раствор 110 мг фенил[6-(1-триизопропилсилилпиррол-3-ил)имидазо[1,2-a]пиридин-2-ил]метанона в 1,5 мл тетрагидрофурана обрабатывают 248 мкл раствора 1M фторида тетрабутиламмония в тетрагидрофуране, перемешивают 2 часа при 25°C, затем концентрируют при пониженном давлении. Остаток очищают хроматографически на картридже с окисью кремния, элюируя смесью дихлорметана и этилацетата (75/25). Фракции, содержащие ожидаемый продукт, соединяют и концентрируют досуха при пониженном давлении, получая 31 мг фенил[6-(1H-пиррол-3-ил)имидазо[1,2-a]пиридин-2-ил]метанона в виде каштановой твердой субстанции.
Пример 4: фенил[6-(1H-пиразол-4-ил)имидазо[1,2-a]пиридин-2-ил]метанон
В микроволновую трубку помещают 250 мг (6-йодолимидазо[1,2-a]пиридин-2-ил)(фенил)метанона, 225 мг 1H-4-пиразолборной кислоты, 33 мг тетракис(трифенилфосфин)палладия, 2,5 мл раствора 2M карбоната натрия, 5 мл толуола и 5 мл ацетонитрила. Реакционную смесь греют 20 минут в микроволновом устройстве, установленном на 150°C, затем охлаждают, разбавляют этилацетатом, фильтруют через целит, сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток очищают хроматографически на картридже с окисью кремния, элюируя этилацетатом. Фракции, содержащие ожидаемый продукт, соединяют и концентрируют досуха при пониженном давлении, получая 15 мг фенил[6-(1H-пиразол-4-ил)имидазо[1,2-a]пиридин-2-ил]метанона в виде бежевой твердой субстанции.
Пример 5: [6-(1H-имидазол-4-ил)имидазо[1,2-a]пиридин-2-ил](фенил)метанон
5.1: фенил[6-(1-тритил-1H-имидазол-4-ил)имидазо[1,2-a]пиридин-2-ил]метанон
В микроволновую трубку помещают 200 мг фенил[6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-a]пиридин-2-ил]метанона, 276 мг 4-йодо-1-тритилимидазола, 26 мг тетракис(трифенилфосфин)палладия, 2 мл раствора 2М карбоната натрия, 4 мл толуола и 4 мл ацетонитрила. Реакционную смесь греют 20 минут в микроволновом устройстве, установленном на 150°C, затем охлаждают, фильтруют через целит, разбавляют этилацетатом, сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток очищают хроматографически на картридже с окисью кремния, элюируя смесью дихлорметана и этилацетата (75/25). Фракции, содержащие ожидаемый продукт, соединяют и концентрируют досуха при пониженном давлении. Твердую фазу растирают в смеси метанола и пентана, затем сушат, получая 135 мг фенил[6-(1-тритил-1H-имидазол-4-ил)имидазо[1,2-a]пиридин-2-ил]метанона в виде бледно-желтой твердой субстанции.
1H-ЯМР спектр (DMSO-d6, δ в ppm): 7,19 (д, J=7,5 Гц, 6H), 7,37-7,48 (м, 9H), 7,51-7,60 (м, 4H), 7,65 (м, 2H), 7,79 (дв.д, J=1,5 и 9,5 Гц, 1H), 8,32 (д, J=7,5 Гц, 2H), 8,53 (с, 1H), 9,02 (шир.с, 1H).
Масс-спектр (LC-MS-DAD-ELSD): m/z 531 [M+H]+.
5.2: [6-(1H-имидазол-4-ил)имидазо[1,2-a]пиридин-2-ил](фенил)метанон
Суспензию 133 мг фенил[6-(1-тритил-1H-имидазол-4-ил)имидазо[1,2-a]пиридин-2-ил]метанона в смеси 5 мл соляной кислоты 2н и 1 мл уксусной кислоты кипятят с обратным холодильником 2,5 часа. Твердую фазу фильтруют и промывают теплой водой. Фильтрат нейтрализуют карбонатом калия и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния и концентрируют при пониженном давлении. Твердую фазу сушат при пониженном давлении, получая 58 мг [6-(1H-имидазол-4-ил)имидазо[1,2-a]пиридин-2-ил](фенил)метанона в виде твердой бежевой субстанции.
Пример 6: (6-фуран-2-илимидазо[1,2-a]пиридин-2-ил)(фенил)метанон
В микроволновую трубку помещают 250 мг (6-йодолимидазо[1,2-a]пиридин-2-ил)(фенил)метанона, 843 мг трибутилфуран-2-илстаннана, 151 мг тетракис(трифенилфосфоний)палладия и 4 мл N,N-диметилформамида. Реакционную смесь греют 10 минут в микроволновом устройстве, установленном на 150°C, затем охлаждают и концентрируют при пониженном давлении. Остаток очищают хроматографически на картридже с окисью кремния, элюируя смесью дихлорметана и этилацетата (90/10). Фракции, содержащие ожидаемый продукт, соединяют и концентрируют досуха при пониженном давлении. Остаток кристаллизуют в смеси метанола и диизопропилового эфира, получая 124 мг (6-фуран-2-илимидазо[1,2-a]пиридин-2-ил)(фенил)метанона в виде бежевой твердой субстанции.
Описываемые ниже промежуточные соединения применимы для получения соединений по настоящему изобретению.
Промежуточное соединение 1: (6-йодоимидазо[1,2-a]пиридин-2-ил)(фенил)метанон
К раствору 4,5 г 2-амино-5-йодопиридина в 35 мл тетрагидрофурана добавляют раствор 5,5 г 3-бромо-1-фенилпропан-1,2-диона в 35 мл тетрагидрофурана. Реакционную смесь перемешивают 16 часов при 20°C, затем концентрируют досуха при пониженном давлении. Остаток вводят в 100 мл этанола и кипятят с обратным холодильником 2,5 часа. Реакционную смесь концентрируют досуха и вводят в насыщенный раствор бикарбоната натрия и дихлорметана. Органическую фазу сушат над сульфатом магния и выпаривают досуха. Твердую фазу растирают в этиловом эфире, фильтруют и сушат, получая 4,14 г (6-йодоимидазо[1,2-a]пиридин-2-ил)(фенил)метанона в виде желто-оранжевой твердой субстанции.
1H-ЯМР спектр (DMSO-d6, δ в ppm): 7,58 (т, J=7,6 Гц, 4H), 7,67 (д, J=7,3 Гц, 1H), 8,30 (д, J=7,8 Гц, 1H), 8,54 (с, 1H), 9,01 (с, 1H).
Масс-спектр (LC-MS-DAD-ELSD): m/z 349: [M+H]+.
Промежуточное соединение 1 (6-йодоимидазо[1,2-a]пиридин-2-ил)(фенил)метанон) уже описано в документе WO 2008/003854 (соединение 22 в таблице). Поэтому оно исключено из объема настоящего изобретения.
Промежуточное соединение 2: фенил[6-(4,4,5,5-тетраметил-l,3,2-диоксаборолан-2-ил)имидазо[1,2-a]пиридин-2-ил]метанон
К раствору 7 г 2-амино-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина в 50 мл тетрагидрофурана добавляют раствор 6 г 3-бромо-1-фенилпропан-1,2-диона в 50 мл тетрагидрофурана. Реакционную смесь перемешивают 16 часов при температуре окружающей среды, затем концентрируют досуха при пониженном давлении. Остаток вводят в 100 мл этанола и кипятят с обратным холодильником в течение 2,5 часов. После концентрирования досуха при пониженном давлении твердую фазу вводят в насыщенный раствор бикарбоната натрия и дихлорметана. Органическую фазу сушат над сульфатом магния и выпаривают досуха. Остаток снова растворяют в 30 мл этанола и 12 мл соляной кислоты 2н. Реакционную смесь перемешивают при 25°C, затем выпаривают досуха и вводят в дихлорметан и 24 мл соды 1н. Органическую фазу сушат над сульфатом магния и выпаривают досуха. Остаток растирают в смеси дихлорметана и этилового эфира. Нерастворимую фракцию отфильтровывают и концентрированный фильтрат растирают в смеси дихлорметана, метанола и этилового эфира. Твердую фазу фильтруют и сушат, получая 1,2 г фенил[6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-a]пиридин-2-ил]метанона в виде бежево-оранжевой твердой субстанции.
1H-ЯМР спектр (DMSO-d6, δ в ppm): 1,33 (с, 12H), 7,44 (дв.д, J=1,5 и 9.5 Гц, 1H), 7,58 (т, J=7,5 Гц, 2H), 7,69 (м, 3H), 8,30 (д, J=7,5 Гц, 2H), 8,70 (с, 1H): 8,95 (шир.с, 1H).
Масс-спектр (IE): m/z 348: [M]+.
Следующие таблицы иллюстрируют химические структуры (таблица 1) и спектроскопические характеристики (таблица 2) некоторых примеров соединений согласно изобретению.
В колонке "Соль" таблицы 1 "-" означает соединение в виде свободного основания, тогда как "HCl" означает соединение в виде гидрохлорида, а отношение в скобках есть отношение (кислота:основание).

Таблица 1


(2:1)








Масс-спектр (LC-MS-DAD-ELSD): m/z 315 [M+H]+
Масс-спектр (LC-MS-DAD-ELSD): m/z 300 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 286 [M-H]+, m/z 288 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 287 [M-H]+, m/z 289 [M+H]+
Масс-спектр (LC-MS-DAD-ELSD): m/z 287 [M-H]+, m/z 289 [M+H]+
Масс-спектр (LC-MS-DAD-ELSD): m/z 289 [M+H]+
Масс-спектр (LC-MS-DAD-ELSD): m/z 322 [M+Na]+
Соединения согласно изобретению были объектом фармакологических исследований, позволяющих определить их модулирующий эффект на NOT.
Оценка активности in vitro на клетках N2A
Активность соединений по изобретению оценивали на клеточной линии (N2A), эндогенно экспрессирующей рецептор мышей Nurr1 и стабильно трансфицированной элементом отклика, связывающим NOT (NBRE), соединенным с геном-репортером люциферазы. EC50 составляют от 0,01 до 1000 нМ. Опыты проводили согласно методике, описанной ниже.
Клеточная линия Neuro-2A происходит из стандартного коммерческого источника (ATCC). Клон Neuro-2A был получен из спонтанной опухоли, происходящей из штамма мышей A albino, по RJ Klebe и сотр. Эту линию Neuro-2A затем стабильно трансфицировали 8NBRE-люциферазой. Клетки N2A-8NBRE культивировали до слияния в чашках для выращивания культур сечением 75 см2, содержащих DMEM, дополненный 10% эмбриональной телячьей сыворотки, 4,5 г/л глюкозы и 0,4 мг/мл генетицина. Через одну неделю культивирования клетки собирали трипсином (0,25%) в течение 30 секунд, затем вводили в суспензию в DMEM без фенолового красного, содержащую 4,5 г/л глюкозы, 10% обезжиренной сыворотки Hyclone, и помещали в белые 96-луночные планшеты с прозрачным дном. Клетки размещали из расчета 60000 на лунку в 75 мкл за 24 часа до добавления продуктов. Продукты вводили в объеме 25 мкл и дополнительно инкубировали 24 часа. В день измерения в каждую лунку добавляют эквивалентный объем (100 мкл) Steadylite, затем ждут 30 минут, чтобы получить полный лизис клеток и образование максимального сигнала. Затем планшеты анализируют в счетчике люминесценции для микропланшетов после того, как они были закрыты липкой пленкой. Продукты готовят в виде маточного раствора концентрацией 10-2 M, затем разбавляют в 100% DMSO. Каждую концентрацию продукта предварительно разбавляют в культуральной среде до инкубирования с клетками, таким образом, в конце содержащими 0,625% DMSO.
Например, соединения 1, 4 и 7 показали CE50 0,7, 0,5 и 0,5 нМ, соответственно.
Таким образом, оказывается, что соединения согласно изобретению имеют моделирующий эффект на NOT.
Следовательно, соединения по изобретению могут применяться для приготовления лекарственных средств для применения в терапии для лечения или профилактики заболеваний, в которых участвуют рецепторы NOT.
Таким образом, согласно одному из других его аспектов, объектом изобретения являются лекарственные средства, которые содержат соединение формулы (I) или соль присоединения этого последнего с фармацевтически приемлемой кислотой.
Эти лекарственные средства находят применение в терапии, в частности для лечения и профилактики нейродегенеративных заболеваний, таких, например, как болезнь Паркинсона, Альцгеймера, таупатия (например, прогрессивный супрануклеарный паралич, лобно-височная деменция, кортикобазальная дегенерация, болезнь Пика); травмы головного мозга, как ишемия, и черепно-мозговые травмы и эпилепсия; психиатрических заболеваний, как шизофрения, депрессия, зависимость от веществ, нарушения дефицита внимания и гиперактивности; воспалительных заболеваний центральной нервной системы, как рассеянный склероз, энцефалит, миелит и энцефаломиелит, и других воспалительных заболеваний, как сосудистые патологии, атеросклероз, воспаления суставов, артроз, ревматоидный артрит; остеоартрита, болезни Крона, язвенного колита; аллергических воспалительных заболеваний, таких как астма, аутоиммунные заболевания, как диабет I-го типа, волчанка, склеродермии, синдром Гийена-Барре, болезнь Аддисона и другие иммунно-зависимые заболевания, остеопороза; рака.
Эти соединения могут также использоваться в качестве лечения в сочетании с прививкой и/или пересадкой стволовых клеток.
Таким образом, объект настоящего изобретения относится к соединению формулы (I), какое определено выше, для лечения указанных заболеваний и расстройств.
Согласно одному из других его аспектов настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве действующего вещества соединение по изобретению. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения согласно изобретению или фармацевтически приемлемой соли, а также по меньшей мере один фармацевтически приемлемый эксципиент.
Указанные эксципиенты выбираются, в соответствии с фармацевтической формой и желаемым способом введения, из обычных эксципиентов, которые известны специалисту.
В фармацевтических композициях по настоящему изобретению для перорального, сублингвального, подкожного, внутримышечного, внутривенного, топического, местного, внутритрахеального, интраназального, чрескожного или ректального введения действующее вещество формулы (I) выше или его соль могут вводиться в стандартной лекарственной форме, в смеси с классическими фармацевтическими эксципиентами, животным и человеку для профилактики или лечения указанных расстройств или заболеваний.
Подходящие стандартные лекарственные формы включают формы для перорального введения, такие как таблетки, мягкие или твердые капсулы, порошки, гранулы и пероральные растворы или суспензии, формы для сублингвального, буккального, внутритрахеального, внутриглазного, интраназального введения, для введения ингаляцией, формы для топического, чрескожного, подкожного, внутримышечного или внутривенного введения, формы для ректального введения и имплантаты. Для топического нанесения соединения по изобретению можно использовать в кремах, гелях, мазях или лосьонах.
Например, одна стандартная лекарственная форма соединения по изобретению в виде таблетки может содержать следующие компоненты:
Могут встречаться особые случаи, когда подходят более высокие или более слабые дозировки; такие дозировки не выходят за рамки изобретения. Обычно согласно практике дозировка, подходящая для каждого пациента, определяется врачом в зависимости от способа введения, массы тела и реакции указанного пациента.
Настоящее изобретение, согласно другому его аспекту, относится также к способу лечения указанных выше патологий, который включает введение пациенту эффективной дозы соединения по изобретению или одной из его фармацевтически приемлемых солей.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРРОЛОПИРРОЛОВЫЕ КОМПОЗИЦИИ В КАЧЕСТВЕ АКТИВАТОРОВ ПИРУВАТКИНАЗЫ (PKR) | 2018 |
|
RU2736217C2 |
| ЗАМЕЩЕННЫЕ ИМИДАЗО[1,2-b]ПИРИДАЗИНЫ, ЗАМЕЩЕННЫЕ ИМИДАЗО[1,5-b]ПИРИДАЗИНЫ, РОДСТВЕННЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ | 2017 |
|
RU2773333C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ НЕКОТОРЫХ ЛЕЙКОЗОВ | 2019 |
|
RU2804709C2 |
| ФТОРСОДЕРЖАЩИЕ ЛИГАНДЫ ДЛЯ НАЦЕЛИВАНИЯ ПЕРИФЕРИЧЕСКИХ БЕНЗОДИАЗЕПИНОВЫХ РЕЦЕПТОРОВ | 2007 |
|
RU2468014C2 |
| ПРОИЗВОДНЫЕ 6-ФЕНИЛ-1Н-ИМИДАЗО[4,5,-с] ПИРИДИН-4-КАРБОНИТРИЛА В КАЧЕСТВЕ ИНГИБИТОРОВ КАТЕПСИНА К И S | 2007 |
|
RU2400482C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2015 |
|
RU2733400C2 |
| НОВОЕ СОЕДИНЕНИЕ БЕНЗИМИДАЗОЛОНА И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2803938C2 |
| АЛЛОСТЕРИЧЕСКИЕ МОДУЛЯТОРЫ МЕТАБОТРОПНЫХ ГЛУТАМАТНЫХ РЕЦЕПТОРОВ | 2004 |
|
RU2360902C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОПИРИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ИХ ОСНОВЕ (ВАРИАНТЫ), СПОСОБ ИНГИБИРОВАНИЯ СЕКРЕЦИИ ЖЕЛУДОЧНОЙ КИСЛОТЫ И СПОСОБ ЛЕЧЕНИЯ СОСТОЯНИЙ, В КОТОРЫЕ ВОВЛЕЧЕНО ИНФИЦИРОВАНИЕ H.PYLORI | 1999 |
|
RU2235725C2 |
| ПРОИЗВОДНОЕ ПИРАЗОЛА, ПРИГОДНОЕ В КАЧЕСТВЕ ИНГИБИТОРА РI3К | 2016 |
|
RU2710549C2 |
Настоящее изобретение относится к области химии гетероциклических соединений, а именно к соединению формулы (I), где X означает фенильную группу; R1, R3 и R4 обозначают атомы водорода; R2 обозначает ненасыщенную моноциклическую гетероциклическую группу, содержащую 5 или 6 атомов, включая от 1 до 2 гетероатомов, выбранных из N и О, причем указанная гетероциклическая группа может быть замещена группой -NRcRd, причем Rc и Rd обозначают водород; в форме основания или кислотно-аддитивной соли. Также изобретение относится к лекарственному средству и фармацевтической композиции на основе соединения формулы (I), к применению соединения формулы (I) для приготовления лекарственного средства. Помимо этого изобретение описывает соединение фенил[6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин-2-ил]метанон и его применение для синтеза соединений формулы (I). Технический результат: получены новые производные имидазо[1,2-а]пиридинов, пригодные для лечения или профилактики заболеваний, в которых участвуют рецепторы NOT. 12 н. и 2 з.п. ф-лы, 2 табл.
1. Соединение формулы (I):
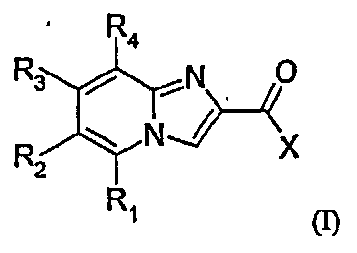
в которой X означает фенильную группу;
R1, R3 и R4 обозначают атомы водорода;
R2 обозначает ненасыщенную моноциклическую гетероциклическую группу, содержащую 5 или 6 атомов, включая от 1 до 2 гетероатомов, выбранных из N и О, причем указанная гетероциклическая группа может быть замещена группой -NRcRd, причем Rc и Rd обозначают водород;
в форме основания или кислотно-аддитивной соли.
2. Соединение формулы (I) по п.1, отличающееся тем, что
X означает фенильную группу;
R1, R3 и R4 представляют собой атомы водорода;
R2 означает пиридин, пиррол, пиразол, имидазол или фуран, возможно замещенную группой NH2;
в форме основания или кислотно-аддитивной соли.
3. Соединение формулы (I) по п.1 или 2, выбранное из:
[6-(6-аминопиридин-2-ил)имидазо[1,2-а]пиридин-2-ил](фенил)-метанона,
фенил(6-пиридин-2-илимидазо[1,2-а]пиридин-2-ил)метанона и его дигидрохлорида,
фенил[6-(1Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2-ил]метанона,
фенил[6-(1Н-пиразол-4-ил)имидазо[1,2-а]пиридин-2-ил]метанона,
[6-(1Н-имидазол-4-ил)имидазо[1,2-а]пиридин-2-ил](фенил)метанона,
[(6-фуран-2-ил)имидазо[1,2-а]пиридин-2-ил](фенил)метанона,
фенил[(6-пиридин-3-ил)имидазо[1,2-а]пиридин-2-ил]метанон,
или из солей присоединения этих соединений к фармацевтически приемлемой кислоте.
4. Лекарственное средство, пригодное для лечения или профилактики заболеваний, в которых участвуют рецепторы NOT, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-3, или соль присоединения этого соединения с фармацевтически приемлемой кислотой.
5. Фармацевтическая композиция, пригодная для лечения или профилактики заболеваний, в которых участвуют рецепторы NOT, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-3, или фармацевтически приемлемую соль этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
6. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения и профилактики нейродегенеративных заболеваний.
7. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения и профилактики травм головного мозга и эпилепсии.
8. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения и профилактики психиатрических заболеваний.
9. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения и профилактики воспалительных заболеваний.
10. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения и профилактики остеопороза и рака.
11. Применение соединение формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения и профилактики болезни Паркинсона, Альцгеймера, таупатий, рассеянного склероза.
12. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения и профилактики шизофрении, депрессии, зависимости от веществ, нарушений дефицита внимания и гиперактивности.
13. Соединение фенил[6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин-2-ил]метанон.
14. Применение соединения по п.13 для синтеза продуктов общей формулы (I), определенных в пп.1-3.
| СПОСОБ ПЕРЕДАЧИ ПРЯМЫХ СИГНАЛОВ УПРАВЛЕНИЯ В СИСТЕМАХ РАДИОСВЯЗИ | 2014 |
|
RU2638161C2 |
| Способ наматывания льняной ровницы на перфорированную катушку для последующей ее жидкостной обработки | 1989 |
|
SU1726585A1 |
| ПРИБОР ДЛЯ ИСПЫТАНИЯ РАФИНАДНОГО САХАРА НА ИЗЛОМ | 1927 |
|
SU5991A1 |
| RU 2002107128 А, 27.09.2003. | |||
Авторы
Даты
2012-02-20—Публикация
2008-12-31—Подача