ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к получению аналогов рифамицина против лекарственно-устойчивых бактерий. Настоящее изобретение, кроме того, также относится к антибактериальным соединениям против лекарственно-устойчивых микобактерий. В настоящем изобретении, кроме того, предлагается фармацевтическая композиция, содержащая антибактериальное соединение против лекарственно-устойчивых бактерий, в частности микобактерий. В настоящем изобретении также предлагается применение антибактериальных соединений для лечения заболевания, вызванного бактериями и, в частности, микобактериями.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
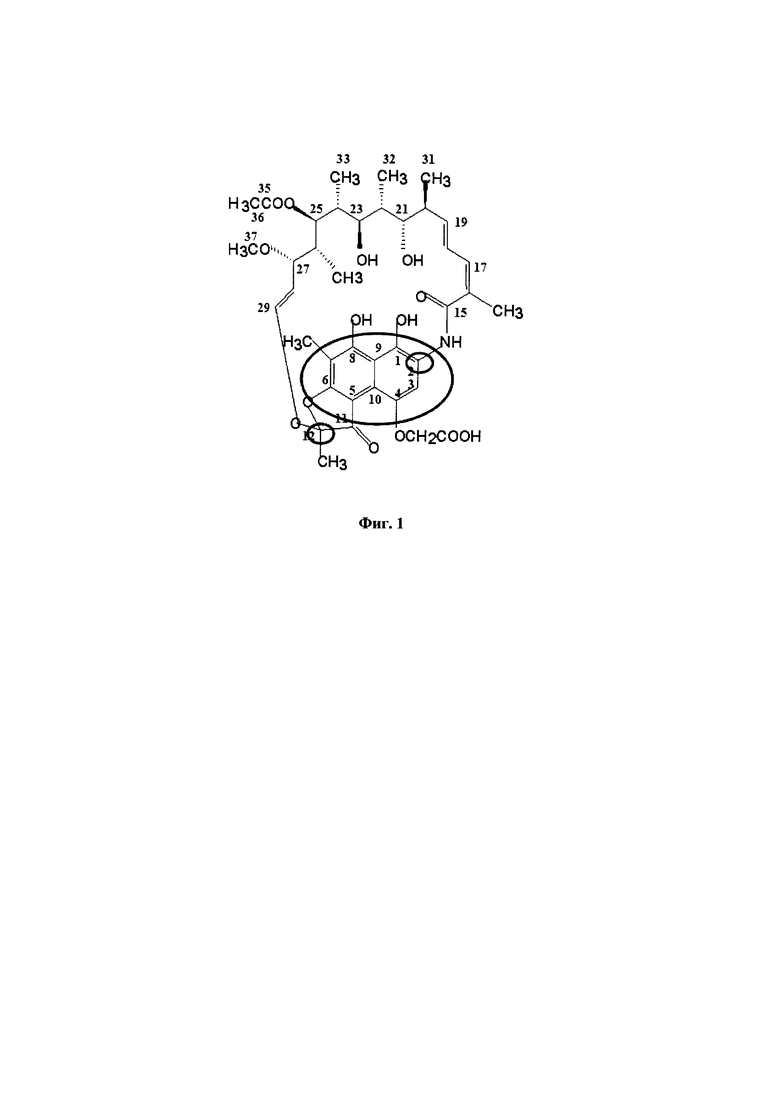
Amycolatopsis mediterranei S699 (АТСС 13685) представляют собой актинобактерии, которые продуцируют важный антибиотический рифамицин В (Фигура 1). Полусинтетические производные рифамицина В используются против Mycobacterium tuberculosis и Mycobacterium leprae, возбудителей туберкулеза (ТБ) и проказы, соответственно. Эти производные также используются против целого ряда других организмов, включающих ассоциированные со СПИДом микобактерии. Рифамицин В и рифамицины вообще принадлежат к ансамицин-классу антибиотиков и характеризуются нафталиновым фрагментом, стянутым алифатической цепью подобно ручке корзины (Фигура 1). Это ароматическое ядро придает красновато-коричневый цвет молекуле рифамицина. Углеродный скелет в рифамицине В бактерий бактерий A. mediterranei S699 построен из двух ацетатных и восьми пропионатных единиц и пусковой единицы 3-амино-5-гидроксибензойной кислота (АНВА). Рифамицин В представляет собой нативные и устойчивые молекулы и действует в качестве исходного материала для синтеза полусинтетических производных, включающих рифамицин S, рифамицин SV, рифампицин, рифабутин, рифапентин и рифаксимин (которые находятся в клиническом применении). Кроме того, с 1960 года штамм S699 подвергается классической программе улучшения штамма, и преемники этого штамма используются для получения рифамицина В. В настоящее время улучшенные промышленные штаммы продуцируют примерно от 15 г/л до 24 г/л рифамицина В.
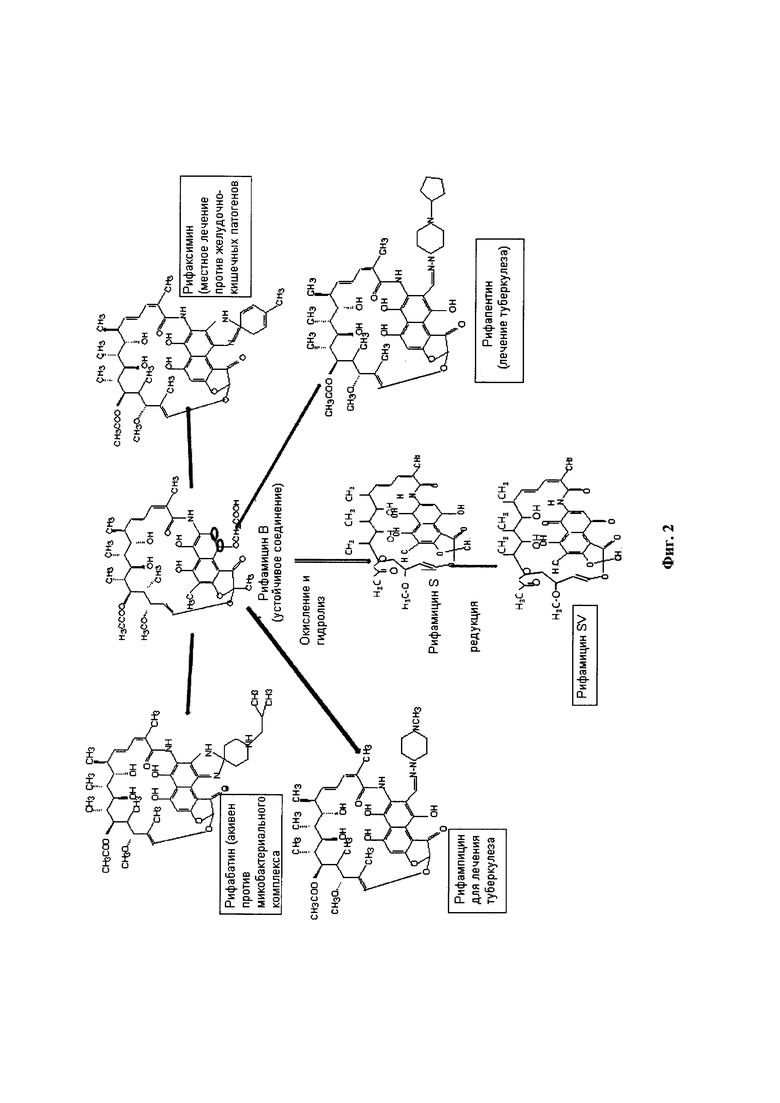
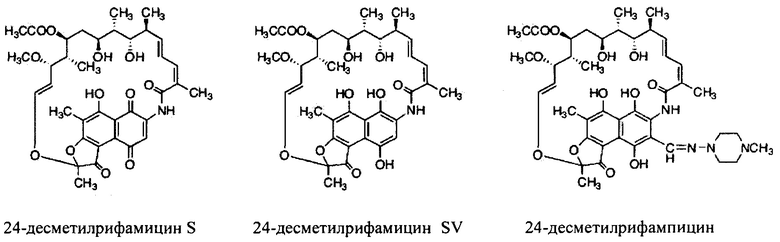
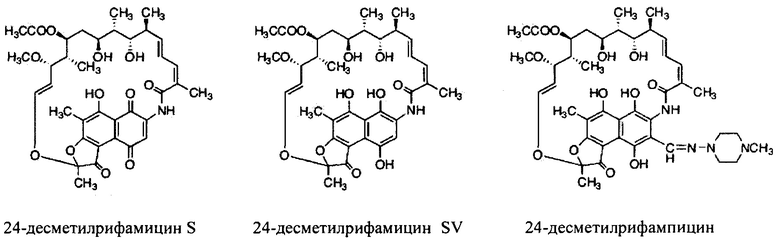
Полусинтетические производные рифамицина В, как упоминалось ранее, были разработаны для улучшения фармакокинетики молекул (Фигура 2). Рифампицин (3-[4-метилпиперазинилимино-метил]рифамицин SV) был впервые одобрен для клинического использования в Италии, в 1968 году. Он получил одобрение Управления по контролю продуктов питания и лекарственных средств [Food and Drug Administration] в 1971 году в США [Sensi,, P. et al. (1983). Farmac. Ed. Sc. Vol. 14, р. 146-147]. Это было первое полусинтетическое производное рифамицина В, оно находит широкое применение при лечении туберкулеза. Связывается с РНК-полимеразой М. tuberculosis и блокирует удлинение цепи РНК.
Другим производным рифамицина В является рифабутин (4-N-изобутилспиропиперидил рифамицин S). Он продается под названием мукобутин [Mycobutin]. Характеризуется как эффективное средство против нескольких штаммов, устойчивых к рифампицину и обладает высокой активностью в отношении Mycobacterium avium комплекса, ассоциированного со СПИДом.
Рифамиксин (4-деози-3'-бромопиридо-[1',2'-1,2]имидиазо[5,4-с]-рифамицин SV), производное рифамицина В, практически не всасывается в кишечнике при пероральном приеме. Это свойство делает его благоприятным для лечения локальных состояний в патогенах желудочно-кишечного тракта.
Рифапентин (3{[(4-циклопентил-1-пиперазинил)имино]метил}рифамицин SV) обладает активностью против микобактерий и фармакокинетическим профилем, который обеспечивает длительное действие. Продается под названием Prifith фирмой Sanofi Aventis. Был одобрен для лечения туберкулеза Food and Drug administration в 1998 году.
A. mediterranei, продуцент рифамицина, имеет интересную историю. Этот вид был выделен из образца почвы из соснового дендрарий на высоте 200 м, около 50 м от берега Святого Рафаэля, Франция. Благодаря морфологическому и биохимическому сходству, этот изолят был классифицирован как Streptomyces mediterranei [Margalith, P. and Beretta, G. (1960). Mycopathol. Mycol. Appl. Vol. 13, p. 321-330]. Позже он был классифицирован как Amycolatopsis mediterranei [Lechevalier et al. (1986). Int. J. Sys. Bacteriol. Vol. 36, p. 29-37]. Автор Лал и его коллеги разработали серию клонирующих векторов (pRL серия), которые могут использоваться для трансформации и клонирования нескольких штаммов A. mediterranei [Lal, R., US 5985560 A (1999); Lal, R. et al. (1991). Appl. Environ. Microbiol. Vol. 57, p. 665-671; Dhingra, G. et al. (2003). Ind. Microbiol. Biotecnol. Vol. 30, p. 195-204].
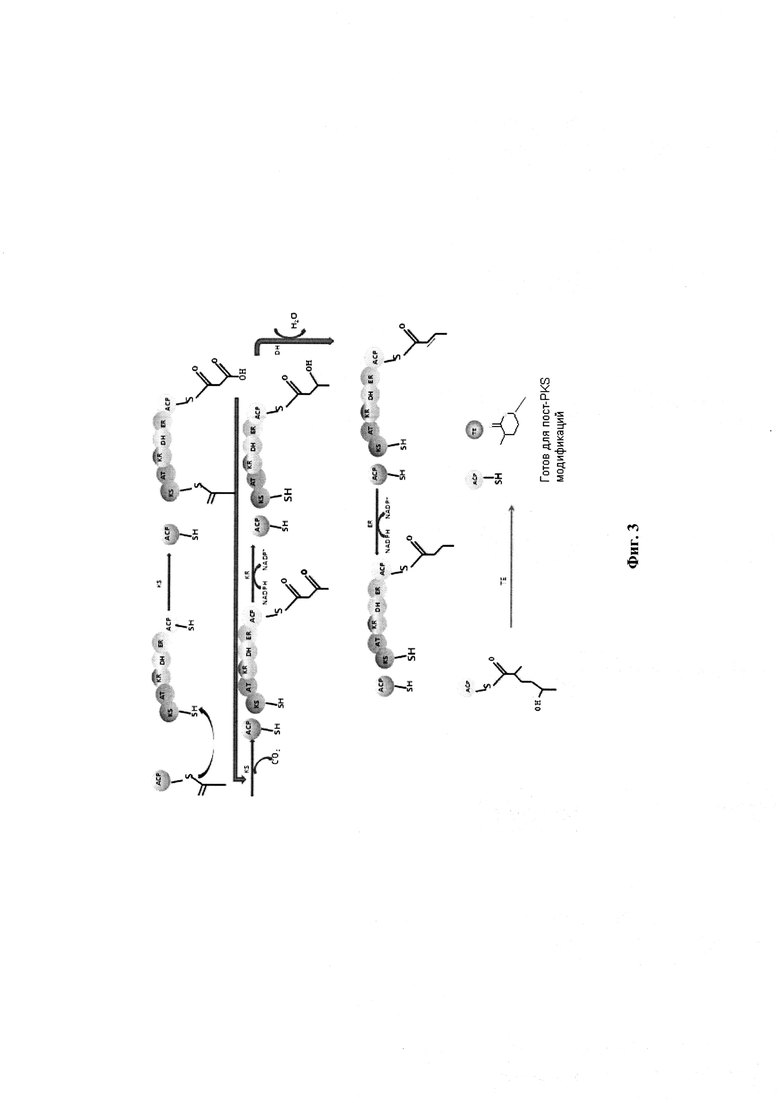
Уместно заметить, что синтез эритромицина (ery), рапамицина (rap) и рифамицина (rif) опосредован через модульную поликетидсинтазу (мультиэнзимные комплексы), также известную как PKS типа I, которые строят эти макроциклические поликетиды путем конденсации ацетатных и пропионатных единиц. PKS типа I имеют коллинеарную архитектуру и состоят из модулей, каждый из которых с каталитическими доменами, которые определяют порядок отбора субстрата для сборки базовой цепи и последующей модификации β-кетоэфиров (поликетидов). Модуль PKS типа I обычно состоит из доменов кетосинтазы (KS), ацилтрансферазы (AT) и ацильного белка-носителя (АСР), которые образуют минимальную PKS. По выбору, могут присутствовать домены кеторедуктазы (KR), дегидратазы (DH) или еноил редуктазы (ER) (также известные как восстановительные домены), чтобы вызвать модификации в цепи кетоэфира. Пусковая единица (ацетил-КоА) загружается на АСР, катализируется AT доменом пускового модуля. Удлинительная цепь передается от АСР предыдущего модуля к KS текущего модуля и катализируется KS доменом. AT домен выбирает тип удлинительной единицы для добавления к растущей цепи поликетида, KS катализирует реакцию конденсации и АСР связывает растущую поликетидного цепь между последовательной конденсацией и принимает удлинительную единицу от AT в рамках подготовки к следующей реакции конденсации. Растущий поликетид модифицируется с помощью восстановительной петли. KR домен приводит β-кетогруппу к гидроксильной группе. DH домен исключает молекулы воды, в результате получается α-β двойная связь, a ER домен преобразует α-β двойную связь в насыщенную связь. Углеродный скелет затем высвобождается из PKS за счет гидролитического действия ТЕ домена (Фигура 3). В то время как наличие АСР, AT и KS важно в модуле, другие домены, как например KR, DH, ER не являются обязательными и могут присутствовать в модуле или не присутствовать.
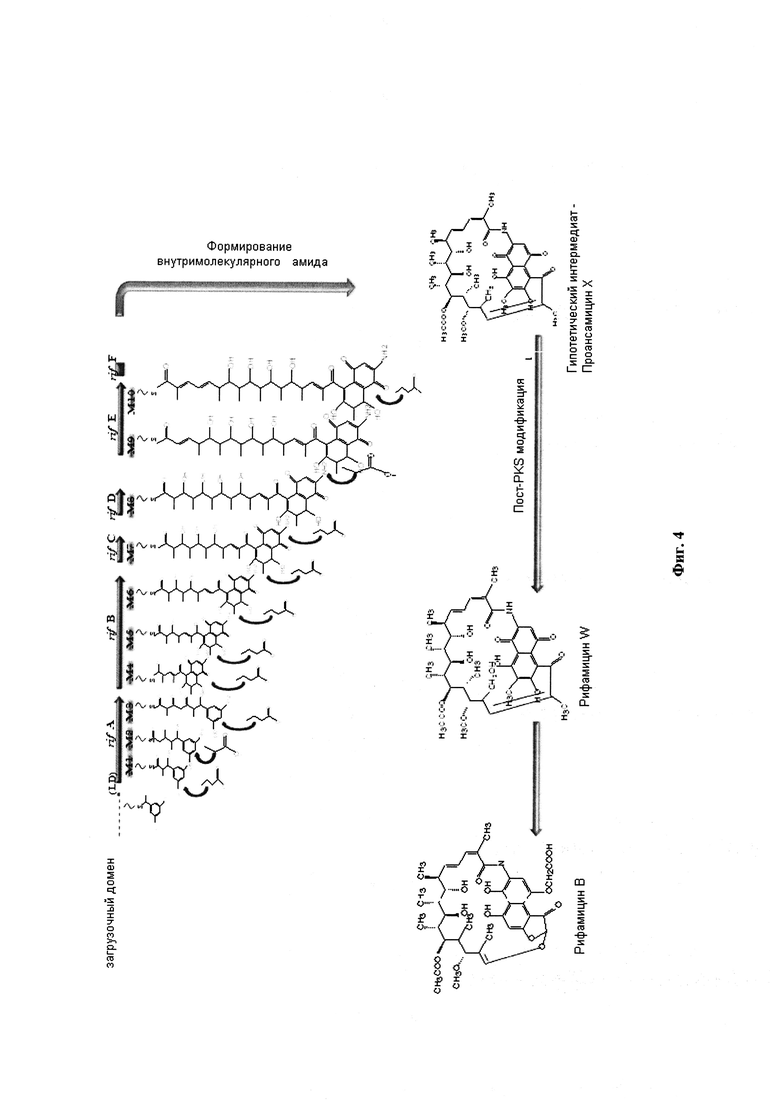
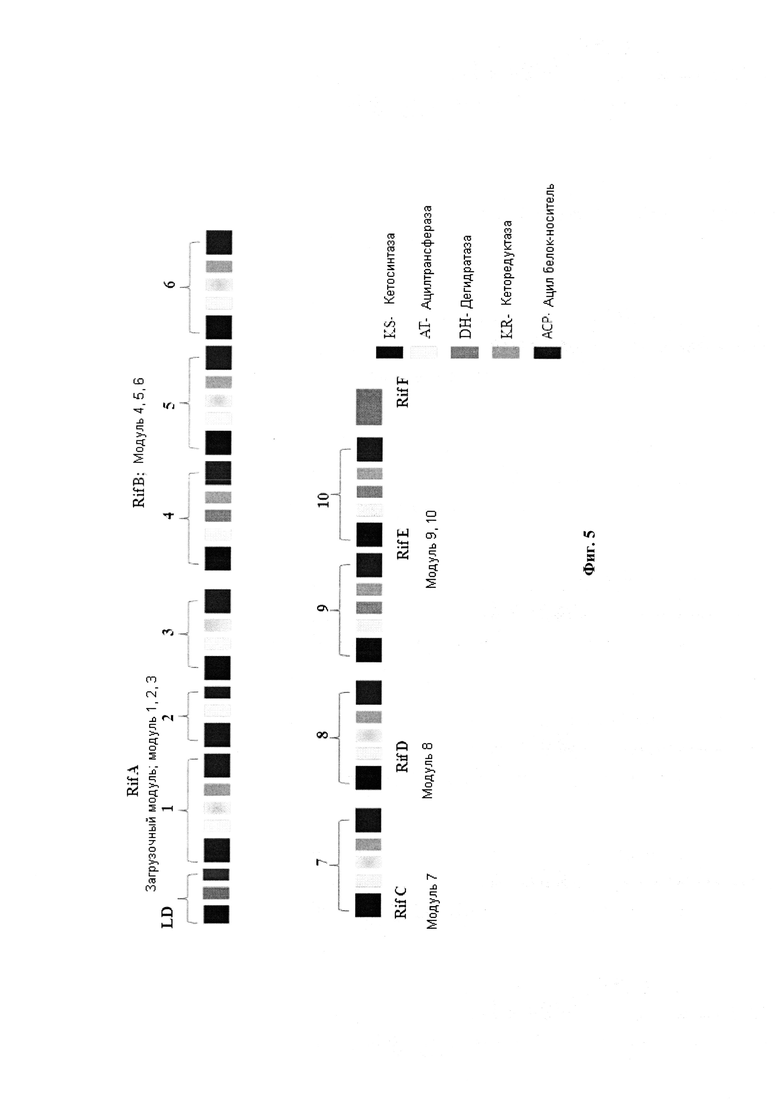
После открытия eryPKS и rapPKS кластера генов весь rifPKS кластер генов, 90 kbp [т.п.н. - тысяча пар нуклеотидов], ответственный за биосинтез рифамицина В, был клонирован из А. meditteranei S699 [August, P.R. et al. (1998). Chem Biol. Vol. 5, p. 69-71]. Биосинтетический кластер генов делится на четыре участка. Участок II (52 kb) является самым большим участком и кодирует модульные PKS. Этот участок делится на пять ORF - rifA, rifB, rifC, rifD и rifE. Участки ORF включают 10 модулей, которые располагаются коллинеарно в соответствии с их функцией в биосинтезе, они катализируют десять последовательных раундов удлинения поликетидный цепи с построением андекатетида [undecaketide] (Фигура 4). Ген rifA состоит из модулей 1-3, rifB из модулей 4-6, rifC из модуля 7, rifD из модуля 8 и rife из модулей 9-10. Порядок доменов в модулях - KS-кетосинтаза, АТ-ацилтрансфераза (необязательные восстановительные домены-DH-дегидратаза и KR-кеторедуктаза) и АСР-ацильный белок-носитель (Фигура 5). ER домен отсутствует в rifPKS. Гену rifA предшествует загрузочная единица, которая активирует пусковую единицу для инициирования образования поликетидной цепи. В rifPKS есть два класса AT доменов. AT домены, обнаруженные в модулях 2 и 9, катализируют внедрение ацетатных удлинительных единиц. Остальные восемь модулей имеют AT домены, которые катализируют внедрение пропионатных удлинительных единиц в растущую поликетидную цепь. Другой ген, RifF, присутствующий непосредственно после rifE, трансляционно соединяется с ней. Роль rifF заключается в циклизации и одновременно высвобождении поликетидной цепи из АСР домена модуля 10 [Stratmann, A. et al. (1999). Microbiol. Vol. 145, p. 3356-3375].
Образование фрагмента нафталина происходит между третьим и четвертым шагом удлинения цепи и не является пост PKS модификацией. Этот шаг был решающим в разработке стратегии обмена [swapping], которая выполняется в данном изобретении.
Применение производных рифамицина, особенно рифампицина, в клиниках привело к значительному снижению уровня смертности в связи с ТБ. Однако, сочетание плохого соблюдения и плохого медицинского надзора привело к появлению штаммов Mycobacterium tuberculosis с множественной лекарственной устойчивостью (MDR). В соответствии с докладом ВОЗ 2011 года - Борьба с туберкулезом в Юго-Восточной Азии [Tuberculosis Control in the South East Asia Region], в Индии зарегистрировано 2,3% случаев MDR-ТБ среди новых случаев ТБ. Структурная сложность рифамицина В, как упоминалось ранее, ограничивает использование химических средств только в отношении С-3 и С-4 молекулы. Это уменьшает количество перестановок и комбинаций измененных молекул, которые могут генерироваться с помощью химического синтеза. Существует настоятельная необходимость в производстве большего числа аналогов рифамицина для эффективного и экономичного лечения MDR-ТБ.
Полусинтетические производные рифамицина В, такие как рифампицин и рифабутин, широко используются в лечении туберкулеза (М. tuberculosis), проказы (М. leprae) и ассоциированных со СПИДом микобактериальных инфекций. Рифампицин впервые поступил на рынок в 1968 году. С тех пор он широко используется для лечения туберкулеза. Тем не менее, сочетание плохого соблюдения и плохого медицинского наблюдения привело к появлению штаммов М. tuberculosis с множественной лекарственной устойчивостью (MDR). Фармацевтические компании и медицинский мир сейчас находятся в поисках экономически выгодных лекарственных препаратов, которые будут эффективны против MDR-ТБ. Сложность химической структуры рифамицина В допускает химическое изменение, как указывалось выше, только на С-3 и С-4 ароматического ядра путем химических модификаций, которые используются в полной мере.
Другой опцией является комбинаторной биосинтез, который включает в себя перестановку/удаление/добавление модулей/доменов к существующему PKS кластеру генов в продуцирующих рифамицин организмах для создания необычного набора генов, которые могут продуцировать представляющие интерес молекулы. Генные кластеры поликетидной синтазы, которые имеют коллинеарное расположение, могут перетасовываться таким способом и демонстрируюти способность продуцировать аналоги эритромицина. Хотя в этом направлении была проделана большая работа на молекулах эритромицина (литература, приведенная в предыдущем разделе), нет никаких сообщений в отношении манипуляций с rifPKS. Поэтому в данной области существует потребность разработки представляющих интерес молекул с лучшей и более высокой степенью эффективности при лечении туберкулеза, а также разработки таких новых молекул, к которым ТБ бактерии не обладают устойчивостью.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Соответственно, основной вариант осуществления настоящего изобретения относится к антибактериальным соединениям и/или их солям, имеющим следующую химическую структуру:
и их солям.
Другой вариант осуществления настоящего изобретения относится к антибактериальным соединениям в соответствии с настоящим изобретением, которые пригодны против инфекции или заболевания, вызванных бактериями.
Другой вариант осуществления настоящего изобретения относится к антибактериальным соединениям в соответствии с настоящим изобретением, которые пригодны против инфекции или заболевания, вызванных видами Mycobacterium.
Другой вариант осуществления настоящего изобретения относится к антибактериальным соединениям в соответствии с настоящим изобретением, которые пригодны против инфекции или заболевания, вызванных видами Mycobacterium, где выбранные виды Mycobacterium представляют собой Mycobacterium tuberculosis и MDR-штаммы М. tuberculosis.
Еще один вариант осуществления настоящего изобретения относится к фармацевтической композиции, содержащей антибактериальные соединения и/или их соли, имеющие следующую химическую структуру:
вместе с их фармацевтически приемлемыми носителями.
Еще один вариант осуществления настоящего изобретения относится к способу лечения, включающему введение пациенту антибактериальные соединения и/или их соли, имеющие следующую структуру:
Еще один вариант осуществления настоящего изобретения относится к применению антибактериальных соединений и/или их солей, имеющих следующую химическую структуру, для лечения заболевания или инфекции
для получения лекарственного средства.
Другой вариант осуществления настоящего изобретения относится к применению лекарственного средства, содержащего антибактериальные соединения в соответствии с настоящим изобретением, для лечения заболевания или инфекции.
Еще один вариант осуществления настоящего изобретения относится к применению лекарственного средства, содержащего антибактериальные соединения в соответствии с настоящим изобретением, для лечения заболеваний или инфекции, вызванных бактериями.
Другой вариант осуществления настоящего изобретения относится к новому штамму Amycolatopsis mediterranei S699#34, содержащему участок гена rapAT2.
Еще один вариант осуществления настоящего изобретения относится к новому штамму Amycolatopsis mediterranei S699#34, в котором rifAT6 участок заменяется rapAT2 участком.
Другой вариант осуществления настоящего изобретения относится к новому штамму Amycolatopsis mediterranei S699#34, способному продуцировать аналоги и производные рифамицина В, содержащие следующую химическую структуру:
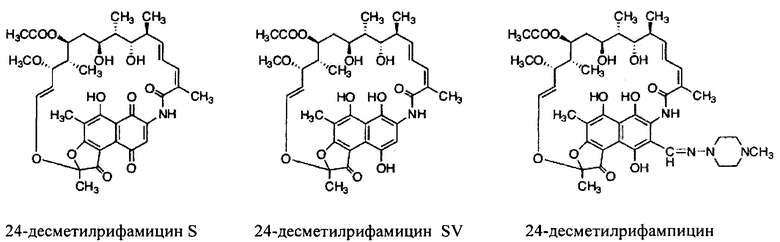
Другой вариант осуществления настоящего изобретения относится к способу получения нового штамма Amycolatopsis mediterranei S699, содержащего rapAT2 участок в rifPKS, причем указанный способ включает следующие этапы:
(a) выделение rifAT6 участка rifPKS из Amycolatopsis mediterrranei S699 и rapAT2 участка Streptomyces hygroscopicus (Согл. No. DSM - 41524);
(b) получение векторных конструкций путем замены rifAT6 участка rifPKS rapAT2 участком Streptomyces hygroscopicus (Согл. No. DSM - 41524);
(c) вставка векторных конструкций, полученных на этапе (b), в Amycolatopsis mediterranei S699; и
(d) получение нового штамма Amycolatopsis mediterrranei S699#34, содержащего rapAT2 участок в rifPKS.
Другой вариант осуществления настоящего изобретения относится к способу получения новых антибактериальных соединений, причем указанный способ включает следующие этапы:
(a) культивирование клеток Amycolatopsis mediterranei S699#34, содержащих rapAT2 участок в rifPKS участке; и
(b) сбор клеток Amycolatopsis mediterrranei S699#34 с получением сырых фракций продуктов;
(c) очистка сырых продуктов с помощью ВЭЖХ;
(d) получение антибактериальных соединений 24-десметилрифамицин В и 24-десметилрифамицин SV.
Другой вариант осуществления настоящего изобретения относится к способу получения 24-десметилрифамицина S, производного 24-десметилрифамицина В, причем указанный способ включает следующие этапы:
(а) вступление в реакцию 24-десметилрифамицина В в присутствии хлорида меди;
(b) осуществление реакции согласно этапу (а) в течение ночи при комнатной температуре;
(c) получение 24-десметилрифамицина S.
Способ получения 24-десметилрифампицина, производного 24-десметилрифамицина В, причем указанный способ включает следующие этапы:
(a) вступление в реакцию 24-десметилрифамицина В в присутствии диметилформамида (DMF) и уксусной кислоты;
(b) добавление параформальдегида и 1,3,5-триметил-гексагидро-1,3,5-триазина к смеси, полученной на этапе (а);
(c) получение 3-метил-1,3-оксазино(5,6-с)-24-десметилрифамицина;
(d) вступление в реакцию соединения, полученного на этапе (с), с 1-амино-4-метил-пиперазином; и
(e) получение 24-десметилрифампицина.
Другой вариант осуществления настоящего изобретения относится к рекомбинантной нуклеотидной последовательности ID No. 1.
Другой вариант осуществления настоящего изобретения относится к бактериальному штамму, содержащему нуклеотидную последовательность ID NO. 1.
Другой вариант осуществления настоящего изобретения относится к бактериальному/ым штамму/ам согласно описанию в настоящем изобретении, содержащему/им нуклеотидную последовательность ID NO: 1.
Другой вариант осуществления настоящего изобретения относится к бактериальному штамму согласно описанию в настоящем изобретении, в котором бактериальный штамм способен продуцировать аналоги рифамицина.
Другой вариант осуществления настоящего изобретения относится к векторным конструкциям, содержащим рекомбинантную нуклеотидную последовательность ID NO: 1.
Еще один вариант осуществления настоящего изобретения относится к векторным конструкциям, в котором векторные конструкции представляют собой рАТ6Е и pAT6F.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Эти и другие признаки, аспекты и преимущества настоящего изобретения станут более понятными из нижеследующего подробного описания со ссылкой на прилагаемые рисунки, на которых одинаковые символы представляют одинаковые детали на всех рисунках, из которых:
Фигура 1: Химические структуры рифамицина В.
Фигура 2: Полусинтетические производные рифамицина В.
Фигура 3: Схематичное представление поступательного механизма PKS типа 1.
Фигура 4: Синтез гипотетического интермедиата с помощью PKS рифамицина участка II.
Фигура 5: Организация энзимного домена в rifPKS кластере генов.
Фигура 6: Стратегия конструирования функциональной кассеты путем замены rifAT6 на rapAT2.
Фигура 7: Схематическое представление стратегии для демонстрации замены rifAT6 на rapAT2.
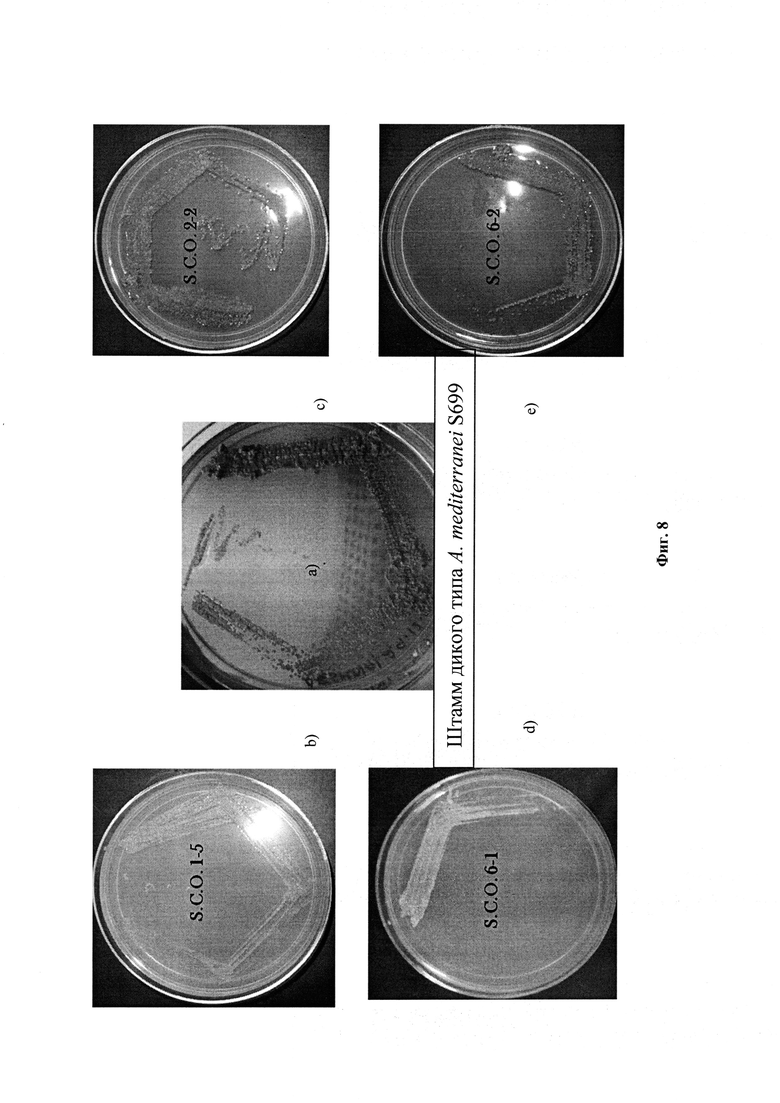
Фигура 8: Фенотипический вид культур, демонстрирующий одиночные кроссоверные клоны.
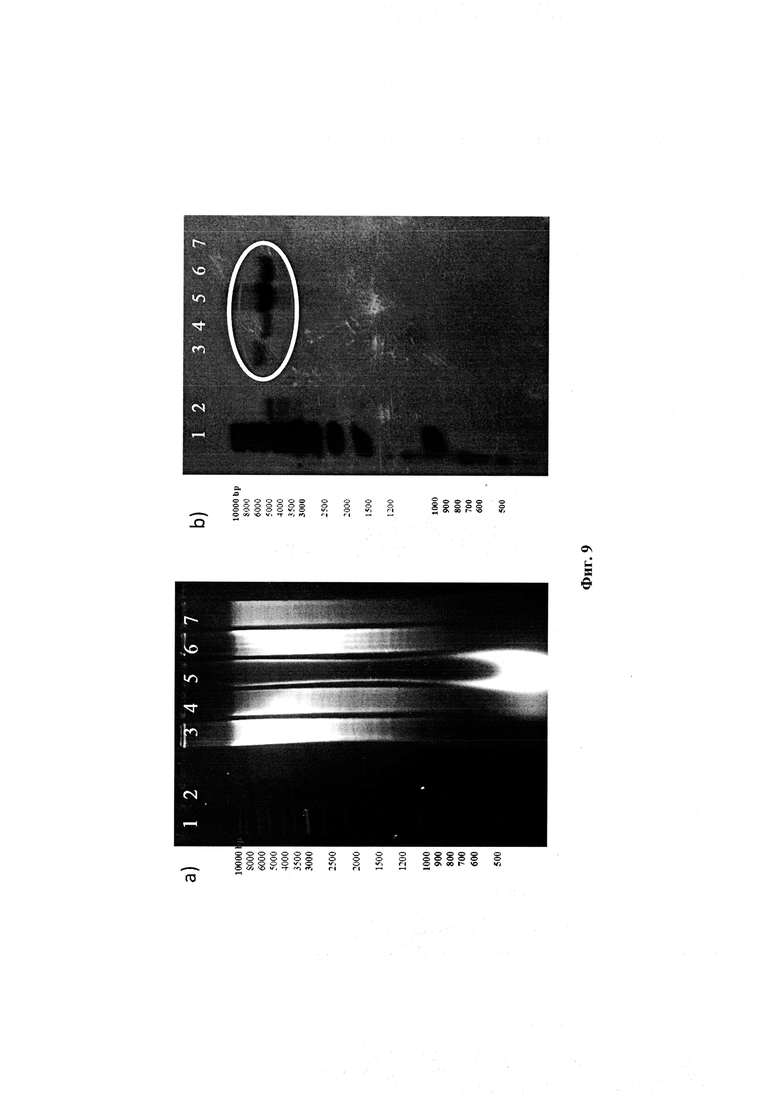
Фигура 9: Профиль гель-электрофореза для одиночных кроссоверных клонов.
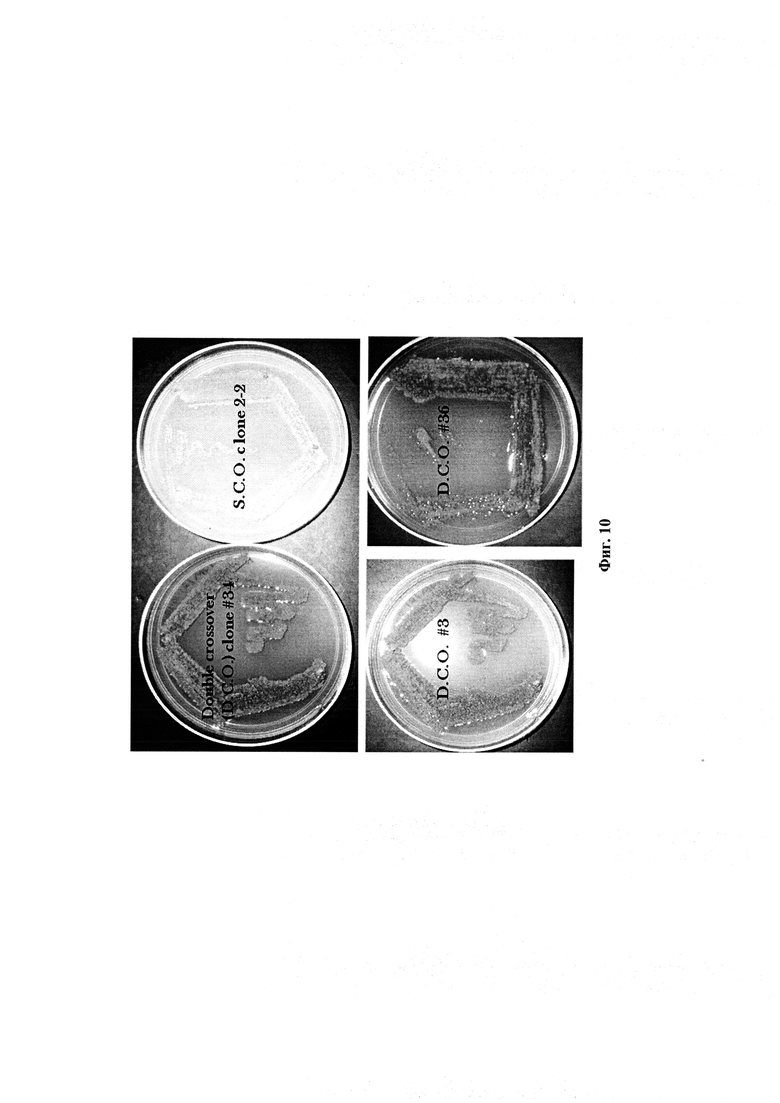
Фигура 10: Фенотипический вид культур, демонстрирующий сдвоенные кроссоверные клоны.
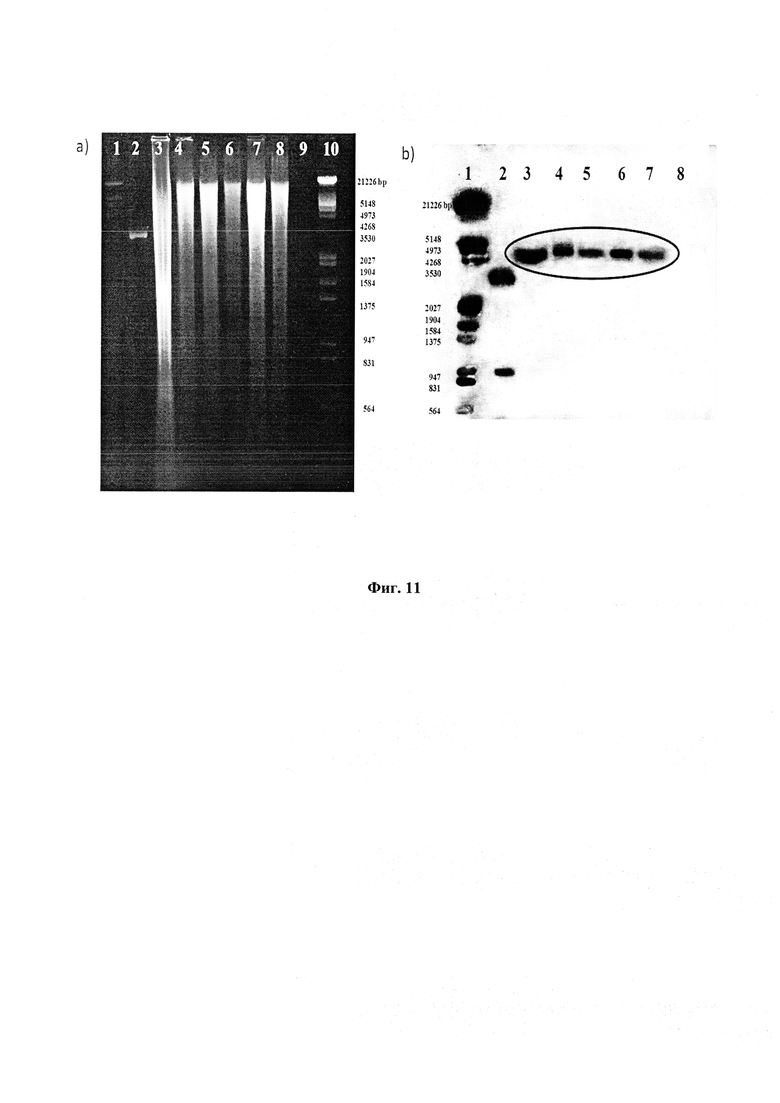
Фигура 11: Профиль гель-электрофореза для сдвоенных кроссоверных клонов.
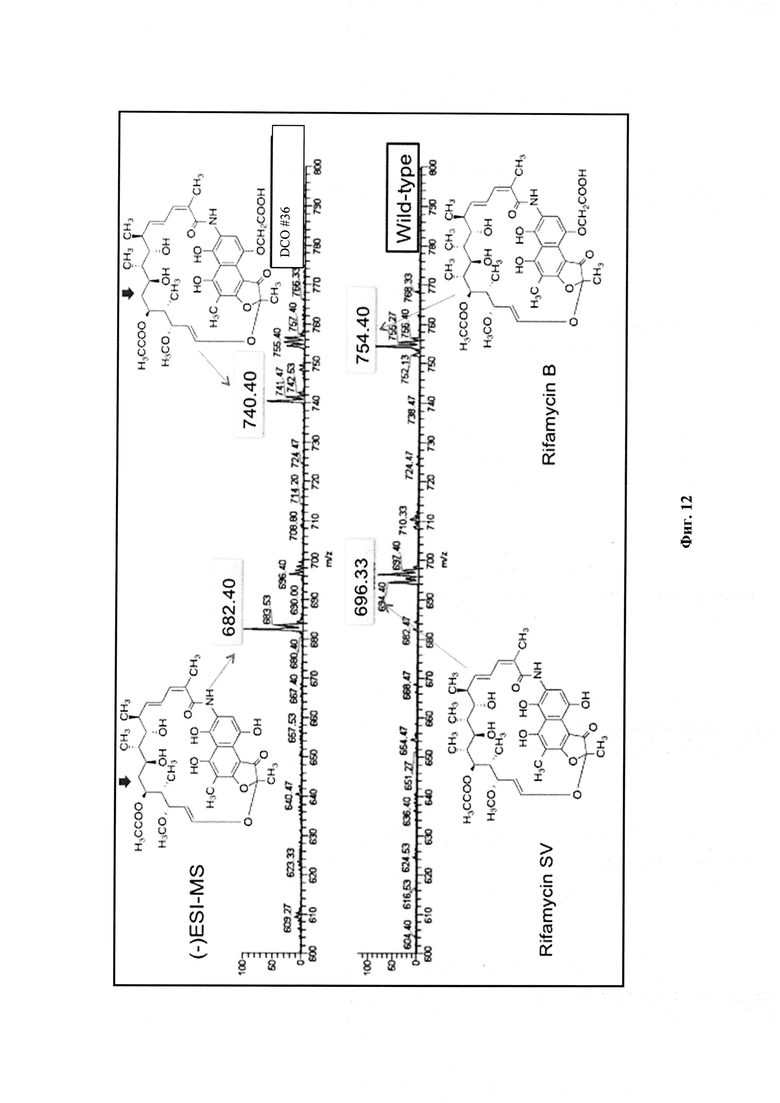
Фигура 12: LC-ESI-MS профиль аналога 24-десметилрифамицин В, извлеченного из DCO.
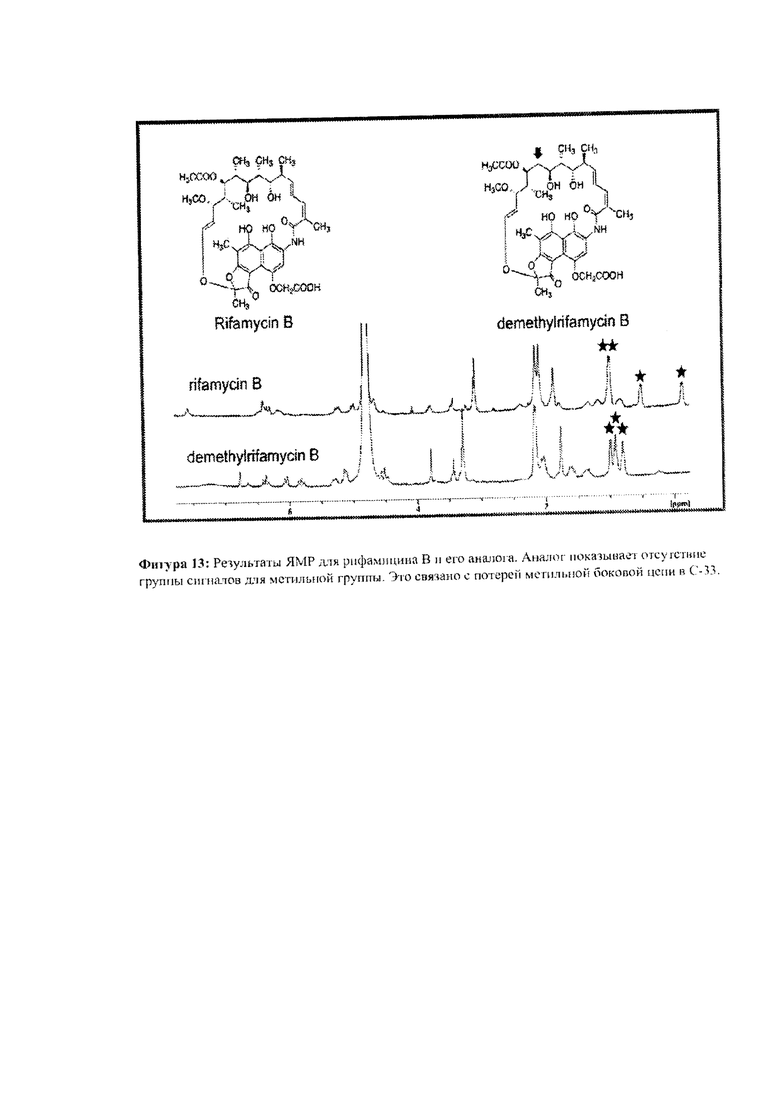
Фигура 13: ЯМР рифамицина В и его аналога.
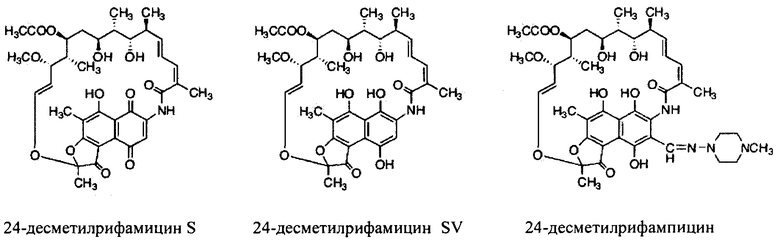
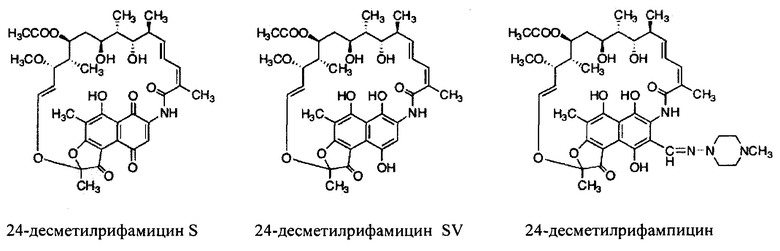
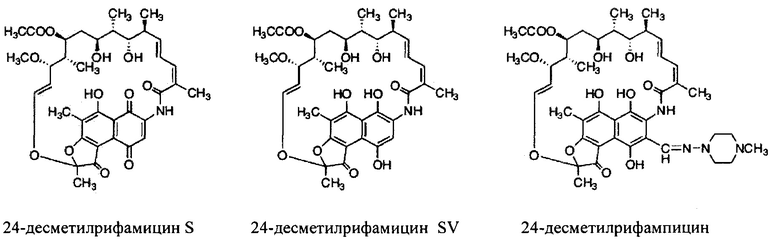
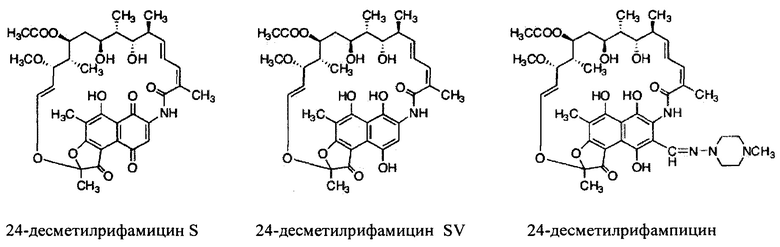
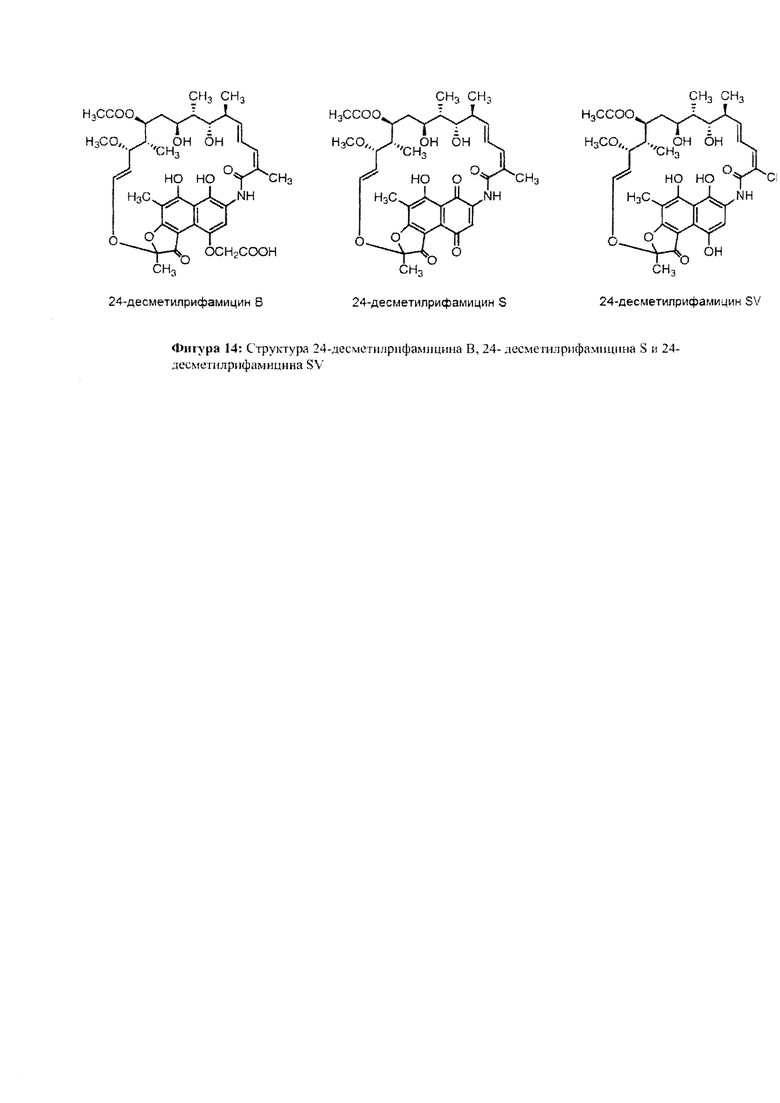
Фигура 14: Структуры 24-десметилрифамицина В, 24-десметилрифамицина S и 24-десметилрифамицина SV.
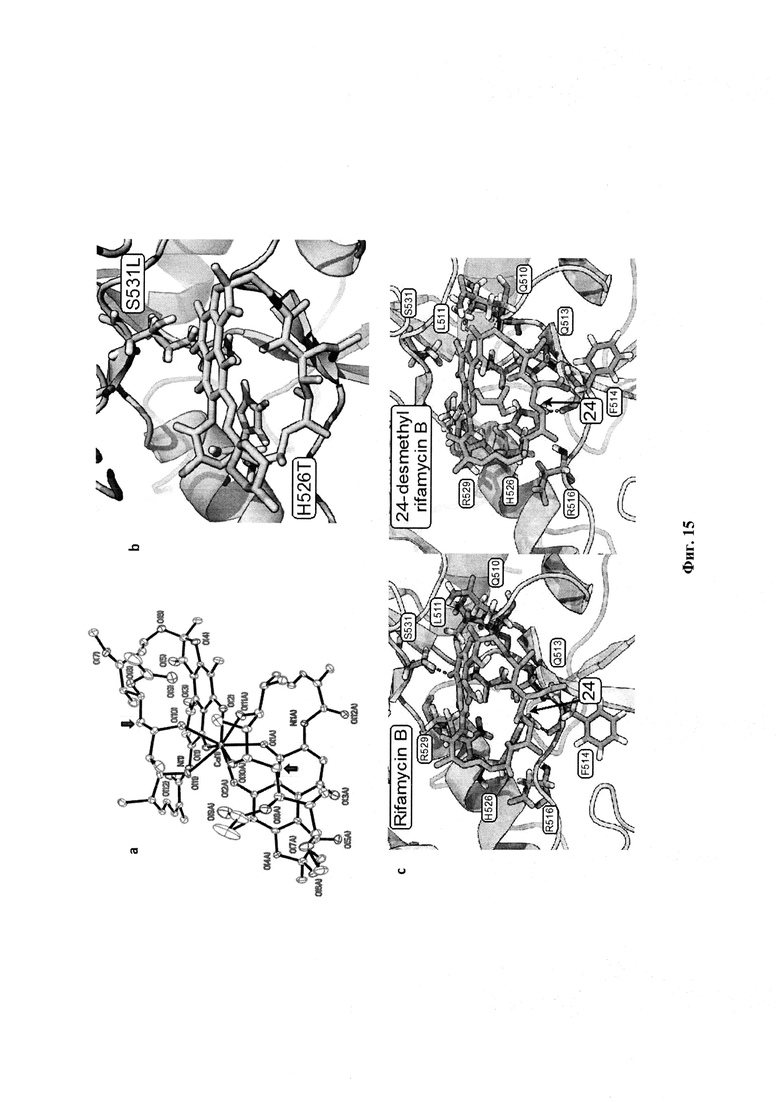
Фигура 15: Кристаллическая структура 24-десметилрифамицина S и лекарственное взаимодействие с ДНК полимеразой А.
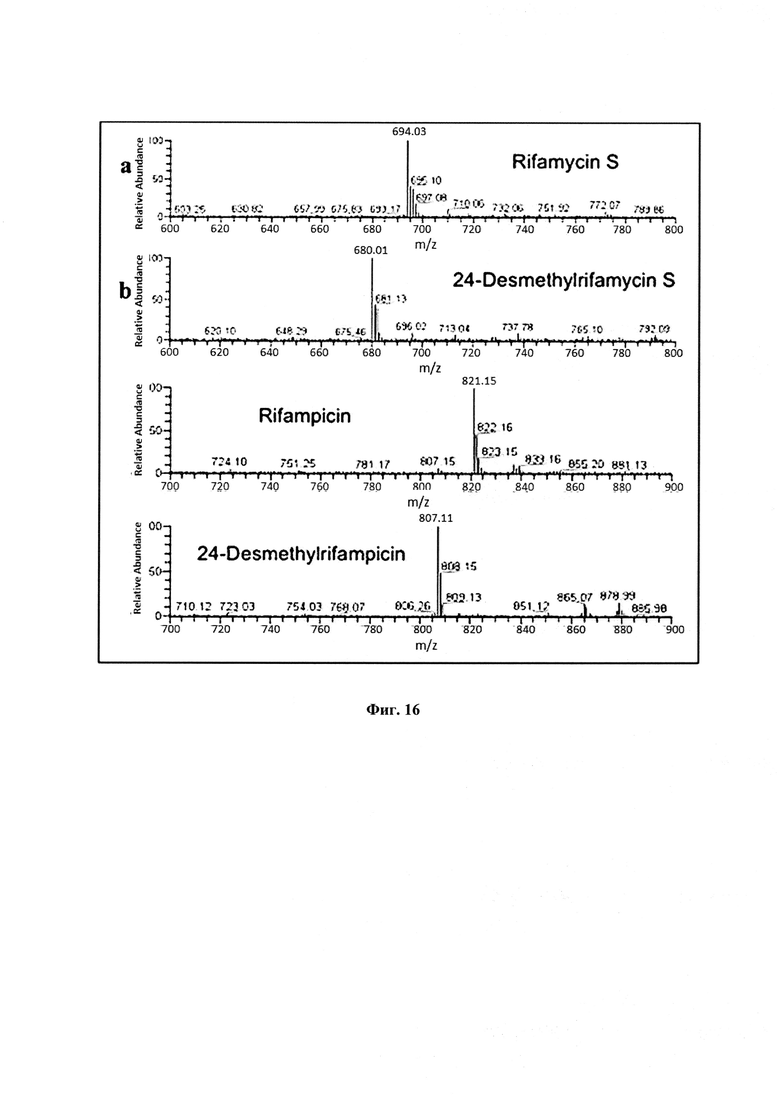
Фигура 16: Спектры ESI-MS [масс-спектрометрия и ионизация электрораспылением] (а) рифамицина S; (b) 24-десметилрифамицина S; (с) рифампицина; (d) 24-десметилрифампицина.
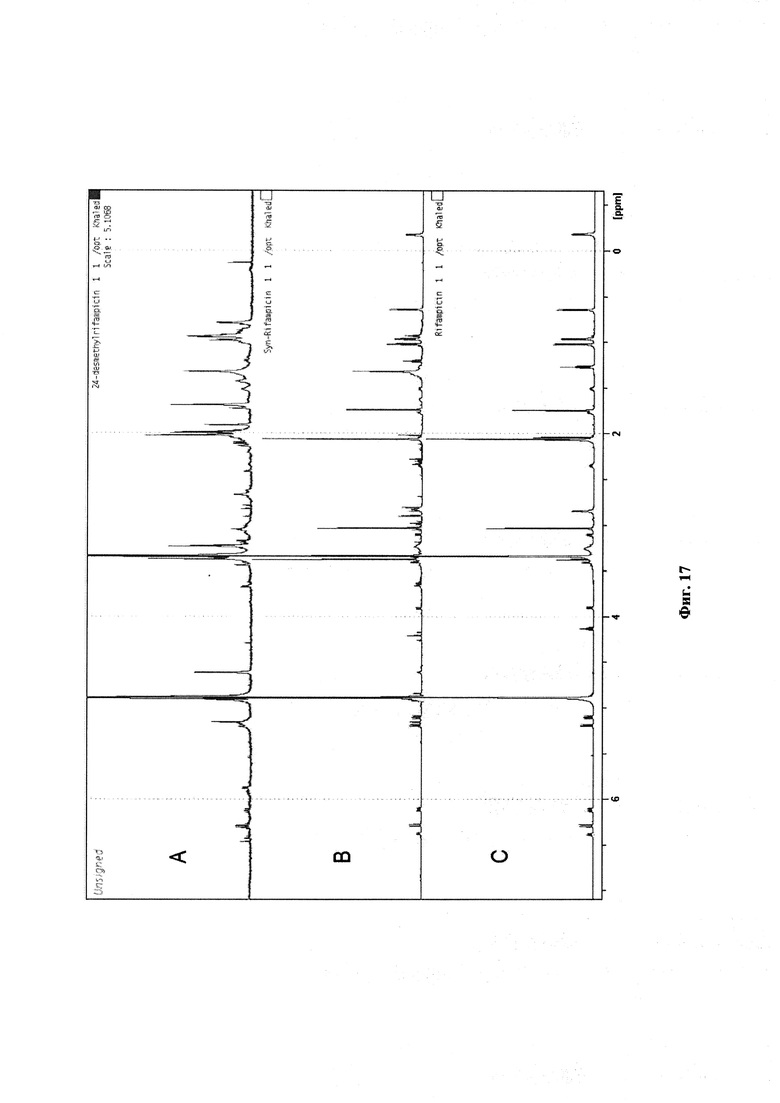
Фигура 17: Спектры ЯМР (а) 24-десметилрифампицина; (б) химически синтезированного рифампицина и (с) коммерчески доступного рифампицина.
Фигура 18: Сравнительный MS/MS анализ (а) 24-десметилрифампицина и (b) рифампицина.
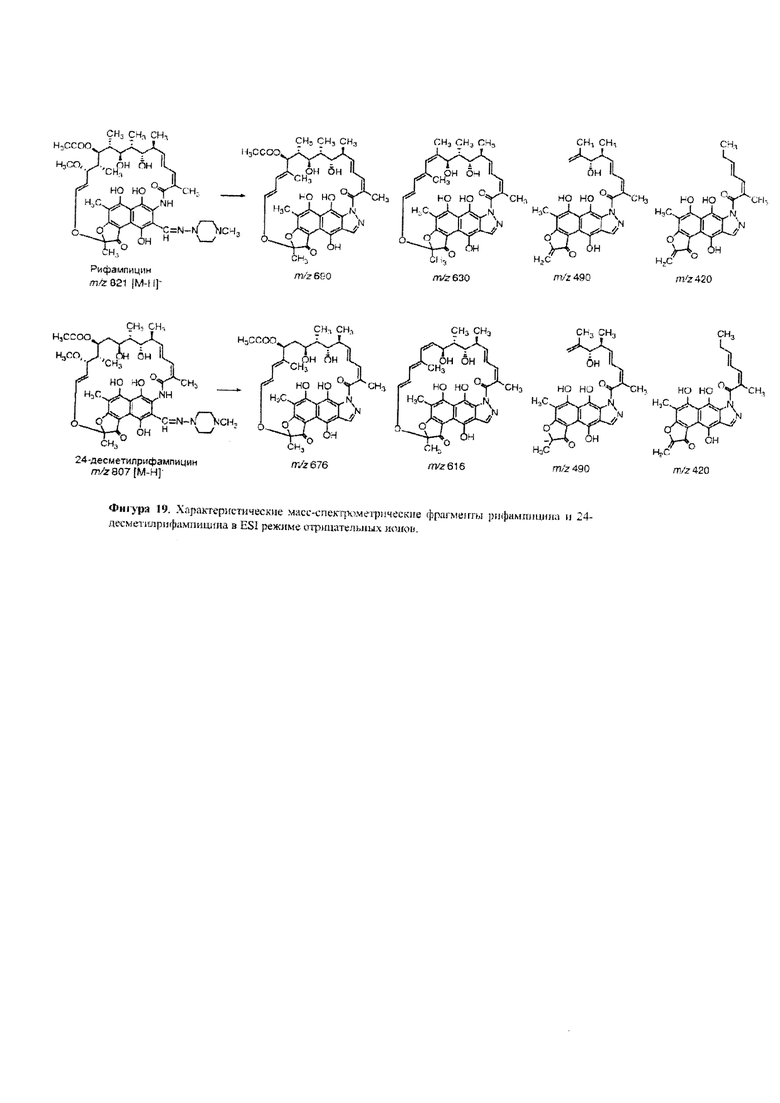
Фигура 19: Характеристические масс-спектрометрические фрагменты рифампицина и 24-десметилрифампицина в ESI [электрораспылительная ионизация] режиме отрицательных ионов.
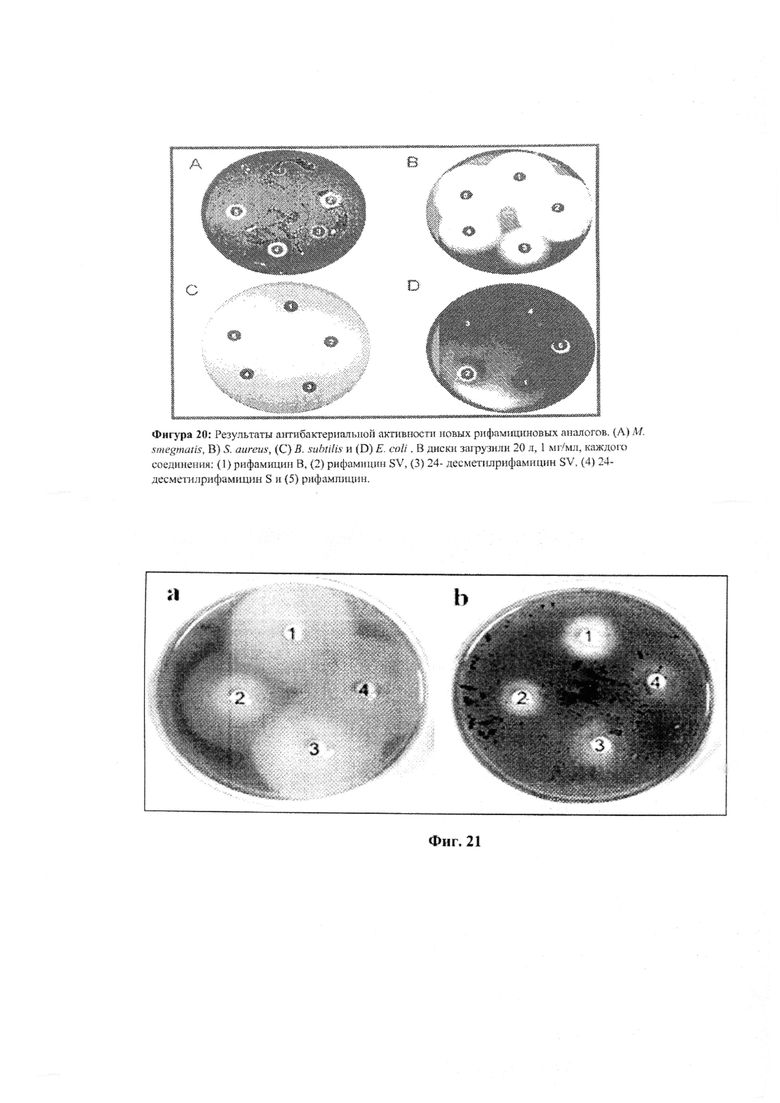
Фигура 20: Антибактериальный анализ новых аналогов рифамицина против различных видов бактерий.
Фигура 21: Антибактериальный анализ активности рифампицина, рифамицина S, 24-десметилрифампицина.
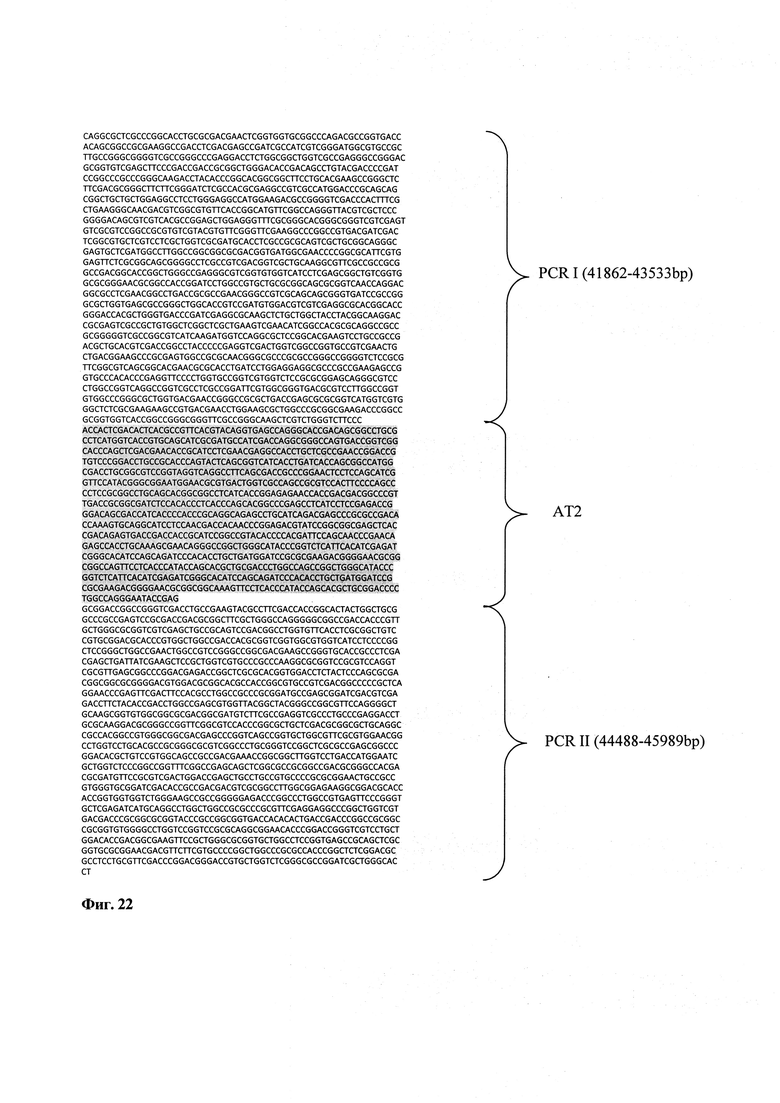
Фигура 22: Нуклеотидная последовательность ID No. 1.
ПОДРОБНОЕ ОПИСАНИЕ
Несмотря на то, что изобретение допускает различные модификации и/или альтернативные способы и/или композиции, конкретный вариант осуществления изобретения представлен в качестве примера на рисунках/фигурах и в таблицах и будет подробно описан ниже. Следует понимать, однако, что изобретение не ограничивается описанными конкретными способами и/или композициями, а наоборот, изобретение охватывает все модификации, эквиваленты и альтернативы, попадающие в пределы сущности и объема изобретения, как определено прилагаемой патентной формулой.
Графики, таблицы, формулы и протоколы представлены в соответствующих случаях с помощью обычных представлений на рисунках с демонстрацией только тех конкретных деталей, которые имеют отношение к пониманию вариантов осуществления настоящего изобретения, чтобы не затенять раскрытие подробностями, которые будут очевидны для обычных специалистов в данной области, имеющими преимущество данного описания.
Следующее описание представляет собой только иллюстративные варианты осуществления и не предназначено для ограничения объема, применимости или конфигурации изобретения каким-либо образом. Скорее, нижеследующее описание дает удобное пояснение для реализации иллюстративных вариантов осуществления настоящего изобретения. В описанные варианты осуществления могут быть внесены различные изменения в отношении функции и расположения описанных элементов без отступления от объема настоящего изобретения.
Термины «содержит», «содержащий» или любые другие их вариации, которые предназначены для охвата неисключительного указания, например, что один или несколько способов или композиций или систем или методов, действующих по определению «содержит…», не исключают, без дополнительных ограничений, существование других способов, подспособов, композиции, подкомпозиций, малых или крупных композиций или других элементов или других структур или дополнительных способов или композиций или дополнительных элементов или дополнительных признаков или дополнительных характеристик или дополнительных атрибутов.
Определения:
В целях данного изобретения, следующие термины будут иметь значение, как определено здесь:
Как используются здесь, термины «комбинаторный подход или комбинаторный биосинтез» при использовании в контексте настоящего изобретения относятся к генетической манипуляции с rifPKS кластером генов путем замены rifAT6 домена rifPKS кластера генов А. mediterranei S699 на rapAT2 домен rapPKS кластера генов Streptomyces hygroscopicus.
Как используются здесь, термины «векторы/клонирующие векторы» при использовании в контексте настоящего изобретения относятся к разработке серии векторов рАТ6А, рАТ6В, рАТ6С, pAT6D, рАТ6Е и pAT6F. Вектор pAT6F представляет собой нерепликативную плазмиду, которая была трансформирована в A. mediterranei S699.
Как используются здесь, термины «производные» при использовании в контексте настоящего изобретения относятся к производным, полученным или приготовленным из 24-десметилрифампицина В. Несколько примеров производных: 24-десметилрифампицин, 24-десметилрифамицин S и 24-десметилрифамицин SV.
Как используются здесь, термины «аналоги» при использовании в контексте настоящего изобретения относятся к аналогам рифамицина В, которые получают путем замены rifAT6 домена на rapAT2 домен или содержат rifAT6 домен, замененный rapAT2 доменом. Одним из таких иллюстративных аналогов является 24-десметилрифамицин В.
Как используются здесь, термины «мутант/ы или мутантный/ые штамм/ы» при использовании в контексте настоящего изобретения относятся к штамму/ам A. mediterraneiin, rifAT6 в домен которого заменен rapAT2 доменом системы PKS-1 и которые способны продуцировать аналоги и производные рифамицина В. Например: Amycolatopsis mediterranei #34, который продуцирует аналог, как например 24-десметилрифамицин В etc.
Как используется здесь, термин «антибактериальное/ые соединение/я» при использовании в контексте настоящего изобретения относится к композициям, которые способны ингибировать рост бактерий или инфекцию, вызванную бактериями, или заболевание, вызванное бактериями, или болезненное состояние, вызванное бактериями, принадлежащими к категории Actinobacteria или любым грамотрицательным бактериям или грамположительным бактериям. В частности, антибактериальные соединения, используемые в контексте настоящего изобретения, относятся к антибактериальным соединениям, эффективным при ингибировании роста бактерий, принадлежащих к видам Mycobacerium. Кроме того, антибактериальные соединения, используемые в контексте настоящего изобретения, относятся к таким антибактериальным соединениям, которые эффективны при ингибировании любого заболевания или любой инфекции или болезненного состояния, вызванных бактериями, принадлежащими к видам Mycobacerium.
Как используется здесь, термин «множественная лекарственная устойчивость/MDR» при использовании в контексте настоящего изобретения относится к состоянию, дающему возможность болезнетворным бактериям противостоять различным антимикробным или антибактериальным соединениям, т.е. химическим веществам с большим разнообразием структуры и функции, направленным на уничтожение бактерий. В частности, MDR в контексте настоящего изобретения относится к состояниям, дающим возможность болезнетворным видам Mycobacerium противостоять различным антибактериальным препаратам или антибактериальным соединениям, причем такими антибактериальными препаратами или антибактериальными соединениями являются это обычно используемые антибиотики или коммерчески доступные антибактериальные препараты или антибактериальные соединения.
Как используется здесь, термин «их соли» при использовании в контексте настоящего изобретения относится к любой соли, сложным эфирам, полиморфам, чистым формам, изомерам, смесям изомеров, комплексам и любым другим производным или аналогам 24-десметилрифамицина В, 24-десметилрифамицина S, 24-десметилрифамицина SV и 24-десметилрифампицина. Более заслуживающие внимания их соли, такие как соль, сложные эфиры, полиморфы, чистые формы, изомеры, смеси изомеров, комплексы и любые другие производные, должны по меньшей мере содержать 24-десметил-форму или структуру, т.е. терять метальную группу в позиции 24 в аналогах, производных, солях, сложных эфирах, полиморфах, чистых формах, изомерах, смесях изомеров, комплексах 24-десметилрифамицина В, 24-десметилрифамицина S, 24-десметилрифамицина SV и 24-десметилрифампицина.
Настоящее изобретение относится к антибактериальным соединениям, которые могут быть эффективными против бактериального заболеваний или инфекции. Более конкретно, настоящее изобретение относится к применению антибактериальных соединений, которые могут эффективно использоваться против инфекции или заболевания, вызванных бактериями группы грамположительных бактерий, подпадающих под категорию Actinobacteria. Антибактериальные соединения в соответствии с настоящим изобретением пригодны против бактерий с множественной лекарственной устойчивостью. Антибактериальные соединения в соответствии с настоящим изобретением пригодны против таких бактерий, как виды Mycobacterium, виды или штаммы Staphylococcus, виды или штаммы Bacillus, виды или штаммы Pseudomonas и штаммы Ecoli.
Кроме того, настоящее изобретение относится к антибактериальным соединениям, которые пригодны против инфекции или заболевания, вызванных видами Mycobacterium. В частности, эти антибактериальные соединения эффективны против Mycobacterium tuberculosis, Mycobacterium leprae и Mycobacterium smegmatis. Другой аспект настоящего изобретения предусматривает антибактериальные соединения, которые пригодны против штаммов видов микобактерий с множественной лекарственной устойчивостью.
Рифамицин был выделен в качестве родственного соединения рифамицинового комплекса [SensiP. et al. (1983). Farmac. Ed. Sc. Vol. 14, p. 146-147), и rifPKS был полностью секвенирован в 1998 году [August, P.R. et al. (1998) Chem. Biol. Vol. 5, p. 69-79]. С тех пор был проведен целый ряд исследований для выяснения функции генного кластера и структуры, а также действия рифамицина В. Однако, уникальная природа rifPKS в получении рифамицина В мешала прогрессу в получении аналогов рифамицина В в течение длительного времени. До этого было трудно генетически манипулировать с rifPKS бактерий A. mediterranei, поскольку для A. mediterranei не было продуктивных генетических технологий и клонирующих векторов. С тех пор одним из авторов настоящего изобретения уже разработана серия клонирующих векторов (PRL серия), которые могут использоваться для трансформации и клонирования нескольких штаммов A. mediterranei [Lal, R., US 5985560 A (1999); Lal, R. et al. (1991). Appl. Environ. Microbiol. Vol. 57, p. 665-671; Dhingra, G. et al. (2003). Ind. Microbiol. Biotecnol. Vol. 30, p. 195-204] и разработанный таким образом метод электротрасформации используется для манипулирования с rifPKS кластером генов для получения аналогов рифамицина. Манипуляции с rifPKS также были основаны на модульной природе поликетидных синтаз эритромицина (eryPKS) и рапамицина (rapPKS), что породило значительный интерес в прошлом к получению новых биоинженерных поликетидов. Хотя eryPKS и rapPKS были клонированы ранее, клонирование и определение характеристик рифамицинового биосинтетического кластера генов или rifPKS в 1998 году [August, P.R. et al. (1998). Chem. Biol. Vol. 5, p. 69-79] открыли возможности манипулирования с rifPKS кластером генов для получения аналогов рифамицина за счет испольования таких же подходов, которые были использованы для eryPKS. В настоящем изобретении был использован комбинаторный подход, в котором для получения аналогов рифамицина В выполняются генетические манипуляции с кластером рифамицинполикетидной синтазы (rifPKS) A. mediterranei S699.
Хотя в последние сорок лет многие производные рифамицина были синтезированы химическими методами, только небольшая группа производных рифамицина в настоящее время используется для лечения туберкулеза. Большинство производных рифамицина, включая применяемые в клиниках, химически модифицированы в позициях С-3 и/или С-4 нафталинового фрагмента. Химические модификации других частей соединения оказались трудными из-за комплексного строения молекулы. Кроме того, исследования с помощью рентгеновской кристаллографии РНК-полимеразы Thermusaquaticus, образующей комплекс с рифампицином, показали, что четыре свободные гидроксильные группы в молекуле важны для связывания РНК-полимеразы [Campbell, Е.A. et al. (2001). Cell. Vol. 104, p. 901-912]). Следовательно, модификации этих гидроксильных групп нежелательны. В связи с вышеизложенным, настоящее изобретение является уникальным в той мере, что в нем предлагается стратегия разработки новых аналогов и производных, в которых происходят модификации в скелете поликетида.
В настоящем изобретении разработаны мутанты A. mediterranei S699 для получения аналога рифамицина В, 24-десметилрифамицина В, что также является доказательством концепции комбинаторного биосинтеза, что дает начало для получения разнообразных аналогов рифамицина В с помощью этого подхода. Производные этого аналога эффективны против MDR-штаммов бактерий М. tuberculosis. Еще более важно то, что данное изобретение впервые приводит подтверждение концепции, что для получения аналогов рифамицина В с помощью комбинаторных подходов можно выполнять манипуляции с rifPKS кластером генов за пределами модуля 4. Мутантный штамм теперь можно усовершенствовать для коммерческого применения.
Соответственно, в настоящем изобретении предлагается стратегия комбинаторного биосинтеза для манипуляций с rifPKS A. mediterranei S699. Таким образом, разработанная стратегия в соответствии с настоящим изобретением позволяет осуществлять замену ацилтрансферазного домена шестого модуля (АТ6) в rifPKS (который рекрутирует пропионат) таким же ацилтрансферазным доменом второго модуля rapPKS (rapAT2 из Streptomyces hygroscopicus (под инвентарным номером: Х86780.1 и DSM коллекция культур-DSM 41524) (который рекрутирует ацетат) в растущую цепь. Обмен этими участками привел к разработке и получению нового аналога рифамицина В, который представляет собой 24-десметилрифамицин В. Кроме того, в настоящем изобретении также предлагается стратегия разработки производных 24-десметилрифамицина В. Таким образом, было установлено, что разработанные новые аналоги и производные эффективны против различных видов бактерий (Фигуры 20-21). Более конкретно эти новые аналоги и производные оказались эффективными против MDR-штаммов М. tuberculosis.
Несмотря на известный факт, что сложные поликетидные системы, подобные rifPKS, считаются мало поддающимися улучшению с помощью метаболической инженерии по своей природе либо из-за негибкости энзимов в прямом направлении воспринимать модифицированные субстраты, либо из-за несоответствия архитектурной модульной структуры модифицированных PKS систем [Khosla, С. et al. (2009). Curr. Opin, Chem.. Biol. Vol. 13, p. 135-143], настоящее изобретение не только указывает способы, как объяснить и распутать существующий недостаток rifPKS системы, но и дает аналоги и производные, высоко эффективные против известных и/или устойчивых штаммов микобактерий. Таким образом, для решения существующей проблемы неисправимой природы системы rifPKS использованы этапы синтеза скелета поликетида рифамицина, особенно нафтохиноновое кольцо, целью был rifAT6 участок гена rifPKS. Этот rifAT6 участок кластера генов rifPKS был заменен на rapAT2 с использованием стратегии замены домена. В результате получился новый аналог рифамицина, т.е. 24-десметилрифамицин В, кроме того, его производные, а именно 24-десметилрифамицин S, 24-десметилрифамицин SV и 24-десметилрифампицин.
Эти аналоги 24-десметилрифамицина В и его производные, 24-десметилрифамицин SV, 24-десметилрифамицин S & 24-десметилрифампицин, были не только получены в сопоставимых количествах, но также показали более сильную антибактериальную активность против Staphylococcus aureus, Mycobacterium smegmatis, Bacillus subtillis, Pseudomonas aeruginosa, Escherichia coli.
В настоящем изобретении также предлагаются мутантные штаммы A. mediterranei S699, которые способны продуцировать аналог/и рифамицина В, т.е. 24-десметилрифамицина В. Настоящее изобретение также предусматривает способ разработки мутантных штаммов А. mediterranei S699. Было установлено в настоящем изобретении, что штаммы A. mediterranei S699 оказались достаточно устойчивыми при мультиплицировании, а также при экспрессии аналогов рифамицина В. Аналог из этих мутантов получили в лабораторных масштабах. Выход продукта составил примерно 50 мг/л аналогового 24-десметилрифамицина В.
Исследования ЯМР аналогов, полученных из мутантных штаммов A. mediterranei S699, показывают, что существует значительная разница в профилях ЯМР рифамицина В и 24-десметилрифамицина В (Фигура 13). Профили ЯМР показывают, что 24-десметилрифамицин В имеет квази-молекулярные ионы с отношением m/z 740, а 24-десметилрифамицин SV соотношение m/z 682, что на 14 атомных единиц массы меньше, чем у рифамицина В и рифамицина SV.
Устойчивость рифамицина связана с генетическими изменениями в 81 - bp участке гроВ гена, кодирующего β-субъединицу ДНК-зависимой РНК-полимеразы (Williams et al. 1998. Mycobacterium tuberculosis. Antimicrob. Agents. Chemother., Vol. 42, pages 1853-1857). В настоящем изобретении используются рифампицин-устойчивые штаммы М. tuberculosis, OSDD 321 и 206 OSDD, которые содержат S531L мутацию, и OSDD 55, который имеет Н526Т мутацию в β-субъединице РНКП. Мутации были подтверждены в штаммах OSDD. На основе данных о последовательности, настоящее изобретение устанавливает, что лекарственно-устойчивые мутации разрушают водородное связывание в поликетидной анса-цепи и в возможном солевом мостике (Фигура 15b). Потеря метальной группы в 24-десметилрифампицине, однако, может привести к конформационным изменениям в анса-цепи, что обеспечит более высокую гибкость соединения связываться с мутированными РНК-полимеразами. Соответственно, считается, что в дополнение к выгодному коэффициенту распределения, гибкость, возникающая в результате разницы в гош, син пентан, и заслоненных взаимодействиях анса-цепи, и изменения в сети водородного связывания, ассоциированных с конформационными изменениями (Фигура 15c), позволяют увеличить аффинность связывания как в штаммах дикого типа, так и в лекарственно-устойчивых штаммах. Эта возможная конформационная гибкость также может быть связана с неурегулированными 1H и 13С спектрами ЯМР 24-десметилрифампицина. В связи с вышеизложенным, настоящее изобретение предлагает самый неожиданный и уникальный вывод в настоящем изобретении - активность 24-десметилрифампицина против рифампицин-устойчивых штаммов М. tuberculosis. 24-десметилрифампицин показал более высокую активность против рифампицин-устойчивых штаммов М. tuberculosis. Таким образом, этот вывод в настоящем изобретении открывает абсолютную надежду для пациентов, страдающих от туберкулеза, где микобактерии стали устойчивыми к существующему рифампициновому лекарственному препарату или родственным препаратам. Эти результаты были подтверждены вычислительными исследованиями возмущения свободной энергии (FEP), которые продемонстрировали, что РНК-полимераза предпочитает 24-десметилрифамицин В на 1,2 ккал/моль, чем рифамицин В (Таблица 1). Это важно, потому что это соединение может теперь разрабатываться в качестве перспективного шага в лечении MDR-ТБ.
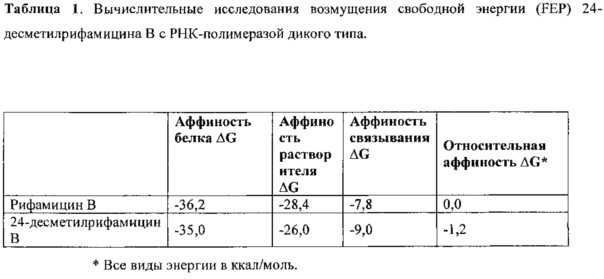
Таким образом, настоящее изобретение демонстрирует создание новых аналогов и производных рифамицина В, показывая впервые, что rifPKS поддается модификации замены домена, приводящей к образованию нового аналога рифамицина.
В настоящем изобретении предлагается уникальная рекомбинантная последовательность ID No. 1 (Фигура 22), которая способна продуцировать аналоги рифамицина. В настоящем изобретении также предлагается векторная конструкция, содержащая рекомбинантную последовательность ID No. 1.
В настоящем изобретении предлагается новый штамм Amycolatopsis mediterranei S699#34, несущий нуклеотидную последовательность ID No.l. Более конкретно, новый штамм имеет идентификационный номер Amycolatopsis mediterranei S699#34, несущий рекомбинантную последовательность ID No. l (Фигура 22), которая обеспечивает штаммы уникальной характеристикой, и эта уникальная особенность позволяет новым штаммам экспрессировать или продуцировать аналоги рифамицина, такие как 24-десметилрифамицин В и 24-десметилрифамицин S.
В настоящем изобретении также предлагаются фармацевтические композиции антибактериальных соединений и их солей, описанных в настоящем изобретении, которые эффективны против бактериальных видов, в частности, микобактерий. Фармацевтическая композиция в соответствии с настоящим изобретением предназначена для парентерального и перорального введения. Предпочтительно, фармацевтическую композицию, описанные в настоящем изобретении, можно вводить парентерально, например, внутривенно, подкожно, внутрикожно или внутримышечно. В настоящем изобретении также предлагаются агенты, которые действуют как «фармацевтически приемлемый наполнитель», причем термин «фармацевтически приемлемый наполнитель» означает носитель фармацевтически приемлемого состава, раствор или добавку для обеспечения возможности доставки, растворения или суспендирования антибактериальных соединений, как описано здесь. Фармацевтическая композиция в соответствии с настоящим изобретением может также содержать фармацевтически приемлемые вспомогательные вещества, как требуется для приближения к физиологическим условиям, таким как регулирование рН, и буферные агенты, регулирующие тоничность агенты, увлажняющие агенты и тому подобное. Фармацевтическая композиция в соответствии с настоящим изобретением может также содержать фармацевтически приемлемые носители, например адъюванты, etc. Фармацевтические композиции в соответствии с данным изобретением также можно вводить в любой удобной форме, например в виде таблетки, капсулы, инъекции, в форме гранул или порошка, например, в саше.
Настоящее изобретение будет пояснено далее со ссылкой на неограничивающие варианты осуществления изобретения.
Соответственно, основной вариант осуществления настоящего изобретения относится к антибактериальным соединениям, имеющим следующую химическую структуру:
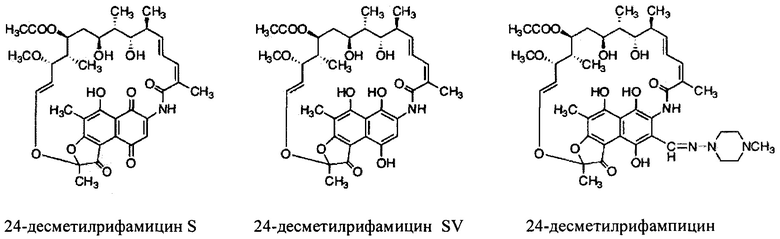
и их солям.
Другой вариант осуществления настоящего изобретения относится к антибактериальным соединениям в соответствии с настоящим изобретением, которые пригодны против инфекции или заболевания, вызванных бактериями.
Другой вариант осуществления настоящего изобретения относится к антибактериальным соединениям в соответствии с настоящим изобретением, которые пригодны против инфекции или заболевания, вызванных видами Mycobacterium.
Другой вариант осуществления настоящего изобретения относится к антибактериальным соединениям в соответствии с настоящим изобретением, которые пригодны против инфекции или заболевания, вызванных видами Mycobacterium, где выбранные виды Mycobacterium представляют собой Mycobacterium tuberculosis и MDR-штаммы М. tuberculosis.
Еще один вариант осуществления настоящего изобретения относится к фармацевтической композиции, содержащей антибактериальные соединения или их соли, имеющие следующую химическую структуру:
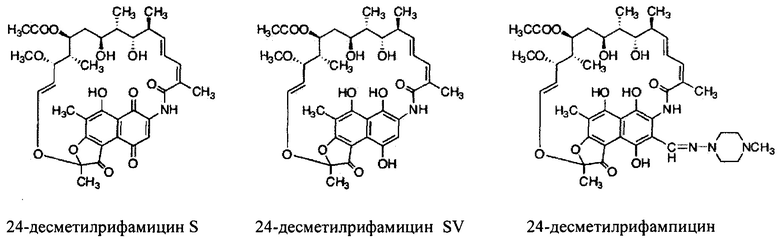
вместе с их фармацевтически приемлемыми носителями.
Другой вариант осуществления настоящего изобретения относится к фармацевтической композиции, содержащей антибактериальные соединения в соответствии с настоящим изобретением, которые пригодны против инфекции или заболевания, вызванных бактериями.
Другой вариант осуществления настоящего изобретения относится к фармацевтической композиции, содержащей антибактериальные соединения в соответствии с настоящим изобретением, которые пригодны против инфекции или заболевания, вызванных видами Mycobacterium.
Еще один вариант осуществления настоящего изобретения относится к фармацевтической композиции, содержащей антибактериальные соединения в соответствии с настоящим изобретением, которые пригодны против инфекции или заболевания, вызванных Mycobacterium tuberculosis и MDR-штаммами М. tuberculosis.
Еще один вариант осуществления настоящего изобретения относится к способу лечения, включающему введение пациенту антибактериальные соединения или их соли, имеющие следующую структуру:
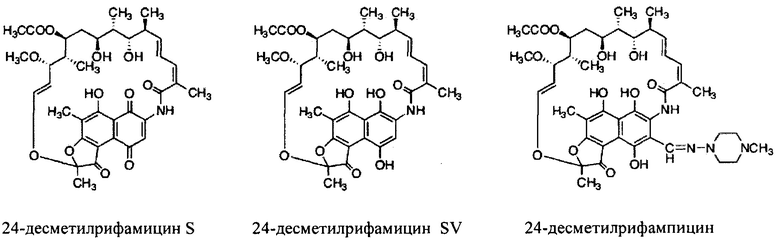
Еще один вариант осуществления настоящего изобретения относится к применению антибактериальных соединений или их солей, имеющих следующую химическую структуру, для лечения заболевания или инфекции.
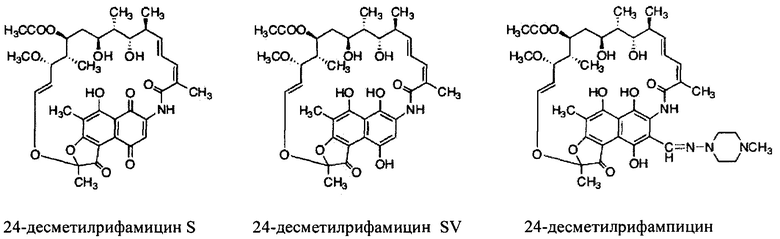
для получения лекарственного средства.
Еще один вариант осуществления настоящего изобретения относится к применению антибактериальных соединений или их солей, имеющих следующую химическую структуру:
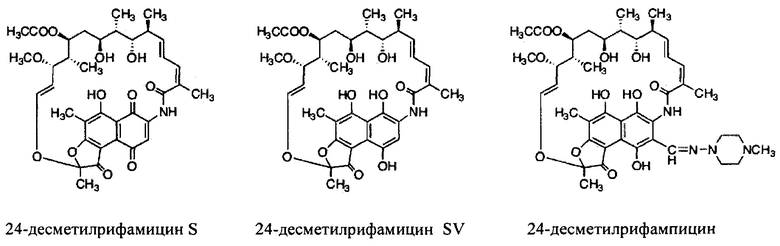
для получения лекарственного средства.
Другой вариант осуществления настоящего изобретения относится к применению лекарственного средства, содержащего антибактериальные соединения по настоящему, изобретению, для лечения заболевания или инфекции.
Еще один вариант осуществления настоящего изобретения относится к применению лекарственного средства, содержащего антибактериальные соединения в соответствии с настоящим изобретением, для лечения заболеваний или инфекции, вызванных бактериями.
Другой вариант осуществления настоящего изобретения относится к применению лекарственного средства, содержащего антибактериальные соединения в соответствии с настоящим изобретением, для лечения заболеваний или инфекции, вызванных видами Mycobacterium.
Еще один вариант осуществления настоящего изобретения относится к применению лекарственного средства, содержащего антибактериальные соединения в соответствии с настоящим изобретением по п. 10 или 13, для лечения заболеваний или инфекции, вызванных видами Mycobacterium, Mycobacterium tuberculosis и MDR-штаммами М. tuberculosis.
Другой вариант осуществления настоящего изобретения относится к способу получения фармацевтической композиции, содержащей антибактериальные соединения в соответствии с настоящим изобретением, вместе с фармацевтически приемлемым/ыми носителем/ями.
Другой вариант осуществления настоящего изобретения относится к новому штамму Amycolatopsis mediterranei S699#34, содержащему rapAT2 участок гена.
Еще один вариант осуществления настоящего изобретения относится к новому штамму Amycolatopsis mediterranei S699#34, где rifAT6 участок заменен rapAT2 участком.
Еще один вариант осуществления настоящего изобретения относится к новому штамму Amycolatopsis mediterranei S699#34, способному продуцировать новые аналоги и производные рифамицина В, например, как описано здесь.
Другой вариант осуществления настоящего изобретения относится к новому штамму Amycolatopsis mediterranei S699#34, способному продуцировать аналоги и производные рифамицина В, содержащему следующую химическую структуру:
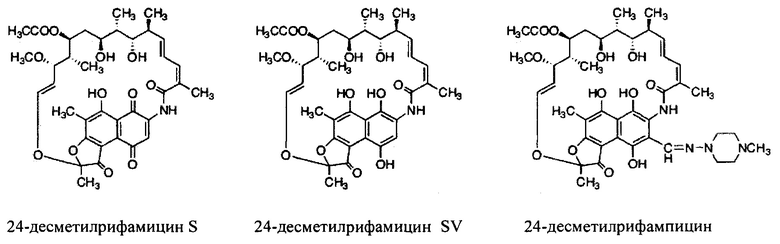
Другой вариант осуществления настоящего изобретения относится к способу получения нового штамма Amycolatopsis mediterranei S699#34, содержащего rapAT2 участок в rifPKS, причем указанный способ включает этапы:
(а) выделение rifAT6 участка rifPKS из Amycolatopsis mediterrranei S699 и rapAT2 участка Streptomyces hygroscopicus (Согл. No. DSM - 41524);
(b) получение векторных конструкций путем замены rifAT6 участка rifPKS rapAT2 участком Streptomyces hygroscopicus (Согл. No. DSM - 41524);
(c) вставка векторных конструкций, полученных на этапе (b), в Amycolatopsis mediterrranei S699; и
(d) получение нового штамма Amycolatopsis mediterrranei S699#34, содержащего rapAT2 участок rifPKS.
Другой вариант осуществления настоящего изобретения относится к способу получения новых антибактериальных соединений, причем указанный способ включает этапы:
(a) культивирование клеток Amycolatopsis mediterrranei S699#34, содержащих rapAT2 участок в rifPKS участке; и
(b) сбор клеток Amycolatopsis mediterrranei S699#34 с получением сырых фракций продуктов;
(c) очистка сырых продуктов с помощью ВЭЖХ;
(d) получение антибактериальных соединений 24-десметилрифамицин В и 24-десметилрифамицин SV.
Другой вариант осуществления настоящего изобретения относится к способу получения 24-десметилрифамицина S, производного 24-десметилрифамицина В, причем указанный способ включает этапы:
(a) вступление в реакцию 24-десметилрифамицина В в присутствии хлорида меди;
(b) осуществление реакции согласно этапу (а) в течение ночи при комнатной температуре;
(c) получение 24-десметилрифамицина S.
Способ получения 24-десметилрифампицина, производного 24-десметилрифамицина В, причем указанный способ включает этапы:
(a) вступление в реакцию 24-десметилрифамицина В в присутствии диметилформамида (DMF) и уксусной кислоты;
(b) добавление параформальдегида и 1,3,5-триметил-гексагидро-1,3,5-триазина к смеси, полученной на этапе (а);
(c) получение 3-метил-1,3-оксазино(5,6-с)-24-десметилрифамицина;
(d) вступление в реакцию соединения, полученного на этапе (с), с 1-амино-4-метил-пиперазином; и
(e) получение 24-десметилрифампицина.
Другой вариант осуществления настоящего изобретения относится к рекомбинантной последовательности ID No. 1.
Другой вариант осуществления настоящего изобретения относится к бактериальному/ым штамму/ам в соответствии с настоящим изобретением, содержащему/им нуклеотидную последовательность ID NO. 1.
Другой вариант осуществления настоящего изобретения относится к штамму Amycolatopsis mediterranei S699 #34, содержащему нуклеотидную последовательность ID NO. 1.
Другой вариант осуществления настоящего изобретения относится к бактериальному штамму в соответствии с настоящим изобретением, причем бактериальный штамм способен продуцировать аналоги рифамицина.
Другой вариант осуществления настоящего изобретения относится к штамму Amycolatopsis mediterranei S699#34, в котором бактериальный штамм способен продуцировать аналоги рифамицина.
Другой вариант осуществления настоящего изобретения относится к рекомбинантной нуклеотидной последовательности ID No. 1, способной экспрессировать новые аналоги рифамицина.
Другой вариант осуществления настоящего изобретения относится к рекомбинантной нуклеотидной последовательности ID No. 1 в соответствии с настоящим изобретением, причем аналоги представляют собой 24-десметилрифамицин В и 24-десметилрифамицин S.
Другой вариант осуществления настоящего изобретения относится к векторным конструкциям, содержащим рекомбинантную нуклеотидную последовательность ID No. 1.
Еще один вариант осуществления настоящего изобретения относится к векторным конструкциям, причем векторные конструкции представляют собой рАТ6Е и pAT6F.
Другой вариант осуществления настоящего изобретения относится к бактериальному штамму, содержащему векторные конструкции, как описано в настоящем изобретении.
Другой вариант осуществления настоящего изобретения относится к штамму Amycolatopsis mediterrranei S699#34, содержащему векторные конструкции, как описано в настоящем изобретении.
Другой вариант осуществления настоящего изобретения относится к штамму Amycolatopsis mediterrranei S699#34, несущему pAT6F вектор, причем pAT6F вектор содержит нуклеотидную последовательность No. 1.
Другой вариант осуществления настоящего изобретения относится к бактериальному штамму, способному нести pAT6F вектор, причем pAT6F вектор содержит нуклеотидную последовательность No. 1.
Другой вариант осуществления настоящего изобретения относится к микробиальному штамму, способному нести pAT6F вектор, причем pAT6F вектор содержит нуклеотидную последовательность No. 1.
Другой вариант осуществления настоящего изобретения относится к микробиальному штамму, способному экспрессировать нуклеотидную последовательность No. 1 и/или ее продукты.
Другой вариант осуществления настоящего изобретения относится к микробному штамму, способному экспрессировать нуклеотидную последовательность No. 1 и/или ее продуктам.
Хотя нет никаких сообщений о манипуляции со скелетом рифамицина В при помощи комбинаторного биосинтеза, но есть сообщения о попытках применения комбинаторного биосинтеза на других генах поликетид синтазы. Заметный успех был достигнут по изменению молекулы рифамицина В с использованием комбинаторного подхода, как видно из описания настоящего изобретения.
Следующее описание представляет собой только иллюстративные варианты осуществления и не предназначено для ограничения объема, применимости или конфигурации изобретения каким-либо образом. Скорее, следующее описание представляет удобную иллюстрацию реализации иллюстративных вариантов осуществления изобретения по различным изменениям, которые можно сделать в функциях и расположении описанных элементов без отступления от объема изобретения.
ПРИМЕРЫ
Пример 1
Генетические манипуляции с A. mediterranei S699.
Обычные генетические процедуры, такие как выделение геномной ДНК (соглано СТАВ-цетилтриметил бромид, метода), выделения плазмиды (набор для очистки ДНК от Promega) и расщепление рестрикционной эндонуклеазы проводились по стандартным методикам. Была сконструирована плазмида pAT6F, которая была трансформирована (с помощью BioRadGenePulser) в A. mediterranei S699 с использованием описанного ранее метода [Dhingra, G. et al. (2003). J. Ind. Microbiol. Biotechnol. Vol. 13, p. 195-204], и электропорированную смесь высеяли на планшеты с YMG агаром, содержащие 4 г дрожжевого экстракта, 10 г солодового экстракта и 4 г глюкозы на литр (рН=7,2), которые покрыли мягким агаром (5 г/л, DifcoTM агар, гранулированный), содержащим 500 μг/мл эритромицина для придания устойчивости после инкубации в течение 12-16 ч. Трансформанты получили через 5-7 дней и выращены в YMG среде, содержащей 50 μг/мл эритромицина (Sigma Aldrich), с подтверждением устойчивости. Интеграция pAT6F в эти одиночные кроссоверные (SCO) клоны была подтверждена саузерн-блот-гибридизацией. Чтобы воздействовать на замену rifAT6 тамим же rapAT2, эти одиночные кроссоверные клоны культивировали в течение 3-4 раундов на планшете с YMG средой без эритромицин. Клетки высевали на планшет с YMG агаром и под давлением эритромицина, и без его давления, и были выбраны колонии, чувствительные к антибиотику. Сдвоены кроссоверные (DCO) клоны были далее подтверждены саузерн-блот-гибридизацией. Для гибридизации по Саузерну геномную ДНК иммобилизовали на Hybond N + мембрану (Amersham Biosciences). Гибридизацию проводили при 65°C в течение 12 ч с помощью [α-32Р]-меченых ДНК-зондов. Для нерадиоактивных методов гибридизацию проводили с использованием DIG-меченого ДНК зонда при 65°C. Тщательные промывки выполняли с помощью 5×SSC, 2×SSC, 1×SSC и 0,1×SSC при 65°C. Полученные DCO клоны содержали рекомбинантную нуклеотидную последовательность ID No. 1 (Фигура 22). Клон A. mediterranei S699, как описан и получен, содержащий рекомбинантную нуклеотидную последовательность ID No. 1, получил (внутренний) идентификационный номер Amycolatopsis mediterranei S699#34.
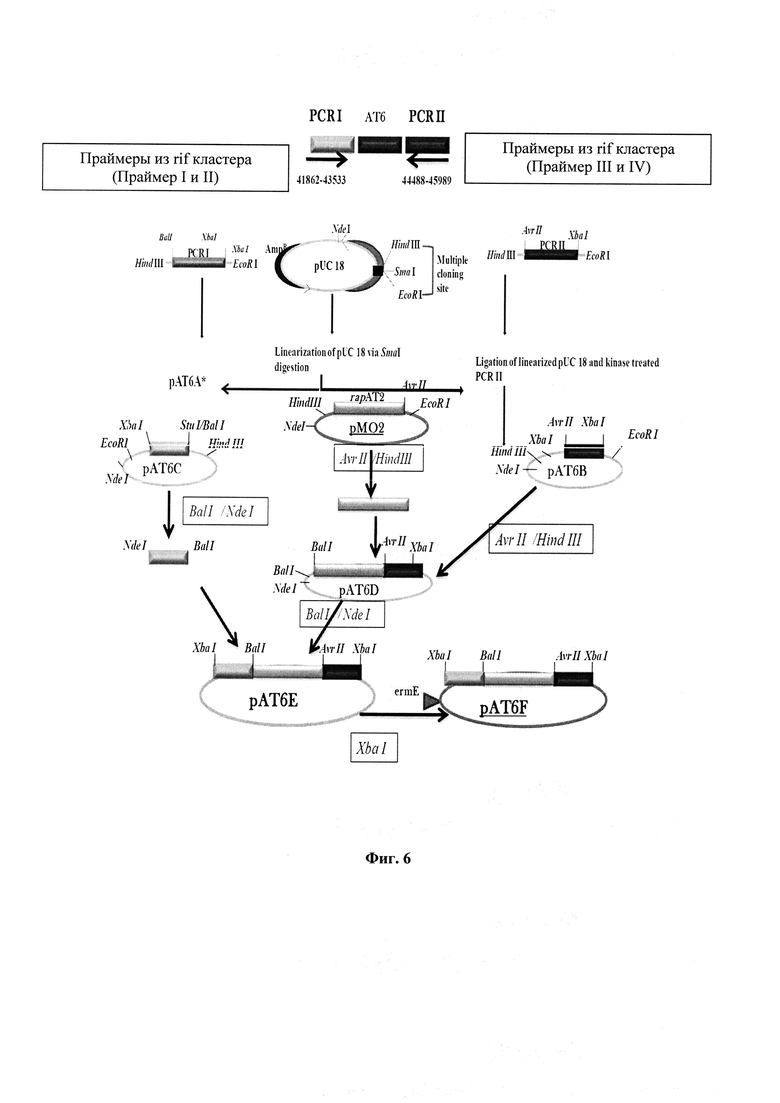
Конструирование праймеров для PCR I [ПЦР] и PCR II
Фланкирующий участок АТ6, также называемый PCR I (41862-43533bp), расположенный в обратном направлении от rifAT6, амплифицировали с использованием олигопраймеров, праймеров I и II (Таблица 1), как прямые и обратные праймеры, соответственно. Сайты рестрикции XbaI и BalI вставили на 5'-концах праймера I и II, соответственно, чтобы облегчить клонирование PCR I в сайте SmaI в pUC 18. Эти сайты были впоследствии использованы для клонирования.
Аналогично PCR II (44488-45989bp), расположенный в прямом направлении от rifAT6, амплифицировали с использованием пары праймеров - праймер III и праймер IV (Таблица 2). Сайт AvrII был вставлен в праймер III, a XbaI в праймер IV на конце 5' конце для последующего клонирования в pUC 18.


Дополнительные нуклеотиды, вставленные для генерации сайта рестрикции во всех праймерах, отмечены красным цветом. Нуклеотидные последовательности сайтов рестрикционых энзимов, образующихся в прямых праймерах PCR I и PCR II, выделены светло-голубым цветом, а в обратных праймерах желтым цветом.
Пример 2
Конструирование рАТ6А, рАТ6В и рАТ6С
Продукты PCR I и PCR II получили из rifPKS на космидном клоне No. 13. Затем выполнили лигирование полинуклеотидной киназы, обработанной фрагментом PCR I или PCR II на SmaI сайте линеаризованной и дефосфорилированной pUC18. После этого смесь лигирования перенесли в E. coli JMI0I. Плазмиды, содержащие PCR I и PCR II в pUC 18, получили название рАТ6А и рАТ6 В, соответственно. В плазмиде 'рАТ6А', PCR I лигировали в направлении, обратном тому, которое требовалось для последующего клонирования. В соответствии с требуемым направлением сайт XbaI в PCR I должен находиться рядом с NdeI сайтом плазмиды, однако у полученных клонов XbaI сайт находился вдали от NdeI сайта плазмиды. Для реверсирования направления PCR I вырезали с помощью EcoRI/HindIII двойного расщепления и вставили в pUC19, получив, наконец, плазмиду, рАТ6С.
Пример 3
Конструирование pAT6D
Плазмиду pMO2 [Olinyk, M. et al. (1996). Chem. Biol. Vol. 3, p. 833-839]), которая имеет ацилтрансферазу модуля 2 (АТ2) биосинтетического генного кластера рапамицина из Streptomyces hygroscopicus, клонированного в нем, расщепили с помощью AvrII/HindIII с высвобождением домена rapAT2. Плазмиду рАТ6В также расщепили с помощью AvrII/HindIII и rapAT2 и линеаризованная рАТ6В были лигированы и смесь лигирования перенесли в E. coli JM101 и отобрали клоны, содержащие правильную вставку. Эти конструкции получили название pAT6D.
Пример 4
Конструирование рАТ6Е
PCR I вырезали путем расщепления рАТ6С с помощью BalI/NdeI и одновременно pAT6D расщепили с помощью BalI/NdeI. И вставки из рАТ6С, и линеаризованную pAT6D лигировали и смесь лигирования перенесли в E. coli JM101. Полученные таким образом конструкции получили название рАТ6Е.
Пример 5
[Стратегия раработки функциональной кассеты (pAT6F - 8.3 kb) для замены (Фигура 6)]: Конструирование конечной кассеты pAT6F
Плазмиду рАТ6Е расщепили с помощью XbaI с высвобождением фрагмента PCR I-rapAT2-PCR II (прибл. 4 kb) и клонировали в XbaI расщепленного вектора pIJ4026, содержащего ген с устойчивостью к эритромицину. pIJ4026 (предоставленный М.J. Bibb, John Innes Institute, Норидж) (Фигура 6) представляет собой плазмиду Е. coli, но содержит ermE ген, который придает устойчивость к эритромицину, и экспрессируется только в A. mediterranei, а не в E. coli. Конечная конструкция содержит 3,85 фрагмент, состоящий из фрагментов PGR I, rapAT2 и PCRII в pIJ4026, получил название pAT6F. 3,85 kb - Фрагмент получил название SEQ ID No. 1 (Фигура 22).
Плазмида pAT6F была трансформирована с помощью электропорации (7,5 кВ/см, 1000 Ом, 25 μФ) в A. mediterranei S699. Одиночные кроссоверные клоны отбирали под давлением эритромицина в GYM агаровой среде (глюкозы 4 г/л; солодового экстракта 10 г/л; дрожжевого экстракта 4 г/л). Были отобраны одиночные кроссоверные (SCO) клоны, которые не показали коричневую пигментацию (из-за отсутствия продуцирования рифамицина, поскольку биосинтетический путь метаболизма был заблокирован интеграцией pAT6F в хромосому через гомологичную рекомбинацию) (Фигура 7 & 8). Плазмида pTA6F содержала нуклеотидную последовательность ID No. 1, как описано в настоящем изобретении и представлено на Фигуре 22.
Для генотипического подтверждения, ДНК от этих одиночных кроссоверных (S.C.O.) клонов гибридизировали с плазмидой (pIJ4026). Четыре одиночных кроссоверных клона (1-5, 2-2, 6-1, 6-2) показали положительный сигнал гибридизации (Фигура 9). Положительный SCO клон 2-2 для выбора сдвоенных кроссоверов (D.C.O.) далее культивировали в течение 3-4 генераций без давления эритромицина. Отобрали чувствительные к эритромицину сдвоенные кроссоверные (D.C.O.) клоны, которые обладали способностью продуцировать рифамициновые (возобновленная коричневая пигментация). Эти клоны имели rifAT6, замененный на rapAT2 (Фигура 7). Полученные сдвоенные кроссоверные клоны (Фигура 10) снова проверили на генетическом уровне на наличие домена АТ2 вместо АТ6 с помощью гибридизации по Саузерну и секвенирования ДНК. Четыре клоны показали положительные сигналы с геном rapAT2 (Фигура 11). Сдвоенные кроссоверные клоны, которые содержали рекомбинантную последовательность ID No. 1, были обозначены как Amycolatopsis mediterranei S699#34.
Ожидаемые аналоги рифамицина, продуцированные этими DCO клонами, проанализировали с помощью LC ESI-MS. Только три из этих положительных клонов (#3, #34 и #36) продуцировали ожидаемый аналог (Фигура 12). Результаты были подтверждены 1Н ЯМР (Фигура 13). Было установлено, что молекулярная масса аналога, составляет 741, что на 14 а.е.м. (атомная единица массы) меньше, чем молекулярный вес нативного рифамицина В (755).
Споры мутантного штамма сначала выращивали на шейкере в YMG среде в течение 3 дней при 30°C и 200 об/мин. Посевную культуру затем использовали для инокуляции (10%, об/об) YMG среды (10×100 мл) в 500-мл колбах. После инкубации в течение 10 дней в тех же условиях культуры центрифугировали, объединенные супернатанты подкислили до рН=3 с помощью 1N HCl, и метаболиты экстрагировали этилацетатом (2×1 л). Сырые экстракты рифамицин-связанных соединений подвергли хроматографии на силикагеле с использованием CHCl3-MeOH/5% NH4OH (10:1, а затем 8:1) в качестве подвижной фазы. Фракции, содержащие продукты, объединили и высушили с помощью роторного испарителя. Полученный продукт далее очистили с помощью ВЭЖХ [YMC-ODS-A, 250×10 мм, CH3CN-HCOONH4 (0,05 М) (60:40), расход 2 мл/мин, 254 нм]. Затем продукт обессолили с помощью Sephadex LH-20 колонки, используя МеОН в качестве элюента, с получением 24-десметирифамицина В (20 мг) и 24-десметирифамицина SV (8 мг).
24-десметирифамицин В: 1Н ЯМР (700 MHz, D2O, криозонд): δ 6.69 (s, 1H, Н-3), 6.34 (d, 1H, J=12 Hz, Н-29), 5.98 (d, J=11 Hz, 1H, H-17), 5.75 (dd, J=15 Hz, 11 Hz, 1H, H-18), 5.21 (dd, J=15 Hz, 10 Hz, 1H, H-19), 5.05 (m, 2H, H-25, H-28), 4.50 (d, J=17 Hz, 1H, -CH2-COOH), 4.42 (d, J=17 Hz, 1H, -CH2-СООН), 3.38 (bd, J=10 Hz, 1H, H-23), 3.22 (m, 2H, H-21 and H-27), 3.22 (s, 3H, H-37), 2.11 (s, 3H, H-36), 2.08 (s, 3H, H-14), 1.98 (m, 2H, H-20 and H-26), 1.70 (s, 3H, H-13), 1.53 (m, 2H, H-22 and H-24), 1.28 (t, J=12 Hz, 1H, H-24), 0.92 (d, J=6.5 Hz, 3H, H-31), 0.85 (d, J=7 Hz, 3H, H-32), 0.72 (d, J=6.5 Hz, 3H, H-34). 13C NMR (175 MHz, CD3OD, криозонд): δC 191.7, 176.7, 174.7, 168.1, 144.7, 142,1, 141.5, 131.5, 126.5, 126.4, 119.4, 117.8, 113.7, 112.8, 112.1, 109.6, 104.4, 101.1, 80.5, 73.9, 72.4, 71.5, 68.8, 54.9, 48.8, 41.4, 39.9, 35.9, 32.2, 21.8, 20.6, 20.5, 15.4, 9.5, 9.5, 6.9. (-)-HR-ESI-TOF-MS m/z 740.2939 (рассч. на C38H46NO14[M-H]-: 740.2918).
24-десметирифамицин SV: 1H ЯМР (700 MHz, CD3OD, криозонд): 1H ЯМР (700 MHz, CD3OD): δ 6.42 (s, 1H), 6.31 (bd, J=12 Hz, 1H), 5.95-5.89 (m, 2H), 5.51 (s, 1H), 5.20 (bt, J=12 Hz, 1H), 5.14 (bd, J=9 Hz, 1H), 3.22 (s, 3H), 3.17 (t, J=10 Hz, 1H), 2.13 (s, 3H), 2.12-2.11 (m, 2H), 2.01 (s, 3H), 1.96 (s, 3H), 1.67 (s, 3H), 1.54-1.49 (m, 4H), 0.93 (d, 6H), 0.78 (d, J=5 Hz, 3H). HRMS (ESI-TOF) m/z (рассч. для C36H44NO12[M-H]-: 682.2707).
Пример 6
Преобразование 24-десметилрифамицина В в 24-десметилрифамицин S
24-десметилрифамицин В (8 мг, 0,0107 ммоль) растворили в МеОН-H2O (10:1, 5 мл), содержащей CuCl2 (0,1 мм). Реакционную смесь перемешивали при КТ в течение ночи с преобразованием 24-десметилрифамицина В в 24-десметилрифамицин S. Смесь подкислили до рН=3 и продукт экстрагировали с помощью этилацетата (3×5 мл). Экстракт подвергли воздействию силикагелевой колонки с использованием CHCl3-МеОН (10:1) в качестве элюента с получением 24-десметилрифамицина S (6 мг).
Продукт проанализировали с помощью (-)-ESI-MS (m/z=680 [МН]-, анализ показал отсутствие фрагмента гликолата и наличие нафтохиноновой единицы в молекуле) и спектра 1Н ЯМР. Интересно, что при хранении в CDCl3 при -20°C образовались прозрачные буро-красные орторомбические кристаллы, что показало димерную форму координации 24-десметилрифамицина S с Са2+ через С-1, С-8, С-21 и С-23 атомы кислорода (Фигура 15а).
1Н ЯМР (300 MHz, CD3OD): 7.85 (s, 1H), 7.04 (m, 1H), 6.88 (bd, J=11 Hz, 1H), 6.59 (m, 1H), 5.23 (dd, J=12.6 Hz, 9.7 Hz), 4.53 (bt, J=8 Hz, 1H), 4.22 (bd, J=10 Hz, 1H), 3.80 (bd, J=10 Hz, 1H), 3.48 (s, 3H), 2.50 (s, 3H), 2.35 (s, 3H), 2.33 (s, 3H), 2.00 (s, 3H), 1.62 (m, 3H), 1.41 (d, J=7 Hz, 3H), 1,29 (d, J=6.8 Hz, 3H), 0.67 (d, J=7 Hz, 3H). HRMS (ESI-TOF) m/z 680.2730 (рассч. для C36H42NO12[M-H]-: 680.2707).
Рентгеновская кристаллография 24-десметилрифамицина S. Дифракционные интенсивности собрали при 173(2) К на CCD-дифрактометре Bruker Apex с использованием МоК излучения = 0.,1073 Å. Пространственная группа была определена на основе систематических отсутствий. Поправки на поглощение вносили с помощью программы SADABS [Sheldrick, G.М. (1998). Bruker/Siemens Area Detector Absorption Correction Program (Bruker AXS, Madison. WI)]. Структуры были решены с помощью прямых методов и методов Фурье и уточнены на F2 с помощью полноматричных методов наименьших квадратов. Все атомы, не являющиеся Н, были уточнены с помощью анизотропных тепловых параметров (Фигура 16). Атомы Н рассматривали в расчетных позициях в модели жесткой группы. Было установлено, что растворяющая вода частично занимает позицию между молекулами при коэффициенте заполнения 0,25. Атомы Н в молекуле растворяющей воды не были приняты во внимание. Параметр Флэка составляет 0,00 (10). Относительно высокое значение Rint, 0,1271, связано с тем, что дифракция в больших углах была очень слабой и статистические данные по интенсивности в больших углах недостаточные. Все расчеты проводились с помощью пакета программ Bruker SHELXTL (в. 6.10) [Sheldrick, G.М. (1998). Bruker/Siemens Area Detector Absorption Correction Program (Bruker AXS, Madison. WI)].
Пример 7
Синтез 24-десметилрифампицина
24-десметилрифамицин S (5 мг, 0,0073 ммоль) растворили в DMF (200 μл) и уксусной кислоте (50 μл). После перемешивания смеси при 50°C добавили параформальдегид (3 мг) и 1,3,5-триметил-гексагидро-1,3,5-триазин (8 μл). Реакционную смесь перемешивали при 50°C в течение 2 ч, пока все исходное вещество не преобразовалось в 3-метил-1,3-оксазино(5,6-с)-24-десметилрифамицин, на что указало голубое пятно на TLC. После этого к смеси добавили 1-амино-4-метил-пиперазин (8 μл). Реакционную смесь перемешивали и контролировали с помощью TLC до исчезновения голубого пятна и образования 24-десметилрифампицина. Смесь разбавили охлажденной 2% уксусной кислотой (1,5 мл) и экстрагировали три раза с помощью CHCl3 (2 мл). Органические фракции объединили и концентрировали до 1 мл и далее промыли 3 раза рассолом. Органические фракции объединили и сушили над безводным сульфатом натрия, затем сушили под роторным испарителем. Сырые фракции подвергли хроматографии на силикагеле с помощью CHCl3-МеОН при соотношении 10:1 & 8:1 в качестве элюента. Фракции, содержащие продукт, объединили и после этого очистили с помощью ВЭЖХ [CH3CN - 0.05 М HCOONH4 (60:40)] с использованием колонки (YMC-ODS-A, вн. диаметр 250×10 мм, размер частиц 5 микрон) и при расходе 2 мл/мин. при 254 нм. Фракции, содержащие 24-десметилрифампицин, высушили и получили титульное соединение (2,5 мг, 0,0031 ммоль) красновато-оранжевого порошка продукта.
1Н ЯМР (500 MHz, CD3OD): (Фигура 17) HRMS (ESI-TOF) m/z 807.3829 (рассч. для C42H55N4O12[M-H]-: 807.3816).
Для подтверждения подлинности 24-десметилрифампицина проведи сравнительный MS/MS анализ (Фигура 18). Результат показал, что 24-десметилрифампицин (m/z 807→676→616→490→420) и рифампицин (m/z 821→690→630→490→420) имеют одинаковые схемы фрагментации, хотя большинство фрагментов 24-десметилрифампицина на 14 атомных единиц массы меньше, чем соответствующие фрагменты из рифампицина (Фигура 19). Эти схемы фрагментации также согласуются с схемами фрагментации, о которых ранее сообщалось в отношении рифампицина (Prasad, В. and Singh, S.J. (2009) Pharm. Biomed. Anal. Vol. 50, pages 475-490).
Пример 8
Антибактериальный анализ
Антибактериальная активность рифампицина и его аналогов и производных, т.е. 24-десметилрифамицина В, 24-десметилрифамицина S, 24-десметилрифамицина SV и 24-десметилрифампицина, также определяется с помощью метода диффузии в агаре.
Mycobacterium smegmatis, Bacillus subtilis, Staphylococcus aureus и Escherichia coli нанесли штрихом на питательный агар и инкубировали в течение ночи при 37°C. Колонии перенесли в питательный бульон и инкубировали при 37°C в течение 24 ч. Рост культур измеряли до должной плотности при 600 нм (BioRad, SmartSpec 300). Инокулят (1 мл) тщательно смешали с теплым питательным агаром (24 мл) и вылили в чашки Петри. Чашки с агаром оставили до затвердевания и высыхания на 30 мин перед анализом. Стерильные диски Ватмана пропитали рифампицином и его аналогами (20  ) при концентрации 1 мг/мл и высушили при комнатной температуре. Диски поместили на чашки с инокулированным агаром и инкубировали при 37°C в течение 24 ч. Для получения контрастного фона зоны ингибирования по всей верхности чашек добавили 0,25% проявляющийся краситель МТТ (2 мл).
) при концентрации 1 мг/мл и высушили при комнатной температуре. Диски поместили на чашки с инокулированным агаром и инкубировали при 37°C в течение 24 ч. Для получения контрастного фона зоны ингибирования по всей верхности чашек добавили 0,25% проявляющийся краситель МТТ (2 мл).
Антибактериальные анализы выполнили с 24-десметилрифамицином S и 24-десметилрифамицином SV на грамположительные и грамотрицательные бактерии, такие как Mycobacterium smegmatis, Bacillus subtilis, Staphylococcus aureus и Escherichia coli (Фигура 20). Результаты показали, что новые соединения (24-десметилрифамицин S и 24-десметилрифамицин SV), полученные из нового аналога 24-десметилрифамицин В, были более активными, чем рифамицин В, против М. smegmatis. Были проведены моделирующие исследования, которые дали возможность предположить, что 24-десметилрифампицин связывается с рифамицин-устойчивой РНК-полимеразой М. tuberculosis лучше, чем рифампицин.
Аналогично антибактериальный анализ провели с использованием 24-десметилрифампицина, 24-десметилрифамицина S и коммерчески доступного рифампицина и рифамицина S против Mycobacterium smegmatis and Staphylococcus aureus. Результаты показали, что 24-десметилрифамицин S и 24-десметилрифампицин активны против М. smegmatis and S. aureus, по сравнению с рифамицином S и рифампицином, соответственно (Фигура 21).
На основании приведенных выше результатов дополнительно было проведено исследование на эффект аналогов и производных в соответствии с настоящим изобретением с целью изучения штаммов М. tuberculosis с множественной лекарственной устойчивостью. Для этого в Open Source Drug Discovery (OSDD; www.osdd.net) приобрели MDR-штаммы и выполнили тестирование на лекарства в Premas Biotech, Харьяна, Индия, по нормативам ВОЗ. Тесты на чувствительность к лекарствам проводили в отношении двух рифампицин-чувствительных, и трех рифампицин-устойчивых штаммов М. Tuberculosis: OSDD 209 & H37Rv и OSDD 55, OSDD 206 & OSDD 321, соответственно (Таблица 3).
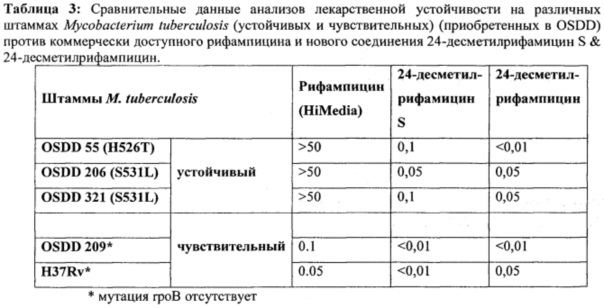
Рифампицин (коммерчески доступный от HiMedia), 24-десметилрифампицин и 24-десметилрифамицин S испытали против вышеуказанных патогенных штаммов. Испытания выполнялись при различных концентрациях (0,01-50 μг/мл) лекарственных средств с использованием системы BacT/ALERT MB [Crump, J.A. et al. (2011). J. Clin. Microbiol. Vol. 49, p. 3054-3057]. Результаты показали, что 24-десметилрифамицин S & 24-десметилрифампицин демонстрируют сильную антибактериальную активность против и рифамицин-чувствительных, и рифамицин-устойчивых штаммов М. tuberculosis.
Анализы на лекарственную чувствительность выполнялись в Premas Biotech, Харьяна, Индия, с использованием различных концентраций лекарственных средств (0,01-1 μг/мл). Тестирование на лекарства выполняли с использованием системы MB BacT/ALERT [Crump, J.A. et al. (2011). J. Clin. Microbiol. Vol. 49, p. 3054-3057], представляющей собой систему обнаружения микобактерий, в которой для определения уровня углекислого газа внутри флакона используется колориметрический датчик и датчик отражения. С ростом микроорганизмов вырабатывается СО2, в результате чего происходит изменение цвета датчика (на дне флакона). По мере увеличения концентрации СО2 цвет меняется от зеленого до желтого. В флаконе содержится среда и МВ/ВасТ восстанавливающая жидкость, которая способствует росту микобактерий. Образец инокулируют во флакон MP BacT/ALERT. Тестирование проводится с двумя контролями: контроль прямого роста (DGC) и контроль пропорционального роста (PGC). DGC предусматривает 0,1 мл посевной культуры в флакон MP BacT/ALERT вместе с 0,5 мл восстанавливающей жидкости. PGC предусматривает 0,5 мл DGC в флакон MP BacT/ALERT вместе с 0,5 мл восстанавливающей жидкости. Тест-флакон предусматривает 0,5 мл посевной культуры в MP BacT/ALERT флакон вместе с 0,5 мл восстанавливающей жидкости, а также антибиотик. Тест считается завершенным, когда PGC флакон сигнализирует положительное показание.
Исследования возмущения свободной энергии
Поскольку аналоги 24-десметилрифамицина показали сравнимую или более высокую активность, чем рифампицин, как против рифампицин-чувствительных, так и против рифампицин-устойчивых М. tuberculosis, авторы решили провести исследования возмущения свободной энергии (FEP) с использованием РНКП дикого типа [Postma, J.P.М. et al. (1982). Faraday Symp. Chem. Soc. Vol. 17, p. 55-67; Singh, U.C. et al. (1987) J. Am. Chem. Soc. Vol. 109, p. 1607-1614] (Таблица 4). Несмотря на то, что расчеты FEP с рифампицин-устойчивой РНКП более желательны, к сожалению, кристаллическая структура мутантной голо-РНКП еще предстоит выявить. Рифамицин В и 24-десметилрифамицин В были выбраны при исследовании исходя из их потенциально низких вычислительных затрат, тогда как для производных рифампицина они несколько выше. Кроме того, было в общем принято считать, что С-3 или С-4 боковые цепи не существенно изменяют связывание лекарственного средства, но заметно изменяют транспортные свойства.
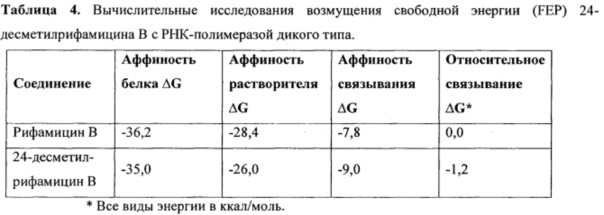
Расчеты FEP были проведены с помощью Gromacs 4.5 [Pronk, S. et al. (2013). Bioinformatics. Vol. 29, p. 845-854] с 21 параллельными окнами из ранее сформированной структуры, а для табулирования свободной энергии связывания использовали соотношение принятия Беннетта [Bennet acceptance ratio]. Результаты FEP показали, что 24-десметилрифамицин В имеет аналогичную с рифамицином В аффинность в отношении РНК-полимеразы дикого типа, но имеет более низкую аффинность к воде, чем последнее соединение. Такое значительное снижение аффинности сольватации 24-десметилрифамицина В влечет за собой более высокий коэффициент распределения для белка, чем рифамицин В, что приводит к повышению относительной аффинности связывания 24-десметилрифамицина В в отношении РНК-полимеразы на 1,2 ккал/моль (Таблица 4).
| название | год | авторы | номер документа |
|---|---|---|---|
| (4-(3-гидроксифенил)пиперазин-1-ил)(5-нитрофуран-2-ил)метанон, обладающий противотуберкулезной активностью в отношении возбудителя туберкулеза с множественной лекарственной устойчивостью, и способ его получения | 2021 |
|
RU2784399C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И НАБОР ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2011 |
|
RU2496475C2 |
| Соединение, фармацевтическая композиция, лекарственное средство, применение соединения, фармацевтической композиции, лекарственного средства | 2015 |
|
RU2723545C2 |
| ПРОТИВОТУБЕРКУЛЕЗНОЕ СРЕДСТВО | 2017 |
|
RU2756208C2 |
| НОВЫЙ АНТИБАКТЕРИАЛЬНЫЙ АГЕНТ 3-(КАРБОКСИМЕТИЛ)-1-(ИМИДАЗО[1,2-b][1,2,4,5]ТЕТРАЗИН-3-ИЛ)-1Н-БЕНЗО[d]ИМИДАЗОЛ-3-ИУМ ХЛОРИД, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ ОТНОСИТЕЛЬНО NEISSERIA GONORRHOEAE И MYCOBACTERIUM TUBERCULOSIS | 2023 |
|
RU2828876C1 |
| НАФТОХИНОНОВЫЕ ПРОИЗВОДНЫЕ И ИХ ИСПОЛЬЗОВАНИЕ ДЛЯ ЛЕЧЕНИЯ И БОРЬБЫ С ТУБЕРКУЛЕЗОМ | 2000 |
|
RU2246299C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ РИФАБУТИНА С ПОВЫШЕННОЙ БИОДОСТУПНОСТЬЮ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ МИКОБАКТЕРИОЗОВ | 2013 |
|
RU2520603C1 |
| АНТИБИОТИЧЕСКИЕ СОЕДИНЕНИЯ | 2010 |
|
RU2536587C2 |
| НОВЫЕ 5-МОДИФИЦИРОВАННЫЕ ПИРИМИДИНОВЫЕ НУКЛЕОЗИДЫ - ИНГИБИТОРЫ РОСТА Mycobacterium tuberculosis | 2013 |
|
RU2517173C1 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ АКТИВНОЙ ИНФЕКЦИИ MYCOBACTERIUM TUBERCULOSIS | 2013 |
|
RU2659149C2 |


Изобретение относится к пригодным в медицине соединениям, имеющим структуру:
 .
.
Предложены новые аналоги рифамицина, эффективные для лечения устойчивых к лекарствам бактерий, в особенности микобактерий, а также способ получения таких соединений, фармацевтическая композиция на их основе и способ лечения бактериальных инфекций с их использованием. Предложенный способ получения 24-десметилрифамицина S включает преобразование 24-десметилрифамицина В в 24-десметилрифамицин S в присутствии хлорида меди в течение ночи при комнатной температуре с получением 24-десметилрифамицина S. 6 н. и 8 з.п. ф-лы, 8 пр., 4 табл., 22 ил.
1. Антибактериальные соединения, имеющие следующую химическую структуру:
 .
.
2. Антибактериальные соединения по п. 1, отличающиеся тем, что антибактериальные соединения пригодны против бактериальной инфекции.
3. Антибактериальные соединения по пп. 1, 2, отличающиеся тем, что антибактериальные соединения пригодны против инфекции, вызванной видами рода Mycobacterium.
4. Антибактериальные соединения по пп. 1-3, отличающиеся тем, что выбранные виды рода Mycobacterium представляют собой Mycobacterium tuberculosis и штаммы М. Tuberculosis с множественной лекарственной устойчивостью.
5. Антибактериальная фармацевтическая композиция, содержащая антибактериальное соединение, выбранное из 24-десметилрифамицина S, 24-десметилрифамицина SV и 24-десметилрифампицина

вместе с их фармацевтически приемлемыми носителями.
6. Фармацевтическая композиция по п. 5, отличающаяся тем, что антибактериальные соединения пригодны против бактериальной инфекции.
7. Фармацевтическая композиция по пп. 5, 6, отличающаяся тем, что антибактериальные соединения пригодны против инфекции, вызванной видами рода Mycobacterium.
8. Фармацевтическая композиция по пп. 5, 6, отличающаяся тем, что антибактериальные соединения пригодны против инфекции, вызванной Mycobacterium tuberculosis и штаммами М. Tuberculosis с множественной лекарственной устойчивостью.
9. Способ лечения бактериальных инфекций, включающий введение пациенту антибактериальных соединений, выбранных из 24-десметилрифамицина S, 24-десметилрифамицина SV и 24-десметилрифампицина
 .
.
10. Применение антибактериальных соединений, выбранных из 24-десметилрифамицина S, 24-десметилрифамицина SV и 24-десметилрифампицина
 ,
,
для лечения бактериальной инфекции.
11. Применение антибактериальных соединений, выбранных из 24-десметилрифамицина S, 24-десметилрифамицина SV и 24-десметилрифампицина
 ,
,
для получения лекарственного средства для лечения бактериальных инфекций.
12. Применение антибактериальных соединений по п. 11 для получения лекарственного средства для лечения инфекции, вызванной видами рода Mycobacterium.
13. Применение антибактериальных соединений по п. 11 для получения лекарственного средства для лечения инфекции, вызванной видами рода Mycobacterium, Mycobacterium tuberculosis и штаммами М. Tuberculosis с множественной лекарственной устойчивостью.
14. Способ получения 24-десметилрифамицина S по п. 1, причем указанный способ включает следующие этапы:
(a) преобразование 24-десметилрифамицина В в 24-десметилрифамицин S в присутствии хлорида меди;
(b) осуществление реакции согласно этапу (а) в течение ночи при комнатной температуре; и
(c) получение 24-десметилрифамицина S.
| Rup Lal, Proceedings of the ninety ninth session of the Indian Science Congress, Bhubaneswar, 2012, part II, pp 55-56 | |||
| Jun Xu et al, Microbiology, 2005, 151, 2515-2528 | |||
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ПРОТИВОТУБЕРКУЛЕЗНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ И СПОСОБ ИХ ИЗГОТОВЛЕНИЯ | 2001 |
|
RU2240795C9 |
Авторы
Даты
2018-11-09—Публикация
2014-03-20—Подача