Изобретение относится к химической промышленности, а именно, к получению новых биологически активных соединений хлоринового ряда, конкретно - к производным хлорофилла α, модифицированных одним и двумя фрагментами миристиновой кислоты.
В литературе описаны различные модифицированные производные хлорофилла α [Белых Д.В., Копылов Е.А., Груздев И.В., Кучин А.В. // Журнал органической химии. 2010. Т. 46. №4. С. 584-592; Белых Д.В., Тарабукина И.С., Матвеев Ю.С., Кучин А.В. // Патент РФ №2310658. Опубл. 20.11.2007; Старцева О.М.: автореферат дис. … кандидата химических наук: 02.00.03 / Старцева Ольга Михайловна; Иван. гос. хим.-технол. ун-т.- Иваново, 2015. -16 с., / Данные соединения интенсивно исследуются в качестве фотосенсибилизаторов (ФС) для фотодинамической терапии (ФДТ) в различных областях медицины (онкология, отоларингология, офтальмология, хирургия, лечение грибковых заболеваний). Некоторые из них уже нашли применение в клинической практике [Миронов А.Ф. / В кн.: Успехи химии порфиринов. Т 4. СПб.: НИИ химии СПбГУ. 2004. С. 271-292; Решетников А.В., Швец В.И, Пономарев Г.В. В кн.: Успехи химии порфиринов. Т 2. СПб.: НИИхимииСПбГУ. 1999. С. 70-114; Feofanov A., Sharonov G., Grichine A., Refregier М., et. al. // Photochemistry and Photobiology. 2004. V 79. P. 172-188].
Ковалентное связывание фрагментов фармацевтических препаратов фрагментами производных хлорофилла α позволяет существенно изменить их биологическую активность. Модификация периферии хлоринового макроцикла путем введения фрагмента миристиновой кислоты [Тезисы докладов Научно-практической конферецнии "Биологически активные вещества: фундаментальные и прикладные вопросы получения и применения», 25 - 30 мая, 2009, Новый Свет, Украина. - Киев: Издатель B.C. Мартынюк, 2009. - 488 с; Болотова Л.Х. Лечение воспалительных заболеваний пародонта препаратами на основе гиалуроновой кислоты группы "Гиалудент": дис. … кандидата медицинских наук: 14.01.14 ГОУВПО "Ставропольская государственная медицинская академия"- Ставрополь, 2010 - 113 с; Биохимия: Учеб. для вузов, Под ред. Е.С. Северина., 2003. ISBN 5-9231-0254-4 - С. 248-263(779 с. )] может способствовать усилению мембранотропности производных хлорофилла, что повышает их эффективность в качестве фотосенсибилизаторов за счет фотоповреждения мембранных структур клеток-мишеней. Варьирование количества фрагментов миристиновой кислоты может влиять на мембранотропность получаемых производных.
Одним из наиболее доступных производных хлорофилла α является метилфеофорбид α, молекула которого содержит несколько активных реакционных центров (экзоцикл, винильная группа, пропионатный заместитель в положении 17 и др.), имеющихся и в молекулах других производных хлорофилла и обеспечивающих широкие возможности для его химической модификации.
Ближайшим структурным аналогом заявляемых соединений является 2-(1-гексилоксиэтил)-2-дивинил пирофеофорбид α (НРРН, известен под торговой маркой «Photochlor», Rosewell Park Cancer Institute, США), представляющий собой фотосенсибилизатор, который проходит клинические испытаниев фотодинамической терапии [Yano S., Hirohara S., Obata M., Hagiya Y., Ogura S., Ikeda A., Kataoka H, Tanaka M., Joh T. // J. Photochem. Photobiol. CPhotochem. Rev. ElsevierB.V., 2011. Vol. 12, №1. P. 46-67; E.B. Санарова, А.В. Ланцова, M.B. Дмитриева, З.С. Смирнова, Н.А. Оборотова // Российский биотерапевтическии журнал № 3 Т. 13- 2014; D. A. Bellnier [et. al.] // LasersSurg. Med. - 2006. - №38. - P. 439-444].
Однако ничего не известно об использовании этого вещества в антимикробной ФДТ.
Изобретательская задача состояла в получении на основе производного хлорофилла α - метилфеофорбид α потенциальных фотосенсибилизаторов для антибактериальной фотодинамической терапии, несущих ковалентно-связанные фрагменты антибактериального препарата.
Поставленная задача решена синтезом новых производных хлорофилла α, модифицированных фрагментами миристиновой кислоты на основе метилфеофорбида α (III) (схема):
4
Схема
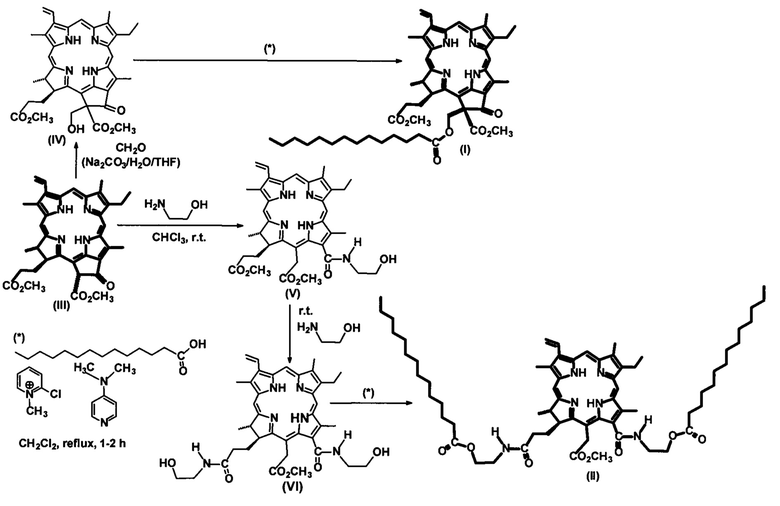
Внедрение фрагмента миристиновой кислоты осуществляли формированием сложноэфирной связи при ацилировании гидроксильных групп соответствующих гидроксихлоринов миристиновой кислотой, карбоксильная группа которой активирована действием реагента Мукаяма (схема). Для введения гидроксильных групп использовали способ взаимодействия метилфеофорбида α с параформом и этаноламином [Белых Д.В., Ашихмина Е.В. // Macroheterocycles 2014 7(1) 88-90; Белых Д.В., Карманова Л.П., Спирихин Л.В., Кучин А.В. // Журнал органической химии. 2007. Т. 43. Вып. 1. С. 120-128]. При действии параформа в присутствии слабого основания на метилфеофорбид α (III) было синтезировано 13(2)-гидроксиметильное производное IV в виде смеси диастереомеров по положению 13(2). Действием этаноламина были получены производные хлорина е6 с одной (V) и двумя (VI) гидроксильными группами. Действие миристиновой кислоты, карбоксильная группа которой активирована реагентом Мукаяма, на полученные гидроксихлорины дает производные с одним (I) и двумя фрагментами миристиновой кислоты (II).
Строение полученных соединений доказано при помощи ЯМР, электронной и ИК-спектроскопии, а также масс-спектрометрии.
В масс-спектрах всех полученных соединений наблюдаются пики, соответствующие молекулярному иону исследованных соединений. Хлориновый хромофор проявляется в электронных спектрах поглощения всех соединений. Наличие фрагмента миристиновой кислоты проявляется в спектре ЯМР 1Н, соотношение интенсивностей мультиплетов протонов соответствует количеству фрагментов миристиновой кислоты в молекуле.
Таким образом, предлагаемые производные хлорофилла α, модифицированного одним или двумя фрагментами миристиновой кислоты позволят получить потенциальные фотосенсибилизаторы для антибактериальной фотодинамической терапии.
Изобретение позволяет получить следующие преимущества:
1). Внедрение на периферию хлоринового макроцикла фрагмента миристиновой кислоты может способствовать усилению мембранотропности производных хлорофилла, что повышает их эффективность в качестве фотосенсибилизаторов за счет фотоповреждения мембранных структур клеток-мишеней.
2). Варьирование количества фрагментов миристиновой кислоты может влиять на мембранотропность получаемых производных.
3). Соединение I может быть использовано для синтеза водорастворимого производного хлорофилла α, модифицированного фрагментом миристиновой кислоты с катионными группами, которое может быть использовано в качестве потенциального фотосенсибилизатора для антибактериальной ФДТ.
Краткое описание чертежей:
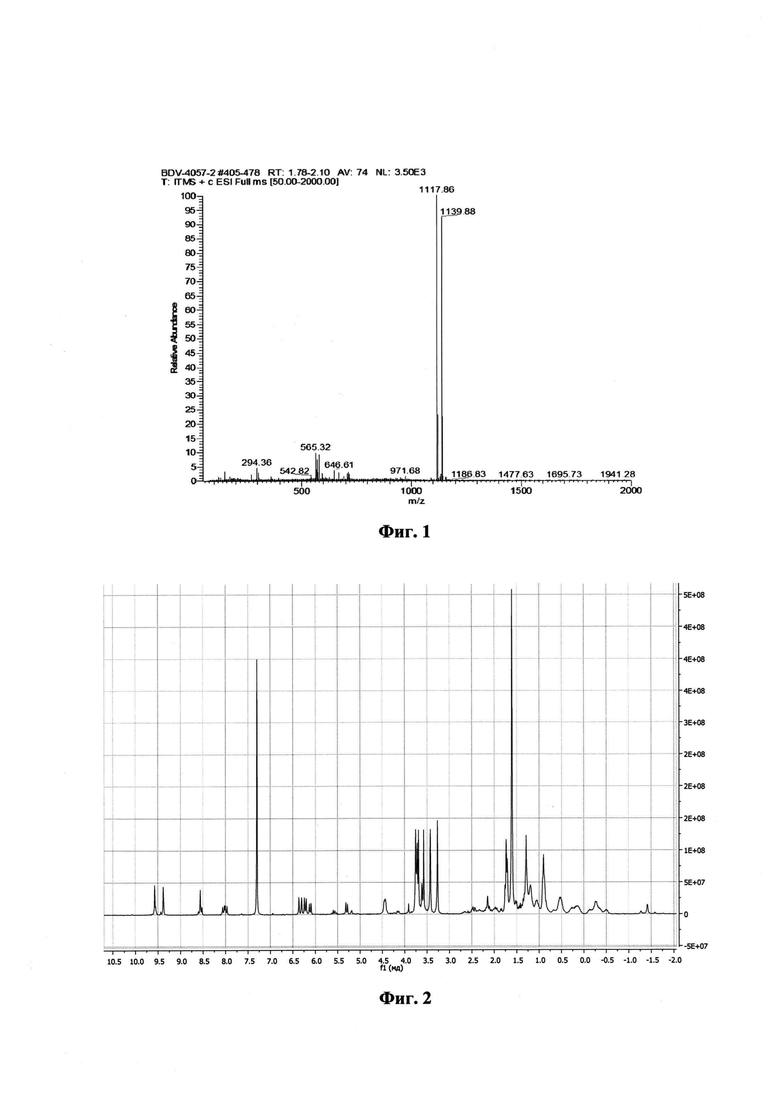
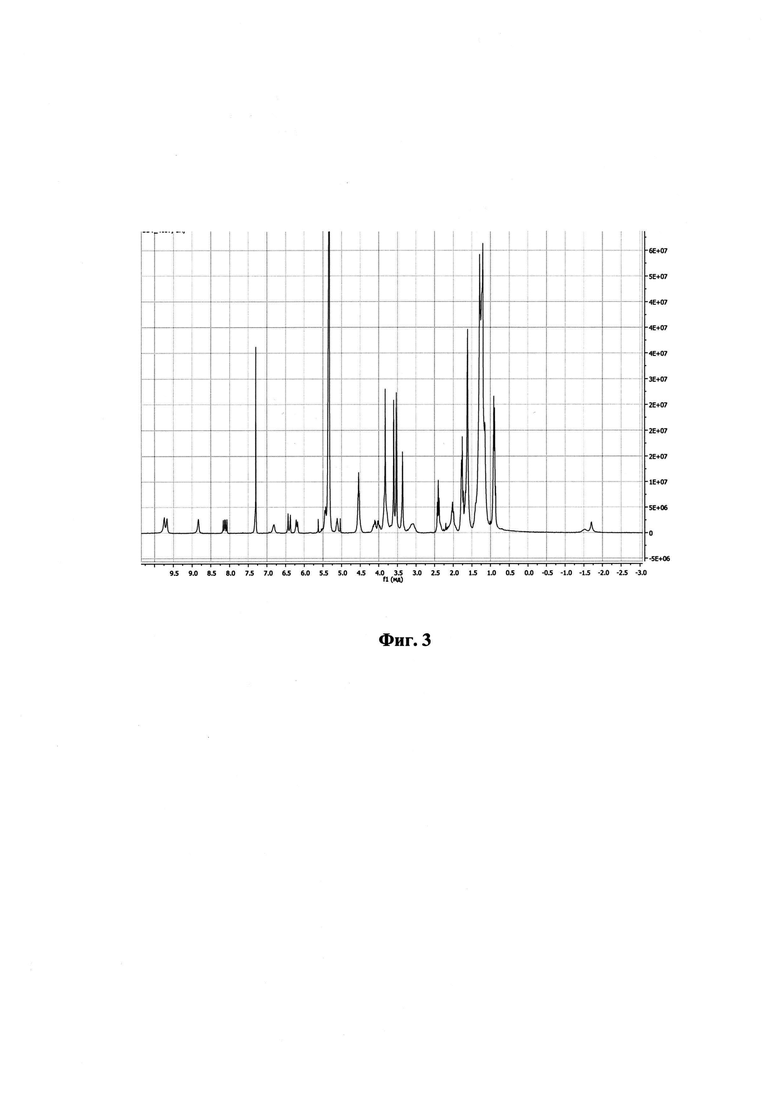
На фиг. 1 изображен масс-спектр ESI соединения II; на фиг. 2 - 1Н ЯМР спектр соединения I; на фиг. 3 - 1Н ЯМР спектр соединения II.
Для синтеза заявляемых соединений используют следующие вещества:
- метилфеофорбид а (III), полученный по известной методике [Патент РФ №2490273 от 20.08.2013 Б.И. №23];
- 4-диметиламинопиридин (DMAP) - 4-(Dimethylamino)pyridine ≥99% CAS Number 1122-58-3 SIGMA-ALDRICH,522805 ALDRICH PubChem Substance ID 24874122;
- хлористый метилен - ГОСТ 9968-86;
- 2-хлор-N-метилпиридиниййодида- 2-Chloro-l-methylpyridinium iodide, 97% A12820 CAS 14338-32-0 Alfa Aesar;
- миристиновая кислота - ООО Вектон-MCAS №544-63-8
- четыреххлористый углерод - тетрахлорметан, CCl4, CAS №56-23-5 ГОСТ 20288-74CCl4;
- ацетон - ЗАО «ЭКОС-1» (ХЧ) ТУ 2633-018-44493179-98 с изм. №1, 2;
- соляная кислота- кислота соляная ХЧ ГОСТ 3118-77 «Аквахим»;
- безводный сульфат натрия - натрий сернокислый безводный, ГОСТ 4166-76, CAS No: 7757 - 82 - 6, ООО "ХПК-ГРУПП";
- соединения IV, V, VI - не выпускаются промышленностью и получены по методике, описанной в литературе [Белых Д.В., Ашихмина Е.В. Гидроксиметелирование экзоцикла метилфеофорбида α // Macroheterocycles 2014 7(1) 88-90; Белых Д.В., Карманова Л.П., Спирихин Л.В., Кучин А.В. Синтез амидных производных хлорина е6 // Журнал органической химии. 2007. Т 43. Вып. 1. С. 120-128].
Заявляемые соединения могут быть получены следующим образом:
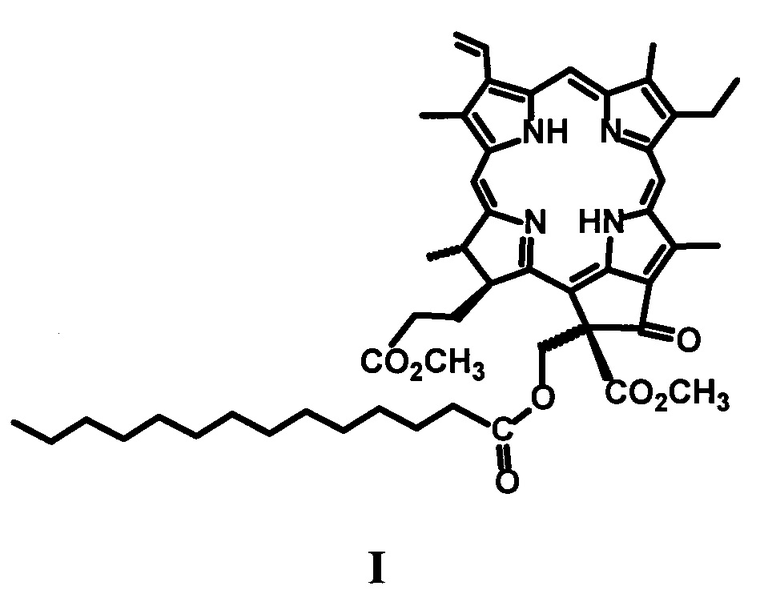
Пример 1. Синтез 13(2)-миристоксиметилфеофорбид α метилового эфира (I).
К раствору 50 мг производного IV в 20 мл хлористого метилена добавляют 25 мг 4-диметиламинопиридина (DMAP), 25 мг 2-хлор-N-метилпиридиний йодида и 12-25 мг миристиновой кислоты, и кипятят в колбе с обратным холодильником в течение 60 минут (контроль ТСХ, элюент CCl4: ацетон = 4: 1). Реакционную смесь переносят в делительную воронку и отмывают от избытка DMAP и продуктов превращения 2-хлор-N-метилпиридинйодида 7% соляной кислотой, затем кислоту отмывают дистиллированной водой до нейтральной реакции промывных вод. Полученный раствор сушат над безводным сульфатом натрия и упаривают при пониженном давлении при температуре 45°С. Остаток после упаривания хроматографируют на силикагеле (элюирование смесью CCl4:ацетон в соотношениях от 40:1 до 1:1). Элюат, содержащий основное вещество, упаривают при пониженном давлении.
Выход 14 мг (32%).
Масс-спектр (ESI) m/z=846.9 [М]+(C51H66N4O7) рассчитано 846.4.
Спектр ЯМР 1Н (CDCl3, 300 МГц), δ, м.д.: 9.57 с (1Н, 10-Н), 9.39 с (1H, 5-Н), 8.56 с (1Н, 20-Н), 8.02 дд (1Н, J 18.3 и 11.9 Гц, 3-СН=СН2), 6.33 д (1Н, J 18.3, 3-СН=НН(транс)), 6.22 д (1Н, J 11.9, 3-СН=СНН(цис)), 13(2)-CH2OC(O)С13Н27: 6.11 д (1Н, J 12.0 Гц) и 5.30 д (1Н, J 12.0); 4.54-4.37 м (2Н, 18-Н, 17-Н), 3.78-3.70 м (2Н, 8-СН2СН3), 3.76 с (3Н, 13(2)-CO2CH3), 3.69 с (3Н, 17-CH2CH2CO2CH3), 3.58 с (3Н, 12-СН3), 3.43 с (3Н, 7-СН3), 3.27 с (3Н, 2-СН3), 2.77-1.80 м (4Н, 17-СН2СН2СО2СН3), 2.15 т (2Н, J 8.3 Гц, 13(2)-СН2ОС(O)СН2С12Н25), 13(2)-СН2ОС(O)СН2(СН2)11СН3: 1.48-0.96 м (14Н), 0.96-0.81 м (2Н), 0.59-0.44 м (2Н), 0.35-0.06 м (2Н), от -0.15 до -0.42 м (2Н); 1.73 т (3Н, J 7.3 Гц, 8-СН2СН3), 1.72 д (3Н, J7.3 Гц, 18-СН3), -0.50 уш.с (1Н, III-NH), -1.41 уш.с (1Н, I-NH).
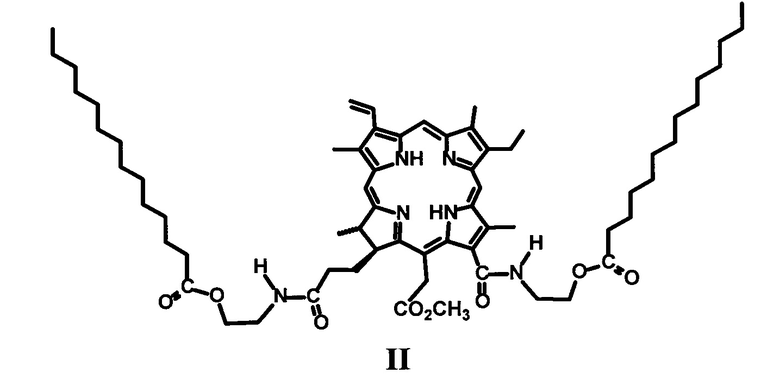
Пример 2. Синтез 13(1),17(3)-N,N'-бис(2-миристоксиэтил)диамид-15-метилового эфира хлорина е6 (II). К раствору 50 мг производного VI в 20 мл хлористого метилена добавляют 25 мг 4-диметиламинопиридина (DMAP), 25 мг 2-хлор-N-метилпиридиний йодида и 24 мг миристиновой кислоты и кипятят в колбе с обратным холодильником в течение 60 минут (контроль ТСХ, элюент CCl4: ацетон = 4: 1). Реакционную смесь переносят в делительную воронку и отмывают от избытка DMAP и продуктов превращения 2-хлор-N-метилпиридинйодида 7% соляной кислотой, затем кислоту отмывают дистиллированной водой до нейтральной реакции промывных вод. Полученный раствор сушат над безводным сульфатом натрия и упаривают при пониженном давлении при температуре 45°С. Остаток после упаривания хроматографируют на силикагеле (элюирование смесью CCl4:ацетон в соотношениях от 40:1 до 1:1). Элюат, содержащий основное вещество, упаривают при пониженном давлении.
Выход: 11 мг (22%).
Масс-спектр (ESI) m/z = 1117.8 [М]+, 1139.8[M+Na]+, (C67H100N6O8) рассчитано 1117.5(Фиг. 2).
Спектр ЯМР 1Н (CDCl3, 300 МГц), δ, м.д.: 9.74 с (1Н, 10-Н), 9.67 с (1Н, 5-Н), 8.83 с (1H, 20-Н), 8.12 дд (1Н, 3-СН=СН2, J 18.3 и 11.9 Гц), 6.72 уш.т (1Н, 13-CONHCH2CH2OC(O)С13Н27, J ок. 6.0 Гц), 6.40 д (1Н,3-СН=СНН(транс), J 18.3), 6.19 д (1Н,3-СН=СНН(цис), J 11.9), 15-CH2CO2CH3: 5.48 д (1Н, J 19.3) и 5.40 д (1Н, J 19.3); 5.12 уш.т (1Н, 17-CH2CH2CONHCH2CH2OC(O)C13H27, J 5.5 Гц), 4.54 т (2Н, 13-CONHCH2CH2OC(O)C13H27, J 5.5 Гц), 4.61-4.45 м (2Н, 17-Н и 18-Н), 4.21-3.56 м (6Н, 17-CH2CH2CONHCH2CH2OC(O)C13H27 и 13-CONHCH2CH2OC(O)C13H27), 3.92-3.74 м (2Н, 8-СН2СН3), 3.82 с (3Н, 15-CH2CO2CH3), 3.60 с (3Н, 12-СН3), 3.53 с (3Н, 7-СН3), 3.36 с (3Н, 2-СН3) 3.22-2.94 м (2Н, 17-СН2СН2СООСН3), 2.41 т (4Н, 13-CONH(CH2)2OC(O)CH2C12H25, 17-CONH(CH2)2OC(O)CH2C12H25, J 73 Гц,), 2.22-1.93 м (2Н, 17-СН2СН2СООСН3), 13-CONH(CH2)2OC(O)CH2(CH2)11CH3) и 17-CH2CH2CONH(CH2)2OC(O)CH2(CH2)11CH3): 1.71-1.65 м (4Н) и 1.39-1.14 м (40Н); 1.82-1.71 м (6Н, 8-СН2СН3, 18-СН3), 0.95-0.86 м (6Н, 13-CONH(CH2)2OC(O)(CH2)12CH3, 17-CONH(CH2)2OC(O)(CH2)12CH3), -1.48 уш.с (1Н, III-NH), -1.70 уш.с (1Н, I-NH).
| название | год | авторы | номер документа |
|---|---|---|---|
| ВОДОРАСТВОРИМОЕ ПРОИЗВОДНОЕ ХЛОРОФИЛЛА α, МОДИФИЦИРОВАННОЕ ФРАГМЕНТОМ МИРИСТИНОВОЙ КИСЛОТЫ | 2017 |
|
RU2680523C1 |
| Новые производные хлорина е, содержащие фрагменты галактозы | 2019 |
|
RU2706698C1 |
| ПРОИЗВОДНЫЕ 4-АРИЛКУМАРИНОВ И ПРОТИВООПУХОЛЕВОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2010 |
|
RU2440998C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФОТОСЕНСИБИЛИЗАТОРОВ НА ОСНОВЕ ЦИКЛОИМИДОВ ХЛОРИНА Р6 | 2016 |
|
RU2626234C1 |
| ПРОИЗВОДНЫЕ 13(1)-N-{2-[N-(КЛОЗО-МОНОКАРБАДОДЕКАБОРАН-1-ИЛ)-МЕТИЛ]АМИНОЭТИЛ}АМИД-15(2),17(3)-ДИМЕТИЛОВОГО ЭФИРА ХЛОРИНА e, ПРОЯВЛЯЮЩИЕ СВОЙСТВА ФОТОСЕНСИБИЛИЗАТОРА | 2009 |
|
RU2406726C1 |
| КОВАЛЕНТНЫЕ КОНЪЮГАТЫ НА ОСНОВЕ ФТАЛОЦИАНИНОВ И МЕТИЛФЕОФОРБИДА а, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ В МЕДИЦИНЕ | 2019 |
|
RU2722309C1 |
| СПОСОБ СИНТЕЗА ДИ- И ТРИАМИНОХЛОРИНОВ | 2006 |
|
RU2304583C1 |
| ПРОИЗВОДНЫЕ ФТОРСОДЕРЖАЩИХ ХЛОРИНОВ, ПРОЯВЛЯЮЩИЕ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2019 |
|
RU2725876C1 |
| 13(1)-N-(4'-N'N'-ДИМЕТИЛПИПЕРАЗИНИЛ ИОДИД) АМИД, 15(2), 17(3)-ДИМЕТИЛОВЫЙ ЭФИР ХЛОРИНА Е6 | 2022 |
|
RU2794092C1 |
| СЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОГО РАЗРУШЕНИЯ КЛЕТОК ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2004 |
|
RU2259200C1 |
Изобретение относится к химической промышленности, а именно к получению новых биологически активных соединений хлоринового ряда, а именно к производным хлорофилла α, модифицированным одним или двумя фрагментами миристиновой кислоты. Синтезированы новые производные хлорофилла формулы (I) и (II) в качестве потенциальных фотосенсибилизаторов для антибактериальной фотодинамической терапии. 3 ил., 2 пр.
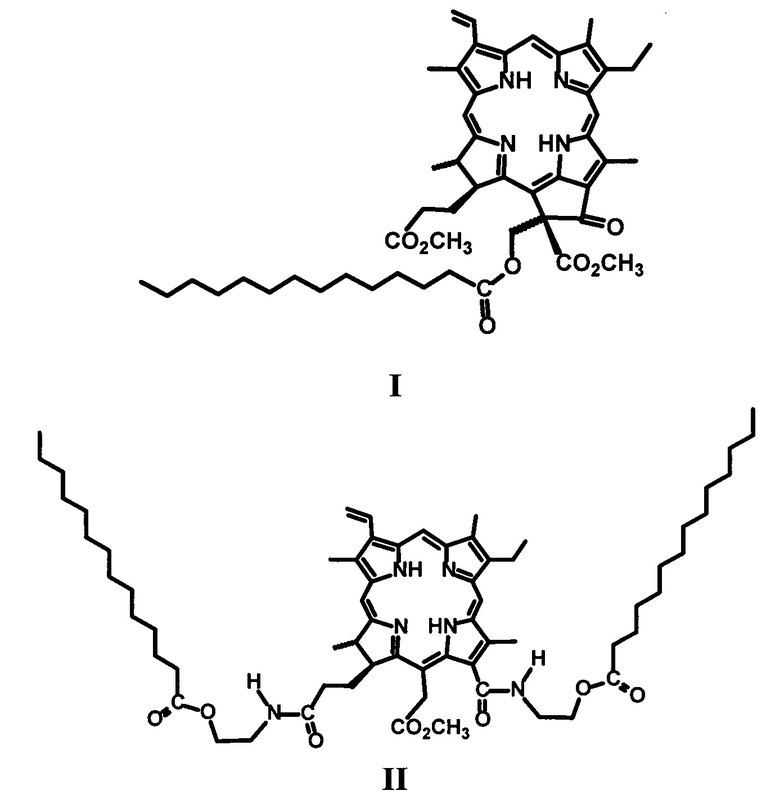
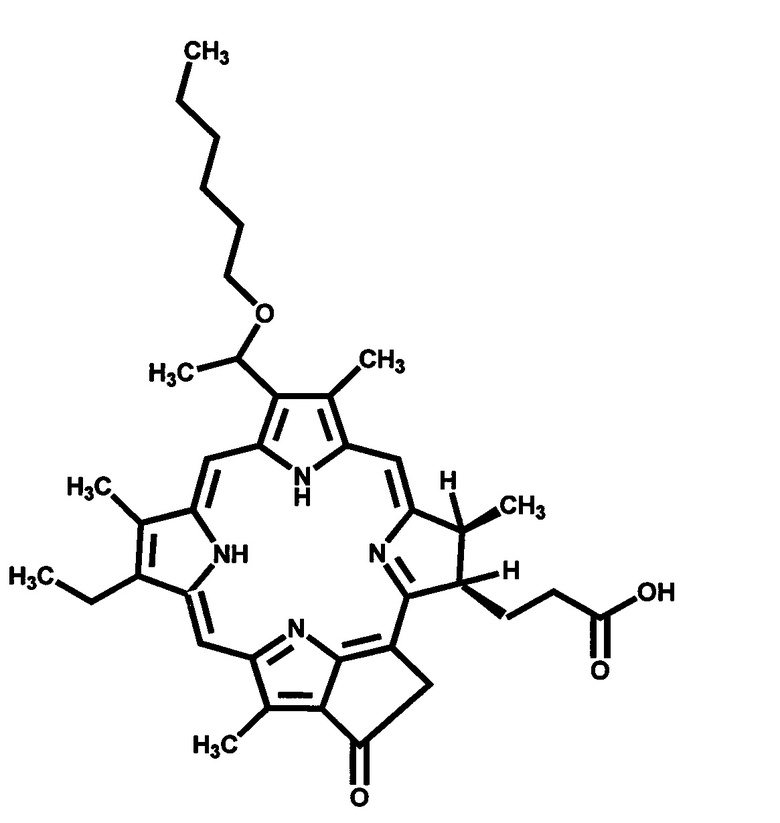
Производные хлорофилла, α модифицированные фрагментами миристиновой кислоты, формулы I-II:
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛОВОГО ЭФИРА ФЕОФОРБИДА (А) | 1999 |
|
RU2180342C2 |
| СПОСОБ СИНТЕЗА ПРОИЗВОДНЫХ ХЛОРОФИЛЛА С ДВУМЯ N, N-ДИМЕТИЛАМИНОМЕТИЛЬНЫМИ ГРУППАМИ | 2007 |
|
RU2337103C9 |
| Д.Р | |||
| Каримов и др | |||
| "Оптимизация условий выделения хлорофиллов из крапивы двудомной (URTICA DIOICA L.) и спирулины (SPIRULINA PLATENSIS)", Химия растительного сырья, 2014, no 4, с.186-196 | |||
| БЕЛЫХ Дмитрий Владимирович, "Химическая модификация периферических заместителей производных хлорофиллов", Автореферат диссертации на соискание ученой степени доктора химических наук, Иваново, 2012. | |||
Авторы
Даты
2018-12-03—Публикация
2018-03-01—Подача