Изобретение относится к новым химическим соединениям класса производных хлорофилла, а именно, амидам хлорина е6, содержащим фрагменты галактозы.
Заявляемые соединения представляют интерес в качестве потенциальных медицинских препаратов для использования при диагностике и фотодинамической терапии онкологических заболеваний.
Общеизвестно, что для обеспечения биодоступности и растворимости потенциальных медицинских препаратов в воде применяется метод введения в порфириновый макроцикл фрагментов различных углеводов, несущих в своей структуре достаточное количество гидроксильных групп, необходимых для гидратации всей биомолекулы в целом. [Renney C. M., Fukuhara G., Inoue Y., Davis A. P. Binding or aggregation? Hazards of interpretation in studies of molecular recognition by porphyrins in water // Chem. Commun. – 2015. – Vol. 51. No. 46. P. 9551–9554. Iqbal Z., Lyubimtsev A., Herrmann T., Hanack M., Ziegler T. Synthesis of Octaglycosylated Zinc(II) Phthalocyanines Synthesis of Octaglycosylated Zinc(I) // Synthesis. – 2010. – Vol. 18. P. 3097–3104. Grin M. A., Lonin I. S., Lakhina A. A., Ol’shanskaya E. S., Makarov A. I., Sebyakin Y. L., Guryeva L. Yu., Toukach P. V., Kononikhin A. S., Kuzmin V. A., Mironov A. F. 1,3-Dipolar cycloaddition in the synthesis of glycoconjugates of natural chlorins and bacteriochlorins // J. Porphyrins Phthalocyanines. – 2009. – Vol. 13. P. 336–345. Silva S., Pereira P. M. R., Silva P., Almeida Paz F. A., Faustino M. A. F., Cavaleiro J. A. S., Tome J. P. C. Porphyrin and phthalocyanine glycodendritic conjugates: synthesis, photophysical and photochemical properties // Chem. Commun. – 2012. – Vol. 48. No. 30. P. 3608–3610]. Все вышесказанное позволяет сделать вывод о перспективности введения фрагментов галактозы в молекулы производных хлорофилла.
Ближайшим аналогом заявляемых соединений можно считать пирофеофорбид 2-деоксиглюкозамид, который получают при взаимодействии активированного N-гидроксисукцинимидом пирофеофорбида а с гидрохлоридом D-глюкозамина. [Zhang M., Zhang Z., Blessington D., Li. H., Busch T. M., Madrak V., Miles J., Chance B., Glickson J. D., Zheng G. Pyropheophorbide 2-Deoxyglucosamide: A New Photosensitizer Targeting Glucose Transporters // Bioconjugate Chem. – 2003. – Vol 14. P. 709–714.].
Описания заявляемых соединений и их свойств в источниках технической информации не обнаружено.
Техническим результатом является расширение арсенала химических соединений новых водорастворимых производных хлорина е6, содержащих несколько галактозных фрагментов. Способность синтезированных соединений к флуоресценции позволяет применять полученные соединения как диагностические препараты и фотосенсибилизаторы для фотодинамической терапии онкологических заболеваний.
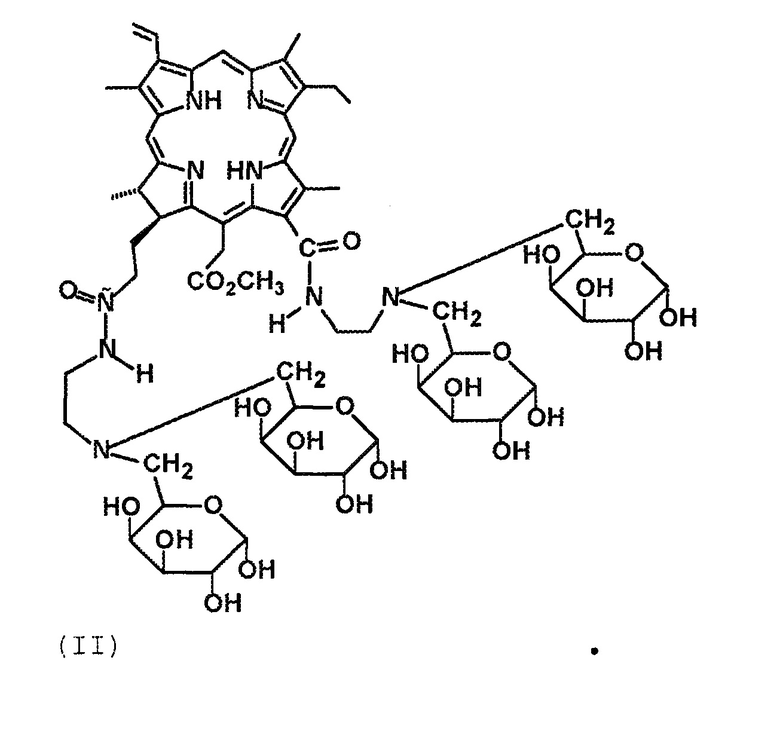
Технический результат достигается тем, что получены новые производные хлорина е6 структурной формулы I в виде 13-N-2-(аминоэтил)-амид-15,17-диметиловый эфир хлорина е6, содержащий два фрагмента галактозы, и структурной формулы II в виде 13,17-N,N-2-(аминоэтил)-диамид-15-метиловый эфир хлорина е6, содержащий четыре фрагмента галактозы:

(I)

(II)
На рис. 1 представлена схема получения заявленных соединений.
Синтез заявляемых соединений Формула I (соединение 4 в схеме (Рис.1)) и Формула II (соединение 7 в схеме (Рис. 1)) осуществлен реакцией алкилирования моно- и диаминопроизводных хлорина е6 трифлатом диизопропилиденгалактозы при кипячении в тетрагидрофуране в присутствии ацетата натрия с последующим снятием диизопропилиденовой защиты галактозных фрагментов (Рис.1). Новые соединения демонстрируются следующими примерами.
Пример 1. Получение соединения 3 (рис.1).
Соединение 3 представляет собой черный мелкокристаллический порошок, растворимо в диметилсульфоксиде, хлороформе. К 300 мг (0.45 ммоль) аминохлорина 2 в 30 мл сухого тетрагидрофурана прибавили 400 мг (1.02 ммоль) трифлата диизопропилиденгалактозы и 84 мг (1.02 ммоль) ацетата натрия. Реакционную смесь кипятили с обратным холодильником в течение 3-х часов (ТСХ, CCl4: ацетон, 4:1). Далее реакционную массу разбавляли 50 мл хлороформа и обрабатывали водой, высушивали над безводным сульфатом натрия и упаривали. Хроматографировали на силикагеле (Alfa Aesar 70–230 mesh) (элюент, CCl4: ацетон, 10:1). Получили 250 мг (48 %) соединения 3. ИК-спектр (KBr), ν/см-1: 3086 (C–H, винильная группа), 1738 (С=О, сложный эфир), 1657 (“амид-I”), 1601 (“хлориновая полоса”), 1514 (“амид-II”). Масс-спектр (ESI), m/z: 1151.83 [M+Н]+, 1173.74 [M+Na]+. ЭСП (CHCl3), λmax/нм, (Iотн (%)): 663 (30), 607 (2), 529 (2), 501 (8), 403 (98). 1Н ЯМР (ДМСО-D7): 9.79 (10-H, c 1H); 9.75 (5-H, c 1H); 9.12 (20-H, c 1H); 8.78 (13(1)-NH (амидный), уш т 1Н, 12.3 Гц); 8.30 (3(1)-Н, д д 1Н, 11.6 и 17.9 Гц); 6.44 (3(2)-Н (транс), д 1Н, 17.7 Гц); 6.17 (3(2)-Н (цис), д 1Н, 11.7 Гц); 15(1)-CH2: 5.56 (д 1Н, 18.9 Гц) и 5.33 (д 1Н, 18.6 Гц); 5.46 (1a-СH-O, 1b-СH-O (галактозные фрагменты), д 2Н, 4.5 Гц); 4.69-4.61 (18-Н, м 1Н); 4.60 (3a-CH-O, 3b-СH-O (галактозные фрагменты), уш д 2Н, 8.1 Гц); 4.47-4.41 (17-Н, м 1Н); 4.40 (4a-CH-O, 4b-СH-O (галактозные фрагменты), уш д 2Н, 7.8 Гц); 4.31 (2a-СH-O, 2b-СH-O (галактозные фрагменты), уш д 2Н, 3.3 Гц); 4.07-3.98 (5a-CH, 5b-CH (галактозные фрагменты), м 2Н); 3.83 (8(1)-СН2, уш к 2Н, 8.0 Гц); 3.73 (15(3)-СН3, с 3Н); 3.59 (17(4)-СН3, с 3Н); 3.53 (12(1)-СН3, 2(1), с 6Н); 3.32 (7(1)-СН3, с 3Н); 6a-CH2, 6b-CH2 (галактозные фрагменты): 3.01-2.89 (м 2Н), 2.84-2.73 (м 2Н); 13(2)-СН2, 13(3)-СН2: 3.91-3.75 (м 2Н) и 3.69-3.47 (м 2Н); 17(1)-СН2, 17(2)-СН2: 2.78-2.64 (м 2Н), 2.43-2.26 (м 2Н); 1.69 (8(2)-СН3, т 3Н, 7.5 Гц); 1.65 (18(1)-СН3, д 3Н, 6.9 Гц); 8a-СН3, 9a-СН3, 11a-СН3, 12a-СН3, 8b-СН3, 9b-СН3, 11b-СН3, 12b-СН3-(диизопропилиденовые группы): 1.51 (с 6Н), 1.36 (с 6Н), 1.22 (с 6Н), 1.18 (с 6Н); -1.79 (I-NH, м 1H); -2.07 (III-NH, м 1H). 13С ЯМР (ДМСО-D7): 129.84 (С(3(1))); 122.40 (С(3(2))); 101.32 (С(10)); 98.97 (С(5)); 96.31 (С(1a), С(1b)); 94.55 (С(20)); 71.42 (С(4a), С(4b)); 70.66 (С(3a), С(3b)); 70.54 (С(2a), С(2b)); 65.37 (С(5a), С(5b)); С(6a), С(6b): 54.77, 54.03; 53.12 (С(17)); 52.27 (С(15(3))); 51.77 (С(17(4))); 48.52 (С(18)); 38.41 (С(13(2)), С(13(3))); 37.21 (С(15(1))); С(17(1)), С(17(2)): 32.54, 31.07; С(8a), С(9a), С(11a), С(12a), С (8b), С(9b), С(11b), С(12b) (диизопропилиденовые группы): 26.46, 26.37, 25.24, 24.45; 23.41 (С(18(1))); 19.40 (С(8(1))); 18.27 (С(8(2))); 12.51 (С(12(1))); 12.07 (С2(1))); 11.47 (С(7(1))).
Получение соединения 4 (формула I).
Соединение 4 представляет собой черный мелкокристаллический порошок, растворимо в диметилсульфоксиде, 95 %-ном этаноле, трифторуксусной кислоте, частично растворимо в метаноле и воде. К 150 мг (0.13 ммоль) конъюгата 3 прибавили 10 мл 90 %-ной трифторуксусной кислоты. Реакционную массу выдерживали при комнатной температуре в течение 3-х часов. Далее отгоняли при пониженном давлении избыток трифторуксусной кислоты. Остаток после упаривания растворяли в 3 мл смеси хлороформ-метанол (1:1), выделяли колоночной хроматографией на силохроме С-120 (SiO2*nH2O) (элюент, последовательно CCl4; CCl4: ацетон, 1:1; CHCl3: метанол, 5:1; CHCl3: метанол, 3:1), (ТСХ, 95 %-ный этанол). Получили 105 мг (81 %) соединения 4. ИК-спектр (KBr), ν/см-1: 3338 (O–H, “галактозные фрагменты”), 1728 (С=О, сложный эфир), 1680 (“амид-I”), 1601 (“хлориновая полоса”), 1543 (“амид-II”). Масс-спектр (ESI), m/z: 992.30 [M+2Н]+, 1013.72 [M+Na]+. ЭСП (CHCl3-C2H5OH), λmax/нм, (Iотн (%)): 663 (31), 609 (4), 530 (4), 501 (1), 402 (99). ЭСП (H2O), λmax/нм, (Iотн (%)): 664 (27), 502 (1), 400 (99). 1Н ЯМР (ДМСО-D7): 9.78 (10-H, c 1H); 9.74 (5-H, c 1H); 9.13 (20-H, c 1H); 9.08 (13(1)-NH (амидный), уш т 1Н, 4.5 Гц); 8.30 (3(1)-Н, д д 1Н, 11.7 и 17.7 Гц); 6.43 (3(2)-Н (транс), д 1Н, 17.7 Гц); 6.16 (3(2)-Н (цис), д 1Н, 11.7 Гц); 15(1)-CH2: 5.55 (д 1Н, 19.2 Гц), 5.34 (д 1Н, 19.2 Гц); 1a-СH-O, 1b-СH-O (галактозные фрагменты): 6.58-6.52 (м 1Н), 6.20-6.12 (м 1Н); 1a-СH-O, 1b-СH-O, 2a-CH-O, 2b-СH-O, 3a-CH-O, 3b-СH-O, 4a-CH-O, 4b-СH-O, 1a-OH, 1b-OH, 2a-OH, 2b-OH, 3a-OH, 3b-OH, 4a-OH, 4b-OH, 5a-CH, 5b-CH (галактозные фрагменты): 5.02-4.96 (м 2Н), 4.80-4.69 (м 2Н), 4.60-4.52 (м 2Н), 4.39-4.30 (м 3Н), 4.18-4.07 (м 1Н), 3.89-3.77 (м 4Н), 3.70-3.56 (м 4Н); 4.44 (17-Н, д 1Н, 9.0 Гц); 4.64 (18-Н, к 1Н, 7.2 Гц); 3.90-3.82 (8(1)-СН2, уш м 2Н); 3.74 (15(3)-СН3, с 3Н); 3.60 (17(4)-СН3, с 3Н); 3.54 (12(1)-СН3, с 3Н); 3.52 (2(1), с 3Н); 3.32 (7(1)-СН3, с 3Н); 6a-CH2, 6b-CH2 (галактозные фрагменты): 3.90-3.77 (м 2Н), 3.70-3.61 (м 2Н); 13(2)-СН2, 13(3)-СН2: 3.91-3.75 (м 2Н), 3.69-3.47 (м 2Н); 17(1)-СН2, 17(2)-СН2: 2.45-2.26 (м 2Н), 2.25-2.08 (м 2Н); 1.70 (8(2)-СН3, т 3Н, 7.8 Гц); 1.66 (18(1)-СН3, д 3Н, 7.2 Гц); -1.80 (I-NH, м 1H); -2.08 (III-NH, м 1H). 13С ЯМР (ДМСО-D7): 129.83 (С(3(1))); 122.40 (С(3(2))); 101.26 (С(10)); 98.99 (С(5)); 103.21 (С(1a), С(1b)); 94.58 (С(20)); 93.22, 98.04, 99.00, 67.99, 69.31, 70.13, 72.66, 74.17 (С(4a), С(4b), С(3a), С(3b), С(2a), С(2b), С(5a), С(5b)); С(6a), С(6b): 55.76, 55.17; 53.14 (С(17)); 52.39 (С(15(3))); 51.83 (С(17(4))); 48.55 (С(18)); 38.57, 38.41 (С(13(2)), С(13(3))); 37.21 (С(15(1))); С(17(1)), С(17(2)): 31.07, 29.92; 23.43 (С(18(1))); 19.44 (С(8(1))); 18.28 (С(8(2))); 12.51 (С(12(1))); 12.23 (С2(1))); 11.47 (С(7(1))).
Пример 2.
Получение соединения 6.
Соединение 6 представляет собой черный мелкокристаллический порошок, растворимо в диметилсульфоксиде, хлороформе. К 340 мг (0.49 ммоль) диаминохлорина 5 в 30 мл сухого тетрагидрофурана прибавили 850 мг (2.17 ммоль) трифлата диизопропилиденгалактозы и 178 мг (2.17 ммоль) ацетата натрия. Реакционную смесь кипятили с обратным холодильником в течение 4-х часов (ТСХ, CCl4: ацетон, 4:2). Далее реакционную массу разбавляли 50 мл хлороформа и обрабатывали водой, высушивали над безводным сульфатом натрия и упаривали. Хроматографировали на силикагеле (Alfa Aesar 70–230 mesh) (элюент, CCl4: ацетон, 5:1). Получили 180 мг (22 %) соединения 6. ИК-спектр (KBr), ν/см-1: 1738 (С=О, сложный эфир), 1662 (“амид-I”), 1601 (“хлориновая полоса”), 1516 (“амид-II”). Масс-спектр (ESI), m/z: 1663.64 [M]+. ЭСП (CHCl3), λmax/нм, (Iотн (%)): 664 (31), 609 (3), 529 (3), 501 (9), 403 (99). 1Н ЯМР (CDCl3): 9.70 (10-H, c 1H); 9.68 (5-H, c 1H); 8.83 (20-H, c 1H); 8.15 (3(1)-Н, д д 1Н, 12.0 и 17.4 Гц); 7.66 (13(1)-NH (амидный), уш т 1Н, 4.5 Гц); 6.40 (3(2)-Н (транс), д 1Н, 18.3 Гц); 6.29 (17(3)-NH (амидный), уш м 1Н); 6.18 (3(2)-Н (цис), д 1Н, 11.1 Гц); 15(1)-CH2: 5.72 (д 1Н, 18.9 Гц), 5.23 (д 1Н, 18.3 Гц); 1a-СH-O, 1b-СH-O, 1с-СH-O, 1d-СH-O (галактозные фрагменты): 5.39 (д 2Н, 5.4 Гц), 5.22 (д 2Н, 4.5 Гц); 2a-СH-O, 2b-СH-O, 2c-СH-O, 2d-СH-O, 3a-CH-O, 3b-СH-O, 3c-CH-O, 3d-СH-O, 4a-CH-O, 4b-СH-O, 4c-CH-O, 4d-СH-O, 5a-CH, 5b-CH, 5c-CH, 5d-CH (галактозные фрагменты): 4.43 (уш д 2Н, 8.1 Гц), 4.26 (уш д 2Н, 9.0 Гц), 4.22-4.06 (уш м 6Н), 4.03-3.91 (уш м 4Н), 3.75-3.66 (уш м 2Н); 4.50 (18-Н, к 1Н, 7.0 Гц); 4.57 (17-Н, д 1Н, 7.5 Гц); 3.90-3.78 (8(1)-СН2, м 2Н); 3.85 (15(3)-СН3, с 3Н); 3.61 (12(1)-СН3, с 3Н); 3.53 (2(1)-СН3, с 3Н); 3.37 (7(1)-СН3, с 3Н); 6a-CH2, 6b-CH2, 6c-CH2, 6d-CH2 (галактозные фрагменты): 3.05-2.89 (м 4Н), 2.70-2.50 (м 4Н); 13(2)-СН2, 13(3)-СН2: 4.04-3.89 (м 4Н); 17(1)-СН2, 17(2)-СН2: 3.33-3.07 (м 4Н); 17(4)-СН2, 17(5)-СН2: 2.52-2.23 (м 2Н), 2.06-1.87 (м 2Н); 1.82-1.70 (18(1)-СН3, 8(2)-СН3, м 6Н); 8a-СН3, 9a-СН3, 11a-СН3, 12a-СН3, 8b-СН3, 9b-СН3, 11b-СН3, 12b-СН3, 8c-СН3, 9c-СН3, 11c-СН3, 12c-СН3, 8d-СН3, 9d-СН3, 11d-СН3, 12d-СН3-(диизопропилиденовые группы): 1.50 (с 6Н), 1.33 (с 6Н), 1.28 (с 6Н), 1.12 (с 6Н), 1.11 (с 6Н), 0.96 (с 6Н), 0.88 (с 6Н), 0.58 (с 6Н); -1.59 (I-NH, м 1H); -1.84 (III-NH, м 1H). 13С ЯМР (CDCl3): 129.13 (С(3(1))); 121.49 (С(3(2))); 100.98 (С(10)); 98.76 (С(5)); 96.44, 96.23 (С(1a), С(1b), С(1c), С(1d)); 93.43 (С(20)); С(2a), С(2b), С(2с), С(2d), С(3a), С(3b), С(3c), С(3d), С(4a), С(4b), С(4c), С(4d), С(5a), С(5b), С(5с), С(5d): 71.75, 71.55, 70.65, 70.52, 70.43, 70.33, 65.42, 65.14; С(6a), С(6b): 54.03, 54.77; 53.12 (С(17)); 52.88 (С(18)); 52.05 (С(15(3))); 38.16 (С(13(2)), С(13(3))); 37.21 (С(15(1))); С(17(1)), С(17(2)): 37.47, 37.00; 32.71, 30.50 (С(17(4)), С(17(5))); Сa(8), Сa(9), Сa(11), Сa(12), Сb(8), Сb(9), Сb(11), Сb(12), Сc(8), Сc(9), Сc(11), Сc(12), Сd(8), Сd(9), Сd(11), Сd(12) (диизопропилиденовые группы): 26.07, 26.00, 25.85, 25.60, 24.70, 24.60, 24.00, 23.47; 23.16 (С(18(1))); 19.75 (С(8(1))); 17.77 (С(8(2))); 12.08 (С(12(1))); 12.17 (С2(1))); 11.37 (С(7(1))).
Получение соединения 7 (Формула II).
Соединение 7 представляет собой черный мелкокристаллический порошок, растворимо в диметилсульфоксиде, трифторуксусной кислоте, водно-этанольной смеси и воде. К 130 мг (0.078 ммоль) конъюгата 6 прибавили 10 мл 90 %-ной трифторуксусной кислоты. Реакционную массу выдерживали при комнатной температуре в течение 4-х часов. Далее отгоняли при пониженном давлении избыток трифторуксусной кислоты. Остаток после упаривания растворяли в 3 мл метанола выделяли колоночной хроматографией на силохроме С-120 (SiO2*nH2O) (элюент, последовательно CCl4; CCl4: ацетон, 1:1; CHCl3: метанол, 5:1; CHCl3: метанол, 1:1), (ТСХ, 95 %-ный этанол). Получили 80 мг (76 %) соединения 7. ИК-спектр (KBr), ν/см-1: 3341 (O–H, “галактозные фрагменты”), 1676 (“амид-I”), 1603 (“хлориновая полоса”), 1543 (“амид-II”). Масс-спектр (ESI), m/z: 1343.47.30 [M+Н]+. ЭСП (C2H5OH-H2O), λmax/нм, (Iотн (%)): 661 (25), 605 (3), 526 (3), 499 (8), 399 (87). ЭСП (H2O), λmax/нм, (Iотн (%)): 658 (22), 603 (3), 501 (8), 400 (93). 1Н ЯМР (ДМСО-D7): 9.81 (10-H, c 1H); 9.78 (5-H, c 1H); 9.16 (20-H, c 1H); 9.38 (13(1)-NH (амидный), уш м 1Н); 8.08 (17(3)-NH (амидный), уш м 1Н); 8.33 (3(1)-Н, д д 1Н, 12.0 и 17.4 Гц); 6.49 (3(2)-Н (транс), д 1Н, 18.3 Гц); 6.22 (3(2)-Н (цис), д 1Н, 12.0 Гц); 15(1)-CH2: 5.52 (д 1Н, 18.6 Гц), 5.30 (д 1Н, 18.3 Гц); 1a-СH-O, 1b-СH-O, 1с-СH-O, 1d-СH-O, 2a-СH-O, 2b-СH-O, 2c-СH-O, 2d-СH-O, 3a-CH-O, 3b-СH-O, 3c-CH-O, 3d-СH-O, 4a-CH-O, 4b-СH-O, 4c-CH-O, 4d-СH-O, 5a-CH, 5b-CH, 5c-CH, 5d-CH, 6a-CH2, 6b-CH2, 6c-CH2, 6d-CH2, 1a-OH, 1b-OH, 2a-OH, 2b-OH, 3a-OH, 3b-OH, 4a-OH, 4b-OH, 1c-OH, 1d-OH, 2c-OH, 2d-OH, 3c-OH, 3d-OH, 4c-OH, 4d-OH (галактозные фрагменты): 5.64-5.20 (уш м 6Н), 5.21-4.70 (уш м 6Н), 4.57-4.11 (уш м 6Н), 3.91-3.76 (уш м 4Н), 3.75-3.50 (уш м 9Н), 3.46-3.20 (уш м 9Н), 3.22-3.10 (уш м 4Н); 4.63 (18-Н, к 1Н, 6.7 Гц); 4.42 (17-Н, д 1Н, 7.2 Гц); 3.91-3.82 (8(1)-СН2, уш м 2Н); 3.74 (15(3)-СН3, с 3Н); 3.56 (12(1)-СН3, с 3Н); 3.55 (2(1), с 3Н); 3.34 (7(1)-СН3, с 3Н); 13(2)-СН2, 13(3)-СН2: 3.50-3.23 (м 4Н); 17(1)-СН2, 17(2)-СН2: 2.66-2.39 (м 4Н); 17(4)-СН2, 17(5)-СН2: 2.26-2.00 (м 4Н); 1.76-1.63 (8(2)-СН3, 18(1)-СН3, м 6Н); -1.72 (I-NH, м 1H); -2.00 (III-NH, м 1H). 13С ЯМР (ДМСО-D7): 129.82 (С(3(1))); 122.51 (С(3(2))); 101.36 (С(10)); 98.97 (С(5)); С(1a), С(1b), С(1с), С(1d), С(2a), С(2b), С(2c), С(2d), С(3a), С(3b), С(3c), С(3d), С(4a), С(4b), С(4c), С(4d), С(5a), С(5b), С(5c), С(5d), С(6a), С(6b), С(6c), С(6d): 68.75, 69.35, 69.69, 70.53, 72.10, 73.51, 76.47, 77.70, 93.26, 93.39, 97.81, 97.94, 98.97, 102.22, 102.32, 103.12; 94.65 (С(20)); 53.29 (С(17)); 52.55 (С(15(3))); 48.81 (С(18)); 37.47 (С(15(1))); 32.67, 32.75 (С(13(2)), С(13(3))); С(17(1)), С(17(2)): 29.47, 30.07; С(17(4)), С(17(5)): 30.73, 30.79; 23.55 (С(18(1))); 19.44 (С(8(1))); 18.31 (С(8(2))); 12.57 (С(12(1))); 12.27 (С2(1))); 11.50 (С(7(1))).
Из литературы известно, что порфирин-галактозные конъюгаты могут избирательно накапливаться в опухоли, поскольку раковые клетки имеют более высокое поглощение галактозы, чем нормальные клетки [Pereira P. M. R., Silva S., Ramalho J. S., Gomes C. M., Girao H., Cavaleiro J. A. S., Ribeiro C. A. F., Tome J. P. C., Fernandes R. The role of galectin-1 in in vitro and in vivo photodynamic therapy with a galactodendritic porphyrin // European Journal of Cancer. – 2016. – Vol. 68. P. 60–69. Feng L., Xujun H., Li L., Li W., Tianjun L. A novel water-soluble near-infrared glucose-conjugated porphyrin: synthesis, properties and its optical imaging effect // J. Porphyrins Phthalocyanines. – 2011. – Vol. 15. No. 4. P. 217–222. Arja K., Elgland M., Appelqvist H., Konradsson P., Lindgren M., Nilsson K. P. R. Synthesis and Characterization of Novel Fluoro-glycosylated Porphyrins that can be Utilized as Theranostic Agents // Chemistry Open. – 2018. – Vol. 7. No. 7. P. 495–503. Menendez M. I., Lopez R., Yanez M., Cardenas-Jiron G. Tautomerization mechanism and spectral properties of porphyrin-glucose complexes as models of antibacterial material // Theor. Chem. Acc. – 2016. – Vol. 135. No. 5. P. 1–15. Arif F., Hiroki T., Tatsuya I., Yusuke A., Maho U., Masaya T., Shiho H., Makoto O., Tsumoru M., Kiyomi K. Synthesis, photophysical properties, and photodynamic activity of positional isomers of TFPP-glucose conjugates // Bioorg. Med. Chem. – 2018. – Vol. 26. No. 8. P. 1848–1858. Pereira P. M. R., Rizvi W., Bhupathiraju N. V. S. D. K., Berisha N., Fernandes R., Tome J. P. C., Drain C. M. Carbon-1 versus carbon-3 linkage of D-galactose to porphyrins: Synthesis, uptake, and photodynamic efficiency // Bioconjugate Chemistry. – 2018. – Vol. 29. No. 2. P. 306–315].
Литературные данные показывают, что углеводные фрагменты, содержащиеся на периферии порфириновых макроциклов, способствуют взаимодействию с клеточными структурами. [Ming W., Zuo-Wei Y., Yang L., Dao-Fu F., Jia-Jia Y., Xue-Bo Y., Tao Z., Dong-Yan C., Tian-Jun L., Xi-Zeng F. Glycosyl-Modified Diporphyrins for in Vitro and in Vivo Fluorescence Imaging // ChemBioChem. – 2013. – Vol. 14. No. 8. P. 979–986. Vicente M. G. H., Bhupathiraju N. V. S. D. K., Hu X., Zhou Z., Fronczek F. R., Couraud P. O., Weksler B., Romero I. A. Synthesis and in vitro evaluation of BBB permeability, tumor cell uptake and cytotoxicity of a series of carboranylporphyrin conjugates // J. Med. Chem. – 2014. – Vol. 57. No. 15. P. 6718–6728. Renney C. M., Fukuhara G., Inoueb Y., Davis A. P. Binding or aggregation? Hazards of interpretation in studies of molecular recognition by porphyrins in water // Chem. Commun. – 2015. – Vol. 51. P. 9551–9554. Iqbal Z., Masilela N., Nyokong T., Lyubimtsev A., Hanack M., Zieglerb T. Spectral, photophysical and photochemical properties of tetra- and octaglycosylated zinc phthalocyanines // Photochemical & Photobiological Sciences. – 2012. – Vol. 11. No. 4. P. 679–686].
Полученные соединения являются водорастворимыми, что подтверждается флуоресценцией водных растворов и записанными спектрами UV-vis водных растворов. Способность синтезированных соединений к флуоресценции позволяет рассматривать полученные соединения как диагностические препараты и фотосенсибилизаторы для фотодинамической терапии онкологических заболеваний.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВОДОРАСТВОРИМОЕ ПРОИЗВОДНОЕ ХЛОРОФИЛЛА α, МОДИФИЦИРОВАННОЕ ФРАГМЕНТОМ МИРИСТИНОВОЙ КИСЛОТЫ | 2017 |
|
RU2680523C1 |
| Соединения фторхинолонового ряда на основе производных пиридоксина, обладающие антибактериальными свойствами | 2019 |
|
RU2713932C1 |
| 13(1)-N-(4'-N'N'-ДИМЕТИЛПИПЕРАЗИНИЛ ИОДИД) АМИД, 15(2), 17(3)-ДИМЕТИЛОВЫЙ ЭФИР ХЛОРИНА Е6 | 2022 |
|
RU2794092C1 |
| ПРОИЗВОДНЫЕ ХЛОРОФИЛЛА α, МОДИФИЦИРОВАННЫЕ ФРАГМЕНТАМИ МИРИСТИНОВОЙ КИСЛОТЫ | 2018 |
|
RU2673888C1 |
| ПРОИЗВОДНЫЕ 13(1)-N-{2-[N-(КЛОЗО-МОНОКАРБАДОДЕКАБОРАН-1-ИЛ)-МЕТИЛ]АМИНОЭТИЛ}АМИД-15(2),17(3)-ДИМЕТИЛОВОГО ЭФИРА ХЛОРИНА e, ПРОЯВЛЯЮЩИЕ СВОЙСТВА ФОТОСЕНСИБИЛИЗАТОРА | 2009 |
|
RU2406726C1 |
| СПОСОБ СИНТЕЗА ДИ- И ТРИАМИНОХЛОРИНОВ | 2006 |
|
RU2304583C1 |
| ФТОРСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ТЕВИНОЛА И ОРВИНОЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2012 |
|
RU2506265C1 |
| Четвертичные аммониевые соли на основе производных витамина В6 | 2015 |
|
RU2607522C1 |
| Способ получения аммонийных солей 3-амино-8-гидрокси-1,6-диоксо-4-циано-2,7-диазаспиро[4.4]нон-3-ен-2-идов | 2016 |
|
RU2631856C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ХРОМАН-2-АМИНОВ | 2016 |
|
RU2652119C1 |

Изобретение относится к применимым в медицине амидам хлорина е6, содержащим фрагменты галактозы, формул


Предложены новые производные для использования при диагностике и фотодинамической терапии онкологических заболеваний. 1 ил., 2 пр.
Новые производные хлорина е6 структурной формулы I в виде 13-N-2-(аминоэтил)-амид-15,17-диметиловый эфир хлорина е6, содержащий два фрагмента галактозы, и структурной формулы II в виде 13,17-N,N-2-(аминоэтил)-диамид-15-метиловый эфир хлорина е6, содержащий четыре фрагмента галактозы

| Min Chang et al | |||
| Bioconjugate Chem., 2003, 14, 709-714 | |||
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ЭКСПРЕССИРУЮЩАЯ МОДУЛЬНЫЙ ПОЛИПЕПТИД ДЛЯ ДОСТАВКИ ФОТОСЕНСИБИЛИЗАТОРА, И ШТАММ ESCHERICHIA COLI ВКПМ В-8356 - ПРОДУЦЕНТ МОДУЛЬНОГО ПОЛИПЕПТИДА | 2004 |
|
RU2265055C2 |
| WO 2011045029 A1, 21.04.2011 | |||
| КОМПОЗИЦИЯ ДЛЯ ФОТОДИНАМИЧЕСКОГО ПОВРЕЖДЕНИЯ КЛЕТОК-МИШЕНЕЙ И СПОСОБ ФОТОДИНАМИЧЕСКОГО ПОВРЕЖДЕНИЯ КЛЕТОК-МИШЕНЕЙ | 1996 |
|
RU2066552C1 |
Авторы
Даты
2019-11-20—Публикация
2019-02-05—Подача