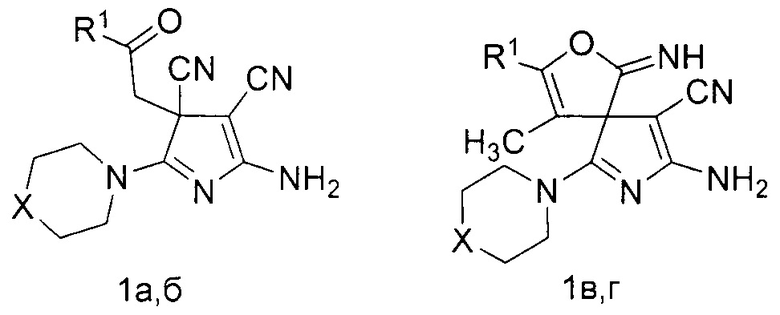
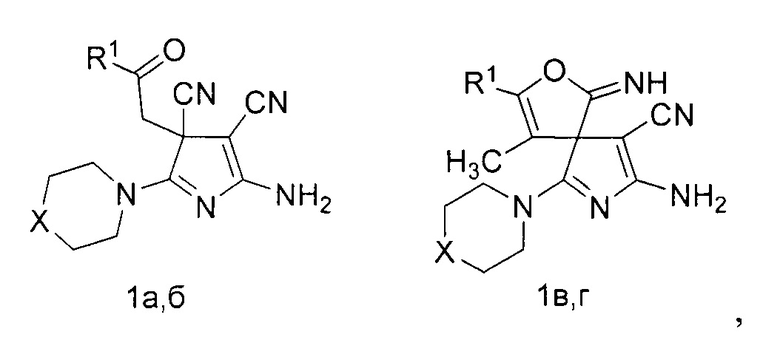
Изобретение относится к области органической химии, а именно к способу получения производных 5-амино-3H-пиррол-4-карбонитрилов общей формулы (1),
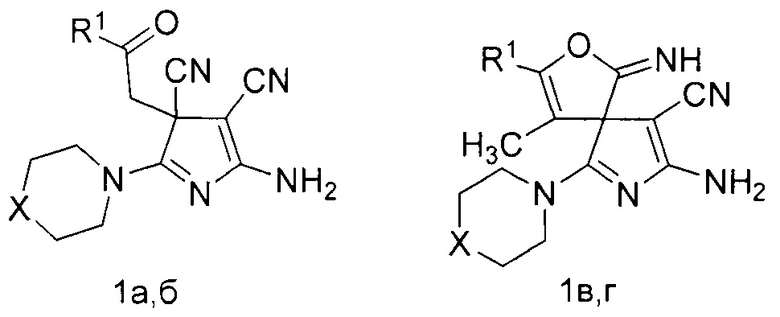
где R1=C6H5, X=S (1a); R1=4-MeC6H4, X=O (1б); R1=C6H5, X=S (1в); R1=CH3, X=S (1г), имеющих в структуре в третьем положении 3H-пиррольного цикла карбонилсодержащий заместитель либо спиросочлененное фурановое кольцо, которые могут быть использованы в качестве биологически активных соединений и в тонком органическом синтезе.
Производные 3H-пиррола являются неароматическими азагетероциклами, малая изученность которых обусловлена ограниченностью числа подходов к их синтезу. Особенностью данной группы соединений является наличие в структуре азациклопентадиенового фрагмента, который во многом определяет их синтетический потенциал.
Известен способ получения 3H-пирролов, в основе которого лежит взаимодействие эфира изоцианоуксусной кислоты с алленами (J.-Y Liao, P.-L. Shao, Y. Zhao // Journal of the American Chemical Society. 2015, Vol. 137, №2, P. 628-631).
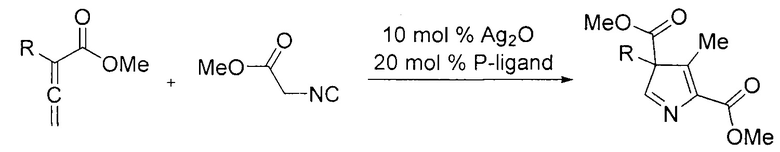
Данный способ приводит к энантиоселективному образованию 3H-пирролов, содержащих в структуре в третьем и пятом положениях сложноэфирные заместители. К недостаткам метода можно отнести использование соединений серебра, а также труднодоступных фосфорсодержащих лигандов.
Известен многокомпонентный синтез 3H-пирролов, в основе которого лежит взаимодействие алкил-2-хлор-2-оксоацетатов, изонитрилов, триалкилфосфитов и тозилметилизонитрила (I. Yavari, Е. Ghanbari, R. Hosseinpour // Helvetica Chimica Acta. 2014, Vol. 97, P. 1004-1008).
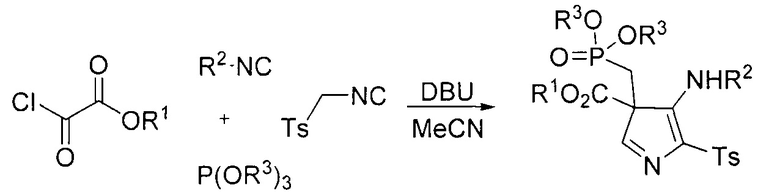
Данный подход позволяет синтезировать 3Н-пирролы с фосфорсодержащими фрагментами в третьем положении. Недостатком процесса является умеренные выходы продуктов до 60%.
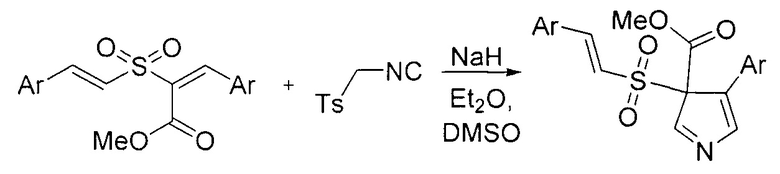
Также описан способ получения биологически активных 3Н-пирролов с антимикробной активностью, основанный на взаимодействии тозилметилизоцианида с непредельными сульфонами (V. Padmavathi, L.T. Radha, K. Mahesh, A. Padmaja // Chemical and Pharmaceutical Bulletin. 2009, Vol. 57, №11, P. 1200-1205). Недостатком этого подхода является труднодоступность исходных сульфонов.
Описан способ синтеза 3Н-пирролов, основанный на взаимодействии оксимов кетонов с ацетиленом в присутствии основания. Этот подход дает возможность синтезировать 3Н-пирролы с алкильными и арильными (гетарильными) заместителями в положениях 2 и 3 (D.A. Shabalin, E.Yu. Schmidt, M.Yu. Dvorko, N.I. Protsuk, I.A. Ushakov, B.A. Trofimov // Russian Journal of Organic Chemistry. 2015, Vol. 51, №9, P. 1346-1348; D.A. Shabalin, Т.Е. Glotova, I.A. Ushakov, M.Yu. Dvorko, A.V. Vashchenko, V.I. Smirnov, E.Yu. Schmidt, A.I. Mikhaleva, B.A. Trofimov // Mendeleev Communications. 2014, Vol. 24, P. 368-369). Недостатками метода являются низкий выход продуктов (8-36%), а также необходимость проведения синтезов при повышенном давлении.
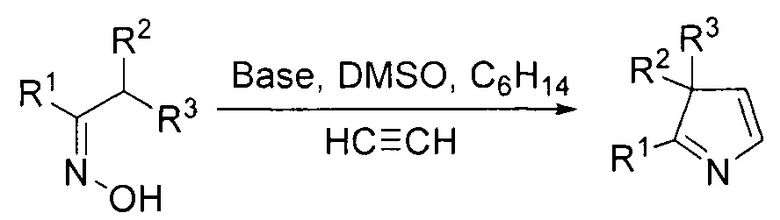
Показан также подход к синтезу 3Н-пирролов на основе Pd-катализируемого внутримолекулярного превращения оксимов (J. Ichikawa, K. Sakoda, J. Mihara, N. Ito // Journal of Fluorine Chemistry. 2006, Vol. 127, P. 489-504).
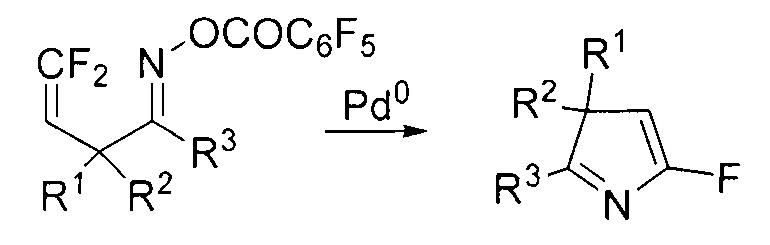
Этот способ позволяет синтезировать труднодоступные 5-фторзамещенные 3Н-пирролы. К недостатку процесса можно отнести необходимость использования дорогостоящих палладиевых катализаторов.
Известен трехкомпонентный метод синтеза 3H-пирролов на основе реакции кетонов, малононитрила и меркаптанов (P. Das, S. Ray, С. Mukhopadhyay // Organic Letters. 2013, Vol. 15, №22, P. 5622-5625).
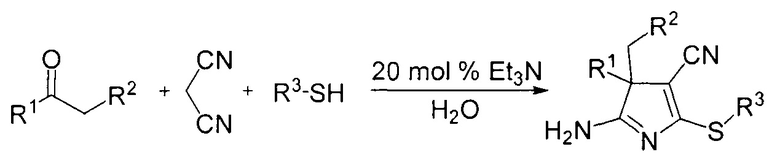
Для данных соединений описана возможность их использования в качестве ингибиторов коррозии стали. Недостатком процесса является возможность использования ограниченного числа меркаптанов, главным образом ароматического ряда.
На основе 4-оксобутан-1,1,2,2-тетракарбонитрилов и морфолина в среде этилацетата при охлаждении до -10°С описано получение 5-амино-3Н-пирролов (M.Yu. Belikov, O.V. Ershov, A.V. Eremkin, O.E. Nasakin, V.A. Tafeenko, E.V. Nurieva // Tetrahedron Letters. 2011, Vol. 52, P. 6407-6410) и спиропроизводных 3Н-пирролов (M.Yu. Belikov, O.V. Ershov, I.V. Lipovskaya, S.V. Fedoseev, О E. Nasakin // Russian Journal of Organic Chemistry. 2013, Vol. 49, №6, P. 864-866).
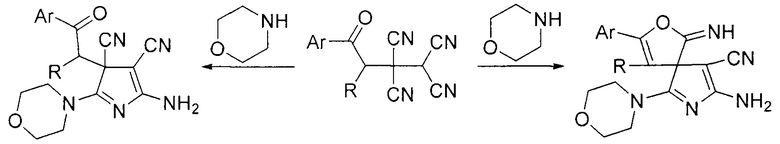
Данный метод позволяет получить 3Н-пирролы на основе 4-оксобутан-1,1,2,2-тетракарбонитрилов с ароматическими заместителями. Недостатком является длительность протекания процесса (3-4 суток), низкая температура проведения процесса, а также невозможность получения 3Н-пирролов на основе 4-оксоалкан-1,1,2,2-тетракарбонитрилов с алкильными заместителями при карбонильной группе.
Наиболее близким по технической сущности являются способ, основанный на взаимодействии 4-оксоалкан-1,1,2,2-тетракарбонитрилов с морфолином. Так известен способ получения спиросочлененных 3H-пирролов взаимодействием 4-оксоалкан-1,1,2,2-тетракарбонитрилов с морфолином (О.В. Ершов, М.Ю. Беликов, О.Е. Насакин. Патент RU 2475489 С1, 2013).
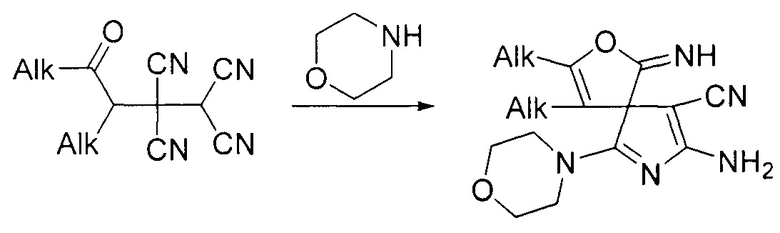
Существенным недостатком является ограниченность реакции субстратами, содержащими только алкильные заместители.
Задачей заявляемого изобретения является разработка простого способа получения производных 5-амино-3H-пиррол-4-карбонитрилов, которые могут быть использованы в качестве биологически активных соединений и в тонком органическом синтезе.
Техническим результатом является получение неописанных в литературе производных 5-амино-3H-пиррол-4-карбонитрилов (1а-г) с выходами не менее 65%..
Технический результат достигается тем, что способ получения производных 5-амино-3Н-пиррол-4-карбонитрилов общей формулы (1а-г),
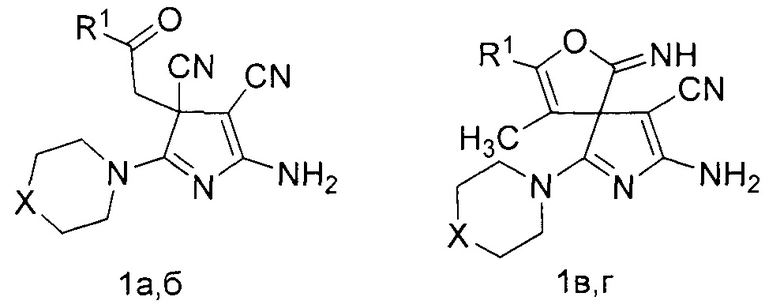
где R1=C6H5, X=S (1a); R1=4-MeC6H4, X=O (1б); R1=C6H5, X=S (1в); R1=CH3, X=S (1г), согласно изобретению включает взаимодействие 4-оксоалкан-1,1,2,2-тетракарбонитрила с вторичным амином в растворителе, в качестве 4-оксоалкан-1,1,2,2-тетракарбонитрила используют 4-оксо-4-фенилбута-1,1,2,2-тетракарбонитрил или 4-оксо-4-(р-толил)бута-1,1,2,2-тетракарбонитрил или 3-метил-4-оксо-4-фенилбута-1,1,2,2-тетракарбонитрил или 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрил, а в качестве вторичного амина используют морфолин или тиоморфолин в мольном соотношении исходных компонентов как 1:3, а взаимодействие ведут в смеси ацетонитрил : диэтиловый эфир в объемном соотношении 2:1 при температуре 0-5°С.
Отличием заявленного способа от прототипа является использование 4-оксоалкан-1,1,2,2-тетракарбонитрила и вторичного амина в мольном соотношении 1:3, а также проведение реакции в смеси ацетонитрила с диэтиловым эфиром в объемном соотношении 2:1 при температуре 0-5°С.
Способ получения производных 5-амино-3H-пиррол-4-карбонитрилов общей формулы
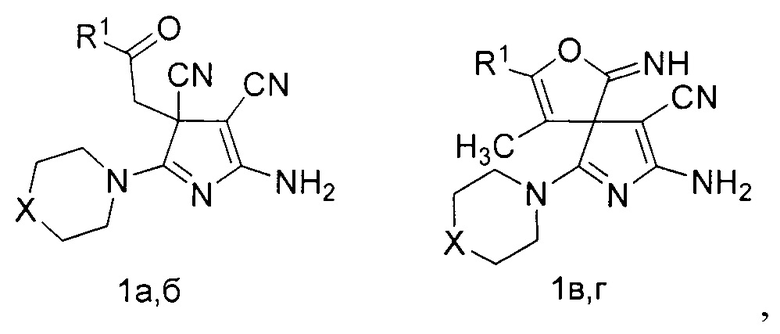
где R1=C6H5, X=S (1a); R1=4-MeC6H4, X=O (1б); R1=C6H5, X=S (1в); R1=CH3, X=S (1г), заключается в том, что к раствору 1 ммоль соответствующего 4-оксоалкан-1,1,2,2-тетракарбонитрила (2) в 3-4 мл смеси ацетонитрил-диэтиловый эфир (2 к 1 по объему) при температуре 0-5°С добавляют 3 ммоль вторичного амина (3,4).
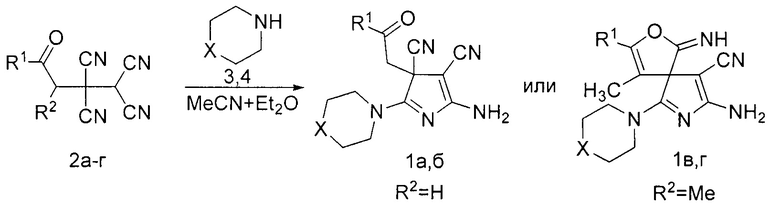
R1=C6H5, X=S (1a); R1=4-MeC6H4, X=O (1б); R1=C6H5, X=S (1в); R1=CH3, X=S (1г), R1=C6H5, R2=H (2a); R1=4-MeC6H4, R2=H (2б); R1=C6H5, R2=CH3 (2в); R1=R2=CH3 (2г).
Реакционную массу перемешивают при данной температуре в течение 12-20 часов. После завершения реакции (контроль ТСХ) реакционную массу охлаждают до -10°С образовавшийся твердый продукт отфильтровывают, промывают на фильтре 2 мл охлажденного (-10°С) диэтилового эфира. Полученный осадок сушат в вакуум-эксикаторе до постоянной массы. Целевые гетероциклы (1а-г) выделяют фильтрованием выпавшего осадка с последующей его осушкой в вакуум-эксикаторе над CaCl2. Метод характеризуется простотой исполнения и отсутствием специального оборудования.
Сущность изобретения включает включает взаимодействие 4-оксоалкан-1,1,2,2-тетракарбонитрила с вторичным амином в растворителе, в качестве 4-оксоалкан-1,1,2,2-тетракарбонитрила используют 4-оксо-4-фенилбута-1,1,2,2-тетракарбонитрил или 4-оксо-4-(р-толил)бута-1,1,2,2-тетракарбонитрил или 3-метил-4-оксо-4-фенилбута-1,1,2,2-тетракарбонитрил или 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрил, а в качестве вторичного амина используют морфолин или тиоморфолин в мольном соотношении исходных компонентов как 1:3, а взаимодействие ведут в смеси ацетонитрил : диэтиловый эфир в объемном соотношении 2:1 при температуре 0-5°С. Строение полученных соединений подтверждены данными ЯМР 1Н спектроскопии и масс-спектрометрии. При получении соединений (1в, г) наблюдается образование смеси геометрических изомеров по иминогруппе. При описании спектров ЯМР 1Н сигналы атомов водорода, отнесенные к минорному диастереомеру, отмечены звездочкой *.
Пример 1. Способ получения 5-амино-3-(2-оксо-2-фенилэтил)-2-тиоморфолино-3Н-пиррол-3,4-дикарбонитрила (1а). К раствору 1 ммоль соответствующего 4-оксоалкан-1,1,2,2-тетракарбонитрила (2) в 3-4 мл смеси ацетонитрил-диэтиловый эфир (2 к 1 по объему) при температуре 0-5°С добавляют 3 ммоль вторичного амина (3,4). Реакционную массу перемешивают при данной температуре в течение 12-20 часов. После завершения реакции (контроль ТСХ) реакционную массу охлаждают до -10°С образовавшийся твердый продукт отфильтровывают, промывают на фильтре 2 мл охлажденного (-10°С) диэтилового эфира. Полученный осадок сушат в вакуум-эксикаторе до постоянной массы. При этом в качестве 4-оксоалкан-1,1,2,2-тетракарбонитрила использовали 4-оксо-4-фенилбута-1,1,2,2-тетракарбонитрил (2а), в качестве вторичного амина тиоморфолин (4). Выход 70%, т.пл. 204-205°С (разл.). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 2.70-2.75 м (4Н, 2CH2S), 3.92 д (1Н, СН2СО, J=17.8), 4.05 д (1Н, СН2СО, J=17.8), 3.90-4.10 м (4Н, 2CH2N), 7.27 с (2Н, NH2), 7.54-7.57 м (2Н, С6Н5), 7.67-7.71 м (1Н, С6Н5), 7.99-8.01 м (2Н, С6Н5). Масс-спектр, m/z (Iотн, %): 351 (20) [М]+, 232 (100).
Пример 2. Способ получения 5-амино-3-(2-оксо-2-[4-метилфенил]этил)-2-морфолино-3Н-пиррол-3,4-дикарбонитрила (1б). Получали аналогично примеру 1, отличающемуся тем, что в качестве 4-оксоалкан-1,1,2,2-тетракарбонитрила использовали 4-оксо-4-(р-толил)бута-1,1,2,2-тетракарбонитрила (2б), в качестве вторичного амина морфолин (3). Выход 72%, т.пл. 215-216°С (разл.). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 2.39 с (3Н, СН3), 3.60-3.80 м (8Н, 4СН2), 3.87 д (1H, СН2СО, J=17.7), 4.02 д (1Н, СН2СО, J=17.7), 7.25 с (2Н, NH2), 7.35 д (2Н, С6Н5, J=7.9), 7.89 д (1H, С6Н5, J=7.9). Масс-спектр, m/z (Iотн, %): 349 (28) [М]+, 216 (100).
Пример 3. Способ получения 8-амино-1-имино-4-метил-3-фенил-6-тиоморфолино-2-окса-7-азаспиро[4.4]нона-3,6,8-триен-9-карбонитрила (1в). Получали аналогично примеру 1, отличающемуся тем, что в качестве 4-оксоалкан-1,1,2,2-тетракарбонитрила использовали 3-метил-4-оксо-4-фенилбута-1,1,2,2-тетракарбонитрила (2в), в качестве вторичного амина тиоморфолин (4). Выход 68%, т.пл. 176-177°С (разл.). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.75 с*, 1.78 с (3Н, СН3); 2.45-2.80 м (4Н, 2CH2S); 3.40-4.15 м (4Н, 2CH2N); 7.16 с, 7.27 с* (2Н, NH2); 7.44-7.53 м (3Н, С6Н5); 7.58-7.63 м (2Н, С6Н5), 9.00 с, 9.23 с* (1H, NH). Масс-спектр, m/z (Iотн, %): 365 (74) [М]+, 232 (41), 77 (100).
Пример 4. Способ получения 8-амино-1-имино-3,4-диметил-6-тиоморфолино-2-окса-7-азаспиро[4.4]нона-3,6,8-триен-9-карбонитрила (1г). Получали аналогично примеру 1, отличающемуся тем, что в качестве 4-оксоалкан-1,1,2,2-тетракарбонитрила использовали 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрила (2г), в качестве вторичного амина тиоморфолин (4). Выход 72%, т.пл. 137-138°С (разл.). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.44 с*, 1.47 с (3Н, СН3); 1.91 с, 1.94 с*, (3Н, СН3); 2.40-2.85 м (4Н, 2CH2S); 3.40-4.15 м (4Н, 2CH2N); 7.02 с, 7.14* с (2Н, NH2); 8.74 с, 8.94 с* (1Н, NH). Масс-спектр, m/z (Iотн, %): 303 (39) [М]+, 232 (68), 43 (100).
Таким образом, предлагаемый способ позволяет получать производные 5-амино-3H-пиррол-4-карбонитрилов, которые могут быть использованы в качестве биологически активных соединений и в тонком органическом синтезе.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 8-АМИНО-1-ИМИНО-6-МОРФОЛИН-4-ИЛ-2-ОКСА-7-АЗАСПИРО[4,4]НОНА-3,6,8-ТРИЕН-9-КАРБОНИТРИЛОВ | 2011 |
|
RU2475489C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АМИНО-8-ГИДРОКСИ-1,6-ДИОКСО-2,7-ДИАЗАСПИРО[4.4]НОН-3-ЕН-4-КАРБОНИТРИЛОВ | 2012 |
|
RU2495040C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-ИМИНО-2,7-ДИОКСАБИЦИКЛО[3.2.1]ОКТАН-4,4,5-ТРИКАРБОНИТРИЛОВ | 2014 |
|
RU2545459C1 |
| Способ получения метилового эфира 2-галоген-6-алкил-3-цианоизоникотиновых кислот | 2016 |
|
RU2616980C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-ОКСОАЛКАН-1,1,2,2-ТЕТРАКАРБОНИТРИЛОВ | 2015 |
|
RU2577537C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-ОКСО-4-ЦИАНО-1,2-ДИГИДРОПИРИДИН-3-КАРБОКСАМИДОВ | 2011 |
|
RU2475480C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АРОИЛЦИКЛОПРОПАН-1,1,2,2-ТЕТРАКАРБОНИТРИЛОВ | 2011 |
|
RU2468001C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-АРИЛ-2-ОКСО-2Н-ХРОМЕН-3-КАРБОНИТРИЛОВ | 2015 |
|
RU2577524C1 |
| 1-имино-2,3,4,5-тетрагидро-1Н-пирроло[3,4-с]пиридин-3,4-дионов | 2016 |
|
RU2613967C1 |
| Способ получения пирроло[3,4-с]хинолинов | 2022 |
|
RU2802332C1 |
Изобретение относится к области органической химии, а именно к способу получения производных 5-амино-3H-пиррол-4-карбонитрилов общей формулы (1), где R1=C6H5, X=S (1a); R1=4-MeC6H4, X=O (1б); R1=C6H5, X=S (1в); R1=CH3, X=S (1г), имеющих в структуре в третьем положении 3H-пиррольного цикла карбонилсодержащий заместитель либо спиросочлененное фурановое кольцо. Способ включает взаимодействие 4-оксоалкан-1,1,2,2-тетракарбонитрила с вторичным амином в растворителе, отличающийся тем, что в качестве 4-оксоалкан-1,1,2,2-тетракарбонитрила используют 4-оксо-4-фенилбута-1,1,2,2-тетракарбонитрил, или 4-оксо-4-(p-толил)бута-1,1,2,2-тетракарбонитрил, или 3-метил-4-оксо-4-фенилбута-1,1,2,2-тетракарбонитрил, или 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрил, а в качестве вторичного амина используют морфолин или тиоморфолин в мольном соотношении исходных компонентов 1:3, а взаимодействие ведут в смеси ацетонитрил:диэтиловый эфир в объемном соотношении 2:1 при температуре 0-5°С. Технический результат - разработан новый способ производных 5-амино-3H-пиррол-4-карбонитрилов, которые могут быть использованы в качестве биологически активных соединений и в тонком органическом синтезе. 4 пр.
1. Способ получения производных 5-амино-3Н-пиррол-4-карбонитрилов общей формулы
где R1=C6H5, X=S (1a); R1=4-MeC6H4, X=O (1б); R1=C6H5, X=S (1в); R1=СН3, X=S (1г), включающий взаимодействие 4-оксоалкан-1,1,2,2-тетракарбонитрила с вторичным амином в растворителе, отличающийся тем, что в качестве 4-оксоалкан-1,1,2,2-тетракарбонитрила используют 4-оксо-4-фенилбута-1,1,2,2-тетракарбонитрил, или 4-оксо-4-(р-толил)бута-1,1,2,2-тетракарбонитрил, или 3-метил-4-оксо-4-фенилбута-1,1,2,2-тетракарбонитрил, или 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрил, а в качестве вторичного амина используют морфолин или тиоморфолин в мольном соотношении исходных компонентов 1:3, а взаимодействие ведут в смеси ацетонитрил:диэтиловый эфир в объемном соотношении 2:1 при температуре 0-5°С.
| BELIKOV M.YU | |||
| ET AL, Russian Journal of Organic Chemistry, vol.49, No.6, 2013, pp.864-866 | |||
| BELIKOV M.YU | |||
| ET AL, Russian Journal of Organic Chemistry, vol.52, No.9, 2016, pp.1312-1315 | |||
| СПОСОБ ПОЛУЧЕНИЯ 8-АМИНО-1-ИМИНО-6-МОРФОЛИН-4-ИЛ-2-ОКСА-7-АЗАСПИРО[4,4]НОНА-3,6,8-ТРИЕН-9-КАРБОНИТРИЛОВ | 2011 |
|
RU2475489C1 |
| WO 2010053998 A, 14.05.2010. | |||
Авторы
Даты
2018-12-20—Публикация
2018-09-04—Подача