Изобретение относится к области органической химии, а именно к области получения производных 4-арил-2-оксо-2H-хромен-3-карбонитрилов, конкретно, 4-арил-7-гидрокси-2-оксо-2H-хромен-3-карбонитрилов, 4-арил-2-оксо-2H-бензо[h]хромен-3-карбонитрилов и 4-арил-3-оксо-3H-бензо[f]хромен-3-карбонитрилов
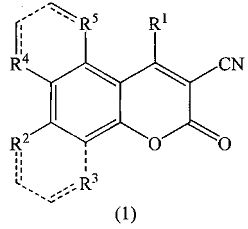
где R1=С6Н5, 3-NO2C6H4, 4-Н3СОС6Н4, R2=ОН, R3=R4=R5=Н; R2+R3 = -СН=СН-СН=СН-, R4=R5=Н; R2=R3=Н, R4+R5 = -СН=СН-СН=СН-, которые могут быть использованы в качестве биологически активных соединений, а именно соединений, обладающих противоопухолевой, противомикробной, противовирусной активностью, антиоксидантными свойствами.
Известен способ получения 4-метил-2-оксо-2H-хромен-3-карбонитрилов общей формулы 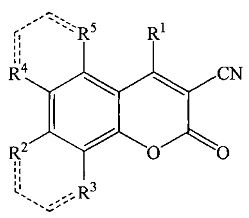 , где R1=СН3, R2=R3=Н, R4+R5 = -СН=СН-СН=СН-, конденсацией Перкина, заключающейся в том, что циануксусную кислоту (NCCH2COOH) подвергают взаимодействию с эквимолярным количеством 1-ацетила-нафтола в присутствии ангидрида пропилфосфоновой кислоты с последующим добавлением триэтиламина (Et3N) в мольном соотношении NCCH2COOH:1-ацетил-2-нафтол:ангидрид пропилфосфоновой кислоты:Et3N=0,01:0,01:0,02:0,02 при температуре 120°C и атмосферном давлении в течение 6-10 ч [Augustine J.K., Bombrun А., Ramappa В., Boodappa С. An efficient one-pot synthesis of coumarins mediated by propylphosphonic anhydride (T3P) via the Perkin condensation // Tetrahedron Letters. 2012, 53, 4422-4425]. Однако высокая стоимость ангидрида пропилфосфоновой кислоты и длительность этого способа ограничивает его применение.
, где R1=СН3, R2=R3=Н, R4+R5 = -СН=СН-СН=СН-, конденсацией Перкина, заключающейся в том, что циануксусную кислоту (NCCH2COOH) подвергают взаимодействию с эквимолярным количеством 1-ацетила-нафтола в присутствии ангидрида пропилфосфоновой кислоты с последующим добавлением триэтиламина (Et3N) в мольном соотношении NCCH2COOH:1-ацетил-2-нафтол:ангидрид пропилфосфоновой кислоты:Et3N=0,01:0,01:0,02:0,02 при температуре 120°C и атмосферном давлении в течение 6-10 ч [Augustine J.K., Bombrun А., Ramappa В., Boodappa С. An efficient one-pot synthesis of coumarins mediated by propylphosphonic anhydride (T3P) via the Perkin condensation // Tetrahedron Letters. 2012, 53, 4422-4425]. Однако высокая стоимость ангидрида пропилфосфоновой кислоты и длительность этого способа ограничивает его применение.
Известны способы получения кумаринов общей формулы (1), где R1=СН3, R2+R3 = -СН=СН-СН=СН-, R4=R5=Н, путем взаимодействия этилцианоацетата (NCCH2COOC2H5) с 2-ацетил-1-нафтолом, во-первых, в среде метилового спирта в присутствии эквимолярного количества диэтиламина при кипячении в течение 3 часов, с последующим охлаждением и выделением полученного продукта [Fondjo E.S., Doepp D. Condensation of some ketones with methylene active nitriles in varied stoichiometries // Journal of Heterocyclic Chemistry. 2006, 43, 1037-1044], во-вторых, в среде бензол-уксусная кислота в присутствии катализатора - ацетата аммония при кипячении в течение 6 часов [Madkour H.M.F. Synthesis and reactions of some 3-cyano-4-methylcoumarins // Heterocycles. 1993, 36, 947-959]. Недостатками данных способов являются высокая токсичность используемых растворителей метилового спирта и бензола, канцерогенные свойства бензола.
Известен способ получения кумаринов общей формулы (1), где R1=СН3, R2=R3=R4=R5=Н, заключающийся во взаимодействии 2-ацетилфенола с малононитрилом (NCCH2CN) в среде этилового спирта в присутствии катализатора - хлорида железа (III) (FeCl3) в мольном соотношении 2-ацетилфенол:малононитрил:хлорид железа (III) = 1:1,2:0,05 при нагревании на масляной бане при температуре 80°C и атмосферном давлении в течение 24 часов и последующей очистке колоночной хроматографией на силикагеле. Выход продукта 50% [Не X., Yan Z., Hu X., Zuo Y., Jiang С., Jin L., Shang Y. FeCl3-catalyzed cascade reaction: an efficient approach to functionalized coumarin derivatives // Synthetic Communications. 2014, 44, 1507-1514]. К недостаткам способа относятся невысокие выходы конечных соединений, возможность получения только 4-метилзамещенных 2-оксо-2H-хроменов, а также длительность процесса и необходимость дополнительной очистки продукта, что сопровождается затратами растворителей.
Таким образом, способ получения 4-арил-2-оксо-2H-хромен-3-карбонитрилов оказывается трудоемким и затратным, так как требует затрат большого количества токсичных растворителей, которые впоследствии требуют вторичной переработки и/или утилизации, а необходимость использования ацетилзамещенных фенолов не позволяет варьировать заместители в четвертом положении.
Наиболее близким по технической сущности к заявляемому изобретению является способ получения 4-арил-2-оксо-2H-хромен-3 -карбонитрилов общей формулы (1), где R1=Ar, R2+R3 = -СН=СН-СН=СН-; R4=R5=Н, R2=R3=Н, R4+R5 = -СН=СН-СН=СН-, окислением 2-амино-4-арил-4H-хромен-3-карбонитрилов путем взаимодействия их с тионилхлоридом (SOCl2) в диметилформамиде (HCON(CH3)2) при температуре 120°C в течение 1-1,5 часов, с последующим охлаждением и выделением полученного продукта холодной водой [Banothu J. Highly efficient conversion of fused 2-amino-4-aryl-4H-chromene-3-carbonitriles into fused 2-oxo-4-aryl-2H-chromene-3-carbonitriles using Vilsmeier conditions // Tetrahedron Letters. 2013, 54, 3862-3864].
К недостаткам данного способа относится использование дорогостоящих реагентов тионилхлорида и диметилформамида, длительность процесса и необходимость очистки продукта методом колоночной хроматографии, что сопровождается дополнительными затратами растворителей.
Задачей данного изобретения является создание упрощенного способа получения производных 4-арил-2-оксо-2H-хромен-3-карбонитрилов, которые могут найти применение в качестве биологически активных соединений, обладающих противоопухолевой, противомикробной, противовирусной активностью, антиоксидантными свойствами.
Техническим результатом является создание упрощенного способа получения производных 4-арил-2-оксо-2H-хромен-3-карбонитрилов, за счет проведения его в одну стадию, с использованием малотоксичных растворителей и доступных окислителей, расширяющего арсенал способов данного назначения.
Технический результат достигается тем, что способ получения производных 4-арил-2-оксо-2H-хромен-3-карбонитрилов общей формулой (1)
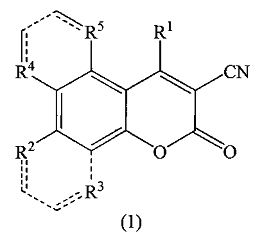
где R1=С6Н5, 3-NO2C6H4, 4-Н3СОС6Н4, R2=ОН, R3=R4=R5=Н; R2+R3 = -СН=СН-СН=СН-, R4=R5=Н; R2=R3=Н, R4+R5 = -СН=СН-СН=СН-, согласно изобретению, характеризуется тем, что 4-арил-4H-хромен-2-амин окисляют на силикагеле при температуре 100-150°C и продувании воздухом в течение 24 часов, после чего полученный целевой продукт выделяют экстракцией этилацетатом.
Сопоставительный анализ заявляемого решения с известными показывает, что предлагаемый способ является более экономически и экологически выгодным. Схема получения является однореакторной и не подразумевает выделение полупродуктов, при этом снижаются затраты растворителей, а соответственно и нежелательные отходы, что является более экологичным. В качестве исходных компонентов используются производные 4-арил-4H-хромен-2-аминов, получаемые трехкомпонентно из замещенного фенола, алифатического или ароматического альдегида и малононитрила [Radwan S.М., Bakhite Е.A., Kamal El-Dean А.М. Synthesis and some reactions of new benzo[b]pyran derivatives // Phosphorus, Sulfur and Silicon and the Related Elements. 1995, 101, 207-212].
Сущность изобретения представлена в примерах.
Пример 1. Способ получения 7-гидрокси-2-оксо-4-фенил-2H-хромен-3-карбонитрила.
1.06 г (10 ммоль) бензальдегида и 0.66 г (10 ммоль) малонодинитрила суспендируют в 20 мл дистиллированной воды.
Отдельно готовят смесь резорцина и водного раствора гидроксида натрия (или калия), последовательно растворяя при перемешивании 0.40 г (10 ммоль) гидроксида натрия (0.56 г гидроксида калия) и 1.10 г(10 ммоль) резорцина в 10 мл дистиллированной воды.
Полученный раствор резорцина с гидроксидом натрия приливают к водному раствору бензальдегида с малонодинитрилом и смесь перемешивают 10-15 мин. Выпавший осадок 2-амино-7-гидрокси-4-фенил-4H-хромен-3-карбонитрила отделяют фильтрованием.
2.64 г (10 ммоль) 2-амино-7-гидрокси-4-фенил-4H-хромен-3-карбонитрила и 13.2 г силикагеля (SiO2) суспендируют в 50 мл этилацетата. Этилацетат отгоняют на роторном испарителе. В течение 24 часов через сухой силикагель при постоянном перемешивании продувают воздух при нагревании при температуре 100-150° до завершения реакции. Контроль за полнотой протекания реакции осуществляется методом тонкослойной хроматографии на пластинках Silufol UV-254, проявление осуществляется парами йода и термическим разложением. Затем 7-гидрокси-2-оксо-4-фенил-2H-хромен-3-карбонитрил экстрагируют 50 мл этилацетата. Выпавший осадок 7-гидрокси-2-оксо-4-фенил-2H-хромен-3-карбонитрила отделяют фильтрованием, промывают пропанолом-2. Выход 86%, т.пл. 175-176°C (разл.). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 7.65-7.63 м, 7.52-7.55 м (5Н, С6Н5), 7.12 д (1H, J=8.7 Гц, СН резорцина), 6.84-6.88 м (2Н, 2СН резорцина).
Пример 2. Способ получения 7-гидрокси-4-(4-метоксифенил)-2-оксо-2H-хромен-3-карбонитрила.
Способ осуществляется аналогично способу 1, вместо бензальдегида использовался 4-метоксибензальдегид. Выход 73%, т.пл. 257-258°C (разл.). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 7.51 д (2Н, J=8.7 Гц, C6H4), 7.22 д (2Н, J=9.6 Гц, C6H4), 7.19 д (1Н, J=8.7 Гц, СН резорцина), 6.82 дд (2Н, J=7.1, 2.4 Гц, 2СН резорцина), 3.88 с (3Н, ОСН3).
Пример 3. Способ получения 7-гидрокси-4-(3-нитрофенил)-2-оксо-2H-хромен-3-карбонитрила.
Способ осуществляется аналогично способу 1, вместо бензальдегида использовался 3-нитробензальдегид. Выход 89%, т.пл. 288-289°C (разл.). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 8.49 д (1Н, J=9.6 Гц, С6Н4), 8.02 д (1Н, J=7.7 Гц, C6H4), 7.96 т (1Н, J=7.9 Гц, C6H4), 7.12 д (1H, J=8.8 Гц, СН резорцина), 6.92 д (1H, J=2.3 Гц, СН резорцина), 6.85 дд (1H, J=8.9, 2.3 Гц, СН резорцина).
Пример 4. Способ получения 2-оксо-4-фенил-2H-бензо[h]хромен-3-карбонитрила.
Способ осуществляется аналогично способу 1, вместо резорцина использовался 1-нафтол. Выход 85%, т.пл. 229-230°C (разл.). Спектр ЯМР 1Н, δ, м.д.: 8.48 д (1H, J=8.1 Гц, СН 1-нафтола), 8.09 д (1Н, J=7.6 Гц, СН 1-нафтола), 7.88-7.80 м (3Н, 3СН 1-нафтола), 7.72-7.69 м (3Н, С6Н5), 7.63-7.60 м (2Н, С6Н5), 7.22 д (1Н, J=8.8 Гц, СН 1-нафтола).
Пример 5. Способ получения 4-(4-метоксифенил)-2-оксо-2H-бензо[h]хромен-3-карбонитрила.
Способ осуществляется аналогично способу 1, вместо бензальдегида использовался 4-метоксибензальдегид, а резорцина - 1-нафтол. Выход 80%, т.пл. 245-246°C (разл.). Спектр ЯМР 1Н, δ, м.д.: 8.48 д (1H, J=8.1 Гц, СН 1-нафтола), 8.09 д (1Н, J=7.6 Гц, СН 1-нафтола), 7.88 д (1H, J=8.9 Гц, СН 1-нафтола), 7.86-7.79 м (2Н, 2СН 1-нафтола), 7.59 д (2Н, J=8.7 Гц, С6Н4), 7.33 д (1H, J=8.7 Гц, СН 1-нафтола), 7.25 д (2Н, J=8.7 Гц, C6H4), 3.90 с (3Н, ОСН3).
Пример 6. Способ получения 3-оксо-1-фенил-3H-бензо[f]хромен-3-карбонитрила.
Способ осуществляется аналогично способу 1, вместо бензальдегида использовался 2-хлорбензальдегид, а резорцина - 2-нафтол. Выход 90%, т.пл. 215-216°C (разл.). Спектр ЯМР 1Н, δ, м.д.: 8.48 д (1H, J=9.1 Гц, СН 2-нафтола), 8.13 д (1Н, J=7.4 Гц, СН 2-нафтола), 7.86 дд (1H, J=8.0, 0.7 Гц, C6H4), 7.79 д (1H, J=9.1 Гц, СН 2-нафтола), 7.78 тд (1Н, J=8.0, 1.7 Гц, С6Н4), 7.72 тд (1H, J=7.6, 1.1 Гц, С6Н4) 7.66 дд (1Н, J=7.6, 1.7 Гц, С6Н4), 7.57 т (1Н, J=7.3 Гц, СН 2-нафтола), 7.35 т (1Н, J=7.9 Гц, СН 2-нафтола), 7.00 д (1Н, J=8.8 Гц, СН 2-нафтола).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 6-стирил-4-трифторметил-2-тиоксо-1,2-дигидропиридин-3-карбонитрилов | 2023 |
|
RU2827934C1 |
| Спироконденсированные производные 2,3-дигидроиндола, их применение в офтальмологии | 2017 |
|
RU2712039C2 |
| Способ получения аммонийных солей 3-амино-8-гидрокси-1,6-диоксо-4-циано-2,7-диазаспиро[4.4]нон-3-ен-2-идов | 2016 |
|
RU2631856C1 |
| МЕХАНОХИМИЧЕСКИЙ СПОСОБ СИНТЕЗА КУМАРИНОВ | 2022 |
|
RU2799566C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АМИНО-8-ГИДРОКСИ-1,6-ДИОКСО-2,7-ДИАЗАСПИРО[4.4]НОН-3-ЕН-4-КАРБОНИТРИЛОВ | 2012 |
|
RU2495040C1 |
| СПОСОБЫ СЕЛЕКТИВНОГО ВВЕДЕНИЯ ЗАЩИТНЫХ ГРУПП В ПРОИЗВОДНЫЕ РЕЗОРЦИНА | 2019 |
|
RU2738408C1 |
| ДИАЛКИЛ(АРИЛ)-ЦИС-2-(2-ГИДРОКСИАРИЛ)-2-АЛКИЛ(АРИЛ)ЭТЕНИЛФОСФИНОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2329271C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(1Н-БЕНЗОХРОМЕН-2-ИЛ)-2,2,2-ТРИФТОРЭТАНОНОВ | 2016 |
|
RU2662439C2 |
| Способ получения замещенных 3-арилпирролов | 2024 |
|
RU2831117C1 |
| ДИГИДРОБЕНЗОДИАЗЕПИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2000 |
|
RU2247115C2 |
Изобретение относится к способу получения производных 4-арил-2-оксо-2H-хромен-3-карбонитрилов общей формулой, где R1=С6Н5, 3-NO2C6H4, 4-Н3СОС6Н4, R2=ОН, R3=R4=R5=Н; R2+R3=-СН=СН-СН=СН-, R4=R5=Н; R2=R3=Н, R4+R5=-СН=СН-СН=СН-, который заключается в том, что соответствующий 4-арил-4H-хромен-2-амин окисляют на силикагеле при нагревании при температуре 100-150°C при продувании воздухом в течение 24 часов, после чего полученный целевой продукт выделяют экстракцией этилацетатом. Эти соединения могут найти применение в качестве биологически активных соединений, а именно соединений, обладающих противоопухолевой, противомикробной, противовирусной активностью, антиоксидантными свойствами. 6 пр.
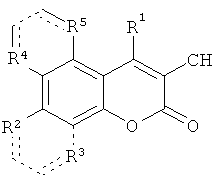
Способ получения производных 4-арил-2-оксо-2H-хромен-3-карбонитрилов общей формулой
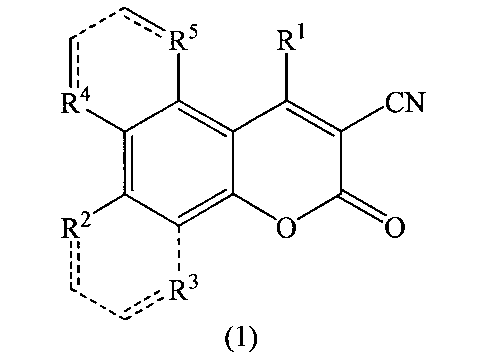
где R1=C6H5, 3-NO2C6H4, 4-H3COC6H4, R2=OH, R3=R4=R5=H; R2+R3=-CH=CH-CH=CH-, R4=R5=H; R2=R3=H, R4+R5=-CH=CH-CH=CH-, характеризующийся тем, что 4-арил-4H-хромен-2-амин окисляют на силикагеле при температуре 100-150°C при продувании воздухом в течение 24 часов, после чего полученный целевой продукт выделяют экстракцией этилацетатом.
| Janardhan Banothu et al, "Highly efficient conversion of fused 2-amino-4-aryl-4H-chromene-3-carbonitriles into fused 2-oxo-4-aryl-2H-chromene-3-carbonitriles using Vismeiere condition,"Tetrahedron Letters,2013,v.54,p/3862-3864 | |||
| Xinwei He et al, "FeCI3-catalyzed cascade reaction^An efficient approach to functionalized coumarin derivatives",Synthetic |
Авторы
Даты
2016-03-20—Публикация
2015-04-08—Подача