ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к CpG олигонуклеотидам и способу их применения. В частности, настоящее изобретение относится к лечению заболеваний, вызываемых иммунными клетками, контролируемыми путем активизирования дендритных клеток с использованием стереоизомера CpG олигонуклеотидов и их стереоизомера.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
[0002] В JP 2002-513763 А (Патентная литература 1), JP 2002-154397 А (Патентная литература 2), JP 2002-521489 А (Патентная литература 3) раскрывается CpG олигонуклеотид и способ его изготовления.
[0003] В JP 2010-504750 А (Патентная литература 4) раскрывается, что олигонуклеотиды, имеющие липофильные замещенные нуклеотидные аналоги из CpG-мотива, вызывают выработку интерферона-α (IFN-α).
[0004] В нижеприведенной непатентной литературе 1 раскрывается, что стереоизомер S-формы тримера CpG олигонуклеотида активирует сигнал МАРК. Все из раскрываемых изобретений данной ссылки инкорпорированы в настоящей заявке путем отсылки.
[0005] В нижеприведенной непатентной литературе 1 раскрывается PF-3512676 (Последовательность №128), все части последовательности являются тиофосфатированным изомером S-формы. Природная олигонуклеиновая кислота легко восстанавливается in vivo. Принимая во внимание, что эфирная связь фосфорной кислоты в олигонуклеиновой кислоте (Р-O связь) изменяется на тиоэфирную связь (P-S связь) фосфорной кислоты, существуют сложности с восстановлением P-S модификаций in vivo.
Список патентной литературы
[0006] [Патентная литература 1] JP 2002-513763 А [Патентная литература 2] JP 2002-154397 А [Патентная литература 3] J Ρ 2002-521489 А [Патентная литература 4] JP 2010-504750 А
Непатентная литература
[0007] [Непатентная литература 1] Authur M. Krieg et al. OLIGONUCLROTIDES 13: pp.491-499 (2003)
[Непатентная литература 2] Clin Cancer Res. 2008 Jul 15; 14(14):4532-42.
[0008] Например, все из последовательностей CpG олигонуклеотидов, раскрытых в непатентной литературе 2, являются тиофосфатированными. Таким образом, CpG олигонуклеотиды, раскрытые в непатентной литературе 2, создают проблемы, заключающиеся в том, что они индуцируют воспаление и токсическую реакцию. При удалении модификации дитиофосфатного остова из CpG олигонуклеотидов, раскрытых в непатентной литературе 2, снижается стабильность нуклеотидов.
[0009] Одной целью настоящего изобретения является создание устойчивого стереоизомера CpG олигонуклеотида.
[0010] Другой целью настоящего изобретения является создание стереоизомера CpG олигонуклеотида, обладающего способностью продуцировать интерферон α (IFN-α).
[0011] Еще одной целью настоящего изобретения является создание лекарственного препарата для лечения конкретного заболевания путем активации дендритных клеток CpG олигонуклеотидом.
[0012] Еще одной целью настоящего изобретения является создание менее цитотоксичного стереоизомера CpG олигонуклеотидов.
Средство для достижения целей
[0013] В основу настоящего изобретения в целом положены следующие новые результаты исследований. Существует возможность повысить устойчивость олигонуклеиновой кислоты in-vivo путем контролирования молекулярной конформации олигонуклеиновой кислоты. Благодаря этому обеспечивается создание устойчивого олигонуклеотида in vivo без введения PS связи во все последовательности. Ввиду того, что не все из последовательностей имеют модификацию PS-связывания, олигонуклеотид по настоящему изобретению обладает исключительно высокой биосовместимостью.
[0014] По меньшей мере, одна из вышеуказанных целей достигается с помощью настоящего изобретения, т.е. первый аспект настоящего изобретения относится к олигонуклеотиду, включающему две-четыре последовательности, каждая из которых представлена формулой 5’-X1X2CpGX3X4-3' (формула (I)) и имеет длину, составляющую от 14 до 32 нуклеотидов.
[0015] В формуле (I) CpG представляет неметилированный CpG без модификаций фосфатного остова. Х1Х2 представляет собой либо АА, AT, GA, либо GT, который может иметь модификацию фосфатного остова. АА, AT, GA или GT, которые могут иметь модификацию фосфатного остова, означают, что они могут иметь 1 или 2 модификации фосфатного остова в любом из АА, AT, GA или GT. Как и было указано выше, Х3Х4 представляет собой ТТ, AT, АС, ТА, ТС или CG, которые могут иметь модификацию фосфатного остова. Олигонуклеотид может иметь модификацию фосфатного остова на сайте, за исключением 5'-Х1X2СрGХ3Х4-3'. Другими словами, олигонуклеотид может иметь модификацию фосфатного остова на фрагменте, за исключением одного из CpG-мотивов, состоящего из 5'-Х1X2СрGХ3Х4-3’. Тем не менее, олигонуклеотид, имеющий, по меньшей мере, одну модификацию фосфатного остова на фрагменте, за исключением одного из CpG-мотивов, является предпочтительным.
[0016] Указанный олигонуклеотид является предпочтительным ввиду того, что Х1X2 представляет собой AT, GT или GA, которые могут иметь модификацию фосфатного остова, и Х3Х4, представляет собой ТТ, AT, АС, ТА, CG или ТС, которые могут иметь модификацию фосфатного остова.
[0017] Указанный олигонуклеотид является предпочтительным ввиду того, что Χ1Χ2, представляет собой либо АА, AT, GA, либо GT без модификаций фосфатного остова, и Х3Х4 представляет собой ТТ, AT, АС, ТС либо CG без модификации фосфатного остова.
[0018] Один из сайтов, имеющий, по меньшей мере, модификацию фосфатного остова, за исключением 5'-Х1X2СрGХ3Х4-3', является предпочтительным стереоизомером S-формы.
[0019] Предпочтительно, чтобы олигонуклеотид настоящего изобретения включал любую из нижеприведенных последовательностей или являлся бы олигонуклеотидом, состоящим из любой из нижеприведенных последовательностей.

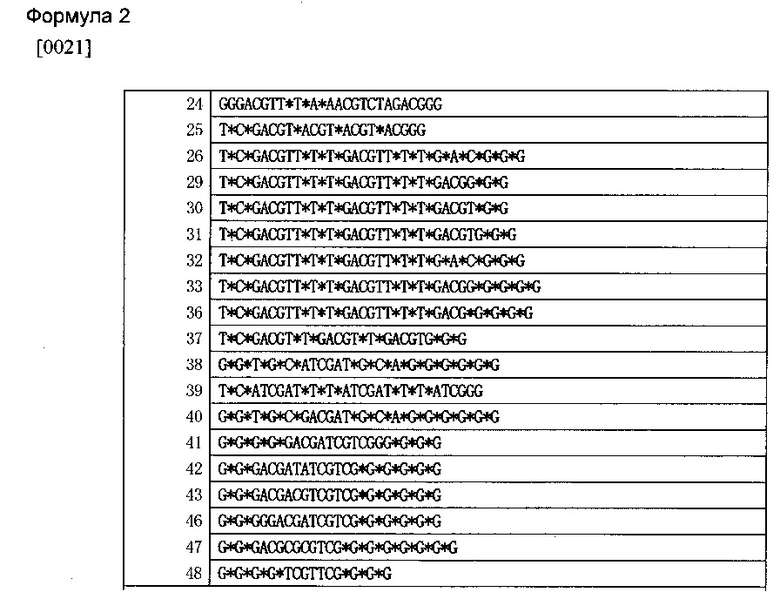


[0024] В вышеприведенных формулах звездочка * обозначает стереоизомер, полученный путем модификации фосфатного остова, по меньшей мере, одна из звездочек* обозначает стереоизомер S-формы. CG фрагмента, соответствующего 5’-X1X2CPGX3X4-3 в вышеуказанных формулах, означает неметилированный CpG без модификаций фосфатного остова.
[0025] Олигонуклеотид по настоящему изобретению является предпочтительным ввиду того, что Х1Х2 представляет собой GA, и Х3Х4 представляет собой ТТ или АС.
[0026] Олигонуклеотид по настоящему изобретению является предпочтительным ввиду того, что, по меньшей мере, одна из модификаций фосфатного остова сайтов, за исключением 5'-Х1X2СрGХ3Х4-3', является олигонуклеотидом, имеющим тиофосфат.
[0027] Последовательность, состоящая из 5'-X1X2CpGX3X4-3' формулы (I), определена как CpG-мотив. Предпочтительно, чтобы олигонуклеотиды настоящего изобретения имели последовательность -(G)m- (m обозначает целое число от 2 до 10) к 5'-концу или 3'-концу CpG-мотива.
[0028] Предпочтительно, чтобы олигонуклеотиды настоящего изобретения имели последовательность -(G)m- (m обозначает целое число от 1 до 6) к 5'-концу или 3'-концу CpG-мотива.
[0029] Предпочтительно, чтобы олигонуклеотиды настоящего изобретения имели последовательность ТС, ТА, TG или СС в точке, расположенной вблизи 5'-конца от CpG-мотива.
[0030] Предпочтительно, чтобы олигонуклеотид настоящего изобретения включал, по меньшей мере, первый CpG-мотив и второй CpG-мотив. Первый CpG-мотив и второй CpG-мотив непосредственно связаны, или первый CpG-мотив и второй CpG-мотив включают частичную последовательность, представленную в виде - (Т)n - (n обозначает целое число от 1 до 3), ТА или ТС между первым CpG-мотивом и вторым CpG-мотивом.
[0031] Олигонуклеотид включает любую одну из нижеприведенных последовательностей или последовательностей, в которых 1, 2 или 3 основания замещены, введены, удалены или добавлены:
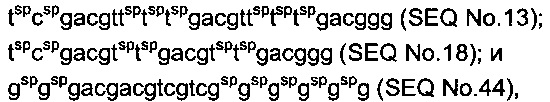
в последовательностях "cg" обозначает неметилированный CpG с модификацией фосфатного остова, и "sp" указывает на то, что модификация S-формы фосфатного остова добавлена между соседними нуклеотидами. Предпочтительно, чтобы указанные олигонуклеотиды проявляли аналогичную устойчивость или активность как последовательность №№13, 18 или 44. В последовательности "cg" означает неметилированный CpG с модификацией фосфатного остова.
[0032] Предпочтительно, чтобы олигонуклеотид настоящего изобретения представлял собой:
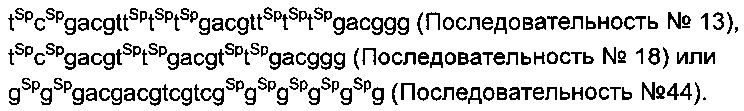
В последовательности "cg" обозначает неметилированный CpG с модификацией фосфатного остова.
[0033] Настоящее изобретение также предусматривает создание композиции, включающей описанные выше олигонуклеотиды.
[0034] Настоящее изобретение также предусматривает создание вакцинного адъюванта, включающего описанные выше олигонуклеотиды.
[0035] Настоящее изобретение также предусматривает создание индуктора для выработки интерферона-α (IFN-α) из дендритных клеток с любым из описанных выше олигонуклеотидов.
[0036] Настоящее изобретение также предусматривает создание лекарственного препарата, имеющего эффективное количество описанных выше олигонуклеотидов в качестве активного ингредиента, в котором лекарственный препарат предназначен для лечения инфекционных заболеваний, рака, респираторных заболеваний, аллергических заболеваний, аутоимунных заболеваний или ран.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
[0037] В соответствии с настоящим изобретением существует возможность создать новый CpG олигонуклеотид с исключительно высокой устойчивостью.
[0038] В соответствии с настоящим изобретением существует возможность создать CpG олигонуклеотид, обладающий иммунорегулирующей способностью.
[0039] В соответствии с настоящим изобретением существует возможность создать лекарственный препарат, включающий иммуномодулирующие факторы, которые содержат CpG олигонуклеотид в качестве активного ингредиента.
[0040] В соответствии с настоящим изобретением существует возможность создать CpG олигонуклеотид, обладающий меньшей цитотоксичностью.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0041] Фиг. 1 - снимок гель-электрофореза последовательностей №№26 - 28 для оценки устойчивости олигонуклеотида S-формы и R-формы в сыворотке.
Фиг. 2 - снимок гель-электрофореза последовательностей №№43-45 для оценки устойчивости олигонуклеотида S-формы и R-формы в сыворотке.
Фиг. 3 - снимок гель-электрофореза последовательностей №№33-35 для оценки устойчивости олигонуклеотида S-формы и R-формы в сыворотке.
ПРЕДПОЧТИТЕЛЬНОЕ ТЕХНИЧЕСКОЕ ВЫПОЛНЕНИЕ ИЗОБРЕТЕНИЯ
[0042] Первый аспект настоящего изобретения относится к олигонуклеотидам, включающим от двух до четырех последовательностей, каждая из которых представлена 5'-Х1X2СрСХ3Х4-3' и имеет длину, составляющую от 14 до 32 нуклеотидов.
[0043] "Олигонуклеотид" или "олиго" означает сахар (например, рибозу или деоксирибозу), связывающий несколько нуклеотидов, то есть, фосфатные группы и замещенные органические основания (один из замещенных пиримидинов (например, цитозин (С), тимин (Т) или урацил (U)) или замещенных пуринов (например, аденин (А) или гуанин (G))). В соответствии со значением, используемом в настоящем описании изобретения, термин "олигонуклеотид" означает как олигорибонуклеотид (ORN), так и олигодеоксирибонуклеотид (ODN). Термин "олигонуклеотид" включает также олигонуклеозид (то есть, олигонуклеотид, не содержащий фосфата) или любой иной полимер органического основания. Олигонуклеотиды могут быть получены из существующих источников нуклеиновых кислот (например, геном или комплементарная ДНК), синтетические нуклеотиды (например, полученные методом синтеза олигонуклеотидов) являются предпочтительными.
[0044] В формуле (I) CpG представляет собой неметилированный CpG без модификации фосфатного остова. С представляет собой 2-деоксицитидин. G представляет собой 2'-деоксигуанозин. p представляет собой связь между нуклеозидом и фосфодиэфиром.
[0045] В формуле (I) Х1X2 представляет собой один из АА, AT, GA, либо GT, который может иметь модификацию фосфатного остова. В формуле (I) Х3Х4 представляет собой один из ТТ, AT, АС, ТА, ТС, либо CG, который может иметь модификацию фосфатного остова. Олигонуклеотид настоящего изобретения может иметь модификацию фосфатного остова на сайте, исключая CpG. Олигонуклеотид может иметь модификацию фосфатного остова на части, исключая CpG-мотив, состоящий из 5'-X1X2CpGX3X4-3'. С другой стороны, существует вышеупомянутая проблема относительно фосфатного остова с модификацией тиофосфатного остова между всеми из нуклеотидов; было бы предпочтительным, чтобы атомы кислорода были замещены атомами серы более чем на 20% менее чем на 95%, более чем на 30% менее чем на 95%, более чем на 20% менее чем на 90%, более чем на 40% менее чем на 95%, более чем на 40% менее чем на 90%, более чем на 40% менее чем на 80%, более чем на 50% менее чем на 95%, более чем на 50% менее чем на 90%, более чем на 20% менее чем на 80%.
[0046] Предпочтительно, чтобы X1X2 настоящего олигонуклеотида являлся одним из AT, GA или GT, которые могут иметь модификацию фосфатного остова, и предпочтительно, чтобы Х3Х4 являлся одним из ТТ, AT, АС, ТА, ТС или CG, которые могут иметь модификацию фосфатного остова.
[0047] Предпочтительно, чтобы Х1X2 настоящего олигонуклеотида являлся одним из АА, AT, GA или GT без модификации фосфатного остова, и предпочтительно, чтобы Х3Х4 являлся одним из ТТ, AT, АС, ТС или CG без модификации остова.
[0048] В том случае, если сайт, кроме CpG-мотив с модификацией фосфатного остова является тиофосфатом, сайт, имеющий, по меньшей мере, одну часть модификации фосфатного остова, кроме CpG-мотива, может являться стереоизомером S-формы. В том случае, если, по меньшей мере, одна из модификаций фосфатного остова, кроме CpG-мотива, замещена атомами или основаниями, кроме атомов серы, было бы предпочтительно, чтобы сайт принимал конформацию s-типа, когда атомы кислорода замещены атомами серы.
[0049] Предпочтительно, чтобы олигонуклеотид настоящего изобретения имел нижепредставленную последовательность или включал любую последовательность, предпочтительно, чтобы олигонуклеотид имел любую из следующих последовательностей.
Формула 5
[0050]




[0054] В вышеприведенной формуле * обозначает стереоизомер с модификацией фосфатного остова. CG секции, соответствующей 5’-X1X2CpGX3X4-3 в вышеприведенной формуле, означает неметилированный CpG без модификаций фосфатного остова. Примерами модификации фосфатного остова являются модификации тиофосфатного остова, модификации дитиофосфатного остова, или модификации фосфорамидатного остова. В указанных модификациях фосфатного остова предпочтительными являются модификации дитиофосфатного остова. Модификация тиофосфатного остова означает преобразование одного из двух немостиковых атомов кислорода, связывающихся с атомами фосфора, имеющими фосфодиэфирную связь соседних нуклеотидов с атомами серы. По меньшей мере, одна из * является стереоизомером S-формы. В данном контексте, как описано выше, стереоизомер S-формы является стереоизомером, принимающим S-форму, когда его атомы или основания, введенные вместо атомов кислорода, являются атомами серы.
[0055] Предпочтительно, чтобы олигонуклеотид настоящего изобретения соответствовал последовательности, представленной формулой (I), или описанным выше последовательностям, и, чтобы Х1X2 представлял собой GA, и Х3Х4 представлял собой ТТ или АС.
[0056] Предпочтительно, чтобы олигонуклеотид настоящего изобретения являлся одним из вышеописанных нуклеотидов, и чтобы модификации фосфатного остова, которые существуют в, по меньшей мере, одном из сайтов, кроме CpG-мотива, являлись олигонуклеотидами, включающими тиофосфат. Иными словами, как описано выше, предпочтительно, чтобы олигонуклеотид также имел модификацию тиофосфатного остова на сайтах, кроме CpG. В этом случае, как описано выше, стереоизомер S-формы является предпочтительным. Тем не менее, в соответствии с настоящим изобретением предпочтительно, чтобы отсутствовала модификация тиофосфатного остова между каждой последовательностью.
[0057] Последовательность, состоящая из 5'-X1X2CpGX3X4-3' формулы (I) определяется как CpG-мотив. Далее, предпочтительно, чтобы олигонуклеотид настоящего изобретения имел последовательность -(G)m- (m обозначает целое число до 2 до 10) к 5'-концу или 3'-концу CpG-мотива.
[0058] Предпочтительно, чтобы олигонуклеотид настоящего изобретения имел последовательность, состоящую из ТС, ТА, TG или СС к 5'-концу CpG-мотива.
[0059] Предпочтительно, чтобы олигонуклеотид настоящего изобретения включал, по меньшей мере, первый и второй CpG-мотивы. Первый и второй CpG-мотивы связывались непосредственно или включали - (Т)n- (n обозначает целое число от 1 до 3), ТА, ТС между первым и вторым CpG-мотивами.
[0060] Предпочтительно, чтобы олигонуклеотид настоящего изобретения имел последовательности, в которых 1, 2 или 3 основания замещены из, введены в, удалены из или добавлены к
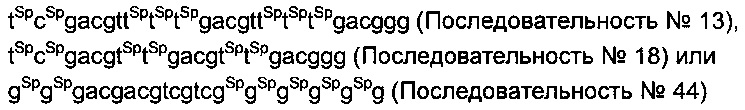
Предпочтительно, чтобы указанные олигонуклеотиды проявляли такую же устойчивость и активность, как и последовательности №13, 18 или 44. В данном случае "cg" обозначает неметилированный CpG, и "Sp" указывает на то, что модификация фосфатного остова S-формы введена между соседними нуклеотидами.
[0061] Предпочтительно, чтобы олигонуклеотид настоящего изобретения включал
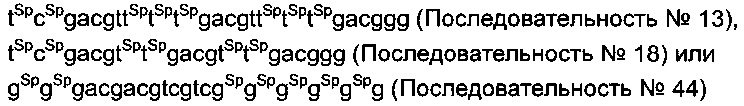
В данном случае "cg" обозначает неметилированный CpG с модификацией фосфатного остова, и "Sp" указывает на то, что модификация фосфатного остова S-формы введена между соседними нуклеотидами.
[0062] Способ синтезирования нуклеотидов
Способ синтезирования нуклеотидов общеизвестен. Нуклеотиды настоящего изобретения могут быть получены с помощью общеизвестного способа. Например, могут быть использованы способы, раскрытые в описании патента No. 450870 и международной заявке на патент No. 2010/064146.
[0063] Другие примеры способа синтезирования нуклеотида приведены в официальном заключении по патенту No. 4942646 и в патенте США No. 5912332. В последнем используется линкер для связывания с твердой подложкой для проведения параллельного синтеза или типовая твердая подложка, такая как стекло с контролируемым размером пор для присоединения фосфатной соли.
[0064] Кроме того, нуклеотид может быть получен, например, с помощью способа, раскрытого в патенте No. 4383534 А. Например, нуклеотид может быть получен В-цианоэтил-фосфороамидатным способом (S.L. Beaucage, М.Н. Caruthers, Tetrahedron Lett. 1981, 22, 1859-62) и нуклеозид Н-фосфонатным способом (Per J. Garegg et al., Tetrahedron Lett. 1986, 27, 4051-4; Brian C. Froehler et al., Nucl Acid Res 1986, 14, 5399-407; Per J. Garegg et al., Tetrahedron Lett. 1988, 27, 4055-8; Barbara L. Gaffney et al., Tetrahedron Lett., 29, 2619-22). Указанные химические вещества могут быть синтезированы с помощью разнообразных автоматических синтезаторов нуклеиновых кислот, имеющихся на рынке. Указанные нуклеиновые кислоты называются синтетическими нуклеиновыми кислотами. В соответствии с другим вариантом существует возможность получения в широком масштабе нуклеиновых кислот настоящего изобретения на основе плазмид. (Sambrook T. et al,. Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, 1989). Нуклеиновая кислота настоящего изобретения может быть разделена на более мелкие фрагменты или введена целиком. Нуклеиновую кислоту получают из последовательности нуклеиновой кислоты (например, геномной последовательности и последовательности комплементарной ДНК) с использованием известных методов (например, методы, в которых используются рестрикционные ферменты, экзонуклеаза или эндонуклеаза). Нуклеиновая кислота, полученная с помощью указанных способов, называется изолированной нуклеиновой кислотой. В целом, изолированная нуклеиновая кислота является, например, нуклеиновой кислотой, отделенной от компонентов, с которыми она естественно, как правило, связана. Например, изолированная нуклеиновая кислота является нуклеиновой кислотой, отделенной от клеток, ядер, митохондрий и хроматина. Содержащая комбинационный мотив нуклеиновая кислота настоящего изобретения включает как синтезированные нуклеиновые кислоты с комбинационным мотивом, так и изолированные нуклеиновые кислоты с комбинационным мотивом.
[0065] Олигонуклеотиды с комбинационным мотивом, обладающие, при необходимости, относительной стойкостью к деградации (например, стабилизированы), являются предпочтительными при использовании in vivo. Термин "стабилизированная молекула нуклеиновой кислоты" означает молекулу нуклеиновой кислоты, являющуюся относительно резистентной к деградации in vivo (например, экзонуклеаза или эндонуклеаза). Стабилизация нуклеиновой кислоты достигается путем модификации фосфатного остова. Стабилизированная нуклеиновая кислота, имеющая модифицированный остов, является предпочтительной в настоящем изобретение. Указанная модификация остова нуклеиновой кислоты обеспечивает повышение активности олигонуклеотида с комбинационным мотивом при введении in vivo. В ряде случае олигонуклеотиды с комбинационным мотивом, содержащие тиофосфатную связь, обеспечивают максимальную активность и защищают нуклеиновую кислоту от деградации, вызываемой внутриклеточными экзонуклеазами и клеточными эндонуклеазами. Кроме того, упоминаются другие модифицированные нуклеиновые кислоты, модифицированные фосфодиэфирные нуклеиновые кислоты, сочетания фосфодиэфирных нуклеиновых кислот и тиофосфатных нуклеиновых кислот (то есть химерных), метилфосфонат, метилтиофосфат, фосфордитионат, р-этокси, и их сочетания.
[0066] Модифицированные остовы (например, тиофосфаты) могут быть синтезированы с использованием автоматизированных способов, в которых используется либо фосфорамидатная химия, либо Н-фосфонатная химия. Арил-фосфонаты и алкил-фосфонаты, например, могут быть получены в соответствии со способом, описание которого приведено в патенте США №US4,469,863. В то время как алкилфофсотриэфир (заряженные атомы кислорода алкилируют, как описано в патенте США No. US5,023,243 и патенте ЕР No. 092,574) может быть получен с использованием коммерчески доступных реагентов путем автоматизированного твердофазного синтеза. В литературе приведено описание способов выполнения модификаций и замещений других остовов ДНК (Например, Uhlmann Ε and Peyman A, Chem. Rev. 1990, 90, 544; Goodchild J., Bioconjugate Chem. 1990, 1, 165).
[0067] Олигонуклеотиды, полученные синтезированием, могут быть подвергнуты очистке с использованием известных методов, например, очистка, снятие защиты, обессоливание и диализирование методом обратно-фазовой ВЭЖХ. Благодаря последнему методу олигонуклеотиды настоящего изобретения могут быть выделены и очищены.
[0068] Настоящее изобретение предусматривает создание композиции с одним из вышеуказанных олигонуклеотидов. Данная композиция является лекарственной композицией. Композиция содержит эффективное количество любого из вышеописанных олигонуклеотидов, и она также может содержать соответствующий известный носитель. Носитель может представлять собой растворитель, такой как вода или спирт. Носитель может представлять собой опциальные вспомогательные вещества, разбавляющие вещества, наполнители, соли, буферы, стабилизаторы, солюбилизаторы, липиды или иные вещества, хорошо известные в данной области техники для создания лекарственных композиций.
[0069] Настоящее изобретение также предусматривает создание вакцинного адъюванта с вышеописанными олигонуклеотидами.. При необходимости вакцинный адъювант может содержать фармацевтически приемлемый носитель. В патенте No. 4126252 раскрывается вакцинный адъювант с олигонуклеотидом. Вакцинный адъювант с олигонуклеотидом настоящего изобретения может включать раскрытые надлежащим образом в настоящей публикации элементы.
[0070] Настоящее изобретение также предусматривает создание индуктора для выработки интерферона-α (IFN-α) из дендритных клеток, включая любой из вышеописанных олигонуклеотидов. Настоящее изобретение также предусматривает создание лекарственного препарата для лечения инфекционных, раковых, респираторных заболеваний, аллергических заболеваний, аутоимунных заболеваний или для заживления ран, включающего эффективное количество любого из описанных выше олигонуклеотидов в качестве активного ингредиента.
[0071] Примеры инфекционных заболеваний, лечение которых осуществляется с использованием лекарственных препаратов настоящего изобретения, включают грибковую инфекцию, персистентную грибковую инфекцию, бактериальную инфекцию, кандидоз, хронический кандидоз кожи и слизистых (CMC), аспергиллез, криптококкоз, вирусную инфекцию, персистентную вирусную инфекцию, инфекции, вызванные вирусом иммунодефицита человека (ВИЧ), инфекции, вызванные вирусом гепатита В, инфекции, вызванные вирусом гепатита С, персистентную бактериальную инфекцию, микобактериальную инфекцию, микобактериальную туберкулезную инфекцию, инфекцию, вызванную коровьей туберкулезной палочкой, и инфекцию, вызванную микобактерией лепры. Например, в официальном отчете по патенту No. 4688815 указывается, что интерферон-α является эффективным при лечении инфекций, в том числе инфекций, вызванных вирусом гепатита С, и в патенте США №4607452 указывается, что интерферон-α является эффективным при лечении инфекций (например, заболевания, вызванного микобактериями, малярии, лейшманиоза, токсоплазмоза, бильгарциоза и заболеваний, вызванных печеночной двуусткой). Лекарственный препарат настоящего изобретения является также эффективным при лечении инфекций за счет выработки интерферона-α.
[0072] Раковые заболевания, лечение которых осуществляется с использованием лекарственных препаратов настоящего изобретения, включают рак и опухоли. Например, в официальном ответе по патенту №4607452 и официальном отчете по патенту №2011-503039 указывается, что интерферон-α (IFN-α) является эффективным при лечении рака и опухолей. Ввиду указанной причины лекарственный противораковый препарат является эффективным при лечении рака и опухолей.
[0073] Примеры респираторных заболеваний, лечение которых осуществляется с использованием лекарственных препаратов настоящего изобретения, включают копролалию, астму, аллергический ринит, бронхит, пневмонию, синдром острой дыхательной недостаточности (СОДН) и аллергический бронхолегочный аспергиллез. Например, в официальном отчете по патенту №2004-505046 указывается, что интерферон-α является эффективным при лечении респираторных заболеваний.
[0074] Примеры аллергических заболеваний, лечение которых осуществляется с использованием лекарственных препаратов настоящего изобретения, включают синдром системной воспалительной реакции (SIRS), анафилаксию или анафилактоидную реакцию, аллергический васкулит, гепатит, нефрит, нефропатию, панкреатит, ринит, артрит, воспалительные заболевания глаз (например, конъюнктивит и т.д.), воспалительное заболевание кишечника (например, язвенный колит, болезнь Крона, эозинофильное заболевание желудочно-кишечного тракта и т.д.), заболевания мозговой и сердечно-сосудистой систем (например, артериосклероз, тромбоз, ишемия / реперфузионное повреждение, рестеноз, инфаркт и т.д.), кожные болезни (например, дерматит (например, атопический дерматит, псориаз, контактный дерматит, экзема, крапивница, почесуха и т.д.), аутоиммунные заболевания (например, рассеянный склероз, ревматоидный артрит, системная красная волчанка, диабет I типа, гломерулонефрит, синдром Сегрена и т.д.), отторжение трансплантированного органа. Например, в официальном отчете по патенту №2004-50546 указывается, что интерферон-α является эффективным при лечении аллергических заболеваний. Ввиду этого лекарственный препарат для лечения аллергических заболеваний настоящего изобретения является эффективным при лечении аллергических заболеваний за счет выработки интерферона-α.
[0075] Примеры аутоиммунных заболеваний, лечение которых осуществляется с использованием лекарственных препаратов настоящего изобретения, включают острую идиопатическую тромбоцитопеническую пурпуру, хроническую идиопатическую тромбоцитопеническую пурпуру, хорею Сиденгама, миастению гравис, системную красную волчанку, волчаночный нефрит, острую ревматическую лихорадку, полигландулярные синдромы, буллезный пемфигоид, диабеты, пурпуру Геноха-Шенлейна, постстрептококковый нефрит, узловатую эритему, синдром дуги аорты, хронический гипокортикоидизм, ревматоидный артрит, рассеянный склероз, саркоидоз, язвенный колит, мультиформную эритему, lg А-нефропатию, узловой полиартериит, анкилозирующий спондилоартрит, Синдром Гудпасчера, облитерирующий тромбангиит, синдром Сегрена, билиарный первичный цирроз печени, аутоиммунный тиреоидит, тиреотоксикоз, склеродермия, хронический активный гепатит, полимиозит / дерматомиозит, полихондрию, обыкновенную пузырчатку, гранулематоз Вегенера, мембранозную нефропатию, боковой амиотрофический склероз, поражения спинного мозга, гигантоклеточный артериит / полимиалгию, пернициозную анемию, быстропрогрессирующий гломерулонефрит, псориаз и фиброзирующий альвеолит. Например, в патенте JP 2007-528209 А указывается, что интерферон-α является эффективным при лечении указанных аутоимунных заболеваний. Ввиду этого лекарственный препарат для лечения аутоиммунных заболеваний настоящего изобретения является эффективным при лечении аутоиммунных заболеваний за счет выработки интерферона-α.
[0076] Раны, лечение которых осуществляется с использованием лекарственных препаратов настоящего изобретения, включают кожные воспаления, раны, образовавшиеся вследствие хирургического вмешательства, гипертрофические рубцы, келоиды. Например, в официальном отчете по патенту №2003-503313 указывается, что интерферон-α (IFN-α) является эффективным при лечении кожных воспалений. Ввиду этого лекарственный препарат для лечения ран настоящего изобретения является эффективным при лечении ран за счет выработки интерферона-α.
[0077] Индуктор выработки интерферона-α (IFN-α) и указанные лекарственные препараты могут быть получены, например, путем использования способа, раскрытого в патенте №.4383534.
[0078] Нуклеотид настоящего изобретения может быть использован для индуцирования IFN 1 типа (то есть, IFN-α и IFN-β). Указанный способ включает процесс, при котором клетка, способная экспрессировать IFN 1 типа, контактирует с эффективным количеством олигонуклеотидов настоящего изобретения, содержащих комбинационный мотив, для индуцирования экспрессии IFN 1 типа с помощью клетки. В последнее время было признано, что основным типом клеток-продуцентов IFN-α у человека являются плазмацитоидные дендритные клетки (pDC). Количество указанного типа клеток является исключительно низким (0,2-0,4%), и этот тип клеток характеризуется негативной линией дифференцировки (то есть, CD3, CD14, а также CD19 не окрашены), CD11c негативной и фенотипически позитивной в отношении CD4, CD123 (IL-3Rα) и главным комплексом гистосовместимости II класса (ГКГС II класса). Способы для измерения IFN 1 типа известны специалистам в данной области техники, и примеры таких способов включают твердофазный иммуноферментный анализ (ELISA), биоанализ и сортировку флуоресцентно-активированных клеток (FACS). Указанные типы анализа могут быть выполнены с использованием доступных на рынке реактивов и наборов для анализа.
[0079] Указанный олигонуклеотид является эффективным для индуцирования системной иммунной реакции и (или) мукозного иммунного ответа. Олигонуклеотиды настоящего изобретения, содержащие комбинационный мотив, могут быть введены пациенту, подверженному воздействию антигенов для индуцирования усиленного иммунного ответа на антигены. Таким образом, например, нуклеотид, содержащий комбинационный мотив, является эффективным для вакцинного адъюванта. Примеры основного вещества, действующего в качестве адъюванта, включают различные вакцины. Адъювант может повысить эффективность антигена, вводимого в иммунные клетки. Предпочтительно, чтобы адъювант был способен повышать или усиливать или содействовать первоначальному действию с помощью активного ингредиента основного вещества.
Примеры вакцины включают вакцины для лечения вирусного гепатита В, гепатита А, японского энцефалита, педиатрических пневмококовых инфекций, дифтерии, коклюша столбняка, кори, краснухи, свинки, ветряной оспы и туберкулеза (вакцина БЦЖ). Примеры противовирусной вакцины включают противогриппозную вакцину, противополиомиелитную вакцину, вакцину против вируса папилломы человека, противоротавирусную вакцину, вакцину против лихорадки, полиовакцину и вакцину от СПИДа. Олигонуклеотид настоящего изобретения действует в качестве адъюванта, используемого в исключительно небольшом количестве. Таким образом, олигонуклеотид настоящего изобретения обладает низкой токсичностью по сравнению с известными адъювантами и вызывает и вызывает немногочисленные побочные эффекты. Ввиду этого, вакцина, вводимая большому количеству пациентов, имеющих различные заболевания, является исключительно эффективной.
[0080] Указанный олигонуклеотид может быть введен с адъювантом ненуклеиновой кислоты. Адъювант ненуклеиновой кислоты представляет собой произвольную молекулу или соединение, за исключением олигонуклеотидов, которые способны стимулировать иммунный гуморальный ответ и (или) клеточную иммунную реакцию. Примеры ненуклеиновой кислоты включают адъюванты, вызывающие депо-эффект, иммуностимулирующие адъюванты. В соответствии со значением, используемом в настоящем контексте, мукозный адъювант ненуклеиновой кислоты является адъювантом, способным индуцировать мукозные иммунные ответы у пациента при введении в поверхность слизистой оболочки с антигеном.
[0081] Олигонуклеотид настоящего изобретения может быть составлен в виде фармацевтической композиции в фармацевтически приемлемом носителе. Указанный олигонуклеотид может быть введен пациенту непосредственно или с комплексом доставки нуклеиновых кислот. Комплекс доставки нуклеиновых кислот означает нуклеиновую кислоту, связанную (например, ионная связь или ковалентная связь, или инкапсулирована) с компонентами направленного воздействия (например, молекулами, образующими высокоаффинную связь с клетками-мишенями (например, поверхность В-клетки) и (или) обеспечивающими повышение клеточного поглощения клетками-мишенями). Примеры комплекса доставки нуклеиновых кислот включают нуклеиновые кислоты, связанные со стеролами, такими как холестерол, липидами (например, катионными липидами, виросомами или липосомами) или факторами специфического связывания с клетками-мишенями (например, лиганды, распознанные специфическим рецептором клетки-мишени). Предпочтительный комплекс должен быть достаточно устойчивым in vivo для предотвращения существенного ослабления связи до интернализации клеткой-мишенью. Однако комплекс может быть расщеплен при соответствующих условиях в клетке таким образом, чтобы происходило выделение нуклеиновой кислоты в функциональной форме.
[0082] Указанный олигонуклеотид и (или) антиген и (или) иные лекарственные препараты могут быть введены отдельно (например, в физиологическом или буферном растворе), и могут также быть введены с использованием любых известных средств доставки.
[0083] Доза описанных в настоящей заявке соединений для мукозальной доставки или топической доставки, как правило, находится в диапазоне приблизительно от 0,1 мкг/дозу до 10 мг/дозу. Доза зависит от того, вводят ли ее ежедневно, еженедельно или ежемесячно и в любой иной период времени. Как правило, мукозальные дозы или локальные дозы находятся в диапазоне приблизительно от 10 мкг/дозу до 5 мг/дозу. Чаще всего, она составляет приблизительно от 100 мкг/дозу до 1 мг/дозу, и введение осуществляют 2-4 раза с интервалом в течение нескольких дней или нескольких недель. Как правило, доза для иммуностимулятора находится в диапазоне приблизительно от 1 мкг/дозу до 10 мг/дозу, чаще всего, в диапазоне приблизительно от 10 мкг/дозу до 1 мг/дозу. Затем, введение осуществляется ежедневно или еженедельно. Доза соединений (указанное соединение доставляется с антигеном, и не доставляется с другим лекарственным препаратом), описанных в настоящей заявке для парентерального введения с целью индуцирования антиген-специфического иммунного ответа, как правило, в 5-10000 больше, чем эффективная мукозальная доза для вакцинного адъюванта или применяемого иммуностимулятора. Как правило, она в 10-1000 раз больше, и чаще всего в 20-100 раз больше. В том случае, если олигонуклеотид вводят в сочетании с другими лекарственными препаратами или вводят с использованием специальных средств доставки, доза соединений, предназначенная для индуцирования врожденного иммунного ответа, повышения антителозависимой клеточно-обусловленной цитотоксичности (ADCC) или индуцирования антиген-специфического иммунного ответа, описанных в настоящей заявке для парентерального введения, как правило, находится в диапазоне от приблизительно 0,1 мкг/дозу до 10 мкг/дозу. Доза зависит от того, вводят ли ее ежедневно, еженедельно или ежемесячно и в любой иной период времени. Как правило, парентеральные дозы для указанных целей находятся в диапазоне приблизительно от 10 мкг/дозу до 5 мг/дозу. Чаще всего, она составляет приблизительно от 100 мкг/дозу до 1 мг/дозу, и введение осуществляют 2-4 раза с интервалом в течение нескольких дней или нескольких недель. Тем не менее, в некоторых примерах осуществления настоящего изобретения парентеральные дозы для указанных целей могут превышать в 5-10000 раз диапазон типичных описанных выше доз.
[0084] В описании настоящего изобретения термин "эффективное количество" означает требуемое или достаточное количество для достижения необходимого биологического эффекта. Например, эффективное количество нуклеиновой кислоты для лечения инфекции означает количество, необходимое для лечения инфекции. С учетом изложенных в настоящем описании идей и выбрав различные активные соединения и весовые коэффициенты (например, эффективность лекарственного вещества, относительная биодоступность, вес тела пациента, серьезность вредных побочных эффектов и предпочтительный способ введения), можно планировать эффективную схему профилактического приема лекарств и эффективную схему лечения, которые являются исключительно эффективными для лечения конкретного пациента, не вызывая существенной токсичности. Эффективное количество для любого конкретного применения может меняться в зависимости от факторов, таких как вид заболевания или состояние, которые подвергаются лечению, конкретного вводимого олигонуклеотида, антигена, размера тела пациенты и тяжести заболевания и состояния. Специалист в данной области техники может эмпирически определить эффективное количество конкретного олигонуклеотида и (или) антигена и (или) других лекарственных препаратов без необходимости проведения большего объема экспериментов.
[0085] Терапевтически эффективное количество в отношении любого из соединений, описанных в настоящей заявке, может быть, в первую очередь, определено на основе данных, полученных в результате проведения экспериментов на животных. Эффективная доза для лечения также может быть определена на основе данных о CpG олигонуклеотиде, который был протестирован на человеке (было начато проведение клинических исследований с участием людей) и на основе данных о мукозальном и локальном введении известных соединенней, имеющих одинаковую фармакологическую активность [Например, другие мукозальные адъюванты (например, большой Т-антиген и другие антигены для вакцинации)]. Для парентерального введения необходимо применять более высокие дозы. Применимая доза может регулироваться на основе относительной биоактивности и эффективности вводимых соединений. В данной области техники хорошо известны иные методы регулирования дозы для достижения максимальной эффективности. Кроме того, специалист в данной области техники может легко отрегулировать дозу.
[0086] При введении состав настоящего изобретения растворяют в фармацевтически приемлемых растворах. Как правило, раствор может включать соли в фармацевтически приемлемых концентрациях, буферные агенты, консерванты, совместимые носители, адъюванты и опциально иные терапевтические ингредиенты.
[0087] Для использования в терапии олигонуклеотид в эффективном количестве может быть введен пациенту любым способом для доставки нуклеиновых кислот к требуемой поверхности (например, на поверхность слизистой и на поверхность организма в целом). Введение фармацевтических композиций настоящего изобретения может быть осуществлено любым способом, известным специалистам в данной области техники. Предпочтительные пути введения включают пероральный, парентеральный, внутримышечный, интраназальный, интратрахеальный, ингаляционный, окулярный, подъязычный, вагинальный, ректальный пути и т.д., однако указанные пути введения не ограничены перечисленными в настоящей заявке путями.
[0088] Для перорального введения соединения (то есть, олигонуклеотиды, антигены и другие лекарственные препараты) могут быть легко приготовлены путем комбинирования активного соединения с известным в данной области фармацевтически приемлемыми носителями. Такие носители позволяют составить соединения настоящего изобретения в таких лекарственных формах, как перорально применяемые пациентом таблетки, пилюли, драже, капсулы, растворы, гели, сиропы, взвеси, суспензии и т.д. Фармацевтические препараты для перорального введения могут быть получены в виде твердого вспомогательного вещества путем добавления при необходимости приемлемых вспомогательных веществ, которые в последующем размельчают в полученной смеси и формируют сердцевину таблетки или сердцевину драже при обработки смеси гранул. В частности, приемлемые вспомогательные вещества являются наполнителями [например, сахар (лактоза, сахароза, маннитол и сорбитол); препараты целлюлозы (например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакант, метилцеллюлоза, гидроксипропил метил-целлюлоза, натрий- карбоксиметилцеллюлоза) и (или) поливинилпирролидон (PVP)]. При необходимости могут быть добавлены вещества для улучшения распадаемости таблеток [например, сшитый поливиниловый пирролидон, агар, альгиновая кислота или ее соль (например, альгинат натрия)]. При необходимости, пероральные лекарственные формы также могут быть введены в физиологическом или буферном растворе для нейтрализации кислотного состояния в организме. Кроме того, пероральные лекарственные формы могут быть введены без каких-либо носителей.
[0089] На сердцевины драже наносят приемлемые подходящие покрытия. Для этой цели можно использовать концентрированные растворы сахара. При необходимости концентрированные растворы сахара могут содержать аравийскую камедь, тальк, поливинил пирролидон, карбомер-гель, полиэтиленгликоль и (или) двуокись титана, лаковые растворы, приемлемые органические растворители или смеси растворителей. С целью определения или характеризации различных сочетаний активных соединений в дозах, к таблеткам или к покрытию драже могут быть добавлены красители или пигменты.
[0090] Примеры фармацевтических препаратов, которые могут быть введены перорально, включают изготовленные твердые капсулы из желатина и мягкие герметичные капсулы, изготовленные из желатина и пластификатора (например, глицерина или сорбитола). Твердые капсулы могут содержать активный ингредиент, смешанный при необходимости с наполнителями (например, лактозой), связующими веществами (например, крахмалом) и (или) лубрикантами (например, тальком или стеаратом магния) и стабилизаторами. В мягкой капсуле активные соединения могут быть растворены или суспендированы в приемлемых жидкостях (например, жирные масла, жидкий парафин или жидкий полиэтиленгликоль). Кроме того, могут быть добавлены стабилизаторы. Также для перорального введения могут быть использованы такие лекарственные формы, как микросферы. Такие микросферы хорошо известны в данной области техники. Все лекарственные формы для перорального введения могут быть использованы в соответствующей дозировке.
[0091] Для буккального введения композиции может быть придана лекарственная форма в виде таблеток или пастилок для рассасывания с использованием известного способа.
[0092] Для ингаляционного введения соединения настоящего изобретения могут быть введены аэрозольным спреем из аэрозольного баллона, находящегося под давлением или ингалятора с использованием приемлемого газа-вытеснителя (например, дихлордифторметана, трихлорфторметана, трихлортрифторэтана, двуокиси углерода или другого подходящего газа. При использовании аэрозоля под давлением единица дозирования может быть определена путем установления клапана для доставки дозированного количества. Для использования в ингаляторе или инсуфляторе может быть предусмотрено создание таких желатиновых капсул и картриджей, которые содержат порошковую смесь соединения и подходящую порошковую базу.
[0093] При необходимости систематической доставки соединения соединение может быть выполнено в лекарственной форме, которая может быть введена парентерально путем инъекции (например, болюсной инъекции или непрерывной инфузии). Лекарственные формы для инъекции могут быть составлены в единичной лекарственной форме (например, ампула или многодозовый контейнер) с консервантом. Соединения могут иметь формы растворов, эмульсий или суспензии в жировом или водном растворителе. Кроме того, они могут содержать лекарственные формы (например, суспендирующие вещества, стабилизаторы и (или) диспергирующие компоненты).
[0094] Фармацевтические лекарственные формы для парентерального введения включают водные растворы активных соединений, являющихся водорастворимыми. Кроме того, суспензии активных соединений могут быть представлены в виде приемлемых масляных инъекционных суспензий. Подходящие липофильные растворители или носители включают жирные масла (например, кунжутное масло), синтетические сложные эфиры жирных кислот, например, этилолеат или триглицериды) или липосомы. Водные инъекционные суспензии могут содержать вещества, повышающие вязкость суспензии (например, натрий-карбоксиметилцеллюлоза, сорбитол или декстран). Для приготовления высококонцентрированных растворов суспензия также может включать вещества, повышающие растворимость соответствующих стабилизаторов или их соединений при необходимости.
[0095] В соответствии с другим вариантом активные соединения могут иметь порошковую форму, которая может быть изготовлена до использования с подходящим носитель (например, стерильная апирогенная вода).
[0096] Также могут быть созданы соединения в форме для ректального или вагинального введения (например, суппозитории или удерживающие клизмы, которые могут содержать обычные суппозиторные основы, такие как масло какао или другие глицериды).
[0097] Кроме вышеизложенного, также могут быть созданы соединения в виде депо-препарата. Такие лекарственные формы длительного действия могут быть получены с использованием подходящих полимерных или гидрофобных материалов (например, в виде эмульсии в приемлемом масле), с использованием ионообменной смолы или с использованием плохорастворимых производных (например, плохорастворимые соли).
[0098] Фармацевтические композиции могут также включать носители или вспомогательные вещества, которые являются подходящей твердой или гелевой фазой. Примеры таких носителей или вспомогательных веществ включают без ограничения карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры (например, полиэтиленгликоль).
[0099] Подходящие жидкие формы фармацевтического препарата или твердые формы фармацевтического препарата включают микроинкапсулированные, хелатные микроскопические золотые частицы с нанесенными на их поверхность активным веществом, включенные в липосомы, содержащиеся в аэрозоле для распыления, включенные в таблетку из микрокапсул для имплантации в кожу, сухую форму для нанесения царапин на коже пациента, водный раствор для ингаляции или солевой раствор. Кроме того, фармацевтические композиции включают гранулы, порошки, таблетки, таблетки с оболочкой, (микро) капсулы, суппозитории, сиропы, эмульсии, суспензии, кремы, капли или препараты, которые могут высвобождать активное соединение в течение длительного периода времени. Как описано выше, лекарственные формы включают, как правило, вспомогательные вещества, добавки и (или) адъюванты (например, разрыхлители, связующие вещества, вещества для нанесения оболочки, подсластители, лубриканты, ароматизаторы, подслащивающие или сольюбилизирующие вещества). Фармацевтические композиции приемлемы для использования в различных системах доставки лекарственных средств. Краткий обзор способов доставки лекарств представлен в работе Langer (1990) Science 249: 1527-33 (которая включена в данную заявку путем отсылки).
[0100] Олигонуклеотид и олигонуклеотид, содержащий другой лекарственный препарат и (или) антиген при необходимости могут быть введены без какой-либо обработки или могут быть введены в виде фармацевтически приемлемой соли. При введении в виде фармацевтически приемлемой соли соль должна быть фармацевтически приемлемой. Однако, фармацевтически приемлемую соль могут использовать для приготовления фармацевтически приемлемых солей. Примеры таких солей включают без ограничения: HCl, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту, малеиновую кислоту, уксусную кислоту, салициловую кислоту, п-толуолсульфоновую кислоту, винную кислоту, лимонную кислоту, метансульфоновую кислоту, муравьиную кислоту, малоновую кислоту, янтарную кислоту, нафтален-2-сульфоновую кислоту и бензолсульфоновую кислоту. Кроме того, такие соли могут быть изготовлены в виде солей щелочных металлов или солей щелочноземельных металлов (например, натриевые соли карбоксиловой кислоты, калиевая соль или кальциевая соль).
[0101] Примеры подходящих буферных агентов включают: уксусную кислоту и ее соль (1-2% масса/объем); лимонную кислоту и ее соль (1-3% масса/объем); борную кислоту и ее соль (0,5-2,5% масса/объем); и фосфорную кислоту и ее соль (0,8-2% масса/объем). Примеры подходящих консервантов включают: бензалконий хлорид (0,003-0,03% масса/объем); хлорбутанол (0,3-0,9% масса/объем); парабены (0,01-0,25% масса/объем), и тимеросал (0,004-0,02% масса/объем).
[0102] Фармацевтические композиции настоящего изобретения могут содержать эффективное количество олигонуклеотида, антигене и (или) других веществ в фармацевтически приемлемом носителе при необходимости. Термин "фармацевтически приемлемый носитель" означает один или несколько совместимых наполнителей, разбавителей или инкапсулирующих веществ в твердой или жидкой форме и подходящих для введения людям или другим позвоночным животным. Термин "носитель" означает природный или синтетический, органический или неорганический компонент, который добавляется для обеспечения применения активного ингредиента. Компоненты фармацевтических композиций могут быть смешаны с соединениями настоящего изобретения, и каждый компонент смешивается таким образом, чтобы не взаимодействовать с каждым другим компонентом.
[0103] Для лечения отдельных пациентов требуются фармацевтические композиции различной эффективности настоящего изобретения, исходя из активности соединения, способа введения, цели иммунизации (то есть, профилактическая иммунизация или иммунотерапия), природы и тяжести заболевания, возраста и веса пациента. Введение требуемой дозы может производиться путем введения количества, соответствующего единицам дозирования, единовременно или путем введения меньшего количества несколько раз.
[0104] Примеры других систем доставки включают систему постоянного высвобождения, систему отложенного высвобождения или систему с замедленным высвобождением. Такие системы позволяют избежать повторных введений соединения, что повышает удобство для пациента и врача. Существует много типов систем доставки и высвобождения лекарственных средств, которые известны специалистам в данной области техники. Примеры систем доставки и высвобождения включают систему на основе полимера (например, поли (лактид-гликолид), сополи оксалат, поликапролактон, полиамидоэфиры, полиортоэфиры, полигидроксибутановая кислота, и полиангидриды). Например, микрокапсулы полимера, включающего фармацевтические композиции, описаны в патенте США №5,075,109. Системы доставки также включают неполимерную систему. Примеры неполимерных систем включают: липиды (стерины (например, холестерин, сложный эфир холестерина) и жирные кислоты или натуральные жиры (например, моноглицериды, диглицериды и триглицериды) и т.д.); системы высвобождения из гидрогеля; силастиковую систему; системы на основе пептида; восковое покрытие; прессованные таблетки, в которых используются известные связывающие и вспомогательные вещества; частично соединенные с имплантом. В частности, системы включает без ограничения следующее: (а) эрозионную систему, в которой вещество настоящего изобретения содержится в лекарственной форме, включенной в матрицу (Патент США №4,452,775, Патент США №4,675,189 и Патент США №5,736,152); (b) диффузионную систему, в которой активный ингредиент высвобождается с контролируемой скоростью из полимера (Патент США №3,854,480, Патент США №5,133,974 и Патент США №5,407,686). Кроме того, могут быть использованы механические насосные системы доставки. Некоторые из них приспособлены для имплантации.
[0105] Ниже изобретение проиллюстрировано примерами. Изложенные ниже примеры не должны рассматриваться как ограничивающие. По всему тексту описания изобретения в настоящую заявку включено все содержание документов, на которые имеется ссылка в материалах заявки.
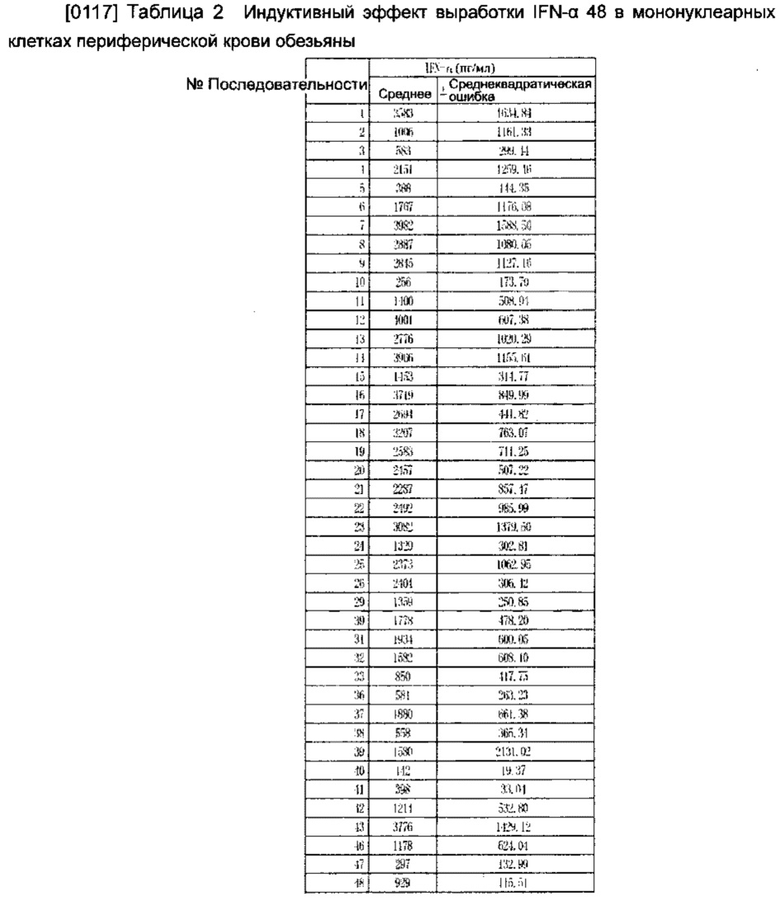
Демонстрационный пример 1
[0106] Синтез хиральной CpG олигонуклеиновой кислоты
CpG олигонуклеиновая кислота (смесь)
Олигонуклеиновую кислоту (смесь), которую синтезировали с использованием фосфорамидитного метода и очищали методом ВЭЖХ, закупали у компании GeneDesign, Inc.
[0107] Синтез CpG олигонуклеотида, в котором модифицирована трехмерная структура.
Удлинения цепи нуклеиновой кислоты проводилось путем повторения следующих стадий (i)-(iv).
(i) 3% DCA (дихлоруксусная кислота)/CH2Cl2 (15 сек),
(ii) Реакция конденсации [Смесь раствора мономера (0,1 М) в MeCN (См. ниже) и раствора PhIMT (N-фенилимидазолий-трифторметансульфоновая кислота) (1 М) в MeCN в отношении 1:1, 5 мин],
(iii) Реакция блокирования [Смесь (0,5 M) CF3Colm в ТГФ и (1 M) DMAN (1,8-бис(диметиламино)нафталин)) в ТГФ в отношении 1:1, 30 сек],
(iv) Реакция сульфуризации (0,1 M DDTT в MeCN, 90 сек) или реакция окисления (0,02 M I2 в растворе Н2O-пиридин-ТГФ, 15 сек).
[0108] После удлинения цепи нуклеиновой кислоты собирали твердофазный носитель в 1,5-мл микропробирку. Твердофазный носитель обрабатывали высококонцентрированным водным раствором аммония (1,2 мл, 55 градусов, 48 часов). Твердофазный носитель удаляли путем фильтрации. Фильтрат высушивали при пониженном давлении и растворяли в воде (1,0 мл). Далее олигомер выделяли и очищали методом обратно-фазовой ВЭЖХ.
[0109] Процедура регулирования раствора мономеров (0,1 М) в MeCN (в случае Rp-Th).
Н-фосфонатный сложный моноэфир тимидиловой кислоты (25 мкмоль) азеотропно высушивали дегидрированным пиридином и дегидрированным толуолом. Растворяли в растворе MeCN-CMP (N-цианометилпиперидин) (объемное соотношение - 9:1; 250 мкл). Далее добавляли Ph3PCl2 (62,5 мкмоль), и раствор перемешивали в течение 10 мин. Затем добавляли AA-L (30 мкмоль; AA-D использовали при выборе Sp-формы), и раствор перемешивали в течение 10 мин. В результате этого получали раствор мономеров.
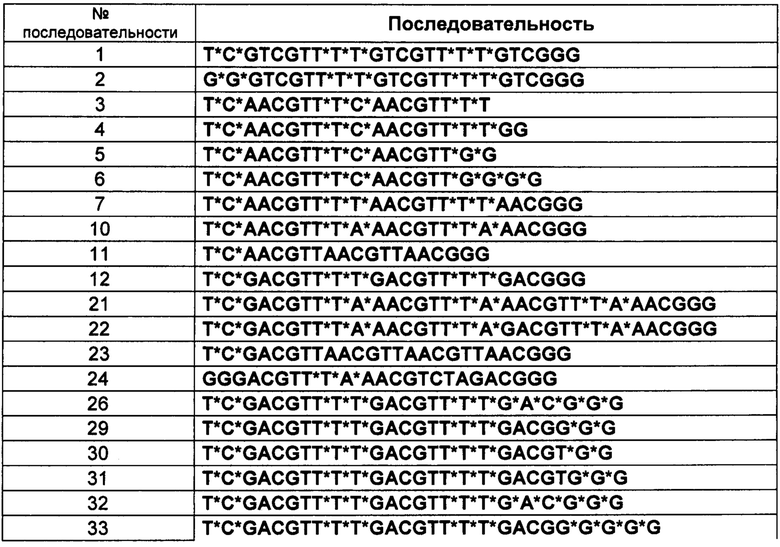
[0110] В вышеприведенном описании DDTT, AA-L и AA-D являются сокращенным обозначением нижеприведенных соединений. Полученные олигонуклеиновые кислоты приведены в Таблице 1.
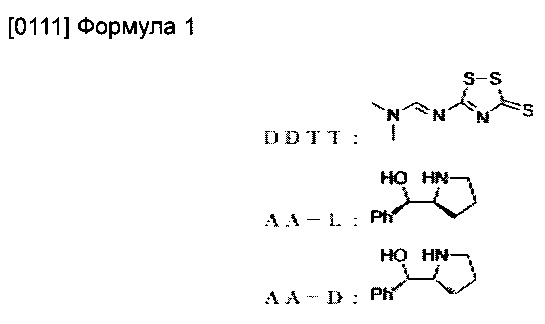


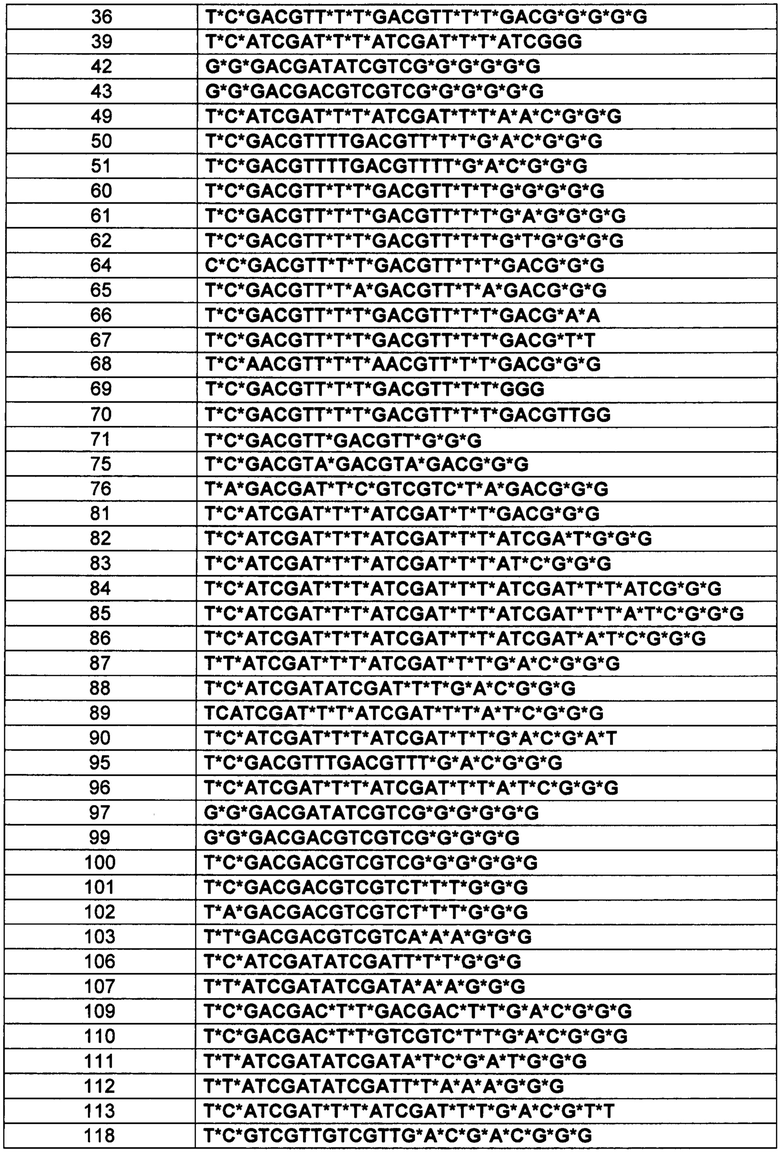
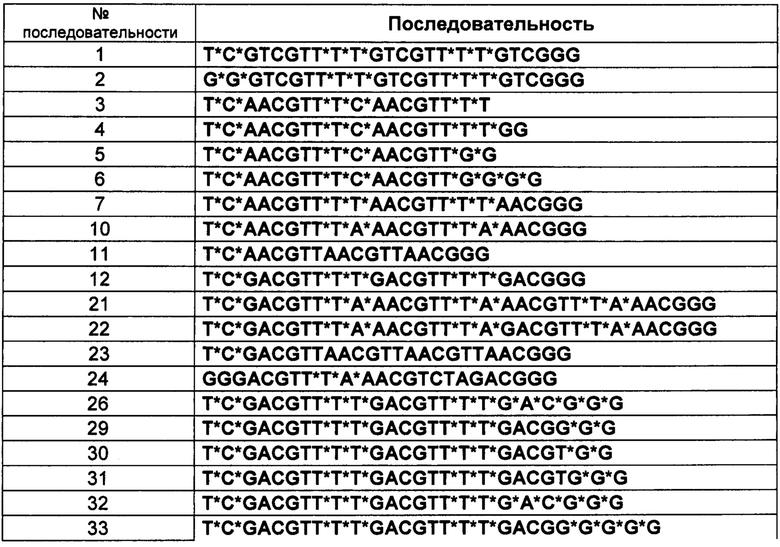
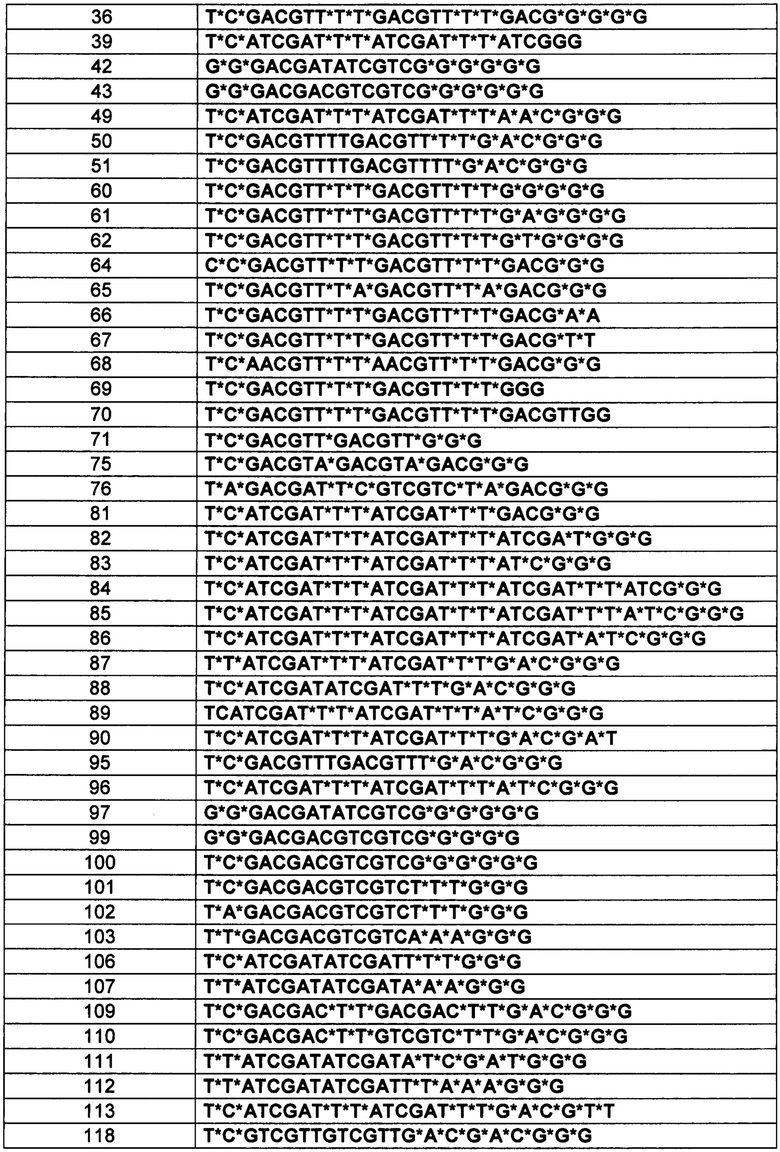
[0114] В вышеприведенных таблицах * обозначает положение, указывающее на то, что модификацией тиофосфатного остова S-формы и модификация тиофосфата R-формы были произвольно индуцированы. В вышеприведенной Таблице, "s" обозначает модификацию тиофосфата S-формы. В вышеприведенной Таблице, "r" обозначает модификацию тиофосфата R-формы.
Демонстрационный пример 2
[0115] Индукция выработки IFN-α в мононуклеарных клетках периферической крови (РВМС) обезьяны.
Кровь брали у обезьяны Масаса fascicularis, анализ крови которой на вирус В показал отрицательный результат, и разводили 3 раза сбалансированным солевым раствором Хенкса. Далее образец расслаивали в среде для центрифугирования Ficoll-Paque PLUS и центрифугировали (2600 об/мин, 30 мин). Получали фракцию, содержащую мононуклеарные клетки периферической крови. После промывания мононуклеарных клеток периферической крови RPMI-средой (1% пенициллина и стрептомицина), мононуклеарные клетки периферической крови суспендировали в RPMI-среде (10% эмбриональной бычьей сыворотки, 1% пенициллина и стрептомицина) при плотности клеток, составляющей 3×106 клеток/мл. Клетки культивировали различными олигонуклеиновыми кислотами (смесь, содержащая олиго-ДНК и DOTAP при соотношении 1:3.2) в 96-луночной круглодонной плашке в течение 17-24 часов с использованием 5% СO2 инкубатора. После культивирования получали надосадочную жидкость клеточной культуры путем центрифугирования (500 об/мин, 5 мин) среды для культивирования. Затем измеряли концентрацию IFN-α в надосадочной жидкости клеточной культуры с использованием тест-набора ELISA(PBL Assay Science).
[0116] Результат приведен в Таблице 2. Из Таблицы 2 видно, что выработку IFN-α индуцировали олигонуклеиновые кислоты последовательностей SEQ No: 1-48 в мононуклеарных клетках периферической крови обезьяны.
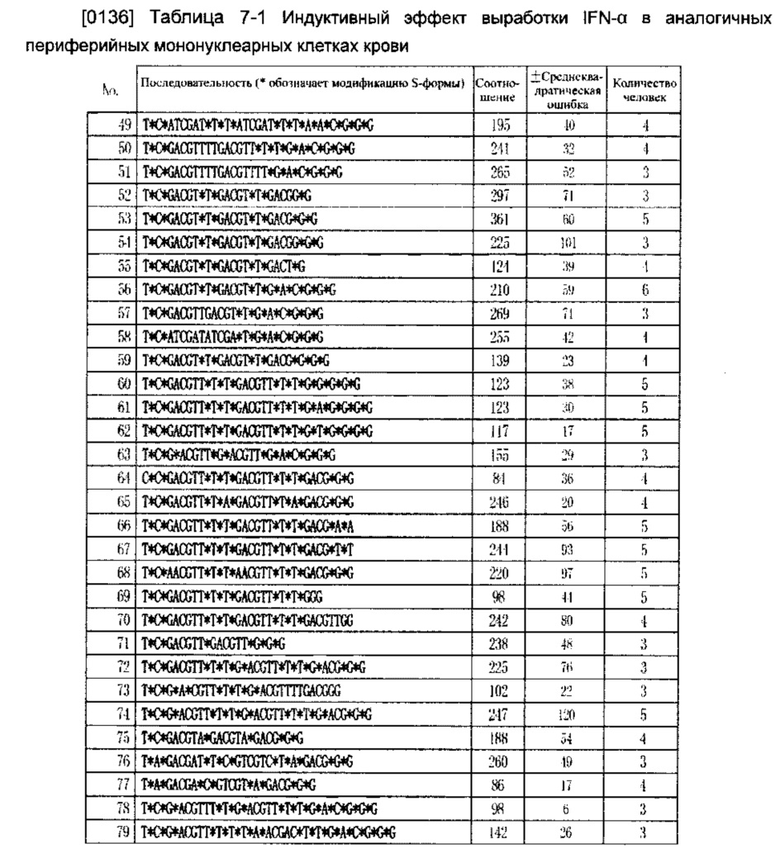
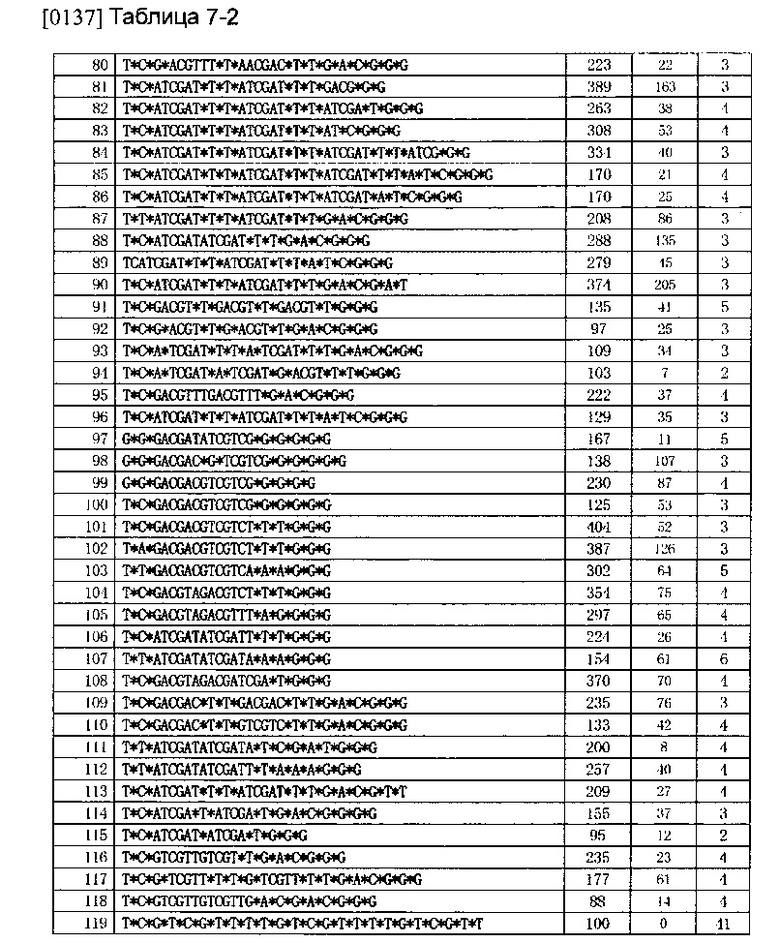
Демонстрационный пример 3
[0118] Оценка устойчивости олигонуклеиновых кислот в обезьяньей сыворотке
Подготовка образцов
Обезьянью сыворотку получали путем центрифугирования (3000 об/мин, 15 мин) крови, взятой у Масаса fascicularis, анализ крови которой на вирус В показал отрицательный результат (Кровь закупали у компании Shin Nippon Biomedical Laboratories, LTD). Олигонуклеиновые кислоты (13,4 нг/мкл) инкубировали в 50% обезьяньей сыворотке при 37 градусах с использованием водяной бани. Образцы обрабатывали при 42 градусах в течение 1,5 часа, используя 0,3 мг/мл протеиназы К. Затем добавляли в равных объемах фенол/хлороформ. После центрифугирования (1000 об/мин, 5 мин) водный слой собирали в качестве образца для проведения анализа методом SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия).
[0119] Проведение анализа методом SDS-PAGE
Полученный в вышеприведенном примере образец (100,5 нг) загружали в 20% SDS-полиакриламидный гель. Анализ методом SDS-PAGE выполняли при 20 мА в течение 120 мин. Далее гель окрашивали в течение 40 минут, используя раствор SYBR-Gold, разведенный 1000 раз. Олигонуклеотиды визуализировали в виде полос флуоресценции, используя прибор для УФ-просвечивания. Интенсивность флуоресценции каждой полосы измеряли с помощью анализатора изображений (IMAGE STATION: Koda).
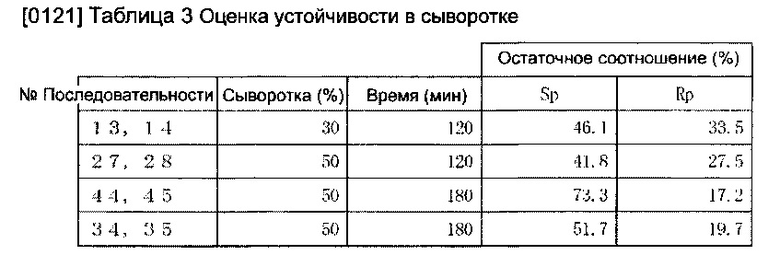
[0120] Результаты приведены на Фиг. 1-3 и в Таблице 3. Фиг. 1 - снимок гель-электрофореза в качестве замены диаграммы, иллюстрирующей устойчивость олигонуклеиновых кислот S-формы и R-формы последовательностей №: 27-28 в сыворотке. Фиг. 2 - снимок гель-электрофореза в качестве замены диаграммы, иллюстрирующей устойчивость олигонуклеиновых кислот S-формы и R-формы последовательностей №: 43-45 в сыворотке. Фиг. 3 - снимок гель-электрофореза в качестве замены диаграммы, иллюстрирующей устойчивость олигонуклеиновых кислот S-формы и R-формы последовательностей №33-35 в сыворотке.
Демонстрационный пример 4
[0122] Тест на индуцирование выработки антиген-специфических антител у мышей
Введение испытуемого вещества
OVA (Wako) и олигонуклеиновые кислоты, которые были приготовлены в концентрации 0,2 мг/мл соответственно в физиологическом солевом растворе использовали в качестве раствора для введения испытуемого вещества.
[0123] Подготовка образцов
В эксперименте использовали 8-недельных мышей линии BALB/cAnCrlCrlj. С помощью обычного анестезирующего оборудования мышей анестезировали изофураном (2,0%-4,0%, форан, Abbott Japan Co., LTD.) и анестезию поддерживали. Далее спину мышей выбривали, вводили подкожно раствор для введения испытуемого вещества при дозе 50 мкл/тело с помощью одноразового шприца и иглы. Спустя две недели после первого введения снова вводили раствор для введения испытуемого вещества. Спустя одну неделю мышей умерщвляли и собирали селезенку и цельную кровь.
[0124] Измерение титра антитела
Плазму, полученную из крови, забираемой у мышей за 5 дней до и 16 дней после введения, использовали в качестве образцов для анализа. Твердофазный раствор в количестве 0,1 мл/лунку помещали в лунки плашки для проведения анализа методом ELISA. Плашку герметизировали и помещали в холодильник на ночь. Далее раствор удаляли, в лунки плашки помещали промывочный раствор в количестве 0,3 мл/лунку, и раствор удаляли. Эту же операцию повторяли дважды. Иными словами, в общем, лунку промывали три раза. Далее в лунки плашки помещали блокирующий раствор в количестве 0,2 мл/лунку. Плашку герметизировали и выдерживали при комнатной температуре в течение 1-4 часов. Далее раствор удаляли, и лунки промывали три раза, как описывалось выше.
[0125] Образец (плазму) для измерения разводили до 1000 раз раствором для разведения. Далее раствор разводили 7 или более раз при стандартном разведении в 2 раза (В результате указанного процесса были получены образцы, разведенные 100-12800 раз). Образцы помещали в лунки плашки в количестве 0,1 мл/лунку для проведения анализа методом ELISA. В качестве слепой пробы раствор для разведения помещали в другую лунку. Плашку герметизировали и инкубировали в течение 1 часа при 37 градусах в инкубаторе для плашек. После инкубирования раствор удаляли. Лунки промывали три раза, как описано выше. Раствор для идентификации антитела помещали в лунке в количестве 0,1 мл/лунку. Плашку герметизировали и инкубировали в течение 1 часа при 37 градусах в инкубаторе для плашек. После инкубирования раствор удаляли. Лунки промывали четыре раза, как описано выше.
[0126] В лунки помещали окрашивающий раствор в количестве 0,1 мл/лунку. Плашку инкубировали в течение 30 минут при комнатной температуре. Далее добавляли стоп-реагент в количестве 0,1 мл/лунку для прекращения реакции. Измеряли поглощающую способность каждой лунки с помощью абсорбционного спектрометра для многолуночной плашки (доминирующая длина волны составляла 450 нм, замещающая длина волны - 620 нм).
[0127] Результат приведен в таблице 4. В таблице 4 приведен результат измерения титра анти-OVA-lgG последовательностей SEQ №№: 27-28. Из Фиг. 4 видно, что олигонуклеиновые кислоты S-формы существенно повышают титр антител по сравнению олигонуклеиновыми кислотами R-формы.

[0129] Измерение веса селезенки
Полученную селезенку промывали холодным физиологическим солевым раствором. Вес селезенки измеряли с помощью электронных весов (HR-200, A&D Company, Limited).
[0130] Результаты приведены в Таблице 5. Из Таблицы 5 видно, что олигонуклеиновые кислоты последовательностей SEQ ID No. 27-28 оказывают влияние на вес селезенки. Из Таблицы 5 видно, что вес селезенки увеличился у мышей, прошедших лечение с использованием олигонуклеиновых кислот R-формы. Данный результат указывает на то, что олигонуклеиновые кислоты R-формы обладают токсичностью. С другой стороны, вес селезенки не увеличился у мышей, прошедших лечение с использованием олигонуклеиновых кислот S-формы. Это указывает на то, что олигонуклеиновые кислоты S-формы не обладают токсичностью или обладают низкой токсичностью.

Демонстрационный пример 5
[0132] CpG олигонуклеиновые кислоты, у которых была модифицирована трехмерная структура, синтезировали, используя аналогичный способ, описание которого приведено в Примере осуществления 1. Последовательности синтезированных олигонуклеиновых кислот приведены в Таблице 6. Индексация в таблице соответствует индексации, описание которой приведено в Примере осуществления 1. Кроме того, в целях ссылки известная последовательность нуклеиновой кислоты показана в SEQ No. 119.


Демонстрационный пример 6
[0135] Используя аналогичный способ, описание которого приведено в Примере осуществления 2, была исследована индукция выработки IFN-α олигонуклеиновых кислот в периферийных мононуклеарных клетках крови (РВМС). Представленные в Таблице значения являются относительными значениями, сравнение которых было проведено со значениями нуклеиновых кислот последовательности SEQ No. 128. Результаты приведены в Таблице 7.
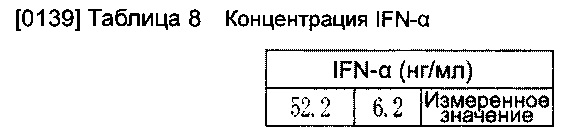
[0138] Используя аналогичный способ, описание которого приведено в Примере осуществления 2, была измерена концентрация IFN-α в случае введения олигонуклеиновых кислот SEQ No. 119. Результат представлен в Таблице 8.
[0140] Настоящее изобретение может быть использовано в области фармацевтической промышленности.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОСТИМУЛИРУЮЩИЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2000 |
|
RU2245149C2 |
| CPG-ОЛИГОНУКЛЕОТИДНЫЕ АНАЛОГИ, СОДЕРЖАЩИЕ ГИДРОФОБНЫЕ Т-АНАЛОГИ С УСИЛЕННОЙ ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2007 |
|
RU2477315C2 |
| ИММУНОСТИМУЛИРУЮЩИЕ ОЛИГОНУКЛЕОТИДЫ | 2009 |
|
RU2477753C2 |
| Иммуностимулирующие олигонуклеотиды | 2012 |
|
RU2610690C2 |
| ИММУНОСТИМУЛИРУЮЩИЕ ФОСФОРТИОАТНЫЕ CpG-ОЛИГОНУКЛЕОТИДЫ, СОДЕРЖАЩИЕ ФОСФОДИЭФИРНЫЕ СВЯЗИ, СПОСОБ ИММУНОМОДУЛЯЦИИ, СПОСОБ СТИМУЛИРОВАНИЯ ИММУННОГО ОТВЕТА | 2003 |
|
RU2338750C2 |
| ПОЛУМЯГКИЕ ИММУНОСТИМУЛИРУЮЩИЕ ОЛИГОНУКЛЕОТИДЫ С-КЛАССА | 2005 |
|
RU2393223C2 |
| ПНЕВМОКОККОВАЯ ВАКЦИНА И ЕЕ ПРИМЕНЕНИЯ | 2010 |
|
RU2536248C2 |
| КОМПЛЕКС, СОДЕРЖАЩИЙ ОЛИГОНУКЛЕОТИД, ОБЛАДАЮЩИЙ ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ, И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2723943C2 |
| НЕКОДИРУЮЩИЙ ИММУНОМОДУЛИРУЮЩИЙ КОНСТРУКТ ДНК С КОВАЛЕНТНО ЗАКРЫТОЙ СТРУКТУРОЙ | 2015 |
|
RU2668387C2 |
| МИКРОЧАСТИЦЫ ДЛЯ ДОСТАВКИ ГЕТЕРОЛОГИЧНЫХ НУКЛЕИНОВЫХ КИСЛОТ | 2001 |
|
RU2295954C2 |

Изобретение относится к олигонуклеотиду, который может быть использован в медицине, включающему от двух до четырех последовательностей, каждая из которых представлена формулой 5'-X1X2CpGX3X4-3', имеющий длину, составляющую от 17 до 32 нуклеотидов, где CpG является неметилированным без модифицированных фосфатных остовов, где олигонуклеотид включает модифицированный фосфатный остов, включающий тиофосфат стереоизомера Sp-типа на сайте, за исключением частей, представленных формулой 5'-X1X2CpGX3X4-3', где Х1Х2 представляет собой один из АА, AT, GA или GT без модифицированных фосфатных остовов, и где Х3Х4 представляет собой ТТ, AT, АС, ТС или CG без модифицированных фосфатных остовов, и олигонуклеотид включает любую одну из последовательностей, где * означает Sp стереоизомер:
Предложен новый CpG олигонуклеотид, обладающий высокой устойчивостью и уменьшенной цитотоксичностью, для выработки интерферона-α. 5 з.п. ф-лы, 3 ил., 11 табл., 6 пр., перечень последовательностей.
1. Олигонуклеотид, включающий от двух до четырех последовательностей, каждая из которых представлена формулой 5'-X1X2CpGX3X4-3', и имеющий длину, составляющую от 17 до 32 нуклеотидов,
в котором CpG является неметилированным CpG без модифицированных фосфатных остовов,
в котором олигонуклеотид включает по меньшей мере один модифицированный фосфатный остов, включающий тиофосфат стереоизомера Sp-типа на сайте, за исключением частей, представленных формулой 5'-X1X2CpGX3X4-3',
в котором Х1Х2 представляет собой один из АА, AT, GA или GT без модифицированных фосфатных остовов, и
в котором Х3Х4 представляет собой ТТ, AT, АС, ТС или CG без модифицированных фосфатных остовов,
в котором олигонуклеотид включает любую одну из последовательностей, представленных последовательностями №№1-7, 10-12, 21-24, 26, 29-33, 36, 39, 42, 43, 49-51, 60-62, 64-71, 75, 76, 81-90,95-97, 99-103, 106, 107, 109-113 и 118:
причем * в вышеприведенной формуле означает Sp стереоизомер, при этом CG в вышеприведенной формуле на сайте, соответствующем 5'-X1X2CpGX3X4-3', означает неметилированный CpG без модифицированных фосфатных остовов.
2. Олигонуклеотид по п. 1, в котором X1X2 представляет собой GA, и в котором Х3Х4 представляет собой ТТ или АС.
3. Олигонуклеотид по п. 1, в котором олигонуклеотид включает последовательность, представленную в виде -(G)m- (m обозначает целое число от 2 до 10), либо на 5' концевой стороне, либо на 3' концевой стороне CpG-мотива, при этом CpG-мотив представляет собой последовательность 5'-X1X2CpGX3X4-3'.
4. Олигонуклеотид по п. 1, в котором олигонуклеотид включает последовательность, представленную в виде -(G)m- (m обозначает целое число от 1 до 6) на 3' концевой стороне CpG-мотива, при этом CpG-мотив представляет собой последовательность 5'-X1X2CpGX3X4-3'.
5. Олигонуклеотид по п. 1, в котором олигонуклеотид включает последовательность, представленную в виде ТС, ТА, TG или СС на 5' концевой стороне CpG-мотива, при этом CpG-мотив представляет собой последовательность 5'-X1X2CpGX3X4-3'.
6. Олигонуклеотид по п. 1, в котором олигонуклеотид включает по меньшей мере первый CpG-мотив и второй CpG-мотив, при этом первый и второй CpG-мотивы представляют собой последовательность 5'-X1X2CpGX3X4-3', олигонуклеотид не включает последовательность между первым CpG-мотивом и вторым CpG-мотивом, или включает последовательность, представленную в виде -(Т)n- (n обозначает целое число от 1 до 3), ТА или ТС между первым CpG-мотивом и вторым CpG-мотивом.
| WO 1998018810 A1, 07.05.1998 | |||
| WO 2006091915 A2, 31.08.2006 | |||
| WO 2004016805 A2, 26.02.2004 | |||
| WO 2001022990 A2, 05.04.2001 | |||
| WO 2000006588 A1, 10.02.2000 | |||
| US 20060003962 A1, 05.01.2006 | |||
| US 20090263413 A1, 22.10.2009 | |||
| EA 200600865 A1, 27.10.2006 | |||
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ CpG-ОЛИГОНУКЛЕОТИДЫ И ВИРУСОПОДОБНЫЕ ЧАСТИЦЫ, ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ АДЪЮВАНТОВ | 2003 |
|
RU2322257C2 |
| КОМПОЗИЦИЯ ДЛЯ СТИМУЛЯЦИИ ИММУННОГО ОТВЕТА (ВАРИАНТЫ), СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЯ И СПОСОБЫ СТИМУЛЯЦИИ ИММУННОГО ОТВЕТА С ИСПОЛЬЗОВАНИЕМ ЭТИХ КОМПОЗИЦИЙ | 2002 |
|
RU2316347C2 |
| Dongbum Kim et al, Biochemical and Biophysical Research Communications, 2009, Volume 379, Issue 2, 362-367. | |||
Авторы
Даты
2019-01-18—Публикация
2013-07-12—Подача