Настоящее изобретение относится к фармацевтической композиции, содержащей (а) парвовирус Н-1 в комбинации с (b) бевацизумабом (Авастин®, Avastin®), и к применению указанной композиции для лечения рака, в частности солидной опухоли.
Рак - вторая по распространенности причина смерти во всем мире. Согласно оценкам, у половины мужчин и одной трети женщин на протяжении их жизни будет диагностирована какая-либо форма рака. Более того, поскольку рак преимущественно представляет собой болезнь старения, по прогнозам, число смертей от рака во всем мире увеличится примерно на 45% с 2007 по 2030 год (с 7,9 млн. до 11,5 млн. смертей) из-за увеличения доли пожилых людей (оценки ВОЗ, 2008 год). Также рак представляет собой заболевание, лечение которого является наиболее дорогостоящим. Последние оценки Национального института онкологии США показали, что общие экономические затраты, связанные с раком, в США в 2007 году составили 226,8 млрд. долларов США. Таким образом, в случае если не будут разработаны более успешные меры по профилактике и выявлению заболевания на ранних стадиях, а также более эффективные способы лечения, ожидается, что это экономическое бремя, которое на сегодняшний представляется огромным, в течение следующих двух десятилетий будет только увеличиваться. Некоторые типы опухолей, такие как опухоли поджелудочной железы, печени, легких, мозга, остаются не охваченными эффективными способами лечения и требуют разработки новых терапевтических вариантов, несмотря на то, что в профилактике, выявлении, диагностике и лечении многих форм рака достигнут значительный прогресс, о чем свидетельствует увеличение процента пятилетней выживаемости при раке в США и Европе за последние тридцать лет. В качестве перспективных инструментов борьбы с раком быстро развивается применение онколитических вирусов, которые, пользуясь специфичной для рака уязвимостью, уничтожают раковые клетки, при этом не повреждая здоровые клетки (Breitbach et al, 2011; Russell et al, 2012). В настоящее время не менее двенадцати различных онколитических вирусов проходят клинические испытания фаз I-III в отношении различных злокачественных новообразований (Russell et al, 2012), при этом их применяют отдельно или в сочетании с другими противораковыми агентами. Среди них в настоящее время онколитический крысиный парвовирус H-1PV проходит оценку на предмет безопасности и первых признаков эффективности в клинических испытаниях фазы I/IIa у пациентов с рецидивирующей мультиформной глиобластомой (МФГ) (Geletneky et al, 2012).
H-1PV представляет собой небольшую (~25 нм в диаметре) икосаэдрическую частицу без оболочки, содержащую одноцепочечный ДНК-геном длиной 5,1 тысяч пар нуклеотидов (Cotmore & Tattersall, 2007). Геномная организация H-1PV состоит из двух транскрипционных единиц под контролем двух промоторов, раннего промотора Р4 и позднего промотора Р38. Промотор Р4 регулирует экспрессию гена, кодирующего неструктурные (NS) белки (NS1 и NS2), а промотор Р38 кодирует капсидные (VP) белки (VP1, VP2, VP3) (Cotmore & Tattersall, 2007). Указанный вирус размножается преимущественно в быстро делящихся раковых клетках. Такая онкоселективностъ основана не на лучшем поглощении вируса раковыми клетками, а скорее на том факте, что для репликации вирусной ДНК необходимы сверхэкспрессирующие факторы раковых клеток, такие как циклин A, E2F или CREB/ATF. Кроме того, раковые клетки часто являются дефектными в своей способности поддерживать эффективный противовирусный иммунный ответ, что способствует размножению вируса (Nuesch et al, 2012). Известно, что указанный вирус активирует множество путей гибели клеток. В зависимости от типа клеток и условий роста H-1PV может индуцировать апоптоз (Hristov et al, 2010; Ohshima et al, 1998; Rayet et al, 1998; Ueno et al, 2001), некроз (Ran et al, 1999) или гибель катепсин В-зависимых клеток (Di Piazza et al, 2007). Указанный вирус был способен индуцировать онколиз даже в раковых клетках, устойчивых к TRAIL (родственный фактору некроза опухоли лиганд, индуцирующий апоптоз), цисплатину и даже при сверхэкспрессии Bcl-2 (di Piazza et al., 2007). Последние результаты показывают, что Вс1-2 не является отрицательным модулятором цитотоксичности парвовируса. Недавно было описано лечение рака с применением парвовируса и его комбинации с химиотерапией или ингибитором HDAC (WO 2009/083232 A1, WO 2011/113600 А1).
Основной неструктурный белок NS1 является главным регулятором репликации вирусной ДНК, экспрессии вирусного гена и цитотоксичности. Единичная экспрессия NS1, подобно вирусу в целом, является достаточной для индуцирования ареста клеточного цикла, апоптоза и клеточного лизиса за счет накопления активных форм кислорода и повреждения ДНК (Hristov et al, 2010). Было показано, что в результате своей онколитической активности указанный вирус обладает онкосупрессивными свойствами, которые были продемонстрированы в раде моделей на животных, что заложило основу для начала клинического испытания в отношении МФГ (Geletneky et al, 2012).
Как рост, так и метастазы солидных опухолей зависят от ангиогенеза (Folkman, J. Cancer Res., 46, 467-73 (1986); Folkman, J. Nat. Cancer Inst., 82, 4-6 (1989); Folkman et al., "Tumor Angiogenesis", Chapter 10, pp.206-32, in The Molecular Basis of Cancer, Mendelsohn et al., eds. (W.B. Saunders, 1995)). Например, было показано, что опухоли, размер которых увеличивается до более 2 мм в диаметре, должны получать собственное кровоснабжение и получают его, вызывая рост новых капиллярных кровеносных сосудов. После того, как эти новые кровеносные сосуды внедряются в опухоль, они обеспечивают приток питательных веществ и факторы роста, необходимые для роста опухоли, а также позволяют опухолевым клеткам попадать в кровообращение и метастазировать в отдаленных участках, таких как печень, легкие или кости (Weidner, New Eng. J. Med., 324 (1), 1-8 (1991)). Естественные ингибиторы ангиогенеза могут предотвратить рост мелких опухолей у животных с опухолями при применении в качестве лекарственных средств (O'Reilly et al., O'Reilly et al., Cell, 79, 315-28 (1994)). Действительно, в некоторых протоколах применение указанных ингибиторов приводит к регрессии опухоли и переходу ее в неактивную стадию даже после прекращения лечения (O'Reilly et al., Cell, 88, 277-85 (1997)). Более того, введение ингибиторов ангиогенеза в определенные опухоли может усилить их ответ на другие терапевтические режимы (например, химиотерапию) (см., например, Teischer et al., Int. J. Cancer, 57, 920-25 (1994)).
Одним из клинически одобренных кандидатов в качестве ингибитора ангиогенеза является бевацизумаб (Avastin® - Genentech/Roche), который представляет собой гуманизированное моноклональное антитело, которое распознает и блокирует фактор роста эндотелия сосудов (VEGF). VEGF - это химический сигнал, который стимулирует рост новых кровеносных сосудов (ангиогенез). Указанное соединение и его получение описаны в патенте США 6054297.
Документ WO 2006/075165 А1 относится к комбинированной терапии, содержащей опухолеселективный токсический вирус и один или более терапевтических агентов, которые уменьшают образование опухолевых кровеносных сосудов или повреждают опухолевую сосудистую сеть.
В недавнем клиническом исследовании фазы III (исследование «AVAglio», Roche) для лечения глиобластомы бевацизумаб вводили совместно с химиотерапевтическим агентом темозоломидом и воздействием излучением. Результаты в отношении общей выживаемости не были многообещающими, и эксперты Американского общества медицинской онкологии (ASCO) в 2013 году пришли к выводу, что ожидания в отношении терапии первой линии не оправдались.
Следовательно, задачей настоящего изобретения является обеспечение средств для улучшенного лечения рака.
В настоящем изобретении данная задача решена с помощью объекта изобретения, определенного в формуле изобретения.
В ходе исследования, которое легло в основу настоящего изобретения, изучался вопрос о том, обладает ли антитело к VEGF, например бевацизумаб, синергией с парвовирусом, например H-1PV или родственным парвовирусом грызунов, в отношении уничтожения раковых клеток. Было показано, что у нескольких пациентов введение бевацизумаба потенцировало онколитическую активность парвовируса синергическим образом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
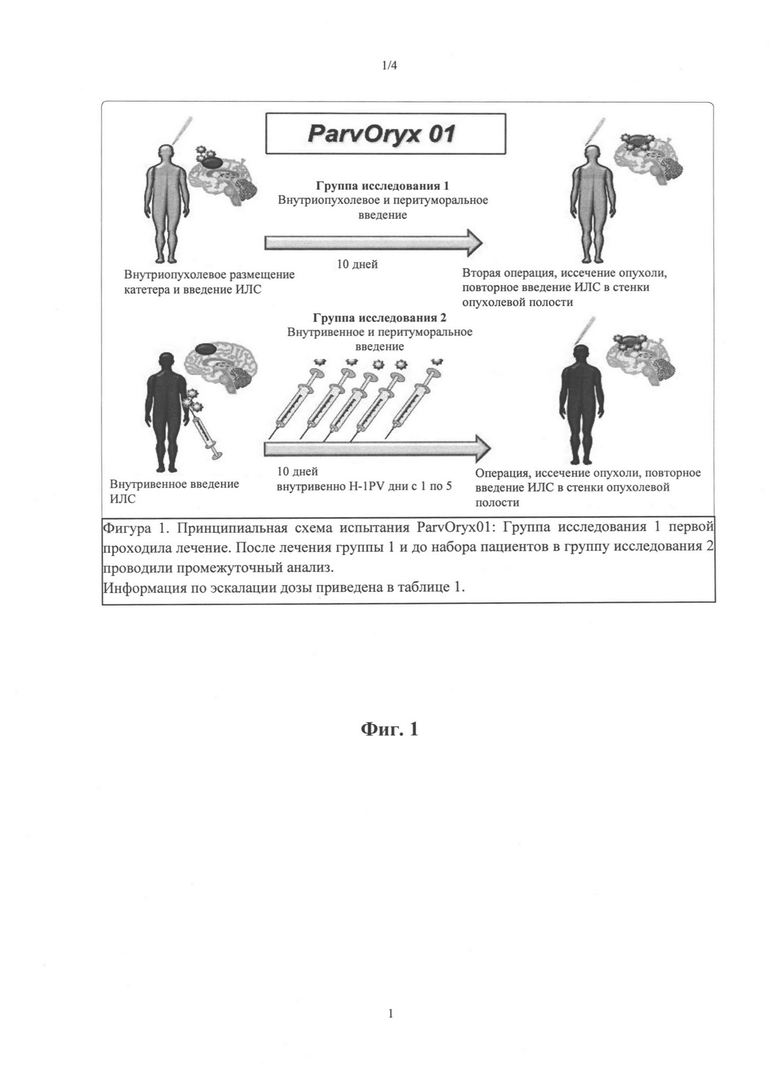
Фиг. 1: Дизайн исследования клинической фазы I/IIa
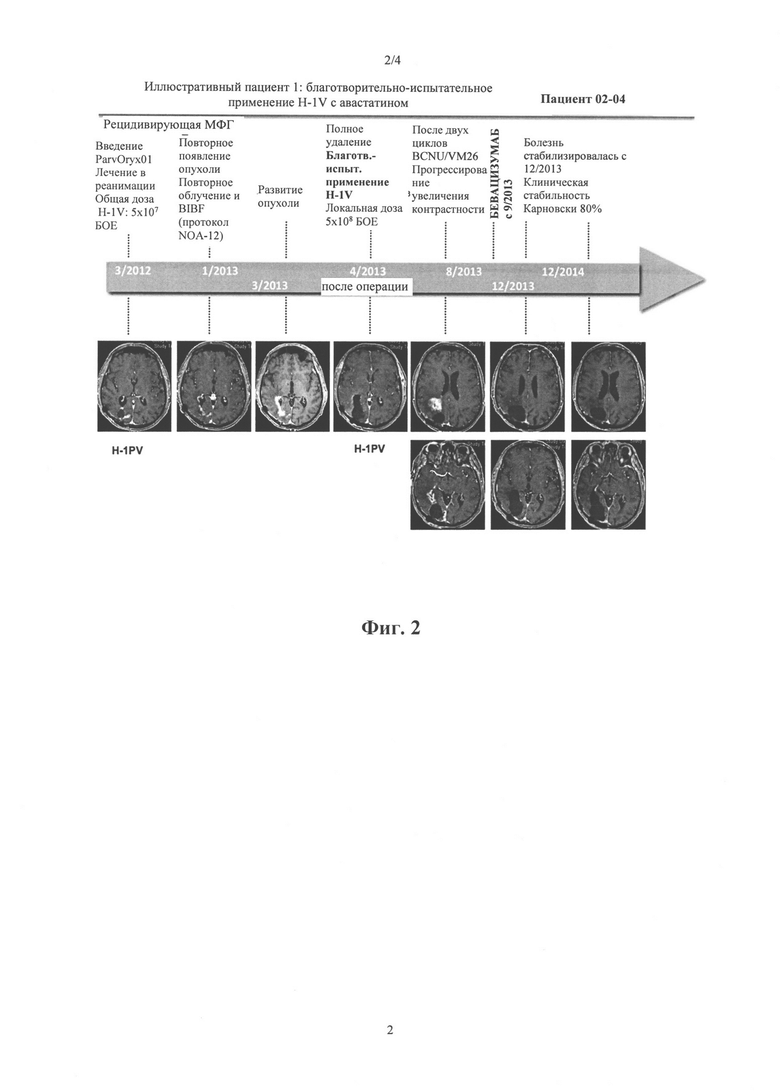
На Фиг. 2: Благотворительно-испытательное применение Н-1 PV с Avastin® у пациента 2-04
Фиг. 3: Благотворительно-испытательное применение Н-1 PV с Avastin® у пациента 5-14
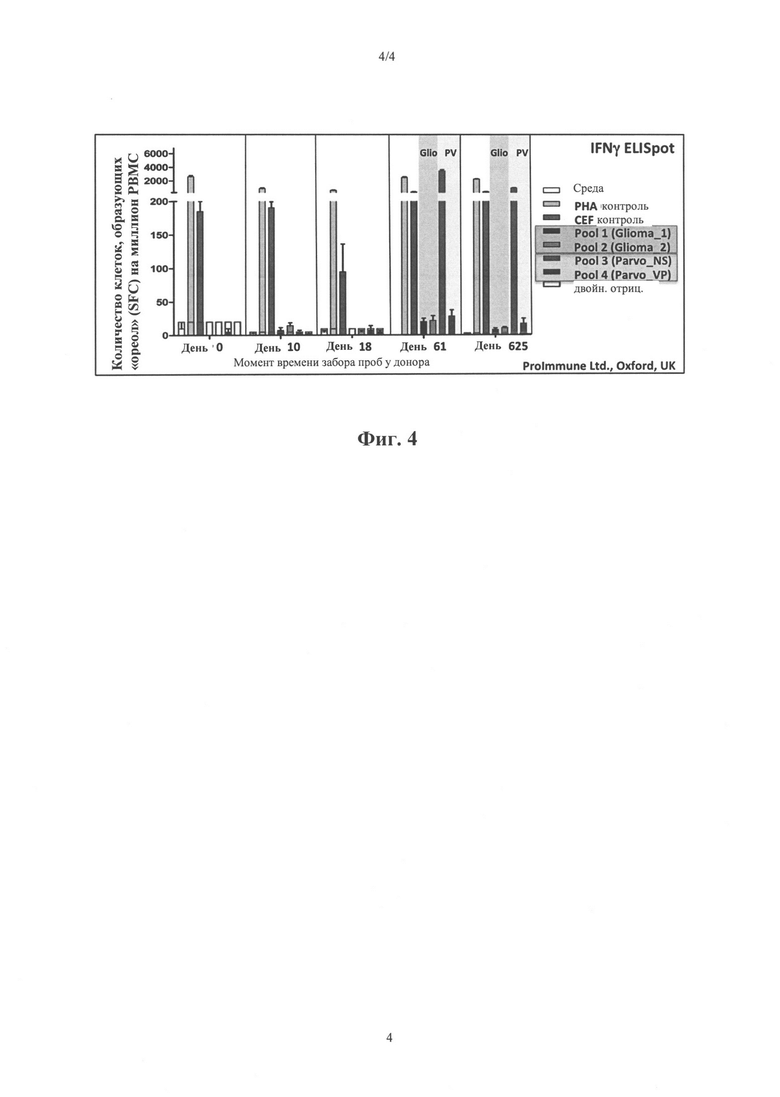
Фиг. 4: Данные EliSpot по пациенту 2-04 Пул 1 и Пул 2: Специфические пептиды мультиформной глиобластомы (МФГ)
Пул 3 и Пул 4: Специфические пептиды парвовируса Н-1 - NS1 и VP
Настоящее изобретение относится к фармацевтической композиции, содержащей (а) парвовирус Н-1 в сочетании с (b) бевацизумабом.
Предпочтительно в указанной фармацевтической композиции указанный парвовирус Н-1 и бевацизумаб содержатся в эффективной дозе в комбинации с фармацевтически приемлемым носителем. Термин «фармацевтически приемлемый» предназначен для обозначения любого носителя, который не влияет на эффективность биологической активности активных ингредиентов и не токсичен для пациента, которому его вводят. Примеры подходящих фармацевтических носителей хорошо известны в данной области техники и включают забуференные фосфатом солевые растворы, воду, эмульсии, такие как эмульсии масло/вода, различные типы смачивающих агентов, стерильные растворы и т.д. Такие носители можно приготовить обычными способами и их можно вводить субъекту в эффективной дозе.
Используемый в настоящем документе термин «парвовирус» включает производные указанного вируса дикого типа или модифицированные компетентные по репликации, а также родственные вирусы или векторы на основе таких вирусов или производных. Специалист в данной области техники на основе настоящего описания, не проводя излишних экспериментов, сможет легко определить подходящие парвовирусы, производные и т.д., а также клетки, которые можно применять для активного получения указанных парвовирусов и которые подходят для проведения терапии.
Термин «эффективная доза» относится к количествам активных ингредиентов, достаточным для оказания воздействия на течение и тяжесть заболевания, приводя к уменьшению или ремиссии указанной патологии. «Эффективную дозу», подходящую для лечения и/или предотвращения указанных заболеваний или расстройств, можно определить с применением методов, известных специалисту в данной области техники.
Дополнительные фармацевтически совместимые носители могут включать гели, биоразлагаемые матричные материалы, имплантационные элементы, содержащие указанный терапевтический агент, или любой другой подходящий носитель, средства или материалы для доставки или дозирования.
Введение указанных соединений можно осуществлять различными способами, например при помощи внутривенного, внутрибрюшинного, подкожного, внутримышечного, местного, внутриопухолевого или внутрикожного введения. Путь введения, конечно, зависит от вида терапии и вида соединений, содержащихся в фармацевтической композиции. Лечащий врач на основании сведений, известных в данной области техники, легко сможет выбрать схему приема указанного парвовируса и бевацизумаба на основании сведений о пациенте, наблюдений и других клинических факторов, включая, например, размер пациента, площадь поверхности тела, возраст, пол, конкретный парвовирус, конкретный ингибитор и т.п., подлежащие введению, время и путь введения, тип и характеристики опухоли, общее состояние здоровья пациента и другие лекарственные средства, которые вводят пациенту. Что касается бевацизумаба, то информацию можно найти на вкладыше в упаковке и информационном листке для пациентов, которые включены в настоящий документ посредством ссылки.
Если указанный парвовирус в комбинации с бевацизумабом согласно настоящему изобретению содержит патогенные вирусные частицы, обладающие способностью проникать через гематоэнцефалический барьер, то лечение можно выполнять или по меньшей мере инициировать путем внутривенной инъекции вируса. Однако предпочтительным способом введения является внутриопухолевое введение.
Поскольку длительное внутривенное лечение может стать неэффективным в результате образования нейтрализирующих вирус антител, после первоначальной внутривенной схемы введения вируса можно применять другие способы введения или альтернативно на протяжении всего курса лечения парвовирусом можно применять указанные различные способы введения, как, например, интракраниальное введение или внутриопухолевое введение вируса.
В качестве другого конкретного способа введения указанный парвовирус (вирус, вектор и/или клеточный агент) можно вводить пациенту из источника, имплантированного указанному пациенту. Например, катетер, например, из силикона или другого биосовместимого материала, можно присоединять к небольшому подкожному резервуару (резервуару Рикхема), установленному у пациента во время удаления опухоли или во время отдельной процедуры, который позволяет осуществлять локальное введение указанной парвовирусной композиции в разное время без дополнительного хирургического вмешательства. Указанный парвовирус или производные векторы также можно вводить в опухоль с помощью стереотаксических хирургических методик или методик нейронавигационного таргетинга.
Введение указанного парвовируса также можно осуществлять путем непрерывной инфузии указанных вирусных частиц или жидкостей, содержащих вирусные частицы, через имплантированные катетеры на низких скоростях потока с применением подходящих насосных систем, например, перистальтических инфузионных насосов или насосов для конвекционного способа доставки (CED, англ. convection enhanced delivery).
Еще один способ введения указанной парвовирусной композиции представляет собой введение из имплантированного изделия, сконструированного с возможностью и приспособленного для дозирования указанного парвовируса в желаемую раковую ткань. Например, можно применять капсулу-имплантат, пропитанную указанным парвовирусом Н-1, при этом указанная капсула-имплантат прикреплена к краям полости резекции после удаления опухоли хирургическим путем. При таком терапевтическом вмешательстве можно применять несколько капсул-имплантатов. Клетки, которые активно продуцируют парвовирус Н-1 или векторы на основе Н-1, можно вводить в указанную опухоль или в указанную опухолевую полость после удаления опухоли.
Терапия при помощи указанной комбинации соединений подходит для терапевтического лечения рака, в частности (но не исключительно) опухоли головного мозга, карциномы поджелудочной железы, карциномы шейки матки, рака легких, рака головы и шеи, рака молочной железы или рака толстой кишки, и может значительно улучшить прогноз указанных заболеваний. Указанная терапия также может делать возможным клиническое применение указанного вируса и/или бевацизумаба в более низких терапевтических дозах, при этом сохраняется или даже усиливается противоопухолевая эффективность, одновременно повышается безопасность и уменьшаются и/или не возникают побочные эффекты. Благодаря сильному синергетическому эффекту между указанными парвовирусом и бевацизумабом можно предвидеть снижение терапевтических доз - например, половина или треть ранее использованных доз одного компонента сохраняют желаемый терапевтический эффект. Благодаря снижению доз можно снизить или избежать (серьезных) побочных эффектов.
Парвовирусная инфекция влияет на гибель опухолевых клеток, но не повреждает здоровые клетки, при этом указанную инфекцию можно вызвать, например, путем интрацеребрального применения подходящего парвовируса, например парвовируса Н-1 или родственного вируса, или векторов на основе указанных вирусов, для проведения опухолеспецифической терапии без неблагоприятных неврологических или других побочных эффектов.
Настоящее изобретение также относится к применению (а) парвовируса Н-1 и (b) бевацизумаба для получения (а) фармацевтической композиции (композиций) или комбинации для лечения рака.
Режим введения (а) и (b) может быть одновременным или последовательным, при этом предпочтительно (а) и (b) вводят последовательно (или раздельно). Это означает, что (а) и (b) могут быть предоставлены в единичной лекарственной форме для совместного применения или в виде отдельных единиц (например, в отдельных контейнерах), которые нужно вводить одновременно или с определенной разницей во времени. Эта разница во времени может составлять от 1 часа до 1 недели, предпочтительно от 12 часов до 3 дней. Кроме того, указанный парвовирус можно вводить при помощи способа введения, отличного от способа введения бевацизумаба. В этом отношении может быть преимущественным вводить парвовирус или бевацизумаб внутриопухолевым путем или другим системным путем, или перорально. В определенном предпочтительном варианте реализации настоящего изобретения указанный парвовирус вводят внутриопухолево, а бевацизумаб внутривенно. Предпочтительно указанный парвовирус и бевацизумаб вводят в виде отдельных соединений. Возможно также одновременное лечение двумя указанными агентами.
В одном предпочтительном варианте реализации настоящего изобретения указанную комбинацию агентов применяют для лечения солидных опухолей и их метастазов. Примеры представляет собой опухоль головного мозга, карциному поджелудочной железы, карциному шейки матки, рак легких, рак головы и шеи, рак молочной железы или рак толстой кишки. В предпочтительном варианте реализации настоящего изобретения указанные опухоли устойчивы к парвовирусной токсичности. В другом предпочтительном варианте реализации настоящего изобретения указанные опухоли, подлежащие лечению, являются рецидивирующими опухолями. Особым преимуществом фармацевтической композиции согласно настоящему изобретению является то, что можно успешно обрабатывать даже стволовые клетки, инициирующие рак. Это оказывает положительное влияние на предотвращение рецидива образования опухолей и метастазов.
Согласно настоящему изобретению парвовирус указанной композиции представляет собой парвовирус Н-1 (H-1PV).
Пациенты, поддающиеся лечению комбинацией агентов согласно настоящему изобретению, включают людей, а также животных, отличных от человека. Примеры последних представляют собой, без ограничения, таких животных как коровы, овцы, свиньи, лошади, собаки и кошки.
Настоящее изобретение также относится к набору, содержащему первый контейнер, второй контейнер и вкладыш в упаковку, причем указанный первый контейнер содержит по меньшей мере одну дозу фармацевтической композиции, содержащей парвовирус Н-1, указанный второй контейнер содержит по меньшей мере одну дозу фармацевтической композиции, содержащей бевацизумаб, и указанный вкладыш в упаковку содержит инструкции по лечению субъекта, имеющего рак, с применением указанной(ых) фармацевтической(их) композиции (композиций).
В настоящем изобретении впервые показано, что указанное комбинационное применение парвовируса H-1PV и бевацизумаба может представлять собой эффективный подход для лечения рака, в частности глиомы и карциномы поджелудочной железы.
Что касается лечения опухолей головного мозга, было показано, что H-1PV, в отличие от других онколитических вирусов, проходит через гематоэнцефалический барьер и инфицирует интрацеребральные опухоли. Это дает возможность усилить исходную местную терапию при помощи последовательных внутривенных введений или интервальное повторное лечение без необходимости в краниотомии.
В целом, полагают, что парвовирус H-1PV оказывает эффект противораковой вакцины, основанный на высвобождении опухоль-специфических антигенов и последующей иммуностимуляции. Это может привести к долгосрочным эффектам предотвращения рецидива заболевания, что потенциально может привести к первоначальному онколизу. Этот эффект усиливается за счет применения бевацизумаба, который представляет собой антитело к VEGF- и действует как антиангиогенный агент. Другими словами, бевацизумаб уменьшает или нормализует образование новых кровеносных сосудов вокруг опухоли, а также уменьшает иммуноподавляющее действие VEGF. Указанная комбинация эффектов делает опухоль более восприимчивой к воздействию иммунной системы, в частности, после предшествующей парвовирусной терапии. Примеры лечения пациентов показывают, что указанная комбинированная терапия приводит либо к ремиссии, либо к стабилизированию заболевания даже в том случае, когда пациенты страдали прогрессирующей рецидивирующей мультиформной глиобластомой.
Нижеприведенный пример поясняет настоящее изобретение более подробно.
Пример 1
Бевацизумаб синергически усиливает онколитическую активность H-1PV
Клиническую фазу исследования I/IIa начинали с участием 18 пациентов, страдающих рецидивирующими злокачественными глиомами. Целью этого исследования являлось изучение безопасности, биораспределения, максимальной переносимой дозы и признаков противоопухолевой активности парвовируса Н-1. Согласно доклиническим данным, указанный парвовирус будет включать не только внутриопухолевое введение вируса, но и внутривенное.
Введение парвовируса Н-1 (состав, соответствующий стандарту качества GMP) осуществляли в 2 группах, в которые входили 12 пациентов (группа I) и 6 пациентов (группа II). В группах 1 и 2 (фигура 1) отличался путь введения.
Режим применения в каждой группе идентичен, но дозу увеличивали, если не наблюдали каких-либо ограничивающих дозу событий. В группе I вводили парвовирус Н-1 (также называемый «исследуемое лекарственное средство», ИЛС) в четырех уровнях доз, а в группе II - в двух уровнях доз (таблица 1).


В группе 1 пациенты получали ИЛС в 1 день путем инъекции в опухолевую ткань с контролем по изображению (image guided injection). В этот день пациенту вводили 50% намеченной общей дозы. После периода наблюдения, составляющего 9 дней, на 10-й день опухоль подвергали резекции. После удаления указанной опухоли вводили вторую половину дозы в стенки резекционной полости путем прямой инъекции. Введение ИЛС завершали указанной инъекцией во время открытого хирургического вмешательства, и какого-либо дополнительного применения вируса не проводили.
В группе 2 начальное введение ИЛС осуществляли внутривенно. Пациенты получали 50% от намеченной дозы пятью инфузиями в дни с 1 по 5, при этом каждая инфузия содержала 10% от общей дозы. После последней инфузии на 5 день следовал период наблюдения до 9 дня, и на 10 день выполняли резекцию опухоли, как в группе 1. По аналогии с группой 1, пациенты получали вторую половину дозы путем инъекции в ткани, окружающие полость опухоли после удаления опухоли, и далее в ходе исследования каких-либо вирусных инъекций пациентам не проводили.
Во время резекции рецидива опухоли 6 пациентов запросили дополнительную инъекцию H-1PV на основании соглашения о благотворительно-испытательном применении:
- Группа I Уровень 1 (внутриопухолевое введение): 2 пациента
- Группа I Уровень 2 (внутриопухолевое введение): 1 пациент
- Группа I Уровень 3 (внутриопухолевое введение): 1 пациент
- Группа II Уровень 3 (внутриопухолевое введение): 2 пациента
После резекции опухоли на стенках опухолевой полости вновь применяли вирус, в то время как все пациенты получали одинаковую дозу вируса, составляющую 5×108 БОЕ.
После резекции рецидива опухоли указанные пациенты получили лечение бевацизумабом в рамках благотворительно-испытательной программы, которая началась в 2013 году.
Обобщенные данные по выживаемости, приведенные ниже (таблица 2), показывают интересный результат - у 5 из 6 пациентов на данный момент между второй инъекцией вируса и вторым рецидивом или смертью (PFS2) прошло больше времени, чем между первой инъекцией вируса и первым рецидивом (PFS1). Это нетипично для мультиформной глиобластомы и представляет собой очень неожиданный результат.
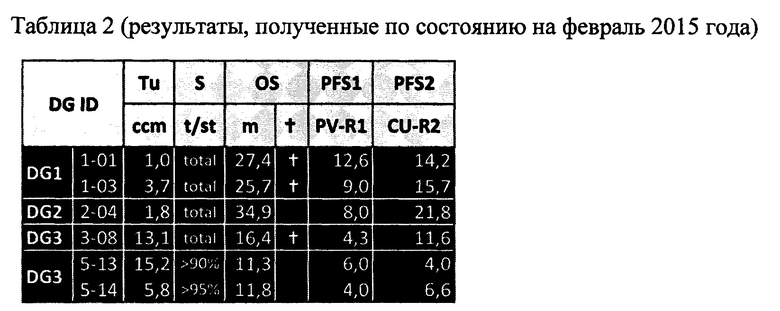
DG: группа дозы (уровень), Tu: размер опухоли, S: операция, t: сумма, st: подсумма, м: месяц, OS: общая выживаемость (месяц), PFS: выживаемость без прогрессирования (месяцы), PFS1: начало виротерапии, первая инъекция вируса - рецидив, PFS2: начало благотворительно-испытательного применения, вторая инъекция вируса - рецидив или смерть; total - общий
Схему лечения (все лечение ИЛС в однократной дозе 1,2Е9 БОЕ) в 2015 году применяли для
пациента 5-13: внутривенное введение 2 сентября 2015 года; перитуморальное введение 3 сентября 2015 г.
пациента 5-14: внутривенное введение 31 августа 2015 года; интраартериальное введение 1 сентября 2015 г.
Через 1-2 недели после введения вируса пациенты снова получали Avastin® в режиме дозировки в соответствии со вкладышем в упаковке.
Недавняя повторная оценка пациентов показала следующие результаты:
Пациент 1-01: без изменений
Пациент 1-03: без изменений
Пациент 2-04: OS 40,9 месяцев; пациент умер; PFS2 24,2 месяцев
Пациент 3-08: без изменений
Пациент 5-13: OS 21,3 месяцев; пациент умер; PFS2 14 месяцев
Пациент 5-14: ОС 24,1 месяца; PFS2 18,4 месяца; пациент по-прежнему жив
В приведенной выше таблице 2 первые четыре пациента (1-01, 1-03, 2-04, 3-08) были в группе внутриопухолевого лечения (группа I), а два последних пациента (5-13 и 5-14) были в группе внутривенного лечения (группа И).
У четырех пациентов клинический ответ на комбинацию неоднократной инъекции H-1PV с последующей терапией бевацизумабом был чрезвычайно благоприятным. У 2 из 4 пациентов [2-04 и 5-14] наступила ремиссия или заболевание стабилизировалось. На основе этих данных можно предположить возможную иммунную стимуляцию за счет повторной инъекции H-1PV, которая, возможно, усиливает действие бевацизумаба.
Для двух пациентов - 2-04 и 5-13 - протокол лечения и МРТ-сканы показаны на фигурах 2 и 3.
Данные EliSpot пациента 2-04 показаны на фигуре 4. Совершенно неожиданно ЦТЛ-ответы на вирус-специфические пептиды NS1 (Poll3, Parvo NS) возникают на 625-й день.
Список литературы
Breitbach CJ, Burke J, Jonker D, Stephenson J, Haas AR, Chow LQ, Nieva J, Hwang TH, Moon A, Part R et al (2011) Intravenous delivery of a multi-mechanistic cancer-targeted oncolytic poxvirus in humans. Nature 477: 99-102
Cotmore SF, Tattersall P (2007) Parvoviral host range and cell entry mechanisms. Adv Virus Res 70: 183-232
Di Piazza M, Mader C, Geletneky K, Herrero у Calle M, Weber E, Schlehofer J, Deleu L, Rommelaere J (2007) Cytosolic Activation of Cathepsins Mediates Parvovirus H-1-Induced Killing of Cisplatin and TRAIL-Resistant Glioma Cells. Journal of Virology 81: 4186-4198
Geletneky K, Huesing J, Rommelaere J, Schlehofer JR, Leuchs B, Dahm M, Krebs O, von Knebel Doeberitz M, Huber B, Hajda J (2012) Phase I/IIa study of intratumoral/intracerebral or intravenous/intracerebral administration of Parvovirus H-1 (ParvOryx) in patients with progressive primary or recurrent glioblastoma multiforme: ParvOryxOl protocol. BMC cancer 12: 99
Hristov G, Kramer M, Li J, El-Andaloussi N, Mora R, Daeffler L, Zentgraf H, Rommelaere J, Marchini A (2010) Through Its Nonstructural Protein NS1, Parvovirus H-1 Induces Apoptosis via Accumulation of Reactive Oxygen Species. J Virol 84: 5909-5922
Nuesch JP, Lacroix J, Marchini A, Rommelaere J (2012) Molecular pathways: rodent parvoviruses-mechanisms of oncolysis and prospects for clinical cancer treatment. Clin Cancer Res 18: 3516-3523
Ohshima T, Iwama M, Ueno Y, Sugiyama F, Nakajima T, Fukamizu A, Yagami K (1998) Induction of apoptosis in vitro and in vivo by H-1 parvovirus infection. The Journal of general virology 79 (Pt 12): 3067-3071
Ran Z, Rayet B, Rommelaere J, Faisst S (1999) Parvovirus H-l-induced cell death: influence of intracellular NAD consumption on the regulation of necrosis and apoptosis. Virus Res 65: 161-174
Rayet B, Lopez-Guerrero JA, Rommelaere J, Dinsart С (1998) Induction of programmed cell death by parvovirus H-1 in U937 cells: connection with the tumor necrosis factor alpha signalling pathway. J Virol 72: 8893-8903
Russell SJ, Peng KW, Bell JC (2012) Oncolytic virotherapy. Nat Biotechnol 30: 658-670
Ueno Y, Harada T, Iseki H, Ohshima T, Sugiyama F, Yagami K (2001) Propagation of rat parvovirus in thymic lymphoma cell line C58(NT)d and subsequent appearance of a resistant cell clone after lytic infection. J Virol 75: 3965-3970
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕПАРАТ ПАРВОВИРУСА ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2016 |
|
RU2698717C2 |
| ЛЕЧЕНИЕ РАКА ГОЛОВНОГО МОЗГА ОНКОЛИТИЧЕСКИМ АДЕНОВИРУСОМ | 2014 |
|
RU2689553C2 |
| Способ оптимизации крупномасштабной продукции парвовируса H-1 в существенно бессывороточной среде | 2017 |
|
RU2714111C1 |
| МЕТАПНЕВМОВИРУС ПТИЦ В ОНКОЛИЗИСЕ | 2012 |
|
RU2571925C2 |
| ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2720984C2 |
| ОНКОЛИТИЧЕСКИЙ АДЕНОВИРУС ДЛЯ ЛЕЧЕНИЯ РАКА, ЕГО ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЕГО | 2010 |
|
RU2536931C2 |
| КОМБИНАЦИЯ ОНКОЛИТИЧЕСКОГО ВИРУСА С МОДУЛЯТОРАМИ ИММУНОЛОГИЧЕСКИХ КОНТРОЛЬНЫХ ТОЧЕК | 2015 |
|
RU2705780C2 |
| ОНКОЛИТИЧЕСКИЕ АДЕНОВИРУСЫ, КОДИРУЮЩИЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, А ТАКЖЕ СПОСОБЫ И ПРИМЕНЕНИЯ, СВЯЗАННЫЕ С НИМИ | 2016 |
|
RU2725799C2 |
| АДЕНОВИРУСНЫЕ ВЕКТОРЫ И СПОСОБЫ И ПРИМЕНЕНИЯ, СВЯЗАННЫЕ С НИМИ | 2009 |
|
RU2520823C2 |
| ВЫДЕЛЕНИЕ ВИРУСА, РОДСТВЕННОГО ПАРВОВИРУСУ-2 СОБАК, ОТ ЕНОТА | 2010 |
|
RU2565538C2 |

Группа изобретений относится к медицине и предназначена для лечения рака, в частности солидных опухолей. Используется фармацевтическая комбинация, содержащая композицию, содержащую парвовирус, и композицию, содержащую бевацизумаб, причем парвовирус представляет собой Н-1 (Н-1PV). Также раскрыт набор для лечения рака, содержащий первый контейнер, второй контейнер и вкладыш в упаковку, причем первый контейнер содержит по меньшей мере одну дозу фармацевтической композиции, содержащей парвовирус Н-1, второй контейнер содержит по меньшей мере одну дозу фармацевтической композиции, содержащей бевацизумаб. Группа изобретений обеспечивает повышение эффективности терапии, предупреждение рецидивов. 3 н. и 9 з.п. ф-лы, 4 ил., 2 табл., 1 пр.
1. Фармацевтическая комбинация для лечения рака, содержащая (а) композицию, содержащую парвовирус, и (b) композицию, содержащую бевацизумаб, при этом указанный парвовирус представляет собой Н-1 (Н-1PV).
2. Фармацевтическая комбинация по п. 1, где указанный парвовирус приготовлен для внутриопухолевого или внутривенного введения, а бевацизумаб приготовлен для внутривенного введения.
3. Применение фармацевтической комбинации по п. 1 или 2 в способе лечения рака.
4. Применение фармацевтической комбинации по п. 3, отличающееся тем, что указанный парвовирус и бевацизумаб вводят последовательно.
5. Применение фармацевтической комбинации по п. 3 или 4, отличающееся тем, что указанное применение представляет собой применение для лечения солидных опухолей и/или инициирующих рак стволовых клеток.
6. Применение фармацевтической комбинации по любому из пп. 3-5, отличающееся тем, что указанное применение представляет собой применение для лечения солидных опухолей, резистентных к цитотоксичности парвовируса.
7. Применение фармацевтической комбинации по любому из пп. 3-6, отличающееся тем, что указанная опухоль представляет собой опухоль головного мозга, карциному поджелудочной железы, карциному шейки матки, рак легких, рак головы и шеи, рак молочной железы или рак толстой кишки.
8. Применение фармацевтической комбинации по любому из пп. 3-7, отличающееся тем, что указанное применение представляет собой применение для лечения глиомы или рецидивирующей мультиформной глиобластомы.
9. Применение фармацевтической комбинации по любому из пп. 3-8, отличающееся тем, что указанный парвовирус и/или бевацизумаб вводят при помощи внутриопухолевого или внутривенного введения.
10. Набор для лечения рака, содержащий первый контейнер, второй контейнер и вкладыш в упаковку, причем указанный первый контейнер содержит по меньшей мере одну дозу фармацевтической композиции, содержащей парвовирус Н-1, указанный второй контейнер содержит по меньшей мере одну дозу фармацевтической композиции, содержащей бевацизумаб, и указанный вкладыш в упаковку содержит инструкции по лечению субъекта, имеющего рак, с применением указанных фармацевтических композиций.
11. Набор по п. 10, отличающийся тем, что указанный рак представляет собой опухоль головного мозга, карциному поджелудочной железы, карциному шейки матки, рак легких, рак головы и шеи, рак молочной железы или рак толстой кишки.
12. Набор по п. 11, отличающийся тем, что указанная опухоль головного мозга представляет собой глиому или рецидивирующую мультиформную глиобластому.
| WO2006075165 A1, 20.07.2006 | |||
| WO2009011924 A9, 23.04.2009 | |||
| ЛОКТЕВ В.Б | |||
| и др | |||
| Онколитические парвовирусы | |||
| Новые подходы к лечению раковых заболеваний, Вестник РАМН, 2012, N 2, с | |||
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| MOEHLER M et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| BMC Cancer | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Телефонная трансляция | 1922 |
|
SU464A1 |
Авторы
Даты
2019-02-11—Публикация
2016-02-10—Подача