ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к областям естественных наук и медицины. В частности, изобретение относится к терапии рака у человека. Более конкретно, настоящее изобретение относится к онколитическому аденовирусному вектору, кодирующему биспецифическое моноклональное антитело. Кроме того, настоящее изобретение относится к способам и применению, в которых используют онколитические аденовирусные векторы, также вместе с адоптивной клеточной терапией.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Постоянно идут разработки новой терапии для лечения рака. Адоптивная клеточная терапия (ACT) представляет собой действенный подход для лечения рака, а также для лечения других заболеваний, таких как инфекции и реакция трансплантат против хозяина. Адоптивный клеточный перенос представляет собой пассивную трансплантацию клеток, выращенных ex vivo, наиболее часто клеток иммунного происхождения, в организм-хозяин с целью переноса иммунологической функциональности и характеристик трансплантата. Адоптивный клеточный перенос может быть аутологическим, как это обыкновенно происходит при адоптивной T-клеточной терапии, или аллогенным, что типично для лечения инфекций или реакции трансплантат против хозяина. В клинике обыкновенные варианты осуществления этого подхода включают перенос или способствующих иммунитету или толерогенных клеток, таких как лимфоциты, пациентам или для того, чтобы усиливать иммунитет против вирусов и рака, или для того, чтобы способствовать толерантности в условиях аутоиммунного заболевания, такого как диабет I типа или ревматоидный артрит.
Адоптивный перенос аутологических инфильтрирующих опухоль лимфоцитов (TIL) или генетически перенаправленных мононуклеарных клеток периферической крови использовали для того, чтобы успешно лечить пациентов с меланомой, а также пациентов с экспрессирующими CD19 гематологическими злокачественными новообразованиями. При ACT наиболее широко используемыми типами клеток являются T-клетки, иногда отсортированные по CD8+, но другие вариации включают CD4+ клетки, NK-клетки, дельта-гамма T-клетки, регуляторные T-клетки и мононуклеарные клетки периферической крови. Клетки могут быть немодифицированными, такими как в TIL терапии, или генетически модифицированными. При TIL терапии используют несортированные поликлональные клетки. Существует два общих пути, чтобы добиваться генетического нацеливания T-клеток на опухолеспецифические мишени. Один представляет собой перенос T-клеточного рецептора с известной специфичностью (TCR терапия) и с совпадающим типом лейкоцитарного антигена человека (HLA, известный как главный комплекс гистосовместимости у грызунов). Другой представляет собой модификацию клеток искусственными молекулами, такими как химерные антигенные рецепторы (CAR). Этот подход не зависит от HLA и является более гибким в отношении нацеливания на молекулы клеточной поверхности. Например, можно использовать одноцепочечные антитела, и CAR также могут содержать костимулирующие домены. Однако мишени CAR клеток должны находиться на мембране клеток-мишеней, тогда как TCR модификации могут использовать внутриклеточные мишени. При TCR и CAR терапии T-клетки получают из периферической крови пациента.
Несмотря на развитие адоптивной клеточной терапии, клинические результаты адоптивной T-клеточной терапии для немеланомных солидных опухолей, составляющих больше чем 90% злокачественных опухолей человека и 95% смертности от злокачественных опухолей, являются неутешительными. Основная причина этого состоит в том, что микроокружение опухоли является сильно иммуносупрессорным, что инактивирует и анергизует T-клеточный трансплантат, ингибирует локальное размножение трансплантата и препятствует направленной миграции адоптивно перенесенных T-клеток к опухоли. В настоящее время не существует эффективных инструментов для решения указанных проблем.
Рекрутеры T-клеток используют для лечения злокачественных опухолей. Основными классами являются трифункциональные антитела, химически связанные Fab и биспецифические рекрутеры T-клеток (BiTE), последние являются наиболее передовыми клинически (Baeuerle PA, Reinhardt C. Cancer Res. 2009 Jun 15;69(12):4941-4). Хотя проводили доклинические исследования нескольких BiTE и клинические исследования двух (блинатумомаб, BiTE против CD19, и солитомаб, BiTE против EpCAM), возникло множество проблем. Основным вопросом является токсичность на мишени вне опухоли, которая приводила к высокому уровню нежелательных явлений, в том числе уровень токсической гибели 12% в клинических исследованиях блинатумомаба (Topp MS et al. 2011, J Clin Oncol. Jun 20;29(18):2493-8). Другой вопрос состоит в недостаточных концентрациях BiTE в мишени (опухоли), который является особенно проблематичным в контексте солидных опухолей, масса которых формирует препятствие для проникновения и концентрирования BiTE. Это, вероятно, объясняет, почему не наблюдали формальные реакции (уменьшение размера опухоли, отвечающее критериям RECIST) в исследованиях с использованием солитомаба. Наилучшими реакциями были временное стабильное заболевание, которого достигали у 38% пациентов (Walter M et al. 2012, J Clin Oncol 30, (suppl; abstr 2504)). Еще одна проблема с BiTE заключается в коротком времени полужизни у человека, что делает необходимым непрерывную инфузию, которая не является практичным решением для повседневного использования.
Онколитические вирусные векторы, вооруженные рекрутером T-клеток, предложены для лечения рака. В WO 2014138314 A1 (PCT/US2014/020935) и Yu et al. (2014, Mol Ther 22(1):102-11) описаны онколитические вирусы из вируса осповакцины, кодирующие BiTE против EphA2. В отношении векторной доставки BiTE, клетки млекопитающих автоматически не секретируют одноцепочечные молекулы, включая двойные одноцепочечные конструкции, такие как BiTE. Фактически, слабая секреция одноцепочечных молекул и конструкций, таких как BiTE, создала препятствие для их использования в генной терапии. Антитела обычно продуцируют плазматические клетки B-клеточной линии дифференцировки и, таким образом, не удивительно, что их продуцирование и высвобождение из эпителиальных опухолевых клеток является проблематичным.
В отношении эффекта онколитических вирусных векторов, или отдельно или вместе с другой терапией, остается простор для усовершенствования. В целом, у терапии гарантирована повышенная специфичность и достаточная способность уничтожать опухоль.
Настоящее изобретение предусматривает эффективные инструменты и способы для терапевтических средств против рака посредством использования специфичных вирусных векторов, например, с адоптивной клеточной терапией.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Цель настоящего изобретения состоит в разработке простых способов и инструментов для преодоления вышеуказанных проблем неэффективной, небезопасной и непредсказуемой терапии рака. В одном из вариантов осуществления изобретение относится к новым способам и средствам для клеточной терапии. Цели изобретения достигаются посредством специфичных вирусных векторов, способов и конфигураций, которые отличаются тем, что указано в независимых пунктах формулы изобретения. Конкретные варианты осуществления изобретения раскрыты в зависимых пунктах формулы изобретения.
Настоящее изобретение предполагает использование специфичных онколитических аденовирусов для решения вопросов, связанных с сильным иммуносупрессорным микроокружением опухоли, которое инактивирует и анергизует T-клеточный трансплантат, ингибирует локальное размножение трансплантата и препятствует направленной миграции адоптивно перенесенных T-клеток в опухоль. Изобретение основано на неожиданном осознании того, что онколитические аденовирусы, кодирующие биспецифические рекрутеры T-клеток (BiTE), могут решать указанные вопросы (фиг. 1). В частности, данные, связанные с настоящим изобретением, указывают на то, что аденовирус может индуцировать сигналы опасности в опухолях мышей и у человека, как показано на примере продуцирования интерферона гамма (фиг. 2), что ведет к снижению экспрессии TIM3 (TIM3 представляет собой ключевой индикатор иммуносупрессии опухоли) (фиг. 3). Важно, что даже если аденовирус отдельно способен продуцировать сигналы опасности в опухоли, этого не достаточно для того, чтобы рекрутировать T-клетки в опухоль (фиг. 4). Таким образом, для оптимального усиления адоптивной клеточной терапии необходимо онколитический аденовирус вооружать BiTE (фиг. 1).
Стоит отметить, что авторы изобретения обладают данными от людей, которые показывают, что экспрессия TIM3 и способность онколитического аденовируса осуществлять понижающую регуляцию TIM3 коррелируют с выживаемостью пациента. Это ценные данные, показывающие, что сигнализация опасности, обусловленная аденовирусом, ведет к понижающей регуляции опухолевой иммуносупрессии, которая коррелирует с клинической пользой у пациентов (фиг. 10). Важно, что не все онколитические вирусы похожи и, фактически, вирус осповакцины не способен продуцировать сигналы опасности в опухолях, и, следовательно, его нельзя сравнивать с аденовирусом для иммунотерапии опухолей через локальное продуцирование BiTE (фиг. 5-6).
Вопросы системной токсичности и низкого локального эффекта, а также короткого времени полужизни BiTE у человека решают с помощью настоящего изобретения, а именно, посредством локального продуцирования BiTE аденовирусным вектором в опухоли, этот признак благоприятен, в частности, в контексте солидных опухолей (фиг. 9).
Также настоящее изобретение решает проблему слабой секреции одноцепочечных молекул BiTE удивительным образом: при использовании онколитического аденовируса, который реплицируется только в опухолевых клетках, и последней стадией репликации является лизис клетки, высвобождение BiTE происходит в микроокружение опухоли (фиг. 8). Другими словами, настоящее изобретение решает проблему секреции BiTE удивительным образом, посредством использования онколизиса в качестве механизма высвобождения. В соответствии с настоящим изобретением, секреция BiTE не требуется и фактически не предпочтительна, поскольку дополнительный способ состоит в ограничении экспрессии BiTE опухолью (вирус лизирует только опухолевые клетки).
Продуцирование BiTE в опухоли может рекрутировать адоптивный T-клеточный трансплантат в опухоль (фиг. 1). Связывание с рецептором молекул клеточной поверхности (например, рецептором CD3) активирует клетки трансплантата в опухоли. Кроме того, аденовирусный онколизис служит причиной сигналов опасности, которые противодействуют опухолевой иммуносупрессии. Вместе эти компоненты достигают антииммуносупрессорного эффекта, который не может быть достигнут с использованием какого-либо компонента отдельно. Стоит отметить, что аденовирус является уникальным среди онколитических вирусов в отношении его способности индуцировать антииммуносупрессорные сигналы опасности через связывание с патоген-ассоциированными рецепторами опознавания паттерна. Кроме того, аденовирус обладает выдающимися эффектами, оказываемыми на T-клетки, тогда как многие другие онколитические вирусы, такие как вирус осповакцины, не очень заметны в этом отношении. Другими словами, вирус осповакцины нельзя использовать для усиления адоптивной клеточной терапии. Наконец, данное описание представляет данные, которые показывают, что вирус осповакцины не является хорошей платформой для усиления адоптивной клеточной терапии, тогда как аденовирус представляет собой оптимальный механизм для противодействия опухолевой иммуносупрессии.
Противовирусный иммунитет считают рестриктивным для виротерапевтических подходов, включая онколитические аденовирусы. Один из вариантов осуществления противовирусного иммунитета представляет собой противовирусные T-клетки. Однако настоящее изобретение к удивлению показывает, что когда онколитический аденовирус используют для продуцирования BiTE в опухоли, противовирусные T-клетки можно перенацеливать против опухоли. Этот эффект усиливается в ходе лечения, поскольку репликация онколитического вируса ведет к дополнительным противовирусным T-клеткам, которые затем также направляют на опухоль через BiTE, продуцируемые вирусом (фиг. 7).
В одном из вариантов осуществления настоящее изобретение относится к усилению T-клеточной терапии с использованием онколитического аденовируса, кодирующего BiTE. Онколитический аденовирус представляет собой оптимальную платформу для использования BiTe для усиления T-клеточной терапии благодаря неожиданному синергизму между антииммуносупрессорными эффектами онколизиса и экспрессией BiTE в опухоли.
В настоящем описании описана конструкция рекомбинантных аденовирусных векторов, способы, связанные с аденовирусными векторами, и их различные использования. Кроме того, аденовирусные векторы по настоящему изобретению, кодирующие рекрутеры T-клеток, можно комбинировать с адоптивными клеточными терапевтическими средствами для лечения рака.
Преимущества согласно настоящему изобретению достигаются с помощью способа лечения злокачественного новообразования, который включает введение эффективного количества аденовирусного вектора по настоящему изобретению (например, отдельно или вместе с TIL) пациенту, страдающему раком, чтобы вызывать регрессию или стабилизацию рака.
Настоящее изобретение относится к онколитическому аденовирусному вектору, включающему
делецию последовательности нуклеиновой кислоты в участке E3, и
последовательность нуклеиновой кислоты, кодирующую биспецифическое моноклональное антитело, вместо удаленной последовательности нуклеиновой кислоты в участке E3.
Настоящее изобретение также относится к онколитическому аденовирусному вектору, включающему
делецию последовательности нуклеиновой кислоты в участке E3, и
последовательность нуклеиновой кислоты, кодирующую биспецифическое моноклональное антитело, вместо удаленной последовательности нуклеиновой кислоты в участке E3,
где биспецифическое моноклональное антитело содержит одноцепочечный вариабельный фрагмент (scFv), специфичный к молекуле клеточной поверхности, и scFv, специфичный к антигену опухоли.
Также настоящее изобретение относится к фармацевтической композиции, содержащей онколитический аденовирусный вектор, включающий делецию последовательности нуклеиновой кислоты в участке E3, и последовательность нуклеиновой кислоты, кодирующую биспецифическое моноклональное антитело, вместо удаленной последовательности нуклеиновой кислоты в участке E3.
Кроме того, настоящее изобретение относится к комбинации онколитического аденовирусного вектора, включающего делецию последовательности нуклеиновой кислоты в участке E3 и последовательность нуклеиновой кислоты, кодирующую биспецифическое моноклональное антитело, вместо удаленной последовательности нуклеиновой кислоты в участке E3, и адоптивной клеточной терапевтической композиции.
Кроме того, настоящее изобретение относится к комбинации онколитического аденовирусного вектора по изобретению и адоптивной клеточной терапевтической композиции для использования в лечении рака.
Кроме того, настоящее изобретение относится к онколитическому аденовирусному вектору по изобретению вместе с адоптивной клеточной терапевтической композицией для использования в лечении рака.
Кроме того, настоящее изобретение относится к онколитическому аденовирусному вектору по изобретению для применения в лечении рака вместе с адоптивной клеточной терапевтической композицией.
Также настоящее изобретение относится к способу лечения рака у пациента, где способ включает введение онколитического аденовирусного вектора по изобретению пациенту.
Также настоящее изобретение относится к онколитическому аденовирусному вектору, включающему делецию в участке E3, и последовательность нуклеиновой кислоты, кодирующую биспецифическое моноклональное антитело, вместо удаленного участка E3, для применения в увеличении эффекта адоптивной клеточной терапии у пациента.
Также настоящее изобретение относится к способу увеличения эффекта адоптивной клеточной терапии у пациента посредством введения онколитического аденовирусного вектора, включающего делецию в участке E3 и последовательность нуклеиновой кислоты, кодирующую биспецифическое моноклональное антитело, вместо удаленного участка E3, пациенту, где пациенту введена или он подлежит введению адоптивной клеточной терапии.
Также настоящее изобретение относится к применению онколитического аденовирусного вектора по настоящему изобретению в получении лекарственного средства для лечения рака у пациента.
Также настоящее изобретение относится к применению онколитического аденовирусного вектора по изобретению в получении лекарственного средства для увеличения эффекта адоптивной клеточной терапии у пациента.
Преимущества конфигураций по настоящему изобретению включают, но не ограничиваясь этим, усиленный терапевтический эффект и сниженные побочные эффекты. Тяжелые нежелательные явления, например, смерть, предотвращаются, поскольку усиление эффекта и антисупрессивные эффекты подхода авторов изобретения могут снижать потребность в предварительной химиотерапии и/или облучении, используемых в способах известного уровня техники, чтобы «создать пространство» для перенесенных клеток и снизить опухолевую иммуносупрессию.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Далее изобретение описано более подробно посредством конкретных вариантов осуществления со ссылкой на приложенные фигуры, на которых:
На фиг. 1 представлен механизм действия T-клеточной терапии с использованием онколитического аденовируса, кодирующего биспецифический рекрутер T-клеток BiTE.
На фиг. 2 показано, что лечение с использованием аденовируса индуцирует сигналы опасности в опухолях. Лечение с использованием 5/3 химерного аденовируса (вектор на основе Ad5, который имеет головку фибры от Ad3) индуцирует сигналы опасности в опухолях B16.OVA, как продемонстрировано с помощью экспрессии интерферона гамма. Связывание аденовирусных патоген-ассоциированных молекулярных паттернов (PAMP) с Toll-подобными рецепторами (TLR) на клетках-хозяевах может индуцировать секрецию интерферона гамма, что ведет к быстрой активации врожденного и адаптивного иммунного ответа. Следовательно, аденовирус можно использовать для того, чтобы генерировать иммуногенный фенотип опухоли, который эффективно распознает иммунная система.
На фиг. 3 показано, что аденовирус имеет антииммуносупрессорные эффекты в микроокружении опухоли. 5/3 химерный аденовирус имеет антииммуносупрессорные эффекты, оказываемые на микроокружение опухоли B16.OVA. Опухоли очень устойчивы к атакам иммунной системы и даже большое число адоптивно перенесенных опухолеспецифических OT-I T-клеток не может преодолеть опухолевую иммуносупрессию. Однако если мышей одновременно лечат 5/3 химерным аденовирусом, в опухолях происходит понижающая регуляция иммуносупрессорных молекул (таких как TIM-3).
На фиг. 4 показано, что одного снятия иммуносупрессии не достаточно для того, чтобы индуцировать направленную миграцию T-клеток к опухолям: необходимы BiTE. Снятия иммуносупрессии не достаточно для того, чтобы индуцировать направленную миграцию T-клеток к опухолям B16.OVA. Внутриопухолевая инъекция 5/3 химерного аденовируса позволяет индуцировать CD8+ T-клетки в периферической крови, но эти клетки не могут эффективно инфильтрировать опухоли. Эта слабая направленная миграция T-клеток к опухоли подчеркивает недостатки онколитического аденовируса и адоптивной T-клеточной терапии, используемых в качестве отдельных средств, подтверждая изобретение для усиления направленной миграции адоптивно перенесенных T-клеток посредством BiTE-экспрессирующего онколитического аденовируса.
На фиг. 5 показано, что аденовирус превосходит вирус осповакцины в отношении индукции клеточного противоопухолевого иммунитета; решающий признак для усиления адоптивной клеточной терапии. Сравнение иммуногенности между аденовирусом (Ad) и вирусом осповакцины (VV). Уровни селезеночных и инфильтрирующих опухоль B16.OVA CD8+ T-клеток выше у мышей, которых лечили 5/3 химерным аденовирусом, по сравнению с мышами, которых лечили онколитическим вирусом осповакцины Western Reserve с двойной делецией (этот штамм использовали Yu et al Mol Ther 2014). Таким образом, онколитический аденовирус, по-видимому, представляет собой идеальную экспрессионную платформу для BiTe из-за свойственной ему иммуногенности, в частности, в контексте адоптивной T-клеточной терапии.
На фиг. 6 показано, что аденовирус более эффективен, чем вирус осповакцины, в отношении индукции противоопухолевого иммунитета. Мышам, несущим сингенные опухоли B16.OVA, инъецировали внутрь опухоли PBS, аденовирус или вирус осповакцины. Образцы опухолевых клеток окрашивали с использованием T-клеточных рецепторов, обнаруживающих пентамер APC, которые специфичны к остатка SIINFEKL овальбумина, и оценивали посредством проточной цитометрии (n=3). Данные показывают изменение в противоопухолевых T-клетках после инъекции аденовируса или вируса осповакцины; аденовирус значительно более эффективен в отношении индукции противоопухолевого иммунитета, тогда как вирус осповакцины фактически был иммуносупрессивным в контексте противоопухолевых T-клеток.
На фиг. 7 показано, что BiTE, доставляемые посредством онколитического аденовируса, нацелены на все классы T-клеток против опухолей, в том числе противовирусные T-клетки. У многих пациентов противовирусные T-клетки значительно более многочисленны, чем противоопухолевые T-клетки (Kanerva A et al. Clin Cancer Res. 2013 May 15;19(10):2734-44). В целом их считают контрпродуктивными в контексте терапии опухоли, поскольку a) они потребляют большую часть доступного ограниченного количества иммунного ответа и b) они могут ограничивать репликацию онколитического вируса. В отличие от этого, изобретение авторов, к удивлению, использует преимущество уже существующего и индуцированного T-клеточного иммунитета против аденовирусов, поскольку нацеливает противовирусные T-клетки на опухоль (фиг. 7). Поскольку TIL из опухолей, которые лечили аденовирусами, содержат как противоопухолевые, так и противовирусные T-клетки, CD3-scFV из BiTe будут активировать эти T-клетки независимо от их эндогенной специфичности (независимо от MHC I). Следовательно, опухолеспецифического уничтожения с помощью этих T-клеток достигают посредством scFV, специфичного к антигену поверхности опухолевой клетки (такому как мезотелин, EpCAM1, MUC1) и не ожидают обнаруживать реактивность вне опухоли/вне мишени. Таким образом, этот подход перенаправляет все CD8+ TIL (противоопухолевые и противовирусные) в противоопухолевые T-клетки через связывание BiTe, продуцируемых вирусом.
На фиг. 8 показано, что онколитический аденовирус, но не нереплицирующийся аденовирус, который кодирует функциональное антитело, ведет к эффективному продуцированию антител и высвобождению из клеток рака. Клетки инфицировали указанными аденовирусами по 100 вирусных частиц (VP)/клетка и несколькими сутками позже анализировали на экспрессию антител с помощью ELISA IgG человека (A) или вестерн-блоттинга (B). В каждый указанный момент времени после инфекции (A) онколитический вирус Ad5/3-OV-Ab (серые и черные столбцы) демонстрировал высокое продуцирование функционального антитела из клеток рака яичников SKOV-3: уровни антител снижались в клеточном лизате (LYS) во время прогрессирующей инфекции и уничтожения клеток рака и демонстрировали значительно накопление в супернатанте (SN). В отличие от этого, нереплицирующийся вирус Ad5/3-Ab не мог продуцировать поддающееся обнаружению антитело в супернатанте, даже несмотря на то, что клеточный лизат демонстрировал признаки антител на сутки 7 после инфекции (белые столбцы). Стоит отметить, что клетки, которые лечили нереплицирующимся вирусом Ad5/3-Ab, были жизнеспособными на всем протяжении эксперимента, что указывает на отсутствие секреции активных антител клетками рака. (B) Супернатант клеток рака молочной железы BT-474 (слева) и эмбриональных клеток 293 человека (справа) анализировали посредством вестерн-блоттинга через 6 суток после инфекции указанными вирусами. При восстанавливающих условиях тяжелую цепь (HC), легкую цепь (LC) и полноразмерное антитело, продуцируемые онколитическим вирусом Ad5/3-OV-Ab, визуализировали в супернатанте обеих клеточных линий, тогда как нереплицирующиеся вирусы Ad5-Ab и Ad5/3-Ab не могли демонстрировать высвобождение антител из клеток BT-474, которые не допускают их репликации. Для того чтобы подтверждать экспрессию антител с помощью нереплицирующегося вируса, авторы изобретения использовали эмбриональные клетки 293 человека (справа), которые допускают репликацию аденовирусов также с делецией E1A, после чего следовал лизис клеток и высвобождение антитела, легко обнаружимого с помощью вестерн-блоттинга. Нереплицирующийся контрольный вирус Ad5/3-Luc, кодирующий люциферазу, использовали в качестве отрицательного контроля. HC и LC обнаруживали с использованием поликлонального IgG козы против человека и антител осла против IgG козы-HRP, соответственно. Аффинность антител была ниже для LC, чем для HC, что давало более слабый сигнал. Столбцы представляют среднее значение ± SEM. **, P < 0,01; *, P < 0,05; все критерии Стьюдента.
На фиг. 9 показано, что онколитический аденовирус, кодирующий антитело, демонстрирует более высокие внутриопухолевые, но при этом более низкие системные уровни антител, чем после системного лечения антителами. Несущих подкожный ксенотрансплантат N87 рака желудка «голых»/NMRI мышей (n=5 на группу) лечили внутриопухолевыми инъекциями онколитического вируса Ad5/3-OV-Ab (2×108 VP/опухоль) или интраперитонеальными инъекциями коммерческого антитела (Ab; 0,3 мкг/г) в сутки 0, 4, 8 и 15. Осуществляли мониторинг здоровья животных и брали опухоли и образцы крови у мышей, умерщвленных в сутки 32 и 40 (системное Ab), сутки 46 (системное Ab и вирус Ad5/3-OV-Ab) и сутки 50 (вирус Ad5/3-OV-Ab). A) Опухоли и образцы крови в конечной точке измеряли посредством ELISA IgG человека для того, чтобы оценивать концентрацию антител: мыши, которых лечили Ad5/3-OV-Ab и умерщвляли в сутки 46 и 50 после лечения, демонстрировали все еще значительно более высокую концентрацию антител в опухолях (P < 0,001, слева), при этом показывая значительно более низкие циркулирующие уровни (P < 0,001, справа), по сравнению с мышами, которых лечили системным Ab, которых умерщвляли раньше в сутки 32, 40 и 46. B) Уровни антител в опухоли и образцах крови каждого индивидуального животного сравнивали с оценочным распределением антител. Усредненное соотношение антител в опухоли в сравнении с кровью было выше 1,0 у мышей, которых лечили вирусом Ad5/3-OV-Ab, тогда как лечение системным Ab давало очень низкое соотношение меньше чем 0,01. Таким образом, лечение с использованием онколитического вируса, экспрессирующего антитела, позволяет достигать усовершенствованной внутриопухолевой концентрации антител, при этом значительно снижая системную экспозицию у животных. Стоит отметить, что большинство мышей, которых лечили вирусом, выживали дольше (вплоть до 50 суток) и, следовательно, демонстрировали доказательство сохраняемого локального продуцирования антител. Величина ошибки представляет среднее±SEM. **, P < 0,01, критерий Стьюдента.
На фиг. 10 показано, что экспрессия маркера истощения T-клеток и иммуносупрессорного рецептора TIM3 снижается после лечения онколитическим аденовирусом и коррелирует с усовершенствованной выживаемостью. 15 пациентов с запущенными солидными опухолями лечили онколитическими аденовирусами в контексте Advanced Therapy Access Program. Опухолевые биоптаты базового уровня и после лечения анализировали с помощью РНК микрочипа (чип HumanHT-12 v4 Expression BeadChips, Illumina) и уровни экспрессии генов сравнивали для того, чтобы идентифицировать различно экспрессированные гены. T-клеточный иммуноглобулин муцин-3 (TIM3), который является маркером истощения и негативным регулятором как врожденного, так и адаптивного иммунного ответа в опухолях, был среди наиболее различно экспрессированных генов: TIM3 демонстрировал основную понижающую регуляцию у 5 пациентов (изменение более 1,0, Δ[log2]) и минорное снижение у 4 пациентов (усредненное изменение 0,38, Δ[log2]). Между тем, 6 пациентов не смогли продемонстрировать понижающую регуляцию TIM3, из которых два пациента демонстрировали повышающую регуляцию после лечения. Когда общую выживаемость сравнивали между этими группами, пациенты с понижающей регуляцией TIM3 (n=9) демонстрировали значительно усовершенствованную выживаемость (P=0,004, логранговый критерий) относительно пациентов без изменения/ с повышающей регуляцией TIM3 (n=6). Медианная выживаемость составляла 204 суток и 64 суток в группах понижающей и повышающей регуляции TIM3, соответственно. Таким образом, в двух третях случаев лечение онколитическим аденовирусом, похоже, ведет к снижению иммуносупрессорного рецептора и маркера истощения TIM3, что сильно коррелирует с пролонгированной общей выживаемостью.
На фиг. 11 представлено усовершенствованное уничтожение клеток in vitro с использованием комбинации TIL и онколитического аденовируса. Клетки HapT1 инфицировали онколитическим аденовирусом (100 VP/клетка) в течение 3 суток перед добавлением HapT1 TIL. Жизнеспособность клеток-мишеней определяли через 24 часа после добавления TIL. Величина ошибки, SE. ****p<0,0001. Наилучшее уничтожение наблюдали, когда T-клетки стимулировали онколитическим аденовирусом.
На фиг. 12 показано, что в отсутствие молекул BiTe, TIL, извлеченные из опухолей HapT1, не оказывают аддитивного эффекта на уничтожение клеток-мишеней в комбинации с онколитическими аденовирусами. Клетки HapT1 высевали на 96-луночный планшет и инкубировали 5 суток с онколитическим аденовирусом Ad5/3-E2F-d24 отдельно или вооруженным IL-2 человека. TIL, извлеченные из развившихся опухолей HapT1, добавляли в клетки 10:1 за 24 ч до измерения жизнеспособности клеток с использованием анализа MTS. Синергизм между вирусами и TIL не наблюдали.
На фиг. 13 (A и B) представлена литическая активность in vitro для вируса Ad 5/3-E2F-d24-E3 в комбинации со специфичным к CD3 человека направленным на EpCAM BiTE (Antihuman EpCam, № по каталогу CABT-33295MH) и PBMC против клеточной линии карциномы ободочной кишки SW480. Фиг. 13A: a) опухолевые клетки SW480 инфицировали с увеличением VP (0,01, 0,1, 1, 10, 100, 1000 VP) вируса Ad 5/3-E2F-d24-E3 и с использованием 10 нг BiTE. Эффекторные клетки (PBMC) добавляли при соотношении эффектора и мишени 5:1. Анализ MTS использовали для того, чтобы определять жизнеспособность клеток через 48 часов после инфекции. Величина ошибки показывает SEM измерений в трех повторениях. Вирус+клетки ср. Вирус+PBMC *P=0,0184, Вирус+клетки ср. Вирус+PBMC+BiTE *** P=0,001. Фиг. 13B: a) опухолевые клетки SW480 инфицировали с использованием 1000 VP вируса Ad 5/3-E2F-d24-E3 и 10 нг BiTE. Эффекторные клетки (PBMC) добавляли при соотношении эффектора и мишени 5:1. Анализ MTS использовали для того, чтобы определять жизнеспособность клеток через 48 часов после инфекции. Величина ошибки показывает SEM измерений в трех повторениях. Вирус+клетки ср. Вирус+PBMC *P =0,0184, Вирус+клетки ср. Вирус+BiTE+PBMC ***P=0,001.
На фиг. 14 показано, что аденовируса или аденовируса, вооруженного IL-2, не достаточно для накопления T-клеток в опухолях. Лечение аденовирусом в комбинации с адоптивным T-клеточным переносом ведет к субоптимальной T-клеточной инфильтрации в опухолях меланомы B16.OVA. Опухоли, собранные через 18 суток после начала лечения, подвергали проточному цитометрическому анализу на овальбумин-специфичные CD8+ T-клетки (OVA) и gp100-специфичные CD8+ T-клетки. OVA и gp100 представляют собой эпитопы, экспрессируемые на клетках меланомы. Различия между различными группами лечения не были статистически значимыми и не отличались от терапия только T-клетками (без вируса). Горизонтальные линии, средние значения.
На фиг. 15 показаны цитотоксические T-клетки в панкреатических опухолях хомяка. Онколитические аденовирусы неспособны рекрутировать цитотоксические CD8+ T-клетки в опухоли. Подкожные панкреатические опухоли хомяка (HapT1) лечили онколитическими аденовирусами Ad5/3-E2F-d24 отдельно или вооруженными IL-2 человека всего 5 раз в течение 19 суток. На 25 сутки животных умерщвляли, и опухолевые клетки метили перекрестно реактивным антителом против CD8b крысы, PE. (Число образцов: имитация и не вооруженные n=5, IL-2 n=1). Онколитический аденовирус в отдельности не способен рекрутировать Cd8 клетки в опухоль. IL-2 выглядел более перспективным, но увеличение не было значительным.
На фиг. 16 представлены результаты повторной антигенной стимуляции иммунокомпетентных хомяков. Хомяков, которых предварительно лечили не вооруженным онколитическим аденовирусом Ad5/3-E2F-d24 или аденовирусом, вооруженным цитокином (TNFα, IL-2 или оба), сопротивлялись опухоли того же типа (HapT1), но не другого типа (DDT1-MF2). Наивных животных, которые предварительно не встречались с какими-либо клеточными линиями, использовали в качестве контроля. Вооружать вирус молекулой, способной индуцировать противоопухолевый иммунитет (например, BITe), необходимо для индукции защитного иммунитета (признака вторичного иммунного ответа против опухолевых эпитопов).
На фиг. 17 представлен эффект in vivo вооруженного или не вооруженного онколитического аденовируса, с использованием или без использования T-клеточной терапии. Внутрь развившихся опухолей HapT1 инъецировали онколитический аденовирус Ad5/3-E2F-d24 (1×107 VP/опухоль) в сутки 1 и 8. В сутки 2 инфильтрирующие опухоль HapT1 лимфоциты, выращенные ex vivo (1,5×106 TIL/опухоль), вводили внутрь опухоли. Величина ошибки, SE. *p<0,05, **p<0,01. Наилучший противоопухолевый эффект наблюдали, когда опухоли лечили онколитическим вирусом и также давали TIL.
На фиг. 18 представлены гипотетические результаты эксперимента с противоопухолевым эффектом in vivo, объединяющего перенос Ad-BiTE и OT1 T-клеток иммунокомпетентным мышам, несущим опухоли B16-OVA. Подкожно имплантированные опухоли B16-OVA (0,25×106 клеток/опухоль) лечили одной интраперитонеальной инъекцией CD8-обогащенных OT1 T-клеток, внутриопухолевой инъекцией Ad-BiTE (1×109 VP/опухоль) или и тем и другим. Инъекции вируса повторяли каждые 7 суток.
На фиг. 19 показано, что аденовирусная доставка цитокинов IL-2 и TNFα усиливает эффект адоптивной клеточной терапии, что дает разумное объяснение для включения цитокинов в онколитический аденовирус, кодирующий BiTE. Несущих опухоль B16-OVA мышей C57 лечили внутриопухолево с использованием 1×109 вирусных частиц вооруженных аденовирусов и интраперитонеально с использованием 1,5×106 CD8-обогащенных OT-1 T-клеток в сутки 1. Лечение вирусом продолжали каждые 7 суток.
На фиг. 20 представлена схема конструкции по настоящему изобретению.
На фиг. 21 представлена карта конструкции по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Вирусные векторы
Онколитические аденовирусные векторы, используемые в настоящем изобретении, могут представлять собой какие-либо аденовирусные векторы, подходящие для лечения человека или животного. В рамках изобретения «онколитический аденовирусный вектор» относится к аденовирусному вектору, способному инфицировать и уничтожать клетки рака посредством избирательной репликации в опухоли по сравнению с нормальными клетками.
В одном из вариантов осуществления изобретения аденовирусные векторы представляют собой векторы из вирусов человека. В одном из вариантов осуществления аденовирусные векторы выбирают из группы, состоящей из векторов Ad5, Ad3 и Ad5/3. В рамках изобретения, выражение «остов нуклеиновой кислоты аденовируса серотипа 5 (Ad5)» относится к геному Ad5. Аналогичным образом «остов нуклеиновой кислоты аденовируса серотипа 3 (Ad3)» относится к геному Ad3. «Вектор Ad5/3» относится к химерному вектору, содержащему или имеющему части обоих векторов Ad5 и Ad3. В конкретном варианте осуществления остов аденовирусного вектора представляет собой остов нуклеиновой кислоты аденовируса серотипа 5 (Ad5) или серотипа 3 (Ad3) с конкретными мутациями. Например, в векторе можно модифицировать области фибры. В одном из вариантов осуществления остов представляет собой остов нуклеиновой кислоты Ad5, который дополнительно содержит головку фибры Ad3. Другими словами, конструкция имеет головку фибры от Ad3, тогда как остальной геном или большая часть остального генома происходит из Ad5. (См., например, фиг. 20)
Аденовирусные векторы можно модифицировать каким-либо образом, известным в данной области, например, посредством делеций, инсерций, мутаций или модификаций в каких-либо областях вируса. Векторы делают опухолеспецифическими в отношении репликации. Например, аденовирусный вектор может содержать модификации в E1, E3 и/или E4, такие как инсерция опухолеспецифических промоторов (например, чтобы управлять E1), делеции областей (например, константной области 2 из E1, как используют в «D24», E3/gp19k, E3/6,7k) и инсерция трансгенов.
Один подход к созданию опухолеспецифического онколитического аденовируса состоит в конструировании делеции 24 пар оснований (D24), затрагивающей константную область 2 (CR2) в E1. В аденовирусе дикого типа CR2 отвечает за связывание клеточного белка Rb супрессора опухоли/регулятора клеточного цикла для индукции фазы синтеза (S), т. е. фазы синтеза или репликации ДНК. Для взаимодействия между pRb и E1A необходимы аминокислоты со 121 до 127 консервативного участка белка E1A, которые удалены в настоящем изобретении. Вектор по настоящему изобретению содержит делецию нуклеотидов, соответствующих аминокислотам 122-129 вектора в соответствии с Heise C. et al. (2000, Nature Med 6, 1134-1139). Известно, что вирусы с D24 имеют сниженную способность преодолевать контрольную точку G1-S и эффективно реплицируются только в клетках, где это взаимодействие не является необходимым, например, в опухолевых клетках с дефектом пути Rb-p16, что включает большинство, если не все опухоли человека. В одном из вариантов осуществления изобретения вектор содержит делецию 24 п. о. (D24) в Rb-связывающей константной области 2 аденовирусного E1 (см. фиг. 20)
Также возможно замещать эндогенный вирусный промотор E1A, например, опухолеспецифическим промотором. В конкретном варианте осуществления изобретения, например, промотор E2F1 (например, в векторе на основе Ad5) или hTERT (например, в векторе на основе Ad3) используют вместо эндогенного вирусного промотора E1A. В одном из вариантов осуществления вектор содержит промотор E2F1 для опухолеспецифической экспрессии E1A.
Участок E3 является несущественным для репликации вируса in vitro, но белки E3 играют важную роль в регуляции иммунного ответа организма-хозяина, т. е. в ингибировании как врожденного, так и специфичного иммунного ответа. В одном из вариантов осуществления изобретения делеция последовательности нуклеиновой кислоты в участке E3 онколитического аденовирусного вектора представляет собой делецию вирусных рамок считывания gp19k и 6,7k. Делеция gp19k/6,7k в E3 относится к делеции 965 пар оснований из участка аденовирусного E3A. В получаемой аденовирусной конструкции удалены оба гена gp19k и 6,7k (Kanerva A et al. 2005, Gene Therapy 12, 87-94). Известно, что продукт гена gp19k связывает и секвестрирует молекулы главного комплекса гистосовместимости I (MHC1, известный у человека как HLA1) в эндоплазматическом ретикулуме и предотвращает распознавание инфицированных клеток цитотоксическими T-лимфоцитами. Поскольку многие опухоли имеют дефицит HLA1/MHC1, делеция gp19k повышает опухоль избирательность к вирусам (вирус выводится быстрее, чем вирус дикого типа из нормальных клеток, но нет различия в опухолевых клетках). Белки 6,7k экспрессированы на клеточных поверхностях, и они принимают участие в понижающей регуляции рецептора 2 TNF-связанного индуцирующего апоптоз лиганда (TRAIL) (см. фиг. 20).
Обе делеции gp19k и 6,7k обеспечивают удивительное преимущество в отношении конкретного варианта осуществления изобретения. Поскольку авторы изобретения пытаются восстановить экспрессию HLA/MHC для презентации опухолевых эпитопов адоптивно перенесенным T-клеткам, экспрессия белка gp19k является контрпродуктивной и фактически повышающая регуляция HLA/MHC требует делеции gp19k. В отношении 6,7k, поскольку один конкретный вариант осуществления изобретения авторов изобретения представляет собой продуцирование TNFα из вируса, и одна из его противоопухолевых активностей представляет собой непосредственный противоопухолевый проапоптозный эффект (как на трансдуцированные, так и на не трансдуцированные фоновые клетки), присутствие 6,7k является контрпродуктивным.
В одном из вариантов осуществления изобретения один или несколько трансгенов помещают в удаленный участок E3 gp19k/6,7k, под управлением промотора E3. Это ограничивает экспрессию трансгена опухолевыми клетками, которые допускают репликацию вируса и последующую активацию промотора E3. В конкретном варианте осуществления последовательность нуклеиновой кислоты, кодирующая двухчастную молекулу, содержащую одноцепочечный вариабельный фрагмент (scFv), специфичный к молекуле клеточной поверхности, и scFv, специфичный к антигену опухоли, вставляют вместо удаленной последовательности нуклеиновой кислоты вирусных рамок считывания gp19k и 6,7k. В другом варианте осуществления изобретения E3 gp19k/6,7k оставляют в векторе, но удаляют одну или несколько других областей E3 (например, E3 9 кДа, E3 10,2 кДа, E3 15,2 кДа и/или E3 15,3 кДа).
Промотор E3 может представлять собой любой экзогенный (например, промотор CMV или E2F) или эндогенный промотор, известный в данной области, в частности, эндогенный промотор E3. Несмотря на то, что промотор E3 главным образом активируется посредством репликации, некоторая экспрессия происходит при экспрессии E1. Поскольку избирательность вирусов типа D24 возникает после экспрессии E1 (когда E1 не способен связывать Rb), эти вирусы экспрессируют E1 также в трансдуцированных нормальных клетках. Таким образом, критически важно также регулировать E1 экспрессию, чтобы ограничивать опосредованную промотором E3 экспрессию трансгена до опухолевых клеток.
Конкретные варианты осуществления изобретения включают онколитические аденовирусные векторы (например, векторы Ad5 или Ad3), репликация которых ограничена путем p16/Rb механизмом двойной избирательности: опухолеспецифический промотор E2F (например, E2F1) помещен перед аденовирусным геном E1A, который мутировал в константной области 2, с тем, чтобы получаемый белок E1A не был способен связывать Rb в клетках. Кроме того, фибру модифицируют посредством 5/3 химеризма для того, чтобы сделать возможным эффективное попадание внутрь опухолевой клетки. И в то же время трансген BiTE, необязательно с другими трансгенами, помещают в участок E3, который удален для открытых рамок считывания gp19k и 6,7k. Этот вооружающий подход связывает экспрессию трансгена с репликацией вируса без потребности в гетерологичных промоторах. L(левая)- и/или R(правая)-ITR последовательности также могут содержаться в векторе в конкретных вариантах осуществления. Последовательности инвертированных концевых повторов (ITR) делают возможным эффективное размножение вирусного генома и дают способность формировать шпильку, помимо других свойств.
В конкретном варианте осуществления изобретения онколитический аденовирусный вектор содержит:
1) промотор E2F1 для опухолеспецифической экспрессии E1A
2) делецию 24 п. о. (D24) в Rb-связывающей константной области 2 аденовирусного E1;
3) делецию последовательности нуклеиновой кислоты вирусных рамок считывания gp19k и 6,7k; и
4) последовательность нуклеиновой кислоты, кодирующую двухчастную молекулу, содержащую одноцепочечный вариабельный фрагмент (scFv), специфичный к молекуле клеточной поверхности, и scFv, специфичный к антигену опухоли, вместо удаленной последовательности нуклеиновой кислоты, как определено в точке 3) (см. фиг. 20).
Биспецифическое моноклональное антитело (BsMAb, BsAb) представляет собой искусственный белок, который состоит из фрагментов двух различных моноклональных антител и, следовательно, способен связывать антигены двух различных типов. Другими словами, биспецифические антитела объединяют два или больше антиген-распознающих элемента в одну конструкцию, которая способна связываться с двумя или больше мишенями.
Примеры биспецифических моноклональных антител включают BsMAb, которые конструируют для того, чтобы одновременно связываться с цитотоксической клеткой (с использованием рецептора, такого как CD3) и мишенью, такой как опухолевая клетка, подлежащая уничтожению. Разработаны BsMAb первого поколения, называемые трифункциональными антителами. Они состоят из двух тяжелых и двух легких цепей, по одной из двух различных антител. Две Fab-области (плечи) направлены против двух антигенов. Fc-область (ножка) выполнена из двух тяжелых цепей и формирует третий сайт связывания; отсюда и название. Другие типы биспецифических антител включают химически связанные Fab, состоящие только из Fab-областей, и двухвалентные и трехвалентные одноцепочечные вариабельные фрагменты (scFv) различных типов (т. е. слитные белки, имитирующие вариабельные домены двух антител). В конкретном варианте осуществления изобретения биспецифическое моноклональное антитело выбирают из группы, состоящей из трифункциональных антител и двухвалентных и трехвалентных одноцепочечных вариабельных фрагментов (scFv). В одном из вариантов осуществления изобретения биспецифическое моноклональное антитело представляет собой двухвалентный одноцепочечный вариабельный фрагмент. Группа двухвалентных одноцепочечных вариабельных фрагментов содержит биспецифические рекрутеры T-клеток (BiTE) и mAb2 (т. е. антитела, сконструированные так, чтобы содержать антигенсвязывающий фрагмент Fcab вместо константной области Fc).
Биспецифические рекрутеры T-клеток (BiTE) представляют собой класс искусственных биспецифических моноклональных антител. Они направляют иммунную систему организма-хозяина, более конкретно цитотоксическую активность T-клеток, против клеток рака. BiTE представляют собой слитные белки, состоящие из двух одноцепочечных вариабельных фрагментов (scFv) различных антител, или аминокислотные последовательности из четырех различных генов в одной пептидной цепь приблизительно 55 кДа. Один из scFv связывается с T-клетками через молекулу клеточной поверхности (например, рецептор CD3), а другой с опухолевой клеткой через опухолеспецифическую молекулу.
В конкретном варианте осуществления биспецифическое моноклональное антитело представляет собой двухчастную молекулу, содержащую одноцепочечный вариабельный фрагмент (scFv), специфичный к молекуле клеточной поверхности, и scFv, специфичный к антигену опухоли. В рамках изобретения, «специфичный к молекуле клеточной поверхности» относится к способности связывать молекулу клеточной поверхности конкретного типа. Также, в рамках изобретения «специфичный к антигену опухоли» относится к способности связывать антиген опухоли конкретного типа.
В одном из вариантов осуществления изобретения молекула клеточной поверхности находится на иммунологических эффекторных клетках. В рамках изобретения «иммунологическая эффекторная клетка» относится к клетке, выбранной из группы, состоящей из T-клеток, CD8+ клеток, CD4+ клеток, NK-клеток, дельта-гамма T-клеток, регуляторных T-клеток и мононуклеарных клеток периферической крови. В конкретном варианте осуществления эффекторные клетки представляют собой T-клетки, т. е. T-лимфоциты. В одном из вариантов осуществления молекулу клеточной поверхности можно выбирать из CD3, CD8 и CD4.
В одном из вариантов осуществления антиген опухоли выбирают из таблицы 1 или из группы, состоящей из мезотелина, EpCAM1 и MUC1.
В одном из вариантов осуществления молекула клеточной поверхности представляет собой CD3 и антиген опухоли выбирают из таблицы 1 или из мезотелина, EpCAM1 или MUC1. В другом варианте осуществления молекула клеточной поверхности представляет собой CD8 и антиген опухоли выбирают из таблицы 1 или из мезотелина, EpCAM1 или MUC1. В дополнительном варианте осуществления молекула клеточной поверхности представляет собой CD4 и антиген опухоли выбирают из таблицы 1 или из мезотелина, EpCAM1 или MUC1. В очень конкретном варианте осуществления антиген опухоли представляет собой мезотелин и молекула клеточной поверхности представляет собой CD3; антиген опухоли представляет собой EpCAM1 и молекула клеточной поверхности представляет собой CD3; или антиген опухоли представляет собой MUC1 и молекула клеточной поверхности представляет собой CD3. В действительности, касательно трансгенов BiTe, конкретные примеры включают анти-мезотелин-линкер-анти-CD3, анти-EpCAM1-линкер-анти-CD3 и анти-MUC1-линкер-анти-CD3.
Таблица 1. Примеры антигенов опухоли, подходящих для настоящего изобретения (http://cvc.dfci.harvard.edu/cvccgi/tadb/nomenclature.pl).
В одном из вариантов осуществления вектор по изобретению кодирует биспецифическое моноклональное антитело, но также может содержать другие трансгены. В конкретном варианте осуществления онколитический аденовирусный вектор кодирует два или больше трансгенов. Конкретные варианты осуществления настоящего изобретения включают аденовирусные векторы, кодирующие биспецифический рекрутер T-клеток и по меньшей мере один цитокин. Цитокины, используемые в настоящем изобретении, можно выбирать из каких-либо цитокинов, известных в данной области. В конкретном варианте осуществления изобретения цитокин представляет собой IL-2, TNFα или CD40L. В действительности, в дополнение к биспецифическому моноклональному антителу онколитический аденовирусный вектор дополнительно может содержать, например, трансген(ы) IL-2, TNFα и/или CD40L.
Цитокины участвуют в иммунном ответе, действуя через различные механизмы, включая рекрутирование T-клеток в направлении опухоли. Нуклеотидная последовательность, кодирующая трансген цитокина, может быть от какого-либо животного, такого как человек, примат, крыса, мышь, хомяк, собака или кошка, но, в частности, его кодирует последовательность человека. Нуклеотидную последовательность, кодирующую трансген, можно модифицировать для того, чтобы усовершенствовать его эффекты, или не модифицировать, т. е. оставлять дикого типа.
Кроме того, комбинация аденовирусных векторов, кодирующих как BiTE, так и по меньшей мере один цитокин, с адоптивными клеточными терапевтическими средствами обеспечивает более эффективные результаты на более широких мишенях, чем можно предполагать.
Другие цитокины действуют посредством привлечения и активации T-клеток и снижения опухолевой иммуносупрессии, тогда как IL-2 индуцирует размножение T-клеточного трансплантата. Таким образом, IL-2 продуцируется локально в опухоли, где он необходим, вместо системной инъекции, как типично выполняют при T-клеточной терапии, что может вызывать побочные эффекты, и, следовательно, основную проблему терапии известного уровня техники (т. е. токсичность системного IL-2) можно предотвращать с помощью этого варианта осуществления. В действительности, предотвращают тяжелые нежелательные явления, даже гибель, поскольку отдельное добавление IL-2, используемое в способах известного уровня техники для того, чтобы размножать и поддерживать перенесенные клетки после их переноса пациенту, не требуется, если вирус продуцирует его при репликации в опухоли. Локальное продуцирование в опухоли также может усиливать искомые эффекты IL-2 (стимуляция и размножение трансплантата), при этом снижая системную экспозицию, которая является причиной нежелательных явлений. Настоящее изобретение предусматривает избирательное лечение с меньшей токсичностью или вредом для здоровых тканей.
Сигнал опасности, обеспечиваемый посредством репликации онколитического вируса и активации патоген-ассоциированных молекулярных рецепторов опознавания паттерна с помощью вирусной ДНК, вместе с действием трансгена(ов) могут снижать опухолевую иммуносупрессию до такой степени, что предварительную терапию можно не использовать. Следовательно, можно избегать и основной проблемы известного уровня техники - токсичности из-за предварительной химиотерапии и облучения.
В одном из вариантов осуществления изобретения вирусный вектор содержит внутренний участок посадки рибосомы (IRES) или необязательно участок шунтирования рибосомы 2A между двумя трансгенами. Таким образом, IRES или участок шунтирования рибосомы 2A могут быть между какими-либо трансгенами, такими как биспецифическое моноклональное антитело и какой-либо цитокин. В рамках изобретения, «IRES» относится к нуклеотидной последовательности, которая допускает инициацию трансляции в середине последовательности информационной РНК при синтезе белка. IRES может быть из какого-либо вируса, но в одном из вариантов осуществления изобретения IRES происходит из вируса энцефаломиокардита (EMCV). В рамках изобретения, «участок шунтирования рибосомы 2A» относится к участку инициации трансляции, в котором рибосомы физически обходят части 5'-нетранслируемой области для того, чтобы достигать инициирующий кодон. Как IRES, так и A2 позволяют вирусам продуцировать два трансгена с одного промотора (промотора E3). IRES можно использовать, например, в следующих местах в аденовирусных конструкциях (фиг. 20): aМезотелин-aCD3-IRES-IL-2 (см. SEQ ID №№ 1, 2, 3, 5, 6, 9); aМезотелин-aCD3-IRES-TNFα (см. SEQ ID №№ 1, 2, 3, 5, 6, 7); aEpCAM-aCD3-IRES-IL-2 (см. SEQ ID №№ 1, 2, 3, 4, 5, 6); aEpCAM-aCD3-IRES-TNFα (см. SEQ ID №№ 1, 2, 3, 4, 5, 7); aMUC1-aCD3-IRES-IL-2 (см. SEQ ID №№ 1, 2, 3, 5, 6, 8); aMUC1-aCD3-IRES-TNFα (см. SEQ ID №№ 1, 2, 3, 5, 7, 8). Нуклеотидные последовательности происходят из аденовирусных конструкций по изобретению и представлены в таблице 2.
Схемы основной структуры вирусных геномов, которые можно использовать, например, в настоящем изобретении, представлены на фиг. 20 (Ad5/3-E2F-D24-трансген). Нуклеотидные последовательности вирусных векторов, содержащих трансгены aМезотелин-aCD3 (например, aМезотелин-aCD3-IRES-IL-2 см. SEQ ID №№ 1, 2, 3, 5, 6, 9; aМезотелин-aCD3-IRES-TNFα см. SEQ ID №№ 1, 2, 3, 5, 6, 7), aEpCAM-aCD3 (например, aEpCAM-aCD3-IRES-IL-2 см. SEQ ID №№ 1, 2, 3, 4, 5, 6; aEpCAM-aCD3-IRES-TNFα см. SEQ ID №№ 1, 2, 3, 4, 5, 7), aMUC1-aCD3 (например, aMUC1-aCD3-IRES-IL-2 см. SEQ ID №№ 1, 2, 3, 5, 6, 8; aMUC1-aCD3-IRES-TNFα см. SEQ ID №№ 1, 2, 3, 5, 7, 8) конструировали в соответствии с последовательностями, перечисленными в таблице 2. Основные способы конструирования аденовирусных векторов хорошо известны специалисту в данной области и описаны, например, в Koski et al. 2010, Hemminki et al. 2015. Эти способы также можно использовать для конструирования аденовирусных векторов по настоящему изобретению.
В дополнение к другим преимуществам, описанным выше, дополнительные преимущества по настоящему изобретению от использования вирусных векторов, содержащих по меньшей мере один трансген цитокина, представляют собой: i) цитокины и вирус per se вызывают сигнал опасности, который рекрутирует T-клетки и другие клетки иммунной системы в опухоли, ii) цитокины индуцируют T-клеточную пролиферацию как в опухоли, так и в локальных лимфоидных органах, iii) цитокины и вирус per se способны индуцировать T-клетки (как адоптивный T-клеточный трансплантат, так и естественные врожденные противоопухолевые T-клетки) на размножение в опухоли, iv) цитокин и/или вирус индуцируют повышающую регуляцию антигенпрезентирующих молекул (HLA) на клетках рака, делая их чувствительными к распознаванию и уничтожению T-клетками, и v) цитокины и репликация вируса благоприятно изменяют микроокружение опухоли посредством снижения иммуносупрессии и клеточной анергии.
Вирусные векторы, используемые в настоящем изобретении, также могут содержать другие модификации, нежели описано выше. Необязательно можно использовать какие-либо дополнительные компоненты или модификации, но они не являются обязательными для настоящего изобретения.
Инсерция экзогенных элементов может усиливать эффекты векторов в клетках-мишенях. Использование экзогенных тканевых или опухолеспецифических промоторов является обыкновенным в рекомбинантных векторах, и их также можно использовать в настоящем изобретении.
Адоптивная клеточная терапия
Один подход по настоящему изобретению представляет собой разработку лечения для пациентов со раком с использованием переноса иммунных лимфоцитов, которые способны вступать в реакцию со раком и уничтожать ее. Выделенные инфильтрирующие опухоль лимфоциты выращивать в культуре до большого числа и вливают пациенту. В настоящем изобретении аденовирусные векторы, кодирующие по меньшей мере биспецифическое моноклональное антитело, можно использовать для увеличения эффекта лимфоцитов. В рамках изобретения, «увеличение эффекта адоптивной клеточной терапии» относится к ситуации, в которой аденовирусный вектор по изобретению способен вызывать более сильный терапевтический эффект у пациента, когда используют вместе с адоптивной клеточной терапевтической композицией по сравнению с терапевтическим эффектом адоптивной клеточной терапевтической композиции отдельно. Фиг. 1 относится к механизму увеличения эффекта посредством иллюстрирования T-клеточной терапии с использованием онколитического аденовируса, кодирующего биспецифический рекрутер T-клеток BiTE. Конкретный вариант осуществления изобретения представляет собой способ лечения рака у пациента, где способ включает введение онколитического аденовирусного вектора по изобретению пациенту, указанный способ дополнительно включает введение адоптивной клеточной терапевтической композиции пациенту. Адоптивную клеточную терапевтическую композицию и векторы по изобретению вводят отдельно. Отдельным введениям адоптивной клеточной терапевтической композиции и аденовирусных векторов может предшествовать миелоаблятивная или немиелоаблятивная предварительная химиотерапия и/или облучение. Лечение адоптивной клеточной терапией предназначено для того, чтобы снижать или устранять злокачественную опухоль у пациента.
Конкретный вариант осуществления изобретения относится к терапии с использованием аденовирусных векторов и адоптивной клеточной терапевтической композиции, например, инфильтрирующих опухоль лимфоцитов, TCR-модифицированных лимфоцитов или CAR-модифицированных лимфоцитов. В частности, T-клеточную терапию, но также какую-либо другую адоптивную терапию, такую как терапия естественными киллерными клетками или другая клеточная терапия, можно использовать в настоящем изобретении. В действительности, в соответствии с настоящим изобретением адоптивная клеточная терапевтическая композиция может содержать немодифицированные клетки, такие как в TIL терапии, или генетически модифицированные клетки. Существует два общих пути достижения генетического нацеливания T-клеток на опухолеспецифические мишени. Один представляет собой перенос T-клеточного рецептора с известной специфичностью (TCR-терапия) и с совпадающим типом лейкоцитарного антигена человека (HLA, известным как главный комплекс гистосовместимости у грызунов). Другой представляет собой модификацию клеток с использованием искусственных молекул, таких как химерные антигенные рецепторы (CAR). Этот подход не зависит от HLA и является более гибким в отношении нацеливания молекул. Например, можно использовать одноцепочечные антитела, и CAR также могут содержать костимулирующие домены. Однако, мишени CAR клеток должны находиться на мембране клеток-мишеней, тогда как TCR модификации могут использовать внутриклеточные мишени.
В рамках изобретения, «адоптивная клеточная терапевтическая композиция» относится к какой-либо композиции, содержащей клетки, подходящие для адоптивного клеточного переноса. В одном из вариантов осуществления изобретения адоптивная клеточная терапевтическая композиция содержит клетки того типа, который выбран из группы, состоящей из инфильтрирующего опухоль лимфоцита (TIL), TCR-модифицированных (т. е. гетерологичным T-клеточным рецептором) лимфоцитов и CAR-модифицированных (т. е. химерным антигенным рецептором) лимфоцитов. В другом варианте осуществления изобретения адоптивная клеточная терапевтическая композиция содержит клетки того типа, который выбран из группы, состоящей из T-клеток, CD8+ клеток, CD4+ клеток, NK-клеток, дельта-гамма T-клеток, регуляторных T-клеток и мононуклеарных клеток периферической крови. В другом варианте осуществления TIL, T-клетки, CD8+ клетки, CD4+ клетки, NK-клетки, дельта-гамма T-клетки, регуляторные T-клетки или мононуклеарные клетки периферической крови формируют адоптивную клеточную терапевтическую композицию. В одном конкретном варианте осуществления изобретения адоптивная клеточная терапевтическая композиция содержит T-клетки. В рамках изобретения, «инфильтрирующие опухоль лимфоциты» или TIL относятся к белым клеткам крови, которые покинули кровоток и мигрировали в опухоль. Лимфоциты можно разделять на три группы, включая B-клетки, T-клетки и естественные киллерные клетки. В другом конкретном варианте осуществления изобретения адоптивная клеточная терапевтическая композиция содержит T-клетки, которые модифицированы мишенеспецифичными химерными антигенными рецепторами или специфично отобранными T-клеточными рецепторами. В рамках изобретения, «T-клетки» относится к CD3+ клеткам, включающим CD4+ хелперные клетки, CD8+ цитотоксические T-клетки и гамма-дельта T-клетки.
В дополнение к подходящим клеткам, адоптивная клеточная терапевтическая композиция, используемая в настоящем изобретении, может содержать какие-либо другие средства, такие как фармацевтически приемлемые носители, буферы, эксципиенты, адъюванты, добавки, антисептики, наполнители, стабилизаторы и/или загустители и/или какие-либо компоненты, обычно встречающиеся в соответствующих продуктах. Выбор подходящих ингредиентов и подходящих способов изготовления для формулирования композиций относится к общим знаниям специалиста в данной области.
Адоптивная клеточная терапевтическая композиция может быть в любой форме, такой как твердая, полутвердая или жидкая форма, подходящая для введения. Состав можно выбирать из группы, состоящей из, но не ограничиваясь этим, растворов, эмульсий, суспензий, таблеток, пеллетов и капсул. Композиции не ограничены конкретным составом, вместо этого композицию можно формулировать в каком-либо известном фармацевтически приемлемом составе. Фармацевтические композиции можно получать посредством каких-либо стандартных процессов, известных в данной области.
Комбинация онколитического аденовирусного вектора по изобретению и адоптивной клеточной терапевтической композиции относится к использованию онколитического аденовирусного вектора и адоптивной клеточной терапевтической композиции вместе, но в качестве отдельных композиций. Специалисту в данной области ясно, что онколитический аденовирусный вектор по настоящему изобретению и адоптивную клеточную терапевтическую композицию не используют в качестве одной композиции. В действительности, аденовирусные векторы используют не для модификации адоптивных клеток, а для модификации опухоли-мишени с тем, чтобы опухоль была более подвержена желаемым эффектам клеточного трансплантата. В частности, настоящее изобретение усиливает рекрутирование адоптивного трансплантата в опухоль и повышает его активность в ней. В конкретном варианте осуществления изобретения онколитические аденовирусные векторы и адоптивная клеточная терапевтическая композиция из комбинации предназначены для одновременного или последовательного, в любом порядке, введения пациенту.
Злокачественная опухоль
Рекомбинантные векторы по настоящему изобретению компетентны для репликации в опухолевых клетках. В одном из вариантов осуществления изобретения векторы компетентны для репликации в клетках, которые имеют дефекты в Rb-пути, в частности, в пути Rb-p16. Эти дефектные клетки включают все опухолевые клетки у животных и человека. В рамках изобретения, «дефекты в Rb-пути» относится к мутациям и/или эпигенетическим изменениям в каких-либо генах или белках пути. Из-за этих дефектов опухолевые клетки чрезмерно экспрессируют E2F и, таким образом, связывание Rb с E1A CR2, которое обычно является необходимым для эффективной репликации, не является необходимым. Кроме того, избирательность аденовирусного вектора по настоящему изобретению опосредует промотор E2F, который только активируется в присутствии свободного E2F, как наблюдают в клетках с дефектным путем Rb/p16. В отсутствие свободного E2F не происходит транскрипция E1A и вирус не реплицируется. Внедрение промотора E2F1 является важным для того, чтобы предотвращать экспрессию E1A в нормальных тканях, которая может вызывать токсичность как непосредственно, так и опосредованно через допущение экспрессии трансгена с промотора E3.
Настоящее изобретение относится к подходам для лечения рака у пациента. В одном из вариантов осуществления изобретения пациентом является человек или животное, в частности, пациент животное или человек, более конкретно человек или животное, страдающее раком.
Подход по настоящему изобретению можно использовать для того, чтобы лечить какие-либо злокачественные опухоли или опухоли, включая как озлокачествленные, так и доброкачественные опухоли, как первичные опухоли, так и метастазы могут быть мишенями в этом подходе. В одном из вариантов осуществления изобретения злокачественная опухоль отличается инфильтрирующими опухоль лимфоцитами. Инструменты по настоящему изобретению конкретно предназначены для лечения метастатических солидных опухолей, отличающихся инфильтрирующими опухоль лимфоцитами. В другом варианте осуществления T-клеточный трансплантат модифицируют опухоле- или тканеспецифическим T-клеточным рецептором химерного антигенного рецептора.
В рамках изобретения, термин «лечение» или «лечить» относится ко введению по меньшей мере онколитических аденовирусных векторов или по меньшей мере онколитических аденовирусных векторов и адоптивной клеточной терапевтической композиции пациенту, предпочтительно пациенту млекопитающему или человеку, в целях, которые включают не только полное излечение, но также профилактику, уменьшение интенсивности или облегчение нарушений или симптомов, связанных со раком или опухолью. Терапевтический эффект можно оценивать посредством мониторинга симптомов пациента, опухолевых маркеров, например, в крови, или, например, размера опухоли или длительности выживаемости пациента
В одном из вариантов осуществления изобретения злокачественную опухоль выбирают из группы, состоящей из назофарингеального рака, синовиального рака, гепатоцеллюлярного рака, рака почки, рака соединительных тканей, меланомы, рака легких, рака кишечника, рака ободочной кишки, рака прямой кишки, рака толстой кишки, рака головного мозга, рака горла, рака рта, рака печени, рака кости, рака поджелудочной железы, хориокарциномы, гастриномы, феохромоцитомы, пролактиномы, T-клеточного лейкоза/лимфомы, невромы, болезни Гиппеля-Линдау, синдрома Золлингера-Эллисона, рака надпочечника, анального рака, рака желчных протоков, рака мочевого пузыря, рака мочеточника, рака головного мозга, олигодендроглиомы, нейробластомы, менингиомы, опухоли спинного мозга, рака кости, остеохондромы, хондросаркомы, саркомы Юинга, рака неизвестной первичной локализации, карциноида, карциноида желудочно-кишечного тракта, фибросаркомы, рака молочной железы, болезни Паджета, рака шейки матки, рака толстой кишки, рака прямой кишки, рака пищевода, рака желчного пузыря, рака головы, рака глаза, рака шеи, рака почки, опухоли Вильмса, рака печени, саркомы Капоши, рака предстательной железы, рака легких, рака яичек, болезни Ходжкина, неходжкинской лимфомы, рака рта, рака кожи, мезотелиомы, множественной миеломы, рака яичников, эндокринной рака поджелудочной железы, глюкагономы, рака поджелудочной железы, рака паращитовидной железы, рака пениса, рака гипофиза, саркомы мягких тканей, ретинобластомы, рака тонкой кишки, рака желудка, рака тимуса, рака щитовидной железы, трофобластной рака, пузырного заноса, рака матки, рака эндометрия, рака влагалища, рака вульвы, акустической невромы, фунгоидного микоза, инсулиномы, карциноидной синдромы, соматостатиномы, рака десны, рака сердца, рака губы, рака оболочек головного мозга, рака рта, рака нерва, рака неба, рака околоушной железы, рака брюшины, рака глотки, плевральной рака, рака слюнной железы, рака языка и рака миндалины.
Прежде чем классифицировать пациента человека или животное в качестве подходящего для терапии по настоящему изобретению, клиницист может обследовать пациента. На основании результатов, отклоняющихся от нормы и указывающих на опухоль или злокачественную опухоль, клиницист может предложить для пациента лечение по настоящему изобретению.
Фармацевтическая композиция
Фармацевтическая композиция по изобретению содержит по меньшей мере вирусные векторы по изобретению одного типа. В одном из вариантов осуществления фармацевтическая композиция по изобретению содержит онколитический аденовирусный вектор, содержащий делецию последовательности нуклеиновой кислоты в участке E3 и последовательность нуклеиновой кислоты, кодирующей биспецифическое моноклональное антитело вместо удаленной последовательности нуклеиновой кислоты в участке E3, где биспецифическое моноклональное антитело содержит одноцепочечный вариабельный фрагмент (scFv), специфичный к молекуле клеточной поверхности, и scFv, специфичный к антигену опухоли. Кроме того, композиция может содержать по меньшей мере два, три или четыре различных вектора. В дополнение к вектору, фармацевтическая композиция также может содержать другие терапевтически эффективные средства, какие-либо другие средства, такие как фармацевтически приемлемые носители, буферы, эксципиенты, адъюванты, добавки, антисептики, наполнители, стабилизаторы и/или загустители и/или какие-либо компоненты, обычно встречающиеся в соответствующих продуктах. Выбор подходящих ингредиентов и подходящих способов изготовления для формулирования композиций относится к общим знаниям специалиста в данной области.
Фармацевтическая композиция может быть в какой-либо форме, такой как твердая, полутвердая или жидкая форма, подходящая для введения. Состав можно выбирать из группы, состоящей из, но не ограничиваясь этим, растворов, эмульсий, суспензий, таблеток, пеллетов и капсул. Композиции по данному изобретению не ограничены конкретным составом, вместо этого композицию можно формулировать в каком-либо известном фармацевтически приемлемом составе. Фармацевтические композиции можно получать посредством каких-либо стандартных процессов, известных в данной области.
В одном из вариантов осуществления изобретения вирусный вектор или фармацевтическая композиция выполняет функцию наполнителя in situ для рекрутирования T-клеток, усиливая их терапевтический эффект и делая возможным их размножение в опухоли.
Фармацевтический набор по настоящему изобретению может содержать онколитические аденовирусные векторы, кодирующие биспецифические моноклональные антитела, или адоптивную клеточную терапевтическую композицию и онколитические аденовирусные векторы, кодирующие биспецифические моноклональные антитела. В конкретном варианте осуществления адоптивную клеточную терапевтическую композицию формулируют в первом составе и онколитические аденовирусные векторы формулируют во втором составе. В другом варианте осуществления изобретения первый и второй составы предназначены для одновременного или последовательного, в любом порядке, введения пациенту.
Введение
Аденовирусный вектор или фармацевтическую композицию по изобретению можно вводить какому-либо эукариотическому пациенту, выбранному из группы, состоящей из растений, животных и человека. В конкретном варианте осуществления изобретения, пациентом является человек или животное. Животное можно выбирать из группы, состоящей из домашних животных, одомашненных животных и продуктивных животных.
Любой стандартный способ можно использовать для введения вектора или композиции пациенту. Путь введения зависит от состава или формы композиции, заболевания, местоположения опухолей, пациента, сопутствующих патологий и других факторов.
В одном из вариантов осуществления изобретения как аденовирусные векторы, так и адоптивную клеточную терапевтическую композицию вводят пациенту. Введение(я) адоптивной клеточной терапевтической композиции и онколитических аденовирусных векторов, кодирующих по меньшей мере одно биспецифическое моноклональное антитело, пациенту можно проводить одновременно или последовательно, в любом порядке. В одном из вариантов осуществления изобретения онколитические вирусные векторы и адоптивную клеточную терапевтическую композицию вводят отдельно. В рамках изобретения, «отдельное введение» или «отдельно» относится к ситуации, в которой адоптивная клеточная терапевтическая композиция и онколитические аденовирусные векторы представляют собой два различных продукта или композиции, отличающихся друг от друга.
Только одно введение аденовирусных векторов по изобретению или отдельные введения адоптивной клеточной терапевтической композиции и онколитических аденовирусных векторов могут иметь терапевтические эффекты. Может иметь место какой-либо период между введениями онколитических аденовирусов или между введениями онколитических аденовирусов и адоптивной клеточной терапевтической композиции, например, в зависимости от пациента и типа, степени или местоположения рака. В одном из вариантов осуществления изобретения имеет место период времени от одной минуты до четырех недель, в частности, от 1 до 10 суток, более конкретно от 1 до 5 суток, между последовательным введением адоптивной клеточной терапевтической композиции и онколитических аденовирусных векторов, кодирующих биспецифическое моноклональное антитело. Также возможно несколько введений адоптивной клеточной терапевтической композиции и онколитических аденовирусных векторов. Количество раз введения адоптивной клеточной терапевтической композиции и онколитических аденовирусных векторов также может различаться в течение периода лечения. Онколитические аденовирусные векторы или фармацевтические или адоптивные клеточные композиции можно вводить, например, от 1 до 10 раз за первые 2 недели, 4 недели, ежемесячно или в течение периода лечения. В одном из вариантов осуществления изобретения введение векторов или каких-либо композиций выполняют от трех до семи раз за первые 2 недели, затем в 4 недели и затем ежемесячно. В конкретном варианте осуществления изобретения, введение выполняют четыре раза за первые 2 недели, затем в 4 недели и затем ежемесячно. Длина периода лечения может варьировать и, например, может длиться от 2 до 12 месяцев или больше.
В конкретном варианте осуществления изобретения адоптивную клеточную терапевтическую композицию и онколитические аденовирусные векторы вводят в одни и те же сутки и после этого онколитические аденовирусные векторы вводят каждую неделю, две недели, три недели или каждый месяц в течение периода лечения, который может длиться, например, от 1 до или 12 месяцев или больше.
В одном из вариантов осуществления изобретения введение онколитического вируса проводят через внутриопухолевую, внутриартериальную, внутривенную, внутриплевральную, внутривезикулярную, внутриполостную или перитонеальную инъекцию или пероральное введение. Любая комбинация введений также возможна. Подход может давать системный эффект, несмотря на локальную инъекцию. Адоптивную клеточную терапевтическую композицию можно вводить внутривенно или внутрь опухоли. В одном из вариантов осуществления введение адоптивной клеточной терапевтической композиции и/или онколитических вирусных векторов, кодирующих по меньшей мере одно биспецифическое моноклональное антитело, проводят через внутриопухолевую, внутриартериальную, внутривенную, внутриплевральную, внутривезикулярную, внутриполостную или перитонеальную инъекцию или пероральное введение. В конкретном варианте осуществления изобретения TIL или T-клетки вводят внутривенно, а вирусные векторы внутрь опухоли и/или внутривенно. Стоит отметить, что вирус доставляют в опухоль отдельно от введения T-клеток; вирус не используют для того, чтобы модифицировать T-клеточный трансплантат ex vivo. В сущности, вирус модифицирует опухоль таким образом, что T-клеточный трансплантат может работать лучше.
Эффективная доза векторов зависит по меньшей мере от пациента, нуждающегося в лечении, типа опухоли, местоположения опухоли и стадии опухоли. Доза может варьировать, например, приблизительно от 1×108 вирусных частиц (VP) приблизительно до 1×1014 VP, в частности приблизительно от 5×109 VP приблизительно до 1×1013 VP и более конкретно приблизительно от 8×109 VP приблизительно до 1×1012 VP. В одном из вариантов осуществления онколитические аденовирусные векторы, кодирующие биспецифическое моноклональное антитело, вводят в количестве 1×1010-1×1014 вирусных частиц. В другом варианте осуществления изобретения доза находится в диапазоне приблизительно 5×1010-5×1011 VP.
Количество переносимых клеток также зависит от пациента, но типичные количества находятся в диапазоне 1×109-1×1012 клеток на инъекцию. Число инъекций также варьирует, но типичные варианты осуществления включают 1 или 2 раунда лечения через несколько (например 2-4) недель.
Любое другое лечение или комбинацию лечений можно использовать в дополнение к терапии по настоящему изобретению. В конкретном варианте осуществления способ или использование по изобретению дополнительно включает введение пациенту параллельной или последовательной лучевой терапии, моноклональных антител, химиотерапии или других лекарственных средств против рака или вмешательства (включая хирургическое).
Термины «лечить» или «увеличивать», а также их производные, в рамках изобретения, не обязательно подразумевают 100% или полное лечение или увеличение. Наоборот, существуют различные степени, которые специалист в данной области распознает в качестве имеющих потенциальную пользу или терапевтический эффект. В этом отношении, данные патентоспособные способы могут обеспечивать какое-либо количество увеличения эффекта T-клеточной терапии или какую-либо степень лечения или предотвращения заболевания.
На фиг. 1 и 7 проиллюстрированы способы и механизмы по настоящему изобретению.
Специалисту в данной области очевидно, что, по мере развития технологии, патентоспособную идею можно реализовать различными способами. Изобретение и его варианты осуществления не ограничены примерами, описанными выше, но могут варьировать в пределах объема формулы изобретения.
ПРИМЕРЫ
Материалы и способы
Животная модель B16-OVA: экспрессирующие овальбумин клетки B16 (B16-OVA) содержали в RPMI, 10% FBS, 5 мг/мл G418, 20 мМ L-глутамина, 1× раствор Pen/Strep (GIBCO). Иммунокомпетентным самкам мышей C57BL/6 в возрасте 4-7 недель имплантировали подкожно 2,5×105 клеток B16-OVA в 50 мкл RPMI, 0% FBS, в правый бок, одна опухоль на мышь. Приблизительно через 10 суток после имплантации опухоли (когда опухоли становились инъецируемыми, минимальный диаметр ~3 мм), мышей делили на группы и лечили в некоторых экспериментах шесть последовательных суток внутриопухолевыми инъекциями или 50 мкл PBS или 1×109 вирусных частиц (VP) онколитического аденовируса в 50 мкл PBS. В других экспериментах три инъекции выполняли в сутки 0, 2 и 4. Поскольку мышиные клетки не чувствительны к аденовирусу человека, множество внутриопухолевых инъекций вируса использовали для того, чтобы имитировать воспаление, индуцированное репликацией вируса (Blair et al., 1989).
Адоптивный перенос: в первые сутки i.t. лечения мыши также получали посредством адоптивного переноса в интраперитонеальную полость от 5×105 до 2×106 покоившихся в течение ночи CD8a-обогащенных и выращенных спленоцитов от мышей C57BL/6-Tg(TcraTcrb)1100Mjb/J (OT-1) в возрасте 4-8 недель, генетически сконструированных, чтобы иметь только овальбумин (OVA)-специфичные CD8 T-клеточные рецепторы, в 100 мкл RPMI, 0% FBS. Обогащение CD8a осуществляли с помощью мышиных CD8a (Ly-2) MicroBeads за 5 суток до переноса, по инструкциям производителя (Miltenyi Biotech, USA, № по каталогу 130-049-401). Обогащенные клетки увеличивали в числе в течение пяти суток в среде для лимфоцитов (RPMI, 10% FBS, 20 мМ L-глутамин, 1× раствор Pen/Strep, 15 мМ HEPES, 50 мкМ 2-меркаптоэтанола, 1 мМ пирувата Na) в присутствии рекомбинантного мышиного IL-2 (160 нг/мл) и растворимого антитела против CD3ε мыши (0,3 мкг/мл, Abcam, клон 145-2C11).
Обработка ткани для проточной цитометрии: мышей умерщвляли и селезенки, дренирующие лимфатические узлы и опухоли собирали в 1-10 мл RPMI, 10% FBS, а также брали кровь посредством терминального кровотечения из сердца в плевральную полость и переносили одноразовым шприцом в EDTA-содержащие микропробирки для центрифуги и обрабатывали для анализа: солидные ткани грубо диссоциировали скальпелем и измельчали в 10 мл одноразовом стерильном кончике пипетки в 5-10 мл лизирующего буфера ACK (150 мМ NH4Cl, 10 мМ KHCO3, 0,1 мМ EDTA, pH 7,2) и инкубировали при комнатной температуре (RT) в течение ~20 минут, после чего клетки осаждали на 1200 об./мин 5 мин +4°C, после чего клетки ресуспендировали в 1-10 мл RPMI, 10% FBS, в зависимости от оценочного количества клеток, и пропускали через 40 мкм стерильный фильтр для того, чтобы создавать раствор отдельных клеток. В некоторых экспериментах опухолевую ткань вместо этого обрабатывали непосредственно после разрезания скальпелем (перед добавлением ACK) в 1 мл общего объема протеазного коктейля (RPMI с добавлением коллагеназы типа A, H или P, Roche, по 1 мг/мл и бензоназы, 125 Ед/мл конечн. конц., Sigma, E1014-25KU) в течение 1-2 часов при 37°C, 5% CO2, после чего добавляли 10 мл лизирующего буфера ACK и клетки обрабатывали, как выше. 200 мкл цельной крови пипетировали в 5 мл ACK лизирующий буфер и обрабатывали, как выше. Клетки или инкубировали в течение ночи при 37°C, 5% CO2 или анализировали непосредственно с помощью иммуноокрашивания и проточной цитометрии.
Обработка ткани для анализа цитокинов: мышей умерщвляли и кусочки опухолей ~2-10 мм3 замораживали в 2 мл микропробирках для центрифуги на сухом льду и хранили при -80°C. Кусочки опухолей взвешивали и добавляли 200 мкл ледяного PBS. Кусочки гомогенизировали с помощью ротора Tissue Master 125, добавляли 1× коктейль ингибиторов протеаз (Sigma) и 0,1% BSA конечн. конц. и пробирки держали на льду. Гомогенат опухоли центрифугировали при 2000 об./мин 10 мин +4°C и супернатант анализировали с использованием цитокиновых бус CBA Flex Set (BD, USA) на BD FACSArray, по инструкциям производителя.
Эксперименты, подтверждающие изобретение
Эксперименты осуществляли в соответствии с главой о материалах и способах в этом раскрытии и в соответствии с экспериментальным разделом, описанным в публикации WO2014170389 (A1) и в предварительно опубликованных статьях (Parviainen et al. 2014, Tahtinen et al. 2015, Tahtinen et al. 2015).
Эксперимент 1 (лечение аденовирусом индуцирует сигналы опасности в опухолях):
Лечение 5/3 химерным аденовирусом Ad5/3-d24-GMCSF индуцировало сигналы опасности в опухолях B16.OVA. Связывание аденовирусных патоген-ассоциированных молекулярных паттернов (PAMP) с Toll-подобными рецепторами (TLR) на клетках-хозяевах индуцирует секрецию интерферона-гамма, связанную с активацией клеток иммунной системы и стимуляцией T-клеток, ведущей к быстрой активации врожденного и адаптивного иммунного ответа. Следовательно, аденовирус можно использовать для того, чтобы генерировать иммуногенный фенотип опухоли, который эффективно распознает иммунная система (фиг. 2).
Эксперимент 2 (аденовирус оказывает антииммуносупрессорные эффекты на микроокружение опухоли):
5/3 химерный аденовирус оказывал антииммуносупрессорные эффекты на микроокружение опухоли B16.OVA. Опухоли обладали высокой устойчивостью к атаке иммунной системы и даже большое число опухолеспецифических OT-I T-клеток не преодолевало опухолевую иммуносупрессию. Однако если мышей одновременно лечили 5/3 химерным аденовирусом, в опухолях возникала понижающая регуляция иммуносупрессорных молекул (таких как TIM-3) (фиг. 3).
Эксперимент 3 (одного снятия иммуносупрессии не достаточно для того, чтобы индуцировать направленную миграцию T-клеток в опухоли: необходимы BiTE):
Снятия иммуносупрессии не достаточно для того, чтобы индуцировать направленную миграцию T-клеток в опухоли B16.OVA. Внутриопухолевая инъекция 5/3 химерного аденовируса индуцировала CD8+ T-клетки в периферической крови, но эти клетки не инфильтрировали опухоли эффективно. Эта слабая миграция T-клеток, направленная на опухоль, подчеркивает недостатки онколитического аденовируса и адоптивной T-клеточной терапии, используемых в качестве отдельных средств, что подтверждает, что настоящее изобретение усиливает направленную миграцию адоптивно перенесенных T-клеток посредством BiTE-экспрессирующего онколитического аденовируса (фиг. 4).
Эксперимент 4 (аденовирус превосходит вирус осповакцины в отношении индукции клеточного противоопухолевого иммунитета; решающий признак для усиления адоптивной клеточной терапии)
Сравнение иммуногенности между аденовирусом (Ad) и вирусом осповакцины (VV). Уровни селезеночных и инфильтрирующих опухоль B16.OVA CD8+ T-клеток выше у мышей, которых лечили 5/3 химерным аденовирусом, по сравнению с мышами, которых лечили онколитическим вирусом осповакцины Western Reserve с двойной делецией (этот штамм использовали Yu et al Mol Ther 2014). Таким образом, онколитический аденовирус, по-видимому, представляет собой идеальную экспрессионную платформу для BiTe из-за присущей ему иммуногенности, в частности, в контексте адоптивной T-клеточной терапии. (фиг. 5)
Эксперимент 5 (аденовирус более эффективен, чем вирус осповакцины, в отношении индукции противоопухолевого иммунитета)
Мышам, несущим сингенные опухоли B16.OVA, инъецировали внутрь опухоли PBS, аденовирус или вирус осповакцины. Образцы клеток опухолей окрашивали T-клеточными рецепторами, обнаруживающими пентамер APC, которые специфичны к остаткам SIINFEKL овальбумина, и оценивали посредством проточной цитометрии (n=3). Данные указывали на изменение в противоопухолевых T-клетках после инъекции аденовируса или вируса осповакцины; аденовирус значительно более эффективен в отношении индукции противоопухолевого иммунитета (фиг. 6).
Эксперимент 6 (BiTE доставляли с помощью онколитического аденовируса, который нацелен на все классы T-клеток против опухолей, включая противовирусные T-клетки (которые в целом считают контрпродуктивными для терапии опухолей))
Кроме того, в настоящем изобретении используют обширный уже существующий T-клеточный иммунитет к Ad5 в популяциях человека, который обычно ограничивает клиническую полезность аденовирусных векторов. Поскольку TIL из опухолей, которые лечили аденовирусами, содержат как противоопухолевые, так и противовирусные T-клетки, CD3-scFV из BiTe будет активировать эти T-клетки независимо от их эндогенной специфичности (независимо от MHC I). Следовательно, опухолеспецифического уничтожения посредством этих T-клеток достигают с помощью scFV, специфичного к антигену поверхности опухолевой клетки (такому как мезотелин, EpCAM1, MUC1), и не ожидают наблюдать реактивность вне опухоли/вне мишени. Таким образом, этот подход перенаправляет все CD8+ TIL (противоопухолевые и противовирусные) в противоопухолевые T-клетки через связывание BiTe, продуцируемых вирусом (фиг. 7).
Эксперимент 7 (онколитический аденовирус, но не нереплицирующийся аденовирус, кодирующий функциональное антитело, ведет к эффективному продуцированию антител и высвобождению из клеток рака)
Клетки SKOV-3, BT-474 и 293 инфицировали указанными аденовирусами по 100 вирусных частиц (VP)/клетка и несколькими сутками позже анализировали экспрессию антител с помощью ELISA IgG человека (A) или вестерн-блоттинга (B). В каждый указанный момент времени после инфекции (A) онколитический вирус Ad5/3-d24-трастузумаб (серые и черные столбцы) демонстрировал высокое продуцирование функционального антитела из клеток рака яичников SKOV-3: уровни антител снижались в клеточном лизате (LYS) во время прогрессирующей инфекции и уничтожения клеток рака и демонстрировали значительное накопление в супернатанте (SN). (OV относится к Ad5/3-d24 и Ab относится к антителу трастузумаб) В отличие от этого, нереплицирующийся вирус Ad5/3-Ab не был способен продуцировать поддающееся обнаружению антитело в супернатанте, даже несмотря на то, что клеточный лизат демонстрировал признаки антитела в сутки 7 после инфекции (белые столбцы). Стоит отметить, что клетки, которые лечили нереплицирующимся Ad5/3-Ab вирусом, были жизнеспособными на всем протяжении эксперимента, что указывает на отсутствие секреции активного антитела клетками рака. (B) Супернатант клеток рака молочной железы BT-474 (слева) и эмбриональных клеток 293 человека (справа) анализировали посредством вестерн-блоттинга на 6 сутки после инфекции указанными вирусами. При восстанавливающих условиях тяжелую цепь (HC), легкую цепь (LC) и полноразмерное антитело, продуцируемые онколитическим вирусом Ad5/3-OV-Ab, визуализировали в супернатанте обеих клеточных линий, тогда как нереплицирующиеся вирусы Ad5-Ab и Ad5/3-Ab не могли демонстрировать высвобождение антител из клеток BT-474, которые не допускают их репликации. Для того чтобы подтверждать экспрессию антител с помощью нереплицирующегося вируса, авторы изобретения использовали эмбриональные клетки 293 человека (справа), которые допускают репликацию аденовирусов также с делецией E1A, после чего следовал лизис клеток и высвобождение антитела, легко обнаружимого с помощью вестерн-блоттинга. Нереплицирующийся контрольный вирус Ad5/3-Luc, кодирующий люциферазу, использовали в качестве отрицательного контроля. HC и LC обнаруживали с использованием поликлонального IgG козы против человека и антител осла против IgG козы-HRP, соответственно. Аффинность антител была ниже для LC, чем для HC, что давало более слабый сигнал. Столбцы представляют среднее значение ± SEM. **, P < 0,01; *, P < 0,05; все критерии Стьюдента (фиг. 8).
Эксперимент 8 (онколитический аденовирус, кодирующий антитело, демонстрирует более высокие внутриопухолевые, но при этом более низкие системные уровни антител, чем после системного лечения антителами)
Несущих подкожный ксенотрансплантат N87 рака желудка (Park et al. 1990) «голых»/NMRI мышей (n=5 на группу) лечили внутриопухолевыми инъекциями онколитического вируса Ad5/3-OV-Ab (2×108 VP/опухоль) или интраперитонеальными инъекциями коммерческого антитела (Ab; 0,3 мкг/г) в сутки 0, 4, 8 и 15. Осуществляли мониторинг здоровья животных и брали опухоли и образцы крови у мышей, умерщвленных в сутки 32 и 40 (системное Ab), сутки 46 (системное Ab и вирус Ad5/3-OV-Ab) и сутки 50 (вирус Ad5/3-OV-Ab). A) Опухоли и образцы крови в конечной точке измеряли посредством ELISA IgG человека для того, чтобы оценивать концентрацию антител: мыши, которых лечили Ad5/3-OV-Ab и умерщвляли в сутки 46 и 50 после лечения, демонстрировали все еще значительно более высокую концентрацию антител в опухолях (P < 0,001, слева), при этом показывая значительно более низкие циркулирующие уровни (P < 0,001, справа), по сравнению с мышами, которых лечили системным Ab, которых умерщвляли раньше в сутки 32, 40 и 46. B) Уровни антител в опухоли и образцах крови каждого индивидуального животного сравнивали с оценочным распределением антител. Усредненное соотношение антител в опухоли в сравнении с кровью было выше 1,0 у мышей, которых лечили вирусом Ad5/3-OV-Ab, тогда как лечение системным Ab давало очень низкое соотношение меньше чем 0,01. Таким образом, лечение с использованием онколитического вируса, экспрессирующего антитела, позволяет достигать усовершенствованной внутриопухолевой концентрации антител, при этом значительно снижая системную экспозицию у животных. Стоит отметить, что большинство мышей, которых лечили вирусом, выживали дольше (вплоть до 50 суток) и, следовательно, демонстрировали доказательство сохраняемого локального продуцирования антител. Величина ошибки представляет среднее±SEM. **, P < 0,01, критерий Стьюдента (фиг. 9).
Эксперимент 9 (экспрессия маркера истощения T-клеток и иммуносупрессорного рецептора TIM3 снижается после лечения онколитическим аденовирусом и коррелирует с усовершенствованной выживаемостью)
15 пациентов с запущенными солидными опухолями лечили онколитическими аденовирусами в контексте Advanced Therapy Access Program (Taipale et al. 2016). Опухолевые биоптаты базового уровня и после лечения анализировали с помощью РНК микрочипа (чип HumanHT-12 v4 Expression BeadChips, Illumina) и уровни экспрессии генов сравнивали для того, чтобы идентифицировать различно экспрессированные гены. T-клеточный иммуноглобулин муцин-3 (TIM3), который является маркером истощения и негативным регулятором как врожденного, так и адаптивного иммунного ответа в опухолях, был среди наиболее различно экспрессированных генов: TIM3 демонстрировал основную понижающую регуляцию у 5 пациентов (изменение более 1,0, Δ[log2]) и минорное снижение у 4 пациентов (усредненное изменение 0,38, Δ[log2]). Между тем, 6 пациентов не смогли продемонстрировать понижающую регуляцию TIM3, из которых два пациента демонстрировали повышающую регуляцию после лечения. Когда общую выживаемость сравнивали между этими группами, пациенты с понижающей регуляцией TIM3 (n=9) демонстрировали значительно усовершенствованную выживаемость (P=0,004, логранговый критерий) относительно пациентов без изменения/ с повышающей регуляцией TIM3 (n=6). Медианная выживаемость составляла 204 суток и 64 суток в группах понижающей и повышающей регуляции TIM3, соответственно. Таким образом, в двух третях случаев лечение онколитическим аденовирусом, похоже, ведет к снижению иммуносупрессорного рецептора и маркера истощения TIM3, что сильно коррелирует с пролонгированной общей выживаемостью (фиг. 10).
Эксперимент 10 (усовершенствованное уничтожение клеток in vitro с использованием комбинации TIL и онколитического аденовируса)
Клетки HapT1 инфицировали онколитическим аденовирусом (100 VP/клетка) в течение 3 суток перед добавлением HapT1 TIL. Жизнеспособность клеток-мишеней определяли через 24 часа после добавления TIL. Величина ошибки, SE. ****p<0,0001. Наилучшее уничтожение наблюдали, когда T-клетки стимулировали онколитическим аденовирусом (фиг. 11).
Эксперимент 11 (в отсутствие молекул BiTe, TIL, извлеченные из опухолей HapT1, не оказывают аддитивного эффекта на уничтожение клеток-мишеней в комбинации с онколитическими аденовирусами)
Клетки HapT1 высевали на 96-луночный планшет и инкубировали 5 суток с онколитическим аденовирусом Ad5/3-E2F-d24 отдельно или вооруженным IL-2 человека. TIL, извлеченные из развившихся опухолей HapT1, добавляли в клетки 10:1 за 24 ч до измерения жизнеспособности клеток с использованием анализа MTS. Синергизм между вирусами и TIL не наблюдали (фиг. 12).
Эксперимент 12 (превосходная литическая активность комбинации вирус+BiTE+PBMC)
SW480 опухолевые клетки высевали на 96-луночный планшет, 10 000 клеток/лунка и инкубировали в течение 24 ч. Клетки инфицировали вирусом Ad 5/3-E2F-d24-E3, 0,01, 0,1, 1, 10, 100 и 1000 вирусных частиц на клетку и 10 нг специфичного к CD3 человека направленного на EpCAM BiTE (Antihuman EpCam, № по каталогу CABT-33295MH) по меньшей мере в трех повторениях, 50 мкл/лунка в средах для анализа (L-15, FBS 2%, L-глутамин 2 мМ, пенициллин 100 Ед/мл и стрептомицин 100 мкг/мл). Эффекторные клетки (PBMC) добавляли в соотношении эффектора и мишени 5:1. В следующие сутки к клеткам добавляли 50 мкл 10% L-15. Через 48 ч после инфекции инфекционные среды заменяли на 100 мкл среды для выращивания, содержащей 10% CellTiter 96 AQueous One Solution (Promega, Madison, WI, USA) и инкубировали в течение двух часов. Поглощение считывали на 490 нм. Величина ошибки показывает SEM измерений в трех повторениях. Вирус+клетки в сравнении с Вирус+PBMC *P=0,0184, Вирус+клетки в сравнении с Вирус+PBMC+BiTE *** P=0,001 (фиг. 13A). Фиг. 13B: SW480 опухолевые клетки инфицировали с использованием 1000 VP вируса Ad 5/3-E2F-d24-E3 и 10 нг BiTE. Эффекторные клетки (PBMC) добавляли при соотношении эффектора и мишени 5:1. Анализ MTS использовали для того, чтобы определять жизнеспособность клеток через 48 часов после инфекции. Величина ошибки показывает SEM измерений в трех повторениях. Вирус+клетки в сравнении с Вирус+PBMC *P =0,0184, Вирус+клетки в сравнении с Вирус+BiTE+PBMC ***P=0,001.
Способ фракционных произведений
Способ фракционных произведений использовали для того, чтобы оценивать синергизм, этот способ разработан на основе способа, исходно созданного Webb (Webb J, 1963).

0,1 VP=1,245=синергический
1 VP=1,32=синергический
10 VP=1,2=синергический
100 VP=1,1=синергический
1000 VP=1,1=синергический
Легенда:
Синергический=соотношение больше чем 1
Аддитивный эффект=равно 1
Антагонизм=меньше чем 1
Результаты:
Эти находки показывают, что BiTE являются синергическими с онколитическим аденовирусом TILT.
Эксперимент 13 (эксперимент по жизнеспособности клеток in vitro, объединяющий Ad-BiTE и OT1 T-клетки на клетках B16-OVA-мишеней)
Клетки B16-OVA высевали на 96-луночные планшеты по 1×104 клеток/лунка и инфицировали с использованием 100 VP/клетка Ad-BiTE, T-клеток (соотношение эффектора и мишени 2:1) или и того и другого. Жизнеспособность клеток определяют через 24 часа посредством анализа MTS.
Эксперимент 14 (аденовируса или аденовируса, вооруженного IL-2, не достаточно для накопления T-клеток в опухолях)
Лечение аденовирусом комбинировали с адоптивным T-клеточным переносом и получали субоптимальную T-клеточную инфильтрацию в опухолях меланомы B16.OVA. Опухоли, собранные через 18 суток после начала лечения, подвергали проточному цитометрическому анализу на овальбумин-специфичные CD8+ T-клетки (OVA) и gp100-специфичные CD8+ T-клетки. OVA и gp100 представляют собой эпитопы, экспрессируемые на клетках меланомы. Различия между различными группами лечения не были статистически значимыми и не отличались от терапия только T-клетками (без вируса). Горизонтальные линии, средние значения (фиг. 14).
Эксперимент 15 (онколитические аденовирусы неспособны рекрутировать цитотоксические CD8+ T-клетки в опухоли)
Подкожные панкреатические опухоли хомяка (HapT1) лечили онколитическими аденовирусами Ad5/3-E2F-d24 отдельно или вооруженными IL-2 человека всего 5 раз в течение 19 суток. На 25 сутки животных умерщвляли, и опухолевые клетки метили перекрестно реактивным антителом против CD8b крысы, PE. (Число образцов: имитация и не вооруженные n=5, IL-2 n=1). Онколитический аденовирус в отдельности не способен рекрутировать Cd8 клетки в опухоль. IL-2 выглядел более перспективным, но увеличение не было значительным (фиг. 15).
Эксперимент 16 (повторная антигенная стимуляция иммунокомпетентных хомяков)
Хомяков, которых предварительно лечили не вооруженным онколитическим аденовирусом Ad5/3-E2F-d24 или аденовирусом, вооруженным цитокином (TNFα, IL-2 или оба), сопротивлялись опухоли того же типа (HapT1), но не другого типа (DDT1-MF2). Наивных животных, которые предварительно не встречались с какими-либо клеточными линиями, использовали в качестве контроля. Вооружать вирус молекулой, способной индуцировать противоопухолевый иммунитет (например, BITe), необходимо для индукции защитного иммунитета (признака вторичного иммунного ответа против опухолевых эпитопов) (фиг. 16).
Эксперимент 17 (эффект in vivo вооруженного или не вооруженного онколитического аденовируса, с использованием или без использования T-клеточной терапии)
Внутрь развившихся опухолей HapT1 инъецировали онколитический аденовирус Ad5/3-E2F-d24 (1×107 VP/опухоль) в сутки 1 и 8. В сутки 2 инфильтрирующие опухоль HapT1 лимфоциты, выращенные ex vivo (1,5×106 TIL/опухоль), вводили внутрь опухоли. Величина ошибки, SE. *p<0,05, **p<0,01. Наилучший противоопухолевый эффект наблюдали, когда опухоли лечили онколитическим вирусом и также давали TIL (фиг. 17).
Эксперимент 18 (результаты эксперимента с противоопухолевым эффектом in vivo, объединяющего перенос Ad-BiTE и OT1 T-клеток иммунокомпетентным мышам, несущим опухоли B16-OVA)
Подкожно имплантированные опухоли B16-OVA (0,25×106 клеток/опухоль) лечили одной интраперитонеальной инъекцией CD8-обогащенных OT1 T-клеток, внутриопухолевой инъекцией Ad-BiTE (1×109 VP/опухоль) или и тем и другим. Инъекции вируса повторяли каждые 7 суток (фиг. 18).
Эксперимент 19 (аденовирусная доставка цитокинов IL-2 и TNFα усиливает эффект адоптивной клеточной терапии: разумное объяснение для включения цитокинов в онколитический аденовирус, кодирующий BiTE)
Несущих опухоль B16-OVA мышей C57 лечили внутриопухолево с использованием 1×109 вирусных частиц вооруженных аденовирусов и интраперитонеально с использованием 1,5×106 CD8-обогащенных OT-1 T-клеток в сутки 1. Лечение вирусом продолжали каждые 7 суток (фиг. 19).
Эксперимент 20 (Новые конструкции вируса)
Авторы изобретения создавали новые онколитические Ad5/3 аденовирусы, несущие следующий остов: Ad5/3-E2F-D24-трансген. Трансгены находились в области удаленных E3 gp19k/6,7k. В векторах использовали следующие трансгены:
aМезотелин-aCD3
aEpCAM-aCD3
aMUC1-aCD3
aМезотелин-aCD3-IRES-IL-2
aМезотелин-aCD3-IRES-TNFα
aEpCAM-aCD3-IRES-IL-2
aEpCAM-aCD3-IRES-TNFα
aMUC1-aCD3-IRES-IL-2
aMUC1-aCD3-IRES-TNFα
(Фиг. 20 и 21)
Аденовирусные векторы на фиг. 20 или карты конструкций на фиг. 21 содержат нуклеотидные последовательности, содержащие, например, трансгены aМезотелин-aCD3 (SEQ ID № 9), aEpCAM-aCD3 (SEQ ID № 4) или aMUC1-aCD3 (SEQ ID № 8), перечисленные в таблице 2. Нуклеотидная последовательность вирусного вектора по настоящему изобретению содержит или состоит, например, из SEQ ID №№ 1, 2, 3, 5, 6, 9 (aМезотелин-aCD3-IRES-IL-2); SEQ ID №№ 1, 2, 3, 5, 6, 7 (aМезотелин-aCD3-IRES-TNFα); SEQ ID №№ 1, 2, 3, 4, 5, 6 (aEpCAM-aCD3-IRES-IL-2); SEQ ID №№ 1, 2, 3, 4, 5, 7 (aEpCAM-aCD3-IRES-TNFα); SEQ ID №№ 1, 2, 3, 5, 6, 8 (aMUC1-aCD3-IRES-IL-2); SEQ ID №№ 1, 2, 3, 5, 7, 8 (aMUC1-aCD3-IRES-TNFα). Аденовирусные векторы конструировали в соответствии с последовательностями, перечисленными в таблице 2. Основные способы конструирования аденовирусных векторов, также используемые для настоящего изобретения, хорошо известны специалисту в данной области и описаны, например, в Koski et al. 2010, Hemminki et al. 2015.
Таблица 2. Список последовательностей.
Литература
Blair GE, Dixon SC, Griffiths SA, Zajdel ME. Restricted replication of human adenovirus type 5 in mouse cell lines. Virus Res. 1989 Dec;14(4):339-46.
Ekkens MJ, Shedlock DJ, Jung E, Troy A, Pearce EL, Shen H, Pearce EJ. Th1 and Th2 cells help CD8 T-cell responses. Infect Immun. 2007 May;75(5):2291-6.
Hemminki, O., S. Parviainen, J. Juhila, R. Turkki, N. Linder, J. Lundin, M. Kankainen, A. Ristimaki, A. Koski, I. Liikanen, M. Oksanen, D. M. Nettelbeck, K. Kairemo, K. Partanen, T. Joensuu, A. Kanerva and A. Hemminki (2015). Immunological data from cancer patients treated with Ad5/3-E2F-Delta24-GMCSF suggests utility for tumor immunotherapy. Oncotarget 6(6): 4467-4481.
Kanerva A et al. 2005, Gene Therapy 12, 87-94.
Kanerva A et al. Clin Cancer Res. 2013 May 15;19(10):2734-44.
Koski, A., L. Kangasniemi, S. Escutenaire, S. Pesonen, V. Cerullo, I. Diaconu, P. Nokisalmi, M. Raki, M. Rajecki, K. Guse, T. Ranki, M. Oksanen, S. L. Holm, E. Haavisto, A. Karioja-Kallio, L. Laasonen, K. Partanen, M. Ugolini, A. Helminen, E. Karli, P. Hannuksela, S. Pesonen, T. Joensuu, A. Kanerva and A. Hemminki (2010). Treatment of cancer patients with a serotype 5/3 chimeric oncolytic adenovirus expressing GMCSF. Mol Ther 18(10): 1874-1884.
Kratky W, Reis e Sousa C, Oxenius A, Spörri R. Direct activation of antigen-presenting cells is required for CD8+ T-cell priming and tumor vaccination. Proc Natl Acad Sci U S A. 2011 Oct 18;108(42):17414-9.
Lugade AA, Sorensen EW, Gerber SA, Moran JP, Frelinger JG, Lord EM. Radiation-induced IFN-gamma production within the tumor microenvironment influences antitumor immunity. J Immunol. 2008 Mar 1;180(5):3132-9.
Park, J. G., H. Frucht, R. V. LaRocca, D. P. Bliss, Jr., Y. Kurita, T. R. Chen, J. G. Henslee, J. B. Trepel, R. T. Jensen, B. E. Johnson and et al. (1990). Characteristics of cell lines established from human gastric carcinoma. Cancer Res 50(9): 2773-2780.
Parviainen, S., M. Ahonen, I. Diaconu, M. Hirvinen, A. Karttunen, M. Vaha-Koskela, A. Hemminki and V. Cerullo (2014). CD40 ligand and tdTomato-armed vaccinia virus for induction of antitumor immune response and tumor imaging. Gene Ther 21(2): 195-204.
Propper DJ, Chao D, Braybrooke JP, Bahl P, Thavasu P, Balkwill F, Turley H, Dobbs N, Gatter K, Talbot DC, Harris AL, Ganesan TS. Low-dose IFN-gamma induces tumor MHC expression in metastatic malignant melanoma. Clin Cancer Res. 2003 Jan;9(1):84-92.
Schroder K, Hertzog PJ, Ravasi T, Hume DA. Interferon-gamma: an overview of signals, mechanisms and functions. J Leukoc Biol. 2004 Feb;75(2):163-89.
Street D, Kaufmann AM, Vaughan A, Fisher SG, Hunter M, Schreckenberger C, Potkul RK, Gissmann L, Qiao L. Interferon-gamma enhances susceptibility of cervical cancer cells to lysis by tumor-specific cytotoxic T cells. Gynecol Oncol. 1997 May;65(2):265-72.
Tahtinen, S., S. Gronberg-Vaha-Koskela, D. Lumen, M. Merisalo-Soikkeli, M. Siurala, A. J. Airaksinen, M. Vaha-Koskela and A. Hemminki (2015). Adenovirus Improves the Efficacy of Adoptive T-cell Therapy by Recruiting Immune Cells to and Promoting Their Activity at the Tumor. Cancer Immunol Res 3(8): 915-925.
Tahtinen, S., S. Kaikkonen, M. Merisalo-Soikkeli, S. Gronberg-Vaha-Koskela, A. Kanerva, S. Parviainen, M. Vaha-Koskela and A. Hemminki (2015). Favorable alteration of tumor microenvironment by immunomodulatory cytokines for efficient T-cell therapy in solid tumors. PLoS ONE 10(6): e0131242.
Taipale, K., I. Liikanen, J. Juhila, R. Turkki, S. Tahtinen, M. Kankainen, L. Vassilev, A. Ristimaki, A. Koski, A. Kanerva, I. Diaconu, V. Cerullo, M. Vaha-Koskela, M. Oksanen, N. Linder, T. Joensuu, J. Lundin and A. Hemminki (2016). Chronic Activation of Innate Immunity Correlates With Poor Prognosis in Cancer Patients Treated With Oncolytic Adenovirus. Mol Ther 24(1): 175-183.
Webb J. Effect of more than one inhibitor, antagonism, summation, and synergism. In: Webb J, ed. Enzyme and metabolic inhibitors. New York: Academic Press, 1963. 488-512.
Yu et al. 2014, Mol Ther 22(1):102-11.
| название | год | авторы | номер документа |
|---|---|---|---|
| РАСШИРЕННАЯ АДОПТИВНАЯ КЛЕТОЧНАЯ ТЕРАПИЯ | 2014 |
|
RU2703438C2 |
| АДЕНОВИРУСНЫЕ ВЕКТОРЫ И СПОСОБЫ И ПРИМЕНЕНИЯ, СВЯЗАННЫЕ С НИМИ | 2009 |
|
RU2520823C2 |
| Покрытые онколитические аденовирусы для противораковых вакцин | 2015 |
|
RU2695375C2 |
| ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2720984C2 |
| ОНКОЛИТИЧЕСКИЙ АДЕНОВИРУС ДЛЯ ЛЕЧЕНИЯ РАКА, ЕГО ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЕГО | 2010 |
|
RU2536931C2 |
| АДЕНОВИРУС, СОДЕРЖАЩИЙ АЛЬБУМИН-СВЯЗЫВАЮЩИЙ УЧАСТОК | 2015 |
|
RU2711371C2 |
| МОДИФИЦИРОВАННЫЕ ОНКОЛИТИЧЕСКИЕ АДЕНОВИРУСЫ | 2019 |
|
RU2788638C2 |
| РЕКОМБИНАНТНЫЙ АДЕНОВИРУС, КОТОРЫЙ СОДЕРЖИТ РИБОЗИМ, ОПОСРЕДУЮЩИЙ ТРАНС-СПЛАЙСИНГ, И ПРОТИВОРАКОВЫЙ ТЕРАПЕВТИЧЕСКИЙ ГЕН, И ЕГО ПРИМЕНЕНИЕ | 2012 |
|
RU2575620C2 |
| ТЕРАПИЯ РАКА | 2019 |
|
RU2827111C2 |
| ХИМЕРНЫЕ АДЕНОВИРУСЫ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2005 |
|
RU2448157C2 |

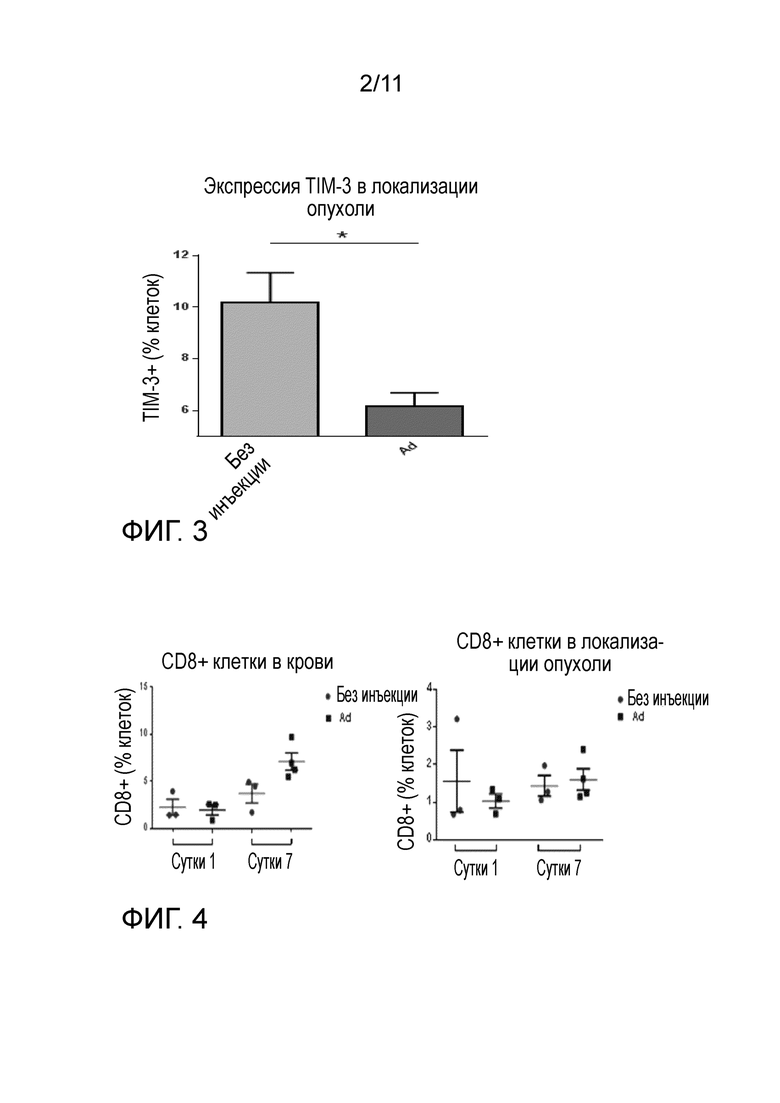
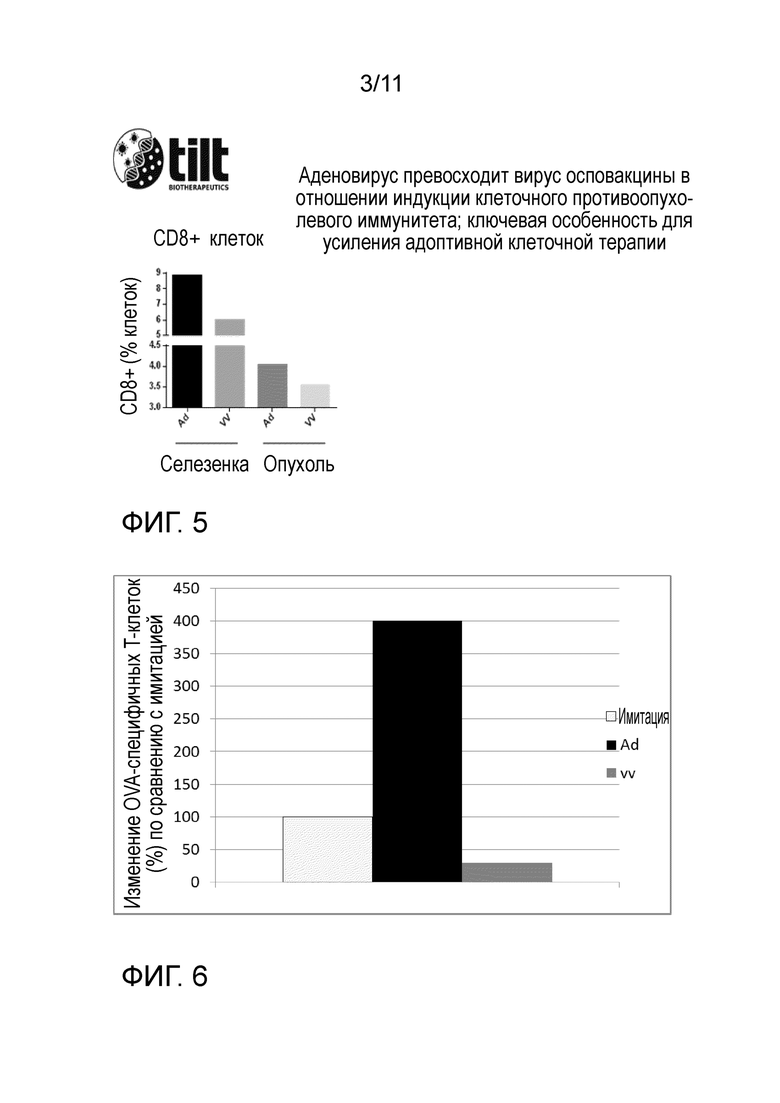
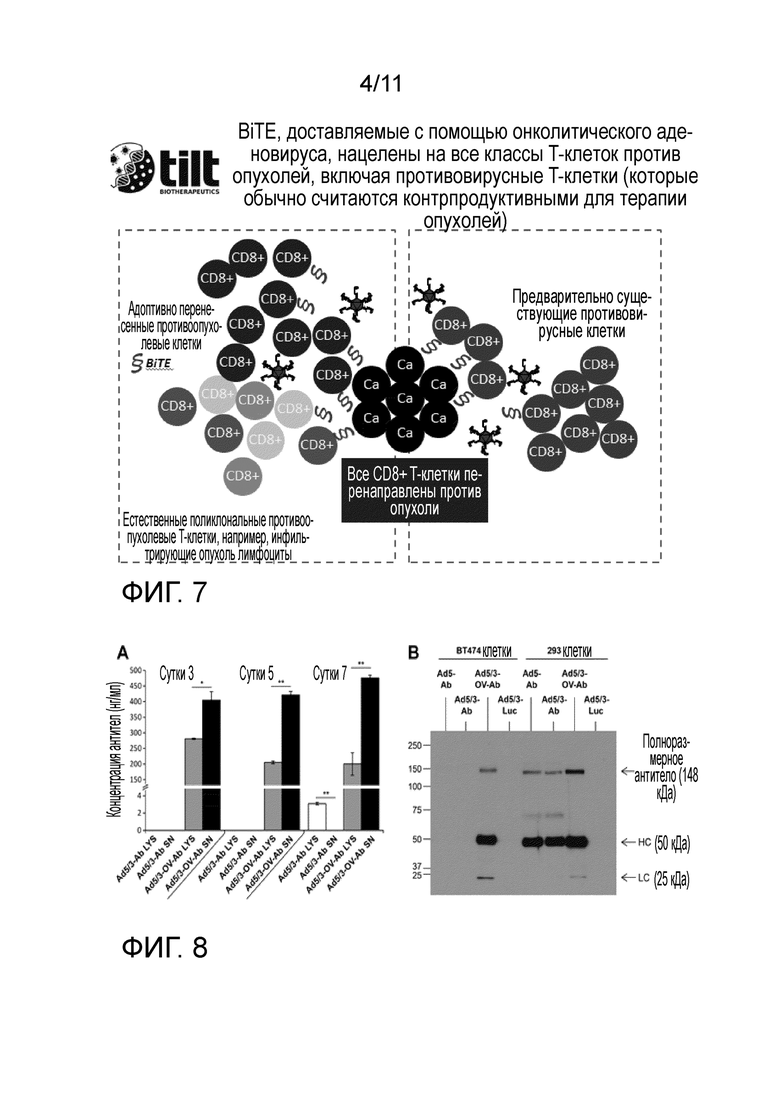

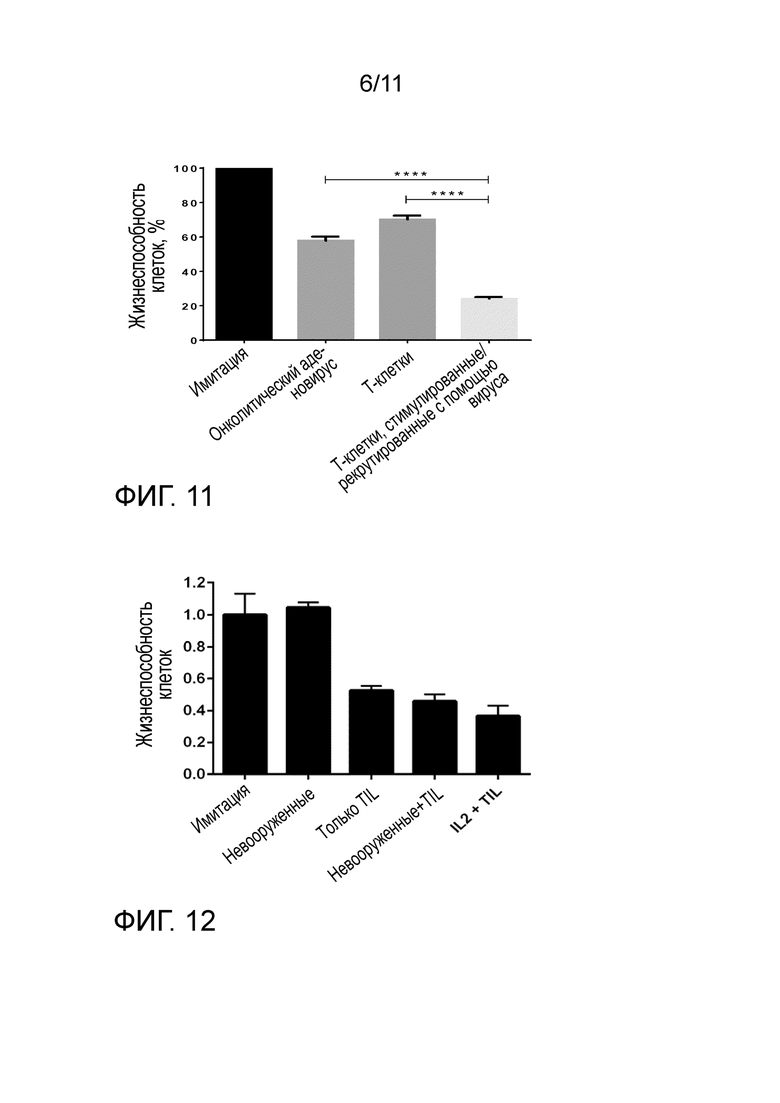
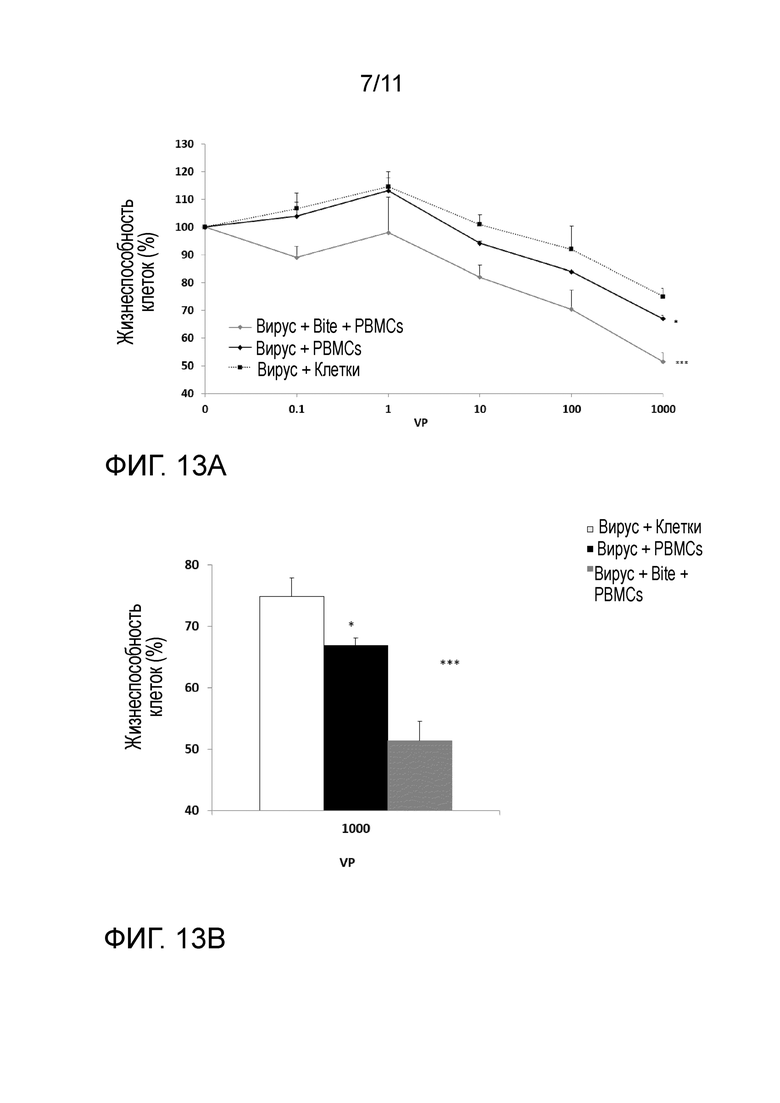
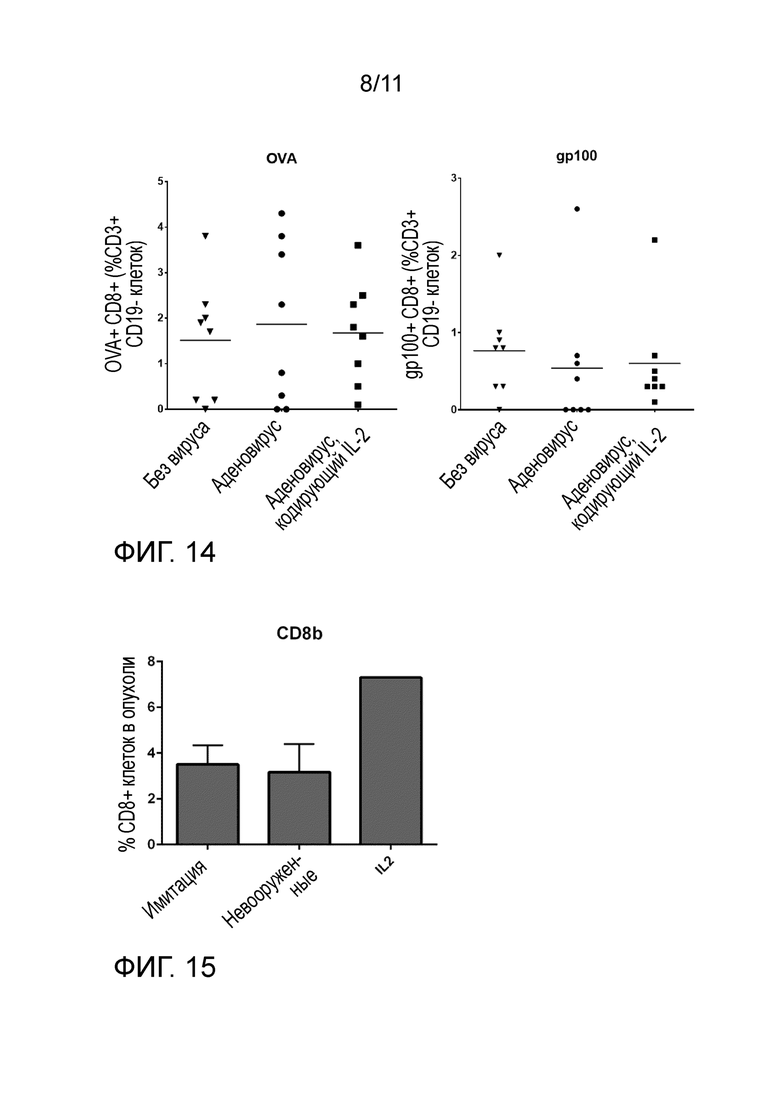
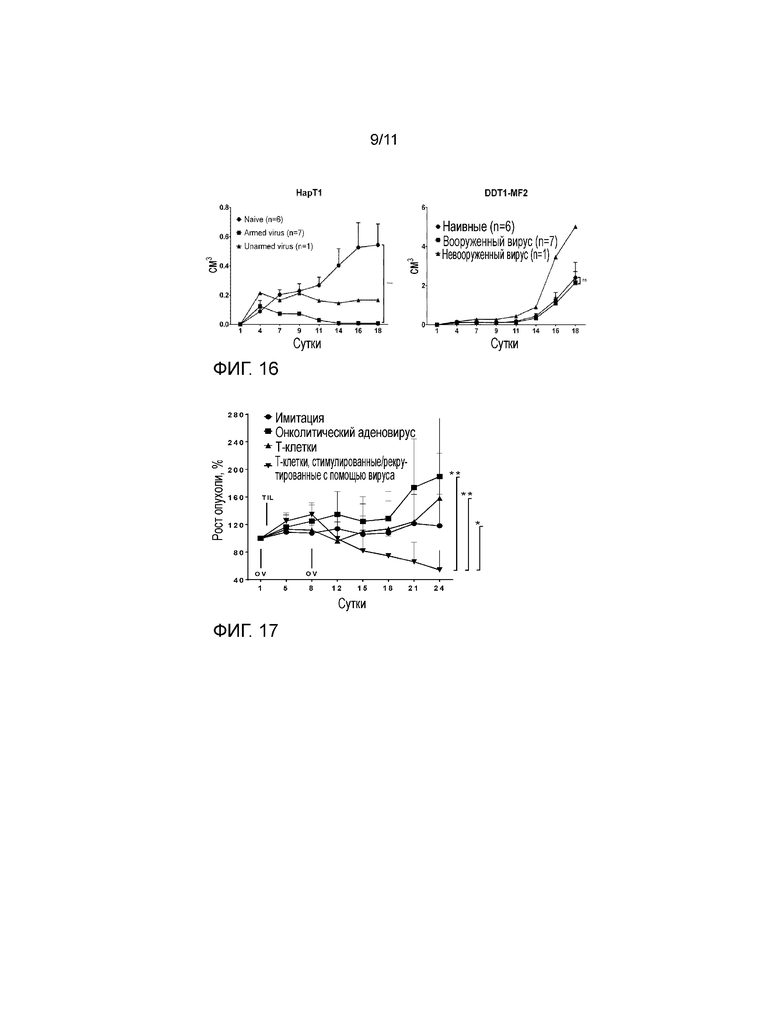
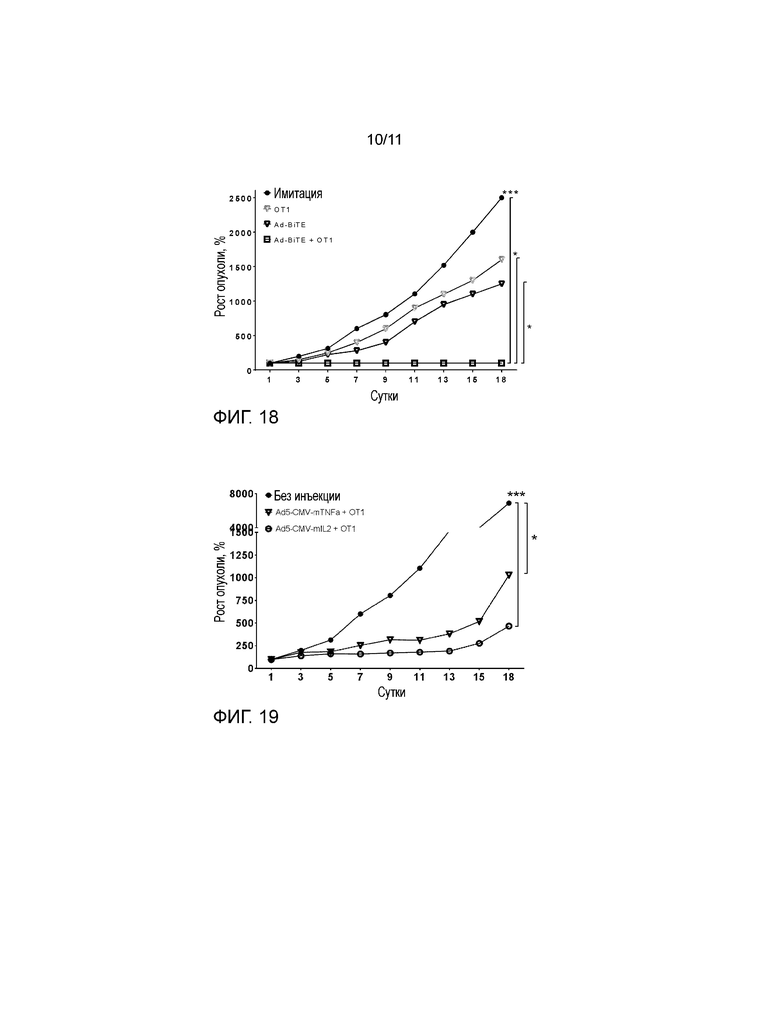
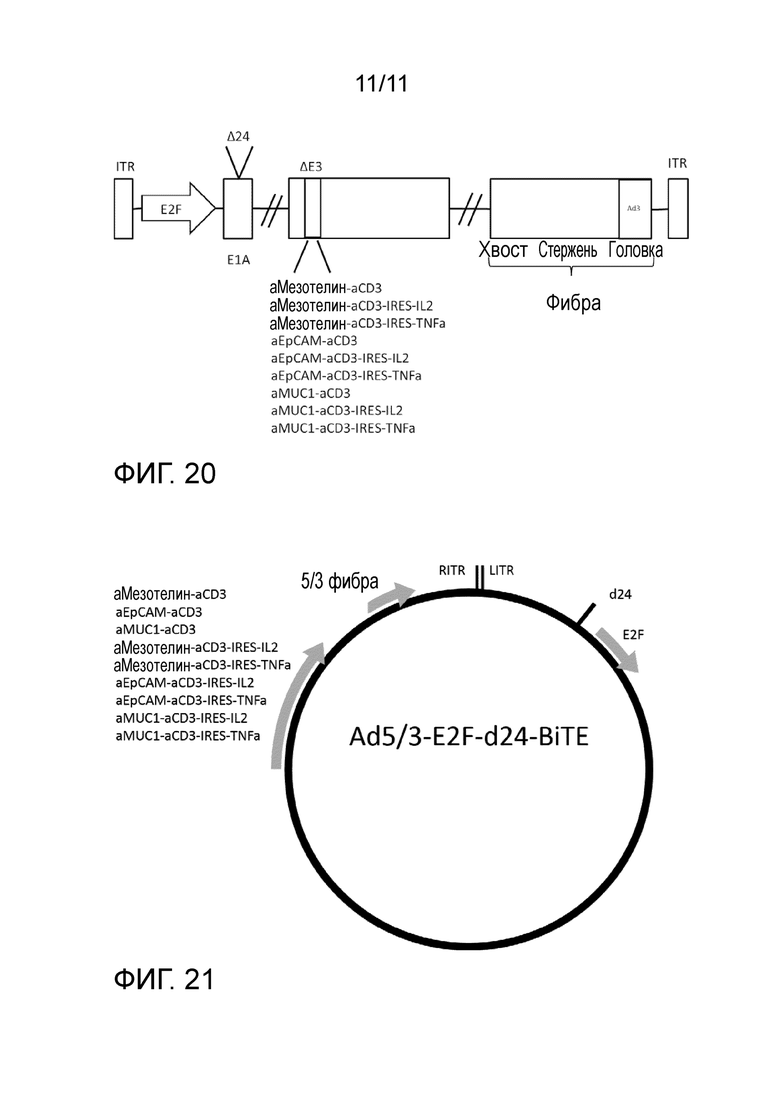
Изобретение относится к биотехнологии. Описан онколитический аденовирусный вектор, включающий делецию последовательности нуклеиновой кислоты в участке E3 и последовательность нуклеиновой кислоты, кодирующую биспецифическое моноклональное антитело, вместо удаленной последовательности нуклеиновой кислоты в участке E3, где биспецифическое моноклональное антитело содержит одноцепочечный вариабельный фрагмент (scFv), специфичный к молекуле клеточной поверхности на иммунологических эффекторных клетках, и scFv, специфичный к антигену опухоли, причем остов аденовирусного вектора представляет собой остов нуклеиновой кислоты аденовируса серотипа 5 (Ad5), и вектор дополнительно содержит головку фибры Ad3. Изобретение расширяет арсенал средств лечения рака и адаптивной клеточной терапии. 4 н. и 19 з.п. ф-лы, 21 ил., 2 табл.
1. Онколитический аденовирусный вектор, включающий
делецию последовательности нуклеиновой кислоты в участке E3 и
последовательность нуклеиновой кислоты, кодирующую биспецифическое моноклональное антитело, вместо удаленной последовательности нуклеиновой кислоты в участке E3, где биспецифическое моноклональное антитело содержит одноцепочечный вариабельный фрагмент (scFv), специфичный к молекуле клеточной поверхности на иммунологических эффекторных клетках, и scFv, специфичный к антигену опухоли, причем остов аденовирусного вектора представляет собой остов нуклеиновой кислоты аденовируса серотипа 5 (Ad5), и вектор дополнительно содержит головку фибры Ad3.
2. Онколитический аденовирусный вектор по п. 1, где вектор дополнительно содержит промотор E2F1 для опухолеспецифической экспрессии E1A.
3. Онколитический аденовирусный вектор по любому из пп. 1 или 2, где вектор дополнительно включает делецию 24 п.о. (D24) в Rb-связывающей константной области 2 аденовирусного E1.
4. Онколитический аденовирусный вектор по любому из пп. 1-3, в котором делеция последовательности нуклеиновой кислоты в участке E3 представляет собой делецию вирусных рамок считывания gp19k и 6,7k.
5. Онколитический аденовирусный вектор по любому из пп. 1-4, где вектор содержит:
1) промотор E2F1 для опухолеспецифической экспрессии E1A;
2) делецию 24 п.о. (D24) в Rb-связывающей константной области 2 аденовирусного E1;
3) делецию последовательности нуклеиновой кислоты вирусных рамок считывания gp19k и 6,7k и
4) последовательность нуклеиновой кислоты, кодирующую двухчастную молекулу, содержащую одноцепочечный вариабельный фрагмент (scFv), специфичный к молекуле клеточной поверхности, и scFv, специфичный к антигену опухоли, вместо удаленной последовательности нуклеиновой кислоты как определено в точке 3).
6. Онколитический аденовирусный вектор по любому из пп. 1-5, где молекула клеточной поверхности находится на T-лимфоцитах.
7. Онколитический аденовирусный вектор по любому из пп. 1-6, где антиген опухоли выбран из таблицы 1 или из группы, состоящей из мезотелина, EpCAM1 и MUC1.
8. Онколитический аденовирусный вектор по любому из пп. 1-7, где молекула клеточной поверхности выбрана из CD3, CD8 и CD4.
9. Онколитический аденовирусный вектор по любому из пп. 1-8, где антиген опухоли представляет собой мезотелин и молекула клеточной поверхности представляет собой CD3; антиген опухоли представляет собой EpCAM1 и молекула клеточной поверхности представляет собой CD3; или антиген опухоли представляет собой MUC1 и молекула клеточной поверхности представляет собой CD3.
10. Онколитический аденовирусный вектор по любому из пп. 1-9, где онколитический аденовирусный вектор кодирует два или больше трансгенов.
11. Онколитический аденовирусный вектор по любому из пп. 1-10, который дополнительно содержит трансген IL-2, TNFα или CD40L.
12. Фармацевтическая композиция для лечения рака, содержащая онколитический аденовирусный вектор по любому из пп. 1-11.
13. Применение онколитического аденовирусного вектора по любому из пп. 1-11 в лечении рака.
14. Применение по п. 13, в котором онколитический аденовирусный вектор используют вместе с адоптивной клеточной терапевтической композицией.
15. Способ лечения рака у пациента, включающий введение пациенту онколитического аденовирусного вектора по любому из пп. 1-11.
16. Способ по п. 15, в котором способ дополнительно включает введение пациенту адоптивной клеточной терапевтической композиции.
17. Способ по п. 16, где адоптивная клеточная терапевтическая композиция содержит клетки того типа, который выбран из группы, состоящей из инфильтрирующего опухоль лимфоцита (TIL), лимфоцитов с модифицированным T-клеточным рецептором и лимфоцитов с модифицированным химерным антигенным рецептором.
18. Способ по п. 16 или 17, в котором адоптивная клеточная терапевтическая композиция содержит клетки того типа, который выбран из группы, состоящей из T-клеток, CD8+ клеток, CD4+ клеток, NK-клеток, дельта-гамма T-клеток, регуляторных T-клеток и мононуклеарных клеток периферической крови.
19. Способ по любому из пп. 16-18, где адоптивная клеточная терапевтическая композиция содержит T-клетки.
20. Способ по любому из пп. 13-19, где злокачественную опухоль выбирают из группы, состоящей из назофарингеального рака, синовиального рака, гепатоцеллюлярного рака, рака почки, рака соединительных тканей, меланомы, рака легких, рака кишечника, рака ободочной кишки, рака прямой кишки, рака толстой кишки, рака головного мозга, рака горла, рака рта, рака печени, рака кости, рака поджелудочной железы, хориокарциномы, гастриномы, феохромоцитомы, пролактиномы, T-клеточного лейкоза/лимфомы, невромы, болезни Гиппеля-Линдау, синдрома Золлингера-Эллисона, рака надпочечника, анального рака, рака желчных протоков, рака мочевого пузыря, рака мочеточника, рака головного мозга, олигодендроглиомы, нейробластомы, менингиомы, опухоли спинного мозга, рака кости, остеохондромы, хондросаркомы, саркомы Юинга, рака неизвестной первичной локализации, карциноида, карциноида желудочно-кишечного тракта, фибросаркомы, рака молочной железы, болезни Паджета, рака шейки матки, рака толстой кишки, рака прямой кишки, рака пищевода, рака желчного пузыря, рака головы, рака глаза, рака шеи, рака почки, опухоли Вильмса, рака печени, саркомы Капоши, рака предстательной железы, рака легких, рака яичек, болезни Ходжкина, неходжкинской лимфомы, рака рта, рака кожи, мезотелиомы, множественной миеломы, рака яичников, эндокринной рака поджелудочной железы, глюкагономы, рака поджелудочной железы, рака паращитовидной железы, рака пениса, рака гипофиза, саркомы мягких тканей, ретинобластомы, рака тонкой кишки, рака желудка, рака тимуса, рака щитовидной железы, трофобластной рака, пузырного заноса, рака матки, рака эндометрия, рака влагалища, рака вульвы, акустической невромы, фунгоидного микоза, инсулиномы, карциноидного синдрома, соматостатиномы, рака десны, рака сердца, рака губы, рака оболочек головного мозга, рака рта, рака нерва, рака неба, рака околоушной железы, рака брюшины, рака глотки, плевральной рака, рака слюнной железы, рака языка и рака миндалины.
21. Способ по любому из пп. 13-20, где введение(я) онколитических вирусных векторов и адоптивной клеточной терапевтической композиции пациенту проводят одновременно или последовательно, в любом порядке.
22. Способ по любому из пп. 13-21, который дополнительно включает введение пациенту параллельной или последовательной лучевой терапии, моноклональных антител, химиотерапии или других лекарственных средств против рака или вмешательств.
23. Способ увеличения эффекта адоптивной клеточной терапии у пациента посредством введения пациенту онколитического аденовирусного вектора по любому из пп. 1-11, где пациенту вводили адоптивную клеточную терапию или он подлежит ее введению.
| WO 2014170389 A1, 23.10.2014 | |||
| WO 2013114367 A9, 08.08.2013 | |||
| WO 2009106096 A1, 03.09.2009 | |||
| СВЯТЧЕНКО В.А | |||
| и др | |||
| Онколитические аденовирусы в терапии злокачественных новообразований: современное состояние и песпективы, Молекулярная биология, т.46, N4, 2012, c.556. |
Авторы
Даты
2020-07-06—Публикация
2016-03-17—Подача