Изобретение относится к биотехнологии и медицине, а именно к созданию нового способа использования хондральных клеток для скринирования веществ, обладающих противовоспалительной активностью.
Остеоартрит (OA) и ревматоидный артрит (РА) - социально значимые заболевания, связанные с воспалительным процессом в суставах, которые приводят к разрушению и деформации суставной поверхности и, в конечном итоге, к инвалидности в 70% случаев. В настоящее время научные исследования сосредоточены на выявлении цитокинов и медиаторов, ответственных за развитие вышеупомянутых заболеваний [1, 2]. К провоспалительным цитокинам относятся ИЛ-1 бета, ИЛ-6, ИЛ-8, ИЛ-15, ИЛ-17, ИЛ-18, ФНО-альфа и другие. Противовоспалительным действием обладают цитокины ИЛ-4, ИЛ-10, ИЛ-13 и другие. Особая роль в патогенезе данных заболеваний отводится таким цитокинам как Интерлейкин-6 (ИЛ-6) и ФНО-альфа [1-5].
В последние годы сделан огромный прогресс в лечении артрита с помощью ФНО-альфа ингибиторов. Показано, что ФНО-альфа играет ключевую роль в патогенезе таких заболеваниях как ревматоидный артрит, анкилозирующий спондилоартрит, болезнь Крона, псориаз, рефрактерная астма и другие. Эти заболевания, часто приводящие к инвалидности, успешно лечат моноклональными антителами против ФНО-альфа такими как инфликсимаб (Remicade), адалимумаб (Humira), этанерцепт (Enbrel), цертолизумаб пегол (Cimzia), голимумаб (Simponi) и др. В случае ревматоидного артрита, ФНО-альфа ингибиторы позволяют добиться ремиссии заболевания за счет ингибирования экспрессии провоспалительных медиаторов и цитокинов, что способствует уменьшению интенсивности деструктивных процессов в суставе и приводит к предотвращению инвалидности. IL-6 ингибиторы: тосилизумаб (Tocilizumab), сарилумаб (Sarilumab), олокизумаб (Olokizumab) и другие также представляют огромный интерес для лечения артритов.
Успех ФНО-альфа и ИЛ-6 ингибирующих лекарств вызвал бум исследовательских работ в поиске новых препаратов [5-7]. С этой целью возникла необходимость создания оптимизированных клеточных тест-систем для поиска новых и сравнения биоэквивалентных ингибиторов провоспалительных цитокинов. Кроме этого, именно клеточные системы in vitro рекомендованы FDA и ЕМА для мониторинга антагонистов ФНО-альфа ингибиторов в крови пациентов [8, 9].
Известен клеточный метод iLite Bioassay (Biomonitor, Copenhagen, Denmark) для оценки антагонистов ФНО-альфа ингибиторов в сыворотке пациентов [10]. Для этого сыворотку пациента смешивают с фиксированным количеством рекомбинантного ФНО-альфа и после смесь добавляют к генноинженерно сконструированной бессмертной культуре человеческих лейкемических клеток К562, несущих репортерную конструкцию NFkappaB-люцифераза. ФНО-альфа, добавленный к клеткам, инициирует внутриклеточную NFkB-зависимую экспрессию каскада генов, включая встроенный репортер-ген, кодирующий фермент люциферазы светлячка. При этом активность ФНО-альфа ингибитора в сыворотке пациента напрямую коррелирует с клеточной люминисценцией.
Недостатком этой клеточной системы является ограниченный поиск только ФНО-альфа ингибиторов, действующих через сигнальную молекулу NFkB. В то время как известна активация трех сигнальных каскадов - NFkappaB, МАРК и ФНО-альфа индуцируемая клеточная гибель. Перекрестная активация этих сигналов в клетках различного происхождения затрудняет интерпретацию результатов при поиске новых лекарственных препаратов для лечения артритов и оценки их терапевтического эффекта.
ФНО-альфа ингибиторы остаются лидирующими препаратами в лечении воспалительных процессов в хрящевой ткани. Использование первичной культуры человеческих клеток, выделенных из хрящевой ткани неоспоримо эффективнее для поиска и оценки лекарственных препаратов, чем использование клеток животных или бессмертных (т.е. с измененным фенотипом онкогенных) культур клеток человека.
Известен клеточный метод определения ФНО-альфа ингибиторов с использованием первичной культуры человеческих хондроцитов, изолированных из суставной поверхности бедренного мыщелка взрослых доноров [11, 12]. ФНО-альфа ингибитор смешивают с фиксированным количеством рекомбинантного ФНО-альфа, затем смесь добавляют к первичной культуре человеческих хондроцитов прошедших 1-3 пассажа (Р1-3). Изменение в экспрессии цитокинов-мишеней оценивают с помощью РТ-ПЦР.
Недостатком является низкое качество и ограниченное количество хондроцитов, выращенных из тканей взрослых доноров. Хондроциты получают от больных перед аутологической имплантацией им хондроцитов или из тканей трупов [11]. Количество биоматериала для аутологической имплантации ограниченно, качество биоматериала от взрослых доноров опосредованно патолого-возрастными изменениями. Хондроциты взрослых доноров способны проходить только ограниченное количество пассажей (Р1-3). Низкое количество пассажей хондроцитов (Р1-3) приводит к наличию клеточного дебриса, и к невозможности создания мастер-банка однородной культуры клеток, необходимого для скрининга большого количеста новых ФНО-альфа ингибиторов. Такого рода ограничения приводят к необоснованной дороговизне и недостаточной эффективности клеточной тест-системы. Данный способ взят нами за прототип.
Целью нашего изобретения является создание нового способа использования хондральных клеток для скринирования веществ, обладающих противовоспалительной активностью. Эта цель достигается тем, что в качестве культуры человеческих клеток используют хондробласты, полученные из гиалиновой хрящевой ткани пальцев шестипалых младенцев, обладающие высоким индексом пассирования Р 1-20, однородностью клеточного монослоя при отсутствии клеточного дебриса, способностью отвечать на ФНО-альфа индукцию и ФНО-альфа ингибирование после криоконсервации.
В качестве источника хрящевой ткани мы используем суставную поверхность гиалиновой межфаланговой ткани пальцев шестипалых младенцев с врожденной полидактилией. Данная хрящевая ткань младенцев не обладает патолого-возрастными изменениями в отличие от биоматериала, используемого в патенте, взятом за прототип. Нами проведено сравнение характеристик клеток, выделенных из суставной поверхности гиалиновой межфаланговой хрящевой ткани пальцев шестипалых младенцев с хондроцитами, описанными в вышеупомянутом патенте, взятом за прототип (Таблица 1).
Как видно из Таблицы 1 в нашем способе и прототипе используются разные фенотипы клеток за счет выделения из разных источников хрящевой ткани: ювенильные хондробласты в нашей тест ситеме и хондроциты взрослых в патенте US. Индекс пассирования у хондробластов, используемых в нашем способе, на порядок выше по сравнению с хондроцитами прототипа - их возможно пересаживать до 20-го пассажа. На ранних пассажах (Р 1-2) любая первичная клеточная культура неоднородна и загрязнена клеточным дебрисом, что снижает ее качества для скрининга. При множественном пассировании клеточная культура ходробластов в нашем способе становится однородной, без клеточного дебриса (Фиг. 1), что обеспечивает высокую эффективность скринирования новых лекарственных веществ.
Возможность длительного пассирования хондробластов приводит к возможности криоконсервации клеточного материала и созданию мастер-банка, что делает данные клетки сопоставимыми с бессмертной культурой клеток и позволяет скринировать большие библиотеки новых веществ с противовоспалительной активностью.
Недостатком метода, взятого за прототип, является ограниченное количество пассажей хондроцитов, присутствие возрастных деструктивных процессов в хрящах взрослых доноров и наличие дебриса в монослое клеток на ранних пассажах, что не позволяет создать мастер банк однородных клеток необходимый для скринирования больших библиотек лекарственных веществ. Кроме этого, в патенте, взятом за прототип, права ограничены методом оценки только ФНО-альфа ингибиторов.
Способ использования хондральных клеток для скринирования веществ, обладающих противовоспалительной активностью, включает смешивание исследуемого противовоспалительного вещества с фиксированным количеством индуктора воспаления, в частности, рекомбинантного ФНО-альфа, и добавления этой смеси к культуре человеческих клеток хондральной этиологии с последующим измерением экспрессии биологического маркера, отличающийся тем, что в качестве культуры человеческих клеток используют хондробласты, полученные из гиалиновой хрящевой ткани пальцев шестипалых младенцев, обладающие высоким индексом пассирования Р1-20, однородностью клеточного монослоя при отсутствии клеточного дебриса, способностью изменять экспрессию цитокинов на ФНО-альфа индукцию и ФНО-альфа ингибирование после криоконсервации.
Способ иллюстрируется лабораторными примерами.
Мы первыми показали, что хондробласты поздних пассажей, полученные из гиалиновой хрящевой ткани пальцев шестипалых младенцев, после криоконсервации не теряют способности изменять экспрессию провоспалительного цитокина-мишени ИЛ-6 в ответ на ФНО-альфа индукцию и ФНО-альфа ингибирование. На Фигуре 2 показано изменение ИЛ-6 экспрессии в ответ на ФНО-альфа индукцию и ФНО-альфа ингибирование в хондробластах 6-го пассажа. Хондробласты были выделены из гиалинового хряща донора №3 и пассированы в культуральных флаконах до 6-го пассажа. Как видно из Фиг. 2, контрольные хондробласты, растущие без добавления ФНО-альфа, имеют минимальную экспрессию ИЛ-6 (контроль). Хондробласты, инкубированные 18 часов с ФНО-альфа (10 нг/мл), показывают значительное увеличение экспрессии ИЛ-6 (ФНОα). Смесь ФНО-альфа (10 нг/мл) с ФНО-альфа ингибитором МАВ (моноклональные антитела к ФНО-альфа в концентрации 10 нг/мл), добавленная к хондробластам на 18 часов, значительно ингибирует экспрессию ИЛ-6 (ФНО + МАВ 10 нг/мл).
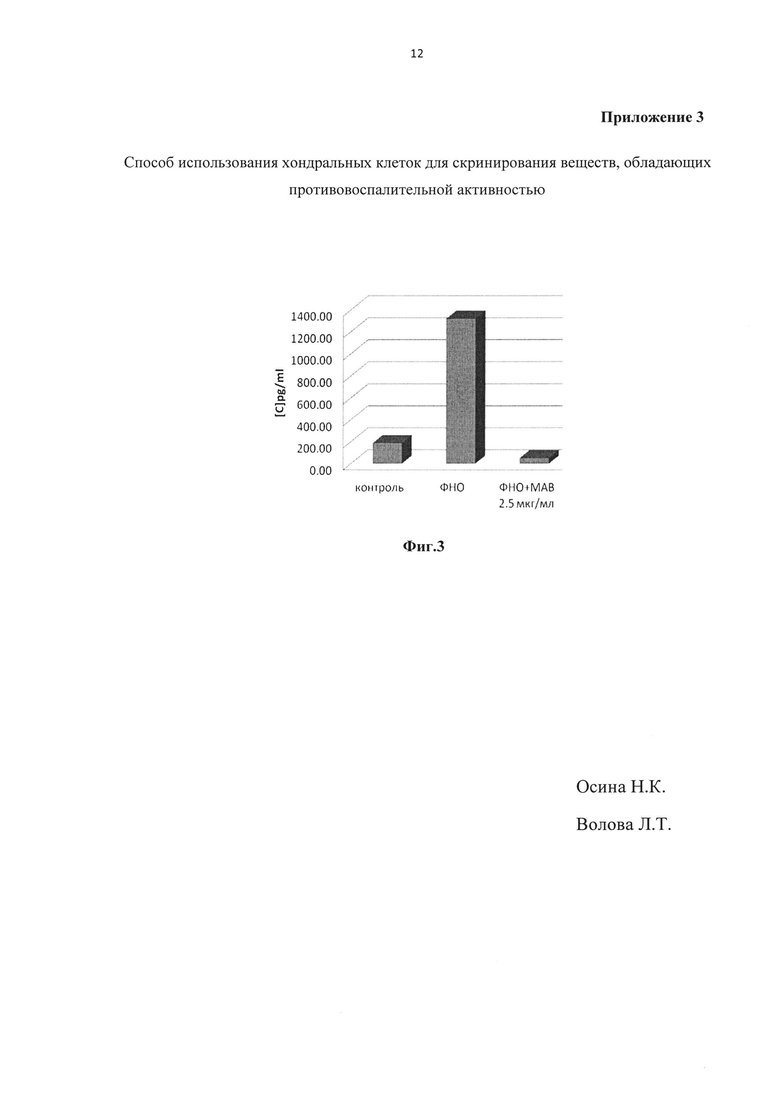
На Фигуре. 3 показано изменение ИЛ-6 экспрессии в ответ на ФНО-альфа индукцию и ФНО-альфа ингибирование в хондробластах того же донора №3 на более позднем 9-ом пассаже после криоконсервации. Хондробласты 6-го пассажа были криоконсервированы в виде мастер-банка при -80 С. Перед использованием в эксперименте клетки были разморожены и пассированы во флаконах до 9-го пассажа. Как следует из Фиг. 3, способность хондробластов изменять экспрессию маркера ИЛ-6 в ответ на ФНО-альфа индукцию и ФНО-альфа ингибирование сохраняется после множественного пассирования и криоконсервации. Размороженные контрольные хондробласты позднего пассажа (пассаж 9), растущие без добавления ФНО-альфа, имеют минимальную экспрессию ИЛ-6 (контроль). Хондробласты, инкубированные 18 часов с ФНО-альфа (10 нг/мл) показывают значительное увеличение экспрессии ИЛ-6 (ФНОα). Смесь ФНО-альфа (10 нг/мл) с ФНО-альфа ингибитором МАВ (моноклональные антитела к ФНО-альфа в концентрации 2,5 мкг/мл, добавленная к хондробластам на 18 часов, полностью ингибирует экспрессию ИЛ-6 до контрольного уровня (ФНО + МАВ 2,5 мкг/мл). Экспериментальные данные подтверждают возможность использования хондробластов из мастер-банка для скринирования веществ с противовоспалительной активностью.
Для подтверждения того, что хондробласты разных доноров имеют способность изменять экспрессию ИЛ-6 в ответ на ФНО-альфа индукцию и ФНО-альфа ингибирование, были протестированы хондробласты от 5 доноров, полученные из гиалиновой хрящевой ткани пальцев шестипалых младенцев (Фиг. 4). В качестве ФНО-альфа ингибитора использовали коммерчески доступный лекарственный препарат (ЛП) Энбрел (Файзер). ФНО-альфа ингибитор Энбрел в двух концентрациях ([С1] 2.5 мкг/мл и [С2] 25 нг/мл) смешивали с фиксированным количеством рекомбинантного ФНО-альфа (10 нг/мл) и затем смесь добавляли к первичной культуре человеческих хондробластов от разных доноров. Изменение экспрессии ИЛ-6 (пг/мл) оценивали с помощью ИФА ИЛ-6 (Вектор-Бест). Как видно на фиг.4, экспрессия ИЛ-6 в хондробластах от всех 5 доноров напрямую коррелирует с присутствием ФНО-альфа в культуральной среде хондробластов. Метод позволяет тестировать ингибирующий эффект лекарственного препарата Энбрел (ЛП) в концентрации от 25 нг/мл до 2.5 мкг/мл. Таким образом, на примере хондробластов от 5 доноров показана воспроизводимая и титруемая экспрессия цитокина-мишени ИЛ-6 в ответ на ФНО-альфа индукцию и ФНО-альфа ингибирование (Фиг. 4).
Наш метод разработан на основе ФНО-альфа индуцируемого измерения ИЛ-6 в культуральной среде с применением коммерчески доступного ИФА-ИЛ-6 (Вектор-Бест). При этом мы оставляем право предполагать, что индукция воспаления может быть достигнута с помощью любого провоспалительного индуктора: биологической или механической природы. Также с учетом литературных данных, демонстрирующих, что человеческие клетки хондральной этиологии в ответ на воспаление способны изменять экспрессию многих генов (например IL-1, IL-8, IL-10, IL-15, IL-17, IL-18, IL-20, IL-21, IFN-gamma, VCAM-1, TIMP2, ММР1, ММР3, ММР13, и др.), мы оставляем за собой право утверждать, что наш способ может быть использован для оценки изменения экспрессии любых других биологических маркеров с помощью различных молекулярно-биологических методов (ИФА, ПЦР, гибридизация и др.) с использованием данных первичных хондробластов.
Способ может быть применен для скрининга новых лекарственных препаратов с противовоспалительной активностью, включая ФНО-альфа и ИЛ-6 ингибиторы; для доклинического тестирования веществ с противовоспалительной активностью, для сравнения биоэквивалентных ФНО-альфа и ИЛ-6 ингибиторов (биосимиляров); для контроля качества противовоспалительных препаратов в процессе их производства и для оценки нейтрализующих ФНО-альфа антител в сыворотке пациентов.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Wojdasiewicz Р, Poniatowski  Szukiewicz D. The role of inflammatory and antiinflammatory cytokines in the pathogenesis of osteoarthritis. Mediators Inflamm. 2014; 2014:561459.
Szukiewicz D. The role of inflammatory and antiinflammatory cytokines in the pathogenesis of osteoarthritis. Mediators Inflamm. 2014; 2014:561459.
2. Burska A, Boissinot M, Ponchel F. Cytokines as Biomarkers in Rheumatoid Arthritis. Mediators of Inflammation. 2014; 2014:545493.
3. B.J. de Lange-Brokaar, A. Ioan-Facsinay, G.J. van Osch et al., "Synovial inflammation, immune cells and their cytokines in osteoarthritis: a review," Osteoarthritis Cartilage, 2012; 20(12):1484-1499.
4. Kim GW, Lee NR, Pi RH, Lim YS, Lee YM, Lee JM, Jeong HS, Chung SH. IL-6 inhibitors for treatment of rheumatoid arthritis: past, present, and future. Arch Pharm Res. 2015; 38(5):575-84.
5. Wang P, Zhu F, Konstantopoulo K. Interleukin-6 Synthesis in Human Chondrocytes Is Regulated via the Antagonistic Actions of Prostaglandin (PG)E2 and 15-deoxy-D12,14-PGJ2.PLoSOne. 2011; 6(11): e27630
6. Willrich MA, Murray DL, Snyder MR. Tumor necrosis factor inhibitors: clinical utility in autoimmune diseases. Transl Res. 2015; 165(2):270-82.
7. Melagraki G, Ntougkos E, Rinotas V, Papaneophytou C, Leonis G, Mavromoustakos T, Kontopidis G, Douni E, Afantitis A, Kollias G. Cheminformatics-aided discovery of small-molecule Protein-Protein Interaction(PPI) dual inhibitors of Tumor Necrosis Factor (TNF) and Receptor Activator of NF-κВ Ligand (RANKL). PLoS Comput Biol. 2017 Apr 20; 13(4).
8. https://www.fda.gov/downloads/drugs/guidances/ucm3 38856.pdf
9. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2012/06/WC500128688.pdf
10. Lallemand C, Kavrochorianou N, Steenholdt C, Bendtzen K, Ainsworth MA, Meritet JF, Blanchard B, Lebon P, Taylor P, Charles P, Alzabin S, Tovey MG. Reporter gene assay for the quantification of the activity and neutralizing antibody response to TNFα antagonists. J Immunol Methods. 2011 Oct 28; 373(1-2):229-39.
11. US 20140140994 A1 Cell-based assay for assessing tnf alpha inhibitors
12.  Blejec A(3), Kregar Velikonja N. Gene expression of cultured human chondrocytes as a model for assessing neutralization efficacy of soluble TNFα by TNFα antagonists. Biologicals. 2015 May; 43(3):171-80.
Blejec A(3), Kregar Velikonja N. Gene expression of cultured human chondrocytes as a model for assessing neutralization efficacy of soluble TNFα by TNFα antagonists. Biologicals. 2015 May; 43(3):171-80.
Приложение 1

| название | год | авторы | номер документа |
|---|---|---|---|
| Гемотест-система | 2023 |
|
RU2829654C1 |
| СПОСОБ ВОСПОЛНЕНИЯ ДЕФЕКТОВ СУСТАВНОГО ХРЯЩА | 2008 |
|
RU2383310C1 |
| КЛЕТОЧНЫЙ ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ДЕСТРУКТИВНО-ДИСТРОФИЧЕСКИХ ЗАБОЛЕВАНИЙ И ТРАВМАТИЧЕСКИХ ПОВРЕЖДЕНИЙ СУСТАВНОГО ХРЯЩА | 2008 |
|
RU2402339C2 |
| КЛЕТОЧНЫЙ ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ И ТРАВМАТИЧЕСКИХ ПОВРЕЖДЕНИЙ СУСТАВНОГО ХРЯЩА | 2008 |
|
RU2402340C2 |
| СПОСОБ ВЫРАЩИВАНИЯ РЕТИКУЛЯРНЫХ КЛЕТОК ЧЕЛОВЕКА | 2009 |
|
RU2410426C2 |
| Способ получения гиалинового хряща | 2016 |
|
RU2627817C1 |
| ПРИМЕНЕНИЕ ХЕМОКИНА CXCL6 В ПРЕДОТВРАЩЕНИИ ИЛИ ВОССТАНОВЛЕНИИ ХРЯЩЕВЫХ ДЕФЕКТОВ | 2004 |
|
RU2363491C2 |
| СПОСОБ СТИМУЛЯЦИИ РОСТА ФИБРОБЛАСТОВ В КУЛЬТУРЕ | 2005 |
|
RU2287013C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДОНОРСКИХ ХОНДРОЦИТОВ | 2009 |
|
RU2409662C2 |
| РАСТВОРЫ И СПОСОБЫ ИНГИБИРОВАНИЯ БОЛИ, ВОСПАЛЕНИЯ И РАЗРУШЕНИЯ ХРЯЩА | 2000 |
|
RU2271825C2 |



Изобретение относится к биотехнологии и медицине. Раскрыт способ скрининга веществ, обладающих противовоспалительной активностью, включающий смешивание исследуемого вещества с фиксированным количеством человеческого ФНО-альфа и добавление этой смеси к культуре клеток хондрального ряда с последующим измерением экспрессии биологического маркера. При этом в качестве культуры человеческих клеток используют хондробласты, полученные из гиалиновой хрящевой ткани пальцев шестипалых младенцев после множественного пассирования до 20-го пассажа, обладающие однородностью клеточного монослоя при отсутствии клеточного дебриса и способностью отвечать на ФНО-альфа индукцию и ФНО-альфа ингибирование после криоконсервации. Изобретение обеспечивает высокую эффективность скрининга новых лекарственных средств за счет использования однородной культуры хондробластов без клеточного дебриса. 4 ил., 1 табл., 1 пр.
Способ скрининга веществ, обладающих противовоспалительной активностью, включающий смешивание исследуемого вещества с фиксированным количеством человеческого ФНО-альфа и добавление этой смеси к культуре клеток хондрального ряда с последующим измерением экспрессии биологического маркера, отличающийся тем, что в качестве культуры человеческих клеток используют хондробласты, полученные из гиалиновой хрящевой ткани пальцев шестипалых младенцев после множественного пассирования до 20-го пассажа, обладающие однородностью клеточного монослоя при отсутствии клеточного дебриса и способностью отвечать на ФНО-альфа индукцию и ФНО-альфа ингибирование после криоконсервации.
| US 20140140994 A1, 22.05.2014 | |||
| JP 2001089390 A, 03.04.2001 | |||
| WO 9409118 A1, 28.04.1994 | |||
| EA 201691260 A1, 28.02.2017. |
Авторы
Даты
2019-03-27—Публикация
2018-03-02—Подача