ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает композицию для лечения и профилактики доброкачественной гиперплазии простаты. Более конкретно, настоящее изобретение предлагает композицию, содержащую пептид, полученный из теломеразы, где композиция предназначена для лечения и профилактики доброкачественной гиперплазии простаты.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Доброкачественная гиперплазия простаты (BPH) представляет собой наиболее распространенное возрастное заболевание мужчин, которое сопровождается ухудшением функционирования мочевыводящих путей. Симптомы, связанные с данным заболеванием, начинают появляться в возрасте после 40 лет, однако большинство клинических симптомов регистрируют у пациентов старше 50. Снижение качества жизни, наблюдающееся при BPH, может вызывать нарушение половой функции, кроме того, на половую функцию может влиять лечение BPH и хирургическое вмешательство по поводу BPH.
Гиперплазия, вызывающая BPH, зависит от мужских половых гормонов. В частности, мужские половые гормоны необходимы для нормальной пролиферации клеток простаты, а также для ингибирования нормального апоптоза. Наиболее известной эндогенной причиной данного заболевания является старение. Простата увеличивается в процессе старения и при нормальном функционировании семенников. Как мужской половой гормон, от которого зависит функционирование простаты, тестостерон играет важную роль в регуляции роста и дифференциации простаты и метаболизируется под действием 5-альфа-редуктазы с образованием дигидротестостерона (DHT), который играет важную роль в регуляции роста простаты и экспрессии генов.
К экзогенным причинам относятся мужские половые гормоны, эстроген, глюкокортикоиды и вещества, родственные ферментам внутренней секреции, индуцируемые диетой и условиями окружающей среды. Физиологические эффекты указанных экзогенных причин опосредуются пептидами факторов роста разных видов.
У мужчин в возрасте от 20 до 50 лет может встречаться BPH, характеризующаяся гистологическими изменениями, индуцируемыми синергическим действием мужских половых гормонов и эстрогена. С возрастом увеличивается отношение эстроген/DHT и вероятность развития BPH.
Кроме того, широко известно, что простата растет до 20 с небольшим лет и затем поддерживает свой размер до 50, используя очень сложные механизмы, включающие в себя эндогенные факторы роста, сигнальные пути, регуляцию клеточных циклов, деление клеток и апоптоз. Изменение среди факторов, регулирующих клеточный цикл, может индуцировать развитие BPH.
Генетический фактор может вносить основной вклад в развитие BPH. Описано, что среди пациентов с семейным анамнезом BPH встречаемость BPH составляет более 60%, и что лечение ингибитором 5α-редуктазы является менее эффективным в группе пациентов с семейным анамнезом BPH. Это можно объяснить тем, что развитие BPH опосредуется механизмами, в которых не участвуют андрогены.
Для лечения BPH можно использовать хирургические и терапевтические методы. Терапевтические методы включают в себя введение лекарственных средств, скорректированное с учетом возраста и клинического состояния пациента. В последнее время в Корее и во всем мире значительно увеличилось число пациентов с BPH, кроме того, увеличилась встречаемость заболевания среди молодых пациентов. Для лечения используют разные лекарственные средства, однако их применение ограничивается побочными эффектами.
Сулпирид представляет собой антагонист рецептора допамина типа 2, который широко используют в качестве депрессорного лекарственного средства. Допамин, образующийся в качестве промежуточного продукта в процессе синтеза адреналина и норадреналина, представляет собой ингибиторный нейромедиатор. Сулпирид ингибирует связывание допамина с его рецептором, которое, в свою очередь, ингибирует секрецию пролактина в рамках допаминергического эффекта, и повышает концентрацию пролактина в крови. Повышение концентрации пролактина в результате продолжительного введения сулпирида вызывает гиперпролактинемию.
Показано, что пролактин связан с пролиферацией простаты, раком простаты, а также с развитием и регуляцией BPH. Кроме того, известно, что пролактин в сочетании с андрогеном увеличивает пролиферацию простаты. Также известно, что пролактин, участвуя в другом механизме, действует как гормон стресса, повышая экспрессию 5α-редуктазы, и индуцирует пролиферацию простаты. Пролактин, который представляет собой один из нестероидных факторов, участвует в пролиферации простаты и индукции BPH. С возрастом уровень пролактина увеличивается, а уровень тестостерона уменьшается. Описано, что пролактин индуцирует BPH у пожилых людей. Показано, что у крыс и людей пролактин участвует в пролиферации и дифференциации простаты. В соответствии с данной работой полагают, что пролактин индуцируется рецепторами, участвующими в путях передачи сигнала.
[Документ известного уровня техники]
[Патентный документ]
KR 2011-0062943 A
KR 2011-0057049 A
EP 1020190 A3
[Не патентный документ]
MCCONNELL, John D., et al. 'The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with Benign Prostate Hyperplasia', New England Journal of Medicine, 1998, Vol.338, No.9, pp.557-563.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Таким образом, авторы настоящего изобретения предпринимают попытки получить композицию для лечения и профилактики BPH, которая оказывает минимальные побочные эффекты и превосходный лечебный эффект, чем и завершают настоящее изобретение.
Авторы настоящего изобретения обнаружили, что пептид, полученный из теломеразы, позволяет проводить лечение и профилактику BPH с высокой эффективностью, чем и завершили настоящее изобретение.
Целью настоящего изобретения является получение композиции, способной вносить вклад в лечение и профилактику BPH.
РЕШЕНИЕ ПРОБЛЕМЫ
Для решения вышеуказанной технической проблемы настоящее изобретение предлагает композицию для лечения и профилактики BPH, которая содержит пептид с последовательностью SEQ ID NO:1 или его фрагмент (далее обозначаемый здесь "PEP1", "GV1001" или "GV"), или последовательность, на 80% или более гомологичную SEQ ID NO:1.
Указанный фрагмент, входящий в состав композиции для лечения и профилактики BPH настоящего изобретения, может содержать 3 или более аминокислот.
Содержание пептида в композиции для лечения и профилактики BPH настоящего изобретения может составлять от 0,01 мг до 1 мг, предпочтительно 0,56 мг (4 нмоль пептида/кг массы тела).
Композиция для лечения и профилактики BPH настоящего изобретения может представлять собой фармацевтическую композицию.
Композиция для лечения и профилактики BPH настоящего изобретения может представлять собой пищевую композицию.
В соответствии с другим вариантом осуществления настоящее изобретение предлагает способ лечения и профилактики BPH путем введения композиции для лечения и профилактики BPH индивидууму, нуждающемуся в таком введении.
В способе лечения и профилактики BPH настоящего изобретения введение композиции можно осуществлять 3 раза в неделю.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Композиция настоящего изобретения, которая содержит пептид с последовательностью SEQ ID NO:1, или последовательность, на 80% или более гомологичную указанной последовательности, обеспечивает лечение и профилактику BPH с превосходной эффективностью и минимальными побочными эффектами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 приведены фотографии, изображающие процесс удаления органов-мишеней с целью измерения их массы.
На фиг. 2 приведены фотографии результатов электрофореза в эксперименте, подтверждающем эффект PEP1 при лечении BPH, которые демонстрируют влияние экспресии 5α-редуктазы в вентральной доле простаты каждой экспериментальной группы, установленное с использованием ОТ-ПЦР.
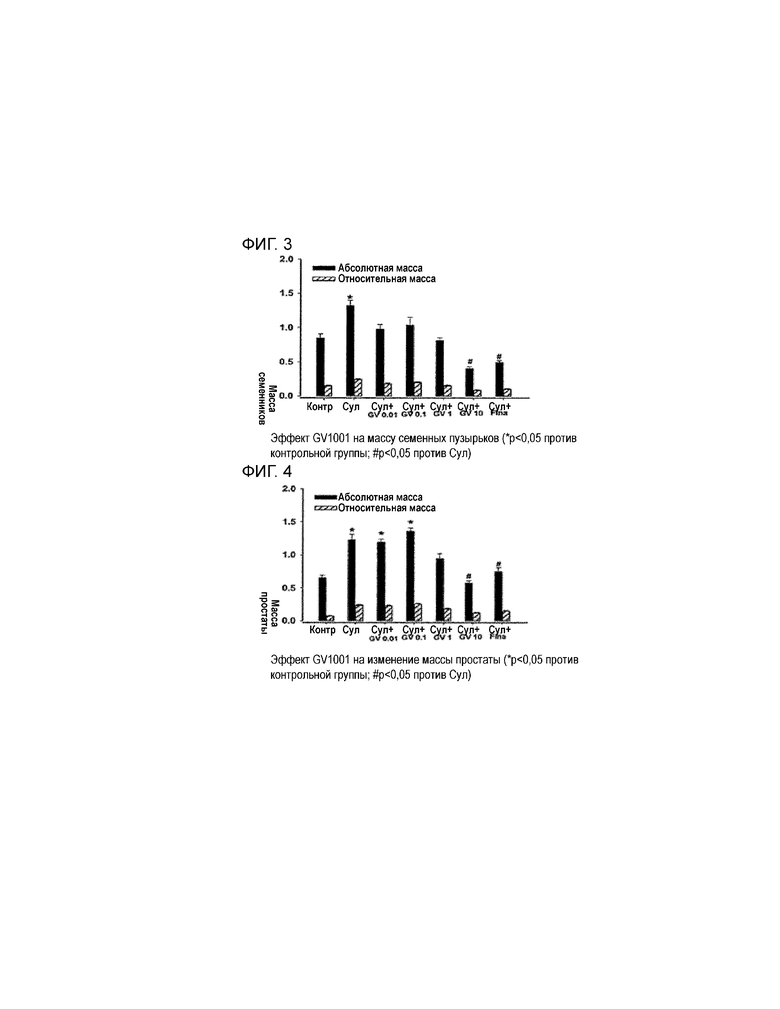
На фиг. 3 приведен график, демонстрирующий результаты эксперимента по подтверждению эффекта PEP1 при лечении BPH, который включает в себя измерение массы семенных пузырьков в каждой экспериментальной группе.
На фиг. 4 приведен график, демонстрирующий результаты эксперимента по подтверждению эффекта PEP1 при лечении BPH, который включает в себя измерение массы простаты в каждой экспериментальной группе.
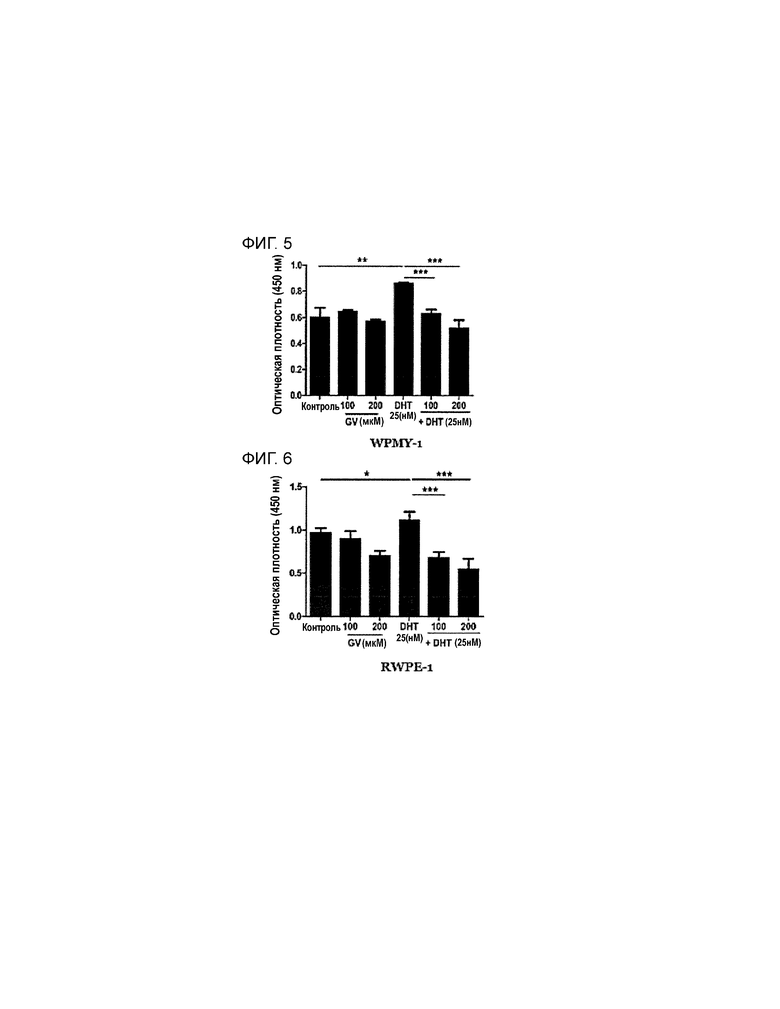
На фиг. 5 приведен график, демонстрирующий уровень пролиферации стромальной клеточной линии животной модели BPH (WPMY-1), получающей лечение PEP1.
На фиг. 6 приведен график, демонстрирующий уровень пролиферации эпителиальной клеточной линии животной модели BPH (RWPE-1), получающей лечение PEP1.
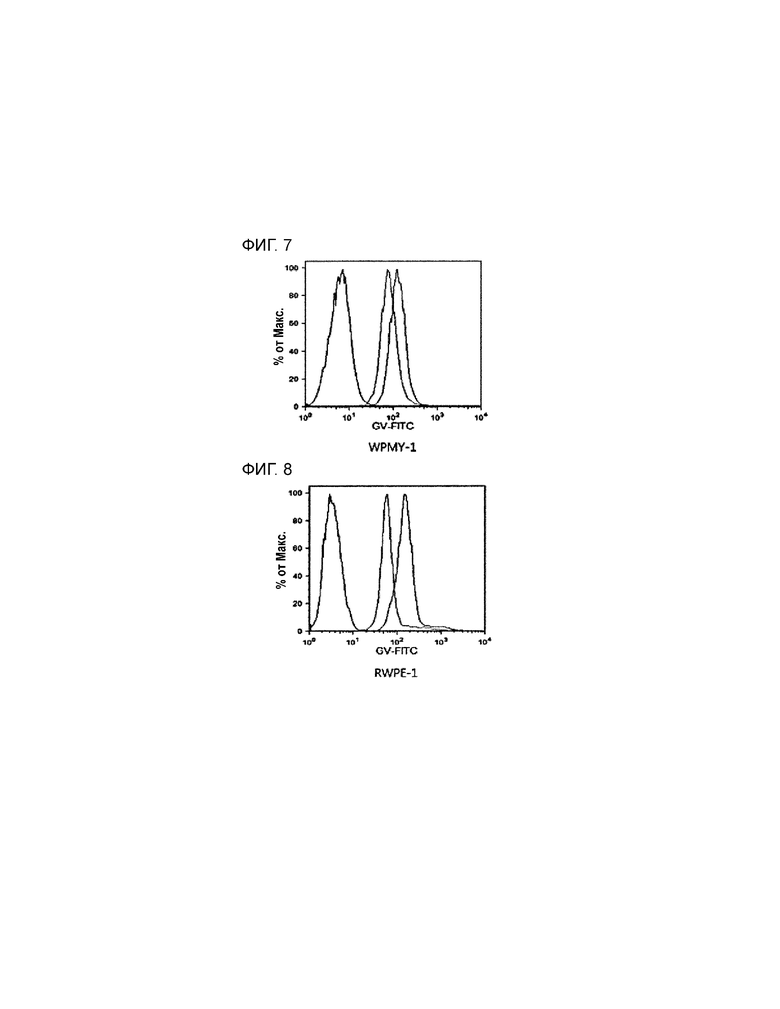
На фиг. 7 приведен график, демонстрирующий способность PEP1 связываться с рецептором андрогенов, измеряемую с использованием конъюгата PEP1-FITC (флуоресцеинизотиоцианат), в стромальной клеточной линии животной модели индуцированной BPH (WPMY-1).
На фиг. 8 приведен график, демонстрирующий способность PEP1 связываться с рецептором андрогенов, измеряемую с использованием конъюгата PEP1-FITC (флуоресцеинизотиоцианат), в эпителиальной клеточной линии животной модели BPH (RWPE-1).
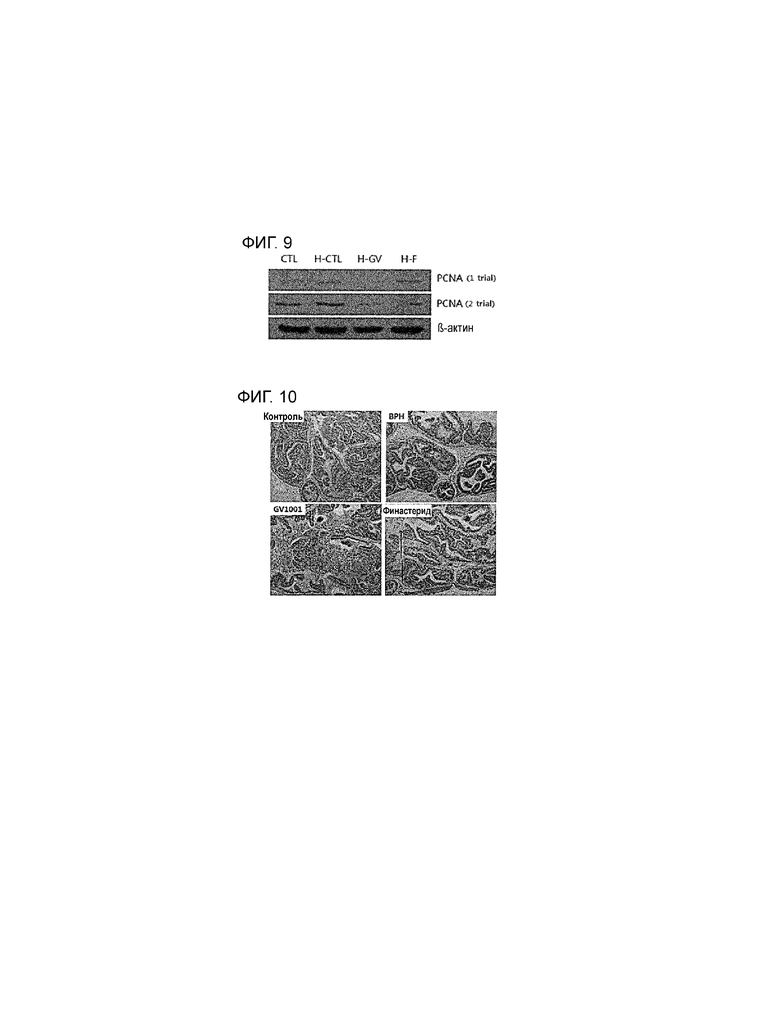
На фиг. 9 приведена фотография результатов электрофореза, демонстрирующая влияние PEP1 на экспрессию PCNA (ядерный антиген пролиферирующих клеток), которая у модели индуцированной BPH осуществляется на повышенном уровне.
На фиг. 10 приведена фотография результатов иммуноокрашивания, демонстрирующая влияние PEP1 на экспрессию Ki67 (MK67), которая у модели индуцированной BPH осуществляется на повышенном уровне.
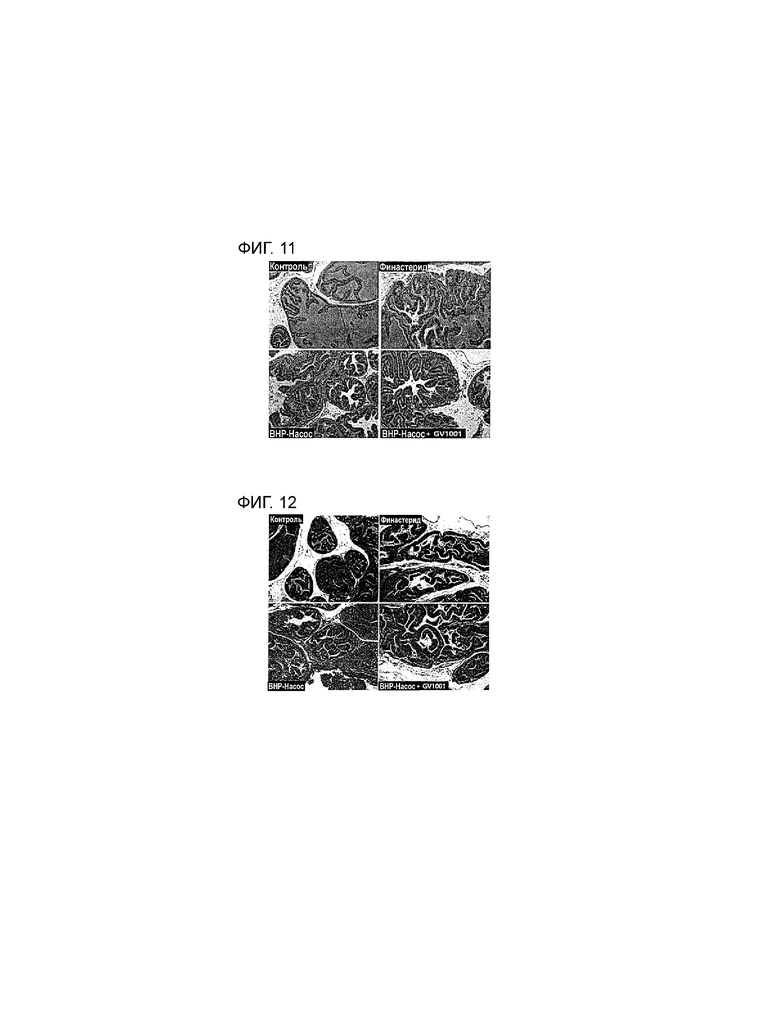
На фиг. 11 приведена фотография результатов эксперимента, проводимого на животных моделях BPH с использованием окрашивания H&E, которые демонстрируют влияние PEP1 на клетки, родственные тканям BPH.
На фиг. 12 приведена фотография результатов эксперимента, проводимого на животных моделях BPH с использованием окрашивания трихромом по Массону, которые демонстрируют влияние PEP1 на клетки, родственные тканям BPH.
На фиг. 13 приведен график, демонстрирующий изменение массы тела животных в эксперименте, включающем в себя измерение влияния PEP1 на животную модель BPH.
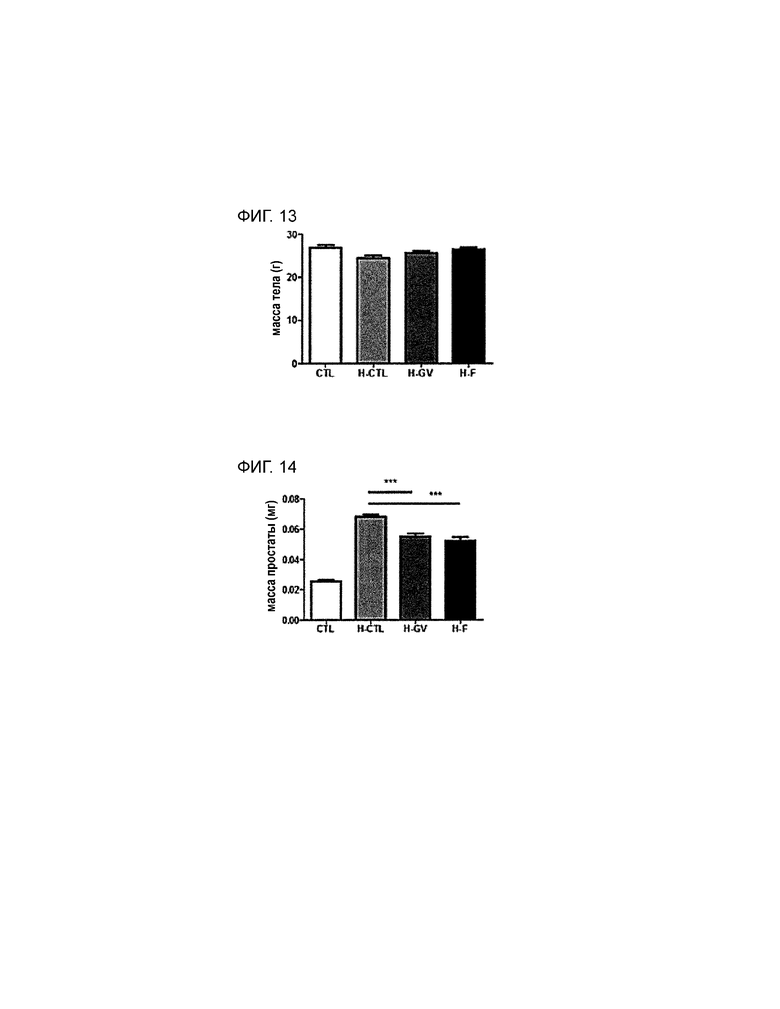
На фиг. 14 приведен график, демонстрирующий изменение массы простаты у животных моделей в эксперименте, включающем в себя измерение влияния PEP1 на животную модель BPH.
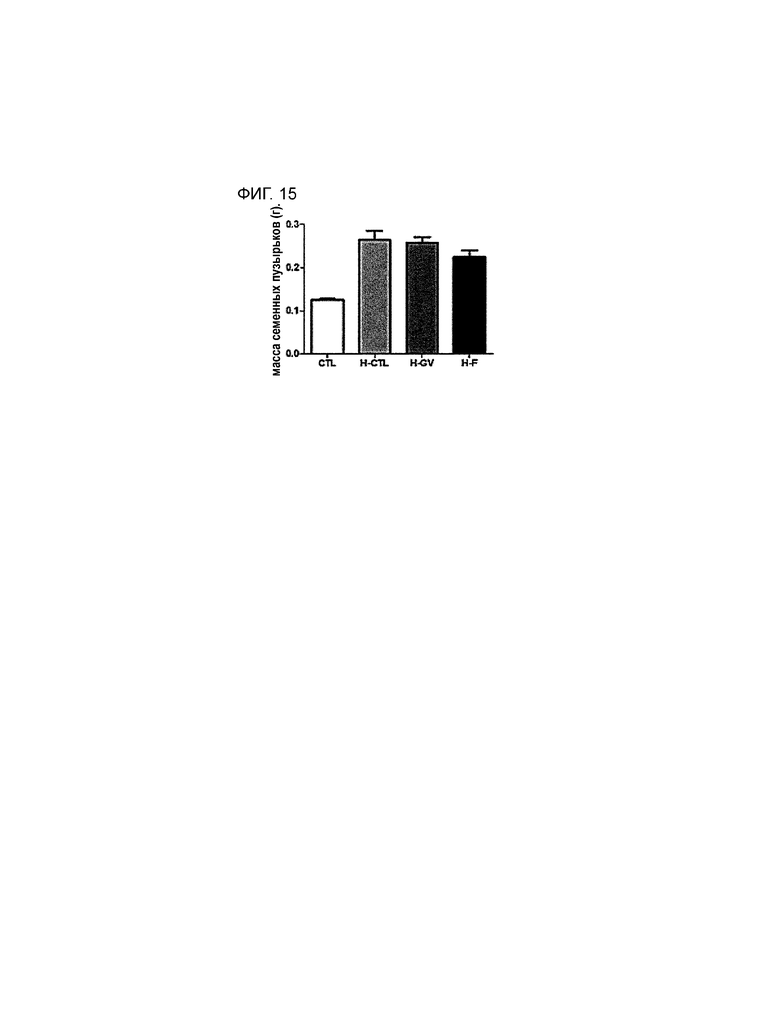
На фиг. 15 приведен график, демонстрирующий изменение массы семенных пузырьков животных в эксперименте, включающем в себя измерение влияния PEP1 на животную модель BPH.
НАИЛУЧШИЙ СПОСОБ ИСПЫТАНИЯ ИЗОБРЕТЕНИЯ
Поскольку настоящее изобретение можно адаптировать к разным областям применения посредством разных модификаций, ниже приведено более подробное описание настоящего изобретения. Однако ограничения по форме практического применения отсутствуют; следует понимать, что изобретение включает в себя концепцию и масштаб технологий во всех модификациях, эквивалентах и альтернативных вариантах. При описании настоящего изобретения опускают все подробные описания предыдущего уровня техники, которые противоречат фундаментальным принципам настоящего изобретения.
Теломер известен как повторяющаяся последовательность генетического вещества, присутствующая на концах хромосом, которая предотвращает повреждение хромосом, или их слияние с другими хромосомами. Длина теломера уменьшается при каждом делении клетки и после определенного числа клеточных делений она достигает критической величины, при которой клетка перестает делиться и умирает. С другой стороны, известно, что удлинение теломер приводит к увеличению продолжительности жизни клетки. Например, раковые клетки выделяют фермент, называемый теломеразой, который предотвращает укорачивание теломер, способствуя пролиферации раковых клеток. Авторы настоящего изобретения установили, что пептид, полученный из теломеразы, позволяет эффективно лечить и предотвращать BPH, и тем самым завершили настоящее изобретение.
В одном варианте осуществления настоящего изобретения пептид с аминокислотной последовательностью SEQ ID NO: 1, пептидный фрагмент вышеуказанного пептида, или пептид, последовательность которого на 80% или более идентична аминокислотной последовательности вышеуказанного пептида, входит в состав теломеразы, в частности, теломеразы Homo sapiens. Раскрытые здесь пептиды могут включать в себя пептиды, содержащие аминокислотную последовательность, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% гомологичную пептидной последовательности SEQ ID NO 1, или ее фрагменту. Кроме того, раскрытые в настоящем изобретении пептиды могут включать в себя пептиды, отличающиеся от SEQ ID NO: 1 или ее фрагмента, по меньшей мере, на одну аминокислоту, по меньшей мере, на 2 аминокислоты, по меньшей мере, на 3 аминокислоты, по меньшей мере, на 4 аминокислоты, по меньшей мере, на 5 трансформированных аминокислот, по меньшей мере, на 6 трансформированных аминокислот, или, по меньшей мере, на 7 аминокислот.
В одном варианте осуществления настоящего изобретения аминокислотные изменения приводят к изменению физических и химических характеристик пептида. Например, аминокислотные изменения можно осуществлять с целью повышения термической стабильности пептида, изменения субстратной специфичности и изменения оптимального значения pH.
Термин "аминокислота" в соответствии с данным описанием включает в себя не только 22 стандартные аминокислоты, которые в природе входят в состав пептидов, но и D-изомеры и модифицированные аминокислоты. Таким образом, в конкретном варианте осуществления настоящего изобретения, описанный здесь пептид включает в себя пептид, содержащий D-аминокислоты. Кроме того, пептид может содержать нестандартные аминокислоты, такие как аминокислоты, модифицированные после трансляции. Примеры пост-трансляционной модификации включают в себя фосфорилирование, гликозилирование, ацилирование (в том числе ацетилирование, миристорилирование, пальмитоилирование), алкилирование, карбоксилирование, гидроксилирование, гликирование, биотинилирование, убихитинилирование, модификации, приводящие к изменению химических свойств (например, деимидирование, деамидирование с β-удалением) и структурные модификации (например, образование дисульфидного мостика). Кроме того, изменения аминокислот включают в себя изменения, возникающие в результате химической реакции в процессе присоединения сшивающих средств, обеспечивающие образование пептидного конъюгата, такие как изменения в аминогруппе, карбоксильной группе или боковой цепи.
Раскрытый здесь пептид может представлять собой пептид дикого типа, идентифицированный и выделенный из природного источника. В то же время, раскрытые здесь пептиды могут представлять собой искусственные варианты, содержащие одну или несколько аминокислотных замен, делеций или вставок по сравнению с SEQ ID NO: 1 или ее фрагментами. Аминокислотные изменения в полипептидах дикого типа - не только в искусственных вариантах - включают в себя изменения, влияющие на укладку белка и/или консервативные аминокислотные замены, которые не оказывают существенного влияния на активность. Примеры консервативных замен включают в себя замены в пределах групп основных аминокислот (аргинин, лизин и гистидин), кислых аминокислот (глутаминовая кислота и аспарагиновая кислота), полярных аминокислот (глутамин и аспарагины), гидрофобных аминокислот (лейцин, изолейцин, валин и метионин), ароматических аминокислот (фенилаланин, триптофан и тирозин), и маленьких аминокислот (глицин, аланин, серин и треонин). В данной области известны аминокислотные замены, которые в целом не изменяют специфическую активность. Наиболее распространенными заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu, Asp/Gly и обратные замены. Другие примеры консервативных замен показаны в нижеследующей таблице 1:
Значительного изменения биологических свойств пептидов достигают путем выбора для замены остатков, в значительной степени отличающихся от исходных, при условии, что они позволяют: (a) сохранять в области замены структуру полипептидного скелета, такую как складчатая или спиральная трехмерная структура, (b) сохранять электрический заряд или гидрофобность молекулы в целевом участке, или (c) сохранять объем боковой цепи. Природные остатки делят на группы по общим свойствам боковых цепей следующим образом:
(1) гидрофобные: норлейцин, met, ala, val, leu, ile;
(2) нейтральные гидрофильные: cys, ser, thr;
(3) кислые: asp, glu;
(4) основные: asn, gin, his, lys, arg;
(5) остатки, которые влияют на ориентацию цепи: gly, pro; и
(6) ароматические: trp, tyr, phe.
Неконсервативные замены можно осуществлять путем замены члена одного из вышеуказанных классов на член другого класса. Любой цистеиновый остаток, не участвующий в поддержании соответствующей трехмерной структуры пептида, как правило, можно заменить на серин, что позволяет повысить окислительную стабильность молекулы и предотвратить образование неправильных поперечных связей. И наоборот, повышения стабильности можно достичь путем добавления в пептид цистеиновой связи (связей).
Другим типом аминокислотных вариантов пептидов являются пептиды с измененным характером гликозилирования. Термин "изменение" в данном описании включает в себя делецию, по меньшей мере, одного углеводного остатка, присутствующего в пептиде, и/или добавление, по меньшей мере, одного гликозилированного остатка, не присутствующего в пептиде.
Гликозилирование пептидов обычно осуществляется как N-связанное или как O-связанное. Термин "N-связанный" в данном описании означает, что углеводные остатки присоединяются к боковой цепи остатков аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин (где X обозначает любую аминокислоту за исключением пролина) распознаются ферментами, присоединяющими углеводный остаток к боковой цепи аспарагина. Следовательно, присутствие одной из указанных трипептидных последовательностей в полипептиде свидетельствует о наличии потенциального участка гликозилирования. Термин "O-связанное гликозилирование" означает, что один из сахаров, включающих в себя N-ацетилгалактозамин, галактозу или ксилозу, присоединяется к гидроксильной группе аминокислоты. Наиболее распространенными гидроксил-содержащими аминокислотами являются серин или треонин, но также могут использоваться 5-гидроксипролин или 5-гидроксилизин.
Добавление участка гликозилирования к пептиду обычно проводят путем изменения аминокислотной последовательности с введением указанной выше трипептидной последовательности (в случае N-связанных участков гликозилирования). Указанное изменение можно осуществить путем добавления, по меньшей мере, одного из остатков серина или треонина к первой последовательности антитела, или путем замены на указанные остатки (в случае O-связанных участков гликозилирования).
Кроме того, пептид настоящего изобретения, содержащий аминокислотную последовательность SEQ ID NO: 1, пептид, содержащий аминокислотную последовательность, гомологичную вышеуказанной последовательности более чем на 80%, или фрагменты вышеуказанного пептида обладают преимуществом, заключающимся в низкой токсичности и высокой стабильности в живых тканях. В соответствии с данным описанием SEQ ID No: 1 представляет собой полученный из теломеразы пептид, содержащий 16 аминокислот.
SEQ ID NO: 1 EARPALLTSRLRFIPK
В одном варианте осуществления настоящее изобретение предлагает композицию для лечения и профилактики BPH, которая содержит пептид с аминокислотной последовательностью SEQ ID NO: 1, пептид с аминокислотной последовательностью, гомологичной вышеуказанной последовательности более чем на 80%, или фрагменты вышеуказанного пептида.
В одном варианте осуществления настоящего изобретения композицию можно вводить всем животным, таким как человек, собака, курица, свинья, корова, овца, морская свинка и обезьяна.
В одном варианте осуществления настоящее изобретение предлагает фармацевтическую композицию для лечения и профилактики BPH, которая содержит пептид с аминокислотной последовательностью SEQ ID NO: 1, пептид с аминокислотной последовательностью, гомологичной вышеуказанной последовательности более чем на 80%, или фрагменты вышеуказанного пептида. В соответствии с одним вариантом осуществления настоящего изобретения фармацевтическую композицию можно вводить перорально, ректально, внутрикожно, внутривенно, внутримышечно, внутрибрюшинно, в костный мозг, эпидурально или подкожно.
Формы для перорального введения могут включать в себя, без ограничения, таблетки, пиллюли, мягкие или твердые капсулы, гранулы, порошки, растворы или эмульсии. Формы для отличного от перорального введения могут включать в себя, без ограничения, препараты для инъекции, препараты для вливания, лосьоны, мази, гели, кремы, суспензии, эмульсии, свечи, пластыри или спреи.
В одном варианте осуществления настоящего изобретения фармацевтическая композиция, при необходимости, может содержать добавки, такие как разбавители, наполнители, смазывающие средства, связующие средства, дезинтегрирующие средства, буферы, диспергирующие средства, поверхностно-активные средства, окрашивающие средства, ароматические средства или подсластители. В одном варианте осуществления настоящего изобретения фармацевтическую композицию можно получить промышленным способом с помощью традиционных методов, известных в данной области.
В одном варианте осуществления настоящего изобретения доза активного ингредиента в медицинской композиции может варьировать в зависимости от возраста, пола, массы, патологии и состояния пациента, способа введения или мнения врача. С учетом указанных факторов специалист в данной области может определить дозу, которая может включать в себя, без ограничения, дозу в диапазоне от 0,01 мкг/кг/день до 10 г/кг/день, например, от 0,1 мкг/кг/день до 1 мг/кг/день, как правило, от 1 мкг/кг/день до 0,1 г/кг/день, более конкретно, от 1 мкг/кг/день до 10 мг/кг/день, предпочтительно от 1 мкг/кг/день до 1 мг/кг/день, более предпочтительно от 0,005 мг/кг/день до 0,05 мг/кг/день, наиболее предпочтительно 0,01 мкг/кг/день, однако указанную дозу можно скорректировать, если существуют различия в эффекте, достигаемом при введении дозы. Для взрослых вводимая доза предпочтительно составляет от 0,1 мг до 1 мг, предпочтительно от 0,4 мг до 0,6 мг, например, наиболее предпочтительная доза составляет 0,56 мг.
В одном варианте осуществления настоящего изобретения фармацевтическую композицию можно вводить, без ограничения, от 1 до 3 раз в день.
В одном варианте осуществления настоящего изобретения композиция может содержать от 0,01 г/л до 1 кг/л, например, от 0,1 г/л до 100 г/л, более конкретно, от 1 г/л до 10 г/л пептида, аминокислотная последовательность которого состоит, по меньшей мере, из SEQ ID NO: 1, пептида, аминокислотная последовательность которого, по меньшей мере, на 80% гомологична вышеуказанной последовательности, или фрагмента вышеуказанного пептда. Если содержание пептида находится в вышеуказанных диапазонах, композиция может удовлетворять требованиям безопасности и стабильности, и, кроме того, указанные диапазоны соответствуют оптимальной эффективности по стоимости.
В одном варианте осуществления настоящее изобретение предлагает пищевую композицию для лечения и профилактики BPH, которая содержит пептид с аминокислотной последовательностью SEQ ID NO: 1, пептид с аминокислотной последовательностью, гомологичной вышеуказанной последовательности более чем на 80%, или фрагменты вышеуказанного пептида.
В одном варианте осуществления настоящего изобретения пищевая композиция не ограничивается конкретными формами, но может находиться, например, в виде таблеток, гранул, порошкообразных, жидких и твердых форм. Каждая форма, помимо активного ингредиента, может содержать традиционно используемые в промышленности ингредиенты, соответственно выбираемые специалистами в данной области, и может продуцировать синергический эффект в сочетании с другими ингредиентами.
Используемые здесь термины предназначены для описания вариантов осуществления, но не для ограничения настоящего изобретения. Термины, перед которыми отсутствуют числа, не предназначаются для ограничения количества, но демонстрируют, что может существовать несколько предметов, обозначаемых используемым термином. Термины "состоящий из", "имеющий", "включающий в себя" и "содержащий" следует интерпретировать в открытом смысле (т.е. как "включающий в себя без ограничения").
Единственной причиной того, что числовые значения указываются в виде диапазонов, является то, что диапазоны удобнее описывать, чем отдельные значения. Если не указано иное, следует понимать, что каждое конкретное числовое значение должно быть описано отдельно и включено в данное описание. Пороги всех диапазонов включены в описание и могут независимо объединяться.
Если не указано иное, или контекст явно не диктует противоположное, все указанные здесь способы можно осуществлять в должном порядке. Каждый вариант осуществления и все варианты осуществления, или типичные выражения (например, "такой как", "подобный ~"), если они не включены в формулу изобретения, используются для более полного описания настоящего изобретения, но не для ограничения объема настоящего изобретения. Любое выражение, присутствующее в данном описании, кроме формулы изобретения, не следует интерпретировать как обязательное для настоящего изобретения. Если не указано иное, используемые здесь технические и научные термины имеют традиционные значения, известные специалистам в области, к которой принадлежит настоящее изобретение.
Предпочтительные варианты осуществления включают в себя наилучший из известных авторам изобретения способ осуществления настоящего изобретения. Вариации предпочтительных вариантов осуществления могут стать очевидными для специалистов в данной области после прочтения указанных выше разъяснений. Авторы настоящего изобретения надеются, что специалисты в данной области смогут использовать вариации надлежащим образом, и что настоящее изобретение можно будет осуществить с помощью способов, отличных от описанных здесь. Таким образом, настоящее изобретение, в соответствии с патентным законом, включает в себя эквиваленты, модификации и вариации основных положений изобретения, приведенных в прилагаемой формуле изобретения. Кроме того, если явно не указано иное, или если контекст не диктует противоположное, все возможные вариации в пределах любого сочетания вышеуказанных компонентов включены в настоящее изобретение. Хотя настоящее изобретение описано и продемонстрировано посредством иллюстративных вариантов осуществления, специалистам в данной области хорошо известно, что форму и детали изобретения можно подвергнуть разным изменениям, не отступая от сущности изобретения и его объема, определенного в приведенной ниже формуле изобретения.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Далее настоящее изобретение описывается более подробно посредством примеров и тестовых примеров. Однако нижеследующие примеры и тестовые примеры приведены лишь в иллюстративных целях и для специалистов в данной области должно быть очевидно, что объем настоящего изобретения не ограничивается примерами и тестовыми примерами.
ПРИМЕР 1: Синтез пептида
Пептид SEQ ID NO: 1 синтезируют, используя традиционный метод твердофазного синтеза пептидов. Более конкретно, пептид синтезируют путем присоединения очередной аминокислоты по C-концу посредством Fmoc-твердофазного пептидного синтеза, SPPS, с использованием ASP48S (Peptron, Inc., Daejeon ROK). Для получения пептидов используют нижеследующие смолы, к которым присоединены первые аминокислоты пептидов:
NH2-Lys(Boc)-2-хлортритиловая смола
NH2-Ala-2-хлортритиловая смола
NH2-Arg(Pbf)-2-хлортритиловая смола
Все аминокислоты, необходимые для синтеза пептида, защищают группой Fmoc по N-концу, а аминокислотные остатки защищают группами Trt, Boc, t-Bu (т-бутиловый сложный эфир), Pbf (2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил), которые можно удалить в кислой среде. Примеры включают в себя следующие защищенные аминокислоты:
Fmoc-Ala-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Glu(OtBu)-OH, Fmoc-Pro-OH, Fmoc-Leu-OH, Fmoc-Ile-OH, Fmoc-Phe-OH, Fmoc-Ser(tBu)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Trp(Boc)-OH, Fmoc-Met-OH, Fmoc-Asn(Trt)-OH, Fmoc-Tyr(tBu)-OH, Fmoc-Ahx-OH, Trt-меркаптоуксусная кислота.
В качестве конденсирующих реагентов используют HBTU [2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметиламиния гексафторфосфат]/HOBt [N-гидроксибензотриазол]/NMM [4-метилморфолин]. Для удаления Fmoc используют пиперидин в 20% DMF. Для удаления защиты с аминокислотных остатков, или для отделения синтезированных пептидов от смолы используют смесь для отщепления [TFA (трифторуксусная кислота)/TIS (триизопропилсилан)/EDT (этандитиол)/H2O=92,5/2,5/2,5/2,5].
Пептидный синтез проводят с использованием твердофазной подложки, повторяя следующие процессы: вначале каждую аминокислоту защищают, затем ее подвергают отдельной реакции, промывают растворителями и удаляют защитные группы. Каждый пептид синтезируют с использованием твердофазной подложки, к которой присоединена первая аминокислота с защитной группой, путем отдельного взаимодействия с соответствующей аминокислотой, промывания растворителем и удаления защитных групп, повторяя указанные процессы. После отделения от смолы синтезированные пептиды очищают методом ВЭЖХ, анализируют методом масс-спектрометрии и лиофилизируют, подтверждают правильность синтеза методом МС и затем лиофилизируют.
Чистота полученных пептидов, определенная методом высокоэффективной жидкостной хроматографии, составляет 95% или выше.
Конкретный процесс синтеза PEP 1 можно представить следующим образом:
1) Присоединение
Защищенную аминокислоту (8 эквивалентов), NH2-Lys(Boc)-2-хлортритиловую смолу и конденсирующий реагент HBTU(8 эквивалентов)/HOBt(8 эквивалентов)/NMM(16 эквивалентов), разведенный в DMF, смешивают и инкубируют при комнатной температуре (КТ) в течение 2 ч. После инкубации реакционную смесь подвергают последовательному промыванию DMF, MeOH и DMF.
2) Удаление защитной группы Fmoc
Добавляют пиперидин в 20% DMF и инкубируют при КТ в течение 5 минут 2 раза, после чего последовательно промывают DMF, MeOH и DMF.
3) Получение основного каркаса пептида NH2-E(OtBu)-A-R(Pbf)-P-A-L-L-T(tBu)-S(tBu)-R(Pbf)L-R(Pbf)-F-I-P-K(Boc)-2-хлортритиловая смола) путем повторения вышеуказанных реакций 1) и 2).
4) Отщепление: к полностью синтезированному пептиду добавляют смесь для отщепления, чтобы отделить его от смолы.
5) К полученной смеси добавляют предварительно охлажденный диэтиловый эфир и центрифугируют, чтобы осадить собранный пептид.
6) После очистки методом препаративной ВЭЖХ подтверждают молекулярную массу методом ЖХ/МС и лиофилизируют с получением порошкообразной формы.
ПРИМЕР 2: Подтверждение влияния PEP1 на BPH в эксперименте с использованием животной модели индуцированной BPH.
1) Получение животной модели индуцированной BPH
Среди андрогенов наиболее распространенным в организме гормоном является тестостерон. Однако наиболее активным гормоном среди андрогенов, связанных с развитием простаты, является 5α-дигидротестостерон (DHT), который образуется из тестостерона под действием 5α-редуктазы. У крыс сулпирид, вводимый в течение 30 дней в концентрации 40 мг/кг, ингибирует рецептор допамина типа 2, увеличивая концентрацию пролактина в организме и индуцируя гиперпролактинемию, что приводит к активации 5α-редуктазы, также показано, что при введении с тестостероном он оказывает синергический эффект. Как описано, DHT, образующийся при гиперпролактинемии, больше увеличивает массу латеральной доли простаты, чем дорсальной или вентральной. С учетом данного факта проводят эксперимент с использованием PEP1, полученного по способу примера 1, который вводят животной модели индуцированной BPH отдельно или совместно с другим тестируемым средством. Зрелых самцов крыс Спрага-Доули (возрастом 6 недель) получают от Центра по выведению экспериментальных животных Jae-il и держат в течение недели (до возраста 7 недель, 49 дней) для обеззараживания, после чего их используют в эксперименте. Чтобы индуцировать BPH, сулпирид (40 мг/кг) вводят перорально один раз в день в течение 30 дней. Каждый эксперимент проводят после получения результата предыдущего эксперимента (Van Coppenolle et al., 2001). Введение тестируемых веществ всем животным начинают каждый день в 10 часов утра. После введения тестируемых веществ каждый день наблюдают общее состояние и специфичные симптомы у каждого животного. Кроме того, перед введением тестируемых веществ измеряют и регистрируют массу тела каждого животного.
2) Тестируемые вещества и вводимые дозы
Сулпирид, используемый в эксперименте в качестве тестируемого вещества, получают от Sigma Chemical Co. (St. Louis, MO, USA). Авторы настоящего изобретения вводят сулпирид (40 мг/кг) один раз в день последовательно в течение 60 дней путем внутрибрюшинной инъекции, чтобы индуцировать BPH, обусловленную гиперпролактинемией. Каждый раз перед введением тестируемых веществ сулпирид вначале растворяют в 0,1 N растворе HCl и затем нейтрализуют до pH 7,0 с помощью 0,1 N раствора NaOH. В группе совместного введения PEP1, полученный по способу примера 1, и финастерид вводят после сулпирида путем внутрибрюшинной инъекции. PEP1 (0,01, 0,1, 1 и 10 мг/кг) получают непосредственно перед применением и вводят путем подкожной инъекции. Финастерид вводят с использованием 15% этанола в кукурузном масле (об/об) в качестве среды каждый день. Вводимую дозу рассчитывают на основе концентрации 0,5 мл/кг, с учетом массы тела, которую измеряют каждый день. Чтобы подтвердить влияние PEP1 на BPH, тестируемые вещества вводят 7 группам, описанным ниже в таблице 2.
1) После окончания эксперимента с введением PEP1 и тестируемых веществ у моделей индуцированной BPH собирают органы, консервируют их и измеряют массу
Через 24 часа после окончания введения тестируемых веществ, которое осуществляли в течение 60 дней, всех животных анестезируют эфиром, собирают кровь из брюшной аорты и отделяют сыворотку. Отделенную сыворотку хранят при -80°C до анализа на гормоны.
У всех животных после тестирования последовательно выделяют крайнюю плоть (PPS), вспомогательные репродуктивные органы, такие как головка полового члена (Gp), семенные пузырьки и коагуляторные железы (SV), вентральная доля простаты (VP), куперова железа (CpG), бульбокавернозная мышца levator aniplus (LABC). Методика выделения в деталях соответствует протоколу OECD.
Для выделения Gp, как указано на фиг. 1, часть Gp зажимают пинцетом и отрезают по линии отделения крайней плоти. Как указано на фиг. 1, чтобы выделить легкое, после выделения мочевого пузыря из слоя мышц брюшной полости раскрывают левую и правую доли легкого, покрытые липидным слоем, поднимают мочевой пузырь, чтобы обнаружить SV, отделяют липид с левой и правой долей легкого с помощью пинцета, отрезают левую долю легкого от уретры после вытягивания с помощью микропинцета, и отрезают правую долю легкого после отделения от уретры с помощью щипцов. В случае SV, содержащих коагуляторные железы, как указано на фиг. 1, SV кладут на бумажную салфетку и разделяют мышцы, липидный слой и железы. Фиксируют основание SV, содержащее семенные канальцы, соединенные с уретрой, с помощью зажима, чтобы предотвратить истечение в процессе удаления семенных пузырьков. После удаления липидов промывают связанные вспомогательные органы, удаляют зажим и помещают семенные пузырьки на чашку, чтобы измерить их массу.
2) Влияние введения PEP1 на экспресию 5α-редуктазы у экспериментальной животной модели индуцированной BPH
После введения сулпирида с тестируемыми веществами в течение 60 дней и сбора вентральных долей простаты, измеряют их влияние на экспрессию 5α-редуктазы методом ОТ-ПЦР. А именно, из вентральной доли простаты выделяют общую РНК (25 мг) и ресуспендируют ее путем добавления воды, обработанной DEPC. Затем проводят количественное определение РНК с помощью спектрофотометра. Первую цепь кДНК синтезируют, используя методы Torres and Ortega (2004). Профиль ПЦР включает в себя денатурацию при 94°C (30 сек), отжиг при 55°C (30 сек) и удлинение при 72°C (30 сек), с повторением цикла 30-35 раз. В качестве контроля при количественном определении методом электрофореза используют GAPDH, уровень экспрессии которого не изменяется под действием других лекарственных средств. Результаты показывают, что повышение уровня 5α-редуктазы под действием сулпирида ингибируется в группе, получающей PEP1, в дозо-зависимой манере, причем ингибиторный эффект в группе, получающей высокую дозу PEP1 (GV 10, группа, получающая PEP1 в дозе 10 мг), выше, чем в группе, получающей финастерид (см. фиг. 2). Таким образом, PEP1 может оказывать дозо-зависимый лечебный и благоприятный эффект на BPH путем ингибирования 5α-редуктазы.
3) Влияние PEP1 на органы экспериментальной животной модели индуцированной BPH
В приведенной ниже таблице 3 показано, что пептид PEP1 влияет на массу семенных пузырьков, массу простаты и индекс простаты в каждой экспериментальной группе. Индекс простаты, указанный в таблице 3, рассчитывают по уравнению "масса тела/конечная масса простаты".
Результаты, приведенные в таблице 3, т.е. результаты измерения семенных пузырьков после введения PEP1 и финастерида (5 мг/кг) у животных с BPH, индуцированной путем введения сулпирида, представляют в виде графика, который демонстрирует, что масса семенных пузырьков после введения высокой дозы PEP1 (10 мг/кг) значительно уменьшается (см. фиг. 3). Кроме того, у животной модели индуцированной BPH при совместном введении сулпирида и PEP1 масса простаты значительно уменьшается (см. фиг. 4). Если значение P меньше 0,05, результат является значимым.
Следовательно, результаты, полученные в примере 2, свидетельствуют о том, что введение PEP1 животной модели с BPH, индуцированной сулпиридом, может эффективно и в дозо-зависимой манере уменьшать экспрессию 5α-редуктазы, массу семенных пузырьков и массу простаты. Таким образом, результаты анализа экспрессии 5α-редуктазы и измерения массы репродуктивных органов свидетельствуют о том, что введение PEP1 позволяет эффективно лечить и улучшать болезненные симптомы, связанные с BPH.
ПРИМЕР 3: Подтверждение влияния PEP1 на BPH путем наблюдения изменений в пролиферации стромальных и эпителиальных клеток простаты по уровню DHT
1) Получение клеток для тестирования и способ проведения эксперимента
После введения в организм тестостерон превращается в DHT под действием 5α-редуктазы и индуцирует пролиферацию клеток простаты, вызывая BPH. Используя данный факт, проводят эксперимент, демонстрирующий влияние PEP1, полученного в примере 1, на пролиферацию линии клеток простаты. В качестве клеточных линий используют WPMY-1 (линия стромальных клеток простаты) и RWPE-1 (линия эпителиальных клеток простаты), полученные от животных моделей. Эксперимент проводят путем высевания WPMY-1 (2,5×103 клеток) и RWPE-1 (1×104 клеток) в 96-луночный планшет с учетом отдельных экспериментальных групп, описанных в таблице 4, чтобы наблюдать изменение пролиферации. Изменение пролиферации наблюдают путем помещения раствора CCK-8 в каждую лунку среды в количестве 10 мкл после отсасывания культуральной среды и измерения оптической плотности в течение 1-4 часов при длине волны 450 нм.
2) Подтверждение наблюдаемых результатов и эффектов
В группах, не обработанных DHT (1-3 группы), отсутствуют значимые различия между группой, не получающей PEP1 (1 группа) и группами, получающими PEP1 (2 и 3 группы), в обоих клеточных линиях WPMY-1 и RWPE-1. В группах, обработанных DHT (4-6 группы), существуют значимые различия между группой, не получающей PEP1 (4 группа), и группами, получающими PEP1 (5 и 6 группы), при этом в группах, обработанных PEP1, наблюдается значительное ингибирование пролиферации (см. таблицу 4 и фиг. 5, 6). Следовательно, PEP1 может эффективно ингибировать пролиферацию клеток простаты, воздействуя на DHT-индуцированную BPH.
Условия обработки групп каждой клеточной линии
ПРИМЕР 4: Подтверждение способности связывать рецептор андрогенов и механизм ингибирования BPH под действием PEP1
1) Получение клеток для тестирования и способ проведения эксперимента
DHT, образующийся под действием 5α-редуктазы, стимулирует пролиферацию клеток простаты путем связывания рецептора андрогенов и вызывает BPH. Используя данный факт, проводят эксперимент по изучению пролиферации клеток простаты, в котором PEP1, полученный в примере 1, вводят в организм. В качестве клеточных линий используют WPMY-1 и RWPE-1, полученные от животных моделей. WPMY-1 и RWPE-1 разделяют на группу, которую обрабатывают антителом против рецептора андрогенов, и группу изотипического контроля, проводят конкурентный анализ, инкубируя с каждым антителом, путем добавления PEP1-FITC (флуоресцинизотиоцианат), и измеряют значение флуоресценции. Значение флуоресценции измеряют методом проточной цитометрии.
2) Подтверждение наблюдаемых результатов и эффектов
Для каждой из WPMY-1 и RWPE-1, значения флуоресценции измеряют вначале в случае взаимодействия с контрольным антителом (конкурирующее антитело, пик крайний справа), затем в случае взаимодействия с антителом против рецептора андрогенов (конкурирующее антитело, пик посередине) и при отсутствии взаимодействия с двумя антителами и связывания с FITC (пик крайний слева) (см. фиг. 7 и фиг. 8). В случае конкуренции с контрольным антителом, изотипическим антителу против рецептора андрогенов, PEP1 связывается с антителом против рецептора андрогенов и значение флуоресценции конъюгата PEP1-FITC увеличивается (пик, сдвинутый вправо на гистограмме графика). В случае конкуренции с антителом против рецептора андрогенов, PEP1 слабо связывается с антителом против рецептора андрогенов и значение флуоресценции уменьшается (пик, сдвинутый влево на гистограмме графика). Следовательно, на основании того, что PEP1 ингибирует BPH, индуцированную DHT, который связывается с антителом против рецептора андрогенов, PEP1 может влиять на BPH путем непосредственного связывания с антителом против рецептора андрогенов.
ПРИМЕР 5: Подтверждение эффективности влияния PEP1 на BPH in vivo с использованием животной модели индуцированной BPH
1) Получение экспериментальных животных
В эксперименте используют самцов мышей C57BL/6 возрастом 6-8 недель (n=10/группу), выращенных в условиях SPF (отсутствия специфических патогенов) в лаборатории для выведения экспериментальных животных Медицинского колледжа Сеульского университета. 50 мг тестостерона энантата (TE, полученного от EVER Pharma Hena GmbH, Germany) для инъекций и 0,5 мг эстрадиола валерата (полученного от EVER Pharma Hena GmbH, Germany) соответственно смешивают в объеме 70 мкл микроосмотического насоса (насос Alzet, полученный от DURECT Corporation, USA), после чего насос трансплантируют в спину мыши под анестезией. Конструкция насоса позволяет высвобождать в организме мыши гормон в концентрации 0,11 мкл в час в течение 28 дней (2 недели) благодаря явлению осмоса.
2) Тестируемые вещества и вводимые дозы
В качестве тестируемых веществ используют тестостерон и финастерид. Чтобы получить животные модели, одной особи (мышиная модель массой 25 г) каждый день подкожно вводят (инъекция) соответственно 250 мкг PEP1, полученного по способу примера 1, и 2500 мкг финастерида (в DMSO или циклодекстрине, полученного от Sigma Aldrich, USA). Спустя 2 недели после введения тестируемых веществ (через 4 недели после трансплантации насоса животной модели) кровь собирают из надглазничной вены и центрифугируют при 14000 об/мин, 4°C, в течение 30 мин, чтобы отделить сыворотку, простату выделяют и замораживают в жидком азоте при -70°C, иди фиксируют жидкостью для фиксации. Экспериментальные группы, используемые в данном эксперименте, описаны ниже в таблице 5.
(контроль)
(BPH)
(PEP1)
(финастерид)
3) Измерение уменьшения факторов, индуцирующих BPH
При индукции BPH повышается уровень PCNA (ядерный антиген пролиферирующих клеток, белок, необходимый для репликации) и Ki67 (MK167, белок, необходимый для пролиферации клеток) в тканях простаты. С учетом данного факта проводят тест, чтобы измерить эффективность PEP1 в отношении ингибирования экспрессии PCNA и Ki67 у мышиной модели индуцированной BPH. PCNA измеряют методом 2D-гель-электрофореза, используя белок, экстрагированный из клеток ткани простаты, а Ki67 измеряют методом иммуноокрашивания, позволяющим детектировать уровень экспрессии в ткани. Результаты показывают, что уровни экспрессия PCNA и Ki67, повышенные в тканях простаты животных с индуцированной BPH, уменьшаются под действием PEP1 (см. фиг. 9 и фиг. 10). Следовательно, PEP1 ингибирует факторы, индуцирующие BPH, и может эффективно использоваться для лечения и улучшения BPH.
4) Измерение изменений в тканях, пораженных индуцированной BPH
Известно, что BPH индуцируется в результате аномальной пролиферации стромальных и эпителиальных клеток, которые составляют предстательную железу. С учетом данного факта, чтобы определить, вызывает ли PEP1 изменения в ткани простаты животной модели индуцированной BPH, проводят гистологический анализ. Метод окрашивания H&E используют для детекции изменений в общей ткани, а метод окрашивания трихромом по Массону используют для измерения уровня воспалительной реакции и для более четкой детекции формы ядер. Результаты показывают, что в группе с индуцированной BPH эпителиальный слой толще, чем в контрольной группе, однако в группе, получающей PEP1, эпителиальный слой располагается в регулярном порядке, подобно контрольной группе, а толщина эпителия меньше, чем в группе с индуцированной BPH (см. фиг. 11 и 12). Следовательно, PEP1 можно эффективно использовать для восстановления изменений в тканях животных с индуцированной BPH и возвращения тканей к нормальному состоянию с отсутствием признаков BPH.
5) Измерение изменений в органах, пораженных BPH
BPH можно детектировать по изменению массы простаты и семенных пузырьков. С учетом данного факта, чтобы определить влияние PEP1 на массу простаты и семенных пузырьков, которая непосредственно свидетельствует о наличии симптомов, связанных с BPH, у животной модели индуцированной BPH измеряют массу тела, массу простаты и массу семенных пузырьков. Результаты измерения приведены в таблице 5 по группам в виде графика (см. фиг. 13, 14 и 15). Изменение общей массы тела не показано, однако показано, что масса простаты в группе, получающей PEP1, значительно ниже, чем в группе, получающей гормон, причем уменьшение массы в группе, получающей PEP1, сравнимо с уменьшением, наблюдающимся в группе, получающей финастерид, который известен как лекарственное средство против BPH, следовательно, полученные результаты подтверждают, что уменьшение, наблюдающееся в группе, получающей PEP1, является значимым. Масса семенных пузырьков в группе, получающей PEP1, меньше, чем в группе, получающей гормон. Следовательно, PEP1 позволяет эффективно снижать массу органов, несущих симптомы BPH.
Во всех приведенных выше примерах, посредством экспериментов, проводимых in vitro и in vivo с использованием животных моделей индуцированной BPH, показано, что PEP1 при введении оказывает существенный эффект на факторы, индуцирующие BPH, рецепторы гормонов и основные репродуктивные органы. Следовательно, можно предположить, что с помощью PEP1 можно эффективно лечить, улучшать и предотвращать BPH, кроме того, существует вероятность, что на основе PEP1 будет разработана композиция для лечения BPH и способ лечения BPH.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Текст нестандартного формата
Полная последовательность теломеразы, 1132 ак.

Группа изобретений относится к медицине, а именно к урологии, и может быть использована для лечения и профилактики доброкачественной гиперплазии простаты (BPH). Предложены композиция, содержащая выделенный пептид с SEQ ID NO:1, и её применение для лечения и профилактики BPH. Использование изобретений позволяет лечить BPH за счет уменьшения экспрессии 5α-редуктазы, ингибирования пролиферации клеток простаты, уменьшения массы семенных пузырьков и простаты. 2 н. и 8 з.п. ф-лы, 15 ил., 5 табл., 5 пр.
1. Композиция для лечения или профилактики доброкачественной гиперплазии простаты (BPH), содержащая выделенный пептид с SEQ ID NO:1.
2. Композиция по п.1, отличающаяся тем, что композиция содержит добавку, выбранную из группы, состоящей из разбавителей, наполнителей, смазывающих средств, связующих средств, дезинтегрирующих средств, буферов, диспергирующих средств, поверхностно-активных средств, окрашивающих средств, ароматических средств или подсластителей.
3. Композиция по п.1, отличающаяся тем, что композицию вводят ректально, внутрикожно, внутривенно, внутримышечно, внутрибрюшинно, в костный мозг, эпидурально или подкожно.
4. Композиция по п.1, отличающаяся тем, что композиция содержит от 0,01 г/л до 1 кг/л выделенного пептида.
5. Композиция по п.1, в которой пептид вводят пациенту в дозе при концентрации от 0,005 до 0,05 мг/кг массы тела.
6. Композиция по п.1, отличающаяся тем, что композиция содержит 0,56 мг выделенного пептида.
7. Композиция по п.1, отличающаяся тем, что композиция содержит 0,4 мг выделенного пептида.
8. Композиция по п.1, в которой пептид вводят пациенту от 1 до 3 раз в день.
9. Композиция по п.1, отличающаяся тем, что композицию вводят пациенту каждые 2 недели в течение общего периода лечения продолжительностью 12 недель, причем выделенный пептид вводят каждый раз при концентрации 4 нмоль/кг массы тела.
10. Применение композиции, содержащей выделенный пептид с SEQ ID NO:1, для лечения или профилактики BPH.
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2008 |
|
RU2485971C2 |
| Устройство для навивки спирали | 1980 |
|
SU1093381A1 |
| WO 2013135266 A1, 19.09.2013 | |||
| KENNETH C | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| IMMUNOL., vol | |||
| Способ образования азокрасителей на волокнах | 1918 |
|
SU152A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| PRAKASH K et al | |||
| Symptomatic and asymptomatic benign prostatic hyperplasia: molecular differentiation by using microarrays//Proc Natl Acad Sci U S A | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
Авторы
Даты
2019-04-01—Публикация
2017-12-07—Подача