Область техники
Настоящее изобретение относится к способам для оценки реакции коагуляции крови, которая опосредуется веществом, обладающим свойством функционального замещения фактора коагуляции крови VIII (FVIII). Кроме того, настоящее изобретение относится к реагентам для оценки реакции коагуляции крови, которые содержат активированный фактор коагуляции крови XI (FXIa); и комплектам, которые содержат такой реагент, для оценки реакции коагуляции крови, которая опосредуется веществом, обладающим свойством функционального замещения фактора коагуляции крови VIII.
Предпосылки создания изобретения
Гемофилия представляет собой геморрагическую болезнь, которая вызывается врожденным дефицитом или дисфункцией фактора коагуляции крови VIII (FVIII) или фактора коагуляции крови IX (FIX). Первая называется гемофилией А, а последняя гемофилией В. Оба этих гена являются расположенными в Х-хромосоме, и их генетические аномалии передаются сцепленным с полом рецессивным наследованием. Таким образом, более 99% пациентов, у которых развивается болезнь, являются мужчинами. Известно, что показатель распространенности составляет приблизительно один из 10000 живых новорожденных мальчиков, и соотношение между гемофилией А и гемофилией В составляет приблизительно 5:1.
У больных гемофилией основные типы кровотечений представляют собой, например, внутрисуставное, внутримышечное, подкожное, интраоральное, внутричерепное, кровотечение пищеварительного тракта и интраназальное кровотечение. В частности, повторяемые внутрисуставные кровотечения могут приводить к развитию суставных расстройств или гемофильной артропатии, сопровождающейся трудностями при ходьбе, и в некоторых случаях, в конечном итоге, требуют хирургического вмешательства по замене сустава. Таким образом, это главный фактор, который снижает качество жизни больных гемофилией. Тяжесть гемофилии хорошо коррелирует с активностью фактора VIII или FIX в крови. Пациенты с активностью менее 1% классифицируются как тяжелые, пациенты с активностью 1% или более и менее чем 5% классифицируются как умеренные, а пациенты с активностью 5% или более и менее чем 40% классифицируются как легкие. Тяжелые пациенты, которые составляют примерно половину больных, демонстрируют симптомы кровотечения несколько раз в месяц, что существенно является чаще по сравнению с больными, которые имеют умеренную и мягкую форму гемофилии. Таким образом, у больных с тяжелой формой гемофилии поддержание активности фактора VIII или FIX в крови на уровне 1% или более с помощью заместительной терапии на основе фактора VIII или FIX может быть эффективным для предотвращения проявления симптомов кровотечения (не патентный документ 1).
В дополнение к гемофилии и приобретенной гемофилии, болезнь Виллебранда, которая вызывается дисфункцией или недостаточностью фактора Виллебранда (vWF), является известной как такая, которая представляет собой родственную патологию кровотечения. vWF является необходимым для тромбоцитов не только для правильного прикрепления к субэндотелиальной ткани на участке повреждения в стенке кровеносного сосуда, но также и для образования комплекса с FVIII и сохранения нормального уровня фактора VIII в крови. Эти функции снижаются у пациентов с болезнью Виллебранда, что вызывает дисфункцию свертывания крови.
Для предотвращения и/или лечения кровотечения у больных гемофилией в основном используются факторы свертывания крови, очищенные из плазмы крови или полученные с помощью методов генной рекомбинации.
Известные способы мониторинга эффективности факторов коагуляции крови, таких как FVIII, включают активированное частичное тромбопластиновое время (АРТТ), одноэтапный способ коагуляции на основе АРТТ и анализ образования тромбина (TGA). АРТТ и одноэтапный способ коагуляции уже давно широко используются в качестве методов мониторинга эффективности композиций FVIII. АРТТ представляет собой способ измерения времени, необходимого для превращения фибриногена в нерастворимый фибрин после добавления АРТТ реагентов, а затем CaCl2 в исследуемую плазму крови, то есть, время до начала коагуляции. Одноэтапный способ коагуляции представляет собой способ измерения времени коагуляции таким же способом, как и АРТТ в дефектной по FVIII плазме крови, к которой была добавлена исследуемая плазма, разведенная в буфере при определенном соотношении, и определения активности фактора VIII в исследуемой плазме на основе калибровочной кривой, которая была получена с помощью серийных разведений нормальной плазмы вместо исследуемой плазмы. TGA представляет собой анализ для измерения количества тромбина, который образовался с течением времени при развитии реакции коагуляции, где количество тромбина определяется как ферментативная активность при использовании флуорогенного субстрата для тромбина (непатентный документ 2). TGA позволяет осуществлять оценку серии реакций коагуляции от начала образования тромбина в реакции коагуляции вплоть до образования тромбина в фазе расширения реакции коагуляции. Кроме того, для реагентов инициации коагуляции в TGA имеются сообщения о реагентах, в которых раствор с низкой концентрацией фосфолипида (4 мкМ) используется как основа и сочетается с низкой концентрацией тканевого фактора (непатентный документ 2), в сочетании с FIXa (не патентные документы 3 и 4), в сочетании с агентом активирующим FXII (эллаговая кислота) (непатентный документ 5), или в сочетании со смешанным раствором с низкой концентрацией тканевого фактора и агента, активирующего FXII (эллаговая кислота) (непатентный документ 5).
В последнее время были обнаружены биспецифические антитела, которые связываются как с активированным фактором коагуляции крови IX (FIXa), так и фактором коагуляции крови X (FX), и заменяют кофакторную функцию FVIII, т.е. функцию содействия активации FX с помощью FIXa (патентные документы 1-3). Однако в то время как такие биспецифические антитела функционально замещают FVIII, механизм проявления их действия не является полностью таким же, как таковой FVIII. Например, фактор VIII демонстрирует активность кофактора только тогда, когда он активируется FXa или тромбином; однако, вышеупомянутые биспецифические антитела не нуждаются в таком процессе активации для того, чтобы продемонстрировать активность кофактора. Таким образом, не является обязательным применять существующие способы мониторинга эффективности FVIII в таких антителах.
[Документы уровня техники]
[Непатентные документы]
[Непатентный документ 1] Astermark J. Haemophilia. 2003 9 (Suppl.1) 32
[Непатентный документ 2] Pathophysiol Haemost Thromb. 2003; 33(1): 4
[Непатентный документ 3] J Thromb Haemost. 2011 Aug; 9(8): 1549-55.
[Непатентный документ 4] J Thromb Haemost. 2003 May; 1(5): 1005-11.
[Непатентный документ 5] Int J Hematol. 2009 Dec; 90(5): 576-82.
[Патентные документы]
[Патентный документ 1] WO 2005/035756
[Патентный документ 2] WO 2006/109592
[Патентный документ 3] WO 2012/067176
Краткое описание сущности изобретения
[Проблемы, которые решаются с помощью изобретения]
Настоящее изобретение было достигнуто с учетом вышеупомянутых обстоятельств. Целью настоящего изобретения является обеспечение способов оценки эффективности вещества в реакции коагуляции крови, где вещество обладает активностью замещения фактора коагуляции крови VIII (FVIII); реагентов инициации коагуляции крови, которые будут использоваться в таких способах; и комплектов, которые содержат такой реагент.
[Способы решения проблем]
Для решения вышеуказанных проблем авторы настоящего изобретения исследовали различные способы оценки гемостатического эффекта и различные реагенты инициации коагуляции крови для создания способа оценки реакции коагуляции крови, которая опосредуется веществом, обладающим активностью замещения фактора коагуляции крови VIII (FVIII). В результате этого авторы настоящего изобретения обнаружили, что при использовании реагента инициации коагуляции крови, содержащего активированный фактор коагуляции крови XI (FXIa), эффект вещества, обладающего активностью замещения фактора коагуляции крови VIII (FVIII), на реакцию коагуляции крови может быть оценен с помощью приемлемой чувствительности при использовании количества тромбина, который образуется в образце крови, в качестве индикатора. Кроме того, авторы настоящего изобретения успешно раскрыли способ для анализа образования тромбина при использовании реагента инициации коагуляции крови, содержащего активированный фактор коагуляции крови XI (FXIa). Настоящее изобретение основано на этих выводах и относится к следующим объектам:
[1] способ для оценки реакции коагуляции крови, которая опосредуется веществом, обладающим активностью замещения фактора коагуляции крови VIII, где способ включает этапы, в процессе которых:
(I) прибавляют реагент инициации коагуляции крови, содержащий активированный фактор коагуляции крови XI, к образцу крови, выделенному от субъекта, где образец включает вещество, обладающее активностью замещения фактора коагуляции крови VIII; и
(II) измеряют количества тромбина, образовавшегося в образце крови, полученном на стадии (I);
[2] способ в соответствии с пунктом 1, где вещество, которое обладает активностью замещения фактора коагуляции крови VIII, представляет собой биспецифическое антитело, которое связывается с фактором коагуляции крови IX или активированным фактором коагуляции крови IX и с фактором коагуляции крови X;
[3] способ в соответствии с пунктом 1 или 2, где субъект представляет собой пациента с геморрагическим заболеванием;
[4] способ в соответствии с пунктом 3, где геморрагическое заболевание представляет собой заболевание, вызванное пониженной или дефектной активностью фактора коагуляции крови VIII или активированного фактора коагуляции крови VIII;
[5] способ в соответствии с пунктом 3 или 4, где геморрагическое заболевание представляет собой заболевание, выбранное из группы, которая состоит из гемофилии, приобретенной гемофилии и болезни Виллебранда, вызванной дисфункцией или дефицитом фактора Виллебранда (vWF);
[6] способ в соответствии с любым из пунктов 1-5, где реагент инициации коагуляции крови представляет собой реагент, который включает активированный фактор коагуляции крови XI и фосфолипид;
[7] реагент инициации коагуляции крови для применения в способе в соответствии с любым из пунктов 1-6, который включает активированный фактор коагуляции крови XI;
[8] реагент инициации коагуляции крови в соответствии с пунктом 7, который дополнительно включает фосфолипид; и
[9] нкомплект для применения в способе в соответствии с любым из пунктов 1-6, который включает реагент инициации коагуляции крови в соответствии с пунктом 7 или 8.
[Эффекты в соответствии с изобретением]
Настоящее изобретение обеспечивает способы оценки реакции коагуляции крови, которая опосредуется веществом, обладающим активностью замещения фактора коагуляции крови VIII, в котором количество тромбина, который образовался в образце крови, используется в качестве индикатора. Вещества, обладающие активностью замещения фактора коагуляции крови VIII, в частности, биспецифические антитела, которые связываются с фактором коагуляции крови IX или активированным фактором коагуляции крови IX и с фактором коагуляции крови X, выражают кофакторную активность с помощью механизма, который не является полностью таким же, как и таковой фактора коагуляции крови VIII. Таким образом, в лечении геморрагических заболеваний таких, как гемофилия, с помощью биспецифического антитела, не обязательно можно применять широко используемые способы оценки эффективности и, таким образом, приемлемая оценка влияния биспецифического антитела может быть невозможной. Настоящее изобретение позволяет осуществлять точную оценку даже указанных выше биспецифических антител в отношении их эффекта при лечении геморрагических заболеваний.
Краткое описание рисунков
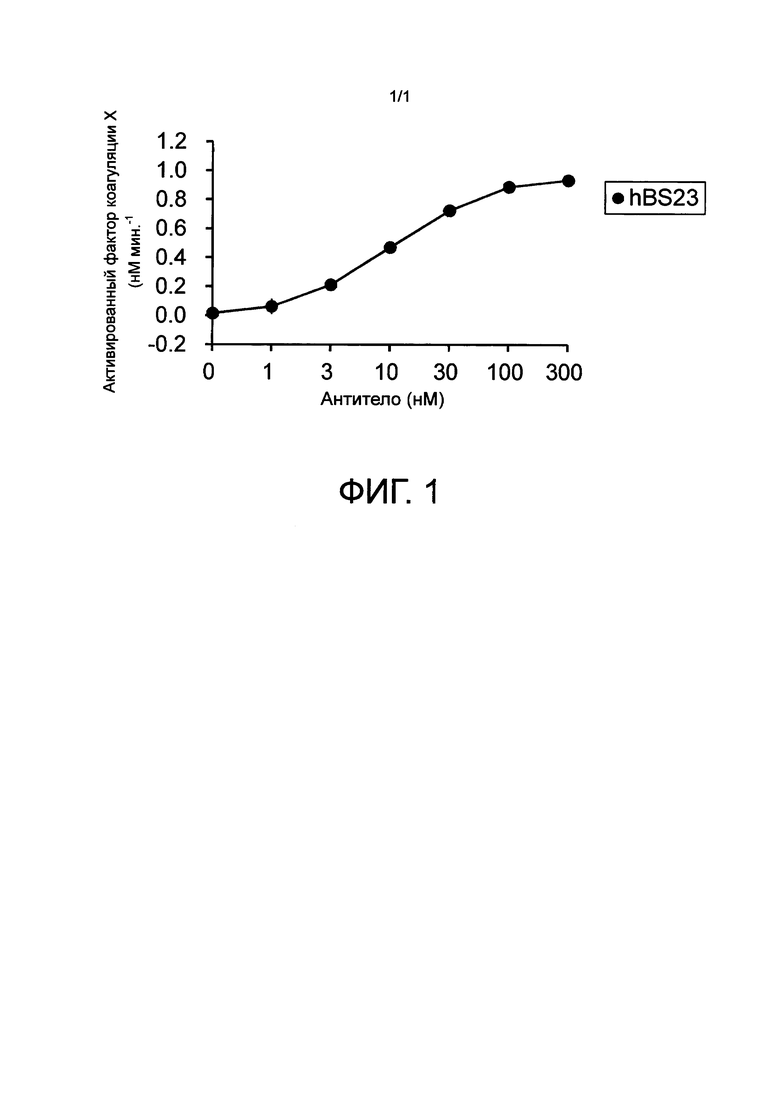
Фиг. 1 показывает активность замещения функции FVIII с помощью hBS23, которое представляет собой одно из биспецифических антител, которые связываются с активированным фактором коагуляции крови IX и фактором коагуляции крови X. hBS23 демонстрирует активность улучшенного образования FXa в присутствии FIXa/FX/фосфолипиды.
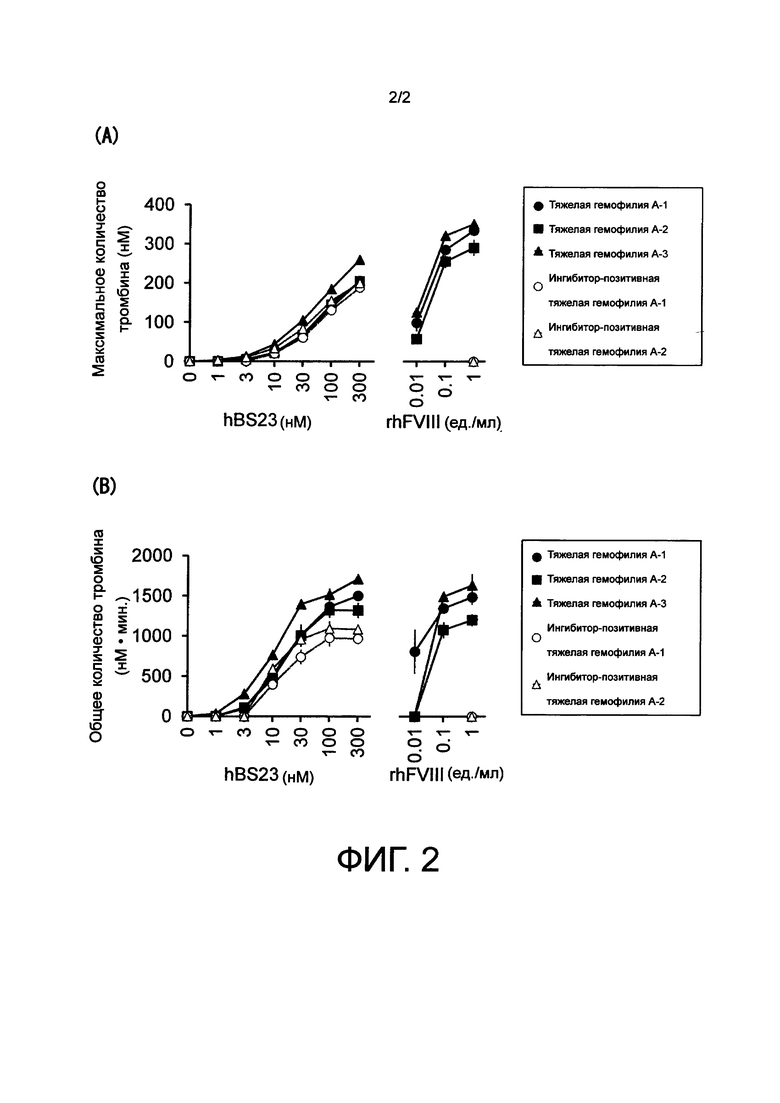
Фиг. 2 показывает эффекты hBS23 и рекомбинантного человеческого фактора коагуляции крови VIII (rhFVIII) в отношении параметров анализа образования тромбина (высота пика (А) и ЕТР (В)) для дефектной по FVIII плазмы крови или дефектной по FVIII плазмы крови с ингибитором. Каждая партия плазмы крови была получена от одного донора, который был подтвержден как такой, который имеет тяжелую форму гемофилии А (плазма 1, 2, 3) или ингибитор-положительную тяжелую форму гемофилии (плазма с ингибитором 1, 2). Титры ингибитора составляли 292 и 148 единиц Бетесда для плазмы с ингибитором 1 и 2, соответственно. В дефектной по FVIII плазме и в дефектной по FVIII плазме с ингибитором, hBS23 повышало высоту пика и ЕТР зависимым от концентрации образом при условиях индукции реагентом на основе FXIa/фосфолипида.
Способ осуществления изобретений
Настоящее изобретение относится к способам оценки реакции коагуляции крови с помощью вещества, обладающего активностью замещения фактора коагуляции крови VIII, где способ включает следующие этапы:
(I) прибавление реагента инициации коагуляции крови, включающего активированный фактор коагуляции крови XI, к образцу крови, полученному от субъекта, где образец включает вещество, обладающее активностью замещения фактора коагуляции крови VIII; и
(II) измерение количества тромбина, образовавшегося в образце крови, полученном на этапе (I).
При использовании способов в соответствии с настоящим изобретением кофактор активности вещества, обладающего активностью замещения фактора коагуляции крови VIII, может быть оценен надлежащим образом. В частности, по сравнению со способами на основе активированного частичного тромбопластинового времени (АРТТ) или анализа образования тромбина на основе индукции с помощью реагента инициации коагуляции, содержащего низкую концентрацию тканевого фактора, которые традиционно широко используются в качестве способов для мониторинга эффективности фактора коагуляции крови, способы в соответствии с настоящим изобретением позволяют контролировать кровоостанавливающее (гемостатическое) действие с более приемлемой чувствительностю.
В настоящем изобретении "способ для оценки реакции коагуляции крови, которая опосредуется веществом, обладающим активностью замещения фактора коагуляции крови VIII" можно иначе назвать как "способ для оценки кофакторной активности вещества, обладающего активностью замещения фактора коагуляции крови VIII". Он также может быть назван как "способ для оценки терапевтического эффекта вещества, обладающего активностью замещения фактора коагуляции крови VIII, в отношении геморрагических заболеваний". Кроме того, он может быть также перефразирован как "способ для оценки профилактического эффекта вещества, обладающего активностью замещения фактора коагуляции крови VIII, в отношении геморрагических заболеваний". Кроме того, "способ оценки", также может быть перефразирован как "способ для определения" или как "способ для измерения".
Фактор коагуляции крови VIII представляет собой одну из серии молекул, которые являются вовлеченными в процесс коагуляции крови. Он демонстрирует активность кофактора в том случае, когда он активируется тромбином или активированным фактором коагуляции крови X, и способствует реакции активации фактора коагуляции крови X с помощью активированного фактора коагуляции крови IX. Вещества, обладающие активностью замещения фактора коагуляции крови VIII, в соответствии с настоящим изобретением являются подобными фактору коагуляции крови VIII в том, что они способствуют активации фактора коагуляции крови X с помощью активированного фактора коагуляции крови IX; однак, они отличаются от фактора коагуляции крови VIII, например, тем, что они не требуют активации с помощью тромбина или активированнго фактора коагуляции крови X.
"Вещество, обладающее активностью замещения фактора коагуляции крови VIII" в соответствии с настоящим изобретением может быть названо иначе как "вещество, обладающее активностью, подобной таковой для фактора коагуляции крови VIII". В данном изобретении фраза "функционально замещает фактор коагуляции крови VIII" означает, что вещество узнает фактор коагуляции IX (FIX) или фактор коагуляции IXa (FIXa) и фактор коагуляции крови X (FX), и способствует активации FX с помощью FIXa (способствует образованию FXa с помощью FIXa). Активность в отношении способствования образованию FXa может быть оценена при использовании, например, системы измерения, которая состоит из FIXa, FX, синтетического субстрата S-2222 (синтетический субстрат FXa) и фосфолипидов. Такая система измерения демонстрирует корреляцию между тяжестью заболевания и клиническими симптомами в случаях гемофилии A (Rosen S, Andersson М, Blomba'ck М и др. Clinical applications of a chromogenic substrate method for determination of FVIII activity. Thromb Haemost 1985; 54: 811-23).
Предпочтительные воплощения вещества, которое обладает свойством функционального замещения фактора коагуляции крови VIII, в настоящем изобретении включают, например, биспецифические антитела, которые связываются с фактором коагуляции крови IX или активированным фактором коагуляции крови IX и с фактором коагуляции крови X. Такие антитела могут быть получены в соответствии со способами, описанными, например, в WO 2005/035756, WO 2006/109592 и WO 2012/067176. В частности, антитела могут быть получены при использовании методик генетической рекомбинации, известных квалифицированному специалисту в данной области техники, на основе последовательностей антитела к фактору коагуляции крови IX и/или активированного фактора коагуляции крови IX и антитела к фактору коагуляции крови X. Полинуклеотид, который кодирует антитело, может быть сконструирован на основе последовательностей антитела к фактору коагуляции крови IX и/или активированному фактору коагуляции крови IX и антитела к фактору коагуляции крови X, с последующим встраиванием в экспрессионный вектор и экспрессией в приемлемой хозяйской клетке (смотри, например, Со, М.S. et al, J. Immunol. (1994) 152, 2968-2976; Better, M. и Horwitz, A.H., Methods Enzymol. (1989) 178, 476-496; Pluckthun, А. и Skerra, A., Methods Enzymol. (1989) 178, 497-515; Lamoyi, E., Methods Enzymol. (1986) 121, 652-663; Rousseaux, J. и др., Methods Enzymol. (1986) 121, 663-669; и Bird, R.E. и Walker, B.W., Trends Biotechnol. (1991) 9, 132-137).
Биспецифические антитела в соответствии с настоящим изобретением могут быть выделены из внутриклеточного содержимого клетки-хозяина или из внеклеточной среды (среды культивирования или др.) и очищены до существенно чистотого состояния и гомогенности. Разделение и очистка антител могут осуществляться с помощью способов, которые обычно используются для разделения и очистки антител и не ограничиваются конкретными способами. Например, антитела могут быть разделены и очищены путем соответствующего выбора и комбинирования колоночной хроматографии, фильтрации, ультрафильтрации, высаливания, осаждения растворителем, экстракции растворителем, дистилляции, иммунопреципитации, электрофореза в SDS-полиакриламидном геле, изоэлектрофокусирования, диализа, перекристаллизации и других. Биспецифические антитела в соответствии с настоящим изобретением включают антитела, описанные, например, в WO 2005/035756, WO 2006/109592 и WO 2012/067176.
Биспецифическое антитело содержит первый сайт связывания антигена и второй антигенсвязывающий сайт, которые могут специфически связываться, по крайней мере, с двумя различными антигенами. Первый сайт связывания антигена и второй сайт связывания антигена не являются специфически ограниченными до тех пор, пока они обладают активностью связывания с фактором коагуляции крови IX и/или активированным фактора коагуляции крови IX и с фактором коагуляции крови X, соответственно, но включают в себя, например, сайты, необходимые для связывания антигена, которые присутствуют в молекулах антител, молекулах скелета (подобные антителам молекулы), пептидах и других, или фрагментах, содержащих эти сайты. Молекулы скелета представляют собой молекулы, которые обладают функцией связывания с молекулами-мишенями. Могут быть использованы любые полипептиды до тех пор, пока они являются конформационно устойчивыми полипептидами, которые могут связываться, по крайней мере, с одним антигеном-мишенью. Примеры таких полипептидов включают вариабельные участки антител, фибронектин (WO 2002/032925), домен протеина A (WO 1995/001937), домен А рецептора LDL (WO 2004/044011, WO 2005/040229), анкирин (WO 2002/020565) и другие, а также молекулы, описанные у Nygren и др. (Current Opinion in Structural Biology, 7: 463-469 (1997); и Journal of Immunol Methods, 290: 3-28 (2004)), Binz и др. (Nature Biotech 23: 1257-1266 (2005)), и Hosse и др. (Protein Science 15: 14-27(2006)). Кроме того, как упоминается в Curr Opin Mol Ther. 2010 Aug; 12(4): 487-95 и Drugs. 2008; 68(7): 901-12, могут также использоваться молекулы пептидов, которые могут связываться с целевыми антигенами.
Биспецифические антитела могут быть получены, например, при использовании методик генетической рекомбинации (смотри, например, Borrebaeck CAK и Larrick JW, THERAPEUTIC MONOCLONAL ANTIBODIES, опубликовано в United Kingdom MACMILLAN PUBLISHERS LTD, 1990). Рекомбинантные антитела могут быть получены путем клонирования ДНК, которые их кодируют, из гибридом или клеток, которые вырабатывают антитела, таких, как сенсибилизированные лимфоциты, которые вырабатывают антитела, путем встраивания их в приемлемые векторы и последующего введения их в хозяев (хозяйские клетки) для получения антител.
Биспецифические антитела могут включать не только цельные антитела, но также фрагменты антител и антитела с низким молекулярным весом (минитела) и модифицированные антитела.
Например, фрагменты антител и минитела включают молекулы диател (Dbs), линейных антител и одноцепочечных антител (далее в данной заявке упоминаются также как scFvs). В данной заявке "Fv" фрагмент представляет собой наименьший фрагмент антитела, который содержит полный сайт узнавания антигена и участок связывания.
Биспецифические антитела включают человеческие антитела, мышиные антитела, крысиные антитела и другие, и их происхождение не является ограничивающим фактором. Они могут также представлять собой генетически модифицированные антитела такие, как химерные и гуманизированные антитела.
Способы получения человеческих антител являются известными в области техники. Например, трансгенные животные, которые несут полный набор генов человеческого антитела, могут быть иммунизированы с помощью желаемых антигенов с целью получения желаемых человеческих антител (смотри международные патентные заявки WO 93/12227, WO 92/03918, WO 94/02602, WO 94/25585, WO 96/34096 и WO 96/33735).
Генетически модифицированные антитела могут также быть получены при использовании известных способов. В частности, например, химерные антитела состоят из вариабельных участков Н цепи и L цепи антитела иммунизированного животного и константных участков Н цепи и L цепи человеческого антитела. Химерные антитела могут быть получены путем связывания ДНК, кодирующей вариабельные участки антитела, которое имеет происхождение от иммунизированного животного, с ДНК, кодирующей константные участки человеческого антитела, встраивания полученного продукта в экспрессионный вектор и последующего введения его в хозяйские клетки для получения антител.
Гуманизированные антитела представляют собой модифицированные антитела, которые также называются измененными человеческими антителами. Гуманизированное антитело конструируют путем переноса CDR антитела, которое имеет происхождение от иммунизированного животного, на участки, определяющие комплементарность человеческого антитела. Традиционные методики генетической рекомбинации являются известными для этих целей (смотри публикацию европейской патентной заявки ЕР 239400; международную публикацию WO 96/02576; Sato K и др., Cancer Research 1993, 53: 851-856; международную публикацию WO 99/51743).
В данном изобретении образец крови, который содержит вещество, обладающее активностью замещения фактора коагуляции крови VIII, является полученным от субъекта. Такой образец крови может быть получен от субъекта, которому было введено вещество, обладающее активностью замещения фактора коагуляции крови VIII. Субъекты включают пациентов с геморрагическими симптомами в любой части тела (пациенты с геморрагическим заболеванием). Основные типы кровотечений включают, например, внутрисуставное, внутримышечное, подкожное, интраоральное, внутричерепное, кровотечение желудочно-кишечного тракта и интраназальное, но не ограничиваются таковыми. Пациенты с геморрагическим заболеванием предпочтительно включают пациентов с геморрагическим заболеванием, вызванным пониженной или дефектной активностью фактора коагуляции крови VIII и/или активированного фактора коагуляции крови VIII. Примеры пациентов с геморрагическим заболеванием, вызванным пониженной или дефектной активностью фактора коагуляции крови VIII и/или активированного фактора коагуляции крови VIII, включают пациентов с геморрагическим симптомом, который является врожденным или приобретенным, сниженной или недостаточной активностью какого-либо одного или обоих факторов коагуляции крови VIII и активированного фактора коагуляции крови VIII. Сниженная активность фактора коагуляции крови VIII и активированного фактора коагуляции крови VIII относится, например, к пациенту, у которого активность этих факторов предпочтительно составляет менее чем 40% (например, менее чем 40%, менее чем 30%, менее чем 20%, или менее чем 10%), более предпочтительно, менее чем 10% (например, менее чем 10%, менее чем 9%, менее чем 8%, менее чем 7% и менее чем 6%), даже более предпочтительно, менее чем 5% (например, менее чем 5%, менее чем 4%, менее чем 3%, или менее чем 2%) и особенно предпочтительно, менее чем 1% от таковой для здорового индивидуума, но также не ограничивается таковыми. Способы определения активности фактора коагуляции крови VIII и активированного фактора коагуляции крови VIII являются хорошо известными квалифицированному специалисту в данной области техники (например, "Minna ni yakudatsu ketsuyuubyou no kiso to rinshou (Widely useful basics и clinics of hemophilia)" Shirahata, A., Iyaku (Medicine и Drug) Journal, 2009).
В частности, пример таких заболеваний является выбранным из гемофилии (гемофилии А и гемофилии В), приобретенной гемофилии и болезни Виллебранда, вызванной вызванной дисфункцией или дефицитом фактора Виллебранда (vWF), но не ограничивается таковыми. Образцы крови включают сыворотку, плазму крови или цельную кровь. В данном изобретении предпочтительно используются образцы плазмы крови. Способы получения образцов крови от субъектов являются хорошо известными квалифицированному специалисту в данной области техники.
В данном изобретении активированный фактор коагуляции крови XI или реагент инициации коагуляции крови, содержащий активированный фактор коагуляции крови XI, прибавляют к образцам крови, полученной от упомянутых выше субъектов.
Активированный фактор коагуляции крови в соответствии с настоящим изобретением может быть очищен и получен с помощью активации фактора коагуляции крови XI при использовании активированного фактора коагуляции крови XII, тромбина, или других и очистки его с помощью хроматографии такой, как ионообменная хроматография, хроматография с обращенной фазой или гель-фильтрационная хроматография, или путем аффинной хроматографии при использовании колонки, на которой иммобилизуют антитело к активированному фактору коагуляции крови XI, или путем дополнительного соединения множества таких колонок.
Аминокислотная последовательность человеческого фактора коагуляции крови XI и нуклеотидная последовательность нуклеиновой кислоты, кодирующей эту аминокислотную последовательность, являются известными как GenBank: NP_000119 (SEQ ID NO: 2) и NM_000128 (SEQ ID NO: 1), соответственно. Однако фактор коагуляции крови XI, упомянутый в данной заявке, не ограничивается человеческим фактором коагуляции крови XI, и он может иметь происхождение от других видов животных (например, лошадей, коров, свиней, кроликов, крыс или мышей). Фактор коагуляции крови XI может представлять собой существующий в природе белок или может быть получен в виде рекомбинантного белка при использовании известных методик генетической рекомбинации. Рекомбинантные белки могут быть получены с помощью способов, известных квалифицированному специалисту в данной области техники. Рекомбинантный белок может быть получен, например, путем введения нуклеиновой кислоты, кодирующей фактор коагуляции крови XI, в подходящий экспрессионный вектор, введения его в подходящую хозяйскую клетку и сбора полученного трансформанта, получения экстракта и последующей его очистки с помощью хроматографии такой, как ионообменная хроматография, хроматография с обращенной фазой или гель-фильтрационная хроматография, или с помощью аффинной хроматографии на колонке, на которой иммобилизуют антитело к активированному фактору коагуляции крови XI, или путем дополнительного соединения множества таких колонок.
Кроме того, когда фактор коагуляции крови XI экспрессируется в хозяйской клетке (например, клетках животных или клетках Escherichia coli) в виде слитого полипептида при использовании белка глутатион S-трансферазы или в виде рекомбинантного полипептида с несколькими дополнительными гистидинами, экспрессированный рекомбинантный полипептид может быть очищен при использовании колонки с глутатионом или колонки с никелем.
Тогда, когда, например, Е.coli используется в качестве хозяина, упомянутый выше вектор не имеет особых ограничений, пока он имеет точку начала репликации для амплификации в Е.coli, так, что вектор подвергается амплификации и его получают в большом объеме в Е.coli (такой, как JM109, DH5α, НВ101, XL1Blue), а также дополнительно содержит ген для селекции трансформированной Е.coli (например, ген устойчивости к лекарственному средству, который позволяет осуществлять скрининг при использовании определенного лекарственного средства (ампициллин, тетрациклин, канамицин, хлорамфеникол). Примеры таких векторов включают М13 векторы, pUC векторы, pBR322, pBluescript, pCR-Script и другие. Альтернативно, тогда, когда целью является субклонировать и вырезать кДНК, такие векторы включают, например, pGEM-T, pDIRECT, рТ7 и другие, в дополнение к векторам, описанным выше. Экспрессионные векторы являются особенно полезными тогда, когда используют векторы для получения фактора коагуляции крови XI. Например, тогда, когда целью является экспрессия в Е.coli, такой как JM109, DH5α, НВ101 и XL1-Blue, экспрессионные векторы не только имеют характеристики, которые позволяют осуществлять амплификацию вектора в Е.coli, а также должны нести промотор, которые позволяет осуществлять эффективную экспрессию в Е.coli, например, lacZ промотор (Ward и др., Nature (1989) 341: 544-546; FASEB J. (1992) 6: 2422-2427), araB промотор (Better и др., Science (1988) 240: 1041-1043), Т7 промотор или другие. Такие векторы включают pGEX-5X-l (Pharmacia), "QIAexpress system" (Qiagen), pEGFP, pET и другие, в дополнение к векторам, описанным выше.
Векторы могут также содержать сигнальную последовательность для секреции полипептида. В качестве сигнальной последовательности для секреции полипептида может использоваться сигнальная последовательность pelB (Lei, S.Р. и др. J. Bacteriol. (1987) 169: 4379) тогда, когда полипептид экспрессируется в периплазму Е.coli. Введение вектора в хозяйские клетки может осуществляться, например, при использовании хлорида кальция или способов электропорации.
В дополнение к векторам для Е.coli, такие векторы включают векторы для экспрессии в клетках млекопитающих (например, pcDNA3 (Invitrogen), pEGF-BOS (Nucleic Acids. Res. 1990, 18(17): p 5322), pEF, и pCDM8), например, экспрессионные векторы, которые имеют происхождение от насекомых (например, "Bac-to-BAC бакуловирусная экспрессионная система" (Gibco-BRL) и pBacPAK8), экспрессионные векторы, которые имеют происхождение от растений (например, рМН1 и рМН2), экспрессионные векторы, которые имеют происхождение от животных (например, pHSV, pMV и pAdexLcw), экспрессионные векторы на основе ретровирусов (например, pZIPneo), дрожжевые экспрессионные векторы (например, "Pichia Expression Kit" (Invitrogen), pNV11 и SP-Q01) и экспрессионные веторы на основе Bacillus subtilis (например, pPL608 и pKTH50).
Тогда, когда целью является экспрессия в клетках животных таких, как СНО, COS и NIH3T3 клетки, такие векторы должны содержать промотор, который является существенным для экспрессии в клетках, например, SV40 промотор (Mulligan и др., Nature (1979) 277: 108), MMLV-LTR промотор, EF1α промотор (Mizushima и др., Nucleic Acids Res. (1990) 18: 5322), CMV промотор и другие более предпочтительно должны иметь ген для селекции трансформированных клеток (например, ген устойчивости к лекарственному средству, который позволяет осуществлять скрининг при использовании лекарственного средства (неомицин, G418 или другие)). Векторы с такими характеристиками включают, например, рМАМ, pDR2, pBK-RSV, pBK-CMV, pOPRSV и pOP13.
Системы для получения полипептида in vivo включают, например, продукционные системы при использовании животного или растения. Нуклеиновая кислота, которая кодирует фактор коагуляции крови XI, вводится в животное или растение, и фактор коагуляции крови XI вырабатывается в организме животного или растения и потом собирается.
В том случае, когда используется животное, могут применяться продукционные системы при использовании животного или насекомого. Млекопитающие, которые могут использоваться, включают коз, свиней, овец, мышей и крупный рогатый скот (Vicki Glaser, SPECTRUM Biotechnology Applications, 1993). В том случае, когда используется животное, может применяться трансгенное животное.
Фактор коагуляции крови XI, полученный так, как описано выше, можно выделить из внутреннего содержимого клетки-хозяина или внеклеточной среды, окружающей эти клетки (среды выращивания или др.), и очистить как существенно чистый и однородный полипептид. Выделение и очистка пептида может быть осуществлена с помощью способов, которые обычно используются для выделения и очистки полипептидов, и не являются ограниченными. Например, полипептиды могут быть выделены и очищены путем соответствующего выбора и комбинирования колоночной хроматографии, фильтрации, ультрафильтрации, высаливания, осаждение растворителем, экстракции растворителем, дистилляции, иммунопреципитации, электрофореза в SDS-полиакриламидном геле, изоэлектрофокусирования, диализа, перекристаллизации и других.
Необязательная модификация или частичное удаление пептида также является возможным путем воздействия фермента на фактор коагуляции крови XI до или после очистки для приемлемой белковой модификации. Примеры ферментов для модификации белка, которые могут быть использованы, включают трипсин, химотрипсин, лизил эндопептидазу, протеинкиназу и глюкозидазу.
Кроме того, фактор коагуляции крови XI также включает белки, которые имеют одно или более изменений аминокислот и являются потенциально способными к активации фактора коагуляции крови IX в активированный фактор коагуляции крови IX. В этом контексте фрагменты фактора коагуляции крови XI также включаются.
При изменении аминокислотного остатка аминокислота предпочтительно мутирует на другую аминокислоту(ы), которая сохраняет свойства аминокислотной боковой цепи. Примеры свойств аминокислотных боковых цепей представляют собой: гидрофобные аминокислоты (A, I, L, М, F, Р, W, Y и V), гидрофильные аминокислоты (R, D, N, С, Е, Q, G, Н, K, S и Т), аминокислоты, содержащие алифатические боковые цепи (G, А, V, L, I и Р), аминокислоты, содержащие боковые цепи с группой гидроксила (S, Т и Y), аминокислоты, содержащие боковые цепи, включающие серу (С и М), аминокислоты, содержащие боковые цепи, включающие карбоновую кислоту, и боковые цепи, включающие амид (D, N, Е и Q), аминокислоты, содержащие основные боковые цепи (R, K и Н), и аминокислоты, содержащие ароматические боковые цепи (Н, F, Y и W) (аминокислоты являются представленными в однобуквенном коде в скобках). Аминокислотные замены в пределах каждой группы называется консервативными заменами. Уже известно, что полипептид, содержащий модифицированную аминокислотную последовательность, в которой один или несколько аминокислотных остатков (например, 2, 3, 4, 5, 10, 20, 30, 40, 50 или 100 остатков) в данной аминокислотной последовательности удаляются, добавляются и/или замещаются другой аминокислотой, могут сохранять исходную биологическую активность (Mark, D.F. и др., Proc. Natl. Acad. Sci. USA; (1984) 81: 5662-6; Zoller, M.J. и Smith, M., Nucleic Acids Res. (1982) 10: 6487-500; Wang, А. и др., Science (1984) 224: 1431-3; Dalbadie-McFarland, G. и др., Proc. Natl. Acad. Sci. USA (1982) 79: 6409-13). Такие мутанты имеют аминокислотную идентичность аминокислотной последовательности, по крайней мере 70%, более предпочтительно, по крайней мере 75%, еще более предпочтительно, по крайней мере 80%, еще более предпочтительно, по крайней мере 85%, еще более предпочтительно, по крайней мере 90%, и наиболее предпочтительно, по крайней мере 95%, с фактором коагуляции крови XI или с фрагментом фактора коагуляции крови XI до изменения аминокислот. При этом идентичность последовательностей определяется как процент остатков, идентичных таковым в исходной аминокислотной последовательности вариабельного участка тяжелой цепи или легкой цепи, как определяется после выравнивания последовательностей, и пробелы являются введенными соответствующим образом для того, чтобы максимизировать идентичность последовательности в случае необходимости.
Идентичность нуклеотидных последовательностей или аминокислотных последовательностей может быть определена при использовании алгоритма BLAST, разработанного Karlin и Altschul (Proc. Natl. Acad. Sci. USA 87: 2264-2268, 1990; и Proc. Natl. Acad. Sci. USA 90: 5873, 1993). Программы под названием BLASTN и BLASTX были усовершенствованы на основе алгоритма BLAST (Altschul SF и др., J. Mol. Biol. 215: 403, 1990). Когда нуклеотидные последовательности подвергаются анализу при использовании BLASTN, то параметры представляют собой, например, балл = 100 и длина слова = 12. Когда нуклеотидные последовательности подвергаются анализу при использовании BLASTX, то параметры представляют собой, например, балл = 50 и длина слова = 3. Когда используются программы BLAST и BLAST с пробелами, то для каждой программы используются параметры по умолчанию. Специфические методики для этих способов анализа являются известными в области техники.
Способы получения ДНК, кодирующей белок с модифицированной аминокислотной последовательностью, которые являются известными специалистам в данной области техники, включают сайт-направленный мутагенез (Kramer, W. и Fritz, H.-J. (1987) Oligonucleotide-directed construction of mutagenesis via gapped duplex DNA. Methods in Enzymology, 154: 350-367), гибридизационные методики (Southern, E.M. (1975) Journal of Molecular Biology, 98, 503) и методики на основе ПЦР (Saiki, R.K. и др. (1985) Science, 230, 1350-1354; Saiki, R.K. и др. (1988) Science, 239, 487-491).
В данном изобретении является предпочтительным прибавлять фосфолипиды к активированному фактору коагуляции крови XI. Фосфолипиды не являются особым образом ограниченными в данном изобретении. Примеры фосфолипидов включают фосфатидилсерин, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилинозитол, фосфатидилглицерин, фосфатидилглицерин и сфингомиелин, а также комбинации двух или более из них, но не ограничивается таковыми. В данном изобретении сочетание фосфатидилсерина, фосфатидилхолина является предпочтительным, а также является предпочтительным фосфатидилэтаноламин.
В данном изобретении активированный фактор коагуляции крови XI может использоваться в форме реагента и прибавляться к образцам крови, полученным от субъектов. В данном изобретении такой реагент называется "реагентом инициации коагуляции крови". "Реагент инициации коагуляции крови" в соответствии с настоящим изобретением может содержать фосфолипиды и соли кальция, магния и др. в дополнение к активированному фактору коагуляции крови XI.
Активированный фактор коагуляции крови XI и/или фосфолипиды могут прибавляться к образцу, полученному из крови в количестве, достаточном для измерения количества образованного тромбина, как будет описано ниже. Активированный фактор коагуляции крови XI может прибавляться, например, в количестве от 0,00001 пмоль до 1000 нмоль на мл образца плазмы крови, но не ограничиваясь таковым. Кроме того, фосфолипиды могут прибавляться, например, в количестве от 0,001 нмоль до 10000 нмоль на мл образца плазмы крови, но не ограничиваясь таковым.
В данном изобретении измеряется количество тромбина, который образовался в образце крови, полученном на этих этапах. Авторы настоящего изобретения выяснили, что кофакторная активность биспецифического антитела, которое связывается с фактором коагуляции крови IX или активированным фактором коагуляции крови IX и с фактором коагуляции крови X, может оцениваться при использовании количества тромбина, которое образовалось в образце крови, в качестве индикатора. То есть, настоящее изобретение обеспечивает способ для оценки реакции коагуляции крови, которая опосредуется веществом, обладающим активностью замещения фактора коагуляции крови VIII (предпочтительно биспецифическим антителом, которое связывается с фактором коагуляции крови IX или активированным фактором коагуляции крови IX и с фактором коагуляции крови X), при использовании количества тромбина, которое образовалось в образце крови, в качестве индикатора. Количество тромбина, которое образовалось в образце крови, может измеряться с помощью способов, хорошо известных квалифицированному специалисту в данной области техники. Например, оно может измеряться путем прибавления реагента для превращения количества тромбина в образце и подсчета максимального количества тромбина (высота пика) и общего количества тромбина (ЕТР) при использовании коммерчески доступных устройств, без ограничения таковыми.
В данном изобретении кофакторная активность биспецифического антитела, которое связывается с фактором коагуляции крови IX или активированным фактором коагуляции крови IX и с фактором коагуляции крови X, может оцениваться с приемлемой чувствительностью при использовании количества тромбина, которое образовалось в образце крови, в качестве индикатора. Кофакторная активность, необходимая для гемостатического эффекта может быть оценена на основе, например, корреляция между клиническим эффектом вещества, обладающего активностью замещения фактора коагуляции крови VIII, и количеством тромбина в способе в соответствии с настоящим изобретением, или сравнения количества тромбина, которое образовалось в образце крови, содержащем вещество, обладающее активностью замещения фактора VIII, и количества тромбина, которое образовалось в образце крови, содержащем активность фактора коагуляции крови VIII, в способе в соответствии с данным изобретением. Например, если в данном изобретении концентрации активированного фактора коагуляции крови XI и фосфолипидов в реагенте инициации коагуляции крови подбираются так, чтобы самый низкий, способный к определению уровень реакции образования тромбина, который можно было увидеть в образце крови, содержащем активность фактора коагуляции крови VIII (фактор VIII: С) 1% или в образце крови с добавлением фактора коагуляции крови VIII с целью достижения FVIII: С 1%, то вещество, имеющее активность замещения фактора коагуляции крови VIII, которое вводится субъекту, может быть оценено как такое, которое обладает активностью индукции реакции коагуляции крови, то есть, как такое, которое обладает кровоостанавливающим (гемостатическим) действием, при использовании наличия реакции образования тромбина. Альтернативно, в данном изобретении, например, тогда, когда количество тромбина, которое образовалось в образце крови, полученном от субъекта (пациент с тяжелой гемофилией), который получил вещество, имеющее активность замещения фактора коагуляции крови VIII, примерно такое же, как или больше, чем количество тромбина, которое образовалось в образце, полученном путем добавления 0,01 ед./мл фактора коагуляции крови VIII к образцу, полученному из крови от того же субъекта, который не содержит вещества, имеющего активность замещения фактора коагуляции крови VIII, или находится в таком состоянии, что активность вещества не показана (образец для сравнения), то вещество, обладающее активностью замещения фактора коагуляции крови VIII, которое вводят субъекту, может быть оценено как такое, которое обладает активностью индукции реакции коагуляции крови, то есть, обладет гемостатическим эффектом. Выражение "количество образовавшегося тромбина является примерно таким же" может означать, что количество тромбина, которое образовалось в образце крови от субъекта, которому вводили вещество, имеющее активность замещения фактора коагуляции крови VIII, составляет, например, плюс или минус 100% или менее, предпочтительно 50% или менее, особенно предпочтительно 20% или менее от количества тромбина, которое образуется в сравнительном образце, но не ограничивается таковым. Количество тромбина, которое образуется, может быть определено с использованием, например, максимального количества тромбина (высота пика) и общего количества тромбина (ЕТР) в качестве индикаторов.
Кроме того, настоящее изобретение обеспечивает реагенты инициации коагуляции крови, которые используются для оценки реакции коагуляции крови в соответствии с настоящим изобретением. Реагенты инициации коагуляции крови в соответствии с настоящим изобретением содержат активированный фактор коагуляции крови XI. Реагенты инициации коагуляции крови в соответствии с настоящим изобретением могут дополнительно содержать фосфолипиды. Примеры фосфолипидов описываются выше. Реагенты инициации коагуляции крови в соответствии с настоящим изобретением могут дополнительно включать соли кальция, магния и другие.
Выражение "реагент инициации коагуляции крови, который используется для оценки реакции коагуляции крови в соответствии с настоящим изобретением" может также быть перефразировано как "применение активированного фактора коагуляции крови XI или активированного фактора коагуляции крови XI и фосфолипидов для получения реагента инициации коагуляции крови, который используется для оценки реакции коагуляции крови". Кроме того, это выражение может быть перефразировано как "активированный фактор коагуляции крови XI или активированный фактор коагуляции крови XI и фосфолипиды для применения в оценке реакции коагуляции крови". Кроме того, реагент инициации коагуляции крови в соответствии с настоящим изобретением может называться как "способ получения реагента инициации коагуляции крови для оценки реакции коагуляции крови, который включает этап рецептирования активированного фактора коагуляции крови XI или активированного фактора коагуляции крови XI и фосфолипидов с фармацевтически или физиологически приемлемым носителем". В данной заявке активированный фактор коагуляции крови XI включает фактор коагуляции крови XI при условии, что он прибавляется извне по отношению к образцу крови. Активированный фактор коагуляции крови XI в соответствии с настоящим изобретением может представлять собой любой из тех, которые являются коммерчески доступными, очищенный из плазмы крови или такой, который получен при использовании методик генетической рекомбинации. Способы их получения являются хорошо известными квалифицированному специалисту в данной области техники.
Различные реагенты такие, как реагент инициации коагуляции крови, необходимый для осуществления способа оценки реакции коагуляции крови в соответствии с настоящим изобретением, могут быть упакованы заранее и быть представлены в виде комплекта. Комплект в соответствии с настоящим изобретением может включать в себя, в дополнение к реагенту инициации коагуляции крови, положительный контроль образца плазмы крови, полученного от человека, активность фактора коагуляции крови VIII и активность фактора коагуляции крови IX которого в крови находятся в норме, вещество, обладающее активностью замещения фактора коагуляции крови VIII, и материалы, которые могут быть использованы в анализе образования тромбина (например, флуорогенный субстрат для тромбина, реагент для преобразования количества тромбина в образце и другие). Кроме того, различные реагенты, которые входят в состав комплекта, могут быть в виде порошка или могут находиться в жидкой форме в соответствии со способом их использования. Кроме того, они могут храниться в соответствующих контейнерах и использоваться тогда, когда это является приемлемым.
Все упоминания предшествующего уровня техники, приведенные в данной заявке, являются включенными в качестве ссылок в данное описание.
Примеры
Ниже настоящее изобретение будет специфически описано со ссылкой на Примеры, но они не должны при этом трактоваться как такие, которые его ограничивают.
Получение биспецифических антител к FIXa/FX, которые обладают активностью замещения функции FVIII, и измерение активности функции замещения FVIII
Биспецифические антитела к FIXa/FX, которые обладают активностью замещения функции FVIII, были получены с помощью способов, описанных в WO 2005/035756, WO 2006/109592 и WO 2012/067176. Гены антитела, описанные в WO 2005/035756, WO 2006/109592 и WO 2012/067176, были встроены в экспрессионный вектор клеток животных, и их трансфицировали в клетки HEK293 для временной экспрессии биспецифических антител. После этого биспецифические антитела, содержащиеся в супернатанте клеточной культуры, очищали при использовании гель-фильтрации на основе протеина А.
Измерение активности замещения функции фактора VIII очищенных таким образом биспецифических антител осуществляли с помощью следующего ферментного анализа. При комнатной температуре 1 нМ человеческого FIXa (Enzyme Research Laboratories), 140 нМ человеческого FX (Enzyme Research Laboratories), 20 мкМ фосфолипидов (10% фосфата дилсерина, 60% фосфатидилхолина и 30% фосфатадилэтаноламина) и биспецифические антитела смешивали в водном физиологическом растворе, забуференном Трис, содержащем 5 мМ CaCl2 и 0,1% бычьего сывороточного альбумина, и инкубировали в течение двух минут для того, чтобы позволить развиться реакции активации FX с помощью FIXa. Эту реакцию останавливали путем прибавления ЭДТА. После этого прибавляли специфический для FXa раствор хромогенного субстрата S-2222 (CHROMOGENIX) и измеряли изменения оптической плотности при 405 нм при использовании SpectraMax 340РС384 (Molecular Devices). Калибровочную кривую получали из изменений оптической плотности при использовании известных концентраций человеческого FXa (Enzyme Research Laboratories), и биспецифические антитела подвергали оценке на активность способствования образованию FXa.
Измерение АРТТ
Измерение осуществляли при использовании Thrombocheck APTT-SLA (Sysmex) в качестве АРТТ реагента и в соответствии со стандартной прописью измерения АРТТ. К 50 мкл дефектной по фактору VIII (FVIII) плазмы крови человека (коммерческий продукт от George King Bio-Medical) или дефектной по VIII (FVIII) плазмы с ингибитором (коммерческий продукт от George King Bio-Medical), содержащей биспецифическое антитело или рекомбинантный человеческий FVIII (rhFVIII, Bayer), добавляли 50 мкл реагента АРТТ. После инкубации в течение трех минут прибавляли 50 мкл 0,02 моль/л раствора хлористого кальция для инициации реакции коагуляции, и АРТТ измеряли при использовании автоматического анализатора свертывания крови (КС4 Delta, Trinity Biotech).
Анализ образования тромбина
Тромбограмму получали с помощью откалиброванной автоматизированной тромбографии при использовании флуорометра с планшетом на 96 ячеек (Thermo Fisher Scientific Instruments), оснащенного набором фильтров для длины волны возбуждения 390 нм / длины волны флуоресценции 460 нм, устройства для рыспыления, программного обеспечения для анализе (программное обеспечение Thrombinoscope версия 3.0.0.29, Thrombinoscope BV). В каждую ячейку прибавляли 80 мкл плазмы крови человека, дефектной по фактору VIII (FVIII), или плазмы, дефектной по FVIII, с ингибитором (George King Bio-Medical), содержащей биспецифическое антитело или рекомбинантный фактор VIII человека (rhFVIII, Bayer). После это прибавляли 20 мкл реагента инициации коагуляции (реагент FXIa/фосфолипид), содержащего 0,47 нМ человеческого фактора XIa (Enzyme Research Laboratories) и 20 мкМ фосфолипидов или РРР-Reagent LOW (Thrombinoscope BV). Для преобразования в количество тромбина прибавляли 20 мкл калибратора тромбина (Thrombinoscope BV) вместо реагента инициации коагуляции. Для инициирования реакции 20 мкл FluCa реагента, полученного из FluCa комплекта (Thrombinoscope BV), автоматически распределяли из запрограммированного устройства. Тромбограмму, высоту пика (максимальное количество тромбина) и ЕТР (общее количество тромбина) подсчитывали при использовании программного обеспечения устройства.
Модель гемофилии А
Гибридомы получали из мышей, иммунизированных человеческим FVIII, а затем идентифицировали анти-FVIII нейтрализующие антитела, которые перекрестно реагируют с таковым макак циномолгус, но не с таковым свиньи. Перекрестная реактивность с макаками циномолгус и свиньи была подтверждена путем добавления антитела к плазме с цитратом для каждого животного и определения, ингибируется ли коагуляции с помощью АРТТ, или анализа образования тромбина. Это антитело к фактору VIII вводили макакам циномолгус в дозе, которая позволяет двукратно продлить АРТТ, для получения состояния приобретенной гемофилии А. После этого животным внутривенно вводили в качестве исследуемого лекарственного средства 0,3 мг/кг hBS23 (N=3), которое представляет собой одно из биспецифических антител, или 1 ед./кг фактора VIII свиньи (N=3). Фактор VIII свиньи получали и очищали обычными способами с использованием методов генной рекомбинации. Группа без введения препарата (N=6) была также создана в качестве контроля. Кровотечение вызывали искусственно у животных под наркозом (мышцы предплечья, плеча и бедра прокалывали при использовании иглы 18G), а затем за животными наблюдали в течение последующих трех дней. В группе, которой вводили 1 ед./кг фактора VIII свиньи, осуществляли дополнительноен введение 1 ед./кг фактора VIII свиньи внутривенно животному дважды в день (в общей сложности шесть раз; без введения в последний день наблюдения). Это схема предназначена для поддержания активности FVIII в плазме крови на уровне 0,01 ед./мл или более. В качестве индикаторов для кровотечения использовали значения гемоглобина (отражающие анемию из-за потери крови) и фиолетовый цвет участка кожи (балл кровотечения)
Результаты
<Активность замещения функции FVIII для биспецифического антитела>
Одно из биспецифических антител, hBS23, продемонстрировало активность в отношении способствования образованию FXa в присутствии комбинации FIXa/FX/фосфолипиды, демонстрируя тот факт, что оно обладало активностью замещения функции FVIII (Фиг. 1).
<In vivo гемостатическая активность антитела>
У контрольных животных наблюдали прогрессивное снижения значения гемоглобина и увеличение площади фиолетового цвета участка кожи спустя три дня. Эти последствия подавлялись с помощью одного внутривенного введения hBS23 или с помощью повторяемого внутривенного введения (два раза в день) 1 ед./кг FVIII свиньи. Степень подавления была приблизительно одинаковой в обоих случаях.
Концентрация hBS23 в плазме крови в течение периода проведения эксперимента составляла приблизительно 30 нМ (от 40 до 18 нМ в среднем на группу), что дает возможность предположить, что hBS23 приблизительно в этой концентрации обладает гемостатической активностью, которая примерно является равной таковой для режима поддержания активности FVIII в плазме крови на уровне 0,01 ед./мл (1% активности FVIII) или более (повторяемые внутривенные введения (два раза в день) 1 ед./кг FVIII свиньи).
<Активность биспецифического антитела в анализе плазмы крови>
Одно из биспецифических антител, hBS23, повышало высоту пика (максимальное количество тромбина) и ЕТР (общее количество тромбина), которые представляют собой параметры для образования тромбина, зависимым от концентрации образом при условиях индукции при использовании реагента FXIa/фосфолипид в дефектной по FVIII плазме крови (Фиг. 2). В соответствии с анализом высоты пика 30 нМ hBS23 имело активность, соответстствующую 0,01 ед./мл rhFVIII (1% активности FVIII) и 300 нМ hBS23 имело активность, близкую к 0,1 ед./мл rhFVIII (10% активности FVIII). Как описывается выше, в анализе in vivo гемостатическую активность, эквивалентную таковой для режима поддержания активности FVIII в плазме крови на уровне 0,01 ед./мл (1% активности FVIII) или более, получали путем поддержания концентрации hBS23 на уровне приблизительно 30 нМ. Таким образом, было высказано предположение, что анализ образования тромбина может представлять собой способ мониторинга, который отражает гемостатическое действие hBS23 с приемлемой чувствительностью.
С другой стороны, тогда, когда проводили анализ образования тромбина при условиях индукции с помощью PPP-Reagent LOW (реагент инициации коагуляции, содержащий низкую концентрацию тканевого фактора), измерение чувствительности активности hBS23 и hFVIII было ниже по сравнению с таковым при условиях индукции с помощью реагента FXIa/фосфолипид, и, таким образом, приемлемое отражение in vivo гемостатического действия считали сложным. Кроме того, тогда, когда значение АРТТ использовали для оценки сспецифической для FVIII активности hBS23, специфическая активность hBS23 при 30 нМ или более подсчитывалась как 1 ед./мл (100% активности FVIII) или более FVIII. Этот результат дает возможность предположить, что FVIII активность hBS23, подсчитанная из значения АРТТ, может быть большей, чем гемостатическое действие в анализе in vivo.
Промышленная применимость
Настоящее изобретение обеспечивает способ для оценки эффекта биспецифического антитела, которое обладает свойством функционального замещения FVIII в реакции коагуляции крови. Путем применения способов в соответствии с настоящим изобретением является возможным определить с приемлемой чувствительностью эффект такого биспецифического антитела в лечении геморрагического заболевания такого, как гемофилия.





Изобретение относится к фармацевтической промышленности, а именно к способу оценки реакции коагуляции крови. Предлагается способ оценки реакции коагуляции крови, которая опосредуется веществом, обладающим активностью замещения фактора коагуляции крови VIII; применение реагента инициации коагуляции крови в способе оценки реакции коагуляции крови; набор для оценки реакции коагуляции крови. Вышеуказанный способ является точной оценкой биоспецифических антител в отношении их эффекта при лечении геморрагических заболеваний. 3 н. и 6 з.п. ф-лы, 2 ил.
1. Способ оценки реакции коагуляции крови, которая опосредуется веществом, обладающим активностью замещения фактора коагуляции крови VIII, где способ включает следующие этапы:
(I) прибавление реагента инициации коагуляции крови, включающего активированный фактор коагуляции крови XI, к образцу крови, полученному от субъекта, где образец включает вещество, обладающее активностью замещения фактора коагуляции крови VIII; и
(II) измерение количества тромбина, образовавшегося в образце крови, полученном на этапе (I).
2. Способ по п. 1, где вещество, которое обладает активностью замещения фактора коагуляции крови VIII, представляет собой биспецифическое антитело, которое связывается с фактором коагуляции крови IX или активированным фактором коагуляции крови IX и с фактором коагуляции крови X.
3. Способ по п. 1 или 2, где субъект представляет собой пациента с геморрагическим заболеванием.
4. Способ по п. 3, где геморрагическое заболевание представляет собой заболевание, вызванное пониженной или дефектной активностью фактора коагуляции крови VIII или активированного фактора коагуляции крови VIII.
5. Способ по п. 3, где геморрагическое заболевание представляет собой заболевание, выбранное из группы, которая состоит из гемофилии, приобретенной гемофилии и болезни Виллебранда, вызванной дисфункцией или дефицитом фактора Виллебранда (vWF).
6. Способ по п. 1, где реагент инициации коагуляции крови представляет собой реагент, который включает активированный фактор коагуляции крови XI и фосфолипид.
7. Применение реагента инициации коагуляции крови, включающего активированный фактор коагуляции крови XI, в способе оценки реакции коагуляции крови по любому из пп. 1-6.
8. Применение реагента инициации коагуляции крови по п. 7, где реагент инициации коагуляции крови дополнительно включает фосфолипид.
9. Набор для оценки реакции коагуляции крови, включающий реагент инициации коагуляции крови, содержащий активированный фактор коагуляции крови XI, положительный контроль образца плазмы крови и материалы, используемые в анализе образования тромбина.
| СПОСОБ ПОЛУЧЕНИЯ ТЕХНИЧЕСКИ ЧИСТОГО ПЛАВЛЕНОГО ДИОКСИДА ЦИРКОНИЯ ПУТЕМ ДУГОВОГО РАЗЛОЖЕНИЯ ЦИРКОНА | 2020 |
|
RU2746386C1 |
| WO 9844352 А1, 08.10.1998 | |||
| US 2007041978 A1, 22.02.2007 | |||
| US 2012237517 A1, 20.09.2012. | |||
Авторы
Даты
2019-04-03—Публикация
2013-09-26—Подача