Область техники
Изобретение относится к области органической химии, связанной с синтезом производных изоксазола, а также к области органической химии, связанной с синтезом фторсодержащих органических соединений, а именно к новым 5-фторизоксазолам, а также способам их получения. Полученные при реализации данного изобретения соединения общей формулы (I), где R выбирают из 3-Cl, 3-Br, 3-NO2, 2-Cl, 2-NO2, 4-NO2, 4-Cl, 4-Br, 4-F, Н.
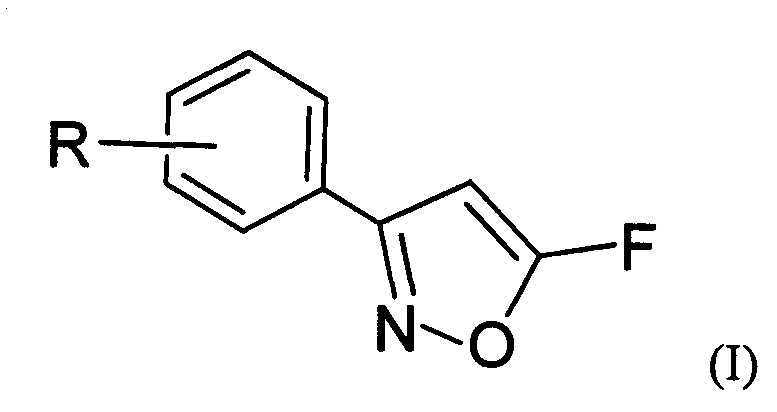
могут быть использованы в лекарственных препаратах и агрохимикатах в качестве действующего вещества, предположительно проявляющего антинематодные и антигельминтные свойства [Gibbons, L.K. US Patent 3781438, 1973; J.B. Carr, H.G. Durham, D.K. Hass. J. Med. Chem., 1977, 20, 934.], а также в качестве прекурсоров в синтезе биологически активных веществ [Ф.А. Лахвич, Е.В. Королева, А.А. Ахрем, Химия гетероцикл. соедин. 1989, №4, 435-453. Baraldi P.G.; Barco A.; Benetti S.; Pollini G.P.; Simoni D. The Use of Isoxazoles as 1,3 Dicarbonyl Equivalents in Organic Synthesis. Synthesis. 1987, 857.  M.; Flasik, R.; Khan, A.F.; Spina, M.; Mihovilovic, M.D.; Stanetty, P. Eur. J. Org. Chem. 2006, 3283-3307].
M.; Flasik, R.; Khan, A.F.; Spina, M.; Mihovilovic, M.D.; Stanetty, P. Eur. J. Org. Chem. 2006, 3283-3307].
Уровень техники
Производные изоксазола с каждым годом находят все более широкое применение в качестве объектов для фармакологических исследований и входят в состав лекарственных препаратов различного назначения, среди которых: Arava (действующее вещество - лефлюномид,); Bextra (действующее вещество - вальдекоксиб); Marplan (действующее вещество - изокарбоксазид); Sulfafurazole [Pevarello, P.; Amici, R.; Brasca, M.G.; Villa, M.; Varasi, M. Recent Applications of the Isoxazole Ring in Medicinal Chemistry. In Targets in Heterocyclic Chemistry; Attanasi, O.A., Spinelli, D., Eds.; Italian Society of Chemistry: Rome, 1999; Vol. 3, pp 301-339. http://www.nextbio.com.]. Они проявляют антибактериальную, противоастматическую и др. виды фармакологической активности, обладают противовоспалительным, анальгетическим, противоревматоидным [Pinto, P.; Dougados, М. Acta Reumatol. Port. 2006, 31, 215-224; Kremer, J.; Genovese, M.; Cannon, G.W.; et. all., J. Rheumatol. 2004, 31, 1521-1531.] и антидепрессивным действием. В свою очередь, фторорганические соединения широко используются при разработке новых лекарственных препаратов, агрохимикатов, а также при изучении биохимических процессов. [Isanbor Ch.; O'Hagan D. Fluorine in medicinal chemistry: a review of anti-cancer agents. // J. Fluor. Chem. 2006, 727, 303-319. Cartwright D. Recent Developments in Fluorine-Containing Agrochemicals, in: Organofluorine Chemistry: Principles and Commercial Applications. Banks R.E., Smart В.E., Tatlow J.C., Eds; Plenum, New York, 1994, p. 237-262. Purser S.; Moore P.R.; Swallow S.; Gouverneur V. Fluorine in medicinal chemistry. // Chem. Soc. Rev. 2008, 37, 320-330]. Согласно различным оценкам, на сегодняшний день во всем мире около 20-25% всех лекарственных препаратов и около 30% агрохимикатов содержат, по меньшей мере, один атом фтора. Высокий интерес к фторорганическим соединениям в этих областях объясняется возможностью изменения свойств биологически-активных веществ (абсорбции, распределения, метаболизма, взаимодействия с биологическими мишенями) путем введения атомов фтора в молекулу. [Kirsch P. Modern Fluoroorganic Chemistry. Synthesis. Reactivity. Applications. // Weinheim: Wiley-VCH. 2004, 321 рр]. Кроме того, фторорганические соединения часто обладают большей биодоступностью по сравнению с аналогами, не содержащими фтор. Таким образом, синтез фторорганических соединений представляет практический интерес. Заявленные в изобретении 3-арил-5-фторизоксазолы объединяют в своей структуре изоксазольный фрагмент и атом фтора, что делает их перспективными прекурсорами при разработке новых лекарственных препаратов и агрохимикатов.
Известен способ синтеза 3-арил-5-галогенизоксазолов, где Hal=Cl, Br, заключающийся во взаимодействии 3-арилизоксазолонов с 5 экв оксогалогенида фосфора, где Hal=Cl, Br, в присутствии триэтиламина в течение 1.5 ч при 120°С. [Gibbons, L.K. US Patent 3781438, 1973]. Недостатками данного способа являются низкие выходы целевых продуктов, труднодоступность и токсичность исходных соединений и невозможность получения соединений заявляемой структурной формулы.
Известен способ синтеза 3-метил-5-фтор-4-этоксикарбонилизоксазола, основанный на реакции диазотирования 5-амино-3-метил-4-этоксикарбонилизоксазола в присутствии большого избытка HF [Saito N., Kurihara Т., Yasuda S., Akagi M. Reaction of aminoazoles with nitrous acid. II. Haloisoxazoles // Yakugaku Zasshi. 1970, 90, 32-35]. Недостатками данного способа являются невысокие выходы целевого продукта, технические сложности, связанные с использованием HF, результат представлен единственным примером.
Наиболее близким к предлагаемому изобретению по технической сущности и достигаемому результату является способ синтеза 5-фторизоксазолов, основанный на реакции 2-алкил-1-бром-1-фторциклопропанов, где Alk=n-Bu, n -Hex с NOCl, активированным триоксидом серы [Bondarenko О.В. et al. Synthesis of 5-fluoro- and 5-bromoalkylisoxazoles via nitrosation of 1,1-dihalocyclopropanes with sulfur trioxide activated nitrosyl chloride // J. Fluorine Chem. 2016, 185, 201-205] Недостатком данного метода является образование смеси региоизомерных 3-алкил- и 4-алкил-5-фторизоксазолов, выходы которых по сумме на превышали 53%..
Раскрытие изобретения
Задачей предлагаемого изобретения является создание новых производных 5-фторизоксазолов и разработка способа их получения.
Поставленная задача решается с помощью производных 5-фторизоксазолов общей формулы (I):
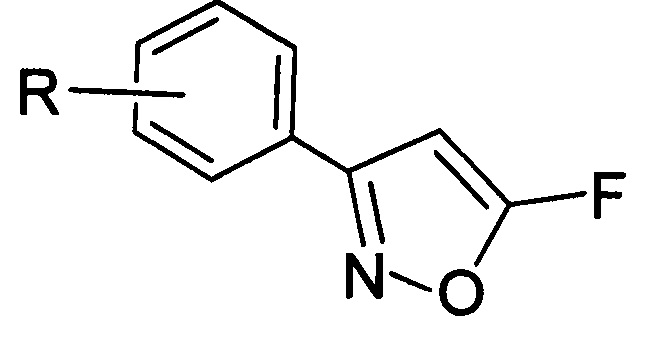
где R=3-Cl, 3-Br, 3-NO2, 2-Cl, 2-NO2, 4-NO2, 4-Cl, 4-Br, 4-F, H.
Поставленная задача также решается способом получения вышеуказанных соединений, заключающемся в нитрозировании 1-бром-1-фторциклопропанов.
В заявляемом способе в реакции нитрозирования используют 2-арил-1-бром-1-фторциклопропаны и хлорсульфат нитрозония. Предпочтительно в случае заявленных 2-арил-1-бром-1-фторциклопропанов образуется только один из двух возможных региоизомерных 5-фторизоксазолов, а именно, 3-арил-5-фторизоксазол. Предпочтительно реакция нитрозирования проводится при комнатной температуре. При этом в качестве нитрозирующего реагента используется хлорсульфат нитрозония.
Техническим результатом изобретения является получение новых труднодоступных химических соединений, и разработка способа получения 3-арил-5-фторизоксазолов в одну стадию с достаточно высокими выходами (не менее 60% для соединений с R=3-Cl, 3-Br, 3-NO2, 2-Cl, 2-NO2, 4-NO2, и не менее 20% для соединений с R=4-Cl, 4-Br, 4-F, Н) и высокой чистоты.
Сущностью способа является реакция присоединения нитрозоний катиона, генерируемого из хлорсульфата нитрозония в заявленных условиях проведения реакции по С(1)-С(2) связи циклопропанового кольца с последующей гетероциклизацией в 3-арил-5-фторизоксазол.
Осуществление изобретения
В литературе описаны реакции 2-арил-1-бром-1-фторциклопропанов с другими нитрозирующими реагентами. Так, в реакции 1-бром-1-фторциклопропанов с тетрафторборатом нитрозония в среде ацетонитрила происходит трехкомпонентная реакция нитрозирования-гетероциклизации с образованием N-оксидов 4-фторпиримидинов. 5-Фторизоксазолы в этом случае получены не были [Sedenkova K.N. et al. Three-component heterocyclization of gem-bromofluorocyclopropanes with NOBF4: Access to 4-fiuoropyrimidine N-oxides // J. Org. Chem. 2012, 77, 9893-9899]. При взаимодействии 2-арил-1-бром-1-фторциклопропанов с тетрафторборатом нитрозония в нитрометане были получены 5-арил-4-бром-4-фторизоксазолины [Бондаренко О.Б., Комаров А.И., Зык Н.В. Нитрозирование 2-арил-1-бром-1-фторциклопропанов тетрафторборатом нитрозония - способ получения 5-арил-4-бром-4-фторизоксазолинов // Известия РАН. Сер. хим. 2016, №7, 1882-1883]. Применение трифлата нитрония приводит к нитрованию ароматических колец 2-арил-1-бром-1-фторциклопропанов, при этом малый цикл не участвует в реакции даже при значительном избытке реагента [Sedenkova K.N. et al. Nitronium salts as novel reagents for the heterocyclization of gem-bromofluorocyclopropanes into pyrimidine derivatives // Tetrahedron Lett. 2015, 56, 4927-4930]. В литературе неизвестен метод синтеза 3-арил-5-фторизоксазолов, основанный на реакции нитрозирования 2-арил-1-бром-1-фторциклопропанов хлорсульфатом нитрозония. Также отсутствуют сведения о получении и свойствах соединений заявляемой структурной формулы.
Оптимальными условиями для проведения реакции, обеспечивающими достаточно высокие выходы образующихся 3-арил-5-фторизоксазолов, являются:
1. Использование мольного соотношения дигалогенциклопропана и хлорсульфата нитрозония, равного 1:1.5-2.0. Избыток хлорсульфата нитрозония используется для достижения максимальной конверсии 2-арил-1-бром-1-фторциклопропанов. Больший избыток хлорсульфата нитрозония приводит к загрязнению целевых продуктов и усложнению стадии очистки из-за частичного осмоления дигалогенциклопропанов.
2. Использование апротонных ненуклеофильных и галогенсодержащих растворителей (CH3NO2, CH2Cl2, CHCl3 C2H4Cl2), предпочтительно нитрометана.
3. Постепенное добавление суспензии хлорсульфата нитрозония в нитрометане к раствору дигалогенциклопропана в нитрометане. Данный порядок смешения реагирующих веществ обеспечивает высокую концентрацию циклопропана на начальном этапе проведения реакции, и, соответственно, высокую скорость нитрозирования, что позволяет сократить время проведения реакции до 1-2 ч даже для циклопропанов с дезактивированными ароматическими кольцами. Данный порядок смешения реагирующих веществ препятствует появлению избытка хлорсульфата нитрозония в реакционной среде, что значительно снижает долю процессов окисления и осмоления.
4. Общее количество растворителя, используемого для проведения реакции рассчитывали, исходя из концентрации дигалогенциклопропана равной 0.25-0.30 моль/л. Для приготовления раствора дигалогенциклопропана использовали 10-15 об. % растворителя, а для приготовления суспензии хлорсульфата нитрозония - 85-90 об. %.
5. Проведение реакции в течении 1-2 ч. Продолжительность синтеза менее указанного времени приводит к снижению выходов заявляемых соединений за счет неполной конверсии исходных 2-арил-1-бром-1-фторциклопропанов. Увеличение продолжительности синтеза более 2 часов не ведет к существенному увеличению выходов целевых продуктов.
Все синтезированные соединения являются новыми. Строение их подтверждено результатами ЯМР спектроскопии, масс-спектрометрии и данными элементного анализа.
Все составляющие для получения хлорсульфата нитрозония тем или иным способом являются доступными соединениями - продуктами многотоннажного неорганического синтеза или отходами производства. Предпочтительно хлорсульфат нитрозония получать в результате взаимодействия нитрозилхлорида с триоксидом серы [Paul R.C., Arora C.L., Malhotra K.С. // Indian J. Chem. 1972, 10, 94; Paul R.C., Arora C.L., Malhotra K.C. // Indian J. Chem. 1972, 10, 92.] или взаимодействием нитрозилсерной кислоты с хлористым тионилом [Hoehle, Т., Mijlhoff, F.C. // Recueil des Travaux Chimiques des Pays-Bas et de la Belgique. 1967, 86, 1153-1158; Auger J., Wartel M., Noel S., Heubel J. // Compt. Rend. C. (L'Academie des sciences Paris). 1967, 265, 997].
Предпочтительно все составляющие для получения хлорсульфата нитрозония, а также сам реагент являются водорастворимыми соединениями и могут быть утилизированы путем нейтрализации водными растворами оснований без ущерба для окружающей среды. 2-Арил-1-бром-1-фторциклопропаны могут быть получены по реакции циклоприсоединения дибромфторметана к замещенным стиролам.
Указанные существенные признаки определяют новизну изобретения и существенные отличия от прототипа и известного уровня техники в данной области.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение 3-(3-бромфенил)-5-фторизоксазола.
В колбу емкостью 50 мл, снабженную капельной воронкой с противодавлением и магнитной мешалкой, помещали 2.00 г (6.8 ммоль) 1-бром-2-(3-бромфенил)-1-фторциклопропана в 2.3 мл нитрометана. К раствору циклопропана в течение 10-20 мин при постоянном перемешивании и комнатной температуре (~20°С) прикапывали суспензию 1.55 г (10.7 ммоль) хлорсульфата нитрозония в 20.7 мл абсолютного нитрометана. По окончании реакции (контроль над полнотой прохождения реакции осуществляли методом ТСХ) реакционную смесь пропускали через слой SiO2, промывали последний хлористым метиленом (3×10 мл). Органические вытяжки объединяли, растворитель упаривали, остаток хроматографировали на колонке (SiO2 40/100, элюент - этилацетат/петролейный эфир, 1:20) и выделяли 1.05 г (64%) 3-(3-бромфенил)-5-фторизоксазола в виде бесцветных кристаллов. Т.пл. 42°С.
Спектр ЯМР 1H, δ, м.д, J, Гц: 5.85 д (1Н, C(4)His, 3JHF 7.5), 7.33 т (1H, CHapoм, 3J 7.8), 7.59 д (1Н, CHapoм, 3J 7.8), 7.66 д (1Н, CHapoм) 3J 7.8), 7.88 с (1Н, CHapoм). Спектр ЯМР 13С, δ, м.д, J, Гц: 77.6 д (C(4)His, 2JCF 16.9), 123.1 (CBr), 125.0 (CHapoм), 129.4 (CHapoм), 130.6 (CHapoм + С(1)аром), 133.7 (CHapoм), 163.8 д (C=N, 3JCF 5.6), 170.1 д (F-C-O, 1JCF 295.5). Спектр ЯМР 19F, δ, м.д, J, Гц:-102.9 д (1F, О-C-F, 3JHF 7.5). Масс-спектр, m/z (Ioтн., %): кластер 241 (1.8), 243 (1.7) М+, кластер 213 (13), 215 (13) [М+-СО], кластер 186 (12), 188 (11.5) [М-СО - HCN=BrC6H4CF]+, 134 (100) [М - СО - Br]+, 107 (95) [C6H4CF]+, 102 (12) [C6H4CN]+, 88 (9), 75 (15) [С6Н3]+, 50 (10). Найдено, %: С 44.47, Н 2.19, N 5.65. C9H5BrFNO. Вычислено, %: С 44.63, Н 2.07, N5.79.
Пример 2. Получение 3-(3-хлорфенил)-5-фторизоксазола.
Из 2.50 г (10.0 ммоль) 1-бром-2-(3-хлорфенил)-1-фторциклопропана и 2.27 г (15.0 ммоль) NOSO3Cl в условиях, описанных в примере 1, получали 1.98 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат: петролейный эфир, 1:20) выделяли 1.52 г (77%) 3-(3-хлорфенил)-5-фторизоксазола в виде бесцветных кристаллов. Т.пл. 31°С, Rf 0.53.
Спектр ЯМР 1Н, δ, м.д, J, Гц: 5.85 д (1Н, C(4)His, 3JHF 7.5), 7.38 т (1Н, CHapoм, 3J 7.7), 7.43 д (1H, CHapoм, 3J 7.7), 7.61 д (1H, CHapoм, 3J 7.7), 7.72 с (1Н, CHapoм). Спектр ЯМР 13С, δ, м.д, J, Гц: 77.6 д (C(4)His, 2JCF 16.9), 124.5 (CHapoм), 126.5 (CHapoм), 130.3 (CHapoм + С(1)аром), 130.7 (CHapoм), 135.1 (С-Cl), 163.9 д (C=N, 3JCF 5.6, 170.1 д (F-C-O, 1JCF 295.6). Спектр ЯМР 19F, δ, м.д, J, Гц:-103.0 д (1F, O-C-F, 3JHF 7.5). Масс-спектр, m/z (Ioтн., %): кластер 197 (5), 199 (1.5) М+, кластер 169 (35), 171 (16) [М+- СО], кластер 142 (53), 144 (21) [М- СО - HCN=ClC6H4CF]+, 134 (17) [М - СО - Cl]+, кластер 111 (12), 113 (3.5) [C6H4Cl]+, 107 (100) [C6H4CF]+, 102 (5) [C6H4CN]+, 75 (52) [С6Н3]+, 50 (38).
Пример 3. Получение 3-(3-нитрофенил)-5-фторизоксазола.
Из 0.78 г (3.0 ммоль) 1-бром-2-(3-нитрофенил)-1-фторциклопропана и 0.87 г (6.0 ммоль) NOSO3Cl в условиях, описанных в примере 1, получали 0.66 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат: петролейный эфи, 1:5) выделяли 0.47 г (75%) 3-(3-нитрофенил)-5-фторизоксазола в виде желтого масла.
Спектр ЯМР 1Н, δ, м.д, J, Гц: 6.03 д (1Н, C(4)His, 3JGF 7.6), 7.70 т (1Н, CHapoм, 3J 8.0), 8.14 д (1H, CHapoм, 3J 8.0), 8.34 д (1Н, CHapoм, 3J 8.0), 8.58 с (1Н, CHapoм). Спектр ЯМР 13С, δ, м.д, J, Гц: 77.9 д (C(4)His, 2JCF 16.8), 121.5 (CHapoм), 125.3 (CHapoм), 130.25 (CHapoм), 130.32 (С(1)аром), 132.1 (CHapoм), 148.6 (C-NO2), 163.1 д (C=N, 3JCF 5.9), 170.4 д (F-C-O, 1JCF 296.4). Спектр ЯМР 19F, δ, м.д, J, Гц: -101.9 (1F, F-C-O, 3JCF 7.6). ИК спектр, см-1: 1640 (C=N), 1540, 1380 (NO2). Масс-спектр, m/z (Ioтн., %): М+ 208 (89), 189 (15) [М+- F], 180 (4) [М+-СО], 153 (10) [М+- СО - HCN=NO2C6H4CF], 150 (30) [М+-NO - СО=C8H5FNO], 134 (100) [М - СО - NO2]+, а также [М+- F - СО - HCN=NO2C6H4C], 122 (10) [C6H4NO2], 114 (25) [М+- F - СО - ОН - NO=C8H4N]+, 107 (72) [C6H4CF]+, 102 (10) [C6H4CN]+, 76 (60) [С6Н4]+, 63 (18) [С5Н3]+, 50 (49), 43 (29). Найдено, %: С 52.03, Н 2.63, N 13.21. C9H5FN2O3. Вычислено, %: С 51.92, Н 2.40, N 13.46.
Пример 4. Получение 3-(4-нитрофенил)-5-фторизоксазола.
Из 0.55 г (2.00 ммоль) 1-бром-2-(4-нитрофенил)-1-фторциклопропана и 0. 58 г (4.00 ммоль) NOSO3Cl в условиях, описанных в примере 1, получали 0.40 г реакционной смеси, после перекристаллизации которой выделили 0.35 г (79%) 3-(4-нитрофенил)-5-фторизоксазола в виде желтых кристаллов. Т.пл. 108-110°С. Rf 0.65 (EtOAc: petroleum ether=1:5).
Спектр ЯМР 1Н, δ, м.д, J, Гц: 6.02 д (1Н, C(4)His, 3JHF 7.4), 7.95 д (2Н, CHapoм, 3J 8.8), 8.32 д (2Н, CHapoм, 3J 8.8). Спектр ЯМР 13С, δ, м.д, J, Гц: 78.1 д (C(4)His, 2JCF 16.8), 124.2 (CHapoм), 127.4 (CHapoм), 134.5 (С(1)аром), 149.1 (C-NO2), 163.2 д (C=N, 3JCF 5.9), 170.4 д (F-C-O, 1JCF 297.1). Спектр ЯМР 19F, δ, м.д, J, Гц: -101.9 д (F-C-O, 3JHF 7.4). Масс-спектр, m/z (Ioтн., %): М+ 208 (1), 180 (22) [М+- СО], 163 (21) [М+- СО - ОН], 153 (40) [М+- СО - HCN=NO2C6H4CF], 150 (8) [M+-NO - СО=C8H5FNO], 134 (70) [М+- СО - NO2,], а также [М+- F -СО - HCN=NO2C6H4C],122 (11) [C6H4NO2], 114 (4) [C6H4C2N]+, 107 (100) [C6H4CF]+, 102 (15) [C6H4CN]+, 76 (13) [C6H4]+, 50 (15). Найдено, %: С 51.65, Н 2.55, N 13.12. C9H5FN2O3. Вычислено, %: С 51.92, Н 2.40, N 13.46.
Пример 5. Получение 3-(2-нитрофенил)-5-фторизоксазола.
Из 0.35 г (1.3 ммоль) 1-бром-2-(2-нитрофенил)-1-фторциклопропана и 0.40 г (2.7 ммоль) NOSO3Cl в условиях, описанных в примере 1, получали 0.33 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат: петролейный эфир, 1:5) выделяли 0.18 г (63%) 3-(2-нитрофенил)-5-фторизоксазола в виде бесцветных кристаллов. Т. пл.=114-116°С. Rf 0.70 (этилацетат: петролейный эфир = 1:5).
Спектр ЯМР 1Н, δ, м.д, J, Гц: 5.74 д (1H, C(4)His, 3JHF 7.4), 7.66-7.72 м (2Н, CHapoм), 7.72-7.78 м (1H, CHapoм), 8.06 д (1Н, CHapoм, 3J 7.8). Спектр ЯМР 13С, δ, м.д, J, Гц: 80.4 д (C(4)His, 2JCF 16.8), 123.9 (С(1)аром), 124.7 (CHapoм), 131.3 (CHapoм), 131.5 (CHapoм), 133.3 (CHapoм), 148.3 (C-NO2), 162.8 д (C=N, 3JCF 5.9), 169.6 д (F-C-O, 1JCF 296.4). Спектр ЯМР 19F, δ, м.д, J, Гц: -103.5 (1F, F-C-O, 3JCF 7.4). Найдено, %: С 51.90, Н 2.65, N 13.26. C9H5FN2O3. Вычислено, %: С 51.92, Н 2.40, N 13.46.
Пример 6. Получение 3-(2-хлорфенил)-5-фторизоксазола.
Из 1.00 г (4.0 ммоль) 1-бром-1-фтор-2-(2-хлорфенил)циклопропана и 1.17 г (8.0 ммоль) NOSO3Cl в условиях, описанных выше, получали 0.677 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат: петролейный эфир, 1:20) выделяли 0.47 г (60%) 3-(2-хлорфенил)-5-фторизоксазола в виде бесцветного масла. Rf 0.46.
Спектр ЯМР 1Н, δ, м.д, J, Гц: 6.06 д (1Н, C(4)His, 3JHF 7.6), 7.37 д.т (1Н, CHapoм, 2J 1.2, 3J 7.6), 7.42 д.д (1Н, CHapoм, 2J 1.7, 3J 7.6), 7.49 д.д (1H, CHapoм, 2J 1.2, 3J 7.6), 7.72 д.д (1Н, CHapoм, 2J 1.7, 3J 7.6). Спектр ЯМР 13С, δ, м.д, J, Гц: 81.1 д (C(4)His, 2JCF 16.9), 127.2 (CHapoм), 128.0 (С(1)аром), 130.5 (2CHаром), 131.5 (CHapoм), 132.9 (С-Cl), 163.8 д (C=N, 3JCF 6.4), 169.3 д (F-C-О, 1JCF 294.8). Спектр ЯМР 19F, δ, м.д, J, Гц: -104.0 (1F, F-C-O, 3JHF 7.5). Масс-спектр, m/z (Ioтн., %): кластер 197 (5), 199 (2) М+, кластер 169 (48), 171 (16) [М+- СО], кластер 142 (80), 144 (26) [М- СО - HCN=ClC6H4CF]+, 134 (35) [М - СО - Cl]+, 107 (100) [C6H4CF]+, 102 (12) [C6H4CN]+, 75 (18) [С6Н3]+, 50 (7).
Пример 7. Получение 3-(4-бромфенил)-5-фторизоксазола.
Из 1.44 г (4.5 ммоль) 1-бром-2-(4-бромфенил)-1-фторциклопропана и 1.10 г (7.6 ммоль) NOSO3Cl в условиях, описанных в примере 1, получали 1.33 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат: петролейный эфир, 1:20) выделяли 0.36 г (30%) 3-(4-бромфенил)-5-фторизоксазола в виде бесцветных кристаллов. Т.пл. 70-72°С. Rf 0.53.
Спектр ЯМР 1Н, δ, м.д, J, Гц: 5.86 д (1Н, C(4)His, 3JHF 7.7), 7.63 с (4Н, CHapoм); Спектр ЯМР 13С, δ, м.д, J, Гц: 77.4 д (C(4)His, 2JCF 17.6), 125.2 (CBr), 127.6 (С(1)аром), 127.9 (2CHаром), 132.3 (2CHаром), 164.2 д (C=N, 3JC-F 5.1), 170.1 д (F-C-O, 1JCF 294.9). Спектр ЯМР 19F, δ, м.д, J, Гц: -103.0 д (1F, O-C-F, 3J 7.6). Найдено, %: С 44.27, Н 2.14, N 5.53. C9H5BrFNO. Вычислено, %: С 44.63, Н 2.07, N 5.79.
Пример 8. Получение 3-(4-хлорфенил)-5-фторизоксазола.
Из 0.85 г (3.4 ммоль) 1-бром-2-(4-хлорфенил)-1-фторциклопропана и 0.83 г (5.7 ммоль) NOSO3Cl в условиях, описанных в примере 1, получали 0.777 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат: петролейный эфир, 1:20) выделяли 0.22 г (33%) 3-(4-хлорфенил)-5-фторизоксазола в виде бесцветных кристаллов. Т.пл. 62-64°С.
Спектр ЯМР 1Н, δ, м.д, J, Гц: 5.84 д (1Н, C(4)His, 3JHF 7.5), 7.44 д (2Н, CHapoм, 3J 8.3), 7.68 д (2Н, CHapoм, 3J 8.3); Спектр ЯМР 13С, δ, м.д, J, Гц: 77.5 д (C(4)His, 2JC-F 17.6), 127.1 (С(1)аром) 127.7 (2CHаром), 129.3 (2CHаром), 136.8 (С-Cl), 164.1 д (C=N, 3JCF 5.9), 170.0 д (1JCF 295.7, F-С-О). Спектр ЯМР 19F, δ, м.д, J, Гц:-103.1 д (1F, O-C-F, 3J 7.5). HRMS Найдено 198.0114, 200.0082 C9H5ClFNO, [М+Н]+; Вычислено 198.0116, 200.0087
Пример 9. Получение 3-фенил-5-фторизоксазола.
Из 0.43 г (2.0 ммоль) 1-бром-2-фенил-1-фторциклопропана и 0.60 г (4.1 ммоль) NOSO3Cl в условиях, описанных в примере 1, после хроматографического выделения на колонке (SiO2 40/60, элюент - этилацетат: петролейный эфир, 1:20) получали 0.07 г (20%) 3-фенил-5-фторизоксазола в виде бесцветного масла. Rf 0.43.
Спектр ЯМР 1Н, δ, м.д, J, Гц: 5.87 д (1H, C(4)His, 3JHF 7.6), 7.49 м (3Н, CHapoм), 7.75 м (2Н, CHapoм). Спектр ЯМР 13С, δ, м.д, J, Гц: 77.5 д (C(4)His, 2JCF 17.7), 126.4 (2CHаром), 128.7 (Саром), 129.0 (2CHаром), 130.7 (CHapoм), 165.1 д (C=N, 3JCF 5.6), 170.0 д (CF, 1JCF 294.7). Спектр ЯМР 19F, δ, м.д, J, Гц: -103.8 д (1F, F-C-O, 3JHF 7.5). Найдено, %: С 66.04, Н 3.74, N 8.20. C9H6NOF. Вычислено, %: 66.26, Н 3.68, N 8.59.
Пример 10. Получение 3-(4-фторфенил)-5-фторизоксазола.
Из 0.93 г (4.0 ммоль) 1-бром-1-фтор-2-(4-фторфенил)циклопропана и 1.03 г (6.9 ммоль) NOSO3Cl в условиях, описанных в примере 1, после хроматографического выделения на колонке (SiO2 40/60, элюент - этилацетат: петролейный эфир, 1:25) получали 0.15 г (20%) 3-(4-фторфенил)-5-фторизоксазола в виде бесцветного масла. Rf 0.4.
Спектр ЯМР 1Н, δ, м.д, J, Гц: 5.83 д (1Н, C(4)His, 3JHF 7.6 Гц), 7.15 т (2Н, CHapoм, 3JGF=3JHH 8.5), 7.74 д.д (2Н, CHapoм, 4JCF 5.3, 3JHH 8.5). Спектр ЯМР 13С, δ, м.д, J, Гц: 77.4 д (C(4)His, 2JCF 17.7), 116.2 д (2CHаром, 2JCF 22.5), 124.9 д (С(1)аром, 4JCF 4.0) 128.5 д (2CHаром, 3JCF 8.8), 164.1 д (C=N, 3JCF 5.6), 164.2 д (Cаром-F, 1JCF 250.6), 170.0 д (Cis-F, 1JCF 294.8). Спектр ЯМР 19F, δ, м.д, J, Гц: -103.5 д (1F, F-C-O, 3JHF 6.8), -109.4 м (1F, F-Cаром). Масс-спектр, m/z (Tотн., %): 181 (0.7) M+, 153 (56) [M+- CO], 126 (100) [M- CO - HCN=FC6H4CF]+, 107 (18) [C6H4CF]+, 121 (7) [FC6H4CN]+, 75 (10) [C6H3]+, 57 (6).
Таким образом, были получены новые производные 3-арил-5-фторизоксазолов и разработан технологичный универсальный одностадийный способ их синтеза из дешевых и доступных реагентов, который позволяет получать соединения заявляемой структурной формулы с достаточно высокими выходами, которые могут проявлять антинематодные и антигельминтаные свойства и представлять интерес в качестве полупродуктов в синтезе биологически активных веществ.
| название | год | авторы | номер документа |
|---|---|---|---|
| 5-АРИЛ-4-ФТОРИЗОКСАЗОЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2018 |
|
RU2708456C1 |
| 3,5-ДИАРИЛИЗОКСАЗОЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2021 |
|
RU2801861C2 |
| ПОЛУЧЕНИЕ НОВОГО КЛАССА ЖИДКОКРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ЧЕТЫРЕХАТОМНЫЙ ФТОРСОДЕРЖАЩИЙ ФРАГМЕНТ МОСТИКОГО ТИПА | 2012 |
|
RU2511009C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГАЛОГЕНПРОИЗВОДНЫХ АРОМАТИЧЕСКИХ И ГЕТЕРОАРОМАТИЧЕСКИХ СОЕДИНЕНИЙ | 2019 |
|
RU2711558C1 |
| СИНТЕЗ НОВОГО КЛАССА ФТОРСОДЕРЖАЩИХ ЖИДКОКРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ С ИСПОЛЬЗОВАНИЕМ ХЛАДОНА 114В2 В КАЧЕСТВЕ ИСХОДНОГО СОЕДИНЕНИЯ | 2012 |
|
RU2505529C1 |
| Метил-3-арил-3a-нитро-4-(трифторметил)-1,2,3,3a,4,9b-гексагидрохромено[3,4-c]пиррол-1-карбоксилаты, обладающие цитотоксической активностью в отношении к клеткам линии карциномы шейки матки человека HeLa, и способ их получения | 2023 |
|
RU2818191C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 3-АРИЛ-5-ХЛОРИЗОКСАЗОЛОВ | 2015 |
|
RU2637927C2 |
| 1-Этил-6-фтор-4-оксо-7-(8-этокси-2-оксо-2Н-хромен-3-ил)-1,4-дигидрохинолин-3-карбоновая кислота, обладающая противотуберкулезной активностью | 2017 |
|
RU2642426C1 |
| ДИЭТИЛ (3,5-БИС(АРИЛИДЕН)-4-ОКСОПИПЕРИДИН-1-ИЛ)-(АРИЛ)-МЕТИЛФОСФОНАТЫ, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНЫМИ СВОЙСТВАМИ | 2015 |
|
RU2603194C1 |
| НОВЫЕ 2',5'-ДИАРИЛСПИРО[ИНДОЛ-3,3'-ПИРРОЛИДИН]-2(1Н)-ОНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2019 |
|
RU2730287C1 |
Изобретение относится к производным 5-фторизоксазолов общей формулы (I), где R=3-Cl, 3-Br, 3-NO2, 2-Cl, 2-NO2, 4-NO2, 4-Cl, 4-Br, 4-F, H. Изобретение также относится к способу получения указанных соединений путем взаимодействия дигалогенциклопропанов общей формулы (II) с хлорсульфатом нитрозония. Технический результат – получены новые соединения, которые могут найти применение в сельском хозяйстве в качестве антинематодных средств, а также разработан технологичный универсальный одностадийный способ их синтеза из доступных реагентов, который позволяет получать соединения заявляемой структурной формулы с достаточно высокими выходами. 2 н. и 6 з.п. ф-лы, 10 пр.
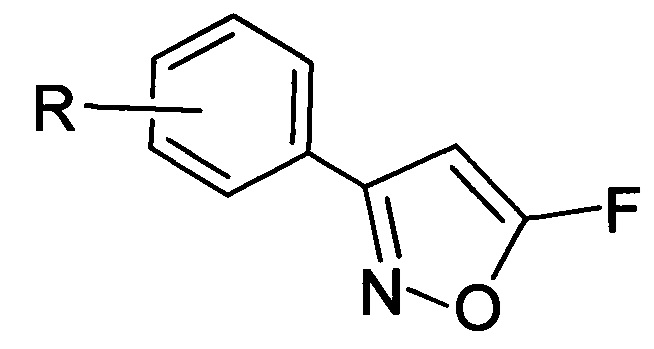 (I)
(I)
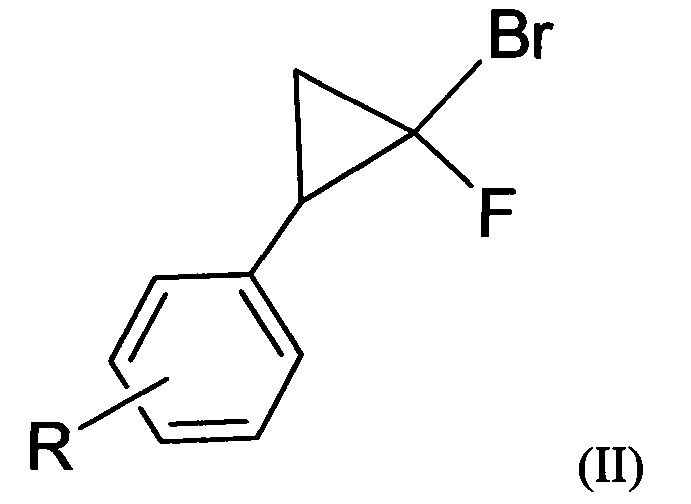
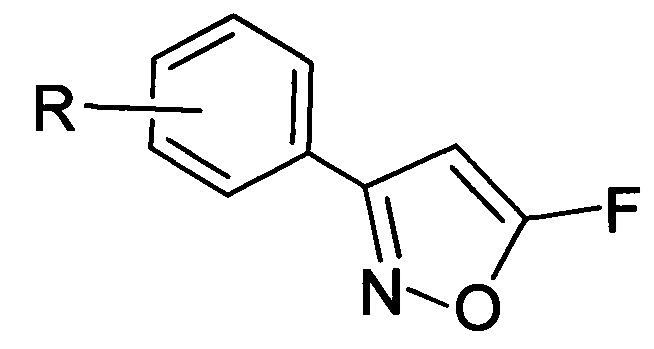
1. Производные 5-фторизоксазолов общей формулы (I):
 ,
,
где R=3-Cl, 3-Br, 3-NO2, 2-Cl, 2-NO2, 4-NO2, 4-Cl, 4-Br, 4-F, H.
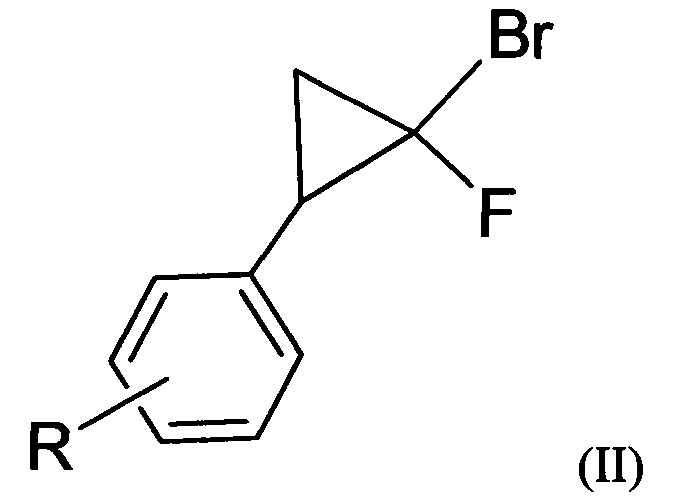
2. Способ получения производных 5-фторизоксазолов по п. 1, характеризующийся тем, что проводят взаимодействие дигалогенциклопропанов общей формулы (II) с хлорсульфатом нитрозония
 ,
,
где R=3-Cl, 3-Br, 3-NO2, 2-Cl, 2-NO2, 4-NO2, 4-Cl, 4-Br, 4-F, H.
3. Способ по п. 2, характеризующийся тем, что циклопропан и хлорсульфат нитрозония берут в мольном соотношении 1: 1.5-2.0.
4. Способ по п. 2, характеризующийся тем, что реакцию проводят в апротонных ненуклеофильных растворителях.
5. Способ по п. 4, характеризующийся тем, что в качестве апротонных ненуклеофильных растворителей используют CH3NO2, CH2Cl2, CHCl3, C2H4Cl2.
6. Способ по п. 2, характеризующийся тем, что смешение реагирующих веществ производят путем прикапывания суспензии хлорсульфата нитрозония в нитрометане к раствору дигалогенциклопропана в нитрометане.
7. Способ по п. 2, характеризующийся тем, что общее количество растворителя, используемого для проведения реакции, рассчитывают, исходя из концентрации дигалогенциклопропана, равной 0.25-0.30 моль/л, при этом для приготовления раствора дигалогенциклопропана используют 10-15 об. % растворителя, а для приготовления суспензии хлорсульфата нитрозония - 85-90 об. %.
8. Способ по п. 2, характеризующийся тем, что реакцию проводят в течение 1-2 ч.
| BONDARENKO O.B | |||
| ET AL, Journal of Fluorine Chemistry, 185, 2016, pp | |||
| Питательное приспособление к трепальным машинам для лубовых растений | 1922 |
|
SU201A1 |
| US 3781438 A1, 25.12.1973 | |||
| ЗАМЕЩЕННЫЕ ИЗОКСАЗОЛЫ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ И СПОСОБ ПОДАВЛЕНИЯ ВОСПАЛЕНИЙ | 1996 |
|
RU2200158C2 |
Авторы
Даты
2019-04-08—Публикация
2017-12-29—Подача