Область техники
Группа изобретений относится к области органической химии, а именно к новым производным 3,5-диарилизоксазолов и высокорегиоселективному способу их получения, в том числе несимметричного строения. Полученные при реализации данного изобретения соединения общей формулы (I)

где R1-6 выбирают из Н, Hal, NO2, NH2, CF3, Alk=C1-С10 и OAlk - OC1-ОС10, неразветвленного и разветвленного строения, которые могут быть использованы в качестве действующего вещества в лекарственных препаратах для лечения онкологических заболеваний.
Уровень техники
Известно, что 3,5-диарилизоксазолы обладают широким спектром биологической активности, включая антигипергликемическую активность [Kumar A., Maurya R.A., Sharma S., Ahmad P., Singh A.B., Tamrakar A. K., Srivastava A.K. Design and synthesis of 3,5-diarylisoxazole derivatives as novel class of anti-hyperglycemic and lipid lowering agents. //Bioorganic&medicinal chemistry. 2009. V. 17. P. 5285-5292], активность против возбудителей лейшманиоза, болезни Шагаса и сонной болезни [Trefzger О.S. et al. Design, synthesis and antitrypanosomatid activities of 3,5-diarylisoxazole analogues based on neolignanes veraguensin, grandisin and machilin G //Chemical biology & drug design. - 2019. - T. 93. - №.3. - C. 313-324], противоопухолевую активность, где их используют в качестве гетероциклических аналогов Комбретастатина А4 с фиксированным олефиновым фрагментом [Kamal A., Bharathi E.V., Reddy J.S., Ramaiah M.J., Dastagiri D., Reddy M.K., Bhadra, M.P. Synthesis and biological evaluation of 3,5-diarylisoxazoline/isoxazole linked 2,3-dihydroquinazolinone hybrids as anticancer agents. //European Journal of Medicinal Chemistry. 2011. V. 46. P. 691-703]. Активно исследуются мезоморфные свойства 3,5-диарилизоксазолов несимметричного строения с целью использования их в качестве жидкокристаллических веществ [Vieira A.A. et al. 1,3-Dipolar cycloaddition reaction applied to synthesis of new unsymmetric liquid crystal compounds-based isoxazole //Tetrahedron Letters. - 2009. - T. 50. - №. 8. - C. 905-908].
Известны 3,5-диарилизоксазолы и способ их получения, основанный на взаимодействии диполярофилов, в качестве которых применяют стиролы и арилацетилены, с нитрилоксидами (ArCNO), которые генерируют in situ в присутствии оснований или окислителей, [Grünanger P., Vita-Finzi P. Isoxazoles. JohnWiley&Sons. 2009. V. 168.]. Однако использование в качестве диполярофилов стиролов приводит к образованию 3,5-диарилизоксазолинов с умеренными выходами и требует дополнительной стадии окисления в целевой изоксазол [Vilela, G.D.; da Rosa, R.R.; Schneider, P.H.; Bechtold, I.H.; Eccher, J.; Merlo, A.A. Expeditious preparation of isoxazoles from D2-isoxazolines as advanced intermediates for functional materials, Tetrahedron Lett, 2011, 49, 6569-6572. R.R. Da Rosa, I.S. Brose, G.D. Vilela, A.A. Merlo. 3,5-Diarylisoxazoles: A New Entry to Soft Crystal Phase. Mol. Cryst. Liq. Cryst. 2015, Vol. 612: pp. 158-168.]. Также использование в качестве диполярофилов арилацетиленов требует катализа металлами [P. Wu, V.V. Fokin. J Org. Chem., 70, 7761 (2005)], в противном случае реакция характеризуется невысокой региоселективностью, а также выходами от умеренных до низких вследствие пониженной реакционной способности тройной связи.
Известны 3,5-диарилизоксазолы, в том числе несимметричного строения, и способ их получения, основанный на взаимодействии гидроксиламина с халконами. В этом случае для получения целевых 3,5-диарилизоксазолов необходима дополнительная стадия окисления первоначально образующихся 3,5-диарилизоксазолинов [Kurangi, R.F.; Kawthankar, R.; Sawal, S.; Desai, V.G.; Tilve, S.G. Sun. Commun. 2007, 37, 585.], либо предварительная модификация халконов, например, в дибромхалконы [Stephens С.Е., Arafa R.K. 3,5-Diarylisoxazoles: individualized three-step synthesis and isomer determination using 13C NMR or mass-spectroscopy. //Journal of chemical education. 2009. V. 83. P. 1336.]. Недостатком данного способа является низкая региоселективность в ряде случаев при синтезе моделей с разными арильными заместителями, а также невысокие (<45%) выходы 3,5-диарилизоксазолов.
Известны 3,5-диарилизоксазолы и способ их получения, основанный на взаимодействии гидроксиламина с 1,3-диарилпропан-1,3-дионами. Недостатком данного способа является низкая региоселективность при синтезе 3,5-диарилизоксазолов с ра3Ными арильными заместителями [S.S. Chauhan, Y.C. Joshi. // Dasayan J. Chem. 2008. V. 1, Р. 475].
Известны 3,5-диарилизоксазолы и способ их получения, основанный на взаимодействии 1,2-диарилциклопропанов с нитрозирующими реагентами. Недостатком способа является низкая региоселективность в случае неодинаковых арильных заместителей [Сагинова Л.Г., Мохаммад Альхамдан, Петросян B.C. //Вестн. МГУ. - 1994. - Т. 35. - №. 2. - С. 186. Bondarenko О.В., Komarov А.I., Karetnikov G.L., Nikolaeva S.N., Zyk N.V. Nitrosylsulfuric acid as a tandem reagent in the synthesis of 3,5-diarylisoxazoles from 1,2-diarylcyclopropanes // Russian Chemical Bulletin. - 2019. - T. 68. - №. 6. - C. 1200-1203].
Известны 3,5-диарилизоксазолы и способ их получения, основанный на циклизации оксимов 1,3-диарил-2-пропин-1-онов, катализируемый комплексами металлов. Способ отличается хорошими выходами на стадии циклизации, однако, его существенным недостатком является возможность использования в реакции только одного из двух изомерных оксимов, оксима син-строения, что требует дополнительной очистки исходного соединения, либо отделения продукта реакции от оксима антистроения на стадии выделения [Kung K.K.Y., LoV. K.Y., KoH.М., LiG.L., Chan P.Y., Leung K.C., Wong M.K. (2013). Cyclometallated gold (III) complexes as effective catalysts for synthesis of propargylic amines, chiral allenes and isoxazoles. // Advanced Synthesis & Catalysis. 2013. V. 355. P. 2055-2070].
Известны 3,5-диарилизоксазолы и способ их получения, основанный на последовательном превращении 3-арилизоксазол-5-онов в 3-арил-5-трифлилизоксазолы под действием трифторметасульфонового ангидрида с последующим введением в реакцию кросс-сочетания Сузуки. Недостатками данного способа являются труднодоступность исходных 3-арилизоксазол-5-онов (сложность при выделении, низкие выходы), использование агрессивных реагентов (ангидрид трифторметансульфоновой кислоты). [Fernandes A.A.G. etal. General Platform for the Conversion of Isoxazol-5-ones to 3,5-Disubstituted Isoxazoles via Nucleophilic Substitutions and Palladium Catalyzed Cross-Coupling Strategies //European Journal of Organic Chemistry. - 2019. - T. 2019. - №. 19. - C. 3022-3034].
Наиболее близкими к заявляемому изобретению по технической сущности и достигаемому результату является способ синтеза 3,5-диарилизоксазолов, основанный на последовательном превращении 3-арилизоксазол-5-онов в 3-арил-5-бромизоксазолы под действием РОВгз с последующим введением в реакцию кросс-сочетания Сузуки. Недостатками данного способа являются труднодоступность исходных 3-арилизоксазол-5-онов (сложность при выделении, низкие выходы), низкие выходы на стадии получения 3-арил-5-бромизоксазалов, низкие выходы при введении последних в реакцию кросс-сочетания Сузуки (19%). [Fernandes A.A.G. etal. General Platform for the Conversion of Isoxazol-5-ones to 3,5-Disubstituted Isoxazoles via Nucleophilic Substitutions and Palladium Catalyzed Cross-Coupling Strategies //European Journal of Organic Chemistry. - 2019. - T. 2019. - №. 19. - C. 3022-3034].
Раскрытие изобретения
Задачей предлагаемого изобретения является создание новых производных 3,5-диарилизоксазолов, в том числе несимметричного строения, и разработка высокорегиоселективного 2-стадийного способа их получения.
Техническим результатом изобретения является высокорегиоселективное получение новых 3,5-диарилизоксазолов, в том числе несимметричного строения, с выходами от 50 до 99% в зависимости от заместителей в бензольных кольцах.
Технический результат достигается производными 3,5-диарилизоказолами общей формулы (I):
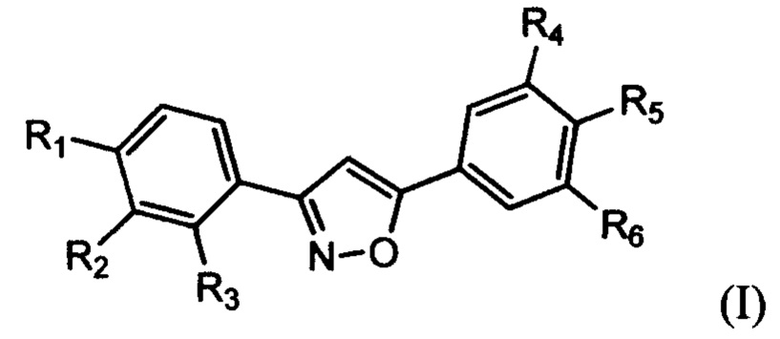
где R1-6 выбирают из Н, Hal, NO2, NH2, CF3, Alk=C1-С10 и OAlk=ОС1-OC10, неразветвленного и разветвленного строения.
Технический результат также достигается способом получения вышеуказанных соединений, заключающемся в высокорегиоселективном двухстадийном процессе: нитрозировании циклопропанов и последующем взаимодействии полученных бромизоксазолов с арилборными кислотами в условиях реакции Сузуки.
В заявленном способе на первой стадии используется реакция нитрозирования 2-арил-1,1-дибромциклопропанов. При этом для проведения реакции на 1 моль 2-арил-1,1-дибромциклопропана берут 3.5-4-кратный мольный избыток нитрозирующего реагента, а общее количество растворителя, используемого для проведения реакции рассчитывают, исходя из концентрации 2-арил-1,1-дибромциклопропана равной 0.05-0.06 моль/л.
В качестве нитрозирующего реагента могут быть использованы соли нитрозония (NOSO3Cl, NOBF4, NOHSO4), предпочтительно в качестве нитрозирующего реагента использовать хлорсульфат нитрозония.
В качестве среды для проведения реакции нитрозирования можно использовать апротонные ненуклеофильные и галогенсодержащие растворители (CH3NO2, CH2Cl2, CHCl3, C2H4Cl2), предпочтительно нитрометан.
Предпочтительно постепенное добавление суспензии хлорсульфата нитрозония в нитрометане к раствору дибромциклопропана в нитрометане. Такой порядок смешения реагирующих веществ обеспечивает высокую скорость нитрозирования и максимально возможную конверсию дибромциклопропана, а также значительно снижает долю процессов окисления и осмоления.
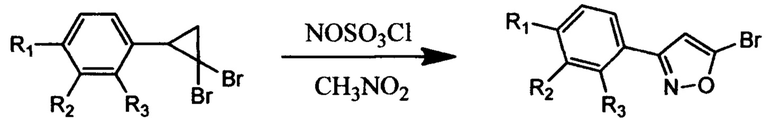
Результатом первой стадии в случае заявленных 2-арил-1,1-дибромциклопропанов является образование только одиного из двух возможных региоизомерных 5-бромизоксазолов, а именно, 3-арил-5-бромизоксазола - удобной базовой структуры для дальнейшей модификации.
На второй стадии полученные 3-арил-5-бромизоксазолы вводят в реакцию не менее, чем с двумя эквивалентами арилборных кислот в условиях реакции кросс-сочетания Сузуки в присутствии не менее 5 мол% палладиевого катализатора и 3.0-3.5 экв неорганического основания при кипячении в смеси полярного органического растворителя и воды (90-100°С) в атмосфере инертного газа.
В качестве палладиевого катализатора используют Pd(PPh3)4, или Pd(PPh3)2Cl;, или Pd(OAc)2. Предпочтительно в качестве неорганического основания используются NaHCO3, или Na2CO3, или K3CO3. В качестве полярного органического растворителя используют диметоксиэтан, или тетрагидрофуран, или 1,4-диоксан. В качестве инертного газа используют азот или аргон.
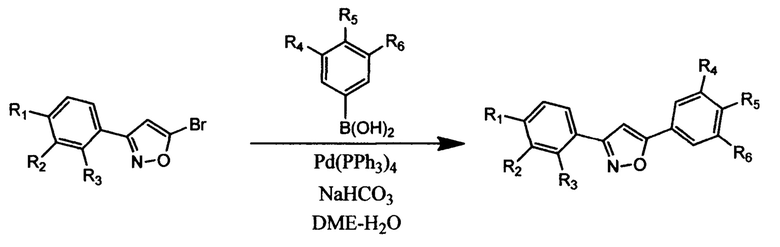
Сущностью способа является высокорегиоселективный двухстадийный синтез 3,5-диарилизоксазолов, в том числе несимметричного строения, исходя из 2-арил-1,1-дибромциклопропанов, путем комбинации реакций нитрозирования и кросс-сочетания Сузуки.
Осуществление изобретения
Все используемые реагенты являются коммерчески доступными, контроль за ходом реакции осуществляли при помощи тонкослойной хроматографии (ТСХ), и время реакции указано только для иллюстрации; выпаривание растворителя осуществляли с использованием роторного испарителя при пониженном давлении при температуре бани примерно 50°С; структуру и чистоту всех выделенных соединений подтверждали, по меньшей мере, одним из следующих методов: ТСХ (пластины для ТСХ с предварительно нанесенным силикагелем 60 UV254 Merck), ядерный магнитный резонанс (ЯМР) и/или масс-спектрометрия. Выход продукта приведен только для иллюстрации. Колоночную флэш-хроматографию осуществляли, используя Merck силикагель 60 (230-400 меш ASTM). Масс-спектры высокого разрешения (HRMS) были зарегистрированы на приборе Bruker microTOF II методом электрораспылительной ионизации (ESI). Измерения выполнены на положительных (напряжение на капилляре -4500 V) или отрицательных (напряжение на капилляре 3200 V) ионах. Диапозон сканирования масс - m/z 50-3000 Д, калибровка внешняя или внутренняя (Electrospray Calibrant Solution, Fluka). Использовался шприцевой ввод вещества для растворов в ацетонитриле или метаноле, скорость потока - 3 мкл/мин. Газ-распылитель - азот (4 л/мин), температура интерфейса - 180°С. Спектры ЯМР регистрировали на приборах Bruker Avance-400 и Agilent 400-MR (рабочая частота 400.1, 100.6 и 376.3 МГц для ядер 1Н, 13С и 19F, соответственно), используя дейтерированный хлороформ (99,8% D) или ДМСО-d6 в качестве растворителя, химические сдвиги измеряли относительно растворителя в миллионных долях (м.д.) для 1Н (CDCl3, δ = 7,24 м.д.) и 13С (CDCl3, δ = 77,13 м.д.) и CFCl3 (CFCl3, δ = 0,00 м.д.) в качестве внешнего стандарта для 19F или тетраметилсилана (TMS) в качестве внутреннего стандарта.
Оптимальными условиями для проведения 1-ой стадии двухстадийного процесса, обеспечивающими выходы 3-арил-5-бромизоксазолов в интервале 50-80%, являются:
1. Использование солей нитрозония (NOSO3Cl, NOBF4, NOHSO4), предпочтительно хлорсульфата нитрозония в качестве нитрозирующего реагента.
2. Использование 3.5-4-кратного избытка хлорсульфата нитрозония по отношению к 2-арил-1,1-дибромциклопропанам. Избыток хлорсульфата нитрозония используется для достижения максимальной конверсии дибромциклопропана. Больший избыток хлорсульфата нитрозония приводит к загрязнению целевых продуктов и усложнению стадии очистки из-за частичного осмоления дигалогенциклопропанов.
3. Использование апротонных ненуклеофильных и галогенсодержащих растворителей (CH3NO2, CH2Cl2, CHCl3, C2H4Cl2), предпочтительно нитрометана. Последний способствует более селективному и быстрому протеканию реакции нитрозирования. Общее количество растворителя, используемого для проведения реакции рассчитывали, исходя из концентрации 2-арил-1,1-дибромциклопропана равной 0.05 моль/л. Проведение реакции в растворах большей концентрации приводит к появлению побочных продуктов, 3-арил-4,5-дибромизоксазолов, и уменьшению выходов целевых соединений. Для приготовления раствора дибромциклопропана использовали 10-15 об. % растворителя, а для приготовления суспензии хлорсульфата нитрозония - 85-90 об. %.
4. Постепенное добавление суспензии хлорсульфата нитрозония в нитрометане к раствору дибромциклопропана в нитрометане. Данный порядок смешения реагирующих веществ обеспечивает высокую концентрацию циклопропана на начальном этапе проведения реакции, и, соответственно, высокую скорость нитрозирования, что позволяет достичь максимально возможной конверсии дибромциклопропана даже для циклопропанов с дезактивированными ароматическими кольцами. Данный порядок смешения реагирующих веществ препятствует появлению избытка хлорсульфата нитрозония в реакционной среде, что значительно снижает долю процессов окисления и осмоления.
5. Проведение реакции при температуре 30-35°С. Показано, что при комнатной температуре реакция нитрозирования протекает медленнее, чем конкурирующие процессы галогенирования и нитрозогалогенирования арилдибромциклопропана, что приводит к расходованию последнего на побочные превращения и, следовательно, снижает выход целевого продукта. При температуре выше 35°С происходит деградация реагента.
6. Проведение реакции в течение 10-40 минут в зависимости от заместителя в бензольном кольце (контроль методом ТСХ по появлению следовых количеств 3-арил-4,5-дибромизоксазола). Показано, что увеличение времени реакции способствует увеличению количества 3-арил-4,5-дибромизоксазола и уменьшению выхода целевого соединения.
По окончании реакции смесь выливают в воду, экстрагируют хлористым метиленом или хлороформом. Органические вытяжки высушивают над безводным сульфатом натрия. Растворитель отгоняют при пониженном давлении (например, на роторном испарителе). Продукт очищают либо путем перекристаллизации (например, растворяя сухой остаток реакционной смеси в горячем этаноле с последующим фильтрованием и охлаждением раствора), либо путем деления реакционной смеси с использованием препаративной колоночной хроматографии на SiO2 (элюент выбирается с учетом полярности исходной молекулы и заместителей в бензольном кольце, например, этилацетат/петролейный эфир = 1:10).
Оптимальными условиями для проведения 2-ой стадии двухстадийного процесса, обеспечивающими выходы 3,5-диарилизоксазолов в интервале 70-99%, являются:
1. Использование в качестве катализатора солей палладия (Pd(PPh3)4, Pd(PPh3)2Cl2, или Pd(OAc)2), предпочтительно тетракис(трифенилфосфин)палладия (0.05 мол эквивалента).
2. Использование двукратного избытка арилборной кислоты по отношению к исходному 3-арил-5-бромизоксазолу. Уменьшение количества арилборной кислоты приводит к уменьшению выхода целевого 3,5-диарилизоксазола, увеличение количества арилборной кислоты не влияет на выход и приводит лишь к перерасходу реагента.
3. Использование в качестве неорганического основания карбонатов щелочных металлов (NaHCO3, Na2CO3, или K2CO3), предпочтительно NaHCO3 в количестве 3 эквивалентов. Сильные основания, например K2CO3, способствуют деградации изоксазольного цикла 3-арил-5-бромизоксазолов, что приводит к снижению выходов целевых 3,5-диарилизоксазолов.
4. Использование смеси кислородсодержащих растворителей (ДМЕ, ТГФ, диоксана, этанола) и воды в соотношении 2:1 в качестве реакционной среды, предпочтительно диметоксиэтана и воды. Замена диметоксиэтана, например, на тетрагидрофуран ведет к снижению выходов 3,5-диарилизоксазолов, т.к. реакция проводится при кипячении, и более низкая температура кипения тетрагидрофурана относительно диметоксиэтана ведет к неполной конверсии исходного соединения.
5. Проведение реакции при температуре 90-100°С (при кипячении в смеси ДМЭ/вода). Показано, что в интервале температур 25-60°С реакция идет очень медленно, либо не идет вовсе, в зависимости от заместителей в бензольных кольцах.
6. Проведение реакции в течение 5-10 часов в зависимости от заместителей в бензольных кольцах (контроль методом ТСХ по исчезновению пятна исходного соединения).
7. Проведение реакции в инертной атмосфере, где в качестве инертного газа можно использовать аргон или азот. Показано, что в присутствии кислорода увеличивается вклад реакции самосочетания арилборной кислоты с образованием симметричного замещенного бифенила, что осложняет стадию очистки целевого соединения.
Большинство полученных соединений являются новыми. Строение их подтверждено результатами ЯМР спектроскопии 1Н и 13С и масс-спектрометрии высокого разрешения. Для 3-(3-трифторметилфенил)-5-бромизоксазола получены данные рентгено-структурного анализа.
Указанные существенные признаки определяют новизну изобретения и существенные отличия от прототипа и известного уровня техники в данной области.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез 5-(3-метил-4-метоксифенил)-3-фенилизоксазола
Стадия 1
В тщательно высушенную одногорлую круглодонную колбу с плотно притертой пробкой и предварительно тарированную помещали суспензию хлорсульфата нитрозония в CH2Cl2. Растворитель отгоняли и определяли массу хлорсульфата нитрозония. Полученные 5.8 г (0.04 моль) белого гигроскопичного порошка хлорсульфата нитрозония растворяли в 180 мл CH3NO2. В тщательно высушенную одногорлую круглодонную колбу на 500 мл, снабженную магнитной мешалкой и капельной воронкой с противодавлением, помещали 2.76 г (0.01 моль) 1,1-дибром-2-фенилциклопропана и 20 мл CH3NO2. Колбу помещали на водяную баню и при перемешивании и нагревании (35°С) к раствору циклопропана прикапывали суспензию хлорсульфата нитрозония. Степень прохождения реакции контролировали методом ТСХ: 1,1-дибром-2-фенилциклопропан - Rf 0.70, 3-фенил-4,5-дибромизоксазол - Rf 0.60, 3-фенил-5-бромизоксазол - Rf 0.48 (элюент бензол/петролейный эфир = 3:2). При появлении следов 3-фенил-4,5-дибромизоксазола реакцию прекращали, выливая реакционную смесь в воду, доводя рН водной фазы до нейтральной реакции. Органический слой отделяли, нитрометан упаривали на роторном испарителе с целью последующей регенерации, органический остаток растворяли в хлороформе и промывали водой. Водные фазы обрабатывали двумя порциями CHCl3. Объединенные органические вытяжки сушили над безводным Na2SO4. Растворитель отгоняли на роторном испарителе. 3-Фенил-5-бромизоксазол и непрореагировавший 1,1-дибром-2-фенилциклопропан выделяли методом препаративной колоночной хроматографии (элюент - бензол/петролейный эфир = 3:2). Выделяли 0.44 г (40%) 5-бром-3-фенилизоксазола в виде желтоватого аморфного порошка, т.пл. = 45°С. Выход указан на вступивший в реакцию исходной циклопропан.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.60 с (1Н, СНизокс), 7.45-7.50 м (3Н, 3СНар), 7.75-7.80 м (2Н, 2СНар).
Спектр ЯМР 13С, δ, м.д. J, Гц: 104.5 (СНизокс), 126.7 (2СНар), 128.0 (Сар), 129.1 (2СНар), 130.6 (СНар), 141.8 (СизоксBr), 164.2 (C=N).
Стадия 2
В круглодонную двугорлую колбу на 25 мл, снабженную магнитной мешалкой, обратным холодильником и отводом для пропускания аргона, помещали 50 мг (0.22 ммоль) 5-бром-3-фенилизоксазола, 55 мг (0.66 ммоль) NaHCO3, 12 мг (0.011) ммоль Pd(PPh3)4, 74 мг (0.44 ммоль) 3-метил-4-метоксифенилборной кислоты, 3 мл DME и 1.5 мл Н2О. Колбу трижды дегазировали и заполняли аргоном. Смесь кипятили 8 часов, а затем оставляли на ночь. На следующий день реакционную смесь пропускали через колонку-фильтр (элюент - этил ацетат). Растворители отгоняли на роторном испарители. 5(3-Метил-4-метоксифенил)-3-фенилизоксазол выделяли методом препаративной колоночной хроматографии (элюент - бензол/петролейный эфир = 3:2 или этилацетат/петролейный эфир = 3:2) в виде бесцветных кристаллов с т.пл. = 98°С. Выход 47 мг (80%).
Спектр ЯМР 1Н, δ, м.д. J, Гц: 2.29 с (3Н, CH3), 3.88 с (3Н, ОСН3), 6.70 с (1Н, СНизокс), 6.89 д (1Н, 3J 8.6 Гц, СНар), 7.44-7.50 м (3Н, СНар), 7.62 уш.с (1Н, СНар), 7.66 д.д (1Н, СНар, 3J 8.4, 4J 1.7 Гц), 7.80-7.90 м (2Н, 2СНар).
Спектр ЯМР 13С, δ, м.д. J, Гц: 16.3 (СН3), 55.4 (ОСН3), 95.9 (СНизокс), 110.3 (СНар), 119.8 (Сар), 124.9 (СНар), 126.8 (2СНар), 127.4 (С-Ме), 128.2 (СНар), 128.9 (2СНар), 129.4 (Сар), 129.9 (СНар), 159.4 (С-ОМе), 162.9 (C=N), 170.7 (С-О).
HRMS [М+Н]+ Найдено: 266.1180; Вычислено для C17H16NO2: 266.1176
Пример 2. Синтез 5-(3,4,5-триметоксифенил)-3-фенилизоксазола
Стадия 2
В результате реакции 5-бром-3-фенилизоксазола (50 мг, 0.22 ммоль) с 3,4,5-триметоксифенилборной кислотой (95 мг, 0.44 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 130 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 62 мг (90%) 5-(3,4,5-триметоксифенил)-3-фенилизоксазола в виде бесцветных кристаллов с т.пл. = 145°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 3.91 с (3Н, ОСН3), 3.93 с (6Н, 2ОСН3), 6.77 с (1Н, С(4)изоксН), 7.04 с (2Н, 2СНар), 7.42-7.51 м (3Н, 3СНар), 7.83-7.89 м (2Н, 2СНар)
Спектр ЯМР 13C, δ, м.д. J, Гц: 55.9 (2OCH3), 60.6 (ОСН3), 96.8 (С(4)изоксН), 102.7 (2СНар), 122.4 (С(1)ар), 126.4 (2СНар), 128.5 (2СНар), 128.6 (С(1)ар), 129.6 (СНар), 139.4 (С-ОСН3), 153.2 (2С-ОСН3), 162.6 (C=N), 169.8 (С-О).
HRMS [M+H]+ Найдено: 312.1226; Вычислено для C18H18NO4: 312.1230.
Пример 3. Синтез 5-(5-индолил)-3-фенилизоксазола
Стадия 2
В результате реакции 5-бром-3-фенилизоксазола (70 мг, 0.31 ммоль) с 5-индолилборной кислотой (100 мг, 0.62 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 155 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 96 мг (99%) 5-(5-индолил)-3-фенилизоксазола в виде серого аморфного порошка с т.пл. = 163°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.67 м (1Н, СНинд), 6.80 с (1Н, СНизокс), 7.30 м (1Н, СНар), 7.49 м (4Н, 4СНар), 7.70 д (1Н, СНар, 3J 7.0 Гц), 7.90 д.д (2Н, СНар, 3J 7.5, 4J 1.8 Гц), 8.18 уш.с (1Н, СНар), 8.40 уш.с (1Н, NH).
HRMS [M+H]+ Найдено: 261.1022; Вычислено для C17H12N3O: 261.1027.
Пример 4. Синтез 3-(2-хлорфенил)-5-(3-хлорфенил)изоксазола
Стадия 7
В результате реакции 1,1-дибром-2-(2-хлорфенил)циклопропана (1 г, 0 003 моль) с NOSO3Cl (1.7 г, 0.012 моль) в 64 мл нитрометана в условиях, описанных в примере 1 (стадия 1), получили 0.7 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделили 0.22 г (54%) 5-бром-3-(2-хлорфенил)изоксазола в виде красного масла.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.77 с (1Н, СНизокс), 7.36 т.д (1Н, СНар, 3J 7.5, 4J 1.9 Гц), 7.41 т.д (1Н, СНар, 3J 7.5, 4J 1.9 Гц), 7.44-7.52 м (1Н, СНар), 7.71 д.д (1Н, СНар, 3J 7.5, 4J 1.9 Гц). Спектр ЯМР 13C, δ, м.д. J, Гц: 107.7 (СНизокс), 127.3 (СНар), 127.3 (Сар), 130.5 (СНар), 130.8 (СНар), 131.5 (СНар), 132.9 (С-Cl), 141.1 (СизоксBr), 162.9 (C=N).
HRMS (ESI) m/z: [M+H]+ Calcd for C9H6BrClNO257.9316, 259.9295, 261.9266; Found 257.9313,259.9293,261.9267.
Стадия 2
В результате реакции 5-бром-3-(2-хлорфенил)изоксазола (50 мг, 0.19 ммоль) с 3-хлорфенилборной кислотой (60 мг, 0.40 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 96 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделяли 47 мг (83%) 3-(2-хлорфенил)-5-(3-хлорфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 86°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 7.02 с (1Н, СНизокс), 7.35-7.45 м (4Н, 4СНар), 7.52 д.д (1Н, СНар, 3J 7.8, 4J 1.4 Гц), 7.71-7.76 м (1Н, СНар), 7.80 д.д (1Н, СНар, 3J 7.2, 4J 2.1 Гц), 7.83 уш.с (1Н, СНар).
Спектр ЯМР 13C, м.д. J, Гц: 101.2 (CHизокс), 123.5 (СНар), 125.5 (СНар), 126.8 (СНар), 127.7 (Сар), 128.6 (Сар), 129.8 (СНар), 130.0 (СНар), 130.1 (СНар), 130.56 (СНар), 130.6 (СНар), 132.5 (Сар-Cl), 134.7 (Сар-Cl), 161.3 (C=N), 167.8 (С-O).
HRMS [М+Н]+ Найдено: 290.0128, 292.0096; Вычислено для C15H10Cl2NO: 290.0134, 292.0104.
Пример 5. Синтез 5-(3-метил-4-метоксифенил)-3-(2-хлорфенил)изоксазола
Стадия 2
В результате реакции 5-бром-3-(2-хлорфенил)изоксазола (50 мг, 0.19 ммоль) с 3-метил-4-метоксифенилборной кислотой (64 мг, 0.40 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 106 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделяли 36 мг (50%) 5-(3-метил-4-метоксифенил)-3-(2-хлорфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 124°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 2.29 с (3Н, СН3), 3.89 с (3Н, ОСН3), 6.85 с (1Н, СНизокс), 6.91 д (1Н, СНар, 3J 8.5 Гц), 7.36-7.41 м (2Н, 2СНар), 7.50-7.55 м (1Н, СНар), 7.61 уш.с (1Н, СНар), 7.68 д.д (1Н, СНар, 3J 8.5, 4J 1.9 Гц), 7.79 д.д (1Н, СНар, 3J 7.0, 4J 2.3 Гц)
Спектр ЯМР 13С, δ, м.д. J, Гц: 15.9 (СН3), 55.0 (ОСН3), 98.9 (CHизокc), 109.6 (СНар), 119.3 (Сар), 124.5 (СНар), 126.7 (СНар), 127.0 (Сар), 127.8 (СНар), 128.2 (Сар), 130.0 (СНар), 130.3 (СНар), 130.6 (СНар), 132.5 (Сар-Cl), 159.0 (Сар-ОСН3), 161.1 (C=N), 169.6 (С-О).
HRMS [М+Н]+ Найдено: 300.0782, 302.0749; Вычислено для C17H15ClNO2: 300.0786,302.0756.
Пример 6. Синтез 3-(3-хлорфенил)-5-(4-хлорфенил)изоксазола
Стадия 7
В результате реакции 1,1-дибром-2-(3-хлорфенил)циклопропана (1 г, 0.003 моль) с NOSO3Cl (1.7 г, 0.012 моль) в 64 мл нитрометана в условиях, описанных в примере 1 (стадия 1), получили 0.6 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделили 0.19 г (50%) 5-бром-3-(3-хлорфенил)изоксазола в виде белых кристаллов с т.пл. = 78°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.58 с (1Н, СНизокс), 7.35-7.45 м (2Н, 2СНар), 7.62 д (1Н, СНар, 3J 7.2 Гц), 7.74 с (1Н, СНар).
Спектр ЯМР 13C, δ, м.д. J, Гц: 104.0 (CHизокс), 124.4 (СНар), 126.3 (СНар), 129.2 (Сар), 129.9 (СНар), 130.2 (СНар), 134.7 (С-Cl), 141.8 (СизоксBr), 162.6 (C=N).
Стадия 2
В результате реакции 5-бром-3-(3-хлорфенил)изоксазола (50 мг, 0.19 ммоль) с 4-хлорфенилборной кислотой (60 мг, 0.4 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 80 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделяли 36 мг (66%) 3-(3-хлорфенил)-5-(4-хлорфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 143°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.80 с (1Н, CHизокс), 7.45 м (4Н, 4СНар), 7.75 м (3Н, 3СНар), 7.85 с (1Н, СНар)
Спектр ЯМР 13C, δ, м.д. J, Гц: 97.3 (CHизокс), 124.5 (СНар), 125.2 (Сар), 126.5 (СНар), 126.7 (2СНар), 129.0 (2СНар), 129.7 (СНар), 129.9 (СНар), 130.2 (Сар), 134.6 (Сар-Cl), 136.1 (Сар-Cl), 161.6 (C=N), 169.2 (С-О).
HRMS (ESI) m/z: [M+H]+ Calcd юг C15H10Cl2NO290.0134, 292.0105, 294.0075; Found 290.0135,292.0103,294.0078.
Пример 7. Синтез 5-фенил-3-(4-хлорфенил)изоксазола
Стадия 1
В результате реакции 1,1-дибром-2-(4-хлорфенил)циклопропана (1 г, 0.003 моль) с NOSO3Cl (1.7 г, 0.012 моль) в 64 мл нитрометана в условиях, описанных в примере 1 (стадия 1), получили 0.71 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделили 0.19 г (50%) 5-бром-3-(4-хлорфенил)изоксазола в виде белых кристаллов с т.пл. = 127°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.58 с (1Н, СНизокс), 7.45 д (2Н, 2СНар, 3J 8.6 Гц), 7.71 д(2Н, 2СНар, 3J 8.6 Гц).
Спектр ЯМР 13C, δ, м.д. J, Гц: 104.3 (СНизокс), 126.5 (Сар), 128.0 (2СНар), 129.4 (2СНар), 136.7 (С-Cl), 142.1 (СизоксBr), 163.2 (C=N).
Стадия 2
В результате реакции 5-бром-3-(4-жлорфенил)изоксазола (50 мг, 0.19 ммоль) с фенилборной кислотой (49 мг, 0.40 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 78 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделяли 34 мг (70%) 5-фенил-3-(4-хлорфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 177°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.81 с (1Н, CHизокс), 7.49 м (5Н, 5СНар), 7.81 м (4Н, 4СНар).
Пример 8. Синтез 3-(2-фторфенил)-5-(3-фторфенил)изоксазола
Стадия 1
В результате реакции 1,1-дибром-2-(2-фторфенил)циклопропана (1.3 г, 0.0044 моль) с NOSO3Cl (2.6 г, 0.018 моль) в 89 мл нитрометана в условиях, описанных в примере 1 (стадия 1), получили 1.08 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделили 0.25 г (64%) 5-бром-3-(2-фторфенил)изоксазола в виде желтого масла.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.75 д (1Н, CHизокс, 5JHF 3.6 Гц), 7.16-7.28 м (2Н, 2СНар), 7.40-7.50 м (1Н, СНар), 7.95 т (1Н, СНар, J 7.6 Гц)
Спектр ЯМР 13C, δ, м.д. J, Гц: 106.4 д (CHизокc, 4JCF 9.8 Гц), 115.7 д (Сар, 2JCF 11.8 Гц), 116.0 д (СНар, 2JCF 21.7 Гц), 124.3 д (СНар, 3.5 Гц), 128.3 д (СНар, JCF 2.6 Гц), 131.9 д (СНар, JCF 8.7 Гц), 141.3 д (СизоксBr, 5JCF 2.0 Гц), 159.1 д (C=N, 3JCF 15 Гц), 159.9 д (C-F, 1JCF 252.1 Гц).
HRMS [М+Н]+ Найдено: 241.9617, 243.9594; Вычислено для C9H5BrFNO: 241.9611, 243.9591.
Стадия 2
В результате реакции 5-бром-3-(2-фторфенил)изоксазола (150 мг, 0.62 ммоль) с 3-фторфенилборной кислотой (173 мг, 1.24 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 220 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделяли 123 мг (78%) 3-(2-фторфенил)-5-(3-фторфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 86°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.99 д (1Н, СНизокс, 5J 3.42 Гц), 7.19 м (3Н, 3СНар), 7.44 м (2Н, 2СНар), 7.53 д.д (1Н, СНар, J 9.4, 1.3 Гц), 7.61 д (1Н, СНар, J 7.6 Гц), 8.04 т (1Н, СНар, J 7.6 Гц).
Спектр ЯМР 13С, δ, м.д. J, Гц: 102.2 д (СНизокс, JCF 9.2 Гц), 112.4 д (СНар, 2JCF 23.8 Гц), 116.0 д (СНар, 2JCF 21.7 Гц), 116.5 д (Сар, JCF 12.0 Гц), 116.7 д (СНар, JCF 21.2 Гц), 121.1 д (СНар, JCF 3.3 Гц), 124.2 д (СНар, JCF 3.5 Гц), 128.6 д (СНар, JCF 2.8 Гц), 128.8 д (Cap, JCF 8.3 Гц), 130.3 д (СНар, JCF 8.3 Гц), 131.4 д (СНар, JCF 8.9 Гц), 158.0 д (C=N, JCF 1.8 Гц), 159.4 д (Cap-F, 1JCF 251.6 Гц), 162.5 д (Cap-F, 1JCF 247.1 Гц), 168.5 (С-О).
Спектр ЯМР 19F, δ, м.д.: -111.6 м (Cap-F), -114.3 м (Cap-F).
HRMS [М+Н]+ Найдено: 258.0733; Вычислено для C15H10F2NO: 258.0725.
Пример 9. Синтез 3-(2-фторфенил)-5-(4-хлорфенил)изоксазола
Стадия 2
В результате реакции 5-бром-3-(2-фторфенил)изоксазола (50 мг, 0.20 ммоль) с 4-хлорфенилборной кислотой (49 мг, 0.40 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 79 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделяли 25 мг (60%) 3-(2-фторфенил)-5-(4-хлорфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 138°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.96 д (1Н, СНизокс, 5JHF 3.4 Гц), 7.23 м (2Н, 2СНар), 7.45 м (3Н, 3СНар), 7.77 д.д (2Н, 2СНар, J8.6, J2.1 Гц), 8.03 м (1Н, СНар)
Спектр ЯМР 13C, δ, м.д. J, Гц: 99.9 д (CHизокc, 4JGF 9.2 Гц), 116.0 д (СНар, 2JCF 21.8 Гц), 116.5 д (Cap, 2JCF 11.6 Гц), 124.3 д (СНар, JCF 3.5 Гц), 125.4 (Cap), 126.7 (2СНар), 128.6 д (СНар, JCF 2.8 Гц), 128.9 (2CHap), 131.4 д (СНар, 3JCF 8.7 Гц), 135.9 (Сар-Cl), 158.0 (C=N), 159.9 д (Cap-F, 1JCF 251.6 Гц), 168.7 (С-О).
Спектр ЯМР 19F, δ, м.д.: -114.3 м (Cap-F).
HRMS (ESI) m/z: [M+H]+Calcd for C15H10FClNO274.0429, 276.0401; Found 274.0425, 276.0400.
Пример 10. Синтез 5-(3-аминофенил)-3-(2-фторфенил)изоксазола
Стадия 2
В результате реакции 5-6ром-3-(2-фторфенил)изоксазола (70 мг, 0.29 ммоль) с 3-аминофенилборной кислотой (79 мг, 0.60 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 130 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 70 мг (95%) 5-(3-аминофенил)-3-(2-фторфенил)изоксазола в виде желтых кристаллов с т.пл. = 107°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 3.87 уш.с (2Н, NH2), 6.76 м (1Н, СН), 6.92 уш.с (1Н, СНизокс), 7.15-7.30 м (5Н, 5СНар), 7.43 м (1Н, СНар), 8.03 т (1Н, СНар, J7.2 Гц).
Спектр ЯМР 13С, δ, м.д. J, Гц: 99.6 д (CHизокc, 4JCF 9.0 Гц), 111.5 (СНар), 115.8 (СНар) 116.0 д (СНар, 2JCF 21.9 Гц) 116.5 (СНар), 116.8 д (Сар, 2JCF 11.6 Гц), 124.2 д (СНар, JCF 3.5 Гц), 127.8 (Сар), 128.7 д (СНар, JCF 2.8 Гц), 129.6 (СНар), 131.2 д (СНар, JCF 8.7 Гц), 146.6 (Cap-NH2), 157.9 (C=N), 159.8 (Cap-F, 1JCF 251.7 Гц), 170.1 (С-О).
Спектр ЯМР 19F, δ, м.д.: -114.2 м (Cap-F).
HRMS [M+H]+ Найдено: 255.0924; Вычислено для C15H12FN2O: 255.0928.
Пример 11. Синтез 5-(3,4,5-триметоксифенил)-3-(2-фторфенил)изоксазола
Стяжки 2
В результате реакции 5-бром-3-(2-фторфенил)изоксазола (50 мг, 0.21 ммоль) с 3,4,5-триметоксифенилборной кислотой (89 мг, 0.42 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 82 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 36 мг (81%) 5-(3,4,5-триметоксифенил)-3-(2-фторфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 114°С.
Спектр ЯМР 1Н NMR (400 MHz, CDCl3) δ3.91 s (3Н, ОМе), 3.95 s (6Н, 20Ме), 6.91 d (1Н, CHis, 5JHF 3.5 Hz), 7.20 m (1H, CHAr), 7.26 td (1H, CHAr, J 7.6, J 1.0 Hz), 7.40-7.48 m (1H, CHSAr), 8.04 dt (1H, CHAr, J 7.6, У 1.6 Hz).
Спектр ЯМР 13C, δ, м.д. J, Гц: 55.9 (2OCH3), 60.6 (ОСН3), 99.3 д (С(4)изоксН, JCF 9.4 Гц), 102.7 (2СНар), 116.0 д (СНар, 2JCF 21.8 Гц), 116.7 д (Cap, JCF 12.0 Гц), 122.4 (С(1)ар), 124.2 д (СНар, JCF 3.3 Гц), 128.7 д (СНар, JCF 2.6 Гц), 131.3 д (СНар, JCF 8.7 Гц), 139.4 (С-ОСН3), 153.2 (2С-ОСН3), 158.0 (C=N), 159.9 д (CF, 1JCF 251.2 Гц), 169.7 (С-О).
Спектр ЯМР 19F, δ, м.д. J, Гц: -114.39 м (C-Fap).
HRMS (ESI) m/z: [M+H]+ Calcd for C18H17FNO4330.1136; Found 330.1120.
Пример 12. Синтез 5-(5-индолил)-3-(2-фторфенил)изоксазола
Стадия 2
В результате реакции 5-6ром-3-(2-фторфенил)изоксазола (50 мг, 0.21 ммоль) с 5-индолилборной кислотой (67 мг, 0.42 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 80 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 50 мг (85%) 5-(5-индолил)-3-(2-фторфенил)изоксазола в виде коричневых кристаллов с т.пл. = 124°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.66 м (1Н, СНинд), 6.97 д (1Н, СНизокс, 5J 3.4 Гц), 7.25 м (3H, 3СНар), 7.46 м (2Н, 2CHap), 7.69 м (1H, СНар), 8.07 т.д (1Н, СНар, У 7.6,14 Гц), 8.20 с (1Н, СНар), 8.63 уш.с (1Н, NH),
Спектр ЯМР 13С, δ, м.д. J, Гц: 98.2 д (СНизокс, 4JCF 8.7 Гц), 103.0 (СНар), 111.4 (СНар), 116.0 д (СНар, 2JCF 21.9 Гц), 117.0 д (Сар, 2JCF 12.0 Гц), 118.5 (СНар), 119.0 (Сар), 119.7 (СНар), 124.2 д (СНар, JCF 3.5 Гц), 125.4 (СНар), 127.6 (Cap), 128.8 д (СНар, JCF 3.0 Гц), 131.2 д (СНар, JCF 8.5 Гц), 136.4 (Сар), 158.0 (C=N), 159.8 д (Cap-F, 1JCF 251.7 Гц), 171.7 (С-О).
Спектр ЯМР 19F, δ, м.д.: -113.9 м (Cap-F).
HRMS [М+Н]+ Найдено: 279.0926; Вычислено для C17H12FN2O: 279.0928.
Пример 13. Синтез 5-(4-пиридинил)-3-(2-фторфенил)изоксазола
Стадия 2
В результате реакции 5-бром-3-(2-фторфенил)изоксазола (70 мг, 0.29 ммоль) с 4-пиридинилборной кислотой (71 мг, 0.60 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 105 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделяли 28 мг (40%) 5-(4-пиридинил)-3-(2-фторфенил)изоксазола в виде желтоватых кристаллов с т.пл. = 122°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 7.16-7.28 m (3H, 2CHAr+CHis), 7.46 м (СНар), 7.70 д (2Н, 2СНпир, 3J 5.0 Гц), 8.03 т.д (1Н, СНар, 3JHH 7.6, 4JHF 1.64 Гц), 8.76 м (2Н, СНпир).
Спектр ЯМР 13С, δ, м.д. J Гц: 102.2 д (СНизокс, 4JCF 9.6 Гц), 116.0 д (СНар, 2JCF 21.9 Гц), 116.1 д (Сар, 2JCF 11.6 Гц), 119.1 (2СНпир), 124.4 д (СНар, JCF 3.7 Гц), 128.6 д (СНар, JCF 2.8 Гц), 131.7 д (СНар, JCF 8.7 Гц), 133.6 (Спир), 150.4 (2СНпир), 158.2 (C=N), 160.1 д (Cap-F, 1JCF 251.6 Гц), 167.2 (С-О).
Спектр ЯМР 19F, δ, м.д.: -114.4 м (Cap-F).
HRMS [М+Н]+ Найдено: 241.0779; Вычислено для C14H10FN2O: 241.0772.
Пример 14. Синтез 5-(3-метил-4-метоксифенил)-3-(4-фторфенил)изоксазола
Стадия 1
В результате реакции 1,1-дибром-2-(4-фторфенил)циклопропана (11 г, 0.004 моль) с NOSO3Cl (2.5 г, 0.016 моль) в 73 мл нитрометана в условиях, описанных в примере 1 (стадия 1), получили 0.5 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделили 0.15 г (40%) 5-6ром-3-(4-фторфенил)изоксазола в виде белых кристаллов с т.пл. = 94°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.56 с (1Н, СНизокс), 7.16 т (2Н, 2СНар, J 8.6 Гц), 7.75 д.д (2Н, 2СНар, J 8.6, 5.3 Гц).
Спектр ЯМР 13C, δ, м.д. J, Гц: 103.9 (СНизокс), 115.8 д (2СНар, 2JCF 21.9 Гц), 123.8 д (Сар, 4JCF 3.1 Гц), 128.3 д (2СНар, 3JCF 8.7 Гц), 141.6 (СизоксBr), 162.9 (C=N), 163.7 д (C-F, 1JCF 251.0 Гц).
HRMS [М+Н]+ Найдено: 241.9615, 243.9594; Вычислено для C9H6BrFNO: 241.9611, 243.9591.
Стадия 2
В результате реакции 5-бром-3-(4-фторфенил)изоксазола (50 мг, 0.20 ммоль) с 3-метил-4-метоксифенилборной кислотой (65 мг, 0.40 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 80 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделяли 40 мг (72%) 5-(3-метил-4-метоксифенил)-3-(4-фторфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 124°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 2.28 с (3H, СН3), 3.88 с (3H, ОСН3), 6.64 с (1Н, СНизокс), 6.89 д (1Н, СНар, 3J 8.5 Гц), 7.15 т (2Н, СНар 3J 8.6 Гц), 7.59 с (1Н, СНар), 7.64 д.д (1Н, СНар, 3J 8.5, 4J 1.8 Гц), 7.84 д.д (2Н, 2СНар, J 8.6, 5.4 Гц).
Спектр ЯМР 13C, δ, м.д. J, Гц: 15.9 (СН3), 55.0 (ОСН3), 95.4 (СНизокс), 109.6 (СНар), 115.5 д (2СНар, 2J 21.9 Гц), 119.2 (Сар), 124.5 (СНар), 125.2 д (Cap, 4JCF 3.1 Гц), 127.0 (Сар), 127.8 (СНар), 128.3 (2СНар, 3JCF 8.3 Гц), 159.0 (Сар-ОСН3), 161.5 (C=N), 163.3 (Cap-F, 1JCF 249.7 Гц), 170.4 (С-О).
Спектр ЯМР 19F, δ, м.д.: -110.9 м (Cap-F).
HRMS [М+Н]+ Найдено: 330.1120; Вычислено для C18H15FNO4: 330.1136.
Пример 15. Синтез 5-(3,4,5-триметоксифенил)-3-(4-фторфенил)изоксазола
Стадия 2
В результате реакции 5-бром-3-(4-фторфенил)изоксазола (50 мг, 0.21 ммоль) с 3,4,5-триметоксифенилборной кислотой (89 мг, 0.42 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 80 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 32 мг (70%) 5-(3,4,5-триметоксифенил)-3-(4-фторфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 134°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 3.90 с (3H, ОСН3), 3.93 с (6Н, 2OCH3), 6.73 с (1Н, С(4)изоксН), 7.03 с (2Н, 2СНар), 7.15 т (2Н, 2СНар, J 8.6 Гц), 7.84 д.д (2Н, 2СНар, J 8.6, 5.3 Гц).
Спектр ЯМР 13С, δ, м.д. J, Гц: 55.8 (2OCH3), 60.6 (ОСН3), 96.6 (С(4)изоксН), 102.7 (2СНар), 115.6 д (2СНар, 2JCF 21.9 Гц), 122.3 (С(1)ар), 124.8 д (С(1)ар, 4JCF 3.1 Гц), 128.3 д (2СНар, 3JCF 8.3 Гц), 139.5 (С-ОСН3), 153.2 (2С-ОСН3), 161.7 (C=N), 163.4 д (CF, 1JCF 250.1 Гц), 169.9 (С-О).
Спектр ЯМР 19F, δ, м.д. J, Гц: -110.49 м (C-Fap).
HRMS [M+H]+ Найдено: 330.1129; Вычислено для C18H17FNO4: 330.1136.
Пример 16. Синтез 5-(5-индолил)-3-(4-фторфенил)изоксазола
Стадия 2
В результате реакции 5-бром-3-(4-фторфенил)изоксазола (34 мг, 0.14 ммоль) с 5-индолилборной кислотой (45 мг, 0.28 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 65 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 24 мг (66%) 5-(5-индолил)-3-(4-фторфенил)изоксазола в виде желтых кристаллов с т.пл. = 180°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.67 м (1Н, СНинд), 6.75 с (1Н, СНизокс), 7.18 т (2Н, 2СНар, 3J 8.5 Гц), 7.29 м (1Н, СНар), 7.49 д (1Н, СНар, 3J 8.5 Гц), 7.68 д.д (1Н, СНар, 3J 8.5, 4J 1.2 Гц), 7.88 д.д (2Н, СНар, J 8.5, J 5.4 Гц), 8.17 с (1Н, СНар), 8.37 уш.с (1Н, NH).
HRMS [М+Н]+ Найдено: 279.0930; Вычислено для C17H12FN2O: 279.0928.
Пример 17. Синтез 5-(3,4,5-триметоксифенил)-3-(2-трифторметилфенил)изоксазола
Стадия 1
В результате реакции 1,1-ди6ром-2-(2-трифторметилфенил)циклопропана (1.0 г, 0.003 моль) с NOSO3Cl (1.7 г, 0.012 моль) в 64 мл нитрометана в условиях, описанных в примере 1 (стадия 1), получили 0.5 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделили 0 26 г (60%) 5-бром-3-(2-трифторметилфенил)изоксазола в виде красного масла.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.52 с (1Н, СНизокс), 7.60-7.70 м (3H, 3СНар), 7.82 д (1Н, СНар, 3J 7.2 Гц).
Спектр ЯМР 13C, δ, м.д. J, Гц: 107.7 к (СНизокс, 5JCF 3.4 Гц), 123.5 к (CF3, 1JCF 273.8 Гц), 126.5 к (СНар, 3JCF 5.1 Гц), 127.1 к (СНар, 4JCF 17 Гц), 128.6 к (Cap-CF3, 2JCF 68.7 Гц), 130.2 (СНар), 131.6 (СНар), 132.0 (Сар), 141.4 (СизоксBr), 163.3 (C=N).
Спектр ЯМР 19F, δ, м.д.: -58.13 с (CF3).
HRMS [М+Н]+ Найдено: 291.9576, 293.9559; Вычислено для C10H6BrF3NO: 291.9579,293.9559.
Стадия 2
В результате реакции 5-бром-3-(2-трифторметилфенил)изоксазола (30 мг, 0.11 ммоль) с 3,4,5-триметоксифенилборной кислотой (46 мг, 0.22 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 76 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 24 мг (64%) 5-(3,4,5-триметоксифенил)-3-(2-трифторметилфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 110°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 3.92 с (3H, ОСН3), 3.95 с (6Н, 2OCH3), 6.66 с (1Н, С(4)изоксН), 7.06 с (2Н, 2СНар), 7.57-7.65 м (1Н, СНар), 7.65-7.70 м (2Н, 2СНар), 7.83 д (1Н, СНар, 3J 7.7 Гц).
Спектр ЯМР 13C, δ, м.д. J, Гц: 55.9 (2OCH3), 60.6 (ОСН3), 100.1 к (С(4)изоксН, JCF 3.0 Гц), 102.8 (2СНар), 122.2 (С(1)ар), 123.3 к (CF3, 1JCF 273.9 Гц), 126.1 к (СНар, 3JCF 5.3 Гц), 127.9 к (C(1)ap, JCF 2.0 Гц), 128.4 к (C-CF3, 2JCF 31.3 Гц), 129.4 (СНар), 131.3 (СНар), 131.5 (СНар), 139.5 (С-ОСН3), 153.3 (2С-ОСН3), 161.7 (C=N), 169.3 (С-О).
Спектр ЯМР 19F, δ, м.д. J, Гц: -58.08 с (CF3).
HRMS [M+H]+ Найдено: 380.1095; Вычислено для C19H17F3NO4: 380.1104.
Пример 18. Синтез 5-(3-метил-4-метоксифенил)-3-(3-трифторметилфенил)изоксазола
Стадия 1
В результате реакции 1,1-дибром-2-(3-трифторметилфенил)циклопропана (1 0 г, 0.003 моль) с NOSO3Cl (1.7 г, 0.012 моль) в 64 мл нитрометана в условиях, описанных в примере 1 (стадия 1), получили 0.68 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделили 0.26 г (60%) 5-бром-3-(3-трифторметилфенил)изоксазола в виде белых кристаллов с т.пл. = 75°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.67 с (1Н, СНизокс), 7.62 т (1Н, СНар, 3J 7.9 Гц), 7.75 д (1Н, СНар, 3J 7.9 Гц), 7.97 д (1Н, СНар, 3J 7.9 Гц), 8.02 уш.с (1Н, СНар).
Спектр ЯМР 13С, δ, м.д. J, Гц: 104.4 (СНизокс), 123.5 к (СНар, JCF 3.8 Гц), 123.7 к (CF3, 1JCF 272.4 Гц), 127.2 к (СНар, JCF 3.0 Гц), 128.9 (Сар), 129.7 (СНар), 129.8 к (СНар, JCF 15 Гц), 131.6 к (Сар-CF3, 2JCF 32.8 Гц), 142.5 (СизоксBr), 163.0 (C=N).
Спектр ЯМР 19F, δ, м.д.: -62.9 с (CF3).
HRMS [М+Н]+ Найдено: 291.9281, 293.9561; Вычислено для C10H6BrF3NO: 291.9579,293.9559.
Стадия 2
В результате реакции 5-бром-3-(3-трифторметилфенил)изоксазола (50 мг, 0.17 ммоль) с 3-метил-4-метоксифенилборной кислотой (57 мг, 0.34 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 81 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделяли 38 мг (67%) 5-(3-метил-4-метоксифенил)-3-(3-трифторметилфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 129°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 2.29 с (3H, СН3), 3.89 с (3H, ОСН3), 6.72 с (СНизокс), 6.90 д (2Н, 2СНар, 3J 8.5 Гц), 7.60-7.72 м (4Н, 4СНар), 8.06 д (2Н, 2СНар, 3J 7.8 Гц), 8.11 уш.с (1Н, СНар).
Спектр ЯМР 13C, δ, м.д. J, Гц: 15.9 (СН3), 55.0 (ОСН3), 95.3 (СНизокс), 109.6 (СНар), 119.0 (Сар), 123.2 к (СНар, 3J 3.8 Гц), 123.5 к (CF3, 1J 272.4 Гц), 124.6 (СНар), 126.0 к (СНар, 3J 3.8 Гц), 127.1 (Сар), 127.8 (СНар), 129.0 (СНар), 129.5 (СНар), 129.8 (С-СН3), 130.8 к (С-CF3, 2J 32.8 Гц), 159.2 (С-ОМе), 161.3 (C=N), 170.9 (С-О).
Спектр ЯМР 19F, δ, м.д.: -62.8 с (CF3).
HRMS [М+Н]+ Найдено: 334.1063; Вычислено для C18H15F3NO2: 334.1049.
Пример 19. Синтез 5-(4-метоксифенил)-3-(3-трифторметилфенил)изоксазола
Стадия 2
В результате реакции 5-бром-3-(3-трифторметилфенил)изоксазола (50 мг, 0.17 ммоль) с 4-метоксифенилборной кислотой (52 мг, 0.34 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 85 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделяли 30 мг (56%) 5-(4-метоксифенил)-3-(3-трифторметилфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 139°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 3.87 с (3H, ОСН3), 6.74 с (1Н, СНизокс), 7.00 д (2Н, 2СНар, 3J 8.9 Гц), 7.60 т (1Н, СНар, 3J 7.8 Гц), 7.71 д (1Н, СНар, 3J 7.8 Гц), 7.78 д (2Н, 2СНар, 3J 8.9 Гц), 8.06 д (1H, СНар, 3J 7.8 Гц), 8.11 уш.с (1Н, СНар).
Спектр ЯМР 13С, δ, м.д. J, Гц: 55.4 (ОСН3), 95.9 (СНизокс), 114.1 (Сар), 114.4 (2СНар), 123.6 к (СНар, 3J 3.8 Гц), 123.8 к (CF3, 1J 272.4 Гц), 126.5 к (СНар, 3J 3.8 Гц), 127.5 (2СНар), 127.7 (Сар), 129.9 к (СНар, 4J 15 Гц), 130.1 (СНар), 131.4 к (C-CF3, 2J 32.8 Гц), 161.3 (С-ОМе), 161.7 (C=N), 171.0 (С-О).
Спектр ЯМР 19F, δ, м.д.: -62.8 с (CF3).
HRMS [М+Н]+ Найдено: 320.0886; Вычислено для C17H13F3NO2: 320.0893.
Пример 20. Синтез 5-(3-аминофенил)-3-(3-трифторметилфенил)изоксазола
Стадия 2
В результате реакции 5-бром-3-(3-трифторметилфенил)изоксазола (78 мг, 0.28 ммоль) с 3-аминофенилборной кислотой (76 мг, 0.56 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 100 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 50 мг (62%) 5-(3-аминофенил)-3-(3-трифторметилфенил)изоксазола в виде желтых кристаллов с т.пл. = 173°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 3.87 уш.с (2Н, NH2), 6.79 д (1Н, СНар, 3J 7.8 Гц), 6.82 с (1Н, СНизокс), 7.24 м (3H, 3СНар), 7.62 м (1Н, СНар), 7.72 д (1Н, СНар, 3J 7.8 Гц), 8.07 д (1Н, СНар, 3J 7.8 Гц), 8.11 с (1Н, СНар).
Спектр ЯМР 13C, δ, м.д. J, Гц: 95.3 (CHизокc), 1115 (СНар), 115.8 (СНар), 116.7 (СНар), 123.2 к (СНар, J 3.8 Гц), 123.5 к (CF3, 1J 276.1 Гц), 126.2 к (СНар, J3.8 Гц), 124.7 (Сар), 127.8 (Сар), 129.1 (СНар), 129.6 к (СНар, J 11.2 Гц), 129.6 (СНар), 131.0 (C-CF3, 2J 32.6 Гц), 146.6 (Cap-NH2), 161.3 (C=N), 170.9 (С-О).
HRMS [М+Н]+ Найдено: 255. 305.0889; Вычислено для C16H12F3N2O: 305.0896.
Пример 21. Синтез 5-(3,4,5-триметоксифенил)-3-(3-трифторметилфенил)изоксазола
Стадия 2
В результате реакции 5-бром-3-(3-трифторметнлфенил)изоксазола (50 мг, 0.18 ммоль) с 3,4,5-триметоксифенилборной кислотой (76 мг, 0.36 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 100 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 52 мг (80%) 5(3,4,5-гриме гоксифенил)-3-(3-трифторметилфенил)изоксазола в виде бесцветных кристаллов с т.пл. = 65°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 3.91 с (3H, ОСН3), 3.94 с (6Н, 2OCH3), 6.81 с (1Н, С(4)изоксН), 7.04 с (2Н, 2СНар), 7.59 т (1Н, СНар, 3J 7.7 Гц), 7.70 д (1Н, СНар, 3J 7.7 Гц), 8.06 д (1Н, СНар, 3J 7.7 Гц), 8.09 уш.с (1Н, СНар).
Спектр ЯМР 13C, δ, м.д. J, Гц: 55.8 (2OCH3), 60.6 (ОСН3), 96.6 (С(4)изоксН), 102.7 (2СНар), 122.1 (С(1)ар), 123.2 к (СНар, 3JCF 3.8 Гц), 123.4 к (CF3, 1JCF 272.2 Гц), 126.2 к (СНар, 3JCF 3.8 Гц), 129.1 (СНар), 129.5 (CHap), 131.0 к (C-CF3, 2JCF 32.8 Гц), 139.6 (С-ОСН3), 153.3 (2С-ОСН3), 161.4 (C=N), 170.4 (С-О) (1 сигнал наложился на другие).
Спектр ЯМР 19F, δ, м.д. J, Гц: -62.85 с (CF3).
HRMS [М+Н]+ Найдено: 380.1092; Вычислено для C19H17F3NO4: 380.1104.
Пример 22. Синтез 5-(3,4,5-триметоксифенил)-3-(4-трифторметилфенил)изоксазола
Стадия 7
В результате реакции 1,1-дибром-2-(4-трифторметилфенил)циклопропана (0 5 г, 0.0015 моль) с NOSO3Cl (0.85 г, 0.006 моль) в 32 мл нитрометана в условиях, описанных в примере 1 (стадия 1), получили 0.35 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделили 0.11 г (50%) 5-6ром-3-(4-трифторметилфенил)изоксазола в виде белых кристаллов с т.пл. = 102°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.65 с (1Н, СНизокс), 7.73 д (2Н, 2СНар, 3J 8.2 Гц), 7.89 д (2Н, 2СНар, 3J 8.2 Гц).
Спектр ЯМР 13C, δ, м.д. J, Гц: 104.1 (СНизокс), 123.3 к (CF3, 1JCF 272.4 Гц), 125.6 к (2СНар, 3JCF 3.7 ГЦ), 126.6 (2СНар), 131.0 к (Сар, 5JCF 1.3 Гц), 132.0 к (Cap-CF3, 2JCF 32.8 Гц), 142.1 (С-Br), 162.6 (C=N).
Спектр 18F, δ, м.д.: -63.0 с (CF3).
HRMS (ESI) m/z: [M+H]+ Calcd for C10H6BrF3NO 291.9579, 293.9559; Found 291.9571,293.9553.
Стадия 2
В результате реакции 5-бром-3-(4-трифторметилфенил)изоксазола (30 мг, 0.11 ммоль) с 3,4,5-триметоксифенилборной кислотой (46 мг, 0.22 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 67 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 36 мг (93%) 5-(3,4,5-триметоксифенил)-3-(4-трифторметилфенил)изоксазола виде бесцветных кристаллов с т.пл. = 133°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 3.92 с (3H, ОСН3), 3.95 с (6Н, 2ОСН3), 6.81 с (1Н, С(4)изоксН), 7.05 с (2Н, 2СНар), 7.73 д (2Н, 2СНар, J 8.2 Гц), 7.98 д (2Н, 2СНар, J 8.2 Гц).
Спектр ЯМР 13С, δ, м.д. J, Гц: 55.9 (2OCH3), 60.6 (ОСН3), 96.7 (С(4)изоксН), 102.8 (2СНар), 122.1 (С(1)ар), 123.4 к (CF3, 1JCF 274.0 Гц), 125.5 к (2СНар, 3JCF 3.7 Гц), 126.7 (2СНар), 131.4 к (C-CF3, 2JCF 33.0 Гц), 132.1 (С(1)ар), 139.7 (С-ОСН3), 153.3 (2С-ОСН3), 161.5 (C=N), 170.4 (С-О)
Спектр ЯМР 19F, δ, м.д. J, Гц: -62.91 с (CF3).
HRMS [М+Н]+ Найдено: 380.1092; Вычислено для C19H17F3NO4: 380.1104.
Пример 23. Синтез 5-(3,4,5-триметоксифенил)-3-(3-нитрофенил)изоксазола
Стадия 1
В результате реакции 1,1-дибром-2-(3-нитрофенил)циклопропана (1.5 г, 0.005 моль) с NOSO3Cl (2.7 г, 0.02 моль) в 94 мл нитрометана в условиях, описанных в примере 1 (стадия 1), получили 1.4 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделили 0.51 г (76%) 5-бром-3-(3-нитрофенил)изоксазола в виде белых кристаллов с т.пл. = 158°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.72 с (1Н, CHизокс), 7.69 т (1Н, СНар, 3J 7.8 Гц), 8.15 д (1Н, СНар, 3J 7.8 Гц), 8.34 д.д (1Н, СНар, 3J 7.8, 4J 1.2 Гц), 8.60 с (1Н, СНар).
Спектр ЯМР 13C, δ, м.д. J, Гц: 104.5 (СНизокс), 121.8 (СНар), 125.2 (СНар), 129.8 (Сар), 130.3 (СНар), 132.3 (СНар), 143.0 (С-Br), 148.7 (Сар-NO2), 162.3 (C=N)
Стадия 2
В результате реакции 5-бром-3-(3-нитрофенил)изоксазола (70 мг, 0.26 ммоль) с 3,4,5-триметоксифенилборной кислотой (ПО мг, 0.52 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 145 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 50 мг (54%) 5-(3,4,5-триметоксифенил)-3-(3-нитрофенил)изоксазола в виде бесцветных кристаллов с т.пл. = 195°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 3.92 с (3H, ОСН3), 3.97 с (6Н, 2OCH3), 6.87 с (1Н, С(4)изоксН), 7.07 с (2Н, 2СНар), 7.69 т (1Н, 3J 8.0 Гц), 8.27 д (1Н, СНар, 3J 8.0 Гц), 8.32 д (1Н, СНар, 3J 8.0 Гц), 8.67 уш.с (1Н, СНар).
Спектр ЯМР 13С, δ, м.д. J, Гц: 55.9 (2OCH3), 60.6 (ОСН3), 96.6 (С(4)изоксН), 102.8 (2СНар), 121.4 (СНар), 121.9 (С(1)ар), 124.2 (СНар), 129.7 (СНар), 130.5 (С(1)ар), 132.1 (СНар), 139.8 (С-ОСН3), 148.2 (C-NO2), 153.3 (2С-ОСН3), 160.8 (C=N), 170.8 (С-О).
HRMS [М+Н]+ Найдено: 357.1071; Вычислено для C18H17N2O6: 357.1081.
Пример 24. Синтез 5-(5-индолил)-3-(3-нитрофенил)изоксазола
Стадия 2
В результате реакции 5-бром-3-(3-нитрофенил)изоксазола (75 мг, 0.28 ммоль) с 5-индолилборной кислотой (90 мг, 0.56 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 110 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 34 мг (40%) 5-(5-индолил)-3-(3-нитрофенил)изоксазола в виде серого аморфного порошка с т.пл. = 214°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 6.68 м (1Н, СНинд), 6.87 с (1Н, CHизокc), 7.32 уш. с (1Н, СНар), 7.51 д (1Н, СНар, 3J 8.5 Гц), 7.69 м (2Н, 2СНар), 8.20 с (1Н, СНар), 8.28 д (1Н, СНар, 3J 7.8 Гц), 8.33 д.д (1Н, СНар, 3J 8.1, 4J 2.1 Гц), 8.37 уш.с (1Н, NH), 8.71 с (1Н, СНар).
HRMS [М+Н]+ Найдено: 306.0879; Вычислено для C17H11N3O3: 306.0873.
Пример 25. Синтез 5-(3,4,5-триметоксифенил)-3-(4-метокси-3-нитрофенил)изоксазола
Стадия 7
В результате реакции 1,1-дибром-2-(4-метокси-3-нитрофенил)циклопропана (0 9 г, 0.0027 моль) с NOSO3Cl (1.6 г, 0.0081 моль) в 54 мл нитрометана в условиях, описанных в примере 1 (стадия 1), получили 0.73 г реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - бензол/петролейный эфир = 3:2) выделили 0.15 г (36%) 5-6ром-3-(4-метокси-3-нитрофенил)изоксазола в виде желтых кристаллов с т.пл. = 128°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 4.03 с (3H, ОСН3), 6.61 с (1Н, CHизокс), 7.20 д (1Н, СНар, 3J 8.8 Гц), 8.00 д.д (1Н, СНар, 3J 8.8, 4J 2.1 Гц), 8.22 д (1Н, СНар, 4J 2.1 Гц).
Спектр ЯМР 13С, δ, м.д. J, Гц: 56.4 (ОСН3), 103.7 (СНизокс), 113.8 (СНар), 120.2 (Сар), 123.8 (СНар), 131.8 (СНар), 142.2 (Сар-ОСН3), 154.0 (СизоксBr), 158.5 (Сар-NO2), 161.6 (C=N).
HRMS [М+Н]+ Найдено: 298.9662; Вычислено для C10H7BrN2O4: 298.9661.
Стадия 2
В результате реакции 5-бром-3-(4-метокси-3-ннтрофенил)изоксазола (50 мг, 0.17 ммоль) с 3,4,5-триметоксифенилборной кислотой (71 мг, 0.34 ммоль) в условиях, описанных в примере 1 (стадия 2), получали 100 мг реакционной смеси, при хроматографировании которой на колонке (SiO2 40/60, элюент - этилацетат/петролейный эфир = 3:2) выделяли 32 мг (50%) 5-(3,4,5-триметоксифенил)-3-(4-метокси-3-нитрофенил)изоксазола виде бесцветных кристаллов с т.пл. = 200-205°С.
Спектр ЯМР 1Н, δ, м.д. J, Гц: 3.92 с (3H, ОСН3), 3.96 с (6Н, 2OCH3), 4.04 с (3H, ОСН3), 6.78 с (1Н, С(4)изоксН), 7.06 с (2Н, 2СНар), 7.21 д (1Н, СНар, 3J 8.8 Гц), 8.12 д.д (1Н, CHap, 3J 8.8, 4J 2.1 Гц), 8.31 д (1Н, СНар, 4J 2.1 Гц)
Спектр ЯМР 13C, δ, м.д. J, Гц: 55.9 (2OCH3), 56.4 (ОСН3), 60.6 (ОСН3), 96.3 (С(4)изоксН), 102.8 (2СНар), 113.7 (СНар), 121.4 (С(1)ар), 122.0 (С(1)ар), 123.8 (СНар), 131.8 (СНар), 139.3 (C-NO2), 139.7 (С-ОСН3), 153.3 (2С-ОСН3), 153.7 (С-ОСН3), 160.4 (C=N), 170.5 (С-О).
HRMS [М+Н]+ Найдено: 387.1174; Вычислено для C19H19N2O7: 387.1186.
Полученные 3,5-диарилизоксазолы были исследованы на цитотоксичность с целью выявления их промышленной применимости. Цитотоксичность оценивали с помощью стандартного МТТ-теста (Mosmann Т. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays // Journal of immunological methods. - 1983. - T. 65. - №. 1-2. - C. 55-63.) на клеточных линиях HEK-293T (человеческая эмбриональная клеточная линия почек), MCF-7 (клеточная линия аденокарциномы молочной железы человека), А-549 (клеточная линия карциномы легкого человека), и VA-13 (здоровые делящиеся клетки легкого человека). Результаты представлены в таблице.
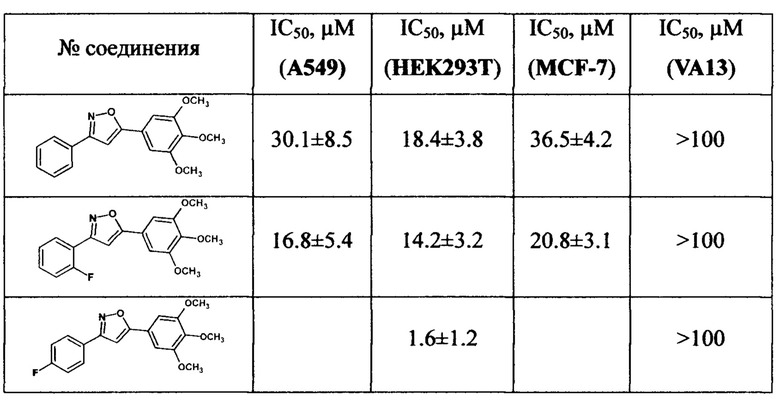
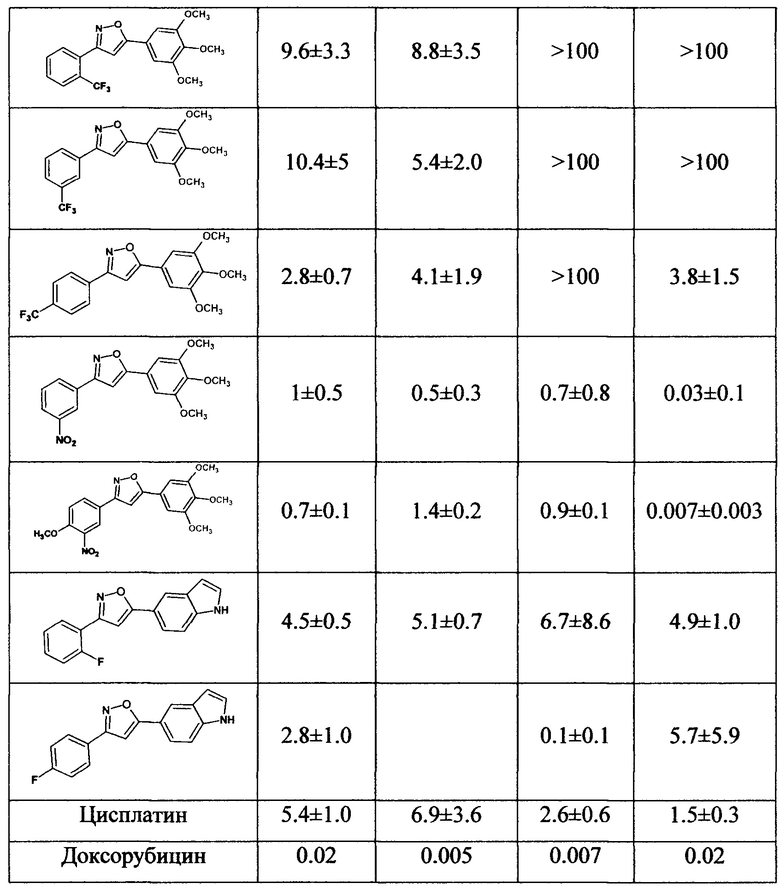
Как следует из данных таблицы, протестированные соединения, аналоги Комбретастатина А4 ряда 3,5-диарилизоксазолов, проявили высокую цитотоксичность по отношению к исследуемым клеточным линиям, в ряде случаев, превосходящую активность известных лекарственных препаратов Doxorubicin и Cisplatin.
| название | год | авторы | номер документа |
|---|---|---|---|
| 5-АРИЛ-4-ФТОРИЗОКСАЗОЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2018 |
|
RU2708456C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАЛОГЕНПРОИЗВОДНЫХ АРОМАТИЧЕСКИХ И ГЕТЕРОАРОМАТИЧЕСКИХ СОЕДИНЕНИЙ | 2019 |
|
RU2711558C1 |
| 3-АРИЛ-5-ФТОРИЗОКСАЗОЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2684322C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 3-АРИЛ-5-ХЛОРИЗОКСАЗОЛОВ | 2015 |
|
RU2637927C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ (Е)-2-(3-(1Н-ПИРРОЛ-2-ИЛ)АЛЛИЛИДЕН)-1Н-ИНДАН-1,3(2Н)-ДИОНОВ, А ТАКЖЕ ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФОТОСЕНСИБИЛИЗАТОРОВ ДЛЯ СОЛНЕЧНЫХ БАТАРЕЙ | 2023 |
|
RU2812075C1 |
| Оксазолидиноны на основе производных пиридоксина, обладающие антибактериальной активностью | 2024 |
|
RU2836570C1 |
| Замещенные 4-(азол-1-илметил)-1-фенил-5,5-диалкилспиро-[2.5]октан-4-олы, способ их получения (варианты), фунгицидная и рострегуляторная композиции на их основе | 2016 |
|
RU2648240C1 |
| ПОЛУЧЕНИЕ НОВОГО КЛАССА ЖИДКОКРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ЧЕТЫРЕХАТОМНЫЙ ФТОРСОДЕРЖАЩИЙ ФРАГМЕНТ МОСТИКОГО ТИПА | 2012 |
|
RU2511009C2 |
| СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ, СОЕДИНЕНИЯ, КОМПЛЕКСНЫЙ МЕТАЛЛООРГАНИЧЕСКИЙ КАТАЛИЗАТОР | 2012 |
|
RU2652807C2 |
| Способ совместного получения 1-(2-амино-4-R-фенил)- и 2-(2-амино-4-R-фенил)бензотриазолов | 2023 |
|
RU2825731C1 |
Изобретение относится к области органической химии, а именно к способу получения производных 3,5-диарилизоксазолов общей формулы (I), где R1 выбирают из Н, F, CF3, ОМе; R2=Н, CF3, NO2; R3=Н, F, CF3; для использования в качестве действующего вещества в лекарственных препаратах для лечения онкологических заболеваний, отличающийся тем, что проводят двухстадийный синтез, где на первой стадии проводят реакцию 2-арил-1,1-дибромциклопропанов общей формулы (II), где R1 выбирают из Н, F, CF3, ОМе; R2=Н, CF3, NO2; R3=Н, F, CF3; с нитрозирующим реагентом в полярном растворителе при температуре 30-35°С в течение 10-40 мин, при этом концентрация 2-арил-1,1-дибромциклопропана составляет 0,05-0,06 моль/л, а на второй стадии проводят реакцию кросс-сочетанию Сузуки 3-арил-5-бромизоксазолов общей формулы (III), где R1 выбирают из Н, F, CF3, ОМе; R2=Н, CF3, NO2; R3=Н, F, CF3; с арилборными кислотами в присутствии палладиевого катализатора и основания в полярном растворителе. Техническим результатом изобретения является высокорегиоселективное получение новых 3,5-диарилизоксазолов, в том числе несимметричного строения, с выходами от 50 до 99% в зависимости от заместителей в бензольных кольцах. 9 з.п. ф-лы, 1 табл., 25 пр.
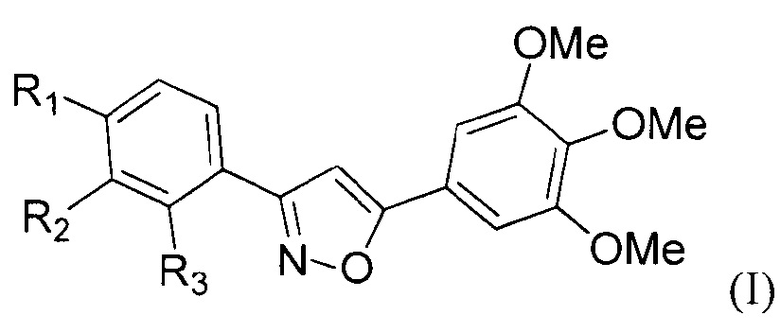
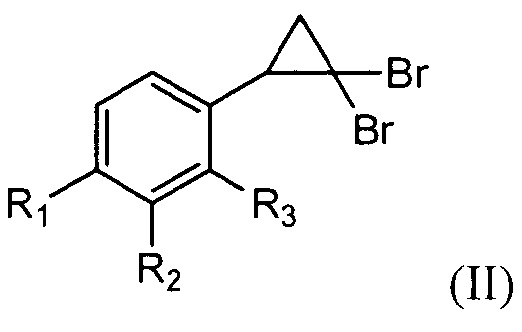

1. Способ получения производных 3,5-диарилизоксазолов общей формулы (I):

R1 выбирают из Н, F, CF3, ОМе; R2=Н, CF3, NO2; R3=Н, F, CF3; для использования в качестве действующего вещества в лекарственных препаратах для лечения онкологических заболеваний, отличающийся тем, что проводят двухстадийный синтез, где на первой стадии проводят реакцию 2-арил-1,1-дибромциклопропанов общей формулы (II)
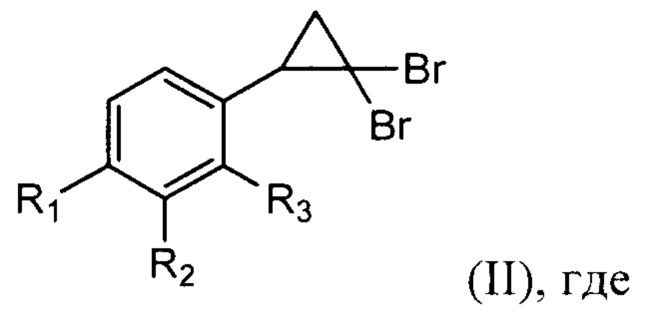
R1 выбирают из Н, F, CF3, ОМе; R2=Н, CF3, NO2; R3=Н, F, CF3; с нитрозирующим реагентом в полярном растворителе при температуре 30-35°С в течение 10-40 мин, при этом концентрация 2-арил-1,1-дибромциклопропана составляет 0,05-0,06 моль/л,
а на второй стадии проводят реакцию кросс-сочетанию Сузуки 3-арил-5-бромизоксазолов общей формулы (III)

R1 выбирают из Н, F, CF3, ОМе; R2=Н, CF3, NO2; R3=Н, F, CF3;
с арилборными кислотами в присутствии палладиевого катализатора и основания в полярном растворителе.
2. Способ по п. 1, характеризующийся тем, что в качестве нитрозирующего реагента используют соли нитрозония выбранные из NOSO3Cl, NOBF4, NOHSO4.
3. Способ по п. 2, характеризующийся тем, что в качестве нитрозирующего реагента используют хлорсульфат нитрозония NOSO3Cl.
4. Способ по п. 3, характеризующийся тем, что используют 3,5-4-кратный мольный избыток хлорсульфата нитрозония.
5. Способ по п. 1, характеризующийся тем, что в качестве полярного растворителя используют апротонные растворители, выбранные из CH3NO2, CH2Cl2, CHCl3, C2H4Cl2.
6. Способ по п. 5, характеризующийся тем, что в качестве апротонного растворителя, используют нитрометан.
7. Способ по п. 1, характеризующийся тем, что на второй стадии 3-арил-5-бромизоксазолы общей формы (III) вводят в реакцию кросс-сочетанию Сузуки с арилборными кислотами в присутствии палладиевого катализатора и основания в полярном растворителе при кипячении.
8. Способ по п. 7, характеризующийся тем, что в качестве основания используют трехкратный мольный избыток NaHCO3, или К2СО3, или Na2CO3.
9. Способ по п. 7, характеризующийся тем, что в качестве палладиевого катализатора используют 0,05 мольных эквивалента Pd(PPh3)4, или Pd(PPh3)2Cl2, или Pd(OAc)2.
10. Способ по п. 7, характеризующийся тем, что в качестве полярного растворителя используют смесь диметоксиэтана с водой, или смесь этанола с водой, или смесь диоксана с водой, или смесь тетрагидрофурана с водой в объемном соотношении 2:1 для всех вариантов смесей.
| MONDAL, SANTANU et al., TEMPO-Mediated Selective Synthesis of Isoxazolines, 5-Hydroxy-2-isoxazolines, and Isoxazoles via Aliphatic δ-C(sp3)-H Bond Oxidation of Oximes | |||
| Chemistry - An Asian Journal, 30.06.2021, 16(17), 2439-2446 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| XIAO, HUAN-LAN et al., Electrochemical synthesis of 3,5-disubstituted isoxazoles | |||
| Journal | |||
Авторы
Даты
2023-08-17—Публикация
2021-07-07—Подача