Изобретение относится к области фармацевтики и медицины, в частности онкологии, и касается синтеза новых соединений диэтил (3,5-бис(арилиден)-4-оксопиперидин-1-л)(арил)метилфосфонатов, обладающих антипролиферативным свойством и низкой острой токсичностью, и может быть использовано для лечения ряда онкологических заболеваний, связанных с пролиферацией опухолевых клеток, в частности рабдомиосаркомы, карциномы кишечника, аденокарциномы молочной железы, и др. злокачественных новообразований.
В настоящее время лечение выше пеечисленных заболеваний представляет собой проблему, поскольку известные химиотерапевтические агенты, применяемые с этой целью, отличаются высокой острой токсичностью, что приводит к сужению терапевтического индекса и сопряжено с различными побочными эффектами в отношении здоровых клеток.
Для предотвращения пролиферации опухолевых клеток известны разнообразные антипролиферативные агенты, действующие на различные стадии клеточного цикла опухолевых клеток и активные в отношении различных клеточных мишеней. Побочные эффекты таких известных агентов обусловлены их неселективностью, то есть тем фактом, что они способны повреждать нормальные клетки, а также оказывать мутагенное воздействие на них. Поэтому в данной области техники продолжает существовать потребность в новых антипролиферативных агентах, подавляющих пролиферацию злокачественных клеток, но не проявляющих мутагенных свойств в отношении нормальных клеток.
Известен патент (US 7582655 В2, МПК A61K 31/445, опубл. 2007-07-05), в котором заявлены соединения, принадлежащие к классу сопряженных диенонов на основе 4-пиперидинона общей формулы
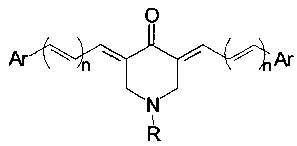
где Ar представляет собой арил или гетероарил, n находится в диапазоне от 0 до 3, причем заместитель R при атоме азота не содержит атома фосфора. В случае n=0 приведенная структурная формула соответствует обобщенной структурной формуле 3,5-бис(арилиден)-4-пиперидинонов. Предполагаемый механизм действия данных соединений включает алкилирование клеточных тиолов и сильфгидрильных групп белков в результате их реакции с винильными связями 3,5-бис(арилиден)-4-пиперидинонов, причем аминные и гидроксильные группы нуклеиновых оснований не вступают в такую реакцию, вследствие чего 3,5-бис(арилиден)-4-пиперидиноны могут быть лишены мутагенных свойств (U. Das et al., Current Medicinal Chemistry, 2009, 16, 2001-2020; R.K. Anchoori et al., Cancer Cell, 2013, 24, 791-805).
Однако, данные соединения, обнаруживая антипролиферативные свойства в субмикромолярных концентрациях ингибирования IC50, имеют высокую острую токсичность.
Наиболее близкой группой соединений, обладающих антипролиферативными свойствами, и принятой за прототип, являются диэтил (3,5-бис(арилиден)-4-оксопиперидин-1-ил) метилфосфонаты (M.V. Makarov et al., Eur. J. Med. Chem., 2009, 44, 2135-2144):
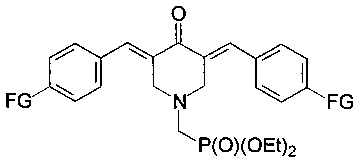
где FG=NMe2, F, NO2, а диэтилфосфонатная группа связана с атомом азота 4-пиперидинонового цикла через одно метиленовое звено.
Однако эти соединения имеют острую токсичность порядка 200-300 мг/кг и выраженную селективную противоопухолевую активность только в отношении клеточных линий рака лимфатической системы, а данные по противоопухолевой активности в отношении опухолей мышечной ткани отсутствуют.
Предлагаемое изобретение решает задачу создания новых противоопухолевых препаратов, обладающих расширенным спектром антипролиферативных свойств и одновременно низкой острой токсичностью, для лечения онкологических заболеваний, связанных с пролиферацией опухолевых клеток.
Настоящее изобретение относится к новым соединениям - диэтил (3,5-бис(арилиден)-4-оксопиперидин-1-ил)(арил)метилфосфонатам, общей формулы 1
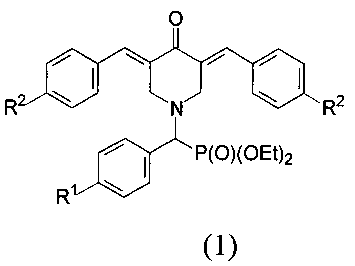
в которой R1=Н, F, ОМе;
R2=Н, F.
Среди соединений общей формулы (1), составляющих один из объектов настоящего изобретения, предпочтительными являются:
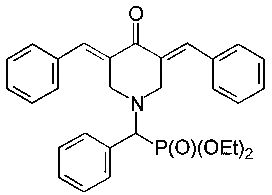
диэтил (3,5-бис(бензилиден)-4-оксопиперидин-1-ил)(фенил)метилфосфонат, имеющий формулу
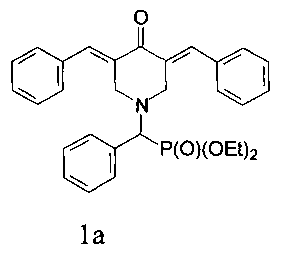
диэтил (3,5-бис(бензилиден)-4-оксопиперидин-1-ил)(4-фторфенил)метилфосфона, имеющий формулу
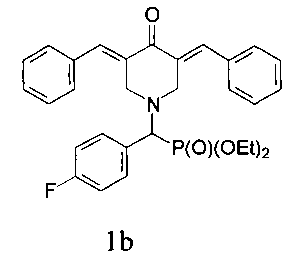
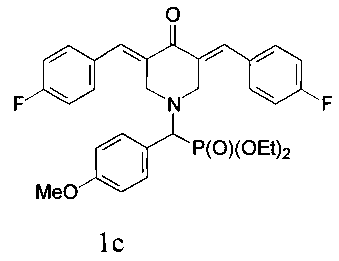
и диэтил (3,5-бис(4-фторбензилиден)-4-оксопиперидин-1-ил)(4-метоксифенил)метилфосфона, имеющий формулу
Структура соединений формул (1а-с) доказана данными мультиядерной спектроскопии ЯМР (на ядрах 1Н, 31Р, 13С и 19F при наличии атомов фтора), а индивидуальность и химическая чистота - данными элементного анализа.
Еще одним аспектом изобретения является обнаруженные нами антипролиферативные свойства соединений общей формулы 1.
Технический эффект заявляемой группы изобретений проявляется сочетанием низкой острой токсичности (более 1000 мг/кг) и расширенным спектром антипролиферативных свойств в отношении опухолей мышечной ткани, что ранее было неизвестно из уровня техники для 3,5-бис(арилиден)-4-пиперидинонов, к которым относятся заявляемые соединения.
Отсутствие источников информации, содержащих ту же совокупность признаков, что и в предлагаемых в изобретении объектах, сообщает им соответствие критерию «новизна».
Та же совокупность признаков позволяет получить новый непредсказуемый эффект - получение соединений, сочетающих низкую острую токсичность (более 1000 мг/кг) и расширенный спектр антипролиферативных свойств, и таким образом сообщает ей соответствие критерию «изобретательский уровень».
Получение новых соединений с использованием известного оборудования с помощью известных компонентов сообщает разработанному изобретению соответствие критерию «промышленная применимость».
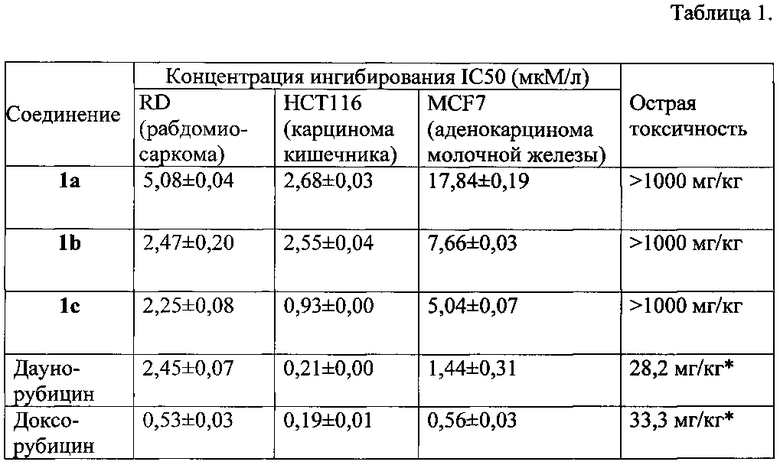
В Таблице 1 приведены результаты определения концентрации исследуемых веществ, вызывающих 50% ингибирование роста популяции клеток и острую токсичность соединений. Сравнительные данные (*)взяты из работы: F.R. Quinn, G.W.A. Milne, "Toxicities Derived from Anti-tumor Screening Data". Fundam. Appl. Toxicol. 1986, 6, 270-277.
Приведенные ниже примеры подтверждают, но не ограничивают предлагаемое изобретение.
Синтез соединений формулы 1 проводили по приведенной ниже схеме исходя из известных закономерностей, используя в качестве исходных соединений диэтил (4-оксопиперидин-1-ил)(арил) метилфосфонаты, а именно диэтил (4-оксопиперидин-1-ил)(фенил)метилфосфонат, диэтил (4-оксопиперидин-1-ил)(4-фторфенил)метилфосфонат и диэтил (4-оксопиперидин-1-ил)(4-метоксифенил)метилфосфонат (их получение описано в статье M.V. Makarov et al., Mendeleev Commun., 2015, 25, 232-233), путем реакции с ароматическими альдегидами в присутствии эфирата трехфтористого бора в качестве кислоты Льюиса, катализирующей альдольно-кротоновую конденсацию, в среде ацетонитрила при комнатной температуре (20-25°С).
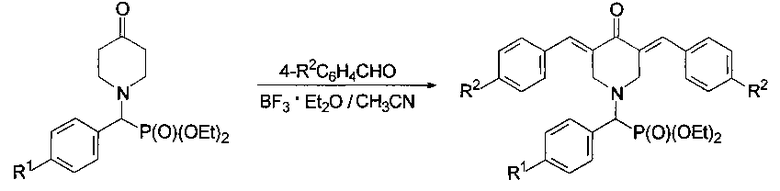
В синтезе заявляемых соединений использовали следующие коммерческие реагенты и растворители, доступные от фирмы Acros Organics: бензальдегид, 4-фторбензальдегид, эфират трехфтористого бора, ацетонитрил, хлористый метилен, сульфат натрия (осушитель), силикагель для колоночной хроматографии, петролейный эфир, ацетон.
В спектрах 31Р синглетный сигнал при δP в диапазоне 21,6-21,9 м.д. свидетельствует о наличии фосфонатной группы (C-P(O)(OEt)2); в спектрах 13С сигнал карбонильной группы проявляется при δC в диапазоне 187,2-187,7 м.д., в спектрах 13С наблюдается характеристичный дублетный сигнал в диапазоне 65,5-66,5 м.д. с константной спин-спинового взаимодействия lJPC приблизительно равной 160 Гц, свидетельствующий о наличии в молекулах связи С-Р; в спектрах 19F синглетный сигнал δF при приблизительно -113 м.д. свидетельствует о наличии атома фтора, связанного с фенильным кольцом. Спектры 1Н также полностью соответствуют структуре соединений 1а-с.
Пример 1. Способ получения диэтил (3,5-бис(бензилиден)-4-оксопиперидин-1-ил)(фенил)метилфосфоната (1а)
В колбе смешивали диэтил (4-оксопиперидин-1-ил)(фенил)метилфосфонат (0,49 г; 1,5-ммоль), бензальдегид (0,32 г; 3,0-ммоль), ацетонитрил (2 мл) и эфират трехфтористого бора (1,5 г, 7 эквивалентов, 10,5 ммоль) и перемешивание продолжали в течение 24 часов при комнатной температуре. Затем к реакционной смеси прибавляли раствор карбоната натрия (1,0 г) в воде и CH2Cl2. Органический слой отделяли, промывали водой, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении досуха. Остаток подвергали колоночной хроматографии на силикагеле (колонка: l, 30 см, d, 2 см). Использовали градиентное элюирование смесями петролейный эфир/ацетон с соотношением от 10:1 до 5:1. Подходящие элюаты упаривали при пониженном давлении с получением желтого кристаллического вещества (0,42 г, 56%), т.пл. 137-142°С. 31Р-ЯМР (CDCl3, 161,98 МГц), δ: 21,73. 1Н-ЯМР (CDCl3, 400,13 МГц), δ: 0,97 и 1,10 (два т, 6Н, 3JHH=7,0 Гц, Р(OCH2CH3)2), 3,57-3,65 (м, 1Н, 0,5 РОСН2), 3,82-4,02 (м, 5Н, СН2 (пиперидин) + 1,5 РОСН2), 4,09 (д, 1Н, СНР, 2JPH=20,0 Гц), 4,27-4,31 (м, 2Н, СН2 (пиперидин)), 7,25-7,42 (м, 13Н, CPhH), 7,31-7,43 (м, 13Н, CPhH), 7,49 (д, 2Н, 3JHH=7,0 Гц, CPhH), 7,78 (с, 2Н, винил). 13С-ЯМР (CDCl3, 100,61 МГц), δ: 16,12 и 16,31 (два д, 3JPC=5,6 Гц, РОСН2СН3), 52,96 (д, 3JPC=8,4 Гц), 62,53 и 62,84 (два д, 2JPC=6,9 Гц, РОСН2), 66,43 (д, 1JPC=159 Гц, РСН), 128,35, 128,42, 128,56, 129,03, 130,16 (д, 3JPC=8,0 Гц), 130,36, 132,42, 133,32, 135,14, 136,49, 187,56 (карбонил). Вычислено для C30H32NO4P (%): С, 71,84; Н, 6,43; N, 2,79. Найдено (%): С, 71,74; Н, 6,57; N, 2,75.
Пример 2. Способ получения диэтил (3,5-бис(бензилиден)-4-оксопиперидин-1-ил)(4-фторфенил)метилфосфоната (1b)
Диэтил (4-оксопиперидин-1-ил)(4-фторфенил)метилфосфонат (1,5·ммоль) смешивали с бензальдегидом (0,37 г; 3,0·ммоль), прибавляли ацетонитрил (2 мл) и эфират трехфтористого бора (1,5 г, 7 эквивалентов, 10,5 ммоль) и перемешивание продолжали в течение 24 часов при комнатной температуре. Затем к реакционной смеси прибавляли раствор карбоната натрия (1,0 г) в воде и CH2Cl2. Органический слой отделяли, промывали водой, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении досуха. Остаток подвергали колоночной хроматографии на силикагеле (колонка: l, 33 см, d, 2 см). Использовали градиентное элюирование смесями петролейный эфир/ацетон с соотношением от 12:1 до 6:1. Подходящие элюаты упаривали при пониженном давлении с получением желтого кристаллического вещества (0,44 г, 58%), т.пл. 96,6-99,3°С. 31Р-ЯМР (CDCl3, 161,98 МГц), δ: 21,63. 19F-ЯМР (CDCl3, 376,50 МГц), δ: -113,39. 1Н-ЯМР (CDCl3, 400,13 МГц), δ: 0,97 и 1,08 (два т, 6Н, 3JHH=7,1 Гц, Р(OCH2CH3)2), 3,56-3,78 (м, 1Н, 0,5 РОСН2), 3,78-4,00 (м, 5Н, СН2 (пиперидин) + 1,5 РОСН2), 4,04 (д, 1Н, СНР, 2JHH=20,0 Гц), 4,23-4,27 (м, 2Н, СН2 (пиперидин)), 6,95 (т, 2Н, 3JHH=3JHF=8,6 Гц, CPh), 7,31-7,43 (м, 12Н, CPhH), 7,78 (с, 2Н, винил). 13С-ЯМР (CDCl3, 100,61 МГц), δ: 16,14 и 16,27 (два д, 3JPC=5,8 Гц, РОСН2СН3), 52,80 (д, 3JPC=8,8 Гц), 62,57 и 62,85 (два д, 2JPC=7,3 Гц, РОСН2), 66,31 (д, 1JPC=160 Гц, РСН), 115,33 (д, 2JFC=21,3 Гц), 128,57, 128,58, 129,10, 130,32, 131,74 (т, 3JPC=3JFC=8,0 Гц), 133,08, 135,06, 136,77, 162,61 (д, 1JCF=250 Гц, F-CPh), 187,44 (карбонил). Вычислено для C30H31FNO4P (%): С, 69,35; Н, 6,01; N, 2,70. Найдено (%): С, 69,07; Н, 6,09; N, 2,61.
Пример 3. Способ получения диэтил (3,5-бис(4-фторбензилиден)-4-оксопиперидин-1-ил)(4-метоксифенил)метилфосфоната (1с).
Диэтил (4-оксопиперидин-1-ил)(4-метоксифенил)метилфосфонат (1,5·ммоль) смешивали с 4-фторбензальдегидом (3,0·ммоль), прибавляли ацетонитрил (2 мл) и эфират трехфтористого бора (1,5 г, 7 эквивалентов, 10,5 ммоль) и перемешивание продолжали в течение 24 часов при комнатной температуре. Затем к реакционной смеси прибавляли раствор карбоната натрия (1,0 г) в воде и CH2Cl2. Органический слой отделяли, промывали водой, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении досуха. Остаток подвергали колоночной хроматографии на силикагеле (колонка: l, 33 см, d, 2 см). Использовали градиентное элюирование смесями петролейный эфир/ацетон с соотношением от 10:1 до 10:3. Подходящие элюаты упаривали при пониженном давлении с получением желтого кристаллического вещества (0,38 г, 48%), т.пл. 135,4-141,3°С. 31Р-ЯМР (CDCl3, 121,49 МГц), δ: 21,99. 19F-ЯМР (CDCl3, 282,40 МГц), δ: -112,99. 1Н-ЯМР (CDCl3, 400,13 МГц), δ: 0,97 и 1,09 (оба т, 3Н, 3JHH=7,0 Гц, Р(OCH2CH3)2), 3,53-3,63 (м, 1Н, 0,5 РОСН2), 3,77 (с, 3Н, ОСН3), 3,81-3,95 (м, 5Н, СН2 (пиперидин) + 1.5 РОСН2), 3,99 (д, 1Н, СНР, 2JPH=20,0 Гц), 4,22-4,26 (м, 2Н, СН2 (пиперидин)), 6,81 (д, 2Н, 3JHH=8,5 Гц), 7,07 (т, 4Н, 3JHH=3JHF=8.7 Гц), 7,31 (дд, 4Н, 3JHH=8,0 Гц, 4JHF=6,0 Гц), 7,36 (д, 2Н, 3JHH=7,8 Гц), 7,70 (с, 2Н). 13С NMR (CDCl3, 100,61 МГц), δ: 16,15 и 16,29 (оба д, 3JPC=5,8 Гц, РОСН2СН3), 52,61 (д, 3JPC=8,0 Гц), 55,17 (ОМе), 62,56 и 62,77 (оба д, 2JPC=7,0 Hz, РОСН2), 65,47 (д, lJPC=160 Гц, РСН), 113,77, 115,70 (д, 2JFC=21,0 Гц), 124,11, 131,29 (д, 4JCF=3,0 Гц), 131,37 (д, 3JPC=8,0 Гц), 132,29 (д, 3JCF=8,8 Гц), 132,91, 135,35, 159,61, 162,89 (д, 1JCF=250 Гц), 187.27 (С=O). Вычислено для C31H34F2NO4P (%): С, 65,60; Н, 5,68; N, 2,47. Найдено (%): С, 65,57; Н, 5,61; N, 2,39.
Биологическая активность полученных соединений
Оценка острой токсичности соединений 1а-с проведена согласно экспресс-методу Прозоровского В.Б. на беспородных белых мышах массой 22-24 г [Прозоровский В.Б., Прозоровская М.П., Демченко В.М. Экспресс-метод определения средней эффективной дозы и ее ошибки // Фармакология и токсикология, 1978, 41(4), 497-502] при внутрибрюшинном способе введения. Установлено, что ЛД50 соединений больше 1000 мг/кг, таким образом, заявляемые соединения относятся к 5 классу веществ по классификации Сидорова К.К. [Сидоров К.К. О классификации токсичности ядов при парентеральных способах введения // В Сб. «Токсикология новых промышеленных химических веществ» (выпуск 13), Москва: Медицина, 1973, 47-51] и являются практически нетоксичными веществами.
Пример 4. Определение антипролиферативных свойств.
Антипролиферативные свойства исследуемых исследуемых соединений 1а-с были определены по МТТ-тесту [Mather J.P., Roberts Р.Е. Introduction to cell and tissue culture. Theory and technique // New York: Plenum Press, 1998, 175-194]. Культуры клеток человека RD (ATCC® CCL-136™) и HCT116 (АТСС® CCL-247™) выращивали в среде DMEM (НЛП ПанЭко), MCF7 (АТСС® НТВ-22™) выращивали в среде ЕМЕМ (НПП ПанЭко). В ростовую среду добавляли 10% эмбриональной телячьей сыворотки (HyClone®, Thermo Scientific), 2 мМ L-глутамина (НЛП ПанЭко), 1% гентамицина (ОАО Биохимик) в качестве антибиотика и инкубировали при 37°С в атмосфере CO2 (5%). Клетки сеяли в 96-луночный планшет (CELLTREAT™) в количестве 1-104 клеток/200 мкл и культивировали при 37°С в атмосфере CO2 (5%). После 24 часов инкубации к культурам клеток были добавлены различные концентрации тестируемых соединений (100, 50, 25, 12.5, 6.25, 3.12 и 1.56 мкМ/л), и далее клетки культивировали в тех же условиях в течение 72 часов. Для каждой концентрации эксперименты были выполнены в трех повторностях. Все вещества растворяли в ДМСО (PANREAC QUIMICA S.L.U), конечная концентрация ДМСО в лунке не превышала 1% и не была токсична для клеток. В контрольные лунки добавляли растворитель в количестве 1%. После инкубации в каждую лунку было добавлено 20 мкл МТТ (бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия) (5 мг/мл) (Sigma-Aldrich) и планшеты дополнительно инкубировали в течение 2 часов. Далее из планшетов удаляли среду и в каждую лунку добавляли по 100 мкл ДМСО для растворения образовавшихся кристаллов формазана. С помощью планшетного анализатора (Victor3, PerkinElmer) определяли оптическую плотность при 530 нм, за вычетом измеренного фонового поглощения при 620 нм. Значение концентрации, вызывающее 50% ингибирование роста популяции клеток (IC50), было определено на основе дозозависимых кривых с помощью программного обеспечения OriginPro 9.0. Результаты определения концентрации исследуемых веществ, вызывающих 50% ингибирование роста популяции клеток и острую токсичность соединений, приведены в таблице 1.
Как видно из приведенных примеров, соединения общей формулы I обладают сочетанием низкой острой токсичности более 1000 мг/кг и расширенным спектром антипролиферативных свойств как в отношении аденокарциномы молочной железы (MCF7), карциномы кишечника (НСТ116), так и в отношении опухоли мышечной ткани - рабдомиосаркомы (RD) и, следовательно, могут быть использованы для лечения онкологических заболеваний, связанных с пролиферацией опухолевых клеток.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-(2,4-ДИМЕТОКСИФЕНИЛ)-2-(2-ГИДРОКСИФЕНИЛ)-5,6-ДИГИДРО-4Н-БЕНЗО[H]ХРОМЕН-3-КАРБОНОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ | 2019 |
|
RU2707972C1 |
| N-ПИПЕРОНИЛЬНЫЕ ПРОИЗВОДНЫЕ ДАУНОРУБИЦИНА, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНЫМИ СВОЙСТВАМИ | 2017 |
|
RU2642068C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФОСФОНАТОВ ИЗ ДИАЛКИЛФОСФИТОВ И ПРОИЗВОДНЫХ НЕПРЕДЕЛЬНЫХ КАРБОНОВЫХ КИСЛОТ | 2014 |
|
RU2551287C1 |
| N-МЕТОКСИБЕНЗИЛЬНЫЕ ПРОИЗВОДНЫЕ ДАУНОРУБИЦИНА, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНЫМИ СВОЙСТВАМИ | 2019 |
|
RU2704326C1 |
| Четвертичные аммониевые соединения на основе 3-гидроксипиридина, обладающие антибактериальной активностью | 2021 |
|
RU2778507C1 |
| Четвертичные аммониевые соли на основе производных витамина В6 | 2015 |
|
RU2607522C1 |
| 2,4,5-ТРИ(МЕТОКСИФЕНИЛ) ЦИС-ИМИДАЗОЛИН И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2019 |
|
RU2730497C1 |
| ФОСФОНИЕВЫЕ СОЛИ НА ОСНОВЕ ПРОИЗВОДНЫХ ПИРИДОКСИНА | 2011 |
|
RU2466728C1 |
| Бромсодержащие пространственно-затрудненные фенолы, обладающие противоопухолевой активностью | 2023 |
|
RU2822270C1 |
| Азопроизводные аминофенолов, обладающие способностью ингибировать образование конечных продуктов гликирования | 2024 |
|
RU2839138C1 |
Изобретение относится к диэтил (3,5-бис(арилиден)-4-оксопиперидин-1-ил)(арил)метилфосфонатам, которые могут найти применение в медицине, общей формулы 1:
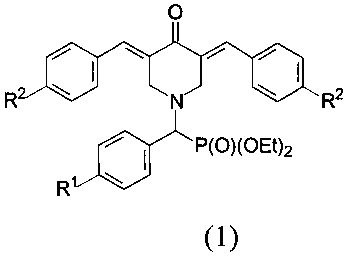
в которой R1=Н, F, ОМе; R2=Н, F.
Предложены новые диэтил (3,5-бис(арилиден)-4-оксопиперидин-1-ил)(арил)метилфосфонаты с антипролиферативными свойствами и низкой острой токсичностью для лечения онкологических заболеваний, включая рабдомиосаркому, карциному кишечника, аденокарциному молочной железы. 2 н. и 3 з.п. ф-лы, 1 табл., 4 пр.
1. Диэтил (3,5-бис(арилиден)-4-оксопиперидин-1-ил)(арил)метилфосфонаты общей формулы 1

в которой R1=Н, F, ОМе;
R2=Н, F.
2. Соединение по п. 1, представляющее
- диэтил (3,5-бис(бензилиден)-4-оксопиперидин-1-ил)(фенил)метилфосфонат, имеющий формулу
3. Соединение по п. 1, представляющее
- диэтил (3,5-бис(бензилиден)-4-оксопиперидин-1-ил)(4-фторфенил)метилфосфонат, имеющий формулу
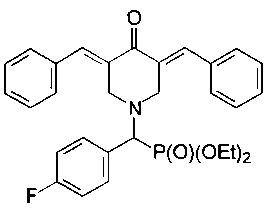
4. Соединение по п. 1, представляющее
- диэтил (3,5-бис(4-фторбензилиден)-4-оксопиперидин-1-ил)(4-метоксифенил)метилфосфонат, имеющий формулу
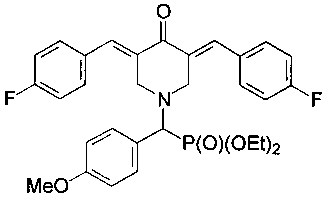
5. Соединения общей формулы 1 по любому из пп. 1-4, обладающие антипролиферативными свойствами.
| US 7582655 B2, 01.09.2009 | |||
| Устройство для добычи озерной соли | 1929 |
|
SU15488A1 |
| WO 2000069889 A1, 23.11.2000. | |||
Авторы
Даты
2016-11-27—Публикация
2015-12-16—Подача