Перекрестные ссылки на родственные заявки
По настоящей заявке испрашивается приоритет предварительной заявки на патент США, No. 61/946,618, поданной 28 февраля 2014 г., предварительной заявки на патент США, No. 62/076,420, поданной 6 ноября 2014 г., и заявки на патент США, No. 14/622,692, поданной 13 февраля 2015 г., все содержание которых полностью включено в настоящее описание путем ссылки.
Уровень техники
Благодаря низкой стоимости, низкой воспламеняемости и свойствам трехэлектронной окислительно-восстановительной реакции алюминия (Al), перезаряжаемые батареи на основе алюминия могут предложить хорошую экономическую эффективность, высокую емкость и безопасность, обеспечивая прорыв в технологии аккумулирования энергии. Однако исследования на протяжении последних нескольких лет в отношении перезаряжаемых батарей на основе алюминия не были такими же успешными, как в отношении других типов батарей, поскольку с ними связаны проблемы разрушения материала катода, низкое разрядное напряжение элемента батареи, емкостная характеристика без плоских участков характеристики разрядного напряжения, и недостаточное предельное количество циклов, т.е. быстрое ослабление емкости батареи.
Именно относительно этого уровня техники необходимо усовершенствование, которое представляет настоящее изобретение.
Сущность изобретения
В определенных вариантах осуществления изобретения металл-ионная батарея включает в себя: (1) анод, включающий в себя алюминии; (2) катод, включающий в себя слоистый активный материал; и (3) электролит, расположенный между анодом и катодом, для поддержания обратимого осаждения и растворения алюминия на аноде и обратимого интеркалирования и деинтеркалирования анионов на катоде.
В некоторых вариантах осуществления изобретения слоистым активным материалом является графит. В некоторых вариантах осуществления изобретения графит является пиролитическим графитом.
В некоторых вариантах осуществления изобретения слоистым активным материалом является слоистый двойной гидроксид, слоистый оксид или слоистый халькогенид.
В некоторых вариантах осуществления изобретения слоистый активный материал имеет пористость в диапазоне 0,05-0,95.
В некоторых вариантах осуществления изобретения электролит соответствует смеси галогенида алюминия и ионной жидкости, а мольное отношение галогенида алюминия к ионной жидкости превышает 1,1. В некоторых вариантах осуществления изобретения галогенидом алюминия является AlCl3, а ионной жидкостью является 1-этил-3-метилимидазолий хлорид. В некоторых вариантах осуществления изобретения мольное отношение AlCl3 к 1-этил-3-метилимидазолий хлорид превышает 1,2. В некоторых вариантах осуществления изобретения содержание воды в электролите составляет не более чем 1000 миллионных долей (ppm).
В дополнительных вариантах осуществления изобретения металл-ионная батарея включает в себя: (1) алюминиевый анод; (2) катод из пористого графита; и (3) электролит в виде ионной жидкости, расположенный между алюминиевым анодом и катодом из пористого графита.
В некоторых вариантах осуществления изобретения катод из пористого графита имеет пористость в диапазоне 0,05-0,95. В некоторых вариантах осуществления изобретения пористость находится в диапазоне 0,3-0,9.
В некоторых вариантах осуществления изобретения электролит на основе ионной жидкости соответствует смеси галогенида алюминия и ионной жидкости, а мольное отношение галогенида алюминия к ионной жидкости превышает 1,1. В некоторых вариантах осуществления изобретения содержание воды в электролите на основе ионной жидкости не превышает 1000 ppm. В некоторых вариантах осуществления изобретения содержание воды не превышает 400 ppm.
В дополнительных вариантах осуществления изобретения способ изготовления металл-ионной батареи включает в себя: (1) получение анода, включающего в себя алюминий; (2) получение катода, включающего в себя активный материал, способный к интеркаляции ионов во время заряда и деинтеркаляции ионов во время разряда, при этом активный материал выбирается по меньшей мере из одного из следующих материалов: углеродсодержащий материал, кремнийсодержащей материал, и германийсодержащий материал; и (3) получение электролита, способного поддерживать обратимое осаждение и растворение алюминия на аноде и обратимую интеркаляцию и деинтеркаляцию ионов на катоде.
В некоторых вариантах осуществления изобретения получение катода включает в себя получение пористого графитового материала. В некоторых вариантах осуществления изобретения получение пористого графитового материала включает в себя формирование графитовой пены посредством осаждения на пористую удаляемую подложку. В некоторых вариантах осуществления изобретения получение пористого графитового материала включает в себя расширение графитового материала посредством электрохимического выделения водорода.
В некоторых вариантах осуществления изобретения получение электролита включает в себя электрохимическое высушивание электролита, для того чтобы содержание воды электролита не превышало 400 ppm.
В дополнительных вариантах осуществления изобретения графитовая пена для металл-ионной батареи формируется путем химического осаждения паров на удаляемую подложку, после чего следует удаление подложки посредством травления.
В дополнительных вариантах осуществления изобретения способ изготовления включает в себя электрохимическое высушивание электролита для уменьшения в электролите содержания воды.
В дополнительных вариантах осуществления изобретения способ формирования пористого графита включает в себя электрохимическое расшелушивание графита, за которым следует реакция выделения водорода для расширения расшелушенного графита.
Также предполагаются другие аспекты и варианты осуществления изобретения. Раскрытая выше сущность изобретения и последующее подробное описание не подразумевают ограничение изобретения отдельным вариантом осуществления изобретения, а подразумевают лишь описание некоторых вариантов осуществления изобретения.
Краткое описание чертежей
Для лучшего понимания природы и задач для некоторых вариантов осуществления изобретения следует сделать ссылки на последующее подробное описание в сочетании с сопроводительными чертежами.
Фиг. 1 показывает схему металл-ионной батареи.
Фиг. 2: Перезаряжаемая алюминиевая батарея, а, схематический чертеж Al/графитовой элемента батареи во время разряда. Алюминиевая фольга использовалась в качестве анода, а фольга из пиролитического графита или трехмерная (3D) графитовая пена использовалась в качестве катода при оптимальном отношении AlCl3/[EMIm]Cl в электролит на основе ионной жидкости. На анодной стороне металлический Al, AlCl4- и Al2Cl7- были активными частицами в реакциях заряда и разряда соответственно. На катодной стороне преимущественно AlCl4- подвергался интеркалированию и деинтеркалированию в пространство между плоскостями графитового слоя во время реакций заряда и разряда соответственно. b, гальваностатические кривые заряда и разряда элемента Al/пиролитический графит при плотности тока около 66 мА г-1. Вставка показывает циклы заряда и разряда элемента, с, тест на стабильность элемента Al/пиролитический графит при плотности тока около 66 мА г-1 Элемента могут иметь глубину разряда приблизительно 100% в течение по меньшей мере 200 циклов и показывать кулоновскую эффективность более 97%. Электрохимические исследования были выполнены в ячейке типа Swagelok с электролитом на основе ионной жидкости: AlCl3:[EMIm]Cl приблизительно 1,3:1 (мольное соотношение).
Фиг. 3: сверхбыстрая и стабильно перезаряжаемая алюминиевая батарея, a, изображение сканирующего электронного микроскопа, показывающее 3D графитовую пену с открытой каркасной структурой (графитовые нитевидные кристаллы в каркасе из пены около 100 мкм в размере). Масштабная метка равна 300 мкм. Вставка - фотография пены. Масштабная метка равна 1 см. b, гальваностатические кривые заряда и разряда элемента Al/3D графит при плотности тока около 4000 мА г-1. Напряжение отсечки при разряде было установлено на значение около 0,5 В, чтобы подавлять реакцию растворения никелевой фольги (токовый коллектор) в электролите на основе ионной жидкости, с, тест на временную стабильность элемента Al/3D графит превышает 7500 циклов заряда и разряда при постоянной плотности тока около 4000 мАг-1 d, Заряд при плотности тока около 5000 мА г-1 и разряд при различных плотностях тока в диапазоне от приблизительно 100 до приблизительно 5000 мА г-1 Электрохимические исследования были выполнены в пакетной ячейке в электролите на основе ионной жидкости: AlCl3:[EMIm]Cl приблизительно 1,3 (мольное соотношение).
Фиг. 4: механизмы реакции алюминиево-ионной батареи, а, циклические вольтамперометрические кривые алюминиевой фольги и пиролитического графита (PG) при частоте сканирования приблизительно 10 мВ с-1 в отношении алюминиевого электрода. b, рентгеновские дифрактограммы (XRD) ex situ (вне места нахождения) пиролитического графита (PG) при различных состояниях заряда и разряда на протяжении второго цикла, b, спектр комбинационного рассеяния, зарегистрированный для PG катода, на протяжении цикла заряда/разряда, показывающий интеркаляцию/деинтеркаляцию аниона хлоралюмината в графит, d, после прокаливания полностью заряженного (около 62 мАч г-1) PG при 850°C на воздухе образец трансформировался в белую пену из оксида алюминия. Масштабная метка соответствует 1 см. Все электрохимические исследования были выполнены в электролите на основе ионной жидкости: AlCl3:[EMIm]Cl приблизительно 1,3 (мольное соотношение).
Фиг. 5: Химическое зондирование графитового катода с помощью рентгеновской фотоэмиссионной спектроскопии (XPS) и электронной оже-спектроскопии (AES). а, данные XPS пика С 1s первоначального 3D графита, полностью заряженного и полностью разряженного 3D графита, показывающие, что графит находится в окисленном состоянии, когда он полностью разряжен. b, c, данные XPS пиков Al 2р и Cl 2р, наблюдаемые при полностью заряженном образце графита. Интенсивности пиков Al 2р и Cl 2р показывают интенсивность в полностью разряженном состоянии, а остаточные сигналы относятся к остаточному захваченному электролиту в образце, d, отображения элементов С, Al и Cl в результате AES, полученные для полностью заряженного образца графита. Равномерно распределенные сигналы и превосходное наложение сигналов С, Al и Cl показывает интеркаляцию анионов AlxCly- в графит после заряда, е, спектр AES, записанный для области, обозначенной белым прямоугольником на фиг. d, показывает наличие сигналов Cl, С, О и Al. f, отображение элементов С, Al и Cl в результате AES, полученной для полностью разряженного образца графита в области, обозначенной белым прямоугольником. В разряженном образце видны маленькие сигналы Al и Cl. g, спектр AES, записанный в области белого прямоугольника, показанного на фиг. f, для разряженного образца, показывает главным образом сигналы С и О, и слабые сигналы Al и Cl. Масштабная метка на фиг. d и f, соответственно, составляет 25 мкм и 10 мкм.
Фиг. 6: рентгеновские дифрактограммы (XRD) материалов графического катода. Природный графит, пиролитический графит, и 3D графит показывают типичную структуру графита, с острым (002) пиком графита на XRD при угле 2θ около 26,55° (d-расстояние = 3,35 ангстрем).
Фиг. 7: Оптимальное соотношение AlCl3/[EMIm]Cl в электролите на основе ионной жидкости, а, гальваностатические кривые заряда и разряда ячеек Al/пиролитический графит при плотности тока около 66 мА г-1 при различных мольных соотношениях (около 1,1, около 1,3, около 1,5, и около 1,8) AlCl3/[EMIm]Cl в электролите на основе ионной жидкости в ячейке типа swagelok. Кулоновская эффективность ячеек показана в круглых скобках. b, спектр комбинационного рассеяния, записанный для смешанного электролита на основе ионной жидкости: AlCl3/[EMIm]Cl около 1,3 (мольное соотношение).
Фиг. 8: Вычисленная разрядная емкость элемента Al/графит с различной массой материала графита, а, Фольга из природного графита, толщиной около 50 мкм и около 130 мкм, и b, пиролитический графит и 3D графит, показывающие весь графитовый материал, принимающий участие в реакции на катоде элемента.
Фиг. 9: гальваностатические кривые заряда и разряда элемента Al/PG. Элемент была установлена с одним слоем стекловидного сепаратора и приблизительно 0,08 мл электролита на основе ионной жидкости, показывая, что уменьшенное количество электролита может составлять около 0,02 мл на 1 мг PG. Электрохимические исследования были выполнены в ячейке типа swagelok с электролитом на основе ионной жидкости: AlCl3/[EMIm]Cl приблизительно 1,3 (мольное соотношение) при плотности тока около 66 мА г-1.
Фиг. 10: Обзор поверхности алюминиевого анода, полученного из Al/PG элемента после: а, 20 циклов и b, 100 циклов, показывающий отсутствие образования древовидной структуры при выполнении циклов. Масштабная метка равна 10 мкм.
Фиг. 11: Электрохимическая стабильность электролита на основе ионной жидкости AlCl3/[EMIm]Cl. а, Гальваностатические кривые Al/PG ячеек с различными напряжениями отсечки заряда при плотности тока около 66 мА г-1 в ячейке типа swagelok. b, Циклическая вольтамперометрическая кривая элемента Al/стекловидный графит, при приблизительно 10 мВ с-1 в ячейке типа swagelok. c-d Тест на стабильность пакетной элемента батареи Al/природный графит при плотности тока около 66 мА г-1 в электролитах, содержащих: с, около 7500-10000 ppm, и d, около 500-700 ppm воды (H2O). Кулоновская эффективность ячеек составляет около 95,2 и около 98,6%, разрядные емкости батареи составляют соответственно около 54,9 и около 61,8 мАч г-1 на 15-ом цикле, е, Хроматографический спектр газа для газообразных образцов, выведенный из ячеек Al/графит, после 30 циклов, использующих электролит с содержанием воды около 7500-10000 ppm. Пик, обнаруженный при удерживании приблизительно 0,5 мин, соответствует газу водороду и соответствует времени удерживания чистого газа водорода в качестве калибровочного газа.
Фиг. 12: Возможности элемента Al/пиролитический графит в отношении С-уровня. а, Удержание емкости элемента Al/пиролитический графит, циклически используемой при различных плотностях тока, показывающий хорошую циклическую стабильность при различных плотностях тока заряда-разряда. Кулоновская эффективность ячеек по отношению к плотности тока для Al/PG ячеек показывает кулоновскую эффективность около 95-97% при плотностях тока около 66-132 мА г-1 Все электрохимические исследования были выполнены в ячейке типа swagelok с электролитом на основе ионной жидкости: AlCl3/[EMIm]Cl приблизительно 1,3 (мольное соотношение).
Фиг. 13: Преимущества пиролитического графита в качестве катода для элемента Al/пиролитический графит. Фотографии: а, природный графит и b, пиролитический графита перед и после полного разряда в электролите на основе ионной жидкости, AlCl3/[EMIm]Cl = приблизительно 1,3 (мольное соотношение). Масштабная метка равна 1 см. Схематические диаграммы показывают химические связи между листами графена природного графита (ван-дер-ваальсова связь) и пиролитического графита (ковалентная связь), с, Гальваностатические кривые заряда и разряда элемента Al/пиролитический графит (при плотности тока около 66 мА г-1) и элемента Al/природный графит (при плотности тока около 33 мА г-1) в ионной жидкости: AlCl3/[EMIm]Cl = приблизительно 1,3 (мольное соотношение) в ячейке типа swagelok.
Фиг. 14: Возможности элемента Al/3D графит в отношении С-уровня. а, Удержание емкости элемента Al/3D графит, циклически используемой при различных плотностях тока, показывает хорошую циклическую стабильность при различных плотностях тока заряда-разряда. Все электрохимические исследования были выполнены в пакетной ячейке ("pouch cell") с электролитом на основе ионной жидкости: AlCl3/[EMIm]Cl приблизительно 1,3 (мольное соотношение). b, Гальваностатические кривые заряда и разряда элемента Al/3D графит, заряжающейся при плотности тока около 5000 мА г-1 и разряжающейся при различных плотностях тока в диапазоне приблизительно 100-5000 мА г-1. Электрохимические исследования были выполнены в пакетном элемента ("pouch cell") с электролитом на основе ионной жидкости: AlCl3:[EMIm]Cl = приблизительно 1,3 (мольное соотношение).
Фиг. 15: Механизм реакции для катодов из графита, а, Спектр комбинационного рассеяния in situ, записанный для катода из 3D графита, на протяжении цикла заряда/разряда, показывающий интеркаляцию/деинтеркаляцию аниона хлоралюмината в графит. b, Рентгеновские дифрактограммы ex situ первоначальной и полностью заряженной (около 62 мА г-1) 3D графитовой пены.
Фиг. 16: Гибкая батарея Al-графит. а, Фотография полностью собранного элемента Al/пиролитический графит в конфигурации пакетного элемента ("pouch cell"), b, Фотография сильно изогнутого или сложенного элемента Al/пиролитический графит, который запитывает красный СИД (светоизлучающий диод). Радиус кривизны (Rc) изгиба составляет около 14 мм. Масштабная метка равна 2 см.
Фиг. 17: Слева направо: пиролитический графит (PG), расширенный PG посредством быстрого нагрева после интеркалирования, и вторично расширенный PG за счет реакции выделения водорода.
Фиг. 18: Испытание на длительную стабильность элемента Al/пиролитический графит, постоянное напряжение заряда составляет около 2,45 В в течение около 1 часа, а разряда (около 0.5 В) при плотности тока около 66 мА г-1.
Фиг. 19: а, Гальваностатические кривые заряда и разряда графитовой фольги (GF), бумаги из углеродного волокна (CFP) и технического углерода (СВ) при плотности тока около 6,6 мА г-1 в электролите AlCl3:[EMIm]Cl с приблизительным отношением 1,3:1. Алюминиевая фольга использовалась в качестве материала анода. Представленный элемент Al/графитовая фольга имеет в три раза более высокую удельную емкость, чем элемента Al/CFP и Al/СВ. b, Гальваностатические кривые заряда и разряда батареи Al/графитовая фольга при плотности тока около 33 мА г-1 с различными мольными отношениями электролитов на основе ионной жидкости AlCl3/[EMIm]Cl. с, Гальваностатические кривые заряда и разряда батареи Al/графитовая фольга при различных напряжениях отсечки. Все гальваностатические испытания были выполнены в двухэлектродной конфигурации.
Фиг. 20: Циклические свойства батареи Al-графит. а, Испытание на длительную стабильность батареи Al-графит при С-уровне около С/2 (около 33 мА г-1), показывающее, что батарея может циклически разряжаться приблизительно на 100% в течение 300 циклов или более, при этом батарея показывает кулоновскую эффективность около 99%. Характеристика заряда и разряда батареи была стабильной (см. вставку на фиг. 20а). b, Удерживание емкости и гальваностатические кривые заряда и разряда (см. вставку b) батареи Al-графит, использующейся циклично при различных С-уровнях (плотностях тока), показывают устойчивую стабильность циклической работы при различных плотностях тока заряда и разряда, с, Циклические вольтамперные кривые алюминиевой фольги и графитовой фольги при скорости сканирования 10 мВ с-1 d, Циклические вольтамперные кривые элемента Al-графит при скорости сканирования 10 мВ с-1 в двухэлектродной конфигурации.
Фиг. 21: Механизм заряда-разряда батареи Al-графит. а, Рентгеновские дифрактограммы ex situ графитовой фольги при различных состояниях заряда и разряда на десятом цикле. b, Рентгеновские дифрактограммы ex situ графитовой фольги в полностью заряженном состоянии на 10-ом, 25-ом и 100-ом циклах, с, Фотографии графитовой фольги перед и после заряда в электролите на основе ионной жидкости AlCl3/[EMIm]Cl, показывающие, что графитовая фольга расширилась почти в десять раз от первоначальной толщины после того, как она была заряжена в трехэлектродном элементе в виде кюветы, d, (в месте нахождения) Спектр комбинационного рассеяния in situ измерялся во время заряда и разряда элемента. Все электрохимические исследования были выполнены в электролите с ионной жидкостью AlCl3:[EMIm]Cl, в соотношении приблизительно 1,3:1.
Фиг. 22: Гибкая батарея Al-графит. а, Фотография полностью собранной батареи Al-графит. b, с Демонстрация изгибаемой батареи Al-графит, включающей красный СИД в изогнутом состоянии, d, Две батареи Al-графит были соединены последовательно, они выдавали постоянное напряжение около 3-4 В, затем они были подключены к преобразователю мощности постоянного тока, чтобы генерировать постоянный ток 1 А при напряжении около 5 В для заряда смартфона.
Фиг. 23: Вычисленные теоретическая емкость и энергозатраты для алюминий-ионной и литий-ионной батарей.
Подробное описание изобретения
Разработка новых типов систем перезаряжаемых батарей может усовершенствовать множество областей техники, от персональной электроники до сетевого накопления энергии. Некоторые варианты осуществления настоящего изобретения направлены на перезаряжаемые металл-ионные батареи с высокими эксплуатационными характеристиками, такие как алюминиевая батарея с большими скоростными возможностями, использующая алюминиевый металлический анод и улучшенные графитовые материалы в качестве катода. Улучшенные материалы для катода из графита могут позволить перезаряжаемым алюминиевым батареям работать в ионной жидкости с превосходными эксплуатационными характеристиками в отношении профиля напряжения разряда, циклической стабильности и скоростной характеристики. Батарея может работать на основе электрохимической окислительно-восстановительной реакции осаждения/растворения алюминия и окислительно-восстановительных реакций графита через интеркалирование/деинтеркалирование анионов хлоралюмината графита в безопасном невоспламеняемом электролите на основе ионной жидкости. В некоторых вариантах осуществления изобретения батарея может показывать хорошо определяемый плоский участок в характеристике напряжения разряда, приблизительно около 2 В, удельную емкость приблизительно 70 мАч г-1 и кулоновскую эффективность около 98%. В более общем смысле, (1) плоский участок на кривой напряжения может быть в диапазоне от приблизительно 2,25 В до приблизительно 1,5 В; (2) удельная емкость (заряда или разряда) может составлять по меньшей мере приблизительно 50 мАч г-1 по меньшей мере приблизительно 60 мАч г-1 по меньшей мере приблизительно 70 мАч г-1 по меньшей мере приблизительно 80 мАч г-1 по меньшей мере приблизительно 90 мАч г-1 по меньшей мере приблизительно 100 мАч г-1 по меньшей мере приблизительно 110 мАч г-1 и вплоть до приблизительно 127 мАч г-1 или более; (3) по меньшей мере около 50% первоначальной разрядной емкости сохраняется после 300, 500 или 1000 циклов заряда/разряда, как например, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 85%, по меньшей мере около 90%, по меньшей мере около 93%, по меньшей мере около 95%, или по меньшей мере около 98%, и вплоть до по 99% или более; и (4) кулоновская эффективность может составлять по меньшей мере около 70%, по меньшей мере около 75%, по меньшей мере около 80%, по меньшей мере около 85%, по меньшей мере около 90%, по меньшей мере около 95%, или по меньшей мере около 98%, и вплоть до приблизительно 99% или более, где выполнение циклов производится при плотности тока С/10, С/5, С/4, С/2, 1С, 2С или с другим более высоким или более низким контрольным уровнем. В некоторых вариантах осуществления изобретения удерживается по меньшей мере около 50% контрольной разрядной емкости, когда выполнение цикла производится при контрольной плотности тока (например, 1С), когда выполнение циклов производится при 2-кратной, 5-кратной, 10-кратной, или 50-кратной контрольной плотности тока (например, 2С, 5С, 10С или 50С), например, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 85%, по меньшей мере около 90%, по меньшей мере около 93%, по меньшей мере около 95%, или по меньшей мере около 98%, и вплоть до 99% или более. В некоторых вариантах осуществления изобретения улучшенный пористый 3D графитовый катод может обеспечивать быстрый транспорт анионов, инфильтрацию и диффузию из электролита к катоду, обеспечивая беспрецедентное время заряда в течение около 1 минуты при высоких плотностях тока заряда, составляющих около 4000 мА г-1 (около 3000 Вт кг-1) значительно больше, чем 7500 циклов, без заметного ухудшения емкости. Низкая стоимость, высокая безопасность, высокая стабильность и высокая скорость заряда алюминиевой батареи открывает дорогу для создания улучшенной системы аккумулирования энергии.
Как показано в варианте осуществления изобретения на фиг. 1, металл-ионная батарея 100 включает в себя: катод 102, анод 104, и разделитель 106, который располагается между катодом 102 и анодом 104. Батарея 100 также включает в себя электролит 108, который располагается между катодом 102 и анодом 104. Батарея 100 является вторичной аккумуляторной батареей, которая является перезаряжаемой, хотя первичные батареи также охватываются настоящим изобретением.
В проиллюстрированном варианте осуществления изобретения батарея 100 является алюминиевой батареей, хотя другие типы металл-ионных батарей также охватываются настоящим изобретением. Анод 104 включает в себя алюминий, например, такой как нелегированная форма алюминия или алюминиевый сплав. В более общем смысле, подходящий материал анода может включать в себя один или более из щелочных металлов (например, литий, калий, натрий, и т.д.), щелочноземельных металлов (например, магний, кальций, и т.д.), переходных металлов (например, цинк, железо, никель, кобальт, и т.д.), главной группы металлов или металлоидов (например, алюминий, кремний, олово, и т.д.), а также металлических сплавов из двух или более вышеуказанных элементов (например, алюминиевый сплав).
Разделитель 106 уменьшает возможность электрического короткого замыкания между катодом 102 и анодом 104, а электролит 108 поддерживает обратимое осаждение и растворение (или удаление) алюминия на аноде 104 и обратимое интеркалирование и деинтеркалирование анионов на катоде 102. Электролит 108 может содержать ионную жидкость, которая поддерживает обратимую окислительно-восстановительную реакцию металла или металлического сплава, включенного в состав анода 104. Примеры ионной жидкости включают в себя алюминаты, такие как алюминаты алкилимидазолия, алюминаты алкилпиридина, алюминаты алкилфторпиразола, алюминаты алкилтриазолия, алюминаты аралкил аммония, алюминаты алкилалкоксиаммония, алюминаты аралкилфосфония, алюминаты аралкилсульфония, алюминаты алкилгуанидина, а также их смеси. Например, электролит 108 может соответствовать или может включать в себя смесь галогенида алюминия и ионной жидкости, при этом мольное отношение галогенида алюминия и ионной жидкости по меньшей мере приблизительно 1,1, или больше чем приблизительно 1,2, и вплоть до приблизительно 1,5 или приблизительно 1,8 или более, таким образом, если галогенидом алюминия является AlCl3, ионная жидкость представляет собой хлорид 1-этил-3-метилимидазолия, причем мольное отношение хлорида алюминия к хлориду 1-этил-3-метилимидазолия по меньшей мере или больше чем приблизительно 1,2. Электролит на основе ионной жидкости может быть с примесями (или иметь добавленные реагенты) для увеличения электрической проводимости и понижения вязкости, или может иным способом изменен, чтобы получить соединения, которые благоприятствуют обратимому электроосаждению металлов.
Более высокая кулоновская эффективность и более высокая циклическая стабильность могут быть достигнуты посредством уменьшения содержания воды в электролите 108, так чтобы уровень содержания воды был не выше, чем приблизительно 7500 ppm, не выше, чем приблизительно 5000 ppm, не выше, чем приблизительно 2000 ppm, не выше, чем приблизительно 1000 ppm, не выше, чем приблизительно 900 ppm, не выше, чем приблизительно 800 ppm, не выше, чем приблизительно 700 ppm, не выше, чем приблизительно 600 ppm, не выше, чем приблизительно 500 ppm, не выше, чем приблизительно 400 ppm, не выше, чем приблизительно 300 ppm, не выше, чем приблизительно 200 ppm, или не выше, чем приблизительно 100 ppm, и вплоть до приблизительно 50 ppm, и до приблизительно 10 ppm, или ниже. В некоторых вариантах осуществления изобретения уменьшенное содержание воды может быть достигнуто с помощью электрохимического высушивания воды, например, с помощью выполнения батареей 100 одного или более циклов заряда/разряда, во время которых остаточная вода в электролите 108 может расходоваться путем разложения до газообразного Н2, который может выделяться из батареи 100.
Катод 102 включает в себя активный материал, который способен участвовать к обратимой интеркаляции или иным образом получать анионы металла из электролита 108, например, путем интеркаляции анионов хлоралюмината во время заряда и деинтеркаляции анионов хлоралюмината во время разряда. Подходящие материалы катода могут включать в себя один или более различных слоистых двухмерных (2D) материалов или трехмерных (3D) материалов. Двухмерные материалы могут включать в себя множество листов или слоев с ковалентными связями между атомами отдельного листа или слоя, и более слабыми взаимодействиями, такими как ван-дер-ваальсова связь, между листами или слоями, хотя однослойный материал также может быть подходящим двухмерным материалом. Трехмерные (3D) материалы могут включать в себя трехмерные кристаллические материалы, а также слоистые материалы, в которых между листами или слоями слоистых материалов существует по меньшей мере некоторая протяженность. Примеры подходящих материалов для катода включают в себя (1) материалы, содержащие углерод (или углеродосодержащие), такие как графитовые материалы (например, графитовая фольга, графитовая пена (или другие пористые структуры), графитовые пленки, графитовые волокна, графитовые порошки или графитовые частицы; материалы из графена; и материалы из углеродных нанотрубок), (2) слоистый двойной гидроксид, (3) слоистый оксид, (4) слоистый халькогенид, (5) кремний (или другие кремнийсодержащие материалы), (б) германий (или другие германийсодержащие материалы), (7) другие материалы, содержащие элементы IV группы, и (8) арсенид галлия (GaAs), помимо других материалов.
Например, катод 102 может включать в себя 2D материал, который является графитом.
В качестве другого примера, катод 102 может включать в себя 3D материал в виде пиролитического графита, в котором ковалентная связь существует между соседними листами графена.
В качестве другого примера катод 102 может включать в себя 3D материал в виде графитовой пены, которая может быть сформирована в виде графитовых нитевидных кристаллов или других вытянутых структур на удаляемой подложке, посредством химического осаждения паров; после этого с помощью травления удаляется подложна. Ширина (например, индивидуальная или средняя ширина, диаметр, или другие поперечные размеры) графитовых нитевидных кристаллов в графитовой пене могут быть в диапазоне от приблизительно 200 нм до приблизительно 2000 мкм, от приблизительно 500 нм до приблизительно 1500 мкм, от приблизительно 500 нм до приблизительно 1000 мкм, от приблизительно 1 мкм до приблизительно 1000 мкм, от приблизительно 1 мкм до приблизительно 900 мкм, от приблизительно 1 мкм до приблизительно 800 мкм, от приблизительно 1 мкм до приблизительно 700 мкм, от приблизительно 1 мкм до приблизительно 600 мкм, от приблизительно 1 мкм до приблизительно 500 мкм, от приблизительно 10 мкм до приблизительно 500 мкм, от приблизительно 10 мкм до приблизительно 400 мкм, от приблизительно 10 мкм до приблизительно 300 мкм, от приблизительно 10 мкм до приблизительно 200 мкм. Пористая графитовая структура также формируется посредством расширения графитового материала, например, с помощью теплового нагрева и расслаивания пиролитического графита после одного или более циклов заряда/разряда, а затем электрохимической реакции выделения водорода в основаном растворе, во время которой водород может расширять пиролитический графит в пористой структуре. В некоторых вариантах реализации характеристикой графита или графитовой пены является пористость, которая является мерой объема пустот, возникающих в результате наличия пор или любых других открытых пространств внутри пены. Пористость может быть представлена как отношение объема пустот к общему объему, а именно, между 0 и 1, или как процентное соотношение между 0% и 100%. В некоторых вариантах реализации графитовая пена может иметь пористость по меньшей мере приблизительно 0,05 или по меньшей мере приблизительно 0,1 и вплоть до 0,95, а если более точно, пористость может составлять от приблизительно 0,1 до приблизительно 0,9, от приблизительно 0,2 до приблизительно 0,9, от приблизительно 0,3 до приблизительно 0,9, от приблизительно 0,4 до приблизительно 0,9, от приблизительно 0,5 до приблизительно 0,9, от приблизительно 0,5 до приблизительно 0,8, от приблизительно 0,6 до приблизительно 0,8. Методы определения пористости включают, например, порозиметрию и оптические или сканирующие методы.
В качестве дополнительного примера, катод 102 может включать 3D материал, такой как кремний или германий.
Примеры
Последующее примеры описывают специфические аспекты некоторых вариантов осуществления изобретения, чтобы проиллюстрировать и обеспечить описание для специалиста в данной области техники. Данные примеры не следует рассматривать как ограничивающее изобретение, поскольку эти примеры только обеспечивают специфическую методологию, полезную для понимания и в практической реализации некоторых вариантов осуществления настоящего изобретения.
Пример 1
Алюминиевые батареи (схематический чертеж на фиг. 2а) сконструированы в виде элемента типа Swagelok или пакетного элемента с анодом из алюминиевой фольги (толщиной около 15-250 мкм) и графитовым катодом, сформированным из фольги, выполненной из PG (около 17 мкм) или из 3D графитовой пены, в электролите на основе ионной жидкости (TL) AlCl3/1-этил-3-метилимидазолий хлорид ([EMIm]Cl), [см. Материалы и способы]. Материал в виде фольги из PG и материал 3D графитовой пены показывают типичную графитовую структуру с острым (002) пиком графита на рентгеновской дифрактограмме (XRD) при угле 2θ около 26,55° (d-расстояние = 3,35 ангстрем) (фиг. 6). Элемент сначала был оптимизирован для работы как элемент типа Swagelok при температуре около 25° с использованием катода из PG фольги. Было определено, что оптимальное отношение AlCl3/[EMIm]Cl, составляет приблизительно от 1,3 до приблизительно 1,5 (фиг. 7), что обеспечивает удельную разрядную емкость около 60-66 мАч/г (на основе массы графита) при кулоновской эффективности около 95-98%. Спектроскопия комбинационного рассеяния выполняется для того, чтобы показать, что в электролите на основе ионной жидкости отношение AlCl3/[EMIm]Cl составляет приблизительно 1,3; анионы AlCl4- и Al2Cl7- (фиг. 7) были преобладающими, с соотношением [AlCl4-]/[Al2Cl7-] приблизительно 2,33. В отношении удельной разрядной емкости (емкость/масса) катода было обнаружено, что она по существу не зависит от массы графита (фиг. 8а, b), показывая, что вся толщина графитовой фольги участвует в реакции на катоде.
Характеристика разрядного напряжения элемента Al/PG показывает плоские участки в диапазоне от приблизительно 2,25 В до приблизительно 2 В и от приблизительно 1,9 В до приблизительно 1,5 В соответственно (фиг. 2b). Относительно высокие плоские участки в разрядном напряжении являются беспрецедентными среди известных алюминий-ионных систем накопления заряда. Аналогичная работа элемента наблюдалась с пониженным количеством электролита до приблизительно 0,02 мл на 1 мг материала катода (фиг. 9). Выполнение цикла заряда/разряда при плотности тока около 66 мА г-1 (С-уровень равен 1С) показало высокую стабильность элемента Al/PG, удерживая приблизительно или по существу 100% удельной емкости на протяжении более чем 200 циклов, с кулоновской эффективностью 98,1±0,4% (см. фиг. 2с). Это согласуется с высокой обратимостью растворения/осаждения алюминиевого анода с кулоновской эффективностью приблизительно 98,6-99,8% в ионных электролитах. В условиях работы батареи на алюминиевом электроде не наблюдалось образование дендрита в процессе выполнения циклов (фиг. 10). Чтобы поддерживать кулоновскую эффективность более чем 96%, напряжение отсечки элемента Al/PG было установлено меньше 2,45 В, выше этого значения наблюдалась уменьшенная эффективность (см. фиг. 11а), вероятно, вследствие побочных реакций (особенно при напряжении выше приблизительно 2,6 В), включая электролит, который тестировался с помощью циклической вольтамперометрии со стекловидным углеродным электродом, взаимодействующим с алюминием (фиг. 11b).
Пониженная кулоновская эффективность и циклическая стабильность элемента алюминиевой батареи наблюдаются при использовании электролита, содержащего более высокое содержание воды, вплоть до приблизительно 7500 ppm (фиг. 11с, d), сопровождающееся заметным выделением водорода, измеренного с помощью газовой хроматографии (фиг. 11е). Эти указанные побочные реакции запускались из-за присутствия воды, остающейся в электролите, с выделением водорода при уменьшающемся потенциале на стороне алюминия во время заряда. Дальнейшее уменьшение содержания воды в электролите с ионной жидкостью может быть желательным для увеличения кулоновской эффективности элементов Al/графит.
Элемент Al/фольга из пиролитического графита показал уменьшенную скоростную характеристику, с пониженной удельной емкостью, когда он заряжен и разряжен при С-уровне выше, чем 1С (фиг. 7). Предполагается, что реакции на катоде в ячейке Al/пиролитический графит включают интеркалирование/деинтеркалирование относительно большого количества анионов хлоралюмината (AlxCly-) в графит (см. фиг. 4, XRD для подтверждения интеркалирования), при этом скоростная характеристика ограничивается медленной диффузией анионов через графитовые слои в фольге из пиролитического графита. На интеркалирование в графит, когда фольга из природного графита (NG) использовалась для замены катода из пиролитического графита в элементе Al/графит, указывало значительное расширение природного графита, приблизительно в 50 раз, образовывались «рыхлые» слои хлопьев, что наблюдалось во время заряда (фиг. 13а); это было видно невооруженным глазом и проявлялось в диффузии, инфильтрации и интеркаляции анионов в графитовые слои. И наоборот, не наблюдалось явного расширения PG фольги после заряда элемента Al/PG (фиг. 13b), несмотря на аналогичную удельную зарядную емкость для двух типов графитовой фольги (фиг. 13с). Превосходная структурная целостность пиролитического графита по сравнению с природным графитом во время заряда и интеркаляции анионов объясняется существованием ковалентной связи между соседними листами графена в гидролитическом графите, но не в природном графите. Таким образом, фольга из 3D пиролитического связанного графита была идентифицирована как улучшенный графитовый материал для перезаряжаемой алюминиевой батареи, позволяющий избежать чрезмерного расширения и разрушения электрода, но в то же время обеспечивающий инфильтрацию и диффузию анионов через множество графитовых стопок для интеркалирования.
Поскольку высокоскоростные батареи высокой мощности чрезвычайно желательны для таких вариантов применения, как сетевое аккумулирование энергии, были выполнены исследования на гибкой трехмерной (3D) графитовой пене (фиг. 3а), сформированной на подложке из никелевой пены посредством химического осаждения паров (см. Материалы и способы), направленные на разработку более открытой рамочной графитовой структуры для алюминиево-графитовых батарей, чтобы значительно уменьшить барьеры инфильтрации и диффузии анионов для алюминиевых батарей со сверхбыстрым зарядом/разрядом. Ширина графитовых нитевидных кристаллов в пене (фиг. 3а) составляет около 100 мкм, а пространство между графитовыми нитевидными кристаллами может значительно уменьшить длину диффузии анионов и сделать материалы катода в высокой степени доступными для электролита, чтобы облегчить быструю работу батареи.
Следует заметить, что элемент Al/3D графитовая пена (в конфигурации пакетного элемента) может заряжаться и разряжаться при высокой плотности тока, вплоть до приблизительно 5000 мА г-1 приблизительно в 75 раз (например, при уровне 75С, время заряда/разряда <1 мин.) выше, чем для элемента Al/PG с аналогичным профилем напряжения и разрядной емкостью (около 60 мАч г-1) (см. фиг. 2b и 3b для сравнения). Впечатляющая циклическая стабильность, около 100% удерживания емкости, наблюдалась на свыше 7500 циклов, с кулоновской эффективностью 97±2,3% (фиг. 3с). Это демонстрирует сверхбыструю алюминий-ионную батарею со стабильностью, превышающей тысячи циклов. Элемент Al/(3D графит удерживает аналогичную емкость и показывает превосходную циклическую стабильность в диапазоне уровней тока заряда/разряда (от приблизительно 1000 до приблизительно 6000 мА г-1), с кулоновской эффективностью около 85-99% (фиг. 14а). Другой желательный аспект состоит в том, что элемент может быстро заряжаться (при 5000 мА г-1 приблизительно за 1 мин.) и постепенно разряжаться (вплоть до приблизительно 100 мА г-1 фиг. 3d и 14b) в течение приблизительно 34 мин., в то же время поддерживая высокую емкость (около 60 мАч г-1). Такая быстрая зарядка и разрядка с переменной скоростью может иметь привлекательность для многих реальных приложений во всем мире.
Были произведены исследования механизма работы алюминий-ионной батареи, а также реакций на электроде в смешанном электролите с ионной жидкостью AlCl3/[EMIm]Cl, оптимальное отношением AlCl3/[EMIm]Cl=1,3 (в молях). Циклическая вольтамметрия (CV) (фиг. 4а) показала волну восстановления от приблизительно -1,0 до приблизительно -0,08 В (относительно алюминия) и волну окисления от приблизительно -0,08 до приблизительно 0,80 В (относительно алюминия) для алюминиевого анода (фиг. 4а, левый график), соответствующих восстановлению/электроосаждению алюминия и окислению/растворению во время заряда и разряда соответственно. Это согласуется с электрохимией окислительно-восстановительной реакции алюминия в ионных жидкостях через следующее уравнение:

и в соответствии с наблюдаемым спектром комбинационного рассеяния анионов AlCl4- и Al2Cl7- в электролите (фиг. 7). На стороне графитового катода наблюдались волна окисления, которая составляет от приблизительно 1,83 до приблизительно 2,50 В (относительно алюминия, фиг. 4а, правый график), и волна восстановления - от приблизительно 1,16 до приблизительно 2,36 В (относительно алюминия) (фиг. 4а, левый график), связанные с окислением и восстановлением графита через интеркаляцию и деинтеркаляцию анионов соответственно (вероятно доминирующим является анион AlCl4- вследствие меньшего размера по сравнению с Al2Cl7-). Диапазон напряжения окисления от приблизительно 1,83 до приблизительно 2,50 В (относительно алюминия, фиг. 4а, правый график), относился к интеркаляции AlCl4- в графит. Волна восстановления находится в диапазоне от приблизительно 1,16 до приблизительно 2,36 В (относительно алюминия) и относится к деинтеркаляции анионов AlCl4-. Природа плеча на кривой восстановления графита в диапазоне от приблизительно 2,36 до приблизительно 1,9 В (фиг. 4а, правый график) и более высокий плоский участок при разрядке (от приблизительно 2,25 до приблизительно 2,0 В) элемента Al/PG после заряда (фиг. 2b) может возникнуть вследствие различных стадий интеркаляции анион-графит.
Предполагается, что происходят следующие упрощенные окислительно-восстановительные реакции катода во время заряда и разряда:
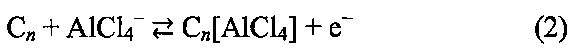
где n - мольное отношением атома/аниона углерода в интеркалированном графите. При оптимальном электролите - AlCl3/[EMIm]Cl = приблизительно 1,3 (мольное отношение), кислотность по Льюису была относительно высокой, а концентрация AlCl4- была приблизительно в 2,3 раза выше, чем концентрация AlCl7-, определяемая выражениями:

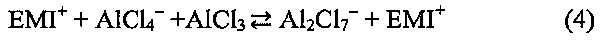
Сбалансированные концентрации AlCl4- и Al2Cl7- в электролите благоприятствуют оптимальной зарядной емкости катода с избыточными анионами AlCl4- для заряда/интеркаляции в графит (уравнение 2) и достаточной концентрацией AlCl7- для заряда/электроосаждения на аноде (уравнение 1). Во время разряда элемента локальная концентрация аниона на анодной стороне является уменьшенной (уравнение 1, ионы AlCl4- были преобразованы в меньшее количество ионов Al2Cl7-), в то время как ионы EMI+ мигрировали к стороне катода, что сопровождалось более значительным количеством анионов AlCl4-, высвобожденных (уравнение 2) из графитовых слоев в окружение катода (фиг. 2а). Эти процессы поддерживают локальную нейтральность заряда на обоих электродах.
Измерение XRD ex situ графитовой фольги (фиг. 4b, см. Материалы и способы) подтвердило интеркаляцию/деинтеркаляцию графита посредством анионов хлоралюмината во время заряда/разряда. Острый пик чистой графитовой фольги (002) при угле 2θ = около 26,55° (d-расстояние = 3,35 ангстрем) (фиг. 4b) по существу исчезает после заряда до удельной емкости приблизительно 30 мАч г-1, в то время как два новых пика появляются при угле около 28,25° (d-расстояние = 3,15 ангстрем) и угле 23,56° (d-расстояние = 3,77 ангстрем) (фиг. 4b), причем пиковые интенсивности дополнительно увеличились после полной заряда до приблизительно 62 мАч г-1. Сдвоенный пик XRD показал сильно деформированные слои графена после интеркаляции анионов. Анализ разделения пиков показал интеркалированное соединение графита стадии 4 с высотой площадки интерколата приблизительно 5,7 ангстрем и расширением площадки приблизительно на 2,35 ангстрем, указывая, что анионы AlCl4- (размером приблизительно на 5,28 ангстрем), были интеркалированы в пространство между слоями графена в деформированном состоянии. Деинтеркалирование после полной разряда привело к восстановлению пика графита, но с широким плечом (фиг. 4b), возможно вызванным необратимыми изменениями в стекинге между слоями графена или маленьким количеством захваченных ионов.
Спектроскопия комбинационного рассеяния in situ выполнялась для зондирования интеркаляции/деинтеркаляции анионов хлоралюминатов в графит во время заряда/разряда элемента (фиг. 4с). Оказалось, что G-полоса графита, приблизительно 1584 см-1 была ослаблена и разделена в сдвоенном пике [приблизительно 1587 см-1 для моды E2g2(i) и приблизительно 1608 см-1 для моды E2g2(b)] после интеркаляции анионов (фиг. 4с), а затем после полного заряда преобразовалась в новый острый пик в спектре комбинационного рассеяния, на приблизительно 1636 см-1 (полоса G2 моды E2g2(b) (спектр приблизительно 2,41 В, фиг. 4с). Спектральные изменения были инвертированы после деинтеркаляции (фиг. 4с), восстановлена типичная G-полоса спектра комбинационного рассеяния (приблизительно 1584 см-1) при полном разряде (спектр приблизительно 0,03 В, фиг. 4с). Аналогичные данные по спектру комбинационного рассеяния и XRD были получены с катодом из 3D графитовой пены (фиг. 15a, b). Интересно, что белая пена оксида алюминия была получена после прокаливания полностью заряженной фольги из PG при температуре около 850°C на воздухе (фиг. 4d), показывая интеркаляцию анионов хлоралюмината через толщину графитовой фольги и преобразование в пену оксида алюминия после окислительного удаления углеродной сети.
Рентгеновская фотоэмиссионная спектроскопия (XPS) и электронная оже-спектроскопия (AES) также выполнялись для зондирования химической природы интеркалированных частиц в графитовые катоды (см. Материалы и способы). Для уменьшения захваченного электролита 3D графитовая пена использовалась для этого исследования, она была тщательно вымыта безводным метанолом. XPS выявила, что после заряда чистого графита приблизительно при 284,8 эВ пик C1s разделяется, показывая плечевой пик при более высокой энергии, приблизительно 285,9 эВ (фиг. 5а), подтверждая электрохимическое окисление углерода графита вследствие интеркаляции анионов AlCl4- (см. уравнение 2). Интеркаляция хлоралюмината также была очевидной исходя из появления пиков Al 2р и Cl 2р, наблюдаемых на графитовом образце (фиг. 5b, с). После разряда, Cls в XPS спектре катода, восстановленный до состояния чистого графита вследствие деинтеркаляции анионов и восстановления углерода (фиг. 5а), сопровождается существенным восстановлением уровня сигналов Al 2р и Cl 2р, зарегистрированных для графитового образца (см. фиг. 5b, с). Наблюдаемые остающиеся сигналы Al и Cl относятся к захваченным/адсорбированным частицам в графитовом образце, исследованном с помощью XPS на большой площади. Кроме того, элементное отображение на основе AES с высоким пространственным разрешением единственного графитового нитевидного кристалла в полностью заряженной 3D графитовой пене выявило Оже-сигналы Al и Cl, равномерно распределенные по графитовому нитевидному кристаллу (фиг. 5d, е), снова подтверждая интеркаляцию анионов хлоралюмината. В полностью разряженном состоянии отображение AES показало деинтеркаляцию анионов из графита с намного более низкими наблюдаемыми Оже-сигналами Al и Cl (фиг. 5f, g). Эти результаты спектроскопии выявили, что в перезаряжаемом Al-элементе происходит интеркаляция/деинтеркаляция ионов хлоралюмината в окислительно-восстановительных реакциях графита.
Было обнаружено, что алюминиевая батарея имеет способность к механическому изгибанию и складыванию (фиг. 16) благодаря гибкости материалов электрода и разделителя. Эти свойства могут быть другим желательным свойством батареи. Кроме того, пакетные элементы алюминиевой батареи просверливались насквозь во время работы батареи, и никакой угрозы безопасности не наблюдалось благодаря невоспламеняемости электролита с ионной жидкостью на воздухе. В целом, улучшенная алюминий-ионная батарея разработана с использованием улучшенных материалов графитового катода с циклической стабильностью вплоть до 7500 или более циклов заряда/разряда без заметного разрушения при сверхвысоких плотностях тока. Al-графитовая батарея может выдавать плотность энергии приблизительно 40 Втч кг-1 или более (сравнимую со свинцово-кислотными и Ni-марганцевыми батареями) и высокую плотность мощности, вплоть до приблизительно 3000 Вт кг-1 или более (подобно суперконденсаторам). Плотности энергии/мощности вычислялись на основе емкости катода приблизительно 65 мАч г-1 и массы активных материалов в электродах и электролите. Перезаряжаемые алюминиевые батареи имеют преимущества по низкой стоимости, высокой безопасности, большой продолжительности работы без заметного разрушения, высокой скорости/мощности и механической гибкости.
Материалы и способы
Приготовление электролитов с ионной жидкостью. Электролит с основе ионной жидкостью при комнатной температуре был изготовлен путем смешивания хлорида 1-этил-3-метилимидазолия ([EMIm]Cl, 97%, Acros Chemical) и безводного хлорида алюминия (AlCl3, 99,999%, Sigma Aldrich). ([EMIm]Cl выдерживался при температуре около 130°С в условиях вакуума в течение приблизительно 16-32 часов для удаления остаточной воды. Электролиты с ионной жидкостью ([EMIm]AlxCly) были приготовлены в перчаточной камере в аргоновой атмосфере (оба материала, ([EMIm]Cl и AlCl3, проявляют высокую гигроскопичность) посредством смешивания безводного AlCl3 с [EMIm]Cl. Полученная в результате светло-желтая прозрачная жидкость размешивалась при комнатной температуре в течение приблизительно 10 минут. Мольное отношение AlCl3 к [EMIm]Cl варьировалось от приблизительно 1,1 до приблизительно 1,8. Содержание воды в ионной жидкости определялось (около 500-700 ppm) с использованием кулонометрического прибора для титрования Карла Фишера, DL 39 (MettlerToledo). Преобладающими анионами в основном расплаве (AlCl3/[EMIm]Cl мольное отношение <1) являются Cl- и AlCl4-, в то время как в кислотных расплавах (AlCl3/[EMIm]Cl мольное отношение >1) образуются анионы хлоралюмината, такие как Al2Cl7-, Al3Cl10- и Al4Cl13-. Соотношение анионов к катионам в электролите AlCl3/[EMIm]Cl определялось с использованием фильтрующей стекловолоконной бумаги (Whatman GF/D), загруженной с покрытым золотом шариком SiO2, размером приблизительно 4-8 мкм, в элемент типа кюветы (0,35 мл, Stama Cells) с произвольной ориентацией кварцевых окон. Затем, в перчаточной камере элемент типа кюветы была заполнен AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3. Спектр комбинационного рассеяния (200-650 см-1) был получен с использованием 785-нм лазера с разрешением 2 см-2. Данные спектра комбинационного рассеяния были получены с поверхности покрытого золотом шарика SiO2, чтобы получить преимущество от поверхностного улучшенного спектра (фиг. 7).
Приготовление 3D графитовой пены. Никелевые пены (Alantum Advanced Technology Materials (Шэньян, Китай) использовались в качестве 3D поддерживающих подложек для наращивания 3D графита методом химического осаждения из паровой фазы (CVD). Никелевые пены нагревались до приблизительно 1000°C в горизонтальной трубчатой печи (Lindberg Blue М, TF55030C) в среде аргона (около 500 см3 мин, кубических сантиметров в минуту) и водорода (около 200 см3 мин) и отжигались примерно 10 мин для очистки поверхности и удаления тонкого поверхностного оксидного слоя. Затем СН4 вводится в реакционную трубку при давлении окружающей среды с расходом около 10 см3 мин, в соответствии с концентрацией 1,4 об. % в общем газовом потоке. После примерно 10 мин подачи потока реакционной газовой смеси образцы быстро охлаждались до комнатной температуры со скоростью около 300°С мин-1 в Ar (около 500 см3 мин) и Н2 (около 200 см3 мин). На никелевые пены, покрытые графитом, наносилось покрытие путем окунания в раствор поли(метилакрилата) (РММА) (около 4,5% в этил ацетате), а затем они выдерживались при температуре около 110°С в течение приблизительно 0,5 часа. Структура РММА/графен/Ni пены была получена после затвердевания. Затем эти образцы были помещены в раствор HCl приблизительно 3М на 3 часа, чтобы по существу полностью растворилась никелевая пена для получения РММА/графит при температуре около 80°С. И в заключение чистый 3D графит был получен посредством удаления РММА в горячем ацетоне при температуре около 55°С и температурной обработки в NH3 (около 80 см3 мин) при температуре около 600°С в течение приблизительно 2 часов, а затем температурной обработки на воздухе при температуре около 450°С в течение приблизительно 2 часов. Микроструктура 3D графита исследовалась с помощью РЭМ анализа с использованием растрового электронного микроскопа FEIXL30 Sirion (фиг. 3а).
Приготовление стекловидного углерода (GC). Стекловидный углерод использовался в качестве токового коллектора в элементе типа swagelok. Приблизительно 72 г фенола (Sigma-Aldrich) и приблизительно 4,5 мл гидроксида аммония (30%, Fisher Scientific) были растворены приблизительно в 100 мл раствора формальдегида (37%, Fisher Scientific) в противотоке, при интенсивном перемешивании. Раствор размешивался при температуре около 90°С до тех пор, пока он не превратился в раствор молочно-белого цвета. Для удаления воды и получения фенольной смолы использовалось роторное испарение. Фенольная смола затвердевала при температуре около 100°С в пресс-форме (стеклянная трубка  дюйма), а затем карбонизировалась при температуре около 850°С в атмосфере аргона в течение почти четырех часов для получения стержня из стекловидного углерода (GC стержень). Полученный в результате стержень из стекловидного углерода добавлял незначительную емкость к катоду.
дюйма), а затем карбонизировалась при температуре около 850°С в атмосфере аргона в течение почти четырех часов для получения стержня из стекловидного углерода (GC стержень). Полученный в результате стержень из стекловидного углерода добавлял незначительную емкость к катоду.
Электрохимические измерения. Перед тем как собрать Al/графитовый элемент в перчаточной камере, все компоненты были нагреты в условиях вакуума при температуре около 60°С в течение приблизительно 12 часов для удаления остаточной воды. Все электрохимические тесты выполнялись при температуре 25±1°С. Элемент типа swagelok (стеклянная трубка  дюйма) была сконструирована с использованием приблизительно 4 мг фольги (0,017 мм, Suzhou Dasen Electronics Materials) из пиролитического графита для катода и приблизительно 90 мг алюминиевой фольги (0,25 мм, Alfa Aesar) для анода. Стержень (10 мм) из стекловидного углерода
дюйма) была сконструирована с использованием приблизительно 4 мг фольги (0,017 мм, Suzhou Dasen Electronics Materials) из пиролитического графита для катода и приблизительно 90 мг алюминиевой фольги (0,25 мм, Alfa Aesar) для анода. Стержень (10 мм) из стекловидного углерода  дюйма использовался в качестве токового коллектора для катода из пиролитического графита, а графитовый стержень (10 мм)
дюйма использовался в качестве токового коллектора для катода из пиролитического графита, а графитовый стержень (10 мм)  дюйма использовался для алюминиевого анода. Шесть слоев фильтровальной бумаги из стекловолокна (Whatman 934-АН) в
дюйма использовался для алюминиевого анода. Шесть слоев фильтровальной бумаги из стекловолокна (Whatman 934-АН) в  дюйма размещались между анодом и катодом. Затем около 1,0 мл электролита на основе ионной жидкости (приготовленного с мольным отношением AlCl3/[EMIm]Cl приблизительно 1,1, приблизительно 1,3, приблизительно 1,5 и приблизительно 1,8) вводилось в ячейку, и она запечатывалась. Затем элемент Al/пиролитический графит заряжался (до приблизительно 2,45 В) и разряжался (до приблизительно 0,01 В) при плотности тока около 66 мА г-1 с помощью измерительного прибора MTI для проверки аккумуляторов (BST8-WA), чтобы идентифицировать идеальное мольное отношение AlCl3/[EMIm]Cl (фиг. 7). Чтобы исследовать кулоновскую эффективность элемента Al/пиролитический графит в электролите AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3, элемент заряжался до приблизительно 2,45 В, приблизительно 2,5, приблизительно 2,55 и приблизительно 2,60 В соответственно и разряжался до приблизительно 0,4 В при плотности тока около 66 мА г-1 (фиг. 11а). Для испытаний циклической стабильности элемент Al/пиролитический графит, в котором использовался электролит AlCl3/[EMIm]Cl (мольное отношение приблизительно 1,3), заряжался/разряжался при плотности тока около 66 мА г1 (фиг. 2b, с). Для изучения С-уровня (C-rate) элемента Al/пиролитический графит, плотность тока варьировалась от приблизительно 66 до приблизительно 264 мА г-1 (фиг. 12). Количество электролита было понижено до приблизительно 0,02 мл на 1 мг материала катода, при этом наблюдалась аналогичная работа элемента (фиг. 9). Дальнейшее уменьшение количества электролита возможно посредством инженерной разработки элемента батареи.
дюйма размещались между анодом и катодом. Затем около 1,0 мл электролита на основе ионной жидкости (приготовленного с мольным отношением AlCl3/[EMIm]Cl приблизительно 1,1, приблизительно 1,3, приблизительно 1,5 и приблизительно 1,8) вводилось в ячейку, и она запечатывалась. Затем элемент Al/пиролитический графит заряжался (до приблизительно 2,45 В) и разряжался (до приблизительно 0,01 В) при плотности тока около 66 мА г-1 с помощью измерительного прибора MTI для проверки аккумуляторов (BST8-WA), чтобы идентифицировать идеальное мольное отношение AlCl3/[EMIm]Cl (фиг. 7). Чтобы исследовать кулоновскую эффективность элемента Al/пиролитический графит в электролите AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3, элемент заряжался до приблизительно 2,45 В, приблизительно 2,5, приблизительно 2,55 и приблизительно 2,60 В соответственно и разряжался до приблизительно 0,4 В при плотности тока около 66 мА г-1 (фиг. 11а). Для испытаний циклической стабильности элемент Al/пиролитический графит, в котором использовался электролит AlCl3/[EMIm]Cl (мольное отношение приблизительно 1,3), заряжался/разряжался при плотности тока около 66 мА г1 (фиг. 2b, с). Для изучения С-уровня (C-rate) элемента Al/пиролитический графит, плотность тока варьировалась от приблизительно 66 до приблизительно 264 мА г-1 (фиг. 12). Количество электролита было понижено до приблизительно 0,02 мл на 1 мг материала катода, при этом наблюдалась аналогичная работа элемента (фиг. 9). Дальнейшее уменьшение количества электролита возможно посредством инженерной разработки элемента батареи.
Фольга пиролитического графита была синтезирована с помощью пиролиза полиамида при высокой температуре, во время которого образуются некоторые ковалентные связи. Фольга из природного графита была изготовлена посредством сжатия расширенных графитовых хлопьев, что приводит к образованию стопок слоев из хлопьев природного графита за счет взаимных ван-дер-ваальсовых связей. Аналогичные характеристики батареи наблюдались с электродами из пиролитического графита и графитовой фольги, показывая, что поведение батареи было производным от характеристики графита для электродов (фиг. 13с). Однако, поскольку фольга из природного графита синтезируется посредством сжатия набухших порошков из природного графита без взаимных ковалентньгх связей, эти виды фольги могут проявлять интенсивное расширение электрода, заметное невооруженным глазом, в то время как фольга из пиролитического графита не показывает заметного расширения электрода благодаря ковалентным связям (фиг. 13a, b).
Пакетные элементы типа "pouch cells" были собраны в перчаточной камере, используя катод из 3D графитовой пены (около 3 мг) и анод из алюминиевой фольги (около 70 мг), которые разделяются двумя слоями фильтровальной бумаги из стекловолокна для предотвращения короткого замыкания. Детали из никелевой фольги (размером 0,09×3×60 мм3) использовались как токовые коллекторы для катода и для анода. Электролит (около 2 мл, приготовленный с использованием AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3) вводился в ячейку, и элемент закрывался с использованием устройства для термосклеивания. Элемент удалялся из перчаточной камеры для испытаний на циклическую стабильность, при этом элемент заряжался/разряжался при плотности тока около 4000 мА г-1 (фиг. 2b, с). Для определения С-уровня и поведения элемента Al/3D графит при быстром заряде/медленном разряде использовались различные плотности тока, приблизительно 100-5000 мА г-1 (фиг. 14 и фиг. 3d). Пакетный элемент был заряжен до приблизительно 2,42 В и разряжался до напряжения отсечки, приблизительно 0,5 В, чтобы сдерживать реакцию растворения никелевой фольги в электролите с ионной жидкостью.
Измерения циклических вольтамперометрических кривых (CV) выполнялись с использованием стабилизатора напряжения/гальваностата модели CHI 760D (СП Instrument) в трехэлектродном режиме. Рабочим электродом была алюминиевая фольга или фольга пиролитического графита, вспомогательный электрод включал алюминиевую фольгу, и алюминиевая фольга использовалась в качестве электрода сравнения. Медная лента прикреплялась к этим электродам в качестве токового коллектора. Все три электрода были помещены в пластиковую ячейку в виде кюветы (1,5 мл) (содержащую электролит AlCl3/[EMIm]Cl, молярное отношение приблизительно 1,3) в перчаточной камере, ячейка затем герметизировалась с помощью резинового колпачка с использованием зажима. Диапазон сканирующего напряжения был установлен приблизительно от -1,0 до 1,0 В (относительно алюминия) для алюминиевой фольги и приблизительно от 0 до 2,5 В (относительно А1) для графитового материала, скорость сканирования составляла приблизительно 10 мВ с-1 (фиг. 4а). Для исследования рабочего диапазона напряжения электролита без интеркалирования катода, выполнялось двухэлектродное измерение с использованием катода в виде стержня стекловидного углерода (GC) против алюминиевого анода в ячейке типа Swagelok в электролите AlCl3/[EMIm]Cl (мольное отношение приблизительно 1,3). Диапазон сканирующего напряжения был установлен от 0 до 2,9 В при скорости сканирования 10 мВ с-1 (фиг. 11b).
Для демонстрации высокой гибкости Al/графитовой элемента, пакетный элемент был собран в перчаточной камере посредством помещения фильтровальной бумаги из стекловолокна между анодом в виде тонкой алюминиевой фольги (около 20-50 мг) и катодом в виде фольги пиролитического графита (около 20-30 мг) с подходящим количеством (около 0,05 мл на 1 мг графитовой фольги) электролита в виде ионной жидкости (AlCl3/[EMIm]Cl, мольное отношение приблизительно 1,3). Элемент Al/графит был способен запитывать красный СИД как в неизогнутом состоянии, так и в изогнутом состоянии (фиг. 16). Как часть испытания на стабильность выполнялся тест на проникновение металлического сверла с использованием полностью заряженного элемента Al/пиролитический графит, присоединенного к красному СИД. Рабочее напряжение элемента Al/пиролитический графит составляло около 1,7 В. Острое сверло из нержавеющей стали внедрялось в центр корпуса элемента с постоянной скоростью.
Изучение графитового катод во время заряда и разряда с помощью рентгеновской дифрактометрии и спектроскопии комбинационного рассеяния in-situ. Для изучения с помощью рентгеновской дифрактометрии (XRD) ex-situ элемент с Al/графитовыми материалами (PG) (в конфигурации Swagelok) заряжался и разряжался при постоянной плотности тока около 66 мА г-1. Реакции были остановлены после зарядной емкости 30 мАч г-1 полной зарядной емкости (приблизительно 62 мАч г-1), и разрядной емкости приблизительно 40 мАч г-1 после того, как емкости зарядная/разрядная емкости находились в стабильном состоянии. Также был подготовлен полностью заряженный (приблизительно 62 мАч г-1) 3D графит. После каждой реакции, заряда и разряда, графитовый катод удалялся из элемента в перчаточной камере. Чтобы избежать реакции между катодом и воздухом/влагой в окружающей атмосфере, катод размещался на предметное стекло, а затем заворачивался в ленту типа "скотч". Завернутые образцы были немедленно удалены из перчаточной камеры для измерения ex-situ XRD, которое выполнялось с помощью инструмента PANalyticalX'Pert (фиг. 4b и фиг. 15b).
Во время процесса заряда/интеркаляции анионов пик (002) графита по существу полностью исчезает и появляются два новых пика. Структура интенсивности сигналов является примером для GIC (интеркалированного соединения графита) ступени внедрения n, где наиболее доминирующим пиком является (00n+1), а вторым наиболее доминирующим пиком является (00n+2). При увеличении состояния заряда от приблизительно уровня в 48-60% (около 30 мАч г-1) до полностью заряженного состояния (около 62 мАч г-1) расстояние между пиками (00n+1) и (00n+2) постепенно увеличивалось, поскольку большее количество анионов AlxCly- интеркалировалось. Посредством определения соотношения d(n+2)/d(n+1) между положением пиков и корреляции их с отношениями GIC чистых стадий, может быть назначена фаза наиболее доминирующей ступени внедрения в наблюдаемом GIC. После назначения (00l) индексов, расстояния (Тс) периодического повторения, высоты (di) канала интеркаляции и расширения (Δd) канала могут быть вычислены с использованием уравнения:
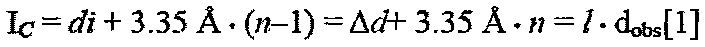
Где l является индексом (00l) плоскостей, ориентированных в направлении стопки слоев, а dobs - наблюдаемая величина расстояния между двумя соседними плоскостями.
Для одновременного использования in-situ спектроскопии комбинационного рассеяния и измерений гальваностатической реакции заряда/разряда использовался элемент в виде кюветы (0,35 мл, Stama Cells) со случайной ориентацией кварцевых волноводных окон. Алюминиевая фольга и графитовый материал (пиролитический графит или 3D графит) использовались как анод и катод соответственно. Электролит был смешанным: AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3. Электрохимический элемент собирался в перчаточной камере, в соответствии с упомянутым выше процессом. Спектр комбинационного рассеяния получался (1500-1700 см-1) с использованием HeNe лазера (633 нм) с разрешением 2 см-1. Спектральные данные были собраны после нескольких последовательных сканирований заряда/разряда между приблизительно 2,45 и приблизительно 0,01 В при плотности тока около 66 мА г-1 (графит PG) (фиг. 4с) или около 1000 мА г-1 (графит 3D) (фиг. 15а).
Измерения рентгеновской фотоэмиссионной спектроскопии (XPS) и электронной оже-спектроскопии (AES). Элементы Al/трехмерный графит были полностью заряжены/разряжены при плотности тока около 4000 мА г-1. Затем элементы Al/трехмерный графит транспортировались в перчаточную камеру для подготовки к анализам ХР8 и AES. Полностью заряженные/разряженные детали из пены трехмерного графита были собраны из пакетных ячеек и вымыты в безводном метаноле для удаления остаточного электролита в виде ионной жидкости AlCl3/[EMIm]Cl. Непосредственно после ополаскивания детали из пены трехмерного графита были прикреплены к кремниевой пластине и обжигались при температуре приблизительно 90°С в течение приблизительно 10 минут для удаления остаточного метанола. Образцы были запечатаны в пластиковый пакет, чтобы избежать загрязнения посредством реакции с влагой и кислородом перед снятием характеристик с помощью рентгеновской фотоэмиссионной спектроскопии (XPS) и электронной оже-спектроскопии (AES). Электронная оже-спектроскопия была получена с помощью работы PHI 700 Scanning Auger Nanoprobe при 10 кВ и 10 нА. Рентгеновская фотоэмиссионная спектроскопия (XPS) выполнялась с помощью устройства PHI VersaProbe Scanning XPS Microprobe (фиг. 5).
Измерения TGA. Полностью заряженные катоды из пиролитического графита были вымыты с помощью метанола в течение приблизительно 24 часов для удаления остаточного электролита в виде ионной жидкости AlCl3/[EMIm]Cl. Непосредственно после промывки образцы из пиролитического графита обжигались при температуре приблизительно 850°С в течение около 3 часов в воздушной атмосфере. Непосредственно после обжига образцы (в виде белой пены) собирались, взвешивались и анализировались на сканирующем электронном микроскопе с помощью рентгеноспектрального электронно-зондового микроанализа (SEM-EDX) для изучения химического соединения (фиг. 4d). Анализы с помощью SEM и EDX выполнялись с использованием растрового электронного микроскопа FEIXL30 Sirion.
Пример 2
Расширенный пиролитический графит для сверхбыстрого катода.
Алюминиевые батареи конструировались в виде пакетных ячеек, использующих алюминиевую фольгу (толщиной приблизительно 15-250 мкм) в качестве анода и катод из фольги (толщиной приблизительно 17 мкм) из пиролитического графита (PG) в электролите AlCl3/1-этил-3-метилимидазолий хлорид ([EMIm]Cl) на основе ионной жидкости (остаточная вода составляет приблизительно 400 миллионных долей). Затем элементы Al/пиролитический графит заряжалась при постоянном напряжении приблизительно 2,5 В в течение около 24 часов. Катод из пиролитического графита (PG) был извлечен из пакета после заряда и промыт этанолом и водой для удаления остаточного электролита в виде ионной жидкости. Фольга из пиролитического графита расширялась посредством быстрого нагревания после интеркаляции/заряда в алюминий-ионной батарее, а затем электрохимической реакции выделения водорода в основном растворе (приблизительно 10М NaOH гидроксида натрия с насыщенным ацетатом натрия (NaAc)) (фиг. 17). Выделившийся водород дополнительно расширяет материал, и он превращается в высокопористую структуру, в то же время поддерживая способность к электрическому соединению (от приблизительно 17 мкм до приблизительно 1 см). Вторичный расширенный пиролитический графит повторно промывался с помощью деионизированной воды для удаления остаточного или лиофилизированного гидроксида натрия NaOH или ацетата натрия (NaAc). Расширенный пиролитический графит имеет высокую пористость и может использоваться для того, чтобы изготавливать сверхбыстрый катод для алюминиевых батарей.
Пример 3
Пакетный элемент с расширенным пиролитическим графитом, работающий при постоянном напряжении заряда. Пакетные элементы были собраны в перчаточной камере с использованием катода из пиролитического графита (около 57 мг) и анода из алюминиевой фольги, которые разделяются двумя слоями фильтровальной бумаги из стекловолокна для предотвращения короткого замыкания. Бумага из углеродного волокна (CFP) использовалась в качестве заднего контакта пиролитического графита с никелевым пруток в качестве токового коллектора для катода, кроме того никелевый пруток использовался как токовый коллектор для анода. Затем вводился электролит (около 2,8 г, приготовленный с использованием AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3) и элемент герметизировался после нагревания. Затем элементы Al/пиролитический графит заряжались при постоянном напряжении приблизительно 2,45 В в течение около 1 часа, и разряжались (до приблизительно 0,5 В) при плотности тока около 66 мА г-1 показывая хорошую емкость и высокую стабильность (фиг. 18).
Пример 4
Электрохимическое высушивание воды из батареи. Пакетные элементы были собраны в перчаточной камере с использованием анода из алюминиевой фольги (толщиной около 15-250 мкм) и катода из пиролитического графита (PG), которые разделяются двумя слоями фильтровальной бумаги из стекловолокна. Предварительно высушенный электролит (остаточная вода составляет приблизительно 400 миллионных долей, электролит приготовлен с использованием AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3) вводится в ячейку, и она закрывается с использованием устройства для термосклеивания. Затем элемент Al/пиролитический графит заряжался (при напряжении приблизительно 2,45 В), и разряжался (до приблизительно 0,5 В) при плотности тока около 66 мА г-1. Газ водород H2 от реакции выделения водорода из остаточной воды заполнял пакет после нескольких циклов. Затем пакет протыкался иглой, чтобы высвободить газ и заново герметизировался. Это повторялось до тех пор, пока пакетный элемент больше не наполнялся газом после того, как три раза газ выпускался. Предполагается, что остаточная вода в электролите расходовалась посредством разложения и электрохимического превращения в газ Н2 во время заряда батареи, обеспечивая способ для электрохимического высушивания электролита батареи до высокой степени высушивания.
Пример 5
Этот пример описывает улучшенную систему алюминий-ионной батареи, использующей гибкую графитовую фольгу в качестве катода, комбинированную с гибким алюминиевым анодом в невоспламеняющимся электролите AlCl3 - ([EMIm]Cl) на основе ионной жидкости с оптимальным составом. Батарея Al/графит (A1/GF) показывает плоскую площадку при разрядке в диапазоне приблизительно 2,25-1,5 В и обеспечивает удельную емкость вплоть до приблизительно 127 мАч г-1 или более, основываясь на массе катода из графитовой фольги. Были исследованы процессы интеркаляции и деинтеркаляции анионов ионной жидкости в графитовый катод, в результате чего выявилось большое увеличение разнесения промежуточного слоя графита вследствие электрохимической интеркаляции анионов AlxCly-. Циклическая стабильность заряда-разряда батареи Al/графитовая фольга (Al/GF) показывает удерживание приблизительно 100% емкости батареи при превышении 300 циклов, кулоновская эффективность приблизительно 98-100%. Батарея Al/графит с высокой экономической эффективностью, безопасностью и высоким напряжением представляет улучшенную систему аккумулирования энергии.
Компоненты батареи Al/графит. С помощью систематического исследования полных характеристик была произведена следующая идентификация среди различных форм углеродных материалов, включающих в себя, например, графитовую фольгу (GF), бумагу из углеродного волокна (CFP), пленки из углеродной сажи (СВ), и различные формы графитовых материалов: алюминиевая фольга (толщина около 15-250 мкм) в качестве желательного анода, графитовая фольга в качестве желательного катода; а также оптимальный электролит на основе ионной жидкости AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3 (например, более чем приблизительно 1,1). Материал катода варьировался и элементы Al/графитовая фольга испытывались при медленном заряде/разряде и плотности тока приблизительно 6,6 мА г-1 (около С/10), чтобы максимизировать удельную емкость. Элемент Al/графитовая фольга показывает значительно более высокую удельную емкость (приблизительно 74 мАч г-1) по сравнению с элементами Al/бумага из углеродного волокна (CFP) (приблизительно 27 мАч г-1) и Al/углеродная сажа (СВ) (приблизительно 36 мАч г-1), но с аналогичными плоскими участками на кривой напряжения, на приблизительно 2,25-1,5 В (см. фиг. 19а). Более высокая емкость может быть извлечена благодаря высокой проводимости и структурной способности к подключению графитовой фольги и большого расстояния между слоями графитовой слоистой структуры по сравнению с ограниченным разнесением неграфитовых структур, таких как бумага из углеродного волокна и углеродная сажа. На стороне анода металлический алюминий может осаждаться из электролита в виде ионной жидкости AlCl3 - ([EMIm]Cl) (когда мольное отношение AlCl3 к [EMIm]Cl больше чем 1).
Характеристики алюминий-ионной батареи зависят от состава электролита и идентификация оптимального состава электролита в виде ионной жидкости AlCl3-([EMIm]Cl) желательна для перезаряжаемой алюминий-ионной батареи с высокими рабочими характеристиками. Характеристики заряда/разряда элемента Al/графитовая фольга изучались при различных мольных отношениях AlCl3 к [EMIm]Cl (от приблизительно 1,1 до приблизительно 2,7) для оптимизации, как показано на фиг. 19b. В электролите AlCl3/[EMIm]Cl на основе ионной жидкости мольное отношение составляет приблизительно 1,1, элемент Al/графитовая фольга может не заряжаться и разряжаться обратимым образом (см. фиг. 19b), что было вызвано отсутствием или низким содержанием аниона Al2Cl7 в случае отношения AlCl3/[EMIm]Cl, равного приблизительно 1,1. Анион Al2Cl7 является главной ионной формой соединения для электроосаждения алюминия во время процесса заряда. Недостаток аниона Al2Cl7 будет вызывать неспособность заряда элемента Al/графитовая фольга при низкой концентрации этих анионов. Другие попытки ранее используемых очень низких отношений AlCl3/[EMIm]Cl и AlCl3/[bbim]Br, составляющих соответственно 1,1-1,2 и 0,5 для алюминиевых батарей, при выполнении условия, обоснованного этим примером, будет нежелательным для перезаряда алюминия в некоторых вариантах осуществления изобретения. Важно отметить, что емкость батареи Al/графитовая фольга чрезвычайно увеличивается, когда мольное отношение AlCl3/[EMIm]Cl немного увеличивается от приблизительно 1,1 до приблизительно 1,3 (фиг. 19b), а затем уменьшается, когда мольное отношение AlCl3/[EMIm]Cl было больше, чем приблизительно 1,5 (см фиг. 19b). Таким образом, было идентифицировано, что оптимальное соотношение в электролите AlCl3/[EMIm]Cl на основе ионной жидкости составляет приблизительно 1,3-1,5.
Оптимальное соотношение ионов AlCl4- и Al2Cl7- при определенном соотношении AlCl3 к [EMIm]Cl может давать увеличение до максимальной емкости батареи посредством балансировки ионов, участвующих в электрохимических реакциях, во время которых происходит интеркаляция AlCl4-/Al2Cl7- в графит на катоде и восстановительная реакция ионов Al2Cl7- с алюминием на аноде. Батарея Al/графитовая фольга показывает самую высокую удельную емкость вплоть до 47 мАч г-1 или более при отсечке напряжения заряда около 1,5 В в электролите AlCl3 /[EMIm]Cl с мольным отношением приблизительно 1,3-1,5 (фиг. 19b), когда отношение ионов AlCl4- к ионам Al2Cl7- находилось в диапазоне приблизительно 2,33-1. Сбалансированная концентрация ионов AlCl4- и Al2Cl7- может способствовать окислительно-восстановительным реакциям на обоих электродах. Кроме того, батарея Al/графитовая фольга в электролите AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3 показывала плоский участок кривой высокого напряжения при разряде в диапазоне 2,25-1,5 В. Для дополнительного увеличения удельной емкости батареи Al/графитовая фольга было установлено более высокое напряжение отсечки (приблизительно 2,5 В) при заряде. Удельная емкость была увеличена от приблизительно 66 мАч г-1 (около 2,2 В) до приблизительно 127 мАч г-1 (около 2,5 В) (фиг. 19с). Высокие напряжения заряда или большее время заряда были определены в качестве причин увеличения разрядной емкости, которая имела отношение к увеличенной интеркаляции графитовой фольги посредством анионов Al-Cl и постепенного расширения графита. Однако возможно появление побочной реакции во время заряда батареи Al/графитовая фольга при более высоком напряжении отсечки (например, приблизительно 2,5 В), что может привести к более низкой кулоновской эффективности.
Свойства батареи Al/графит в циклических процессах. Большая часть расширения графита происходит во время первых циклов батареи в стадии активизации батареи. Как только устойчивая стадия достигнута, продолжительные циклические измерения показывают, что батарея Al/графитовая фольга все еще удерживает приблизительно 100% удельной емкости (около 66 мАч г-1) после 300 циклов или более при плотности тока приблизительно 33 мА г-1 (приблизительно С/2), с кулоновской эффективностью около 98-100% (см. фиг. 20а). Кроме того, батарея Al/графитовая фольга поддерживала плоский участок высокого напряжения разряда (приблизительно 2,5-1,5 В) после 200 циклов или более заряда/разряда (см. вставку на фиг. 20а), создавая осуществимую и многообещающую ячейку для аккумулирования энергии. Никакого спада емкости батареи не наблюдалось до тех пор, пока осуществлялось обслуживание для подавления короткого замыкания электрода, вызванного чрезмерным расширением графитового катода. Измерение скоростной характеристики показало, что элемент Al/графитовая фольга в электролите AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3 проявляет превосходную циклическую стабильность при различных скоростях, с кулоновской эффективностью около 98-100% (см. фиг. 20b). Высокая емкость, составляющая приблизительно 67 мАч г-1), была получена при плотности тока заряда/разряда около 16,5 мА г-1 (С-уровень приблизительно равен С/4) в конце измерения. Однако, когда С-уровень увеличивается от приблизительно С/2 (около 33 мА г-1) до приблизительно 1С (около 66 мА г-1) и приблизительно 3С (около 198 мА г-1), элемент Al/графитовая фольга выдает уменьшенные емкости, соответственно составляющие приблизительно 24 мАч г-1 и 16 мАч г-1 (см. фиг. 20b). Пониженная емкость при более высокой скорости была, возможно, вследствие природы механизма интеркаляции/деинтеркаляции с ограниченной диффузией. Кроме оценки характеристик заряда/разряда посредством выполнения гальваностатических циклов (фиг. 20а и 20b), также проводились исследования характеристик циклических вольтамперных кривых (CV) батареи Al/графитовая фольга. Электрохимическое поведение анода из алюминиевой фольги и катода из графитовой фольги в электролите AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3 исследовались с помощью вольтамперных кривых при скорости сканирования 10 мВ с-1 (фиг. 20с). Волна восстановления (от приблизительно -0,62 до приблизительно -0,08 В относительно алюминия) при сканировании вперед и единственная волна окисления (от приблизительно -0,08 до приблизительно 0,85 В относительно алюминия) при обратном сканировании наблюдались на алюминиевом аноде (фиг. 20с, левый график). Восстановление и окисление относятся к осаждению и растворению алюминия соответственно. Наблюдения показывают, что алюминиевый анод проявляет стабильное обратимое поведение в отношении осаждения и растворения в оптимизированном электролите AlCl3 - [EMIm]Cl. На стороне катода из графитовой фольги волна окисления (приблизительно 1,88-2,5 В относительно алюминия) и волна восстановления (приблизительно 0,9-2,01 В) были получены в электролите на основе ионной жидкости AlCl3 - [EMIm]Cl, как показано в правой части фиг. 20с. Окисление и восстановление относятся к интеркаляции/деинтеркаляции анионов в/из графита соответственно. Вероятно, что анион, вовлекаемый в интеркаляцию, является AlCl4-, в соответствии с составом ионов в электролите AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3. Диапазон напряжения (приблизительно 0,9-2,5 В) при интеркаляции/деинтеркаляции аниона AlCl4- (фиг. 20с) согласовывался с диапазоном напряжения на катоде другого спаренного графитового элемента (приблизительно 0,9-2,15 В относительно алюминия) (интеркаляция EMI+ в графит на стороне анода и интеркаляция AlCl4- в графит на стороне катода). Несмотря на то, что ион Al2Cl7- имеет больший размер, размер анионов AlCl4- и Al2Cl7- вдоль одного измерения является аналогичным. Ион Al2Cl7- может все еще вовлекаться в процесс интеркаляции/деинтеркаляции в графит как нежелательная реакция во время реакции заряда/разряда батареи Al/графитовая фольга. Кроме того, реакции электрохимической интеркаляции, происходящие на графитовом катоде, дополнительно подтверждались наглядным свидетельством видимого невооруженным глазом расширения графита после повторяющихся циклов заряда и разряда (фиг. 21с). Хотя предполагалось, что окисление графита в электролите AlCl3 - [EMIm]Cl включает в себя интеркаляцию хлора Cl2, потенциал такой окислительной интеркаляции приблизительно на 0,6 В выше, чем потенциал интеркаляции аниона AlCl4-. Поэтому интеркаляция анионов AlCl4- и Al2Cl7- в графитовый катод должна быть доминирующим процессом во время разряда батареи. Элемент типа Swagelok с двумя электродами использовался для оценки циклической стабильности батареи Al/графитовая фольга в электролите AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3, глубина разряда около 100% (от приблизительно 2,5 до приблизительно 0,01 В) при фиксированной скорости сканирования 10 мВ с-1 (см. фиг. 20d). Как показано на фиг. 20d, емкости заряда и разряда батареи Al/графитовая фольга увеличиваются, а затем стабилизируются с увеличением циклов сканирования (что отображается увеличением площадей, окружаемых петлей) и достигают максимума емкости заряда/разряда после 50 циклов. Структура заряда-разряда батареи стабильно поддерживалась вплоть до 300 циклов, стабильно показывая высокую характеристику заряда-разряда батареи Al/графитовая фольга в электролите AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3 (см. фиг. 20d).
Механизм заряда-разряда батареи Al/графитовая фольга. Чтобы более глубокого понимания механизма процесса интеркаляции/деинтеркаляции, выполнялись измерения ex situ XRD и in situ спектроскопия комбинационного рассеяния графитового катода. Фиг. 21а показывает ex situ измерение дифракции рентгеновского излучения (XRD) графитового катода в элементе Al/графитовая фольга, циклично работавшем при постоянной плотности тока (около 33 мА г-1), элемент выполнил 10 циклов перед тем, как производились измерения. Графитовые катоды заряжались или разряжались до различных желаемых емкостей (подробности см. в разделе Способы). Фольга из чистого графита показала единственный (002) графитовый пик при угле 2θ = приблизительно 26,55° (d-расстояние = приблизительно 3,35 ангстрем) (фиг. 21а). После заряда батареи Al/графитовая фольга до приблизительно 60% полной емкости, пик (002) исчезает, и появляются два новых пика при угле приблизительно 27,44° (приблизительно 3,24 ангстрем) и приблизительно 24,13° (приблизительно 3,68 ангстрем) (фиг. 21а). Эта кривая интенсивности является примером для GIC (интеркалированные соединения графита) ступени внедрения n, где наиболее доминирующим пиком является пик (00n+1), а вторым наиболее доминирующим пиком является пик (00n+2). При увеличении состояния заряда от приблизительно 60% полной емкости расстояние между пиками (00n+1) и (00n+2) постепенно увеличивалось (фиг. 21а), по мере того как интеркалировалось большее количество анионов AlCl4- и Al2Cl7-. Посредством определения соотношения между пиковыми положениями d(n+2)/d(n+1) и коррелируя эти положения с соотношениями для GIC чистой ступени внедрения, возможно назначить наиболее доминирующую фазу ступени внедрения наблюдаемого GIC. При назначении индексов (00l) появляется возможность вычислять период повторяемости отражений (Ic), высоту (di) канала интеркалянта и расширение (Δd) канала. Соответственно, была вычислена высота (di) канала интеркалянта, которая должна приблизительно составлять 5,74 ангстрем, что аналогично теоретической длине анионов AlCl4- и Al2Cl7- (приблизительно 5,28 ангстрем) вдоль более короткой стороны, обеспечивая свидетельство интеркаляции анионов AlCl4- и Al2Cl7- в графит во время заряда. Дальнейшая деинтеркаляция приводит к обратному ступенчатому изменению перехода (см. дифрактограммы (XRD) при разряде приблизительно 60% и полном разряде на фиг. 21а). Пик (002) графита (приблизительно 3,35 ангстрем) повторно образовывался в полностью разряженном состоянии (фиг. 21а). Однако уширенный пик (002) графита наблюдался в дифрактограмме (XRD) полностью разряженного образца (фиг. 21а), по сравнению с пиком (002) фольги из чистого графита. Разница по ширине вероятно появляется вследствие уменьшения длины корреляции вдоль оси слоя. Это также может быть связано с тем, что некоторые анионы AlCl4- и Al2Cl7- остаются между слоями графита. Фиг. 21b показывает дифрактограммы (XRD) полностью заряженных графитовых образцов после выполнения 10 (с фиг. 21а), 25 и 100 циклов. Расстояние между пиками (00n+1) (приблизительно 3,19 ангстрем) и (00n+2) (приблизительно 3,72 ангстрем) остается, показывая, что батарея Al/графитовая фольга достигла стабильной емкости после выполнения 10 циклов. Фиг. 21с показывает фотографии графитовой фольги перед и после того, как она была заряжена в электролите в виде ионной жидкости AlCl3 /[EMIm]Cl, отображающие, что графитовая фольга расширилась приблизительно в 10 раз относительно первоначальной ширины после заряда в трех-электродной ячейке в виде кюветы. In situ спектроскопия комбинационного рассеяния использовалась для исследования интеркаляции анионов AlClx- в графитовую фольгу. Фиг. 21d отображает in situ спектр комбинационного рассеяния графитового катода во время заряда и разряда, значения напряжения на спектре соответствуют состояниям интеркаляции и деинтеркаляции анионов AlCl4- и Al2Cl7- в графит. В начале заряда (фиг. 21d, спектр приблизительно 0,59 В) и в конце разряда (фиг. 21d, спектр приблизительно 0,01 В) наблюдался типичный рамановский спектр графита с главным пиком G-полоса, составляющим приблизительно 1578 см-1. Начиная от спектра с приблизительно 1,91 В, выступающий пик с более высокими волновыми числами показал подъем G-полосы (фиг. 21d). Интенсивность выступающего пика чрезвычайно увеличивается и догоняет интенсивность первоначальной G-полосы (соответствует зарядному напряжению приблизительно 1,95 В), как показано на фиг. 21d. Расщепление G-полосы (приблизительно 1578 см-1) на двойной пик E2g2(i) (приблизительно 1578 см-1) и E2g2(b) (приблизительно 1600 см-1) в рамановском спектре является отображением интеркаляции ионов в графит. При более высоком зарядном напряжении элемента Al/графитовая фольга (приблизительно 1,95-2,20 В) G-полоса, приблизительно 1578 см-1, постепенно уменьшается и превращается в фоновый шум (см. спектр в диапазоне приблизительно 1,95-2,20 В на фиг. 3d), и острый пик в рамановском спектре, который окончательно наблюдался приблизительно при 1617 см-1 (полоса частот G2-полоса) (спектр приблизительно 2,20 В, фиг. 21d), соответствует интеркаляционным соединениям графита ступени внедрения 2. Во время разряда были видны противоположные тенденции, в соответствии с деинтеркаляцией анионов AlCl4- и Al2Cl7- из графитовой структуры (см. фиг. 21d). Интенсивность G2-полосы сначала постепенно увеличивается при уменьшении разрядного напряжения и смещается от приблизительно 1617 см-1 (G2) до приблизительно 1604 см-1 (E2g2(b)) (спектр в диапазоне приблизительно 2.18-1.76 В). Затем полоса (E2g2(b)) уменьшается и исчезает, после чего следует новое появление и рост первоначальной E2g2(i) (приблизительно 1578 см-1) (см. спектр в диапазоне приблизительно 1,73-0,01 В на фиг. 21d). Окончательный типичный рамановский спектр графита был восстановлен (спектр приблизительно при 0,01 В на фиг. 21d). Обратимые изменения ex situ XRD (фиг. 21а) и in situ спектроскопии комбинационного рассеяния (фиг. 2Id) в значительной степени подтвердили механизм интеркаляции/деинтеркаляции и высокую обратимость батареи Al/графитовая фольга.
Гибкая батареи Al/графит. Фиг. 22 показывает прочность гибкой батареи Al/графит, к которой подключен красный СИД. и от которой заряжается сотовый телефон при изогнутом состоянии батареи. Алюминиевый анод, стеклянный фильтрующий разделитель и графический катод герметизировались в термическом пакете со слоистой структурой, заполненном электролитом AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3 (см. фиг. 20а). Гибкая батарея Al/графит может давать питание и включать красный СИД в неизогнутом состоянии (фиг. 22b, с). Красный СИД сохранился в светоизлучающем состоянии, когда батарея была изогнута почти на 180° (фиг. 22b, с). Фиг. 22d показывает две батареи Al/графит, соединенные последовательно (присоединенные к преобразователю постоянного тока с пошаговым увеличением напряжения от приблизительно 3 В до приблизительно 5 В) для заряда смартфона, даже в изогнутом состоянии. Эти демонстрации показывают, что батарея Al/графит является практически реальным источником энергии для электронного оборудования следующего поколения, основанным на способных выдерживать изгибание, имплантируемых и пригодных для ношения устройствах.
Таким образом, эти примеры описывают улучшенную систему алюминий-ионной батареи, использующую гибкую графитовую фольгу в качестве катода, объединенную с алюминиевым анодом в электролите в виде ионной жидкости AlCl3/[EMIm]Cl. Батарея Al/графит показывает превосходные электрохимические свойства со стабильным поведением при выполнении циклической работы в течение более 200 циклов заряда-разряда, с высоким плоским участком при разряде на графике напряжения, диапазон приблизительно 2,25-1,5 В. Оценочная плотность энергии батареи Al/графит с графитовой фольгой в качестве катода перед алюминиевым анодом составляет приблизительно 662 Втч кг-1, что сравнимо с литий-ионной батареей. Теоретические емкости и энергозатраты для батареи Al/графит, включающей в себя графитовый катод, вычислены и показаны в таблице 1 на фиг. 23. Из этих вычислений видно, что батарея Al/графит имеет перевес над используемыми в технике существующего уровня литий-ионными батареями. Алюминиевая сторона батареи имеет очень высокую удельную емкость, составляющую приблизительно 2980 Ач/кг в некоторых вариантах осуществления изобретения. В некоторых вариантах осуществления изобретения удельная емкость со стороны катода устанавливает предел для емкости батареи и может достигать приблизительно 372 Ач/кг или более, допуская аналогичную степень интеркаляции, как у ионов лития в графит. Учитывая низкую стоимость и безопасную природу батарея Al/графит, эта батарея может использоваться в качестве источника энергии для различных вариантов потребления энергии, таких как электрические транспортные средства и портативные электронные устройства, также она может использоваться как устройства аккумулирования энергии для возобновляемой энергии и для замещения существующих в настоящее время литий-ионных батарей с лучшими конструкциями элемента и разработками передовых материалов. Способы
Приготовление электролитов на основе ионной жидкости. Электролит на основе ионной жидкости комнатной температуры изготавливался из хлорида 1-этил-3-метилимидазолия ([EMIm]Cl, 97%, Acros chemicals) и безводного хлорида алюминия (AlCl3, 98,5%, Acros chemicals). Приготовление электролитов на основе ионной жидкости AlCl3 - ([EMIm]Cl) производилось в заполненной аргоном перчаточной камере (AlCl3 обладает высокой реактивностью). Электролиты были приготовлены путем растворения хлорида алюминия AlCl3 в [EMIm]Cl и размешивания при комнатной температуре в течение приблизительно 10 минут, в результате чего получается светло-желтый прозрачный раствор. Мольное отношение AlCl3 к [EMIm]Cl варьировалось от приблизительно 0,8 до приблизительно 2,7. Доминирующими анионами в основных растворах (мольное отношение AlCl3/[EMIm]Cl <1) являются Cl- и AlCl4-. При добавлении избыточного количества AlCl3 к кислым растворам (мольное отношение AlCl3/[EMIm]Cl >1) формируются анионы хлоралюминатов, такие как Al2Cl7-, Al3Cl10- и Al4Cl13-.
Электрохимические измерения. Предварительные испытания двухэлектродного элемента выполнялись как в пластиковой ячейке в виде кюветы объемом 1,4 мл, так и в ячейке типа Swagelok размером  дюйма с анализатором MTI батареи (BST8-WA, Ричмонд). Алюминиевая фольга (толщиной приблизительно 0,015 мм, корпорация MTI) была выбрана в качестве анода, а катод из графитовой фольги (толщиной приблизительно 0,13 мм, GTA Flexible Graphite) был получен от компании GrafTech International, Ltd. Для сравнения, бумага из графитового волокна (GDL10 АА, SGL Carbon) и технический углерод (Black Pearl 2000, Cabot) также использовались в качестве материала катода. Фильтр из стекловолокна Whatman 934-АН использовался в качестве разделительной мембраны. Алюминиевый анод, один из вышеуказанных катодов и разделитель герметизировались в пластиковой ячейке в виде кюветы, содержащей электролит AlCl3:([EMIm]Cl), мольное отношение приблизительно 1,3:1, с помощью плоской резины в заполненной аргоном перчаточной камере. Гальваностатическая реакция заряда/разряда была произведена в отношении элемента при напряжении приблизительно 2,3-0,01 В при различных плотностях тока (приблизительно 6,6-33 мА г-1). Элемент типа Swagelok конструировался с использованием графитовой фольги (GF) (приблизительно 0,018 г) в качестве катода, четырех слоев мембраны из стекловолокна и алюминиевой фольги (приблизительно 0,006 г) в качестве анода. Затем несколькими каплями электролита (AlCl3/[EMIm]Cl на основе ионной жидкости с мольными отношениями приблизительно 1,1, 1,2, 1,3, 1,4, 1,5, 1,8 и 2,7) элементы были заполнены и загерметизированы в перчаточной камере. Элемент типа Swagelok заряжался и разряжался при напряжении на элементе приблизительно 2,5-0,01 В при постоянной плотности тока приблизительно 33 мА г-1. Кратковременное испытание по заряду/разряду батареи Al/графит (в элементе типа Swagelok) выполнялось при различных плотностях тока (приблизительно 16,5-198 мА г-1) в электролите на основе ионной жидкости AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3. В случае длительного испытания по заряду/разряду плотность тока была установлена приблизительно 33 мА г-1. Циклические вольтамперометрические измерения выполнялись с использованием потенциостата/гальваностата модели VMP3 (Bio-Logic) в трехэлектродном и двухэлектродном режимах. Рабочим электродом была алюминиевая фольга или графитовая фольга, вспомогательный электрод - платиновая фольга, а алюминиевая фольга использовалась в качестве электрода сравнения. Все три электрода были герметизированы в пластиковом элементе в виде кюветы, содержащей электролит на основе ионной жидкости AlCl3:[EMIm]Cl, мольное отношение приблизительно 1,3:1, следуя той же самой процедуре по герметизации, как описывалось ранее. Циклические вольтамперометрические (CV) измерения выполнялись в лаборатории при постоянных условиях окружающей среды. Диапазон сканирования был установлен от приблизительно -1 до приблизительно 0,85 В (относительно алюминия) для алюминиевой фольги и приблизительно от 0 до 2,5 В (относительно алюминия) для графитовой фольги, скорость сканирования составляла 10 мВ с-1. Для двухэлектродного режима (элемент типа Swagelok) батарея Al/графит заряжалась и разряжалась в электролите AlCl3:[EMIm]Cl с мольным отношением приблизительно 1,3:1. Сборочный узел элемента типа Swagelok был выполнен, следуя той же самой описанной выше процедуре. Все электрохимические измерения выполнялись в лаборатории в условиях окружающей среды с температурой 25±1°С.
дюйма с анализатором MTI батареи (BST8-WA, Ричмонд). Алюминиевая фольга (толщиной приблизительно 0,015 мм, корпорация MTI) была выбрана в качестве анода, а катод из графитовой фольги (толщиной приблизительно 0,13 мм, GTA Flexible Graphite) был получен от компании GrafTech International, Ltd. Для сравнения, бумага из графитового волокна (GDL10 АА, SGL Carbon) и технический углерод (Black Pearl 2000, Cabot) также использовались в качестве материала катода. Фильтр из стекловолокна Whatman 934-АН использовался в качестве разделительной мембраны. Алюминиевый анод, один из вышеуказанных катодов и разделитель герметизировались в пластиковой ячейке в виде кюветы, содержащей электролит AlCl3:([EMIm]Cl), мольное отношение приблизительно 1,3:1, с помощью плоской резины в заполненной аргоном перчаточной камере. Гальваностатическая реакция заряда/разряда была произведена в отношении элемента при напряжении приблизительно 2,3-0,01 В при различных плотностях тока (приблизительно 6,6-33 мА г-1). Элемент типа Swagelok конструировался с использованием графитовой фольги (GF) (приблизительно 0,018 г) в качестве катода, четырех слоев мембраны из стекловолокна и алюминиевой фольги (приблизительно 0,006 г) в качестве анода. Затем несколькими каплями электролита (AlCl3/[EMIm]Cl на основе ионной жидкости с мольными отношениями приблизительно 1,1, 1,2, 1,3, 1,4, 1,5, 1,8 и 2,7) элементы были заполнены и загерметизированы в перчаточной камере. Элемент типа Swagelok заряжался и разряжался при напряжении на элементе приблизительно 2,5-0,01 В при постоянной плотности тока приблизительно 33 мА г-1. Кратковременное испытание по заряду/разряду батареи Al/графит (в элементе типа Swagelok) выполнялось при различных плотностях тока (приблизительно 16,5-198 мА г-1) в электролите на основе ионной жидкости AlCl3/[EMIm]Cl с мольным отношением приблизительно 1,3. В случае длительного испытания по заряду/разряду плотность тока была установлена приблизительно 33 мА г-1. Циклические вольтамперометрические измерения выполнялись с использованием потенциостата/гальваностата модели VMP3 (Bio-Logic) в трехэлектродном и двухэлектродном режимах. Рабочим электродом была алюминиевая фольга или графитовая фольга, вспомогательный электрод - платиновая фольга, а алюминиевая фольга использовалась в качестве электрода сравнения. Все три электрода были герметизированы в пластиковом элементе в виде кюветы, содержащей электролит на основе ионной жидкости AlCl3:[EMIm]Cl, мольное отношение приблизительно 1,3:1, следуя той же самой процедуре по герметизации, как описывалось ранее. Циклические вольтамперометрические (CV) измерения выполнялись в лаборатории при постоянных условиях окружающей среды. Диапазон сканирования был установлен от приблизительно -1 до приблизительно 0,85 В (относительно алюминия) для алюминиевой фольги и приблизительно от 0 до 2,5 В (относительно алюминия) для графитовой фольги, скорость сканирования составляла 10 мВ с-1. Для двухэлектродного режима (элемент типа Swagelok) батарея Al/графит заряжалась и разряжалась в электролите AlCl3:[EMIm]Cl с мольным отношением приблизительно 1,3:1. Сборочный узел элемента типа Swagelok был выполнен, следуя той же самой описанной выше процедуре. Все электрохимические измерения выполнялись в лаборатории в условиях окружающей среды с температурой 25±1°С.
Изучение in-situ спектроскопии комбинационного рассеяния и ex situ рентгеновской дифрактометрии катода из графита во время заряда и разряда. Для
одновременного использования in-situ рамановской спектроскопии и гальваностатических измерений реакции заряда/разряда, использовался элемент в виде кюветы (0,35 мл, Stama Cells) с произвольной ориентацией кварцевых окон. Алюминиевая фольга и графитовая фольга использовались как анод и катод соответственно. Электролитом являлась смесь AlCl3:[EMIm]Cl с мольным отношением приблизительно 1,3:1. Электрохимический элемент собирался в перчаточной камере. Рамановский спектр возбуждался гелий-неоновым (HeNe) лазером (633 нм) с разрешением 2 см-1 в диапазоне 1400-1800 см-1. Данные спектра были собраны после нескольких последовательных сканирований заряда/разряда батареи Al/графитовая фольга между приблизительно 2,3 и 0,01 В при плотности тока приблизительно 33 мА г-1. Для изучения ex situ XRD батарея Al/графитовая фольга (в конфигурации Swagelok) заряжалась и разряжалась при постоянной плотности тока приблизительно 33 мА г-1, реакции были остановлены после приблизительно 60% заряда, полного заряда и приблизительно 60% разряда емкости батареи после 10 циклов заряда/разряда. Кроме того, полностью заряженные образцы были получены после 25 и после 100 циклов заряда/разряда соответственно. После реакции заряда или разряда катод из графитовой фольги удалялся из элемента в перчаточной камере. Чтобы избежать реакции между катодом и воздухом/влагой окружающей атмосферы, катод располагался на предметном стекле и затем образец оборачивали клейкой лентой. Завернутые лентой образцы удалялись из перчаточной камеры в окружающую воздушную среду для немедленного выполнения ex situ XRD. Измерение ex situ XRD выполнялось на оборудовании PANalytical X'Pert.
В контексте данного документа элементы в форме единственного числа "a", "an", и "the" включают в себя обозначаемые объекты во множественном числе до тех пор, пока контекст однозначно не обозначает обратное. Таким образом, например, ссылка на объект может включать в себя множество объектов до тех пор, пока контекст однозначно не обозначает обратное.
В контексте данного документа термины "соединять", "соединенный", "соединяющий" и "соединение" относятся к рабочему соединению или сцеплению. Соединенные объекты могут быть непосредственно присоединены друг к другу или могут быть присоединены друг к другу не напрямую, например, через другой набор объектов.
В контексте данного документа термины "по существу" и "приблизительно" используются для описания и объяснения небольших изменений. Когда они используются во взаимосвязи с событием или обстоятельством, эти термины могут относиться к примерам, в которых точно произошло событие или обстоятельство, так же как и к примерам, в которых событие или обстоятельство произошло в близком приближении. Например, термины могут относиться к меньше чем или равно ±10%, также как меньше чем или равно ±5%, меньше чем или равно ±4%, меньше чем или равно ±3%, меньше чем или равно ±2%, меньше чем или равно ±1%, меньше чем или равно ±0,5%, меньше чем или равно ±0,1%, меньше чем или равно ±0,05%.
Несмотря на то, что изобретение описано со ссылками на конкретные варианты осуществления изобретения, следует принимать во внимание, что специалистами в данной области техники могут быть выполнены различные изменения, и эквивалентные компоненты могут заменяться без выхода за пределы сущности и объема изобретения, как это определяется прилагаемыми пунктами формулы изобретения. Кроме того, может быть реализовано множество модификаций, чтобы адаптироваться к определенной ситуации, материалу, химическому соединению, способу, операции или операциям, цели, сущности и объему изобретения. Предполагается, что все такие модификации должны быть в пределах объема прилагаемых пунктов формулы изобретения. В частности, в то время как определенные способы были описаны со ссылкой на отдельные операции, выполненные в определенном порядке, следует принимать во внимание, что эти операции могут объединяться, подразделяться, или выполняться в другом порядке, чтобы образовывать эквивалентный способ, не выходя за пределы области идей изобретения. Соответственно, до тех пор, пока это специально не обозначено, порядок и группирование операций не являются ограничением изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСОВЕРШЕНСТВОВАННЫЕ ЭЛЕКТРОЛИТЫ, ТОКОСБОРНИКИ И СВЯЗУЮЩИЕ ДЛЯ ПЕРЕЗАРЯЖАЕМЫХ МЕТАЛЛ-ИОННЫХ БАТАРЕЙ | 2016 |
|
RU2758916C2 |
| Способ плазмоэлектрохимической переработки графита из использованных литий-ионных аккумуляторов | 2023 |
|
RU2825576C1 |
| Электрохимические вторичные элементы для применения в высокоэнергетических и высокомощных батареях | 2016 |
|
RU2721079C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОСТРУКТУРИРОВАННОГО МНОГОСЛОЙНОГО ТРЕХМЕРНОГО КОМПОЗИТНОГО МАТЕРИАЛА ДЛЯ ОТРИЦАТЕЛЬНОГО ЭЛЕКТРОДА ЛИТИЙ-ИОННОЙ БАТАРЕИ, КОМПОЗИТНЫЙ МАТЕРИАЛ, ОТРИЦАТЕЛЬНЫЙ ЭЛЕКТРОД И ЛИТИЙ-ИОННАЯ БАТАРЕЯ | 2011 |
|
RU2459319C1 |
| АЛЮМИНИЙ-ИОННАЯ БАТАРЕЯ | 2018 |
|
RU2701680C1 |
| ПОЛУЧЕНИЕ ГРАФЕНА И ГРАФАНА | 2014 |
|
RU2682166C2 |
| ЭЛЕКТРИЧЕСКИЙ АККУМУЛЯТОР И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2015 |
|
RU2689413C2 |
| Перезаряжаемые натриевые элементы для использования в батареях с высокой удельной энергией | 2017 |
|
RU2742351C2 |
| БЫСТРОЗАРЯДНАЯ СИСТЕМА (ВАРИАНТЫ) И СПОСОБ СОЗДАНИЯ БЫСТРОЗАРЯДНОГО КОМПОЗИТА (ВАРИАНТЫ) | 2015 |
|
RU2691097C2 |
| Металл-серный проточный аккумулятор | 2023 |
|
RU2820527C2 |

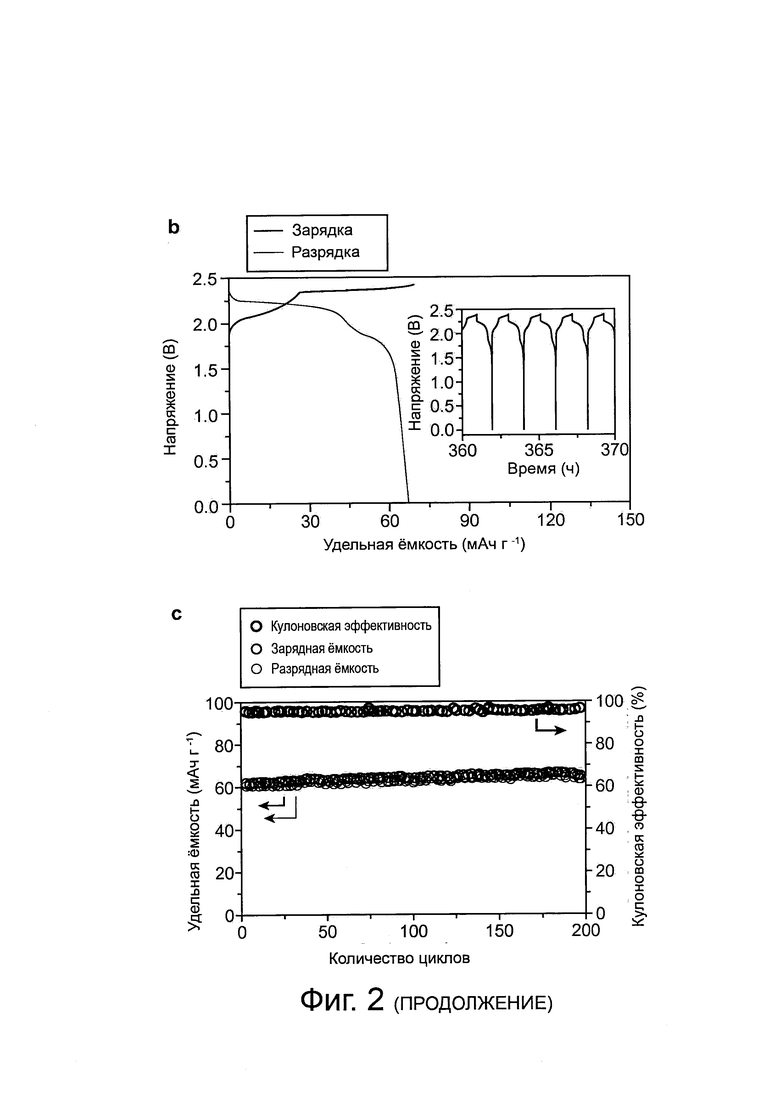
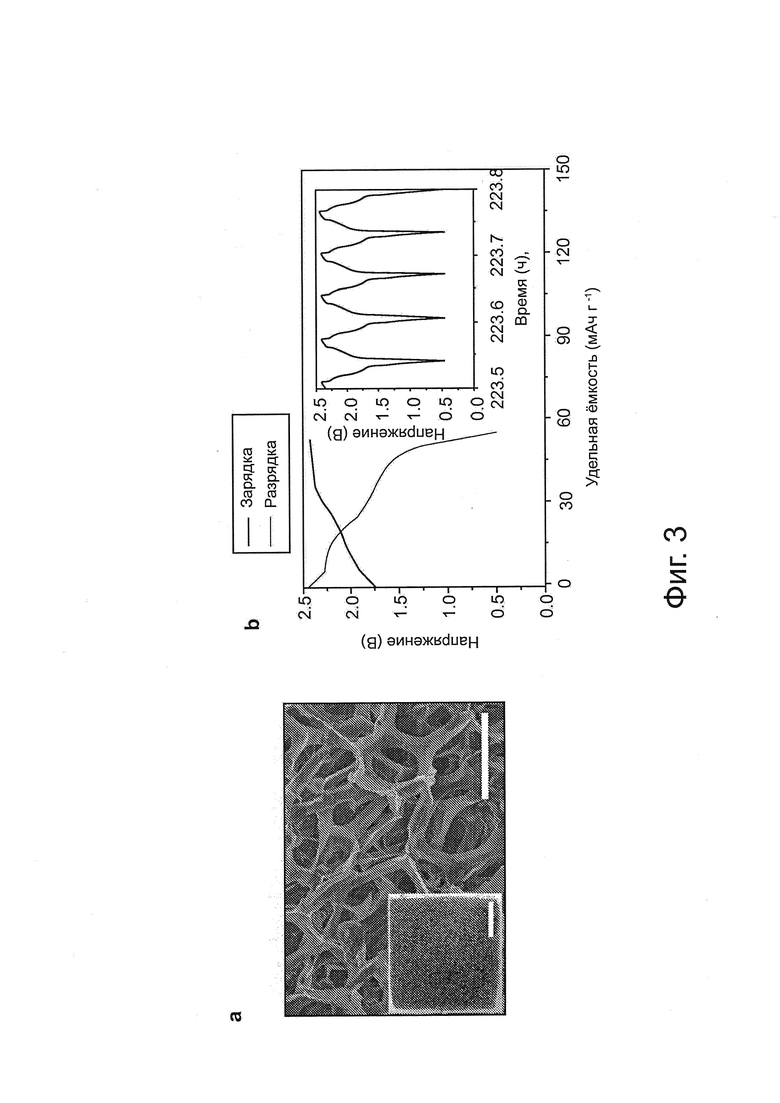

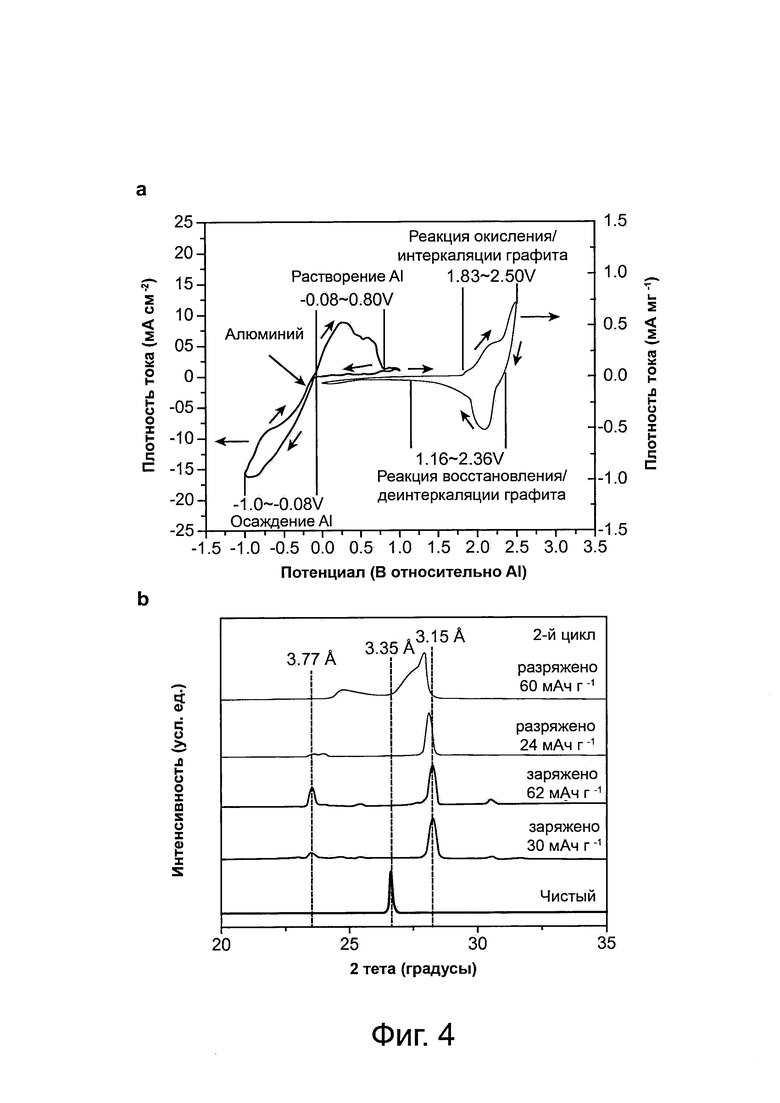
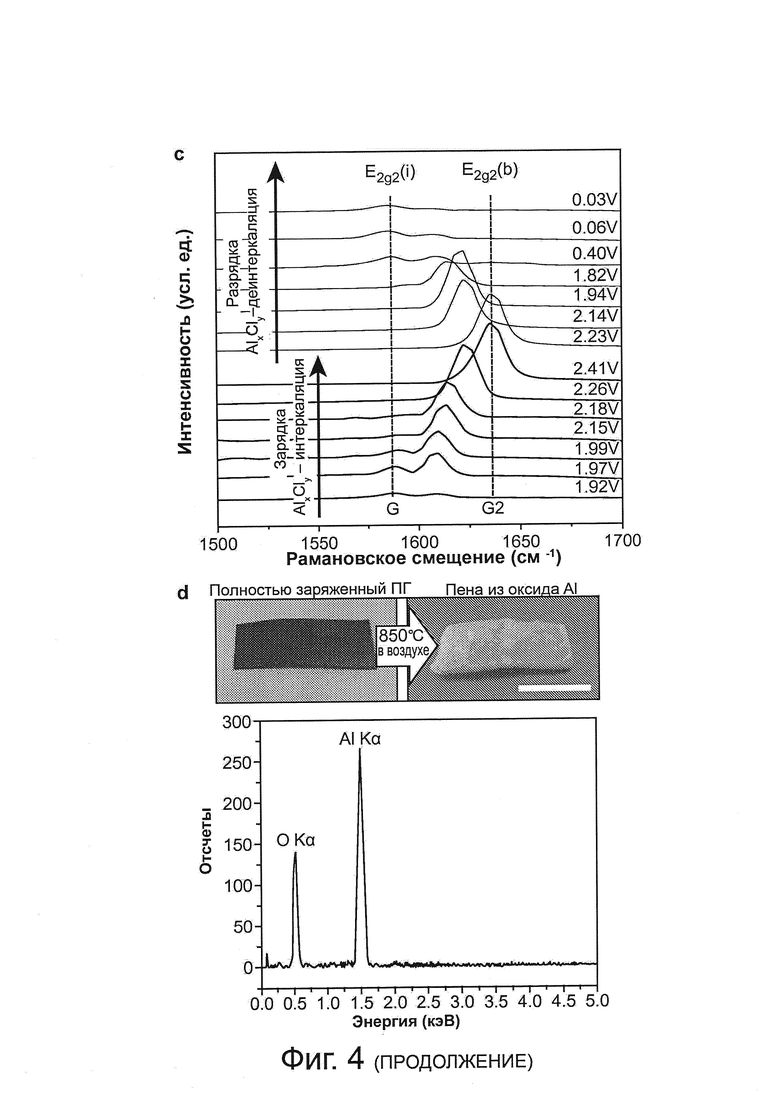
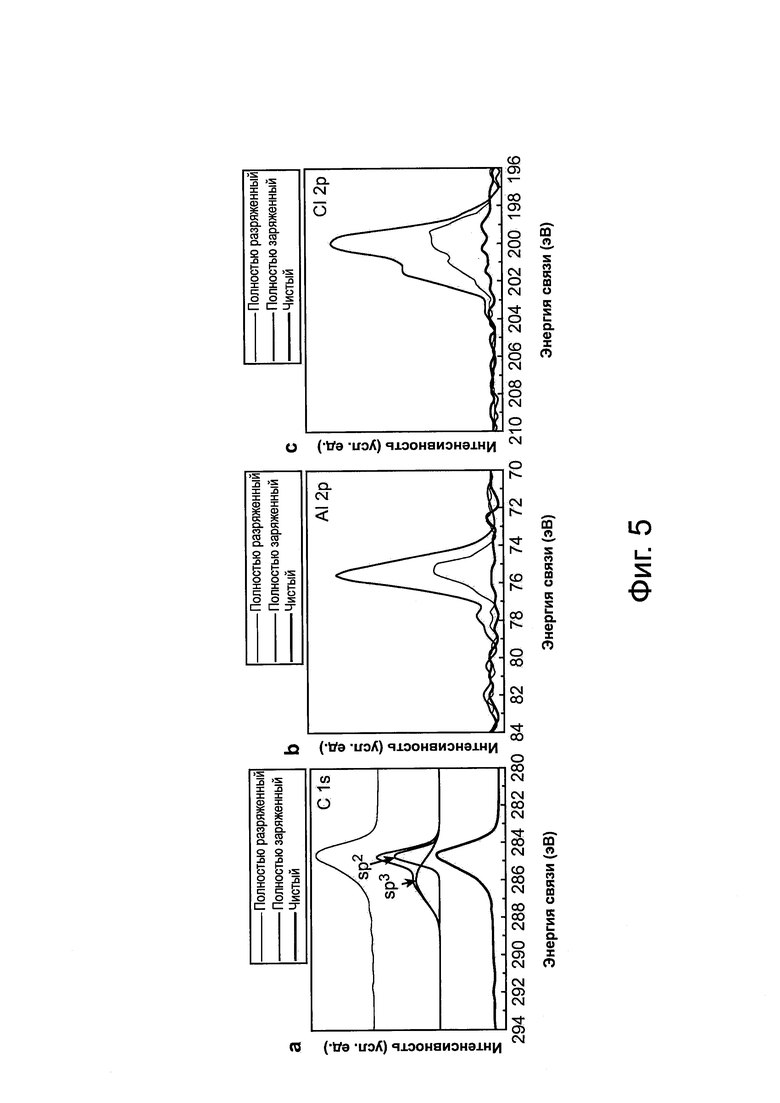







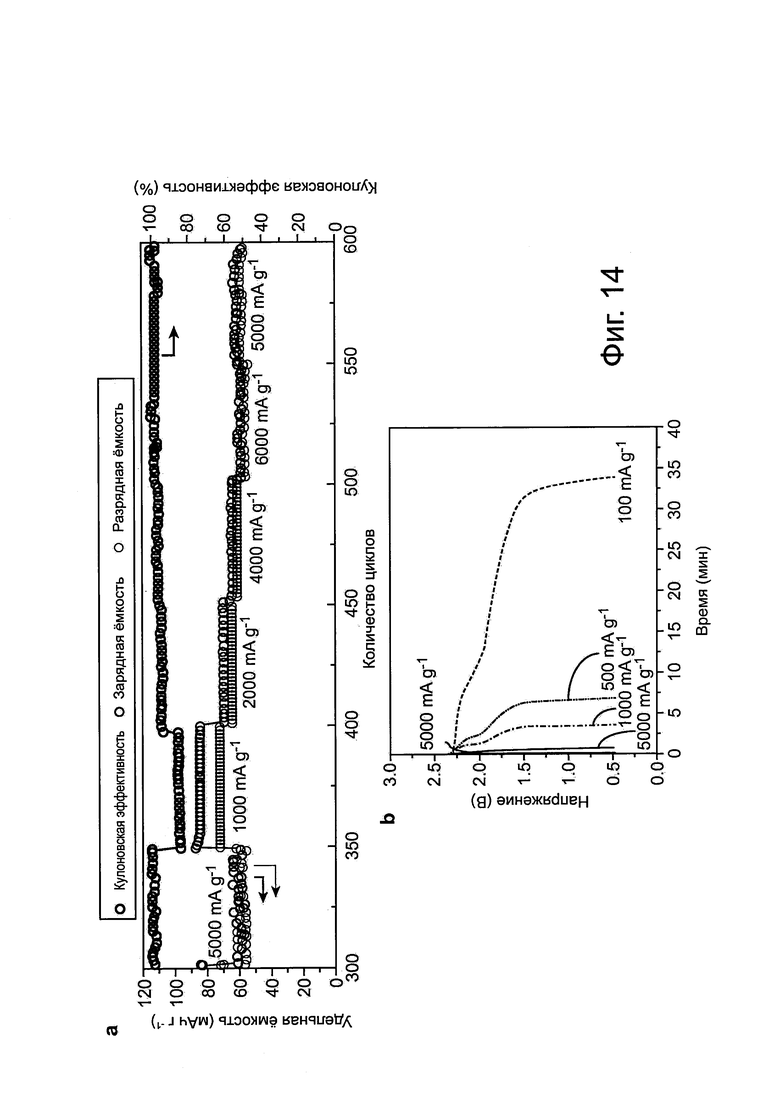
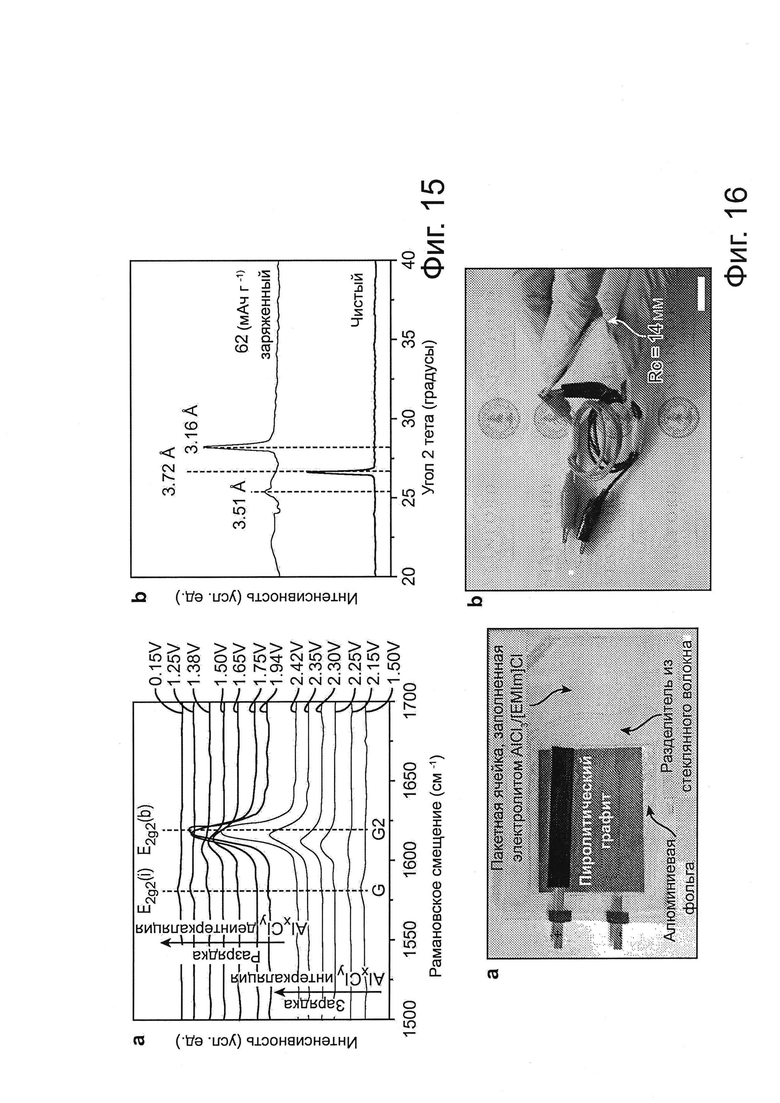


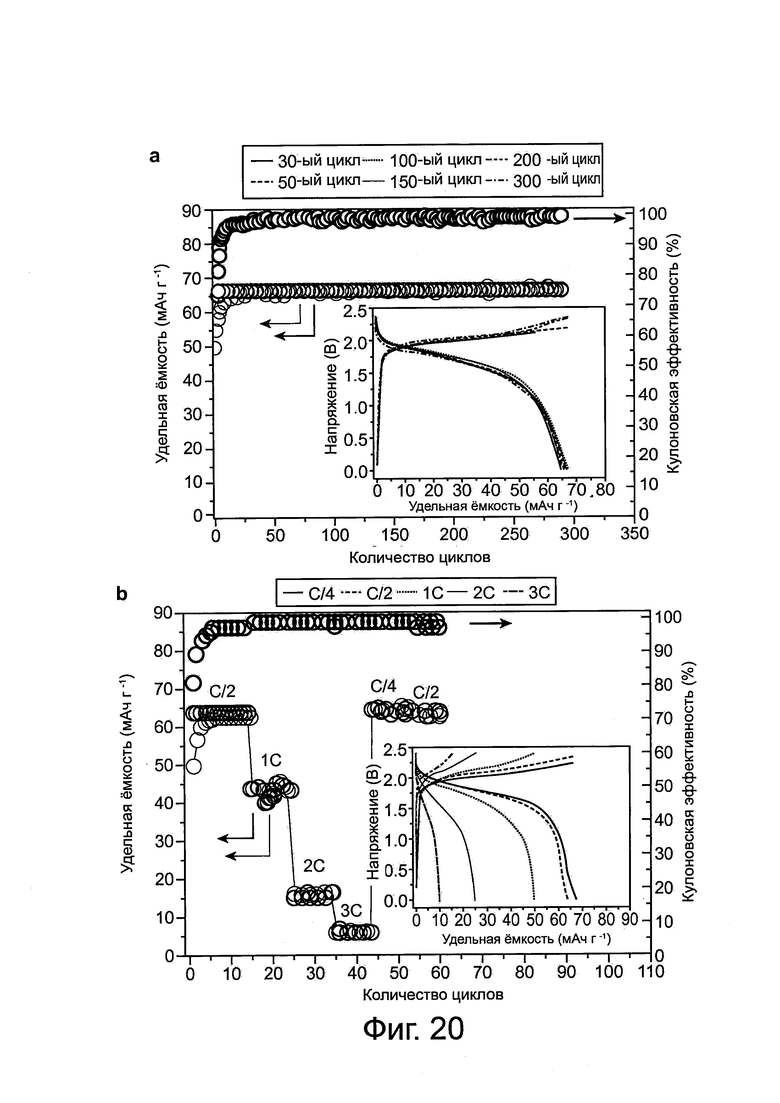



Изобретение относится к области электротехники, а именно к сверхбыстро перезаряжаемой металл-ионной батарее с низкой воспламеняемостью, которая может быть использована в качестве источника энергии для электрических транспортных средств или портативных электронных устройств. Металл-ионная батарея включает в себя: анод (1), содержащий алюминий, катод (2), содержащий слоистый активный материал и электролит (3), расположенный между анодом и катодом, для поддержания обратимого осаждения и растворения алюминия на аноде и обратимого интеркалирования и деинтеркалирования анионов на катоде, при этом катод выполнен на основе пористого пиролитического графита, а электролит представляет собой ионную безводную жидкость. Повышение циклической стабильности батареи при различных плотностях тока является техническим результатом изобретения. 3 н. и 11 з.п. ф-лы, 23 ил., 5 пр.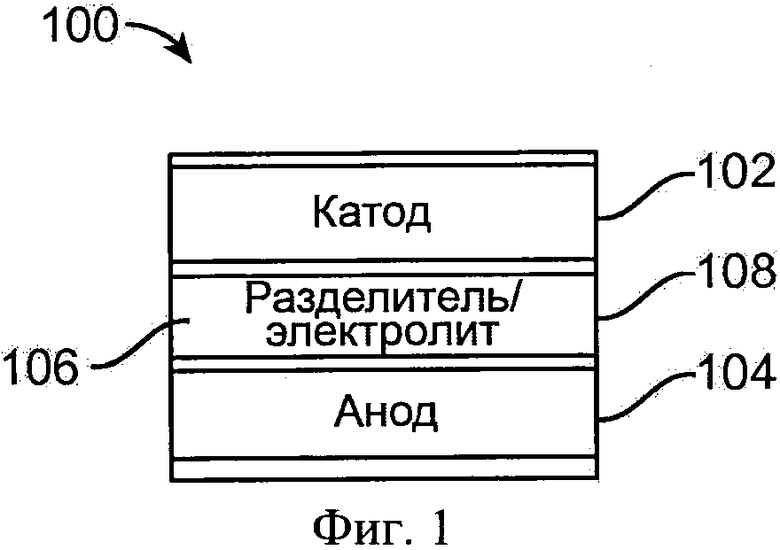
1. Металл-ионная батарея, содержащая:
анод, включающий алюминий;
катод, включающий слоистый активный материал, причем слоистый активный материал представляет собой пиролитический графит; и
электролит, расположенный между анодом и катодом, для поддержания обратимого осаждения и растворения алюминия на аноде и обратимого интеркалирования и деинтеркалирования анионов на катоде.
2. Батарея по п. 1, в которой слоистый активный материал имеет пористость в диапазоне 0,05–0,95.
3. Батарея по п. 1, в которой электролит соответствует смеси галогенида алюминия и ионной жидкости, причем мольное отношение галогенида алюминия к ионной жидкости превышает 1,1.
4. Батарея по п. 3, в которой галогенидом алюминия является AlCl3, а ионной жидкостью является хлорид 1-этил-3-метилимидазолия.
5. Батарея по п. 4, в которой мольное отношение AlCl3 к 1-этил-3-метилимидазолий хлориду превышает 1,2.
6. Батарея по п. 1, в которой содержание воды в электролите составляет не более чем 1000 ppm.
7. Металл-ионная батарея, содержащая:
алюминиевый анод;
катод из пористого графита, причем катод из пористого графита представляет собой графитовую пену, которая имеет пористость в диапазоне от 0,5±10% до 0,9±10%; и
электролит на основе ионной жидкости, расположенный между алюминиевым анодом и катодом из пористого графита.
8. Батарея по п. 7, в которой электролит на основе ионной жидкости соответствует смеси галогенида алюминия и ионной жидкости, причем мольное отношение галогенида алюминия к ионной жидкости превышает 1,1.
9. Батарея по п. 7, в которой содержание воды в электролите на основе ионной жидкости не превышает 1000 ppm.
10. Батарея по п. 9, в которой содержание воды не превышает 400 ppm.
11. Способ изготовления металл-ионной батареи, включающий:
получение анода, содержащего алюминий;
получение катода, содержащего пористый графитовый материал, способный к интеркаляции ионов во время заряда и к деинтеркаляции ионов во время разряда, при этом пористый графитовый материал представляет собой графитовую пену, которая имеет пористость в диапазоне от 0,5±10% до 0,9±10%; и
получение электролита, способного поддерживать обратимое осаждение и растворение алюминия на аноде и обратимую интеркаляцию и деинтеркаляцию ионов на катоде.
12. Способ по п. 11, в котором получение пористого графитового материала включает в себя формирование графитовой пены посредством осаждения на пористую удаляемую подложку.
13. Способ по п. 11, в котором получение пористого графитового материала включает в себя расширение графитового материала посредством электрохимического выделения водорода.
14. Способ по п. 11, в котором получение электролита включает в себя электрохимическое высушивание электролита, так чтобы содержание воды в электролите не превышало 400 ppm.
| US 4463072 А, 31.07.1984 | |||
| US 2012045688 A1, 23.02.2012 | |||
| US 2012082904 A1, 05.04.2012 | |||
| US 2010316914 A1, 16.12.2010 | |||
| RU 2009117719 A, 20.11.2010 | |||
| СA 2842017 A1, 24.01.2013. |
Авторы
Даты
2019-04-10—Публикация
2015-02-27—Подача