Настоящее изобретение относится к устройству для диагностики in vitro в образце крови или одного из ее компонентов, предназначенному для обнаружения реакций между антигенами эритроцитов и антителами, которые специфически направлены против этих антигенов.
Изобретение также относится к применению этого устройства для идентификации и определения групп крови.
Целью иммуногематологических методов диагностики является обеспечение или диагностика атаки антител на красные кровяные клетки. Для этого нужны инструменты, позволяющие обнаружить антигены на поверхности красных клеток, наличие или отсутствие которых определяет группу крови, а также определить, содержит ли кровь одно или больше антител, направленных против известных антигенов красных клеток; присутствие антитела означает вероятность несовместимости.
Таким образом, распространенные методы включают поиск и идентификацию антигенов группы крови на поверхности эритроцитов и/или поиск и идентификацию содержащихся в плазме антител против антигенов групп крови.
Например, для системы АВО тест Бета-Винсента определяет антигены красных клеток, а комплементарный тест Симонина-Михона или перекрестная проверка по сыворотке определяет антитела сыворотки крови.
В ходе теста Бета-Винсента красные клетки индивидуума смешивают с реагентами, состоящими из антител известной специфичности. В общем случае, результаты теста наблюдают по агглютинации красных клеток, возникающей, когда антитела распознают соответствующие антигены эритроцитов.
В тесте Симонина плазму индивидуума смешивают с пробами красных кровяных клеток (red blood cell tests), каждая из которых относится к конкретной группе антигенов системы АВО. В ходе теста определяют агглютинацию пробы красных кровяных клеток с плазмой индивидуума.
Поиск так называемых транзиторных антител предполагает регистрацию наличия или отсутствия в крови индивидуума иммуноглобулинов, направленных против различных эритроцитарных антигенов. В ходе поиска аутоантител у индивидуума непосредственно ищут антитела, уже обнаруженные in vivo. Задачей поиска аллоантител является обнаружение факта прикрепления этих иммуноглобулинов к пробам красных клеток с известными антигенами, и выполняется это непрямыми методами Кумбса.
В настоящее время известно очень большое количество способов и устройств, применяемых для фенотипирования в области иммуногематологии, но существующие методы фенотипирования групп крови связаны с большим количеством недостатков.
Например, способы с применением микропланшетов нуждаются в этапе центрифугирования, за которым следует этап перемешивания. Этап перемешивания критически важен, поскольку множество реакций, одновременно протекающих на твердом носителе, характеризуются различными кинетическими параметрами ресуспендирования. Это означает риск разрушить слабую агглютинацию, не добившись успеха в ресуспендировании сильной агглютинации. Эти действия необходимо контролировать визуально, особое внимание уделяя явлению адгезии некоторых реагентов.
Аналогично, хотя проводятся тесты, основанные на технологиях гель-фильтрации, существует риск пропустить некоторые агглютинации, особенно при плазматическом тесте группы по АВО, в связи с диссоциацией, вызванной фрагментацией небольших агглютинатов при их прохождении через гель.
Серьезным недостатком всех этих способов является необходимость центрифугирования для декантации красных клеток или проведения их через гель; этот этап значительно увеличивает время и стоимость анализа и требует использования больших центрифуг, которыми трудно управлять.
Известен также способ иммунофильтрации, такой как описан в заявке ЕР 2167967, который состоит из захвата аналита, присутствующего в образце, при его прохождении через пористую мембрану с перехватывающим элементом и обнаружения его присутствия выявляющим элементом. Устройство такого типа содержит область депонирования образца, гидрофильную пористую мембрану, на которой находится перехватывающий реагент и под которой располагается абсорбирующая мембрана. Проведение такого вида исследования состоит из осаждения чистого или разбавленного образца в области депонирования, в ходе которого образец проходит через пористую мембрану и оседает на абсорбирующей мембране. Если в образце присутствует соответствующий перехватывающему элементу аналит, он иммобилизируется перехватывающим элементом при прохождении по капиллярам пористой мембраны. Кроме того, область захвата предпочтительного аналита обнаруживают с помощью выявляющего агента, способного определить присутствие аналита в области захвата и содержащего компонент, позволяющий проводить такое обнаружение визуально (окрашенный продукт) или физическим или химическим методом.
Однако этот способ характеризуется низкой чувствительностью и специфичностью, так как при осаждении образца он распространяется по пористой мембране и впитывается ею, в результате большое количество аналита теряется в мертвом объеме пористой мембраны или выходит за пределы области захвата. То же самое касается и выявляющего раствора. Чтобы депонировать большое количество исследуемого образца и выявляющего раствора, необходимо слишком сильно увеличить абсорбирующую систему, а это не позволяет проводить тесты в небольших объемах с контролируемой кинетикой без выявляющих агентов и с использованием автоматического микродозатора.
В попытке решить эту проблему и сконцентрировать сигнал, в заявках СА 1312265 или WO 02052263 предложено разместить выше и ниже гидрофильной пористой мембраны гидрофобную структуру, которая направляла бы поток через область захвата. Однако в таких устройствах сохраняется проблема центробежной диффузии от пятна; в результате выявляющие элементы, проходящие через область (пятно) захвата и не связывающиеся с ним, могут центробежно диффундировать в гидрофильную пористую мембрану и накапливаться на периферии пятна. Это позволяет им избегать промывки, которая также сфокусирована на пятне. Затем по механизмам центростремительной диффузии эти выявляющие элементы могут вернуться в область захвата, что приводит к появлению окраски там даже в случае отсутствия предпочтительного аналита. Данное явление очень быстро (обычно 5-15 минут) делает невозможным проведение теста из-за ложных положительных результатов, что представляет собой большую проблему, поскольку устройства подобного типа не могут повторить анализ в случае сомнения, человеческой ошибки или потери информации.
Еще одной крупной проблемой существующих в настоящее время устройств иммунофильтрации является необходимость контролировать скорость движения и, в некоторых случаях, продолжительность предварительной инкубации. Важность этих параметров обусловлена тем, что взаимодействие между перехватывающим элементом и аналитом, а также между аналитом и выявляющим элементом характеризуется специфической кинетикой. Кинетика описывает зависимость числа актов взаимодействия от времени. Поскольку учитывается как взаимодействие в паре перехватывающий агент / аналит, так и в паре выявляющий агент / аналит, для получения адекватного сигнала необходимо обеспечить достаточное число взаимодействий в каждой паре. Если взаимодействие между перехватывающим агентом и захваченным аналитом протекает медленно, необходимо снизить скорость прохождения образца через мембрану. Если же лимитирующей стадией является взаимодействие между выявляющим агентом и аналитом, необходимо обеспечить более продолжительную предварительную инкубацию, когда выявляющий элемент и аналит перемешиваются над областью захвата. Без конкретной системы прохождение через гидрофильную мембрану происходит быстро (500 мкл/мин).
Для контроля потока предлагалось использовать поршень, в частности, в заявке US 2008318342.
Для контроля времени предварительной инкубации в заявке WO 03016902 предложено использовать устройство, состоящее из двух частей: в верхней части расположена область сбора образца и пористая мембрана, а в нижней части -пористая и абсорбирующая мембрана. В первоначальном положении эти два блока не взаимодействуют, и жидкость не может течь по капиллярам. После механической обработки эти две области приходят в контакт друг с другом, после чего жидкость может протекать по капиллярам. Также предложено депонировать перехватывающий элемент на гидрофобной мембране и активизировать прохождение жидкости добавлением поверхностно-активного вещества.
Механические подходы трудно реализовать, поскольку для них требуется разработать специальные системы. Кроме того, любые возникающие при работе с ними проблемы требуют участия подготовленных специалистов.
Добавление поверхностно-активного вещества при проведении теста для ускорения работы системы чрезвычайно нежелательно, поскольку оно серьезно мешает взаимодействию между перехватывающими агентами и аналитами. Кроме того, в иммуногематологии используемые в качестве выявляющих агентов красные клетки несовместимы с жидкими поверхностно-активными веществами, так как последние растворяют мембраны красных клеток, и они теряют гемоглобин.
Еще один способ, описанный в заявке ЕР 0334015, предполагает для контроля потока использование дополнительной мембраны, расположенной ниже первой, но предлагаемое устройство не может решить проблемы, связанные с диффузийе образца и выявляющего элемента в гидрофильную пористую мембрану.
Таким образом, существующие иммуногематологические диагностические тесты характеризуются большим количеством недостатков.
Задачей настоящего изобретения является устранение недостатков известных решений путем создания устройства, адаптированного для иммуногематологической диагностики in vitro и работающего с использованием капиллярных явлений, которое является надежным, быстрым, мобильным и экономичным, простым в изготовлении и использовании, может быть выполнено с миниатюрными размерами и автоматизировано и характеризуется достаточной чувствительностью.
Для достижения этой цели настоящее изобретение предлагает устройство для диагностики in vitro, предназначенное для обнаружения в образце крови или одного из ее компонентов по меньшей мере одной реакции между антигеном эритроцитарного фенотипа и антителом, специфически направленным против этого антигена, характеризующееся тем, что оно содержит:
- подложку и
- гидрофобную пористую мембрану толщиной от 0,05 до 1,5 мм с диаметром пор от 2 до 30 мкм, причем указанная мембрана содержит по меньшей мере одну гидрофильную область реакции, предназначенную для получения указанного образца, и поверхность указанной области реакции меньше поверхности гидрофобной пористой мембраны.
Изобретение относится также к применению этого устройства, в конкретных способах фенотипирования эритроцитарных групп крови и обнаружения антител с использованием этого устройства.
Настоящее изобретение с успехом исправляет все недостатки существующих в настоящее время тестов иммунофильтрации, в частности, в связи с:
- недопущением возврата выявляющего агента, вызывающего появление ложных положительных ответов,
- повышенной чувствительностью из-за использования меньших объемов,
- миниатюризацией и автоматизацией системы,
- контролем кинетики реакции без необходимости выполнения механических действий с устройством.
Другие характеристики и преимущества вытекают из следующего описания изобретения, приводимого только для примера и проиллюстрированного прилагаемыми рисунками, на которых:
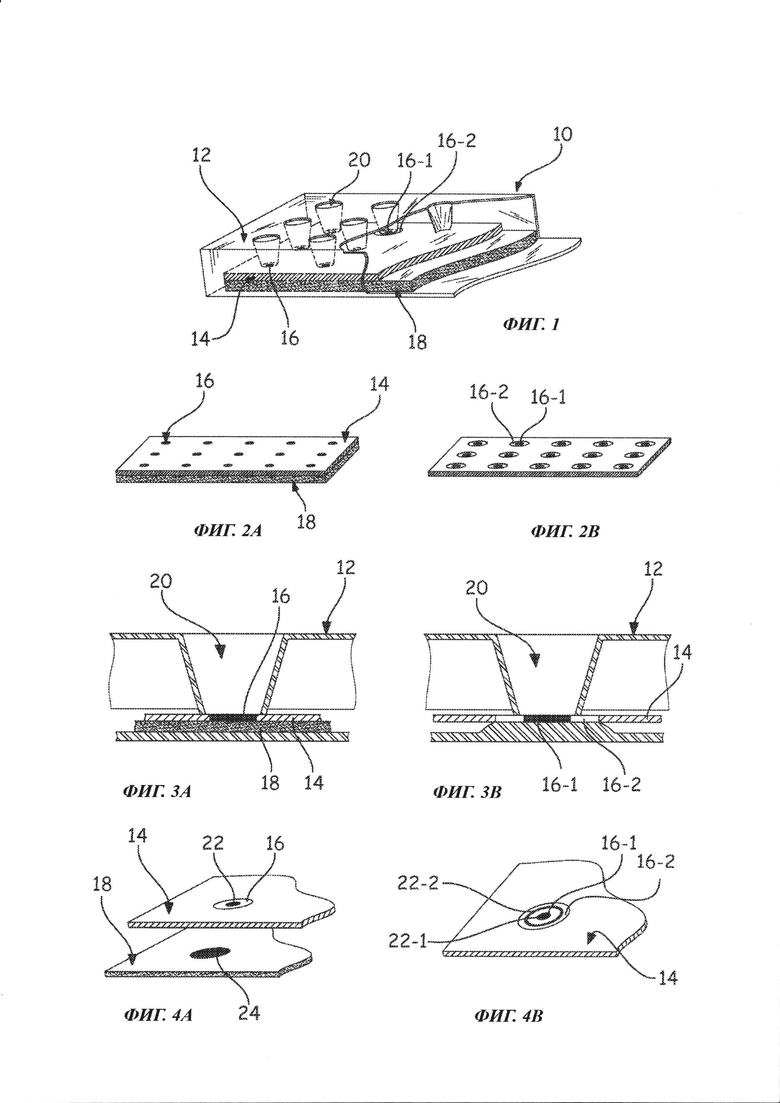
- фигура 1 иллюстрирует схему конкретного воплощения устройства по изобретению с соблюдением законов перспективы;
- фигура 2А иллюстрирует гидрофобную пористую мембрану и поглощающую мембрану устройства по изобретению с первым вариантом расположения гидрофильных областей реакции;
- фигура 2В иллюстрирует гидрофобную пористую мембрану и поглощающую мембрану устройства по изобретению со вторым вариантом расположения гидрофильных областей реакции;
- фигура 3А представляет собой сечение устройства по изобретению с гидрофобной пористой мембраной, соответствующей варианту фигуры 2А;
- фигура 3В представляет собой сечение устройства по изобретению с гидрофобной пористой мембраной, соответствующей варианту фигуры 2В;
- фигура 4А иллюстрирует результаты, полученные после применения устройства по изобретению, область реакции гидрофобной пористой мембраны которого показана на рисунке 2А, а также фрагмент расположенной ниже поглощающей мембраны; а также
- фигура 4В иллюстрирует результаты, полученные после применения устройства по изобретению, область реакции гидрофобной пористой мембраны которого показана на рисунке 2 В.
Устройство 10 по изобретению представляет собой устройство для диагностики in vitro для детекции в образце крови или одного из ее компонентов по меньшей мере одной реакции между антигеном эритроцитарного фенотипа и антителом, специфически направленным против этого антигена.
Это устройство предназначено для диагностики in vitro с использованием капиллярных явлений, оно особенно подходит для иммуногематологической диагностики in vitro.
Антиген эритроцитарного фенотипа, антиген эритроцитарной группы или антиген группы крови означает все иммуногенные молекулы, присутствующие на поверхности красных клеток и способные вызывать образование направленных против них антител и/или распознавание и последующее разрушение красных клеток под действием иммунной системы.
Реакция между антигеном эритроцитарного фенотипа и антителом, направленным специфически против этого антигена, в описании изобретения называется реакцией антиген-антитело.
Образец крови или одного из ее компонентов означает цельную кровь или один из ее компонентов, выбранный специфически из фракции красных клеток (эритроцитов), белых клеток (лейкоцитов), плазмы или сыворотки.
Как показано на фигуре 1, устройство 10 по изобретению содержит:
- подложку 12 и
- гидрофобную пористую мембрану 14, содержащую по меньшей мере одну гидрофильную область реакции 16, предназначенную для получения исследуемого образца.
Толщина пористой мембраны 14 находится в интервале от 0,05 до 1,5 мм, предпочтительно от 0,1 до 1 мм, более предпочтительно от 0,4 до 0,8 мм.
Диаметр пор находится в интервале от 2 до 30 мкм, предпочтительно от 7 до 12 мкм.
Гидрофобная пористая мембрана 14 может содержать любой материал, не изменяемый под действием водных растворителей. Этот материал, в частности, может быть выбран из природных полимеров, модифицированных химически или немодифицированных, таких как, например, полимер нитроцеллюлозы или целлюлоза, или из синтетических полимеров, таких как, например, полиэтилен, полиэтилен высокой плотности (ПЭВП) или фторированные полимеры, например, ПВДФ. Этот материал должен быть гидрофобным с самого начала, или его следует сделать гидрофобным адекватной обработкой. Эти полимеры можно функционализировать активными группами, способными образовывать связи с применяемыми впоследствии перехватывающими агентами.
Гидрофобная пористая мембрана 14 содержит по меньшей мере одну гидрофильную область реакции 16. Поверхность области реакции 16 меньше поверхности гидрофобной пористой мембраны 14, то есть, мембрану 14 нельзя полностью гидрофилизировать.
Гидрофильную(ые) область(и) реакции 16 на пористой мембране 14 предпочтительно сделаны гидрофильными путем локального введения детергента, без изменения химических функций пористого субстрата предварительной химической или физической обработкой гидрофобной пористой мембраны 14.
Детергент означает любой гидрофилизирующий агент, то есть, любое вещество, способное сделать гидрофобную мембрану 14 гидрофильной.
Применяемый детергент можно выбрать из природных детергентов, химически модифицированных природных детергентов или детергентов, полученных в ходе химического синтеза. Предпочтительно, это неионное поверхностно-активное вещество, например, Тритон Х-100, Твин 20 или сапонин.
Детергент можно разбавить водным раствором или органическим растворителем, таким как этанол, в концентрации от 0,01 до 5%. Предпочтительно, детергент, применяемый для того, чтобы сделать мембрану 14 локально гидрофильной, используется в дозе от 0,01 до 2% (вес/объем).
Количество использованного детергента, с учетом других характеристик мембраны (в особенности, ее пористости и толщины) контролирует скорость движения жидкостей через мембрану. Обычно считается, что не следует превышать максимальную дозу 0,1% для детергента Тритон Х-100 и 0,05% для Твина, чтобы сделать гидрофильной мембрану, предназначенную для получения перехватывающего элемента. Однако из-за конкретных характеристик мембраны 14 по изобретению детергенты, способные сделать эту мембрану гидрофильной, могут быть локально использованы в дозе вплоть до 2%, особенно для Тритона Х-100 или Твина-20, без разрушения реактивности области, которая облегчает гидрофилизацию мембраны 14.
Одна и та же гидрофобная мембрана 14 может содержать несколько гидрофильных областей реакции 16 при условии, что эти области не пересекаются.
Области реакции 16 могут быть любых геометрических форм, но предпочтительно, чтобы они принимали форму кругов или пятен с диаметром от 0,3 до 20 мм.
Область реакции 16 может быть гидрофильной по всей толщине пористой мембраны 14 и/или на ее поверхности.
Область реакции 16 может характеризоваться одной и той же степенью гидрофилизации, как показано на фигурах 2А, 3А и 4А. Такая конфигурация особенно хорошо подходит для обнаружения присутствия специфических антител в анализируемом образце.
В соответствии с вариантом изобретения, область реакции 16 может содержать несколько областей с различными степенями гидрофилизации.
Как показано на фигурах 2В, 3В и 4В, область реакции 16 может содержать две гидрофильные области 16-1 и 16-2, причем степень гидрофилизации в центре 16-1 области реакции больше, чем на периферии 16-2. Эти гидрофильные области находятся предпочтительно только на поверхности мембраны 14.
Область реакции 16 также может содержать две гидрофильные области с различной степенью гидрофилизации, одна из которых располагается на поверхности, а другая в толщине мембраны.
Если область реакции 16 содержит две гидрофильные области, область реакции 16 сделана гидрофильной с использованием двух различных детергентов, без изменения химических функций пористого субстрата предварительной химической или физической обработкой пористой мембраны.
Преимущественно, конфигурация области реакции 16 с двумя участками различной гидрофилизации, в особенности на поверхности, такая как показана на фигурах 2В, 3В и 4В, отвечает конкретной потребности профессионалов в области переливания крови в обнаружении одновременного сосуществования двух популяций, одна из которых положительна, а другая отрицательна, это явление называется двойной популяцией. Эта конфигурация особенно хорошо подходит для детекции и идентификации конкретных антигенов в исследуемом образце.
Гидрофильная область реакции 16 пористой мембраны 14 может содержать перехватывающие агенты. Перехватывающие агенты абсорбируются или ковалентно связываются с мембраной 14.
Термин "перехватывающий агент" означает любой химический или биологический элемент, зафиксированный в области 16 и способный удержать соответствующий аналит, содержащийся в исследуемом образце, возможно, в комплексе с выявляющим агентом.
Если задача заключается в обнаружении в исследуемом образце конкретных антител, то такие перехватывающие агенты содержат антигены конкретного фенотипа эритроцитов. Это могут быть антигены, очищенные или не очищенные от фрагментов или мембран содержащих их клеток, клетки, не содержащие антигены или какие-либо свои компоненты, или даже рекомбинантные протеины или антигены, полученные путем синтеза. В предпочтительном варианте перехватывающие агенты представляют собой красные кровяные клетки без гемоглобина, но несущие антигены.
Если задача заключается в обнаружении в исследуемом образце конкретных антигенов, перехватывающие агенты представляют собой антитела.
Если в области реакции 16 присутствуют перехватывающие агенты, то их можно депонировать одновременно с детергентом, используемым для гидрофилизации мембраны 14 с целью ограничения области реакции 16, или после гидрофилизации, независимо от детергента.
Перехватывающие агенты можно депонировать в область реакции 16 в составе не-денатурирующего буфера, рН которого стабилизирован между значениями 4 и 10, предпочтительно между 6,5 и 7,8, еще более предпочтительно между 7 и 7,5. Перехватывающие агенты могут либо абсорбироваться, либо связываться ковалентно.
Перехватывающие агенты можно смешивать с адъювантами, обеспечивающими их микробиологическую стабильность, такими как азид натрия, антибиотики, и их конформационную стабильность, такими как сахара (сахароза, декстроза, трегалоза), а также с другими агентами, известными специалистам в данной области для выполнения этих функций.
Перехватывающие агенты могут присутствовать во всей области 16 или только в ее части.
Детергент и/или перехватывающие агенты предпочтительно представляют собой растворы, которые можно депонировать автоматизированными или ручными пипетками. Предпочтительно, чтобы эти растворы можно было легко депонировать с помощью игл, удерживающих предпочтительный объем силами капиллярного притяжения. Эти иглы можно изготавливать из любых материалов, в частности из металла, и они могут содержать гидрофобное покрытие или не содержать его. Их концы могут быть плоскими или содержать выемки определенного объема.
Депонирование растворов детергентов и/или перехватывающих агентов должно сопровождаться сушкой мембраны, причем продолжительность сушки зависит от температуры: при комнатной температуре сушить надо не менее 4 часов, а при 37°С не менее часа.
Устройство по изобретению может содержать поглощающую мембрану 18, расположенную под пористой мембраной 14. Эта мембрана 18 поглощает жидкости, депонированные на уровне областей реакции 16, которые не удержались на мембране 14, в особенности, если область реакции 16 гидрофильна по всей толщине мембраны 14.
Мембрана 18 может содержать материал, обеспечивающий пассивное поглощение за счет капиллярных явлений, такой как поглощающая бумага, целлюлоза и т.д., или состоять из поглощающих полимеров. Например, можно использовать следующие продукты:
- Millipore С048, С068, С083, С248
- Whatman CF3, CF4, CF10, категория 470, CF5, CF6, CF7, категория 900, категория 300
- Ahlstrom категории 601, 642, 631, 238, 237, 222, 243, 320
- Pall категории 111, 113, 133, 165, 197, 8975, 8964, 8301, Accuwik® Ultra
- Суперпоглощающая подложка Cleanis Gelmax
- Хлопок
Состав и размеры поглощающей мембраны 18 необходимо выбрать так, чтобы они могли поглотить все растворы, используемые при проведении исследования (Vобщий в мкл). Мембраны, которые можно охарактеризовать по их поглощающей способности (С в мкл/см2) и размерам (D в см2), подбирают так, чтобы соответствовать следующему уравнению: D>Vобщий/С.
Альтернативно, жидкость может поглощаться за счет разницы давлений между областью над мембраной и под ней. Например, для этого можно использовать аспирационную систему с частичным вакуумом.
Мембрана 14 и необязательно мембрана 18 помещены в подложку 12.
Подложка 12 устройства 10 по изобретению предпочтительно является жесткой подложкой. Например, это может быть твердая оболочка.
Подложка предпочтительно содержит жесткий материал, который не допускает протечек жидкости. В частности, это может быть пластик, такой как полипропилен, полиэтилен, полистирол, акрилонитрил-бутадиеновый стирол, полиэтилентерефталат, поликарбонат, полиамид, поливинилхлорид, метилполиметакрилат.
Предпочтительно подложка 12 содержит по меньшей мере одно отверстие 20, причем каждой гидрофильной области реакции 16 пористой мембраны 14 соответствует свое отверстие 20. Это отверстие 20 соответствует области сбора образца, депонированного на гидрофильную область реакции 16. Гидрофильная область 16 может быть по размеру идентична основанию отверстия, меньше или больше него, что означает, что две гидрофильные области всегда разделены гидрофобным участком на мембране 14.
Края отверстия 20 могут быть прозрачными, чтобы видеть расположенные ниже сигналы, если это требуется.
Размер области сбора должен быть таким, чтобы в ней мог поместиться по меньшей мере максимальный объем исследуемого образца, депонированного на реакционной мембране 16.
Независимость каждой области реакции 16 обеспечивается барьером, создаваемым гидрофобной мембраной между реакционными областями. Эта независимость позволяет выполнять несколько видов диагностики на одном и том же устройстве с одной мембраной. Согласно варианту изобретения, эту независимость можно также реализовать, сегментируя подложку 12 на физически независимые отделенные друг от друга сектора, каждый со своей собственной мембраной.
Кроме того, чтобы улучшить контакт между мембранами 14 и 18, можно создать область дополнительной уплотненной массы вокруг отверстия 20 и перед отверстием обтекателя напротив указанного отверстия 20.
Подложка 12 может представлять собой твердую оболочку с несколькими отверстиями 20, ее внешние размеры должны быть совместимы со стандартом SBS/AINSI.
Настоящее изобретение также относится к способу производства устройства 10, описанного выше, характеризующемуся тем, что он включает следующие этапы:
- гидрофилизацию гидрофобной пористой мембраны 14 толщиной от 0,05 до 1,5 мм с диаметром пор от 2 до 30 мкм, по меньшей мере в одной области 16 указанной мембраны с помощью по меньшей мере одного детергента;
- депонирование раствора перехватывающего агента;
- сушку;
- сборку пористой мембраны 14 и поглощающей мембраны 18, расположенной ниже пористой мембраны 14, на подложке 12.
Устройство 10 по изобретению можно применять для того, чтобы с использованием капиллярных явлений определять присутствие или отсутствие аналита в биологической жидкости, в частности в крови или одной из ее составных частей. Этот аналит может быть антигеном эритроцитарного фенотипа или антителом, направленным против этого антигена.
Устройство 10 может быть особенно полезно для:
- фенотипирования красных клеток, то есть, для определения антигенов на их поверхности,
- проведения теста Симонина, идентифицирующего наличие анти-А или анти-В антител,
- поиска или идентификации антител, направленных против клеточных антигенов для конкретных эритроцитов, что касается поиска аллоантител, аутоантител или даже холодовых агглютининов.
Таким образом, специфическим объектом изобретения является применение устройства 10 для идентификации и определения в образце крови или одного из ее компонентов групп крови по системе АВО, расширенного фенотипирования резуса, поиска иррегулярного агглютинина, поиска аутоантител, поиска холодового антиглобулина и/или перекрестной проверки на совместимость.
Применение устройства 10 по изобретению требует использования выявляющего агента. Предпочтительно, это красные кровяные клетки. Эти клетки:
- представляют собой красные кровяные клетки известного фенотипа, называемые пробами красных кровяных клеток, для применения в устройстве для поиска антител или выполнения теста Симонина;
- содержатся в исследуемом образце для применения в устройстве для фенотипирования.
Если целью является определение присутствия аналита в исследуемом образце, в зависимости от аналита может потребоваться изменить перехватывающий агент, выявляющий агент, способ гидрофилизации (одиночная или многократная, по толщине или на поверхности) и последующий протокол исследования.
В любом случае перед депонированием исследуемого образца на области реакции можно осуществить гидратацию области реакции 16 буферным раствором. Этот буфер может содержать раствор, рН которого стабилизирован в интервале от 6 до 8,5, предпочтительно от 6,5 до 7,8, в особенности от 7 до 7,5, а осмотическая концентрация находится в интервале от 250 мОсм до 800 мОсм, предпочтительно от 300 мОсм до 600 мОсм. Этот раствор может дополнительно содержать детергенты в низких концентрациях (Твин 20 от 0,01 до 0,05% (масс/об)), агенты насыщения (БСА) и/или агенты, способные усиливать реакции антиген-антитело.
Аналогично, чтобы узнать результаты, необходимо использовать промывку буфером. Такой буфер предпочтительно содержит PBS (забуференный фосфатом физиологический раствор), TBS (забуференный Трис физиологический раствор) или физиологический раствор рН от 2 до 10, предпочтительно от 5 до 9. Необходимо контролировать осмотическую концентрацию буфера, это позволит избежать гемолиза красных клеток. Буфер необходимо подобрать так, чтобы не отделить выявляющие агенты или окрашенные аналиты, прямо или косвенно зафиксированные перехватывающими агентами. Неожиданно оказалось, что для применения в устройстве по изобретению предпочтительно применять слегка гиперосмотические промывающие растворы (то есть, от 300 до 800 мОсм), полученные при растворении компонентов физиологического раствора, например, NaCl, или неионные осмолиты, такие как, например, глицин или таурин. Такой буфер можно окрасить красителями, контрастирующими с окраской выявляющего агента. Например, если выявляющий агент представляет собой красные кровяные клетки, промывающий буферный раствор можно окрасить в синий или зеленый цвета. Для устранения фонового шума к промывающему раствору можно также добавить незначительную концентрацию поверхностно-активного вещества. Такие поверхностно-активные вещества предпочтительно являются неионными веществами и, в частности, представляют собой сложные эфиры Сахаров, в особенности полиоксиэтиленовые эфиры сорбитана (Твин).
Работая с устройством 10, жидкости можно депонировать с помощью системы пипетирования или с использованием системы капиллярной репликации.
В основном, устройство по изобретению не нуждается ни в центрифугировании, ни в перемешивании, ни в вакуумировании, ни в специальных дополнительных устройствах. С ним можно полностью автономно работать вручную, а также его можно автоматизировать и использовать в составе роботизированных установок. Различные характеристики мембраны 14 позволяют контролировать скорость движения жидкости, делая его настолько медленным, чтобы успела пройти реакция антиген-антитело, каким бы большим ни был размер пор мембраны 14.
В соответствии с первым вариантом, изобретение направлено на применение устройства 10 для фенотипирования красных клеток.
Задача состоит в поиске антигенов на поверхности красных клеток. В данном случае антитело или смесь антител применяют в качестве перехватывающих агентов, способных распознавать специфические интересующие антигены или их варианты. В качестве антител можно использовать очищенные или полуочищенные моноклональные антитела, содержащее моноклональное антитело культуральное поверхностно-активное вещество (см. таблицу 1) или поликлональные антитела, анти-сыворотку. Можно также использовать агглютинины или лектины.
Далее приводится неполный список моноклональных антител:

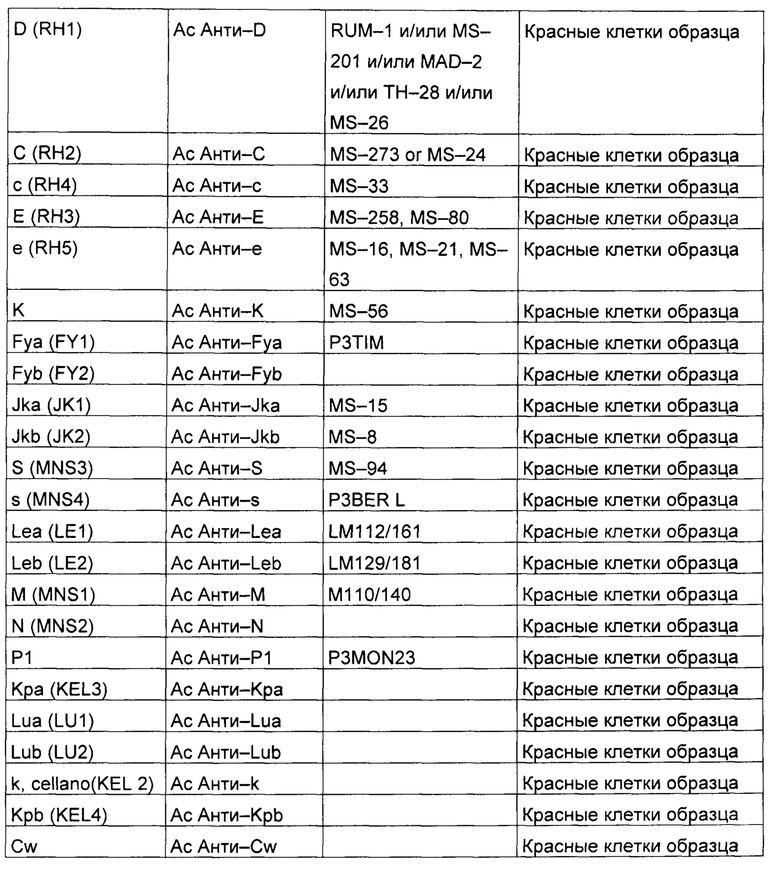
В соответствии с конкретным вариантом осуществления, изобретение направлено на способ фенотипирования эритроцитарных групп крови в образце эритроцитов (выделенные клетки или цельная кровь) для одновременного обнаружения популяции положительного фенотипа и популяции отрицательного фенотипа (двойная популяция), включающий следующие этапы:
- депонирование раствора для гидратации пористой мембраны 14 в центре области реакции устройства 10 по изобретению; причем указанная область реакции 16 содержит две гидрофильные области 16-1 и 16-2, где степень гидрофилизации в центре 16-1 области реакции больше, чем на периферии 16-2, и в центре находятся перехватывающие агенты, содержащие антитела; раствор для гидратации мембраны представляет собой такой раствор, который благоприятен для иммуногематологических реакций, возможно содержащий добавки, такие как, например, буфер с рН от 6 до 8,5, предпочтительно от 6,5 до 7,8, в особенности от 7 до 7,5, и осмолярностью от 250 до 800 мОсм, предпочтительно от 300 до 600 мОсм. Этот раствор может содержать детергенты в низкой концентрации (особенно, Твин 20 от 0,01 до 0,05% (масс/об)), насыщающие агенты (например, БСА) и/или агенты, способные усиливать реакции антиген-антитело. Этот буфер может обладать также протеазной активностью, достигаемой, например, путем добавления ферментов, таких как папаин или бромелаин. Буфер может также содержать поликатион-содержащие агенты, такие как полибрен или полилизин, для усиления реакции и увеличения продолжительности контакта клеток с перехватывающим элементом;
- разведение подлежащих фенотипированию красных клеток в буферном растворе, конкретно, в буферном растворе, благоприятном для иммуногематологических реакций, возможно содержащем добавки, например, в буфере с рН от 6 до 8,5, предпочтительно от 6,5 до 7,8, в особенности от 7 до 7,5, и осмолярностью от 250 до 800 мОсм, предпочтительно от 300 до 600 мОсм. Этот раствор может содержать детергенты в низкой концентрации (особенно, Твин 20 от 0,01 до 0,05% (масс/об)), насыщающие агенты (например, БСА) и/или агенты, способные усиливать реакции антиген-антитело. Этот буфер может обладать также протеазной активностью, достигаемой, например, путем добавления ферментов, таких как папаин или бромелаин. Буфер может также содержать поликатион-содержащие агенты, такие как полибрен или полилизин, для усиления реакции и увеличения продолжительности контакта клеток с перехватывающим элементом;
- введение этого раствора, содержащего подлежащие фенотипированию красные клетки, в центр 16-1 области реакции;
- инкубация при температуре, предпочтительно от 15 до 40°С, в частности от 18 до 25°С, в течение времени от 60 секунд до 15 минут, в частности от 2 до 10 минут;
- депонирование в область реакции промывающего раствора; промывающим является раствор, не препятствующий реакциям антиген-антитело, поддерживающий целостность красных клеток и не допускающий неспецифических взаимодействий, такой как, например, буфер с рН от 6 до 8,5, предпочтительно от 6,5 до 7,8, в особенности от 7 до 7,5, и осмолярностью от 250 до 800 мОсм, предпочтительно от 300 до 600 мОсм. Этот раствор может содержать детергенты в низкой концентрации (особенно, Твин 20 от 0,01 до 0,05% (масс/об)), насыщающие агенты (например, БСА) и/или агенты, способные усиливать реакции антиген-антитело. Если ранее использовали поликатионный агент, то этот буфер должен быть сильно ионным, например, должен содержать более 100 мМ NaCl, чтобы разрушить неспецифические взаимодействия, вызванные добавкой этого типа.
Депонируемый образец может представлять собой красные клетки или цельную кровь. Образец можно разбавить в буфере, содержащим раствор с рН, стабилизированным в интервале от 6 до 8,5, предпочтительно от 6,5 до 7,8, в особенности от 7 до 7,5, и осмолярностью от 250 до 800 мОсм, предпочтительно от 300 до 600 мОсм. Этот раствор может содержать детергенты в низкой концентрации (особенно, Твин 20 от 0,01 до 0,05% (масс/об)), насыщающие агенты (например, БСА) и/или агенты, способные усиливать реакции антиген-антитело. Этот буфер может обладать также протеазной активностью, достигаемой, например, путем добавления ферментов, таких как папаин или бромелаин.
Гидрофилизация областей реакции 16 мембраны 14 устройства 10, осуществляемая для выполнения этого процесса, предпочтительно представляет собой гидрофилизацию поверхности.
Например, гидрофилизацию можно осуществить раствором Твина 20 в этаноле в концентрации от 0,1 до 1% (масс/об), предпочтительно от 0,2 до 1% (масс/об), в объеме от 2 до 40 мкл, и предпочтительно от 5 до 20 мкл, в центре которого создается область гидрофилизации, а толщина обеспечивается применением водного раствора Тритона X100 в концентрации от 0,1 до 2% (масс/об), предпочтительно от 0,5 до 1% (масс/об), в объеме от 25 нл до 15 мкл, предпочтительно от 100 нл до 10 мкл.
Если красные клетки, присутствующие в образце, содержат антиген, распознаваемый перехватывающим элементом, они остаются иммобилизированными в центре области реакции 16 мембраны 14, несмотря на промывку, и центральная область реакции 16-1 остается красной. Если красные клетки образца не содержат антигена, распознаваемого перехватывающим элементом, они вымываются при промывке: центральная область 16-1 остается белой, а в периферической области 16-2 формируется красное кольцо. Если образец содержит две различные популяции, наблюдается красное окрашивание центра 22-1 и периферического кольца 22-2.
Регистрация результатов может осуществляться визуально или в автоматическом режиме.
В соответствии с еще одним вариантом осуществления изобретение направлено на способ фенотипирования эритроцитарных групп крови в образце эритроцитов (выделенные клетки или цельная кровь), не допускающий обнаружение двойных популяций и включающий следующие этапы:
- депонирование раствора для гидратации пористой мембраны 14 в центре области реакции устройства 10 по изобретению; причем указанная область реакции 16 содержит одну гидрофильную область, где находятся перехватывающие агенты, содержащие антитела; раствор для гидратации мембраны представляет собой такой раствор, который благоприятен для иммуногематологических реакций, возможно, содержащий добавки, такой как, например, буфер с рН от 6 до 8,5, предпочтительно от 6,5 до 7,8, в особенности от 7 до 7,5, и осмолярностью от 250 до 800 мОсм, предпочтительно от 300 до 600 мОсм. Этот раствор может содержать детергенты в низкой концентрации (особенно, Твин 20 от 0,01 до 0,05% (масс/об)), насыщающие агенты (например, БСА) и/или агенты, способные усиливать реакции антиген-антитело. Этот буфер может обладать также протеазной активностью, достигаемой, например, путем добавления ферментов, таких как папаин или бромелаин. Буфер может также содержать поликатион-содержащие агенты, такие как полибрен или полилизин, для усиления реакции и увеличения продолжительности контакта клеток с перехватывающими элементами;
- возможное разведение подлежащих фенотипированию красных клеток в буферном растворе, конкретно, в буферном растворе, благоприятном для иммуногематологических реакций, возможно, содержащем добавки, например, в буфере с рН от 6 до 8,5, предпочтительно от 6,5 до 7,8, в особенности от 7 до 7,5, и осмолярностью от 250 до 800 мОсм, предпочтительно от 300 до 600 мОсм. Этот раствор может содержать детергенты в низкой концентрации (особенно, Твин 20 от 0,01 до 0,05% (масс/об)), насыщающие агенты (например, БСА) и/или агенты, способные усиливать реакции антиген-антитело. Этот буфер может обладать также протеазной активностью, достигаемой, например, путем добавления ферментов, таких как папаин или бромелаин. Буфер может также содержать поликатион-содержащие агенты, такие как полибрен или полилизин, для усиления реакции и увеличения продолжительности контакта клеток с перехватывающим элементом;
- введение этого раствора, содержащего подлежащие фенотипированию красные клетки, в центр области реакции;
- инкубация при температуре, предпочтительно от 15 до 40°С, в частности, от 18 до 25°С, в течение времени от 2 секунд до 15 минут, в частности, от 1 до 10 минут;
- депонирование в область реакции промывающего раствора; промывающим является раствор, не препятствующий реакциям антиген-антитело, поддерживающий целостность красных клеток и не допускающий неспецифических взаимодействий, такой как, например, буфер с рН от 6 до 8,5, предпочтительно от 6,5 до 7,8, предпочтительно от 7 до 7,5, и осмолярностью от 250 до 800 мОсм, предпочтительно от 300 до 600 мОсм. Этот раствор может содержать детергенты в низкой концентрации (особенно, Твин 20 от 0,01 до 0,05% (масс/об)), насыщающие агенты (например, БСА) и/или агенты, способные усиливать реакции антиген-антитело. Если ранее использовали поликатионный агент, то этот буфер должен быть сильно ионным, например, должен содержать более 100 мМ NaCl, чтобы разрушить неспецифические взаимодействия, вызванные добавкой этого типа.
Гидрофилизация областей реакции 16 мембраны 14 устройства 10, осуществляемая для выполнения этого процесса, может представлять собой гидрофилизацию по толщине мембраны. Необходимо, чтобы устройство 10 содержало также поглощающую систему, расположенную ниже мембраны 14, например, поглощающую мембрану 18.
Гидрофилизацию можно проводить водным раствором Тритон Х100 в концентрации от 0,1 до 2% (масс/об), предпочтительно от 0,5 до 1% (масс/об), в объеме от 25 нл до 15 мкл, предпочтительно от 100 нл до 10 мкл.
Если красные клетки образца содержат антиген, распознаваемый перехватывающим элементом, они остаются иммобилизированными в центре 22 области реакции 16 мембраны 14, несмотря на промывку, и область реакции 16 остается красной. Если красные клетки образца не содержат антигена, распознаваемого перехватывающим элементом, они вымываются при промывке и Область реакции 16 остается белой. Поглощающая мембрана 18 поглощает (область 24) все, что не связалось с мембраной 14.
Регистрация результатов может осуществляться визуально или в автоматическом режиме.
В соответствии со вторым вариантом, изобретение направлено на применение устройства 10 для обнаружения мультивалентных антител в крови или тесте Симонина.
Задачей является поиск специфических антител. Таким образом, перехватывающий элемент содержит антиген, против которого направлено предпочтительное антитело.
Иммобилизированные антигены могут представлять собой синтетические антигены, сопряженные или нет с полимером или протеином. Кроме того, они могут представлять собой рекомбинантные протеины, содержащие одну или более последовательности антигена или смеси антигенов предпочтительных вариантов. Иммобилизированные антигены могут также находится на клетках или фрагментах клеток, в особенности, на фрагментах мембран или клетках без цитоплазматического содержимого. Такие клетки, в частности, могут быть красными клетками без цитоплазмы, называемыми также "тенями".
Если образец содержит антитела против интересующего антигена, последние прикрепляются к поверхности мембраны 14 на уровне области реакции 16.
Необходимо использовать выявляющий элемент для обнаружения этих антител, также распознавая их природу (анти-IgG, анти-IgM). Если же применяемое антитело является мультивалентным (может одновременно обнаружить несколько антигенов), то можно воспользоваться выявляющим элементом, также несущим интересующий антиген.

Еще одним объектом изобретения является способ обнаружения присутствующих в крови мультивалентных антител в образце плазмы, сыворотки или цельной крови, включающий следующие этапы:
- депонирование исследуемого образца в область реакции 16 устройства 10, причем указанная область реакции 16 содержит перехватывающие агенты, включая антигены;
- введение красных клеток известного фенотипа, содержащих те же антигены, что и перехватывающие агенты;
- прохождение смеси через гидрофильную область, причем указанная гидрофильная область обеспечивает время прохождения через нее от 1 до 45 минут, предпочтительно от 3 до 15 минут;
- депонирование в область реакции промывающего раствора, такого как, например, буфер с рН от 6 до 8,5, предпочтительно от 6,5 до 7,8, в особенности от 7 до 7,5, и осмолярностью от 250 до 800 мОсм, предпочтительно от 300 до 600 мОсм. Этот раствор может содержать детергенты в низкой концентрации (особенно, Твин 20 от 0,01 до 0,05% (масс/об)) и насыщающие агенты (например, БСА).
Образец для депонирования может представлять собой плазму, сыворотку или цельную кровь, разбавленную или нет в буфере, содержащим раствор рН от 6 до 8,5, предпочтительно от 6,5 до 7,8, в особенности от 7 до 7,5, и осмолярностью от 250 до 800 мОсм, предпочтительно от 300 до 600 мОсм. Этот раствор может дополнительно содержать детергенты в низкой концентрации (например, Твин 20 от 0,01 до 0,05% (масс/об)), насыщающие агенты (особенно, БСА), и/или агенты, способные усиливать реакции антиген-антитело. Минерализация буфера составляет предпочтительно менее 100 мМ NaCl.
Гидрофилизация областей реакции 16 мембраны 14 устройства 10, осуществляемая для выполнения этого процесса, предпочтительно проводится по толщине мембраны. Таким образом, необходимо, чтобы устройство 10 содержало также поглотительную систему, расположенную ниже мембраны 14, например, поглощающую мембрану 18.
Гидрофилизацию можно проводить водным раствором Тритона Х100 в концентрации от 0,3 до 2% (масс/об), предпочтительно от 0,5 до 1% (масс/об), в объеме от 25 нл до 15 мкл, предпочтительно от 100 нл до 10 мкл. Перехватывающие агенты могут быть депонированы на мембране, смешаны с детергентом или добавлены после гидрофилизации реакционных областей 16.
Если исследуемая плазма содержит антитела против антигена, присутствующего в перехватывающем агенте и в выявляющем агенте (пробы красных кровяных клеток), в области реакции 16 появляется красный центр 22. Белый центр сигнализирует об отсутствии в исследуемой плазме антител, направленных против антигена, присутствующего в перехватывающем и в выявляющем агенте (пробы красных кровяных клеток). Поглощающая мембрана 18 поглощает (область 24) все, что не связалось с мембраной 14.
Регистрация результатов может осуществляться визуально или в автоматическом режиме.
В соответствии с третьим вариантом, изобретение направлено на применение устройства 10 для обнаружения иррегулярного агглютинина в крови.
Задачей является идентификация красных клеток, сенситизированных антителами плазмы образца или активацией последующего комплемента.
В таком формате перехватывающий агент либо отсутствует, либо он представляет собой агент агрегации, такой как поликатионный полимер.
После инкубации с плазмой тестовой панели красных клеток в смесь добавляют агент, способный обратно агрегировать красные клетки. Такой агент обратной агрегации можно выбрать из поликатионных полимеров, например, полибрена, полилизина или полиэтиленимина. Красные кровяные клетки удерживаются и формируют сгусток глобул, поскольку размер сформированных агрегатов слишком велик, чтобы они могли пройти через мембрану. Глобулы отмывают от избытка неспецифических глобулинов с помощью раствора, содержащего также и агент агрегации, чтобы не допустить дестабилизации сгустка. После промывки удержанных глобул добавляют многовалентный реагент Кумбса, который позволяет осуществить ретикуляцию клеток сгустка, если они были сенситизированы. Добавление основанного на физиологическом растворе буфера с небольшим количеством поверхностно-активного вещества разрушает агрегаты несенситизированных клеток и сохраняет агрегаты ретикулированных сенситизированных клеток.
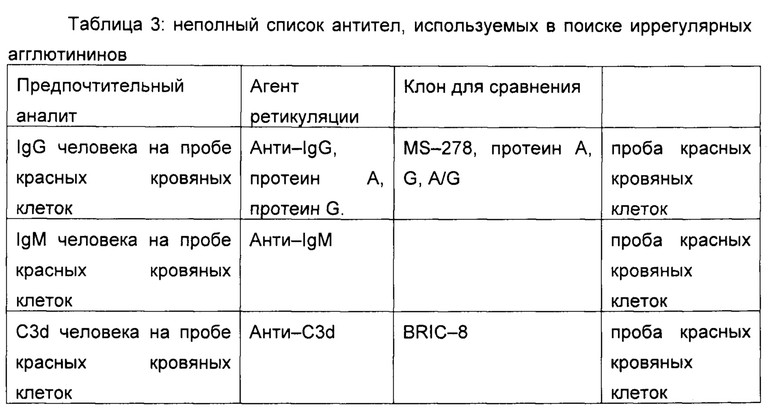
Для реализации этих способов гидрофилизацию реакционных областей 16 мембраны 14 устройства 10 предпочтительно выполняют по толщине. Таким образом, необходимо, чтобы устройство 10 также содержало поглотительную систему, расположенную ниже мембраны 14, например, поглощающую мембрану 18.
Гидрофилизацию можно проводить водным раствором Тритона Х100 в концентрации от 0,3 до 2% (масс/об), предпочтительно от 0,5 до 1% (масс/об), в объеме от 25 нл до 15 мкл, предпочтительно от 100 нл до 10 мкл. Можно, преимущественно, использовать агент обратной агрегации, предпочтительно выбранных из поликатионных полимеров, например, полибрена, полилизина или полиэтиленимина.
В соответствии с этим третьим вариантом, еще один объект изобретения представляет собой способ обнаружения анти-эритроцитарных антител в крови, перекрестной проверки на совместимость или поиска аутоантител или холодового агглютинина в образце плазмы, сыворотки или цельной крови, характеризующийся следующими этапами:
- для поиска аллоантител исследуемый образец сначала инкубируют с буфером, пробами красных кровяных клеток известного фенотипа и агентом, способным агрегировать красные клетки, при температуре от 15 до 40°С, предпочтительно около 37°С, в течение времени от 3 до 60 минут, предпочтительно от 5 до 30 минут; буфер характеризуется низкой ионной силой (L ISS-буфер, где LISS=low ionic strength, низкая ионная сила), например, он содержит менее 50 мМ NaCl; для поиска аутоантител используют просто раствор красных кровяных клеток образца без предварительной инкубации;
- к этой смеси добавляют агент, способный агрегировать клетки, например, раствор гексадиметрин бромида;
- через промежуток времени, предпочтительно от 15 секунд до 5 минут, смесь депонируют в область реакции 16 устройства 10 по изобретению и позволяют ей течь; над пятном она формирует сгустки клеток;
- в область реакции депонируют раствор, содержащий агент, способный агрегировать красные клетки, где этот агент может представлять собой, например, раствор гексадиметринбромида, предпочтительно, концентрация гексадиметринбромида в растворе находится в интервале от 0,01 до 2% (масс/об), еще более предпочтительно в интервале от 0,05 до 0,5%; данный агент позволяет отмыть неспецифические протеины и обеспечивает целостность сгустка клеток;
- в область реакции депонируют реагент Кумбса, человеческий антиглобулин или анти-комплемент; а также
- в область реакции депонируют промывающий раствор, такой как, например, гипертонический физиологический раствор, имеющий рН от 6 до 8,5, предпочтительно от 6,5 до 7,8, предпочтительно от 7 до 7,5, и осмолярность от 300 до 800 мОсм. Этот раствор может дополнительно содержать детергенты в низкой концентрации (например, Твин 20 от 0,01 до 0,05% (масс/об)) и краситель, цвет которого контрастирует с красным (синий или зеленый).
Подлежащий депонированию образец может представлять собой плазму, сыворотку или цельную кровь, разбавленную или нет в буфере, содержащем раствор с рН от 6 до 8,5, предпочтительно от 6,5 до 7,8, в особенности от 7 до 7,5, и осмолярностью от 250 до 800 мОсм, предпочтительно от 300 до 600 мОсм. Этот раствор может дополнительно содержать детергенты в низкой концентрации (например, Твин 20 от 0,01 до 0,05% (масс/об)), насыщающие агенты (особенно, БСА), и/или агенты, способные усиливать реакции антиген-антитело. Минерализация буфера составляет предпочтительно менее 50 мМ NaCl.
Если исследуемая плазма содержит антитела, направленные против антигена, присутствующего в выявляющем агенте (пробы красных кровяных клеток), или если красные кровяные клетки образца уже сенситизированы in vivo, в области реакции 16 появляется красное центральное пятно 22. Белое центральное пятно сигнализирует об отсутствии или недетектируемом количестве антител, направленных против антигена выявляющего агента (пробы красных кровяных клеток). Поглощающая мембрана 18 поглощает (область 24) все, что не связалось с мембраной 14.
Регистрация результатов может осуществляться визуально или в автоматическом режиме.
С помощью устройства 10 по изобретению можно проводить комплементарные тесты, чаще всего одновременно выполняемые специалистами на одной карточке, при этом все тесты проводят и интерпретируют одинаково.
На каждой карточке можно регистрировать несколько аналитов, сгруппированных в столбцы для каждого образца (донора или пациента), а сами образцы группируются в строки (то есть, по строкам представлены образцы, по столбцам - аналиты). Это могут быть, например, карточки для:
- определения группы крови по системе ABO-D
- определения резуса по системе Резуса-Келла
- поиска иррегулярного агглютинина (3 эритроцитарных фенотипа)
- идентификации иррегулярного агглютинина (10 эритроцитарных фенотипов)
- расширенного фенотипирования
- прямого контроля с антиглобулином,
- прямого теста на совместимость
Устройство 10 по изобретению может входить в состав набора, включающего также реагенты, необходимые для выполнения по меньшей мере одного из способов применения указанного устройства.
Группа изобретений относится к устройству для диагностики in vitro и применению этого устройства для идентификации и определения групп крови. Раскрыто устройство (10) для диагностики in vitro для детекции по меньшей мере одной реакции между антигеном эритроцитарного фенотипа и антителом, содержащее подложку (12) и гидрофобную пористую мембрану (14) толщиной от 0,05 до 1,5 мм с диаметром пор от 2 до 30 мкм, причем указанная мембрана содержит по меньшей мере одну гидрофильную область реакции (16), предназначенную для получения указанного образца, и поверхность гидрофильной области реакции (16) меньше поверхности гидрофобной пористой мембраны (14). Также раскрыты способ изготовления данного устройства, способ фенотипирования эритроцитарных групп крови, способ обнаружения холодового агглютинина, аутоантител, мультивалентных и анти-эритроцитарных антител, а также способ проведения перекрестной проверки на совместимость образца плазмы с использованием указанного устройства. Группа изобретений обеспечивает надежное, мобильное и экономичное устройство, которое является простым в изготовлении и использовании, миниатюрным, автоматизированным и позволяет проводить анализ с высокой чувствительностью. 10 н. и 16 з.п. ф-лы; 7 ил., 3 табл.
1. Устройство (10) для диагностики in vitro для детекции по меньшей мере одной реакции между антигеном эритроцитарного фенотипа и антителом, специфически направленным против этого антигена, в образце крови или одного из ее компонентов, характеризующееся тем, что оно содержит:
- подложку (12) и
- гидрофобную пористую мембрану (14) толщиной от 0,05 до 1,5 мм с диаметром пор от 2 до 30 мкм, причем указанная мембрана содержит по меньшей мере одну гидрофильную область реакции (16), предназначенную для получения указанного образца, и поверхность гидрофильной области реакции (16) меньше поверхности гидрофобной пористой мембраны (14).
2. Устройство (10) для диагностики по п. 1, характеризующееся тем, что гидрофильная область реакции (16) пористой мембраны (14) сделана гидрофильной с помощью детергента без модификации химических функций пористого субстрата предварительной физической или химической обработкой пористой мембраны.
3. Устройство (10) для диагностики по п. 2, характеризующееся тем, что детергент представляет собой неионное поверхностно-активное вещество.
4. Устройство (10) для диагностики по п. 2, характеризующееся тем, что детергент применяют в дозе от 0,01 до 2% вес/объем.
5. Устройство (10) для диагностики по п. 1, характеризующееся тем, что пористая мембрана (14) закреплена на подложке (12) и что подложка (12) содержит по меньшей мере одно отверстие (20), причем каждой гидрофильной области реакции (16) пористой мембраны соответствует свое отверстие (20).
6. Устройство (10) для диагностики по п. 1, характеризующееся тем, что подложка (12) представляет собой твердую пластиковую подложку.
7. Устройство (10) для диагностики по п. 1, характеризующееся тем, что оно также содержит поглощающую мембрану (18), расположенную ниже пористой мембраны (14).
8. Устройство (10) для диагностики по п. 1, характеризующееся тем, что гидрофильная область реакции (16) пористой мембраны (14) содержит еще перехватывающие агенты, способные удержать соответствующий аналит.
9. Устройство (10) для диагностики по п. 8, характеризующееся тем, что перехватывающие агенты, способные удержать соответствующий аналит, содержат антигены конкретного фенотипа эритроцитов.
10. Устройство (10) для диагностики по п. 9, характеризующееся тем, что перехватывающие агенты, способные удержать соответствующий аналит, представляют собой красные кровяные клетки, лишенные гемоглобина.
11. Устройство (10) для диагностики по п. 8, характеризующееся тем, что перехватывающие агенты, способные удержать соответствующий аналит, представляют собой антитела.
12. Устройство (10) для диагностики по п. 8, характеризующееся тем, что перехватывающие агенты, способные удержать соответствующий аналит, представляют собой поликатионные полимеры.
13. Устройство (10) для диагностики по п. 1, характеризующееся тем, что область реакции (16) гидрофильна по всей толщине пористой мембраны.
14. Устройство (10) для диагностики по п. 1, характеризующееся тем, что область реакции (16) гидрофильна на поверхности пористой мембраны.
15. Устройство (10) для диагностики по п. 1, характеризующееся тем, что область реакции (16) содержит две гидрофильные области (16-1 и 16-2), причем степень гидрофилизации в центре (16-1) области реакции больше, чем на периферии (16-2).
16. Устройство (10) для диагностики по п. 1, характеризующееся тем, что область реакции (16) содержит две гидрофильные области с различной степенью гидрофилизации, одна из которых располагается на поверхности, а другая - в толщине мембраны.
17. Устройство (10) для диагностики по п. 15, характеризующееся тем, что область реакции (16) сделана гидрофильной с помощью двух различных детергентов без модификации химических функций пористого субстрата предварительной физической или химической обработкой пористой мембраны.
18. Способ производства устройства (10) по п. 1, характеризующийся тем, что включает следующие этапы:
- гидрофилизацию гидрофобной пористой мембраны (14) толщиной от 0,05 до 1,5 мм с диаметром пор от 2 до 30 мкм, по меньшей мере в одной области (16) указанной мембраны с помощью по меньшей мере одного детергента;
- сушку.
19. Применение устройства по п. 1 для идентификации и определения групп крови.
20. Способ фенотипирования эритроцитарных групп крови в образце эритроцитов для обнаружения присутствия двух различных популяций антигенов, характеризующийся следующими этапами:
- дополнительное депонирование раствора для гидратации пористой мембраны (14) в центре области реакции устройства (10) по п. 1; причем указанная область реакции (16) дополнительно содержит две гидрофильные области (16-1, 16-2), где степень гидрофилизации в центре (16-1) области реакции больше, чем на периферии (16-2), и дополнительно в центре находятся перехватывающие агенты, способные удержать соответствующий аналит, содержащие антитела;
- разведение подлежащих фенотипированию красных клеток в буферном растворе;
- введение этого раствора, содержащего подлежащие фенотипированию красные клетки, в центр области реакции;
- инкубация;
- депонирование в область реакции промывающего раствора и
- обнаружение присутствия двух различных популяций антигенов, если центр (22-1) и периферическое кольцо (22-2) области реакции остаются красными после депонирования промывающего раствора.
21. Способ фенотипирования эритроцитарных групп крови в образце эритроцитов, характеризующийся следующими этапами:
- дополнительное депонирование раствора для гидратации пористой мембраны (14) в центре области реакции (16) устройства (10) по п. 1, причем указанная область реакции (16) дополнительно содержит одну гидрофильную область и дополнительно содержит перехватывающие агенты, способные удержать соответствующий аналит, содержащие антитела;
- разведение подлежащих фенотипированию красных клеток в буферном растворе;
- введение этого раствора, содержащего подлежащие фенотипированию красные клетки, в центр области реакции;
- инкубация;
- депонирование в область реакции промывающего раствора и
- определение присутствия антигена группы крови, если красные клетки, присутствующие в образце, содержат антиген, распознаваемый перехватывающим элементом, остаются таким образом иммобилизированными в центре (22) области реакции (16) пористой мембраны, которая остается красной, или определение отсутствия антигена группы крови, если красные клетки, присутствующие в образце, не содержат антиген, распознаваемый перехватывающим элементом, и область реакции (16) остается белой после депонирования промывающего раствора.
22. Способ обнаружения присутствующих в крови мультивалентных антител в образце плазмы, сыворотки или цельной крови, включающий следующие этапы:
- депонирование исследуемого образца в область реакции (16) устройства (10) по п. 1, причем указанная область реакции (16) дополнительно содержит перехватывающие агенты, содержащие антигены;
- введение проб красных кровяных клеток известного фенотипа, содержащих те же антигены, что и перехватывающие агенты, способные удержать соответствующий аналит;
- прохождение смеси через гидрофильную область;
- депонирование в область реакции промывающего раствора и
- определение присутствия мультивалентных антител к антигену, присутствующему в перехватывающем агенте, если центр (22) области реакции (16) остается красным, или определение отсутствия мультивалентных антител, если центр (22) области реакции (16) остается белым после депонирования промывающего раствора.
23. Способ обнаружения присутствующих в крови антиэритроцитарных антител в образце плазмы, сыворотки или цельной крови, характеризующийся следующими этапами:
- предварительная инкубация исследуемого образца с буфером, пробами красных кровяных клеток известного фенотипа и агентом, способным агрегировать красные клетки;
- добавление к этой смеси агента, способного агрегировать красные клетки;
- депонирование смеси в область реакции (16) устройства (10) по п. 1;
- депонирование в область реакции раствора, содержащего агент, способный агрегировать красные клетки;
- депонирование в область реакции реагента Кумбса, человеческого антиглобулина или антикомплемента;
- депонирование в область реакции промывающего раствора и
- определение присутствия антиэритроцитарных антител, если исследуемая плазма содержит антитела, направленные против проб красных кровяных клеток известного фенотипа, центр (22) области реакции (16) остается красным, или определение отсутствия указанных антител, если в области реакции (16) появляется белое центральное пятно (22) после депонирования промывающего раствора.
24. Способ проведения перекрестной проверки на совместимость образца плазмы, характеризующийся следующими этапами:
- предварительная инкубация исследуемого образца с буфером, красными кровяными клетками известного фенотипа и агентом, способным агрегировать красные клетки;
- добавление к этой смеси агента, способного агрегировать красные клетки;
- депонирование смеси в область реакции (16) устройства (10) по п. 1;
- депонирование в область реакции раствора, содержащего агент, способный агрегировать красные клетки;
- депонирование в область реакции реагента Кумбса, человеческого антиглобулина или антикомплемента;
- депонирование в область реакции промывающего раствора и
- определение присутствия антиэритроцитарных антител, если исследуемая плазма содержит антитела, направленные против красных кровяных клеток известного фенотипа, центр (22) области реакции (16) остается красным, или определение отсутствия указанных антител, если в области реакции (16) появляется белое центральное пятно (22) после депонирования промывающего раствора.
25. Способ поиска аутоантител в образце плазмы, сыворотки или цельной крови, характеризующийся следующими этапами:
- добавление к исследуемому образцу агента, способного агрегировать красные клетки;
- депонирование смеси в область реакции (16) устройства (10) по п. 1;
- депонирование в область реакции раствора, содержащего агент, способный агрегировать красные клетки;
- депонирование в область реакции реагента Кумбса, человеческого антиглобулина или антикомплемента;
- депонирование в область реакции промывающего раствора и
- определение присутствия аутоантител, если исследуемая плазма содержит аутоантитела, направленные против антигена, присутствующего в выявляющем агенте, в области реакции (16) появляется красное центральное пятно (22), или определение отсутствия указанных аутоантител, если в области реакции (16) появляется белое центральное пятно (22) после депонирования промывающего раствора.
26. Способ поиска холодового агглютинина в образце плазмы, сыворотки или цельной крови, характеризующийся следующими этапами:
- предварительная инкубация исследуемого образца с буфером, пробами красных кровяных клеток известного фенотипа и агентом, способным агрегировать красные клетки;
- добавление к этой смеси агента, способного агрегировать красные клетки;
- депонирование смеси в область реакции (16) устройства (10) по п. 1;
- депонирование в область реакции раствора, содержащего агент, способный агрегировать красные клетки;
- депонирование в область реакции реагента Кумбса, человеческого антиглобулина или антикомплемента;
- депонирование в область реакции промывающего раствора и
- определение присутствия холодового агглютинина, если исследуемая плазма содержит аутоантитела, направленные против антигена, присутствующего в выявляющем агенте, в области реакции (16) появляется красное центральное пятно (22), или определение отсутствия указанного холодового агглютинина, если в области реакции (16) появляется белое центральное пятно (22) после депонирования промывающего раствора.
| МАГНИТНАЯ СИСТЕМА ЭЛЕКТРОМАГНИТНОГО АППАРАТА | 0 |
|
SU367468A1 |
| ПОЛУАВТОМАТ ДЛЯ НАМОТКИ ЭЛЕКТРИЧЕСКИХ СОПРОТИВЛЕНИЙ | 0 |
|
SU408378A1 |
| ТЕСТ-СИСТЕМА С ИСПОЛЬЗОВАНИЕМ ЭЛЕМЕНТОВ НЕЭНЗИМАТИЧЕСКОГО РАСПОЗНАВАНИЯ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА | 2005 |
|
RU2398235C2 |
| WO 2009007649 A2, 15.01.2009. | |||
Авторы
Даты
2019-04-18—Публикация
2013-06-11—Подача