РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет по предварительной заявке на патент США №61/802,259, поданной 15 марта 2013 г., и по предварительной заявке на патент США №61/809,290, поданной 5 апреля 2013 г. Полное содержание обеих заявок полностью включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым гетероарильным непептидным соединениям, которые имитируют гептапептид агниотензина (1-7) [Ang(1-7)] и действуют как антагонисты рецептора Mas, в частности, селективно. Настоящее изобретение также относится к способам применения таких соединений в качестве терапевтических средств, в частности, для лечения связанных с ангиотензином заболеваний или нарушений, к фармацевтическим композициям, содержащим такие соединения и к путям синтеза для получения таких соединений.
УРОВЕНЬ ТЕХНИКИ
Широкий диапазон физиологических и патофизиологических состояний связан с ренин-ангиотензиновой системой (РАС), которая является важным регулятором артериального кровяного давления и включает образование и действие нескольких ангиотензиновых пептидов (Фигура 1). Основные ангиотензиновые пептиды включают декапептид ангиотензин I (Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu), октапептид ангиотензин II (Asp-Arg-Val-Tyr-Ile-His-Pro-Phe), гептапептид ангиотензина (1-7) (Asp-Arg-Val-Tyr-Ile-His-Pro) и гексапептид ангиотензин IV (Val-Tyr-Ile-His-Pro-Phe).
Пептиды ангиотензина и родственные им ферменты играют ключевые роли в сердечно-сосудистой системе, почечной системе, гематопоэтической системе, гепатобилиарной системе, легочной системе, желудочно-кишечной системе, нервной системе и во многих других важнейших физиологических и патофизиологических путях, частично за счет стимуляции активности стволовых клеток (Фигура 1). Ренин воздействует на ангиотензиноген, в результате чего образуется ангиотензин I (AngI), который расщепляется ангиотензинпревращающим ферментом (АСЕ, АПФ) с образованием ангиотензина II (AngII) и нейтральными эндопептидазами с образованием Ang(1-7), который также образуется из AngII в результате расщепления под действием АСЕ2.
Три сопряженных с G-белком рецептора (GPCR), которые являются медиаторами многих эффектов пептидов ангиотензина, представляют собой рецептор AngII 1 типа (AT1R), рецептор AngII 2 типа (AT2R) и рецептор Mas (Mas), известный как нативный рецептор для Ang(1-7). Активация или дезактивация этих рецепторов играет важные роли в многочисленных тканях, включая сердце, кровеносные сосуды, печень, почки и головной мозг. Разработка селективных антагонистов для AT1R дала много важных терапевтических средств для лечения болезней сердца и других состояний. Позднее выяснение полезных эффектов AT2R привело к появлению селективных агонистов AT2R в качестве потенциальных терапевтических средств.
Согласно настоящему изобретению раскрыт новый класс низкомолекулярных миметиков Ang(1-7), которые обладают способностью связываться с рецептором Mas и активировать его, и могут служить в качестве потенциальных терапевтических средств для широкого спектра заболеваний, связанных с ангиотензином. Ang(1-7) действует как эндогенный агонист рецептора Mas, и было показано, что он обладает рядом важных полезных эффектов.
Было показано, что Ang(1-7) модулирует каскады, на которые влияют ожирение и диабет, а также, что он оказывает благоприятные эффекты при ишемическом повреждении органов при диабете и гипертензии (Benter et al., 2006; 2007; Singh et al., 2011). В модели метаболического синдрома у крыс повышенные уровни Ang(1-7) в циркулирующей крови повышали толерантность к глюкозе, чувствительность к инсулину и снижали дислипидемию (Santos et al., 2010; Marcus et al., 2012). Кроме того, Ang(1-7) улучшает сердечную функцию у животных с диабетом и после инфаркта миокарда и обращает угнетение костного мозга, вызванное диабетом (Loot et al., 2002; Langeveld et al., 2008; Ebermann et al, 2008). В Фазе II клинического испытания, было показано, что пептидный аналог Ang(1-7) уменьшает диабетическое осложнение при незаживающих язвах (Balingat et al, 2012). Хотя этот пептид может иметь потенциальное применение в снижении диабета и резистентности к инсулину, ежедневные инъекции пептида не могут быть оптимальным путем введения, гарантирующим, что пациент с хроническим заболеванием будет придерживаться лечения. Поэтому сохраняется потребность в низкомолекулярных аналогах Ang(1-7), которые можно эффективно применять для контроля диабета, характеризующиеся улучшенной приверженностью пациентов лечению.
Ang(1-7) и его пептидные аналоги являются негипертензивными регенеративными факторами в клинических испытаниях по ускорению излечивания гематопоэтических и кожных повреждений. Фармацевтические составы, содержащие Ang(1-7), продемонстрировали безопасность для клинического использования, а также было обнаружено, что они стимулируют восстановление костного мозга и гематопоэза (Rodgers et al, 2002, 2006 и Pham et al 2013). Была показана активность Ang(1-7) в нескольких моделях регенерации тканей. Предполагают, что эффекты Ang(1-7) реализуются за счет образования метаболитов арахидоновой кислоты, оксида азота (NO) или метаболитов брадикинина (BK) (Albrect 2007; Ribeirio-Olivera et al., 2008; Dias-Peixoto et al., 2008). NO вносит вклад в защиту от недостаточности органов при диабете и в эффекты модуляторов РАС при улучшении конечных результатов у лиц с диабетом (Kosugi et al., 2010). Ang(1-7) также может снижать ишемическое повреждение органов при диабете за счет стимуляции PPARγ - пути, который стимулируется некоторыми терапевтическими средствами, применяемыми для снижения резистентности к инсулину при диабете (Dhaunsi et al., 2010).
Нативным рецептором для Ang(1-7) является сопряженный с G-белком рецептор Mas, при этом генетическая делеция Mas приводила к прекращению связывания Ang(1-7). Соответственно, Ang(1-7) обладал способностью связывать трансфецированные Mas клетки и вызывал высвобождение арахидоновой кислоты. Кроме того, у мышей с нокаутом Mas отсутствуют негативные изменения натрия в моче и объема воды и связывания Ang(1-7) в почках. Кроме того, аорты без Mas теряют способность расслабляться в ответ на стимуляцию пептидом Ang(1-7) (Santos et al., 2003). Mas опосредует полезные эффекты Ang(1-7) по ускорению восстановления миелосуппрессии и снижению хронического воспаления у больных диабетом.
Несмотря на некоторый прогресс и значительные усилия, все еще существует потребность в новых терапевтических средствах, которые могут быть эффективны в предотвращении диабета, которые бы уменьшали осложнения диабета и обеспечивали лечение состояний, связанных с диабетом. Современный способ лечения диабета включает применение таких противодиабетических агентов как инсулин, бигуаниды, тиазолидиндионы, несульфонилмочевинные стимуляторы секреции инсулина и пептидные аналоги. Существующие в настоящее время способы лечения направлены на снижение уровня глюкозы в циркулирующей крови путем восполнения секреции инсулина или повышения чувствительности клеток к активации инсулином. Несмотря на контроль глюкозы в циркулирующей крови сопутствующие диабету осложнения сохраняются, хотя их прогрессирование и замедляется. К ним относятся развитие сердечно-сосудистых нарушений, таких как атеросклероз, гипертензия, застойная сердечная недостаточность и ишемия головного мозга. Со способностью контролировать диабет также связывают дисфункцию других органов, включая дисфункцию почек, диабетическую ретинопатию и неврологическую дисфункцию. Эти сопутствующие состояния могут быть следствием неконтролируемого хронического воспаления, которое может усиливаться неконтролируемой глюкозотоксичностью или резистентностью к инсулину.
Несмотря на дорогостоящие попытки, которые привели к успешному созданию и разработке антагонистов рецептора 1 ангиотензина II (AT1R), известных как блокаторы ангиотензиновых рецепторов (ARB), аналогичные исследования, направленные на идентификацию агонистов рецепторов AT2R и Mas были ограничены. Несколько значимых примеров: соединение 21 - агонист AT2R и родственные соединения (Steckeling et al., 2011), агонист Mas AVE-0991 (Santos et al., 2006) и некоторые производные модулятора Mas (Zhang et al., 2012).
Выявление эффективных миметиков Ang(1-7), которые в значительной степени и селективно активируют рецептор Mas, остается сложной задачей. Молекулы этого типа представляют большой интерес, и ожидается, что они найдут применение для лечения нескольких важных заболеваний, которые представляют нерешенную медицинскую задачу.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из аспектов настоящего изобретения предложены гетероарильные непептидные соединения, которые имитируют гептапептид ангиотензин (1-7) и действуют как антагонисты рецептора Mas, в частности, селективно. Кроме того, согласно настоящему изобретению предложены способы применения таких соединений в качестве терапевтических средств, в частности, для лечения связанных с ангиотензином заболеваний или нарушений и связанных с ними состояний. Настоящее изобретение также обеспечивает фармацевтические композиции, содержащие такие соединения, и пути синтеза для получения таких соединений.
В одном варианте реализации соединения согласно настоящему изобретению имеют общую формулу 1 и включают соли соединений такой формулы:
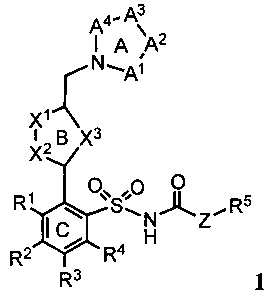
где:
кольцо А представляет собой пятичленное или шестичленное гетероарильное или гетероциклильное кольцо, содержащее либо комбинацию двух не являющихся соседними атомов азота или кислорода, либо комбинацию трех или четырех атомов азота или кислорода;
кольцо В представляет собой пятичленное или шестичленное гетероарильное кольцо, которое содержит по меньшей мере один атом азота;
кольцо С представляет собой необязательно замещенное арильное кольцо;
А1, А2, А3, А4 независимо выбраны из группы, состоящей из =N-, -С(=O)-, -C(Ra)=, =C(Rb)-, -C(Rc)(Rd)-N(Re)-, -C(Rc)(Rd)-O- или -[C(Rc)(Rd)]n-, причем n равно 1 или 2;
Х1-Х2 представляет собой (R6)C-N, N-C(R6), N-N, N-O, O-N, N-S или S-N;
X3 представляет собой (R7)C=C(R8), О, S или N(R9);
Z представляет собой О, NH или связь с R5;
Ra и Rb независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, галогена, гидрокси, гидроксиалкила, алкоксиалкила, алкокси, арилокси, формила, ацила, ациламидо или карбокси, при условии, что Ra и Rb также могут быть соединены с образованием кольца, включающего до 6 атомов;
Rc и Rd независимо выбраны из группы, состоящей из водорода, алкила, арила или гетероарила, при условии, что Rc и Rd также могут быть соединены с образованием кольца, включающего до 6 атомов;
Re представляет собой водород, алкил, арил, гетероарил, ацил, алкоксиацил, аминоацил, диалкиламиноацил или диалкиламиноацил;
R1, R3, R4, R6, R7 и R8 независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, арилметила, гетероарилметила, фтора, брома, йода, циано, гидрокси, амино, алкиламино, алкокси, арилокси, алкоксиалкила или арилоксиалкила;
R2 представляет собой алкил, алкенил, алкинил, арил, гетероарил, арилметил, гетероарилметил, алкокси, трифторметокси, перфторалкокси, арилокси, алкоксиалкил или арилоксиалкил;
R5 представляет собой алкил, арил, гетероарил, гидроксиалкил, карбоксиалкил, алкоксиалкил или арилоксиалкил; и
R9 представляет собой водород, алкил, арил, гетероарил, ацил, алкоксиацил, аминоацил, диалкиламиноацил или диалкиламиноацил.
Во втором варианте реализации согласно настоящему изобретению предложены способы получения предложенных соединений.
В третьем варианте реализации согласно настоящему изобретению предложены фармацевтические композиции, содержащие одно или больше предложенных соединений в фармацевтически приемлемом носителе.
В четвертом варианте реализации согласно настоящему изобретению предложены соединения, которые действуют как непептидные миметики Ang(1-7) или как эффективные агонисты рецептора Mas.
В пятом варианте реализации согласно настоящему изобретению предложены способы лечения связанных с ангиотензином заболеваний или нарушений и связанных с ними состояний.
В шестом варианте реализации предложенные способы и композиции применяют в пероральном, парентеральном или топическом введении, включающем соединение согласно настоящему изобретению или фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
В частности, согласно настоящему изобретению предложены способы и композиции для лечения связанных с ангиотензином заболеваний или нарушений и связанных с ними состояний, при пероральном, парентеральном (например, подкожном, интратекальном, эпидуральном, внутривенном, внутриглазном) и топическом введении.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1: Ренин-ангиотензиновая система (РАС). На этой фигуре перечислены основные ангиотензиновые пептиды РАС и показаны их биосинтез и рецепторы-мишени, которые опосредуют различные виды биологической активности этих пептидов.
Фигура 2: Связывающие участки предложенных соединений в модели гомологии AT2R. (А) Химическая структура соединения-примера 7. (В) Модель соединения 7 стыкуется с гомологичной моделью AT2R. В целях ясности, в моделях на этих фигурах показаны только этильные группы на месте бутильных групп соединения 7. (С) Контактирующие остатки в сайте связывания соединения 7 на AT2R. (D) Общая ориентация соединения 7 в его сайте связывания на AT2R. (Е) Контактирующие остатки в сайте связывания изомера соединения 7 по пиразолу на AT2R. (F) Контактирующие остатки в связывающем сайте соединения, более близкого к соединению-примеру 7, в котором пиридиновое кольцо заменено бензольным кольцом. (G) Модель соединения, показанная на (F) стыковалась с гомологичной моделью AT2R. В целях ясности, в моделях на этой фигуре показана только этильная группа вместо бутильной группы соединения 7. (G) Общая ориентация соединения в его сайте связывания на AT2R показана на (F).
Фигура 3: Связывающие участки предложенных соединений в модели гомологии рецептора Mas. (А) Контактирующие остатки в сайте связывания соединения-примера 7 на рецепторе Mas. (В) Модель соединения 7 стыковалась в гомологичной модели рецептора Mas, демонстрируя некоторые остатки, участвующие в сайте связывания. В целях ясности, в моделях на этой фигуре показана только этильная группа на месте бутильной группы соединения 7. (C)-(D) Общая ориентация соединения 7 в его сайте связывания на рецепторе Mas.
Фигура 4: В стабильно трансфецированных Mas клетках СНО сравнивали Ang(1-7) с соединением 7, это сравнение выявило зависящее от концентрации повышение уровня NO, измеряемое как уровень флуоресценции (А). Активность в качестве агониста Mas подтверждалась тем, что при совместном введении с А779, агонистом Mas, как Ang(1-7), так и соединение 7 блокировались до фонового уровня флуоресценции.
Фигура 5: Оценивали глюкозу крови натощак (ГКР) у животных db/db, которым в течение 14 вводили нейтральную основу, 500 мкг/кг/день Ang(1-7 и соединение 7. Соединение 7 снижало уровень глюкозы в периферической крови >40% от уровней, определенных у мышей, которым вводили нейтральную среду или Ang(1-7) (А).
Фигура 6: Соединение 7 может предотвращать органомеглию у животных db/db. Этим животным в течение 14 дней вводили нейтральную среду, 500 мкг/кг Ang(1-7) или 500 мкг/кг/день соединения 7. У животных, которым вводили соединение 7, наблюдалась способность к предотвращению развития кардиомегалии (А) и гипертрофии левой почки (В), причем разница между db/db контролями была статистически значимой (р<0,05). Имела место тенденция, заключающаяся в том, что правая почка была близка к гетерозиготному контролю и меньше, чем в db/db контролях (D).
Фигура 7: Оценивали уровни липидов в печени у животных db/db, которым в течение 14 вводили несущую среду, 500 мкг/кг/день Ang(1-7) и соединение 7. Печень получавших соединение 7 (правая панель) мышей характеризовалась пониженным окрашиванием красителем Oil Red (красные капельки указывают на отложения жира) по сравнению с контролями db/db (которые получали физиологический раствор) (левая панель).
Фигура 8: Диабет вызывает ухудшение состояния костного мозга, который является источником ряда предшественников, участвующих в процессах заживления, в частности, клеток крови (эритроцитов, тромбоцитов и лейкоцитов). Лечение с использованием как и Ang(1-7), так и соединения 7 повышало количественные показатели содержания клеток в костном мозге, как показано на (А). Кроме того, соединение 7 обеспечивало сравнимое с Ang(1-7) повышение количественных показателей клеток костного мозга, а также ранних предшественников (CFU-GEMM - колониеобразующие единицы, в которых образуются гранулоциты, эритроциты, моноциты и мегакариоциты), миелоидных предшественников (CFU-GM - колониеобразующие единицы гранулоцитов-макрофагов), эритроидных предшественников (BFU-E - эритроидные «взрывообразующие единицы») и мезенхимальных стволовых клеток (MSC, МСК) (В-Е).
Фигура 9: Влияние соединения 7 на пролиферацию клеток опухоли оценивали с использованием MDA MB 231 методом повышения концентраций. Соединение 7 не увеличивало пролиферацию MDA MB 231 линии клеток рака молочной железы. Напротив, соединение 7 ингибировало пролиферацию опухоли с рассчитанной IC50, равной 58 мкМ.
Фигура 10: Измеряли поглощение и распределение вводимого внутривенно соединения 7 в крови мышей C57Bl/6. Животных подвергали эвтаназии в различные моменты времени после введения соединения 7, брали кровь и получал из нее плазму. Концентрации соединения 7 измеряли методом ЖХ-МС/МС. Биодоступность соединения 7 при пероральном введении составляла 30%.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
А. Определения
Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют значение, обычно понимаемое специалистами в данной области. Все патенты, заявки, опубликованные заявки и другие публикации полностью включены посредством ссылки. В случае, когда существует несколько определений для какого-либо используемого в настоящем документе термина, должно применяться определение, приведенное в настоящем разделе, если не указано иное.
В настоящем документе номенклатурные названия алкил, алкокси, карбонил и т.д. используются в обычном для специалиста в данной области понимании. В настоящем описании алкильные группы могут включать алкильные радикалы с линейной цепью, разветвленной цепью или циклические, содержащие до приблизительно 20 атомов углерода или от 1 до 16 атомов углерода, линейные или разветвленные. Примеры алкильных групп в настоящем документе включают следующие, но не ограничиваются ими: метил, этил, пропил, изопропил, изобутил, н-бутил, сек-бутил, трет-бутил, изопентил, неопентил, трет-пентил и изогексил. В настоящем документе низший алкил относится к углеродным цепям, содержащим от приблизительно 1 или приблизительно 2 атомов углерода до приблизительно 6 атомов углерода. Подходящие алкильные группы могут быть насыщенными или ненасыщенными. Кроме того, алкил может также содержать один или больше заместителей на одном или большем числе атомов углерода, причем заместители выбраны из группы, состоящей из С1-С15 алкила, аллила, алленила, алкенила, С3-С7 гетероцикла, арила, галогена, гидрокси, амино, циано, оксо, тио, алкокси, формила, карбокси, карбоксамидо, фосфорил, фосфонат, фосфонамидо, сульфонила, алкилсульфоната, арилсульфоната и сульфонамида. Дополнительно, алкильная группа может содержать до 10 гетероатомов, в некоторых вариантах реализации 1, 2, 3, 4, 5, 6, 7, 8 или 9 гетероатомных заместителей. Подходящие гетероатомы включают азот, кислород, серу или фосфор.
В настоящем документе «циклоалкил» относится к моно- или полициклической системе колец, в некоторых вариантах реализации включающей от 3 до 10 атомов углерода, в других вариантах реализации включающей от 3 до 6 атомов углерода. Система колец циклоалкильной группы может состоять из одного кольца или двух или больше колец, которые могут быть соединены друг с другом в конденсированную, мостиковую или спиросистему.
В настоящем документе «арил» относится к ароматическим моноциклическим или полициклическим группам, содержащим от 3 до 16 атомов углерода. В настоящем описании арильные группы представляют собой арильные радикалы, которые могут содержать до 10 гетероатомов, в некоторых вариантах реализации 1, 2, 3 или 4 гетероатомов. Арильная группа также необязательно может содержать один или больше заместителей, в некоторых вариантах реализации 1-3 или 4 заместителя, представляющих собой арильную группу или группу низшего алкила, и также может быть конденсирована с другими арильными или циклоалкильными кольцами. Подходящие арильные группы включают, например, следующие группы: фенил, нафтил, толил, имдазолил, пиридил, пирролил, тиенил, пиримидил, тиазолил и фурил.
В настоящем описании кольцо определяется как содержащее до 20 атомов, которые могут включать один или больше атомов азота, кислорода, серы или фосфора, при условии, что кольцо может содержать один или больше заместителей, выбранных из группы, состоящей из водорода, алкила, аллила, алкенила, алкинила, арила, гетероарила, хлора, йода, брома, фтора, гидрокси, алкокси, арилокси, карбокси, амино, алкиламино, диалкиламино, ациламино, карбоксамидо, циано, оксо, тио, алкилтио, арилтио, ацилтио, алкилсульфоната, арилсульфоната, фосфорила, фосфоната, фосфонамидо и сульфонила, и также при условии, что кольцо может также содержать одно или больше конденсированных колец, включая карбоциклические, гетероциклические, арильные или гетероарильные кольца.
Термин «алкенил» относится к разветвленному или неразветвленному углеводороду, содержащему по меньшей мере одну двойную углерод-углеродную связь.
Термин «алкинил» относится к разветвленному или неразветвленному углеводороду, содержащему по меньшей мере одну углерод-углеродную тройную связь.
Термин «карбокси» относится к группе -СО2Н.
Термин «гидрокси» относится к группе -ОН.
Термин «алкокси» относится к группе формулы R-O-, где R представляет собой «алкил», соответствующий приведенному в настоящей заявке определению.
Термин «карбоцикл» относится к неароматическому 3-8-членному углеродному кольцу, которое может быть насыщенным, мононенасыщенным или полиненасыщенным.
Термин «амино» включает первичные, вторичные или третичные аминогруппы.
Термин «циано» относится к группе -CN.
В настоящем документе алкенильные и алкинильные углеродные цепи, в отсутствие уточнения, содержат от 2 до 20 атомов углерода, или от 2 до 16 атомов углерода, и являются линейными или разветвленными. Алкенильные углеродные цепи, включающие от 2 до 20 атомов углерода, в некоторых вариантах реализации содержат от 1 до 8 двойных связей, а алкенильные углеродные цепи, включающие от 2 до 16 атомов углерода, в некоторых вариантах реализации содержат от 1 до 5 двойных связей. Алкинильная углеродная цепь, включающая от 2 до 20 атомов углерода, в некоторых вариантах реализации содержит от 1 до 8 тройных связей, а алкинильные углеродные цепи, включающие от 2 до 16 атомов углерода, в некоторых вариантах реализации содержат от 1 до 5 тройных связей.
В настоящем документе «гетероарил» относится к моноциклической или полициклической ароматической системе колец, и в некоторых вариантах реализации включает от приблизительно 4 до приблизительно 15 членов, причем один или больше, в одном варианте реализации от 1 до 4 атомов в системе колец представляет собой гетероатом, т.е., элемент, отличный от углерода включая азот, кислород или серу, но не ограничиваясь ими. Гетероарильная группа может быть необязательно конденсирована с бензольным кольцом. Гетероарильные группы включают следующие, но не ограничиваются ими: фурил, имдазолил, пирролидинил, пиримидинил, триазолил, тетразолил, тиенил, пиридил, пирролил, н-метилпирролил, хинолинил и изохинолинил.
В настоящем документе «гетероциклил» относится к моноциклической или полициклической неароматической системе колец, в одном варианте реализации содержащей от 3 до 10 членов, в другом варианте реализации содержащей от 4 до 7 членов, в другом варианте реализации содержащей от 5 до 6 членов, причем один или больше, в некоторых вариантах реализации от 1 до 3, атомов в системе колец представляет собой гетероатом, т.е.; элемент, отличный от углерода включая азот, кислород или серу, но не ограничиваясь ими. В тех вариантах реализации, где гетероатом(ы) представляет(ют) собой азот, причем азот необязательно замещен алкилом, алкенилом, алкинилом, арилом, гетероарилом, аралкилом, гетероаралкилом, циклоалкилом, гетероциклилом, циклоалкилалкилом, гетероциклилалкилом, ацилом, гуанидино, или азот может быть кватернизирован с образованием аммонийной группы, причем заместители выбраны из приведенных выше.
В настоящем документе «аралкил» относится к алкильной группе, в которой один из атомов водорода в алкиле заменен на арильную группу.
В настоящем документе «гало», «галоген» или «галид» относится к F, Cl, Br или I.
В настоящем документе «галогеналкил» относится к алкильной группе, в которой один или больше атомов водорода заменены на галоген. Такие группы включают следующие, но не ограничиваются ими: хлорметил и трифторметил.
В настоящем документе «арилокси» относится к RO-, в котором R представляет собой арил, включая низший арил, такой как фенил.
В настоящем документе «ацил» относится к группе -COR, включая, например, алкилкарбонил, циклоалкилкарбонил, арилкарбонил или гетероарилкарбонилы, каждый из которых может необязательно быть замещен.
В настоящем документе «субъект» представляет собой животное, обычно млекопитающее, включая человека, такого как пациент.
В настоящем документе аббревиатуры для любых защитных групп, аминокислот и других соединений, если не указано иное, соответствуют их обычному использованию, принятым сокращениям или биохимической номенклатуре IUPAC-IUB (см., (1972) Biochem. 11:942-944).
В настоящем документе фармацевтически приемлемые производные соединения включают их соли, сложные эфиры, енольные эфиры, сложные енольные эфиры, ацетали, кетали, ортоэфиры, полуацетали, полукетали, кислоты, основания, сольваты, гидраты или пролекарства. Такие производные могут быть легко получены специалистами в данной области с использованием известных способов дериватизации. Полученные соединения могут вводиться животным или людям без значительных токсических эффектов и либо являются фармацевтически активными, либо представляют собой пролекарства. Фармацевтические соли включают следующие, но не ограничиваются ими: аминные соли, такие как следующие, но не ограничиваясь ими: N,N'-дибензилэтилендиамин, хлорпрокаин, холин, аммиак, диэтаноламин и другие гидроксиалкиламины, этилендиамин, н-метилглюкамин, прокаин, н-бензилфенэтиламин, 1-пара-хлорбензил-2-пирролидин-1'-илметилбензимидазол, диэтиламин и другие алкиламины, пиперазин и трис(гидроксиметил)аминометан; соли щелочных металлов, таких как литий, калий и натрий, но не ограничиваясь ими; соли щелочноземельных металлов, такие как перечисленные ниже, но не ограничиваясь ими: барий, кальций и магний; соли переходных металлов, такие как цинк, но не ограничиваясь им; и соли других металлов, такие как перечисленные ниже, но не ограничиваясь ими: вторичный кислый фосфат натрия и динатрий фосфат; и и также включая, но не ограничиваясь ими, соли минеральных кислот, такие как гидрохлориды и сульфаты, но не ограничиваясь ими; и соли органических кислоты, такие как перечисленные ниже, но не ограничиваясь ими: ацетаты, лактаты, малаты, тартраты, цитраты, аскорбаты, сукцинаты, бутираты, соли валериановой кислоты и фумараты. Фармацевтически приемлемые сложные эфиры включают следующие, но не ограничиваются ими: алкильные, алкенильные, алкинильные, арильные, гетероарильные, аралкильные, гетероаралкильные, циклоалкильные и гетероциклильные сложные эфиры кислотных групп, включая следующие, но не ограничиваясь ими: карбоновые кислоты, фосфорные кислоты, фосфиновые кислоты, сульфоновые кислоты, сульфиновые кислоты и бороновые кислоты. Фармацевтически приемлемые енольные эфиры включают следующие, но не ограничиваются ими: производные формулы C=C(OR), где R представляет собой водород, алкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, циклоалкил или гетероциклил. Фармацевтически приемлемые сложные енольные эфиры включают следующие, но не ограничиваются ими: производные Формулы C=C(OC(O)R), где R представляет собой водород, алкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, циклоалкил или гетероциклил. Фармацевтически приемлемые сольваты и гидраты представляют собой комплексы соединения с одной или большим числом молекул растворителя или воды или от 1 до приблизительно 100, или от 1 до приблизительно 10, или от одной до приблизительно 2, 3 или 4 молекул растворителя или воды.
В настоящем документе термин «лечение» обозначает любое действие, которое облегчает или иным образом полезно изменяет один или больше симптомов заболевания или нарушения. Лечение также охватывает любое фармацевтическое применение описанных в настоящем документе композиций, такое как применение для лечения указанного в настоящем документе заболевания.
В настоящем документе облегчение симптомов конкретного нарушения путем введения конкретного соединения или фармацевтической композиции относится к любому уменьшению, постоянному или временному, продолжительному или преходящему, которое может быть отнесено на счет или связано с введением композиции.
В. Соединения
Как указано выше, согласно настоящему изобретению предложены соединения, способы и композиции для лечения связанных с ангиотензином заболеваний и нарушений.
Предложенные соединения обладают способностью селективно воздействовать на некоторые сопряженные рецепторы.
Согласно настоящему изобретению предложены соединения общей формулы 1 и его соли:

где:
кольцо А представляет собой пятичленное или шестичленное гетероарильное или гетероциклильное кольцо, содержащее либо комбинацию двух не являющихся соседними атомов азота или кислорода, либо комбинацию трех или четырех атомов азота или кислорода;
кольцо В представляет собой пятичленное или шестичленное гетероарильное кольцо, которое содержит по меньшей мере один атом азота;
кольцо С представляет собой необязательно замещенное арильное кольцо;
А1, А2, А3, А4 независимо выбраны из группы, состоящей из =N-, -С(=O)-, -C(Ra)=, =C(Rb)-, -C(Rc)(Rd)-N(Re)-, -C(Rc)(Rd)-O- или -[C(Rc)(Rd)]n-, причем n равно 1 или 2;
Х1-Х2 представляет собой (R6)C-N, N-C(R6), N-N, N-O, O-N, N-S или S-N;
X3 представляет собой (R7)C=C(R8), О, S или N(R9);
Z представляет собой О, NH или связь с R5;
Ra и Rb независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, галогена, гидрокси, гидроксиалкила, алкоксиалкила, алкокси, арилокси, формила, ацила, ациламидо или карбокси, при условии, что Ra и Rb также могут быть соединены с образованием кольца, включающего до 6 атомов;
Rc и Rd независимо выбраны из группы, состоящей из водорода, алкила, арила или гетероарила, при условии, что Rc и Rd также могут быть соединены с образованием кольца, включающего до 6 атомов;
Re представляет собой водород, алкил, арил, гетероарил, ацил, алкоксиацил, аминоацил, диалкиламиноацил или диалкиламиноацил;
R1, R3, R4, R6, R7 и R8 независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, арилметила, гетероарилметила, фтора, брома, йода, циано, гидрокси, амино, алкиламино, алкокси, арилокси, алкоксиалкила или арилоксиалкил;
R2 представляет собой алкил, алкенил, алкинил, арил, гетероарил, арилметил, гетероарилметил, алкокси, трифторметокси, перфторалкокси, арилокси, алкоксиалкил или арилоксиалкил;
R5 представляет собой алкил, арил, гетероарил, гидроксиалкил, карбоксиалкил, алкоксиалкил или арилоксиалкил; и
R9 представляет собой водород, алкил, арил, гетероарил, ацил, алкоксиацил, аминоацил, диалкиламиноацил или диалкиламиноацил.
В некоторых предпочтительных вариантах реализации R2 представляет собой трифторметокси.
В других предпочтительных вариантах реализации Z представляет собой О, NH.
В примерах реализации кольцо А включает кольца, выбранные из группы, состоящей из следующих, но не ограничиваются ими:
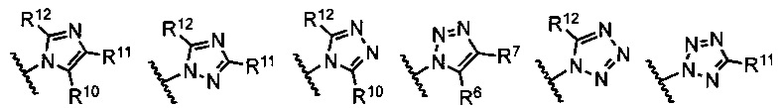

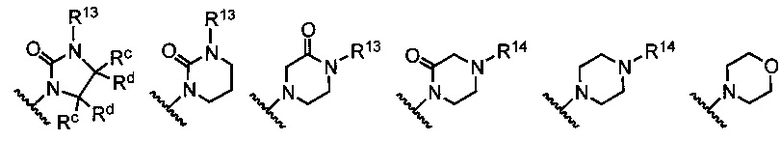
где:
R10 и R11 независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, галогена, гидрокси, гидроксиалкила, алкоксиалкила, алкокси, арилокси, формила, ацила, ациламидо или карбокси, при условии, что R10 и R11 также могут быть соединены с образованием карбоциклического, гетероциклического, арильного или гетероарильного кольца;
R12 представляет собой водород, алкил, алкенил, алкинил, арил, гетероарил, галоген, гидрокси, гидроксиалкил, алкоксиалкил, алкокси, арилокси или ациламидо;
R13 представляет собой водород, алкил, арил или гетероарил;
R14 представляет собой водород, алкил, арил, гетероарил, ацил, алкоксиацил, аминоацил, диалкиламиноацил или диалкиламиноацил; и
Rf, Rg, Rh и Ri независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, арилметила, гетероарилметила, фтора, брома, йода, гидрокси, амино, алкиламино, алкокси, арилокси, алкоксиалкила или арилоксиалкила.
В других примерах реализации кольцо В включает, пяти- или шестичленное гетероарильное кольцо, выбранное из группы, состоящей из:

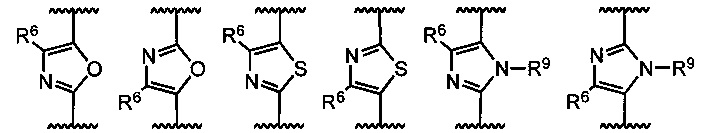

где группы R6, R7, R8 и R9 определены как в общей формуле 1, но не ограничивается им.
В некоторых примерах реализации предложенные соединения имеют общую формулу, выбранную из группы, состоящей из:
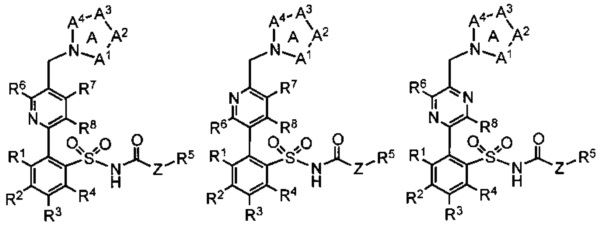





 ,
,
где группы R1, R2, R3, R4 R5, R6, R7, R8, R9, А1, А2, А3, А4 и Z определены как в общей формуле 1.
В других примерах реализации предложенные соединения имеют общую группу, выбранную из группы, состоящей из:





 ,
,
где:
R1, R2, R3, R4 R5, R6, R7, R8, R9, Ra, Rb, Rc, Rd и Z определены как в общей формуле 1.
R10 и R11 независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, галогена, гидрокси, гидроксиалкила, алкоксиалкила, алкокси, арилокси, формила, ацила, ациламидо или карбокси, при условии, что R10 и R11 также могут быть соединены с образованием карбоциклического, гетероциклического, арильного или гетероарильного кольца;
R12 представляет собой водород, алкил, алкенил, алкинил, арил, гетероарил, галоген, гидрокси, гидроксиалкил, алкоксиалкил, алкокси, арилокси или ациламидо;
R13 представляет собой водород, алкил, арил или гетероарил;
R14 представляет собой водород, алкил, арил, гетероарил, ацил, алкоксиацил, аминоацил, диалкиламиноацил или диалкиламиноацил; и
Rf, Rg, Rh и Ri, независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, арилметила, гетероарилметила, фтора, брома, йода, гидрокси, амино, алкиламино, алкокси, арилокси, алкоксиалкила или арилоксиалкила.
В дополнительных вариантах реализации предложенные соединения имеют общую формулу, выбранную из группы, состоящей из:





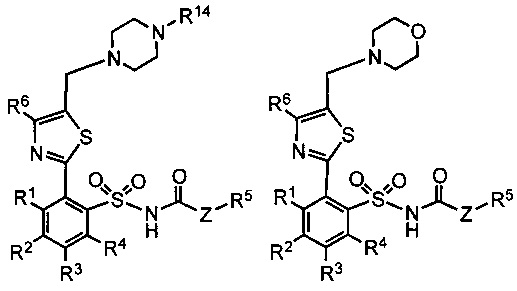 ,
,
где:
R1, R2, R3, R4 R5, R6, R7, R8, R9, Ra, Rb, Rc, Rd и Z определены как в общей формуле 1.
R10 и R11 независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, галогена, гидрокси, гидроксиалкила, алкоксиалкила, алкокси, арилокси, формила, ацила, ациламидо или карбокси, при условии, что R10 и R11 также могут быть соединены с образованием карбоциклического, гетероциклического, арильного или гетероарильного кольца;
R12 представляет собой водород, алкил, алкенил, алкинил, арил, гетероарил, галоген, гидрокси, гидроксиалкил, алкоксиалкил, алкокси, арилокси или ациламидо;
R13 представляет собой водород, алкил, арил или гетероарил;
R14 представляет собой водород, алкил, арил, гетероарил, ацил, алкоксиацил, аминоацил, диалкиламиноацил или диалкиламиноацил; и
Rf, Rg, Rh и Ri, независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, арилметила, гетероарилметила, фтора, брома, йода, гидрокси, амино, алкиламино, алкокси, арилокси, алкоксиалкила или арилоксиалкила.
В некоторых предпочтительных вариантах реализации предложенные соединения имеют общую формулу 2a, b или 3a, b:

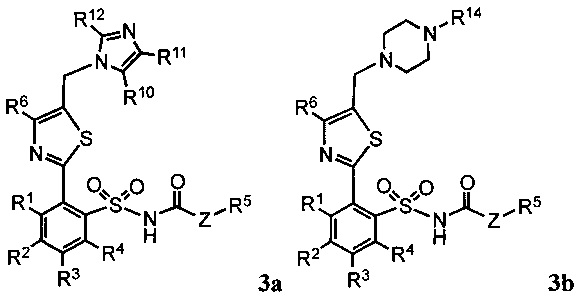
где:
R1, R2, R3, R4 R5, R6, R7, R8, R9, Ra, Rb, Rc, Rd и Z определены как в общей формуле 1.
R10 и R11 независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, галогена, гидрокси, гидроксиалкила, алкоксиалкила, алкокси, арилокси, формила, ацила, ациламидо или карбокси, при условии, что R10 и R11 также могут быть соединены с образованием карбоциклического, гетероциклического, арильного или гетероарильного кольца;
R12 представляет собой водород, алкил, алкенил, алкинил, арил, гетероарил, галоген, гидрокси, гидроксиалкил, алкоксиалкил, алкокси, арилокси, или ациламидо;
R13 представляет собой водород, алкил, арил или гетероарил;
R14 представляет собой водород, алкил, арил, гетероарил, ацил, алкоксиацил, аминоацил, диалкиламиноацил или диалкиламиноацил; и
Rf, Rg, Rh и Ri, независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, арилметила, гетероарилметила, фтора, брома, йода, гидрокси, амино, алкиламино, алкокси, арилокси, алкоксиалкила или арилоксиалкила.
В дополнительных предпочтительных вариантах реализации согласно настоящему изобретению предложены соединения, имеющие общую формулу 4a, b, 5a, b или 6a, b:
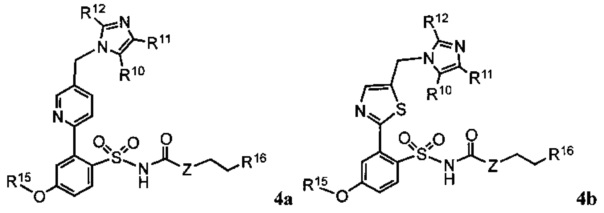


где:
R1, R2, R3, R4 R5, R6, R7, R8, R9, Ra, Rb, Rc, Rd и Z определены как в общей формуле 1.
R10 и R11 независимо выбраны из группы, состоящей из водорода, алкила, алкенила, алкинила, арила, гетероарила, галогена, гидрокси, гидроксиалкила, алкоксиалкила, алкокси, арилокси, формила, ацила, ациламидо или карбокси, при условии, что R10 и R11 также могут быть соединены с образованием карбоциклического, гетероциклического, арильного или гетероарильного кольца;
R12 представляет собой водород, алкил, алкенил, алкинил, арил, гетероарил, галоген, гидрокси, гидроксиалкил, алкоксиалкил, алкокси, арилокси или ациламидо;
R14 представляет собой водород, алкил, арил, гетероарил, ацил, алкоксиацил, аминоацил, диалкиламиноацил или диалкиламиноацил; и
R15 представляет собой алкил, арил, гетероарил, арилметил, гетероарилметил, трифторметил или пентафторэтил; и
R16 представляет собой водород, гидрокси, метокси, алкокси, алкил, алкенил, алкинил, арил, гетероарил, амино, алкиламино или диалкиламино.
В некоторых примерах вариантов реализации R10, R11 и R12 представляют собой водород, и R14 представляет собой метил.
В других примерах вариантов реализации R15 представляет собой трифторметил, R16 представляет собой этил.
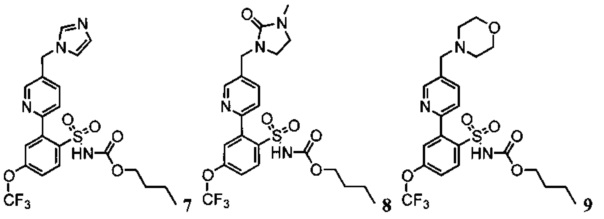
Примеры реализации представлены соединениями 7, 8, 9, 10 и 11:

С. Получение соединений
Предложенные в настоящем документе соединения могут быть получены известными в данной области способами или общими способами, известными в данной области, примеры которых приведены Примерах 2-5, приведенных в настоящем документе.
Предложенные соединения Формулы 1 могут быть получены двумя альтернативными способами, которые включают применение комбинации двух промежуточных соединений.
Первый способ получения соединений Формулы 1 начинается с Этапа 1, который включает бромирование промежуточного бромида гетероарила Ia с получением промежуточного соединения Ib. На Этапе 2 промежуточное соединение Ib приводят во взаимодействие с промежуточным амином, содержащим кольцо А Формулы Ic с получением промежуточного соединения Id. На Этапе 3 промежуточное соединение Id приводят во взаимодействие с промежуточной бороновой кислотой или боронатом Формулы Ie (содержащим бороновую группу B(OR)2, где R представляет собой Н или алкил) в условиях опосредуемого палладием кросс-сочетания с получением промежуточного соединения Формулы If. На Этапе 4 удаляют трет-бутильную защитную группу Промежуточного соединения If и вводят оставшуюся функциональную группу известными в данной области способами с получением соединения Формулы 1.
Этап 1:

Этап 2:

Этап 3:
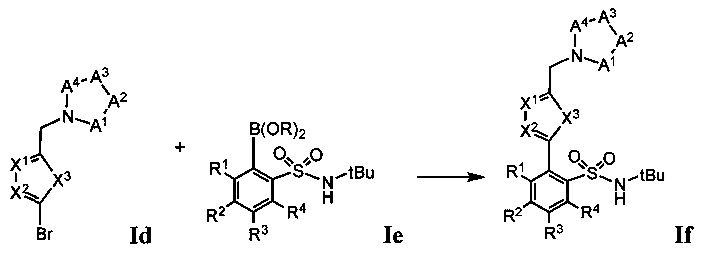
Этап 4:

Второй способ подразумевает другой порядок этих этапов. На Этапе 1 промежуточную бороновую кислоту или боронат Формулы Ie приводят во взаимодействие с бромидом гетероарила Формулы Ia в условиях катализируемого палладием кросс-сочетания с получением промежуточного соединения Ig. На Этапе 2 промежуточное соединение Ig бромируют с получением промежуточного соединения Ih. На Этапе 3 промежуточное соединение Ih приводят во взаимодействие с промежуточным амином, содержащим кольцо А Формулы Ic с получением промежуточного соединения If. На Этапе 4 (описанном выше) удаляют защитную трет-бутильную группу Промежуточного соединения If и вводят оставшуюся функциональную группу известными в данной области способами с получением соединения Формулы 1.
Этап 1:

Этап 2:

Этап 3:

В модифицированном способе промежуточное соединение Id получают путем восстановительного аминирования промежуточного альдегидного соединения Ii промежуточным амидом Ic.
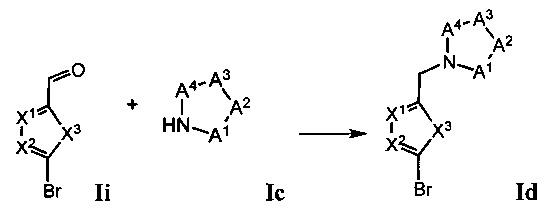
В другом модифицированном способе промежуточное соединение If получают путем восстановительного аминирования промежуточного альдегидного соединения Ij промежуточным амидом Ic.

D. Получение фармацевтических композиций
Описанные в настоящем документе фармацевтические композиции содержат терапевтически эффективные количества одного или большего числа соединений, описанных в настоящем документе, или их солей в фармацевтически приемлемом носителе.
Композиции содержат одно или больше описанных в настоящем документе соединений или их солей. В предпочтительном варианте соединения изготовлены в виде подходящих фармацевтических препаратов, таких как растворы, суспензии, таблетки, диспергируемые таблетки, пилюли, капсулы, порошки, составы с замедленным высвобождением или эликсиры, для перорального, буккального, интраназального, вагинального, ректального введения, введения в глаз или в стерильные растворы или суспензии для парентерального введения, а также препараты в форме трансдермальных пластырей и сухие порошки для ингаляций. Обычно соединения, описанные выше, готовят в виде фармацевтических композиций с использованием методик и процедур, хорошо известных специалистам в данной области (см., например, Ansel Introduction to Pharmaceutical Dosage Forms, Fourth Edition 1985, 126).
В композициях эффективные концентрации одного или большего числа соединений или фармацевтически приемлемых производных смешаны с подходящим фармацевтическим носителем или наполнителем. Соединения могут быть дериватизированы с получением соответствующих солей сложных эфиров, енольных эфиров или сложных эфиров, кислот, оснований, сольватов, гидратов или пролекарств перед получением композиций как описано выше. Концентрации соединений в композициях эффективны для доставки после введения количества, которое обеспечивает лечение, предотвращение или облегчения одного или более симптомов состояния, включая следующие, но не ограничиваясь ими: сердечно-сосудистое заболевание (инфаркт миокарда, застойная сердечная недостаточность, сердечно-сосудистое заболевание при диабете, фибрилляция предсердий, гипертензия, заболевание периферических сосудов, эректильная дисфункция, инсульт, преэклампсия, стенты с покрытием, ингибирующим рестеноз, синдром Марфана и аневризма брюшной/грудной аорты), метаболические заболевания (инсулинорезистентность и метаболический синдром), болезни почек (диабетическая нефропатия, лекарственная почечная недостаточность и хроническая почечная недостаточность), заболевания легких (фиброз легких, острое повреждение легких, легочная гипертензия и астма), воспалительные и аутоиммунные заболевания (артрит, болезнь Крона, реакция «трансплантат против хозяина», системный склероз и рассеянный склероз), неврологические заболевания (депрессия, тревожность, деменция, болезнь Альцгеймера, нейродегенеративные заболевания, черепно-мозговая травма, периферическая нейропатия, повреждение спинного мозга и болезнь Хантингтона), скелетно-мышечные заболевания (мышечная дистрофия и мышечная травма), фиброзные заболевания (сокращение рубцов, фиброз легких, фиброз печени и фиброз сердца), заболевания кожи (заживление раны, смягчение последствий воздействия радиации, восстановление кожи, сокращение рубцов и алопеция), болезни глаз (дегенерация желтого пятна, рубцевание роговицы и диабетическая ретинопатия), болезни печени (неалкогольный стеатоз печени, фиброз печени, гепатобилиарные заболевания, стеатоз печени, цирроз и фиброз печени), онкологические заболевания и связанные заболевания (рак и поддерживающая терапия при онкологических заболеваниях), заболевание желудочно-кишечного тракта (стрессовые язвы и болезнь Крона) и заболевания костного мозга (восстановление после миелосуппрессии после облучения или химиотерапии, аутологический трансплантат, смягчение последствий воздействия радиации, приживление трансплантата, аллогенный трансплантат, приживление трансплантированных клеток, гематопоэз и повреждение костного мозга и миелодиспластические синдромы).
Обычно композиции изготавливают в форме для введения однократной дозы. Для приготовления лекарственной формы композиции навеску соединения растворяют, суспендируют, диспергируют или другим способом подмешивают в выбранный наполнитель в эффективной концентрации, которая обеспечивает снижение выраженности или облегчение состояния. Фармацевтические носители или наполнители, подходящие для введения описанных в настоящем документе соединений включают любые такие носители, известные специалистам как подходящие для конкретного пути введения.
Дополнительно согласно настоящему изобретению предусмотрено, что соединения могут быть включены в композицию в качестве единственного фармацевтически активного ингредиента или могут быть объединены с другими активными ингредиентами. Липосомные суспензии, включая липосомы с направленной доставкой в ткани, включая липосомы с направленной доставкой в опухоли, также могут быть подходящими фармацевтически приемлемыми носителями. Их можно получить в соответствии со способами, известными специалистам в данной области. Например, составы с липосомами могут быть получены как описано в патенте США №.4,522,811. Вкратце, липосомы, такие как многослойные липосомы (MLV), могут быть получены путем высушивания фосфатидилхолина белка и фосфатидилсерина мозга (в молярном отношении 7:3) на внутренней поверхности колбы. Добавляют раствор описанного в настоящем документе соединения в фосфатном буферном растворе без двухвалентных катионов (ФБР) и встряхивают колбу до диспергирования липидной пленки. Полученные везикулы промывают для удаления неинкапсулированного соединения, осаждают путем центрифугирования, а затем ресуспендируют в ФБР.
Активное соединение включают в фармацевтически приемлемый носитель в количестве, достаточном для реализации терапевтически полезного эффекта при отсутствии нежелательных эффектов для пациента, которого лечат. Терапевтически эффективная концентрация может быть определена эмпирически, путем исследования соединений в in vitro и in vivo системах, описанных в настоящем документе, с последующей экстраполяцией по ним дозировок для человека.
Концентрация активного соединения в фармацевтической композиции будет зависеть от параметров всасывания, инактивации и выведения активного соединения, физико-химических характеристик соединения, режима введения и вводимого количества, а также других характеристик, известных специалистам в данной области. Например, доставляемое количество достаточно для облегчения одного или более симптомов заболеваний или нарушений, связанных со следующими, но не ограничиваясь ими: сердечно-сосудистое заболевание (инфаркт миокарда, застойная сердечная недостаточность, сердечно-сосудистое заболевание при диабете, фибрилляция предсердий, гипертензия, заболевание периферических сосудов, эректильная дисфункция, инсульт, преэклампсия, стенты с покрытием, ингибирующим рестеноз, синдром Марфана и аневризма брюшной/грудной аорты), метаболические заболевания (инсулинорезистентность и метаболический синдром), болезни почек (диабетическая нефропатия, лекарственная почечная недостаточность и хроническая почечная недостаточность), заболевания легких (фиброз легких, острое повреждение легких, легочная гипертензия и астма), воспалительные и аутоиммунные заболевания (артрит, болезнь Крона, реакция «трансплантат против хозяина», системный склероз и рассеянный склероз), неврологические заболевания (депрессия, тревожность, деменция, болезнь Альцгеймера, нейродегенеративные заболевания, повреждение спинного мозга, черепно-мозговая травма, периферическая нейропатия и болезнь Хантингтона), скелетно-мышечные заболевания (мышечная дистрофия и мышечная травма), фиброзные заболевания (сокращение рубцов, фиброз легких, фиброз печени и фиброз сердца), заболевания кожи (заживление раны, смягчение последствий воздействия радиации, восстановление кожи, сокращение рубцов и алопеция), болезни глаз (дегенерация желтого пятна, рубцевание роговицы и диабетическая ретинопатия), болезни печени (неалкогольный стеатоз печени, фиброз печени, гепатобилиарные заболевания, стеатоз печени, цирроз и фиброз печени), онкологические заболевания и связанные заболевания (рак и поддерживающая терапия при онкологических заболеваниях), заболевание желудочно-кишечного тракта (стрессовые язвы и болезнь Крона) и заболевания костного мозга (восстановление после миелосуппрессии после облучения или химиотерапии, аутологический трансплантат, смягчение последствий воздействия радиации, приживление трансплантата, аллогенный трансплантат, приживление трансплантированных клеток, гематопоэз и повреждение костного мозга и миелодиспластические синдромы).
Обычно терапевтически эффективная дозировка должна обеспечивать концентрацию в сыворотке или плазме от приблизительно 0,1 нг/мл до приблизительно 50-100 мкг/мл. Фармацевтические композиции обычно должны обеспечивать дозировку от приблизительно 0,001 мг до приблизительно 100 мг соединения на килограмм массы тела в день. Дозированные фармацевтические лекарственные формы готовят таким образом, чтобы обеспечить от приблизительно 1 мг до приблизительно 2000 мг и предпочтительно от приблизительно 10 до приблизительно 200 мг существенного активного ингредиента или комбинации существенных ингредиентов в единице лекарственной формы.
Активный ингредиент можно вводить одной дозой или можно разделять на несколько меньших доз для введения через некоторые промежутки времени. Понятно, что точная дозировка и продолжительность лечения зависят от заболевания, которое лечат, и могут быть определены эмпирическим путем с использованием известных протоколов тестирования или экстраполяции данных in vivo или in vitro исследований. Следует отметить, что значения концентраций и дозировок могут также варьировать в зависимости от тяжести состояния, которое облегчают. Также следует понимать, что для любого конкретного субъекта конкретные режимы дозирования должны со временем регулироваться в соответствии с индивидуальными потребностями и профессиональным суждением лица, которое осуществляет введение или наблюдение за введением композиций, и что диапазоны концентраций, представленные в настоящем документе, являются только примерами и не подразумевают ограничения объема или реализации заявленных композиций.
Фармацевтически приемлемые производные включают кислоты, основания, енольные эфиры и сложные эфиры, соли, сложные эфиры, гидраты, сольваты и пролекарственные формы. Производное выбирают таким образом, чтобы его фармакокинетические свойства превосходили свойства соответствующего нейтрального соединения.
Таким образом, эффективные концентрации или количества одного или большего числа соединений, описанных в настоящем документе, или их фармацевтически приемлемых производным, смешивают с подходящим фармацевтическим носителем или наполнителем для системного, топического или местного введения с получением фармацевтических композиций. Соединения включают в количестве, эффективном для облегчения одного или более симптомов заболеваний или нарушений или для лечения или предотвращения заболеваний или нарушений, связанных с сердечно-сосудистым заболеванием (инфаркт миокарда, застойная сердечная недостаточность, сердечно-сосудистое заболевание при диабете, фибрилляция предсердий, гипертензия, заболевание периферических сосудов; эректильная дисфункция, инсульт, преэклампсия, стенты с покрытием, ингибирующим рестеноз, синдром Марфана и аневризма брюшной/грудной аорты), болезнями обмена веществ (инсулинорезистентность и метаболический синдром), болезнями почек (диабетическая нефропатия, лекарственная почечная недостаточность и хроническая почечная недостаточность), заболевания легких (фиброз легких, острое повреждение легких, легочная гипертензия и астма), воспалительными и аутоиммунными заболеваниями (артрит, болезнь Крона, реакция «трансплантат против хозяина», системный склероз и рассеянный склероз), неврологическими заболеваниями (депрессия, тревожность, деменция, болезнь Альцгеймера, нейродегенеративные заболевания, повреждение спинного мозга, черепно-мозговая травма, периферическая нейропатия и болезнь Хантингтона), заболеваниями опорно-двигательного аппарата (мышечная дистрофия и мышечная травма), фиброзными заболеваниями (сокращение рубцов, фиброз легких, фиброз печени и фиброз сердца), заболеваниями кожи (заживление раны, смягчение последствий воздействия радиации, восстановление кожи, сокращение рубцов и алопеция), болезнями глаз (дегенерация желтого пятна, рубцевание роговицы и диабетическая ретинопатия), болезнями печени (неалкогольный стеатоз печени, фиброз печени, гепатобилиарные заболевания, стеатоз печени, цирроз и фиброз печени), онколонгическими и связанными заболеваниями (рак поддерживающая терапия при онкологических заболеваниях), заболеваниями желудочно-кишечного тракта (стрессовые язвы и болезнь Крона) и заболеваниями костного мозга (восстановление после миелосуппрессии после облучения или химиотерапии, аутологический трансплантат, смягчение последствий воздействия радиации, приживление трансплантата, аллогенный трансплантат, приживление трансплантированных клеток, гематопоэз и повреждение костного мозга и миелодиспластические синдромы). Концентрация активного соединения в композиции будет зависеть от параметров всасывания, инактивации и выведения активного соединения, схемы введения, вводимого количества, конкретной лекарственной формы, а также других факторов, известных специалисту в данной области.
Композиции предназначаются для введения соответствующим путем, в том числе перорально, парентерально, внутривенно, вагинально, интраназально, буккально, сублингвально, ректально, в глаз, топически и местно. Для перорального введения в данном случае предпочтительны капсулы и таблетки. Композиции имеют жидкую, полужидкую или твердую форму, и их получают путем, подходящим для каждого пути введения. Предпочтительные пути введения включают парентеральный и пероральный пути введения. В данном случае предпочтительно пероральное введение.
Растворы или суспензии, применяемые для парентерального, внутрикожного, подкожного или топического применения могут включать любой из следующих компонентов: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, нелетучее масло, гидроксиэтилцеллюлоза (HEC), β-циклодекстрин, гидроксипропил-β-циклодекстрин, коллоидные растворы карбоксиметилцеллюлозы, коллоидные растворы гидроксиэтилцеллюлозы и полиэтиленгликоля, глицерин, пропиленгликоль или другие синтетические растворители; противомикробные средства, такие как бензиловый спирт и метилпарабены; актиоксиданты, такие как аскорбиновая кислота и бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота (ЭДТА); буферы, такие как ацетаты, цитраты и фосфаты и вещества для модификации тоничности, такие как хлорид натрия или декстроза. Препараты для парентерального введения могут быть заключены в ампулы, одноразовые шприцы или флаконы, содержащие одну или несколько доз, выполненные из стекла, пластика или другого подходящего материала.
В другом варианте реализации биоактивный липид (липиды) вводят в полимерном составе, включая следующие, но не ограничиваясь ими: сополимер DL-молочной и гликолевой кислот (PLGA), полимолочная кислота (PLA), сополимеры PLA-PLGA, поликапролактоновые частицы и хитозановые наночастицы.
В тех случаях, когда соединения демонстрируют недостаточную растворимость, можно применять методы солюбилизации соединений. Такие методы известны специалистам и включают применение сорастворителей, таких как диметилсульфоксид (ДМСО), применение поверхностно-активных веществ, таких как TWEEN®, или растворение в водном растворе бикарбоната натрия, но не ограничиваются ими.
После смешивания или добавления соединения (соединений) полученная смесь может представлять собой раствор, суспензию, эмульсию и т.п. Форма полученной смеси зависит от ряда факторов, включая предполагаемый путь введения и растворимость соединения в выбранном носителе или наполнителе. Эффективная концентрация достаточна для облегчения симптомов заболевания, нарушения или соединения, которое лечат, и может быть определена эмпирически.
Может быть предпочтительно представить фармацевтические композиции согласно настоящему изобретению для введения людям и животным в дозированных лекарственных формах, таких как таблетки, капсулы, пилюли, порошки, гранулы, стерильные растворы или суспензии для парентерального введения и растворы или суспензии для перорального введения, и эмульсии вода-масло, содержащие подходящие количества соединений или их фармацевтически приемлемых производных. Фармацевтически терапевтически активные соединения и их производные обычно изготавливают и вводят в дозированных лекарственных формах или формах, содержащих несколько доз. Дозированные лекарственные формы относятся к физически раздельным единицам, подходящим для субъектов, представляющих собой людей и животных, и индивидуально упакованы так, как известно в данной области. Каждая единица дозирования содержит заранее определенное количество терапевтически активного соединения, достаточное для обеспечения желаемого терапевтического эффекта, в комбинации с необходимым терапевтическим носителем, средой или разбавителем. Примеры дозированных лекарственных форм включают ампулы и шприцы, а также таблетки или капсулы в индивидуальной упаковке. Дозированные лекарственные формы можно вводить по частям или по несколько единиц. Формы, содержащие несколько доз, представляет собой множество идентичных дозированных форм, упакованных в один контейнер, для введения в форме отдельных доз. Примеры форм, содержащих несколько доз, включают флаконы, бутылки с таблетками или капсулами или бутылки объемом несколько пинт или галлонов. Соответственно форма, содержащая несколько доз, представляет собой несколько единиц, содержащих по одной дозе, которые не разделены в упаковке.
Композиция может содержать, в дополнение к активному ингредиенту, разбавитель, такой как лактоза, сахароза, дикальций фосфат или карбоксиметилцеллюлоза; смазывающее вещество, такое как стеарат магния, стеарат кальция и тальк; и связующее вещество, такое как крахмал, природные камеди, такие как гуммиарабик, желатин, глюкоза, молассы, поливинилпирролидон, целлюлозы и их производные, повидон, кроссповидоны и другие подобные связующие, известные специалистам в данной области. Жидкая композиция, пригодная для фармацевтического введения, может, например, быть получена путем растворения, диспергирования или других способов смешивания активного соединения, определенного выше, и необязательных фармацевтических вспомогательных веществ, таких как, например, вода, физиологический раствор, водный раствор декстрозы, глицерин, гликоли, этанол и т.п., с получением раствора или суспензии. При желании, фармацевтическая композиция для введения может также содержать небольшие количества нетоксичных вспомогательных веществ, таких как смачивающие вещества, эмульгаторы или солюбилизаторы, pH-буферные вещества и т.п., например, ацетат, цитрат натрия, производные циклодекстрина, сорбитан монолаурат, триэтаноламиннатрия ацетат, триэтаноламин олеат и другие такие агенты. Фактические способы получения таких лекарственных форм известны или будут понятны специалистам; например, см. Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., 15th Edition, 1975. Композиции и составы для введения в любом случае будут содержать некоторое количество активного соединения в количестве, достаточном для облегчения симптомов у субъекта лечения.
Могут быть получены лекарственные формы или композиции, содержащие активный ингредиент в диапазоне от 0,005% до 100%, где оставшуюся часть составляет нетоксичный носитель. Для перорального введения фармацевтически приемлемые нетоксичные композиции получают путем введения любых обычно применяемых вспомогательных веществ, таких как, например, маннитол, лактоза, крахмал, стеарат магния, тальк, производные целлюлозы, кроскармеллоза натрия, глюкоза, сахароза, карбонат магния или сахарин натрия фармацевтического качества. Такие композиции включают растворы, суспензии, таблетки, капсулы, порошки и составы с замедленным высвобождением, такие как перечисленные ниже, но не ограничиваясь ими: имплантаты и микроинкапсулированные системы доставки, и биоразлагаемые, биосовместимые полимеры, такие как коллаген, этиленвинил ацетат, полиангидриды, полигликолевая кислота, сложные полиортоэфиры; полимолочная кислота и другие. Способы получения этих композиций известны специалистам в данной области. Предусмотренные композиции могут содержать 0,001%-100% активного ингредиента, предпочтительно 0,1-85%, обычно 75-95%.
Активные соединения и фармацевтически приемлемые производные могут быть приготовлены с носителями, которые защищают соединение от быстрого выведения из организма, такие как покрытия или составы с замедленным высвобождением.
Композиции могут включать другие активные соединения, которые обеспечивают желаемые комбинации свойств. Охарактеризованные в настоящем документе соединения или их фармацевтически приемлемые производные, описанные в настоящем документе, также может быть полезно вводить для терапевтических или профилактических целей совместно с другим фармакологическим агентом, который, как известно, имеет значение для лечения одного или большего числа заболеваний или медицинских состояний, указанных выше в настоящем документе, включая следующие, но не ограничиваясь ими: сердечно-сосудистое заболевание (инфаркт миокарда, застойная сердечная недостаточность, сердечно-сосудистое заболевание при диабете, фибрилляция предсердий, гипертензия, заболевание периферических сосудов, эректильная дисфункция, инсульт, преэклампсия, стенты с покрытием, ингибирующим рестеноз, синдром Марфана и аневризма брюшной/грудной аорты), метаболические заболевания (инсулинорезистентность и метаболический синдром), болезни почек (диабетическая нефропатия, лекарственная почечная недостаточность и хроническая почечная недостаточность), заболевания легких (фиброз легких, острое повреждение легких, легочная гипертензия и астма), воспалительные и аутоиммунные заболевания (артрит, болезнь Крона, реакция «трансплантат против хозяина», системный склероз и рассеянный склероз), неврологические заболевания (депрессия, тревожность, деменция, болезнь Альцгеймера, нейродегенеративные заболевания, повреждение спинного мозга, черепно-мозговая травма, периферическая нейропатия и болезнь Хантингтона), скелетно-мышечные заболевания (мышечная дистрофия и мышечная травма), фиброзные заболевания (сокращение рубцов, фиброз легких, фиброз печени и фиброз сердца), заболевания кожи (заживление раны, смягчение последствий воздействия радиации, восстановление кожи, сокращение рубцов и алопеция), болезни глаз (дегенерация желтого пятна, рубцевание роговицы и диабетическая ретинопатия), болезни печени (неалкогольный стеатоз печени, фиброз печени, гепатобилиарные заболевания, стеатоз печени, цирроз и фиброз печени), онкологические заболевания и связанные заболевания (рак и поддерживающая терапия при онкологических заболеваниях), заболевание желудочно-кишечного тракта (стрессовые язвы и болезнь Крона) и заболевания костного мозга (восстановление после миелосуппрессии после облучения или химиотерапии, аутологический трансплантат, смягчение последствий воздействия радиации, приживление трансплантата, аллогенный трансплантат, приживление трансплантированных клеток, гематопоэз и повреждение костного мозга, а также миелодиспластические синдромы). Предполагается, что такая комбинированная терапия составляет другой аспект композиций и способов лечения, охарактеризованных в настоящем документе.
1. Композиции для перорального введения или введения через кожу и слизистые оболочки
Лекарственные формы для перорального введения имеют форму твердого вещества, геля или жидкости. Твердые лекарственные формы представляют собой таблетки, капсулы, гранулы и нерасфасованные порошки. Типы таблеток для перорального введения включают прессованные, жевательные пастилки и таблетки, которые могут быть снабжены растворяющимся в кишечнике покрытием, сахарным покрытием или пленочным покрытием. Капсулы могут представлять собой твердые или мягкие желатиновые капсулы, а гранулы и порошки могут быть представлены в шипучей или нешипучей форме в комбинации с другими ингредиентами, известными специалистам в данной области.
В некоторых вариантах реализации составы представляют собой твердые лекарственные формы, предпочтительно капсулы, суппозитории, быстрорастворимые формы (например, пленки и готовые-таблетки (redi-tablets)) или таблетки. Таблетки, пилюли, капсулы, лепешки и т.п. могут содержать любой из следующих ингредиентов или соединений близкой природы: связующее вещество, разбавитель, разрыхлитель, смазывающее вещество, скользящее вещество, подсластитель и ароматизирующее вещество.
Примеры связующих веществ включают микрокристаллическую целлюлозу, трагакантовую камедь, раствор глюкозы, гуммиарабик, раствор желатина, сахарозу и крахмальную пасту. Смазывающие вещества включают тальк, крахмал, стеарат кальция или магния, ликоподий и стеаровую кислоту. Разбавители включают, например, лактозу, сахарозу, крахмал, каолин, соль, маннитол и дикальций фосфат. Скользящие вещества включают коллоидный дикосид кремния, но не ограничиваются им. Разрыхлители включают кроскармеллозу натрия, натрий крахмал гликолят, альгиновую кислоту, кукурузный крахмал, картофельный крахмал, бентонит, метилцеллюлозу, агар и карбоксиметилцеллюлозу. Красители включают, например, любые одобренные водорастворимые красители, имеющие сертификат FD&C (вещества, разрешенные в США для применения в пищевых, фармацевтических и косметических продуктах), и их смеси и водонерастворимые красители, имеющие сертификат FD&C, суспендированные на гидрате оксида алюминия. Подсластители включают сахарозу, лактозу, маннитол и искусственные подсластители, такие как сахарин, и любое число высушенных распылением вкусоароматических веществ. Вкусоароматические вещества включают природные вкусоароматические вещества, экстрагированные из растений, таких как фрукты, и синтетические смеси веществ, которые обеспечивают приятные вкусовые ощущения, такие как перечная мята и метилмалицилат, но не ограничиваясь ими. Смачивающие вещества включают пропиленгликоль моностеарат, сорбитан моноолеат, диэтиленгликоль монолаурат и полиоксиэтилен лауриловый эфир. Растворяющиеся в кишечнике покрытия включают жирные кислоты, жиры, воски, шеллак, аммонированный шеллак и целлюлозы ацетат-фталаты. Пленочные покрытия включают гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу натрия, полиэтиленгликоль 4000 и целлюлозы ацетат фталат.
В случае, если необходимо пероральное введение, соединение может быть представлено в композиции, которая защищает его от кислой среды в желудке. Например, композиция может быть снабжена растворяющимся в желудке покрытием, которое поддерживает ее целостность в желудке и высвобождает активное соединение в кишечнике. Композиция может также быть изготовлена в комбинации с антацидом или другим подобным ингредиентом.
Если дозированная лекарственная форма представляет собой капсулу, она содержит, в дополнение к материалу указанного выше типа, жидкий носитель, такой как жирное масло. Дополнительно согласно настоящему изобретению предусмотрено, что дозированные лекарственные формы могут содержать различные другие материалы, которые модифицируют физическую форму единицы дозирования, например, дражированные покрытия, и другие растворяющиеся в кишечнике вещества. Соединения можно также вводить в форме компонента эликсира, суспензии, сиропа, облатки, орошения, жевательной резинки и т.п. Сироп может содержать, в дополнение к активным соединениям, сахарозу в качестве подсластителя и некоторые консерванты, красители и окрашивающие вещества и вкусоароматические вещества.
Активные материалы также можно смешивать с другими активными материалам, которые не оказывают отрицательного влияния на желаемую активность, или с материалами, которые дополняют желаемую активность, такими как антациды антациды, блокаторы Н2 и диуретики. Активный ингредиент представляет собой соединение или его фармацевтически приемлемое производное, описанные в настоящем документе. Могут включаться более высокие концентрации активного ингредиента, до примерно 98% по массе.
Фармацевтически приемлемые носители, включаемые в таблетки, представляют собой связующие, смазывающие вещества, разбавители, разрыхлители, красители, вкусоароматические вещества и смачивающие вещества. Таблетки с разрушающимся в кишечнике покрытием, благодаря присутствию разрушающегося в кишечнике покрытия, устойчивы к действию кислоты в желудке и растворяются или распадаются в нейтральной или щелочной среде кишечника. Таблетки с покрытием на основе сахара представляют собой прессованные таблетки, на которые нанесены различные слои фармацевтически приемлемых веществ. Таблетки с пленочным покрытием представляют собой прессованные таблетки, покрытые полимером или другим подходящим покрытием. Полученные многократным прессованием таблетки представляют собой прессованные таблетки, полученные с использованием более чем одного цикла прессования с использованием фармацевтически приемлемых веществ, упомянутых ранее. Красители также могут применяться во всех перечисленных выше лекарственных формах. Вкусоароматические вещества и подсластители применяют в прессованных таблетках, таблетках с дражированным покрытием, полученных многократным прессованием и жевательных таблетках. Ароматизирующие вещества и подсластители особенно полезны в изготовлении жевательных таблеток и пастилок.
Жидкие лекарственные формы для перорального введения включают водные растворы, эмульсии, суспензии, растворы и/или суспензии, получаемые из нешипучих гранул, и шипучие препараты, восстанавливаемые из шипучих гранул. Водные растворы включают, например, эликсиры и сиропы. Эмульсии могут быть либо типа масло-в-воде, либо типа вода-в-масле.
Эликсиры представляют собой прозрачные подслащенные водно-спиртовые препараты. Фармацевтически приемлемые носители, применяемые в эликсирах, включают растворители. Сиропы представляют собой концентрированные водные растворы сахара, например, сахарозы, и могут содержать консервант. Эмульсия представляет собой двухфазную систему, в которой одна жидкость диспергирована в форме маленьких шариков в другой жидкости. Фармацевтически приемлемые носители, применяемые в эмульсиях, представляют собой неводные жидкости, эмульгаторы и консерванты. В суспензиях применяют фармацевтически приемлемые суспендирующие вещества и консерванты. Фармацевтически приемлемые вещества, применяемые в нешипучих гранулах, которые восстанавливают с получением жидкой лекарственной формы, включают разбавители, подсластители и смачивающие вещества. Фармацевтически приемлемые вещества, применяемые в шипучих гранулах, которые восстанавливают с получением жидкой лекарственной формы, включают органические кислоты и источник диоксида углерода. Красители и вкусоароматические вещества применяют во всех описанных выше лекарственных формах.
Растворители включают глицерин, сорбит, этиловый спирт и сироп. Примеры консервантов включают глицерин, метил и пропилпарабен, бензойная кислота, бензоат натрия и спирт. Примеры неводных жидкостей, применяемых в эмульсиях, включают минеральное масло и хлопковое масло. Примеры эмульгаторов включают желатин, гуммиарабик, трагакант, бентонит и поверхностно-активные вещества такие как полиоксиэтилен сорбитан моноолоеат. Суспендирующие вещества включают натрий-карбоксиметилцеллюлозу, пектин, трагакант, вигум и трагакантовую камедь. Разбавители включают лактозу и сахарозу. Подсластители включают сахарозу, сиропы, глицерин и искусственные подсластители, такие как сахарин. Смачивающие вещества включают пропиленгликоль моностеарат, сорбитан моноолеат, диэтиленгликоль монолаурат и полиоксиэтилен-лауриловый эфир. Органические кислоты включают лимонную и винную кислоту. Источники диоксида карбона включают бикарбонат натрия и карбонат натрия. Красители включают любые одобренные водорастворимые красители, имеющие сертификат FD&C (вещества, разрешенные в США для применения в пищевых, фармацевтических и косметических продуктах), и их смеси. Ароматизирующие вещества включают природные вкусоароматические вещества, экстрагированные из растений, таких как фрукты, и синтетические смеси соединений, которые обеспечивают приятные вкусовые ощущения.
Для твердой лекарственной формы раствор или суспензию, например, в пропиленкарбонате, растительных маслах или триглицеридах, в предпочтительном варианте заключают в желатиновую капсулу. Такие растворы, а также их получение и заключение в капсулы, раскрыты в патентах США №№4,328,245, 4,409,239 и 4,410,545. В случае жидкой лекарственной формы раствор, например, в полиэтиленгликоле, может быть разбавлен достаточным количеством фармацевтически приемлемого жидкого носителя, например, воды, для легкого отмеривания для введения.
В альтернативном варианте полутвердые составы для перорального введения могут быть получены путем растворения или диспергирования активного соединения или воли в растительных маслах, гликолях, триглицеридах, сложных эфирах пропиленгликоля (например, пропиленкарбонат) и других подобных носителях, и заключения этих растворов или суспензий в твердые или мягкие оболочки для капсул. Другие полезные составы включают составы, описанные в патентах США № Re 28,819 и 4,358,603 (соответствующие части этих патентов включены в настоящий текст посредством ссылки). Вкратце, такие составы включают составы, содержащие охарактеризованное в настоящем документе соединение, диалкилированные моно- или полиалкиленгликоли, включая следующие, но не ограничиваясь ими: 1,2-диметоксиметан, диглим, триглим, тетраглим, полиэтиленгликоль-350-диметиловый эфир, полиэтиленгликоль-550-диметиловый эфир, полиэтиленгликоль-750-диметиловый эфир, где 350, 550 и 750 относятся к примерной средней молекулярной массе полиэтиленгликоля, и один или больше актиоксидантов, таких как бутилированный гидрокситолуол (ВНТ, БГТ), бутилированный гидроксианизол (ВНА), пропилгаллат, витамин Е, гидрохинон, гидроксикумарины, этаноламин, лецитин, цефалин, аскорбиновая кислота, яблочная кислота, сорбит, фосфорная кислота, тиодипропионовая кислота и ее сложные эфиры и дитиокарбаматы, но не ограничиваются ими.
Другие составы включают, но не ограничиваются следующими: водные спиртовые растворы, включая фармацевтически приемлемый ацеталь. Спирты, применяемые в этих составах - это любые фармацевтически приемлемые смешиваемые с водой растворители, содержащие одну или больше гидроксильных групп, включая пропиленгликоль и этанол, но не ограничиваясь ими. Ацетали включают ди(низший алкил)ацетали или альдегиды - низшие алкилы, такие как ацетальдегиддиэтилацеталь.
Во всех вариантах реализации составы в форме таблеток и капсул могут быть снабжены покрытием как известно специалистам для модификации или замедления растворения активного ингредиента. Таким образом, например, они могут быть снабжены обычным расщепляемым в кишечнике покрытием, таким как фенилсалицилат, воски и ацетат-фталат целлюлозы.
2. Инъецируемые формы, растворы и эмульсии
Парентеральное введение, обычно характеризующееся подкожными, внутримышечными или внутривенными инъекциями, также предусмотрено настоящим документом. Инъекционные лекарственные средства могут быть приготовлены в обычных формах, в виде жидких растворов или суспензий, твердых форм, которые могут быть растворены или суспендированы в жидкости перед инъекцией, или в качестве эмульсий. Подходящими вспомогательными веществами являются, например, воды, физиологический раствор, декстроза глицерин или этанол. Дополнительно согласно настоящему изобретению предусмотрено, что при необходимости фармацевтические композиции для введения могут также содержать небольшие количества нетоксичных вспомогательных веществ, таких как смачивающие вещества или эмульгаторы, pH буферные вещества, стабилизаторы, вещества, повышающие растворимость и другие подобные агенты, такие как, например, ацетат натрия, сорбитан монолаурат, триэтаноламин олеат и циклодекстрины. Имплантация системы с медленным высвобождением или отложенным высвобождением, поддерживающих постоянный уровень дозировки (см., например, патент США №3,710,795), также предусмотрены настоящим документом. Вкратце, соединение согласно настоящему изобретению диспергируют в твердой внутренней матрице, например, полиметилметакрилате, полибутилметакрилате, пластифицированном или непластифицированном поливинилхлориде, пластифицированном нейлоне, пластифицированном полиэтилентерефталате, природном каучуке, полиизопрене, полиизобутилене, полибутадиене, полиэтилене, сополимерах этилен-винилацетат, силиконовых каучуках, полидиметилсилоксанах, силикон-карбонатных сополимерах, гидрофильных полимерах, таких как гидрогели сложные эфиры акриловой и метакриловой кислот, коллаген, поперечно сшитый поливиниловый спирт и поперечно сшитый частично гидролизованный поливинилацетат, который окружен внешней полимерной мембраной, например, полиэтиленом, полипропиленом, сополимерами этилен/пропилен, сополимерами этилен/этилакрилат, сополимерами этилен/винилацетат, силиконовыми каучуками, полидиметилсилоксанами, неопреновым каучуком, хлорированным полиэтиленом, поливинилхлоридом, сополимерами винилхлорида с винилацетатом ацетат, винилиден хлоридом, этиленом и пропиленом, иономером полиэтилен терефталата, бутилкаучуком, эпихлоргидриновыми каучуками, сополимером этилен/виниловый спирт, терполимером этилен/винил ацетат/виниловый спирт и сополимером этилен/винилоксиэтанол, который не растворяется в физиологических жидкостях. Соединение диффундирует через внешнюю полимерную мембрану на этапе контроля скорости высвобождения. Процентное содержание активного соединения, содержащегося в таких композициях для парентерального введения в большой степени зависит от природы конкретной композиции, а также от активности соединения и потребностей субъекта.
Парентеральное введение композиций включает внутрикожное, внутривенное, подкожное и внутримышечное введение. Препараты для парентерального введения включают стерильные растворы, готовые для инъекций, стерильные сухие растворимые продукты, такие как лиофилизированные порошки, готовые для смешивания с растворителем непосредственно перед введением, включая подкожные таблетки, стерильные суспензии, готовые для инъекций, стерильные сухие нерастворимые продукты, готовые для объединения с основой непосредственно перед применением и стерильные эмульсии. Растворы могут быть либо водными, либо неводными.
В случае внутривенного введения подходящие носители включают физиологический солевой раствор или фосфатный буферный раствор (ФБР) и растворы, содержащие загустители и солюбилизаторы, такие как глюкоза, полиэтиленгликоль и пропиленгликоль и их смеси.
Фармацевтически приемлемые носители, применяемые в препаратах для парентерального введения, включают водные среды, неводные среды, противомикробные средства, изотонические веществ, буферы, актиоксиданты, местные анестетики, суспендирующие и диспергирующие вещества, эмульгаторы, секвестрирующие или хелатирующие вещества и другие фармацевтически приемлемые вещества.
Примеры водных основ включают инъекционный хлорид натрия, инъекционный раствор Рингера, изотонический раствор декстрозы для инъекций, стерильную воду для инъекций, раствор Рингер-лактат с декстрозой для инъекций. Неводные основы для парентерального введения включают нелетучие масла растительного происхождения, хлопковое масло, кукурузное масло, кунжутное масло и арахисовое масло. К препаратам для парентерального введения, упакованным в контейнеры, содержащим несколько доз, необходимо добавлять противомикробные средства в бактериостатических или фунгистатических концентрациях, которые включают фенолы или крезолы, соединения ртути, бензиловый спирт, хлорбутанол, сложные эфиры п-гидроксибензойной кислоты с метилом и пропилом, тимеросал, бензалкония хлорид и бензэтония хлорид. Изотонические вещества включают хлорид натрия и декстрозу. Буферы включают фосфат и цитрат. Актиоксиданты включают бисульфат натрия. Местные анестетики включают прокаина гидрохлорид. Суспендирующие и диспергирующие вещества включают натрий-карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу и поливинилпирролидон. Эмульгаторы включают Полисорбат 80 (TWEEN® 80). Вещества, секвестрирующие или хелатирующие ионы металлов, включают ЭДТА. Фармацевтические носители также включают этиловый спирт, полиэтиленгликоль и пропиленгликоль в качестве смешивающихся с водой сред и гидроксид натрия, соляную кислоту, лимонную кислоту или молочную кислоту для регулировки pH.
Концентрацию фармацевтически активного соединения подбирают таким образом, чтобы инъекция обеспечивало количество, эффективное для обеспечения желаемого фармакологического эффекта. Как известно в данной области техники, точная доза зависит, от возраста, массы и состояния пациента или животного.
Дозированные препараты для парентерального введения упаковывают в ампулу, флакон или шприц с иглой. Как известно в данной области техники и в соответствии с практикой в данной области все препараты для парентерального введения должны быть стерильны.
В качестве иллюстрации, внутривенная или внутриартериальная инфузия стерильного раствора, содержащего активное соединение, является эффективным путем введения. Другим вариантом реализации является стерильный или масляный раствор или суспензия, содержащие активный материал, который при необходимости вводят путем инъекции для обеспечения желаемого фармакологического эффекта.
Инъекционные лекарственные средства предназначены для местного и системного введения. Обычно терапевтически эффективную дозировку изготавливают таким образом, чтобы она содержала концентрацию по меньшей мере от примерно 0,1% масс/масс до примерно 90% масс/масс или больше, предпочтительно, больше 1% масс/масс активного соединения в ткань (ткани), которую лечат. Активный ингредиент можно вводить одной дозой или можно разделять на несколько меньших доз для введения через некоторые промежутки времени. Понятно, что точная дозировка и продолжительность лечения зависят от заболевания, которое лечат, и могут быть определены эмпирическим путем с использованием известных протоколов тестирования или экстраполяции данных in vivo или in vitro исследований. Следует отметить, что концентрации и значение дозировки также могут варьировать в зависимости от возраста индивидуума, которого лечат. Также следует понимать, что для любого конкретного субъекта конкретные режимы дозирования должны со временем регулироваться в соответствии с индивидуальными потребностями и профессиональным суждением лица, которое осуществляет введение или наблюдение за введением композиций, и что диапазоны концентраций, представленные в настоящем документе, являются только примерами, и не предназначены для ограничения объема или реализации заявленных составов.
Соединение может быть суспендировано в мелкодисперсную или другую подходящую форму или может быть дериватизировано для получения более растворимого активного продукта или получения пролекарства. Форма полученной смеси зависит от ряда факторов, включая предполагаемый путь введения и растворимость соединения в выбранном носителе или среде. Эффективная концентрация достаточна для облегчения симптомов состояния и может и может быть определена эмпирическим путем.
3. Лиофилизированные порошки
Формы, предусмотренные в настоящем документе, также включают лиофилизированные порошки, которые могут быть восстановлены для введения в форме растворов, эмульсий и других смесей. Они также могут восстанавливаться и вводиться в форме твердых препаратов или гелей.
Стерильный лиофилизированный порошок получают путем растворения соединения, предложенного в настоящем документе или его фармацевтически приемлемого производного в подходящем растворителе. Растворитель может содержать вспомогательное вещество, которое улучшает стабильность, или другой фармакологический компонент порошка или восстановленного раствора, полученного из порошка. Вспомогательные вещества, которые могут применяться, включают, но не ограничиваются следующими: декстроза, сорбит, фруктоза, кукурузный сироп, ксилит, глицерин, глюкоза, сахароза или другие подходящие вещества. Растворитель может также содержать буфер, такой как цитратный, натриевый или калий-фосфатный или другие подобные буферы, известные специалистам в данной области, обычно, с pH близким к нейтральному. Последующая стерильная фильтрация раствора с последующей лиофилизацией в стандартных условиях, известных специалистам в данной области, обеспечивает необходимый состав. Обычно полученный раствор распределяют во флаконы для лиофилизации. Каждый флакон содержит одну дозу (10-2000 мг, предпочтительно 100-500 мг) или несколько доз соединения для соответствующего дозирования. Лиофилизированный порошок можно хранить в подходящих условиях, таких как температура от примерно 4°С до комнатной температуры.
Восстановление этого лиофилизированного порошка водой для инъекций дает состав для применения для парентерального введения. Для восстановления примерно 1-50 мг, предпочтительно 5-35 мг, более предпочтительно примерно 9-30 мг лиофилизированного порошка добавляют на мл стерильной воды или другого подходящего носителя. Точное количество зависит от выбранного соединения. Такое количество может быть определено эмпирически.
4. Топическое введение
Смеси для топического применения получают как это описано для местного и системного введения. Полученная смесь может представлять собой раствор, суспензию, эмульсии и т.п. и изготовлена в форме кремов, гелей, мазей, эмульсий, растворов, эликсиров, лосьонов, суспензий, настоек, паст, пенок, аэрозолей, препаратов для орошения, спреев, суппозиториев, повязок, кожных пластырей или в виде любого другого состава, пригодного для топического введения.
Соединения или их фармацевтически приемлемые производные могут быть приготовлены в виде аэрозолей для топического применения, например, путем ингаляций (см., например, патенты США №№4,044,126, 4,414,209 и 4,364,923, в которых описаны аэрозоли для доставки стероида, пригодного для лечения воспалительных заболеваний, в частности, астмы или других заболеваний легких, и соответствующие части которых включены в настоящий документ посредством ссылки). Эти составы для введения в дыхательные пути могут иметь форму аэрозоля или раствора для небулайзера, или ультратонкого порошка для инсуфляции, отдельно или в комбинации с инертным носителем, таким как лактоза. В таком случае диаметр частиц препарата обычно будет меньше 50 микрон, в предпочтительном варианте меньше 10 микрон.
Соединения могут быть включены в составы для локального или топического применения, такого как топическое нанесение на кожу и слизистые оболочки, например, в глаз, в форме гелей, кремов и лосьонов для нанесения на глаз или для интрацистернального или интраспинального введения. Топическое введение предусмотрено для трансдермальной доставки, а также для введения в глаза или слизистую оболочку, или для ингаляционных способов терапии. Также можно вводить назальные растворы активного соединения отдельно или в комбинации с другими фармацевтически приемлемыми вспомогательными веществами.
Эти растворы, в частности, те, которые предназначены для применения для глаз, могут быть изготовлены в форме 0,01%-10% изотонических растворов с pH~5-7, с соответствующими солями.
5. Композиции для других путей введения
Другие пути введения, такие как топическое применение, трансдермальные пластыри и ректальное введение, также предусмотрены настоящим изобретением.
Например, фармацевтические лекарственные формы для ректального введения представляют собой ректальные суппозитории, капсулы и таблетки для системного эффекта. Ректальные суппозитории в настоящем документе обозначают любые твердые тела для введения в прямую кишку, которые плавятся или размягчаются при температуре тела, высвобождая один или больше фармакологически или терапевтически активных ингредиентов. Фармацевтически приемлемые вещества, применяемые в суппозиториях, представляют собой основы или носители и вещества, повышающие температуру плавления. Примеры основ включают масло какао (масло какао-бобов), глицерин-желатин, карбовакс (полиоксиэтиленгликоль) и подходящие смеси моно-, ди- и триглицеридов жидких кислот. Возможно применение комбинаций различных оснований. Вещества, повышающие температуру плавления суппозиториев, включают спермацет и воск. Ректальные суппозитории могут быть получены либо путем прессования, либо путем формовки. Обычно масса ректального суппозитория составляет примерно от 2 до 3 г.
Таблетки и капсулы для ректального введения изготавливают с использованием тех же фармацевтически приемлемых веществ и способов, которые применяются для составов для перорального введения.
6. Изготавливаемые изделия
Соединения или их фармацевтически приемлемые производные могут быть упакованы в форме изделий, содержащих упаковочный материал, соединение или его фармацевтически приемлемое производное согласно настоящему изобретению, которое применяется для лечения, предотвращения или облегчения одного или более симптомов, связанных с заболеваниями, включая следующие, но не ограничиваясь ими: сердечно-сосудистое заболевание (инфаркт миокарда, застойная сердечная недостаточность, сердечно-сосудистое заболевание при диабете, фибрилляция предсердий, гипертензия, заболевание периферических сосудов, эректильная дисфункция, инсульт, преэклампсия, стенты с покрытием, ингибирующим рестеноз, синдром Марфана и аневризма брюшной/грудной аорты), метаболические заболевания (инсулинорезистентность и метаболический синдром), болезни почек (диабетическая нефропатия, лекарственные почечная недостаточность и хроническая почечная недостаточность), заболевания легких (фиброз легких, острое повреждение легких, легочная гипертензия и астма), воспалительные и аутоиммунные заболевания (артрит, болезнь Крона, реакция «трансплантат против хозяина», системный склероз и рассеянный склероз), неврологические заболевания (депрессия, тревожность, деменция, Болезнь Альцгеймера, нейродегенеративные заболевания, повреждение спинного мозга, черепно-мозговая травма, периферическая нейропатия и болезнь Хантингтона), скелетно-мышечные заболевания (мышечная дистрофия и мышечная травма), фиброзные заболевания (сокращение рубцов, фиброз легких, фиброз печени и фиброз сердца), заболевания кожи (заживление раны, смягчение последствий воздействия радиации, восстановление кожи, сокращение рубцов и алопеция), болезни глаз (дегенерация желтого пятна, рубцевание роговицы и диабетическая ретинопатия), болезни печени (неалкогольный стеатоз печени, фиброз печени, гепатобилиарные заболевания, стеатоз печени, цирроз и фиброз печени), онкологические заболевания и связанные заболевания (рак и поддерживающая терапия при онкологических заболеваниях), заболевание желудочно-кишечного тракта (стрессовые язвы и болезнь Крона) и заболевания костного мозга (восстановление после миелосуппрессии после облучения или химиотерапии, аутологический трансплантат, смягчение последствий воздействия радиации, приживление трансплантата, аллогенный трансплантат, приживление трансплантированных клеток, гематопоэз и повреждение костного мозга и миелодиспластические синдромы) и этикетку, указывающую, что соединение или его фармацевтически приемлемое производное применяется для лечения, предотвращения или облегчения одного или более симптомов, связанных с указанными выше заболеваниями.
Изготавливаемые изделия согласно настоящему изобретению содержат упаковочные материалы. Упаковочные материалы для применения в фармацевтических продуктах известны специалистам в области, см., например, патенты США №№5,323,907, 5,052,558 и 5,033,252 (соответствующие части этих патентов включены в настоящий документ посредством ссылки). Примеры фармацевтических упаковочных материалов включают, но не ограничиваются следующими: блистерные упаковки, бутылки, пробирки, ингаляторы, помпы, мешки, флаконы, контейнеры, шприцы, бутыли и любой упаковочный материал, подходящий для выбранного состава и предполагаемого пути введения и лечения. Предусмотрен широкий диапазон форм соединений и композиций согласно настоящему изобретению, а также различные способы лечения для каждого нарушения, ассоциированного со следующими: сердечно-сосудистое заболевание (инфаркт миокарда, застойная сердечная недостаточность, сердечно-сосудистое заболевание при диабете, фибрилляция предсердий, гипертензия, заболевание периферических сосудов, эректильная дисфункция, инсульт, преэклампсия, стенты с покрытием, ингибирующим рестеноз, синдром Марфана и аневризма брюшной/грудной аорты), метаболические заболевания (инсулинорезистентность и метаболический синдром), болезни почек (диабетическая нефропатия, лекарственная почечная недостаточность и хроническая почечная недостаточность), заболевания легких (фиброз легких, острое повреждение легких, легочная гипертензия и астма), воспалительные и аутоиммунные заболевания (артрит, болезнь Крона, реакция «трансплантат против хозяина», системный склероз и рассеянный склероз), неврологические заболевания (депрессия, тревожность, деменция, болезнь Альцгеймера, нейродегенеративные заболевания, повреждение спинного мозга, черепно-мозговая травма, периферическая нейропатия и болезнь Хантингтона), скелетно-мышечные заболевания (мышечная дистрофия и мышечная травма), фиброзные заболевания (сокращение рубцов, фиброз легких, фиброз печени и фиброз сердца), заболевания кожи (заживление раны, смягчение последствий воздействия радиации, восстановление кожи, сокращение рубцов и алопеция), болезни глаз (дегенерация желтого пятна, рубцевание роговицы и диабетическая ретинопатия), болезни печени (неалкогольный стеатоз печени, фиброз печени, гепатобилиарные заболевания, стеатоз печени, цирроз и фиброз печени), онкологические заболевания и связанные заболевания (рак и поддерживающая терапия при онкологических заболеваниях), заболевание желудочно-кишечного тракта (стрессовые язвы и болезнь Крона) и заболевания костного мозга (восстановление после миелосуппрессии после облучения или химиотерапии, аутологический трансплантат, смягчение последствий воздействия радиации, приживление трансплантата, аллогенный трансплантат, приживление трансплантированных клеток, гематопоэз и повреждение костного мозга и миелодиспластические синдромы).
Е. Способы применения и способы лечения соединениями и композициями
Предложенные соединения могут селективно воздействовать на некоторые сопряженные с G-белком рецепторы и могут применяться в качестве селективных агонистов этих рецепторов.
Соединения, предложенные согласно настоящему изобретению, действуют как низкомолекулярные модуляторы родственных ангиотензину пептидов. Предложенные соединения могут действовать против рецептора Mas, который также известен как пептид Ang(1-7). В качестве части их действия в отношении ангиотензиновых рецепторов, или в дополнение к нему или вместо него, предложенные соединения могут имитировать эндогенные эффекты пептида Ang(1-7) и обеспечивать преимущества всех полезных видов его активности и терапевтических эффектов.
В одном из предпочтительных вариантов реализации предложенные соединения можно применять в качестве селективных агонистов рецептора Mas, и они не действуют как агонисты рецептора ангиотензина II AT1R. В другом предпочтительном варианте реализации предложенные соединения могут применяться в качестве агонистов рецептора Mas и/или в качестве агонистов рецептора ангиотензина II AT2R, но не действуют в качестве агонистов рецептора II AT1R. В другом предпочтительном варианте реализации предложенные соединения действуют как агонисты рецептора Mas и/или как агонисты рецептора ангиотензина II AT2R, но не действуют как антагонисты рецептора ангиотензина II AT1R.
В одном варианте реализации согласно настоящему изобретению предложены фармацевтические композиции, содержащие соединение Формулы 1 или его соль и любой предпочтительный носитель, которые можно применять для терапевтического введения.
В другом варианте реализации настоящего изобретения предложен способ повышения образования NO в клетке, включающий приведения клетки в контакт с эффективным количеством соединения, соответствующего формуле 1 (или любой раскрытой в настоящем документе формулы, полученной из формулы 1, такой как формула 2-11), или его солей.
В другом варианте реализации настоящего изобретения предложен способ снижения глюкозы в крови у нуждающегося в этом пациента, включающий введение пациенту эффективного количества соединения, соответствующего формуле 1 (или любой раскрытой в настоящем документе формулы полученной из формулы 1, такой как формула 2-11), или его солей.
В одном из предпочтительных вариантов реализации предложенный способ применяют у пациента с сахарным диабетом.
В другом варианте реализации настоящего изобретения предложен способ снижения накопления жира у нуждающегося в этом пациента, включающий введение пациенту эффективного количества соединения, соответствующее формуле 1 (или любой раскрытой в настоящем документе формулы полученной из формулы 1, такой как формула 2-11) или его солей.
В одном из предпочтительных вариантов реализации предложенный способ применяют у пациента с неалкогольным стеатогепатитом.
В другом варианте реализации настоящего изобретения предложен способ усиления пролиферации клеток-предшественников костного мозга у нуждающегося в этом пациента включающий введение пациенту эффективного количества соединения, соответствующего формуле 1 (или любой раскрытой в настоящем документе формулы полученной из формулы 1, такой как формула 2-11) или его солей.
В одном из предпочтительных вариантов реализации предложенный способ применяют у пациента с миелодиспластическим синдромом.
В другом варианте реализации настоящего изобретения предложен способ лечения пациента с раком, включающий введение пациенту эффективного количества соединения, соответствующее формуле 1 (или любой раскрытой в настоящем документе формулы полученной из формулы 1, такой как формула 2-11) или его солей.
В одном из предпочтительных вариантов реализации предложенный способ применяют у пациента с раком молочной железы.
В другом варианте реализации настоящего изобретения предложен способ лечения связанного с ангиотензином заболевания или нарушения включающий: введение нуждающемуся в этом пациенту эффективного количества предложенного соединения Формулы 1 (или любой раскрытой в настоящем документе формулы, полученной из формулы 1, такой как формула 2-11) или его солей, или фармацевтической композиции, содержащей соединение согласно настоящему изобретению, причем количество соединения эффективного для ослабления по меньшей мере одного симптома, связанного с заболеванием или нарушением, или для отсрочивания или предотвращения возникновения по меньшей мере одного симптома заболевания.
В одном из примеров реализации согласно настоящему изобретению предложены соединения, способы и композиции для лечения заболеваний, опосредуемых ангиотензином II, воздействующие на его рецептор I типа (AT1R) или действующие через другие механизмы. Соответственно, в одном из аспектов изобретение обеспечивает способы и композиции для модулирования, облегчения или лечения заболеваний или состояний; связанных с нежелательными действиями пептида, родственного ангиотензину, такого как II.
В другом варианте реализации согласно настоящему изобретению предложен способ применения предложенных соединений Формулы 1 или их солей и композиций для лечения заболеваний или нарушений и связанных состояний, опосредуемых нежелательными эффектами родственного ангиотензину пептида, такого как ангиотензин II. В другом варианте реализации согласно настоящему изобретению предложен способ применения предложенных соединений и композиций для лечения нарушений, опосредуемых сниженной активностью стволовых клеток/клеток-предшественников.
Согласно настоящему изобретению предложены низкомолекулярные непептидные соединения, а также способы и композиции для лечения связанных с ангиотензином заболеваний и нарушений, включая следующие, но не ограничиваясь ими: сердечно-сосудистые заболевания (инфаркт миокарда, застойная сердечная недостаточность, сердечно-сосудистое заболевание при диабете, фибрилляция предсердий, гипертензия, заболевание периферических сосудов, эректильная дисфункция, инсульт, преэклампсия, стенты с покрытием, ингибирующим рестеноз, Синдром Марфана и аневризма брюшной/грудной аорты), метаболические заболевания (инсулинорезистентность и метаболический синдром), болезни почек (диабетическая нефропатия, декарственная почечная недостаточность и хроническая почечная недостаточность), заболевания легких (фиброз легких, острое повреждение легких, легочная гипертензия и астма), воспалительные и аутоиммунные заболевания (артрит, Болезнь Крона, реакция «трансплантат против хозяина», системный склероз и рассеянный склероз), неврологические заболевания (депрессия, тревожность, деменция, болезнь Альцгеймера, нейродегенеративные заболевания, повреждение спинного мозга, черепно-мозговая травма, периферическая нейропатия и болезнь Хантингтона), скелетно-мышечные заболевания (мышечная дистрофия и мышечная травма), фиброзные заболевания (сокращение рубцов, фиброз легких, фиброз печени и фиброз сердца), заболевания кожи (заживление раны, смягчение последствий воздействия радиации, восстановление кожи, сокращение рубцов и алопеция), болезни глаз (дегенерация желтого пятна, рубцевание роговицы и диабетическая ретинопатия), болезни печени (неалкогольный стеатоз печени, фиброз печени, гепатобилиарные заболевания, стеатоз печени, цирроз и фиброз печени), онкология и связанные заболевания (рак поддерживающая терапия при онкологии), заболевание желудочно-кишечного тракта (стрессовые язвы и болезнь Крона) и заболевания костного мозга (восстановление после миелосуппрессии после облучения или химиотерапии, аутологический трансплантат, смягчение последствий воздействия радиации, приживление трансплантата, аллогенный трансплантат, приживление трансплантата, гематопоэз и повреждение костного мозга и миелодиспластические синдромы).
В одном из предпочтительных вариантов реализации согласно настоящему изобретению предложены соединения, способы и композиции для лечения болезней и нарушений обмена веществ и связанных заболеваний, таких как сахарный диабет, связанные с диабетом сердечно-сосудистые нарушения, связанные с диабетом изъязвления кожи, связанная с диабетом гипертензия, диабетические заболевания глаз и связанные с ожирением заболевания или состояния.
В одном из примеров реализации предложенные соединения, способы и композиции применяют для уменьшения последствий гипергликемии у пациентов с диабетом, не вызывая гипогликимии.
В других примерах реализации предложенные соединения и композиции можно применять для лечения связанного с ангиотензинном заболевания или нарушения и связанных состояний, включая: сердечно-сосудистое заболевание, заболевание почек, гематологическое заболевание, фиброзное заболевание, заболевание печени, аутоиммунное/воспалительное заболевание, метаболическое заболевание, легочное заболевание, диабет, заболевание глаз, неврологическое заболевание или рак.
Более конкретно согласно настоящему изобретению предложен способ применения предложенных соединений и фармацевтических композиций для лечения различных связанных с ангиотензинном заболеваний или нарушений.
В одном примере реализации согласно настоящему изобретению предложены способы и композиции для лечения известного связанного с ангиотензином заболевания.
В одном из предпочтительных вариантов реализации согласно настоящему изобретению предложен способ лечения диабета, ожирения или другого заболевания системы обмена веществ.
Предпочтительные способы и композиции включают фармацевтические композиции для топического, парентерального и перорального введения, содержащие предложенного соединение и производные или фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Согласно изобретению также предложен способ применения предложенных фармацевтических композиций для лечения связанных с ангиотензином заболеваний и нарушений.
В одном из примеров реализации согласно настоящему изобретению предложен способы и композиции для лечения болезней и нарушений обмена веществ, включая диабет и связанные соединения, после перорального, парентерального (например, подкожного, интратекального, эпидурального и внутривенного) и топического введения, такого как доставка в кожу, глаз или слизистую оболочку.
В другом варианте реализации предложенные соединения, способы и композиции применяют в пероральном, парентерального или топическом введении, включающем соединение согласно настоящему изобретению или фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Далее настоящее изобретение описано в нижеследующих примерах, которые являются исключительно иллюстративными и которые не предназначены для ограничения объема изобретения, охарактеризованного в формуле изобретения.
ПРИМЕРЫ
Пример 1. Дизайн на основании структуры и идентификация непептидных низкомолекулярных соединений, которые селективно связываются с рецептором Mas, на основании структуры.
Предложенные соединения разрабатывали таким образом, чтобы они обладали полезной агонистической активностью в отношении рецептора AT1. В отсутствие доступных рентгенографических структур для соответствующих ангиотензиновых рецепторов, таких как рецепторы AT1, АТ2 и Mas, предложенные соединения выявляли с использованием моделирования гомологии сопряженных с G-белком рецепторов для оценки ключевых структурных характеристик. Модели гомологии для этих рецепторов получали с использованием автоматизированной системы Prime (Prime, v3,1,  , LLC, New York, NY, США). Последовательность AT1, AT2 и MAS загружали из Universal Protein Resource (UniProt). Последовательность AT2R и рецептора MAS выравнивали с последовательностью рецептора ноцицептина/орфанина FQ (PDB ID: 4ЕА3 Chain А) в системе определения гомологии Prime, размещая пробелы в петлевых участках. Prime использовали для построения гомологичных моделей с использованием способа построения с использованием базы знаний. Внеклеточные петли полученной гомологичной структуры удаляли в рабочей среде Maestro и использовали инструмент Schrodinger's Protein Preparation Wizard для добавления атомов водорода, корректировки порядков связей, удаления несущественных молекул воды, предсказания состояний протонирования боковой цепи, таутомерии и ориентации полярных водородов, а также для минимизации энергии белковой структуры. Ортостерический сайт модели гомологии исследовали на предмет полярных остатков, способных образовывать водородные связи с молекулами.
, LLC, New York, NY, США). Последовательность AT1, AT2 и MAS загружали из Universal Protein Resource (UniProt). Последовательность AT2R и рецептора MAS выравнивали с последовательностью рецептора ноцицептина/орфанина FQ (PDB ID: 4ЕА3 Chain А) в системе определения гомологии Prime, размещая пробелы в петлевых участках. Prime использовали для построения гомологичных моделей с использованием способа построения с использованием базы знаний. Внеклеточные петли полученной гомологичной структуры удаляли в рабочей среде Maestro и использовали инструмент Schrodinger's Protein Preparation Wizard для добавления атомов водорода, корректировки порядков связей, удаления несущественных молекул воды, предсказания состояний протонирования боковой цепи, таутомерии и ориентации полярных водородов, а также для минимизации энергии белковой структуры. Ортостерический сайт модели гомологии исследовали на предмет полярных остатков, способных образовывать водородные связи с молекулами.
С использованием этих моделей гомологии в тестах на вытеснение Ang II и Ang(1-7) при связывании, а также в других связанных анализах были смоделированы, оптимизированы, получены и исследованы, несколько серий соединений-примеров. Результатом этих исследований стала идентификация и валидация релевантных структурных признаков предложенных соединений.
Репрезентативный пример, включающий модель, связанную с соединением-примером 7, представлен на Фигуре 2. Для ясности в этих моделях показана только этильная группа на месте бутильной группы соединения 7. В этом примере предпочтительность связывания соединения 7 (Фигура 2A-D) с AT2R сравнивают с содержащем пиразол изомером соединения 7 (Фигура 2Е). Несмотря на небольшие различия в их структуре, их ориентация при связывании существенно различается, что указывает на важность более основного атома азота в соединении 7. Другое сравнение соединения 7 с соответствующим соединением, в котором кольцо пиридина заменено бензольным кольцом (Фигура 2F-H), показало, что присутствие основного азота в соединении 7, который предположительно протонирован, препятствует включению этого соединения в неполярное окружение части этих сопряженных с G-белком рецепторов, расположенной под поверхностью, которая предпочтительна для бифенильной структуры (Фигура 2G-H). Напротив, соединение 7 способно связываться в альтернативной ориентации, более близкой к поверхности (Фигура 2B-D). Альтернативная предпочтительность имеет место для близких соединений, в которых кольцо пиридина заменено бензольным кольцом (Фигура 2F-H). Общая ориентация связанных соединений (Фигура 2В в сравнении с 2G и 2D в сравнении с 2Н), а также контактирующие остатки в сайте связывания трансмембранных сопряженных с G-белком рецепторов (Фигура 2С в сравнении с 2Е и 2F), резко меняется в присутствии основного азота, присутствующего в соединениях, таких как 7, обеспечивая способность этих соединений дифференцированно связываться с AT2R. Связывание этих соединений с AT1R и рецептором Mas характеризуется аналогичными отличиями, которые обуславливают дифференцированные профили активности.
В целом эти модели выявляют ключевые структурные признаки, необходимые для того чтобы предложенные соединения могли функционировать как селективные антагонисты Mas в отсутствие значительной агонистической или антагонистической активности в отношении AT1R или AT2R. При таком дифференцированном предпочтительном связывании предложенные соединения не способны адекватно связываться с AT1R и AT2R, и ожидается, что они будут неспособны проявлять себя как эффективные агонисты или антагонисты этих рецепторов.
Репрезентативный пример, включающий модель, связанную с предполагаемым связыванием соединения-примера 7 с рецептором Mas, представлен на Фигуре 3. Для ясности на этих моделях показана только этильная группа на месте бутильной группы соединения 7. Предполагаемая предпочтительность связывания соединения 7 в гомологичной модели гомологии Mas выявила несколько сильных взаимодействий с полярными остатками в сайте связывания (Фигура 3В). Присутствие основного азота, который предположительно протонирован, а также других полярных групп в соединении 7 позволяет этому соединению сильно взаимодействовать в этом полярном сайте рецептора Mas. Контактирующие остатки в сайте связывания (фигура 3А) и общая ориентация связанного соединения, более близкая к поверхности рецептора Mas (фигура 3C, D), указывают на уникальный профиль связывания предложенных соединений, который обеспечивает их способность действовать в качестве селективных агонистов рецептора Mas. И наоборот, ожидается, что аналогичные соединения без этих характеристик будут более дифференцированно воздействовать на AT1R и/или AT2R в отсутствие значительного селективного агонистического действия в отношении рецептора Mas.
Эти связывающие фрагменты, которые препятствуют эффективному связыванию с AT1R и AT2R, но в то же время обеспечивают эффективное селективное связывание с рецептором Mas, не известны в данной области и обеспечивают существенное подтверждение структурной новизны предложенных примеров соединений, которую также отражают соответствующие приведенные в качестве примера данные о связывании и другие приведенные для примера в настоящем документе биологические данные.
Пример 2. Синтез примера - соединения 7 - (бутил(2-(5-((1H-имдазол-1-ил)метил)пиридин-2-ил)-4-(трифторметокси)фенил)сульфонилкарбамата).
В описанных ниже примерах синтеза авторы старались обеспечивать точность приводимых численных значений (например, обозначающих количества, температуру и т.д.), но следует учитывать некоторые экспериментальные ошибки и отклонения. Если не указано иное, части являются массовыми частями, значения молекулярной массы представляют собой среднюю молекулярную массу, температура приведена в градусах Цельсия, а давление равно атмосферному или близко к нему. Исходные материалы, используемые в этих примерах, обычно либо являются коммерчески доступными, либо могут быть легко получены из коммерчески доступных реагентов с использованием процедур, включающих один или более этапов.
Этап 1: Синтез 5-((1Н-имдазол-1-ил)метил)-2-бромпиридина. Исходный материал - 2-бром-5-(бромметил)пиридин синтезировали согласно опубликованному протоколу (Tetr. Lett. 2002, 43, 1697). К перемешиваемому раствору этого соединения (2 г, 8 ммоль) в 20 мл диметилформамида добавляли имидазол (537 мг, 8 ммоль, 1 экв.) и K2CO3 (3,32 г, 24 ммоль, 3 экв.) и перемешивали в течение ночи. Реакционную смесь концентрировали под вакуумом, Неочищенную смесь растворяли в EtOAc и 10 мл 10% лимонной кислоты и экстрагировали. Органические слои промывали водой, затем солевым раствором, сушили при помощи MgSO4, концентрировали под вакуумом и очищали автоматизированной хроматографией, в результате чего получали 1,35 г беловатого твердого вещества (71% выход, Rf=0,30 в 10% МеОН в ДХМ). 1Н-ЯМР (400 МГц, CDCN) δ 8,26 (d, J=2,4 Гц, 1H), 7,61 (s, 1H), 7,51 (d, J=8,2 Гц, 1H), 7,45 (dd, J=8,3, 2,5 Гц, 1H), 7,04 (s, 1H), 6,97 (s, 1H), 5,15 (s, 2H).
Этап 2: Синтез N-(трет-бутил)-4-(трифторметокси)бензол-сульфонамида. В круглодонную колбу объемом 500 мл, оборудованную мешалкой, добавляли 4-(трифторметокси)бензол-1-сульфонил хлорид (25 г, 95,9 ммоль) и 100 мл ТГФ и охлаждали колбу до 0°С. Трет-бутиламин (100 мл, 959 ммоль, 10 экв.) растворяли в 100 мл ТГФ в колбе Эрленмейера. Первые 50 мл раствора трет-бутиламина добавляли по каплям в раствор сульфонилхлорида, а остаток вливали непосредственно из колбы Эрленмейера. После перемешивания реакционной смеси в течение 2 часов в ледяной бане, баню удаляли и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали под вакуумом, в результате чего получали белое твердое вещество, которое растворяли в Н2О и EtOAc, помещали в делительную воронку и экстрагировали. Органические слои промывали водой, 10% водным раствором HCl, насыщенным раствором NaHCO3, солевым раствором, сушили при помощи MgSO4, фильтровали через вату и концентрировали под вакуумом, в результате чего получали 28,26 г (колич.) желтого масла, которое отверждали перемешиванием под вакуумом, в результате чего получали желтое кристаллическое твердое вещество. 1Н-ЯМР (400 МГц, CDCl3) δ 7,90 (d, J=8,8 Гц, 2Н), 7,23 (d, J=8,3 Гц, 2Н), 5,32 (s, 1H), 1,15 (s, 9H). 13С-ЯМР (101 МГц, CDCl3) δ 151,80 (q, J=1,8 Гц), 142,04, 129,12, 120,87 (d, J=1,0 Гц), 120,35 (q, J=259,1 Гц), 55,01, 30,15. 19F-ЯМР (376 МГц, CDCl3) δ -57,87.
Этап 3: Синтез (2-(N-(трет-бутил)сульфамоил)-5-(трифторметокси)фенил)бороновой кислоты. N-(трет-бутил)-4-(трифторметокси)бензолсульфонамид (28,26 г, 95 ммоль) помещали в круглодонную колбу объемом 500 мл, оборудованную мешалкой, и помещали под вакуум при перемешивании. Получали желтое твердое кристаллическое вещество, которое измельчали большой пробиркой для ЯМР и помещали в более высокий вакуум. В колбу через канюлю вводили 300 мл ТГФ Drisolv®. Выравнивали давление при помощи баллона с аргоном и охлаждали колбу до ~ -78°С в бане с сухим льдом и ацетоном. В колбу по каплям добавляли 2,5 М н-бутиллитий (114 мл, 285 ммоль, 3 экв.), не удаляя баню с ацетоном и льдом. Колбу быстро переносили в баню с ацетонитрилом и сухим льдом и перемешивали в течение 3,5 часов, (помещали реакционную смесь в сухой лед, а затем добавляли ацетонитрил). Реакционную смесь затем охлаждали до ~ -78°С в бане сухой лед-ацетонитрил и добавляли триизопропилборат (33 мл, 142,5 ммоль, 1,5 экв.), сначала медленно, а затем быстро. Реакционную смесь перемешивали в течение ночи, без добавления дополнительного льда. Колбу открывали и быстро добавляли 200 мл 2 н. HCl. Реакционную смесь экстрагировали, после чего водную фазу этилацетатом экстрагировали и объединяли с органическим слоем реакционной смеси, сушили при помощи MgSO4, фильтровали через вату и концентрировали под вакуумом, в результате чего получали 48,26 г сырого желтого масла, которое использовали на следующем этапе без дальнейшей очистки.
Этап 4: Синтез 2-(5-((1Н-имдазол-1-ил)метил)пиридин-2-ил)-N-(трет-бутил)-4-(трифторметокси)бензолсульфонамида. Бромид, полученный на этапе 1 (1,35 г, 5,6 ммоль), и бороновую кислоту, полученную на Этапе 3 (7,6 г, 22,4 ммоль, 4 экв.), объединяли в 200 мл круглодонной колбе. Добавляли в колбу Pd(PPh3)4 (1,3 г, 0,2 ммоль, 1,12) в атмосфере N2, помещали колбу под вакуум и добавляли 60 мл толуола, 10 мл EtOH и 33 мл 1М водного раствор NaOH. Реакционную смесь перемешивали при 85°С в течение ночи и концентрировали под вакуумом. Остаток растворяли в EtOAc, экстрагировали солевым раствором, органический слой сушили при помощи MgSO4, фильтровали через вату, концентрировали на целите (Celite®) и очищали автоматизированной хроматографией, в результате чего получали 670 мг (26% выход). 1Н-ЯМР (400 МГц, CD3OD) δ 8,61 (s, 1H), 8,25 (d, J=8,8 Гц, 1H), 7,81 (d, J=7,9 Гц, 1H), 7,68 (d, J=7,9 Гц, 1H), 7,56 (df, J=8,8, 2,4, 1,1 Гц, 1H), 7,45 (d, J=2,0 Гц, 1H), 5,42 (s, 2H), 1,22 (s, 9H). 13С-ЯМР (101 МГц, CD3OD) δ 156,32, 151,07, 147,22, 140,70, 140,47, 136,58, 132,95, 130,94, 124,91, 123,91, 120,29 (q, J=257,6 Гц), 120,15, 54,33, 28,92. 19F-ЯМР (376 МГц, CD3OD) δ -59,36. MC (ионизация электрораспылением): m/z=455,0 [М+Н]+.
Этап 5: Синтез 2-(5-((1Н-имдазол-1-ил)метил)пиридин-2-ил)-4-(трифторметокси)бензолсульфонамида. Продукт Этапа 4 (670 мг, 1,47 ммоль) нагревали с обратным холодильником в течение ночи в 3 мл трифторуксусной кислоты. Реакционную смесь охлаждали до комнатной температуры, нейтрализовали насыщенным раствором NaHCO3, экстрагировали этилацетатом, сушили при помощи MgSO4, фильтровали через вату, сушили на целите (Celite®) и очищали автоматизированной хроматографией с использованием градиента от 0% до 8% МеОН в ДХМ, в результате чего получали 271 мг целевого продукта (46% выход). 1Н-ЯМР (400 МГц, CD3OD) δ 8,59 (s, 1H), 8,25 (d, J=8,7 Гц, 1H), 7,85 (s, 1H), 7,79 (dd, J=8,0, 1,5 Гц, 1H), 7,62 (d, J=8,1 Гц, 1H), 7,54 (d, J=8,7 Гц, 1H), 7,47 (s, 1H), 7,23 (s, 1H), 7,06 (s, 1H), 5,37 (s, 2H). 13С-ЯМР (101 МГц, CD3OD) δ 157,93, 152,57, 152,55, 148,69, 141,91, 141,50, 138,13, 134,20, 131,89, 125,63, 125,14, 121,71 (q, J=515,7, 257,8 Гц), 121,66, 48,66. 19F-ЯМР (376 МГц, CD3OD) δ -59,28. MC (ионизация электрораспылением): m/z=399,0 [M+H]+.
Этап 6: Синтез бутил(2-(5-((1Н-имдазол-1-ил)метил)пиридин-2-ил)-4-(трифторметокси)фенил)сульфонилкарбамата. К перемешиваемому раствору продукта Этапа 5 (271 мг, 0,68 ммоль) и 4-(диметиламино)пиридина (91 мг, 0,75 ммоль, 1,1 экв.) в 10 мл пиридина добавляли бутилхлорформат (1,76 мл, 13,6 ммоль, 20 экв.). Реакционную смесь перемешивали при комнатной температуре в течение ночи и концентрировали под вакуумом. Остаток растворяли в 20 мл 10% лимонной кислоты и EtOAc. Органические слои экстрагировали три раза этилацетатом и сушили при помощи MgSO4, фильтровали через вату, концентрировали на целите (Celite®) и очищали автоматизированной хроматографией с использованием градиента от 0% до 20% МеОН в ДХМ, в результате чего получали 289 мг белой пены (58% выход). 1Н-ЯМР (400 МГц, CD3OD) δ 8,60 (s, 1H), 8,32 (d, J=8,8 Гц, 1H), 7,84 (d, J=7,4 Гц, 1H), 7,71 (d, J=8,0 Гц, 1H), 7,62-7,53 (m, 1H), 7,46 (s, 1H), 7,36 (d, J=1,6 Гц, 1H), 7,30 (s, 1H), 5,49 (s, 2H), 3,98 (t, J=6,5 Гц, 2H), 1,58-1,44 (m, 2H), 1,30 (dt, J=15,2, 7,3 Гц, 3H), 0,98-0,83 (m, 3Н). 19F-ЯМР (376 МГц, CDCl3) δ -55,37. MC (ионизация электрораспылением): m/z=499,0 [M+H]+.
Пример 3. Синтез примера - соединения 8 - (бутил(2-(5-((3-метил-2-оксоимдазолидин-1-ил)метил)пиридин-2-ил)-4-(трифторметокси)фенил)сульфонилкарбамата).
Этап 1: Синтез 5-((1Н-имдазол-1-ил)метил)-2-бромпиридина. Исходный материал - 2-бром-5-(бромметил)пиридин синтезировали в соответствии с опубликованным протоколом (Tetr. Lett. 2002, 43, 1697). В 50 мл круглодонную колбу, содержащую 1-метил-2-имдазолидинон (250 мг, 2,5 ммоль) и NaH - 60% дисперсию в минеральном масле (110 мг, 2,75 ммоль, 1,1 экв.), при 0°С добавляли 3 мл ДМФ Drisolv®. Реакционная смесь превращалась в мутное белое твердое вещество, затем ее нагревали до комнатной температуры и перемешивали в течение час. 2-бром-5-(бромметил)пиридин (750 мг, 1,2 ммоль, 3 экв.) растворяли в 1 мл ДМФ Drisolv® и перемешивали реакционную смесь в течение ночи при комнатной температуре. Реакционную смесь концентрировали под вакуумом, растворяли в EtOAc и насыщенном растворе NH4Cl и экстрагировали. Органические слои концентрировали под вакуумом, и очищали автоматизированной хроматографией, в результате чего получали 173 мг (26%) светло-коричневого масла Rf=0,15 в 75% EtOAc в гексанах/1% МеОН). 1Н-ЯМР (600 МГц, CD3OD) δ 8,26 (d, J=2,4 Гц, 1H), 7,62 (dd, J=8,2, 2,5 Гц, 1H), 7,56 (d, J=8,2 Гц, 1H), 4,33 (s, 2H), 3,36-3,31 (m, 2H), 3,28-3,23 (m, 2H), 2,77 (s, 3Н). 13С-ЯМР (151 МГц, CD3OD) δ 150,70, 141,72, 140,28, 134,46, 129,45, 45,97, 45,95, 43,46, 31,40.
Этап 2: Синтез N-(трет-бутил)-2-(5-((3-метил-2-оксоимдазолидин-1-ил)метил)пиридин-2-ил)-4-(трифторметокси)бензолсульфонамида. Бромид, полученный на Этапе 1 (173 мг, 0,64 ммоль), и бороновую кислоту, полученную на Этапе 2 Примера 2 (874 мг, 2,54 ммоль, 4 экв.), объединяли в круглодонной колбе. Добавляли в колбу Pd(PPh3)4 (462 мг, 0,4 ммоль, 0,63 экв.) в атмосфере N2, помещали колбу под вакуум и добавляли 20 мл толуола, 5 мл EtOH и 3,84 мл 1 н. водного раствора NaOH. Реакционную смесь перемешивали при 90°С в течение 2 дней, концентрировали под вакуумом, растворяли в EtOAc и Н2О и экстрагировали. Органические слои промывали солевым раствором, фильтровали через целит (Celite®), концентрировали на целите (Celite®) и очищали автоматизированной хроматографией, в результате чего получали 232 мг (75%) коричневого масла. Rf=0,25 в 80% EtOAc в гексанах с 1% МеОН). 1Н-ЯМР (400 МГц, CD3OD) δ 8,46 (d, J=2,4 Гц, 1Н), 8,12 (d, J=8,7 Гц, 1H), 7,74 (dd, J=8,2, 2,3 Гц, 1H), 7,53 (d, J=8,1 Гц, 1H), 7,46-7,37 (m, 1H), 7,33 (d, J=2,6 Гц, 1H), 4,34 (s, 2H), 3,33-3,13 (m, 4H), 2,69 (s, 3H), 1,09 (s, 9H). 19F-ЯМР (376 МГц, CD3OD) δ -59,16. MC (ионизация электрораспылением): m/z=487,0 [M+H]+.
Этап 3: Синтез 2-(5-((3-метил-2-оксоимдазолидин-1-ил)метил)-пиридин-2-ил)-4-(трифторметокси)бензолсульфонамида. Продукт Этапа 2 (232 мг, 0,47 ммоль) перемешивали в течение 2 дней при комнатной температуре в 10 мл трифторуксусной кислоты. Реакционную смесь нейтрализовали насыщенным раствором NaHCO3, экстрагировали этилацетатом, сушили и очищали автоматизированной хроматографией с градиентом от 0% до 2,8% МеОН в ДХМ, в результате чего получали 121,4 мг (60%) беловатого порошка. 1Н-ЯМР (400 МГц, CD3OD) δ 9,16 (d, J=2,2 Гц, 1H), 8,78 (d, J=8,7 Гц, 1H), 8,45 (dd, J=8,1, 2,2 Гц, 1H), 8,20 (dd, J=8,1, 0,9 Гц, 1H), 8,12 (ddd, J=8,8, 2,5, 1,2 Гц, 1H), 8,07 (d, J=2,5 Гц, 1H), 5,02 (s, 2H), 3,98-3,84 (m, 4H), 3,34 (s, 3Н). 19F-ЯМР (376 МГц, CD3OD) δ -57,66.
Этап 4: Синтез бутил((2-(5-((3-метил-2-оксоимдазолидин-1-ил)метил)пиридин-2-ил)-4-(трифторметокси)фенил)сульфонил)карбамата. Получали аналогично Этапу 6 Примера 2. 1Н-ЯМР (400 МГц, CD3OD) δ 8,43 (dd, J=2,3, 0,9 Гц, 1H), 8,23 (d, J=8,9 Гц, 1H), 7,73 (dd, J=8,0, 2,2 Гц, 1H), 7,54-7,44 (m, 2H), 7,30-7,24 (m, 1H), 4,37 (s, 2H), 3,92 (t, J=6,5 Гц, 2H), 3,33-3,23 (m, 4H), 2,72 (s, 3H), 1,48-1,37 (m, 2H), 1,26-1,15 (m, 2H), 0,80 (t, J=7,4 Гц, 3Н). 19F-ЯМР (376 МГц, CD3OD) δ -59,29. MC (ионизация электрораспылением): m/z=531,0 [M+H]+.
Пример 4. Синтез соединения 9 - (бутил(2-(5-(морфолинометил)пиридин-2-ил)-4-(трифторметокси)фенил)сульфонил-карбамата) и соединения 10 - (бутил(2-(5-((4-метилпиперазин-1-ил)метил)пиридин-2-ил)-4-(трифторметокси)фенил)сульфонилкарбамата)
Этап 1: Синтез N-(трет-бутил)-2-(5-метилпиридин-2-ил)-4-(трифторметокси)бензолсульфонамида. 2-бром-5-метилпиридин (1,23 мг, 7,15 ммоль) и бороновую кислоту, полученную на Этапе 2 Примера 2 (4,9 г, 14,3 ммоль, 2 экв.), объединяли в круглодонной колбе. Pd(PPh3)4 (1,65 г, 1,43 ммоль, 0,2 экв.) добавляли в колбу в атмосфере N2, помещали колбу под вакуум со 100 мл толуола, 20 мл EtOAc и 42 мл 1 н. водного раствора NaOH. Реакционную смесь перемешивали при 90°С в течение 2 дней, концентрировали под вакуумом, растворяли в EtOAc и H2O и экстрагировали. Органические слои промывали NaHCO3, сушили MgSO4, фильтровали, концентрировали на целите (Celite®) и очищали автоматизированной хроматографией с градиентом от 5% до 40% EtOAc в гексанах, в результате чего получали 3,027 г (Rf=0,3 в 20% EtOAc в гексанах). 1Н-ЯМР (400 МГц, CDCl3) δ 8,15 (dt, J=2,3, 0,8 Гц, 1Н), 7,95 (d, J=8,7 Гц, 1Н), 7,69-7,64 (m, 1H), 7,38 (ddd, J=8,0, 2,3, 0,9 Гц, 1Н), 7,12 (dd, J=8,0, 0,8 Гц, 1Н), 7,06 (ddd, J=8,7, 2,5, 1,2 Гц, 1Н), 2,08 (d, J=1,0 Гц, 3Н), 1,04 (s, 9Н). 19F-ЯМР (376 МГц, CDCl3) δ -57,76. МС (ионизация электрораспылением): m/z: [M+H]+ расч. 389,11; эксп. 389,0. MC (ионизация электрораспылением): m/z=389,0 [М+Н]+.
Этап 2: Синтез 2-(5-(бромметил)пиридин-2-ил)-N-(трет-бутил)-4-(трифторметокси)бензолсульфонамида. Раствор продукта Этапа 1 (3,027 г, 7,8 ммоль) и н-бромсукцинимида (1,526 г, 8,6 ммоль, 1,1 экв.) в 100 мл ДХМ и 100 мл Н2О перемешивали под воздействием УФ излучения при 80-90°С в круглодонной колбе, оборудованной обратным холодильником, в течение 48 часов. Реакционную смесь затем охлаждали до комнатной температуры, вливали в делительную воронку и экстрагировали. Органические слои сушили при помощи MgSO4, фильтровали через вату, концентрировали на целите (Celite®) и пропускали через колонку с силикагелем в процессе автоматической хроматографии с использованием градиента от 5% до 40% EtOAc в гексанах, в результате чего получали 517 мг сырой смеси, которую использовали на следующем этапе без дальнейшей очистки. МС (ионизация электрораспылением): m/z: 466,9 [М+Н]+.
Этап 3: Синтез N-(трет-бутил)-2-(5-(морфолинометил)пиридин-2-ил)-4-(трифторметокси)бензолсульфонамид. К перемешиваемому раствору Продукта Этапа 2 (186 мг, 0,4 ммоль) в 3 мл диметилформамида добавляли морфолин (0,104 мл, 1,19 ммоль, 3 экв.) и K2CO3 (329 мг, 2,39 ммоль, 6 экв.) и перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь концентрировали под вакуумом на целите и очищали автоматизированной хроматографией с градиентом от 0% до 100% EtOAc в гексанах, в результате чего получали 67 мг прозрачной пленки (35% выход, Rf=0,3 в-50% EtOAc в гексанах). 1Н-ЯМР (400 МГц, CD3OD) δ 8,63 (d, J=1,5 Гц, 1H), 8,27 (d, J=8,8 Гц, 1H), 7,97 (dd, J=8,1, 2,2 Гц, 1H), 7,67 (dd, J=8,0, 0,7 Гц, 1H), 7,56 (ddd, J=8,8, 2,5, 1,2 Гц, 1H), 7,47 (dd, J=2,4, 0,7 Гц, 1H), 3,78-3,70 (m, 4H), 3,66 (s, 2H), 2,59-2,50 (m, 4H), 1,25 (s, 9H). 19F-ЯМР (376 МГц, CD3OD) δ -59,27. MC (ионизация электрораспылением): m/z: 474,0 [M+H]+.
Этап 4: Синтез бутил((2-(5-(морфолинометил)пиридин-2-ил)-4-(трифторметокси)фенил)сульфонил)карбамата. Продукт Этапа 3 (67 мг, 0,14 ммоль) перемешивали в течение 2 дней при комнатной температуре в 10 мл трифторуксусной кислоты. Реакционную смесь перемешивали при комнатной температуре в течение 2 дней, концентрировали под вакуумом и растворяли в МеОН, концентрировали под вакуумом 3 раза. К полученному сырому продукту добавляли 4-(диметиламино)пиридин (48,8 мг, 0,4 ммоль, 2,85 экв.), бутил хлорформат (0,361 мл, 2,8 ммоль, 20 экв.) и 5 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение 2 дней и концентрировали под вакуумом. К остатку добавляли 300 мг лимонной кислоты, затем EtOAc и Н2О. Органические слои экстрагировали три раза этилацетатом и сушили при помощи MgSO4, фильтровали через вату, концентрировали на целите (Celite®) и очищали автоматизированной хроматографией, в результате чего получали 44,5 мг чистого продукта (61% выход). 1Н-ЯМР (400 МГц, CD3OD) δ 8,57 (s, 1H), 8,31 (d, J=8,8 Гц, 1H), 7,90 (d, J=7,8 Гц, 1H), 7,75 (d, J=8,0 Гц, 1H), 7,59-7,48 (m, 1H), 7,34 (d, J=2,6 Гц, 1H), 3,92 (t, J=6,5 Гц, 2H), 3,81-3,71 (m, 4H), 2,71-2,61 (m, 4H), 1,51 (dd, J=8,9, 5,8 Гц, 2H), 1,32 (dt, J=11,3, 3,7 Гц, 2H), 0,91 (t, J=7,3 Гц, 3Н). 19F-ЯМР (376 МГц, CD3OD) δ -59,27. MC (ионизация электрораспылением): m/z: 518,0 [M+H]+.
Этап 5: Синтез N-(трет-бутил)-2-(5-((4-метилпиперазин-1-ил)метил)пиридин-2-ил)-4-(трифторметокси)бензолсульфонамида. К перемешиваемому раствору Продукта Этапа 2 (136 мг, 0,29 ммоль) в 3 мл диметилформамида добавляли 1-метилпиперазин (98,6 мкл, 0,87 ммоль, 3 экв.) и K2CO3 (240 мг, 1,74 ммоль, 6 экв.) и перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь концентрировали под вакуумом на целите и очищали автоматизированной хроматографией с использованием градиента от 0% до 20% МеОН в ДХМ, в результате чего получали 41 мг прозрачной пленки (29% выход, Rf=0,2 в 10% МеОН в ДХМ). 1Н-ЯМР (400 МГц, CD3OD) δ 8,61 (d, J=1,6 Гц, 1H), 8,26 (d, J=8,8 Гц, 1H), 7,95 (dd, J=8,1, 2,2 Гц, 1H), 7,66 (dd, J=8,1, 0,6 Гц, 1H), 7,56 (ddd, J=8,8, 2,5, 1,2 Гц, 1H), 7,46 (d, J=1,8 Гц, 1H), 3,68 (s, 2H), 2,58 (s, 8H), 2,34 (s, 3H), 1,24 (s, 9H). 19F-ЯМР (376 МГц, CD3OD) δ -59,32. MC (ионизация электрораспылением): m/z: 487,2 [M+H]+.
Этап 6: Синтез бутил((2-(5-((4-метилпиперазин-1-ил)метил)пиридин-2-ил)-4-(трифторметокси)фенил)сульфонил)карбамата. Продукт Этапа 6 (41 мг, 0,07 ммоль) перемешивали в течение 2 дней при комнатной температуре в 4,5 мл трифторуксусной кислоты. Реакционную смесь перемешивали при комнатной температуре в течение 2 дней, концентрировали под вакуумом и растворяли в МеОН, концентрировали под вакуумом 2 раза. К полученному сырому продукту добавляли 4-(диметиламино)пиридин (9 мг, 0,14 ммоль, 1 экв.), бутилхлорформат (0,191 мл, 1,48 ммоль, 20 экв.) и пиридин. Реакционную смесь перемешивали при комнатной температуре в течение 2 дней и концентрировали под вакуумом. К остатку добавляли 300 мг лимонной кислоты, затем EtOAc и Н2О. Органические слои экстрагировали три раза этилацетатом и сушили при помощи MgSO4, фильтровали через вату, концентрировали на целите (Celite®) и очищали автоматизированной хроматографией, в результате чего получали 44 мг беловатой пленки (колич., Rf=0,1 в 20% МеОН в ДХМ). 1Н-ЯМР (400 МГц, CD3OD) δ 8,58 (s, 1H), 8,27 (d, J=8,8 Гц, 1H), 7,91 (s, 1H), 7,63-7,49 (m, 2H), 7,33 (d, J=3,1 Гц, 1H), 3,97 (t, J=6,4 Гц, 2H), 3,75 (s, 2H), 2,81 (p, J=15,8, 15,2 Гц, 19H), 1,47 (q, J=6,9 Гц, 2H), 1,27 (dq, J=14,8, 7,5, 6,8 Гц, 4H), 0,85 (t, J=7,3 Гц, 3Н). 19F-ЯМР (376 МГц, CD3OD) δ -59,25. MC (ионизация электрораспылением): m/z: 531,1 [М+Н]+.
Пример 5. Синтез примера - соединения 11 (бутил(2-(5-((1H-имдазол-1-ил)метил)тиазол-2-ил)-4-(трифторметокси)фенил)сульфонилкарбамата).
Этап 1: Синтез 2-бром-5-(бромметил)тиазола. Раствор 2-бром-5-метилтиазола (1 г, 5,6 ммоль) а н-бромсукцинимида (1,1 г, 6,18 ммоль, 1,1 экв.) в 40 мл ДХМ и 40 мл Н2О перемешивали, под воздействием УФ излучения при 90°С в круглодонной колбе, оборудованной обратным холодильником, в течение 3 часов. Реакционную смесь затем охлаждали до комнатной температуры, вливали в делительную воронку и экстрагировали. Водный слой экстрагировали еще два раза дихлорметаном, объединяли органические слои, сушили при помощи MgSO4, фильтровали через вату, концентрировали и очищали автоматизированной хроматографией с использованием градиента от 0% до 3% EtOAc в гексанах, в результате чего получали 1,24 г (78%). 1Н-ЯМР (400 МГц, CDCl3) δ 7,46 (d, J=0,9 Гц, 1H), 4,57 (d, J=0,9 Гц, 3Н). 13С-ЯМР (101 МГц, CDCl3) δ 141,92, 139,80, 137,39, 22,37. MC (ионизация электрораспылением): m/z: 255,8 [М+Н]+.
Этап 2: Синтез 5-((1Н-имдазол-1-ил)метил)-2-бромтиазола. К перемешиваемому раствору Продукта Этапа 1 (765 мг, 2,98 ммоль) в 20 мл ДМСО добавляли имидазол (202 мг, 2,98 ммоль, 1 экв.) и K2CO3 (1,23 г, 8,94 ммоль, 3 экв.) и перемешивали в течение ночи. Реакционную смесь экстрагировали солевым раствором и EtOAc и концентрировали под вакуумом и очищали автоматизированной хроматографией, в результате чего получали 306,6 мг (42%) целевого продукта. МС (ионизация электрораспылением): m/z: 243,9 [М+Н]+.
Этап 3: Синтез 2-(5-((1Н-имдазол-1-ил)метил)тиазол-2-ил)-N-(трет-бутил)-4-(трифторметокси)бензолсульфонамида. Бромид, полученный на Этапе 2 (306,6 мг, 1,26 ммоль), и бороновую кислоту, полученную на Этапе 2 Примера 2 (1,29 г, 3,78 ммоль, 3 экв.), объединяли в круглодонной колбе. Pd(PPh3)4 (290 мг, 0,25 ммоль, 0,2 экв.) добавляли в колбу в атмосфере N2, помещали колбу под вакуумом с 10 мл толуола, 3 мл EtOH и 1,26 мл 2М водного раствора Na2CO3. Реакционную смесь перемешивали при 90°С в течение 2 дней, фильтровали через целит®, концентрировали на целите (Celite®) и очищали автоматизированной хроматографией, в результате чего получали 157 мг коричневого масла (27% выход, Rf=0,30 в 5% МеОН в ДХМ).
Этап 4: Синтез 2-(5-((1Н-имдазол-1-ил)метил)тиазол-2-ил)-4-(трифторметокси)бензолсульфонамида. Продукт Этапа 3 (157 мг, 0,34 ммоль) перемешивали в течение 2 дней при комнатной температуре в 10 мл трифторуксусной кислоты. Реакционную смесь нейтрализовали насыщенным раствором NaHCO3, экстрагировали этилацетатом, сушили на целите (Celite®) и очищали автоматизированной хроматографией с использованием градиента от 0% до 10% МеОН в ДХМ, в результате чего получали 107 мг беловатого порошка (78% выход). МС (ионизация электрораспылением): m/z: 404,9 [М+Н]+.
Этап 5: Синтез бутил((2-(5-((1Н-имдазол-1-ил)метил)тиазол-2-ил)-4-(трифторметокси)фенил)сульфонил)карбамата. К перемешиваемому раствору продукта Этапа 4 (64,6 мг, 0,16 ммоль) и 4-(диметиламино)пиридина (19,5 мг, 0,16 ммоль, 1 экв.) в 3 мл пиридина добавляли бутилхлорформат (0,407 мл, 3,2 ммоль, 20 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 2 дней и концентрировали под вакуумом. К остатку добавляли 300 мг лимонной кислоты, затем EtOAc и Н2О. Органические слои экстрагировали три раза этилацетатом и сушили при помощи MgSO4, фильтровали через вату, концентрировали на целите (Celite®) и очищали автоматизированной хроматографией с использованием градиента от 0% до 20% МеОН в ДХМ, в результате чего получали 40,7 мг (50% выход). 1H-ЯМР (600 МГц, CD3OD) δ 8,46 (s, 1H), 8,22 (d, J=8,8 Гц, 1H), 7,87 (s, 1H), 7,56-7,34 (m, 3H), 7,26 (s, 1H), 5,61 (s, 2H), 3,84 (t, J=6,5 Гц, 2H), 1,46-1,32 (m, 2H), 1,25-1,09 (m, 2H), 0,76 (t, J=7,4 Гц, 3Н). 19F-ЯМР (564 МГц, CD3OD) δ -59,35. MC (ионизация электрораспылением): m/z=504,9 [M+H]+ MC (ионизация электрораспылением): m/z: 505,0 [M+H]+.
Пример 6. Неспособность соединения-примера 7 конкурировать с Ang II за рецепторы ангиотензина AT1R и AT2R.
Исследовали способность соединения 7 конкурировать in vitro с радиомеченым Ang II или его аналогами в анализе вытеснения за рецепторы AT1R и AT2R. Результаты показали, что соединение 7 обладало очень слабой активностью в отношении рецептора ATI, вытесняя Ang II с ЕС50 выше 10 мкМ, что указывает на то, что соединение 7 не является эффективным агонистом или антагонистом AT1R. В том же анализе с AT1R, соединение, аналогичное 7, в котором пиридиновое кольцо заменено бензольным кольцом, обладало близкой активностью, вытесняя Ang II с ЕС50 выше 10 мкМ. В анализе вытеснения с AT2R соединение 7 вытесняло Ang II с ЕС50 выше 10 мкМ, что указывает на то, что оно не является эффективным агонистом AT2R. В том же тесте AT2R соединение, аналогичное 7, в котором пиридиновое кольцо заменено бензольным кольцом было способно замещать Ang II с ЕС50 ниже 0,5 мкМ.
Эти результаты указывают на присущую соединению-примеру 7 селективность, а также на то, что соединение 7 в концентрациях ниже молекулярных не связывается эффективно ни с AT1R, ни с AT2R и, соответственно, не является эффективным агонистом или антагонистом этих рецепторов. Эти результаты указывают также на то, что общая структура соединения-примера 7 не позволяет соединениям этого типа эффективно связываться с AT1R, в то время как присутствие основного азота в середине ароматического кольца (например, пиридина) значительно снижает способность этого соединения связываться с AT2R.
Пример 7. Активность соединений-примеров 7, 8, 9, 10 и 11 в анализе конкурентного связывания с вытеснением флуоресцентного Ang(1-7).
Клетки СНО, стабильно трансфецированные рекомбинантным человеческим протоонкогеном mas1 с использованием человеческого цитомегаловируса в качестве носителя, выращивали до 80% конфлюентности. Клетки открепляли трипсином и собирали путем центрифугирования. Клетки промывали три раза в буфере постепенно уменьшающейся температуры. Конечное число клеток на анализ составляло 5×105. Все последующие этапы осуществляли на льду. Исследуемое соединение добавляли к клеткам в течение 10 минут до добавления флюоресцентно меченного А(1-7). Через 10 минут дополнительной инкубации клетки промывали для удаления несвязанного А(1-7) и регистрировали флюоресценцию при длине возбуждения 490 нм и длине испускания 520 нм.
В этом анализе связывания соединения-примеры 7, 8, 9, 10 и 11 продемонстрировали способность вытеснять флуоресцентный Ang(1-7) следующим образом:

Эти результаты указывают на то, что соединения-примеры 7, 8, 9, 10 и 11 способны эффективно вытеснять Ang(1-7) с рецептора Mas с различной эффективностью, что позволяет предположить, что предложенные соединения ведут себя как миметики Ang(1-7), способные связываться на рецепторе Mas. Совместно результаты, полученные для Примеров 6 и 7, указывают на то, что предложенные соединения способны селективно связываться с рецептором Ang(1-7), но не с рецепторами Ang II, т.е. AT1R или AT2R.
Пример 8. Активность соединения-примера 7 в отношении рецетора Mas.
Трансфецированные клетки, которые экспрессируют Mas, использовали для идентификации и оценки в качестве агонистов Mas соединений согласно настоящему изобретению, по стимуляции продукции NO в качестве измеряемого параметра. Клетки СНО, стабильно трансфецированные вектором pTEJ-8, содержащим рекомбинантный клон человеческого Masl, выращивали до непрерывного слоя. Клетки промывали три раза в течение 30/5/5 минут предварительно нагретой солевой смесью (37°С) Tyrodes (дополненной 1 г/л NaHCO3 и 1,9 г/л d-глюкозы). Клетки инкубировали в течение короткого периода времени в 700 мкл солевой смеси Tyrodes с добавками, содержащей 10 мкМ PTIO, 100 мкМ DAN и 1 мМ L-аргинина. При использовании антагонистов для конкурентных анализов клетки обрабатывали ингибитором в концентрации 1×10-7 М в течение 15 минут, после чего добавляли дополнительное лекарственное средство.
Тестируемые химические соединения (от 10-8 до 10-6 М или максимальная экспериментально определенная концентрация, не вызывающая токсичности) добавляли к клеточной среде и встряхивали планшеты в течение 1 минуты, а затем помещали в инкубатор на 2 часа. Через 2 часа супернатанты клеток переносили в непрозрачные 96-луночные планшеты и регистрировали интенсивность флюоресценции при длинах волн возб./исп. 380/425.
Было обнаружено, что соединение 7 является эффективным селективным ингибитором Mas, причем было показано, что его способность усиливать образование NO близка к способности А(1-7) (Фигура 4). Определенная в этом анализе ЕС50 составляла 10 нМ; Подтверждая то, что 7 являются селективным агонистом Mas, совместное введение А779, селективного антагониста Mas, снижало образование NO до начального уровня.
Пример 9. Активность соединения-примера 7 снижает уровень глюкозы в крови при диабете.
У мышей, гомозиготных по связанной с диабетом синхронной мутации Leprdb (BKS.Cg-Dock7m+/+Leprdb/J), которые представляют собой модель ожирения для диабета 2 типа вследствие укорочения рецептора лептина, перед началом лечения были подтверждены уровни глюкозы в плазме крови >500 мг/дл. Пища и вода были в неограниченном доступе, и всех мышей держали при 12-часовом цикле свет/темнота. Мышам BKS.Cg-Dock7m+/+Leprdb/J и соответствующим гетерозиготным контролям (n=6/группы) вводили физиологический раствор (контроль), Ang-(1-7) (500 мкг/кг/день) или Соединение 7, в дозе 500 мкг/кг/день в течение двух недель путем подкожных инъекций (SC). Мышам не давали пиши в течение ночи перед оценкой уровней глюкозы в плазме. Брали кровь из подкожной вены и определяли в ней глюкометром уровень глюкозы.
На этой модели было выявлено, что в группе, получавшей соединение 7, уровни глюкозы крови натощак (FBG, ГКН), измеренные в конце исследования, были значительно ниже (р<0,05), чем у мышей db/db, которые получали физиологический раствор (Фигура 5). Уровни глюкозы у мышей, получавших соединение 7, были статистически значимо ниже, чем у контролей db/db или db/db, которые получали Ang(1-7). Соединение 7 снижало глюкозу периферической крови >40% относительно уровней, определенных у мышей, которые получали нейтральную среду или А(1-7). В терминах избыточной глюкозы крови относительно контролей без диабета Соединение 7 проявило способность снижать ГКН на 72%.
Пример 10: Активность соединения-примера 7, в отношении предотвращения органомегалии при диабете и метаболическом синдроме.
Мышей db/db, получавших соединение 7 (500 мкг/кг/день) или Ang(1-7) (500 мкг/кг/день), подвергали эвтаназии после 14 дней лечения. При некропсии собирали органы для гистологического анализа и взвешивали их. На Фигурах 6А-6С сердца, левую и правую почки, нормированные по длине большеберцовой кости, взвешивали, при этом значения для db/db, получавших соединение 7, были ниже, чем контроли db/db (физиологический раствор) и db/db, которые получали Ang(1-7). В этой модели соединение 7 предотвращало развитие каридиомегалии (А) и гипертрофии левой почки (В), причем отличие от контролей db/db было статистически значимым (р<0,05).
Пример 11: Активность соединения-примера 7 может предотвращать накопление жира у мышей с диабетом.
Экспериментально оценивали уровни липидов в печени животных db/db, которых в течение 14 дней лечили с использованием нейтрального носителя, 500 мкг/кг/день Ang(1-7) или Соединения 7. Собирали печени, выделенные из мышей. Срезы ткани печени промывали холодным физиологическим раствором и замораживали в присутствии состава для оптимизации температурного резания (ОСТ). Затем ткани резали на срезы толщиной 10 мкм с использованием криостата. Окрашивание красителем Oil Red О и Н&Е осуществляли в соответствии с описанными с опубликованными процедурами (Yang et al., 2013). Ткани осматривали и получали изображения и использованием светового микроскопа (Olympus ВХ51) (Фигура 6). Соединение 7 (Фигура 6, правая панель) уменьшало окрашивание Oil Red (красные капельки указывают на отложения жира) по сравнению с контролями db/db (Фигура 6, левая панель).
Пример 12: Активность соединения-примера 7 способна усиливать пролиферацию клеток-предшественников костного мозга.
Брали бедренные и большеберцовые кости мышей db/db, которым подкожно вводили 500 мкг/кг/день Ang(1-7) или Соединения 7 в течение 14 дней, и собирали костный мозг путем промывания раствором фосфатного буфера, содержащим 2% фетальной бычьей сыворотки. После сбора костного мозга эритроциты лизируют гипотоническим раствором (как описано выше), смешивают с 0,04% трипанового синего и оценивают количество клеток в условиях световой микроскопии при помощи гематоцитометра. Аликвоты клеток ресуспендировали в концентрации 1×106 клеток/мл (GM (гранулоциты-макрофаги) и GEMM (гранулоциты, эритроциты, моноциты и мегакариоциты), костный мозг), 1,5×106 клеток/мл (BFU-E, костный мозг). Сто мкл каждой суспензии добавляли в 900 мкл полутвердой среды, содержащей 0,9% метилцеллюлозы в среде MDM в модификации Искова, 15% фетальной бычьей сыворотки, 1% бычьего сывороточного альбумина, 10 мкг/мл инсулина бычьей поджелудочной железы, 200 мкг/мл человеческого трансферрина, 10-4 М 2-меркаптоэтанола, 2 мм глютамина, 10 нг/мл рекомбинантного мышиного интерлейкина 3, 10 нг/мл рекомбинантного человеческого интерлейкина 6, 50 нг/мл рекомбинантного мышиного фактора стволовых клеток 3 единицы/мл эритропоэтина. Затем смесь в дупликатах добавляли в лунки 24-луночного планшета. Затем культуры помещали в увлажненную атмосферу, содержащую 5% СО2 в воздухе, при 37°С. В день 14 при помощи фазово-контрастной микроскопии подсчитывали число колоний предшественников.
Также культивировали клетки костного мозга для определения количеств мезенхимальных стволовых клеток в анализе колониеобразующих единиц фибробластов (CFU-F, KOE-F). 2,5×105 клеток/мл, 2 мл на лунку, разбавляли в среде Mesencult (Stem Cell Technologies, Vancouver, ВС, Канада), и 2 мл помещали в каждую лунку 24-луночного планшета. Затем культуры ингибировали при 37°С в увлажненной атмосфере, содержащей 5% СО2 в воздухе. В дни 2, 5 и 8 при помощи фазово-контрастной микроскопии подсчитывали число образующихся колоний предшественников.
Диабет вызывает ухудшение состояния костного мозга, который является источником ряда предшественников, участвующих в процессах заживления, в частности, клеток крови (эритроцитов, тромбоцитов и лейкоцитов). Лечение с использованием как Ang(1-7), так и соединения 7 повышало количественные показатели содержания клеток в костном мозге. Соединение 7 обеспечивало сравнимое с Ang(1-7) повышение количественных показателей клеток костного мозга, а также ранних предшественников (CFU-GEMM - колониеобразующие единицы, в которых образуются гранулоциты, эритроциты, моноциты и мегакариоциты), миелоидных предшественников (CFU-GM - колониеобразующие единицы гранулоцитов-макрофагов), эритроидных предшественников (BFU-E - эритроидные «взрывообразующие единицы») и мезенхимальных стволовых клеток (MSC, МСК) (Фигура 8).
Пример 13. Активность соединения-примера 7 в исследованиях противоопухолевой активности: Оценивали способность соединения 7 модулировать пролиферацию раковой опухоли на линии клеток рака молочной железы MDA MB 231. Клетки MDA MB 231 обрабатывали увеличивающимися концентрациями соединения 7 в диапазоне от 1×10-12 до 1×10-3 М, с которыми клетки инкубировали в течение 48 часов. После инкубации исследовали жизнеспособность клеток с использованием 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида или МТТ, причем жизнеспособные клетки способны восстанавливать МТТ до формазана и образовывать нерастворимый кристалл. Солюбилизированные кристаллы можно исследовать спектрофотометрическими методами, что позволяет сравнивать жизнеспособность клеток с клетками, обработанными нейтральным носителем. Приведены собранные данные жизнеспособности клеток MDA MB 231 (Фигура 9). Добавление соединения 7, потенциального агониста Mas, не увеличивало пролиферацию клеток рака молочной железы и, соответственно, не повышало пролиферацию в опухоли. Напротив, при 1×10-12 М (1 пмоль) соединения 7 пролиферация клеток составляла лишь 70% от клеток, обработанных нейтральной средой. Кроме того, жизнеспособность MDA MB 231 снижалась в зависимости от концентрации, причем определенная с использованием анализа нуклона IC50 составляла 5,82×10-8 М (58 мкМ).
Пример 14. Исследовали биодоступность соединения 7 при пероральном введении в концентрации 500 мкг/кг у мышей C57B1/6. Лекарственное средство давали путем внутривенной инъекции или путем зондового введения через рот и собирали кровь через 0,5, 1, 2, 4, 8, 24 часов в гепаринизированные пробирки. Уровень лекарственного средства в крови измеряли жидкостной хроматогрфией-масс-спектрометрией. Биодоступность определяли по следующему отношению AUCIG/AUCIV (Отношение площадей под кривыми для зондового и внутривенного введений, Фигура 10). Эти фрамакокинетические исследования показали, что биодоступность соединения 7 составляет 30% после зондового введения через рот и что могут быть получены составы с дополнительно повышенной биодоступностью.
Пример 15. Исследовали острую токсичность соединения 7 в концентрации 500 мкг/кг у мышей C57B1/6, которым делали подкожные или внутривенные инъекции, и исследовали его безопасность в течение 7 дней после введения. В этом исследовании по определению диапазона не было явных признаков токсичности или изменений в массе органов или гематологических показателях.
ЦИТИРУЕМЫЕ ИСТОЧНИКИ
Albrecht, D. (2007). Angiotensin-(1-7)-induced plasticity changes in the lateral amygdala are mediated by COX-2 and NO. Learning & Memory, 14(3), 177-184.
Balingit PP, Armstrong DG, Reyzelman AM, Bolton L, Verco SJ, Rodgers KE, Nigh KA, diZerega GS. NorLeu3-A(1-7) stimulation of diabetic foot ulcer healing: results of a randomized, parallel-group, double-blind, placebo-controlled phase 2 clinical trial. Wound Repair Regen. 2012 Jul-Aug; 20(4):482-90. doi: 10, 1111
Benter IF, Yousif MH, Anim JT, Cojocel C, Diz DI (2006) Angiotensin-(1-7) prevents development of severe hypertension and end-organ damage in spontaneously hypertensive rats treated with L-NAME. Am J Physiol Heart Circ Physiol 290(2):H684-H691.
Benter IF, Yousif MH, Cojocel C, AL-Maghrebi M, Diz DI (2007) Angiotensin-(1-7) prevents диабет-induced cardiovascular dysfunction. Am J Physiol Heart Circ Physiol 292(1):H666-672.
Dias-Peixoto MF, Santos RAS, Gomes ERM,. Alves MNM, Almeida PWM, Greco L, Rosa M, Fauler B, Michael Bader, Alenina N, Guatimosim S. Molecular Mechanisms Involved in the Angiotensin-(1-7)/Mas Signaling Pathway in Cardiomyocytes. Hypertension. 2008; 52: 542-548
Dhaunsi, G.S., Yousif, M.H., Akhtar, S., Chappell, M.C, Diz, D.I., & Benter, I.F. (2010). Angiotensin-(1-7) prevents диабет-induced attenuation in PPAR-γ and catalase activities. European journal of pharmacology, 638(1), 108-114.
Ebermann L, Spillmann F, Sidiropoulos M, Escher F, Heringer-Walther S, Schultheiss HP, Tschope C, Walther T (2008) The angiotensin-(1-7) receptor agonist AVE0991 is cardioprotective in diabetic rats. Eur J Pharmacol 590(1-3):276-280.
Kosugi, Т., Heinig, M., Nakayama, Т., Matsuo, S., & Nakagawa, T. (2010). eNOS knockout mice with advanced diabetic nephropathy have less benefit from renin-angiotensin blockade than from aldosterone receptor antagonists. The American journal of pathology, 176(2), 619-629.
Langeveld, B., A.J. Roks, and R.A. Tio. et al. Rat abdominal aorta stenting: a new and reliable small animal model for in-stent restenosis. J Vase Res 2004. 41:377-386
Loot AE, Roks AJ, Henning RH, Tio RA, Suurmeijer AJ, Boomsma F, van Gilst WH (2002) Angiotensin-(1-7) attenuates the development of heart failure after myocardial infarction in rats Circulation 105(13): 1548-1550.
Marcus, Y., et al., Angiotensin 1-7 as Means to Prevent the Метаболический синдром: Lessons From the Fructose-Fed Rat Model. Диабет, 2013. 62(4): p. 1121-1130.
Pham H, Schwartz BM, Delmore JE, Reed E, Cruickshank S, Drummond L, Rodgers KE, Peterson KJ, Dizerega GS. Pharmacodynamic stimulation of thrombogenesis by angiotensin (1-7) in recurrent рак яичников patients receiving gemcitabine and platinum-based chemotherapy. Cancer Chemother Pharmacol. 2013 Apr; 71(4):965-72.
Ribeiro-Oliveira A, Nogueira AI, Pereira RM, Boas WW, Dos Santos RA, Simoes e Silva AC (2008) The renin-angiotensin system and diabetes: an update. Vase Health Risk Manag 4(4):787-803.
Rodgers KE, Oliver J, diZerega GS. Phase I/II dose escalation study of angiotensin 1-7 [A(1-7)] administered before and after chemotherapy in patients with newly diagnosed breast cancer. Cancer Chemother Pharmacol. 2006 May; 57(5):559-68.
Rodgers KE, Xiong S, diZerega GS. Accelerated recovery from irradiation injury by angiotensin peptides. Cancer Chemother Pharmacol. 2002 May; 49(5):403-11.
Santos RA, Simoes e Silva AC, Marie C, Silva DM, Machado RP, de Buhr I, Heringer-Walther S, Pinheiro SV, Lopes MT, Bader M, Mendes EP, Lemos VS, Campagnole-Santos MJ, Schultheiss HP, Speth R, Walther T (2003) Angiotensin-(1-7) is an endogenous ligand for the G protein-coupled receptor Mas Proc Natl Acad Sci USA 100(14):8258-8263.
Santos, R.A.S., and Ferreira, A.J. (2006). Pharmacological Effects of AVE 0991, a Nonpeptide Angiotensin-(1-7) Receptor Agonist. Cardiovascular Drug Reviews, 24(3-4), 239-246.
Santos, S.H.S., Braga, J.F., Mario,  ,
, 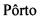 , L.C.J., da
, L.C.J., da  Rodrigues-Machado, M., Murari, A., & Santos, R.A.S. (2010). Improved lipid and glucose metabolism in transgenic rats with increased circulating angiotensin-(1-7). Arteriosclerosis, thrombosis, and vascular biology, 30(5), 953-961.
Rodrigues-Machado, M., Murari, A., & Santos, R.A.S. (2010). Improved lipid and glucose metabolism in transgenic rats with increased circulating angiotensin-(1-7). Arteriosclerosis, thrombosis, and vascular biology, 30(5), 953-961.
Singh K, Singh T, Sharma PL (2011) Beneficial effects of angiotensin-(1-7) in diabetic rats with cardiomyopathy. Ther Adv Cardiovasc Dis 5(3):159-167.
Steckelings, U.M., Larhed, M., Hallberg, A., Widdop, R.E., Jones, E.S., Wallinder, C., Namsolleck, P.,  , В., and Unger, T. (2011). Non-peptide AT2-receptor agonists. Curr Opin Pharmacol, 11(2), 187-192.
, В., and Unger, T. (2011). Non-peptide AT2-receptor agonists. Curr Opin Pharmacol, 11(2), 187-192.
Zhang, Т., Li, Z., Dang, H., Chen, R., Liaw, C., Iran, T.-A., Boatman, P.D., Connolly, D.Т., and Adams, J.W. (2012). Inhibition of Mas G-protein signaling improves coronary blood flow, reduces myocardial infarct size, and provides long-term cardioprotection. American Journal of Physiology -Heart and Circulatory Physiology, 302(1), H299-H311.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ТИЕНО[3,2-D]ПИРИМИДИН-4-ОНА | 2019 |
|
RU2768828C1 |
| НОВЫЕ ПРОИЗВОДНЫЕ 3,5-ДИЗАМЕЩЕННОГО ПИРИДИНА И 3,5-ДИЗАМЕЩЕННОГО ПИРИДАЗИНА И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2799544C2 |
| ИНГИБИТОРЫ α-АМИНО-β-КАРБОКСИМУКОНАТ-ε-СЕМИАЛЬДЕГИД-ДЕКАРБОКСИЛАЗЫ | 2015 |
|
RU2746405C2 |
| ТРИПЕПТИДНОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2015 |
|
RU2685709C2 |
| ИНГИБИТОРЫ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ (MMP) И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2820540C2 |
| ИНГИБИТОРЫ ДЕКАРБОКСИЛАЗЫ ПОЛУАЛЬДЕГИДА α-АМИНО-β-КАРБОКСИМУКОНОВОЙ КИСЛОТЫ | 2019 |
|
RU2841136C2 |
| АГОНИСТЫ РЕЦЕПТОРА АПЕЛИНА (APJ) И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2705800C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ МОДУЛЯЦИИ АКТИВНОСТИ АТ2R | 2015 |
|
RU2721241C2 |
| СПОСОБ ПРЕДОТВРАЩЕНИЯ И ЛЕЧЕНИЯ БОЛЕЗНИ ПЕЧЕНИ С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ РЕЦЕПТОРА АДЕНОЗИНА A | 2007 |
|
RU2457842C2 |
| СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ ПРОТЕИНКИНАЗ | 2012 |
|
RU2612972C2 |


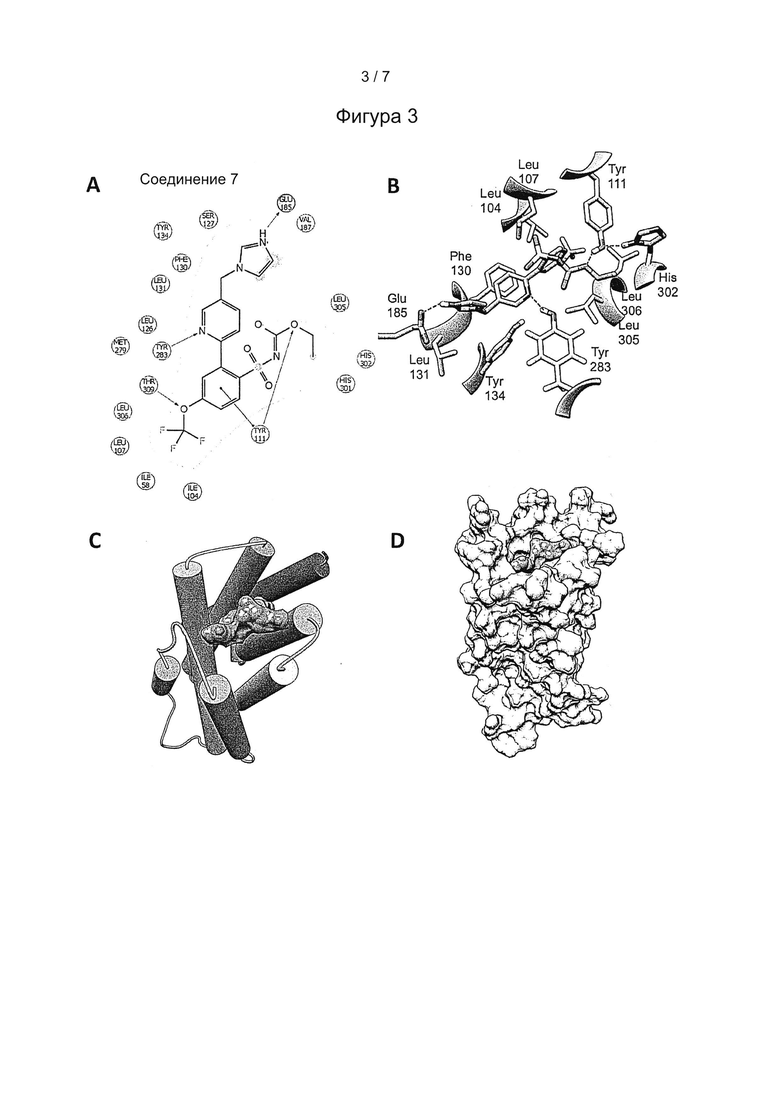
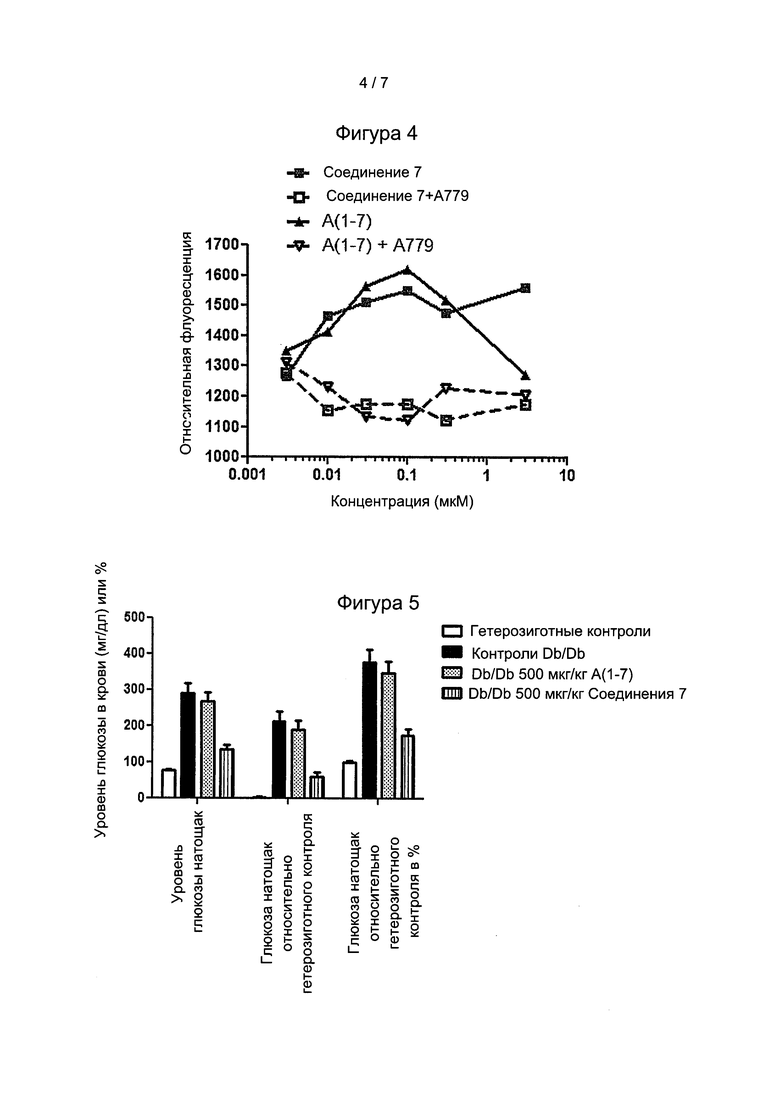

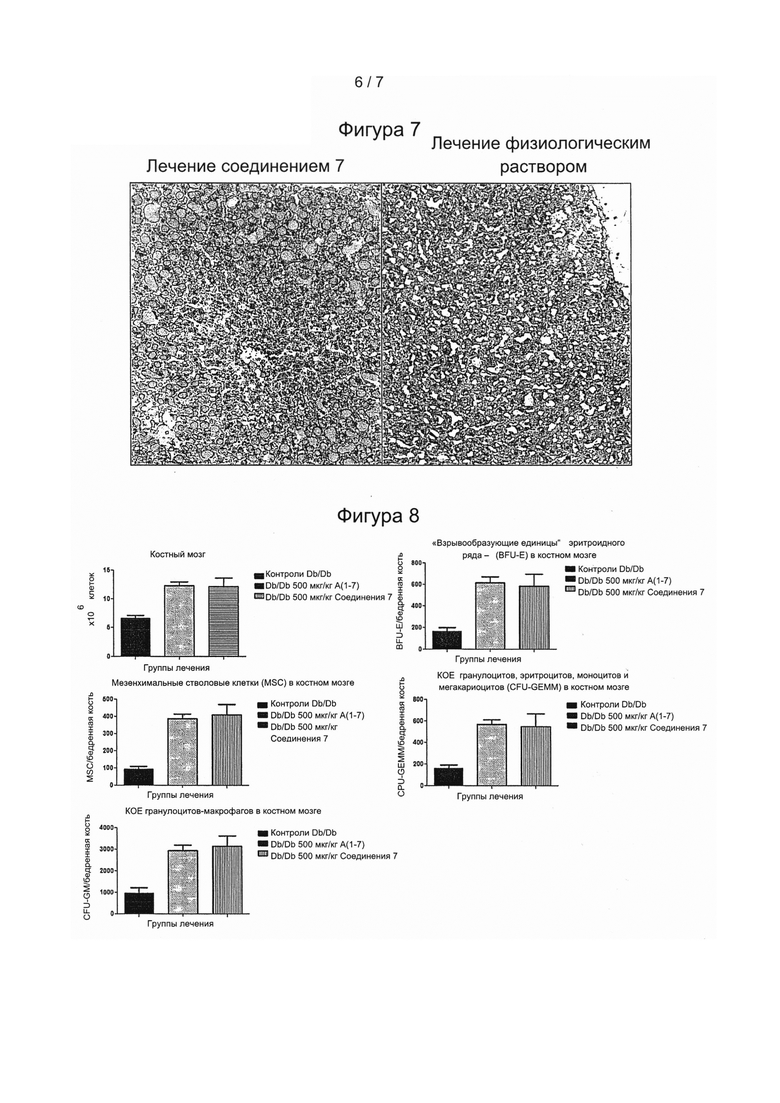

Изобретение относится к низкомолекулярным непептидным соединениям формулы 1, где значения R1-R5, Z, кольцо A, кольцо B указаны в формуле изобретения, а также способам и композициям для лечения связанных с ангиотензином заболеваний и нарушений. В частности, соединения согласно настоящему изобретению пригодны для лечения метаболических заболеваний и нарушений, таких как сахарный диабет, связанные с диабетом сердечно-сосудистые нарушения, связанные с диабетом изъязвления кожи, связанная с диабетом гипертензия и связанные с диабетом заболевания глаз. 8 н. и 21 з.п. ф-лы, 10 ил., 15 пр.

1. Соединение, имеющее общую формулу 1
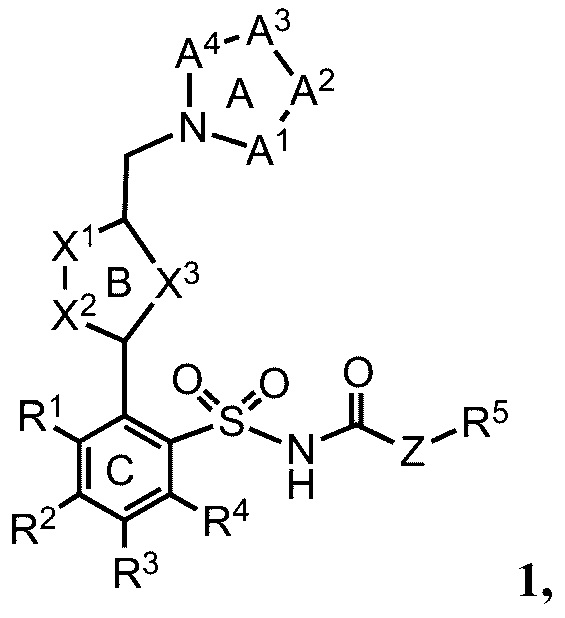
где кольцо А представляет собой
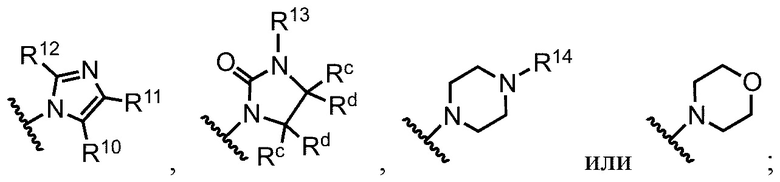
кольцо В представляет собой

Z представляет собой -О- или -NH-;
Rc и Rd представляют собой водород;
R2 представляет собой трифторметокси;
R5 представляет собой С1-С15 алкил;
R1, R3, R4, R6, R7, R8, R10, R11 и R12 представляют собой водород и
R13 и R14 представляют собой водород или С1-С15 алкил,
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, имеющее общую формулу, выбранную из группы, состоящей из:
 ,
,
или его фармацевтически приемлемая соль.
3. Соединение по п. 1, имеющее общую формулу, выбранную из группы, состоящей из:
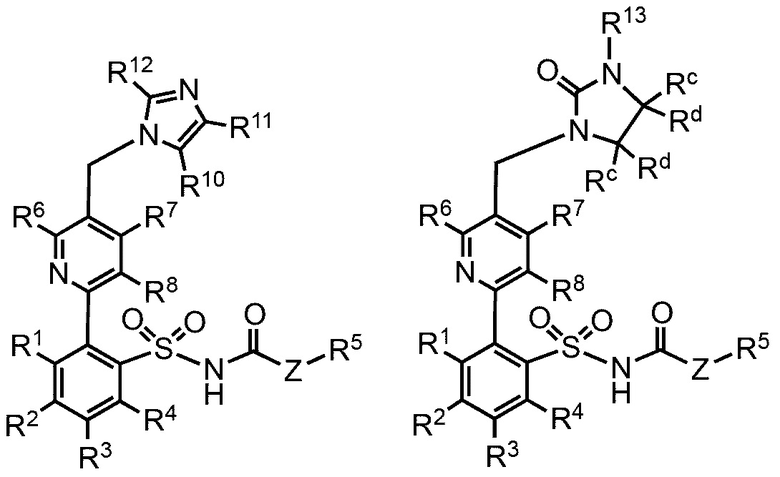

или его фармацевтически приемлемая соль.
4. Соединение по п. 1, имеющее общую формулу, выбранную из группы, состоящей из:
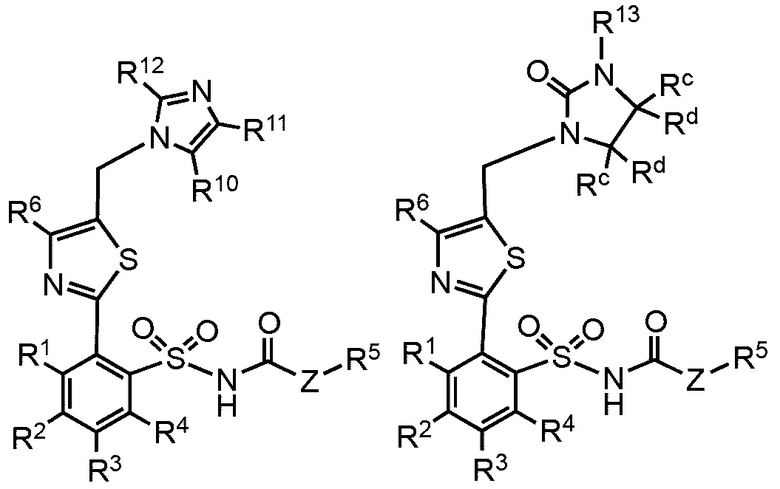
 ,
,
или его фармацевтически приемлемая соль.
5. Соединение по п. 1, имеющее общую формулу 2а,b или 3а,b:


или его фармацевтически приемлемая соль.
6. Соединение по п. 1, имеющее общую формулу 4a,b, 5а,b или 6а,b:
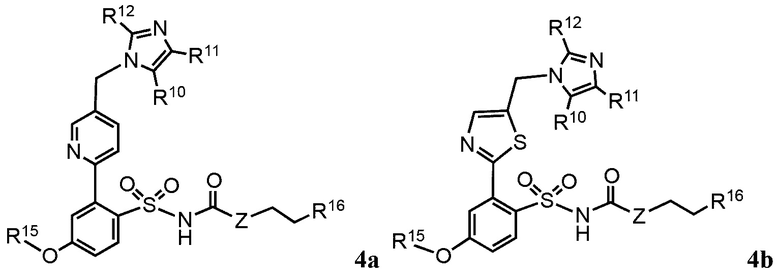
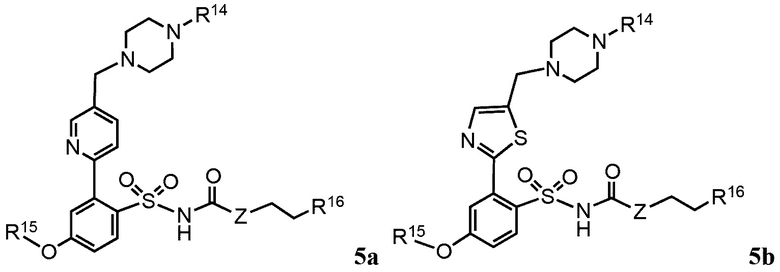
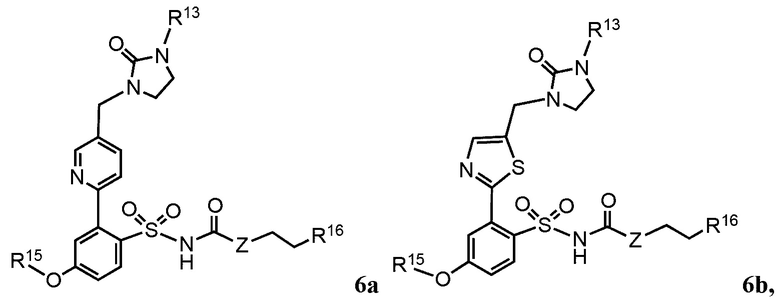
где R15 представляет собой трифторметил и
R16 представляет собой водород или С1-С15 алкил,
или его фармацевтически приемлемая соль.
7. Соединение по п. 1, имеющее формулу 7, 8, 9, 10 или 11:
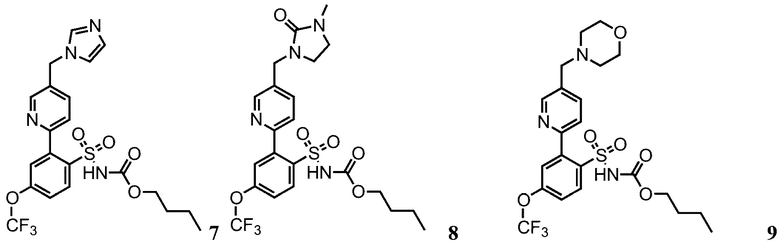

или его фармацевтически приемлемая соль.
8. Соединение по п. 1, имеющее формулу 7
 ,
,
или его фармацевтически приемлемая соль.
9. Соединение по п. 1, имеющее формулу 10
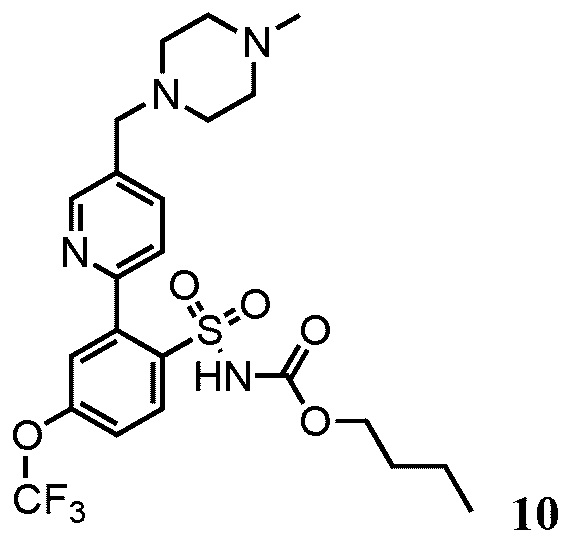 ,
,
или его фармацевтически приемлемая соль.
10. Фармацевтическая композиция для лечения связанных с ангиотензином заболеваний, нарушений или состояний, содержащая эффективное количество соединения по любому из пп. 1-9 и фармацевтически приемлемый носитель.
11. Способ повышения образования NO в клетке, включающий приведение в контакт клетки с эффективным количеством соединения общей формулы 1

где кольцо А представляет собой

кольцо В представляет собой

Z представляет собой -О- или -NH-;
Rc и Rd представляют собой водород;
R2 представляет собой трифторметокси;
R5 представляет собой С1-С15 алкил;
R1, R3, R4, R6, R7, R8, R10, R11 и R12 представляют собой водород и
R14 представляет собой водород или С1-С15 алкил,
или его фармацевтически приемлемой соли.
12. Способ по п. 11, отличающийся тем, что указанное соединение представляет собой агонист рецептора Mas.
13. Способ по п. 11, отличающийся тем, что указанное соединение представляет собой агонист рецептора ангиотензина II AT2R.
14. Способ лечения связанного с ангиотензином заболевания или нарушения, включающий введение нуждающемуся в этом пациенту эффективного количества соединения общей формулы 1

где кольцо А представляет собой
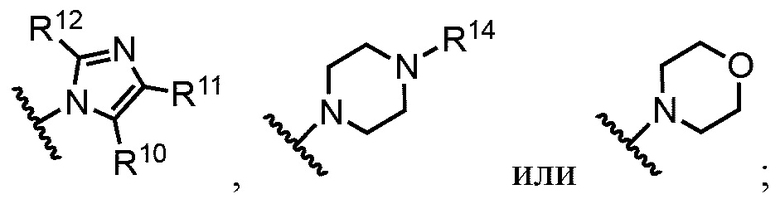
кольцо В представляет собой

Z представляет собой -О- или -NH-;
Rc и Rd представляют собой водород;
R2 представляет собой трифторметокси;
R5 представляет собой С1-С15 алкил;
R1, R3, R4, R6, R7, R8, R10, R11 и R12 представляют собой водород и
R14 представляет собой водород или С1-С15 алкил,
или его фармацевтически приемлемой соли,
причем указанное количество эффективно для облегчения по меньшей мере одного симптома, связанного с заболеванием или нарушением, или для отсрочивания или предотвращения возникновения по меньшей мере одного симптома заболевания.
15. Способ по п. 14, отличающийся тем, что связанное с ангиотензином заболевание или нарушение представляет собой связанное с диабетом сердечно-сосудистое заболевание, связанное с диабетом метаболическое заболевание, связанное с диабетом заболевание глаз, связанное с диабетом заболевание костного мозга или рак молочной железы.
16. Способ по п. 15, отличающийся тем, что (а) связанное с диабетом сердечно-сосудистое заболевание выбрано из группы, состоящей из инфаркта миокарда, застойной сердечной недостаточности, сердечно-сосудистого заболевания при диабете, фибрилляции предсердий, гипертензии, заболевания периферических сосудов, эректильной дисфункции, инсульта, преэклампсии, стентов с покрытием, ингибирующих рестеноз, синдрома Марфана и аневризмы брюшной/грудной аорты, (b) связанное с диабетом метаболическое заболевание выбрано из группы, состоящей из инсулинорезистентности и метаболического синдрома, (с) связанное с диабетом заболевание глаз выбрано из группы, состоящей из дегенерации желтого пятна, рубцевания роговицы и диабетической ретинопатии, (d) связанное с диабетом заболевание костного мозга выбрано из группы, состоящей из миелосупрессии после облучения или химиотерапии, аутологического трансплантата, смягчения последствий воздействия радиации, приживления трансплантата, аллогенного трансплантата, приживления трансплантированных клеток, гематопоэза, повреждения костного мозга и миелодиспластических синдромов.
17. Способ по п. 14, отличающийся тем, что связанное с ангиотензином заболевание или нарушение представляет собой связанное с диабетом метаболическое заболевание или нарушение или состояние, связанное с ними, сахарный диабет, связанные с диабетом сердечно-сосудистые нарушения, связанные с диабетом изъязвления кожи, связанную с диабетом гипертензию, связанные с диабетом заболевания глаз или связанные с ожирением заболевания или состояния.
18. Способ по п. 14, отличающийся тем, что заболевание представляет собой сахарный диабет.
19. Способ по п. 14, отличающийся тем, что заболевание представляет собой миелодиспластический синдром.
20. Способ по п. 14, отличающийся тем, что заболевание представляет собой диабетическое заболевание глаз.
21. Способ снижения содержания глюкозы в крови у нуждающегося в этом пациента, включающий введение пациенту эффективного количества соединения общей формулы 1

где кольцо А представляет собой

кольцо В представляет собой

Z представляет собой -О- или -NH-;
Rc и Rd представляют собой водород;
R2 представляет собой трифторметокси;
R5 представляет собой С1-С15 алкил;
R1, R3, R4, R6, R7, R8, R10, R11 и R12 представляют собой водород и
R14 представляет собой водород или С1-С15 алкил,
или его фармацевтически приемлемой соли.
22. Способ по п. 21, отличающийся тем, что у пациента сахарный диабет.
23. Способ повышения пролиферации клеток-предшественников костного мозга у нуждающегося в этом пациента, включающий введение пациенту эффективного количества соединения общей формулы 1
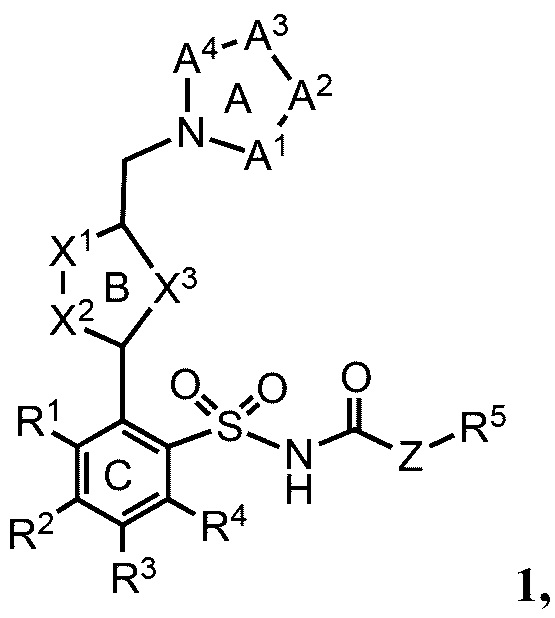
где кольцо А представляет собой

кольцо В представляет собой

Z представляет собой -О- или -NH-;
Rc и Rd представляют собой водород;
R2 представляет собой трифторметокси;
R5 представляет собой С1-С15 алкил;
R1, R3, R4, R6, R7, R8, R10, R11 и R12 представляют собой водород и
R14 представляет собой водород или С1-С15 алкил,
или его фармацевтически приемлемой соли.
24. Способ снижения накопления жира у нуждающегося в этом пациента, включающий введение пациенту эффективного количества соединения общей формулы 1

где кольцо А представляет собой

кольцо В представляет собой
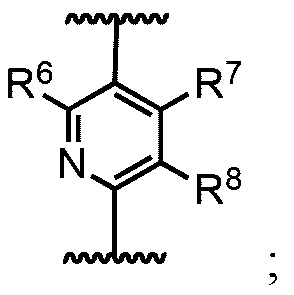
Z представляет собой -О- или -NH-;
Rc и Rd представляют собой водород;
R2 представляет собой трифторметокси;
R5 представляет собой С1-С15 алкил;
R1, R3, R4, R6, R7, R8, R10, R11 и R12 представляют собой водород и
R14 представляет собой водород или С1-С15 алкил,
или его фармацевтически приемлемой соли.
25. Способ по п. 24, отличающийся тем, что у пациента неалкогольный стеатогепатит.
26. Способ лечения рака молочной железы у нуждающегося в этом пациента, включающий введение пациенту эффективного количества соединения общей формулы 1
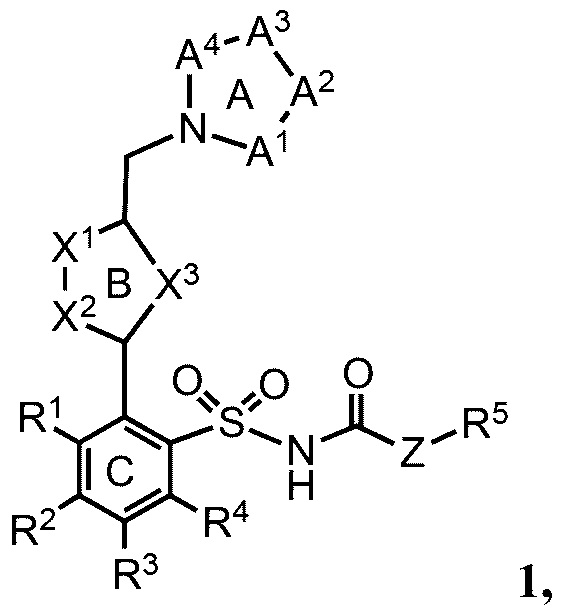
где кольцо А представляет собой

кольцо В представляет собой

Z представляет собой -О- или -NH-;
Rc и Rd представляют собой водород;
R2 представляет собой трифторметокси;
R5 представляет собой С1-С15 алкил;
R1, R3, R4, R6, R7, R8, R10, R11 и R12 представляют собой водород и
R14 представляет собой водород или С1-С15 алкил,
или его фармацевтически приемлемой соли.
27. Способ по любому из пп. 11-26, отличающийся тем, что соединение представляет собой

или его фармацевтически приемлемую соль.
28. Способ по любому из пп. 11-26, отличающийся тем, что соединение представляет собой

или его фармацевтически приемлемую соль.
29. Способ по любому из пп. 11-26, отличающийся тем, что соединение представляет собой
или его фармацевтически приемлемую соль.
| ИНГИБИТОРЫ ПРОЛИЛГИДРОКСИЛАЗЫ | 2010 |
|
RU2518071C2 |
| US 5395844 A1, 07.03.1995 | |||
| US 20050032851 A1, 10.02.2005 | |||
| US 20120329784 A1, 27.12.2012 | |||
| US 20080318951 A1, 25.12.2008 | |||
| US 20110009409 A1, 13.01.2011 | |||
| WO 2000001389 A1, 13.01.2000. | |||
Авторы
Даты
2019-05-20—Публикация
2014-03-15—Подача