ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к областям молекулярной биологии и биохимии, и, в частности, к разработке фармацевтических препаратов для модуляции активности рецептора ангиотензина II 2-го типа (AT2R).
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Рецептор ангиотензина II 2-го типа AT2R является частью противовоспалительного/вазодилатирующего звена ренин-ангиотензиновой системы (РАС). Активация AT2R способствует улучшению при сердечно-сосудистых заболеваниях и инсультах, подавляет раковые заболевания и оказывает нейропротективную роль (1-17).
АТ2-рецептор представляет собой трансмембранный рецепторный белок, содержащий последовательность из 363 аминокислот, которые образуют семь трансембранных доменов. Трехмерная структура AT2R пока не установлена, однако включает в себя пять потенциальных сайтов гликозилирования и консервативный остаток лизина (Lys 199 или K199), который является критическим для взаимодействия лиганд-белок. Также во второй внутриклеточной петле AT2R протеинкиназа C содержит потенциальный сайт фосфорилирования (18).
AT2R относится к семейству рецепторов, сопряженных с G-белком (GPCR). Активация AT2R стимулирует различные белковые фосфатазы (например, SHP1, MKP1 и PP2A) и ингибирует рост раковых клеток. Опосредованная активация AT2R пути брадикинина/оксида азота/цГМФ и пути рецептора простагландина I2-IP способствует вазодилатирующим эффектам (19-23). Однако многие сигнальные механизмы, активируемые AT2R, независимы от G-белка и включают прямые взаимодействия между AT2R и другими клеточными белками. AT2R взаимодействует с семейством AT2R-взаимодействующих белков (ATIP), вовлеченных в дифференцировку нейронов, ремоделирование сосудов и подавление опухолей через C-терминальный цитоплазматический домен (CCD) (24). Показано, что AT2R взаимодействует с рецепторами семейства ErbB и с Na+/H+-обменником NHE6 через третью внутриклеточную петлю (ICL) и CCD, и что третья ICL AT2R участвует в ослаблении сигнализации рецептора ангиотензина II 1-го типа (AT1R) (25, 26). Опосредованный AT2R апоптоз также требует третьей ICL (27, 28). Примечательно, что делеция CCD снижает аффинность AT2R к ангиотензину II (АТ II), но увеличивает его аффинность к пептидному лиганду CGP42112A и усиливает индуцированное АТ II снижение цГМФ (29, 30). Данные результаты научных наблюдений подчеркивают роли третьей ICL и CCD в сигнализации AT2R.
При болезни Паркинсона (БП) наблюдается снижение регуляции AT2R (31). Несмотря на то, что о роли AT2R при БП известно немногое, установлено, что активация AT2R вызывает дифференцировку дофаминергических нейронов из мезэнцефальных предшественников (32). Кроме того, активация AT2R является нейропротективной для культивируемых дофаминергических нейронов головного мозга, тогда как применение антагониста AT2R устраняет нейропротекторные эффекты (33).
Ранние исследования Mendelsohn и др. (1988), а также Unger и др. (1988) с использованием биохимических и фармакологических подходов установили наличие ренин-ангиотензиновой системы в головном мозге (34, 35). Различные компоненты (например, ангиотензинпревращающий фермент (АПФ), АТ II и рецепторы АТ II) присутствуют в зонах мозга, участвующих в регуляции водно-электролитного баланса и артериального давления (36, 37), а также в структурах, связанных с познанием, поведением и передвижением. Примечательно, что все данные компоненты, и, в частности AT2R, проявляют высокую экспрессию в эмбриональный период развития. Это указывает на то, что они могут играть важную роль в процессе развития. По данным Nuyt и др., на основании исследований, проведенных на эмбрионах и новорожденных крысах, мРНК AT2R первоначально возникла (в частности, уже на 13-ые сут эмбрионального развития) в дифференцирующейся латеральной гипоталамической области, но и временно в различных развивающихся/дифференцирующихся структурах головного мозга (38). В большинстве различных областей онтогенез экспрессии мРНК AT2R сильно коррелируется с их созреванием и дифференцировкой (как, например: в мозжечке, комплексе нижней оливы и мозговых костномозговых двигательных ядрах, иннервирующих язык, периоральную и челюстную мышцы, когда как экспрессия AT2R резко уменьшена в зрелых нейронах).
Из исследований, проведенных на клеточных линиях, следует, что активация AT2R во время развития принимает участие в удлинении аксонов, миграции нейронов, нейронной гибели и балансе сохранения выживаемости, а также в создании и поддержании синаптических связей. У взрослых крыс высокие уровни AT2R были обнаружены в продолговатом мозге (который контролирует автономные функции), в перемычке и миндалевидном теле (которые связаны с тревожно-подобным поведением), в таламусе (который связан с сенсорным восприятием), в верхнем двухолмии (которое контролирует движения глаз в ответ на визуальную информацию и связано с гипервозбудимостью мигания при паркинсонизме), а также в субталамическом ядре и мозжечке (областях, связанных с изучением моторных функций) (39, 40, 41).
Согласно Bottari и др., AT2R обнаруживаются в нейронах, но не в астроцитах или глиальных клетках. Наличие AT2R в ограниченных областях мозга взрослого и его обширное распространение у плода (во многих дифференцирующихся структурах и ядрах) свидетельствует о его роли в нейронной функции и развитии нейронов, соответственно (42). Соответственно, используя клетки нейронного происхождения и модели регенерации нейронов, было обнаружено, что AT2R принимает участие в регуляции апоптоза и клеточной дифференцировки. Помимо его кратковременной экспрессии во многих структурах во время развития, экспрессия AT2R возрастает в мозге после повреждения клеток, что свидетельствует о том, что он играет роль в нейронном заживлении. Помимо дифференцировки нейронов, которая имеет первостепенное значение для регенерации нервов, AT2R также стимулирует дифференцировку гематопоэтических клеток, ключевой процесс во время регенерации и восстановления (31).
Ишемическое повреждение характеризуется инфильтрацией ряда гематопоэтических клеток, таких как тромбоциты, макрофаги и лейкоциты (43). Примечательно, что AT2R обладает способностью индуцировать дифференцировку моноцитов человека в дендритные клетки (44), что указывает на потенциальный защитный эффект. Подтверждением данного защитного эффекта AT2R является научное наблюдение, в котором было обнаружено более значительное ишемическое повреждение у мышей с удаленной экспрессией AT2R гемопоэтических клеток (45). Полученные результаты показывают, что экспрессия и активация AT2R в гематопоэтических клетках является частью полезного эффекта после травмы головного мозга (46).
Почечные дофаминовые D1-подобные рецепторы (D1R) и AT2R являются важными натрийуретическими рецепторами, уравновешивающими опосредованную АТ1R трубчатую реабсорбцию натрия. У односторонне нефрэктомизированных крыс Спрег-Доули, нагруженных натрием, прямая почечная интерстициальная инфузия высокоселективного агониста D1R индуцировала натрийуретический ответ, который был отменен специфическим антагонистом AT2R PD-123319 или ингибитором полимеризации микротрубочек нокодазолом, но не ингибитором полимеризации актина цитохалазином D. Результаты показывают, что натрийурез, индуцированный D1R, требует накопления AT2R в апикальных плазматических мембранах клеток проксимальных почечных канальцев через микротрубочки с использованием сигнального пути аденилатциклазы/цАМФ. Данные исследования дают принципиально новые знания относительно механизмов, в результате которых почечные D1R и AT2R действуют совместно для стимуляции экскреции натрия in vivo (47).
Воздействия на первичные нейроны Соединением 21 (C21), агонистом AT2R, улучшали функциональное восстановление при экспериментальном повреждении спинного мозга путем активации аксональной пластичности и через нейропротекторные, и антиапоптотические механизмы (48).
Несмотря на то, что AT2R относится к семейству белков GPCR, его сигнальные механизмы являются нетипичными и остаются неясными. Активированный AT2R индуцирует сосудорасширяющий каскад брадикинина (БК)/оксида азота/цГМФ, стимулирует различные белковые фосфатазы (например, SHP1, MKP1 и PP2A) и ингибирует рост раковых клеток (19-23). AT2R также взаимодействует с семейством AT2R-взаимодействующих белков (ATIP), вовлеченных в дифференцировку нейронов, ремоделирование сосудов и подавление опухолей через CCD (49, 50). Постоянное воздействие блокатора рецептора АТ1 (ARB) может привести к перенаправлению АТ II в AT2R, который обычно соэкспрессируется с AT1R в сердечно-сосудистых тканях, что приводит к увеличению активации AT2R и усилению взаимного влияния AT1R-AT2R. У мышей с инактивированным AT2R ARB были неспособны понижать постинфарктное острофазное ремоделирование, что указывает на необходимость присутствия AT2R для кардиозащитного действия ARB (17).
Сердечно-сосудистые защитные эффекты AT2R подчеркиваются тем фактом, что умеренная сердечно-специфическая избыточная экспрессия AT2R защищает сердце от ишемического повреждения (16).
Воспалительный каскад, способствующий развитию сердечно-сосудистых заболеваний (ССЗ), был спонтанно изучен за последнее десятилетие, что было обусловлено заметным увеличением распространенности заболевания. Объективно оценивая, почти 70% всех смертельных случаев от сахарного диабета 1-го типа (СД1) связаны с этим состоянием (51). Повышенная активация провоспалительного AT1R наблюдается при сердечно-сосудистых заболеваниях и гипертонии (3). В целом, повышенная активация AT1R активирует регуляцию провоспалительных и прораковых белков, таких как nf-kb, IL-6 (52, 53, 54).
Диабетическая нефропатия отмечена повышенными базальными уровнями некоторых цитокинов (например, TNF-альфа, IL-6), и поэтому экспериментальные воздействия были сфокусированы на модуляции аналогичных маркеров. Многочисленные исследования показали, что уровни цитокинов в сыворотке и моче положительно коррелировали с прогрессированием заболевания. В частности, связанные с патогенезом нефропатии молекулы, такие как IL-6, были идентифицированы как ответственные за изменение проницаемости эндотелиальных клеток сосудов и развитие утолщения базальной мембраны, соответственно (55).
Хроническая активация РАС системно и локально повышает АТ II. Затем АТ II связывается с AT1R и индуцирует сигнальные пути, которые способствуют мышечному спазму, удержанию соли и воды, фиброзу, гипертрофии и гиперплазии, которые лежат в основе многих метаболических заболеваний и плохого сердечно-сосудистого, и почечного прогноза. Блокада РАС может быть применена на нескольких уровнях: путем торможения секреции ренина, АПФ или сигнализации AT1R (1, 2, 5, 9). Были разработаны эффективные на всех указанных уровнях РАС-блокаторы, и в настоящее время используются для блокирования чрезмерной активации РАС и для защиты от заболеваний обмена веществ, связанных с РАС, включая сахарный диабет (2).
Тем не менее данные рандомизированных клинических исследований, таких как исследование терапии алискиреном при сахарном диабете 2-го типа, продолжающееся до достижения конечных точек со стороны сердца и почек, (ALTITUDE), и продолжающееся до получения окончательного результата исследование терапии только телмисартаном и телмисартаном совместно с рамиприлом (ONTARGET) показывают, что двойная блокада РАС была не эффективной по сравнению с монотерапией в предотвращении серьезных исходов у пациентов с известным сосудистым заболеванием или сахарным диабетом с ишемическим поражением органов (56-58). Клинические данные, подтверждающие связь инактивации РАС с заболеваниями почек, и фундаментальные исследования РАС, начали раскрывать сложные саморегулирующиеся сигнальные петли, которые тонко регулируют активацию РАС и адаптивную/защитную роль РАС во многих тканях (9). В этой связи, АТ II проявляет свои сосудорасширяющие/защитные сердечно-сосудистые/противовоспалительные эффекты, когда активирует AT2R.
Митохондрии также экспрессируют локальную систему ангиотензина (MAS). Важно отметить, что AT2R, расположенный во внутренней мембране митохондрий, играет важную роль в опосредовании дыхания митохондрий. Известно, что во время процесса старения митохондриальная экспрессия AT2R снижается, а экспрессия провоспалительного АТ1R увеличивается (62). Критическая роль MAS в старении указывает на то, что данная система играет роль в развитии болезни Альцгеймера (БА). В дальнейшем подтверждении было показано, что бета амилоид приводит к повышенной олигомеризации и потере функции рецептора АТ2R, который, как считается, способствует патогенезу болезни (63, 64).
Сообщалось, что блокаторы АТ1R (ARB) уменьшают возрастную митохондриальную дисфункцию, ослабляют индуцированную гипертензией почечную митохондриальную дисфункцию и защищают от сердечной митохондриальной дисфункции в условиях острой ишемии (62,65). Теоретически ингибирование AT1R ARB позволяет большему количеству АТ II соединяться и активировать AT2R. В связи с этим, повышение противостоящей системы AT2R обеспечит дополнительные улучшения в функции митохондрий. Нарушение AT1R было связано с увеличением числа митохондрий и повышением регуляции способствующих выживанию генов никотинамид фосфорибозилтрансферазы (Nampt) и сиртуина 3 (Sirt3) в почках, что привело к заметному увеличению продолжительности жизни у мышей (66). Из данных генов, как известно, Sirt3 регулирует стресс, опосредованный БА (67).
NHE6 представляет собой митохондриальный белок, расположенный во внутренней мембране митохондрии, который, как известно, улучшает познание и память, а мутации в гене NHE6 связаны с различными неврологическими нарушениями, такими как аутизм и синдром Кристиансона (68-70). Показано, что AT2R взаимодействует с NHE6 через третью ICL. AT2R ингибирует опосредованное АТ1R фосфорилирование треонина/тирозина NHE6 (71-73). Это указывает на то, что опосредованное AT1R фосфорилирование является признаком деградации, которая предотвращается взаимодействием AT2R-NHE6.
MCL-1 (белок дифференцировки миелоидной лейкемической клетки) представляет собой белок, который является членом семейства Bcl-2 (74). Существуют два различных варианта MCL-1, основанных на альтернативном сплайсинге: длинная форма и две более короткие изоформы. Длинная форма (MCL-1L) содержит 312 остатков, в то время как короткие изоформы (MCL-1S) составляют 271 остаток, причем разница в 41 остаток наблюдается на C-конце. MCL-1L содержит стандартные домены, найденные в семействе Bcl-2, включая BH1, BH2, BH3 и трансмембранный домен. Напротив, MCL-1S содержит только домен BH3. Данный альтернативный сплайсинг приводит к двум совершенно различным биологическим функциям для MCL-1L и MCL-1S. В частности, MCL-1L, как известно, является антиапоптотическим, в то время как MCL-1S, в полном контрасте, является проапоптотическим (75,76). BH3-подобная часть домена MCL-1S может связываться и димеризоваться с MCL-1L (77). Это взаимодействие ингибирует биологическую активность MCL-l, и, следовательно, MCL-1S является антагонистом MCL-1L.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение основано, по меньшей мере, частично, на идентификации класса специфических небольших агонистов, которые связываются с рецептором ангиотензина II 2-го типа (AT2R), тем самым активируя его. Агонисты полезны в качестве исследовательских, диагностических и терапевтических реагентов, особенно в методах исследования, диагностики и лечения, связанных с заболеваниями, состояниями или нарушениями, характеризующимися недостаточной активностью AT2R или чрезмерной активностью AT1R. Агонисты AT2R по настоящему изобретению представляют собой полипептиды (или производные полипептида, или аналоги), содержащие 6 аминокислотных остатков с генерической последовательностью A1-A2-A3-A4-A5-A6, где A1 представляет собой Lys; A2 - Pro, 3Hyp или 4Hyp; A3 - Leu или Ile; A4 - Lys, A5 - Pro, 3Hyp или 4Hyp, и A6 - Trp. Таким образом, агонисты AT2R по настоящему изобретению включают полипептиды (или производные полипептида, или аналоги), включающие в себя, состоящие из, или состоящие по существу из любой из последовательностей: Lys-Pro-Leu-Lys-Pro-Trp; Lys-3Hyp-Leu-Lys-Pro-Trp; Lys-4Hyp-Leu-Lys-Pro-Trp; Lys-Pro-Ile-Lys-Pro-Trp; Lys-3Hyp-Ile-Lys-Pro-Trp; Lys-4Hyp-Ile-Lys-Pro-Trp; Lys-Pro-Leu-Lys-3Hyp-Trp; Lys-3Hyp-Leu-Lys-3Hyp-Trp; Lys-4Hyp-Leu-Lys-3Hyp-Trp; Lys-Pro-Ile-Lys-3Hyp-Trp; Lys-3Hyp-Ile-Lys-3Hyp-Trp; Lys-4Hyp-Ile-Lys-3Hyp-Trp; Lys-Pro-Leu-Lys-4Hyp-Trp; Lys-3Hyp-Leu-Lys-4Hyp-Trp; Lys-4Hyp-Leu-Lys-4Hyp-Trp; Lys-Pro-Ile-Lys-4Hyp-Trp; Lys-3Hyp-Ile-Lys-4Hyp-Trp; и Lys-4Hyp-Ile-Lys-4Hyp-Trp. В некоторых вариантах осуществления, когда A2 представляет собой Pro, A5-3Hyp или 4 Hyp. В некоторых вариантах осуществления, когда A5 представляет собой Pro, A2-3Hyp или 4Hyp.
Таким образом, в одном аспекте, настоящее изобретение относится к композициям агонистов AT2R, включая химически чистые реагенты и фармацевтические композиции, содержащие агонист AT2R, при необходимости в лиофилизированной форме или в сочетании с фармацевтически приемлемым носителем.
В другом аспекте, настоящее изобретение относится к способам активации AT2R в клетках млекопитающих in vitro с использованием композиции агониста AT2R по настоящему изобретению. В некоторых вариантах осуществления этот способ используется в качестве контроля для характеристики и/или количественного определения понижающих эффектов на активацию рецептора (например, эффекты воздействия на мишень рапамицина в клетках млекопитающих (MTOR), NHE6, ErbB3, активность синтазы оксида азота, MCL-1 и простагландин 12-IP). Композиции реагента-агониста AT2R также могут быть использованы in vivo в качестве контроля для или конкурентного, или неконкурентного ингибитора, активации AT2R или инактивации AT1R в ответ на воздействия другими лекарственными препаратами или препаратами-кандидатами.
В другом аспекте, настоящее изобретение относится к способам лечения пациента с диагнозом, подверженного риску диагноза, или иным образом нуждающегося в лечении любых заболеваний, состояний или нарушений, характеризующихся недостаточной активностью AT2R или чрезмерной активностью AT1R. Способы включают введение терапевтически эффективного количества агониста AT2R по настоящему изобретению в фармацевтически приемлемом носителе пациенту, нуждающемуся в этом. Аналогично, изобретение относится к агонистам AT2R настоящего изобретения для применения при получении или производстве лекарственного средства для лечения пациента с диагнозом, подверженного риску диагноза, или иным образом нуждающегося в лечении любых заболеваний, состояний или нарушений, характеризующихся недостаточной активностью AT2R или чрезмерной активностью AT1R, или недостаточной активностью путей, которые понижают сигнализацию AT2R (например, заболевания, состояния или нарушения, характеризующиеся недостаточными: MTOR, NHE6, ErbB3, синтазой оксида азота, MCL-1 или активностью простагландина 12-IP, или продуцированием). Заболевания, состояния или нарушения, с возможностью лечения способами и лекарственными средствами по настоящему изобретению, включают, без ограничения, (а) хроническое воспаление, вызванное чрезмерной активацией АТ1R или недостаточной активацией AT2R; (b) заболевания, состояния или нарушения, при которых выявляется увеличение уровней циркулирующих в крови, по меньшей мере, одной из изоформ MCL-1, (c) гипертензия, опосредованная AT1R, (d) гипертензия, опосредованная AT2R, и/или сердечно-сосудистая болезнь, (e) нейродегенеративные заболевания, опосредованные AT2R, включая, но не ограничиваясь, болезнь Альцгеймера, болезнь Паркинсона, АЛС и возрастное ухудшение психического состояния, (f) нейронные повреждения (например, травмы спинного мозга, инсульт, ишемически-реперфузионное повреждение), (g) раковые заболевания (h) преэклампсия, (i) осложнения сахарного диабета (например, ретинопатия, некроз клеток поджелудочной железы, метаболический синдром), (j) нефропатия, опосредованная воспалением, (k) заболевание печени, опосредованное воспалением (например, рак печени, печеночная недостаточность), (l) сердечно-сосудистое заболевание, опосредованное воспалением (например, ишемия миокарда и повреждение, миокардиальный фиброз, сердечный приступ), (m) панкреатит, (n) недостаточная мышечная масса (например, истощение мышечной ткани из-за болезни или лечения рака), (o) деградация NHE6, опосредованная AT1R, (p) недостаточная митохондриальная активность, и (q) заболевания, состояния или нарушения, характеризующиеся недостаточными: MTOR, NHE6, ErbB3, синтазой оксида азота, MCL-1 или активностью простагландина 12-IP, или продуцированием.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующие чертежи иллюстрируют варианты осуществления настоящего изобретения и не предназначены для ограничения границ объема изобретения в соответствии с пунктами формулы изобретения.
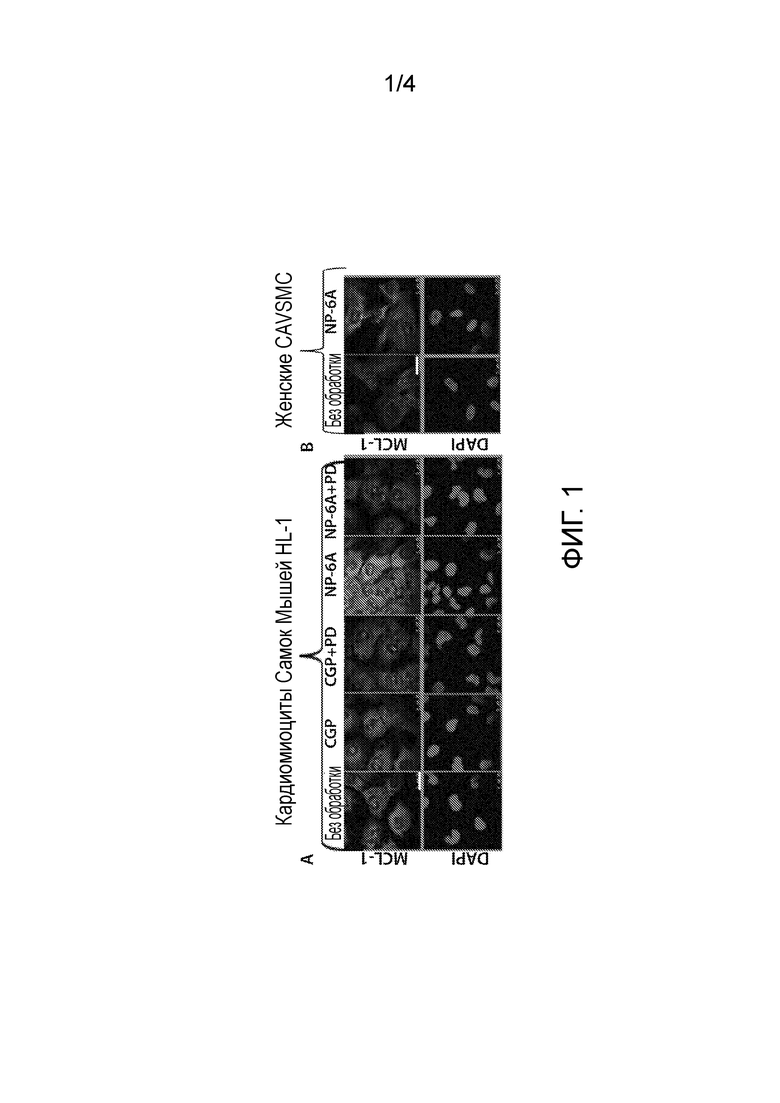
На Фиг. 1 показано, что агонист NP-6AK увеличивает экспрессию MCL-1 в HL-1 кардиомиоцитах самок мышей и CAVSMC человека. CGP, частичный агонист, был не в состоянии увеличить MCL-1. Добавление PD, антагониста AT2R, предотвращает повышающее регулирование MCL-1, опосредованное NP-6AK, что указывает на то, что данный эффект осуществляется через AT2R.
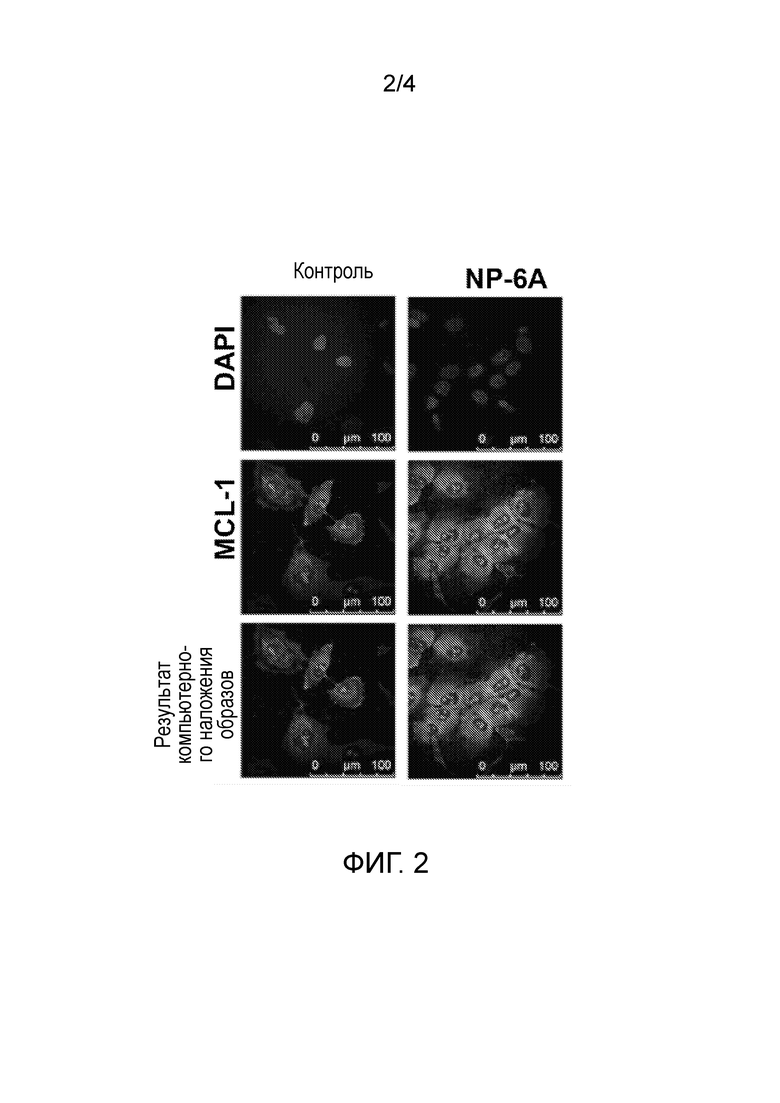
На Фиг. 2 показано иммунофлюоресцентное окрашивание клеток SH-SY5Y, подвергнутых воздействию (24 ч) с использованием агониста NP-6AK, с антителами против MCL-1 и ядерным красителем DAPI. n≥80 и *p<0.01 по сравнению с контролем. Для повышающего регулирования MCL-1 агонист NP-6AK был более эффективным, чем контроль.
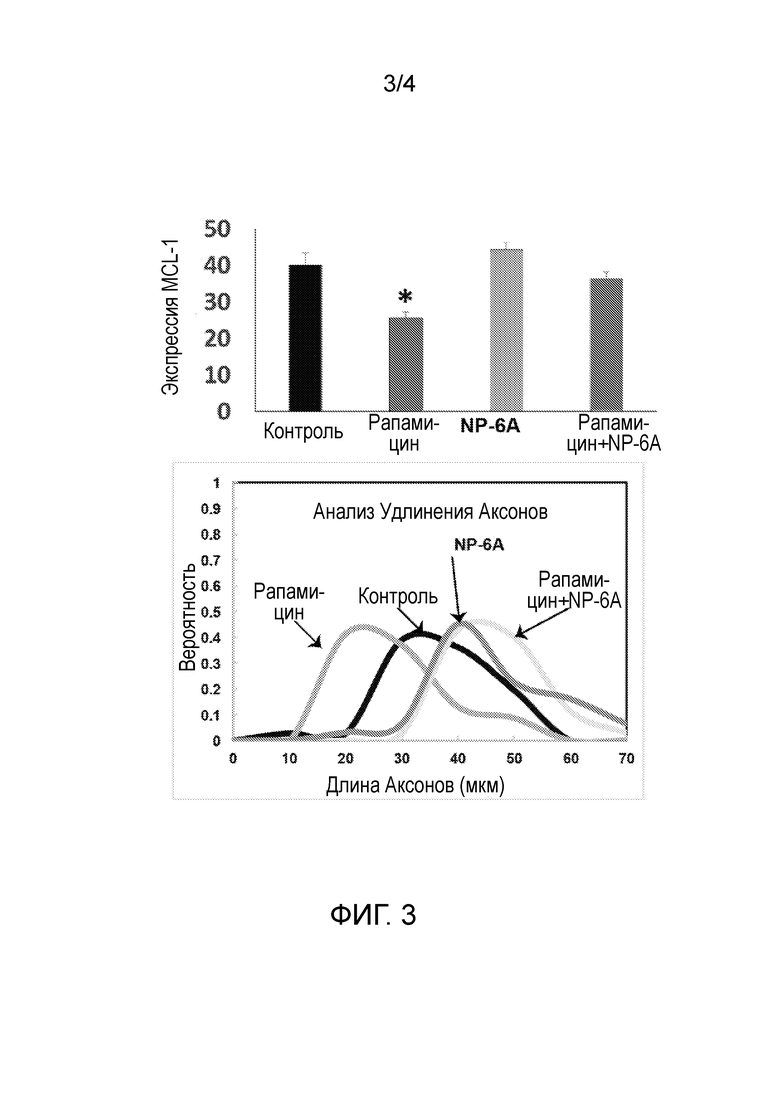
На Фиг. 3 показано, что агонист NP-6AK способствует удлинению аксонов и отменяет опосредованное рапамицином подавление в клетках SH-SY5Y.
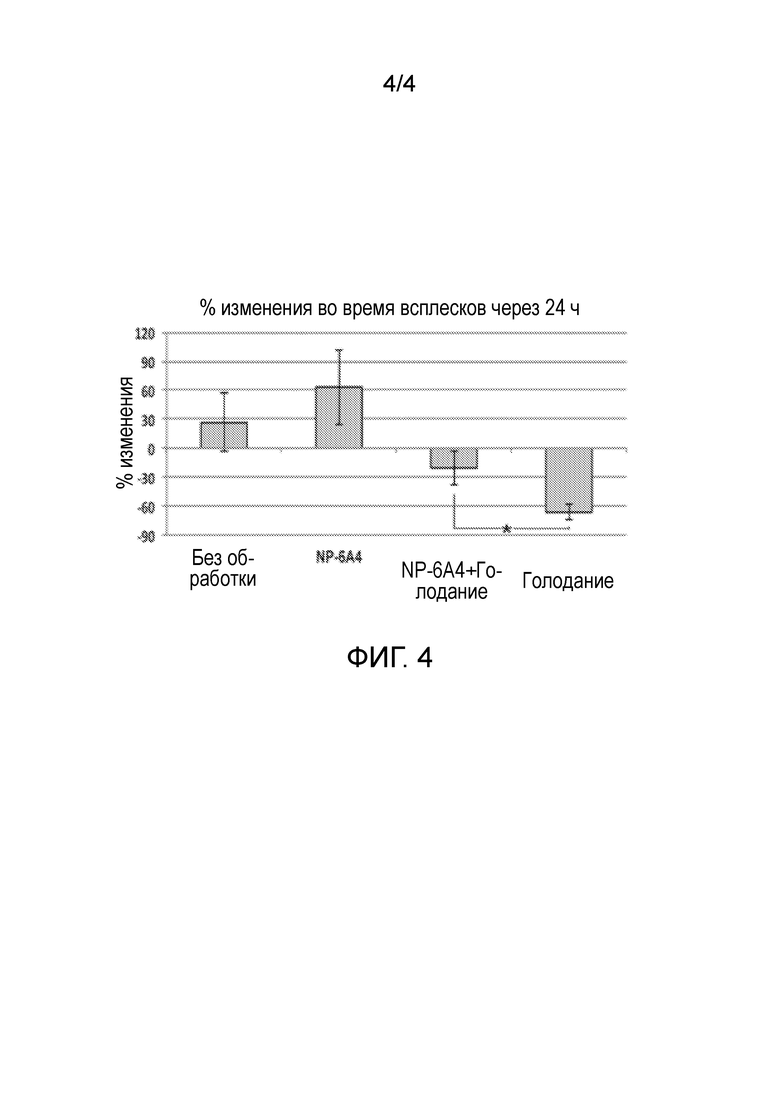
На Фиг. 4 показаны данные исследований с использованием ex vivo ткани, которые показали, что агонист NP-6AK обеспечивал нейропротекцию нормальным первичным мышиным эмбриональным кортикальным нейронам в культуре при намеренном лишении питательных веществ. Для лишения питательных веществ первичные кортикальные нейроны (14 DIV) инкубировали в среде Локка без глюкозы с 300 нм агониста NP-6AK или без него. Клетки, подвергнутые воздействию агониста NP-6AK, имели на 60% увеличенную активность (p<0,05) по сравнению с отрицательным контролем, подтверждающие предыдущие данные, свидетельствующие о повышенной жизнеспособности клеток в условиях сывороточного голодания и нейропротекции.
ПОДРОБНОЕ ОПИСАНИЕ
Активация AT2R подавляется при различных болезненных состояниях, включая артериальную гипертензию, сахарный диабет, раковые заболевания и различные нейродегенеративные заболевания. Подавление AT2R приводит к повышению активности AT1R, который является основной причиной метаболических заболеваний (например, сердечно-сосудистых и почечных заболеваний, сахарного диабета 2-го типа) и раковых заболеваний. В связи с этим, настоящее изобретение относится к новому классу лабораторных реагентов и терапевтических полипептидов, которые могут быть использованы для характеристики и лечения таких расстройств.
Перечень ссылочных документов и определения
Патентная и научная литература, упомянутая в данном документе, устанавливает знания, которые доступны специалистам в данной области техники. Выданные патентные документы U.S., заявки U.S. в стадии рассмотрения, опубликованные иностранные патентные документы и заявки, а также перечень ссылочных документов, включая базы данных белковых и нуклеотидных последовательностей, которые приводятся в данном документе, включены сюда посредством ссылки в той же степени, как если бы каждый был особенно и индивидуально указан для включения в качестве ссылки.
В контексте данного документа, термины «примерно» или «приблизительно» подразумевают погрешность двадцать процентов (20%) от указанного численного количества.
В контексте данного документа, термин «a» означает один или несколько.
В контексте данного документа, термины «повышен» или «понижен» означают, по меньшей мере, на 10% больше или меньше, соответственно, относительно предварительного воздействия агонистом по настоящему изобретению.
В контексте данного документа, термин «фармацевтическая композиция» включает активный агент и фармацевтически допустимый носитель.
В контексте данного документа, термин «фармацевтически допустимый» относится к молекулярным объектам и композициям, которые являются физиологически переносимыми и обычно не вызывают тяжелой аллергической, пирогенной или аналогично нежелательной реакции при введении млекопитающему.
В контексте данного документа, термин «носитель» относится к разбавителю, адъюванту, эксципиенту или несущей среде, с которой вводится соединение. Такими фармацевтическими носителями могут быть стерильные жидкости, такие как вода и масла, в том числе нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Вода или другие водные растворы, солевые растворы, водные растворы декстрозы и глицерина могут быть использованы в качестве носителей, особенно для инъекционных растворов. Подходящие фармацевтические носители описаны в книге «Remington's Pharmaceutical Sciences» под ред. E. W. Martin (61).
Полипептидные модуляторы активности AT2R
Настоящее изобретение относится к новому классу агонистов, которые представляют собой полипептиды (или производные полипептида, или аналоги), содержащие 6 аминокислотных остатков с генерической последовательностью A1-A2-A3-A4-A5-A6, где A1 представляет собой Lys; A2 - Pro, 3Hyp или 4Hyp; A3 - Leu или Ile; A4 - Lys, A5 - Pro, 3Hyp или 4Hyp, и A6 - Trp. Данный новый класс относится к агонистами NP-6AK. Последовательности с Hyp по меньшей мере в одном положении могут быть предпочтительными из-за повышенной стабильности. Другие производные или аналоги этих агонистов могут включать химические модификации, которые повышают стабильность в кровотоке для использования в качестве фармацевтического реагента.
Одной из возможных модификаций является образование искусственных пептидных связей для дополнительной стабильности или присоединения атомов боковой цепи к другому атому остатка. Пример такого химического вещества приведен у Hook и др. (60). Авторы описывают бета-аминокислоты, в которых боковые цепи присоединены к бета-углероду, тогда как боковые цепи природных аминокислот присоединены к альфа-углероду. Различные исследования показали, что данные «бета-пептиды» менее подвержены деградации неспецифическими пептидазами по сравнению с природными пептидами. Могут быть использованы любые химические вещества, которые модифицируют природный пептид для дополнительной стабильности, включая пептоиды, в которых боковая цепь присоединена к азоту.
Другим способом стабилизации полипептидов по настоящему изобретению является ковалентная или нековалентная связь с инертным водорастворимым полимером. При системном введении терапевтические композиции часто быстро удаляются из кровообращения и поэтому могут вызывать относительно недолгосрочную фармакологическую активность. Следовательно, для поддержания терапевтической эффективности могут потребоваться частые инъекции относительно больших доз биологически активных соединений. Любой водорастворимый (например, по меньшей мере примерно 0,01 мг/мл) инертный полимер, который обеспечивает конъюгат с необходимым увеличением стабильности или периода полураспада, подходит для использования в настоящем изобретении. Особенно предпочтительными являются небелковые полимеры. Полимер, предпочтительно, представляет собой гидрофильный синтетический полимер, такой как поливиниловый полимер (например, поливинилалкоголь и поливинилпирролидон), полиалкиленовый эфир (например, полиэтиленгликоль (ПЭГ)); полиоксиалкилен (например, полиоксиэтилен, полиоксипропилен и блок-сополимеры полиоксиэтилена и полиоксипропилена (Pluronics)); полиметакрилат; или карбопол. Однако также полезны природные полимеры, такие как разветвленные или неразветвленные полисахариды, которые включают сахаридные мономеры: D-маннозу, D- и L-галактозу, фукозу, фруктозу, D-ксилозу, L-арабинозу, D-глюкуроновую кислоту, сиаловую кислоту, D-галактуроновую кислоту, D-маннуроновую кислоту (например, полиманнуроновую кислоту или альгиновую кислоту), D-глюкозамин, D-галактозамин, D-глюкозу и нейрамининовую кислоту, включая, например, лактозу, амилопектин, крахмал, гидроксиэтилкрахмал, амилозу, сульфат декстрана, декстран, декстрины, гликоген или полимеры сахарных спиртов, такие как полисорбит и полиманнитол, гепарин или гепаран. Молекулярная масса полимера может составлять примерно от 10,000 до 500,000 дальтон (D) и может часто составлять около 20,000 D, около 30,000 D, около 40,000 D или около 50,000 D.
Известно, что соединения, модифицированные ковалентным присоединением водорастворимых полимеров, такие как полиэтиленгликоль (ПЭГ), сополимеры полиэтиленгликоля и полипропиленгликоля или монометоксиполиэтиленгликоль (мПЭГ), карбоксиметилцеллюлоза, декстран, поливинилалкоголь, поливинилпирролидон или полипролин, проявляют значительно более длительный периода полураспада в крови после внутривенной инъекции, чем соответствующие немодифицированные соединения. Такие модификации также могут увеличивать растворимость композиции в водном растворе, уменьшать агрегацию, повышать физическую или химическую стабильность соединения и снижать иммуногенность и реакционную способность композиции.
Прикрепление полиэтиленгликоля (ПЭГ) к композициям агонистов по настоящему изобретению особенно полезно, поскольку ПЭГ обладает очень низкой токсичностью для млекопитающих и может уменьшить иммуногенность или антигенность композиций агонистов. Были описаны многочисленные активированные формы ПЭГ, подходящие для прямой реакции с белками. Полезные для реакции с белковыми аминогруппами ПЭГ-реагенты включают активные сложные эфиры карбоновой кислоты или карбонатных производных, особенно те, в которых замещаемыми группами являются N- гидроксисукцинимид, п-нитрофенол, имидазол или 1-гидрокси-2-нитробензол-4-сульфонат. Производные ПЭГ, содержащие малеимидо- или галоацетильные группы, являются полезными реагентами для модификации свободных белковых сульфгидрильных групп. Аналогично, реагенты ПЭГ, содержащие аминогидразиновые или гидразидные группы, полезны для взаимодействия с альдегидами, образующимися при окислении периодатами углеводных групп в белках.
Композиции агонистов по настоящему изобретению могут быть доставлены в микрокапсулирующем устройстве для того, чтобы уменьшить или предотвратить иммунный ответ хозяина против полипептида или против клеток, которые могут продуцировать полипептид. Полипептид или композиции по настоящему изобретению также могут быть доставлены микрокапсулированными в мембране, такой как липосома. В качестве примера, полимеры, такие как ПЭГ, могут быть успешно присоединены к одному или нескольким реакционноспособным аминокислотным остаткам в полипептиде композиций агонистов, таким как альфа-аминогруппа аминоконцевой аминокислоты, эпсилон-аминогруппа лизиновых боковых цепей, сульфгидрильные группы цистеиновых боковых цепей, карбоксильные группы аспартильных и глутамиловых боковых цепей, альфа-карбоксильная группа карбоксиконцевой аминокислоты, тирозиновые боковые цепи, или к активированным производным гликозильных цепей, прикрепленных к определенным остаткам аспарагина, серина или треонина.
Другим способом модификации полипептидных агонистов по настоящему изобретению является добавление сигнальной последовательности к N- или С-концу. Термин «сигнальная последовательность», в контексте данного документа, относится к любому короткому пептиду, который направляет движение белка в клетке. Сигнальные последовательности могут быть, например, направлять секрецию полипептида или локализацию внутри внутриклеточного пространства. Сигнальные последовательности также часто детерминируют ориентацию пептида через клеточную мембрану. Одним из примеров является N-концевая последовательность из примерно 20 аминокислот, которая направляет секреторные и трансмембранные белки в эндоплазматический ретикулум (ЭПР) (см., например, von Heijne (1985), J. Mol. Biol. 184:99-105). Сигнальные последовательности могут также быть сконструированы таким образом, чтобы включать один или несколько специфичных сайтов узнавания протеиназой, вследствие чего сигнальные последовательности будут удалены эндогенными протеазами после движения.
Реагенты-агонисты AT2R
Активация AT2R в лабораторных испытаниях представляет большой интерес из-за многих эффектов AT2R, описанных выше. В связи с этим, в одном аспекте, настоящее изобретение относится к агонистам AT2R в качестве реагентов для in vitro или in vivo лабораторных исследований.
Таким образом, агонист AT2R NP-6AK имеет ценность в качестве контроля для характеристики количественного определения понижающих эффектов на активацию рецептора, таких как эффекты воздействия на мишень рапамицина в клетках млекопитающих (MTOR), NHE6, ErbB3 и синтазу оксида азота.
Например, клетки яичника китайского хомячка (СНО), экспрессирующие AT2R и MTOR, обработанные агонистом NP-6AK и инсулином для активации как MTOR, так и AT2R. AT2R подавляет опосредованное MTOR фосфорилирование рибосомального белка S6 (RPS6). Вестерн-блоттинг может быть использован для определения степени фосфорилирования RPS6, которое уменьшается, по меньшей мере, на 10% в ответ на активацию AT2R агонистом NP-6AK. Та же клеточная линия затем может быть обработана другим агонистом-кандидатом AT2R для оценки эффективности агониста-кандидата, или та же клеточная линия может быть обработана как агонистом AT2R по настоящему изобретению, так и антагонистом-кандидатом AT2R (например, EMA300, Smith и др. (2013), Pain Medicine 14(10):1557-68; PD123319, Chakrabarty и др. (2008), Endocrinology 149(7):3452), для оценки эффективности и механизма действия (т.е. конкурентный, неконкурентный) антагониста-кандидата.
Агонист NP-6AK увеличивает уровни экспрессии, по меньшей мере, одной, а в некоторых вариантах осуществления настоящего изобретения, всех трех изоформ MCL-1.
Методы лечения
Для того, чтобы лечить воспалительный ответ, опосредованный AT1R, или воспалительный ответ, вызванный недостаточной активацией AT2R, и/или проявляющихся от них симптомов, агонист NP-6AK вводится любым путем, который позволит обеспечить доставку активного агента в пораженные клетки. В некоторых вариантах осуществления настоящего изобретения введение является подкожным, внутримышечным или внутрибрюшинным, но может также осуществляться путем ингаляции, внутриартериального, внутривенного, внутрикожного, местного, перорального, парентерального, интравентрикулярного или внутричерепного введения. В соответствии с другим вариантом, активный агент может быть доставлен локально в систему или пораженные клетки любым подходящим способом.
При терапевтических воздействиях по настоящему изобретению терапевтически эффективное количество фармацевтической композиции вводят пациенту, относящемуся к млекопитающим. В контексте данного документа, термин «терапевтически эффективное количество» означает количество, достаточное для уменьшения, по меньшей мере, на 15 процентов, предпочтительно, по меньшей мере, на 50 процентов, более предпочтительно, по меньшей мере, на 90 процентов и, наиболее предпочтительно, фактического устранения или предотвращения клинически значимого показателя или дефицита активности, функционального состояния и реакции пациента. В частности, терапевтически эффективное количество вызовет один или несколько из следующих факторов: снижение активации AT1R, увеличение активации AT2R; снижение уровней кортизола; стабилизирование уровней инсулина; снижение уровней провоспалительных цитокинов, снижение уровней провоспалительных интерлейкинов, повышение функции дофаминергических нейронов, снижение активности реактивных форм кислорода, снижение секреции слизи или снижение, или увеличение любых других соответствующих маркеров, как обсуждалось в контексте данного документа, или которые могут быть известны специалисту в данной области техники, поскольку это касается кистозного фиброза (КФ), сахарного диабета, метаболического синдрома X; гипергликемии, аутизма, болезни Альцгеймера, воспаления или ракового заболевания. Частота и дозировка терапии может быть оттитрована дежурным врачом или ветеринаром, используя стандартные методы доза-ответ, которые хорошо известны в данной области техники.
Фармацевтические составы
Жидкие формы, такие как лосьоны, подходящие для местного введения или для косметического применения, могут включать подходящую водную или неводную несущую среду с буферами, суспендирующими и дозирующими агентами, загустителями, усилителями проникновения и тому подобным. Твердые формы, такие как кремы или пасты, или тому подобное, могут включать, например, любой из следующих ингредиентов: воду, масло, спирт или жир в качестве субстрата с поверхностно-активным веществом, полимеры, такие как полиэтиленгликоль, загустители, твердые вещества и тому подобное. Жидкие или твердые составы могут включать улучшенные технологии доставки, такие как липосомы, микросомы, микрогубки и тому подобное.
Вышеописанные компоненты для жидких, полутвердых и твердых локальных композиций являются исключительно репрезентативными. Другие материалы, а также технологии изготовления и тому подобное изложены в части 8 книги «Remington's Pharmaceutical Sciences», 17-е изд., 1985, издательство «Mack Publishing Company», Истон, штат Пенсильвания, США, которая включена в данный документ путем ссылки.
Когда фармацевтические композиции вводят трансдермально, их обычно используют в виде жидких растворов или гелей. В данных условиях концентрация агонистов по настоящему изобретению находится в пределах от примерно 0,1% до примерно 20% и, предпочтительно, от примерно 0,1% до примерно 10% композиции, остальная часть представляет собой смешанную водную или неводную несущую среду, такую как спирты и тому подобное, суспендирующие агенты, гелеобразующие агенты, поверхностно-активные вещества и тому подобное. Примеры подобных подходящих материалов описаны ниже.
Композиции, содержащие агонист, по настоящему изобретению, также могут быть введены в трансдермальных формах с пролонгированным высвобождением или в составе трансдермальных систем доставки лекарственных средств с пролонгированным высвобождением. Описание репрезентативных материалов с пролонгированным высвобождением можно найти в используемых материалах книги «Remington's Pharmaceutical Sciences», см. выше.
Композиции агониста для системного введения включают композиции для перорального введения, то есть жидкости и твердые вещества, и композиции для инъекций.
Композиции для перорального введения могут принимать форму стерильных жидких растворов или суспензий, или стерильных порошков. Однако чаще всего композиции представлены в единичных лекарственных формах для облегчения точного дозирования. Термин «единичные лекарственные формы» относится к физически дискретным единицам, подходящим в качестве единичных доз для людей и других млекопитающих, причем каждая единица содержит предопределенное количество активного вещества, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с подходящим фармацевтическим растворителем. Типичные единичные лекарственные формы включают профилированные, предварительно отмеренные ампулы или шприцы жидких композиций, или пилюли, таблетки, капсулы или тому подобное, в случае твердых композиций. Согласно одному варианту осуществления настоящего изобретения, композиция для агонистов обычно представляет собой микрокомпонент (примерно 0,01 до примерно 20 мас.% или, предпочтительно, примерно от 0,1 до примерно 15 мас.%), остальная часть представляет собой различные несущие среды или носители и технологические вспомогательные вещества, способствующие формированию желаемой формы дозирования.
Жидкие формы, подходящие для перорального введения, могут включать подходящую водную или неводную несущую среду с буферами, суспендирующими и дозирующими агентами, красителями, ароматизаторами и тому подобным. Твердые формы могут включать, например, любой из следующих ингредиентов или соединений аналогичной природы, включая связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; растворитель, такой как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; глидант, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как перечная мята, метилсалицилат или апельсиновый ароматизатор.
В соответствии с другим вариантом осуществления настоящего изобретения, инъекционные композиции обычно основаны на инъекционном стерильном физиологическом растворе или фосфатно-солевом буферном растворе, или других инъекционных носителях, известных в данной области техники. Соединение в таких композициях по настоящему изобретению обычно представляет собой микрокомпонент, примерно 0,1-30 мас.%, остальная часть представляет собой инъекционный носитель и тому подобное.
Вышеописанные компоненты для перорально вводимых или инъецируемых композиций являются исключительно репрезентативными. Другие материалы, а также технологии изготовления и тому подобное изложены в упомянутой выше части книги «Remington's Pharmaceutical Sciences».
ПРИМЕРЫ
Согласно настоящему изобретению, если NP-6AK являются агонистами, включая полипептиды, включающие в себя, состоящие из, или состоящие по существу из любой из последовательностей Lys-Pro-Leu-Lys-Pro-Trp; Lys-3Hyp-Leu-Lys-Pro-Trp; Lys-4Hyp-Leu-Lys-Pro-Trp; Lys-Pro-Ile-Lys-Pro-Trp; Lys-3Hyp-Ile-Lys-Pro-Trp; Lys-4Hyp-Ile-Lys-Pro-Trp; Lys-Pro-Leu-Lys-3Hyp-Trp; Lys-3Hyp-Leu-Lys-3Hyp-Trp; Lys-4Hyp-Leu-Lys-3Hyp-Trp; Lys-Pro-Ile-Lys-3Hyp-Trp; Lys-3Hyp-Ile-Lys-3Hyp-Trp; Lys-4Hyp-Ile-Lys-3Hyp-Trp; Lys-Pro-Leu-Lys-4Hyp-Trp; Lys-3Hyp-Leu-Lys-4Hyp-Trp; Lys-4Hyp-Leu-Lys-4Hyp-Trp; Lys-Pro-Ile-Lys-4Hyp-Trp; Lys-3Hyp-Ile-Lys-4Hyp-Trp; и Lys-4Hyp-Ile-Lys-4Hyp-Trp, то могут быть протестированы на различных клеточных системах для демонстрации активности агониста AT2R и эффективности способов, описанных в данном документе.
Таким образом, агонист NP-6AK, содержащий последовательность Lys-Pro-Leu-Lys-Pro-Trp, способствовал выживаемости клеток параллельно мышиных HL-1 кардиомиоцитов и гладких сосудистых мышечных клеток человека, действуя через активацию AT2R. Жизнеспособность клеток оценивали путем измерения митотического индекса клеток (МИ) с использованием клеточного анализатора «Xcelligence™» (Westburg BV, Leusden, Нидерланды) в режиме реального времени для количественного определения эффекта различных методов воздействия на жизнеспособность, адгезию и пролиферацию клеток. Клеточные линии, обработанные агонистом NP-6AK (300 нМ), продемонстрировали значительно более высокую выживаемость и большую пролиферацию, чем те, которые были обработаны CGP42112A (300 нМ) (Sigma-Aldrich, Co. LLC, США, Сент-Луис, Миссури), частичным агонистом AT2R. CGP42112A и агонист NP-6AK (300 нМ) увеличивали МИ клеток HL-1, культивируемых без сыворотки, в порядке CGP42112A (≥14%), NP-6AK (≥25%). Увеличение МИ является прямым эффектом активации AT2R. Это было подтверждено добавлением антагониста AT2R, PD123319 (Sigma-Aldrich, Co. LLC, США, Сент-Луис, Миссури). В присутствии данного антагониста жизнеспособность клеток, в ином случае наблюдаемая с использованием агониста NP-6AK, отсутствовала.
Агонист NP-6AK повышающе регулировал MCL-1, избирательно активируя AT2R параллельно нескольких линий клеток. Этот эффект наблюдался в кардиомиоцитах, сосудистых гладких мышечных клетках человека, клетках SH-SY5Y (ATCC, США, Манассас, Виргиния) и нейронных клетках PC-12 (ATCC, США, Манассас, Виргиния) в условиях сывороточного голодания и/или токсичности сыворотки. При инкубировании с агонистом NP-6AK в концентрации 300 нМ, кардиомиоциты проявляли экспрессию MCL-1 на 45% выше, тогда как гладкие сосудистые мышечные клетки человека проявляли экспрессию MCL-1 на 22% выше (Фигура 1). Когда какая-либо из данных клеточных линий была предварительно обработана антагонистом AT2R, таким как PD123319, повышающее регулирование MCL-1 не наблюдалось, подразумевая, что активация AT2R NP-6AK необходима для регуляции MCL-1. Клетки, обработанные агонистом NP-6AK, генерировали более высокое повышающее регулирование MCL-1 по сравнению с теми клетками, которые обрабатывались частичным агонистом, таким как CGP42112A.
Линия клеток SH-SY5Y представляет собой линию нейронных клеток с дофаминергическими и адренергическими рецепторами. Когда данная клеточная линия обрабатывалась рапамицином, экспрессия MCL-1 снижалась. Добавление агониста NP-6AK к данной клеточной линии после воздействия рапамицином было способно восстанавливать экспрессию MCL-1. Когда был добавлен только агонист NP-6AK с концентрацией 300 нМ, данные клетки отображали 2-кратное увеличение экспрессии MCL-1. См. Фигуру 2.
Сывороточное голодание уменьшало жизнеспособность клеток SH-SY5Y и клеток PC-12. Когда данные клеточные линии были обработаны агонистом NP-6AK, они имели более высокую степень жизнеспособности и демонстрировали повышенную экспрессию MCL-1 и удлинение аксонов. См. Фигуру 3. Когда клетки PC-12 обрабатывали антагонистом AT2R PD123319, защитные эффекты агониста NP-6AK были потеряны, что указывает на то, что прямое действие агониста NP-6AK происходит через активацию AT2R. Обработка данной клеточной линии 300 нМ агониста NP-6AK привела к повышению жизнеспособности клеток более чем на 30% по сравнению с обработкой нативным лигандом AT2R АТ II (300 нМ). Относительно обработки 300 нМ CGP42112A, клетки, обработанные агонистом NP-6AK, демонстрировали увеличение жизнеспособности более чем на 70%. Воздействие АТ II или CGP42112A было более негативным по сравнению с результатами, полученными при обработке клеток антагонистом AT2R PD123319. Активация АТ2R агонистом NP-6AK способствует жизнеспособности клеток, тогда как активация AT2R другими лигандами вредна для него. Данные результаты оценивали с использованием MTS-анализа пролиферации клеток (Biovision Inc., США, Милпитас, Калифорния).
Ex vivo нейроны получали и обрабатывали агонистом NP-6AK в разных условиях для оценки нейропротекторных свойств. Нормальные первичные мышиные эмбриональные кортикальные нейроны в культуре (14 сут in vitro) были намеренно лишены питательных веществ с помощью инкубирования в среде Локка без глюкозы (Schnapf и др., 1990). Затем данные культуры дополняли 300 нМ агониста NP-6AK или инкубировали без агониста NP-6AK. Культуры, которые были дополнены 300 нм агониста NP-6AK, демонстрировали увеличение активности на 60% (p<0,05) по сравнению с отрицательным контролем. См. Фигуру 4.
Тучных крыс Цукера (ZO) (Charles River Laboratories, Inc., США, Уилмингтон, Массачусетс), диабетическую животную модель с признаками сердечно-сосудистых заболеваний, лечили в течение 2 нед (доза 0,9 мг/кг/д) с помощью подкожной инъекции NP-6AK и оценивали по нескольким маркерам сердечно-сосудистого состояния, включая маркеры крови и структурные параметры сердца. Контролями был ZO крысы, которые получали физиологический раствор. Профили плазмы и мочи, полученные натощак, показали, что животные, получающие агонист NP-6AK, имели пониженные триглицериды (~50%), белок мочи (~68%), пониженную N-ацетил-бета-А-глюкозаминидазу мочи (~60%) и повышенный в среднем на 12% ЛПВП. Эхокардиография, проведенная с использованием платформы «Vevo® 2100» (VisualSonics, США, Торонто, Онтарио, Калифорния), показала, что животные, подвергнутые воздействию агонистом NP-6AK, имели улучшенные структурные параметры сердца, включая периферическую деформацию эндокарда (вид короткой оси) и индекс производительности миокарда (MPI) (p≤0,005), и E/E'-соотношение (p≤0,002), сильный предиктор первичных кардиальных событий. См. Таблицу 1.
ТАБЛИЦА 1
Несмотря на то, что настоящее изобретение было подробно описано с особой ссылкой на данные предпочтительные варианты осуществления изобретения, другие варианты осуществления изобретения могут достичь аналогичных результатов. Вариации и модификации настоящего изобретения будут очевидны для специалистов в данной области техники, при этом изобретение предназначено для охвата в прилагаемой формуле изобретения всех таких модификаций и эквивалентов. Полное раскрытие всех ссылок, заявок, патентов и публикаций, цитируемых в данном документе, включено в настоящее описание посредством перечня ссылочных документов.
ПЕРЕЧЕНЬ ССЫЛОЧНЫХ ДОКУМЕНТОВ
1. Kalupahana and Moustaid-Moussa (2012), ʺThe renin-angiotensin system: a link between obesity, inflammation and insulin resistance,ʺ Obes. Rev. 13(2):136-49.
2. Santos et al. (2014), ʺThe Therapeutic Role of Renin-Angiotensin System Blockers in Obesity-Related Renal Disorders,ʺ Curr. Clin. Pharmacol. 9(1):2-9.
3. Saavedra et al. (2011), ʺBlockade of brain angiotensin II AT1 receptors ameliorates stress, anxiety, brain inflammation and ischemia: Therapeutic implications,ʺ Psychoneuroendocrinology 36(1):1-18.
4. Herr et al. (2008), ʺPotential role of Renin-Angiotensin-system for tumor angiogenesis in receptor negative breast cancer,ʺ Gynecol. Oncol. 109:418-25.
5. Kintscher et al. (2009), ʺInhibiting angiotensin type 1 receptors as a target for diabetes,ʺ Expert Opin. Ther. Targets 10:1257-63.
6. Vinson et al. (2012), ʺThe renin-angiotensin system in the breast and breast cancer,ʺ Endocr. Relat. Cancer 19(1):R1-19.
7. Steckelings et al. (2012), ʺAT2 receptor agonists: hypertension and beyond,ʺ Curr. Opin. Nephrol. Hypertens. 21(2):142-6.
8. McCarthy et al. (2009), ʺAngiotensin AT2 receptor stimulation causes neuroprotection in a conscious rat model of stroke,ʺ Stroke 40:1482-9.
9. Ferreira et al. (2010), ʺTherapeutic implications of the vasoprotective axis of the renin-angiotensin system in cardiovascular diseases,ʺ Hypertension 55(2):207-13.
10. Doi et al. (2010), ʺAngiotensin II type 2 receptor signaling significantly attenuates growth of murine pancreatic carcinoma grafts in syngeneic mice,ʺ BMC Cancer 10:67.
11. Pickel et al. (2010), ʺOverexpression of angiotensin II type 2 receptor gene induces cell death in lung adenocarcinoma cells,ʺ Cancer Biol. Ther. 9(4):277-85.
12. Brown et al. (2006), ʺAT2 receptor stimulation may halt progression of pheochromocytoma,ʺ Ann. N.Y. Acad. Sci. 1073:436-43.
13. Adachi et al. (2003), ʺAngiotensin II type 2 receptor deficiency exacerbates heart failure and reduces survival after acute myocardial infarction in mice,ʺ Circulation.107:2406-8.
14. Ohinata et al. (2009), ʺOrally administered novokinin, an angiotensin AT2 receptor agonist, suppresses food intake via prostaglandin E2-dependent mechanism in mice,ʺ Peptides 30:1105-8.
15. Unger and Dahlöf (2010), ʺCompound 21, the first orally active, selective agonist of the angiotensin II type 2 (AT2) receptor: implications for AT2 receptor research and therapeutic potential,ʺ J. Renin Angiotensin Aldosterone Syst.11:75-7.
16. Qi et al. (2012), ʺModerate cardiac-selective overexpression of angiotensin II type 2 receptor protects cardiac functions from ischaemic injury,ʺ Exp. Physiol. 97:89-101.
17. Oishi et al. (2006), ʺAT2 receptor mediates the cardioprotective effects of AT1 receptor antagonist in post-myocardial infarction remodeling, Life Sci. 80(1):82-8.
18. Carey et al. (2000), ʺRole of the Angiotensin Type 2 Receptor in the Regulation of Blood Pressure and Renal Function,ʺ Hypertension 35(1):155-163.
19. Ohinata et al. (2009), ʺOrally administered novokinin, an angiotensin AT2 receptor agonist, suppresses food intake via prostaglandin E2-dependent mechanism in mice,ʺ Peptides 30:1105-1108.
20. Guimond and Gallo-Payet (2012), ʺHow does angiotensin AT(2) receptor activation help neuronal differentiation and improve neuronal pathological situations?ʺ Front Endocrinol. (Lausanne) 3:164.
21. Siragy and Carey (1997), ʺThe subtype 2 (AT2) angiotensin receptor mediates renal production of nitric oxide in conscious rats, J. Clin. Invest. 100:264-269.
22. Widdop et al. (2002), ʺAT2 receptor-mediated relaxation is preserved after long-term AT1 receptor blockade,ʺ Hypertension 40:516-520.
23. Yayama et al. (2006), ʺAngiotensin II stimulates endothelial NO synthase phosphorylation in thoracic aorta of mice with abdominal aortic banding via type-2 receptor,ʺ Hypertension 48:958-964.
24. Rodrigues-Ferreira and Nahmias (2010), ʺAn atypical family of angiotensin II AT2 receptor-interacting proteins,ʺ Trends Endocrinol. Metab. 21:684-690.
25. Knowle et al. (2000), ʺIdentification of an interaction between the angiotensin II receptor sub-type AT2 and the ErbB3 receptor, a member of the epidermal growth factor receptor family,ʺ Regul. Pept. 87(1-3):73-82.
26. Pulakat et al. (2005), ʺLigand-dependent complex formation between the Angiotensin II receptor subtype AT2 and Na+/H+ exchanger NHE6 in mammalian cells,ʺ Peptides 26(5):863-73.
27. Yamada et al. (1996), ʺAngiotensin II type 2 receptor mediates programmed cell death,ʺ Proc. Natl. Acad. Sci. (USA) 93(1):156-60.
28. Lehtonen et al. (1999), ʺAnalysis of functional domains of angiotensin II type 2 receptor involved in apoptosis,ʺ Mol. Endocrinol. 13(7):1051-60.
29. Pulakat et al. (2005), ʺRoles of the intracellular regions of angiotensin II receptor AT2 in mediating reduction of intracellular cGMP levels,ʺ Cell Signal. 17(3):395-404.
30. Pulakat et al. (2002), ʺRole of C-terminal cytoplasmic domain of the AT2 receptor in ligand binding and signaling,ʺ FEBS Lett. 524(1-3):73-8.
31. Gendron et al. (2003), ʺThe angiotensin type 2 receptor of angiotensin II and neuronal differentiation: from observations to mechanisms,ʺ J. Mol. Endocrinol. 31(3):359-72.
32. Rodriguez-Pallares et al. (2004), ʺAngiotensin II increases differentiation of dopaminergic neurons from mesencephalic precursors via angiotensin type 2 receptors,ʺ Eur. J. Neurosci. 20(6):1489-98.
33. Zawada et al. (2005), ʺAngiotensin II protects cultured midbrain dopaminergic neurons against rotenone-induced cell death,ʺ Brain Res. 1045(1-2):64-71.
34. Mendelsohn et al. (1988), ʺLocalization of angiotensin II receptor binding in rabbit brain by in vitro autoradiography,ʺ J. Comp. Neurol. 270:372-384.
35. Unger et al. (1988), ʺBrain angiotensin: pathways and pharmacology,ʺ Circulation 77(60):I40-54.
36. Severs and Daniels-Severs (1973), ʺE'ects of angiotensin on the central nervous system,ʺ Pharmacol. Rev. 25:415-449.
37. Phillips (1987), ʺFunctions of angiotensin in the central nervous system,ʺ Ann. Rev. Physiol. 49:413-435.
38. Nuyt et al. (1999), ʺOntogeny of angiotensin II type 2 receptor mRNA expression in fetal and neonatal rat brain,ʺ J. Comp. Neurol. 407:193-206
39. Song et al. (1992), ʺMapping of angiotensin II receptor subtype heterogeneity in rat brain,ʺ J. Comp. Neurol. 316:467-484.
40. Lenkei et al. (1996), ʺDistribution of angiotensin II type-2 receptor (AT2) mRNA expression in the adult rat brain,ʺ J. Comp. Neurol. 373:322-339.
41. Lenkei et al. (1997), ʺExpression of angiotensin type-1 (AT1) and type-2 (AT2) receptor mRNAs in the adult rat brain: a functional neuroanatomical review,ʺ Front. Neuroendocrinol. 18:383-439.
42. Bottari et al. (1992), ʺCharacterization and distribution of angiotensin II binding sites in fetal and neonatal astrocytes from di'erent rat brain regions,ʺ Brain Res. 585:372-376.A.
43. Okamura et al. (1999), ʺUpregulation of renin-angiotensin system during differentiation of monocytes to macrophages,ʺ J. Hypertens. 17(4):537-545.
44. Nahmod et al. (2003), ʺControl of dendritic cell differentiation by angiotensin II,ʺ FASEB J. 17(3):491-493.
45. Iwanami et al. (2011), ʺEffect of angiotensin II type 2 receptor deletion in hematopoietic cells on brain ischemia-reperfusion injury,ʺ Hypertension 58(3):404-409.
46. Borlongan et al. (2011), ʺThe great migration of bone marrow-derived stem cells toward the ischemic brain: therapeutic implications for stroke and other neurological disorders,ʺ Prog. Neurobiol. 95(2):213-228.
47. Padia et al. (2012), ʺMechanisms of dopamine D(1) and angiotensin type 2 receptor interaction in natriuresis,ʺ Hypertension 59(2):437-45.
48. Namsolleck et al. (2013), ʺAT2-receptor stimulation enhances axonal plasticity after spinal cord injury by upregulating BDNF expression,ʺ Neurobiol Dis. 51:177-91.
49. Guimond et al. (2013), ʺExpression and role of the angiotensin II AT2 receptor in human prostate tissue: in search of a new therapeutic option for prostate cancer.ʺ The Prostate 73(10):1057-1068.
50. Wruck et al. (2005), ʺRegulation of transport of the angiotensin AT2 receptor by a novel membrane-associated Golgi protein,ʺ Arterioscler. Thromb. Vasc. Biol. 25(1):57-64.
51. Libby et al. (2002), ʺInflammation and Atherosclerosis,ʺ Circulation 105(9):1135-1143.
52. LaMarca (2011), ʺHypertension in Response to IL-6 During Pregnancy: Role of AT1-receptor Activation.ʺ Int. J. Interferon Cytokine Mediator Res. 2011(3):65-70.
53. Mitra et al. (2010), ʺAngiotensin II-induced Upregulation of AT1-receptor Expression: Sequential Activation of NFkB and Elk-1 in Neurons.ʺ Am. J. Physiol. Cell Physiol. 299(3):C561-9.
54. Mizushima et al. (2010), ʺBlockage of Angiotensin II Type 1 Receptor Regulates TNF-α-induced MAdCAM-1 Expression via Inhibition of NF-κB Translocation to the Nucleus and Ameliorates Colitis.ʺ Am. J. Physiol. Gastrointest. Liver Physiol. 298(2):G255-G266.
55. Dronavalli et al. (2008), ʺThe pathogenesis of diabetic nephropathy.ʺ Nat. Clin. Pract. Endocrinol. Metab. 4(8):444-452.
56. Parving et al. (2012), ʺCardiorenal End Points in a Trial of Aliskiren for Type 2 Diabetes.ʺ New Eng. J. Med. 367(23):2204-2213.
57. Harel et al. (2012), ʺThe Effect of Combination Treatment with Aliskiren and Blockers of the Renin-angiotensin System on Hyperkalaemia and Acute Kidney Injury: Systematic Review and Meta-analysis.ʺ BMJ 344(1):e42-e42.
58. Liebson and Amsterdam (2009), ʺOngoing Telmisartan Alone and in Combination With Ramipril Global Endpoint Trial (ONTARGET): Implications for Reduced Cardiovascular Risk.ʺ Prev. Cardiol. 12(1):43-50.
59. Unger (2003), ʺThe Ongoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial Program,ʺ Am. J. Cardiol. 91(10A):28G-34G.
60. Hook et al. (2005), ʺThe Proteolytic Stability of 'Designed' Beta-peptides Containing Alpha-peptide-bond Mimics and of Mixed Alpha,beta-peptides: Application to the Construction of MHC-binding Peptides,ʺ Chem. Biodivers. 2(5):591-632.
61. Remington's Pharmaceutical Sciences (18th Ed., E. W. Martin (ed.), Mack Publishing Co., Easton, Pa.
62. Abadir et al. (2011), ʺIdentification and Characterization of a Functional Mitochondrial Angiotensin System,ʺ Proc. Natl. Acad. Sci. (USA) 108(36):14849-14854.
63. Thathiah and De Strooper (2011), ʺThe Role of G Protein-coupled Receptors in the Pathology of Alzheimer's Disease,ʺ Nat. Rev. Neurosci. 12(2):73-87.
64. Abdalla et al. (2009), ʺAngiotensin II AT2 Receptor Oligomers Mediate G-protein Dysfunction in an Animal Model of Alzheimer Disease,ʺ J. Biol. Chem. 284(10):6554-6565.
65. Kurihara et al. (2006), ʺNeuroprotective Effects of Angiotensin II Type 1 Receptor (AT1R) Blocker, Telmisartan, via Modulating AT1R and AT2R Signaling in Retinal Inflammation,ʺ Invest. Ophthalmol. Vis. Sci. 47(12):5545-5552.
66. Benigni et al. (2009), ʺDisruption of the Ang II Type 1 Receptor Promotes Longevity in Mice,ʺ J. Clin. Invest. 119(3):524-530.
67. Weir et al. (2012), ʺCNS SIRT3 Expression Is Altered by Reactive Oxygen Species and in Alzheimer's Disease,ʺ PLoS ONE 7(11):e48225.
68. Deane et al. (2013), ʺEnhanced recruitment of endosomal Na+/H+ exchanger NHE6 into Dendritic spines of hippocampal pyramidal neurons during NMDA receptor-dependent long-term potentiation.ʺ J. Neurosci. 33(2):595-610.
69. Schwede et al. (2013), ʺGenes for Endosomal NHE6 and NHE9 Are Misregulated in Autism Brains,ʺ Mol. Psychiatry 19(3):277-9.
70. Xinhan et al. (2011), ʺNa+/H+ Exchanger Isoform 6 (NHE6/SLC9A6) Is Involved in Clathrin-dependent Endocytosis of Transferrin,ʺ Am. J. Physiol. Cell Physiol. 301(6):C1431-C1444.
71. Kumar et al. (2002), ʺIdentification of the Region of AT2 Receptor Needed for Inhibition of the AT1 Receptor-mediated Inositol 1,4,5-triphosphate Generation.ʺ FEBS Lett. 532(3):379-86.
72. Hetrick et al. (2008), ʺLigand mediated protein-protein interaction between the angiotensin receptor type AT1 and the human NHE6 isoform." FASEB J. 22:726.5.
73. Gul et al. (2012), ʺRAS-Mediated Adaptive Mechanisms in Cardiovascular Tissues: Confounding Factors of RAS Blockade Therapy and Alternative Approaches,ʺ Cardiorenal Med. 2(4):268-280.
74. Shieh et al. (2009), ʺModification of alternative splicing of Mcl-1 pre-mRNA using antisense morpholino oligonucleotides induces apoptosis in basal cell carcinoma cells,ʺ J. Invest. Dermatol. 129(10):2497-506.
75. Bae et al. (2000), ʺMCL-1S, a splicing variant of the antiapoptotic BCL-2 family member MCL-1, encodes a proapoptotic protein possessing only the BH3 domain,ʺ J. Biol. Chem. 275(33):25255-61.
76. Yang et al. (1996), ʺMCL-1, a member of the BLC-2 family, is induced rapidly in response to signals for cell differentiation or death, but not to signals for cell proliferation,ʺ J. Cell Physiol. 166(3):523-36.
77. Thomas et al. (2010), ʺMcl-1: the molecular regulation of protein function,ʺ FEBS Lett. 584(14):2981-9.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NOVOPYXIS INC.
<120> КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ МОДУЛЯЦИИ АКТИВНОСТИ AT2R
<130> 2209352.00122WO1
<140> PCT/US2015/061597
<141> 2015-11-19
<150> 62/081,839
<151> 2014-11-19
<160> 21
<170> PatentIn version 3.5
<210> 1
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Pro, 3Hyp or 4Hyp
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Leu or Ile
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Pro, 3Hyp or 4Hyp
<400> 1
Lys Xaa Xaa Lys Xaa Trp
1 5
<210> 2
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<400> 2
Lys Pro Leu Lys Pro Trp
1 5
<210> 3
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 3Hyp
<400> 3
Lys Xaa Leu Lys Pro Trp
1 5
<210> 4
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 4Hyp
<400> 4
Lys Xaa Leu Lys Pro Trp
1 5
<210> 5
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<400> 5
Lys Pro Ile Lys Pro Trp
1 5
<210> 6
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 3Hyp
<400> 6
Lys Xaa Ile Lys Pro Trp
1 5
<210> 7
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 4Hyp
<400> 7
Lys Xaa Ile Lys Pro Trp
1 5
<210> 8
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 3Hyp
<400> 8
Lys Pro Leu Lys Xaa Trp
1 5
<210> 9
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 3Hyp
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 3Hyp
<400> 9
Lys Xaa Leu Lys Xaa Trp
1 5
<210> 10
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 4Hyp
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 3Hyp
<400> 10
Lys Xaa Leu Lys Xaa Trp
1 5
<210> 11
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 3Hyp
<400> 11
Lys Pro Ile Lys Xaa Trp
1 5
<210> 12
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 3Hyp
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 3Hyp
<400> 12
Lys Xaa Ile Lys Xaa Trp
1 5
<210> 13
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 4Hyp
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 3Hyp
<400> 13
Lys Xaa Ile Lys Xaa Trp
1 5
<210> 14
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 4Hyp
<400> 14
Lys Pro Leu Lys Xaa Trp
1 5
<210> 15
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 3Hyp
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 4Hyp
<400> 15
Lys Xaa Leu Lys Xaa Trp
1 5
<210> 16
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 4Hyp
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 4Hyp
<400> 16
Lys Xaa Leu Lys Xaa Trp
1 5
<210> 17
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 4Hyp
<400> 17
Lys Pro Ile Lys Xaa Trp
1 5
<210> 18
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 3Hyp
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 4Hyp
<400> 18
Lys Xaa Ile Lys Xaa Trp
1 5
<210> 19
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 4Hyp
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 4Hyp
<400> 19
Lys Xaa Ile Lys Xaa Trp
1 5
<210> 20
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Leu or Ile
<220>
<221> MOD_RES
<222> (5)..(5)
<223> 3Hyp or 4Hyp
<400> 20
Lys Pro Xaa Lys Xaa Trp
1 5
<210> 21
<211> 6
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Описание Искусственной Последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> 3Hyp or 4Hyp
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Leu or Ile
<400> 21
Lys Xaa Xaa Lys Pro Trp
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ-АГОНИСТЫ GIP И СПОСОБЫ | 2015 |
|
RU2716985C2 |
| СПОСОБЫ ДОСТАВКИ НЕЙРОПРОТЕКТИВНОГО ПОЛИПЕПТИДА В ЦЕНТРАЛЬНУЮ НЕРВНУЮ СИСТЕМУ | 2017 |
|
RU2790566C2 |
| АНТИ-TIGIT АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2817838C2 |
| АНТИ-TIGIT АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2732591C2 |
| Модифицированные аналоги GIP пептида | 2019 |
|
RU2817673C2 |
| КОНСТРУКЦИИ, ИМЕЮЩИЕ SIRP-АЛЬФА ДОМЕН ИЛИ ЕГО ВАРИАНТ | 2016 |
|
RU2740672C2 |
| АГОНИСТЫ И АНТАГОНИСТЫ ГИБРИДНОГО РЕЦЕПТОРА IL-1 I ТИПА | 2011 |
|
RU2754957C2 |
| ЛЕЧЕНИЕ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2755997C2 |
| АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2788095C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ РАССТРОЙСТВ | 2014 |
|
RU2763796C2 |
Изобретение относится к области биотехнологии, конкретно к пептидным агонистам рецептора ангиотензина II 2-го типа (AT2R), и может быть использовано для лечения диабета, сердечно-сосудистых заболеваний, метаболического синдрома и гипертензии. Предложены фармацевтические композиции на основе полипептида формулы: A1-A2-A3-A4-A5-A6, где: A1 представляет собой Lys, A2 представляет собой Pro, 3Hyp или 4Hyp, A3 представляет собой Leu или Ile, A4 представляет собой Lys, A5 представляет собой Pro, 3Hyp или 4Hyp и A6 представляет собой Trp. Изобретение обеспечивает эффективное лечение заболеваний, характеризующихся недостаточной активностью AT2R или чрезмерной активностью рецептора ангиотензина II 1-го типа (AT1R). 2 н. и 2 з.п. ф-лы, 4 ил., 1 табл., 1 пр.
1. Фармацевтическая композиция для лечения заболевания, состояния или расстройства, характеризующегося недостаточной активностью рецептора ангиотензина II 2-го типа (AT2R), содержащая эффективное количество полипептида и фармацевтически приемлемый носитель,
где полипептид содержит аминокислотную последовательность, которая соответствует формуле:
A1-A2-A3-A4-A5-A6,
где:
A1 представляет собой Lys,
A2 представляет собой Pro, 3Hyp или 4Hyp,
A3 представляет собой Leu или Ile,
A4 представляет собой Lys,
A5 представляет собой Pro, 3Hyp или 4Hyp, и
A6 представляет собой Trp,
где заболевание, состояние или расстройство включает диабет, сердечно-сосудистое заболевание, метаболический синдром и гипертензию,
и где полипептид обладает активностью агониста AT2R при введении в клетку, экспрессирующую рецептор AT2R.
2. Фармацевтическая композиция для лечения заболевания, состояния или расстройства, характеризующегося чрезмерной активностью рецептора ангиотензина II 1-го типа (AT1R), содержащая эффективное количество полипептида и фармацевтически приемлемый носитель,
где полипептид содержит аминокислотную последовательность, которая соответствует формуле:
A1-A2-A3-A4-A5-A6,
где:
A1 представляет собой Lys,
A2 представляет собой Pro, 3Hyp или 4Hyp,
A3 представляет собой Leu или Ile,
A4 представляет собой Lys,
A5 представляет собой Pro, 3Hyp или 4Hyp, и
A6 представляет собой Trp,
где заболевание, состояние или расстройство включает диабет, сердечно-сосудистое заболевание, метаболический синдром и гипертензию,
и где полипептид обладает активностью агониста AT2R при введении в клетку, экспрессирующую рецептор AT2R.
3. Фармацевтическая композиция по п.1 или 2, в которой:
если A2 представляет собой Pro, то A5 представляет собой 3Hyp или 4Hyp; или
если A5 представляет собой Pro, то A2 представляет собой 3Hyp или 4Hyp.
4. Фармацевтическая композиция по п.1 или 2, которая является лиофилизированной.
| WO 2013158628, 24.10.2013 | |||
| ALI et al., Chronic AT 2 receptor activation increases renal ACE2 activity, attenuates AT 1 receptor function and blood pressure in obese Zucker rats, Kidney International, 2013, v.84, n.5, p.931 - 939 | |||
| YAMADA Y | |||
| ET AL., Hypotensive activity of novokinin, a potent analogue of ovokinin(2-7), is mediated by angiotensin |
Авторы
Даты
2020-05-18—Публикация
2015-11-19—Подача