Изобретение относится к медицине, а именно медицинской генетике и оториноларингологии, в частности, выявлению наиболее распространенных в Якутии мутаций гена GJB2, обуславливающих аутосомно-рецессивную глухоту 1А типа (АРГ 1А).
Известны решения по выявлению мутаций в гене GJB2, обуславливающих наследственные нарушения слуха, например, способ выявления мутаций в гене GJB2, сопровождающихся развитием несиндромальной аутосомно-рецессивной глухоты (см. RU №2317547, кл. G01N 33/50, С12Q 1/68, опубл. 20.02.2008), позволяющий одновременно выявить три GJB2-мутации c.35delG (p.Gly12ValfsX2), с.167delT (p.Leu56ArgfsX26) и с.235delС (p.Leu79Cysfs), путем проведения мультиплексной полимеразной реакции. В данном случае, мутационная изменчивость может быть легко обнаружена по изменению длины фрагментов в один нуклеотид после электрофоретического разделения амплифицирующих участков ДНК с возможным содержанием данных делеций, без обработки продуктов полимеразной цепной реакции (ПЦР) эндонуклеазами рестрикции, что весьма упрощает методику детекции. Тем не менее, из представленных трех мутаций, варианты с.167delT и с.235delС не являются характерными в якутской популяции, поскольку ранее проведенный анализ спектра и частоты мутаций гена GJB2 у пациентов с врожденными нарушениями слуха из Якутии (n=393 из них n=363 неродственных) показал, что в спектре 8 выявленных патогенных вариантов (мутаций) данного гена, наиболее распространены три мутации (аллельная частота >1%): c.-23+1G>A (42.28%), с.35delG (5.92%) и c.109G>A (1.92%), на долю которых приходится 98% всех патогенных аллелей (51,10%) от числа исследованных хромосом неродственных пациентов. В исследованной выборке пациентов мутация с.167delT, которая является мажорной среди глухих евреев ашкенази, была выявлена только у одного русского пациента в гетерозиготном состоянии (0,13%, 1/726), а характерная для стран Центральной и Восточной Азии мутация с.235delС, ни среди пациентов, ни среди контрольной группы не была обнаружена (см. Анализ спектра и частоты GJB2-мутаций у пациентов с врожденными нарушениями слуха в Республике Саха (Якутия) / В.Г. Пшенникова, Н.А. Барашков, Ф.М. Терютин и др. // Мед. генетика. - 2015. - Т. 14. - №6 (156). - С. 10-2327; Spectrum and Frequency of the GJB2 Gene Pathogenic Variants in a Large Cohort of Patients with Hearing Impairment Living in a Subarctic Region of Russia (the Sakha Republic) / N.A. Barashkov, V.G. Pshennikova, O.L. Posukh et al // PLoS One. - 2016. - Vol. 11(5):e0156300. doi: 10.1371/journal.pone.0156300).
Известен способ детекции 17 мутаций генов GJB2 и GJB6 при наследственной несиндромальной глухоте (см. RU №2448163, кл. G01N 33/50, С12Q 1/68, опубл. 20.04.2012), при котором в диагностическую панель наследственной несиндромальной глухоты включает спектр из 17 аллельных вариантов гена GJB2 (из них c.71G>A, c.79G>A и c.341A>G не имеют клинического значения), где ПЦР-амплификацию участков генов GJB2 и GJB6 проводят в 8 реакционных смесях из 10 пар последовательностей олигонуклеотидов, что технически трудоемко и экономически затратно для его применения при рутинной ДНК-диагностике АРГ 1А в Якутии.
Способ одновременной диагностики наследственных заболеваний (см. RU №2627115, кл. G01N 33/50, С12Q 1/68, опубл. 03.08.2017) позволяет одновременно диагностировать пять наследственных заболеваний на основе использования биочипа с иммобилизованными на его поверхности олигонуклеотидными мишенями для детекции точковых мутаций локализованных в пяти генах, среди которых включена детекция мутации c.-23+1G>A в гене GJB2, ответственной за АРГ 1А. Способ осуществляется с учетом этнической принадлежности больных, поскольку состав мутаций для данного биочипа, оптимизирован и строго специфичен только для популяции якутов. Отметим, что при распределении пациентов с врожденными нарушениями слуха из Якутии по этнической принадлежности, наиболее частой GJB2-мутацией у пациентов якутов (n=296) была с.-23+1G>A (51,8%), второй - c.109G>А (2,3%), и третьей - c.35delG (1,6%). У русских пациентов (n=51) были выявлены также три частые GJB2-мутации: с.35delG (22,3%), с.-23+1G>A (5,3%) и c.313_326 del14 (2,1%). Однако, широкое внедрение в практику технологии биочипов сдерживается из-за дороговизны всего комплекса автоматизированного оборудования (и специальных роботов), необходимых для их производства и нанесения биологических макромолекул на платформу.
Задача, на решение которой направлено заявленное изобретение, является создание способа выявления наиболее распространенных в Якутии мутаций гена GJB2, обуславливающих аутосомно-рецессивную глухоту 1А типа.
Технический результат, получаемый при решении поставленной задачи, выражается в быстром и точном выявлении GJB2-мутаций, ответственных за 98% всех патогенных вариантов, обуславливающих аутосомно-рецессивную глухоту 1А типа в Якутии.
Для решения поставленной задачи, способ выявления наиболее распространенных в Якутии мутаций гена GJB2 c.-23+1G>A, с.35delG и c.109G>A, обуславливающих аутосомно-рецессивную глухоту 1А типа, отличается тем, что для проведения амплификации значимых GJB2-районов, содержащих данные мутации, используются следующие праймеры: c.-23+1G>A (F) - 5'-CCGGGAAGCTCTGAGGAC-3', (R) - 5'-GCAACCGCTCTGGGTCTC-3'; c.35delG (F) - 5'-ACTCAGGTGAACAAGCTACT-3', (R) - 5'-TCTTTCCAATGCTGGTGGAGTGTTTGTTCCCA-3' и c.109G>A (F) - 5'-TCTTTTCCAGAGCAAACCGCCCAGAG-3', (R) - 5'-TGCTCATCTCCCCACACCTCCTTTGCAGCGTCAA-3', с последующим проведением анализа полиморфизма длин рестрикционных фрагментов с использованием эндонуклеаз AsuHPI, Bsc4I, HindII.
Сопоставительный анализ признаков заявленного решения с признаками аналогов свидетельствует о соответствии заявленного решения критерию «новизна».
Совокупность признаков изобретения обеспечивает решение заявленной технической задачи, а именно, получение молекулярно-генетического способа выявления мутаций гена GJB2, обуславливающих аутосомно-рецессивную глухоту 1А типа, наиболее распространенных в Якутии.
Преимуществом предлагаемого способа перед существующими аналогами является то, что он позволяет рутинным способом быстро и точно выявить GJB2-мутации ответственных за 98% всех патогенных вариантов, обуславливающих аутосомно-рецессивную глухоту 1А типа в Якутии, который разработан на основе полученных результатов многолетних молекулярно-генетических исследований врожденных нарушений слуха в Якутии.
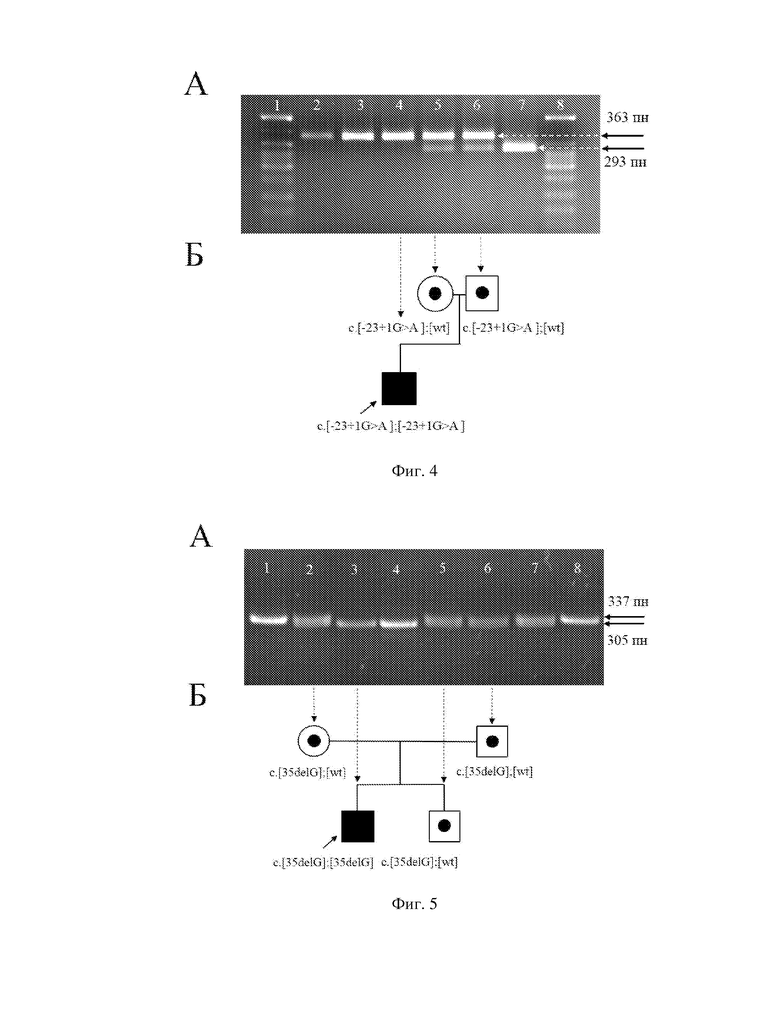
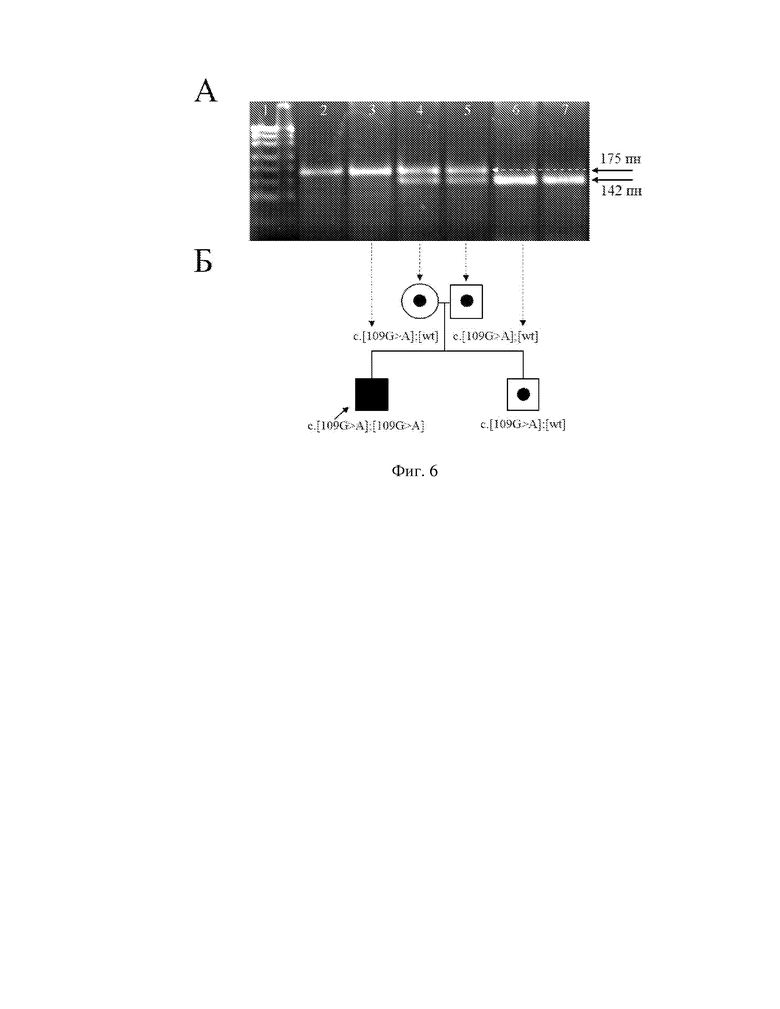
Заявляемое техническое решение иллюстрируется чертежами, где на фигуре 1 показана область перекрывания последовательности олигонуклеотидных праймеров для детекции мутации c.-23+1G>A (IVS1+1G>A) локализованной на сайте сплайсинга интронной области, прилежащей к экзону 1 гена GJB2. Рамками отмечены прямой и обратный олигодезоксинуклеотидные праймеры; на фигуре 2 - область перекрывания оригинальной последовательности олигонуклеотидных праймеров для детекции мутации c.35delG (p.Gly12ValfsX2) в экзоне 2 гена GJB2. Рамками отмечены прямой и обратный олигодезоксинуклеотидные праймеры. Внизу показана модификация обратного праймера, где пунктирной рамкой выделен нуклеотид тимин в 38 положении, заменяемый на гуанин для создания искусственного полиндромного участка сайта рестрикции эндонуклеазами Bsc4I; на фигуре 3 - область перекрывания оригинальной последовательности олигонуклеотидных праймеров для детекции c.109G>A (p.Val37Ile) в экзоне 2 гена GJB2. Рамками отмечены прямой и обратный олигодезоксинуклеотидные праймеры. Внизу показана модификация обратного праймера, где пунктирной рамкой выделены два нуклеотида тимин в 113 положении и последующий гуанин, заменяемые на аденин и цитозин, соответственно, для создания искусственного полиндромного участка сайта рестрикции эндонуклеазами HindII; на фигуре 4 - детекция мутации c.-23+1G>A (IVS1+1G>A) в интронной области прилежащей к экзону 1 гена GJB2. При этом, А - электрофореграмма ПЦР-ПДРФ анализа для детекции мутации c.-23+1G>A (4% агарозный гель). Дорожки: 1 и 8 - маркер молекулярного веса pUC19 DNA/MspI; 2 и 3 - контроль биаллельной (гомозиготной) c.-23+1G>A; 4 - пробанд; 5 - мать; 6 - отец; 7 - контроль без c.-23+1G>A. Б - родословная семьи пробанда с выявленными генотипами по мутации c.-23+1G>A. При наличии биаллельной c.-23+1G>A сайт рестрикции отсутствует - 363 пн; при наличии моноаллельной c.-23+1G>A присутствует наличие двух бэндов - 363 пн и 293 пн; при отсутствии c.-23+1G>A визуализируется один бэнд - 293 пн; на фигуре 5 - детекция мутации c.35delG (p.Gly12ValfsX2) гена GJB2. При этом, А - электрофореграмма ПЦР-ПДРФ анализа для детекции мутации c.35delG (10% полиакриламидный гель). Дорожки: 1 и 8 - контроль без мутации c.35delG; 2 - мать; 3 - пробанд; 4 - контроль по биаллельной (гомозиготной) мутации c.35delG; 5 - сибс; 6 - отец; 7 - контроль по моноаллельной (гетерозиготной) мутации c.35delG. Б - родословная семьи пробанда с выявленными генотипами по мутации c.35delG. При наличии биаллельной c.35delG сайт рестрикции отсутствует - 337 пн; при наличии моноаллельной c.35delG присутствует наличие двух бэндов - 337 пн и 305 пн; при отсутствии делеции c.35delG визуализируется один бэнд - 305 пн; на фигуре 6 - детекция мутации c.109G>A (p.Val37Ile) гена GJB2 (экзон 2). При этом, А - электрофореграмма ПЦР-ПДРФ анализа для детекции мутации c.109G>A (4% агарозный гель). Дорожки: 1 - маркер молекулярного веса pUC19 DNA/MspI, 2 - контроль биаллельной (гомозиготной) мутации c.109G>A, 3 - пробанд, 4 - мать, 5 - отец, 6 - сибс, 7 - контроль без c.109G>A. Б - родословная семьи пробанда с выявленными генотипами по мутации c.109G>A. При наличии биаллельной c.109G>A сайт рестрикции отсутствует - 175 пн; при наличии моноаллельной c.109G>A присутствует наличие двух бэндов - 175 пн и 142 пн; при отсутствии c.109G>A визуализируется один бэнд - 142 пн.
Алгоритм заявленного способа состоит из трех этапов последовательного поиска мутаций в гене GJB2 - c.-23+1G>A (Мутация сплайсинга мРНК), c.35delG (p.Gly12ValfsX2) и с.109G>A (p.Val37Ile):
1 этап - поиск мутации c.-23+1G>A в интронной области прилежащей к экзону 1. В результате поиска, при обнаружении данной мутации в биаллельном состоянии (c.[-23+1G>A];[-23+1G>A]), ДНК-диагностика АРГ 1А будет положительной. При выявлении мутации в моноаллельном состоянии (c.[-23+1G>A];[Wt]) или в ее отсутствии (c.[Wt];[Wt]), ДНК-диагностика АРГ 1А будет отрицательной. В отрицательных случаях, следует перейти ко второму этапу. Детекция мутации c.-23+1G>A в гене GJB2 представлена на фигуре 4;
2 этап - поиск мутации c.35delG в белок-кодирующем регионе гена в экзоне 2. В результате данного этапа, при обнаружении c.35delG в биаллельном состоянии (c.[35delG];[35delG]) или в компаунд-гетерозиготном состоянии с мутацией c.-23+1G>A (c.[-23+1G>A];[35delG]), то ДНК-диагностика АРГ 1А будет положительной. При выявлении c.35delG в моноаллельном состоянии (c.[35delG];[Wt]), либо в ее отсутствии (c.[Wt]; [Wt]), ДНК-диагностика АРГ 1А будет отрицательной. В отрицательных случаях, следует перейти к следующему этапу. Детекция мутации c.35delG представлена на фигуре 5;
3 этап - поиск мутации с.109G>A, так же в экзоне 2. В результате, при обнаружении с.109G>A в биаллельном состоянии (c.[109G>A];[109G>A]) или в компаунд-гетерозиготном состоянии с мутацией c.-23+1G>A или c.35delG (c.[-23+1G>A];[109G>A], c.[35delG];[109G>A]) ДНК-диагностика АРГ 1А будет положительной. При выявлении мутации с.109G>A в моноаллельном состоянии (c.[109G>A];[Wt]), либо в ее отсутствии (c.[Wt];[Wt]), ДНК-диагностика АРГ 1А будет отрицательной. Детекция мутации c.109G>A представлена на фигуре 6.
В заключении всех проведенных этапов поиска GJB2-мутаций (c.-23+1G>A, c.35delG, c.109G>A), когда ДНК-диагностика остается неинформативной, при моноаллельных состояниях (Mut/Wt) существует вероятность как случайного гетерозиготного носительства мутации, так и наличия другой мутации на второй аллели, находящейся в компаунд-гетерозиготном состоянии, либо в транс-положении за пределами анализируемой области гена GJB2. В тех случаях, когда не будет выявлена ни одна из трех мутаций (Wt/Wt), то потеря слуха может быть связана с другими, более редкими в Якутии GJB2-мутациями, либо нарушение слуха не связано с мутационными изменениями гена GJB2.
Способ осуществляется следующим образом.
1) С информированного согласия на обследование (у детей - после информированного согласия родителей или опекунов) осуществляется забор венозной крови из локтевой вены для выделения образцов геномной ДНК.
2) Геномная ДНК выделяется с помощью фенол-хлороформной экстракции, описанный в работе С. Метью (см. Mathew C.C. The isolation of high molecular weight eucariotic DNA / C.C. Mathew // Methods in Molecular Biology / Ed. Walker J.M.Y.L.: Human Press. - 1984. - Vol. 2. - P. 31-34).
3) В дальнейшем, полученную ДНК без посторонних примесей (со значениями ΔА260/ΔА280 = 1,8-2,0), используют в качестве матрицы для полимеразной цепной реакции для амплификации значимых районов гена GJB2. Для амплификации интрон-экзонного 1 района возможно содержащий вариант c.-23+1G>A используются последовательности олигонуклеотидов, описанные в работе A. Sirmaci с соавторами (см. Sirmaci A. The c.IVS1+1G>A mutation in the GJB2 gene is prevalent and large deletions involving the GJB6 gene are not present in the Turkish population / A. Sirmaci, D. Akcayoz-Duman, M. Tekin // J. Genet. - 2006. - Vol. 85(3). - P. 213-216): (F) - 5'-CCGGGAAGCTCTGAGGAC-3', (R) 5'-GCAACCGCTCTGGGTCTC-3'. (см. фигуру 1). Для амплификации участков экзона 2, возможно содержащие варианты c.35delG и c.109G>A используются оригинальные последовательности олигонуклеотидов, дизайн которых представлен на фигурах 2 и 3, соответственно: c.35delG (F) - 5'-ACTCAGGTGAACAAGCTACT-3', (R) - 5'-TCTTTCCAATGCTGGTGGAGTGTTTGTTCCCA-3'; (c.109G>A) (F) - 5'-TCTTTTCCAGAGCAAACCGCCCAGAG-3', (R) - 5'-TGCTCATCTCCCCACACCTCCTTTGCAGCGTCAA-3'.
Способ осуществляется с применением стандартного состава реакционной смеси: 1 мкг геномной ДНК, соответствующее количество каждого олигонуклеотида, 125 мкМ дезоксинуклеозидтрифосфата (Promega, USA) помещают в буфер для ПЦР следующего состава (концентрации указаны для 10х буфера): 67 mM Tris- HCl, pH 8,6-8,8 при 20°С, 6,7 mM MgCl2, 16,6 mM (NH4)2SO4, 0,01% Tween 20. К полученной смеси добавляют 5 единиц термофильной ДНК-полимеразы. Состав реакционной смеси представлен в таблице. Режим амплификации, описан в способе детекции 17 мутаций генов GJB2 и GJB6 при наследственной несиндромальной глухоте (см. RU №2448163, кл. G01N 33/50, С12Q 1/68, опубл. 20.04.2012).
4) После проведения амплификации необходимых фрагментов, для детекции мутаций проводится ПДРФ-анализ с использованием эндонуклеаз: для c.-23+1G>A - AsuHPI (см. фиг. 1); для детекции с.35delG - Bsc4I (см. фиг. 2); для детекции c.109G>A - HindII (см. фиг. 3). Реакция проводится согласно протоколу фирмы производителя указанных эндонуклеаз. Результаты ПДРФ-анализа оцениваются методом электрофореза: c.-23+1G>A и c.109G>A на горизонтальном (15 х 15) в 4% агарозном геле; с.35delG на вертикальном (20 х 20) в 10% полиакриламидном геле. Перед нанесением на электрофорез пробы в соотношении 1:5 с краской, содержащей 0,25% бромфенолового синего, 0,25% ксиленцианола и 15% фикола.
5) Детекцию результатов проводят путем окрашивания гелей бромистым этидием с последующей визуализацией в УФ-свете на трансиллюминаторе, так: на фигуре 4 показана электрофореграмма ПЦР-ПДРФ анализа для детекции мутации c.-23+1G>A, где наличие аллелей в 363 пн и 293 пн будет указывать на гетерозиготное носительство, детекция аллели в 363 пн - на гомозиготное состояние; на фигуре 5 показана электрофореграмма ПЦР-ПДРФ анализа для детекции мутации с.35delG, где наличие аллелей в 337 пн и 305 пн будет указывать на гетерозиготное носительство, аллели в 337 пн - на гомозиготное состояние; на фигуре 6 показана электрофореграмма ПЦР-ПДРФ анализа для детекции мутации c.109G>A, где наличие аллелей в 175 пн и 145 пн будет указывать на гетерозиготное носительство, аллели в 175 пн - на гомозиготное состояние.
Время исследования (от начала выделения ДНК исследуемого до детекции GJB2-варианта) составляет 5 (1 этап) - 7 (все 3 этапа) дней.
Результативность предлагаемого нами способа детекции трех GJB2-мутаций c.-23+1G>A, c.35delG, c.109G>A, была проверена на образцах ДНК 393 пациентов с врожденными нарушениями слуха из Якутии, с ранее выявленными генотипами гена GJB2, полученных в результате прямого секвенирования по Сэнгеру значимых районов гена GJB2 (интронная область, прилежащая к экзону 1 и экзон 2). Из них, с генотипами по данным мутациям были выявлены: c.[-23+1G>A];[-23+1G>A] - 149 (37,9%); c.[35delG];[35delG] - 14 (3,6%); c.[109G>A];[109G>A] - 4 (1,0%); c.[-23+1G>A];[35delG] - 18 (4,6%); c.[-23+1G>A];[109G>A] - 2 (0,5%); c.[35delG];[109G>A] - 1 (0,3%); c.[-23+1G>A];[Wt] - 18 (4,6%); c.[-23+1G>A];[вариант не имеющий клинического значения] - 10 (2,5%); c.[35delG];[Wt] - 3 (0,8%); c.[109G>A];[Wt] - 3 (0,8%); без мутаций c.[Wt];[Wt] - 125 (31,8%) (см. Анализ спектра и частоты GJB2-мутаций у пациентов с врожденными нарушениями слуха в Республике Саха (Якутия) / В.Г. Пшенникова, Н.А. Барашков, Ф.М. Терютин и др. // Мед. генетика. - 2015. - Т. 14. - №6 (156). - С. 10-2327; Spectrum and Frequency of the GJB2 Gene Pathogenic Variants in a Large Cohort of Patients with Hearing Impairment Living in a Subarctic Region of Russia (the Sakha Republic) / N.A. Barashkov, V.G. Pshennikova, O.L. Posukh et al // PLoS One. - 2016. - Vol. 11(5):e0156300. doi: 10.1371/journal.pone.0156300). В результате проведенной проверки предлагаемого способа на образцах ДНК пациентов выявленных с генотипами по мутациям c.-23+1G>A, c.35delG, c.109G>A гена GJB2, все генотипы полностью соответствовали результатам ранее полученных с помощью прямого секвенирования по Сэнгеру гена GJB2. Таким образом, предлагаемый способ в применении оказался точным и информативным и может быть применим при рутинной ДНК-диагностике наследственной глухоты/тугоухости в региональном контексте.
Таблица
Реакционная смесь для ПЦР
гена
GJB2
буфер (х10)
(мкл)
(мкл)
(мкл)
(мкл)
(мкл)
(100 ng/ml)
(мкл)
(мкл)
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ ДНК-диагностики аутосомно-рецессивной глухоты-103 | 2019 |
|
RU2727684C1 |
| СПОСОБ ДЕТЕКЦИИ 17 МУТАЦИЙ ГЕНОВ GJB2 И GJB6 ПРИ НАСЛЕДСТВЕННОЙ НЕСИНДРОМАЛЬНОЙ ГЛУХОТЕ | 2010 |
|
RU2448163C2 |
| Способ диагностики мутации c.-23+1G>A (rs80338940) гена GJB2 | 2020 |
|
RU2746055C1 |
| Способ диагностики мутации 35delG (rs80338939) гена GJB2 | 2020 |
|
RU2739889C1 |
| Способ диагностики мутации 167delT (rs80338942) гена GJB2 | 2020 |
|
RU2739943C1 |
| Способ одновременной диагностики наследственных заболеваний | 2015 |
|
RU2627115C2 |
| СПОСОБ ВЫЯВЛЕНИЯ МУТАЦИЙ В ГЕНЕ GJB2, СОПРОВОЖДАЮЩИХСЯ РАЗВИТИЕМ НЕСИНДРОМАЛЬНОЙ АУТОСОМНО-РЕЦЕССИВНОЙ ГЛУХОТЫ | 2006 |
|
RU2317547C1 |
| Способ ДНК-диагностики врожденной формы катаракты (CTRCT18) | 2017 |
|
RU2648464C1 |
| СПОСОБ ВЫЯВЛЕНИЯ МУТАЦИИ с.-53-2А>G В ГЕНЕ ПРЕСТИНА (SLC26A5), ВЫЗЫВАЮЩЕЙ РАЗВИТИЕ НЕСИНДРОМАЛЬНОЙ АУТОСОМНО-РЕЦЕССИВНОЙ ГЛУХОТЫ | 2012 |
|
RU2505608C1 |
| Способ дифференциальной и подтверждающей молекулярно-генетической диагностики нейросенсорной тугоухости в популяции чувашей | 2021 |
|
RU2768033C1 |


Изобретение относится к области медицины, в частности к медицинской генетике и оториноларингологии, и предназначено для выявления мутаций гена GJB2, обуславливающих аутосомно-рецессивную глухоту 1А типа. Предложен способ, включающий детекцию трех наиболее распространенных в Якутии мутаций c.-23+1G>A, с.35delG и c.109G>A с использованием праймеров и с последующим проведением анализа полиморфизма длин рестрикционных фрагментов с использованием эндонуклеаз AsuHPI, Bsc4I, HindII. Изобретение обеспечивает быстрое и точное выявление GJB2-мутаций, ответственных за 98% всех патогенных вариантов, обуславливающих аутосомно-рецессивную глухоту 1А типа в Якутии. 6 ил., 1 табл.
Способ выявления мутаций гена GJB2, обуславливающих аутосомно-рецессивную глухоту 1А типа, включающий детекцию трех наиболее распространенных в Якутии мутаций c.-23+1G>A, с.35delG и c.109G>A, отличающийся тем, что для проведения амплификации значимых GJB2-районов используются следующие праймеры: c.-23+1G>A (F) - 5'-CCGGGAAGCTCTGAGGAC-3', (R) - 5'-GCAACCGCTCTGGGTCTC-3'; c.35delG (F) - 5'-ACTCAGGTGAACAAGCTACT-3', (R) - 5'-TCTTTCCAATGCTGGTGGAGTGTTTGTTCCCA-3'; (c.109G>A) (F) - 5'-TCTTTTCCAGAGCAAACCGCCCAGAG-3', (R) - 5'-TGCTCATCTCCCCACACCTCCTTTGCAGCGTCAA-3', с последующим проведением анализа полиморфизма длин рестрикционных фрагментов с использованием эндонуклеаз AsuHPI, Bsc4I, HindII.
| BARASHKOV N.A | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| PLoS One | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| ПШЕННИКОВА В.Г | |||
| и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Мед | |||
| генетика | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| СПОСОБ ВЫЯВЛЕНИЯ МУТАЦИЙ В ГЕНЕ GJB2, СОПРОВОЖДАЮЩИХСЯ РАЗВИТИЕМ НЕСИНДРОМАЛЬНОЙ АУТОСОМНО-РЕЦЕССИВНОЙ ГЛУХОТЫ | 2006 |
|
RU2317547C1 |
| NOGOVITSYNA A.N | |||
| et al | |||
| Medical-genetic service of the population republic of sakha (Yakutia) | |||
| Yakut Medical Journal | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
Авторы
Даты
2019-05-21—Публикация
2017-11-29—Подача