ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет согласно 35 U.S.C. §119(e) по предварительным патентным заявкам США с серийными номерами No. 61/087943, поданной 11 августа 2008 года, 61/097495 и 61/097516, поданных 16 сентября 2008 года, и 61/138863, поданной 18 декабря 2008 года, содержание каждой из этих заявок включено в настоящий документ в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам лечения сахарного диабета сверхбыстродействующим прандиальным инсулином. Конкретные варианты осуществления изобретения относятся к различным способам введения, преимуществом которых является уникальный кинетический профиль таких составов, а также к замене такого инсулина одним или несколькими пероральными противодиабетическими средствами в стандартном режиме лечения сахарного диабета 2 типа.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Сахарным диабетом (в дальнейшем в настоящем документе диабет) в настоящее время страдает по меньшей мере 200 миллионов человек по всему миру. Два основных подтипа диабета включают типы 1 и 2. Диабет 1 типа насчитывается приблизительно у 10% из 200 миллионов человек, страдающих диабетом. Диабет 1 типа вызывается аутоиммунной деструкцией секретирующих инсулин β-клеток в островках Лангерганса поджелудочной железы. Диабет 2 типа насчитывается у остальных 90% больных индивидуумов, и его распространенность растет. Диабет 2 типа часто, но не всегда, ассоциирован с ожирением, и, хотя его ранее называли диабетом с поздним началом или диабетом с началом во взрослом состоянии, в настоящее время он становится все более распространенным у более молодых индивидуумов. Диабет 2 типа вызывается сочетанием резистентности к инсулину и недостаточной секреции инсулина.
Физиологическая роль инсулина
У здорового индивидуума не в состоянии нагрузки базальный уровень глюкозы имеет тенденцию оставаться одинаковым изо дня в день, благодаря природному циклу обратной связи. Любая тенденция к повышению концентрации глюкозы в плазме компенсируется повышением секреции инсулина и подавлением секреции глюкагона, которые регулируют продукцию глюкозы в печени (глюконеогенез и высвобождение из запасов гликогена) и захват глюкозы в ткани, для поддержания постоянной концентрации глюкозы в плазме. Если масса индивидуума увеличивается или он становится инсулинрезистентным по любой другой причине, уровни глюкозы в крови возрастают, что приводит к повышенной секреции инсулина для компенсации резистентности к инсулину. Таким образом, уровни глюкозы и инсулина модулируются для минимизации изменений этих концентраций, одновременно сохраняя нормальную продукцию и утилизацию глюкозы.
Идентифицировано пять различных фаз секреции инсулина: (1) базальная секреция инсулина, в которой инсулин высвобождается в постабсорбтивном состоянии; (2) головная фаза, в которой секреция инсулина запускается видом, запахом и вкусом пищи до всасывания какого-либо питательного вещества в кишечнике, опосредуемая иннервацией поджелудочной железы; (3) ранняя фаза секреции инсулина, в которой начальный выброс инсулина происходит в течение первых 5-10 минут после воздействия на β-клетки быстрого повышения уровня глюкозы или других усилителей секреции; (4) вторая фаза секреции инсулина, где уровни инсулина возрастают более постепенно и она связана со степенью и длительностью стимула; и (5) третья фаза секреции инсулина, которая описана только in vitro. Во время этих стадий инсулин секретируется, подобно многим другим гормонам, пульсирующим образом, что приводит к колебаниям концентраций в крови. Колебания включают быстрые выбросы (происходящие каждые 8-15 минут), которые накладываются на более медленные колебания (происходящие каждые 80-120 минут), которые связаны с колебаниями концентрации глюкозы в крови.
Помимо глюкозы секрецию инсулина могут индуцировать другие энергетические субстраты (в частности, аминокислоты), а также гормоны и лекарственные средства. Следует отметить, что ответ на инсулин, наблюдаемый после приема пищи, не может быть объяснен только повышением уровней глюкозы в крови, но также он зависит от других факторов, таких как присутствие жирных кислот и других усилителей секреции в пище, активируемая нервной системой головная фаза и желудочно-кишечные гормоны.
Когда индивидууму проводят внутривенную нагрузку глюкозой, наблюдают двухфазный ответ инсулина, который включает быстрое повышение с пиком, межпиковое падение и последующую более медленную фазу повышения. Этот двухфазный ответ наблюдают только тогда, когда концентрация глюкозы возрастает быстро, например, после болюса глюкозы или инфузии глюкозы. Более медленное повышение при введении глюкозы, которое наблюдают в физиологических условиях, индуцирует более постепенно возрастающую секрецию инсулина без точно ограниченного двухфазного ответа, наблюдаемого в ответ на болюсную инфузию глюкозы.
Моделирование ответов на инсулин ранней фазы в нормальных физиологических условиях продемонстрировало, что после приема пищи концентрация глюкозы возрастает более постепенно (Cmax достигалась в течение приблизительно 20 минут) относительно того, что наблюдают в случае болюсных инъекций глюкозы (Cmax достигалась в течение приблизительно 3-10 минут).
Здоровые β-клетки поджелудочной железы генерируют ранний ответ на подобное приему пищи воздействие глюкозы, который быстро повышает уровень инсулина в сыворотке как в кровообращении системы воротной вены, так и на периферии. Напротив, дефектные β-клетки, у которых нарушен ответ на инсулин ранней фазы, генерируют замедленный ответ на подобное приему пищи воздействие глюкозы.
Накапливающиеся данные указывают на то, что ранний относительно быстрый ответ на инсулин после проглатывания глюкозы играет критическую роль в поддержании постпрандиального гомеостаза глюкозы. Ранний скачок в концентрации инсулина может ограничить первоначальные колебания концентраций глюкозы, главным образом, путем ингибирования эндогенной продукции глюкозы. Таким образом, ожидается, что индукция быстрого ответа инсулина у индивидуума вызовет улучшенный гомеостаз глюкозы в крови.
У здорового индивидуума прием пищи индуцирует секреторный выброс инсулина, генерируя относительно быструю волну концентрации инсулина в сыворотке, которая затем относительно быстро спадает (см. фигуру 1). Эта ранняя фаза ответа инсулина ответственна за прекращение, или снижение, высвобождения глюкозы из печени. Затем гомеостатические механизмы приводят секрецию инсулина (и уровни инсулина в сыворотке) в соответствие с нагрузкой глюкозой. Этот процесс наблюдают как медленное снижение умеренно повышенных уровней инсулина в сыворотке обратно до исходного уровня, и он соответствует кинетике второй фазы.
Диабет
Центральной характеристикой диабета является нарушенная функция β-клеток. Одним из нарушений, которые происходят при прогрессировании диабета как 1 типа, так и 2 типа, является утрата индуцируемого приемом пищи быстрого ответа инсулина. Следовательно, печень продолжает продуцировать глюкозу, которая добавляется к глюкозе, которая употребляется с пищей и всасывается из основных компонентов пищи.
Диабетики 2 типа, как правило, проявляют замедленный ответ на повышение уровней глюкозы в крови. В то время как у здоровых индивидуумов обычно высвобождение инсулина начинается в пределах 2-3 минут после употребления пищи, у диабетиков 2 типа эндогенный инсулин может не секретироваться до тех пор, пока уровень глюкозы в крови не начнет расти, а затем секретируется с кинетикой второй фазы, которая представляет собой медленное повышение концентрации до протяженного плато. В результате, эндогенная продукция глюкозы не прекращается и продолжается после употребления пищи и пациент испытывает гипергликемию (повышенные уровни глюкозы в крови). Другой характеристикой диабета 2 типа является снижение действия инсулина, называемое резистентностью к инсулину. Резистентность к инсулину проявляется как снижение максимальной скорости выведения глюкозы (GERmax) и как повышение концентрации инсулина, требуемой для достижения GERmax. Таким образом, чтобы контролировать данную нагрузку глюкозой требуется большее количество инсулина, и эта повышенная концентрация инсулина должна поддерживаться в течение более длительного периода времени. Следовательно, пациент с диабетом также подвергается действию повышенных концентраций глюкозы в течение более длительных периодов времени, что далее усиливает резистентность к инсулину. Кроме того, длительное повышение уровней глюкозы в крови само по себе является токсичным для β-клеток.
Диабет 1 типа возникает в результате разрушения продуцирующих инсулин клеток поджелудочной железы (β-клеток) собственной иммунной системой организма. Это в конечном итоге приводит к полному дефициту гормона инсулина. Диабет 2 типа возникает в других и менее хорошо понятных обстоятельствах. Ранняя утрата ранней фазы высвобождения инсулина и последующее непрерывное высвобождение глюкозы приводят к повышению концентраций глюкозы. Высокие уровни глюкозы обеспечивают резистентность к инсулину, и резистентность к инсулину вызывает продолжительное повышение концентрации глюкозы в сыворотке. Эта ситуация может привести к самоусиливающемуся циклу, в котором еще более высокие концентрации инсулина являются менее эффективными в отношении контроля уровней глюкозы в крови. Более того, как отмечалось выше, повышенные уровни глюкозы являются токсичными для β-клеток, снижая количество функциональных β-клеток. Генетические дефекты, нарушающие рост или поддержание микрососудов, питающих островки, также могут играть роль в их повреждении (Clee, S. M., et al. Nature Genetics 38:688-693, 2006). В итоге, поджелудочная железа становится перегруженной, и у индивидуумов происходит прогрессирование с развитием дефицита инсулина, сходного с диабетом 1 типа у человека.
Лечение
Терапия инсулином является стандартным лечением для диабета 1 типа. В то время как начинающийся диабет 2 типа можно лечить диетой и физической нагрузкой, большинство диабетиков с диабетом 2 типа на ранней стадии в настоящее время лечат пероральными противодиабетическими средствами, но с ограниченным успехом. По мере прогрессирования заболевания пациентов обычно переводят на терапию инсулином. Однако эти способы лечения не являются способами излечения.
При типичном течении первым используемым пероральным противодиабетическим средством является метформин, супрессор продукции глюкозы печенью. Применение метформина не ассоциировано с увеличением массы тела или гипогликемией. Если лечение метформином является недостаточным для контроля гипергликемии, в режим лечения можно добавлять усилитель секреции инсулина, наиболее часто, сульфонилмочевину. Усилители секреции повышают базальный уровень инсулина, снижая средние уровни глюкозы в крови. Применение сульфонилмочевин ассоциировано с увеличением массы тела и может приводить к гипогликемии, хотя тяжелая гипогликемия является нечастой. Если эта комбинации двух пероральных противодиабетических средств является недостаточной для контроля гипергликемии, к режиму добавляют либо третье пероральное средство, такое как глитазон, либо базальный инсулин длительного действия. По мере прогрессирования заболевания, терапию инсулином можно усиливать добавлением препаратов инсулина среднего и короткого (быстрого) действия, вводимых совместно по меньшей мере с некоторыми из каждодневных приемов пищи.
Современные способы лечения инсулином можно дополнять или заменять эндогенной продукцией инсулина для обеспечения базальных и подобных второй фазе профилей, однако они не имитируют кинетику ранней фазы (см. фигуру 2). Кроме того, общепринятая терапия инсулином часто вовлекает только одну или две суточных инъекции инсулина. Однако более интенсивная терапия, такая как три или более введений в сутки, обеспечивающая лучший контроль уровней глюкозы в крови, очевидно является преимущественной (см. например, Nathan, D. M., et al., N Engl J Med 353:2643-53, 2005), однако многие пациенты отказываются от проведения дополнительных инъекций. Применение этих общепринятых препаратов инсулина ассоциировано с повышением массы тела и значительным риском гипогликемии, включая тяжелые угрожающие жизни гипогликемические явления.
До недавнего времени подкожная (SC) инъекция была единственным коммерчески доступным способом доставки инсулина для самостоятельного введения пациентами. Однако подкожное введение инсулина не приводит к оптимальной фармакодинамике вводимого инсулина. Всасывание в кровь (даже в случае быстродействующих аналогов инсулина) не имитирует прандиальный физиологический паттерн секреции инсулина в виде крутой волны концентрации инсулина в сыворотке. Подкожные инъекции также редко являются идеальными для предоставления инсулина диабетикам 2 типа, и они могут в действительности ухудшить действие вследствие замедленного всасывания и непостоянной и низкой скорости всасывания в кровоток. Однако было показано, что если инсулин вводят внутривенно вместе с приемом пищи, у диабетиков 2 типа на ранней стадии происходит прекращение высвобождения глюкозы в печени и проявляется повышенный физиологический контроль глюкозы. Кроме того, уровни свободных жирных кислот снижаются с более высокой скоростью, чем без терапии инсулином. Хотя внутривенное введение инсулина возможно и является эффективным при лечении диабета 2 типа, оно не является целесообразным решением, поскольку введение инсулина при каждом приеме пищи не является безопасным или выполнимым.
В течение короткого периода времени существовал ингалируемый инсулин EXUBERA® (Pfizer), который поставлялся на рынок для лечения диабета. Этот препарат инсулина имел фармакокинетический профиль, сходный с инъецируемыми быстродействующими аналогами, и его использовали в качестве замены инсулина короткого действия в стандартной модели лечения. Хотя этот препарат инсулина позволял пациентам применять препараты инсулина короткого действия для того, чтобы избежать инъекций, он не обеспечивал никаких других явных преимуществ, что привело к его коммерческому неуспеху. Более того, поскольку его кинетический профиль был настолько сходен с подкожно вводимыми регулярными и быстродействующими препаратами инсулина, то, после учета отличий в биодоступности, его дозирование и режимы введения могут в основном повторять дозирование и режимы введения для подкожных препаратов инсулина.
Разработан сверхбыстродействующий инсулин, инсулин-фумарилдикетопиперазин (FDKP), хотя он еще и не является коммерчески доступным. Растущий опыт применения этого состава инсулина в исследованиях у человека демонстрирует, что его уникальный кинетический профиль можно приспособить к различным схемам дозирования и способам введения, поскольку его применяют в различных ситуациях и популяциях пациентов для достижения улучшенного гликемического контроля. Такие способы являются задачей настоящего описания.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Варианты осуществления, описанные в настоящем документе, включают способы, пригодные для лечения сахарного диабета, включая как диабет 1 типа, так и диабет 2 типа, с использованием сверхбыстродействующего состава инсулина. Описанные способы относятся к способам определения дозировок, к применению стандартных дозировок, которые не корректируют от приема пищи к приему пищи индивидуумом, и к применению разделенных дозировок, где состав инсулина вводят в начале приема пищи и в последующий момент времени. В определенных вариантах осуществления, состав инсулина представляет собой инсулин-FDKP, и его вводят путем легочной ингаляции. Такие составы можно преимущественно использовать при лечении пациентов с резистентностью к подкожному инсулину, и способы выбора таких пациентов также описаны в настоящем документе.
Варианты осуществления способа включают введение инсулина таким образом, чтобы имитировать связанную с приемом пищи раннюю фазу ответа инсулина. При имитации кинетики ранней фазы максимальных уровней инсулина в сыворотке можно достигать в пределах от приблизительно 12 до приблизительно 30 минут после введения. Уровни инсулина в сыворотке также могут возвращаться приблизительно к исходному уровню в пределах приблизительно двух или трех часов после введения. Препараты инсулина, имитирующие кинетику ранней фазы таким путем, называют в настоящем документе сверхбыстродействующими препаратами инсулина. В одном варианте осуществления используют дозу, достаточную для снижения или контроля колебаний концентрации глюкозы. В одном варианте осуществления, инсулин вводят пациенту, нуждающемуся в терапии инсулином, во время приема пищи, т.е. в пределах приблизительно 10 минут, предпочтительно 5 минут до начала приема пищи, или через 30, 25, 15 или 10 минут после начала приема пищи. (Более короткие периоды времени после начала являются предпочтительными для пациентов с нормальным опустошением желудка, более длительные периоды времени после начала приема пищи являются предпочтительными для пациентов с замедленным опустошением желудка). В следующих вариантах осуществления, инсулин вводят по меньшей мере два раза, сначала в начале приема пищи (т.е. в пределах плюс или минус 10 минут от начала приема пищи) и второй раз, например, через 30-120 минут после начала приема пищи.
В предпочтительных вариантах осуществления легочную доставку обеспечивают путем ингаляции состава сухого порошка, содержащего фумарилдикетопиперазин (FDKP) вместе с инсулином. При таком применении, термин "фумарилдикетопиперазин", как используют в настоящем документе, также включает его соли. Один такой вариант осуществления включает инсулин и соль FDKP. В другом таком варианте осуществления инсулин находится в комплексе с FDKP. Например, инсулин может находиться в комплексе (быть связанным) с поверхностью самоагрегированных кристаллических микрочастиц FDKP, и его называют в настоящем документе в общем "инсулин-FDKP", а также инсулином TECHNOSPHERE® (TI, MannKind Corp.). В других вариантах осуществления FDKP заменен другими C-замещенными дикетопиперазинами, например 3,6-ди(сукцинил-4-аминобутил)-2,5-дикетопиперазином ("сукцинилдикетопиперазин", SDKP). В одном аспекте этих вариантов осуществления, доставку упрощают с использованием ингалятора единичной дозы, такого как система для ингаляции MEDTONE® (MannKind Corp.), используемая в примерах ниже и описанная в USPN 7305986 и 7464706, которые включены в настоящий документ в качестве ссылок в полном объеме. Предпочтительные дозировки, исходя из наполнения этой системы, находятся в диапазоне приблизительно от 7,5 МЕ до 120 МЕ, в частности от 15 до 90 МЕ, или более 24 МЕ инсулина в комплексе с фумарилдикетопиперазином или эквивалентом. Дозировки также могут быть выражены в качестве дозы, выпускаемой из ингалятора. Эти дозировки предпочтительно находятся в диапазоне от 6 E до 48 Е на кассету ингалятора для дозировок для пациента от 6 Е до 72 или 96 Е. Как объяснено ниже, дозировки можно более универсально выражать в подкожных эквивалентных (subQ eq) единицах. В этих единицах предпочтительные дозировки находятся в диапазоне 1-32 или более единиц, например 3, 6, 9… или 4, 8, 12… subQ eq единиц. Например, в случае альтернативной системы для ингаляции, описанной в патентных заявках США No. 12/484125, 12/484129 и 12/484137, дозировки 3-4 subQ eq единиц обеспечивают с помощью кассет, заполненных 20-22 МЕ.
В одном варианте осуществления доза инсулина содержит дозу, достаточную для контроля колебаний концентрации глюкозы. В другом варианте осуществления инсулин достигает максимальных уровней в сыворотке в течение приблизительно 15 минут после введения. В другом варианте осуществления максимальный уровень инсулина в сыворотке составляет по меньшей мере 60 мЕ/л. В другом варианте осуществления максимальная концентрация инсулина в сыворотке по меньшей мере на 60, 100 или 120 мЕ/л превышает исходную концентрацию инсулина до дозирования. В одном аспекте этого варианта осуществления реципиент имеет диабет 2 типа. В другом варианте осуществления доза инсулина является достаточной для контроля уровней глюкозы в крови. В другом варианте осуществления доза инсулина является достаточной для снижения или подавления высвобождения глюкозы из печени. В одном аспекте этого варианта осуществления подавление длится несколько часов (см. ФИГ. 5). В одном аспекте этого варианта осуществления нижний уровень эндогенной продукции глюкозы достигается быстрее, чем после подкожного введения регулярного инсулина или быстродействующего аналога инсулина, предпочтительно, в течение ≤60 минут, более предпочтительно, в течение ≤50 минут, еще более предпочтительно в течение приблизительно 40 минут. В другом варианте осуществления доза является достаточной для максимального подавления эндогенной продукции глюкозы.
Дополнительные варианты осуществления относятся к способам улучшенного лечения пациентов с диабетом, включающим выбор пациента, нуждающегося в улучшенном гликемическом контроле, прекращение текущего лечения и регулярное введение сверхбыстродействующего инсулина по меньшей мере с двумя приемами пищи каждые сутки.
В других вариантах осуществления необходимость в улучшении гликемического контроля определяют из уровней HbA1c. В одном варианте осуществления уровень HbA1c в сыворотке составляет ≥8%. В других вариантах осуществления уровень HbA1c в сыворотке составляет ≥7,5%, ≥7,0%, ≥6,5% или ≥6,0%. В других вариантах осуществления необходимость в улучшении гликемического контроля определяют из повышенной средней амплитуды колебаний концентрации глюкозы или повышенных постпрандиальных уровней глюкозы в крови. В другом варианте осуществления пациент имеет признаки повышенного окислительного стресса, и окислительный стресс измеряют по уровням 8-изо-PGF(2a). Повышенный окислительный стресс коррелирует с повышенной средней амплитудой колебаний концентрации глюкозы.
В одном аспекте этих вариантов осуществления, пациент, кроме того, нуждается в предотвращении увеличения массы тела, и лечение сверхбыстродействующим инсулином не приводит к увеличению массы тела или не приводит к настолько большому увеличению массы тела, которое ожидается от другого способа лечения. В родственном варианте осуществления пациент имеет ожирение и/или нуждается в снижении массы тела, и лечение сверхбыстродействующим инсулином приводит к снижению массы тела, стабильной массе тела или к меньшему увеличению массы тела, по сравнению с тем, что ожидается от другого способа лечения. Такие варианты осуществления могут, кроме того, включать стадию оценки снижения массы тела или меньшего увеличения массы тела, чем ожидается в ином случае. В одном аспекте изобретения оценку проводят после ≥12 недель лечения сверхбыстродействующим инсулином, принимаемым с приемом пищи. В другом аспекте оценку проводят после ≥24 недель. В других аспектах оценку проводят после ≥36 недель или ≥48 недель.
В различных вариантах осуществления способ дополнительно включает оценку улучшения гликемического контроля. В одном варианте осуществления гликемический контроль оценивают по уровню HbA1c. В другом варианте осуществления гликемический контроль оценивают по постпрандиальным колебаниям концентрации глюкозы. В одном аспекте изменение уровня глюкозы после приема пищи оценивают по постпрандиальному уровню глюкозы в крови. В другом аспекте его оценивают по окислительному стрессу, например по уровням 8-изо-PGF(2a) или других индикаторов, известных в данной области. В другом варианте осуществления гликемический контроль оценивают по уровню глюкозы в крови натощак. В следующих вариантах осуществления эти факторы оценивают в различных комбинациях. В одном аспекте изобретения оценку проводят после ≥12 недель лечения сверхбыстродействующим инсулином, принимаемым с приемом пищи. В другом аспекте оценку проводят после ≥24 недель. В других аспектах оценку проводят после ≥36 недель или ≥48 недель.
В одном варианте осуществления сверхбыстродействующий инсулин регулярно вводят по меньшей мере с двумя приемами пищи каждые сутки. В другом варианте осуществления сверхбыстродействующий инсулин вводят по меньшей мере с тремя приемами пищи каждые сутки. В другом варианте осуществления сверхбыстродействующий инсулин вводят с каждым основным или существенным приемом пищи каждые сутки. В другом варианте осуществления сверхбыстродействующий инсулин вводят с любым приемом пищи, содержащей более 15 г углеводов.
Некоторые варианты осуществления включают модификацию современного стандартного способа лечения диабета путем замены того или иного из принятых способов лечения введением сверхбыстродействующего инсулина с приемом пищи.
Один из вариантов осуществления относится к способам более эффективного комбинирования сверхбыстродействующего инсулина с аналогом инсулина длительного действия, например инсулином гларгин. В этом варианте осуществления прандиальное введение сверхбыстродействующего инсулина комбинируют с утренней дозой аналога инсулина длительного действия, вводимого в течение 6 часов после пробуждения на сутки. В некоторых аспектах этого варианта осуществления дозу аналога инсулина длительного действия вводят в пределах 1, 2, 3 или 4 часов после пробуждения. В одном аспекте этого варианта осуществления аналог инсулина длительного действия представляет собой инсулин гларгин. В другом аспекте этого варианта осуществления аналог инсулина длительного действия представляет собой инсулин детемир. В родственных аспектах аналог инсулина длительного действия представляет собой инсулин гларгин, и вторую дозу вводят от 8 до 14 часов после утренней дозы. Альтернативно первая доза является единственной дозой, вводимой в течение суток. В другом варианте осуществления вместо использования инъекций инсулина длительного действия используют инсулиновый насос для обеспечения постоянной инфузии инсулина, например регулярного инсулина человека. В одном варианте осуществления сверхбыстродействующий состав инсулина содержит инсулин и дикетопиперазин. В конкретном варианте осуществления сверхбыстродействующий состав инсулина содержит инсулин-FDKP.
Некоторые варианты осуществления включают модификацию современного стандартного режима лечения диабета 2 типа путем замены лечения усилителем секреции инсулина прандиальным введением сверхбыстродействующего инсулина. Другие варианты осуществления включают модификацию современного стандартного режима лечения диабета 2 типа путем замены прандиальным введением сверхбыстродействующего инсулина лечения сенсибилизатором к инсулину. Другие варианты осуществления включают модификацию современного стандартного режима лечения диабета 2 типа путем замены прандиальным введением сверхбыстродействующего инсулина лечения как усилителем секреции инсулина, так и сенсибилизатором к инсулину.
В одном варианте осуществления, описанном в настоящем документе, предусматривается способ лечения диабета 2 типа, включающий: выбор пациента с диабетом 2 типа, в текущее время подвергаемого лечению супрессором продукции глюкозы печенью и усилителем секреции инсулина; прекращение лечения усилителем секреции инсулина; и регулярное введение сверхбыстродействующего препарата инсулина по меньшей мере с одним устоявшимся приемом пищи. В другом варианте осуществления лечение супрессором продукции глюкозы печенью также прекращают.
В другом варианте осуществления пациент, кроме того, выбран по наличию резистентности к инсулину в нижней части диапазона резистентности к инсулину. В другом варианте осуществления пациент, кроме того, выбран по необходимости снижения массы тела или избегания увеличения массы тела. В другом варианте осуществления пациент, кроме того, выбран по наличию хорошо или умеренно контролируемого уровня глюкозы в крови натощак. В другом варианте осуществления пациент, кроме того, выбран по наличию уровня HbA1c ≥8. В другом варианте осуществления пациент, кроме того, выбран по наличию повышенной средней амплитуды колебаний концентрации глюкозы.
В другом варианте осуществления стадия введения не включает инъекцию, где пациент, кроме того, является кандидатом для лечения инсулином и, кроме того, выбран вследствие боязни укола иглой или желания избежать частых инъекций.
В другом варианте осуществления супрессор продукции глюкозы печенью представляет собой метформин, и усилитель секреции инсулина представляет собой сульфонилмочевину. В одном варианте осуществления сверхбыстродействующий препарат инсулина вводят путем ингаляции, например в качестве сухого порошка. В другом варианте осуществления сверхбыстродействующий препарат инсулина содержит фумарилдикетопиперазин (FDKP), связанный с инсулином, такой как инсулин-FDKP.
В другом варианте осуществления сверхбыстродействующий препарат инсулина вводят с каждым приемом пищи, содержащей более 15 г углеводов. В другом варианте осуществления сверхбыстродействующий препарат инсулина вводят в дозировке, достаточной для максимального снижения продукции глюкозы печенью в пределах 60 минут после введения. В другом варианте осуществления сверхбыстродействующий препарат инсулина вводят в дозировке, находящейся в диапазоне от 1 до 32 подкожных эквивалентных единиц.
В одном варианте осуществления в настоящем документе предусматривается способ лечения диабета 2 типа, включающий: выбор пациента с диабетом 2 типа, в данное время подвергаемого лечению супрессором продукции глюкозы печенью, который нуждается в улучшении гликемического контроля и который может быть кандидатом для комбинированного лечения указанным супрессором продукции глюкозы печенью и усилителем секреции инсулина; и вместо этого комбинированное лечение указанным супрессором продукции глюкозы печенью с регулярным введением сверхбыстродействующего препарата инсулина по меньшей мере с одним устоявшимся приемом пищи.
В одном варианте осуществления в настоящем документе предусматривается способ лечения диабета 2 типа, включающий: выбор пациента с диабетом 2 типа, в данное время подвергаемого лечению сенсибилизатором к инсулину и усилителем секреции инсулина; прекращение лечения усилителем секреции инсулина; и регулярное введение сверхбыстродействующего препарата инсулина с каждым приемом пищи. В другом варианте осуществления лечение сенсибилизатором к инсулину также прекращают. В другом варианте осуществления пациент, кроме того, выбран по наличию резистентности к инсулину в верхней части диапазона резистентности к инсулину. В другом варианте осуществления сенсибилизатор к инсулину представляет собой тиазолидиндион (TZD), такой как пиоглитазон.
В одном варианте осуществления в настоящем документе предусматривается улучшенный способ лечения гипергликемии комбинацией сверхбыстродействующего инсулина и аналога инсулина длительного действия, включающий: прандиальное введение сверхбыстродействующего инсулина, и введение дозы аналога инсулина длительного действия в пределах 6 часов после пробуждения на сутки. В другом варианте осуществления гипергликемия является результатом диабета 2 типа. В другом варианте осуществления введение аналога инсулина длительного действия проводят в пределах 3 часов после пробуждения. В другом варианте осуществления аналог инсулина длительного действия представляет собой инсулин детемир или инсулин гларгин. В другом варианте осуществления инсулин длительного действия представляет собой инсулин гларгин и способ дополнительно включает введение второй дозы инсулина гларгина и вторую дозу вводят от 8 до 14 часов после указанной утренней дозы.
В другом варианте осуществления сверхбыстродействующий инсулин включает состав, содержащий инсулин и дикетопиперазин, такой как инсулин-FDKP. В другом варианте осуществления сверхбыстродействующий инсулин вводят путем ингаляции в легкие.
В одном варианте осуществления в настоящем документе предусматривается улучшенный способ лечения гипергликемии комбинацией сверхбыстродействующего инсулина и экзогенного базального инсулина, включающий: прандиальное введение сверхбыстродействующего инсулина и постоянную инфузию инсулина короткого действия с помощью инсулинового насоса. В другом варианте осуществления инсулин короткого действия представляет собой регулярный инсулин человека или быстродействующий аналог инсулина. В другом варианте осуществления сверхбыстродействующий состав инсулина представляет собой инсулин-FDKP.
В одном варианте осуществления в настоящем документе предусматривается способ контроля гликемии, связанной с каждодневным приемом пищи, без коррекции дозы инсулина по содержимому пищи, включающий стадию введения предварительно определенной дозировки сверхбыстродействующего состава инсулина во время приема пищи при каждом каждодневном приеме пищи. В другом варианте осуществления содержимое пищи составляет ≥25%, ≥50%, ≤150% или ≤200% от обычного содержимого пищи, как используют при определении предварительно определенной дозы.
В одном варианте осуществления в настоящем документе предусматривается способ контроля гликемии, связанной с каждодневным приемом пищи, у пациента с замедленным или пролонгированным всасыванием питательных веществ, включающий стадии: выбора пациента с замедленным всасыванием питательных веществ; введения от 50% до 75% от заданной дозировки сверхбыстродействующего состава инсулина во время приема пищи при каждодневных приемах пищи; и введение остальной части предварительно определенной дозировки через от 30 до 120 минут после начала каждодневного приема пищи. В другом варианте осуществления сверхбыстродействующий состав инсулина представляет собой инсулин-FDKP.
В другом варианте осуществления замедленное всасывание питательных веществ связано с болезненным состоянием. В другом варианте осуществления замедленное всасывание питательных веществ связано с пищей с высоким содержанием жиров или волокон. В другом варианте осуществления пролонгированное всасывание питательных веществ связано с длительным приемом пищи.
В одном варианте осуществления в настоящем документе предусматривается способ контроля гликемии, связанной с каждодневным приемом пищи, где дозировку инсулина корректируют согласно гликемической нагрузке употребляемой пищи, включающий стадии: введения начальной заданной дозы сверхбыстродействующего состава инсулина во время приема пищи при каждодневном приеме пищи; определения постпрандиального уровня глюкозы в крови через 1-2 часа после начала каждодневного приема пищи; и, если постпрандиальный уровень глюкозы в крови составляет >140 мг/дл, введения второй дозы сверхбыстродействующего состава инсулина, где вторая доза составляет от 25% до 100% от начальной дозы. В другом варианте осуществления сверхбыстродействующий состав инсулина представляет собой инсулин-FDKP.
В одном варианте осуществления в настоящем документе предусматривается способ лечения диабетиков с резистентностью к подкожному инсулину, включающий стадии: выбора пациента с резистентностью к подкожному инсулину, исходя из нетипично высокой дозировки инсулина; прекращения лечения подкожно вводимыми составами инсулина быстрого действия, короткого действия или среднего действия; и начала лечения путем введения прандиальных доз инсулин-FDKP путем ингаляции, эффективных для контроля постпрандиальной гипогликемии.
В другом варианте осуществления нетипично высокая дозировка инсулина составляет ≥2 единиц/кг/сутки. В другом варианте осуществления стадия выбора, кроме того, включает выбор основания, что пациент имеет нормальные или практически нормальные уровни эндогенного базального инсулина. В другом варианте осуществления уровень эндогенного базального инсулина составляет ≤50 мкЕ/мл.
В другом варианте осуществления стадия выбора, кроме того, включает одно из следующих: выбор, исходя из липоатрофии или липодистрофии области инъекции; выбор, исходя из наличия у пациента 2 установленных показателей уровня HbA1c ≥9% за период от 6 до 9 месяцев при усиленном режиме инсулина; или выбор, исходя из наличия у пациента угрожающей жизни гликемической нестабильности, характеризующейся периодами гипергликемии и/или гипогликемии, несмотря на соблюдение его режима инсулина и любой диеты или режима физической нагрузки.
В другом варианте осуществления способ дополнительно включает стадию подтверждения того, что пациент имеет резистентность к подкожному инсулину, путем определения того, что достигается сходная или повышенная степень гликемического контроля при по существу более низкой дозировке инсулина после коррекции, исходя из относительной биодоступности.
В одном варианте осуществления в настоящем документе предусматривается способ определения индивидуальной дозировки сверхбыстродействующего инсулина для каждодневного приема пищи, включающий стадии: введения низкой дозы сверхбыстродействующего инсулина во время приема пищи при каждодневном приеме пищи, для которого титруют дозировку, каждые сутки в течение по меньшей мере 3 суток в период титрования, составляющий не более недели; повторяющегося повышения дозировки на величину низкой дозы при каждом последующем периоде титрования и введения ее во время приема пищи при каждодневном приеме пищи, для которого титруют дозировку, каждые сутки в течение по меньшей мере трех суток в период титрования до достижения конечного результата титрования.
В другом варианте осуществления низкую дозу предоставляют в кассете с единичной дозой. В другом варианте осуществления период титрования составляет 3 суток или одну неделю. В другом варианте осуществления низкая доза составляет 1-5 subQ eq единиц. В другом варианте осуществления сверхбыстродействующий состав инсулина представляет собой инсулин-FDKP.
В другом варианте осуществления конечный результат титрования выбран из: 1) достигаемое среднее значение глюкозы через 2 часа после приема пищи составляет от 70 до 110 мг/дл, 2) дозировка, исходя из подкожных эквивалентных (subQ eq) единиц, является максимальной дозировкой, 3) возникают явления тяжелой гипогликемии с подтвержденным SMBG <36 мг/дл и дозировку снижают на эквивалент одной кассеты с низкой дозой, и 4) возникают явления гипогликемии от мягкой до умеренной с подтвержденным SMBG <70 мг/дл, дозировку снижают на эквивалент одной кассеты с низкой дозой на одну неделю, а затем титрование возобновляют до достижения любого из конечных результатов 1-3 или дозировку устанавливают на уровень, ниже уровня, который вновь вызывает гипогликемию от мягкой до умеренной.
В другом варианте осуществления дозировки для двух или более каждодневных приемов пищи титруют одновременно. В другом варианте осуществления дозировки для двух или более каждодневных приемов пищи титруют последовательно от приема пищи, приводящего к наиболее высокому 2-часовому постпрандиальному уровню глюкозы в крови, до приема пищи, приводящего к более низкому 2-часовому постпрандиальному уровню глюкозы в крови.
В другом варианте осуществления максимальная дозировка составляет 24 subQ eq единицы или 2 subQ eq единицы.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На ФИГ. 1 представлено установление кинетики первой фазы высвобождения инсулина после искусственной стимуляции путем болюсной инфузии глюкозы.
На ФИГ. 2 представлена концентрация инсулина в сыворотке после введения подкожного (SC) регулярного инсулина человека или подкожного быстродействующего инсулина (NOVOLOGTM). NOVOLOGTM представляет собой зарегистрированное торговое название Novo Nordisk Pharmaceuticals, Bagsvaerd, Denmark.
На ФИГ. 3. представлен график данных, полученных в исследовании, в котором концентрации глюкозы в крови измеряли в различные моменты времени после приема пищи у пациентов с диабетом 2 типа, которым вводили инсулин лизпро (HUMALOG®, 1), EXUBERA® (2) и состав инсулина, содержащим фумарилдикетопиперазин (инсулин-FDKP, 3), в начале приема пищи. На графике также показаны (чертежи линиями внизу) инфузии экзогенной глюкозы, проводимые пациентам при необходимости для поддержания эугликемических уровней после каждого введения, и они указанны как 1a, 2a и 3a, соответственно.
На ФИГ. 4 представлен график с данными, полученными в исследовании, в котором измеряли скорость всасывания глюкозы в течение периода времени после приема пищи у пациентов с диабетом 2 типа, которым вводили инсулин лизпро, EXUBERA® и состав инсулин-FDKP в начале приема пищи.
На ФИГ. 5 представлен график данных, полученных из исследования, в котором определяли эндогенную продукцию глюкозы после приема пищи у пациентов с диабетом 2 типа, которым вводили инсулин лизпро, EXUBERA® и состав инсулин-FDKP в начале приема пищи.
На ФИГ. 6 представлен график данных, полученных из исследования, в котором проводили мониторинг в течение периода времени скорости исчезновения глюкозы у пациентов с диабетом 2 типа, которым вводили инсулин лизпро, EXUBERA® и состав инсулин-FDKP в начале приема пищи.
На ФИГ. 7 представлены профили средняя концентрация инсулина-время для пациентов с диабетом 2 типа, которым вводили инсулин лизпро и 60 Е или 90 Е состава инсулин-FDKP в начале приема пищи в исследовании клэмпа глюкозы.
На ФИГ. 8 представлена концентрация глюкозы в крови у пациентов с диабетом 2 типа, которым вводили инсулин лизпро (3) и 60 Е (1) или 90 Е (2) состава инсулин-FDKP в начале приема пищи в исследовании клэмпа глюкозы. Время инфузии глюкозы и количество инфузируемой глюкозы представлено в качестве 1a, 2a и 3a, соответственно, для 60 Е и 90 Е инсулин-FDKP и инсулина лизпро.
На ФИГ. 9 представлен график данных, полученных в исследовании клэмпа глюкозы, на котором показана скорость всасывания глюкозы у пациентов с диабетом 2 типа, которым вводили 60 Е или 90 Е инсулин-FDKP и инсулин лизпро сразу после приема пищи.
На ФИГ. 10 представлен график данных, полученных в экспериментах по клэмпу глюкозы, в которых эндогенную продукцию глюкозы после приема пищи определяли у пациентов с диабетом 2 типа, которым вводили 60 Е или 90 Е инсулин-FDKP и инсулин лизпро в начале приема пищи.
На ФИГ. 11 представлен график данных, полученных из экспериментов, в которых поводили мониторинг скорости исчезновения глюкозы в течение периода времени у индивидуумов с диабетом 2 типа, которым вводили 60 Е или 90 Е инсулин-FDKP и инсулин лизпро в начале приема пищи.
На ФИГ. 12 представлен график данных из исследования, в котором сравнивали применение инсулин-FDKP и инсулина гларгин с инсулином аспарт и инсулином гларгин, на котором показаны профили глюкозы в крови из 7 точек на 52 неделе исследования.
На ФИГ. 13 представлен график, на котором показаны данные экспериментов по измерению уровней глюкозы в крови натощак в образцах крови у индивидуумов, которым проводили подкожные инъекции базального инсулина (инсулина гларгин/LANTUS®) на ночь, и инсулин-FDKP, который вводили с приемом пищи путем легочной ингаляции. Также на графике представлены данные группы сравнения, т.е., индивидуумов, которым вводили смесь NOVOLOG® 70/30 (предварительная смесь) на завтрак и ужин, как рекомендовано изготовителем. У всех индивидуумов был диагностирован субоптимально контролируемый диабет 2 типа, и их ранее лечили режимами подкожных препаратов инсулина с антигипергликемическими средствами или без них.
На ФИГ. 14 представлен график, на котором представлены данные экспериментов по измерению средних уровней глюкозы в крови в образцах, взятых в семь моментов времени в течение суток, т.е., натощак, после завтрака, перед обедом, после обеда, перед ужином, после ужина и на ночь в течение трех суток в течение указанной недели, у индивидуумов, которым вводили инсулин гларгин на ночь и прандиальный инсулин-FDKP путем легочной ингаляции на первой неделе лечения (штриховые линии; исходный уровень) и на 52 неделе (сплошная линия) лечения. Данные показывают повышение концентрации глюкозы в крови у индивидуумов с диабетом 2 типа в течение суток, однако данные для 52 недели указывают на то, что уровни глюкозы в крови были значительно более низкими, чем при начале лечения и лучше контролировались.
На ФИГ. 15 представлена схема испытания для клинического исследования, сравнивающего прандиальный TI (инсулин-FDKP) (группа 1) с метформином + усилитель секреции (группа 2) и прандиальным TI + метформин (группа 3).
На ФИГ. 16 представлены исходные демографические данные для пациентов, включенных в исследование, представленное на ФИГ. 15.
На ФИГ. 17 представлено снижение HbA1c после 12 и 24 недель лечения TI отдельно, TI и метформином, или метформином и усилителем секреции. Термины "оставленные", "переведенные", "непереведенные" и "все переведенные" определены на фигуре 15.
На ФИГ. 18 представлена доля пациентов, достигших целевого HbA1c ≤7% после 12 и 24 недель лечения TI отдельно, TI и метформином, или метформином и усилителем секреции.
На ФИГ. 19 представлена доля пациентов, достигших целевого HbA1c <6,5% после 12 и 24 недель лечения TI отдельно, TI и метформином, или метформином и усилителем секреции.
На Фиг. 20 представлены уровни глюкозы в крови после 12 и 24 недель лечения TI отдельно.
На ФИГ. 21 представлены уровни глюкозы в крови после 12 и 24 недель лечения метформином и усилителем секреции.
На ФИГ. 22 представлены уровни глюкозы в крови после 12 и 24 недель лечения TI и метформином.
На ФИГ. 23 представлены уровни глюкозы в крови через 1 и 2 часа после приема пищи после 12 и 24 недель лечения TI отдельно.
На ФИГ. 24 представлены уровни глюкозы в крови через 1 и 2 часа после приема пищи после 12 и 24 недель лечения метформином и усилителем секреции.
На ФИГ. 25 представлены уровни глюкозы в крови через 1 и 2 часа после приема пищи после 12 и 24 недель лечения TI и метформином.
На ФИГ. 26 представлены изменения колебаний концентрации глюкозы в крови (измеренные как изменение уровней AUC (мг•ч/дл) после 12 и 24 недель лечения метформином и усилителем секреции.
На ФИГ. 27 представлены уровни глюкозы в крови натощак после 12 и 24 недель лечения TI отдельно, TI и метформином, или метформином и усилителем секреции.
На ФИГ. 28 представлены изменения массы после 12 и 24 недель лечения TI отдельно, TI и метформином, или метформином и усилителем секреции.
ОПРЕДЕЛЕНИЕ ТЕРМИНОВ
Перед изложением подробного описания, может быть полезным предоставление объяснения некоторых терминов, которые использованы в дальнейшем в настоящем документе:
Сухой порошок: как используют в настоящем документе "сухой порошок" относится к композиции мелких частиц, которая не суспендирована или не растворена в пропелленте, носителе или другой жидкости. Это не подразумевает полного отсутствия молекул воды.
Первая фаза: как используют в настоящем документе, "первая фаза" относится к волне уровня инсулина, индуцируемой болюсной внутривенной инъекцией глюкозы. Первая фаза высвобождения инсулина обеспечивает волну концентрации инсулина в крови, которая представляет собой быстрый пик, который затем убывает относительно быстро.
Ранняя фаза: как используют в настоящем документе "ранняя фаза" относится к повышению концентрации инсулина в крови, индуцируемому в ответ на прием пищи, которое достигает пика в пределах 20-30 минут. Отличий между ранней фазой и первой фазой не всегда тщательно придерживаются в общей литературе.
Колебание: как используют в настоящем документе, "колебание" относится к концентрациям глюкозы в крови, которые находятся либо выше, либо ниже исходного уровня до приема пищи или другой начальной точки. Колебания, как правило, выражают как площадь под кривой (AUC) на графике уровня глюкозы в крови с течением времени. AUC может быть выражена различным образом. В некоторых случаях, может происходить как снижение ниже, так и повышение выше исходного уровня, обеспечивающие положительную и отрицательную области. В некоторых вычислениях отрицательная AUC вычитается из положительной, а в других их абсолютные значения складываются. Положительные и отрицательные AUC также можно рассматривать по отдельности. Также можно использовать более сложную статистическую оценку. В некоторых примерах она также может относиться к концентрациям глюкозы в крови, которые повышаются или падают ниже нормального диапазона. Нормальная концентрация глюкозы в крови обычно составляет между 70 и 110 мг/дл у индивида натощак, менее чем 120 мг/дл через два часа после приема пищи, и менее чем 180 мг/дл после приема пищи.
Скорость элиминации глюкозы: как используют в настоящем документе, "скорость элиминации глюкозы" (GER) представляет собой скорость, с которой глюкоза исчезает из крови. С использованием клэмпа глюкозы ее можно определить как скорость инфузии глюкозы, требуемая для достижения стабильного уровня глюкозы в крови, часто приблизительно 120 мг/дл, в ходе экспериментальной процедуры клэмпа глюкозы. Эта скорость элиминации глюкозы равна скорости инфузии глюкозы, сокращаемой как GIR.
Фаза "медового месяца": как используют в настоящем документе, "фаза медового месяца" диабета 1 типа относится к ранним стадиям заболевания, характеризующимся утратой ранней фазы высвобождения инсулина, а оставшиеся функциональные β-клетки продуцируют немного инсулина, который высвобождается с кинетикой второй фазы.
Гипергликемия: как используют в настоящем документе, "гипергликемия" представляет собой концентрацию глюкозы в крови натощак выше нормы, обычно 126 мг/дл или выше. В некоторых исследованиях гипергликемические явления определяли как концентрации глюкозы в крови, превышающие 280 мг/дл (15,6 мМ).
Гипогликемия: как используют в настоящем документе, "гипогликемия" представляет собой концентрацию глюкозы в крови ниже нормы, обычно менее 63 мг/дл (3,5 мМ). Клинически значимую гипогликемию определяют как концентрация глюкозы в крови ниже 63 мг/дл или концентрация, вызывающая симптомы у пациента, такие как когнитивное нарушение, поведенческие изменения, бледность, потоотделение, гипотония, приливы крови и слабость, которые являются общепризнанными симптомами гипогликемии и которые исчезают при употреблении достаточного количества калорий. Тяжелую гипогликемию определяют как гипогликемическое явление, которое требует инъекций глюкагона, инфузий глюкозы или помощи со стороны.
Вблизи: как используют в настоящем документе, термин "вблизи", используемый в отношении приема пищи, относится к периоду, близкому по времени к началу приема пищи.
Композиция инсулина: как используют в настоящем документе, "композиция инсулина" относится к любой форме инсулина, пригодной для введения млекопитающему, и включает инсулин, выделенный из млекопитающего, рекомбинантный инсулин, инсулин, связанный с другими молекулами или преобразованный ими, и молекулы инсулина с измененными последовательностями, при условии, что они сохраняют клинически значимую активность снижения уровня глюкозы в крови. Также включаются композиции инсулина, пригодные для введения любым путем, включая легочный, подкожный, назальный, пероральный, буккальный и сублингвальный. Композиции инсулина можно изготавливать в качестве сухих порошков, водных растворов или суспензий или неводных растворов или суспензий (что является типичным для ингаляторов с отмеряемой дозой) для ингаляции; водных растворов или суспензий для подкожного, сублингвального, буккального, назального или перорального введения; и твердых дозированных форм для перорального и сублингвального введения.
Связанное с инсулином нарушение: как используют в настоящем документе, термин "связанные с инсулином нарушения" относится к нарушениям, вовлекающим продукцию, регуляцию, метаболизм и действие инсулина у млекопитающего. Связанные с инсулином нарушения включают, но не ограничиваются ими, предиабет, сахарный диабет 1 типа, сахарный диабет 2 типа, гипогликемию, гипергликемию, резистентность к инсулину, секреторную дисфункцию, утрату функции β-клеток поджелудочной железы и утрату β-клеток поджелудочной железы.
Неинсулинзависимые пациенты, имеющие связанные с инсулином нарушения: как используют в настоящем документе выражение "неинсулинзависимые пациенты, имеющие связанные с инсулином нарушения" относится к пациентам с нарушениями, для которых терапия экзогенно предоставляемым инсулином не является стандартным лечением согласно диагнозу. Неинсулинзависимые пациенты, имеющие связанные с инсулином нарушения, которые не лечат экзогенно вводимым инсулином, включают пациентов с диабетом 2 типа, диабетом 1 типа в фазу "медового месяца", пациентов с предиабетом и реципиентов трансплантатов, продуцирующих инсулин клеток.
Резистентность к инсулину: как используют в настоящем документе, термин "резистентность к инсулину" относится к неспособности клеток пациента отвечать на инсулин надлежащим образом или эффективно. Поджелудочная железа отвечает на эту проблему на клеточном уровне путем продукции большего количества инсулина. В конечном итоге поджелудочная железа не может поддерживать потребность организма в инсулине и в кровотоке скапливается избыток глюкозы. Пациенты с резистентностью к инсулину часто имеют высокие уровни глюкозы в крови и высокие уровни инсулина, циркулирующие в их кровотоке в одно время.
Диапазон резистентности к инсулину: как используют в настоящем документе "диапазон резистентности к инсулину" относится к диапазону, в котором степень резистентности пациента к инсулину может варьировать. Хорошо понятно, что от человека к человеку, и от одного момента в прогрессировании диабета 2 типа до другого степень резистентности к инсулину может отличаться. Несмотря на то, что не существует общепринятых единиц для резистентности к инсулину, специалист в данной области может определить низкую степень резистентности к инсулину в противоположность более высокой степени резистентности к инсулину. В идеальном случае резистентность к инсулину можно измерять с помощью способов эугликемического клэмпа, однако они не являются практичными для повседневного применения. Более простые способы оценки включают HOMA (см. Matthew DR, Hosker JP, Rudenski AS, et al., Homeostasis model assessment: insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man, Diabetologia 1985;28:412-419) и сходный QUICKI (Katz A, Nambi SS, Mather K, Baron AD, Follmann DA, Sullivan G, Quon MJ. Quantitative insulin sensitivity check index: a simple, accurate method for assessing insulin sensitivity in human. J Clin Endocrinol Metab. 2000 Jul;85(7):2402-10). В качестве показателя степени резистентности к инсулину также можно использовать непосредственно уровни инсулина в сыворотке натощак, причем концентрации 50-100 пмоль/л указывают на резистентность в нижней части диапазона и концентрации 300 пмоль/л указывают на резистентность в верхней части диапазона. Наконец, для пациентов, уже проходящих лечение инсулином, общую суточную дозу обычно принимают в качестве показателя того, имеет ли индивидуум высокую или низкую степень резистентности к инсулину.
Инсулин среднего действия: как используют в настоящем документе, "инсулин среднего действия" или инсулин ленте, относится к инсулину с началом действия, обычно приблизительно от двух до четырех часов после инъекции и пиками от четырех до 12 часов после инъекции, и он продолжает действовать в течение от 10 до 18 часов. Типичные препараты инсулина среднего действия получают путем смешивания регулярного инсулина с веществом, которое обеспечивает всасывание инсулина медленнее. Неограничивающим примером является инсулин NPH. Инсулин среднего действия может обеспечить многие из преимуществ инсулина длительного действия.
Инсулин длительного действия: как используют в настоящем документе, термин "инсулин длительного действия" относится к составу инсулина, который начинает работать в пределах приблизительно 1-6 часов и обеспечивает постоянный уровень активности инсулина в течение вплоть до 24 часов или более. Инсулин длительного действия действует с максимальной силой приблизительно через 8-12 часов, иногда дольше. Инсулин длительного действия обычно вводят утром и перед сном. Неограничивающие примеры инсулина длительного действия включают, но не ограничиваются ими, инсулин гларгин или инсулин детемир, которые являются аналогами инсулина, и инсулин ультраленте, который представляет собой регулярный инсулин человека, изготовленный для медленного всасывания. Инсулин длительного действия наилучшим образом подходит для удовлетворения потребностям в базальном, в противоположность прандиальному, инсулине.
Прием пищи: как используют в настоящем документе, термины "прием пищи", "приемы пищи" и/или "время приема пищи" и т.д. включают традиционные приемы пищи и время приема пищи; однако также они включают употребление какой-либо пищи не зависимо от размера и/или времени. Как используют в настоящем документе "устоявшийся прием пищи" относится к конкретным периодам в сутки для основного употребления пищи, таким как обычное или традиционное трехразовое питание. Некоторых диабетиков призывают к приемам пищи четыре раза в сутки в немного меньшем количестве для снижения максимальных уровней глюкозы в крови; такой прием пищи также включен в значение термина "устоявшийся прием пищи".
Микрочастицы: как используют в настоящем документе, термин "микрочастицы" включает микрокапсулы, имеющие наружную оболочку, состоящую либо из дикетопиперазина отдельно, либо из комбинации дикетопиперазина и одного или нескольких лекарственных средств. Также он включает микросферы, содержащие лекарственное средство, диспергированное по сфере; частицы неправильной формы; и частицы, в которых лекарственное средство нанесено на поверхность(и) частицы или заполняет их пустоты.
Прандиальный: как используют в настоящем документе, термин "прандиальный" относится к чему-либо для еды или перекуса. В зависимости от контекста он может относиться к периоду времени, меньшему чем через четыре часа после начала приема пищи, или к периоду, в течение которого продолжается употребление пищи.
Перипрандиальный: как используют в настоящем документе, "перипрандиальный" относится к периоду времени, начинающемуся непосредственно до и кончающемуся вскоре после употребления еды или закуски.
Постпрандиальный: как используют в настоящем документе, "постпрандиальный" относится к периоду времени, как правило час или более, после начала приема пищи и после завершения употребления пищи. Как используют в настоящем документе, "поздний постпрандиальный" относится к периоду времени после 2 часов после употребления еды или закуски.
Усиление: как правило, усиление относится к состоянию или действию, которое повышает эффективность или активность некоторого средства выше уровня, которого средство может в ином случае достигнуть. Аналогично, оно может относиться прямо к повышению эффекта или активности. Как используют в настоящем документе, "усиление", в частности, относится к способности повышенных концентраций инсулина в крови повышать эффективность последующих уровней инсулина, например, в отношении повышения скорости элиминации глюкозы.
Предиабетический: как используют в настоящем документе, термин "предиабетический" относится к пациенту с нарушенной толерантностью к глюкозе натощак, т.е. к уровню глюкозы в крови натощак между 100 мг/дл (5,5 ммоль/л) и 126 мг/дл (7,0 ммоль/л), или к 2-часовому постпрандиальному уровню глюкозы в крови между 140 мг/дл (7,8 ммоль/л) и 200 мг/дл (11,1 ммоль/л).
Быстродействующий инсулин: как используют в настоящем документе, термин "быстродействующий инсулин" относится к составу инсулина, который достигает максимальной концентрации в крови в течение приблизительно 45-90 минут, и максимальной активности приблизительно от одного до 3 часов после введения. Быстродействующий инсулин может оставаться активным в течение приблизительно от четырех до шести часов. Неограничивающим примером быстродействующего инсулина является аналог инсулина лизпро (HUMALOG®). Кинетические профили, попадающие в это определение, имеются у снятого с продажи продукта EXUBERA® и экспериментального состава VIAJECT® (Biodel Inc.), основанных на регулярном инсулине человека.
Вторая фаза: как используют в настоящем документе, "вторая фаза" относится к беспиковому высвобождению инсулина в ответ на повышенные уровни глюкозы в крови. Это отличается от "кинетики второй фазы", которая относится к медленному убыванию умеренно повышенных уровней инсулина в крови обратно до исходного уровня.
Инсулин короткого действия: как используют в настоящем документе термин "инсулин короткого действия" включает регулярный инсулин и быстродействующие препараты, как правило, используемые приблизительно во время приема пищи.
Закуска: как используют в настоящем документе "закуска" относится конкретно к пище, употребляемой между устоявшимися приемами пищи.
Супрессор продукции глюкозы печенью: как используют в настоящем документе, выражение "супрессор продукции глюкозы печенью" относится к лекарственным средствам, которые подавляют продукцию глюкозы печенью (глюконеогенез в печени, мобилизация из запасов гликогена). Неограничивающим примером супрессора продукции глюкозы печенью является метформин.
Инсулин TECHNOSPHERE®: как используют в настоящем документе, "инсулин TECHNOSPHERE®" или "TI" относится к композиции инсулина, содержащей регулярный инсулин человека и микрочастицы TECHNOSPHERE®, систему для доставки лекарственного средства. Микрочастицы TECHNOSPHERE® содержат дикетопиперазин, конкретно 3,6-ди(фумарил-4-аминобутил)-2,5-дикетопиперазин (фумарилдикетопиперазин, FDKP). Конкретно, инсулин TECHNOSPHERE® содержит композицию FDKP/инсулин человека. Инсулин TECHNOSPHERE® представляет собой сверхбыстродействующий инсулин, доставляемый путем легочного введения, и он имитирует физиологическое высвобождение инсулина ранней фазы во время приема пищи. Этот состав также имеет генерическое название "инсулин-FDKP". В некоторых контекстах продукт называют порошком мономера инсулина человека [происхождение из рДНК] для ингаляций.
Как используют в настоящем документе, "дикетопиперазин" или "DKP" включает дикетопиперазины и их соли, производные, аналоги и модификации, находящиеся в объеме общей формулы 1, где атомы кольца E1 и E2 в положениях 1 и 4 представляют собой либо O, либо N, и по меньшей мере одна из боковых цепей R1 и R2, расположенных в положениях 3 и 6, соответственно, содержит группу карбоновой кислоты (карбоксилата). Соединения формулы 1 включают, без ограничений, дикетопиперазины, дикетоморфолины и дикетодиоксаны и их аналоги с заменами.
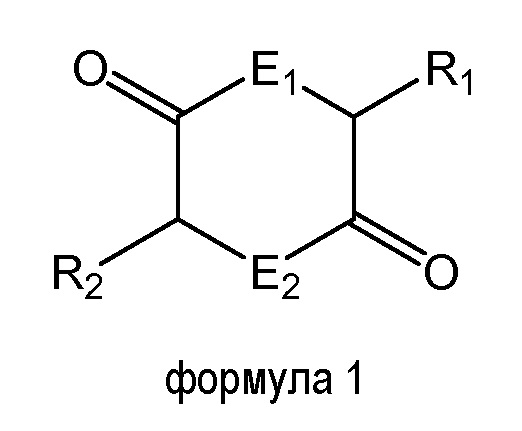
Микрочастицы дикетопиперазина, в дополнение к обеспечению аэродинамически подходящих микрочастиц, обеспечивающих доставку глубоко в легкое, также быстро растворяются и высвобождают любое доставляемое лекарственное средство, далее ускоряя всасывание в кровоток. Дикетопиперазины могут иметь форму частиц, которые включают лекарственное средство или частицы, на которые лекарственное средство может быть адсорбировано. Комбинация лекарственного средства и дикетопиперазина может обеспечить повышенную стабильность лекарственного средства. Эти частицы можно вводить различными способами введения. В качестве сухих порошков эти частицы можно доставлять путем ингаляции в конкретные области дыхательной системы, в зависимости от размера частиц. Кроме того, можно получать частицы, достаточно малые для включения во внутривенную суспензионную дозированную форму. Также возможна пероральная доставка, где частицы включают в суспензию, таблетки или капсулы.
В другом варианте осуществления настоящего изобретения DKP представляет собой производное 3,6-ди(4-аминобутил)-2,5-дикетопиперазина, которое может быть получено (термической) конденсацией аминокислоты лизина. Иллюстративные производные включают 3,6-ди(сукцинил-4-аминобутил)-, 3,6-ди(малеил-4-аминобутил)-, 3,6-ди(глутарил-4-аминобутил)-, 3,6-ди(малонил-4-аминобутил)-, 3,6-ди(оксалил-4-аминобутил)- и 3,6-ди(фумарил-4-аминобутил)-2,5-дикетопиперазин. Применение DKP для доставки лекарственного средства известно в данной области (см. например патенты США No. 5352461, 5503852, 6071497 и 6331318, каждый из которых включен в настоящий документ в качестве ссылки для всего, что в нем указано в отношении дикетопиперазинов и опосредуемой дикетопиперазином доставки лекарственных средств). Применение солей DKP описано в совместно рассматриваемой патентной заявке США No. 11/210710, поданной 23 августа 2005 года, которая включена в настоящий документ в качестве ссылки для всех ее указаний в отношении солей дикетопиперазина. Легочная доставка лекарственных средств с использованием микрочастиц DKP описана в патенте США No. 6428771, который включен в качестве ссылки в полном объеме.
TECHNOSPHERE®/плацебо: Как используют в настоящем документе, "TECHNOSPHERE®/плацебо" относится к частицам TECHNOSPHERE®, которые не связаны с инсулином или другим активным веществом.
Tmax: как используют в настоящем документе, термин "Tmax" относится к времени от введения до достижения параметром (таким как концентрация или активность) его максимального значения.
Единицы измерения: подкожные и внутривенные дозировки инсулина выражают в МЕ, которые определяют в стандартизованных биологических измерениях. Количества инсулина, изготовленного с фумарилдикетопиперазином, также описаны в МЕ, поскольку они являются показателями инсулина в крови. Дозировки TECHNOSPHERE®/инсулина выражают в произвольных единицах (Е), которые являются числовым эквивалентом инсулина, включенного в состав дозировки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Инсулин-FDKP был открыт как сверхбыстродействующий инсулин, способный имитировать физиологическое высвобождение инсулина ранней фазы во время приема пищи. Что касается изучения того, каким образом препарат инсулина с этим уникальным фармакокинетическим профилем можно успешно использовать при лечении диабета 2 типа, его до настоящего времени оценивают по сравнению с другими препаратами инсулина (см. например патентные заявки США No. 11/032278, 11/329686, 11/278381 и 11/461746, каждая из которых включена в настоящий документ в качестве ссылки в полном объеме). Варианты осуществления, описанные в настоящем документе, относятся к тому, каким образом конкретные дозировки и способы введения таких препаратов инсулина можно выбирать для конкретных пациентов и применять в различных популяциях пациентов для преимущественного эффекта. Определенные варианты осуществления относятся к тому, как такие препараты инсулина можно использовать в комбинации с пероральными противодиабетическими средствами, в частности, сенсибилизаторами к инсулину и усилителями секреции инсулина, и/или вместо них, для достижения сходного или преимущественного эффекта. Некоторые другие варианты осуществления относятся к тому, как такие препараты инсулина можно использовать в комбинации с экзогенно предоставляемыми препаратами базального инсулина и/или вместо них для достижения сходного или преимущественного эффекта. Сходное описание также представлено в предварительных патентных заявках США No. 61/087943, 61/097495, 61/097516 и 61/138863, каждая из которых включена в настоящий документ в качестве ссылки в полном объеме.
Как правило, различные варианты осуществления вовлекают применение прандиального сверхбыстродействующего инсулина у определенных популяций. Эти популяции людей могут быть названы людьми, нуждающимися в одном или другом или нескольких из преимуществ, обеспечиваемых различными описанными способами, способными получить пользу от них или желающими получить пользу от них. Такие преимущества могут выражаться как получение установленной клинической пользы или стремление к ней. Также такие преимущества могут включать устранение или предотвращение различных побочных эффектов, неблагоприятных исходов, противопоказаний и т.п., или снижение риска или возможности их возникновения. Аналогично способы могут вовлекать стадию выбора пациента, исходя из того, что он является частью одной или другой популяции. Следует понимать, что выбор может включать оценку пациента врачом или другим работником здравоохранения в отношении конкретных параметров, но также он может включать самостоятельный выбор пациентом лечения, исходя из сходных данных или принимая совет врача или другого работника здравоохранения. Аналогично, стадии введения этих способов могут включать естественный прием лекарственного средства (или аналогично прекращение лечения лекарственным средством) пациентом, но также они могут включать назначение или предоставление другой конкретной инструкции по приему (или прекращению) лекарственного средства врачом или другим работником здравоохранения. Следующие варианты осуществления изобретения включают применение сверхбыстродействующих препаратов, композиций или составов инсулина для таких целей, и для изготовления лекарственных средств для таких целей.
Как используют в настоящем документе, имитация физиологической ранней фазы высвобождения инсулина во время приема пищи (или сходные термины) не обязательно указывают на точное воспроизведение всех признаков физиологического ответа. Она может относиться к препаратам инсулина и способам обеспечения волны или пика концентрации инсулины в крови, которые представляют собой как относительно быстрый подъем, так и падение концентрации. В определенных вариантах осуществления подъем до пиковой концентрации занимает менее 30 минут, предпочтительно, менее чем приблизительно 20 минут или 15 минут и в следующих вариантах осуществления он отнимает по меньшей мере 5 или по меньшей мере 10 минут до достижения пика; например, достижение пиковой концентрации в течение 12-14 минут или 10-20 минут, и т.д., после введения или первого отклонения от исходного уровня. В определенных вариантах осуществления падение после достижения пиковой концентрации инсулина вовлекает снижение до половины максимального уровня через 80 минут, альтернативно 50 минут, или альтернативно 35 минут после достижения пика. Как правило, концентрация инсулина достигает исходного уровня от 2 до 3 часов после введения. Это отличается от препаратов инсулина и способов обеспечения более постепенного подъема (от 30 минут до несколько часов) до максимальной достигаемой концентрации инсулина и длительного плато около максимальной концентрации. Быстродействующие аналоги (RAA) в большей степени демонстрируют достижение пика, чем регулярный инсулин человека, но даже для наиболее быстрого из коммерчески доступных RAA, как описано в информации об их назначении, инсулина лизпро (HUMALOG®), описано Tmax, составляющее 30-90 минут. Для сравнения, для инсулина аспарт (NOVOLOG®) описано срединное Tmax 40-50 минут у индивидуумов с диабетом 1 типа, а для инсулина глулизин (APIDRA®) описано срединное Tmax 60 и 100 минут у индивидуумов с диабетом 1 типа и диабетом 2 типа, соответственно с диапазоном 40-120 минут в обеих популяциях. Более того, для RAA требуется приблизительно 6 часов для возвращения концентрация к исходному уровню. Имитация физиологической ранней фазы высвобождения инсулина во время приема пищи также может относиться к препаратам инсулина и способам, в которых волна в концентрации инсулина может достоверно согласовываться с началом приема пищи. Также она может относиться к достижению (и к связанным с ним способов) максимальной скорости элиминации глюкозы (GERmax) в пределах приблизительно 30-90 минут, предпочтительно, приблизительно 45-60 минут, после введения. Препараты инсулина с такими характеристиками называют в настоящем документе сверхбыстродействующими. В вариантах осуществления изобретения способы, которые имитируют раннюю фазу высвобождения, как правило, также представляют собой способы, которые могут выполняться самими диабетиками без специального медицинского обучения, такого как обучение внутривенной инъекции. Специальное медицинское обучение не включает обучение применению медицинских устройств, таких как ингаляторы сухих порошков, которые обычно используют лица, которые не обучаются медицинскими специалистами. В некоторых вариантах осуществления сверхбыстродействующий инсулин можно вводить при каждом употреблении любой пищи, независимо от размера и/или времени. Тем не менее, предпочтительно, чтобы инсулин вводили только с приемом пищи, обеспечивающим по меньшей мере пороговую гликемическую нагрузку (которая может зависеть от дозы инсулина), так чтобы предотвратить риск гипогликемии. Различные способы оценки гликемической нагрузки известны в данной области, в том числе "подсчет углеводов" (вычисление/оценка количества грамм углеводов в пище), использование хлебных единиц и учет гликемического индекса употребляемых продуктов.
Значение термина "сверхбыстрый" также может быть понятным из дальнейшего сравнения с другими препаратами инсулина. Регулярные препараты инсулина человека для подкожной инъекции считают препаратами короткого действия, называемыми так, главным образом, вследствие их длительности действия. Как правило, достижение ими максимальной концентрации инсулина в крови отнимает по меньшей мере 1-2 часов, и достижение максимальной активности может отнять 2-4 часа. Значительный подъем или активность могут длиться до 10-12 часов. Другие препараты инсулина короткого действия включают быстродействующие аналоги инсулина, такие как инсулин аспарт, инсулин глулизин и инсулин лизпро. Поскольку эти препараты инсулина легче диссоциируют из гексамера на мономеры при инъекции, они достигают пиковых концентраций в крови быстрее (30-100 минут) и, следовательно, также имеют более быстрое начало действия, чем у регулярного инсулина человека. Препараты инсулина для легочного введения, такие как в настоящее время снятый с продажи продукт EXUBERA®, проявляют фармакодинамику, сходную с быстродействующими аналогами. Было опубликовано сравнение фармакодинамических профилей нескольких легочных составов, инсулина лизпро и инсулин-FDKP, показывающее, что инсулин-FDKP определенно быстрее достигает максимальной активности и она скорее снижается в сторону исходного уровня (Heinemann et al. Br J Diab Dis 4:295-301, 2004). Таким образом, в то время как сверхбыстродействующий инсулин тратит приблизительно две трети его активности снижения инсулина в пределах 2 часов после введения, эти другие препараты, как правило, тратят приблизительно треть или менее активности снижения инсулина за тот же период времени. С другой стороны этого диапазона находятся препараты инсулина длительного действия, такие как инсулин гларгин или инсулин детемир, которые в идеальном случае обеспечивают постоянный уровень активности инсулина в течение длительных периодов времени, например вплоть до 24 часов. Они предназначены для обеспечения базальной активности и, как правило, их вводят один раз в сутки или два раза в сутки. По существу, быстрота начала действия не является критическим параметром. Наконец, существуют препараты инсулина, называемые препаратами среднего действия с длительностью действия между продуктами короткого действия и длительного действия.
Понятно, что повышение GER, приводящее к быстрому достижению GERmax, зависит не только от быстроты повышения концентрации инсулина, но также от достижения достаточной высоты пика. Для диабетиков 1 типа она представляет собой пиковую концентрацию инсулина по меньшей мере приблизительно 60 мЕ/л, предпочтительно по меньшей мере приблизительно 80 мЕ/л. Для диабетиков 2 типа резистентность к инсулину, которая является частью состояния, может сделать необходимыми более высокие концентрации инсулина, как правило, по меньшей мере приблизительно 100 мЕ/л, предпочтительно, по меньшей мере приблизительно 120 мЕ/л, по меньшей мере приблизительно 140 мЕ/л, или более, в зависимости от степени резистентности. Таким образом, в различных вариантах осуществления высота пика по меньшей мере на 60, 100 или 120 мЕ/л превышает исходный уровень концентрации инсулина до дозирования. Эти пиковые концентрации инсулина по существу превышают концентрации, достигаемые типичными дозами не вызывающих волны продуктов инсулина, таких как стандартные препараты для подкожного введения, включая препараты, называемые быстродействующими или скородействующими, и препараты для неинъекционного введения, имеющие сходную кинетику, которая описана.
Сравнительно медленное и плавное повышение концентрации инсулина и пролонгированный период действия, связанные с препаратами инсулина, которые не имитируют раннюю фазу высвобождения, ограничивают способность контролировать колебания глюкозы. Доза, которую можно вводить, обычно является недостаточной для контроля повышения уровня глюкозы в крови после приема пищи вследствие уменьшения необходимости в избегании гипогликемии после гликемической нагрузки при приеме пищи. Эти вопросы, кроме того, рассмотрены в совместно рассматриваемой патентной заявке США No. 11/278381, которая включена в настоящий документ в качестве ссылки в полном объеме. Следовательно, резкие колебания концентраций глюкозы в крови (измеренные, например, в качестве MAGE: средней амплитуды гликемических колебаний) имеют больший эффект, чем хроническая гипергликемия (как правило, измеренная как уровень Hb1Ac), на ассоциированный с диабетом окислительный стресс, и, таким образом, являются важным параметром для контроля в целях предотвращения диабетических осложнений, свойственных такому стрессу (см. Monnier, L., et al. JAMA 295:1681-1687, 2006; и Brownlee, M. & Hirsch, I. JAMA 295:1707-1708, которые включены в настоящий документ в качестве ссылок в полном объеме). Кроме того, заявитель подразумевает, что высокий выброс и высокая скорость изменения концентрации инсулина подавляют продукцию глюкагона, снижающего высвобождение глюкозы печенью. Это приводит к снижению гликемической нагрузки, и, следовательно, к уменьшению потребности в инсулине и сниженных колебаниях глюкозы.
Сверхбыстродействующий инсулин особенно хорошо подходит для контроля постпрандиального уровня глюкозы в крови (PPG). (Для обзора значимости PPG см. MannKind Corporation. Postprandial hyperglycemia: Clinical significance, pathogenesis and treatment. Valencia, CA: MannKind Corporation; 2009:1-20). Сверхбыстрая кинетика не только обеспечивает лучшее соответствие активности инсулина времени, когда глюкоза всасывается из пищи, также аналогично происходит более быстрая и преимущественно распределенная по времени супрессия продукции глюкозы печенью (см. пример 1). Таким образом, она направлена на оба источника глюкозы, приводящие к постпрандиальной гипергликемии. Варианты осуществления, описанные в настоящем документе, направлены на ограничение 1- и 2-часового PPG до ≤140 мг/дл, ≤180 мг/дл или ≤200 мг/дл. Неожиданно, стало очевидным, что контроль уровней PPG имеет длительные благоприятные эффекты также на уровни глюкозы в крови натощак. Учитывая эти свойства и данные о клиническом применении, представленные в примерах ниже, в настоящем документе описано, как сверхбыстродействующие инсулины, такие как инсулин-FDKP можно преимущественно использовать в конкретных популяциях пациентов отдельно или в комбинации со стандартными пероральными противодиабетическими лекарственными средствами и в противоположность современным моделям лечения.
Лечение диабета традиционно сфокусировано на контроле средних концентраций глюкозы в крови, отражаемых уровнями Hb1Ac. Описанные в настоящем документе способы предназначены для минимизации не только уровней Hb1Ac (средняя концентрация глюкозы в крови) и сопутствующей токсичности глюкозы; но также для контроля резких отклонений в концентрации глюкозы (колебаний концентрации глюкозы). Снижение колебаний концентрации глюкозы также смягчает общую воспалительную нагрузку и окислительное повреждение микрососудов вследствие окислительного стресса. Таким образом, даже для пациентов, у которых замена сверхбыстродействующего инсулина одним или несколькими пероральными лекарственными средствами может приводить только к сходному контролю уровней HbA1c, лечение может обеспечить преимущество относительно лечения пероральными лекарственными средствами отдельно. Действительно, оно представляет собой преимущество, которое также не достижимо добавлением базального инсулина к режиму лечения. Также нельзя ожидать, что быстродействующие инсулины отдельно обеспечат это преимущество в полной мере, особенно по сравнению с оптимизированной дозой сверхбыстродействующего инсулина.
Этого преимущества достигают путем повседневного введения препарата инсулина, имитирующего высвобождение ранней фазы, который представляет собой сверхбыстродействующий препарат инсулина, вместе по меньшей мере с одним, предпочтительно по меньшей мере двумя или тремя приемами пищи в сутки, или с каждым устоявшимся приемом пищи, или с каждым приемом пищи, включая закуски. Такое лечение должно поддерживаться, для увеличения преимуществ и для повышения эффективности в течение любого количества суток, недель, месяцев и лет, вплоть до конца жизни пациента (или до того времени, когда исходное связанное с инсулином нарушение будет вылечено или иным образом смягчено). Под "повседневным" подразумевают, что указанная схема введения является идеальной и обычно используемой, однако отклонения от реальной мировой практики этого протокола, такие как случайно пропущенный прием пищи или пропущенные дозы, не отклоняются от объема заявленного изобретения. В различных вариантах осуществления инсулин обычно вводят с любым приемом пищи или закуски, которые в ином случае приведут к превышению уровня глюкозы 140 мг/дл, или альтернативно 180 мг/дл; с любой пищей или закуской, соответствующими 1, 2, 3 или более хлебных единиц; с любой пищей или закуской, содержащей более чем приблизительно 15, 20, 30 или 45 г углеводов.
Варианты осуществления способов, описанных в настоящем документе, включают множество режимов дозирования, включая, но не ограничиваясь ими, дозирование при каждом приеме пищи или закуски, дозирование при каждом приеме пищи или закуски с содержанием углеводов более 15 г, дозирование при каждом приеме пищи или закуски с содержанием углеводов более 30 г, при каждом приеме пищи или закуски с содержанием углеводов более 45 г. Дозировки и желаемые концентрации композиции инсулина могут варьировать, в зависимости от конкретного предусмотренного применения. Определение соответствующей дозировки или способа введения обычно находится в пределах квалификации специалиста в данной области. Однако врачи наиболее часто знакомы с жидкими составами инсулина, которые позволяют постоянное варьирование дозы. Инсулин-FDKP поставляется в качестве сухого порошка в предварительно отмеренных единичных дозах. Таким образом, в настоящем документе описаны конкретные инструкции для определения соответствующих дозировок инсулин-FDKP для индивидуума. Более того длительность лечения может варьировать в зависимости от конкретного применения, и определение длительности лечения находится в пределах квалификации специалиста в данной области.
Быстрое всасывание и по существу отсутствие концевой части профиля активности сверхбыстродействующих препаратов инсулина, таких как инсулин-FDKP, также подразумевают, что они обеспечивает снижение возможности индукции гипогликемии по сравнению с другими препаратами инсулина. Понятно, что употребление закуски для противодействия поздней постпрандиальной гипогликемии приводит к увеличению массы тела, ассоциированому со стандартными способами лечения инсулином. Напротив, применение инсулин-FDKP ассоциировано с отсутствием увеличения массы тела; действительно, наблюдали снижение массы тела.
Внутривенная инъекция инсулина может эффективно воспроизводить первую фазу ответа и почти соответствовать ранней фазе ответа, однако она не является практичным способом лечения длящегося всю жизнь состояния, требующего многократных ежедневных введений. По этим причинам инсулин для внутривенной инъекции не подразумевается под термином "сверхбыстродействующие препараты инсулина", как используют в настоящем документе. Традиционные подкожные инъекции всасываются в кровоток сравнительно медленно, даже при использовании быстродействующих составов, которые, тем не менее, отнимают час для достижения максимальной концентрации в крови и имеют плато, длящееся несколько часов. Многие легочные составы, которые оценивали, являются эквивалентами подкожного инсулина по эффективности и аналогично не достигают сверхбыстрой кинетики, требуемой для имитации ранней фазы высвобождения, как определено выше. Тем не менее, существует возможность действительно быстрого всасывания при использовании невнутривенной доставки, такой как легочное и пероральное введение или подкожное введение составов, содержащих усиливающие всасывание эксципиенты. Как описано в настоящем документе, использовали доставку с использованием составов сухого порошка на основе дикетопиперазина.
Таким образом, предпочтительный вариант осуществления обеспечивает способ достижения желаемой подобной ранней фазе кинетики путем легочного введения состава инсулина в виде сухого порошка, содержащего инсулин в комплексе с микрочастицами дикетопиперазина. Этот состав быстро всасывается, достигая пиковых уровней в сыворотке в пределах приблизительно от 10 до 15 минут. Это является достаточно быстрым для имитации кинетики физиологической связанной с приемом пищи ранней фазы ответа инсулина. Короткое резкое повышение до пиковых концентраций инсулина в сыворотке является критическим для быстрой супрессии эндогенной продукции глюкозы и имеет дополнительный эффект сжатия основной части действия инсулина до перипрандиального временного интервала, в противоположность составам более медленного действия. Это снижает величину и длительность каких-либо связанных с приемом пищи отклонений от нормальных уровней глюкозы и связанную с глюкозой токсичность, а также риск гипогликемии после приема пищи. Такой улучшенный контроль уровней глюкозы в крови, достигаемый с помощью этого сухого порошка инсулина, более подробно описан в совместно рассматриваемой патентной заявке США No. 11/278381, поданной 3/31/06, которая включена в настоящий документ в качестве ссылки в полном объеме. Как описано в заявке США No. 11/329686 и указано выше, предварительно высокие уровни инсулина усиливают скорость элиминации глюкозы, что означает, что глюкоза может элиминироваться быстрее, если существует предшествующая волна высокой концентрации инсулина.
Системы для доставки лекарственного средства на основе микрочастиц дикетопиперазина и связанные с ними способы описаны в патентах США 5352461 и 5503852. Применение дикетопиперазина и микрочастиц биодеградируемого полимера при легочной доставке описано в патентах США 6428771 и 6071497. Детали, касающиеся различных аспектов возможных составов и процессов производства, могут быть найдены в патентах США 6444226 и 6652885; в патенте США 6440463; в совместно рассматриваемых предварительных патентных заявках США No. 60/717524, поданной 9/14/05; и 60/776605, поданной 4/14/06. Свойства и конструкция предпочтительной запускаемой вдохом системы для ингаляции сухого порошка описаны в патентной заявке США No. 10/655153. Аспекты лечения с использованием инсулина в комплексе с микрочастицами дикетопиперазина описаны в патенте США 6652885, а также в совместно рассматриваемой патентной заявке США No. 11/032278. Кроме того, в патентной заявке США No. 11/210710 описано применение солей дикетопиперазина для получения инсулина как для легочной, так и для пероральной доставки. Каждый из патентов и патентных заявок, упомянутых в этом абзаце, включен в настоящий документ в качестве ссылок в полном объеме.
Независимо от того, вводят инсулин-FDKP или другой препарат инсулина, имитирующий раннюю фазу высвобождения, отдельно или вместе с другим средством, таким как базальный инсулин, супрессор высвобождения глюкозы печенью, такой как метформин, или сенсибилизирующее к инсулину лекарственное средство, например тиазолидиндион (TZD), сверхбыстродействующий инсулин вводят вместе с устоявшимися приемами пищи, по меньшей мере один раз и предпочтительно от двух до четырех раз в сутки, или большее количество раз вплоть до введения с каждым приемом пищи, в зависимости от необходимости. Для достижения максимальной пользы от лечения, его следует проводить в течение длительного периода времени, предпочтительно, по меньшей мере 12 недель, более предпочтительно, по меньшей мере 24 недель, еще более предпочтительно от приблизительно 6 месяцев до приблизительно двух лет, и наиболее предпочтительно в течение оставшейся жизни пациента или до излечения исходного диабета.
Современное лечение диабета, главным образом, нацелено на снижение уровней HbA1c до 7% или ниже. Уровни HbA1c выше 8% указывают на то, что следует провести переоценку текущей терапии пациента. Может быть желательным достижение нормальных уровней HbA1c, но с помощью современных поставляемых на рынок продуктов инсулина это можно осуществить только с неприемлемым риском тяжелой гипогликемии. Таким образом, пациентов с уровнями HbA1c ниже 8% обычно не считают кандидатами для более интенсивного лечения, т.е. для лечения инсулином, особенно современными прандиальными препаратами инсулина. Даже пациенты с HbA1c выше 8%, но которым еще не вводили базальный или смешанный инсулин, не могут считаться кандидатами для лечения режимом прандиального инсулина. В вариантах осуществления, описанных в настоящем документе, риск гипогликемии значительно снижается, частично вследствие отсутствия концевой части активности инсулина, проявляемой сверхбыстродействующим инсулином, и является возможным лечение пациентов с HbA1c ниже 7%. Кроме того, пользы от снижения глюкозы в крови можно ожидать даже при верхнем пределе нормального диапазона. Например, одно исследование показало, что риск сердечно-сосудистых явлений является в 5-8 раз выше для индивидуумов с HbA1c>7% по сравнению с индивидуумами с HbA1c<5%. Другое исследование показало прогрессирующее повышение риска заболевания почек при переходе HbA1c от <6% до >8%. Таким образом, в некоторых вариантах осуществления для лечения отбирают пациентов с уровнями HbA1c ≤ 6,5% или ≤6%. Хотя способы, главным образом, рассмотрены применительно к пациентам-людям, адаптация к не являющимся человеком млекопитающим не выходит за объем описания или способностей специалиста в смежных областях.
Определение индивидуальной дозировки
Инсулин-FDKP представляет собой состав сухого порошка для ингаляции, предоставляемый в кассетах, содержащих предварительно отмеренное количество порошка, которые вставляют в ингалятор. Инсулин вводят путем ингаляции через ингалятор для доставки порошка в легкие. Могут быть предоставлены кассеты, содержащие различные дозы, и первоначальную дозировку можно получать либо с использованием отдельной кассеты, содержащей желаемую дозировку, либо с использованием нескольких кассет (за один раз).
Пациентом может быть диабетик с недостаточно контролируемой гипергликемией, например с HbA1c более 7%, или диабетик с достаточно контролируемыми уровнями глюкозы в крови, но желающий получить преимущества, достигаемые с помощью сверхбыстродействующего инсулина (например, снижение массы тела или предотвращение увеличения массы тела, снижение риска гипогликемии, снижение колебаний глюкозы, и т.д.).
Определение индивидуальной дозировки начинают с определения каждодневного приема пищи (т.е. завтрака, обеда, ужина, регулярного употребления закусок, и т.д.), приводящего к наиболее высоким 2-часовым постпрандиальным уровням глюкозы в крови с использованием SMBG (уровень глюкозы в крови, измеренный в сыворотке) из 7 точек. Затем проводят титрование с повышением дозировки для этого приема пищи. После установления соответствующей дозировки для этого приема пищи, титруют дозировку при каждодневном приеме пищи, приводящем к следующему из наиболее высоких уровню глюкозы в крови, и так далее до тех пор, пока не будут определены дозировки для всех каждодневных приемов пищи. В одном варианте осуществления исходную дозировку принимают с приемом пищи без титрования. В альтернативном варианте осуществления титрование для всех каждодневных приемов пищи проводят одновременно, а не последовательно. Приемы пищи, для которых проводят титрование дозы, предпочтительно являются "обычными" для пациента с точки зрения размера и содержания компонентов пищи с небольшим варьированием этих параметров.
Титрование начинают путем приема одной кассеты с низкой дозой с представляющим интерес приемом(ами) пищи. Кассеты с низкой дозой инсулин-FDKP могут обеспечить выпускаемую дозу, например, 6 или 12 Е инсулина. Наиболее часто титрование проводят с помощью кассет по 12 Е, но пациенты с меньшей массой тела, с меньшей степенью гипергликемии, подлежащей контролю, и/или с более низкими степенями резистентности к инсулину, могут предпочитать начинать титрование при более низкой дозе и/или продолжать титрование с меньшими приращениями. Для ясности ниже описано титрование для дозы 12 Е, но следует понимать, что титрование может быть сходным образом основано на 6 Е или другой кассете с низкой дозой. Аналогично, даже если титрование основано на кассете, которая не является наиболее низкой доступной дозой, в качестве альтернативы способу, описанному ниже, для обеспечения последнего приращения (или снижения) дозировки можно использовать кассету с меньшей дозой.
Начальную дозу можно применять в течение недели. На каждой последующей неделе дозировку для данного приема пищи повышают на дозу кассеты с низкой дозой (т.е. 12 Е) до тех пор пока 1) 2-часовой постпрандиальный срединный уровень глюкозы не составит от 70 до 110 мг/дл, или 2) дозировка, исходя из выпускаемой дозы, не составит 72 Е, или 3) не возникнут явления гипогликемии. В случае явлений от мягкой до умеренной гипогликемии с подтвержденным SMBG <70 мг/дл дозировку снижают но одну кассету с низкой дозой (т.е. 12 Е) и удерживают при этой дозировке в течение одной недели, а затем титрование возобновляют. В случае явлений тяжелой гипогликемии с подтвержденным SMBG <36 мг/дл дозировку снижают на одну кассету с низкой дозой (т.е. 12 Е), удерживают на этой новой дозе, и начинают титрование для следующего приема пищи. В альтернативном варианте осуществления также в качестве конечного результата титрования можно использовать уровень глюкозы в крови до приема пищи от 70 до 110 мг/дл. В некоторых вариантах осуществления указанный выше второй критерий для завершения повышения дозы устанавливает более высокую конечную дозу или критерий не используют совсем.
В альтернативном варианте осуществления начальную дозировку можно оценить, исходя из относительной биодоступности, по дозировке подкожно вводимого инсулина. Это становится важным при адаптации схемы титрования к другим составам и системам для ингаляции, чем те, которые используются в примерах ниже. Более универсальную шкалу получают путем идентификации дозировки согласно экспозиции инсулина (которая представляет собой AUC концентрации инсулина в крови с течением времени). В случае описанного выше титрования выпускаемые 12 Е соответствуют 3-4 подкожным эквивалентным единицам (subQ eq). Таким образом, в различных вариантах осуществления низкая доза может составлять, например, приблизительно 1, 1,5, 2, 3, 4 или 5 subQ eq единиц. Пределом для повышения дозы могут быть 18, 24, 32 или более subQ eq единиц.
Выражение дозы в subQ eq единицах также облегчает переход на применение сверхбыстродействующего инсулина, если пациент находится на режиме инсулина. Если пациенты уже находятся на режиме прандиального инсулина, им следует начинать с той же subQ eq дозы, которую они используют в данный момент, с использованием которой затем проводят титрование вверх или вниз, в основном, как описано выше. Если пациент находится на режиме инсулина более длительного действия отдельно или смеси инсулинов короткого или более длительного действия, тогда 50% от общей суточной дозы следует делить на количество приемов пищи в сутки и это количество сверхбыстродействующего инсулина в sub/Q eq единицах следует использовать в качестве начальной дозы при титровании. В случае, когда сверхбыстродействующий инсулин предоставлен в форме, которая не позволяет точное сопоставление с текущей дозировкой, дозу сверхбыстродействующего инсулина можно округлить в меньшую сторону или округлить до ближайшего значения (т.е. в большую или меньшую сторону) для применения в качестве начальной дозы. В одном варианте осуществления этот выбор оставляется специалисту, однако конкретные варианты осуществления устанавливают один или другой выбор.
Таким образом, в настоящем документе предусмотрен способ определения дозировки инсулин-FDKP для каждодневного приема пищи индивидуумом, включающий стадию введения с приемом пищи начальной дозировки, эквивалентной одной кассете с низкой дозой каждый день в течение недели. На каждой последующей неделе дозировку повышают на количество в кассете с низкой дозой до тех пор, пока не достигают конечного результата титрования, где конечный результат титрования выбран, исходя из следующей группы: 1) достигается 2-часовой постпрандиальный медианный уровень глюкозы от 70 (или альтернативно 80) до 110 мг/дл, 2) дозировка в расчете на выпускаемую дозу, составляет 72 Е, 3) возникает явление тяжелой гипогликемии с подтвержденным SMBG <36 мг/дл, и дозировку снижают на эквивалент одной кассеты с низкой дозой, и 4) возникает явление от мягкой до умеренной гипогликемии с подтвержденным SMBG <70 (или альтернативно 80) мг/дл, дозировку снижают на эквивалент одной кассеты с низкой дозой на одну неделю, а затем титрование возобновляют до достижения одного из других конечных результатов или дозировку устанавливают на уровне ниже уровня, который вызывает гипогликемию от мягкой до умеренной.
Варианты осуществления, описанные в настоящем документе, включают способ, в котором дозировку для каждого каждодневного приема пищи определяют, как описано выше, для каждого из каждодневных приемов пищи последовательно. Этот вариант осуществления включает определение того, какой каждодневный прием пищи приводит к наиболее высокому 2-часовому постпрандиальному уровню глюкозы в крови и титрование в первую очередь этого приема пищи. В некоторых вариантах осуществления для этого определения используют SMBG из 7 точек. Затем титруют каждодневный прием пищи, приводящий к следующему из наиболее высоких 2-часовых постпрандиальных уровней глюкозы в крови. При каждом нетитрованном приеме пищи, для которого дозировка не определена, вводят начальную дозу. В альтернативных вариантах осуществления дозировки для всех каждодневных приемов пищи титруют одновременно.
В одном варианте осуществления кассета с низкой дозой обеспечивает выпускаемую дозу 3-4 subQ eq единиц инсулина. В другом варианте осуществления кассета с низкой дозой обеспечивает выпускаемую дозу 1,5-2 subQ eq единиц инсулина. В некоторых вариантах осуществления группа конечных результатов титрования дополнительно включает уровень глюкозы в крови до приема пищи между 70 и 110 мг/дл.
В различных альтернативных вариантах осуществления титрование основано по меньшей мере на трех последовательных каждодневных измерениях в противоположность проведению ежедневно в течение недели, как описано выше, или в следующей альтернативе на 3-6 суточных измерениях в течение недели. В других альтернативных вариантах осуществления титрование основано на препрандиальном SMBG/SMBG перед сном вместо 2-часового постпрандиального SMBG. Таким образом, для определения дозы для завтрака используют измерение перед обедом, для определении дозы для обеда используют измерение перед ужином, и для определения дозы для ужина используют измерение перед сном.
Применение стандартной дозы
Традиционное лечение прандиальным инсулином вовлекает тщательную коррекцию дозировки инсулина согласно ожидаемой гликемической нагрузке индивидуального приема пищи, исходя из ее размера и содержимого. Необходимости в этом можно избежать или по меньшей мере снизить путем применения сверхбыстродействующего состава инсулина. Традиционные составы прандиального инсулина, вводимые как путем подкожной инъекции/инфузии, так и путем ингаляции, оказывают эффект на уровень глюкозы в крови, главным образом, путем повышения скорости элиминации глюкозы на протяжении относительно длительного периода времени. Общая достигаемая элиминация глюкозы, как правило, пропорциональна введенной дозе. В противоположность этому, сверхбыстродействующие составы инсулина оказывают свой эффект на протяжении относительно ограниченного периода времени и большая доля эффекта на уровень глюкозы в крови является результатом быстрого снижения высвобождения глюкозы в печени до базальных уровней. Быстрое повышение уровня инсулина в крови, достигаемое с помощью сверхбыстродействующих препаратов инсулина делает возможным быстрое повышение активности элиминации глюкозы и также обеспечивает сигнал для уменьшения высвобождения глюкозы печенью. Однако высокие достигаемые концентрации инсулина для обеспечения этих эффектов превышают диапазон, в котором скорость элиминации глюкозы (GER) пропорциональна концентрации инсулина. Таким образом, хотя дальнейшее повышение дозировки инсулина удлиняет период времени, на протяжении которого GER является повышенной, этого достигают путем увеличения периода времени, в течение которого концентрация инсулина превышает диапазон, в котором GER пропорциональна концентрации инсулина. Таким образом, общая элиминация глюкозы с помощью сверхбыстродействующих препаратов инсулина является значительно менее чувствительной к дозе. Более того, концентрации инсулина возвращаются к исходным уровням скорее после введения, таким образом, этот эффект также является ограниченным по времени и гомеостатические механизмы восстанавливаются скорее, чем в случае традиционных составов короткого действия, которые являются относительно более длительно действующими, тем самым снижая возможность поздней постпрандиальной гипогликемии вследствие активности экзогенного инсулина.
В результате, возможно установить стандартную дозировку для каждого из каждодневных приемов пищи и применять эту дозу, независимо от варьирования калорийности или гликемической нагрузки от приема пищи к приему пищи. Поскольку эффект снижения уровня глюкозы в крови настолько связан со снижением высвобождения глюкозы в печени, эффективного снижения достигают без тщательного сопоставления дозировки с гликемической или калорийной нагрузкой, даже если употребляют больше пищи, чем обычно. Поскольку повышение GER является сравнительно кратковременным, и, главным образом, хорошо соответствует по времени периоду, в течение которого прием пищи повышает уровни глюкозы в крови, риск гипогликемии является низким, даже если употребляют меньшее количество пищи. Тем не менее в предпочтительных вариантах осуществления калорийность и/или гликемическая нагрузка пищи поддерживаются в диапазоне от 25, 50 или 75% до 125, 150, 200 или 250%, от калорийности и/или гликемической нагрузки обычной пищи (используемой для определения стандартной дозы). Поскольку резистентность к инсулину, и, таким образом, способность отвечать на инсулин, варьируют в течение суточного цикла, главным образом, является предпочтительной установка стандартной дозы для каждого приема пищи, хотя на практике установленная стандартная дозировка может быть одинаковой для различных каждодневных приемов пищи. Этот способ может быть особенно хорошо подходящим для диабетиков со значительной остаточной способностью продуцировать инсулин и регулировать уровни глюкозы в крови, таких как диабетики 2 типа с ранее прогрессирующим заболеванием.
Таким образом, в настоящем документе предусматриваются способы лечения диабета стандартизованными дозами, которые не корректируют, исходя из содержания конкретной пищи. Способ включает прандиальное введение предварительно определенной стандартной дозировки сверхбыстродействующего состава инсулина без коррекции дозировки, исходя из содержимого пищи. В различных вариантах осуществления этим способом проводят введение во время любого или всех каждодневных приемов пищи; т.е., например во время завтрака, или завтрака и обеда, или завтрака и ужина, или завтрака, обеда и ужина, и т.д. В некоторых вариантах осуществления для всех приемов пищи используют одну предварительно определенную дозировку. В предпочтительных вариантах осуществления используют предварительно определенные дозировки для каждого приема пищи; т.е., например, для завтрака, для обеда, для ужина и т.д. В некоторых вариантах осуществления содержимое пищи оценивают по калорийности. В других вариантах осуществления содержимое пищи оценивают по гликемической нагрузке. В предпочтительных вариантах осуществления содержимое пищи поддерживают в диапазоне от 25, 50 или 75% до 125, 150, 200 или 250% от обычной пищи, использованной для определения предварительно определенной дозировки инсулина.
В одном варианте осуществления сверхбыстродействующий состав инсулина представляет собой инсулин-FDKP. В другом варианте осуществления введение проводят путем ингаляции в легкие.
Применение разделенных, добавочных и отсроченных дозировок
В случае традиционных режимов прандиального инсулина, дозировку выбирают, исходя из предположения о том, сколько пищи будет съедено, а затем пытаются согласовать употребление с предварительным ожиданием. Если съедают больше пищи, или доля углеводов, волокон и жиров в ней отличается от обычной или ожидаемой, невозможно улучшить гликемический контроль путем введения повторной дозы после приема пищи, когда эти факторы известны с большей определенностью, вследствие задержки между введением и началом действия традиционных составов. Напротив, сверхбыстродействующие составы инсулина достигают эффекта настолько быстро, что может быть преимущественной коррекция дозировки инсулина в зависимости от пищи путем введения вторичной дозы после приема пищи. Применение разделенных дозировок может быть особенно хорошо подходящим для диабетиков, отличных от диабетиков 2 типа с высокой продукцией эндогенного инсулина и только умеренной резистентностью к инсулину, например для диабетиков 1 типа (после стадии "медового месяца" заболевания) и диабетиков 2 второго типа позднее при прогрессировании заболевания.
В одном применении этого способа введения применяют разделенную дозировку при приемах пищи, в которых ожидается замедленное всасывание. Замедление может быть следствием болезненного состояния - продолжительный диабет ассоциирован с замедленным всасыванием питательных веществ; или она может быть следствием содержимого пищи - более высокое содержание жира и волокон имеют тенденцию к замедлению всасывания пищи. Применение разделенных дозировок также можно преимущественно использовать в случае приемов пищи из нескольких блюд или других длительных приемов пищи, таких как на праздниках и банкетах. Даже если индивидуум ограничивает общее употребление в соответствии с обычным приемом пищи, тот факт, что употребление пищи продлевается дольше, чем обычный период времени, также приводит к продлению всасывания питательных веществ. Разделенные дозы позволяют нацеливание на этот длительный профиль всасывания питательных веществ. По сравнению с дозировкой инсулина, которую использовали бы с приемом пищи в качестве единичной дозы, от половины до трех четвертей, например две трети, дозы вводят в начале приема пищи, а остальную часть дозировки вводят от 30 до 120 минут позднее.
Таким образом, дополнительные варианты осуществления относятся к способу лечения диабета, включающему выбор пациента, предположительно имеющего замедленное всасывание питательных веществ, введение начальной дозы от 1/2 до 3/4 предварительно определенной дозировки сверхбыстродействующего состава инсулина в начале приема пищи и введение остальной части предварительно определенной дозировки на 30-120 минут позднее. В одном варианте осуществления начальная доза составляет 2/3 от предварительно определенной дозировки. В некоторых вариантах осуществления замедленное всасывание связано с болезненным состоянием (диабетом). В других вариантах осуществления замедленное всасывание связано с содержимым пищи. В следующих аспектах этих вариантов осуществления, содержимое пищи включает высокое содержание волокон. В других аспектах этих вариантов осуществления содержимое пищи имеет высокое содержание жиров. В следующем аспекте высокое содержание жиров составляет ≥25% от содержимого пищи. В следующем аспекте высокое содержание жиров составляет ≥35% от содержимого пищи. В одном варианте осуществления сверхбыстродействующий состав инсулина представляет собой инсулин-FDKP. В другом варианте осуществления введение проводят путем ингаляции в легкие.
В другом применении этого способа введения, разделенную дозировку используют для коррекции дозировки инсулина относительно истинной гликемической нагрузки. Начальную дозу вводят в начале приема пищи, через от 60 до 120 минут определяют уровень глюкозы в крови, и повторную или добавочную дозу вводят, если уровень глюкозы в крови превышает 140 мг/дл. В некоторых вариантах осуществления вторичная дозировка равна 50-100% от начальной дозировки. В некоторых вариантах осуществления уровень глюкозы в крови определяют постоянным мониторингом уровня глюкозы.
Таким образом, дополнительные варианты осуществления предусматривают способ лечения диабета, включающий введение начальной дозы сверхбыстродействующего состава инсулина в начале приема пищи, определение уровня глюкозы в крови через 60-120 минут после начала приема пищи, и, если уровень глюкозы в крови превышает 140 (или альтернативно 150) мг/дл, введение второй дозы сверхбыстродействующего состава инсулина, где дозировка второй дозы составляет от 25% или 50% до 100% от дозировки начальной дозы. В одном варианте осуществления сверхбыстродействующий состав инсулина представляет собой инсулин-FDKP. В другом варианте осуществления введение проводят путем ингаляции в легкие.
В варианте этого способа введения в начале приема пищи дозу не вводят. Вместо этого введение является отсроченным, например на 10, 15, 20 или 30 минут после начала приема пищи. Этот вариант является особенно пригодным, когда ожидают замедленного всасывания питательных веществ.
Таким образом, варианты осуществления, описанные в настоящем документе, обеспечивают способ лечения диабета, включающий введение дозы сверхбыстродействующего состава инсулина после начала приема пищи пациенту, ожидающему замедленного всасывания питательных веществ. В одном варианте осуществления замедленное всасывание является следствием более высокого содержания жиров и волокон по сравнению с обычным приемом пищи, используемым при определении дозировки. В другом варианте осуществления замедленное всасывание является следствием длительного диабета. В одном варианте осуществления сверхбыстродействующий состав инсулина представляет собой инсулин-FDKP. В другом варианте осуществления введение проводят путем ингаляции в легкие.
Лечение пациентов с резистентностью к подкожному инсулину
Многие из преимуществ инсулин-FDKP связаны с его сверхбыстрой кинетикой. Однако инсулин-FDKP, как правило, вводят путем ингаляции препарата сухого порошка. Существует класс пациентов, которые могут получить дополнительное преимущество от этого состава вследствие его способа введения, а именно пациенты с резистентностью к подкожному инсулину. Это явление отличается от резистентности к инсулину, обычно ассоциированной с диабетом 2 типа, которую, как правило, понимают как результат сниженной способности к ответу клеток по всему организму на инсулин, и оно не связано с ней.
Явление резистентности к подкожному инсулину не повсеместно признается экспертами в области диабета как истинное физиологическое состояние. Определенно, его этиология не полностью понятна и действительно, может существовать множество факторов, которые могут привести к этому состоянию. Тем не менее, опыт с ингалируемым инсулином продемонстрировал клиническую реалистичность этого явления. Существуют пациенты, для которых требуются существенно более высокие дозы инсулина, чем в ином случае можно ожидать при лечении подкожно вводимым инсулином, и для которых при переключении на легочный инсулин требуется количество инсулина, более соответствующее тому, что можно было бы ожидать, исходя из их медицинского состояния. Резистентность к подкожному инсулину также может приводить к трудности установления удовлетворительного контроля гипергликемии и к вариабельности ответа на инсулин.
Для проспективной идентификации пациентов с диабетом, имеющих резистентность к подкожному инсулину, можно учитывать несколько факторов. Прежде всего, пациент применяет высокие дозы инсулина, особенно по сравнению с тем, что обычно требуется с учетом его медицинского состояния, включая массу тела и стадию течения заболевания. Например, высокая доза инсулина представляет собой дозу, превышающую 2 единицы/кг/сутки. Этот критерий может далее сочетаться с тем, что пациент имеет нормальные или практически нормальные базальные уровни эндогенного инсулина в сыворотке, например ≤50 мкЕ/мл инсулина. Такие пациенты, как правило, имеют диабет 2 типа на ранней стадии течения заболевания. Альтернативно высокое применение инсулина может сочетаться с липоатрофией или липодистрофией в качестве диагностических критериев.
В других альтернативных вариантах осуществления применение высокой дозы инсулина может сочетаться с очень плохо контролируемой гипергликемией в качестве критерия выбора. О плохо контролируемой гипергликемии может свидетельствовать выявление три раза уровня HbA1c ≥9% за период 12 месяцев, несмотря на лечение усиленным режимом инсулина, например терапию базальным-болюсным инсулином, или непрерывную подкожную инфузию инсулина (CSII; т.е., инсулиновый насос) и т.д., в течение периода ≥6 месяцев. Обычно уровни HbA1c определяют раз в три месяца. Предпочтительно, чтобы выявление три раза уровней HbA1c ≥9% было последовательным. В альтернативных вариантах осуществления о плохо контролируемой гипергликемии могут свидетельствовать выявление два раза уровней HbA1c ≥9% за период 6-9 месяцев.
В альтернативных вариантах осуществления применение высокой дозы инсулина может сочетаться с угрожающей жизни гликемической нестабильностью в качестве критерия выбора. Угрожающая жизни гликемическая нестабильность может быть охарактеризована периодами гипергликемии и/или гипогликемии, несмотря на соблюдение диеты, физической нагрузки и режимов инсулина.
Таким образом, варианты осуществления, представленные в настоящем документе, относятся к способам лечения диабетиков с резистентностью к подкожному инсулину. Эти способы включают стадию выбора пациентов с резистентностью к подкожному инсулину, исходя из нетипично высокой дозировки инсулина. В некоторых вариантах осуществления дозировка инсулина составляет ≥2 единиц/кг/сутки. В некоторых вариантах осуществления выбор, кроме того, основан на том, что пациент имеет нормальные или практически нормальные уровни эндогенного инсулина. У некоторых из этих пациентов базальный уровень эндогенного инсулина составляет ≤50 мкЕ/мл. В других вариантах осуществления выбор, кроме того, основан на том, что пациент находится на усиленном режиме инсулина и у него три раза выявлен уровень HbA1c ≥9% за период 12 месяцев. В других вариантах осуществления выбор, кроме того, основан на том, что пациент имеет угрожающую жизни гликемическую нестабильность, характеризующуюся периодами гипергликемии и/или гипогликемии, несмотря на соблюдение им режима инсулина и любой диеты и режима физической нагрузки.
Эти способы также включают стадию прекращения лечения подкожно вводимыми составами инсулина быстрого, короткого или среднего действия. Следует отметить, что пациенты, у которых не может продуцироваться достаточное количество инсулина для удовлетворения базальных потребностей, должны продолжать прием базального инсулина, даже при подкожном введении. В настоящее время коммерчески доступные составы базального инсулина (длительного действия) представляют собой только составы для подкожного введения. Однако разрабатываются другие препараты инсулина длительного действия, которые потенциально можно вводить другими способами введения, и предусматривается их применение в способах, представленных в настоящем документе. Эти способы также включают стадию (начала) лечения путем введения прандиальных доз инсулин-FDKP путем ингаляции.
Следующие варианты осуществления могут включать стадию подтверждения диагноза резистентности к подкожному инсулину путем определения, что достигается сходная или повышенная степень гликемического контроля при существенном снижении дозировки инсулина. В некоторых вариантах осуществления гликемический контроль оценивают по уровню HbA1c. В других вариантах осуществления его оценивают по постпрандиальным уровням глюкозы в крови и/или уровням глюкозы в крови натощак. В различных вариантах осуществления дозировка инсулина (исключая какие-либо базальные потребности) снижена на ≥10, ≥20 или ≥50% или более. В некоторых вариантах осуществления сниженную дозировку оценивают путем измерения уровней инсулина в сыворотке. В других вариантах осуществления она основана на используемой дозировке и относительной биодоступности составов инсулина.
Комбинированное применение сверхбыстродействующего инсулина и аналогов инсулина длительного действия
Одним из способов применения сверхбыстродействующего инсулина является применение в комбинации с инсулином длительного действия в режиме базальный-болюсный инсулин. При терапии базальным-болюсным инсулином используют инсулин длительного действия для обеспечения или дополнения базального уровня инсулина, и для управления конечной повышенной нагрузки глюкозой во время приема пищи вводят болюс инсулина короткого действия. Различные преимущественные характеристики сверхбыстродействующего инсулина делают его выбор идеальным для применения в качестве инсулина короткого действия в таких режимах.
Многие препараты инсулина длительного действия вводят два раза в сутки, но инсулин гларгин (продаваемый в качестве LANTUS® Sanofi-Aventis) одобрен и поставляется на рынок для введения один раз в сутки. Согласно предписывающей информации изготовителя (пересмотр в марте 2007 года) инсулин гларгин обеспечивает относительно постоянную активность снижения глюкозы в течение 24 часов и его можно вводить в любое время в течение суток, при условии, что его вводят в одно и то же время каждый день. Кроме того, инсулин детемир (продаваемый в качестве LEVEMIR® Novo Nordisk) одобрен и выпускается на рынок для введения либо два раза в сутки, либо один раз в сутки с приемом пищи вечером или на ночь (информация, представленная изготовителем, версия 3, вышедшая 16 мая 2007 года).
В клинических испытаниях было выявлено, что сверхбыстродействующий состав инсулина, содержащий инсулин-FDKP, используемый в комбинации с инсулином гларгин, является эффективным для контроля колебаний концентрации глюкозы. В измерениях уровней глюкозы из 7 точек инсулин-FDKP был способен сгладить неровный паттерн, являющийся следствием постпрандиальных колебаний концентрации глюкозы, но в течение дня исходные уровни глюкозы в крови имеют тенденцию к повышению. У диабетиков 1 типа (см. пример 2 и ФИГ. 12) и диабетиков 2 типа (см. ФИГ. 13) наблюдали сходное поведение. Существует несколько факторов, которые могут привести к этому повышению. Резистентность к инсулину имеет тенденцию повышению в течение дня. Кроме того, инсулин гларгин, использованный в исследовании, вводили вечером перед сном, как предусматривается информацией, предоставленной изготовителем. Таким образом, наибольшая потребность в активности инсулина возникает в поздний период эффективности дозы инсулина гларгин, когда она ослабевает.
При типичных комбинациях инсулин гларгин используют в комбинации либо с прандиальным инсулином короткого действия, либо со смесями препаратов инсулина короткого и среднего действия, вводимых перед завтраком и ужином. Препараты инсулина среднего действия имеют тенденцию к обеспечению активности снижения уровня глюкозы, как для периодов приема пищи, так и для периодов между приемами пищи. Даже выпускаемые на рынок препараты инсулина короткого действия проявляют большую часть активности после всасывания большей части питательных веществ пищи. Таким образом, в обычно используемых режимах, вовлекающих комбинации инсулина гларгин и препаратов инсулина короткого действия, другие препараты инсулина обеспечивают добавочную активность во время бодрствования. Напротив инсулин-FDKP имеет короткую длительность действия, хорошо соответствующую периоду времени, в течение которого пища вызывает повышенную нагрузку глюкозой, но не обеспечивающую существенную активность инсулина для контроля исходного уровня. Таким образом, при комбинировании со сверхбыстродействующим инсулином, таким как инсулин-FDKP, любая недостаточность дозы или длительности инсулина гларгин может усиливаться по сравнению с общепринятыми режимами. Инсулин детемир имеет более короткую длительность действия, чем инсулин гларгин, так что при использовании один раз в сутки такой дефицит должен быть еще более выраженным. Для исправления таких эффектов режима, в которых комбинируется применение сверхбыстродействующих препаратов инсулина и аналога инсулина длительного действия, необходимо предусматривать, чтобы аналог инсулина длительного действия вводили рано во время бодрствования, например во время завтрака или в пределах 1, 2, 3 или 4 часов после пробуждения. В некоторых вариантах осуществления ранняя доза аналога инсулина длительного действия представляет собой единственную дозу, вводимую в течение суток. В других вариантах осуществления, аналог инсулина длительного действия представляет собой инсулин гларгин и его вводят два раза в сутки, с ранней дозой и поздней дозой приблизительно через от 8 до 14, предпочтительно 10-12, часов после ранней дозы, например приблизительно во время ужина. Предполагается типичный цикл сна и бодрствования, при котором человек спит в течение длительного периода, обычно ночью, а затем просыпается и становится активным на оставшуюся часть суток, помимо короткого дневного сна. Таким образом, выражения, такие как "в пределах определенного времени после пробуждения", "рано во время бодрствования" и сходные термины относятся ко времени, когда индивидуум просыпается и начинает свою каждодневную активность.
Комбинированное применение сверхбыстродействующего инсулина и базального инсулина, предоставляемое путем инфузии
Инсулиновые насосы представляют собой компактные устройства, которые доставляют различные формы инсулина в соответствующее время для обеспечения контроля уровня глюкозы в крови. При корректном использовании эти устройства улучшают контроль уровня глюкозы в крови с меньшими гипогликемическими явлениями и лучшим длительным контролем. Насосы являются программируемыми и дают пациентам степень свободы для варьирования того, что, когда или как они едят, путем обеспечения коррекции скоростей доставки инсулина для различного времени суток. Последние модели инсулиновых насосов относительно легко применять, и они являются удобными для ношения. Эти более новые насосы имеют встроенные калькуляторы дозировок, которые контролируют сложные вычисления дозировок инсулина, ранее проведенные пациентами. Пациенты способны программировать болюсные дозы, чтобы они совпадали с приемом пищи, а также различные скорости доставки базального инсулина для различного времени суток, в зависимости от меняющихся потребностей. Эти насосы также вычисляют, сколько инсулина все еще действует из предшествующей болюсной дозы. Некоторые насосы имеют дополнительные интеллектуальные признаки, такие как программируемые напоминания и предупредительные сигналы, информация и возможность скачивания, которая позволяет пациенту сохранить информацию в компьютере для тщательного хранения записей, база данных об углеводах для вычисления количества углеводов, употребленных с пищей, и некоторые характеристики безопасности.
В качестве альтернативы подкожной болюсной инъекции инсулина длительного действия, также базальный инсулин можно обеспечить путем непрерывной инфузии. Этот подход устраняет необходимость в инсулине длительного действия, поскольку инсулин предоставляется непрерывно. Этот подход также может устранить какие-либо недостатки, ассоциированные с такими препаратами, например повышенную иммуногенность или связывание с рецепторами инсулин-подобных факторов роста, которые могут возникать в случае аналогов. Поскольку при этом подходе скорость инфузии может изменяться в течение суток, профиль базальной активности инсулина можно более легко корректировать в зависимости от изменения диеты и физиологии индивидуума. (Возможности инсулиновых насосов более подробно рассмотрены в разделе, касающемся систем искусственной поджелудочной железы, ниже). Обычной методологией в случае инсулиновых насосов является нацеливание на то, чтобы охватить как прандиальные, так и базальные, потребности с использованием одного из быстродействующих аналогов. Когда насос используют только для предоставления базального инсулина - как в случае прандиального предоставляемого не через насос сверхбыстродействующего инсулина - можно использовать регулярный инсулин человека. Однако для пациентов с меньшей потребностью в стабильном базальном инсулине более быстрая кинетика быстродействующих аналогов может обеспечить преимущество.
Таким образом, варианты осуществления обеспечивают способ лечения диабета, включающий инфузию инсулина с помощью инсулинового насоса для удовлетворения потребностей в базальном инсулине и введение сверхбыстродействующего инсулина для удовлетворения прандиальных потребностей. В некоторых вариантах осуществления доставляемый с помощью насоса инсулин представляет собой регулярный инсулин человека. В других вариантах осуществления доставляемый с помощью насоса инсулин представляет собой быстродействующий аналог инсулина. В одном варианте осуществления сверхбыстродействующий состав инсулина представляет собой инсулин-FDKP. В другом варианте осуществления введение сверхбыстродействующего инсулина проводят путем ингаляции в легкие.
Применение сверхбыстродействующего инсулина в комбинации с пероральными противодиабетическими лекарственными средствами или вместо них
Стандарт лечения диабета 2 типа определяется и регулярно обновляется в согласованных заявлениях, публикуемых American Diabetes Association and the European Association for the Study of Diabetes. Общий курс описанного лечения, обобщенно представленный ниже, остается практически постоянным в последние годы (см. например, Nathan et al. Diabetes Care 29:1963-1972, 2006; Nathan et al. Diabetes Care 31:173-175, 2008; и Nathan et al. Diabetes Care 32:193-203, 2009), причем наиболее существенным изменением является изменение при последнем обновлении, которое представляет собой добавление к алгоритму лечения агонистов GLP-1.
Курс лечения, описанный в этих согласованных заявлениях, начинается с изменения образа жизни вместе с лекарственным средством метформином после постановки диагноза (стадия 1). Изменение образа жизни включает улучшение диеты и повышение физической нагрузки. Метформин представляет собой лекарственное средство, классифицируемое как бигуанид. Хотя исторически эти лекарственные средства описаны как сенсибилизаторы к инсулину, основным эффектом является снижение продукции глюкозы печенью. Эта активность, по-видимому, зависит от присутствия инсулина и лечение метформином может быть ассоциировано в некоторой степени с повышенной чувствительностью к инсулину. Однако в настоящем документе избегают применения термина "сенсибилизатор к инсулину" к бигуанидам, поскольку механизм действия отличается от механизма действия тиазолидиндионов, которые в настоящее время более часто подразумеваются под этим термином и для которых основным эффектом является повышение чувствительности к инсулину. Поскольку метформин присутствует на протяжении всего дня, его эффект наблюдают как снижение уровней глюкозы в крови натощак (FBG). Приблизительно 30% пациентов не могут переносить метформин, по меньшей мере при дозировках, подходящих для приемлемого гликемического контроля, причем желудочно-кишечные побочные действия являются главной проблемой. Предписывающая информация (пересмотр в январе 2009 года) для метформина (выпускаемого на рынок как GLUCOPHAGE® Bristol-Myers Squibb) включает противопоказания для применения у пациентов с заболеванием или дисфункцией почек, гиперчувствительностью к лекарственному средству или метаболическим ацидозом, а также другие предостережения.
Если надлежащий гликемический контроль не достигается (главным образом, HbA1c остается ≥7%) на 1 стадии лечения, 2 стадия лечения предусматривает добавление второго средства. Оно может представлять собой базальный инсулин, сульфонилмочевину, пиоглитазон или агонист GLP-1. Если два средства (причем второе средство не является базальным инсулином) все еще не устанавливают надлежащий гликемический контроль, общее мнение предусматривает либо переключение второго средства на базальный инсулин, либо применение комбинации сульфонилмочевины и пиоглитазона в качестве второго средства. Если комбинация сульфонилмочевины и пиоглитазона все еще не устанавливает надлежащий гликемический контроль, общее мнение предусматривает переключение второго средства на базальный инсулин. В случае любого из этих путей общее мнение предполагает, что первым используемым режимом инсулина является базальный инсулин.
Сульфонилмочевины являются усилителями секреции инсулина, т.е. они усиливают секрецию инсулина. В этот класс включены лекарственные средства хлорпропамид, глибурид, гликлазид, глимепирид и глипизид. Основной проблемой в случае этих средств является повышенный риск гипогликемии, особенно высокий в случае хлорпропамида и глибурида. Применение этих средств также связано с повышенной смертностью от сердечно-сосудистого заболевания. В случае этих средств распространено увеличение массы тела. Противопоказания, предостережения и взаимодействия лекарственных средств, типичные для сульфонилмочевин, могут быть найдены в предписывающей информации для глипизида (продаваемого в качестве GLUCOTROL® Pfizer; пересмотр в сентябре 2006 года). Также существуют опасения, что усилители секреции инсулина повышают нагрузку на уже перегруженную поджелудочную железу, что приводит к постепенному снижению функции β-клеток и ограничению их длительной пригодности. Известны другие усилители секреции инсулина, такие как глиниды, например репаглинид и натеглинид. Риск увеличения массы тела в случае этих средств сходен с сульфонилмочевинами, однако риск гипогликемии может не быть настолько повышенным. Агонисты GLP-1 и ингибиторы DPP-4 (дипептидилпептидазы-4) также можно считать усилителями секреции инсулина. Как используют, усилители секреции инсулина обеспечивают активность в течение суток, так что эффект легко наблюдать в качестве снижения FBG.
Пиоглитазон (продаваемый в качестве ACTOS® Takeda Pharmaceuticals) представляет собой тиазолидиндион (глитазон, TZD), который увеличивает чувствительность мышц, жира и печени к инсулину, тем самым противодействуя аспекту резистентности к инсулину диабета 2 типа, и, таким образом, его обычно называют сенсибилизатором к инсулину. TZD ассоциирован с задержкой жидкости и застойной сердечной недостаточностью, а также с повышенными уровнями переломов костей, особенно при остеопорозе у женщин. TZD также включают лекарственное средство розиглитазон (продаваемый в качестве AVANDIA® GlaxoSmithKline), который, кроме того, ассоциирован с ишемией миокарда. Эти и другие побочные эффекты, предостережения и т.д., такие как увеличение массы тела, описаны в информации, предоставляемой изготовителем для ACTOS® (версия августа 2008 года) и AVANDIA® (версия октября 2008 года).
Третья (и последняя) стадия в согласованном алгоритме достигается, если, или когда, поскольку диабет 2 типа является прогрессирующим заболеванием, надлежащий гликемический контроль не достигается путем лечения, включающего базальный инсулин согласно второй стадии. Третья стадия предусматривает продолжение изменение образа жизни и лечения метформином с предыдущих стадий вместе с усиленным лечением инсулином. Как описано, усиленное лечение может включать прандиальное применение быстродействующих аналогов инсулина, но определенно оно вовлекает продолжение применения базального инсулина.
Группы пациентов, которых лечили согласно вариантам осуществления, описанным в настоящем документе, отличаются от групп пациентов, которым наиболее часто проводят терапию инсулином. Действительно, факторы, которые могут побудить врача назначить инсулин согласно данной схеме, никак не проясняют относительную эффективность сверхбыстродействующего инсулина по сравнению с пероральными противодиабетическими средствами, особенно с учетом различных фармакокинетических профилей доступных препаратов инсулина. Более того, как видно из вышесказанного, применение инсулина, как правило, начинается с базального инсулина, причем прандиальные препараты инсулина добавляют только после неуспеха базального инсулина отдельно. Напротив, способы, описанные в настоящем документе, вовлекают применение прандиального сверхбыстродействующего инсулина рано в ходе лечения.
Пациентов со связанными с инсулином нарушениями на ранней стадии можно подразделить на различные подгруппы и лечить в соответствии с различными вариантами осуществления настоящего изобретения. Некоторые индивиды могут принимать достаточно инсулина для поддержания негипергликемического уровня глюкозы в крови натощак, однако не могут избежать резких колебаний уровня глюкозы в крови после приема пищи. Диабетики с ранним диабетом 2 типа часто могут использовать диету и физические нагрузки для контроля даже существенной гипергликемии, но у них уже утрачена ранняя фаза высвобождения инсулина. В современной практике пациентов, у которых оказались неуспешными диета и физическая нагрузка, наиболее часто далее лечат супрессором продукции глюкозы печенью, таким как метформин, с целью преодоления резистентности к инсулину и повышения эффективности продуцируемого инсулина. В вариантах осуществления, описанных в настоящем документе, этим пациентам вводят прандиальный имитирующий раннюю фазу препарат инсулина вместо сенсибилизатора к инсулину, или в дополнение к нему. Менее часто (и ранее) первое пероральное лекарственное средство, предлагаемое диабетикам, представляло собой усилитель секреции инсулина, такой как сульфонилмочевина, для повышения секреции инсулина. Более часто (и в настоящее время) такие средства используют в комбинации с супрессором продукции глюкозы печенью в качестве последующей стадии при лечении, если применение сенсибилизатора отдельно не обеспечивает желаемый уровень гликемического контроля. Однако применение усилителей секреции также может приводить к увеличению массы тела и гипогликемическим явлениям, таким образом, в одном варианте осуществления, в таких комбинированных способах лечения используют прандиальный имитирующий раннюю фазу препарат инсулина вместо усилителя секреции.
Уровни глюкозы как натощак, так и после приема пищи, приводят к повышению уровней HbA1c. Сверхбыстродействующие препараты инсулина могут преимущественно влиять на уровни глюкозы в крови как натощак, так и после приема пищи. Первоначально признавали, что они являются особенно пригодными для контроля постпрандиального уровня глюкозы в крови в противоположность препаратам базального инсулина или усилителям секреции инсулина, или даже препаратам инсулина короткого действия. Предполагают, что частично это является следствием их более быстрой супрессии эндогенной продукции глюкозы (см. пример 1). Таким образом, варианты осуществления, описанные в настоящем документе, относятся к пациентам с плохо контролируемым постпрандиальным уровнем глюкозы в крови или у которых отсутствие гликемического контроля сильнее ассоциировано с повышением постпрандиальных уровней глюкозы в крови. Например, пациенты с меньшей степенью резистентности к инсулину могут быть способны продуцировать достаточное количество инсулина для обеспечения существенного контроля глюкозы в крови натощак и в некоторых вариантах осуществления они могут быть выбраны для лечения сверхбыстродействующим инсулином отдельно. Для сравнения, пациенты с более высокой степенью резистентности к инсулину могут иметь плохой контроль уровня глюкозы как натощак, так и после приема пищи, и в некоторых вариантах осуществления они могут быть выбраны для лечения сверхбыстродействующим инсулином и пероральным противодиабетическим средством в комбинации.
Сверхбыстродействующий инсулин и супрессоры продукции глюкозы печенью
Как сверхбыстродействующий инсулин, так и лекарственные средства на основе бигуанидов, такие как метформин, действуют в качестве супрессоров высвобождения глюкозы печенью. Однако, как используют, эти лекарственные средства проявляют эффект круглосуточно, в то время как прандиальный сверхбыстродействующий инсулин проявляет этот эффект более специфично, после приема пищи. Таким образом, сверхбыстродействующий инсулин может заменять или усиливать активность пероральных супрессоров продукции глюкозы печенью.
Таким образом, в одном варианте осуществления сверхбыстродействующий инсулин используют для лечения индивидуума с диабетом 2 типа, нуждающегося в улучшенном гликемическом контроле, с хорошо или умеренно контролируемым FBG, но плохо контролируемым PPG. В различных аспектах вариантов осуществления, потребность в улучшенном гликемическом контроле определяют как уровень HbA1c, PPG через 1 или 2 часа, или окислительный стресс. В некоторых вариантах осуществления хорошо контролируемым FBG является FBG ≤110 или ≤130 мг/дл. В некоторых вариантах осуществления умеренно контролируемым FBG является FBG ≤154 мг/дл, ≤180 или ≤192 мг/дл. В исследованиях было определено, что при уровнях HbA1c ≤8,4% по меньшей мере половина общей гипергликемии является следствием PPG (Monnier, L. et al. Diabetes Care 26:881-885, 2003). Таким образом, в некоторых вариантах осуществления индивидуум с хорошо или умерено контролируемым FBG, но с плохо контролируемым PPG представляет собой индивидуума с HbA1c ≤8,4%. (HbA1c 8,4% соответствует среднему уровню глюкозы в плазме приблизительно 192-198 мг/дл; см. Diabetes Care 32, suppl.1:S13-S61, 2009, особенно таблицы 8 и 9). В различных вариантах осуществления индивидуум с плохо контролируемым PPG представляет собой индивидуума с PPG через 1 или 2 часа ≥140 или ≥180, или ≥200 мг/дл. Следует отметить, что индивидуумы, у которых PPG через 2 часа после нагрузки 75 г глюкозы составлял ≥200 мг/дл, имели практически удвоенный риск смертности, чем пациенты, у которых PPG через 2 часа составил <200 мг/дл, независимо от их FPG (Lancet 354:617-621, 1999). В одном варианте осуществления индивидуум не получает в текущий момент времени какое-либо лечение лекарственным средством и сверхбыстродействующий инсулин используют в качестве единственного фармакологического средства. В другом варианте осуществления индивидуум подвергается лечению пероральными супрессорами продукции глюкозы печенью и к его режиму лечения добавляют прандиальный сверхбыстродействующий инсулин. В одном варианте осуществления пероральным супрессором продукции глюкозы печенью является метформин. В одном варианте осуществления сверхбыстродействующий состав инсулина представляет собой инсулин-FDKP. В другом варианте осуществления введение сверхбыстродействующего инсулина проводят путем ингаляции в легкие.
В других вариантах осуществления для индивидуума с диабетом 2 типа, нуждающегося в улучшенным гликемическим контроле, может быть полезным лечение супрессором продукции глюкозы печенью, но такие пероральные средства противопоказаны или не переносятся, и вместо них используют сверхбыстродействующий инсулин. Вариантом этого случая является случай, когда пероральное средство не переносится в достаточной дозировке и сверхбыстродействующий инсулин используют для дополнения его активности.
Сверхбыстродействующий инсулин и усилители секреции инсулина
Усилители секреции инсулина, такие как сульфонилмочевины и глиниды, повышают секрецию инсулина и, тем самым концентрации инсулина в кровотоке. Сверхбыстродействующие препараты инсулина также повышают концентрации инсулина в кровотоке. Однако, как используют, лекарственные средства проявляют свой эффект круглосуточно, в то время как прандиальный сверхбыстродействующий инсулин проявляет этот эффект более специфично, после приема пищи. Таким образом, сверхбыстродействующий инсулин может заменить активность усилителя секреции инсулина. В одном варианте осуществления сверхбыстродействующий состав инсулина представляет собой инсулин-FDKP. В другом варианте осуществления введение сверхбыстродействующего инсулина проводят путем ингаляции в легкие.
Таким образом, в одном варианте осуществления пациент, проходящий лечение супрессором продукции глюкозы печенью и усилителем секреции инсулина, прекращает лечение усилителем секреции и начинает лечение сверхбыстродействующим инсулином. В родственных вариантах осуществления пациент, проходящий лечение супрессором продукции глюкозы печенью, является кандидатом для лечения усилителем секреции инсулина и вместо лечения усилителем секреции начинает лечение сверхбыстродействующим инсулином. В одном варианте осуществления пациент нуждается в улучшенном гликемическом контроле. В различных аспектах этого варианта осуществления потребность в улучшенном гликемическом контроле определяют по уровню HbA1c, PPG через 1 или 2 часа, или окислительного стресса.
В других вариантах осуществления для индивидуума с диабетом 2 типа может быть полезно лечение усилителем секреции инсулина, однако такие пероральные средства противопоказаны или не переносятся, и вместо него используют сверхбыстродействующий инсулин. В других вариантах осуществления пациент нуждается в снижении риска гипогликемии или увеличения массы тела.
Сверхбыстродействующий инсулин и сенсибилизаторы к инсулину
Сенсибилизаторы к инсулину, такие как пиоглитазон и другие TZD, повышают утилизацию инсулина в различных тканях, тем самым снижая резистентность к инсулину и приводя к снижению уровней инсулина в крови. Лечение TZD приводит к заметным снижениям FBG. Лечение прандиальным сверхбыстродействующим инсулином приводит к снижению FBG. Это происходит несмотря на тот факт, что в случае прандиального сверхбыстродействующего инсулина отсутствует прямая активность элиминации глюкозы в периоды голодания. Влияние сверхбыстродействующих препаратов инсулина на уровни глюкозы натощак были неожиданными и указывают на то, что они могут снизить резистентность к инсулину или действовать в качестве сенсибилизатора к инсулину. Интересно, что быстрый пик концентрации инсулина, достигаемый с помощью сверхбыстродействующего препарата инсулина, усиливает последующую активность инсулина. Это особенно заметно у диабетиков с диабетом 2 типа в период времени сразу после введения, однако этот эффект может быть длительным. Таким образом, лечение прандиальным сверхбыстродействующим инсулином имеет эффекты, сходные с сенсибилизаторами к инсулину.
Таким образом, в некоторых вариантах осуществления пациентов выбирают для лечения, включающего сверхбыстродействующий инсулин, исходя из наличия высокой степени резистентности к инсулину. В других вариантах осуществления пациентов, которым может быть полезно лечение сенсибилизатором к инсулину, таким как TZD, но которые обладают чувствительностью к этому лекарственному средству или в ином случае оно является противопоказанным, лечат сверхбыстродействующим инсулином вместо этого лекарственного средства. Например, TZD могут быть противопоказаны у женщин с остеопорозом.
Пациенты, для которых может быть полезным лечение прандиальным сверхбыстродействующим инсулином согласно различным вариантам осуществления, включают пациентов, которые достигают недостаточного гликемического контроля с помощью сенсибилизатора к инсулину и у которых в ином случае к режиму лечения был бы добавлен усилитель секреции инсулина, или пациентов, которые достигают недостаточного гликемического контроля с помощью комбинации сенсибилизатора к инсулину и усилителя секреции инсулина. Подгруппы этих групп включают подгруппы пациентов, которые, кроме того, имеют боязнь укола иглы или по иным причинам хотели бы избежать инъекций, и подгруппы, которые имеют ожирение, избыточную массу тела или иным образом желают избежать увеличение массы тела или минимизировать его, или которым необходимо снизить массу тела. Кроме того, повышенные уровни инсулина ассоциированы с повышенной частотой рака молочной железы. Таким образом, людям с повышенным риском рака молочной железы может быть особенно полезно снижение резистентности к инсулину. В одном варианте осуществления сверхбыстродействующий состав инсулина представляет собой инсулин-FDKP. В другом варианте осуществления введение сверхбыстродействующего инсулина проводят путем ингаляции в легкие.
Прандиальный сверхбыстродействующий инсулин против базального инсулина
Когда лечение двумя пероральными лекарственными средствами не обеспечивает надлежащего гликемического контроля, стандарты лечения предлагают пути лечения с применением базального инсулина или третьего перорального лекарственного средства. На выбор добавления третьего перорального лекарственного средства вместо добавления инсулина часто влияет нежелание проводить каждодневные инъекции, даже в отсутствии боязни укола иглой, риск гипогликемии и вероятность увеличения массы тела. Таким образом, варианты осуществления изобретения обеспечивают следующее лечение для комбинированной пероральной терапии, которая включает инсулин, но не включает укол иглой и минимизирует или устраняет увеличение массы тела. Нельзя ожидать, что ингалируемый инсулин EXUBERA®, вследствие его кинетики, подобной подкожно доставляемому инсулину, обеспечит такие же преимущества, как сверхбыстродействующий препарат инсулина. Это применение демонстрирует, что прандиальный сверхбыстродействующий инсулин предоставляет уникальную альтернативу раннему применению базального инсулина в целом, и что он обеспечивает конкретное преимущество для группы пациентов, у которых использование иглы, риск гипогликемии или перспектива увеличения массы тела являются особенно проблематичными.
Пациенты, для которых может быть полезно лечение согласно различным вариантам осуществления, описанным в настоящем документе, включают пациентов, которые достигают недостаточного гликемического контроля с помощью пероральных супрессоров продукции глюкозы печенью и у которых в ином случае к их режиму лечения был бы добавлен усилитель секреции инсулина, или пациентов, которые достигают недостаточного гликемического контроля с помощью комбинации перорального супрессора продукции глюкозы печенью и усилителя секреции инсулина. Подгруппы этих групп включают подгруппы пациентов, которые, кроме того, имеют боязнь укола иглы или по иным причинам хотели бы избежать инъекций, и подгруппы, которые имеют ожирение, избыточную массу тела или иным образом желают избежать увеличение массы тела, или которым необходимо снизить массу тела.
ПРИМЕРЫ
ПРИМЕР 1
Эксперименты проводили для установления эффекта сверхбыстродействующего инсулина, в частности состава для ингаляции, содержащего инсулин-FDKP, по сравнению с подкожно вводимым инсулином лизпро (лизпро, HUMALOG®, Eli Lilly & Co.) и ингалируемым рекомбинантным инсулином человека (EXUBERA®, Pfizer Inc.) на эндогенную продукцию глюкозы после нагрузки пищей и в ходе процедуры эугликемического клэмпа у индивидуумов с диабетом 2 типа. Состав инсулин-FDKP вводят индивидуумам путем пероральной ингаляции с использованием ингалятора с сухим порошком MEDTONE® (MannKind Corp.).
После завершения нагрузки пищей, данные анализировали согласно статистическому плану. Было выявлено, что общая экспозиция инсулина является приблизительно на 40% более высокой после введения 12 Е лизпро, по сравнению либо с 45 Е инсулин-FDKP (TI), либо 4 мг EXUBERA®. Таким образом, исследование вновь перепланировали, и индивидуумов не переводили в часть исследования с эугликемическим клэмпом глюкозы согласно исходному протоколу и лечению (4 мг EXUBERA®, 45 Е TI и 12 Е лизпро). Исследование было изменено (A1) и оно включало 12 индивидуумов (10 были повторно включены после первой нагрузки пищей) и только два способа лечения, которые представляли собой 10 Е лизпро и 60 и 90 Е TI. Дозы выбирали, исходя из относительной биодоступности, наблюдаемой после первой нагрузки пищей (OP), где при допущении линейной кинетики, 10 Е лизпро и 60 Е TI могли привести к сходной экспозиции. Группа дозы 90 Е была включена для оценки эффекта в группе с наиболее высокой дозой TI, исследованной в испытаниях 3 фазы. Шести из 12 индивидуумов вводили 60 Е TI, а другим 6 индивидуумов вводили 90 Е TI. Всем 12 индивидуумам вводили 10 Е лизпро перекрестным образом.
Способы и результаты, представленные ниже, описаны на основе исходного протокола (OP), который включает нагрузку пищей у 18 индивидуумов с тремя способами лечения (EXUBERA®, лизпро и TI), и изменения 1 (A1), которое включает 12 индивидуумов, которых лечили только TI и лизпро.
В исследовании участвовали индивидуумы с диабетом 2 типа, которых лечили инсулином. Индивидуумов подвергали скринингу и оценивали до, в процессе или после экспериментов и данные анализировали, как описано ниже. Индивидуумов отбирали, исходя из нескольких ключевых критериев включения, включая мужчин и женщин, имеющих возраст ≥18 и ≤70 лет и с клиническим диагнозом сахарного диабета 2 типа в течение ≥12 месяцев. Индивидуумы, отобранные для исследования, также имели стабильный противодиабетический режим инсулина в течение предыдущих 3 месяцев; HbA1c ≤8,5%; индекс массы тела (BMI) от ≤34 кг/м2 до ≥25 кг/м2; котинин в моче ≤100 нг/мл; PFT в FEV1 ≥70% от предсказанного значения, диффузионная способность CO одиночного дыхания (нескорректированная по DLco) ≥70% от предсказанного значения. Индивидуумов также лечили пероральным противодиабетическим лекарственным средством в течение предшествующих 3 месяцев; общая суточная потребность в инсулине составляла ≥1,2 МЕ/кг массы тела. Критерии для исключения из исследования также включали нестабильный контроль диабета и/или данные о серьезных осложнениях диабета (например, автономная невропатия); креатинин в сыворотке > 1,8 мг/дл у женщин и > 2,0 мг/дл у мужчин. Другое клинически значимое заболевание легких подтверждали с помощью документированного анамнеза или тестирования легочной функции.
Согласно OP, исследование планировали как рандомизированное открытое 3-сторонее перекрестное исследование. Посещения включали исходное скрининговое посещение, 3 последовательных посещения для введения для теста с нагрузкой пищей с последующим минимум 8-недельным (вплоть до максимум 12 недель) периодом восстановления от кровопотери, промежуточным посещением для установления безопасности, 3 последовательных посещения для процедуры клэмпа глюкозы, и конечное посещение для завершения. Во время этого анализа все пациенты завершили по меньшей мере посещения для нагрузки пищей, и использовали только эти данные. Скрининговое посещение(я) (V1) проводили за от 1 до 21 суток до первого посещения для введения (V2) с от 7 до 21 сутками между посещениями для введения (V2, V3 и V4) для теста нагрузки пищей. Между V4 и следующим посещением (V6) для введения проходило минимум 8 недель. Дополнительное посещение для установления безопасности (V5) было назначено на 1-3 суток перед первой из 3 процедур клэмпа глюкозы (V6). Процедуру клэмпа глюкозы проводили во время 3 посещений, V6, V7 и V8, с перерывом между посещениями от 7 до 21 суток. Конечное посещение (V9) происходило от 2 до 10 суток после V8 для оценки физического состояния, такой как оценка массы тела и роста.
Согласно A1 исследование планировали как рандомизированное открытое 2-стороннее перекрестное исследование. Посещения включали начальное скрининговое посещение, 2 последовательных посещения для теста нагрузки пищей с последующим минимум 4-недельным (вплоть до максимум 12 недель) периодом восстановления от кровопотери, промежуточным посещением для установления безопасности, 2 последовательных посещения для процедуры клэмпа глюкозы, и конечное посещение для завершения. Скрининговое посещение(я) (V1) происходило за от 1 до 21 суток до первого посещения для введения (V2) с перерывом от 7 до 21 суток между посещениями для введения (V2 и V3) для теста нагрузки пищей. Между V3 и следующим посещением для введения (V5) проходило минимум 4 недели. Дополнительное посещение для установления безопасности (V4) было намечено на 1-3 суток до первой из 3 процедур клэмпа глюкозы (V5). Процедуру клэмпа глюкозы проводили при 2 посещениях, V5 и V7, с перерывом от 7 до 21 суток между посещениями. Конечное посещение (V8) происходило через от 2 до 10 суток после V7 для проведения оценки физического состояния, такой как оценка массы тела и роста.
При каждом посещении для введения в ходе нагрузки пищей индивидуумов госпитализировали в клиническое отделение за ночь до начала введения. При первом посещении для введения (V2) для теста нагрузки пищей, индивидуумов случайным образом распределяли для введения инсулин-FDKP, инсулина лизпро или EXUBERA® (OP) и инсулин-FDKP и лизпро (A1), исходя из перекрестной схемы. Для процедур клэмпа глюкозы каждый индивидуум проходил тот же порядок случайного распределения, что и для тестов нагрузки пищей.
В процессе исследования, проводили периодическое взятие крови для определения фармакокинетических и/или фармакодинамических параметров, и образцы для установления безопасности отбирали, начиная за 12 часов до начала режимов лечения и нагрузки пищей, и после этого в течение периода 8 часов. Скрининговое тестирование и все 3 теста нагрузки пищей требовали в совокупности 409,5 мл крови для анализа и оценки лечения (OP) и 279 мл крови для A1. Посещения для процедуры клэмпа глюкозы, конечное посещение и промежуточное посещение для установления безопасности требовали всего 514,2 мл крови (OP) и 365 мл крови для A1 для анализа и оценки способов лечения. Общий объем крови, требуемый для исследований A1, составил 644 мл на индивидуума. Инфузию радиоактивно меченной D2-глюкозы проводили индивидуумам за 12 часов до начала нагрузки пищей и введения инсулина.
Тест нагрузки пищей: для теста нагрузки пищей использовали BOOST PLUS® (12 жидких унций), состоящий из 67,5 г углеводов, 21 г белков, 21 г жиров, с энергетической ценностью 540 ккал. BOOST PLUS® был обогащен U-13C-глюкозой для определения количества всосавшейся глюкозы. Одновременно использовали непрерывную инфузию обогащенной 6,6-2H2 глюкозы для оценки эндогенной продукции глюкозы, EGP. Взятие образцов для EGP натощак (f-EGP) проводили до начала внутривенной инфузии инсулина лизпро, т.е. в конце 7-часового периода инфузии обогащенной 6,6-2H2 глюкозы согласно OP. В A1 непрерывную инфузию инсулина проводили с использованием либо инсулина лизпро (для индивидуумов, которым вводили TI), либо регулярного инсулина человека (для индивидуумов, которым вводили лизпро). Устанавливали исходные концентрации глюкозы в крови 90 мг/дл (OP) и 110 мг/дл (A1) и их поддерживали путем варьируемой инфузии инсулина и 20% глюкозы, обогащенной 6,6-2H2 глюкозой, в течение периода по меньшей мере 5 часов перед дозированием инсулин-FDKP, инсулина лизпро или EXUBERA® (OP) или инсулин-FDKP и лизпро согласно A1. Скорость инфузии инсулина лизпро (OP) и скорость инфузии лизпро или RHI (A1) фиксировали на наименьшем возможном уровне за 90 минут до дозы введения. После дозирования концентрации глюкозы в крови удерживали от падения ниже 90 мг/дл (OP) и 75 мг/дл (A1) путем инфузии глюкозы.
Дозирование с помощью тестируемых способов лечения проводили путем введения дозы 45 Е инсулин-FDKP, 12 Е подкожного инсулина лизпро или 4 мг рекомбинантного инсулина человека (EXUBERA®), вводимого путем пероральной ингаляции в 0 момент времени (OP), или 10 Е подкожного лизпро и 60 или 90 Е TI (A1) непосредственно перед проглатыванием BOOST PLUS®. Согласно OP, дозу инсулина лизпро выбирали, исходя из информации, предоставленной на предписывающем ярлыке. Дозу, выбранную для EXUBERA®, получали путем обратного вычисления, исходя из информации о наиболее часто используемой дозе, предоставленной FDA Advisory Committee в предписывающем документе о EXUBERA®. Дозу инсулин-FDKP получали из результатов завершенных клинических исследований 2 и 3 фазы, проведенных MannKind Corporation, правоприемник заявки. Согласно A1, дозы вычисляли, исходя из экспозиции инсулина, наблюдаемой согласно OP. Концентрации глюкозы в крови определяли в образцах артериализированной венозной крови с регулярными интервалами. Количество перорально всосавшейся глюкозы оценивали путем определения U-13C-глюкозы. EGP определяли путем измерения 6,6-2H2 глюкозы с использованием модифицированных вычислений для нестационарного состояния (R. Hovorka, H. Jayatillake, E. Rogatsky, V. Tomuta, T. Hovorka and D. T. Stein. Calculating glucose fluxes during meal tolerance test: a new computational approach. Am. J. Physiol Endocrinol. Metab 293 (2):E610-E619, 2007). Концентрации C-пептида измеряли до и после введения дозы для оценки эндогенной секреции инсулина. Кроме того, также определяли концентрации глюкагона и свободных жирных кислот.
Процедура клэмпа глюкозы: для оценки EGP использовали непрерывную инфузию 6,6-2H2 глюкозы. Образцы крови для определения EGP натощак (f-EGP) отбирали до начала внутривенной инфузии инсулина, т.е., в конце 7-часового периода обогащенной инфузии 6,6-2H2 глюкозы индивидуумам. Исходные концентрации глюкозы в крови, составляющие 90 мг/дл (OP) и 110 мг/дл (A1) устанавливали и поддерживали путем варьируемой инфузии инсулина и 20% глюкозы, обогащенной 6,6-2H2 глюкозой, с помощью устройства Biostator в течение периода по меньшей мере 4 часов перед дозированием инсулин-FDKP, инсулина лизпро или EXUBERA® (OP), и либо лизпро, либо TI согласно A1.
Дозирование с помощью тестируемых способов лечения проводили путем введения дозы 45 Е инсулин-FDKP, 12 Е подкожного инсулина лизпро или 4 мг рекомбинантного инсулина человека (EXUBERA®) согласно OP, и лизпро или 60 или 90 Е TI (A1) в том же порядке, что и для теста нагрузки пищей, для каждого конкретного индивидуума. EGP определяли для каждого индивидуума путем измерения 6,6-2H2 глюкозы в образцах крови и с использованием вычислений, модифицированных Hovorka et al. (ниже) для нестационарного состояния. Для оценки эндогенной секреции инсулина измеряли концентрации C-пептида в сыворотке до и после введения дозы. Кроме того, концентрации глюкагона и свободных жирных кислот определяли с регулярными интервалами. Все индивидуумы возвращались к предшествующим противодиабетическим режимам лечения в конце каждого посещения для введения.
Результаты OP-части исследования представлены на ФИГ. 3-6. На ФИГ. 3 представлен график данных, полученных из величин в образцах крови, полученных от пациентов в этом исследовании. В частности, на ФИГ. 3 представлены измеренные концентрации глюкозы в крови в различные моменты времени после нагрузки пищей у пациентов с диабетом 2 типа, которым вводили инсулин лизпро (1), EXUBERA® (2) и состав инсулина, содержащий фумарилдикетопиперазин (инсулин-FDKP, TI, 3) в начале приема пищи. Моменты времени на кривых графиков с данными для каждого введения соответствуют средней величине для всех образцов, проанализированных в исследовании. Также на графике показаны экзогенные инфузии глюкозы, вводимые пациентам при необходимости в течение экспериментов для поддержания эугликемических (уровень глюкозы в крови остается выше 90 мг/дл) уровней после проведения каждого из введений и они представлены на графике в качестве 1a, 2a и 3a, соответственно для инсулина лизпро, EXUBERA® и инсулин-FDKP. Как показано на ФИГ. 3, уровни глюкозы отличаются для всех трех введений. Из данных очевидно, что индивидуумы, которым вводили инсулин лизпро, имели передозировку вследствие необходимости введения пациентам повторяющихся инфузий глюкозы для поддержания выше 90 мг/дл. Также на графике показано, что индивидуумы, которым вводили инсулин-FDKP, имели сниженные уровни глюкозы значительно раньше, чем другие в случае других введений, причем некоторым индивидуумам при этом введении требовались инфузии глюкозы для поддержания выше 90 мг/дл на ранних стадиях исследования. Однако индивидуумам, которым вводили инсулин-FDKP, не требовалась дополнительная инфузия глюкозы приблизительно через шесть часов после начала введения, что указывает на то, что это введение является эффективным в отношении поддержания гликемического контроля в течение пролонгированного периода времени. Также данные указывают на то, что концентрация глюкозы контролировалась у всех индивидуумов при всех введениях, однако, у индивидуумов, которым вводили инсулин-FDKP, контроль глюкозы был более эффективным от начала до приблизительно 120 минут после введения. Требовались минимальные инфузии глюкозы (после начальной фазы) до момента времени после шести часов после введения инсулин-FDKP (когда потребность в глюкозе, вероятно, обеспечивается исходной инфузией инсулина) по сравнению с индивидуумами, которым вводили EXUBERA® и лизпро и которым инфузировали глюкозу приблизительно через 4 и 3 часов соответственно, после введения. Данные указывают на то, что пациенты, которым вводили лизпро и EXUBERA®, могли достигнуть гипогликемических уровней после дозирования, если бы им не проводили инфузию глюкозы. Таким образом, инсулин-FDKP может быть способен поддерживать уровень глюкозы в крови выше гипогликемических уровней более эффективно, чем другие способы лечения, в течение более длительного периода времени.
На ФИГ. 4 представлен график данных, полученных для пациентов в исследовании, описанном выше, показывающий скорость всасывания глюкозы в течение периода времени после приема пищи у пациентов с диабетом 2 типа, которым вводили состав инсулина лизпро, EXUBERA® и инсулин-FDKP непосредственно перед приемом пищи. Моменты времени на графиках данных для каждой кривой введения соответствуют среднему значению для всех образцов, проанализированных в экспериментах. Данные, представленные на ФИГ. 4 показывают, что все индивидуумы, которым проводили три введения, проявляли сходные паттерны скорости всасывания глюкозы из употребленной пищи. Таким образом, данные указывают на то, что лечение не изменяет скорости всасывания глюкозы из пищи у индивидуумов, которым проводили введение.
На ФИГ. 5 представлен график данных, полученных в экспериментах, в которых эндогенную продукцию глюкозы после приема пищи определяли у пациентов с диабетом 2 типа, которым вводили состав инсулина лизпро, EXUBERA® и инсулин-FDKP в начале приема пищи. Моменты времени на графиках данных для каждой кривой введения соответствует среднему значению для всех образцов, проанализированных в экспериментах. Кривые данных для трех введений демонстрируют, что введение всех трех средств было в сходной степени эффективным в отношении эндогенной продукции глюкозы у индивидуумов, которым проводили введение, указывая на психологический максимум для этого эффекта. Следует отметить, что у индивидуумов, которым вводили инсулин-FDKP, наблюдали максимальное ингибирование эндогенной продукции глюкозы значительно быстрее или более рано (приблизительно через 40 минут) после введения по сравнению с инсулином лизпро (приблизительно через 80 минут) и EXUBERA® (приблизительно через 125 минут).
На ФИГ. 6 представлен график данных, полученных в экспериментах, в которых проводили мониторинг скорости исчезновения глюкозы в течение периода времени у индивидуумов с диабетом 2 типа, которым вводили состав инсулина лизпро, EXUBERA® и инсулин-FDKP в начале приема пищи, как описано выше. Моменты времени на графиках с данными для каждой кривой введения соответствуют средней величине для всех образцов, проанализированных в экспериментах. Кроме того, скорость исчезновения глюкозы стандартизировали для учета массы тела каждого индивидуума путем деления скорости исчезновения глюкозы на массу тела индивидуума. Данные показывают, что скорость исчезновения или утилизации глюкозы у индивидуумов отличалось для всех введений. Следует отметить, что скорость исчезновения глюкозы для инсулин-FDKP была очевидно значительно более высокой, чем для инсулина лизпро или EXUBERA®. Это было существенно при первом измерении после дозирования, приблизительно через 10 минут после дозирования, в то время как скорость исчезновения глюкозы в других случаях значимо не отличалась от исходного уровни до момента приблизительно 30 минут. Скорость исчезновения глюкозы в случае инсулин-FDKP достигала пика приблизительно через 40 минут после дозирования, значительно ранее по сравнению с инсулином лизпро (приблизительно через 120 минут) и EXUBERA® (приблизительно через 150 минут).
Также в исследовании было показано, что определение C-пептида (данные не представлены) отчетливо продемонстрировало, что повышение концентрации C-пептида было отсроченным в группе TI по сравнению с лизпро и EXUBERA®. Это последнее повышение концентрации C-пептида (и эндогенной продукции инсулина) связано со способностью каждого из экзогенных препаратов инсулина контролировать глюкозу, всосавшуюся из пищи, и, по-видимому, связано с формой профилей инсулина для каждой группы введения. Медленное повышение концентраций инсулина после EXUBERA® и лизпро (срединное tmax 113 и 75 минут, соответственно, против tmax 20 минут в группе TI), приводит к сниженной способности контролировать глюкозу рано после приема пищи, и, таким образом, к раннему повышению у пациентов ответа эндогенного инсулина. Однако задержка эндогенной продукции инсулина в группе TI указывает на лучший контроль глюкозы в крови в ранней части исследования, когда концентрации TI являются высокими.
В общем, данные исследования указывают на то, что инсулин-FDKP является значительно и неожиданно более эффективным лекарственным средствам у пациентов с диабетом 2 типа, чем существующие лекарственные средства, т.е., инсулин лизпро и EXUBERA®, в том, что лекарственное средство инсулин-FDKP было более быстрым в отношении ингибирования эндогенной продукции глюкозы и более быстрым в отношении индукции исчезновения глюкозы или скорости утилизации. Является неожиданным, что EXUBERA® является настолько более медленным по этим параметрам, чем инсулин лизпро, с котором он в остальном кинетически сходен. Это дополнительно подчеркивает неэквивалентность этих двух ингалируемых препаратов инсулина (т.е. инсулин-FDKP и EXUBERA®), уже очевидную из различной кинетики.
Результаты A1-части исследования представлены на ФИГ. 7-11. На ФИГ. 7 показано графическое представление данных для величин, определенных в образцах крови, полученных от индивидуумов в этом исследовании. В частности, на ФИГ. 7 показаны профили средняя концентрация инсулина-время для трех введений. Показаны общие концентрации инсулина (сумма концентраций регулярного инсулина человека и лизпро в каждый момент времени), поскольку весь инсулин в этой системе ассоциирован с индуцированным ответом. После введения как 60, так и 90 Е, инсулин-FDKP, наблюдаемые максимальные концентрации инсулина являются значительно более высокими (196 и 216 мкЕ/мл после TI против 83 мкЕ/мл после лизпро) и встречаются значительно ранее (срединное tmax 15 и 17,5 минут после TI против 60 минут после лизпро) при сравнении с максимальными концентрациями инсулина после введения лизпро. Однако средняя экспозиция была в высокой степени сходной между этими тремя группами, с общей AUC для инсулина 24,384, 18,616 и 19,575 мкЕ/мл*мин для двух дозовых групп TI и дозовой группы лизпро, соответственно.
На ФИГ. 8 представлены измеренные концентрации глюкозы в крови в различные моменты времени после нагрузки пищей у пациентов с диабетом 2 типа, которым вводили либо 60, либо 90 Е, состава инсулина, содержащего фумарилдикетопиперазин (инсулин-FDKP, 2, 3), и инсулина лизпро (1) в начале приема пищи. Моменты времени на кривых для каждого введения на графиках данных соответствует среднему значению для всех образцов, проанализированных в исследовании. Также на графике показаны инфузии экзогенной глюкозы, проводимые пациентам при необходимости в ходе экспериментов для поддержания эугликемических (для поддержания уровня глюкозы в крови выше 75 мг/дл) уровней после проведения каждого из введений и они представлены на графике в качестве 1a, 2a и 3a, соответственно, для 60 и 90 Е инсулин-FDKP, и инсулина лизпро, соответственно. Как видно на ФИГ. 7, форма профиля глюкозы отличается для всех трех введений, однако максимальные уровни глюкозы являются высоко сходными, и глюкоза контролировалась при введении во всех трех случаях. Также на графике показано, что индивидуумы, которым вводили любую из доз инсулин-FDKP, имели сниженные уровни глюкозы значительно ранее, чем после введения лизпро, с более эффективным контролем глюкозы в пределах первых 120-180 минут после введения дозы. Индивидуумам, которым вводили как 90 Е инсулин-FDKP, так и лизпро, требовались некоторые дополнительные инфузии глюкозы для поддержания уровня глюкозы на уровне или выше 75 мг/дл. После 90 Е TI, некоторым индивидуумам требовались дополнительные инфузии глюкозы в ранний период после введения дозы, и после лизпро эти инфузии требовались в более поздний период. Это явление может быть следствием высокой скорости выведения глюкозы, наблюдаемой у пациентов, которым вводили 90 Е инсулин-FDKP. После введения инсулин-FDKP до конца исследования (когда потребность в глюкозе, вероятно, является следствием инфузии исходного инсулина) требовались минимальные инфузии глюкозы (после начальной фазы) по сравнению с индивидуумами, которым вводили лизпро и которым проводили инфузии глюкозы через от 5 до 8 часов после введения. Этот результат указывает на повышенное присутствие и активность инсулина после введения лизпро в моменты времени, находящиеся за пределами ожидаемого всасывания глюкозы после приема пищи. Кроме того, очевидно, что в группе 90 Е инсулин-FDKP уровни глюкозы в крови контролировались более эффективно, чем в группе, в которой вводили дозу 60 Е инсулин-FDKP, что приводило к более низким уровням глюкозы в крови в период времени 0-180 минут. Вследствие лучшего контроля, меньшее количество эндогенного инсулина секретировалось у пациентов, которым вводили дозу 90 Е инсулин-FDKP, и, таким образом, эндогенный инсулин вносил малый вклад в общий профиль инсулина у индивидуумов в этой группе. Более того, данные указывают на то, что большее количество эндогенного инсулина вносило вклад в общий профиль инсулина в группе, в которой вводили дозу 60 Е инсулин-FDKP, что делает средние профили инсулина сходными для двух протестированных групп.
На ФИГ. 9 представлен график данных, полученных для пациентов в исследовании, описанном выше, на котором показана скорость всасывания глюкозы в течение периода времени после приема пищи у пациентов с диабетом 2 типа, которым вводили 10 Е инсулина лизпро, и 60 и 90 Е состава инсулин-FDKP непосредственно перед приемом пищи. Моменты времени на кривой для каждого введения на графиках данных соответствуют среднему значению для всех образцов, проанализированных в экспериментах. Данные на ФИГ. 9 показывают, что все индивидуумы обладали сходным паттерном скорости всасывания глюкозы из употребленной пищи. Таким образом, данные указывают на то, что введение не изменяло скорость всасывания глюкозы у индивидуумов, которым проводили введение, из пищи.
На ФИГ. 10 представлен график данных, полученных в экспериментах, в которых эндогенную продукцию глюкозы определяли у пациентов с диабетом 2 типа, которым вводили 10 Е инсулина лизпро и либо 60 Е, либо 90 Е, состава инсулин-FDKP в начале приема пищи. Моменты времени на кривых для каждого введения на графиках данных соответствуют среднему значению для всех образцов, проанализированных в экспериментах. Двух индивидуумов, которым вводили 90 Е инсулин-FDKP исключили из анализа вследствие сложности в интерпретации смоделированных результатов. Кривые данных для трех введений показывают, что введения во всех трех случаях были эффективными в отношении ингибирования эндогенной продукции глюкозы индивидуумов, которым проводили введение, в сходной степени между введениями 60 Е инсулин-FDKP и 10 Е лизпро. Также данные указывают на то, что введение 90 Е инсулин-FDKP имеет больший и более быстрый эффект в отношении ингибирования эндогенной продукции глюкозы. Следует отметить, что индивидуумы, которым вводили инсулин-FDKP, имели пиковое ингибирование эндогенной продукции глюкозы значительно быстрее или раньше (приблизительно через 40 и 60 минут для двух введений) после дозирования, чем инсулин лизпро (приблизительно через 100 минут).
На ФИГ. 11 представлен график данных, полученных из экспериментов, в которых определяли скорость исчезновения глюкозы у пациентов с диабетом 2 типа, которым вводили 10 Е инсулина лизпро и либо 60 Е, либо 90 Е, состава инсулин-FDKP в начале приема пищи, как описано выше. Моменты времени кривых для каждого введения на графиках данных соответствуют среднему значению для всех образцов, проанализированных в экспериментах. Кроме того, скорость исчезновения глюкозы стандартизировали для учета массы тела каждого индивидуума путем деления скорости исчезновения глюкозы на массу тела индивидуума. Данные показывают, что скорость исчезновения или утилизации глюкозы у всех индивидуумов отличается для всех случаев введения. Следует отметить, что скорость исчезновения глюкозы в случае дозовых групп как 60 Е, так и 90 Е, инсулин-FDKP стала очевидной значительно ранее, чем для инсулина лизпро. Скорость исчезновения глюкозы в группах введения инсулин-FDKP была существенной при первом определении после дозирования, приблизительно через 5 минут после дозирования, и достигала пика приблизительно через 30-50 минут после дозирования, значительно раньше по сравнению с инсулином лизпро (приблизительно через 100 минут).
В общем, данные исследования указывают на то, что инсулин-FDKP был значительно более эффективным лекарственным средством у пациентов с диабетом 2 типа, по сравнению с существующими лекарственными средствами, т.е., инсулином лизпро, в том, что лекарственное средство инсулин-FDKP было быстрее в отношении ингибирования эндогенной продукции глюкозы и быстрее в отношении индукции скорости исчезновения или утилизации глюкозы у пациентов с диабетом 2 типа. Оказалось, что эффект инсулин-FDKP на EGP и утилизацию глюкозы усиливался при повышения дозы.
ПРИМЕР 2
Проспективное многоцентровое открытое рандомизированное контролируемое клиническое испытание, сравнивающее эффективность и безопасность у индивидуумов с диабетом 1 типа, которым вводили подкожный базальный инсулин и прандиальную ингаляцию инсулин-FDKP против подкожного базального и прандиального инсулина в течение периода лечения из 52 недель и 4-недельного наблюдения
Это исследование представляло собой многоцентровое открытое рандомизируемое контролируемое клиническое испытание с участием нескольких стран, сравнивающее гликемический контроль у индивидуумов с диабетом 1 типа, которым вводили базальный инсулин и ингалируемый порошок прандиального инсулин-FDKP (TI) (группа ингалируемого порошка TI) с индивидуумами, которым вводили базальный инсулин и подкожный быстродействующий инсулин аспарт (группа сравнения). Это исследование включало фазу введения из 52 недель и фазу наблюдения из 4 недель. В ходе 4-недельной фазы наблюдения были запланированы оценка легочной функции и оценка отдельных клинических лабораторных показателей.
Исследования начиналось с включения в исследование на -3 неделе. У индивидуумов проводили полную оценку безопасности и соответствия требованиям, включая HbA1c и уровень глюкозы в плазме натощак (FPG).
На -1 неделе индивидуумов случайным образом разделяли на одно из 2 следующих лечений:
базальный инсулин + прандиальный ингалируемый порошок TI
Базальный инсулин + прандиальный подкожный быстродействующий инсулин
На -1 неделе индивидуумы вновь проходили первые три части анкетирования лечения инсулином (ITQ) (только для оценки стабильности от теста к тесту). После прохождения анкетирования, индивидуумов, случайным образом распределенных в группу ингалируемого порошка TI, обучали использовать ингалятор MEDTONE® с порошком для ингаляции TECHNOSPHERE®/инсулин (инсулин-FDKP); индивидуумов в группе сравнения обучали использовать шприцы-ручки NOVOLOG®; всех индивидуумов обучали вводить LANTUS®. Кроме того, всех индивидуумов обучали пользоваться устройством для мониторинга уровня глюкозы в крови (HBGM), предоставляемом в начале испытания, и вести дневник, и для них проводили обучение по диабету. При необходимости любое обучение повторяли на 0 неделе.
В начале фазы лечения индивидуумы проходили несколько посещений для титрования/оценки дозы для коррекции терапии инсулином. Посещения для титрования проводились один раз в неделю в течение первых 4 недель. В течение с 4 по 10 недели, проводили три "посещения" по телефону (на 6 неделе, 8 неделе и 10 неделе) для титрования дозы, если необходимо. Однако титрование дозы допускалось на протяжении всего испытания.
Для всех индивидуумов получали профиль глюкозы в крови из 7 точек для любых 3 суток в течение недели, непосредственно предшествующей каждому посещению от 0 недели до 52 недели. 7 точек включали образцы перед завтраком и через 2 часа после завтрака, до приема пищи в середине дня и через 2 часа после приема пищи в середине дня, перед приемом пищи вечером и через 2 часа после приема пищи вечером и на ночь (7 точек в сутки, в течение 3 суток). Эти уровни глюкозы в крови (BG) записывали в дневниках HBGM, которые собирали при клинических посещениях. Дневники с 4 недели по 10 неделю (в ходе титрования дозы), которые обсуждались по телефону, собирали при следующих посещениях учреждения.
Тест нагрузки пищей проводили на 4 неделе (в ходе титрования дозы), на 26 неделе и на 52 неделе. Моменты времени взятия образцов крови при нагрузке пищей представляли собой: -30, 0, 30, 60, 90, 105, 120, 180, 240, 300 и 360 минут. Также измеряли уровни глюкозы в крови (BG) с использованием устройств для измерения глюкозы HBGM, чтобы помочь исследователю принять решение по лечению, и значения получали в моменты времени -30, 0, 60 и 120 минут во время нагрузки пищей.
Способы лечения для гликемического контроля, использованные в испытании, представляли собой следующие способы: прандиальный ингалируемый порошок инсулин-FDKP (TI), прандиальный инсулин аспарт и базальный инсулин гларгин. Индивидуумы, отнесенные к группе ингаляционного порошка TI (ингаляционный порошок TI в комбинации с терапией базальным инсулином) вводили подкожный базальный инсулин гларгин (LANTUS®) один раз в сутки (на ночь) и ингалируемый порошок TI от 3 до 4 раз в сутки, непосредственно перед основными приемами пищи или закуски, в зависимости от клинической необходимости. Коррекцию дозы ингалируемого порошка TI и частоты применения до более чем 3 раз в сутки проводили согласно мнению исследователей. Индивидуумы в группе сравнения вводили подкожный базальный инсулин гларгин один раз в сутки (на ночь) и подкожную инъекцию быстродействующего инсулина (NOVOLOG®) от 3 до 4 раз в сутки, непосредственно перед основными приемами пищи (не позднее чем за 10 минут до приемов пищи).
Главной задачей этого испытания было сравнение эффективности ингалируемого порошка TI + базальный инсулин против инсулина аспарт + базальный инсулин в течение 52 недель с оценкой по изменению HbA1c (%) от исходного уровня. Исследовали всего 565 индивидуумов в США, Европе, России и Латинской Америке. Всего 293 индивидуумам вводили ингалируемый порошок TI + базальный инсулин, и 272 индивидуумам вводили инсулин аспарт + базальный инсулин.
Основной результат эффективности оценивали с использованием предварительно определенных анализов ANCOVA и смешанной модели с повторяющимися измерениями (MMRM). Вследствие непропорциональных выпадений данных между группой лечения ингалируемым порошком TI + базальный инсулин и группой лечения инсулин аспарт + базальный инсулин, было нарушено допущение пропуска полностью случайным образом для модели ANCOVA. В связи с этим, в качестве вторичного подтверждения использовали MMRM. Ингалируемый порошок TI удовлетворял первичному результату не меньшей эффективности в модели MMRM, но не в модели ANCOVA. Среднее изменение от исходного уровня в течение 52 недель было сравнимым в обеих группах лечения, со среднеквадратичным отличием -0,25% в пользу инсулина аспарт. Исходя из результатов для обеих моделей, между группами лечения не было клинически значимых отличий в среднем изменении HbA1c от исходного уровня. Действительно, в 2 группах лечения сравнимый процент индивидуумов достигал заданных уровней HbA1c. Не было статистически значимых отличий в проценте индивидуумов, у которых уровень HbA1c снижался до ≤8,0% (50,99% для группы ингалируемого порошка TI, 56,16% для группы сравнения); ≤7,0% (16,34%, группа ингалируемого порошка TI; 15,98%, группа сравнения); и ≤6,5% (7,43%, группа ингалируемого порошка TI; 7,31%, группа сравнения).
Снижение HbA1c было сравнимым между группами и сохранялось в течение 52 недель. У индивидуумов в группе TI происходило снижение до 8,21 (SD 1,15) % на 14 неделе от исходного уровня 8,41 (SD 0,92) %; снижение сохранялось на 52 неделе (8,20 [SD 1,22] %). У индивидуумов в группе инсулина аспарт происходило снижение до 8,07 (SD 1,09) % на 14 неделе от исходного уровня 8,48 (SD 0,97) %; на 52 неделе снижение сохранялось (7,99 [SD 1,07] %).
Когда анализ изменения HbA1c от исходного уровня корректировали по экспозиции инсулина гларгин в течение последних 3 месяцев в модели ANCOVA, не было выявлено эффекта вследствие экспозиции инсулина гларгин.
В течение 52-недельного периода лечения, уровни глюкозы в плазме натощак (FPG) значимо снизились (p = 0,0012) в группе ингалируемого порошка TI по сравнению с уровнями FPG у индивидуумов, принимавших инсулин аспарт, несмотря на сходные уровни дозы базального инсулина в обеих группах как в начале, так и в конце, испытания. В группе ингалируемого порошка TI средний FPG снизился на 44,9 (SD 104,7) мг/дл от 187,6 (SD 85,1) мг/дл на исходном уровне до 140,1 (SD 72,1) мг/дл в конце периода введения, по сравнению с меньшим снижением, составляющим 23,4 (SD 103,1) мг/дл от 180,8 (SD 86,9) мг/дл на исходном уровне до 161,3 (SD 68,2) мг/дл в течение того же периода времени в группе сравнения.
Вторичным результатом эффективности был процент индивидуумов с 2-часовым постпрандиальным уровнем глюкозы (PPG) <140 мг/дл и <180 мг/дл после нагрузки пищей. Значения PPG через 2 часа у индивидуумов обеих категорий на 26 и 52 неделях были сравнимы в каждой группе введения. Абсолютные величины для Cmax PPG на исходном уровне и 52 неделе были одинаковыми в обеих группах введения.
Индивидуумы в группе ингалируемого порошка TI потеряли в среднем 0,5 кг в течение периода лечения 52 недель по сравнению со средним увеличением массы, составляющим 1,4 кг, наблюдаемым в группе сравнения. Отличия между группами были статистически значимыми (p<0,0001) с отличием между способами лечения -1,8 кг. Среднее изменение массы тела от исходного уровня (0 неделя) не было статистически значимым для группы TI (p =0,1102), в то время как среднее увеличение массы тела для группы инсулина аспарт было значимым (p<0,0001).
В целом, в обоих испытуемых группах достигали сравнимых уровней HbA1c и постпрандиальных уровней глюкозы в крови; однако у индивидуумов, которых лечили ингалируемым порошком TI, это происходило в контексте отсутствия влияния на массу тела и с более эффективным контролем глюкозы в крови натощак.
Ингалируемый порошок TI хорошо переносился на протяжении 52 недель лечения. Профиль безопасности ингалируемого порошка TI был сходен с профилем безопасности, наблюдаемым в более ранних испытаниях в клинической программе по разработке ингалируемого порошка TI; в ходе испытания не появлялось отрицательных данных о безопасности. Не было описано новообразований в легких. Не было статистических отличий между лечением ингалируемым порошком TI и лечением для сравнения в отношении изменения FEV1 (форсированный объем выдоха за одну секунду) от исходного уровня, FVC (форсированная жизненная емкость) и TLC (общая емкость легких). Наиболее частыми неблагоприятными явлениями при испытании у индивидуумов, которым вводили ингалируемый порошок TI, были гипогликемия от мягкой до умеренной и временный мягкий сухой кашель.
Профили BG из семи точек получали, исходя из HBGM; данные, полученные во все указанные моменты времени для групп ITT и PP, соответственно, представлены на ФИГ. 12. Статистику вывода не проводили.
На ФИГ. 12 представлен профиль BG из 7-точек на 52 неделе для обеих групп лечения. Исходные значения до завтрака были ниже в группе TI, как и ожидали от значений FPG на 52 неделе: 139,1 (SD 72,6) мг/дл для группы TI против 49,5 (SD 80,2) мг/дл для группы инсулина аспарт. От периода перед завтраком до периода до обеда значения BG были ниже в группе TI. Однако от периода после обеда до периода на ночь средние суточные значения BG были сходны в обеих группах лечения. Согласующиеся результаты наблюдали в группе PP (данные не представлены). В обеих группах введения отсутствовало параллельное и устойчивое повышение BG от периода перед ужином до периода на ночь, которое, вероятно, было результатом недостаточного дозирования инсулина гларгин. Дозирование на ночь инсулина гларгин может не обеспечить полного 24-часового охвата у всех индивидуумов с диабетом 1 типа (Barnett A. Vascular Health and Risk Management 2:59-67, 2006;) (LANTUS® вводили один раз в сутки согласно ярлыку). Хотя происходило повышение исходного уровня глюкозы в обеих группах лечения как вечером, так и на протяжении суток, этот эффект является более выраженным в группе лечения TI.
ПРИМЕР 3
Проспективное многоцентровое открытое рандомизированное контролируемое клиническое испытание, сравнивающее эффективность и безопасность у индивидуумов с DM T2, которым вводили подкожный базальный инсулин и прандиальную ингаляцию TI, против подкожных предварительно смешанных лекарственных средств инсулина в течение периода лечения из 52 недель и 4-недельного наблюдения
В этом исследовании сравнивали эффективность, выражаемую в изменении HbA1c в течение 52 недель, прандиального введения ингалируемого порошка TI в комбинации с терапией базальным инсулином (группа TI) против предварительной смеси инсулина среднего действия и инсулина быстрого действия (группа сравнения) у индивидуумов с недостаточно контролируемым диабетом 2 типа, которых ранее лечили режимами подкожного инсулина ± пероральные антигипергликемические средства. Снижение HbA1c было сравнимым между TI + базальный инсулин и предварительно смешанным инсулином. Процент отвечающих с HbA1c с конце исследования ≤7,0% был сравнимым и статистически не отличался между группами TI + базальный инсулин и предварительно смешанного инсулина. Следует отметить, что уровни глюкозы натощак были значительно снижены при лечении TI + базальный инсулин по сравнению с предварительно смешанным инсулином (см. ФИГ. 13). Кроме того, как уровень глюкозы натощак, так и колебания глюкозы, были снижены для группы TI + базальный инсулин между началом и концом периода лечения (см. ФИГ. 14). Как отмечалось в примере 2, для TI + базальный инсулин (см. ФИГ. 14) исходные уровни глюкозы в крови имели тенденцию к повышению в течение суток.
ПРИМЕР 4
Это исследование представляло собой открытое испытание 3 фазы из 24 недель, предназначенное для оценки эффективности и безопасности прандиального TECHNOSPHERE®/инсулина (инсулин-FDKP, TI) отдельно или в комбинации с метформином против метформина и усилителя секреции, современного стандартного режима лечения, у индивидуумов с сахарным диабетом 2 типа, недостаточно контролируемым комбинацией метформином и усилителем секреции. На ФИГ. 15 и 16 представлена схема испытания для клинического исследования и исходные демографические данные для пациентов, включенных в исследование. Индивидуумов случайным образом распределяли 1:1:1 в одну из 3 групп лечения и им проводили противодиабетическое лечение, исходя из группы рандомизации в течение первых 12 недель; последующие 12 недель испытания считали периодом наблюдения.
Схема испытания была необычной в том, что не было формального подготовительного периода для титрования исследуемых лекарственных средств. Индивидуумы имели всего только 12 недель лечения для титрования эффективной дозы исследуемого лекарственного средства перед проведением оценки первичного результата эффективности. Для индивидуумов с продолжающимся недостаточным контролем после терапии в течение 12 недель в любой из 3 групп требовалось либо переключение на TI + метформин, либо прекращение участия в испытании. Общая продолжительность периода лечения составила 24 недели.
Это исследование не было испытанием лечения до заданной цели и исследователи не преследовали цели лечения до конкретных HbA1c или уровня глюкозы в плазме натощак (FPG). Исследователям позволяли титровать TI, исходя из их клинического мнения, с верхними пределами, указанными для уровня глюкозы в крови до приема пищи, после приема пищи и на ночь, но без схемы с фиксированной дозой. Несмотря на то, что протокол позволял титрование вплоть до 90 Е TI на прием пищи, среднее значение на прием пищи для дозы TI составило ~65 Е в конце испытания, указывая на то, что исследователи неохотно титровали выше.
При непосредственном сравнении прандиального TI отдельно или в комбинации с метформином против обычно используемого антигипергликемического режима. Все три группы введения продемонстрировали статистически и клинически значимое снижение уровней HbA1c на протяжении исследования. TI был сравнимым в отношении снижения HbA1c и FPG и значительно более эффективным в отношении постпрандиального контроля - как при формальных нагрузках пищей так и в подвергаемых самостоятельному мониторингу профилях глюкозы. У индивидуумов, которым вводили прандиальный TI отдельно или в комбинации с метформином в течение 24 недель масса тела в среднем снижалась. Сверхбыстрая фармакокинетика TI может синхронизировать уровни инсулина с повышением после приема пищи уровня глюкозы в крови, тем самым препятствуя чрезмерной инсулинотерапии и сопутствующему увеличению массы тела.
TI отдельно или в комбинации с метформином был хорошо переносим в течение 24 недель лечения. На ФИГ. 17-28 представлены результаты исследования. Профиль безопасности TI был сходен с профилем безопасности, наблюдаемым в более ранних испытаниях в программе по клинической разработке TI; в ходе испытания не появилось отрицательных данных о безопасности. Во всех группах лечения наблюдали очень низкие уровни тяжелой гипогликемии без возникновения случаев у пациентов, которым вводили TI отдельно или с пероральными гипогликемическими средствами, и с их возникновением у 2% пациентов, когда TI и метформин комбинировали. Даже при таком выраженном снижении HbA1c в целом, не наблюдали повышения массы тела. Детальная оценка безопасности для легких, включая FEv1 и DLCO в течение 24 недель исследования, показала отсутствие отличий в легочной функции между пациентами, ингалирующими TI, и пациентами, которые проводили только пероральную терапию.
TI + метформин
Для индивидуумов, которые завершили испытание, прандиальный TI + метформин обеспечили клинически значимое снижение среднего значения HbA1c от исходного уровня (-1,68 [1,0] %) после лечения в течение 24 недель, что сравнимо с этим показателем для стандартного антигипергликемического режима. Однако TI + метформин обеспечили статистически лучший постпрандиальный контроль по сравнению с метформином + усилитель секреции после лечения в течение 12 и 24 недель и сравнимое среднее снижение FPG от исходного уровня после 24 недель. В этой группе лечения происходило среднее снижение массы тела (-0,75 кг) в течение 24 недель и общая встречаемость гипогликемии от мягкой до умеренной составляла 35,0%.
TI отдельно
Для индивидуумов, которые завершили испытание, прандиальный TI отдельно был успешным в отношении обеспечения клинически значимого среднего снижения HbA1c от исходного уровня (1,82 [1,1] %) после лечения в течение 24 недель. Изменение от исходного уровня было численно более высоким по сравнению со стандартным антигипергликемическим режимом метформина + усилитель секреции. В конце испытания TI отдельно обеспечил значительно более эффективный постпрандиальный контроль со сравнимым средним снижением FPG от исходного уровня. В этой группе лечения произошло суммарное снижение массы тела (-0,04 кг) в течение 24 недель и общая встречаемость гипогликемии от мягкой до умеренной составила 27,6%.
Метформин + усилитель секреции
Для индивидуумов, которые завершили испытание, метформин + усилитель секреции были успешными в отношении обеспечения клинически значимого среднего снижения HbA1c (1,23 [1,1] %) от исходного уровня после 24 недель, но со значительно менее эффективным контролем после приема пищи, чем в группах TI (ФИГ. 17 и 18). Среднее снижение FPG и массы тела от исходного уровня было сходным со снижением, наблюдаемым для группы TI + метформин (ФИГ. 21-22). Общая встречаемость гипогликемии от мягкой до умеренной составила 20,8%.
Принимаемый с пищей TI отдельно или в комбинации с метформином значительно снижает уровни HbA1c в течение 12 и 24 недель (ФИГ. 23-25). Этого достигают путем контроля уровней глюкозы в крови в течение 24 часов, что демонстрируется уровнями глюкозы в крови из 7 точек. Главный эффект TI обуславливается снижением постпрандиальных колебаний концентрации глюкозы в крови, о чем свидетельствуют снижения 1- и 2-часовых постпрандиальных уровней глюкозы, AUC и Cmax. Данные этого испытания свидетельствуют в поддержку применения прандиального TI в комбинации с метформином у индивидуумов с диабетом 2 типа, которым требуется улучшение как постпрандиального уровня глюкозы, так и как FPG (ФИГ. 26-28). Также они указывают на возможность применения прандиального TI в качестве монотерапии у индивидуумов с диабетом 2 типа, которым требуется улучшение постпрандиального гликемического контроля, однако которые имеют достаточный контроль в отношении FPG.
Большинству пациентов с диабетом 2 типа в конечном итоге требуется лечение инсулином для поддержания гликемического контроля. Лечение прандиальным TI отдельно или в комбинации с метформином обеспечивает эффективный гликемический контроль без увеличения массы тела. Это является особенно важным для пациентов с диабетом 2 типа, которые часто имеют избыточную массу или ожирение.
Обобщение
Данные демонстрируют, что TI отдельно или в комбинации с метформином клинически и значимо снижал HbA1c в течение 12 и 24 недель без увеличения массы тела. TI отдельно или в комбинации с метформином контролирует общие каждодневные уровни глюкозы в крови лучше, чем метформин + усилитель секреции, исходя из уровней глюкозы в крови из 7 точек.
Также данные демонстрируют, что TI отдельно или в комбинации с метформином контролирует постпрандиальные колебания уровней глюкозы в крови лучше, чем метформин + усилитель секреции (1) через 1 ч и 2 ч в тестах нагрузки пищей; (2) с точки зрения уровней AUC через 12 и 24 недель; (3) с точки зрения 1- и 2-часовых постпрандиальных уровней глюкозы в крови (≤ 180 мг/дл) через 12 и/или 24 недель; и (4) с точки зрения 1- и 2-часовых постпрандиальных уровней глюкозы в крови (≤ 140 мг/дл) через 12 и/или 24 недель.
Кроме того, TI отдельно или в комбинации с метформином снижает уровень глюкозы в крови натощак через 12 и 24 недели.
В целом, встречаемость гипогликемии была низкой во всех группах лечения.
Более того, средние изменения тестов функции легких, включающих FEV1, FVC, TLC и DLco-HB1 от исходного уровня для группы TI отдельно и группы TI + метформин значимо не отличались от группы метформин + усилитель секреции на 12 неделе или 24 неделе.
Если нет иных указаний, все числа, выражающие количества ингредиентов, свойства, такие как молекулярная масса, условия реакции и т.д., используемые в описании и формуле изобретения следует понимать как модифицированные во всех случаях термином "приблизительно". Таким образом, если нет иных указаний, числовые параметры, указанные в представленном ниже описании и прилагаемой формуле изобретения, являются приближениями, которые могут варьировать, в зависимости от желаемых свойств, которые стремились достигнуть с помощью настоящего изобретения. Самое меньшее, и не в качестве попытки ограничить применение принципов эквивалентов до объема формулы изобретения, каждый числовой параметр должен истолковываться по меньшей мере ввиду числа представленных значащих цифр и с использованием общепринятых способов округления. Несмотря на то, что числовые диапазоны и параметры, устанавливающие широкий объем изобретения, являются приближениями, числовые значения, указанные в конкретных примерах, представлены настолько точно, насколько это возможно. Однако любое числовое значение в своей основе обязательно содержит ошибки, являющиеся следствием стандартного отклонения, выявляемого при соответствующем измерении при тестировании.
Форму единственного числа и сходные упоминания, используемые в контексте описания изобретения (особенно в контексте представленной ниже формулы изобретения) следует истолковывать как охватывающую как единственное, так и множественное, число, если в настоящем документе нет иных указаний или если контекст этому явно не противоречит. Перечисление диапазонов значений в настоящем документе предназначено только в качестве способа сокращения, указывающего конкретно на каждое отдельное значение, находящееся в данном диапазоне. Если в настоящем документе нет иных указаний, каждое конкретное значение включено в описание, как если бы оно было отдельно приведено в настоящем документе. Все способы, описанные в настоящем документе, можно проводить в любом пригодном порядке, если в настоящем документе нет иных указаний или в ином случае если контекст этому явно не противоречит. Применение любых и всех примеров, или иллюстрирующих формулировок (например "такой как"), представленных в настоящем документе, предназначено только для лучшего изложения изобретения и в ином случае не ограничивает объем заявленного изобретения. Никакие формулировки в описании не следует истолковывать, как указывающие на любой незаявленный элемент, необходимый для осуществления на практике изобретения.
Группирование альтернативных элементов или вариантов осуществления изобретения, описанных в настоящем документе, не следует истолковывать как ограничение. Каждый представитель группы может быть указан и заявлен отдельно или в комбинации с другими представителями группы или другими элементами, встречающимся в настоящем документе. Ожидается, что один или несколько представителей группы могут быть включен в группу или удален из группы по причине удобства и/или патентоспособности. Когда происходит любое такое включение или удалении, подразумевают, что описание, представленное в настоящем документе, содержит модифицированную группу, таким образом удовлетворяя письменному описанию любой и всех групп Маркуша, используемых в прилагаемой формуле изобретения.
Предпочтительные варианты осуществления этого изобретения описаны в настоящем документе, включая наилучший способ, известный авторам изобретения, для осуществления изобретения. Безусловно, варианты этих предпочтительных вариантов осуществления станут очевидными специалистам в данной области при прочтении представленного выше описания. Авторы изобретения ожидают, что квалифицированные специалисты при необходимости будут использовать такие варианты, и авторы изобретения подразумевают применение изобретения на практике, отличное от конкретно описанного в настоящем документе. Таким образом, это изобретение включает все модификации и эквиваленты объекта, приведенного в прилагаемой формуле изобретения, что позволяется действующим законодательством. Более того, изобретением охватывается любая комбинация описанных выше элементов во всех возможных вариантах, если в настоящем документе нет иных указаний или в ином случае если контекст этому явно не противоречит.
Конкретные варианты осуществления, описанные в настоящем документе, могут быть далее ограничены в формуле изобретения с использованием формулировок "состоящий из" или "по существу состоящий из". При использовании в формуле изобретения, как поданной, так и добавленной после изменения, промежуточный термин "состоящий из" исключает любой элемент, стадию или ингредиент, не указанные в формуле изобретения. Промежуточный термин "по существу состоящий из" ограничивает объем формулы изобретения указанными материалами или стадиями и материалами или стадиями, не оказывающими существенного влияния на основную и новую характеристику(и). Варианты осуществления изобретения, заявленные таким образом, являются по существу или полностью описаны и поддержаны в настоящем документе.
Более того, на протяжении этого описания приведены ссылки на патенты и патентные публикации. Каждая из указанных выше цитированных ссылок и печатных публикаций отдельно включена в настоящий документ в качестве ссылок в полном объеме.
В заключение, следует понимать, что варианты осуществления изобретения, описанные в настоящем документе, являются иллюстрациями принципов настоящего изобретения. В объеме изобретения находятся другие модификации, которые можно использовать. Таким образом, в качестве неограничивающего примера можно использовать альтернативные конфигурации настоящего изобретения согласно указаниям, представленным в настоящем документе. Таким образом, настоящее изобретение не ограничивается точно тем, что показано и описано.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ СВЕРХБЫСТРОДЕЙСТВУЮЩЕГО ИНСУЛИНА | 2009 |
|
RU2519706C2 |
| ЛЕЧЕНИЕ САХАРНОГО ДИАБЕТА С ПОМОЩЬЮ СОСТАВОВ ИНСУЛИНОВ ДЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2014 |
|
RU2705797C2 |
| СПОСОБ ПРЕДОТВРАЩЕНИЯ ПОБОЧНЫХ ЭФФЕКТОВ GLP-1 | 2008 |
|
RU2474415C2 |
| ДОСТАВКА АКТИВНЫХ ВЕЩЕСТВ | 2008 |
|
RU2467741C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2013 |
|
RU2670106C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ОКАЗАНИЯ ПОМОЩИ В УПРАВЛЕНИИ ЛЕКАРСТВЕННОЙ ТЕРАПИЕЙ ДИАБЕТА | 2019 |
|
RU2823201C2 |
| ЛИКСИСЕНАТИД В КАЧЕСТВЕ ДОПОЛНИТЕЛЬНОЙ ТЕРАПИИ К БАЗАЛЬНОМУ ИНСУЛИНУ ПРИ ДИАБЕТЕ 2 ТИПА | 2012 |
|
RU2606154C2 |
| СПОСОБЫ ИСПОЛЬЗОВАНИЯ ДИАЦЕРЕИНА В ДОПОЛНИТЕЛЬНОМ ЛЕЧЕНИИ ДИАБЕТА | 2011 |
|
RU2563988C2 |
| ЛИКСИСЕНАТИД И МЕТФОРМИН ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА ТИПА 2 | 2012 |
|
RU2623023C2 |
| ЛЕЧЕНИЕ САХАРНОГО ДИАБЕТА С ПОМОЩЬЮ СОСТАВОВ ИНСУЛИНОВ ДЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2014 |
|
RU2834367C2 |

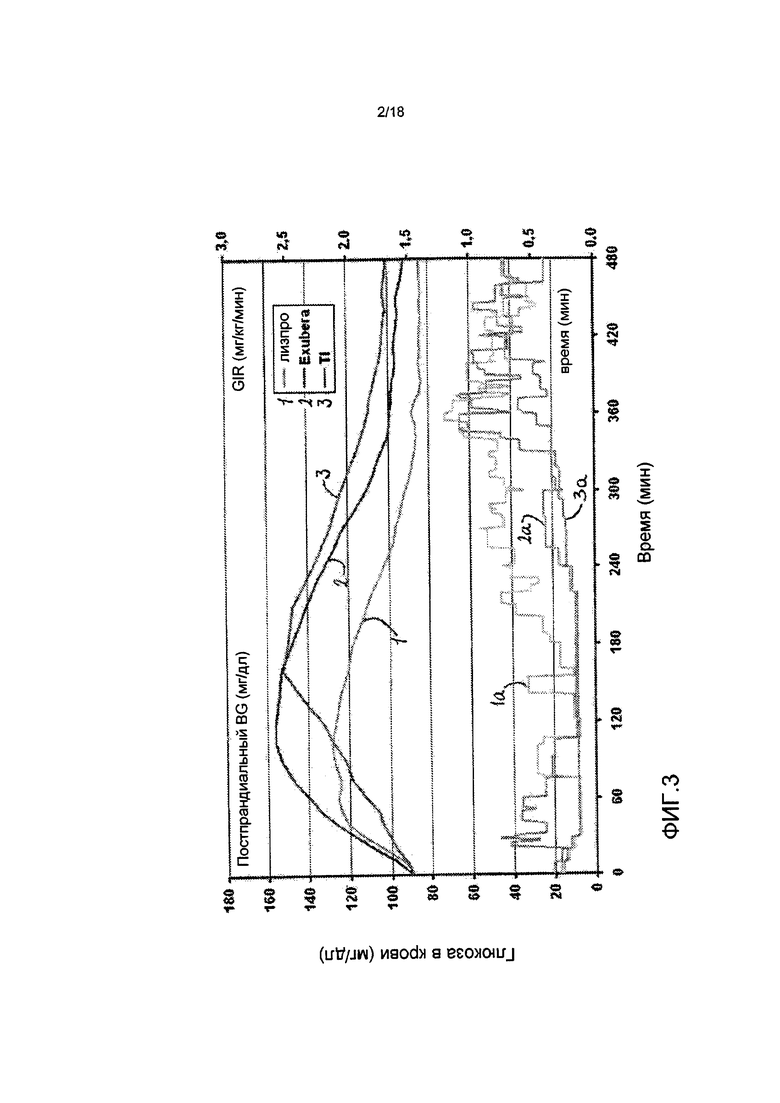
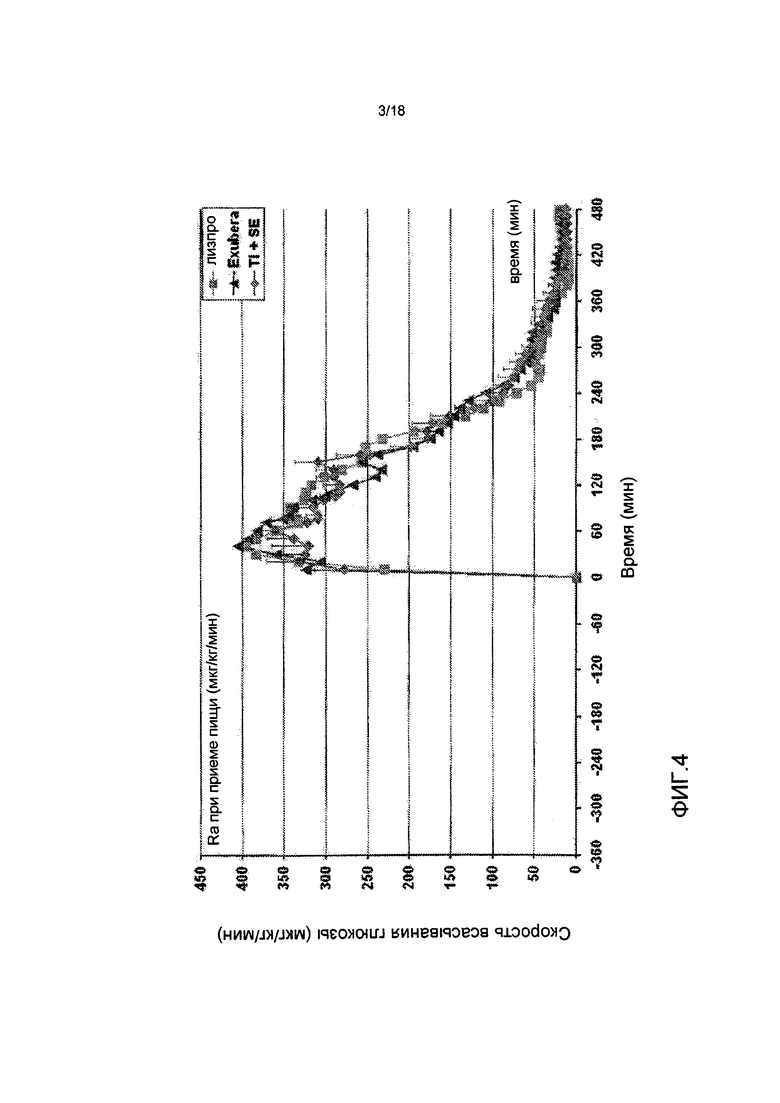

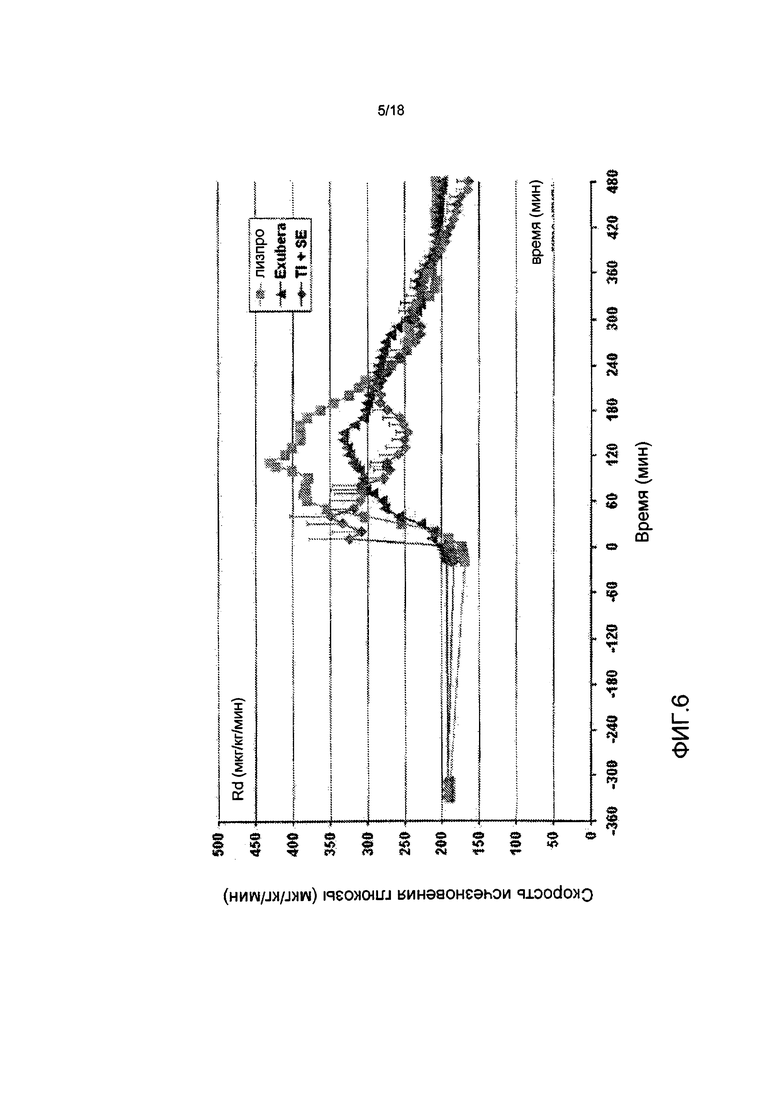
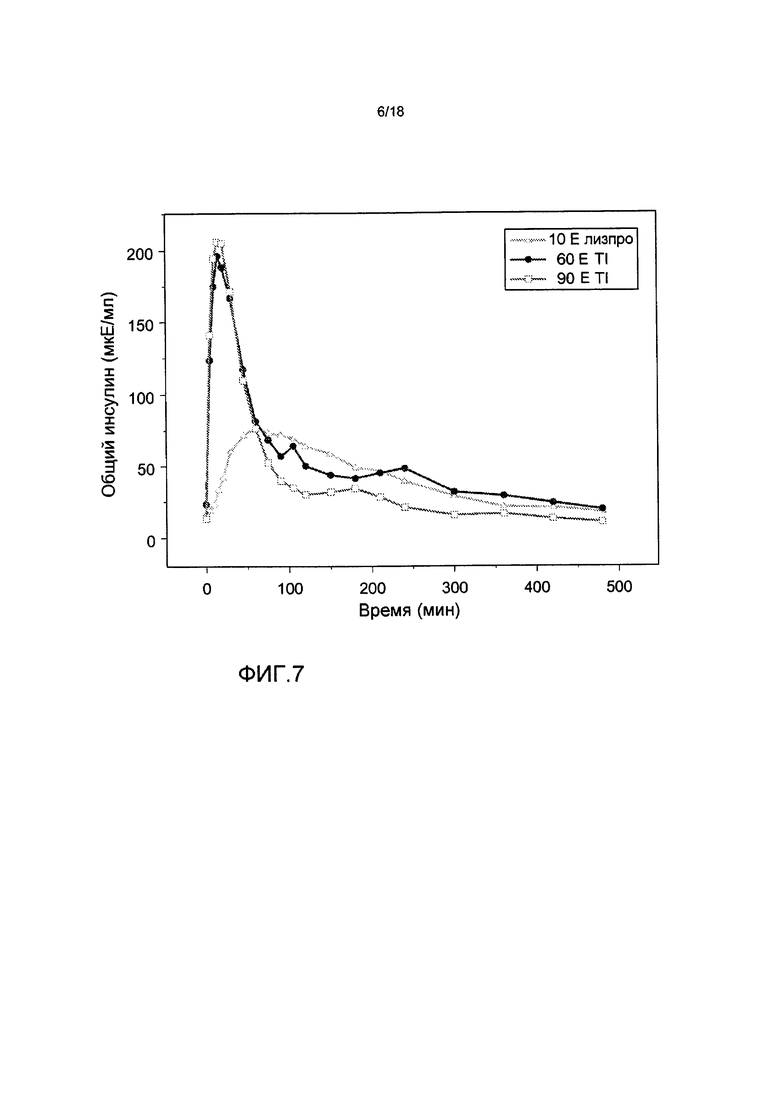
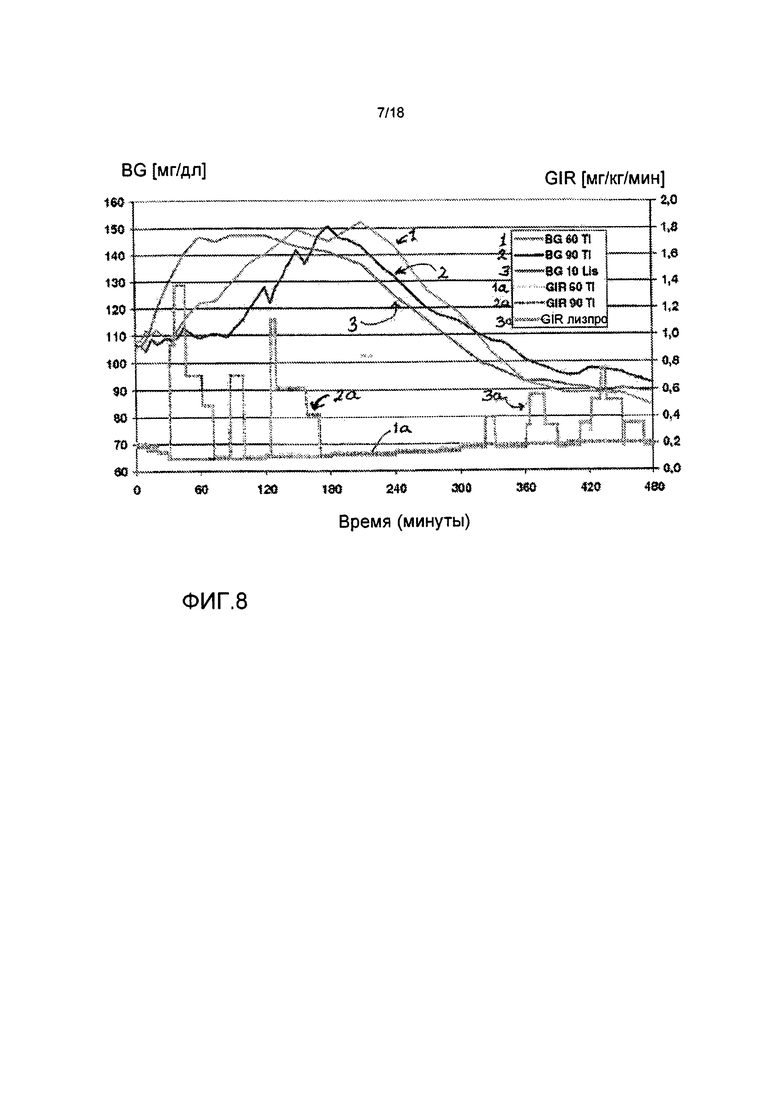



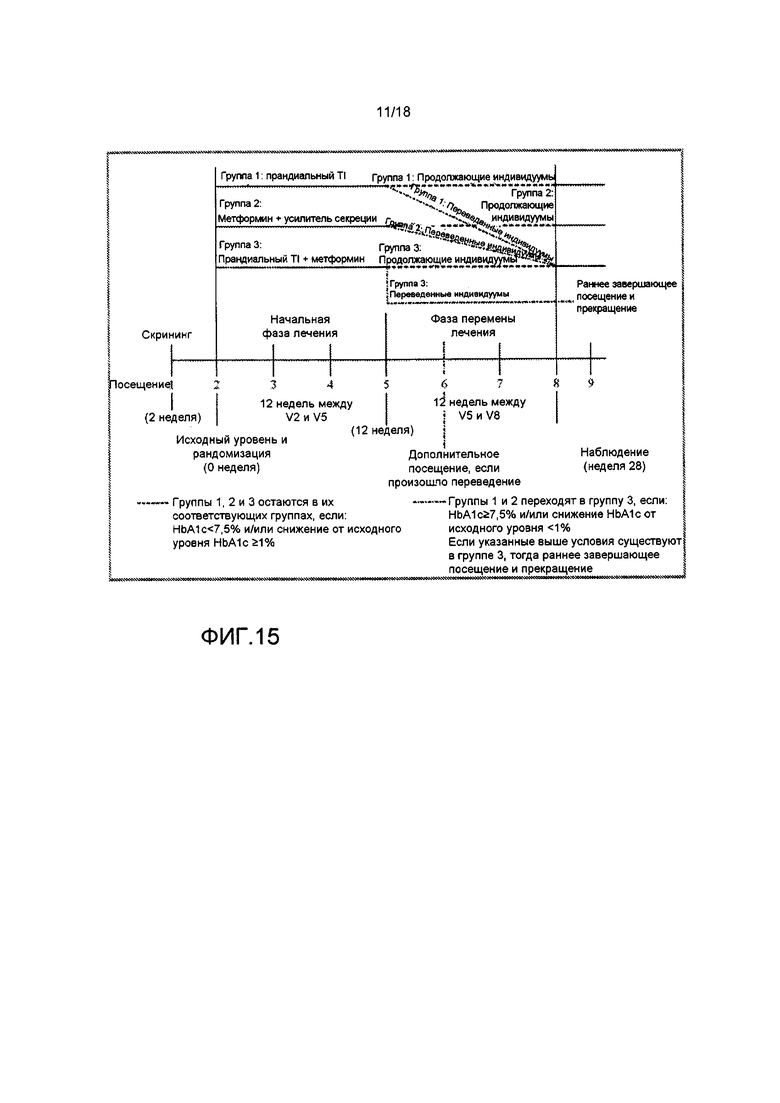

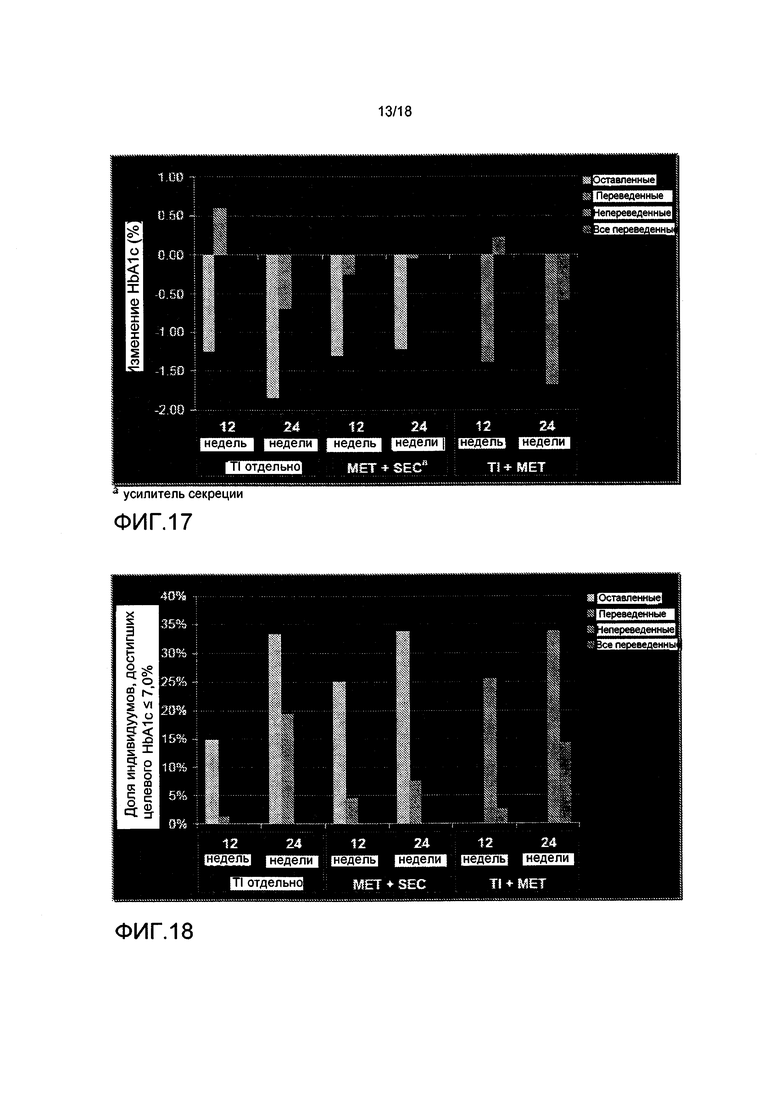
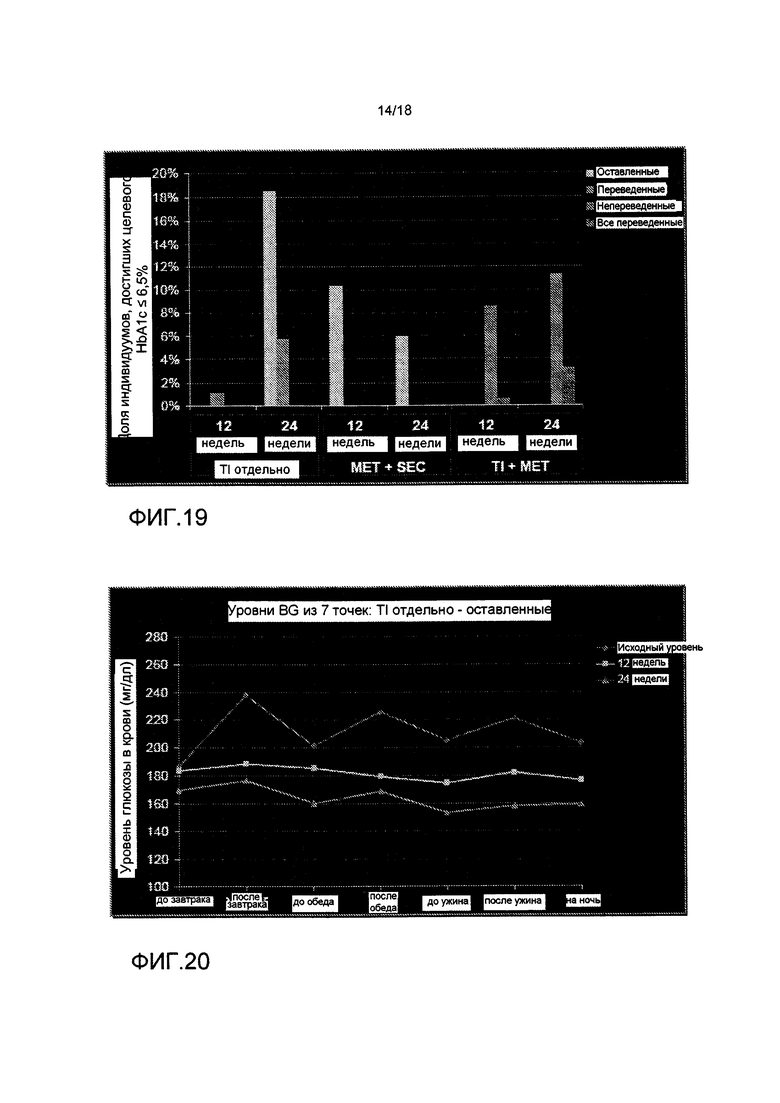
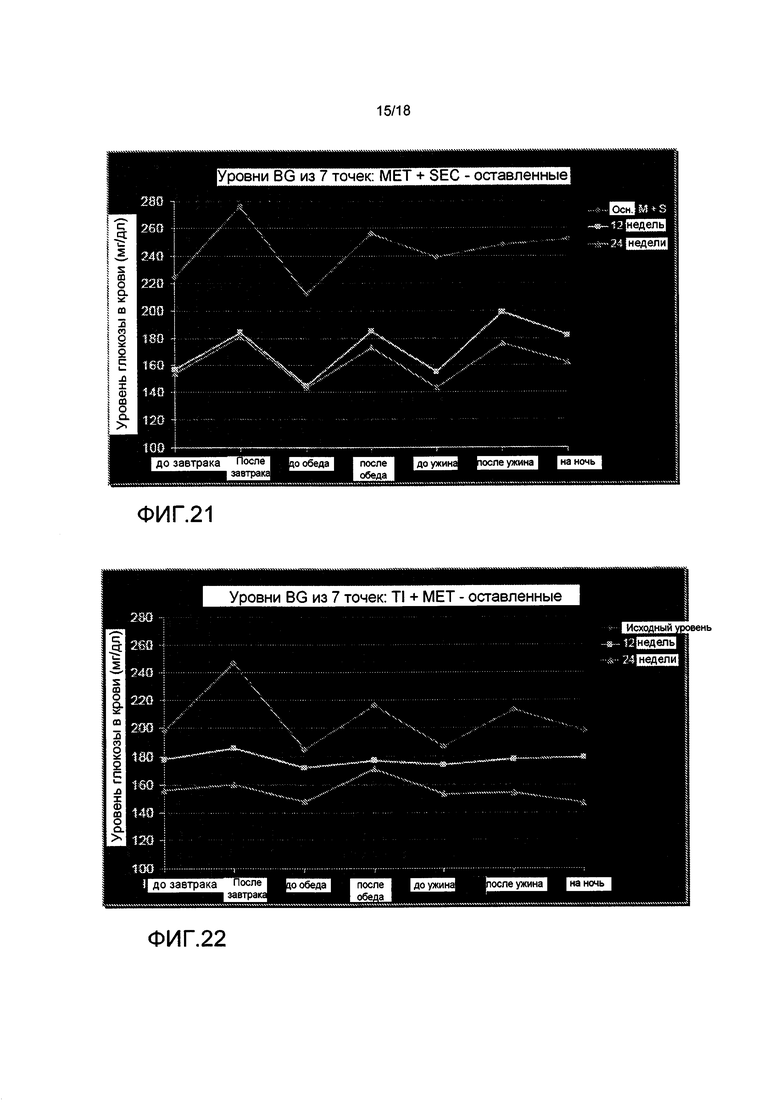
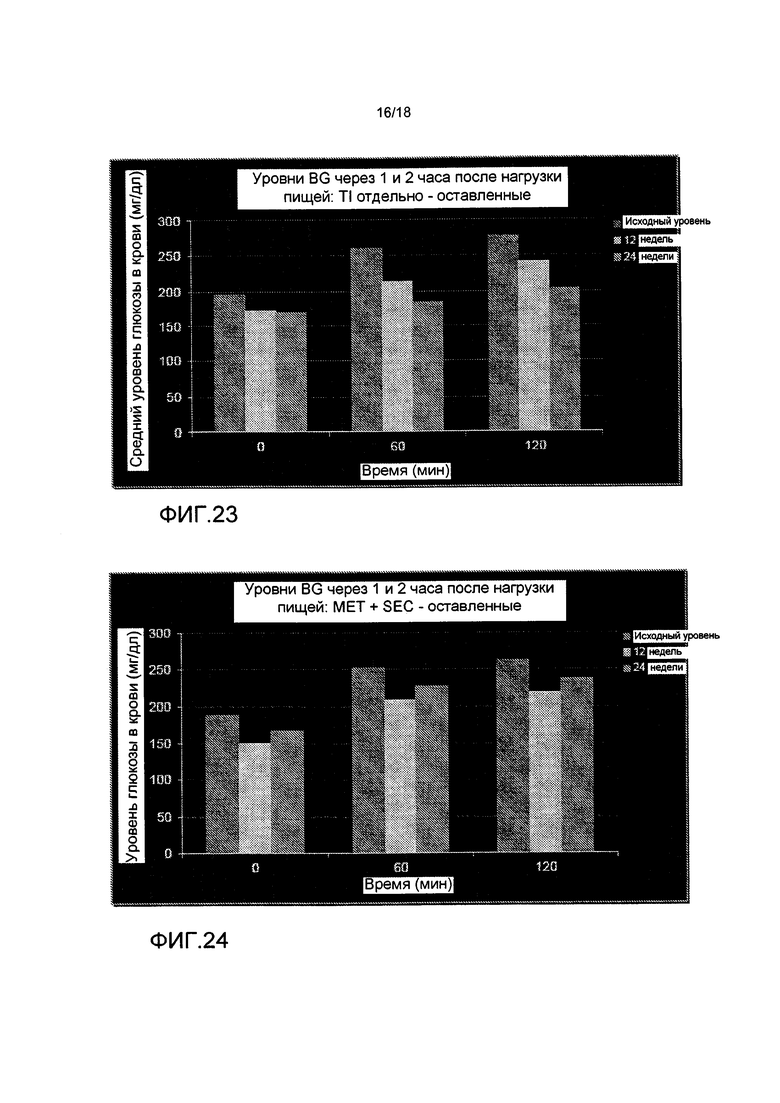
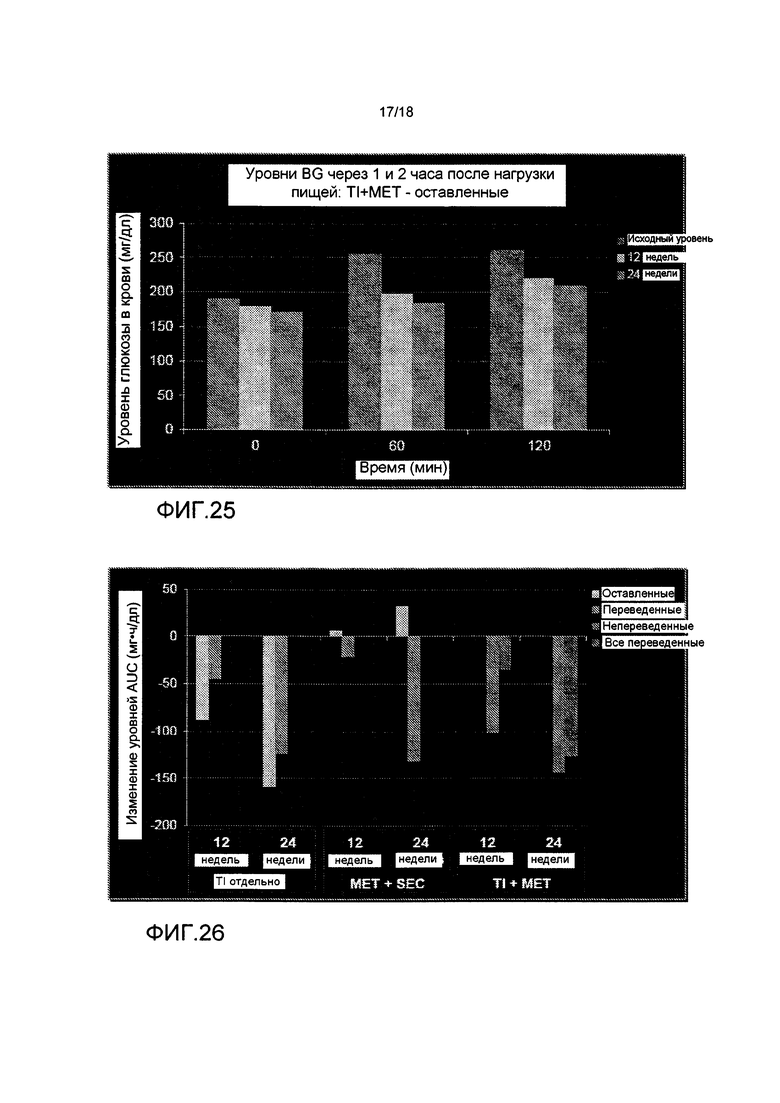
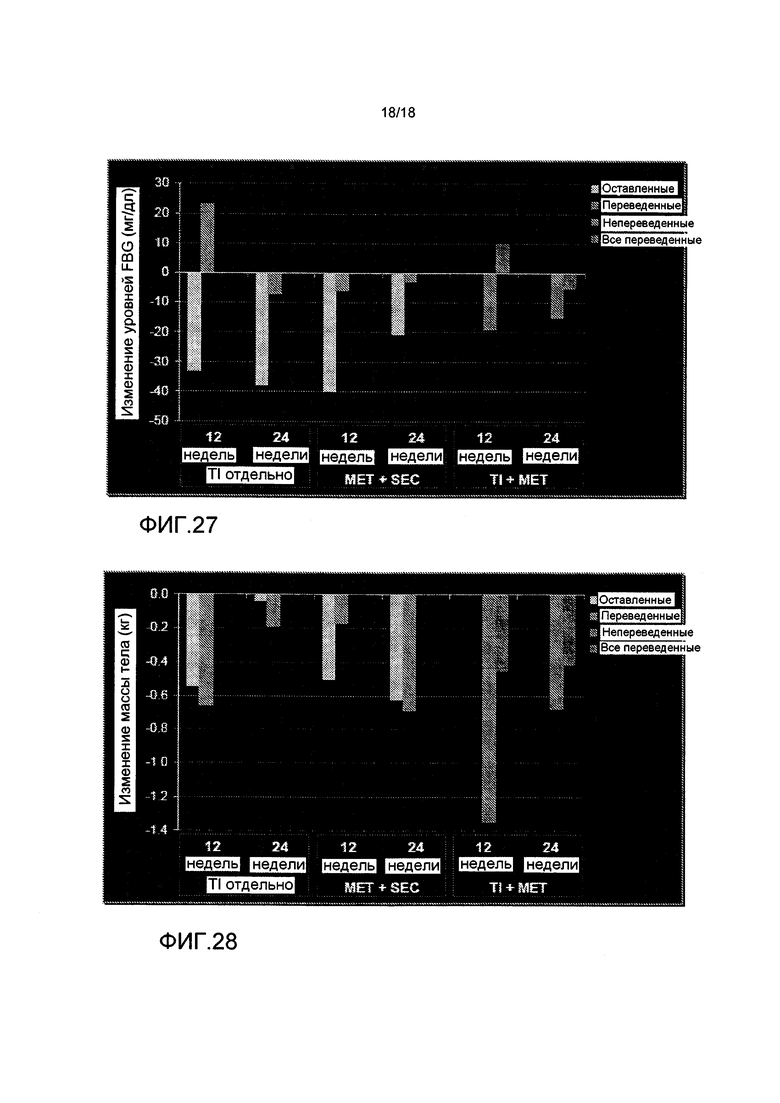
Настоящая группа изобретений относится к медицине, а именно к эндокринологии, и касается лечения сахарного диабета сверхбыстродействующим инсулином. Для этого введение препарата сверхбыстродействующего инсулина в стандартной дозе осуществляют во время приема пищи, затем определяют постпрандиальный уровень глюкозы и в том случае, если постпрандиальный уровень составляет > 140 мг/дл, вводят дополнительную дозу сверхбыстродействующего инсулина, составляющую от 25% до 100% от начальной дозы. Такая схема дозирования позволяет обеспечить оптимальный контроль уровня гликемии. 4 н. и 20 з.п. ф-лы, 28 ил., 4 пр.
1. Способ контроля гликемии, связанной с каждодневным приемом пищи, путем введения общей дозы инсулина, которую корректируют по гликемической нагрузке употребленной пищи, включающий стадии:
введения начальной предварительно определенной дозы сверхбыстродействующего состава инсулина во время приема пищи при каждодневном приеме пищи, где начальная предварительно определенная доза представляет собой стандартную дозу для каждодневного приема пищи;
определения постпрандиального уровня глюкозы в крови через период времени от 1 до 2 часов после начала каждодневного приема пищи; и,
если постпрандиальный уровень глюкозы в крови составляет >140 мг/дл, введение дополнительной дозы сверхбыстродействующего состава инсулина, где дополнительная доза составляет от 25% до 100% от начальной дозы.
2. Способ контроля гликемии, связанной с каждодневным приемом пищи, путем введения общей дозы инсулина, которую корректируют по гликемической нагрузке употребленной пищи так, чтобы постпрандиальный уровень глюкозы в крови через период времени от 1 до 2 часов после начала каждодневного приема пищи составлял ≤200 мг/дл, включающий стадии:
введения начальной предварительно определенной дозы сверхбыстродействующего состава инсулина во время приема пищи при каждодневном приеме пищи, где начальная предварительно определенная доза представляет собой стандартную дозу для каждодневного приема пищи;
определения постпрандиального уровня глюкозы в крови через период времени от 1 до 2 часов после начала каждодневного приема пищи; и
введения дополнительной дозы сверхбыстродействующего состава инсулина, где дополнительная доза составляет от 25% до 100% от начальной дозы.
3. Способ по п.2, где постпрандиальный уровень глюкозы в крови составляет ≤140 мг/дл.
4. Способ контроля гликемии, связанной с одним или более каждодневным приемом пищи, у пациента, страдающего диабетом, включающий:
введение от 50% до 75% или 100% начальной предварительно определенной дозы сверхбыстродействующего состава инсулина во время приема пищи при каждодневном приеме пищи, где начальная предварительно определенная доза представляет собой стандартную дозу для каждодневного приема пищи, предварительно определенную на основании обычного содержимого пищи пациента при каждодневном приеме пищи;
введение оставшейся части предварительно определенной дозы через период времени от 30 до 120 минут после начала каждодневного приема пищи, при условии, что
а) у пациента замедленное всасывание питательных веществ;
b) у пациента пролонгированное всасывание питательных веществ, и
дополнительно включающий введение дополнительной дозы сверхбыстродействующего состава инсулина через период времени от 30 до 120 минут после начала каждодневного приема пищи, при условии, что
а) калорийность пищи пациента для этого приема пищи выше, чем калорийность обычной пищи пациента при каждодневном приеме пищи, или
b) постпрандиальный уровень глюкозы в крови через период времени от 1 до 2 часов после начала этого приема пищи составляет >140 мг/дл.
5. Способ по п.4, где у пациента замедленное всасывание питательных веществ.
6. Способ по п.4, где у пациента пролонгированное всасывание питательных веществ.
7. Способ по п.4, где калорийность пищи пациента для этого приема пищи выше, чем калорийность обычной пищи пациента при каждодневном приеме пищи.
8. Способ по п.4, где дополнительная доза составляет от 25% до 100% начальной предварительно определенной дозы сверхбыстродействующего состава инсулина для приема пищи.
9. Способ по любому из пп.4-7, где дополнительная доза вводится через период времени от 60 до 120 минут после начала каждодневного приема пищи.
10. Способ по п.5 или 6, где замедленное или пролонгированное всасывание питательных веществ связано с болезненным состоянием.
11. Способ по п.5 или 6, где замедленное или пролонгированное всасывание питательных веществ связано с высоким содержанием жира или волокон в пищи.
12. Способ по п.5 или 6, где замедленное или пролонгированное всасывание питательных веществ связано с более длительным приемом пищи.
13. Способ контроля гликемии, связанной с одним или более каждодневным приемом пищи, у пациента, страдающего диабетом, без коррекции дозы инсулина по содержимому пищи, включающий стадию введения стандартной дозы сверхбыстродействующего состава инсулина во время одного и более приемов пищи при каждодневном приеме пищи, где для каждого данного каждодневного приема пищи стандартная доза для каждодневного приема пищи предварительно определяется на основании обычного содержимого пищи пациента при каждодневном приеме пищи, и где по крайней мере случайно содержимое пищи варьируется от ≥25% до ≤250% обычного содержимого пищи, и стандартная доза не корректируется, когда содержимое пищи варьируется от ≥25% до ≤250% обычного содержимого пищи, которое использовалось для определения стандартной дозы.
14. Способ по п.13, где стандартная доза вводится при каждом приеме пищи.
15. Способ по п.13, где при каждом приеме пищи используется одна предварительно определенная доза.
16. Способ по п.13, где предварительно определенная доза устанавливается при каждом приеме пищи.
17. Способ по п.13, где содержимое пищи оценивают по гликемической нагрузке.
18. Способ по п.13, где содержимое пищи оценивают по калорийности.
19. Способ по п.13, где содержимое пищи составляет от ≥25% до ≤250% от обычного содержимого пищи, которое использовалось для определения стандартной дозы.
20. Способ по п.19, где содержимое пищи составляет от ≥50% до ≤250% от обычного содержимого пищи, которое использовалось для определения стандартной дозы.
21. Способ по п.13, где содержимое пищи составляет от ≥25% до ≤200% от обычного содержимого пищи, которое использовалось для определения стандартной дозы.
22. Способ по п.21, где содержимое пищи составляет т ≥25% до ≤150% от обычного содержимого пищи, которое использовалось для определения стандартной дозы.
23. Способ по пп.1, 2, 5 и 14, где сверхбыстродействующий состав инсулина представляет собой инсулин-дикетопиперазин.
24. Способ по пп.1, 2, 5 и 14, где сверхбыстродействующий состав инсулина представляет собой инсулин-фумарилдикетопиперазин.
| ИНДОЛЫ, ОБЛАДАЮЩИЕ ПРОТИВОДИАБЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2003 |
|
RU2328483C2 |
| TACK C.J | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| J Diabetes Sci Technol | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| PFUTZNER A | |||
| et al | |||
| "Technosphere/Insulin--a new approach for effective delivery of human insulin via the pulmonary route" | |||
| Diabetes Technol Ther | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| RAVE L | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| J Diabetes Sci Technol | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2019-05-22—Публикация
2014-04-03—Подача