Область техники
Изобретение относится к медицине, в частности к проблеме лечения туберкулеза. Как известно, лечение туберкулеза требует очень длительных курсов специфической химиотерапии с использованием различных комбинаций противотуберкулезных препаратов, в основном, антибиотиков.
Уровень техники
Длительность курсов приема антибиотиков приводит возникновению лекарственной устойчивости возбудителя - микобактерий туберкулеза (МБТ). При этом, использование при лечении больных туберкулезом новых, вновь созданных противотуберкулезных препаратов также достаточно быстро приводит к появлению лекарственно-устойчивых штаммов МБТ. Кроме того, при туберкулезной инфекции значительная часть микобактерий находится - персистирует и размножается внутриклеточно - в тканевых макрофагах.
Известно, что применение бактериофагов для лечения различных микробных инфекции, в общем, рассматривается мировой научной общественностью в качестве альтернативы эры применения антибиотиков в связи с распространением лекарственной устойчивости к этим препаратам. Однако, практически, несмотря на имеющиеся публикации об успешном применении бактериофагов для лечения некоторых воспалительных заболеваний микробной природы, их применение в настоящее время ограничено (A. Nilsson. Phage therapy. Constraints and possibilities. Upsala J. of Med. Sciences, 2014, 119, 192-198).
Известны также, экспериментальные работы от 70-х годов и до 1991 г., в которых были предприняты попытки лечения туберкулезной инфекции с помощью различных штаммов микобактериофагов. Однако, полученные результаты были ограниченными по эффективности и уступали применению традиционных противотуберкулезных лекарственных веществ (Козьмин-Соколов Б.Н. и др. Влияние микобактериофагов на течение экспериментальной туберкулезной инфекции у белых мышей. Проблемы туберкулеза 1975, №4, с. 75-79; Земскова З.С., Дорожкова И.Р. Патоморфологическая оценка лечебного действия микобактериофагов при туберкулезе. Проблемы туберкулеза 1991, №11, с. 63-66).
В 2000-е годы интерес к применению микобактериофагов, в частности, к перспективе применения литического микобактериофага D 29 для лечения туберкулезной инфекции, вновь вырос и обсуждается в некоторых международных публикациях последнего времени (Gr. Hatfull. Mycobacteriophages: Windows into Tuberculosis. Plos patogens. 2014, v. 10, issue 3). Обсуждаются вопросы доступности, транспорта микобактериофагов к зонам туберкулезного воспаления и к внутриклеточно расположенным микобактериям, а также к вероятной возможности элиминации микобактериофагов микро и макрофагами периферической крови.
Известны способы лекарственного транспорта с помощью различных микронных, субмикронных и наноносителей. Чаще всего используются полимеры молочной и гликолевой кислоты, альгинаты, а также частицы хитозана. (Y. Wang et al. Review. Manufacturing Techniques and Surface Engineering of Polymer Based Nanoparticles for Targeted Drug Delivery to Cancer. Nanomaterials 2016, 6, 26 p. 1-18).
Липосомы также являются одним из наиболее известных методов лекарственного транспорта, а также в качестве перспективных антигенных носителей для получения вакцин, поскольку их фосфолипидная мембрана хорошо совместима с клетками эукариотов и может быть различным образом модифицирована, получением иммунолипосом и др. В этих целях их размер обычно не превышает 150-200 нм (R. Nisini et al. The Multirole of liposomes in therapy and prevention of infection diseases. Review. Frontiers in Immunology, 2018, v. 9 art. 155, p. 1-23.). Экспериментальные исследования применения липосомальных антибиотиков для лечения туберкулезной инфекции проводились с начала 80-х годов прошлого века, первой из которых была публикация одного авторов настоящей заявки (Vladimirsky М.А. and Ladigina G.A. Antibacterial activity of liposomal-entrapped streptomycin mice infected with Mycobacterium tuberculosis. Biomedicine and Pharmacotherapy, 1982, v. 36, N. 8-9, p. 375-377). Размеры этих липосом не превышали 100 нм. Эти работы в дальнейшем были подтверждены развивались, но препятствием к практическому применению липосомальных антибиотиков для лечения туберкулеза стало накопление препарата в печени, что позже несколько нивелировалось при использовании stealth липосом с полиэтиленгликолем. Липосомы, содержащие микобактериофаг, в качестве саморазмножающегося лекарства теоретически могли бы эффективно доставляться в мелкие бронхи дренирующие очаги специфического туберкулезного воспаления. Однако, идея использования липосом в качестве транспортного средства для применения микобактериофагов до сих пор сдерживалась размерами частиц микобактериофага, поскольку литический микобактериофаг имеет размер головки фага - 65 нм и размер фагового хвоста - 110 нм. Следовательно, липосомы, включающие частицы размером около 200 нм должны быть слишком большими для того чтобы быть фагоцитированными клетками эукариотов. Поэтому задача получения и применения липосом с включенными частицами микобактериофага не была тривиальной и до сих пор использование таких экспериментальных препаратов с целью их литического действия на микобактерий туберкулеза, в том числе, на внутриклеточную популяцию микобактерий не было описано.
Наиболее близким к заявляемому является препарат микобактериофага, получаемый способом по патенту Ю.Н. Курунова и сотр. 2001 г. «Способ фаготерапии туберкулеза» №2214829, 2001 г., который заключается в очищении микобактериофага от бактериального лизата при высокоскоростном (70-100 тыс g) центрифугировании в градиенте цезия, затем полученный препарат встряхивали вместе с фосфолипидной пленкой, получая таким образом многослойные липосомы и вводили их ректально мышам, инфицированным микобактериями туберкулеза.
Использованная в способе технология выделения микобактериофагов в градиенте цезия дает относительно низкий выход (Boulanger P. Purification of bacteriophages and SDS-PAGE analysis of phage structural proteins from ghost particles. In: Clokie MR, Kropinksi AM, editors. Bacteriophages: Methods and Protocols. Humana Press; New York: 2009. pp. 227-238), а также повреждает жизнеспособность фаговых частиц (Carlson K. Appendix: Working with bacteriophages: common techniques and methodological approaches. In: Kutter EM, Sulakvelidze A, editors. Bacteriophages: biology and application. CRC Press; Boca Raton, FL: 2005). Кроме того, приведенный авторами патента способ получения препарата микобактериофагов, позволяет получать только очень крупные многослойные липосомы размером 5-10 микрон («Липосомы в биологических системах», под ред Г. Грегориадиса пер. с англ., Москва 1983 г.). Также известный препарат не стерилизуется, поскольку его используют только для ректального введения. Препарат невозможно стерилизовать без повреждения жизнеспособности фаговых частиц, например, путем лиофилизации с последующим гамма облучением, что также приведет к повреждению ДНК микобактериофага. Кроме того, липосомы размером 5-10 микрон не могут фагоцитироваться клетками макроорганизма - макрофагами, что не позволит в полном объеме реализовать противотуберкулезный эффект препарата.
Раскрытие изобретения
Задачей заявляемого изобретения является создание препарата на основе литического штамма микобактериофага, инактивирующего внутриклеточные микобактерий туберкулеза.
Поставленная задача решается препаратом для инактивации (лизиса) внутриклеточных микобактерий туберкулеза, представляющий собой микобактериофаг D29 (АТСС - Американская коллекция клеточных культур), включенный в бислойную фосфолипидную липосому размером 0,4 микрон.
Также поставленная задача решается способом получения указанного препарата, заключающимся в выделении и очистке фаговых частиц из бактериальных лизатов M. smegmatis с помощью ионно-обменной хроматографии на колонке Q-sepharose. Полученный очищенный микобактериофаг в концентрации не менее 108 pfu/мл встряхивают с фосфолипидной пленкой в течение 5-10 минут, экструзией полученных частиц через фильтр с порами 5 микрон и последующей 20-кратной экструзией с использованием фильтров размером пор 0,4 мк, концентрированием и отделением включенной в липосомы фракции микобактериофага с помощью центрифугирования при 13±2 тыс об/мин в течение 30±5 минут. Предпочтительно использовать фосфолипидную пленку, полученную из фосфатидилхолина, холестерина и твин-80 взятых в массовом соотношении 5±1:1±0,8:1,2±0,2.
Преимуществом заявляемого технического решения является:
1. Для выделения микобактериофагов, в частности, микобактериофага D29 из бактериального лизата M. smegmatis, в суспензии которых производится размножение микобактериофага, используется альтернативная технология выделения и очистки микобактериофага: Evelien М. Adriaenssens, Susan М. Lehman et. al. CIM® Monolithic Anion-Exchange Chromatography as a Useful Alternative to CsCl Gradient Purification of Bacteriophage Particles. Virology 2012, 434(2), p. 265-270., K. Liu et al. Purification an concentration of mycobacteriophage D29 using monolithic chromatographic columns. J. of Virological Methods, 2012, v. 186, p. 7-13, которая позволяет сохранить жизнеспособность частиц бактериофага.
2. Заявляемым способом были получены липосомальные частицы с включенными микобактериофагами оптимального размера - в основном с размером частиц около 400 нм, что обеспечивает возможность их фагоцитоза макрофагами, что, в свою очередь, позволяет в полном объеме реализовать противотуберкулезный эффект препарата.
3. Получение стерильного препарата, подтверждаемого размером фильтруемых частиц и сохранением стерильности в отношении банальной микрофлоры в течение 3-4-недельного периода культивирования инфицированных микобактериями макрофагов на агаровой питательной среде 7Н10, при котором определяли рост МБТ при отсутствии банальной микрофлоры.
4. Заявляемым способом достигается высокая - 80% эффективность включения частиц микобактериофага в липосомы, тогда как в ранее описанном способе не производилось отделение фракции липосом с включенным микобактериофагом и не изучалась эффективность его включения.
5. Полученный таким способом, заявляемый препарат на основе микобактериофага обеспечивает проникновение частиц микобактериофага в клетки перевиваемой культуры макрофагов не менее, чем в 4 раза более эффективно и обеспечивает е инактивацию микобактерий туберкулеза, инфицирующих макрофаги также не менее чем в 4-5 раз более эффективно.
Краткое описание чертежей
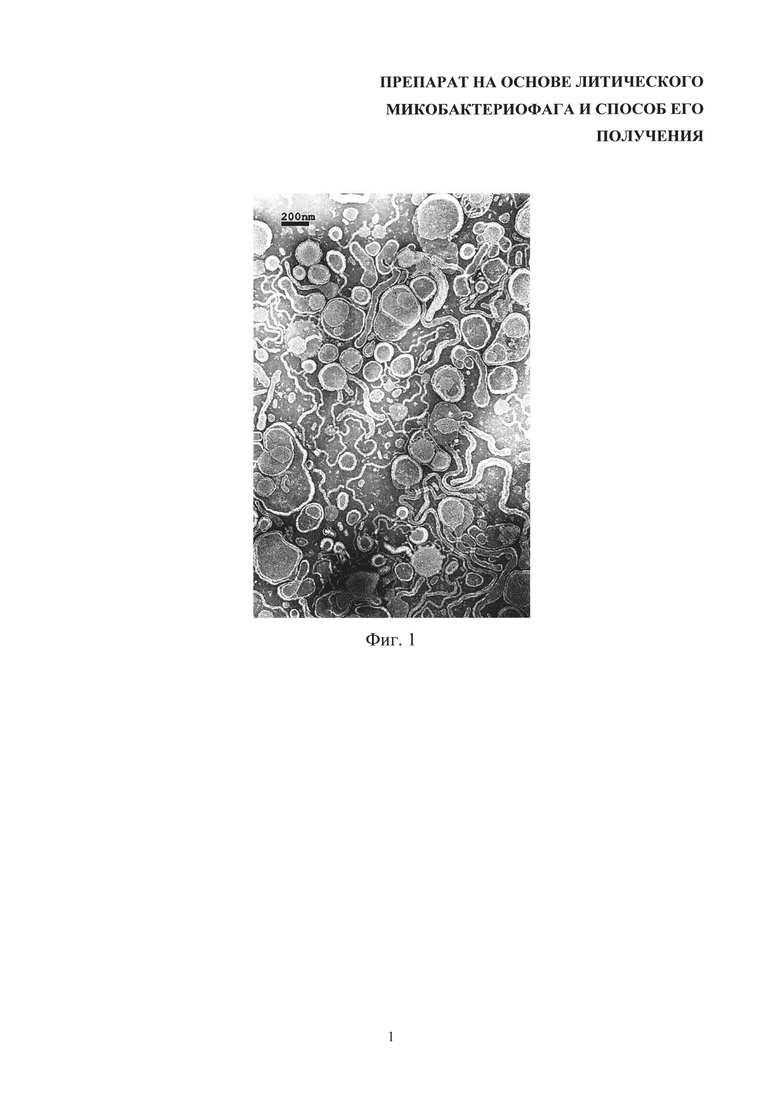
Изобретение поясняется следующими чертежами, где на фиг. 1 представлено негативное контрастирование бислойных липосом без фага.
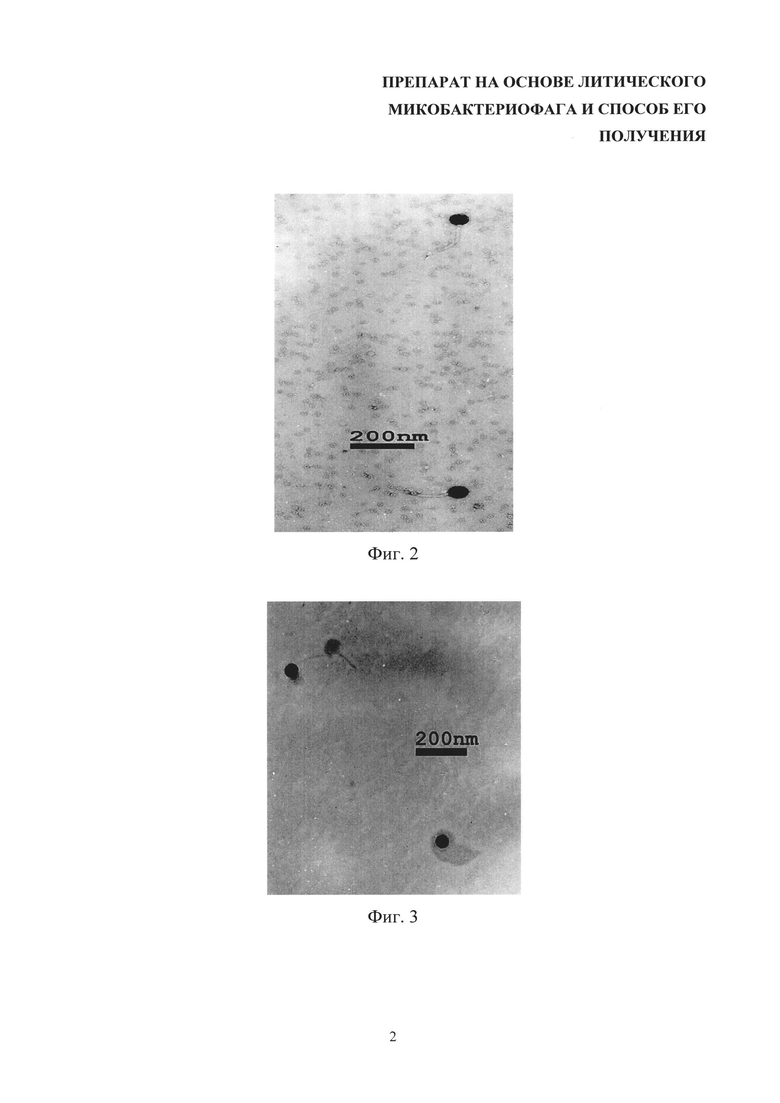
На фиг. 2 показано позитивное контрастирование контрольного образца микобактериофага уранилцетатом. Видны ДНК головка фага и хвост.
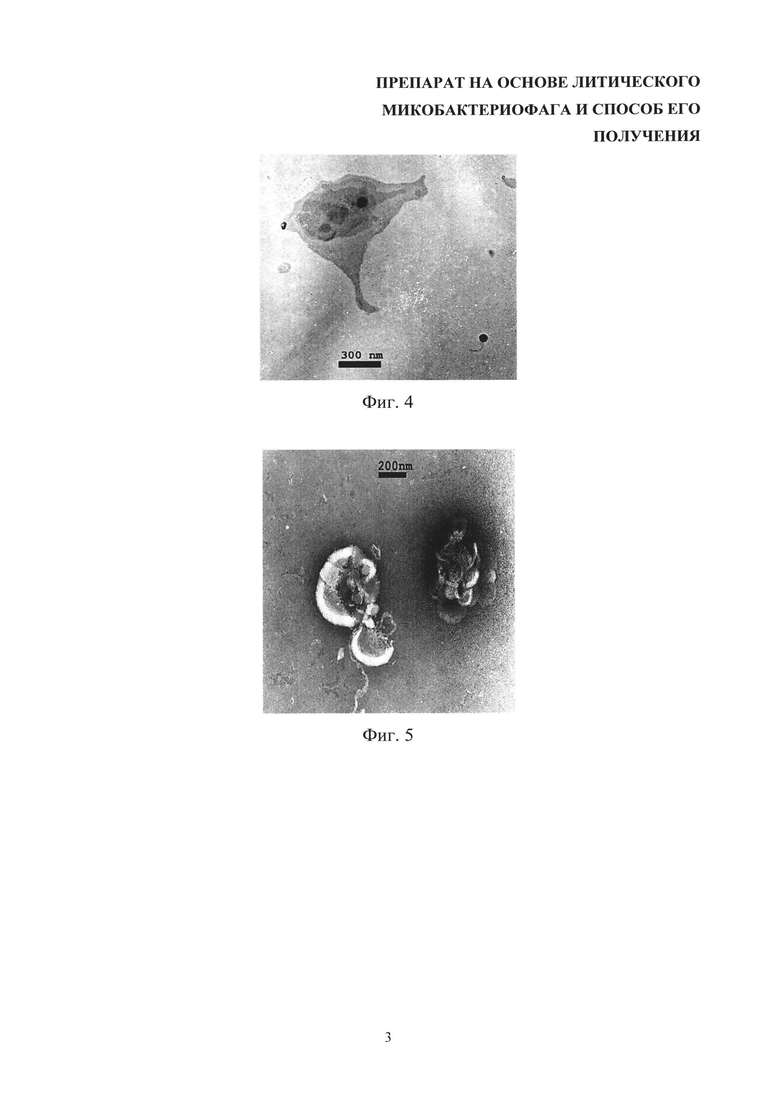
На фиг. 3 показано позитивное контрастирование. Справа внизу - головка фага, включенного в липосому.
На фиг. 4 показано позитивное контрастирование. Головка фага, включенного в липосому.
На фиг. 5 показано негативное контрастирование разрушенной липосомы. При затекании контрастирующего вещества видны головки фагов.
Осуществление изобретения
Для получения липосом очищенный при ионно-обменной хроматографии на колонке Q-sepharose препарат микобактериофагов D29 (набор реагентов Fast Plaque ТВ, Biotec laboratories Ltd. Ipswich United Kingdom) в концентрации фаговых частиц не менее 108 плакобразующих единиц (pfu)/мл и диализованный против фагового буферного раствора, встряхивают в течение 5-10 минут с фосфолипидной пленкой. Полученные многослойные липосомы подвергают последовательной экструзии через фильтры с размером пор 5 микрон, а затем 20 кратной экструзии (продавливание) через фильтры с размером пор 0,4 микрон, после чего для концентрирования и отделения липосом с включившимися микобактериофагами от не включившихся частиц микобактериофага, а также для освобождения препарата от мелких липосомных частиц, препарат центрифугируют при 13±2 тыс. об/мин. в течение 30±5 мин. Далее концентрацию микобактериофага, включенного в липосомы измеряют с помощью количественной ПЦР в реальном времени и определяют процент включения частиц фага в липосомы, который составляет не менее 80%.
В качестве фосфолипидных пленок могут быть использованы пленки, образованные фосфотидилхолином, для укрепления мембраны получаемых липосом в состав пленки добавляют холестерин, взятый в массовом соотношении 1±0,8 к 5±1 фосфатидилхолина. Также для стабильности препарата в пленки дополнительно добавляют неионогенное поверхностно активное вещество - твин-80 в количестве 1,2±0,2 мг на 5±1 мг фосфатидилхолина.
Размер и морфология получаемых бислойных липосом продемонстрированы с помощью электронной микроскопии при негативном и позитивном контрастировании уранилацетатом (фиг. 1-5).
Достижение литического действия микобактериофагов на внутриклеточно МБТ, расположенные демонстрируется при использовании, в качестве примера, модели макрофагов мышей, в качестве которых были использованы клетки перевиваемой линии RAW 264.7 (АТСС - американская коллекция клеточных культур), инфицированных МБТ (музейный штамм H37Rv, получен из Государственного института стандартизации и контроля биопрепаратов (ГИСК) им. Л.А. Тарасевича). Для аналогичных исследований могут быть также использованы перевиваемая линия макрофагов человека ТНР (АТСС), а также возможно менее изученная модель микрогранулемы in vitro, состоящая из лимфоцитов и макрофагов крови человека, инфицированных микобактериями туберкулеза. Литическое действие микобактериофага D29, включенного в липосомы в отношении внутриклеточных микобактерий туберкулеза (МБТ), а также эффективность проникновения липосомного микобактериофага в клетки макрофагов сравнивается с микобактериофагом не включенным в липосомы при аналогичной фаговой активности. Литическое (антибактериальное) действие МБТ измеряется при посевах инфицированных макрофагов, после их двукратного замораживания и оттаивания на агаровую питательную среду 7Н10 Миддлбрук.
Способ получения препарата для литического действия в отношении внутриклеточной популяции микобактерий туберкулеза (МБТ) на основе микобактериофага D29 реализуется путем его размножения в культуре нетуберкулезных микобактерий M. smegmatis (АТСС 101), выделения и очистки с помощью ионно-обменной хроматографии, получением многослойных липосом при 5-10 минутном встряхивании препарата микобактериофага специфической активностью не менее 108 плакобразующих фаговых частиц (pfu) в мл фагового буферного раствора, Ph-7,5 с фосфолипидной пленкой, получаемой после выпаривания на роторном испарителе растворенного в 96° этанола фосфатидилхолина, холестерина и твин-80 в соотношении 5±1:1±0,8:1,2±0,2 с экструзией через фильтр с порами 5 микрон и последующей 20-кратной экструзией с использованием фильтров с размером пор 0,4 мк, концентрированием и отделением включенной в липосомы фракции микобактериофага от не включенных фаговых частиц, а также отделением более мелких липосомных частиц с помощью центрифугирования при 13 тыс об/ мин в течение 30 минут, исследованием количественного (процентного) содержания включенных в липосомы частиц микобактериофага путем определения ДНК микобактериофага с помощью количественной ПЦР в реальном времени, составляющего не менее 80% от внесенного микобактериофага, контролем полученного препарата с помощью электронной микроскопии и анализом биологической активности в культуре макрофагов перевиваемой линии, инфицированных МБТ. Пример осуществления изобретения.
1. Модель внутриклеточной инфекции микобактерий туберкулеза: макрофаги перевиваемой линии RAW 264.7 (АТСС), инфицировали МБТ музейного штамма H37Rv при инкубации в течение 24 часов; суспензия инфицированных макрофагов выделяли с освобождением от не включившихся микобактерий с помощью центрифугирования при 2 тыс обор/мин в градиенте плотности раствора Ficoll-Paque (GE Healthcare) на разделе сред и отмывали в питательной среде RPMI 1640 с последующим культивированием в лунках 6-луночного культурального планшета с использованием среды RPMI 1640 с 20% фетальной бычьей сыворотки, L-глютамина, MEM Vitamins, MEM NEAA, Sodium Pyruvate PenStrep (0,1) mcg/ml); затем после суточной инкубации в лунках планшета вносили микобактериофаг D29 известной активности - 108 плакобразующих частиц (pfu) в мл в липосомальной форме и не включенного в липосомы в равных количествах, определяемых по числу pfu и концентрации ДНК фага.
2. Приготовление липосомального микобактерифага: 40 мг яичного фосфатидилхолина (фирма Lipoid, Германия), 8 мг холестерина (Sigma) и 8,8 мг твин 80 растворяли в 3 мл 96% этанола; высушивали на роторном испарителе до получения липидной пленки; вносили 3 мл хроматографически очищенного на ионнообменной колонке Q сефарозы препарата микобактериофага с активностью не менее 108 pfu/мл; встряхивали до образования суспензии, продавливали через стерильный фильтр 5,0 с размером пор 5 мк, а затем не менее 20 раз через стерильный фильтр с размером пор 0,4 мк; центрифугировали для освобождения от не включенного в липосомы микобактериофага и измеряли относительное количество ДНК фага в осадке в сравнении с общим количеством ДНК внесенного в препарат фага. Контроль полученного липосомального препарата микобактериофага проводили также при использовании электронной микроскопии фиг. 1-5.
3. Исследование эффективности антимикобактериального действия липосомального микобактериофага: после 24 часовой инкубации культуры макрофагов с внутриклеточными МБТ с препаратами микобактериофагов (липосомальный и свободный микобактериофаг) клетки отмывали однократно питательной средой; снимали инфицированные макрофаги с поверхности лунок в объеме 200 мкл; проводили двукратное замораживание и оттаивание материалов, после чего по 100 мкл из каждого образца засевали на чашки с питательной средой 7Н10 для определения жизнеспособности МБТ, а также по 100 мкл аналогичных материалов исследовали для определения количества ДНК микобактериофага с помощью ПЦР в реальном времени.
Результаты исследования: 1. Количество ДНК фага, включенного в липосомы, определяемого в клетках инфицированных макрофагов по данным количественного ПЦР -анализа в 4-8 раз (в разных экспериментах) превышало количество ДНК свободного, не включенного в липосомы фага.
2. Количество колоний МБТ выявленных в результате культивирования: в контрольных чашках без фага - 300-500; в чашках с микобактериофагом не включенным в липосомы составляло - 15-27 колоний, тогда как в чашках с после воздействия липосомального фага число колоний - 3-4 на чашку. Различия статистически значимы.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ФАГОТЕРАПИИ ТУБЕРКУЛЕЗА | 2001 |
|
RU2214829C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМАЛЬНОЙ ФОРМЫ ИЗОНИАЗИДА | 2009 |
|
RU2429841C1 |
| АНТИБАКТЕРИАЛЬНОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И ПТИЦ, СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЦЫПЛЯТ ПРИ ЗАБОЛЕВАНИЯХ БАКТЕРИАЛЬНОЙ ЭТИОЛОГИИ, СПОСОБ ЛЕЧЕНИЯ РЕСПИРАТОРНОЙ БОЛЕЗНИ ТЕЛЯТ БАКТЕРИАЛЬНОЙ ЭТИОЛОГИИ, СПОСОБ ПРОФИЛАКТИКИ ТУБЕРКУЛЕЗА У КРУПНОГО РОГАТОГО СКОТА | 1999 |
|
RU2158587C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАПСУЛИРОВАННОЙ ФОРМЫ ПРОТИВОТУБЕРКУЛЕЗНЫХ ПРЕПАРАТОВ РИФАМИЦИНОВОГО РЯДА | 2009 |
|
RU2420287C1 |
| СПОСОБ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА У ЧЕЛОВЕКА | 2002 |
|
RU2238091C2 |
| СПОСОБ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА ЛЕГКИХ | 1995 |
|
RU2122855C1 |
| СРЕДСТВО С ЛИПОСОМАМИ, СОДЕРЖАЩИМИ ИЗОНИАЗИД | 2016 |
|
RU2622755C1 |
| АНТИБАКТЕРИАЛЬНОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ВНУТРИКЛЕТОЧНЫХ ИНФЕКЦИЙ | 2006 |
|
RU2308970C1 |
| УСОВЕРШЕНСТВОВАННЫЕ ЛИПОСОМЫ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2482837C2 |
| СПОСОБ КОМПЛЕКСНОЙ ДИАГНОСТИКИ АКТИВНОГО ГЕНИТАЛЬНОГО ТУБЕРКУЛЕЗА У ЖЕНЩИН | 2011 |
|
RU2473089C1 |
Изобретение относится к области биотехнологии. Изобретение касается препарата для инактивации (лизиса) внутриклеточных микобактерий туберкулеза на основе литического штамма микобактериофага, инактивирующего внутриклеточные микобактерий туберкулеза, представляющего собой микобактериофаг D29, включенный в бислойную фосфолипидную липосому размером 0,4 микрон, и способа его получения, заключающегося в выделении и очистке фаговых частиц из бактериальных лизатов M.smegmatis с последующим включением в фосфолипидные липосомы, где выделение и очистку фаговых частиц из бактериальных лизатов M.smegmatis проводят с помощью ионно-обменной хроматографии на колонке Q-sepharose, полученный очищенный микобактериофаг в концентрации не менее 108 pfu/мл встряхивают с фосфолипидной пленкой в течение 5-10 минут, проводят экструзию полученных частиц через фильтр с порами 5 микрон и последующей 20-кратной экструзией с использованием фильтров размером пор 0,4 мкм, концентрированием и отделением включенной в липосомы фракции микобактериофага с помощью центрифугирования при 13±2 тыс. об/мин в течение 30±5 минут, при этом используют фосфолипидную пленку, полученную из фосфатидилхолина, холестерина и твин-80, взятых в массовом соотношении 5±1:1±0,8:1,2±0,2. 2 н. и 1 з.п. ф-лы, 5 ил.
1. Препарат для инактивации внутриклеточных микобактерий туберкулеза, представляющий собой микобактериофаг D29, включенный в бислойную фосфолипидную липосому размером 0,4 микрон.
2. Способ получения препарата по п. 1, заключающийся в выделении и очистке фаговых частиц из бактериальных лизатов M.smegmatis с последующим включением в фосфолипидные липосомы, отличающийся тем, что выделение и очистку фаговых частиц из бактериальных лизатов M.smegmatis проводят с помощью ионно-обменной хроматографии на колонке Q-sepharose, полученный очищенный микобактериофаг в концентрации не менее 108 pfu/мл встряхивают с фосфолипидной пленкой в течение 5-10 минут, проводят экструзию полученных частиц через фильтр с порами 5 микрон и последующей 20-кратной экструзией с использованием фильтров размером пор 0,4 мкм, концентрированием и отделением включенной в липосомы фракции микобактериофага с помощью центрифугирования при 13±2 тыс. об/мин в течение 30±5 минут.
3. Способ по п. 2, отличающийся тем, что используют фосфолипидную пленку, полученную из фосфатидилхолина, холестерина и твин-80, взятых в массовом соотношении 5±1:1±0,8:1,2±0,2.
| СПОСОБ ФАГОТЕРАПИИ ТУБЕРКУЛЕЗА | 2001 |
|
RU2214829C2 |
| СМИРНОВА Н.С | |||
| и др | |||
| Солесос | 1922 |
|
SU29A1 |
| ЛАПЕНКОВА М.Б | |||
| и др | |||
| Солесос | 1922 |
|
SU29A1 |
Авторы
Даты
2019-06-13—Публикация
2018-08-16—Подача