Область изобретения
Настоящее изобретение относится к области конъюгатов антитело-лекарственное средство (ADC). ADC по настоящему изобретению содержит антитело против MUC1 или мутантное антитело против MUC1. Настоящее изобретение относится к ADC с мутантным антителом против MUC1 с повышенной аффинностью связывания с антигеном. В частности, аспарагин 57 вариабельной области тяжелой цепи заменяют другой аминокислотой в мутантной версии гуманизированного антитела PankoMab. Таким образом, участок гликозилирования в области CDR2 делетирован, и аффинность связывания с антигеном повышена. ADC демонстрировал значительную противоопухолевую эффективность. В конкретных вариантах осуществления настоящее изобретение относится к терапевтическому и диагностическому применению этих конъюгатов антитело-лекарственное средство и способам получения таких конъюгатов антитело-лекарственное средство.
УРОВЕНЬ ТЕХНИКИ
Антитела против опухолеспецифических антигенов являются широко используемыми терапевтическими средствами против злокачественных новообразований. В настоящее время одобрено множество противоопухолевых антител для терапии человека. Некоторые из этих антител действуют, блокируя некоторые пути передачи сигнала, являющиеся критическими для выживания или пролиферации конкретных злокачественных клеток. Другие противоопухолевые антитела активируют иммунный ответ пациента против злокачественных клеток-мишеней, например, инициируя антителозависимую клеточную цитотоксичность (ADCC) с помощью естественных киллеров. Этот механизм индуцируется посредством связывания Fc-части антитела с Fc-рецепторами на иммунных клетках.
Интересной и важной группой антител являются антитела, направленные против муциновых белков. Муцины представляют собой семейство высокомолекулярных, сильно гликозилированных белков, продуцируемых многими эпителиальными тканями позвоночных. Их можно подразделять на муциновые белки, являющиеся мембраносвязанными из-за наличия гидрофобного, проходящего через мембрану домена, способствующего его удержанию в плазматической мембране, и муцины, секретирующиеся на слизистых поверхностях или секретирующиеся, становясь компонентами слюны. Семейство муциновых белков человека состоит из множества членов семейства, включая мембраносвязанный MUC1.
Повышенная продукция муцинов происходит при многих аденокарциномах, включая рак поджелудочной железы, легких, молочной железы, яичников, толстого кишечника и т.д. Муцины также гиперэкспрессируются при заболеваниях легких, таких как астма, бронхит, хроническая обструктивная болезнь легких или кистозный фиброз. Два мембранных муцина, MUC1 и MUC4, тщательно изучены на предмет их роли в патологическом процессе. Кроме того, муцины также исследовали в качестве потенциальных диагностических маркеров. В этой области известно несколько антител против муциновых белков (Clin. Cancer Res., 2011 Nov 1;17(21):6822-30, PLoS One, 2011 Jan 14;6(1):e15921), в частности, MUC1. Однако их терапевтическую эффективность все еще можно улучшить.
В связи с этим, в этой области существует потребность в терапевтических антителах против MUC1 с улучшенными свойствами.
ADC состоят из трех разных компонентов (антитело, линкер и лекарственное средство/нагрузка), отвечающих за доставку нагрузки специфически в клетки-мишени. К настоящему времени на рынок вышли четыре ADC (гемтузумаб озогамицин (Милотарг®), инотузумаб озогамицин (Besponsa®), брентуксимаб ведотин (Adcetris®), трастузумаб эмтанзин (T-DM1; Kadcyla®)). Кроме того, существует более 60 ADC, разработанных для направленного воздействия на широкий диапазон гемобластозов и солидных опухолей. ADC представляют собой новую парадигму химиотерапии злокачественных новообразований. Имея специфичность моноклонального антитела и цитотоксическую активность низкомолекулярных лекарственных средств, ADC обещают стать важной частью прецизионной медицины будущего, а также комбинированного лечения. Таким образом, существует потребность в получении дополнительных ADC и средствах, способах и применении, касающихся лечения и/или диагностики заболеваний.
Известны ADC, в которых экзатекан конъюгируют с антителом (например, антителом против HER2) через линкер (WO2014/057687, WO2015/115091). Однако, ADC, в которых экзатекан конъюгируют с антителом против MUC1, неизвестен.
Сущность изобретения
Авторы настоящего изобретения обнаружили, что делеция участка гликозилирования в вариабельной области тяжелой цепи антитела против MUC1 PankoMab не приводила к исчезновению связывания с антигеном, а неожиданно повышала аффинность антитела к антигену. Это было особенно неожиданным, т.к. участок гликозилирования находится во второй определяющей комплементарность области вариабельной области тяжелой цепи (CDR-H2). CDR являются областями антитела, напрямую вовлеченными в связывание антигена и обеспечивающими контакт с эпитопом. Таким образом, в целом, ожидают, что модификация аминокислот CDR будет неблагоприятной для аффинности связывания с антигеном. Гуманизированное антитело PankoMab дополнительно содержит участок гликозилирования в CDR-H2, несущий крупную углеводную структуру. Эта углеводная структура находится непосредственно на поверхности связывания с антигеном, и, таким образом, ее считают участвующей в связывании с антигеном. Однако, как показано в примерах, вариант PankoMab (N54Q), в котором участок гликозилирования делетирован посредством замены аминокислоты, несущей углеводную структуру, демонстрирует повышенную аффинность связывания с антигеном. Кроме того, авторы настоящего изобретения обнаружили, что конъюгат или конъюгат антитело-лекарственное средство (ADC), содержащий PankoMab или вариант PankoMab (PM-N54Q), демонстрирует значительную противоопухолевую эффективность в отношении MUC1-положительной опухоли, и что PM-N54Q-ADC демонстрировал значительную противоопухолевую эффективность по сравнению с PankoMab-ADC.
Таким образом, в первом аспекте, настоящее изобретение относится к конъюгату, содержащему антитело, конъюгированное с цитотоксическим средством, где антитело способно связываться с MUC1 и содержит
(i) вариабельную область тяжелой цепи, содержащую определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и
(ii) вариабельную область легкой цепи, содержащую определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6.
Во втором аспекте настоящее изобретение относится к композиции, содержащей конъюгат по изобретению.
В третьем аспекте настоящее изобретение относится к композиции или конъюгату по изобретению для применения в медицине, в частности, в лечении, профилактике или диагностике злокачественного новообразования.
В четвертом аспекте настоящее изобретение относится к способу лечения злокачественного новообразования у нуждающегося в этом индивидуума, включающему введение индивидууму со злокачественным новообразованием терапевтически эффективного количества конъюгата по изобретению.
В пятом аспекте настоящее изобретение относится к наборам или устройствам, содержащим конъюгат по изобретению, родственным способам, которые можно использовать в диагностике, детекции или мониторинге MUC1-ассоциированных нарушений, таких как злокачественное новообразование.
Другие цели, признаки, преимущества и аспекты настоящего изобретения будут очевидны специалистам в этой области из следующего описания и формулы изобретения. Однако следует понимать, что следующее описание, формула изобретения и конкретные примеры, в которых указаны предпочтительные варианты осуществления настоящего изобретения, указаны исключительно в иллюстративных целях. Различные изменения и модификации сущности и объема описываемого изобретения будут очевидны специалистам в этой области из следующего описания.
ОПРЕДЕЛЕНИЯ
В рамках изобретения следующие выражения, как правило, предпочтительно, должны иметь приведенные ниже значения, если контекст не указывает на иное.
В рамках изобретения выражение "содержат", помимо своего буквального значения, также включает и конкретно относится к выражениям "состоит, по существу, из" и "состоит из". Таким образом, выражение "содержат" относится к вариантам осуществления, где объект изобретения, "содержащий" конкретно перечисленные элементы, не содержит дополнительные элементы, а также варианты осуществления, где объект изобретения, "содержащий" конкретно перечисленные элементы, может предусматривать и/или фактически предусматривает дополнительные элементы. Аналогично, выражение "имеет" следует понимать как выражение "содержит", также включающее и конкретно относящееся к выражениям "состоит, по существу, из" и "состоит из". Термин "состоит, по существу, из", по возможности, в частности, относится к вариантам осуществления, где объект изобретения содержит 20% или менее, в частности, 15% или менее, 10% или менее или, в частности, 5% или менее дополнительных элементов в дополнение к конкретно перечисленным элементам, из которых, по существу, состоит объект изобретения.
Термин "антитело", в частности, относится к белку, содержащему по меньшей мере две тяжелые цепи и две легкие цепи, соединенные дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (VH) и константной области тяжелой цепи (CH). Каждая легкая цепь состоит из вариабельной области легкой цепи (VL) и константной области легкой цепи (CL). Константная область тяжелой цепи содержит три, или в случае антител типа IgM или IgE четыре, константных домена тяжелой цепи (CH1, CH2, CH3 и CH4), где первый константный домен CH1 является смежным с вариабельной областью, и его можно соединять со вторым константным доменом CH2 посредством шарнирной области. Константная область легкой цепи состоит только из одного константного домена. Вариабельные области можно дополнительно разделять на области гипервариабельности, обозначаемые как определяющие комплементарность области (CDR), перемежающиеся с более консервативными областями, обозначаемыми как каркасные области (FR), где каждая вариабельная область содержит три CDR и четыре FR. Вариабельные области тяжелых и легких цепей содержат связывающий домен, взаимодействующий с антигеном. Константные области тяжелой цепи могут быть любого типа, такими как тяжелые цепи γ-, δ-, α-, μ- или ε-типа. Предпочтительно, тяжелая цепь антитела является γ-цепью. Кроме того, константная область легкой цепи также может быть любого типа, такой как легкие цепи κ- или λ-типа. Предпочтительно, легкая цепь антитела является κ-цепью. Термины "тяжелая цепь γ- (δ-, α-, μ- или ε-) типа" и "легкая цепь κ- (λ-) типа" относятся к тяжелым цепям антитела или легким цепям антитела, соответственно, имеющим аминокислотные последовательности константной области, полученные из природных аминокислотных последовательностей константной области тяжелой или легкой цепи, в частности, аминокислотных последовательностей константной области тяжелой или легкой цепи человека. В частности, аминокислотная последовательность константных доменов тяжелой цепи γ-типа (в частности, γ1-типа) является по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности константных доменов тяжелой цепи γ антитела человека (в частности, γ1 человека). Кроме того, аминокислотная последовательность константного домена легкой цепи κ-типа является, в частности, по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности константного домена легкой цепи κ антитела человека. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами организма-хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента. Антитело может являться, например, гуманизированным, человеческим или химерным антителом.
Термин "антигенсвязывающая часть" антитела, как правило, относится к полноразмерному антителу или одному или более фрагментам антитела, сохраняющим способность специфически связываться с антигеном. Показано, что антигенсвязывающую функцию антитела могут выполнять фрагменты полноразмерного антитела. Примеры связывающих фрагментов антитела включают Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; F(ab)2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, каждый из которых связывается с одним и тем же антигеном, соединенные дисульфидным мостиком в шарнирной области; Fd-фрагмент, состоящий из доменов VH и CH1; Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела; и dAb-фрагмент, состоящий из домена VH.
Термин "Fab-часть" антитела, в частности, относится к части антитела, содержащей вариабельные области тяжелой и легкой цепи (VH и VL) и первые домены константных областей тяжелой и легкой цепи (CH1 и CL). В случаях, когда антитело не содержит все эти области, термин "Fab-часть" относится только к тем из областей VH, VL, CH1 и CL, которые присутствуют в антителе. Предпочтительно, термин "Fab-часть" относится к части антитела, соответствующей фрагменту, полученному посредством расщепления природного антитела папаином, соответствующую антигенсвязывающей активности антитела. В частности, Fab-часть антитела включает антигенсвязывающий участок или имеет его антигенсвязывающую способность. Предпочтительно, Fab-часть содержит по меньшей мере область VH антитела.
Термин "Fc-часть" антитела, в частности, относится к части антитела, содержащей константные области тяжелой цепи 2, 3, и в соответствующих случаях, 4 (CH2, CH3 и CH4). В частности, Fc-часть содержит по две каждой из этих областей. В случаях, когда антитело не содержит все из этих областей, термин "Fc-часть" относится только к тем из областей CH2, CH3 и CH4, которые присутствуют в антителе. Предпочтительно, Fc-часть содержит по меньшей мере область CH2 антитела. Предпочтительно, термин "Fc-часть" относится к части антитела, соответствующей фрагменту, полученному посредством расщепления природного антитела папаином, не имеющей антигенсвязывающей активности антитела. В частности, Fc-часть антитела может связываться с Fc-рецептором и, таким образом, например, содержит участок связывания Fc-рецептора или имеет способность к связыванию Fc-рецептора.
В рамках изобретения термины "антитело" и "конструкция антитела" в некоторых вариантах осуществления относятся к популяции антител или конструкций антител, соответственно, одного типа. В частности, все антитела или конструкции антител из популяции демонстрируют признаки, используемые для определения антитела или конструкции антитела. В некоторых вариантах осуществления все антитела или конструкции антител в популяции имеют аминокислотную последовательность. Ссылка на конкретный тип антитела, такой как антитело, способное специфически связываться с MUC1, в частности, относится к популяции этого типа антител.
В рамках изобретения термин "антитело" также включает фрагменты и производные указанного антитела. В частности, "фрагмент или производное" антитела является белком или гликопротеином, полученным из указанного антитела и способным связываться с тем же антигеном, в частности, с тем же эпитопом, что и антитело. Таким образом, в рамках изобретения термин "фрагмент или производное" антитела, в основном, относится к функциональному фрагменту или производному. В особенно предпочтительных вариантах осуществления фрагмент или производное антитела содержит вариабельную область тяжелой цепи. Показано, что антигенсвязывающую функцию антитела могут выполнять фрагменты полноразмерного антитела или его производные. Примеры фрагментов антител включают (i) Fab-фрагменты, моновалентные фрагменты, состоящие из вариабельной области и первого константного домена каждой из тяжелой и легкой цепи; (ii) F(ab)2-фрагменты, бивалентные фрагменты, содержащие два Fab-фрагмента, соединенные дисульфидным мостиком в шарнирной области; (iii) Fd-фрагменты, состоящие из вариабельной области и первого константного домена CH1 тяжелой цепи; (iv) Fv-фрагменты, состоящие из вариабельной области тяжелой цепи и легкой цепи одного плеча антитела; (v) scFv-фрагменты, Fv-фрагменты, состоящие из одной полипептидной цепи; (vi) (Fv)2-фрагменты, состоящие из двух Fv-фрагментов, ковалентно связанных друг с другом; (vii) вариабельный домен тяжелой цепи; и (viii) мультитела, состоящие из вариабельной области тяжелой цепи и вариабельной области легкой цепи, ковалентно связанных друг с другом таким образом, что связывание вариабельных областей тяжелой цепи и легкой цепи может происходить только межмолекулярно, но не внутримолекулярно. Производные антитела, в частности, включают антитела, связывающиеся или конкурирующие за тот же антиген, что и родительское антитело, но имеющие иную аминокислотную последовательность, чем родительское антитело, из которого оно получено. Эти фрагменты и производные антител получают общепринятыми способами, известными специалистам в этой области.
Целевую аминокислотную последовательность "получают" из референсной аминокислотной последовательности, или она "соответствует" референсной аминокислотной последовательности, если целевая аминокислотная последовательность обладает гомологией или идентичностью по всей длине в отношении соответствующей части референсной аминокислотной последовательности по меньшей мере 75%, более предпочтительно - по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 93%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%. Термин "соответствующая часть" означает, что, например, каркасная область 1 вариабельной области тяжелой цепи (FRH1) целевого антитела соответствует каркасной области 1 вариабельной области тяжелой цепи референсного антитела. В конкретных вариантах осуществления целевая аминокислотная последовательность, "полученная" или "соответствующая" референсной аминокислотной последовательности, является на 100% гомологичной или, в частности, 100% идентичной по всей своей длине в отношении соответствующей части референсной аминокислотной последовательности. "Гомологию" или "идентичность" аминокислотной последовательности или нуклеотидной последовательности, предпочтительно, определяют в рамках изобретения по всей длине референсной последовательности или по всей длине соответствующей части референсной последовательности, соответствующей последовательности, гомология или идентичность которой определена. Антитело, полученное из родительского антитела, определяемое по одной или более аминокислотным последовательностям, таким как специфические последовательности CDR или специфические последовательности вариабельной области, в частности, является антителом, имеющим аминокислотные последовательности, такие как последовательности CDR или последовательности вариабельной области, являющиеся по меньшей мере на 75%, предпочтительно - по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 93%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% гомологичными или идентичными, в частности, идентичными соответствующим аминокислотным последовательностям родительского антитела. В некоторых вариантах осуществления антитело, полученное из (т.е. являющееся производным) родительского антитела, содержит те же последовательности CDR, что и родительское антитело, но отличается остальными последовательностями вариабельных областей.
В рамках изобретения термин "антитело" также относится к мультивалентным и мультиспецифическим антителам, т.е. конструкциям антител, имеющим более двух участков связывания, каждый из которых связывается с одним и тем же эпитопом, и конструкциям антител, имеющим один или более участков связывания, связывающихся с первым эпитопом, и один или более участков связывания, связывающихся со вторым эпитопом, и, необязательно, даже дополнительные участки связывания, связывающиеся с дополнительными эпитопами.
Предпочтительно, термин "специфическое связывание" означает, что средство, такое как антитело, сильнее связывается с мишенью, такой как эпитоп, для которой оно является специфическим, по сравнению со связыванием с другой мишенью. Примеры критериев определения того, является ли связывание специфическим или нет, могут включать константу диссоциации (в настоящем описании обозначаемую как "KD"). Средство связывается сильнее с первой мишенью по сравнению со второй мишенью, если оно связывается с первой мишенью с константой диссоциации (Kd), являющейся более низкой, чем константа диссоциации для второй мишени. Предпочтительно, константа диссоциации для мишени, с которой специфически связывается средство, является более чем в 100, 200, 500 раз или более чем 1000 раз более низкой, чем константа диссоциации для мишени, с которой средство не связывается специфически. Кроме того, термин "специфическое связывание", в частности, означает аффинность связывания между партнерами по связыванию с константой аффинности Ka по меньшей мере 106 M-1, предпочтительно - по меньшей мере 107 M-1, более предпочтительно - по меньшей мере 108 M-1. Термин "антитело, специфическое в отношении некоторого антигена", в частности, относится к антителу, способному связываться с указанным антигеном с аффинностью с Ka по меньшей мере 106 M-1, предпочтительно - по меньшей мере 107 M-1, более предпочтительно - по меньшей мере 108 M-1. Например, термин "антитело против MUC1", в частности, относится к антителу, специфически связывающемуся с MUC1 и, предпочтительно, способному связываться с MUC1 с аффинностью с Ka по меньшей мере 106 M-1, предпочтительно - по меньшей мере 107 M-1, более предпочтительно - по меньшей мере 108 M-1.
Термин "MUC1" относится к белку MUC1, также известному как муцин-1, полиморфный эпителиальный муцин (PEM) или антиген злокачественной опухоли 15-3, в частности, к MUC1 человека (регистрационный номер P15941). MUC1 является членом семейства муцинов и кодирует мембраносвязанный, гликозилированный фосфопротеин. MUC1 имеет массу корового белка 120-225 кДа, повышающуюся до 250-500 кДа при гликозилировании. Он выступает на 200-500 нм за пределы поверхности клетки. Белок заякорен в апикальной поверхности многих эпителиальных клеток с помощью трансмембранного домена. Внеклеточный домен включает домен с варьирующимся числом тандемных повторов (VNTR) размером 20 аминокислот, при этом количество повторов варьируется от 20 до 120 у разных индивидуумов. Эти повторы богаты остатками серина, треонина и пролина, делающими возможным сильное O-гликозилирование. В некоторых вариантах осуществления термин "MUC1" относится к опухолеассоциированному MUC1 ("TA-MUC1"). TA-MUC1 является MUC1, присутствующим на злокачественных клетках. Этот MUC1 отличается от MUC1, присутствующего на незлокачественных клетках, своим гораздо более высоким уровнем экспрессии, локализацией и гликозилированием. В частности, TA-MUC1 расположен аполярно по всей поверхности злокачественных клеток, в то время как в незлокачественных клетках MUC1 имеет строго апикальную экспрессию и, таким образом, недоступен для системно вводимых антител. Кроме того, TA-MUC1 имеет аномальное O-гликозилирование, в результате чего экспонируются новые пептидные эпитопы на остове белка MUC1 и новые углеводные опухолевые антигены, такие как антиген Томсена-Фриденрайха альфа (TFα).
Термин "TFα", также обозначаемый как антиген Томсена-Фриденрайха альфа или Core-1, относится к дисахариду Gal-β1,3-GalNAc, связанному в виде O-гликозида в альфа-аномерной конфигурации с гидроксиаминокислотами серином или треонином белков в клетках карциномы.
Термин "сиаловая кислота", в частности, относится к любым N- или O-замещенным производным нейраминовой кислоты. Он может относиться к 5-N-ацетилнейраминовой кислоте и 5-N-гликолилнейраминовой кислоте, но, предпочтительно, относится только к 5-N-ацетилнейраминовой кислоте. Сиаловая кислота, в частности, 5-N-ацетилнейраминовая кислота, предпочтительно, присоединена к углеводной цепи через 2,3- или 2,6-связь. Предпочтительно, в антителах, представленных в настоящем описании, присутствует 2,3- а также 2,6-связанные сиаловые кислоты.
В рамках изобретения термин "относительное количество гликанов" относится к конкретной процентной доле или диапазону процентов гликанов, присоединенных к антителам из препарата антител или в композиции, содержащей антитела, соответственно. В частности, термин "относительное количество гликанов" относится к конкретной процентной доле или диапазону процентов всех гликанов, содержащихся в антителах и, таким образом, присоединенных к полипептидным цепям антител в препарате антител или композиции, содержащей антитела. Термин "100% гликанов" относится ко всем гликанам, присоединенным к антителам из препарата антител или в композиции, содержащей антитела, соответственно. Например, термин "относительное количество гликанов, несущих GlcNAc в точке ветвления, 10%" относится к композиции, содержащей антитела, где 10% всех гликанов, содержащихся в антителах и, таким образом, присоединенных к полипептидным цепям антител в указанной композиции, содержат остаток GlcNAc в точке ветвления, в то время как 90% всех гликанов, содержащихся в антителах и, таким образом, присоединенных к полипептидным цепям антитела в указанной композиции, не содержат остаток GlcNAc в точке ветвления. Соответствующее референсное количество гликанов, представляющее собой 100%, может представлять собой все гликановые структуры, присоединенные к антителам в композиции, или все N-гликаны, т.е. все гликановые структуры, присоединенные к остатку аспарагина в антителах в композиции, или все гликаны комплексного типа. Референсная группа гликановых структур, как правило, конкретно указана или напрямую очевидна специалисту в этой области из условий.
Термин "N-гликозилирование" относится ко всем гликанам, присоединенным к остаткам аспарагина полипептидной цепи белка. Эти остатки аспарагина, как правило, являются частью участков N-гликозилирования, имеющих аминокислотную последовательность Asn-Xaa-Ser/Thr, где Xaa может являться любой аминокислотой, за исключением пролина. Аналогично, "N-гликаны" являются гликанами, присоединенными к остаткам аспарагина полипептидной цепи. Термины "гликан", "гликановая структура", "углевод", "углеводная цепь" и "углеводная структура", как правило, используют в настоящем описании синонимично. N-гликаны, как правило, имеют общую коровую структуру, состоящую из двух остатков N-ацетилглюкозамина (GlcNAc) и трех остатков маннозы, имеющую структуру Manα1,6-(Manα1,3-)Manβ1,4-GlcNAcβ1,4-GlcNAcβ1-Asn, при этом Asn представляет собой остаток аспарагина полипептидной цепи. N-гликаны разделяют на три разных типа, а именно гликаны комплексного типа, гликаны гибридного типа и высокоманнозные гликаны.
Числа, приведенные в настоящем описании, в частности, относительные степени конкретного гликозилирования, предпочтительно, следует понимать как приблизительные значения. В частности, числа, предпочтительно, могут быть на 10% выше и/или ниже, в частности, до 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% выше и/или ниже.
В рамках изобретения термин "конъюгат антитело-лекарственное средство (ADC)" или "конъюгат", в основном, относится к связыванию антитела или его антигенсвязывающего фрагмента с другим средством, таким как химиотерапевтическое средство, токсин, иммунотерапевтическое средство, зонд для визуализации и т.п. Связывание может представлять собой ковалентные связи или нековалентные взаимодействия, такие как электростатические силы. Для получения конъюгата антитело-лекарственное средство можно использовать различные линкеры, известные в этой области и представленные в настоящем описании. Кроме того, конъюгат антитело-лекарственное средство можно получать в форме слитого белка, который можно экспрессировать с полинуклеотида, кодирующего иммунный конъюгат. В рамках изобретения термин "слитый белок" относится к белкам, полученным посредством соединения двух или более генов или фрагментов генов, исходно кодирующих отдельные белки (включая пептиды и полипептиды). Трансляция слитого гена приводит к получению одного белка с функциональными свойствами, полученными от каждого из исходных белков.
В "конъюгате" друг с другом связывают два или более соединения. В некоторых вариантах осуществления в конъюгате сохраняются по меньшей мере некоторые из свойств каждого соединения. Связывания можно достигать посредством ковалентной или нековалентной связи. Предпочтительно, соединения из конъюгата соединяют посредством ковалентной связи. Разные соединения из конъюгата можно напрямую связывать друг с другом с помощью одной или более ковалентных связей между атомами соединения. Альтернативно, соединения можно связывать друг с другом с помощью химического фрагмента, такого как линкерная молекула, где линкер ковалентно связан с атомами соединения. Если конъюгат состоит из более чем двух соединений, эти соединения, например, можно соединять в конформации цепи, одно соединение можно соединять со следующим соединением или каждое из нескольких соединений можно соединять с одним центральным соединением.
Термин "нуклеиновая кислота" включает одноцепочечные и двухцепочечные нуклеиновые кислоты и рибонуклеиновые кислоты, а также дезоксирибонуклеиновые кислоты. Они могут содержать природные, а также синтетические нуклеотиды и могут быть природно или синтетически модифицированы, например, посредством метилирования, 5'- и/или 3'-кэпирования.
Термин "экспрессионная кассета", в частности, относится к конструкции нуклеиновой кислоты, способной делать возможной и регулировать экспрессию кодирующей последовательности нуклеиновой кислоты, встроенной в нее. Экспрессионная кассета может содержать промоторы, участки связывания рибосомы, энхансеры и другие контрольные элементы, регулирующие транскрипцию гена или трансляцию мРНК. Точная структура экспрессионной кассеты может варьироваться как функция биологического вида или типа клеток, но, как правило, содержит 5'-нетранскрибируемые и 5'- и 3'-нетранслируемые последовательности, участвующие в инициации транскрипции и трансляции, соответственно, такие как TATA-бокс, последовательность кэпа, последовательность CAAT и т.п. Более конкретно, 5'-нетранскрибируемые последовательности контроля экспрессии содержат промоторную область, включающую промоторную последовательность для транскрипционного контроля функционально связанной нуклеиновой кислоты. Экспрессионные кассеты также могут содержать энхансерные последовательности или вышележащие активаторные последовательности.
В рамках изобретения термин "промотор" относится к последовательности нуклеиновой кислоты, находящейся выше (5') последовательности нуклеиновой кислоты, подлежащей экспрессии, и контролирующей экспрессию последовательности, предоставляя участок распознавания и связывания для РНК-полимераз. "Промотор" может включать дополнительные участки распознавания и связывания для дополнительных факторов, участвующих в регуляции транскрипции гена. Промотор может контролировать транскрипцию прокариотического или эукариотического гена. Кроме того, промотор может являться "индуцибельным", т.е. инициировать транскрипцию в ответ на индуцирующее средство, или может являться "конститутивным", если транскрипция не контролируется индуцирующим средством. Ген, находящийся под контролем индуцибельного промотора, не экспрессируется или экспрессируется лишь в небольшой степени в отсутствие индуцирующего средства. В присутствии индуцирующего средства ген активируется, или повышается уровень транскрипции. Это опосредовано, в основном, связыванием специфического фактора транскрипции.
Термин "вектор" используют в настоящем описании в его наиболее широком значении, и он включает любой промежуточный носитель для нуклеиновой кислоты, позволяющей указанной нуклеиновой кислоте, например, встраиваться в прокариотические и/или эукариотические клетки и, при необходимости, интегрироваться в геном. Векторы этого типа, предпочтительно, реплицируются и/или экспрессируются в клетках. Векторы включают плазмиды, фагмиды, бактериофаги или вирусные геномы. В рамках изобретения термин "плазмида", как правило, относится к конструкции экстрахромосомного генетического материала, как правило, кольцевому дуплексу ДНК, который может реплицироваться независимо от хромосомной ДНК.
В рамках изобретения термин "клетка-хозяин" относится к любой клетке, которую можно трансформировать или трансфицировать с использованием экзогенной нуклеиновой кислоты. В рамках изобретения термин "клетки-хозяева" включает прокариотические (например, E. coli) или эукариотические клетки (например, клетки млекопитающих, в частности, клетки человека, дрожжевые клетки и клетки насекомых). Особенно предпочтительными являются клетки млекопитающих, такие как клетки людей, мышей, хомяков, свиней, коз или приматов. Клетки можно получать из множества типов тканей, и они включают первичные клетки и линии клеток. Нуклеиновая кислота может присутствовать в клетке-хозяине в форме одной копии или двух или более копий и в одном из вариантов осуществления экспрессируется в клетке-хозяине.
В рамках изобретения термин "пациент" означает человека, не являющегося человеком примата или другого животного, в частности, млекопитающего, такого как корова, лошадь, свинья, овца, коза, собака, кошка или грызун, такой как мышь и крыса. В особенно предпочтительном варианте осуществления пациент является человеком.
В рамках изобретения термин "злокачественное новообразование", в частности, включает лейкозы, семиномы, меланомы, карциномы, тератомы, лимфомы, саркомы, мезотелиомы, нейробластомы, глиомы, рак прямой кишки, рак эндометрия, рак почки, рак надпочечника, рак щитовидной железы, гемобластоз, рак кожи, злокачественное новообразование головного мозга, рак шейки матки, злокачественное новообразование кишечника, рак печени, рак толстого кишечника, рак желудка, злокачественное новообразование кишечника, рак головы и шеи, злокачественное новообразование желудочно-кишечного тракта, злокачественное новообразование лимфоузлов, рак пищевода, колоректальный рак, рак поджелудочной железы, злокачественное новообразование уха, горла и носа (ЛОР), рак молочной железы, рак предстательной железы, рак мочевого пузыря, рак матки, рак яичников и рак легких и их метастазы. В рамках изобретения термин "злокачественное новообразование" также включает метастазы злокачественного новообразования.
Термин "опухоль" означает группу клеток или ткань, образующуюся в результате неправильно регулируемой пролиферации клеток. Опухоли могут демонстрировать частичное или полное отсутствие структурной организации и функциональной координации с нормальной тканью и, как правило, образуют отдельную массу ткани, которая может являться доброкачественной или злокачественной.
Термины "опухоль" и "злокачественное новообразование" используют взаимозаменяемо.
Термин "метастазирование" означает распространение злокачественных клеток из исходного очага в другую часть организма. Образование метастазов является очень сложным процессом и, как правило, включает открепление злокачественных клеток от первичной опухоли, проникновение в кровоток и оседание для роста в нормальных тканях где-либо в организме. Если опухолевые клетки метастазируют, новую опухоль называют вторичной или метастатической опухолью, и ее клетки, как правило, напоминают клетки в исходной опухоли. Это означает, например, что, если рак молочной железы метастазирует в легкие, вторичная опухоль состоит из аномальных клеток молочной железы, а не из аномальных клеток легких. В этом случае опухоль в легких называют метастатическим раком молочной железы, а не раком легких.
Термин "фармацевтическая композиция", в частности, относится к композиции, подходящей для введения человеку или животному, т.е. композиции, содержащей компоненты, являющиеся фармацевтически приемлемыми. Предпочтительно, фармацевтическая композиция содержит активное соединение или его соль или пролекарство вместе с носителем, дилюентом или фармацевтическим эксципиентом, таким как буфер, консервант и регулятор тоничности.
Числовые диапазоны, представленные в настоящем описании, являются включительными для чисел, определяющих диапазон. Заголовки, приведенные в настоящем описании, не ограничивают различные аспекты или варианты осуществления настоящего изобретения, которые можно прочитать, обратившись к описанию в целом. В одном из вариантов осуществления объект изобретения, представленный в настоящем описании как содержащий некоторые стадии в случае способов или как содержащий некоторые ингредиенты в случае композиций, относится к объекту изобретения, состоящему из соответствующих стадий или ингредиентов. Предпочтительно выбирать и комбинировать предпочтительные аспекты и варианты осуществления, представленные в настоящем описании, и конкретный объект изобретения, возникающий из соответствующей комбинации предпочтительных вариантов осуществления, также принадлежит к настоящему изобретению.
Подробное описание изобретения
Настоящее изобретение основано на разработке варианта гуманизированного антитела против MUC1 PankoMab, где участок гликозилирования в CDR-H2 делетирован (PM-N54Q). Делеции участка гликозилирования достигают посредством замены аминокислоты Asn (аспарагина) 57 вариабельной области тяжелой цепи (а именно аминокислоты 57 SEQ ID NO: 11) другой аминокислотой, в частности, Gln (глутамином). Asn 57 является акцепторным аминокислотным остатком участка гликозилирования, к которому присоединяется углеводная структура. Замена этого остатка аспарагина другим остатком устраняет гликозилирование, т.к. углеводная структура может переноситься на остаток аспарагина только ферментами клетки-хозяина. Неожиданно обнаружили, что делеция участка гликозилирования в CDR-H2 PankoMab повышает аффинность связывания антитела с антигеном.
В связи с этим, настоящее изобретение относится к конъюгату, содержащему антитело, конъюгированное с цитотоксическим средством, где антитело способно связываться с MUC1 и содержит
(i) вариабельную область тяжелой цепи, содержащую определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и
(ii) вариабельную область легкой цепи, содержащую определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6.
Связывание с MUC1
Антитело специфически связывается с эпитопом MUC1. Эпитоп находится во внеклеточных тандемных повторах MUC1. В некоторых вариантах осуществления антитело связывается с MUC1 в зависимости от гликозилирования. В частности, антитело сильнее связывается, если указанные тандемные повторы являются гликозилированными по остатку треонина N-ацетилгалактозамином (Tn), сиалил-α2-6-N-ацетилгалактозамином (sTn), галактоза-β1-3-N-ацетилгалактозамином (TF) или галактоза-β1-3-(сиалил-α2-6)-N-ацетилгалактозамином (sTF), предпочтительно - Tn или TF. Предпочтительно, молекула углевода связана с остатком треонина α-O-гликозидной связью. Эпитоп в домене с тандемными повторами MUC1, в частности, содержит аминокислотную последовательность PDTR (SEQ ID NO: 13) или PESR (SEQ ID NO: 14). Связывание с этим эпитопом, предпочтительно, зависит от гликозилирования, как описано выше, где, в частности, связывание повышается, если описанная выше молекула углевода присоединена к остатку треонина последовательности PDTR или PESR (SEQ ID NO: 13 и 14), соответственно.
Эпитоп является опухолеассоциированным эпитопом MUC1 (TA-MUC1). Термин "эпитоп TA-MUC1", в частности, относится к эпитопу MUC1, находящемуся на опухолевых клетках, но не на нормальных клетках, и/или доступных только для антител в кровотоке организма-хозяина, когда он присутствует на опухолевых клетках, но не когда он присутствует на нормальных клетках. В некоторых вариантах осуществления связывание антитела с клетками, экспрессирующими эпитоп TA-MUC1, является более сильным, чем связывание с клетками, экспрессирующими нормальный, неопухолевый MUC1. Предпочтительно, указанное связывание является по меньшей мере в 1,5 раз более сильным, предпочтительно - по меньшей мере, в 2 раза более сильным, по меньшей мере в 5 раз более сильным, по меньшей мере в 10 раз более сильным или по меньшей мере в 100 раз более сильным. В случае связывания TA-MUC1 антитело, предпочтительно, специфически связывается с гликозилированным опухолевым эпитопом MUC1 таким образом, что сила связи повышается по меньшей мере в 2 раза, предпочтительно - 4 или 10 раз, наиболее предпочтительно - в 20 раз по сравнению со связью с негликозилированным пептидом идентичной длины и идентичной пептидной последовательности. Указанное связывание можно анализировать или определять посредством ELISA, RIA, анализа поверхностного плазмонного резонанса (далее в настоящем описании обозначаемого как "SPR") или т.п. Примеры оборудования, используемого в анализе SPR, могу включать BlAcoreTM (производимый GE Healthcare Bio-Sciences Crop.), ProteOnTM (производимый Bio-Rad Laboratories, Inc.), биосенсор DRX2 (производимый Dynamic Biosensors GmbH), SPR-Navi(TM) (производимый BioNavis Oy Ltd.), SpreetaTM (производимый Texas Instruments Inc.), SPRi-PlexIITM (производимый Horiba, Ltd.) и Autolab SPRTM (производимый Metrohm). Связывание антитела с антигеном, экспрессирующимся на поверхности клетки, можно анализировать посредством проточной цитометрии или т.п.
Кроме того, антитело может демонстрировать антигенсвязывающие свойства, схожие со свойствами референсного антитела, содержащего вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 11 или SEQ ID NO: 10 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO: 12. Предпочтительно, референсное антитело является гуманизированным антителом PankoMab. В частности, антитело специфически связывается с тем же антигеном, что и референсное антитело, и, предпочтительно, связывается с указанным антигеном с более высокой аффинностью. Т.е. антитело, предпочтительно, связывается с антигеном с аффинностью с константой диссоциации, более низкой, чем у референсного антитела, более предпочтительно - по меньшей мере на 10% более низкой, по меньшей мере на 20% более низкой, по меньшей мере на 30% более низкой или по меньшей мере на 50% более низкой. Кроме того, антитело, предпочтительно, демонстрирует перекрестную специфичность с референсным антителом, содержащим вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 11 или SEQ ID NO: 10 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO: 12. В частности, гуманизированное антитело может блокировать связывание референсного антитела с MUC1, если оно присутствует в достаточно высокой концентрации. Это возможно, если связывание референсного антитела в MUC1 является пространственно-затрудненным, когда антитело уже связано с антигеном MUC1.
Антитело против MUC1
Антитело, способное связываться с MUC1, содержит вариабельную область тяжелой цепи, содержащую определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и вариабельную область легкой цепи, содержащую определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6.
В некоторых вариантах осуществления вариабельная область тяжелой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 9. В частности, вариабельная область тяжелой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности SEQ ID NO: 9. В этих вариантах осуществления вариабельная область тяжелой цепи все еще содержит CDR, имеющие аминокислотные последовательности SEQ ID NO: 1, 2 и 3. Таким образом, любые отклонения последовательности от SEQ ID NO: 9 локализованы в каркасных областях, но не в CDR. В частности, вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 9.
В некоторых вариантах осуществления CDR-H2 имеет аминокислотную последовательность SEQ ID NO: 2, где аминокислота в положении 8 SEQ ID NO: 2 выбрана из группы, состоящей из глутамина, аланина, валина, гистидина, триптофана, тирозина, лизина и аргинина; в частности, глутамина, гистидина, триптофана, тирозина, лизина и аргинина. Предпочтительно, аминокислота в положении 8 SEQ ID NO: 2 является глутамином, гистидином, триптофаном, лизином или аргинином, в частности, глутамином. В частности, CDR-H2 имеет аминокислотную последовательность SEQ ID NO: 7.
В некоторых вариантах осуществления CDR-H2 имеет аминокислотную последовательность SEQ ID NO: 8.
В конкретных вариантах осуществления, вариабельная область тяжелой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 10. В частности, вариабельная область тяжелой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности SEQ ID NO: 10. В этих вариантах осуществления вариабельная область тяжелой цепи содержит CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 7, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3. Таким образом, любые отклонения последовательности от SEQ ID NO: 10 локализованы в каркасных областях, но не в CDR. В частности, вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 10.
В конкретных вариантах осуществления вариабельная область тяжелой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 11. В частности, вариабельная область тяжелой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности SEQ ID NO: 11. В этих вариантах осуществления вариабельная область тяжелой цепи содержит CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 8, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3. Таким образом, любые отклонения последовательности от SEQ ID NO: 11 находятся в каркасных областях, но не в CDR. В частности, вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 11.
В некоторых вариантах осуществления вариабельная область легкой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 12. В частности, вариабельная область легкой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности SEQ ID NO: 12. В этих вариантах осуществления вариабельная область легкой цепи все еще содержит CDR, имеющие аминокислотные последовательности SEQ ID NO: 4, 5 и 6. Таким образом, любые отклонения последовательности от SEQ ID NO: 12 локализованы в каркасных областях, а не в CDR. В частности, вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 12.
В конкретных вариантах осуществления вариабельная область тяжелой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 9, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 2 и 3, и вариабельная область легкой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 12, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6. В частности, вариабельная область тяжелой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 9, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 2 и 3, и вариабельная область легкой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 12, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6.
В конкретных вариантах осуществления вариабельная область тяжелой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 10, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 7 и 3, и вариабельная область легкой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 12, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6. В частности, вариабельная область тяжелой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 10, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 7 и 3, и вариабельная область легкой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 12, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6.
В конкретных вариантах осуществления вариабельная область тяжелой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 11, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 8 и 3, и вариабельная область легкой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 12, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6. В частности, вариабельная область тяжелой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 11, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 8 и 3, и вариабельная область легкой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 12, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6.
В конкретных вариантах осуществления вариабельная область тяжелой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности, представленной аминокислотами 20-136 SEQ ID NO: 20. В частности, вариабельная область тяжелой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности, представленной аминокислотами 20-136 SEQ ID NO: 20. В этих вариантах осуществления вариабельная область тяжелой цепи содержит CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3. Таким образом, любые отклонения последовательности от аминокислотной последовательности, представленной аминокислотами 20-136 SEQ ID NO: 20, локализованы в каркасных областях, а не в CDR. В частности, вариабельная область тяжелой цепи содержит аминокислотную последовательность, представленную аминокислотами 20-136 SEQ ID NO: 20. В некоторых вариантах осуществления аминокислота в положении 76 SEQ ID NO: 20 выбрана из группы, состоящей из глутамина, аланина, валина, гистидина, триптофана, тирозина, лизина и аргинина; в частности, глутамина, гистидина, триптофана, тирозина, лизина и аргинина. Предпочтительно, аминокислота в положении 76 SEQ ID NO: 20 является глутамином, гистидином, триптофаном, лизином или аргинином, в частности, глутамином. В частности, CDR-H2 имеет аминокислотную последовательность SEQ ID NO: 7, и/или вариабельная область тяжелой цепи содержит аминокислотную последовательность, представленную аминокислотами 20-136 SEQ ID NO: 23.
В конкретных вариантах осуществления вариабельная область легкой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности, представленной аминокислотами 21-133 SEQ ID NO: 21. В частности, вариабельная область легкой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности, представленной аминокислотами 21-133 SEQ ID NO: 21. В этих вариантах осуществления, вариабельная область легкой цепи все еще содержит CDR, имеющие аминокислотные последовательности SEQ ID NO: 4, 5 и 6. Таким образом, любые отклонения последовательности от аминокислотной последовательности, представленной аминокислотами 21-133 SEQ ID NO: 21, локализованы в каркасных областях, а не в CDR. В частности, вариабельная область легкой цепи содержит аминокислотную последовательность, представленную аминокислотами 21-133 SEQ ID NO: 21.
В конкретных вариантах осуществления вариабельная область тяжелой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности, представленной аминокислотами 20-136 SEQ ID NO: 20, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 7 и 3, и вариабельная область легкой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности, представленной аминокислотами 21-133 SEQ ID NO: 21, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6. В частности, вариабельная область тяжелой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности, представленной аминокислотами 20-136 SEQ ID NO: 20, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 7 и 3, и вариабельная область легкой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности, представленной аминокислотами 21-133 SEQ ID NO: 21, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6.
В конкретных вариантах осуществления тяжелая цепь содержит аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 15. В частности, тяжелая цепь содержит аминокислотную последовательность, являющуюся по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности SEQ ID NO: 15. В этих вариантах осуществления тяжелая цепь содержит CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3. Таким образом, любые отклонения последовательности от SEQ ID NO: 15 локализованы в каркасных областях, а не в CDR. В частности, тяжелая цепь содержит аминокислотную последовательность SEQ ID NO: 15. В некоторых вариантах осуществления аминокислота в положении 57 SEQ ID NO: 15 выбрана из группы, состоящей из глутамина, аланина, валина, гистидина, триптофана, тирозина, лизина и аргинина; в частности, глутамина, гистидина, триптофана, тирозина, лизина и аргинина. Предпочтительно, аминокислота в положении 57 SEQ ID NO: 15 является глутамином, гистидином, триптофаном, лизином или аргинином, в частности, глутамином. В частности, CDR-H2 имеет аминокислотную последовательность SEQ ID NO: 7, и/или вариабельная область тяжелой цепи содержит аминокислотную последовательность, представленную аминокислотами 20-136 SEQ ID NO: 22.
В конкретных вариантах осуществления тяжелая цепь содержит аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 19. В частности, тяжелая цепь содержит аминокислотную последовательность, являющуюся по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности SEQ ID NO: 19. В этих вариантах осуществления, тяжелая цепь содержит CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 8, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3. Таким образом, любые отклонения последовательности от SEQ ID NO: 19 локализованы в каркасных областях, а не CDR. В частности, тяжелая цепь содержит аминокислотную последовательность SEQ ID NO: 19.
В конкретных вариантах осуществления легкая цепь содержит аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 16. В частности, легкая цепь содержит аминокислотную последовательность, являющуюся по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности SEQ ID NO: 16. В этих вариантах осуществления легкая цепь все еще содержит CDR, имеющие аминокислотные последовательности SEQ ID NO: 4, 5 и 6. Таким образом, любые отклонения последовательности от SEQ ID NO: 16 локализованы в каркасных областях, а не в CDR. В частности, легкая цепь содержит аминокислотную последовательность SEQ ID NO: 16.
В конкретных вариантах осуществления тяжелая цепь имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 15, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 7 и 3, и вариабельная область легкой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 16, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6. В частности, тяжелая цепь имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 15, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 7 и 3, и легкая цепь имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 16, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6.
В конкретных вариантах осуществления, тяжелая цепь имеет аминокислотную последовательность являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 19, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 8 и 3, и легкая цепь имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 16, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6. В частности, тяжелая цепь имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 19, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 8 и 3, и легкая цепь имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 16, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6.
Антитело включает свои модифицированные формы. Термин "модифицированная форма" антитела означает антитело, снабженное химической или биологической модификацией. Химически модифицированная форма включает форму, имеющую аминокислотный скелет, конъюгированный с химическим фрагментом, форму, имеющую химически модифицированную N-связанную или O-связанную углеводную цепь, и т.п. Указанный химический фрагмент или форма могут являться токсическими или цитотоксическими. Биологически модифицированная форма включают форму, подвергнутую посттрансляционной модификации (например, N-связанному или O-связанному гликозилированию, N-концевому или C-концевому процессингу, дезамидированию, изомеризации аспарагиновой кислоты или окислению метионина), форму, содержащую остаток метионина, добавленный на N-конец посредством экспрессии с использованием прокариотических клеток-хозяев, и т.п. Такая модифицированная форма также предназначена для включения формы, меченой, чтобы сделать возможной детекцию или выделение антитела или антигена, например, меченую ферментом форму, флуоресцентно меченую форму и аффинно меченую форму. Такую модифицированную форму антитела можно использовать в улучшении стабильности или удержания в крови исходного антитела, снижении иммуногенности, детекции или выделении антитела или антигена и т.д.
В частности, антитело может содержать одну или более модификаций, выбранных из группы, состоящей из дефукозилирования, сниженного содержания фукозы, N-связанного гликозилирования, O-связанного гликозилирования, N-концевого процессинга, C-концевого процессинга, дезамидирования, изомеризации аспарагиновой кислоты, окисления метионина, замен двух остатков лейцина (L) аланином (A) в положении 234 и 235 (в соответствии с индексом EU) тяжелой цепи (LALA), амидирования остатка пролина и делеции или отсутствия одной, двух или трех аминокислот на карбоксильном конце. В конкретных вариантах осуществления в антителе отсутствуют одна, две или три карбокси-концевые аминокислоты в одной или обеих тяжелых цепях, или в нем отсутствуют две карбокси-концевые аминокислоты, и карбокси-концевые остатки пролина амидированы в одной или обеих тяжелых цепях.
Такую модификацию можно осуществлять в произвольном положении или желаемом положении антитела. Альтернативно, ту же, или две, или более разных модификаций можно осуществлять в одном, или двух, или более положениях.
Например, известно, что в антителах, продуцируемых культивируемыми клетками млекопитающих, отсутствует карбокси-концевой остаток лизина в тяжелой цепи (Journal of Chromatography A, 705: 129-134 (1995)). Также известно, что иногда отсутствуют 2 карбокси-концевых аминокислотных остатка (т.е. глицин и лизин) тяжелой цепи, и что остаток пролина, теперь локализующийся на карбокси-конце, амидирован (Analytical Biochemistry, 360: 75-83 (2007)). Однако такое отсутствие или модификация в этих последовательностях тяжелой цепи не влияет ни на способность антитела связываться с его антигеном, ни на эффекторные функции (активацию комплемента, антителозависимую цитотоксичность и т.д.) антитела.
В некоторых вариантах осуществления антитело содержит делецию, или в нем отсутствуют, 1 или 2 аминокислоты на карбокси-конце тяжелой цепи и имеет амидированный остаток (например, амидированный остаток пролина в карбокси-концевом участке тяжелой цепи). Однако антитело не ограничено описанными выше типами при условии, что мутант с делецией сохраняет способность к связыванию с антигеном.
В некоторых вариантах осуществления две тяжелые цепи антитела могут состоять из любого типа тяжелой цепи, выбранного из группы, состоящей из полноразмерных тяжелых цепей и тяжелых цепей мутанта с делецией, или могут состоять из комбинации любых двух выбранных типов. Количественное соотношение тяжелых цепей варианта с делецией зависит от типа культивируемых клеток млекопитающих, продуцирующих антитело, и условий культивирования клеток.
В конкретных вариантах осуществления антитело может включать две тяжелые цепи, в обеих из которых отсутствует один карбокси-концевой аминокислотный остаток.
В конкретных вариантах осуществления антитело содержит тяжелую цепь, имеющую аминокислотную последовательность, представленную аминокислотами 1-446 SEQ ID NO: 15 или 22, и легкую цепь, имеющую аминокислотную последовательность, представленную аминокислотами 1-219 SEQ ID NO: 16. В некоторых вариантах осуществления аминокислота в положении 57 SEQ ID NO: 15 выбрана из группы, состоящей из глутамина, аланина, валина, гистидина, триптофана, тирозина, лизина и аргинина; в частности, глутамина, гистидина, триптофана, тирозина, лизина и аргинина. Предпочтительно, аминокислота в положении 57 SEQ ID NO: 15 является глутамином, гистидином, триптофаном, лизином или аргинином, в частности, глутамином.
В конкретных вариантах осуществления антитело содержит тяжелую цепь, имеющую аминокислотную последовательность, представленную аминокислотами 1-446 SEQ ID NO: 19, и легкую цепь, имеющую аминокислотную последовательность, представленную аминокислотами 1-219 SEQ ID NO: 16.
В некоторых вариантах осуществления антитело конкурирует за связывание с TA-MUC1 с антителом, содержащим вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 10, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 12, или антителом, содержащим вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 11, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 12.
В некоторых вариантах осуществления антитело имеет следующие свойства: (a) специфически связывается с MUC1 и/или(b) имеет активность, интернализуясь в MUC1-экспрессирующие клетки посредством связывания с MUC1.
В некоторых вариантах осуществления антитело содержит по меньшей мере одну тяжелую цепь антитела. В частности, антитело содержит две тяжелые цепи антитела. Тяжелые цепи антитела, в частности, содержат домен VH, домен CH1, шарнирную область, домен CH2 и домен CH3. В некоторых других вариантах осуществления тяжелые цепи антитела содержат домен CH2 и домен CH3, но не содержат домен CH1. В дополнительных вариантах осуществления один или более константных домена тяжелых цепей можно заменять другими доменами, в частности, схожими доменами, такими как, например, альбумин. Тяжелые цепи антитела могут быть любого типа, включая γ-, α-, ε-, δ- и μ-цепи, и предпочтительно являются γ-цепями, включая γ1-, γ2-, γ3- и γ4-цепи, в частности, γ1-цепи. Таким образом, антитело, предпочтительно, является антителом IgG-типа, таким как антитело IgG1-, IgG3- или IgG4-типа, в частности, антитело IgG1-типа.
В частности, антитело дополнительно содержит по меньшей мере одну легкую цепь антитела, в частности, две легкие цепи антитела. Легкие цепи антитела, в частности, содержат домен VL и домен CL. Легкая цепь антитела может являться κ-цепью или λ-цепью и, в частности, является κ-цепью.
В некоторых вариантах осуществления антитело содержит две тяжелые цепи антитела и две легкие цепи антитела. В частности, антитело содержит две тяжелые цепи антитела γ1-типа, каждая из которых содержит домен VH, домен CH1, шарнирную область, домен CH2 и домен CH3, и две легкие цепи антитела κ-типа, каждая из которых содержит домен VL и домен CL.
В альтернативных вариантах осуществления антитело не содержит легкую цепь антитела. В этих вариантах осуществления вариабельную область легкой цепи можно подвергать слиянию с N-концом вариабельной области тяжелой цепи или встраивать C-конец в вариабельную область тяжелой цепи. Для соединения вариабельной области легкой цепи с остальными частями тяжелой цепи можно использовать пептидные линкеры.
В предпочтительных вариантах осуществления антитело содержит Fc-область. Антитело, в частности, может являться целым антителом, содержащим две тяжелые цепи, каждая из которых содержит домены VH, CH1, шарнирную область, CH2 и CH3, и две легкие цепи, каждая из которых содержит домены VL и CL. Антитело, в частности, способно связываться с одним или более Fcγ-рецепторами человека, в частности, Fcγ-рецептором IIIA человека. В альтернативных вариантах осуществления антитело не связывается или незначительно связывается с Fcγ-рецептором IIIA человека и, в частности, не связывается или незначительно связывается с любым Fcγ-рецептором человека. В этих вариантах осуществления антитело, в частности, не содержит участок гликозилирования в домене CH2.
В альтернативных вариантах осуществления антитело не содержит Fc-область. В этих вариантах осуществления антитело, в частности, является одноцепочечным фрагментом вариабельной области (scFv) или другим фрагментом антитела, несодержащим Fc-область.
Гликозилирование антитела против MUC1
Антитело против MUC1 может содержать домен CH2 в одной или более тяжелых цепях антитела. Природные антитела человека IgG-типа содержат участок N-гликозилирования в домене CH2. Домены CH2, присутствующие в антителе, могут содержать или не содержать участок N-гликозилирования. В некоторых вариантах осуществления антитело не содержит участок гликозилирования в домене CH2. В частности, антитело не содержит остаток аспарагина в положении тяжелой цепи, соответствующем положению 297 по системе нумерации IMGT/Eu. Например, антитело может содержать мутацию Ala297 в тяжелой цепи. В этих вариантах осуществления антитело, предпочтительно, имеет значительно сниженную способность, или у нее полностью отсутствует способность индуцировать через связывание с Fcγ-рецепторами антителозависимую клеточную цитотоксичность (ADCC), и/или антителозависимый клеточный фагоцитоз (ADCP), и/или комплементзависимую цитотоксичность (CDC). В этом смысле термин "значительно сниженная способность", в частности, относится к снижению до 10% или менее, в частности, 3% или менее, 1% или менее или 0,1% или менее активности по сравнению с тем же антителом, содержащим участок N-гликозилирования в доменах CH2 и имеющим общий профиль гликозилирования млекопитающих, такой как профиль, достигаемый посредством получения в линиях клеток человека или линиях клеток CHO, например, профиль гликозилирования, представленный в настоящем описании. В этих вариантах осуществления антитело, в частности, является антителом IgG1-типа.
В альтернативных вариантах осуществления домены CH2, присутствующие в антителе, содержат участок N-гликозилирования. Этот участок гликозилирования, в частности, находится в положении аминокислоты, соответствующем положению аминокислоты 297 тяжелой цепи по системе нумерации IMGT/Eu, и имеет мотив аминокислотной последовательности AsnXaaSer/Thr, где Xaa может являться любой аминокислотой, за исключением пролина. N-связанное гликозилирование в Asn297 является консервативным в IgG млекопитающих, а также в гомологичных областях других изотипов антител. Из-за необязательных дополнительных аминокислот, которые могут присутствовать в вариабельной области, или других модификаций последовательности конкретное положение этого консервативного участка гликозилирования может варьироваться в аминокислотной последовательности антитела. Предпочтительно, гликаны, присоединенные к антителу, являются биантеннарными N-связанными углеводными структурами комплексного типа, предпочтительно, содержащими по меньшей мере следующую структуру:
Asn - GlcNAc - GlcNAc - Man - (Man - GlcNAc)2
где Asn является остатком аспарагина полипептидной части антитела; GlcNAc является N-ацетилглюкозамином, и Man является маннозой. Концевые остатки GlcNAc могут дополнительно нести остаток галактозы, который, необязательно, может нести остаток сиаловой кислоты. Дополнительный остаток GlcNAc (обозначенный как GlcNAc в точке ветвления) можно присоединять к Man, ближайшей к полипептиду. Фукозу можно связывать с GlcNAc, присоединенному к Asn. В этих вариантах осуществления антитело, в частности, является антителом IgG1-типа.
В предпочтительных вариантах осуществления антитело не содержит N-гликолилинейраминовые кислоты (NeuGc) или детектируемые количества NeuGc. Кроме того, антитело предпочтительно также не содержит эпитопы Galili (структуры Galα1,3-Gal) или детектируемые количества эпитопа Galili. В частности, относительное количество гликанов, несущих NeuGc и/или структуры Galα1,3-Gal, составляет менее 0,1% или даже менее 0,02% от общего количества гликанов, присоединенных к доменам CH2 антител в популяции антител.
В частности, антитело имеет профиль гликозилирования человека. Из-за этих свойств гликозилирования, чужеродные иммуногенные не принадлежащий человеку структуры, вызывающие побочные эффекты, отсутствуют, что означает, что избегают нежелательных побочных эффектов или недостатков, как известно, вызываемых некоторыми чужеродными структурами сахаров, такими как иммуногенные, не принадлежащие человеку сиаловые кислоты (NeuGc) или эпитоп Galili (структуры Gal-Gal), известными в случае систем продукции на основе грызунов, или другими структурами, подобными иммуногенным высокоманнозным структурам, известным, например, в случае дрожжевых систем.
В конкретных вариантах осуществления антитело содержит профиль гликозилирования, имеющий детектируемое количество гликанов, несущих остаток GlcNAc в точке ветвления. В частности, относительное количество гликанов, несущих остаток GlcNAc в точке ветвления, составляет по меньшей мере 0,5%, в частности, по меньшей мере 1% общего количества гликанов, присоединенных к участкам гликозилирования антитела в композиции. Кроме того, в определенных вариантах осуществления профиль гликозилирования содержит относительное количество гликанов, несущих по меньшей мере один остаток галактозы, по меньшей мере 25% общего количества гликанов, присоединенных к антителу в композиции. В частности, относительное количество гликанов, несущих по меньшей мере один остаток галактозы, составляет по меньшей мере 30%, в частности, по меньшей мере 35% или по меньшей мере 40% общего количества гликанов, присоединенных к антителу в композиции. В конкретных вариантах осуществления профиль гликозилирования содержит относительное количество гликанов, несущих по меньшей мере один остаток сиаловой кислоты, по меньшей мере 1% общего количества гликанов, присоединенных к антителу в композиции. В частности, относительное количество гликанов, несущих по меньшей мере один остаток сиаловой кислоты, составляет по меньшей мере 1,5%, в частности, по меньшей мере 2% общего количества гликанов, присоединенных к антителу в композиции.
Антитело может иметь профиль гликозилирования, имеющий высокое количество коровой фукозы или низкое количество коровой фукозы. Сниженная степень фукозилирования повышает способность антитела индуцировать ADCC. В некоторых вариантах осуществления относительное количество гликанов, несущих коровый остаток фукозы, составляет 40% или менее, в частности, 30% или менее или 20% или менее от общего количества гликанов, присоединенных к антителу в композиции. В альтернативных вариантах осуществления относительное количество гликанов, несущих коровый остаток фукозы, составляет по меньшей мере 60%, в частности, по меньшей мере 65% или по меньшей мере 70% общего количества гликанов, присоединенных к антителу в композиции.
Способность антитела индуцировать ADCC и силу указанной индукции ADCC можно контролировать Благодаря наличию или отсутствию участка гликозилирования в домене CH2 антитела против MUC1 и наличию или отсутствию фукозы в гликановых структурах в указанном участке гликозилирования. Активность ADCC повышают посредством гликозилирования Fc-части антитела и дополнительно посредством снижения степени фукозилирования в указанном гликозилировании. В некоторых случаях важна точная настройка активности ADCC. Таким образом, в некоторых случаях антитело без участка гликозилирования в домене CH2, антитело с участком гликозилирования в домене CH2 и с высокой степенью фукозилирования или антитело с участком гликозилирования в домене CH2 и с низкой степенью фукозилирования могут являться наиболее предпочтительными.
Получение антитела против MUC1
Предпочтительно, антитело рекомбинантно получают в клетке-хозяине. Клетка-хозяин, используемая для получения антитела, может представлять собой любые клетки-хозяева, которые можно использовать для получения антител. Подходящие клетки-хозяева, в частности, являются эукариотическими клетками-хозяевами, в частности, клетками-хозяевами млекопитающих. Примеры клеток-хозяев включают дрожжевые клетки, такие как линии клеток Pichia pastoris, клетки насекомых, такие как линии клеток SF9 и SF21, растительные клетки, клетки птиц, такие как линии клеток утки EB66, клетки грызунов, такие как линии клеток CHO, NS0, SP2/0 и YB2/0, и клетки человека, такие как линии клеток HEK293, PER.C6, CAP, CAP-T, AGE1.HN, Mutz-3 и KG1.
В некоторых вариантах осуществления антитело получают рекомбинантно в линии клеток крови человека, в частности, линии клеток миелолейкоза человека. Предпочтительные линии клеток человека, которые можно использовать для получения антитела, а также подходящие способы получения описаны в WO 2008/028686 A2. В конкретном варианте осуществления антитело получают посредством экспрессии в линии клеток миелолейкоза человека, выбранной из группы, состоящей из NM-H9D8, NM-H9D8-E6 и NM-H9D8-E6Q12 и линий клеток, полученных из них. Эти линии клеток депонированы под регистрационными номерами DSM ACC2806 (NM-H9D8; депонируемая на 15 сентября 2006 года), DSM ACC2807 (NM-H9D8-E6; депонируемая на 5 октября 2006 года) и DSM ACC2856 (NM-H9D8-E6Q12; депонируемая на 8 августа 2007 года) в соответствии с требованиями Будапештского договора в Deutsche Sammlung von Mikroorganismen und Zellkulturen (DSMZ), Inhoffenstraβe 7B, 38124 Braunschweig (DE) от лица Glycotope GmbH, Robert-Rössle-Str. 10, 13125 Berlin (DE). Клетки NM-H9D8 обеспечивают профиль гликозилирования с высокой степенью сиалирования, высоким количеством GlycNAc в точке ветвления, высокой степенью галактозилирования и высокой степенью фукозилирования. Клетки NM-H9D8-E6 и NM-H9D8-E6Q12 обеспечивают профиль гликозилирования, схожий с таковым у клеток NM-H9D8, за исключением того, что степень фукозилирования является очень низкой. Другие подходящие линии клеток включают K562, линию клеток миелолейкоза человека, находящуюся в American Type Culture Collection (ATCC CCL-243), а также линии клеток, полученные из указанных выше клеток.
В дополнительных вариантах осуществления антитело получают рекомбинантно в клетках CHO. В частности, антитело можно получать рекомбинантно в линии клеток CHO dhfr-, такой как линия клеток ATCC № CRL-9096.
Конъюгаты антитела против MUC1
В рамках изобретения антитело конъюгируют с одним или более цитотоксическими средствами. Цитотоксическое средство может являться любым средством, подходящим для конъюгации с антителом. Если в антителе присутствует более одного цитотоксического средства, эти цитотоксические средства могут являться идентичными или другими, и, в частности, все они являются идентичными. Конъюгацию цитотоксического средства с антителом можно осуществлять любыми известными в этой области способами. Цитотоксическое средство можно присоединять к антителу ковалентно, в частности, посредством слияния или химического сопряжения, или нековалентно. В некоторых вариантах осуществления цитотоксическое средство ковалентно присоединяют к антителу, в частности, через линкерный фрагмент. Линкерный фрагмент может являться любым химическим веществом, подходящим для присоединения цитотоксического средства к антителу.
В дополнение к цитотоксическому средству, конъюгат по изобретению может дополнительно содержать дополнительное средство, конъюгированное с ним. Дополнительное средство, предпочтительно, можно использовать в терапии, диагностике, прогнозировании и/или мониторинге заболевания, в частности, злокачественного новообразования. Например, дополнительное средство может быть выбрано из группы, состоящей из радионуклидов, химиотерапевтических средств, антител или фрагментов антител, в частности, имеющих иную специфичность, чем антитело против MUC1, например, антитела против контрольных точек, блокирующие или активирующие иммуномодулирующие мишени, ферментов, доменов взаимодействия, детектируемых меток, токсинов, цитолитических компонентов, иммуномодуляторов, иммуноэффекторов, антигенов MHC класса I или класса II и липосом.
Конкретным предпочтительным цитотоксическим средством является радионуклид или цитотоксическое средство, способное уничтожать злокачественные клетки, такое как химиотерапевтическое средство. В некоторых предпочтительных вариантах осуществления химиотерапевтическое средство присоединяют к антителу против MUC1, получая конъюгат. Химиотерапевтическое средство конкретно не ограничено, при условии, что соединение имеет противоопухолевый и имеет заместитель или частичную структуру, которую можно соединять с линкерной структурой. После расщепления части или всего линкера в опухолевых клетках, химиотерапевтическое средство или фрагмент противоопухолевого соединения высвобождается таким образом, что химиотерапевтическое средство демонстрирует противоопухолевый эффект. Когда линкер отщепляется в положении соединения от средства, химиотерапевтическое средство высвобождается в своей исходной структуре, проявляя свой исходный противоопухолевый эффект.
Конкретные примеры химиотерапевтических средств, которые можно конъюгировать в качестве цитотоксического средства, включают алкилирующие средства, такие как цисплатин, антиметаболиты, растительные алкалоиды и терпеноиды, алкалоиды барвинка, подофиллотоксин, таксаны, такие как таксол, ингибиторы топоизомеразы, такие как иринотекан и топотекан, антинеопластические средства, такие как доксорубицин, или ингибиторы микротрубочек, такие как майтанзин/майтанзиноиды
Химиотерапевтическое средство, в частности, можно выбирать из группы, состоящей из ингибитора V-АТФазы, проапоптотического средства, ингибитора Bcl2, ингибитора MCL1, ингибитора HSP90, ингибитора IAP, ингибитора mTor, стабилизатора микротрубочек, дестабилизатора микротрубочек, доластатина, майтанзина, майтанзиноида, аматоксина, метионинаминопептидазы, ингибитора ядерного экспорта белков CRM1, ингибитора DPPIV, ингибиторов протеасом, ингибиторов реакций переноса фосфорила в митохондриях, ингибитора белкового синтеза, ингибитора киназ, ингибитора CDK2, ингибитора CDK9, ингибитора кинезина, ингибитора HDAC, ингибитора топоизомеразы I, ДНК-повреждающего средства, ДНК-алкилирующего средства, ДНК-интеркалятора, средства, связывающегося с малой бороздкой ДНК, ингибитора DHFR, ингибитора образования микротрубочек, стабилизатора микротрубочек, стабилизатора актина, ингибитора топоизомеразы II, соединения платины, ингибитора рибосом, ингибитора РНК-полимеразы II и бактериального токсина. В конкретных вариантах осуществления, химиотерапевтическое средство, присоединенное к антителу против MUC1, выбрано из группы, состоящей из ингибитора микротрубочек, такого как майтанзиноид, ингибитора топоизомеразы I, ДНК-повреждающего средства, ДНК-алкилирующего средства и средства, связывающегося с малой бороздкой ДНК.
В некоторых вариантах осуществления химиотерапевтическое средство является майтанзином или майтанзиноидом. Конкретные примеры майтанзиноидов, которые можно использовать для конъюгации, включают майтанзинол, N2'-деацетил-N2'-(3-меркапто-1-оксопропил)-майтанзин (DM1), N2'-деацетил-N2'-(4-меркапто-1-оксопентил)-майтанзин (DM3), и N2'-деацетил-N2'-(4-метил-4-меркапто-1-оксопентил)-майтанзин (DM4). В частности, к антителу против MUC1 присоединяют DM1 или DM4. В некоторых вариантах осуществления химиотерапевтическое средство, присоединенное к антителу против MUC1, является средством, связывающимся с малой бороздкой ДНК, в частности, пирролобензодиазепином (PBD), димером пирролобензодиазепина (димером PBD), дуокармицином, дуокармицин-гидроксибензамид-азаиндолом (DUBA), секо-дуокармицин-гидроксибензамид-азаиндолом (секо-DUBA) или доксорубицином. В некоторых вариантах осуществления химиотерапевтическое средство, присоединенное к антителу против MUC1, является ДНК-алкилирующим средством, в частности, индолинобензодиазепином или оксазолидинобензодиазепином. В некоторых вариантах осуществления химиотерапевтическое средство, присоединенное к антителу против MUC1, является ДНК-повреждающим средством, в частности, калихимицином. В некоторых вариантах осуществления химиотерапевтическое средство, присоединенное к антителу против MUC1, является ингибитором топоизомеразы I, в частности, камптотецином и его производными, такими как 7-этил-10-гидрокси-камптотецин (SN-38), (S)-9-диметиламинометил-10-гидроксикамптотецин (топотекан), (1S,9S)-1-амино-9-этил-5-фтор-1,2,3,9,12,15-гексагидро-9-гидрокси-4-метил-10H,13H-бензо[де]пирано [3',4':6,7]индолизино[1,2-b]хинолин-10,13-дион (экзатекан (DX-8951))и N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]-2-гидроксиацетамид (DXd). В некоторых вариантах осуществления химиотерапевтическое средство, присоединенное к антителу против MUC1, является ингибитором образования микротрубочек, в частности, тубулизином, ансамитоцином, подофиллотоксином или винбластином. В некоторых вариантах осуществления химиотерапевтическое средство, присоединенное к антителу против MUC1, является стабилизатором микротрубочек, в частности, паклитакселом или эпотилоном. В некоторых вариантах осуществления химиотерапевтическое средство, присоединенное к антителу против MUC1, является стабилизатором актина, в частности, фаллотоксином. В некоторых вариантах осуществления химиотерапевтическое средство, присоединенное к антителу против MUC1, является ингибитором топоизомеразы II, в частности, тенипозидом, XK469, разоксаном, амсакрином, идарубицином или мебароном. В некоторых вариантах осуществления химиотерапевтическое средство, присоединенное к антителу против MUC1, является соединением платины, в частности, цисплатином, карбоплатином, оксалиплатином, недаплатином, триплатина тетранитратом, фенантриплатином, пикоплатином или саттраплатином. В некоторых вариантах осуществления химиотерапевтическое средство, присоединенное к антителу против MUC1, является ингибитором рибосом, в частности, рицином, сапорином, абрином, дифтерийным токсином или экзотоксином A. В некоторых вариантах осуществления химиотерапевтическое средство, присоединенное к антителу против MUC1, является ингибитором РНК-полимеразы II, в частности, аматоксином, таким как, например, аманитин. В некоторых вариантах осуществления химиотерапевтическое средство, присоединенное к антителу против MUC1, является бактериальным токсином, в частности, токсином сибирской язвы. Подходящие конъюгаты антитела и лекарственного средства также описаны в EP 16 151 774.3 и LU 92659, включенных в настоящее описание в качестве ссылки.
В предпочтительных вариантах осуществления химиотерапевтическое средство является (1S,9S)-1-амино-9-этил-5-фтор-1,2,3,9,12,15-гексагидро-9-гидрокси-4-метил-10H,13H-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13-дионом (экзатеканом (DX-8951)) или DXd.
Экзатекан(DX-8951) является противоопухолевым соединением, представленным следующей формулой:
[Формула 1]
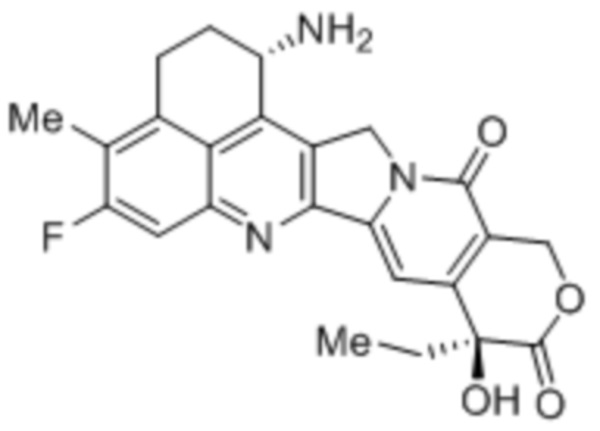
Соединения легко можно получать, например, способом, описанным в патентной публикации США № US2016/0297890 или другими известными способами, и аминогруппу в положении 1, предпочтительно, можно использовать в качестве положения соединения с линкерной структурой. Кроме того, экзатекан может высвобождаться в опухолевых клетках, хотя часть линкера все еще присоединена к нему. Однако, соединение проявляет исключительный противоопухолевый эффект даже в таком состоянии.
DXd является соединением, представленным следующей формулой:
[Формула 2]
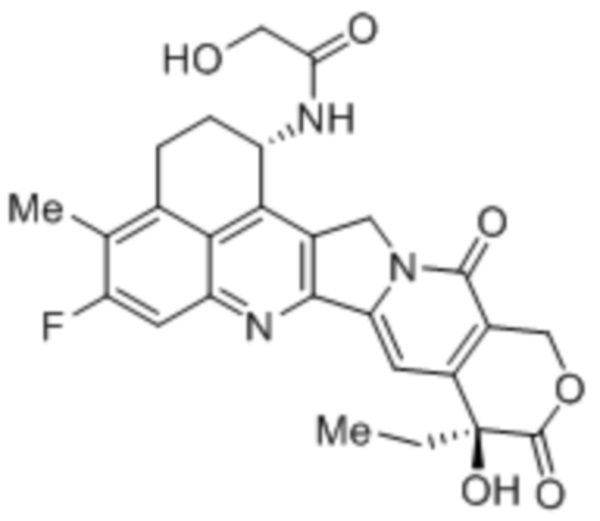
Т.к. экзатекан или DXd имеют структуру камптотецина, известно, что равновесие сдвигается в сторону структуры с образованным лактонным кольцом (замкнутым кольцом) в кислой водной среде (например, порядка pH 3), в то время как равновесие сдвигается в сторону структуры с незамкнутым лактонным кольцом (незамкнутое кольцо) в основной водной среде (например, порядка pH 10). Также ожидают, что конъюгат лекарственного средства, в который включают остатки экзатекана, соответствующие такой замкнутой кольцевой структуре и открытой кольцевой структуре, будет иметь эквивалентный противоопухолевый эффект, и разумеется, любой из такие конъюгатов лекарственных средств входит в объем настоящего изобретения. В некоторых вариантах осуществления дополнительное средство является полипептидом или белком. Этот полипептид или белок, в частности, можно подвергать слиянию с полипептидной цепью антитела. В некоторых вариантах осуществления дополнительное средство, являющееся полипептидом или белком, подвергают слиянию с C-концом легкой цепи антитела. В вариантах осуществления, где антитело содержит две легкие цепи антитела, дополнительное средство, являющееся полипептидом или белком, можно подвергать слиянию с C-концом каждой из двух легких цепей антитела. В дополнительных вариантах осуществления дополнительное средство, являющееся полипептидом или белком, подвергают слиянию с C-концом тяжелой цепи антитела. В вариантах осуществления, где антитело содержит две тяжелые цепи антитела, дополнительное средство, являющееся полипептидом или белком, можно подвергать слиянию с C-концом каждой из двух тяжелых цепей антитела. Дополнительные средства могут являться идентичными или отличаться и, в частности, иметь одинаковую аминокислотную последовательность. Подходящие примеры таких дополнительных средств, являющихся полипептидом или белком, можно выбирать из группы, состоящей из цитокинов, хемокинов, антител, антигенсвязывающих фрагментов, ферментов и доменов взаимодействия.
В некоторых вариантах осуществления дополнительное средство, являющееся полипептидом или белком, является антителом против контрольных точек, блокирующим и/или запускающим активирующие сигналы. Примеры соответствующих мишеней включают CD40, CD3, CD137 (4-1BB), OX40, GITR, CD27, CD278 (ICOS), CD154 (лиганд CD40), CD270 (HVEM) и CD258 (LIGHT) в качестве активирующих мишеней, CTLA4, PD1, CD80, CD244, A2AR, B7-H3 (CD276), B7-H4 (VTCN1), BTLA, IDO, KIR, LAG3, TIM-3, VISTA и фосфатидилсерин в качестве ингибиторных мишеней, и их соответствующие лиганды, такие как PDL1. В конкретных примерах антитело против MUC1 содержит две тяжелые цепи и две легкие цепи, как представлено в настоящем описании, где фрагмент scFv, специфически связывающийся с CD3, подвергают слиянию с C-концом каждой тяжелой цепи; или где фрагмент scFv, специфически связывающийся с PDL1, подвергают слиянию с C-концом каждой легкой цепи.
В дополнительных вариантах осуществления дополнительное средство, являющееся полипептидом или белком, является иммуномодулирующим соединением, таким как хемокин, цитокин или фактор роста. Подходящие цитокины включают интерфероны, такие как интерферон-α, интерферон-β и интерферон-γ, и интерлейкины. Подходящие факторы роста включают Г-КСФ и ГМ-КСФ.
Конкретные примеры линкеров включает структуры, представленные следующими формулами (a)-(f):
(a) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
(b) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
(c) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
(d) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
(e) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-, и
(f) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-, где -(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
[Формула 3]
В конкретных вариантах осуществления линкеры содержат структуры, представленные следующими формулами (a)-(c):
(a) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
(b) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-, и
(c) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
В предпочтительных вариантах осуществления линкеры содержат структуру, представленную следующей формулой (a):
(a) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
В альтернативном варианте осуществления конъюгат содержит структуру лекарственное средство-линкер, представленную следующей формулой, где антитело конъюгируют со структурой лекарственное средство-линкер, представленной следующей формулой с помощью тиоэфирной связи, символом "*" указана точка соединения с антителом:
[Формула 4]
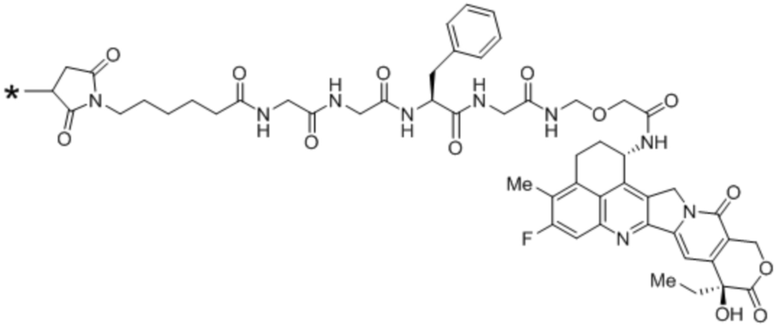
В предпочтительном варианте осуществления конъюгат содержит структуру лекарственное средство-линкер, представленную следующей формулой,
[Формула 5]
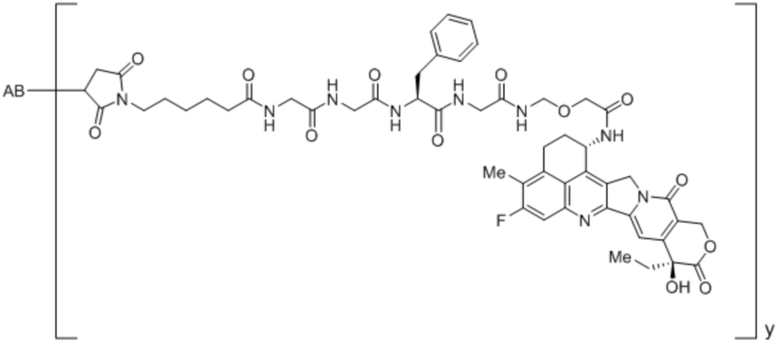
где AB представляет собой антитело, y представляет собой среднее количество единиц структуры лекарственное средство-линкер, конъюгированной с антителом, на антитело, антитело конъюгируют со структурой лекарственное средство-линкер, представленной указанной выше формулой, посредством тиоэфирной связи, и антитело представляет собой указанное выше антитело против MUC1, предпочтительно, антитело, являющееся любой из следующих комбинаций a)-d) вариабельной области тяжелой цепи и вариабельной области легкой цепи или тяжелой цепи и легкой цепи:
(a) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 10, и вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 12,
(b) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 11, и вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 12,
(c) тяжелая цепь имеет аминокислотную последовательность SEQ ID NO: 15, и легкая цепь имеет аминокислотную последовательность SEQ ID NO: 16, и
(d) тяжелая цепь имеет аминокислотную последовательность SEQ ID NO: 19, и легкая цепь имеет аминокислотную последовательность SEQ ID NO: 16:
В указанных выше конъюгатах количество конъюгированных молекул лекарственного средства (или цитотоксического средства) на молекулу антитела является ключевым фактором, влияющим на его эффективность и безопасность. Получение конъюгата антитело-лекарственное средство (или конъюгатов) осуществляют, устанавливая условия реакции, такие как количества исходных материалов и реагентов, используемых для реакции, таким образом, чтобы достичь постоянного количества конъюгированных молекул лекарственного средства. В отличие от химической реакции низкомолекулярного соединения, как правило, получают смесь, содержащую разные количества конъюгированных молекул лекарственного средства. Количество конъюгированных молекул лекарственного средства на молекулу антитела определяют и указывают как среднее значение, т.е. среднее количество конъюгированных молекул лекарственного средства. Если не указано иначе, т.е. за исключением случая конъюгата антитело-лекарственное средство, имеющего конкретное количество конъюгированных молекул лекарственного средства, включенных в смесь конъюгатов антитело-лекарственное средство, имеющих разные количества конъюгированных молекул лекарственного средства, количество конъюгированных молекул лекарственного средства по настоящему изобретению также, как правило, означает среднее значение. Количество молекул экзатекана или DXd, конъюгированных с молекулой антитела, является контролируемым, и в качестве среднего количества конъюгированных молекул лекарственного средства на антитело можно конъюгировать приблизительно от 1 до 10 молекул экзатекана или от 1 до 10 DXd. Количество молекул экзатекана или DXd, предпочтительно, составляет от 2 до 8, более предпочтительно - от 4 до 8, более предпочтительно - от 7 до 8, и еще более предпочтительно - 8. Следует отметить, что специалист в этой области может создавать реакцию для конъюгации необходимого количества молекул лекарственного средства с молекулой антитела с учетом описания примеров в настоящей заявке и может получать конъюгат антитело-лекарственное средство с контролируемым количеством конъюгированных молекул экзатекана.
В указанном выше предпочтительном варианте осуществления после переноса конъюгатов внутрь опухолевых клеток линкерный фрагмент расщепляется, затем DXd высвобождается, проявляя противоопухолевый эффект (Clinical Cancer Research, 2016, Oct 15;22(20):5097-5108, Epub 2016 Mar 29).
Конъюгат, меченый различными радиоактивными или нерадиоактивными изотопами, также включен в настоящее изобретение. Один или более атомов, составляющих конъюгат по настоящему изобретению, может содержать изотоп атома с неприродным соотношением. Примеры изотопа атома включают дейтерий (2H), тритий (3H), йод-125 (125I) и углерод-14 (14C). Кроме того, конъюгат можно радиоактивно метить радиоактивным изотопом, таким как тритий (3H), йод-125 (125I), углерод-14 (14C), медь 64 (64Cu), цирконий-89 (89Zr), йод-124 (124I), фтор-18 (18F), индий-111 (111In), углерод-11 (11C) и йод-131 (131I). Конъюгат, меченый радиоактивным изотопом, можно использовать в качестве терапевтического или профилактического средства, реагента для исследований, такого как реагент для анализа, и средства диагностики, такого как средства для диагностической визуализации in vivo. Безотносительно радиоактивности, любой тип изотопного варианта конъюгата входит в объем настоящего изобретения.
Нуклеиновая кислота, экспрессионная кассета, вектор, линия клеток и композиция
Антительная часть конъюгата по настоящему изобретению может кодироваться нуклеиновой кислотой. Последовательность указанной нуклеиновой кислоты может иметь любую нуклеотидную последовательность, подходящую для кодирования антитела. Однако, предпочтительно, последовательность нуклеиновой кислоты по меньшей мере частично адаптирована к конкретному использованию кодонов в клетках-хозяевах или организме, в котором будут экспрессировать нуклеиновую кислоту, в частности, использованию кодонов в организме человека. Нуклеиновая кислота может являться двухцепочечной или одноцепочечной ДНК или РНК, предпочтительно - двухцепочечной ДНК, такой как кДНК или одноцепочечная РНК, такая как мРНК. Она может являться одной последовательной молекулой нуклеиновой кислоты или может состоять из нескольких молекул нуклеиновой кислоты, каждая из которых кодирует другую часть антитела. Нуклеотидная последовательность тяжелой цепи варианта PankoMab (PM-N54Q) может быть представлена SEQ ID NO: 17, и нуклеотидная последовательность легкой цепи варианта PankoMab (PM-N54Q) может быть представлена SEQ ID NO: 18.
Если антитело состоит из нескольких разных аминокислотных цепей, таких как легкая цепь и тяжелая цепь антитела, нуклеиновая кислота, например, может являться единой молекулой нуклеиновой кислоты, содержащей несколько кодирующих областей, каждая из которых кодирует одну из аминокислотных цепей антитела, предпочтительно, разделенных регуляторными элементами, такими как элементы IRES, для получения отдельных аминокислотных цепей, или нуклеиновая кислота может состоять из нескольких молекул нуклеиновой кислоты, где каждая молекула нуклеиновой кислоты содержит одну или более кодирующих областей, каждая из которых кодирует одну из аминокислотных цепей антитела. В дополнение к кодирующим областям, кодирующим антитело, нуклеиновая кислота также может содержать дополнительные последовательности нуклеиновой кислоты или другие модификации, которые, например, могут кодировать другие белки, могут влиять на транскрипцию и/или трансляцию кодирующих областей, могут влиять на стабильность или другие физические или химические свойства нуклеиновой кислоты, или вообще могут не иметь функции.
Экспрессионная кассета или вектор может содержать нуклеиновую кислоту и промотор, функционально связанный с указанной нуклеиновой кислотой. Кроме того, экспрессионная кассета или вектор может содержать дополнительные элементы, в частности, элементы, которые могут влиять на транскрипцию и/или трансляцию нуклеиновой кислоты, амплификацию и/или воспроизведение экспрессионной кассеты или вектора, интеграцию экспрессионной кассеты или вектора в геном клетки-хозяина и/или количество копий экспрессионной кассеты или вектора в клетке-хозяине и/или регулировать их. Подходящие экспрессионные кассеты и векторы, содержащие соответствующие экспрессионные кассеты для экспрессии антител, хорошо известны на современном уровне техники и, таким образом, не требуют дополнительного обсуждения в настоящем описании.
Клетка-хозяин может содержать нуклеиновую кислоту или экспрессионную кассету или вектор. Клетка-хозяин может являться любой клеткой-хозяином. Она может являться выделенной клеткой или клеткой, содержащейся в ткани. Предпочтительно, клетка-хозяин является культивируемой клеткой, в частности, первичной клеткой или клеткой стабильной линии клеток, предпочтительно, клеткой, полученной из опухоли. Предпочтительно, она является бактериальной клеткой, такой как E. coli, дрожжевой клеткой, такой как клетка Saccharomyces, в частности, S. cerevisiae, клеткой насекомого, такой как клетка Sf9, или клеткой млекопитающего, в частности, клеткой человека, такой как полученная из опухоли клетка человека, клеткой хомяка, такой как CHO, или клетками приматов. В предпочтительном варианте осуществления клетку-хозяина получают из клеток миелолейкоза человека. Предпочтительно, она выбрана из следующих клеток или линий клеток: K562, KG1, MUTZ-3 или клеток или линии клеток, полученных их них, или смеси клеток или линий клеток, включающих по меньшей мере одну из указанных выше клеток. Клетка-хозяин, предпочтительно, выбрана из группы, состоящей из NM-H9D8, NM-H9D8-E6, NM H9D8-E6Q12 и клетки или линии клеток, полученных из указанных клеток-хозяев. Эти линии клеток и их свойства подробно описаны в заявке PCT WO 2008/028686 A2. В дополнительных вариантах осуществления клетка-хозяин является клеткой линии CHO dhfr-, такой как линия клеток с ATCC № CRL-9096. В предпочтительных вариантах осуществления клетку-хозяина оптимизируют для экспрессии гликопротеинов, в частности, антител, имеющих конкретный профиль гликозилирования. Предпочтительно, использование кодонов в кодирующей области нуклеиновой кислоты и/или промотор и дополнительные элементы экспрессионной кассеты или вектора совместимы и, более предпочтительно, оптимизированы для используемого типа клетки-хозяина. Предпочтительно, антитело продуцируется клеткой-хозяином или линией клеток, как описано выше.
В способе получения антитела можно использовать клетки-хозяева, как представлено в настоящем описании. Способ, в частности, включает стадии получения клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, культивирования клетки-хозяина в условиях, подходящих для экспрессии антитела, и получения антитела, экспрессируемого клеткой-хозяином. Антитело, представленное в настоящем описании, можно получать указанным способом.
В другом аспекте настоящее изобретение относится к композиции, содержащей конъюгат по изобретению. Кроме того, композиция может содержать один или более дополнительных компонентов, выбранных из группы, состоящей из растворителей, дилюентов и эксципиентов. Предпочтительно, композиция является фармацевтической композицией. В этом варианте осуществления все компоненты композиции, предпочтительно, являются фармацевтически приемлемыми. Композиция может являться твердой или жидкой композицией, в частности, предпочтительно, водной - раствором, эмульсией или суспензией, или лиофилизированным порошком.
Применение в медицине
Конъюгат, в частности, можно использовать в медицине, в частности, в терапии, диагностике, прогнозировании, детекции и/или мониторинге заболевания, в частности, заболевания, представленного в настоящем описании, предпочтительно - злокачественного новообразования, инфекций, воспалительных заболеваний, реакции "трансплантат против хозяина" и иммунодефицитов.
Таким образом, в дополнительном аспекте изобретение относится к конъюгату или композиции для применения в медицине. Предпочтительно, применение в медицине является применением в лечении, прогнозировании, диагностике, детекции и/или мониторинге заболевания, такого как, например, заболевания, ассоциированные с аномальным ростом клеток, таким как злокачественное новообразование, инфекции, такие как бактериальные, вирусные, грибковые или паразитарные инфекции, воспалительные заболевания, такие как аутоиммунные заболевания и воспалительные заболевания кишечника, и заболевания, ассоциированные со снижением активности иммунитета, такие как иммунодефициты. В предпочтительном варианте осуществления заболевание является злокачественным новообразованием.
Предпочтительно, злокачественное новообразование имеет детектируемую экспрессию MUC1 (TA-MUC1), предпочтительно, детектируемую посредством иммуногистохимии, ELISA, RIA, анализа иммуноферментных пятен (ELISPOT), дот-блоттинга, реакции Оухтерлони, или встречного иммуноэлектрофореза (CIE), или гибридизации in situ. В частности, оно включает клетки, имеющие экспрессию MUC1 (TA-MUC1), являющуюся детектируемой посредством иммуногистохимии или гибридизации in situ. Злокачественное новообразование можно тестировать на уровне MUC1 (TA-MUC1) перед введением антитела против MUC1.
Настоящее изобретение дополнительно относится к наборам и устройствам, содержащим конъюгат по изобретению, и соответствующим способам, которые можно использовать в диагностике, детекции или мониторинге MUC1-ассоциированных нарушений, таких как злокачественное новообразование. В некоторых вариантах осуществления настоящее изобретение относится к набору для ELISA сэндвич-типа для тестирования или диагностики, содержащему конъюгат по настоящему изобретению. Этот набор может дополнительно содержать один или более из раствора белковых стандартов MUC1 (TA-MUC1), окрашивающего реагента, буферного раствора для разведения, антитела для твердой фазы, антитела для детекции и промывочного раствора и т.п. Предпочтительно, количество конъюгата, связанного с антигеном, можно измерять способом, таким как способ с использованием поглощения, флуоресценции, люминесценции или радиоактивного изотопа (RI). Предпочтительно, в измерении используют абсорбционный спектрофотометр для чтения планшетов, флуоресцентный спектрофотометр для чтения планшетов, люминесцентный спектрофотометр для чтения планшетов, жидкостной сцинтилляционный счетчик RI или т.п.
Антитело можно использовать для иммуногистохимического (IHC) анализа.
Иммуногистохимия конкретно не ограничена, при условии, что этот подход включает реакцию тканевого среза с антигенсвязывающим антителом (первичным антителом) и детекцию первичного антитела, связанного с антигеном.
Различные формы злокачественных новообразований, включая метастазы, можно подвергать лечению с использованием конъюгата по изобретению. В частности, злокачественное новообразование можно выбирать из группы, состоящей из рака толстого кишечника, рака легких, рака яичников, рака молочной железы, такого как тройной негативный рак молочной железы, рака поджелудочной железы, рака шейки матки, рака эндометрия, злокачественного новообразования желудочно-кишечного тракта, рака почки, рака головы и шеи, рака щитовидной железы и уротелиального рака. В частности, злокачественное новообразование можно дополнительно выбирать из рака желудка, рака печени, рака мочевого пузыря, рака кожи, рака предстательной железы и гемобластоза. В некоторых вариантах осуществления злокачественное новообразование является метастазирующим злокачественным новообразованием. Злокачественное новообразование может включать любой тип метастазов, такой как метастазы в коже, метастазы в лимфоузлах, метастазы в легких, метастазы в печени, перитонеальные метастазы, плевральные метастазы и/или метастазы в головном мозге. В некоторых вариантах осуществления злокачественное новообразование имеет воспалительный фенотип. В этих вариантах осуществления любой из типов злокачественных новообразований, описанных выше, может представлять собой воспалительное злокачественное новообразование.
В некоторых вариантах осуществления вирусная инфекция вызвана вирусом иммунодефицита человека, вирусом простого герпеса, вирусом Эпштейна-Барр, вирусом гриппа, вирусом лимфоцитарного хориоменингита, вирусом гепатита B или вирусом гепатита C. Воспалительное заболевание может быть выбрано из воспалительного заболевания кишечника, воспалительного заболевания органов малого таза, ишемического инсульта, болезни Альцгеймера, астмы, обыкновенной пузырчатки и дерматита/экземы. Аутоиммунное заболевание может быть выбрано из группы, состоящей из целиакии, сахарного диабета типа 1, болезни Грейвса, воспалительного заболевания кишечника, рассеянного склероза, псориаза, ревматоидного артрита, системной красной волчанки, витилиго, псориатического артрита, атопического дерматита, склеродермии, саркоидоза, первичного биллиарного цирроза, синдрома Гийена-Барре, аутоиммунного гепатита и анкилозирующего спондилита. В некоторых вариантах осуществления заболевание включает или ассоциировано с клетками, экспрессирующими MUC1, в частности, TA-MUC1. Например, злокачественное новообразование, подлежащее лечению, является MUC1-положительным, в частности, TA-MUC1-положительным, т.е. включает злокачественные клетки, экспрессирующие MUC1, в частности, TA-MUC1.
В конкретных вариантах осуществления конъюгат используют для лечения в комбинации с другим терапевтическим средством, в частности, для лечения злокачественного новообразования в комбинации с другим противоопухолевым средством. Указанное дополнительное терапевтическое средство может являться любым известным противоопухолевым средством. Подходящие противоопухолевые терапевтические средства, которые можно комбинировать с конъюгатом по изобретению, могут являться химиотерапевтическими средствами, другими антителами, иммуностимулирующими средствами, цитокинами, хемокинами и вакцинами. Кроме того, терапию конъюгатом можно комбинировать с лучевой терапией, хирургическим вмешательством и/или традиционной китайской медициной.
Противоопухолевые средства, которые можно использовать в комбинации с конъюгатом, можно выбирать из любого химиотерапевтического средства, в частности, химиотерапевтических средств, о которых известно, что они эффективны для лечения MUC1-положительных злокачественных новообразований. Тип химиотерапевтического средства также зависит от злокачественного новообразования, подлежащего лечению. Партнера по комбинации можно выбирать из группы, состоящей из таксанов, таких как паклитаксел (Taxol), доцетаксел (Taxotere) и SB-T-1214; циклофосфамида; иматиниба; пазропаниба; капецитабина; цитарабина; винорелбина; гемцитабина; антрациклинов, таких как даунорубицин, доксорубицин, эпирубицин, идарубицин, валрубицин и митоксантрон; ингибиторов ароматазы, таких как аминоглутетимид, тестолактон (Teslac), анастрозол (Arimidex), летрозол (Femara), экземестан (Aromasin), ворозол (Rivizor), форместан (Lentaron), фадрозол (Afema), 4-гидроксиандростендион, 1,4,6-андростатриен-3,17-дион (ATD) и 4-андростен-3,6,17-трион (6-ОКСО); ингибиторов топоизомеразы, таких как иринотекан, топотекан, камптотецин, ламелларин D, этопозид (VP-16), тенипозид, доксорубицин, даунорубицин, митоксантрон, амсакрин, эллиптицины, ауринтрикарбоновая кислота и HU-331; химиотерапевтических средств на основе платины, таких как цис-диамминдихлороплатина (II) (цисплатин), цис-диаммин(1,1-циклобутандикарбоксилато)платина (II) (карбоплатин) и [(1R,2R)-циклогексан-1,2-диамин](этандиоато-O, O')платина (II) (оксалиплатин); ингибиторов PARP, таких как олапариб, рукапариб и нирапариб; агонистов TLR, таких как имиквимод и резиквимод; и антиметаболитов, в частности, антифолатов, таких как метотрексат, пеметрексед, ралтитрексед и пралатрексат, аналогов пиримидина, таких как фторурацил, гемцитабин, флоксуридин, 5-фторурацил и тегафур-урацил, и аналогов пурина, селективных модуляторов эстрогеновых рецепторов и ингибиторов эстрогеновых рецепторов.
Кроме того, терапевтические антитела также можно использовать в качестве дополнительного партнера по комбинации. Они могут являться любым антителом, которое можно использовать в терапии злокачественных новообразований, отличающимся от антитела против MUC1. В частности, дополнительное антитело одобрено для лечения злокачественных новообразований посредством введения, например, Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), Европейским агентством лекарственных средств (EMA, ранее EMEA) и Федеральным институтом лекарственных средств и медицинских изделий Германии (BfArM). Примерами дополнительного антитела, которое можно использовать для комбинированного лечения, являются антитела против EGFR, такие как цетуксимаб, томузотуксимаб, панитумумаб, залутумумаб, нимотузумаб, матузумаб и нецитумумаб; антитела против HER2, такие как трастузумаб, тимигутузумаб и пертузумаб; антитела против VEGF, такие как бевацизумаб (Avastin); антитела против CD52, такие как алемтузумаб (Campath); антитела против CD30, такие как брентуксимаб (Adcetris); антитела против CD33, такие как гемтузумаб (Mylotarg); и антитела против CD20, такие как ритуксимаб (Rituxan, Mabthera), тозитумомаб (Bexxar) и ибритумомаб (Zevalin). Дополнительные примеры антител, подходящих для комбинирования с противоопухолевой терапии, представленной в настоящем описании, включают антитела против антигенов, выбранных из группы, состоящей из антигена Томсена-Фриденрайха (TFα, TFβ), Tn, антигена Льюиса Y, CD44, рецептора фолата α, ганглиозида NeuGc-GM3, DLL-3, RANKL, PTK7, Notch-3, эфрина A4, рецептора инсулиноподобного фактора роста 1, рецептора активина-подобной киназы-1, клаудина-6, дисиалоганглиозида GD2, эндоглина, трансмембранного гликопротеина NMB, CD56, опухолеассоциированного трансдуктора кальциевого сигнала 2, тканевого фактора, эктонуклеотид-пирофосфатазы/фосфодиэстеразы 3, CD70, P-кадгерина, мезотелина, шестидоменного трансмембранного эпителиального антигена предстательной железы 1 (STEAP1), родственной карциноэмбриональному антигену молекулы клеточной адгезии 5 (CEACAM5), нектина 4, гуанилилциклазы C, члена 4 семейства 44 переносчиков растворенных веществ (SLC44A4), простатспецифический мембранного антигена (PSMA), транспортера цинка ZIP6 (LIV1 (ZIP6)), SLIT и NTRK-подобного белка 6 (SLITRK6), гликопротеина трофобласта (TPBG; 5T4), Fyn3, карбоангидразы 9, NaPi2b, экстра-домена B фибронектина, рецептора эндотелина ETB, VEGFR2 (CD309), тенасцина c, коллагена IV и периостина.
Конъюгат можно дополнительно комбинировать с антителами против контрольных точек, т.е. антителами, блокирующими или активирующими иммуномодулирующие мишени. Таким образом, можно блокировать ингибиторные сигналы для иммунного ответа и/или можно запускать активирующие сигналы. Примеры соответствующих мишеней включают CD40, CD3,CD137 (4-1BB), OX40, GITR, CD27, CD278 (ICOS), CD154 (лиганд CD40), CD270 (HVEM) и CD258 (LIGHT) в качестве активирующих мишеней, CTLA4, PD1, CD80, CD244, A2AR, B7-H3 (CD276), B7-H4 (VTCN1), BTLA, IDO, KIR, LAG3, TIM-3, VISTA и фосфатидилсерин в качестве ингибиторных мишеней и их соответствующие лиганды, такие как PDL1.
В дополнительных вариантах осуществления конъюгат можно комбинировать с лечением иммуномодулирующими соединениями, такими как хемокины, цитокины, факторы роста и вакцины. Подходящие цитокины включают интерфероны, такие как интерферон-α, интерферон-β и интерферон-γ, и интерлейкины. Подходящие факторы роста включают Г-КСФ и ГМ-КСФ.
Конъюгат, предпочтительно, используют для лечения первичной опухоли, рецидивирующей опухоли и/или метастазов таких опухолей и, в частности, используют для лечения до, во время или после хирургического вмешательства и для профилактики или лечения метастазов. Конъюгат, в частности, предназначен для лечения пациента в качестве адъювантной терапии. В некоторых вариантах осуществления конъюгат предназначен для лечения пациента в качестве неоадъювантной терапии или комбинированной неоадъювант-адъювантной терапии. Кроме того, конъюгат предназначен для лечения пациента в качестве паллиативного лечения.
Терапия злокачественного новообразования конъюгатом, предпочтительно, приводит к ингибированию роста опухоли и, в частности, уменьшению размера опухоли. Кроме того, с помощью лечения предотвращают возникновение дополнительных метастазов и/или снижают их количество. Предпочтительно, лечение приводит к повышению выживаемости без прогрессирования и/или повышению продолжительности жизни и, таким образом, общей выживаемости.
Настоящее изобретение дополнительно относится к способам терапии, диагностики, прогнозирования, детекции и/или мониторинга заболевания с использованием конъюгата по изобретению. Варианты осуществления и примеры применения конъюгата в медицине также аналогично можно использовать в отношении медицинских способов. В частности, настоящее изобретение относится к способу лечения заболевания у нуждающегося в этом индивидуума, включающему введение индивидууму терапевтически эффективного количества конъюгата по настоящему изобретению.
Например, изобретение относится к способу лечения злокачественного новообразования у нуждающегося в этом индивидуума, включающему введение индивидууму со злокачественным новообразованием терапевтически эффективного количества конъюгата по изобретению. В конкретных вариантах осуществления злокачественное новообразование отличается экспрессией TA-MUC1. Злокачественное новообразование может быть выбрано из группы, состоящей из рака яичников, рака молочной железы, рака поджелудочной железы, рака легких, рака толстого кишечника, рака желудка, рака печени, рака почки, гемобластоза, рака эндометрия, рака щитовидной железы, лейкоза, семином, меланом, карцином, тератом, лимфом, сарком, мезотелиом, нейробластом, глиом, рака прямой кишки, рака надпочечников, рака кожи, злокачественного новообразования головного мозга, рака шейки матки, злокачественного новообразования кишечника, злокачественного новообразования кишечника, рака головы и шеи, злокачественного новообразования желудочно-кишечного тракта, злокачественного новообразования лимфоузлов, рака пищевода, колоректального рака, злокачественного новообразования уха, носа и горла (ЛОР), рака предстательной железы, рака мочевого пузыря, рака матки и их метастазов.
Кроме того, изобретение относится к способу диагностики, детекции или мониторинга злокачественного новообразования, включающему стадию приведения тестового образца в контакт с конъюгатом по изобретению.
Способы повышения аффинности связывания с MUC1
Способ повышения аффинности связывания антитела с MUC1 может включать
(i) вариабельную область тяжелой цепи, содержащую определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 8, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и
(ii) вариабельную область легкой цепи, содержащую определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6,
способу, включающему стадию замены аминокислотного остатка в положении 8 CDR-H2 любым аминокислотным остатком, за исключением аспарагина, что приводит к получению CDR-H2, имеющей аминокислотную последовательность SEQ ID NO: 2.
Антитело, аффинность связывания которого с MUC1 подлежит повышению, в частности, является антителом, способным связываться с MUC1, как представлено в настоящем описании, за исключением того, что оно содержит аспарагин в положении 8 последовательности CDR-H2.
В некоторых вариантах осуществления вариабельная область тяжелой цепи антитела, аффинность связывания которого с MUC1 подлежит повышению, содержит аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 11. В частности, вариабельная область тяжелой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности SEQ ID NO: 11. В этих вариантах осуществления вариабельная область тяжелой цепи все еще содержит CDR, имеющие аминокислотные последовательности SEQ ID NO: 1, 8 и 3. Таким образом, любые отклонения последовательности от SEQ ID NO: 11 локализованы в каркасных областях, а не в CDR. В частности, вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 11.
В некоторых вариантах осуществления вариабельная область легкой цепи антитела, аффинность связывания которого с MUC1 подлежит повышению, содержит аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 12. В частности, вариабельная область легкой цепи содержит аминокислотную последовательность, являющуюся по меньшей мере на 95%, в частности, по меньшей мере на 98% идентичной аминокислотной последовательности SEQ ID NO: 12. В этих вариантах осуществления вариабельная область легкой цепи все еще содержит CDR, имеющие аминокислотные последовательности SEQ ID NO: 4, 5 и 6. Таким образом, любые отклонения последовательности от SEQ ID NO: 12 локализованы в каркасных областях, а не в CDR. В частности, вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 12.
В конкретных вариантах осуществления вариабельная область тяжелой цепи антитела, аффинность связывания которого с MUC1 подлежит повышению, имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 11, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 8 и 3, и вариабельная область легкой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 12, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6. В частности, вариабельная область тяжелой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 11, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 1, 8 и 3, и вариабельная область легкой цепи имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 12, где CDR все еще имеют аминокислотные последовательности SEQ ID NO: 4, 5 и 6.
Например, антитело, аффинность связывания которого с MUC1 подлежит повышению, является антителом против MUC1, описанным в WO 2004/065423 A2 или WO 2011/012309 A1. В частности, антитело с аффинностью связывания с MUC1, которую необходимо повысить, является гатипотузумабом или PankoMab.
Антитело, аффинность связывания с MUC1 которого повышают, в частности, является антителом, способным связываться с MUC1, как представлено в настоящем описании.
В некоторых вариантах осуществления связывание с MUC1 является таким, как представлено в настоящем описании. Термин "повышение аффинности связывания" с MUC1, в частности, относится к повышению по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 33% или по меньшей мере на 50%. В предпочтительных вариантах осуществления аффинность связывания с MUC1 повышают по меньшей мере на 50%. Аффинность связывания с MUC1 можно определять, как описано в примерах, в частности, с использованием анализа поверхностного плазмонного резонанса или технологии switchSENSE® (биосенсора DRX2, производимого Dynamic Biosensors GmbH), как описано, например, в примере 4a и b.
В некоторых вариантах осуществления стадию замены аминокислотного остатка в положении 8 CDR-H2 осуществляют посредством встраивания мутации в нуклеиновую кислота, кодирующую антитело, где мутацию встраивают в кодон, кодирующий указанный аминокислотный остаток. Встраивание мутации можно осуществлять любым способом. В этой области известно несколько подходящих способов, и специалист в этой области может выполнять необходимые действия для встраивания мутации. Затем антитело с повышенной аффинностью связывания MUC1 можно получать посредством экспрессии мутантной нуклеиновой кислоты, например, в клетке-хозяине. Нуклеиновые кислоты, клетки-хозяева и способы получения антитела представлены в настоящем описании, и их можно использовать для способа повышения аффинности связывания с MUC1.
В конкретных вариантах осуществления способ повышения аффинности связывания антитела с MUC1 включает стадии
(a) получения нуклеиновой кислоты, кодирующей антитело с аффинностью связывания с MUC1, подлежащей повышению;
(b) встраивание мутации в указанную нуклеиновую кислоту для получения мутантной нуклеиновой кислоты, где мутацию встраивают в кодон, кодирующий аминокислотный остаток в положении 8 CDR-H2, таким образом, что указанный кодон кодирует любой аминокислотный остаток, за исключением аспарагина; и
(c) экспрессии мутантной нуклеиновой кислоты для получения антитела с повышенной аффинностью связывания с MUC1.
Способ получения антитела с повышенной аффинностью связывания с MUC1 может включать
(a) получение нуклеиновой кислоты, кодирующей антитело, содержащее
(i) вариабельную область тяжелой цепи, содержащую определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 8, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и
(ii) вариабельную область легкой цепи, содержащую определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6;
(b) встраивание мутации в указанную нуклеиновую кислоту для получения мутантной нуклеиновой кислоты, где мутацию встраивают в кодон, кодирующий аминокислотный остаток в положении 8 CDR-H2, таким образом, что указанный кодон кодирует любой аминокислотный остаток, за исключением аспарагина; и
(c) получение антитела с повышенной аффинностью связывания с MUC1 посредством экспрессии мутантной нуклеиновой кислоты в клетке-хозяине.
Варианты осуществления, признаки и примеры, представленные в настоящем описании для других аспектов, в частности, в случае способа повышения аффинности связывания антитела с MUC1, также аналогично можно использовать в отношении способа получения антитела с повышенной аффинностью связывания с MUC1.
В некоторых вариантах осуществления способ получения антитела с повышенной аффинностью связывания с MUC1 дополнительно включают стадию (d) обработки антитела с повышенной аффинностью связывания с MUC1.
Например, обработка антитела с повышенной аффинностью связывания MUC1 может включать выделение антитела из культуры клеток. Термин "выделение антитела", в частности, относится к отделению антитела от остальных компонентов культуры клеток. Отделение антитела от среды для культивирования клеток можно осуществлять, например, хроматографическими способами. В этой области известны подходящие способы и средства для выделения антител, и специалист в этой области легко может использовать их.
Полученное антитело, необязательно, можно подвергать дополнительным стадиям обработки, таким как, например, стадии модификации, такой как химическое или ферментативное присоединение дополнительного средства к антителу, и/или стадии составления для получения антитела с желаемым качеством и композицией. Такие дополнительные стадии обработки и способы, как правило, известны в этой области.
В дополнительных вариантах осуществления стадия (d) дополнительно включает стадию получения фармацевтического состава, содержащего антитело. Получение фармацевтического состава, содержащего антитело, или составление антитела в виде фармацевтической композиции, в частности, включает замену буферного раствора или компонентов буферного раствора композиции, содержащей антитело. Кроме того, эта стадия может включать лиофилизацию антитела. В частности, антитело переносят в композицию, содержащую только фармацевтически приемлемые ингредиенты.
Способ получения 1
Конъюгат антитело-лекарственное средство, представленный приведенной ниже формулой (1), в которой антитело соединено с линкерной структурой посредством тиоэфирной связи, можно получать посредством проведения реакции антитела, имеющего сульфгидрильную группу, преобразованную из дисульфидной связи посредством восстановления антитела, с соединением (2), которое можно получать известным способом (например, способом, описанным в патентной публикации США № US2016/297890 (например, способом, описанным в абзацах [0336]-[0374])). Этот конъюгат антитело-лекарственное средство можно получать, например, следующим способом.
[Формула 6]
где AB представляет собой антитело с сульфгидрильной группой (3a), где
L1 имеет структуру, представленную -(сукцинимид-3-ил-N)-, и
L1' представляет собой малеимидную группу, представленную следующей формулой.
[Формула 7]
(3)
-L1-LX имеет структуру, представленную следующими формулами:
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)- и
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-
Среди них более предпочтительными являются следующие:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)- и
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
Более предпочтительными являются следующие:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)- и
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH--CH2CH2CH2-C(=O)-.
(NH-DX) имеет структуру, представленную следующей формулой:
[Формула 8]
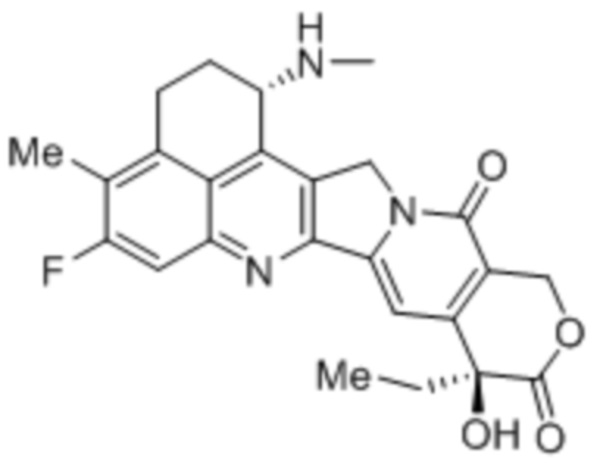
и представляет собой группу, получаемую посредством удаления одного атома водорода аминогруппы в положении 1 экзатекана. В описанной выше схеме реакции (формула 8) соединение формулы (1) можно интерпретировать как имеющее структуру, в которой один фрагмент структуры от лекарственного средства до конца линкера соединяют с одним антителом. Однако, это описание дано для краткости, и, фактически, есть много случаев, в которых с одной молекулой антитела соединяют множество указанных выше фрагментов структур. То же самое верно и для способа получения, описанного ниже.
В частности, конъюгат антитело-лекарственное средство (1) можно получать посредством проведения реакции соединения (2), которое можно получать известным способом (например, способом, описанным в патентной публикации США № US2016/297890 (например, способом, описанным в абзацах [0336]-[0374])), с антителом (3a), имеющим сульфгидрильную группу.
Получение сульфгидрильной группы на антителе (3a) можно осуществлять способом, хорошо известным специалисту в этой области (Hermanson, G.T, Bioconjugate Techniques, pp. 56-136, pp. 456-493, Academic Press (1996)). Неограничивающие примеры способа могут включать: проведение реакции реагента Трота с аминогруппой антитела; проведение реакции N-сукцинимидил-S-ацетилтиоалканоатов с аминогруппой антитела с последующей реакцией с гидроксиламином; проведение реакции N-сукцинимидил-3-(пиридилдитио)пропионата с антителом с последующей реакцией с восстановителем; проведение реакции антитела с восстановителем, таким как дитиотреитол, 2-меркаптоэтанол или трис(2-карбоксиэтил)фосфин гидрохлорид (TCEP) для восстановления межцепочечной дисульфидной связи в антителе для образования сульфгидрильной группы.
В частности, антитело с частично или полностью восстановленными межцепочечными дисульфидными связями можно получать, используя от 0,3 до 3 молярных эквивалентов TCEP в качестве восстановителя на межцепочечную дисульфидную связь в антителе и проводя реакцию восстановителя с антителом в буферном растворе, содержащем хелатирующее средство. Примеры хелатирующего средства могут включать этилендиаминтетрауксусную кислоту (ЭДТА) и диэтилентриаминпентауксусную кислоту (DTPA). Хелатирующее средство можно использовать в концентрации от 1 мМ до 20 мМ. В качестве буферного раствора можно использовать раствор фосфата натрия, бората натрия, ацетата натрия или т.п. В качестве конкретного примера, антитело (3a), имеющее частично или полностью восстановленные сульфгидрильные группы, можно получать посредством реакции антитела с TCEP при температуре от 4°C до 37°C в течение от 1 до 4 часов.
Следует отметить, что осуществляя реакцию присоединения сульфгидрильной группы к фрагменту лекарственное средство-линкер, фрагмент лекарственное средство-линкер можно конъюгировать посредством тиоэфирной связи.
Затем, используя от 2 до 20 молярных эквивалентов соединения (2) на антитело (3a), имеющее сульфгидрильную группу, можно получать конъюгат антитело-лекарственное средство (1), в котором конъюгированы от 2 до 8 молекул лекарственного средства на антитело. В частности, раствор, содержащий растворенное в нем соединение (2), можно добавлять к буферному раствору, содержащему антитело (3a), имеющее сульфгидрильную группу, для реакции. В этом контексте, в качестве буферного раствора можно использовать раствор ацетата натрия, фосфата натрия, бората натрия или т.п. pH реакции составляет от 5 до 9, и более предпочтительно, реакцию можно осуществлять при pH приблизительно 7. В качестве растворителя для растворения соединения (2) можно использовать органический растворитель, такой как диметилсульфоксид (DMSO), диметилформамид (DMF), диметилацетамид (DMA) или N-метил-2-пирролидон (NMP). Реакцию можно осуществлять посредством добавления раствора, содержащего соединение (2), растворенное в органическом растворителе при 1-20% об./об., к буферному раствору, содержащему антитело (3a), имеющее сульфгидрильную группу. Температура реакции составляет от 0°C до 37°C, более предпочтительно - от 10°C до 25°C, и время реакции составляет от 0,5 до 2 часов. Реакцию можно останавливать посредством дезактивации реакционной способности непрореагировавшего соединения (2) с использованием тиол-содержащего реагента. Тиол-содержащий реагент является, например, цистеином или N-ацетил-L-цистеином (NAC). Более конкретно, реакцию можно останавливать посредством добавления от 1 до 2 молярных эквивалентов NAC к используемому соединению (2) и инкубации полученной смеси при комнатной температуре в течение от 10 до 30 минут.
Идентификация конъюгата антитело-лекарственное средство
Полученный конъюгат антитело-лекарственное средство (например, конъюгат антитело-лекарственное средство (1)) можно подвергать концентрированию, замене буфера, очистке и измерению концентрации антитела и среднего количества конъюгированных молекул лекарственного средства на молекулу антитела общими способами, описанными ниже, для идентификации конъюгата антитело-лекарственное средство (1).
1. Общий способ A: Концентрирование водного раствора антитела или конъюгата антитело-лекарственное средство.
В контейнер Amicon Ultra (50,000 MWCO, Millipore Corporation) добавляли раствор антитела или конъюгата антитело-лекарственное средство и концентрировали раствор антитела или конъюгата антитело-лекарственное средство посредством центрифугирования (центрифугирования при 2000×g-4000×g в течение от 5 до 30 минут) с использованием центрифуги (Allegra X-15R, Beckman Coulter, Inc.).
2. Общий способ B: Измерение концентрации антитела
Используя УФ-детектор (Nanodrop 1000, Thermo Fisher Scientific Inc.), осуществляли измерение концентрации антитела по инструкциям производителя. В связи с этим, использовали коэффициент поглощения при 280 нм, отличающийся среди антител (от 1,3 мл·мг-1cm-1 до 1,8 мл·мг-1cm-1).
3. Общий способ C: Замена буфера для антитела
Колонку NAP-25 (кат. № 17-0852-02, GE Healthcare Japan Corporation) с использованием носителя Sephadex G-25 уравновешивали фосфатным буфером (50 мМ, pH 6,0) (обозначаемым как в настоящем описании PBS 6,0/ЭДТА), содержащим хлорид натрия (50 мМ) и ЭДТА (2 мМ), по инструкциям производителя. Водный раствор антитела вводили в количестве 2,5 мл на колонку NAP-25, а затем собирали фракцию (3,5 мл), элюированную с 3,5 мл PBS 6,0/ЭДТА. Эту фракцию концентрировали общим способом A. После измерения концентрации антитела общим способом B, концентрацию антитела доводили до 20 мг/мл с помощью PBS 6,0/ЭДТА.
4. Общий способ D: Очистка конъюгата антитело-лекарственное средство
Колонку NAP-25 уравновешивали любым коммерчески доступным буферным раствором, таким как ацетатный буфер, содержащий сорбит (5%) (10 мМ, pH 5,5;, обозначаемый в настоящем описании как ABS). Водный реакционный раствор конъюгата антитело-лекарственное средство (приблизительно 2,5 мл) вводили в колонку NAP-25, а затем проводили элюцию буферным раствором в количестве, определенном производителем, для сбора фракции антитела. Очистку посредством гель-фильтрации, при которой собранную фракцию снова вводили в колонку NAP-25, и элюцию осуществляли с использованием буферного раствора, повторяли всего 2 или 3 раза для получения конъюгата антитело-лекарственное средство, исключая неконъюгированное лекарственное средство-линкер и низкомолекулярные соединения (трис(2-карбоксиэтил)фосфин гидрохлорид (TCEP), N-ацетил-L-цистеин (NAC) и диметилсульфоксид).
5. Общий способ E: Измерение концентрации антитела в конъюгате антитело-лекарственное средство и среднего количества конъюгированных молекул лекарственного средства на молекулу антитела
Концентрацию конъюгированного лекарственного средства в конъюгате антитело-лекарственное средство можно вычислять, измеряя поглощение УФ водного раствора конъюгата антитело-лекарственное средство при двух длинах волн 280 нм и 370 нм, а затем осуществляя вычисления, приведенные ниже.
Общее поглощение при любой указанной длине волны равно сумме поглощения всех поглощающих свет химических веществ, присутствующих в системе [аддитивность поглощения]. Таким образом, основываясь на гипотезе о том, что молярные коэффициент поглощения антитела и лекарственного средства не изменяют до и после конъюгации антитела и лекарственного средства, концентрация антитела и концентрация лекарственного средства в конъюгате антитело-лекарственное средство представлены следующими уравнениями:
A280=AD,280+AA,280 = εD,280CD + εA,280CA Уравнение (1)
A370=AD,370+AA,370 = εD,370CD + εA,370CA Уравнение (2)
В этом контексте A280 представляет собой поглощение водного раствора конъюгата антитело-лекарственное средство при 280 нм, A370 представляет собой поглощение водного раствора конъюгата антитело-лекарственное средство при 370 нм, AA,280 представляет собой поглощение антитела при 280 нм, AA,370 представляет собой поглощение антитела при 370 нм, AD,280 представляет собой поглощение предшественника конъюгата при 280 нм, AD,370 представляет собой поглощение предшественника конъюгата при 370 нм, εA,280 представляет собой молярный коэффициент поглощения антитела при 280 нм, εA,370 представляет собой молярный коэффициент поглощения антитела при 370 нм, εD,280 представляет собой молярный коэффициент поглощения предшественника конъюгата при 280 нм, εD,370 представляет собой молярный коэффициент поглощения предшественника конъюгата при 370 нм, CA представляет собой концентрацию антитела в конъюгате антитело-лекарственное средство, и CD представляет собой концентрацию лекарственного средства в конъюгате антитело-лекарственное средство.
В этом контексте, в отношении εA,280, εA,370, εD,280 и εD,370, используют предварительно полученные значения (рассчитанные значения на основе значений вычислений или измерений, полученных посредством УФ-измерений соединения). Например, εA,280 можно рассчитывать из аминокислотной последовательности антитела известным способом вычисления (Protein Science, 1995, vol. 4, 2411-2423). εA,370, как правило, составляет нуль. εD,280 и εD,370 можно получать по закону Бугера-Ламберта-Бера (Поглощение=молярная концентрация×молярный коэффициент поглощения×длина пути кюветы) посредством измерения поглощения раствора, в котором используемого предшественника конъюгата растворяют в некоторой молярной концентрации. CA и CD можно определять, измеряя A280 и A370 водного раствора конъюгата антитело-лекарственное средство, а затем решая систему уравнений (1) и (2), подставляя эти значения. Кроме того, разделяя CD на CA, можно определять среднее количество конъюгированных молекул лекарственного средства на антитело.
6. Общий способ F: Измерение среднего количества конъюгированных молекул лекарственного средства на молекулу антитела в конъюгате антитело-лекарственное средство - (2)
Среднее количество конъюгированных молекул лекарственного средства на молекулу антитела в конъюгате антитело-лекарственное средство также можно определять посредством высокоэффективной жидкостной хроматографии (ВЭЖХ) следующим способом, в дополнение к указанному выше "5. Общему способу E". Далее в настоящем описании будет представлен способ измерения среднего количества конъюгированных молекул лекарственного средства посредством ВЭЖХ, когда антитело конъюгировано с лекарственным средством-линкером посредством дисульфидной связи. Специалист в этой области может соответствующим образом измерять среднее количество конъюгированных молекул лекарственного средства посредством ВЭЖХ в зависимости от паттерна соединения между антителом и лекарственным средством-линкером, учитывая этот способ.
F-1. Получение образца для анализа ВЭЖХ (восстановление конъюгата антитело-лекарственное средство)
Раствор конъюгата антитело-лекарственное средство (приблизительно 1 мг/мл, 60 мкл) смешивают с водным раствором дитиотреитола (DTT) (100 мМ, 15 мкл). Инкубируя смесь при 37°C в течение 30 минут, расщепляют дисульфидную связь между легкой цепью и тяжелой цепью конъюгата антитело-лекарственное средство. Полученный образец используют в анализе ВЭЖХ.
F-2. Анализ ВЭЖХ
Анализ ВЭЖХ осуществляют в следующих условиях измерения.
Система ВЭЖХ: Система ВЭЖХ Agilent 1290 (Agilent Technologies, Inc.)
Детектор: Ультрафиолетовый абсорбционный спектрофотометр (длина волны измерения: 280 нм)
Колонка: ACQUITY UPLC BEH Фенил (2,1×50 мм, 1,7 мкм, 130 Ангстрем; Waters Corp., P/N 186002884)
Температура колонки: 80°C
Подвижная фаза A: Водный раствор, содержащий 0,10% трифторуксусной кислоты (TFA) и 15% 2-пропанола
Подвижная фаза B: Раствор ацетонитрила, содержащий 0,075% TFA и 15% 2-пропанола
Программа градиента: 14%-36% (0 мин-15 мин), 36%-80% (15 мин-17 мин), 80%-14% (17 мин-17,01 мин.) и 14% (17,01 мин-25 мин)
Впрыскивание образца: 10 мкл
ИЛИ
Система ВЭЖХ: Система ВЭЖХ Agilent 1290 (Agilent Technologies, Inc.)
Детектор: Ультрафиолетовый абсорбционный спектрофотометр (длина волны измерения: 280 нм)
Колонка: PLRP-S (2,1×50 мм, 8 мкм, 1000 Ангстрем; Agilent Technologies, Inc., P/N PL1912-1802)
Температура колонки: 80°C
Подвижная фаза A: 0,04% водный раствор TFA
Подвижная фаза B: Раствор ацетонитрила, содержащий 0,04% TFA
Программа градиента: 29%-36% (0 мин-12,5 мин), 36%-42% (12,5 мин-15 мин), 42%-29% (15 мин-15,1 мин) и 29%-29% (15,1 мин-25 мин)
Впрыскивание образца: 15 мкл
F-3. Анализ данных
F-3-1. Легкая цепь и тяжелая цепь антитела представлены Li и Hi, соответственно, в соответствии с количеством конъюгированных молекул лекарственного средства (где i представляет собой количество конъюгированных молекул лекарственного средства, т.е. количество конъюгированных молекул лекарственного средства по настоящему изобретению представлено как L0, L1, H0, H1, H2, H3, и т.д.).
По сравнению с неконъюгированными легкими (L0) и тяжелыми (H0) цепями антитела, легкая цепь, связанная с одной молекулой лекарственного средства (L1), тяжелая цепь, связанная с одной молекулой лекарственного средства (H1), тяжелая цепь, связанная с двумя молекулами лекарственного средства (H2), и тяжелая цепь, связанная с тремя молекулами лекарственного средства (H3), проявляют более высокую гидрофобность пропорционально количеству конъюгированных молекул лекарственного средства и, таким образом, имеют большее время удержания. Таким образом, эти цепи элюируют в порядке L0 и L1 или H0, H1, H2, и H3. Пики детекции можно приписывать любому из L0, L1, H0, H1, H2 и H3 посредством сравнения с временем удержания L0 и H0.
F-3-2. Т.к. лекарственное средство-линкер поглощает УФ, значения площади пика корректируют в ответ на количества in конъюгированных молекул лекарственное средство-линкер в соответствии со следующим выражением, используя молярные коэффициенты поглощения легкой цепи или тяжелой цепи и лекарственное средство-линкер.
[Выражение 1]
Скорректированное значение площади пика легкой цепи, связанной с i молекул лекарственного средства (ALi)

εL,280: Молярный коэффициент поглощения легкой цепи при 280 нм
εD,280: Молярный коэффициент поглощения лекарственного средства-линкера при 280 нм
i: Количество конъюгированных молекул лекарственного средства
[Выражение 2]
Скорректированное значение площади пика легкой цепи, связанной с i молекул лекарственного средства (AHi)
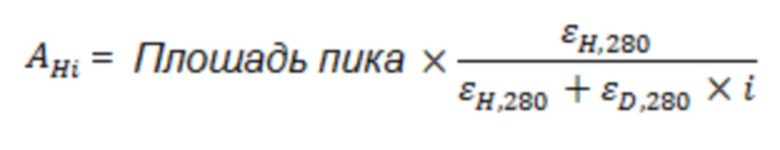
εH,280: Молярный коэффициент поглощения тяжелой цепи при 280 нм
εD,280: Молярный коэффициент поглощения лекарственного средства-линкера при 280 нм
i: Количество конъюгированных молекул лекарственного средства
В этом контексте значение, рассчитанное из аминокислотной последовательности легкой цепи или тяжелой цепи каждого антитела известным способом вычисления (Protein Science, 1995, vol. 4, 2411-2423), можно использовать в качестве молярного коэффициента поглощения (280 нм) легкой цепи или тяжелой цепи антитела. Точно измеренный молярный коэффициент поглощения (280 нм) соединения, в котором малеимидная группа превращена в сукцинимидный тиоэфир посредством реакции каждого лекарственного средства-линкера с меркаптоэтанолом или N-ацетилцистеином, использовали в качестве молярного коэффициента поглощения (280 нм) лекарственного средства-линкера. Специалист в этой области может соответствующим образом задавать длину волны для измерения поглощения, но, предпочтительно, она является длиной волны, при которой можно измерять пик антитела, и более предпочтительно - 280 нм.
F-3-3. Соотношение площади пика (%) каждой цепи вычисляют для суммы скорректированных значений площадей пиков в соответствии со следующим выражением.
[Выражение 3]

F-3-4. Среднее количество конъюгированных молекул лекарственного средства на молекулу антитела в конъюгате антитело-лекарственное средство вычисляют в соответствии со следующим выражением.
Среднее количество конъюгированных молекул лекарственного средства = (соотношение площади пика L0×0+соотношение площади пика L0×1+соотношение площади пика H0×0+соотношение площади пика H1×1+соотношение площади пика H2×2+соотношение площади пика H3×3)/100×2
Следует отметить, что для обеспечения количества конъюгата, можно смешивать множество конъюгатов, имеющих почти одинаковое среднее количество конъюгированных молекул лекарственного средства (например, порядка ±1), полученных в схожих условиях, для получения новой партии. В этом случае среднее количество молекул лекарственного средства попадает между средними количествами молекул лекарственного средства до смешивания.
Конкретные варианты осуществления
Далее описаны конкретные варианты осуществления антительной части конъюгата по настоящему изобретению.
Вариант осуществления 1. Антитело, способное связываться с MUC1, содержащее
(i) вариабельную область тяжелой цепи, содержащую определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и
(ii) вариабельную область легкой цепи, содержащую определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6.
Вариант осуществления 2. Антитело по варианту осуществления 1, где аминокислота в положении 8 CDR-H2 выбрана из группы, состоящей из глутамина, аланина, валина, гистидина, триптофана, тирозина, лизина и аргинина, в частности, глутамина, гистидина, триптофана, тирозина, лизина и аргинина, в частности, глутамина.
Вариант осуществления 3. Антитело по варианту осуществления 1, где аминокислота в положении 8 CDR-H2 является глутамином, гистидином, аргинином, триптофаном или лизином.
Вариант осуществления 4. Антитело по вариантам осуществления 1-3, где CDR-H2 имеет аминокислотную последовательность SEQ ID NO: 7.
Вариант осуществления 5. Антитело по варианту осуществления 1, где CDR-H2 имеет аминокислотную последовательность SEQ ID NO: 8.
Вариант осуществления 6. Антитело, способное связываться с MUC1, содержащее
(i) вариабельную область тяжелой цепи, которая
(a) имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 9, и
(b) содержит определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и
(ii) вариабельную область легкой цепи, которая
(a) имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 12, и
(b) содержит определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6.
Вариант осуществления 7. Антитело, способное связываться с MUC1, содержащее
(i) вариабельную область тяжелой цепи, которая
(a) имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 9, и
(b) содержит определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и
(ii) вариабельную область легкой цепи, которая
(a) имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 12, и
(b) содержит определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6.
Вариант осуществления 8. Антитело по варианту осуществления 6 или 7, где аминокислота в положении 8 CDR-H2 выбрана из группы, состоящей из глутамина, аланина, валина, гистидина, триптофана, тирозина, лизина и аргинина, в частности, глутамина, гистидина, триптофана, тирозина, лизина и аргинина, в частности, глутамина.
Вариант осуществления 9. Антитело по варианту осуществления 7 или 8, где аминокислота в положении 8 CDR-H2 является глутамином, гистидином, аргинином, триптофаном или лизином.
Вариант осуществления 10. Антитело, способное связываться с MUC1, содержащее
(i) вариабельную область тяжелой цепи, которая
(a) имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 10, и
(b) содержит определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 7, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и
(ii) вариабельную область легкой цепи, которая
(a) имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 12, и
(b) содержит определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6.
Вариант осуществления 11. Антитело, способное связываться с MUC1, содержащее
(i) вариабельную область тяжелой цепи, которая
(a) имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 10, и
(b) содержит определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 7, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и
(ii) вариабельную область легкой цепи, которая
(a) имеет аминокислотную последовательность, являющуюся по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 12, и
(b) содержит определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6.
Вариант осуществления 12. Антитело, способное связываться с MUC1, содержащее
(i) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 9, и
(ii) вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 12.
Вариант осуществления 13. Антитело по варианту осуществления 12, где аминокислота в положении 57 SEQ ID NO: 9 выбрана из группы, состоящей из глутамина, аланина, валина, гистидина, триптофана, тирозина, лизина и аргинина, в частности, глутамина, гистидина, триптофана, тирозина, лизина и аргинина, в частности, глутамина.
Вариант осуществления 14. Антитело по варианту осуществления 12, где аминокислота в положении 57 SEQ ID NO: 9 является глутамином, гистидином, аргинином, триптофаном или лизином.
Вариант осуществления 15. Антитело, способное связываться с MUC1, содержащее
(i) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 10, и
(ii) вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 12.
Вариант осуществления 16. Антитело, способное связываться с MUC1, содержащее
(i) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную аминокислотами 20-136 SEQ ID NO: 20 или 23, и
(ii) вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную аминокислотами 21-133 SEQ ID NO: 21.
Вариант осуществления 17. Антитело, способное связываться с MUC1, содержащее
(i) тяжелую цепь, которая
(a) имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% или по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 15, и
(b) содержит определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 2 или 7, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и
(ii) вариабельную область легкой цепи, которая
(a) имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% или по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 16, и
(b) содержит определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6.
Вариант осуществления 18. Антитело, способное связываться с MUC1, содержащее
(i) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 15 или SEQ ID NO: 22, и
(ii) вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 16.
Вариант осуществления 19. Антитело, способное связываться с MUC1, содержащее
(i) вариабельную область тяжелой цепи, которая
(a) имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% или по меньшей мере на 95% идентичной аминокислотной последовательности SEQ ID NO: 19, и
(b) содержит определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 8, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и
(ii) вариабельную область легкой цепи, которая
(a) имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% или 95% идентичной аминокислотной последовательности SEQ ID NO: 16, и
(b) содержит определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6.
Вариант осуществления 20. Антитело, способное связываться с MUC1, содержащее
(i) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную аминокислотами 20-460 SEQ ID NO: 19, и
(ii) вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную аминокислотами 21-239 SEQ ID NO: 16.
Вариант осуществления 21. Антитело по любому из вариантов осуществления 1-20, где антитело содержит по меньшей мере одну тяжелую цепь, содержащую вариабельную область тяжелой цепи, домен CH1, шарнирную область, домен CH2 и домен CH3.
Вариант осуществления 22. Антитело по любому из вариантов осуществления 1-20, где антитело содержит две тяжелые цепи, каждая из которых содержит вариабельную область тяжелой цепи, домен CH1, шарнирную область, домен CH2 и домен CH3.
Вариант осуществления 23. Антитело по варианту осуществления 21 или 22, где антитело является антителом IgG-типа, в частности, антителом IgG1-, IgG2- или IgG4-типа.
Вариант осуществления 24. Антитело по любому из вариантов осуществления 1-23, где антитело содержит по меньшей мере одну легкую цепь, содержащую вариабельную область легкой цепи и домен CL.
Вариант осуществления 25. Антитело по любому из вариантов осуществления 1-22, где антитело содержит две легкие цепи, каждая из которых содержит вариабельную область легкой цепи и домен CL.
Вариант осуществления 26. Антитело по варианту осуществления 24 или 25, где легкая цепь является легкой цепи κ-типа.
Вариант осуществления 27. Антитело по любому из вариантов осуществления 1-26, где антитело не содержит участок N-гликозилирования в домене CH2.
Вариант осуществления 28. Антитело по любому из вариантов осуществления 1-26, где антитело содержит участок N-гликозилирования в домене CH2 тяжелых цепей антитела.
Вариант осуществления 29. Антитело по варианту осуществления 28, где антитело имеет профиль гликозилирования, имеющий одну или более из следующих характеристик
(i) относительное количество гликанов, несущих остаток GlcNAc в точке ветвления, по меньшей мере 0,5% общего количества гликанов, присоединенных к участкам гликозилирования антитела в композиции;
(ii) относительное количество гликанов, несущих по меньшей мере один остаток галактозы, по меньшей мере 30% общего количества гликанов, присоединенных к участкам гликозилирования антитела в композиции;
(iii) относительное количество гликанов, несущих остаток коровой фукозы, по меньшей мере 60% общего количества гликанов, присоединенных к участкам гликозилирования антитела в композиции.
Вариант осуществления 30. Антитело по варианту осуществления 28, где антитело имеет профиль гликозилирования, имеющий одну или более из следующих характеристик
(i) относительное количество гликанов, несущих остаток GlcNAc в точке ветвления, по меньшей мере 0,5% общего количества гликанов, присоединенных к участкам гликозилирования антитела в композиции;
(ii) относительное количество гликанов, несущих по меньшей мере один остаток галактозы, по меньшей мере 30% общего количества гликанов, присоединенных к участкам гликозилирования антитела в композиции;
(iii) относительное количество гликанов, несущих остаток коровой фукозы, 40% или менее от общего количества гликанов, присоединенных к участкам гликозилирования антитела в композиции.
Далее описаны конкретные варианты осуществления конъюгата по настоящему изобретению.
Вариант осуществления 31. Антитело по любому из вариантов осуществления 1-30, содержащее дополнительное средство, предпочтительно цитотоксическое средство, конъюгированное с ним.
Вариант осуществления 32. Антитело по варианту осуществления 31, где цитотоксическое средство является химиотерапевтическим средством, соединенным с антителом.
Вариант осуществления 33. Антитело по варианту осуществления 32, где химиотерапевтическое средство выбрано из группы, состоящей из ингибитора микротрубочек, такого как майтанзиноида, ингибитора топоизомеразы I, ДНК-повреждающего средства, ДНК-алкилирующего средства и средства, связывающегося с малой бороздкой ДНК.
Вариант осуществления 34. Антитело по варианту осуществления 32, где химиотерапевтическое средство выбрано из группы, состоящей измайтанзинола, N2'-деацетил-N2'-(3-меркапто-1-оксопропил)-майтанзина (DM1), N2'-деацетил-N2'-(4-меркапто-1-оксопентил)-майтанзина (DM3) и N2'-деацетил-N2'-(4-метил-4-меркапто-1-оксопентил)-майтанзина (DM4).
Вариант осуществления 35. Антитело по варианту Вариант осуществления 32, где химиотерапевтическое средство выбрано из группы, состоящей из пирролобензодиазепина (PBD), димера пирролобензодиазепина (димера PBD), дуокармицина, дуокармицин-гидроксибензамид-азаиндола (DUBA), секо-дуокармицин-гидроксибензамид-азаиндола (секо-DUBA) и доксорубицина.
Вариант осуществления 36. Антитело по варианту осуществления 32, где химиотерапевтическое средство выбрано из группы, состоящей из индолинобензодиазепина и оксазолидинобензодиазепина.
Вариант осуществления 37. Антитело по варианту осуществления 32, где химиотерапевтическое средство является калихимицином.
Вариант осуществления 38. Антитело по варианту осуществления 32, где химиотерапевтическое средство выбрано из группы, состоящей из камптотецин, 7-этил-10-гидрокси-камптотецина (SN-38), (S)-9-диметиламинометил-10-гидроксикамптотецина (топотекана), (1S,9S)-1-амино-9-этил-5-фтор-1,2,3,9,12,15-гексагидро-9-гидрокси-4-метил-10H,13H-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13-диона (экзатекана (DX-8951)) и DXd.
Вариант осуществления 39. Антитело по варианту осуществления 32, где химиотерапевтическое средство является противоопухолевым соединением, представленным следующей формулой:
[Формула 1]

Вариант осуществления 40. Антитело по варианту осуществления 32, где химиотерапевтическое средство является противоопухолевым соединением, представленным следующей формулой:
[Формула 2]

Вариант осуществления 41. Антитело по варианту осуществления 31, где дополнительно дополнительное средство, являющееся полипептидом или белком, слито с полипептидной цепью антитела.
Вариант осуществления 42. Антитело по варианту осуществления 41, где антитело содержит две тяжелые цепи антитела и две легкие цепи антитела, и дополнительное средство, являющееся полипептид или белком, слито с каждым из C-концов указанных тяжелых цепей антитела или каждым из C-концов указанных легких цепей антитела.
Вариант осуществления 43. Антитело по варианту осуществления 41 или 42, где дополнительное средство выбрано из группы, состоящей из цитокинов, хемокинов, других антител, антигенсвязывающих фрагментов, ферментов и связывающих доменов.
Вариант осуществления 44. Антитело по варианту осуществления 42, где дополнительное средство является scFv-фрагментом, специфически связывающимся с CD3, и одно из указанных дополнительных средств слито с C-концом каждой тяжелой цепи антитела.
Вариант осуществления 45. Антитело по варианту осуществления 42, где дополнительное средство является scFv-фрагментом, специфически связывающимся с PDL1, и одно из указанных дополнительных средств слито с C-концом каждой легкой цепи антитела.
Вариант осуществления 46. Антитело по вариантам осуществления 31-45, где цитотоксическое средство, предпочтительно, ингибитор топоизомеразы I, такой как DX-8951 или DXd, конъюгируют с ним через линкер, имеющий любую структуру, выбранную из группы, состоящей из следующих формул (a)-(f):
(a) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
(b) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
(c) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
(d) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
(e) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)- и
(f) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
где антитело соединяют с концом -(сукцинимид-3-ил-N), противоопухолевое соединение соединяют с карбонильной группой фрагмента -(CH2)n2-C(=O)- (n2 представляет собой целое число 1 или 3) в самой крайней из формул (a)-(f) с атомом азота аминогруппы в положении 1 в качестве положения соединения, GGFG представляет собой аминокислотную последовательность, состоящую из глицин-глицин-фенилаланин-глицин, соединенных пептидными связями, и
-(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
[Формула 3]

соединенную с антителом в положении 3 и соединенную с метиленовой группой в линкерной структуре, содержащей эту структура на атоме азота в положении 1.
Вариант осуществления 47. Конъюгат, содержащий антитело по любому из вариантов осуществления 1-30. конъюгированное с цитотоксическим средством.
Вариант осуществления 48. Конъюгат по варианту осуществления 47, где цитотоксическое средство является химиотерапевтическим средством.
Вариант осуществления 49. Конъюгат по варианту осуществления 48, где химиотерапевтическое средство выбрано из группы, состоящей из ингибитора микротрубочек, ингибитора топоизомеразы I, ДНК-повреждающего средства, ДНК-алкилирующего средства и средства, связывающегося с малой бороздкой ДНК.
Вариант осуществления 50. Конъюгат по варианту осуществления 48, где химиотерапевтическое средство выбрано из группы, состоящей из майтанзинола, N2'-деацетил-N2'-(3-меркапто-1-оксопропил)-майтанзина (DM1), N2'-деацетил-N2'-(4-меркапто-1-оксопентил)-майтанзина (DM3), и N2'-деацетил-N2'-(4-метил-4-меркапто-1-оксопентил)-майтанзина (DM4).
Вариант осуществления 51. Конъюгат по варианту осуществления 48, где химиотерапевтическое средство выбрано из группы, состоящей из пирролобензодиазепина (PBD), димера пирролобензодиазепина (димера PBD), дуокармицина, дуокармицин-гидроксибензамид-азаиндола (DUBA), секо-дуокармицин-гидроксибензамид-азаиндола (секо-DUBA) и доксорубицина.
Вариант осуществления 52. Конъюгат по варианту осуществления 48, где химиотерапевтическое средство выбрано из группы, состоящей из индолинобензодиазепина и оксазолидинобензодиазепина.
Вариант осуществления 53. Конъюгат по варианту осуществления 48, где химиотерапевтическое средство является калихимицином.
Вариант осуществления 54. Конъюгат по варианту осуществления 48, где химиотерапевтическое средство выбрано из группы, состоящей из камптотецина, 7-этил-10-гидрокси-камптотецина (SN-38), (S)-9-диметиламинометил-10-гидроксикамптотецина (топотекана), (1S,9S)-1-амино-9-этил-5-фтор-1,2,3,9,12,15-гексагидро-9-гидрокси-4-метил-10H,13H-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13-диона (экзатекана (DX-8951)) и DXd.
Вариант осуществления 55. Конъюгат по варианту осуществления 48, где химиотерапевтическое средство является противоопухолевым соединением, представленным следующей формулой:
[Формула 1]

Вариант осуществления 56. Конъюгат по варианту осуществления 48, где химиотерапевтическое средство является противоопухолевым соединением, представленным следующей формулой:
[Формула 2]

Вариант осуществления 57. Конъюгат по варианту осуществления 47, где дополнительное средство, являющееся полипептидом или белком, слито с полипептидной цепью антитела.
Вариант осуществления 58. Конъюгат по варианту осуществления 57, где антитело содержит две тяжелые цепи антитела и две легкие цепи антитела, и дополнительное средство, являющееся полипептидом или белком, слито с каждым из C-концов указанных тяжелых цепей антитела или каждым из C-конов указанных легких цепей антитело.
Вариант осуществления 59. Конъюгат по варианту осуществления 57 или 58, где дополнительное средство выбрано из группы, состоящей из цитокинов, хемокинов, других антител, антигенсвязывающих фрагментов, ферментов и связывающих доменов.
Вариант осуществления 60. Конъюгат по варианту осуществления 58, где дополнительное средство является scFv-фрагментом, специфически связывающимся с CD3, и одно из указанных дополнительных средств слито с C-концом каждой тяжелой цепи антитела.
Вариант осуществления 61. Конъюгат по варианту осуществления 58, где дополнительное средство является scFv-фрагментом, специфически связывающимся с PDL1, и одно из указанных дополнительных средств слито с C-концом каждой легкой цепи антитела.
Вариант осуществления 62. Конъюгат по любому из вариантов осуществления 47-61, где антитело конъюгируют с дополнительным средством или химиотерапевтическим средством, предпочтительно, ингибитором топоизомеразы I, таким как DX-8951 или DXd, через линкер, имеющий любую структуру, выбранную из группы, состоящей из следующих формул (a)-(f):
(a) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
(b) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
(c) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
(d) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
(e) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-, и
(f) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
где антитело соединяют с концом -(сукцинимид-3-ил-N), противоопухолевое соединение соединяют с карбонильной группой фрагмента -(CH2)n2-C(=O)- (n2 представляет собой целое число 1 или 3) в самой крайней из формул (a)-(f) с атомом азота аминогруппы в положении 1 в качестве положения соединения, GGFG представляет собой аминокислотную последовательность, состоящую из глицин-глицин-фенилаланин-глицин, содиненных пептидными связями, и
-(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
[Формула 3]

соединенную с антителом в положении 3 и соединенную с метиленовой группой в линкерной структуре, содержащей эту структуру на атоме азота в положении 1.
Вариант осуществления 63. Конъюгат по любому из вариантов осуществления 47-61, где антитело или его антигенсвязывающий фрагмент конъюгируют с лекарственным средством-линкером, представленным следующей формулой (где символом "*" обозначена точка соединения с антителом) посредством тиоэфирной связи, антитело содержит любую из следующих комбинаций a)-f) вариабельной области тяжелой цепи и вариабельной области легкой цепи или тяжелой цепи и легкой цепи:
(a) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 10, и вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 12,
(b) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 11, и вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 12,
(c) тяжелая цепь содержит аминокислотную последовательность SEQ ID NO: 15 или 22, и легкая цепь содержит аминокислотную последовательность SEQ ID NO: 16,
(d) тяжелая цепь содержит аминокислотную последовательность SEQ ID NO: 19, и легкая цепь содержит аминокислотную последовательность SEQ ID NO: 16.
(e) тяжелая цепь имеет аминокислотную последовательность, представленную аминокислотами 1-446 SEQ ID NO: 15 или 22, и легкая цепь имеет аминокислотную последовательность, представленную аминокислотами 1-219 SEQ ID NO: 16, и
(f) тяжелая цепь имеет аминокислотную последовательность, представленную аминокислотами 1-446 SEQ ID NO: 19, и легкая цепь имеет аминокислотную последовательность, представленную аминокислотами 1-219 SEQ ID NO: 16:
[Формула 4]
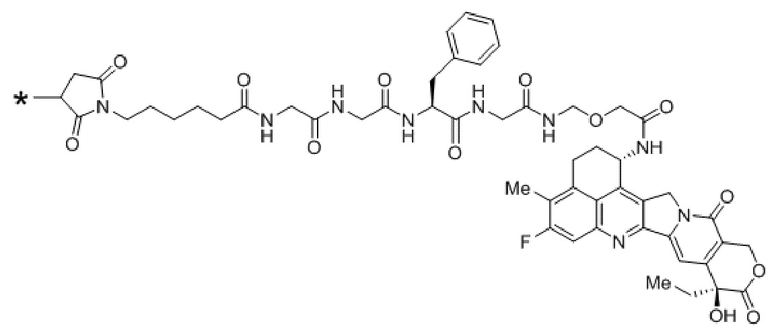
Вариант осуществления 64. Конъюгат или антитело, представленный следующей формулой,
[Формула 5]
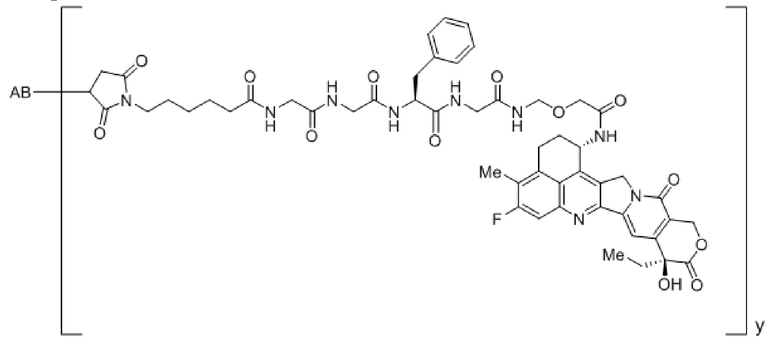
где AB представляет собой антитело, антитело содержит вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 10, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 12, y представляет собой среднее количество единиц структуры лекарственное средство-линкер, конъюгированных с антителом, на антитело, и y находиться в диапазоне от 1 до 10, в диапазоне от 2 до 8, в диапазоне от 3 до 8, в диапазоне от 7 до 8 или в диапазоне от 7,5 до 8, и антитело конъюгируют со структурой лекарственное средство-линкер, представленной указанной выше формулой, посредством тиоэфирной связи.
Вариант осуществления 65. Конъюгат или антитело, представленный следующей формулой,
[Формула 5]

где AB представляет собой антитело, антитело содержит вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 11, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 12, y представляет собой среднее количество единиц структуры лекарственное средство-линкер, конъюгированных с антителом, на антитело, и y находится в диапазоне от 1 до 10, в диапазоне от 2 до 8, в диапазоне от 3 до 8, в диапазоне от 7 до 8 или в диапазоне от 7,5 до 8, и антитело конъюгируют со структурой лекарственное средство-линкер, представленной указанной выше формулой, посредством тиоэфирной связи.
Вариант осуществления 66. Конъюгат или антитело, представленный следующей формулой,
[Формула 5]

где AB представляет собой антитело, антитело содержит тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 15 или 22, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 16, y представляет собой среднее количество единиц структуры лекарственное средство-линкер, конъюгированных с антителом, на антитело и y находится в диапазоне от 1 до 10, в диапазоне от 2 до 8, в диапазоне от 3 до 8, в диапазоне от 7 до 8 или в диапазоне от 7,5 до 8, и антитело конъюгируют со структурой лекарственное средство-линкер, представленной указанной выше формулой, посредством тиоэфирной связи.
Вариант осуществления 67. Конъюгат или антитело, представленное следующей формулой,
[Формула 5]

где AB представляет собой антитело, антитело содержит тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 19, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 16, y представляет собой среднее количество единиц структуры лекарственное средство-линкер, конъюгированных с антителом, на антитело, и y находится в диапазоне от 1 до 10, в диапазоне от 2 до 8, в диапазоне от 3 до 8, в диапазоне от 7 до 8 или в диапазоне от 7,5 до 8, и антитело конъюгируют со структурой лекарственное средство-линкер, представленной указанной выше формулой, посредством тиоэфирной связи.
Вариант осуществления 68. Конъюгат или антитело по любому из вариантов осуществления 31-67, где антитело содержит одну или более модификаций, выбранных из группы, состоящей из дефукозилирования, сниженного содержания фукозы, N-связанного гликозилирования, O-связанного гликозилирования, N-концевого процессинга, C-концевого процессинга, дезамидирования, изомеризации аспарагиновой кислоты, окисления метионина, замены двух остатков лейцина (L) аланином (A) в положении 234 и 235 тяжелой цепи (LALA), амидирования остатка пролина и делеции или отсутствия одной или двух аминокислот на карбоксильном конце.
Вариант осуществления 69. Конъюгат или антитело по варианту осуществления 68, где антитело содержит делецию, или в нем отсутствуют, одна или две аминокислоты на карбоксильном конце тяжелой цепи.
Вариант осуществления 70. Конъюгат или антитело по варианту осуществления 69, где антитело содержит две тяжелые цепи, в обеих из которых отсутствует один карбокси-концевой аминокислотный остаток.
Вариант осуществления 71. Конъюгат или антитело, представленный следующей формулой,
[Формула 5]

где AB представляет собой антитело, антитело содержит тяжелую цепь, имеющую аминокислотную последовательность, представленную аминокислотами 1-446 SEQ ID NO: 15 или 22, и легкую цепь, имеющую аминокислотную последовательность, представленную аминокислотами 1-219 SEQ ID NO: 16, y представляет собой среднее количество единиц структуры лекарственное средство-линкер, конъюгированных с антителом, на антитело, и y находится в диапазоне от 1 до 10, в диапазоне от 2 до 8, в диапазоне от 3 до 8, в диапазоне от 7 до 8 или в диапазоне от 7,5 до 8, и антитело конъюгируют со структурой лекарственное средство-линкер, представленной указанной выше формулой, посредством тиоэфирной связи.
Вариант осуществления 72. Конъюгат или антитело, представленный следующей формулой,
[Формула 5]

где AB представляет собой антитело, антитело содержит тяжелую цепь, имеющую аминокислотную последовательность, представленную аминокислотами 1-446 SEQ ID NO: 19, и легкую цепь, имеющую аминокислотную последовательность, представленную аминокислотами 1-219 SEQ ID NO: 16, y представляет собой среднее количество единиц структуры лекарственное средство-линкер, конъюгированных с антителом, на антитело, и y находится в диапазоне от 1 до 10, в диапазоне от 2 до 8, в диапазоне от 3 до 8, в диапазоне от 7 до 8 или в диапазоне от 7,5 до 8, и антитело конъюгируют со структурой лекарственное средство-линкер, представленной указанной выше формулой, посредством тиоэфирной связи.
Вариант осуществления 73. Конъюгат или антитело по любому из вариантов осуществления 31-72, где количество конъюгированных молекул лекарственного средства на молекулу антитела составляет 8.
Вариант осуществления 74. Фармацевтическая композиция, содержащая антитело или конъюгат по любому из вариантов осуществления 31-73 и один или более дополнительных компонентов, выбранных из группы, состоящей из растворителей, дилюентов и эксципиентов.
Вариант осуществления 75. Антитело или конъюгат по любому из вариантов осуществления 31-73 или фармацевтическая композиция по варианту осуществления 74 для применения в медицине.
Вариант осуществления 76. Антитело или конъюгат по любому из вариантов осуществления 31-73 или фармацевтическая композиция по варианту осуществления 74 для применения в лечении, прогнозировании, диагностике и/или мониторинге заболеваний, ассоциированных с аномальным ростом клеток, таких как злокачественное новообразование; инфекций, таких как бактериальные, вирусные, грибковые или паразитарные инфекции; воспалительных заболеваний, таких как аутоиммунные заболевания и воспалительные заболевания кишечника; и заболеваний, ассоциированных со сниженной активностью иммунитета, таких как иммунодефициты.
Вариант осуществления 77. Антитело, конъюгат или фармацевтическая композиция по варианту осуществления 76 для применения в лечении злокачественного новообразования, в частности, злокачественного новообразования, экспрессирующего TA-MUC1, где злокачественное новообразование выбрано из группы, состоящей из рака яичников, рака молочной железы, рака поджелудочной железы, рака легких, рака толстого кишечника, рака желудка, рака печени, рака почки, гемобластоза, рака эндометрия, рака щитовидной железы, лейкоза, семином, меланом, карцином, тератом, лимфом, сарком, мезотелиом, нейробластом, глиом, рака прямой кишки, рака надпочечников, рака кожи, злокачественного новообразования головного мозга, рака шейки матки, злокачественного новообразования кишечника, злокачественного новообразования кишечника, рака головы и шеи, злокачественного новообразования желудочно-кишечного тракта, злокачественного новообразования лимфоузлов, рака пищевода, колоректального рака, злокачественного новообразования уха, носа и горла (ЛОР), рака предстательной железы, рака мочевого пузыря, рака матки и их метастазов.
Вариант осуществления 78. Антитело, конъюгат или фармацевтическая композиция по варианту осуществления 76 для применения в лечении инфекций, где инфекция выбрана из группы, состоящей из бактериальных инфекций, вирусных инфекций, грибковых инфекций и паразитарных инфекций.
Вариант осуществления 79. Антитело, конъюгат или фармацевтическая композиция по варианту осуществления 76 для применения в лечении аутоиммунных заболеваний, где аутоиммунное заболевание выбрано из группы, состоящей из целиакии, сахарного диабета типа 1, болезни Грейвса, воспалительного заболевания кишечника, рассеянного склероза, псориаза, ревматоидного артрита и системной красной волчанки.
Вариант осуществления 80. Способ лечения злокачественного новообразования у нуждающегося в этом индивидуума, включающий введение индивидууму со злокачественным новообразованием, в частности, злокачественным новообразованием, экспрессирующим TA-MUC1, терапевтически эффективного количества конъюгата или антитела по любому из вариантов осуществления 31-73 или композиции по варианту осуществления 74.
Вариант осуществления 81. Способ лечения злокачественного новообразования по варианту осуществления 80, где злокачественное новообразование выбрано из группы, состоящей из рака яичников, рака молочной железы, рака поджелудочной железы, рака легких, рака толстого кишечника, рака желудка, рака печени, рака почки, гемобластоза, рака эндометрия, рака щитовидной железы, лейкоза, семином, меланом, карцином, тератом, лимфом, сарком, мезотелиом, нейробластом, глиом, рака прямой кишки, рака надпочечников, рака кожи, злокачественного новообразования головного мозга, рака шейки матки, злокачественного новообразования кишечника, злокачественного новообразования кишечника, рака головы и шеи, злокачественного новообразования желудочно-кишечного тракта, злокачественного новообразования лимфоузлов, рака пищевода, колоректального рака, злокачественного новообразования уха, носа и горла (ЛОР), рака предстательной железы, рака мочевого пузыря, рака матки и их метастазов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 показаны кривые связывания антител против MUC1 с разными пептидами MUC1 по результатам ELISA. На (A) показано связывание антигена с PankoMab N54Q (PM-N54Q), в котором отсутствует гликозилирование Fab, и PankoMab, содержащим гликозилирование Fab (PM), с пептидом MUC1, содержащим последовательность эпитопа PDTR. Треонин в пептиде MUC1 является гликозилированным с помощью Tn, sTn, TF или sTF. На (B) показано связывание PankoMab и PM-N54Q с пептидом MUC1, содержащим вариант последовательности эпитопа PESR. Серин в пептиде MUC1 является гликозилированным с помощью Tn. На (C) показано связывание PM-N54Q с пептидом MUC1, содержащим последовательность эпитопа PDTR. Треонин в пептиде MUC1 является гликозилированным с помощью Tn или негликозилированным. На (D) показано связывание нескольких вариантов N54X с пептидом Tn-PDTR MUC1 по сравнению с PankoMab, содержащим гликозилирование Fab, разведенным из супернатанта культуры транзиторно трансфицированных клеток. На (E) показаны кривые связывания трех очищенных вариантов N54X без гликозилирования Fab по сравнению с PankoMab с гликозилированием Fab с гликозилированным с помощью Tn-PDTR, TF-PDTR и негликозилированным пептидом MUC1 PDTR. На (F) показано связывание двух вариантов каркасов PM-N54Q с пептидом MUC1 Tn-PDTR по сравнению с PankoMab с гликозилированием Fab. В случае варианта каркаса mf-a девять аминокислот являются мутантными в каркасе VH и три в каркасе VL, в случае mf-b также девять аминокислот являются мутантными в каркасе VH и четыре в каркасе VL.
На фигуре 2 показан анализ поверхностного плазмонного резонанса (Biacore) связывания антител против MUC1 PM и PM-N54Q с гликозилированным пептидом PDTR-MUC1. Строили график максимального сигнала связывания различных концентраций PM-N54Q и PankoMab относительно концентрации антитела.
На фигуре 3 показаны результаты флуоресцентного обнаружения приближения с помощью устройства DRX. Показаны кривые ассоциации и диссоциации. (A) PM с гликозилированием Fab по сравнению с (B) PM-N54Q без гликозилирования Fab.
На фигуре 4 показан акриламидный гель с SDS в случае электрофоретического разделения PM-N54Q и PankoMab в невосстановительных (слева) и восстановительных (справа) условиях. Дорожка 1: PM-N54Q после стадии захвата; дорожка 2: PM-N54Q после стадии заключительной очистки; дорожка 3: PankoMab после стадии захвата; дорожка 4: PankoMab после стадии заключительной очистки; дорожка 5: маркер молекулярной массы.
На фигуре 5 показан окрашенный кумасси синим гель в анализе изоэлектрофокусирования PM-N54Q, в котором отсутствует гликозилирование Fab, и PankoMab, являющееся Fab-гликозилированным. Дорожка 1: PankoMab с гликозилированием Fab; дорожка 2: PM-N54Q без гликозилирования Fab.
На фигуре 6 показано связывание антитела против MUC1 с Fcγ-рецептором IIIa. Увеличивающиеся концентрации антитела PM-N54Q или PankoMab вытесняют соединенные с антителом кролика против мыши акцепторные частицы из нагруженных FcγRIIIa донорных частиц, таким образом, снижая детектируемую хемилюминесценцию. В анализе использовали низкофукозилированные антитела, как показано на фигуре 6A, и высокофукозилированные антитела, как показано на фигуре 6B.
На фигуре 7 показано связывание антител против MUC1 PM-N54Q, PM-N54D и PM с гликозилированием Fab с линиями опухолевых клеток (A) CaOV-3 и (B) HSC-4, анализируемое посредством проточной цитометрии.
На фигуре 8 показана цитотоксическая активность A) контрольного hIgG-ADC, "голого" PankoMab и PankoMab-ADC против линий злокачественных клеток MDA-MB-468 с экспрессией белков TA-MUC1, B) контрольного hIgG-ADC, "голого" PankoMab и PankoMab-ADC против линий злокачественных клеток HCT-15 без экспрессии белков TA-MUC1, C) контрольного hIgG-ADC, "голого"PankoMab, PankoMab-ADC, "голого"PM-N54Q и PM-N54Q-ADC против линий злокачественных клеток NCI-H441 с экспрессией белков TA-MUC1, D) контрольного hIgG-ADC, "голого" PankoMab, PankoMab-ADC, "голого" PM-N54Q и PM-N54Q-ADC против линий злокачественных клеток HPAC с экспрессией белков TA-MUC1. Клетки обрабатывали каждым соединением в течение 6 дней и вычисляли жизнеспособность клеток (%) посредством анализа АТФ. Данные представляют собой среднее ± SD (N=3).
На фигуре 9 показана противоопухолевая эффективность контрольного hIgG-ADC, "голого" PankoMab и PankoMab-ADC в отношении MDA-MB-468-несущих бестимусных мышей. Контрольный hIgG-ADC, "голое" PankoMab и PankoMab-ADC в дозах 3 мг/кг или носитель (ацетатный буферный раствор) вводили в виде однократной дозы внутривенно MDA-MB-468-несущим бестимусным мышам (N=6/группц). Данные об оцениваемом объеме опухоли представляют собой среднее ± SEM. Стрелкой указано время введения. Оцениваемые объемы опухолей через 21 день после введения PankoMab-ADC сравнивали с группой, которой вводили контрольным hIgG-ADC или "голое" PankoMab, с использованием t-критерия Стьюдента. ***P<0,001.
На фигуре 10 показана противоопухолевая эффективность контрольного hIgG-ADC, "голого" PankoMab и PankoMab-ADC в отношении HCC70-несущих бестимусных мышей. Контрольный hIgG-ADC, "голое" PankoMab и PankoMab-ADC в дозах 10 мг/кг или носитель (ацетатный буферный раствор) вводили в виде однократной дозы внутривенно HCC70-несущим бестимусным мышам (N=6/группц). Данные об оцениваемом объеме опухоли представляют собой среднее ± SEM. Стрелкой указано время введения. Оцениваемые объемы опухолей через 21 день после введения PankoMab-ADC сравнивали с группой, которой вводили контрольный hIgG-ADC или "голое" PankoMab, с использованием t-критерия Стьюдента. ***P<0,001.
На фигуре 11 показана противоопухолевая эффективность контрольного hIgG-ADC, "голого" PM-N54Q, PankoMab-ADC и PM-N54Q-ADC в отношении HPAC-несущих бестимусных мышей. Контрольный hIgG-ADC, "голое" PM-N54Q, PankoMab-ADC и PM-N54Q-ADC в дозах 10 мг/кг или носитель (ацетатный буферный раствор) вводили в виде однократной дозы внутривенно HPAC-несущим бестимусным мышам (N=6/группу). Данные об оцениваемом объеме опухоли представляют собой среднее ± SEM. Стрелкой указано время введения. Оцениваемые объемы опухолей через 21 день после введения PankoMab-ADC и PM-N54Q-ADC сравнивали с группой, которой вводили контрольный hIgG-ADC, с использованием критерия Даннетта. ***P<0,001.
На фигуре 12 показана противоопухолевая эффективность контрольного hIgG-ADC, "голого" PankoMab, "голого" PM-N54Q, PankoMab-ADC и PM-N54Q-ADC в отношении NCI-H441-несущих бестимусных мышей. "Голое" PankoMab, "голое" PM-N54Q в дозах 10 мг/кг, контрольный hIgG-ADC, PankoMab-ADC и PM-N54Q-ADC в дозах 3 мг/кг или носитель (ацетатный буферный раствор) вводили в виде однократной дозы внутривенно NCI-H441-несущим бестимусным мышам (N=6/группу). Данные об оцениваемом объеме опухоли представляют собой среднее ± SEM. Стрелкой указано время введения. Оцениваемые объемы опухолей через 31 день после введения PankoMab-ADC и PM-N54Q-ADC сравнивали с группой, которой вводили контрольный hIgG-ADC, с использованием критерия Даннетта. ***P<0,001.
На фигуре 13 показана противоопухолевая эффективность контрольного hIgG-ADC, "голого" PankoMab, "голого" PM-N54Q, PankoMab-ADC и PM-N54Q-ADC в отношении OVCAR-5-несущих бестимусных мышей. Контрольный hIgG-ADC, "голое" PankoMab, "голое" PM-N54Q, PankoMab-ADC и PM-N54Q-ADC в дозах 10 мг/кг или носитель (ацетатный буферный раствор) вводили в виде однократной дозы внутривенно OVCAR-5-несущим бестимусным мышам (N=6/группу). Данные об оцениваемом объеме опухоли представляют собой среднее ± SEM. Стрелкой указано время введения. Оцениваемый объемы опухолей через 14 дней после введения PankoMab-ADC и PM-N54Q-ADC сравнивали с группой, которой вводили контрольный hIgG-ADC, с использованием критерия Даннетта. Оцениваемые объемы опухолей через 14 дней после введения PM-N54Q-ADC сравнивали с группой, которой вводили PankoMab-ADC, с использованием t-критерия Стьюдента. ***P<0,001.
На фигуре 14 показана противоопухолевая эффективность контрольного hIgG-ADC, PankoMab-ADC и PM-N54Q-ADC в отношении HCT-15-несущих бестимусных мышей. Контрольный hIgG-ADC, PankoMab-ADC и PM-N54Q-ADC в дозах 10 мг/кг или носитель (ацетатный буферный раствор) вводили в виде однократной дозы внутривенно HCT-15-несущим бестимусным мышам (N=6/группу). Данные об оцениваемом объеме опухоли представляют собой среднее ± SEM. Стрелкой указано время введения. Оцениваемые объемы опухолей через 21 день после введения PankoMab-ADC и PM-N54Q-ADC сравнивали с группой, которой вводили контрольный hIgG-ADC, с использованием критерия Даннетта. ***P<0,001.
На фигуре 15 показана аминокислотная последовательность тяжелой цепи гуманизированного антитела PMN54Q (SEQ ID NO: 15, где аминокислота в положении 57 является Gln, а именно SEQ ID NO: 22).
На фигуре 16 показана аминокислотная последовательность легкой цепи гуманизированных антител PM N54Q и PankoMab (SEQ ID NO: 16).
На фигуре 17 показана аминокислотная последовательность тяжелой цепи гуманизированного антитела PankoMab (SEQ ID NO: 19).
На фигуре 18 показана аминокислотная последовательность тяжелой цепи химерного антитела PMN54Q (SEQ ID NO: 20, где аминокислота в положении 76 является Gln, а именно SEQ ID NO: 23).
На фигуре 19 показана аминокислотная последовательность легкой цепи химерного антитела PMN54Q (SEQ ID NO: 21).
Примеры
Пример 1:
1. Получение антител против MUC1.
Последовательность нуклеиновой кислоты тяжелой цепи гуманизированного антитела PankoMab (см., например, WO2011/012309) модифицировали посредством мутации кодона для Asn54 по системе нумерации Kabat/EU (положение аминокислоты 57 в SEQ ID NO: 11) в кодон для любой аминокислоты, за исключением Asn, в частности, для Gln.
1) Получение антител против MUC1 в линии клеток миелолейкоза человека
С помощью векторов, содержащих кодирующие последовательности тяжелой цепи γ1-типа и легкой цепи κ-типа мутантных антител, трансфицировали линию клеток миелолейкоза человека NM-H9D8 (DSM ACC2806). Разные антитела против MUC1, содержащие мутацию N54X (PankoMab N54X/PM-N54X, где X является любой аминокислотой, за исключением N/Asn) или мутации аминокислот в каркасных последовательностях VH и VL, экспрессировали в полученных клонах, продуцирующих конструкции с профилем гликозилирования человека. Концентрацию антител против MUC1 в супернатанте определяли посредством измерения Octet с использованием покрытых протеином A стержней или количественно анализировали по поглощению УФ при 280 нм после очистки с помощью хроматографии с протеином A. Характеристики связывания разных антител против MUC1 определяли с помощью ELISA с антигеном (см. пример 2), и выбранные очищенные антитела также анализировали с помощью анализа Скэтчарда (см. пример 3), Biacore (см. пример 4a), технологии DRX2 switchSENSE® (см. пример 4b) или проточной цитометрии (пример 7).
Кроме того, PM-N54Q и немутантное PankoMab с гликозилированием Fab также экспрессировали в линии клеток миелолейкоза человека NM-H9D8-E6Q12 (DSMACC2856), экспрессирующей антитело со сниженной фукозой. Вместе с теми же антителами, экспрессируемыми в NM-H9D8, эти антитела очищали и анализировали в примере 6 на их свойства связывания с рецептором Fc-гамма IIIA.
2) Получение антитела против MUC1 в линии клеток CHO
Кодирующие PM-N54Q последовательности (нуклеотидная последовательность тяжелой цепи PM-N54Q представлена SEQ ID NO: 17 и нуклеотидная последовательность легкой цепи PM-N54Q представлена SEQ ID NO: 18), которые синтезировали с помощью GeneArtTM от ThermoFisher Scientific, клонировали в экспрессионные векторы и с помощью полученных плазмид электротрансфицировали клетки CHO. Объединенные клетки, выращенные в условиях селекционного давления, использовали для производства мутантного антитела PM-N54Q общими способами. Антитело против MUC 1 (PM-N54Q), продуцируемое в линии клеток CHO, использовали для примеров 8 и 9.
2.PankoMab-ADC, N54Q-ADC и DXd
PankoMab-GEX, обозначающее гуманизированное моноклональное антитело против TA-MUC1, содержащее участок гликозилирования в CDR2-H2 (гликозилирование Fab), и PM-N54Q, обозначающее гуманизированное моноклональное антитело против TA-MUC1, в котором отсутствует гликозилирование Fab (пример 1-1), PankoMab-ADC и PM-N54Q-ADC получали известным способом, таким как описываемый в WO2014/057687 и WO2015/115091. Антитело PankoMab-GEX содержит тяжелую цепь, содержащую SEQ ID NO: 19, и легкую цепь, содержащую SEQ ID NO: 16, таким образом антитело PankoMab-GEX связано с лекарственным средством-линкером формулы 2. Упомянутое выше антитело PM-N54Q содержит тяжелую цепь, содержащую SEQ ID NO: 15, и легкую цепь, содержащую SEQ ID NO: 16, таким образом, антитело PM-N54Q связано с лекарственным средством-линкером формулы 2.
[Формула 2]
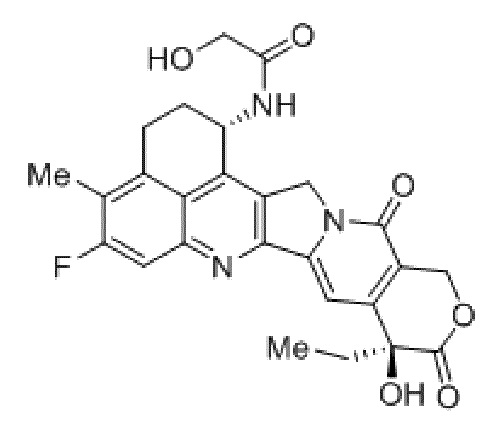
Такие структуры PankoMab-ADC и PM-N54Q-ADC соответствуют следующей формуле 5 (y: количество конъюгированных молекул лекарственного средства на молекулу антитело составляет от 4 до 8, а именно, среднее количество конъюгированных молекул лекарственного средства (y) на антитело: приблизительно 8), AB представляет собой PankoMab или PM-N54Q.
[Формула 5]

Контрольный hIgG-ADC состоял из гуманизированного моноклонального антитела IgG1 изотипического контроля, несвязывающегося с клетками млекопитающих, и того же лекарственного средства-линкера, что и PnakoMab-ADC и PM-N54Q-ADC. Нагрузку ADC (DXd) получали известным способом, таким, как описываемый в WO2014/057687 и WO2015/115091.
Пример 2: ELISA с антигеном
Характеристики связывания с антигеном PankoMab N54X,где участок N-гликозилирования в Fab-части подвергнут нокауту, сравнивали с PankoMab, имеющим участок N-гликозилирования в своей Fab-части.
Характеристики связывания Fab-дегликозилированной версии MUC1-специфического антитела PankoMab (PM-N54Q) по сравнению с (гликозилированным) PankoMab-GEX® анализировали с использованием по-разному гликозилированных и негликозилированных, полученных из MUC1 пептидов с тандемными повторами в исследованиях ELISA. В основном, оба антитела демонстрируют одинаковую степень связывания с гликозилированными пептидами PDTR (APPAHGVTSAPD-T(X)-RPAPGSTAPPAHGVTSA) с разным гликозилированием в T: наиболее сильное связывание наблюдали с пептидом PDTR, несущим Galβ1-3GalNAcальфа (TF) с последующим сиалированным TF и O-гликозилированием GalNAcальфа (Tn). Связывание в случае O-гликозилирования сиалированным GalNAcальфа (sTn) являлось значимо более низким. Как и PankoMab-GEX®, PM-N54Q демонстрировало лишь небольшую аффинность связывания с негликозилированным пептидом PDTR MUC1, что свидетельствует о соответствующей специфичности в отношении опухоли (фигура 1C).
Однако по сравнению с PankoMab-GEX® наблюдали в четыре раза более высокое связывание PM-N54Q в ELISA с антигеном TA-MUC1 с использованием биотинилированного гликопептида, несущего O-гликана GalNAcальфа (Tn). PM-N54Q связывается приблизительно в семь раз лучше с тем же пептидом MUC1 при гликозилировании сиалированным GalNAcальфа (sTn). Связывание с Galβ1-3GalNAcальфа (TF) и сиалированным TF (sTF) по треонину в последовательности PDTR (фигура 1A) было в два раза лучшим в случае PM-N54Q.
Оба антитела демонстрировали сильно сниженное связывание с вариантом пептида MUC1 APPAHGVTSAPE-S(Tn)-RPAPGSTAPPAHGVTSA с гликозилированием Tn по серину по сравнению с пептидом PDT(Tn)R. Однако Fab-дегликозилированное PM-N54Q также связывается значимо сильнее, чем PankoMab-GEX® (фигура 1B).
Различные другие Fab-дегликозилированные варианты PM-N54X сравнивали с PankoMab, имеющим N-гликозилирование в своей Fab-части. Сначала все варианты сравнивали непосредственно в супернатанте без очистки. Концентрацию определяли с помощью Octet. Все варианты PM-N54X связывались лучше, чем Fab-гликозилированное PM. Кроме того, наблюдали четкую тенденцию зависимости от химических свойств боковой цепи аминокислоты. Группы карбоновой кислоты на боковой цепи демонстрировали наименьшее усиление связывания. Лучшее связывание наблюдали в случае аминокислот с одним или двумя атомами азота (в виде первичных или вторичных аминов) (фигура 1D).
Кроме того, выбранные Fab-дегликозилированные варианты (PM-N54H, -W и -Q) очищали с помощью хроматографии с протеином A и анализировали посредством ELISA (фигура 1E). Улучшение связывания с пептидом TF-MUC1 является приблизительно 5-8-кратным, а с пептидом Tn-MUC1 - приблизительно 2-3-кратным по сравнению с PankoMab с Fab-гликозилированием, соответственно.
Кроме того, два разных варианта каркаса PM-N54Q анализировали на связывание с Tn-гликозилированным пептидом PDTR-MUC1 посредством ELISA (см. фигуру 1F). Вариант каркаса mf-a несет девять мутаций аминокислот в каркасе VH и три в каркасе VL; вариант mf-b также несет девять мутаций аминокислот в каркасе VH и четыре в каркасе VL. Оба мутантных варианта демонстрировали схожее связывание по сравнению с антителом PM-N54Q.
Пример 3: Сатурационные анализы связывания антител против MUC1 с клетками MCF-7 и ZR-75-1
Два фактора являются особенно критическими для терапевтической пригодности антитела: аффинность и количество участков связывания антитела на опухолевых клетках.
Связывание Fab-дегликозилированной версии MUC1-специфического антитела PankoMab (PM-N54Q) на TA-MUC-1-положительных линиях опухолевых клеток человека оценивали с использованием радиоактивно меченых антител посредством сатурационного анализа связывания на линии клеток карциномы молочной железы человека ZR-75-1 и MCF-7 по сравнению с Fab-гликозилированным PankoMab-GEX®. Антитела хелатировали 12-кратным молярным избытком p-SCN-бензил-DTPA в 50 мМ карбоната натрия, 150 мМ NaCl, pH8,7, в течение 2 ч. при 37°C с последующей инкубацией при 2-8°C в течение ночи. Свободный хелатор удаляли с помощью обессоливающих колонок и "тупиковой" фильтрации (отсечка 50 кДа, 6-кратная замена буфера на PBS). Хелатированные антитела радиоактивно метили 111In без носителя (2 мкКи/мкг антитела) в течение 1 ч. при 37°C в 6 мМ фосфате, 1,6 мМ KCl, 80 мМ NaCl, 0,2 M ацетата натрия, 0,1 M HCl. Препараты нейтрализовали добавлением 8-9-кратного объема 10-кратного концентрированного PBS. К препарату нейтрализованных меченых антител добавляли приблизительно 1/50 объема эмбриональной телячьей сыворотки. Для анализа связывания клеток использовали 1×106 клеток. К осажденным клеткам добавляли несколько концентраций меченых антител (30-1000 нг/200 мкл в 1% BSA/PBS). Смеси ресуспендированных клеток-антител измеряли с помощью счетчика гамма-излучения и инкубировали в течение 1 ч. при 4°C. Клетки со связанными антителами отделяли посредством центрифугирования и промывали 1% BSA/PBS в течение еще одного часа при 4°C. Затем клеточный осадок измеряли на связанное 111In-меченное антитело с помощью счетчика гамма-излучения. Оценку осуществляли с использованием "ka для одного участка" с помощью GraphPad Prism. Полученные данные приведены в таблице 1. Данные свидетельствуют о высокой аффинности и очень большом количестве участков связывания PM-N54Q на этих опухолевых клетках. Связывание являлось более чем в 2,5 раз более высоким, чем в случае PankoMab-GEX®, и а также количество участков связывания немного повышалось.
Таблица 1: Константа ассоциации и антигенсвязывающие участки на MUC1+ опухолевых клетках
Пример 4a: Анализ поверхностного плазмонного резонанса (BiaCore)
Связывание Fab-дегликозилированной версии MUC1-специфического антитела PankoMab (PM-N54Q) с полученным из TA-MUC-1 гликозилированным пептидом оценивали посредством анализа поверхностного плазмонного резонанса (Biacore). Стрептавидиновый сенсорный чип покрывали биотинилированным пептидом TA-MUC1 (Tn-гликозилированным или негликозилированным). PankoMab и PM-N54Q разводили последовательно 1:3 от 3600 до 4,9 нМ в HPS-EP. Разведения впрыскивали со скоростью 50 мкл/мин. Максимальное связывание каждой концентрации определяли в единицах ответа (RU), соответственно, и оценивали с использованием GraphPad Prism с помощью "связывания одного участка". На фигуре 2 показаны полученные кривые связывания с PM-N54Q по сравнению с PankoMab-GEX®. Вычисляли аффинности (KD) 388 нМ и 652 нМ в случае PM-N54Q и PankoMab-GEX®, соответственно. Таким образом, в этих экспериментальных условиях определяли приблизительно двукратное повышение аффинности.
Пример 4b: Флуоресцентное обнаружение приближения (с использованием DRX2, Dynamic Biosensors)
Новым способом определения констант связывания и аффинности является флуоресцентное обнаружение приближения с использованием одноцепочечной ДНК (96-мерной), нанесенной пятнами на чип, и комплементарной ДНК, соединенной с лигандом. В настоящем исследовании в качестве лиганда для захвата биотинилированных пептидов TA-MUC1 использовали стрептавидин. Связывание PankoMab с пептидами приводило к изменению флуоресценции. Скорости прямой и обратной реакции можно вычислять во время ассоциации и диссоциации. Благодаря более высокой чувствительности можно осуществлять мониторинг более быстрых взаимодействий по сравнению с поверхностным плазмонным резонансом. Это приводит к кинетике связывания, отличающейся, от SPR, но более сравнимой со способом "золотого стандарта" KinExA с измерением в жидкостной системе.
PankoMab и PM-N54Q разбавляли от 300 нМ в соотношении 1:9 постепенно до 3,67 нМ в буфере PE140 и наносили на связанные с чипом пептиды. Кривые связывания оценивали посредством моноэкспоненциальной глобальной аппроксимации (программное обеспечение устройства). Кривые связывания PM и PM-N54Q в качестве примеров приведены на фигуре 3A и B. Вычисленные аффинности вариантов PankoMab приведены в таблице 2:
Таблица 2: Константы диссоциации вариантов PankoMab от антигенного пептида
Пример 5: Биохимическая характеризация
Для анализа чистоты и идентичности антитела использовали электрофорез в ПААГ с SDS в невосстановительных и восстановительных условиях. Профиль полос на гелях в случае невосстановительных условий соответствует основной полосе в области приблизительно 160 кДа и методологическим артефактам тяжелых и легких цепей и их комбинаций (~25, 50-55, 75, 110, 135 кДа). На гелях в восстановительных условиях наблюдали отдельные полосы легких и тяжелых цепей в области 25 и 50-55 кДа. Из-за отсутствия гликозилирования Fab PM-N54Q имело меньшую тяжелую цепь, как и ожидали (см. фигуру 4, справа).
Профиль заряда четко отличается, о чем свидетельствует изоэлектрофокусирование (IEF; см. фигуру 5). Гликозилирование Fab, в значительной степени, представляет собой сиалирование, в то время как гликозилирование Fc лишь в минимальной степени представляет собой сиалирование. Таким образом, PankoMab-GEX® имеет более заряженные изоформы, чем PM-N54Q, что отражает более высокий уровень отрицательно заряженных сиаловых кислот в Fab-части.
Пример 6: Связывание рецептора Fcγ
Анализы связывания FcγR в случае FcγRIIIa (CD16a) основаны на технологии AlphaScreen® от PerkinElmer. Платформа AlphaScreen® основана на простой технологии на основе частиц от PerkinElmer и является более эффективной альтернативой общепринятому ELISA, т.к. не требуются стадии промывки.
Для анализов связывания рецепторов His-меченый FcγRIIIa (Glycotope GmbH) фиксировали на донорных хелатных частицах Ni. Связанные с антителами против MUC1 и антителами кролика против мыши акцепторные частицы конкурируют за связывание с FcγR. В случае взаимодействия FcγR со связанными с антителами кролика против мыши акцепторными частицами, донорные и акцепторные частицы сближаются, что после возбуждения лазером при 680 нм приводит к испусканию света. Максимального сигнала (сигналmax) достигают без конкурирующего средства. В случае конкуренции, когда тестовое антитело связывается с FcγR, сигналmax снижается в зависимости от концентрации. Хемилюминесценцию количественно анализировали посредством измерения при 520-620 нм (способ AlphaScreen®) с использованием многоканального ридера EnSpire 2300 (PerkinElmer). Все результаты выражали как среднее ± стандартное отклонение для двух параллельных образцов. Данные оценивали и вычисляли с использованием нелинейной аппроксимации кривой (сигмоидный переменный угловой коэффициент кривой доза-эффект) с использованием программного обеспечения GraphPad Prism 5. В результате получали зависящую от концентрации сигмоидную кривую, определяемую по верхнему плато, нижнему плато, угловому коэффициенту и EC50.
Как показано на фигуре 6A и B, аффинность связывания с FcγRIIIa являлась сравнимой в случае PankoMab N54Q и PankoMab, при этом на фигуре A показано, что в анализе использовали низкофукозилированные антитела, а на фигуре B - высокофукозилированные антитела. Таким образом, устранение гликозилирования Fab не влияло на взаимодействие антитела с рецептором.
Пример 7: Связывание с клеточным TA-MUC1
N54Q и N54D транзиторно экспрессировали и очищали с помощью хроматографии с протеином A. Связывание двух вариантов с TA-MUC1 на поверхности клеток сравнивали с PM с гликозилированием Fab с использованием двух разных линий клеток карциномы. Линия клеток плоскоклеточной карциномы языка HSC-4 экспрессирует TA-MUC1 со средней степенью, и линия клеток карциномы яичников CaOV-3 экспрессирует TA-MUC1 с высокой степенью. Опухолевые клетки инкубировали с антителами в серийных разведениях и связанные антитела определяли с использованием фикоэритрин-конъюгированного антитела козы против IgG человека (тяжелая и легкая цепь). Контрольный IgG человека включали для отслеживания фонового окрашивания. Связывание анализировали посредством проточной цитометрии.
Анализируемые конструкции PM, PM-N54Q и PM-N54D демонстрировали сильное и специфическое связывание с TA-MUC1-экспрессирующими клетками HSC-4 и CaOV-3 по сравнению с контрольным IgG1 человека (фигура 7). Связывание PM-N54D с TA-MUC1high клетками CaOV-3 являлось сравнимым с PM с гликозилированием Fab, в то время как PM-N54Q демонстрировало немного превосходящее связывание (фигура 7A). При использовании клеток карциномы HSC-4, экспрессирующих TA-MUC1 на промежуточном уровне, вариант PM-N54Q четко превосходил PM по связыванию с клеточным TA-MUC1, в то время PM-N54D демонстрировало худшее связывание по сравнению с PM с гликозилированием Fab (фигура 7B).
Пример 8: Оценка эффективности in vitro PankoMab-ADC и PM-N54Q-ADC
8.1 Линии клеток
Линию клеток рака молочной железы человека MDA-MB-468, линию клеток рака поджелудочной железы человека HPAC и линию клеток рака легких человека NCI-H441 использовали в качестве клеток, экспрессирующих TA-MUC1 на среднем или высоком уровне. Линию клеток колоректального рака человек HCT-15 использовали в качестве TA-MUC1-отрицательных клеток. Эти линии клеток приобретали в ATCC. Каждую линию клеток культивировали в соответствии с инструкцией. Уровень экспрессии TA-MUC1 на каждой линии злокачественных клеток подтверждали посредством проточной цитометрии.
8.2 Оценка эффективности in vitro PankoMab-ADC
Суспензию MDA-MB-468 получали для достижения концентрации 1,25×104 клеток/мл с использованием среды для культивирования и добавляли в каждую лунку черного 96-луночного планшета с прозрачным дном в количестве 80 мкл/лунку (1000 клеток/лунку). В случае лунок с пустыми пробами в лунки добавляли только среды в количестве 80 мкл/лунку (N=3). Все клетки инкубировали в течение ночи в условиях, подходящих для MDA-MB-468.
Суспензию HCT-15 получали для достижения концентрации 3,1×103 клеток/мл с использованием среды для культивирования, суспензию добавляли в каждую лунку черного 96-луночного планшета с прозрачным дном в количестве 80 мкл/лунку (250 клеток/лунку). В случае лунок с пустыми пробами, в лунки добавляли только среды в количестве 80 мкл/лунку (N=3). Все клетки инкубировали в течение ночи в условиях, подходящих для HCT-15.
На следующий день каждое из "голого" PankoMab, контрольного hIgG-ADC и PankoMab-ADC 3-кратно серийно разводили каждой средой для культивирования от 500 нМ до 0,2 нМ. По двадцать микролитров этих разведенных растворов добавляли в соответствующие лунки (конечная концентрация: от 100 нМ до 0,04 нМ). В случае лунок с пустыми пробами и необработанных лунок, в лунки добавляли 20 мкл каждой среды для культивирования в отдельности. Все планшеты инкубировали в течение 6 дней в условиях, подходящих для каждой линии клеток.
После инкубации измеряли количество АТФ в каждой лунке с использованием люминесцентного анализа жизнеспособности клеток CellTiter-Glo (Promega). Люминесценцию измеряли с помощью многоканального счетчика (ARVO X3, PerkinElmer Japan Co., Ltd.). Этот анализ осуществляли в трех параллелях.
Жизнеспособность клеток в каждом образце вычисляли по следующему уравнению:
Жизнеспособность клеток (%) = 100×(T-B)/(C-B)
T: интенсивность люминесценции тестовой лунки
C: средняя интенсивность люминесценции необработанных лунок
B: средняя интенсивность люминесценции лунок с пустыми пробами
8.3 Сравнение эффективности in vitro PankoMab-ADC и PM-N54Q-ADC
Суспензию HPAC получали для достижения концентрации 1,25×104 клеток/мл с использованием среды для культивирования и добавляли в каждую лунку черного 96-луночного планшета с прозрачным дном в количестве 80 мкл/лунку (1000 клеток/лунку). В случае лунок с пустыми пробами, в лунки добавляли только среды в количестве 80 мкл/лунку (N=3). Все клетки инкубировали в течение ночи в условиях, подходящих для HPAC.
Суспензию NCI-H441 получали для достижения концентрации 1,25×104 клеток/мл с использованием среды для культивирования и добавляли в каждую лунку черного 96-луночного планшета с прозрачным дном в количестве 80 мкл/лунку (1000 клеток/лунку). В случае лунок с пустыми пробами, в лунки добавляли только среды в количестве 80 мкл/лунку (N=3). Все клетки инкубировали в течение ночи в условиях, подходящих для NCI-H441.
На следующий день каждое из "голого" PankoMab, "голого" PM-N54Q, hIgG-ADC, PankoMab-ADC, и PM-N54Q-ADC 3-кратно серийно разводили каждой средой для культивирования от 500 нМ до 0,2 нМ. По двадцать микролитров этих разведенных растворов добавляли в соответствующие лунки (конечная концентрация: от 100 нМ до 0,04 нМ). В случае лунок с пустыми пробами и необработанных лунок, в лунки добавляли 20 мкл каждой среды для культивирования в отдельности. Все планшеты инкубировали в течение 6 дней в условиях, подходящих для каждой линии клеток.
После инкубации измеряли количество АТФ в каждой лунке с использованием люминесцентного анализа жизнеспособности клеток CellTiter-Glo (Promega). Люминесценцию измеряли с помощью многоканального счетчика (ARVO X3, PerkinElmer Japan Co., Ltd.). Этот анализ осуществляли в трех параллелях.
Жизнеспособность клеток в каждом образце вычисляли по следующему уравнению:
Жизнеспособность клеток (%) = 100×(T-B)/(C-B)
T: интенсивность люминесценции тестовой лунки
C: средняя интенсивность люминесценции необработанных лунок
B: средняя интенсивность люминесценции лунок с пустыми пробами
Соотношение мощности цитотоксической активности PankoMab-ADC и PM-N54Q-ADC в отношении HPAC и NCI-H441 и их 95% CI вычисляли посредством апостериорного анализа с использованием 3-параметрического логистического параллельного анализа (общий угловой коэффициент) с использованием EXSUS версии 8.1 (CAC Croit, Tokyo, Japan) на основе выпуска SAS 9.4 (SAS Institute Japan, Tokyo, Japan) (Emax: 100, Emin: оценка). Различия мощности цитотоксической активности считали значимыми, если 95% CI соотношения мощности исключал 1.
Пример 9: Оценка эффективности in vivo PankoMab-ADC и PM-N54Q-ADC
9.1 Линии клеток
Линию клеток рака молочной железы человека MDA-MB-468 и HCC70, линию клеток рака поджелудочной железы человека HPAC, и линию клеток рака легких человека NCI-H441 использовали в качестве клеток, экспрессирующих TA-MUC1 на среднем или высоком уровне. Линию клеток колоректального рака человек HCT-15 использовали в качестве TA-MUC1-отрицательных клеток. Эти линии клеток приобретали в ATCC. Линию клеток рака яичников человека OVCAR-5 приобретали в National Cancer Institute и использовали в качестве опухолевых клеток с низкой экспрессией TA-MUC1. Каждую линию клеток культивировали в соответствии с инструкцией. Уровень экспрессии TA-MUC1 на каждой линии злокачественных клеток подтверждали посредством проточной цитометрии и IHC-окрашивания.
9.2 Оценка эффективности in vivo PankoMab-ADC
Клетки MDA-MB-468 суспендировали в Matrigel (BD), 1×107 клеток подкожно трансплантировали в правый бок каждой самки бестимусной мыши (день 0) и the мышей случайным образом распределяли по группам в день 20 (N=6). После группирования раствор каждого из "голого" PankoMab, контрольного hIgG-ADC или PankoMab-ADC вводили в виде однократной дозы внутривенно в дозе 3 мг/кг. Группу, которой вводили носитель (ацетатный буферный раствор), принимали за контрольную группу. После введения длину и ширину опухоли у каждой мыши измеряли с помощью цифрового калипера дважды в неделю в течение 21 дня.
Клетки HCC70 суспендировали в физиологическом растворе (Otsuka Pharmaceutical Factory, Inc.), 1×107 клеток подкожно трансплантировали в правый бок каждой самки бестимусной мыши (день 0), и мышей случайным образом распределяли по группам в день 19 (N=6). После группирования раствор каждого из "голого" PankoMab, контрольного hIgG-ADC или PankoMab-ADC вводили в виде однократной дозы внутривенно в дозе 10 мг/кг. Группу, которой вводили носитель (ацетатный буферный раствор), принимали за контрольную группу. После введения длину и ширину опухоли у каждой мыши измеряли с помощью цифрового калипера дважды в неделю в течение 21 дня.
Оцениваемый объем опухоли у каждой мыши вычисляли по следующему уравнению:
Оцениваемый объем опухоли (мм3) = 1/2×длина (мм)×ширина (мм)2
Ингибирование роста опухоли (TGI, %) в каждой группе в последний день измерения в группах, которым вводили носитель, также вычисляли по следующему уравнению и округляли до целого числа.
TGI (%) = (1−T/C)×100
T: средний оцениваемый объем опухоли (мм3) в случае "голого" PankoMab, контрольного hIgG-ADC или PankoMab-ADC
C: средний оцениваемый объем опухоли (мм3) в группе, которой вводили носитель
Для оценки противоопухолевой эффективности PankoMab-ADC объемы опухолей каждой мыши в последний день измерения в группах, которым вводили (MDA-MB-468: день 41, HCC70: день 40), сравнивали с группами, которым вводили контрольный hIgG-ADC, или группой, которой вводили "голое" PankoMab, с использованием t-критерия Стьюдента. Все статистические анализы осуществляли в виде апостериорного анализа с использованием системы SAS выпуска 9.2 (SAS Institute Inc.). Статистически значимым считали значение P менее 0,05.
9.3 Сравнение эффективности in vivo PankoMab-ADC и PM-N54Q-ADC
Клетки HPAC суспендировали в физиологическом растворе (Otsuka Pharmaceutical Factory, Inc.), 3×106 клеток подкожно трансплантировали в правый бок каждой самки бестимусной мыши (день 0) и мышей случайным образом распределяли по группам в день 11 (N=6). После группирования раствор каждого из "голого" PM-N54Q, контрольного hIgG-ADC, PankoMab-ADC или PM-N54Q-ADC вводили в виде однократной дозы внутривенно в дозе 10 мг/кг. Группу, которой вводили носитель (ацетатный буферный раствор), принимали за контрольную группу. После введения длину и ширину опухоли у каждой мыши измеряли с помощью цифрового калипера дважды в неделю в течение 21 дня.
Клетки NCI-H441 суспендировали в Matrigel (BD), 5×106 клеток подкожно трансплантировали в правый бок каждой самки бестимусной мыши (день 0) и мышей случайным образом распределяли по группам в день 7 (N=6). После группирования растворы каждого из "голого" PankoMab или "голого" PM-N54Q вводили в виде однократной дозы внутривенно в дозе 10 мг/кг, и раствор контрольного hIgG-ADC, PankoMab-ADC или PM-N54Q-ADC вводили в виде однократной дозы внутривенно в дозе 3 мг/кг. Группу, которой вводили носитель (ацетатный буферный раствор), принимали за контрольную группу. После введения, длину и ширину опухоли у каждой мыши измеряли с помощью цифрового калипера дважды в неделю в течение 31 дня.
Клетки OVCAR-5 суспендировали в физиологическом растворе (Otsuka Pharmaceutical Factory, Inc.), 5×106 клеток подкожно трансплантировали в правый бок каждой самки бестимусной мыши (день 0) и мышей случайным образом распределяли по группам в день 12 (N=6). После группирования раствор "голого" PankoMab, "голого" PM-N54Q, контрольного hIgG-ADC, PankoMab-ADC или PM-N54Q-ADC вводили в виде однократной дозы внутривенно в дозе 10 мг/кг. Группу, которой вводили носитель (ацетатный буферный раствор), принимали за контрольную группу. После введения длину и ширину опухоли у каждой мыши измеряли с помощью цифрового калипера дважды в неделю в течение 21 дня.
Клетки HCT-15 суспендировали в физиологическом растворе (Otsuka Pharmaceutical Factory, Inc.), 5×106 клеток подкожно трансплантировали в правый бок каждой самки бестимусной мыши (день 0) и мышей случайным образом распределяли по группам в день 10 (N=6). После группирования раствор контрольного hIgG-ADC, PankoMab-ADC или PM-N54Q-ADC вводили в виде однократной дозы внутривенно в дозе 10 мг/кг. Группу, которой вводили носитель (ацетатный буферный раствор), принимали за контрольную группу. После введения длину и ширину опухоли у каждой мыши измеряли с помощью цифрового калипера дважды в неделю в течение 21 дня.
Объем опухоли у каждой мыши вычисляли по следующему уравнению:
Оцениваемый объем опухоли (мм3) = 1/2×длина (мм)×ширина (мм)2
Ингибирование роста опухоли (TGI, %) у каждой мыши в последний день измерения в группах, которым вводили носитель, или в последний день, когда все группы еще были живы, также вычисляли по следующему уравнению и округляли до целого числа.
TGI (%) = (1−T/C)×100
T: средний оцениваемый объем опухоли (мм3) в случае "голого" PankoMab, "голого" PM-N54Q, контрольного hIgG-ADC, PankoMab-ADC или PM-N54Q-ADC
C: средний оцениваемый объем опухоли (мм3) в группе, которой вводили носитель
Для оценки противоопухолевой эффективности каждого соединения в отношении мышей, несущих HPAC, NCI-H441, OVCAR-5 и HCT-15, объемы опухолей у каждой мыши мышь в последний день измерения в группах, которым вводили контрольный hIgG-ADC (HPAC: день 32, NCI-H441: день 38, HCT-15: день 32), или в последний день, когда все группы все еще были живы (OVCAR-5: день 26), сравнивали с группами, которым вводили контрольный hIgG-ADC, с использованием критерия Даннетта. Кроме того, объемы опухолей OVCAR-5-несущих бестимусных мышей в день 33 сравнивали с помощью t-критерия Стьюдента между группами, которым вводили PankoMab-ADC и PM-N54Q-ADC. Все статистические анализы осуществляли в виде апостериорного анализа с использованием системы SAS выпуска 9.2 (SAS Institute Inc.). Статистически значимым считали значение P менее 0,05.
Пример 10: Результаты
10.1 Цитотоксическая активность PankoMab-ADC в отношении TA-MUC1-положительных линий злокачественных клеток и отрицательных клеток in vitro
Для исследования того, демонстрирует ли PankoMab-ADC зависящую от мишени и зависящую от лекарственного средства цитотоксическую активность в отношении линий злокачественных клеток человека, оценивали эффективность in vitro "голого" PankoMab, контрольного hIgG-ADC и PankoMab-ADC в отношении клеток рака молочной железы человека MDA-MB-468 (TA-MUC1-положительных) и клеток колоректального рака человека HCT-15 (TA-MUC1-отрицательных). Как показано на фигуре 8, "голое" PankoMab и hIgG-ADC демонстрировали небольшую активность в отношении каждой линии клеток (IC50>100 нМ). В этих условиях PankoMab-ADC демонстрировал дозозависимую цитотоксическую активность в отношении TA-MUC1-положительных клеток MDA-MB-468 (фигура 8A, IC50<10 нМ). Но он не демонстрировал активность в отношении TA-MUC1-отрицательных клеток HCT-15 (фигура 8B, IC50>100 нМ). Учитывая эти результаты, был сделан вывод о том, что PankoMab-ADC демонстрирует зависящую от мишени и зависящую от лекарственного средства цитотоксическую активность в отношении TA-MUC1-положительных линий злокачественных клеток in vitro.
1.2 Сравнение цитотоксической активности PankoMab-ADC и PM-N54Q-ADC в отношении TA-MUC1-положительных клеток in vitro
Для исследования того, может ли улучшение аффинности связывания антигена вносить вклад в повышение цитотоксической активности, оценивали эффективность in vitro PankoMab-ADC и PM-N54Q-ADC в отношении линии клеток рака поджелудочной железы человека HPAC и линия клеток рака легких человека NCI-H441. Цитотоксическая активность PM-N54Q-ADC в отношении них являлась более чем в 1,5 раз более высокой, чем у PankoMab-ADC (фигура 8C и фигура 8D). Соотношение мощности PM-N54Q-ADC и PankoMab-ADC в отношении HPAC составляло 1,917 (1,611-2,280, 95% CI), и в отношении NCI-H441 составляло 1,663 (1,495-1,849, 95% CI при EC50). Эти данные свидетельствуют о том, что цитотоксическая активность PM-N54Q-ADC являлась значимо более высокой, чем у PankoMab-ADC. Эти результаты позволяют предполагать, что улучшение аффинности связывания антигена PankoMab-ADC может вносить свой вклад в значимое повышение активности уничтожения клеток.
10.3 Противоопухолевая эффективность PankoMab-ADC в отношении TA-MUC1-положительной опухоли
Для исследования того, проявляет ли PankoMab-ADC эффективность не только in vitro, но также и in vivo, оценивали противоопухолевую эффективность "голого" PankoMab, контрольного hIgG-ADC и PankoMab-ADC в отношении MDA-MB-468-несущих мышей. Как показано на фигуре 9, "голое" PankoMab и контрольный IgG-ADC (3 мг/кг, однократное введение) не демонстрировали противоопухолевую эффективность (оба TGI составляли -18% в день 41). В отличие от этого, PankoMab-ADC (3 мг/кг, однократное введение) значительно ингибировал рост опухоли (TGI составляло 97% в день 41). Кроме того, он демонстрировал значимую противоопухолевую эффективность по сравнению с контрольным hIgG-ADC и "голым" PankoMab (в обоих случаях P<0,001 в день 41). В терминах изменения массы тела, не наблюдали какой-либо потери массы тела, вызванным введением лекарственных средств, во всех группах, которым вводили лекарственные средства.
Также оценивали противоопухолевую эффективность "голого" PankoMab, контрольного hIgG-ADC и PankoMab-ADC в отношении HCC70-несущих мышей. Как показано на фигуре 10, "голое" PankoMab и контрольный hIgG-ADC (10 мг/кг, однократное введение) демонстрировали низкую противоопухолевую эффективность в отношении этих моделей ксенотрансплантатов (TGI составляло 10% и 29% в день 40, соответственно). В отличие от этого, PankoMab-ADC (10 мг/кг, однократное введение) значимо ингибировал рост опухоли (TGI составляло 95% в день 40). Кроме того, он демонстрировал статистически значимую противоопухолевую эффективность по сравнению с контрольным hIgG-ADC (в обоих случаях P<0,001 в день 40). В терминах изменения массы тела, не наблюдали какой-либо потери массы тела, вызванным введением лекарственных средств, во всех группах, которым вводили лекарственные средства. Эти результаты позволяют предполагать, что PankoMab-ADC имеет высокую противоопухолевую эффективность и демонстрирует зависящую от мишени и зависящую от лекарственного средства противоопухолевую эффективность в отношении различных моделей TA-MUC1-положительных ксенотрансплантатов.
10.4 Сравнение противоопухолевой эффективности PankoMab-ADC и PM-N54Q-ADC в отношении TA-MUC1-положительной опухоли in vivo
Для исследования того, имеет ли PM-N54Q-ADC равную или более высокую противоопухолевую эффективность в отношении TA-MUC1-положительных опухолевых клеток по сравнению с PankoMab-ADC, сравнивали противоопухолевую эффективность PankoMab-ADC и PM-N54Q-ADC в отношении различных типов TA-MUC1-положительных опухолевых клеток.
Сначала авторы настоящего изобретения оценивали эффективность in vivo в отношении опухолевых клеток HPAC и NCI-H441 со средней или высокой экспрессией TA-MUC1. Как показано на фигуре 11, "голое" PM-N54Q и контрольный hIgG-ADC (10 мг/кг, однократное введение) демонстрировали низкую противоопухолевую эффективность в отношении HPAC-несущих мышей (TGI составляло 27% и 18% в день 32, соответственно). В отличие от этого, PankoMab-ADC и PM-N54Q-ADC (10 мг/кг, однократное введение) значительно ингибировали рост опухоли (оба TGI составляли 93% в день 32). Кроме того, PankoMab-ADC и PM-N54Q-ADC (10 мг/кг, однократное введение) демонстрировали статистически значимую противоопухолевую эффективность по сравнению с контрольным hIgG-ADC (в обоих случаях P<0,001 в день 32). В терминах изменения массы тела, не наблюдали какой-либо потери массы тела, вызванным введением лекарственных средств, во всех группах, которым вводили лекарственные средства.
Как показано на фигуре 12, "голое" PankoMab и "голое" PM-N54Q (10 мг/кг, однократное введение) демонстрировали низкую противоопухолевую эффективность в отношении NCI-H441-несущих мышей (TGI составляло 8% и 12% в день 38, соответственно). Хотя в группе, которой вводили контрольный hIgG-ADC (3 мг/кг, однократное введение), наблюдали противоопухолевую эффективность в течение двух недель после введения, наблюдали возобновление роста опухоли после дня 21 (TGI составляло 71% в день 38). В отличие от этого, PankoMab-ADC и PM-N54Q-ADC (3 мг/кг, однократное введение) значительно ингибировали рост опухоли (оба TGI составляли 99% в день 38). Кроме того, PankoMab-ADC и PM-N54Q-ADC демонстрировали статистически значимую противоопухолевую эффективность по сравнению с контрольным hIgG-ADC (P<0,001 в день 38, соответственно). В терминах изменения массы тела, не наблюдали какой-либо потери массы тела, вызванным введением лекарственных средств, во всех группах, которым вводили лекарственные средства.
Затем авторы настоящего изобретения оценивали эффективность in vivo в отношении опухолевых клеток OVCAR-5 с низкой экспрессией TA-MUC1. Как показано на фигуре 13, "голое" PankoMab, PM-N54Q и контрольный hIgG-ADC (10 мг/кг, однократное введение) демонстрировали небольшую противоопухолевую эффективность в отношении OVCAR5-несущих мышей (TGI составляло 1%, 11% и 3% в день 26, соответственно). В этой модели противоопухолевая эффективность PankoMab-ADC (10 мг/кг, однократное введение) была ограничена (TGI составляло 37% в день 26), но PM-N54Q-ADC (10 мг/кг, однократное введение) демонстрировал высокую противоопухолевая эффективность(TGI составляло 73% в день 26). Кроме того, PankoMab-ADC и PM-N54Q-ADC демонстрировали статистически значимую противоопухолевую эффективность по сравнению с контрольным hIgG-ADC (P=0,01 и P<0,001 в день 26, соответственно). Кроме того, PM-N54Q-ADC демонстрировал статистически значимую противоопухолевую эффективность по сравнению с PankoMab-ADC (P<0,001 в день 26). В терминах изменения массы тела, не наблюдали какой-либо потери массы тела, вызванным введением лекарственных средств, во всех группах, которым вводили лекарственные средства.
И наконец, авторы настоящего изобретения оценивали эффективность in vivo в отношении опухолевых клеток HCT-15, являющихся TA-MUC1-отрицательными.
Как показано на фигуре 14, "голое" PankoMab и PM-N54Q (10 мг/кг, однократное введение) демонстрировали небольшую противоопухолевая эффективность в отношении этой модели (TGI составляло 7%, 4% в день 32, соответственно). Кроме того, PankoMab-ADC, PM-N54Q-ADC и контрольный hIgG-ADC также демонстрировали небольшую противоопухолевую эффективность в отношении этой модели (TGI составляло 15%, 22%, и 26% в день 32, соответственно).
Учитывая эти результаты, был сделан вывод о том, что противоопухолевая эффективность PankoMab-ADC и PM-N54Q-ADC зависит от мишени и зависит от лекарственного средства. Кроме того, улучшение аффинности связывания антигена может вносить свой вклад в повышение противоопухолевой эффективности в отношении TA-MUC1-положительных опухолевых клеток.
Идентификация депонируемого биологического материала
Линии клеток DSM ACC 2806, DSM ACC 2807 и DSM ACC 2856 депонированы в DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Inhoffenstraβe 7B, 38124 Braunschweig (DE) от лица Glycotope GmbH, Robert-Rössle-Str. 10, 13125 Berlin (DE) на даты, указанные в следующей таблице.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Daiichi Sankyo Company, Limited
<120> КОНЪЮГАТ АНТИТЕЛО ПРОТИВ MUC1-ЛЕКАРСТВЕННОЕ СРЕДСТВО
<130> PN838543
<150> EP18173253.8
<151> 2018-05-18
<160> 23
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR-H1
<400> 1
Asn Tyr Trp Met Asn
1 5
<210> 2
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR-H2
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> Xaa является любой аминокислотой, за исключением Asn
<400> 2
Glu Ile Arg Leu Lys Ser Asn Xaa Tyr Thr Thr His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 3
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR-H3
<400> 3
His Tyr Tyr Phe Asp Tyr
1 5
<210> 4
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR-L1
<400> 4
Arg Ser Ser Lys Ser Leu Leu His Ser Asn Gly Ile Thr Tyr Phe Phe
1 5 10 15
<210> 5
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR-L2
<400> 5
Gln Met Ser Asn Leu Ala Ser
1 5
<210> 6
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR-L3
<400> 6
Ala Gln Asn Leu Glu Leu Pro Pro Thr
1 5
<210> 7
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR-H2
<400> 7
Glu Ile Arg Leu Lys Ser Asn Gln Tyr Thr Thr His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 8
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR-H2
<400> 8
Glu Ile Arg Leu Lys Ser Asn Asn Tyr Thr Thr His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 9
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи
<220>
<221> ВАРИАНТ
<222> (57)..(57)
<223> Xaa является любой аминокислотой, за исключением Asn
<400> 9
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Arg Leu Ser Cys Val Ala Ser Gly Phe Pro Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Lys Ser Asn Xaa Tyr Thr Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Arg His Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 10
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи
<400> 10
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Arg Leu Ser Cys Val Ala Ser Gly Phe Pro Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Lys Ser Asn Gln Tyr Thr Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Arg His Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 11
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Arg Leu Ser Cys Val Ala Ser Gly Phe Pro Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Lys Ser Asn Asn Tyr Thr Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Arg His Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 12
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи
<400> 12
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Asn Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Phe Phe Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 13
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Эпитоп
<400> 13
Pro Asp Thr Arg
1
<210> 14
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Эпитоп
<400> 14
Pro Glu Ser Arg
1
<210> 15
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь
<220>
<221> ВАРИАНТ
<222> (57)..(57)
<223> Xaa является любой аминокислотой, за исключением Asn
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Arg Leu Ser Cys Val Ala Ser Gly Phe Pro Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Lys Ser Asn Xaa Tyr Thr Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Arg His Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Gly Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 16
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь
<400> 16
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Asn Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Phe Phe Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 17
<211> 1401
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь
<400> 17
atgaagcacc tgtggttctt tctgctgctg gtggccgctc ctagatgggt gctgtctgaa
60
gtgcagctgg tggaatctgg cggaggattg gttcagcctg gcggctccat gagactgtct
120
tgtgtggcct ctggcttccc cttctccaac tactggatga actgggtccg acaggcccct
180
ggcaaaggac tggaatgggt cggagagatc cggctgaagt ccaaccagta caccacacac
240
tacgccgagt ccgtgaaggg cagattcacc atctctcggg acgactccaa gaactccctg
300
tacctgcaga tgaacagcct gaaaaccgag gacaccgccg tgtactactg cacccggcac
360
tactacttcg actactgggg ccagggcacc ctggtcacag tttcttccgc ttccaccaag
420
ggacccagcg tgttccctct ggctccttcc agcaagtcta cctctggcgg aacagctgct
480
ctgggctgcc tggtcaagga ctactttcct gagcctgtga ccgtgtcctg gaactctggc
540
gctctgacat ctggcgtgca cacctttcca gctgtgctgc agtcctccgg cctgtactct
600
ctgtcctctg tcgtgaccgt gccttccagc tctctgggaa cccagaccta catctgcaat
660
gtgaaccaca agccttccaa caccaaggtg gacaagaagg tggaacccaa gtcctgcgac
720
aagacccaca cctgtcctcc atgtcctgct ccagaactgc tcggcggacc ttccgtgttc
780
ctgtttcctc caaagcctaa ggacaccctg atgatcagca gaacccctga agtgacctgc
840
gtggtggtgg atgtgtctca cgaggacccc gaagtgaagt tcaattggta cgtggacggc
900
gtggaagtgc acaacgccaa gaccaagcct agagaggaac agtacaactc cacctacaga
960
gtggtgtccg tgctgaccgt gctgcaccag gattggctga acggcaaaga gtacaagtgc
1020
aaggtgtcca acaaggccct gcctgctcct atcgaaaaga ccatctccaa ggccaagggc
1080
cagcctaggg aaccccaggt ttacaccttg cctccaagca gggacgagct gaccaagaac
1140
caggtgtccc tgacctgcct cgtgaaggga ttctacccct ccgatatcgc cgtggaatgg
1200
gagtctaatg gccagcctga gaacaactac aagacaaccc ctcctgtgct ggactccgac
1260
ggctcattct tcctgtactc caagctgaca gtggacaagt ccagatggca gcagggcaac
1320
gtgttctcct gctccgtgat gcatgagggc ctgcacaacc actacaccca gaagtccctg
1380
tctctgagcc ccggcaaatg a
1401
<210> 18
<211> 720
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь
<400> 18
atggttctgc agacacaggt gttcatctcc ctgctgctgt ggatctctgg cgcctacggc
60
gacatcgtga tgacccagtc tccactgagc aaccccgtga cacctggcga gcctgcctcc
120
atctcttgcc ggtcctctaa gtctctgctg cactccaacg gcatcaccta ctttttctgg
180
tatctgcaga agcccggcca gtctcctcag ctgctgatct accagatgtc caacctggcc
240
tctggcgtgc ccgatagatt ttccggctct ggctctggca ccgacttcac cctgagaatc
300
tccagagtgg aagccgagga cgtgggcgtg tactactgtg cccagaacct ggaactgcct
360
cctacctttg gccagggcac caaggtggaa atcaagcgga cagtggccgc tccttccgtg
420
tttatcttcc caccttccga cgagcagctg aagtccggca cagcttctgt cgtgtgcctg
480
ctgaacaact tctaccctcg ggaagccaag gtgcagtgga aggtggacaa tgccctgcag
540
tccggcaact cccaagagtc tgtgaccgag caggactcca aggacagcac ctacagcctg
600
tcctccacac tgaccctgtc caaggccgac tacgagaagc acaaggtgta cgcctgcgaa
660
gtgacccatc agggcctgtc tagccctgtg accaagtctt tcaaccgggg cgagtgctga
720
<210> 19
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Arg Leu Ser Cys Val Ala Ser Gly Phe Pro Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Lys Ser Asn Asn Tyr Thr Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Arg His Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Gly Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 20
<211> 460
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь
<220>
<221> ВАРИАНТ
<222> (76)..(76)
<223> Xaa является любой аминокислотой, за исключением Asn
<400> 20
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Met Arg Leu Ser Cys Val Ala Ser Gly Phe Pro Phe
35 40 45
Ser Asn Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Gly Glu Ile Arg Leu Lys Ser Asn Xaa Tyr Thr Thr His
65 70 75 80
Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Thr Arg His Tyr Tyr Phe Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val
130 135 140
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr
145 150 155 160
Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr
165 170 175
Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser
195 200 205
Ser Thr Trp Pro Ser Gln Thr Val Thr Cys Asn Val Ala His Pro Ala
210 215 220
Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys
225 230 235 240
Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe
245 250 255
Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val
260 265 270
Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe
275 280 285
Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Lys Pro
290 295 300
Arg Glu Glu Gln Ile Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro
305 310 315 320
Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val
325 330 335
Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
340 345 350
Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys
355 360 365
Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asn
370 375 380
Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro
385 390 395 400
Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser
405 410 415
Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala
420 425 430
Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His
435 440 445
His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
450 455 460
<210> 21
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь
<400> 21
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Ile Val Met Thr Gln Ser Pro Leu Ser Asn Pro
20 25 30
Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser
35 40 45
Leu Leu His Ser Asn Gly Ile Thr Tyr Phe Phe Trp Tyr Leu Gln Lys
50 55 60
Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
85 90 95
Thr Leu Arg Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
100 105 110
Cys Ala Gln Asn Leu Glu Leu Pro Pro Thr Phe Gly Gln Gly Thr Lys
115 120 125
Val Glu Ile Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro
130 135 140
Pro Ser Ser Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe
145 150 155 160
Leu Asn Asn Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp
165 170 175
Gly Ser Glu Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp
180 185 190
Ser Lys Asp Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys
195 200 205
Asp Glu Tyr Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys
210 215 220
Thr Ser Thr Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
225 230 235
<210> 22
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь
<400> 22
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Arg Leu Ser Cys Val Ala Ser Gly Phe Pro Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Lys Ser Asn Gln Tyr Thr Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Arg His Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Gly Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 23
<211> 460
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь
<400> 23
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Met Arg Leu Ser Cys Val Ala Ser Gly Phe Pro Phe
35 40 45
Ser Asn Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Gly Glu Ile Arg Leu Lys Ser Asn Gln Tyr Thr Thr His
65 70 75 80
Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Thr Arg His Tyr Tyr Phe Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val
130 135 140
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr
145 150 155 160
Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr
165 170 175
Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser
195 200 205
Ser Thr Trp Pro Ser Gln Thr Val Thr Cys Asn Val Ala His Pro Ala
210 215 220
Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys
225 230 235 240
Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe
245 250 255
Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val
260 265 270
Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe
275 280 285
Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Lys Pro
290 295 300
Arg Glu Glu Gln Ile Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro
305 310 315 320
Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val
325 330 335
Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
340 345 350
Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys
355 360 365
Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asn
370 375 380
Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro
385 390 395 400
Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser
405 410 415
Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala
420 425 430
Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His
435 440 445
His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
450 455 460
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ПРОТИВ MUC1 | 2019 |
|
RU2792347C2 |
| АМАТОКСИНОВЫЕ КОНЪЮГАТЫ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2826004C2 |
| КОНЪЮГАТ АНТИТЕЛА ПРОТИВ CEA И АНАЛОГА ЭКСАТЕКАНА И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2833323C1 |
| НАЦЕЛЕННЫЕ НА uPARAP КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2017 |
|
RU2740311C2 |
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18.2 И ЕГО КОНЪЮГАТ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2022 |
|
RU2814164C2 |
| КОНЪЮГАТЫ АНТИТЕЛ С ЛЕКАРСТВЕННЫМИ ВЕЩЕСТВАМИ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2799547C2 |
| ЛЕКАРСТВЕННЫЙ КОНЪЮГАТ ПРОИЗВОДНОГО ЭРИБУЛИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2021 |
|
RU2830242C1 |
| АНТИТЕЛА ПРОТИВ CD79b, КОНЪЮГАТЫ С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2805251C2 |
| ЛЕКАРСТВЕННЫЕ КОНЪЮГАТЫ ИЗ МОНОКЛОНАЛЬНЫХ АГЕНТОВ, СВЯЗЫВАЮЩИХ cMET, И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2813828C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С ROR2 | 2018 |
|
RU2784586C2 |
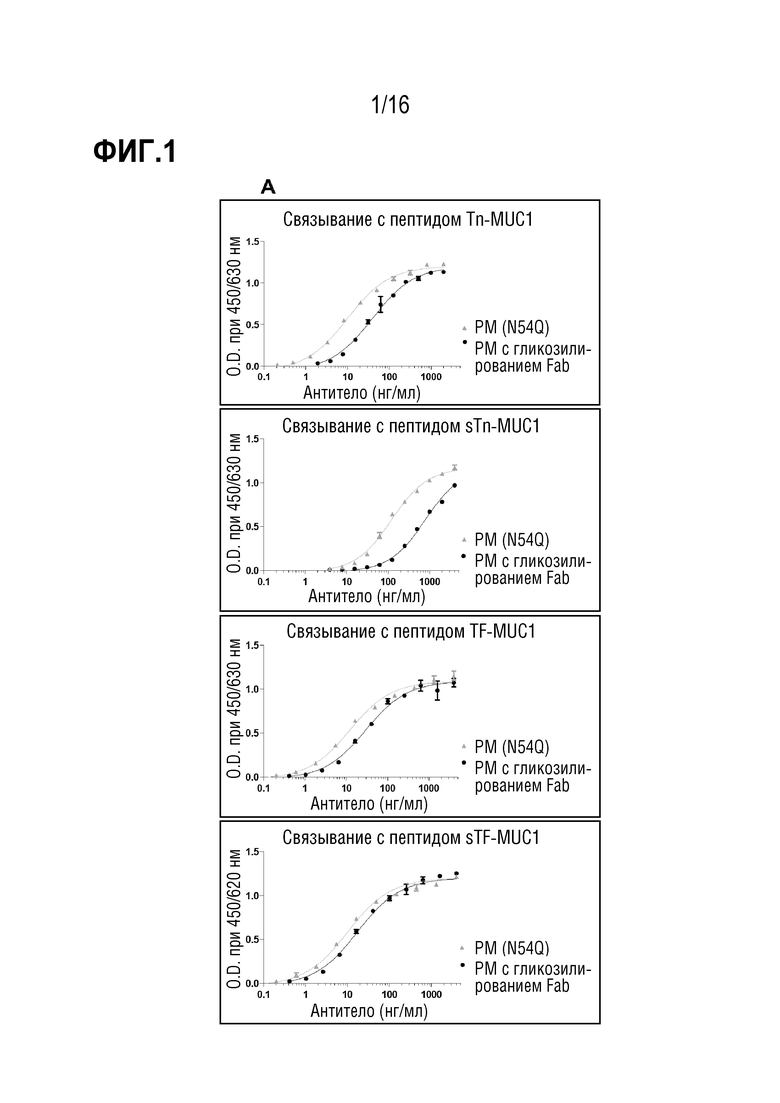
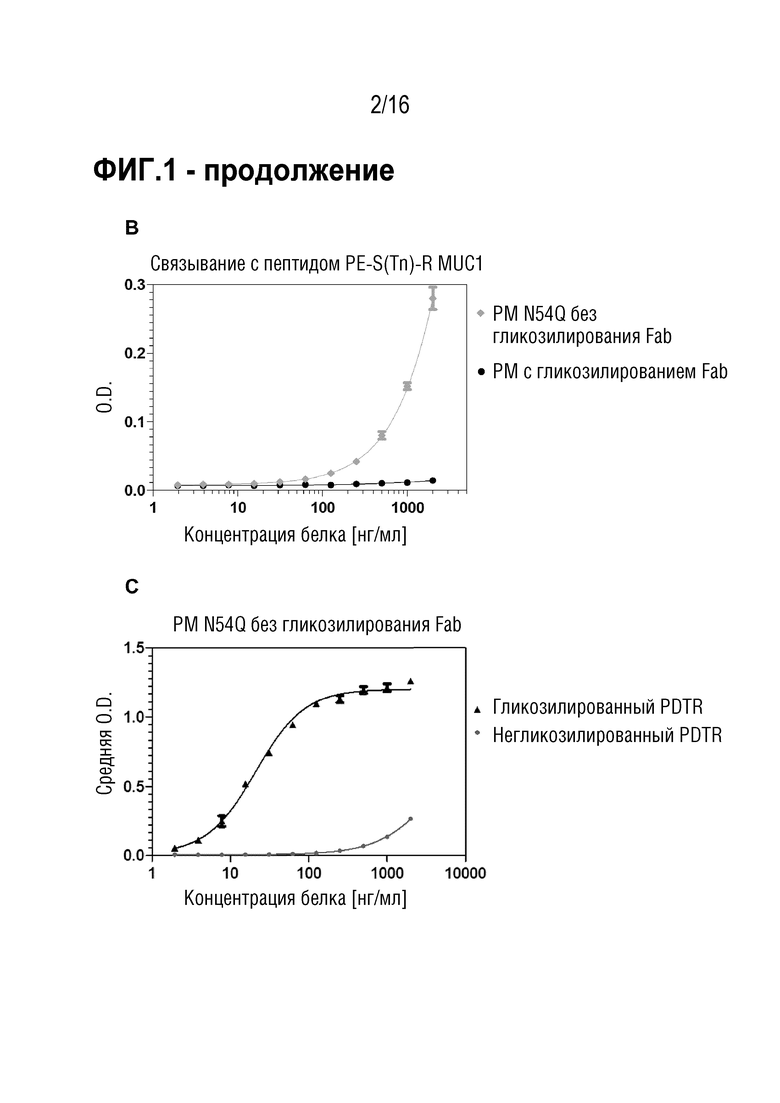
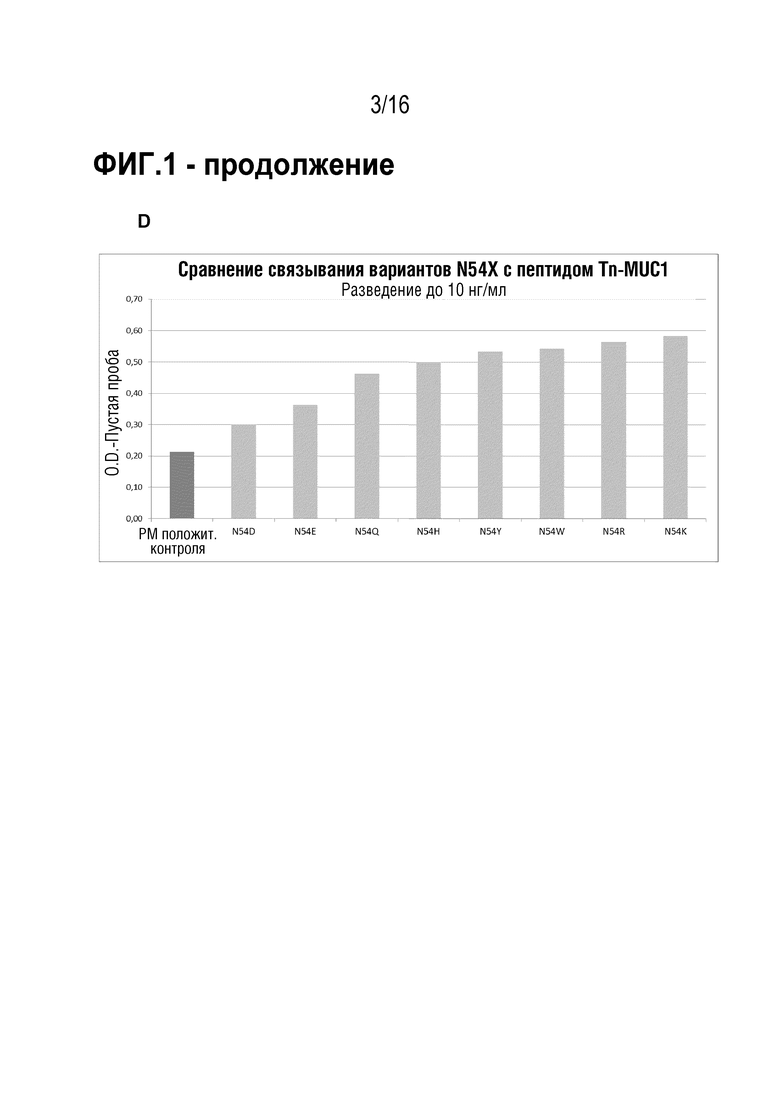
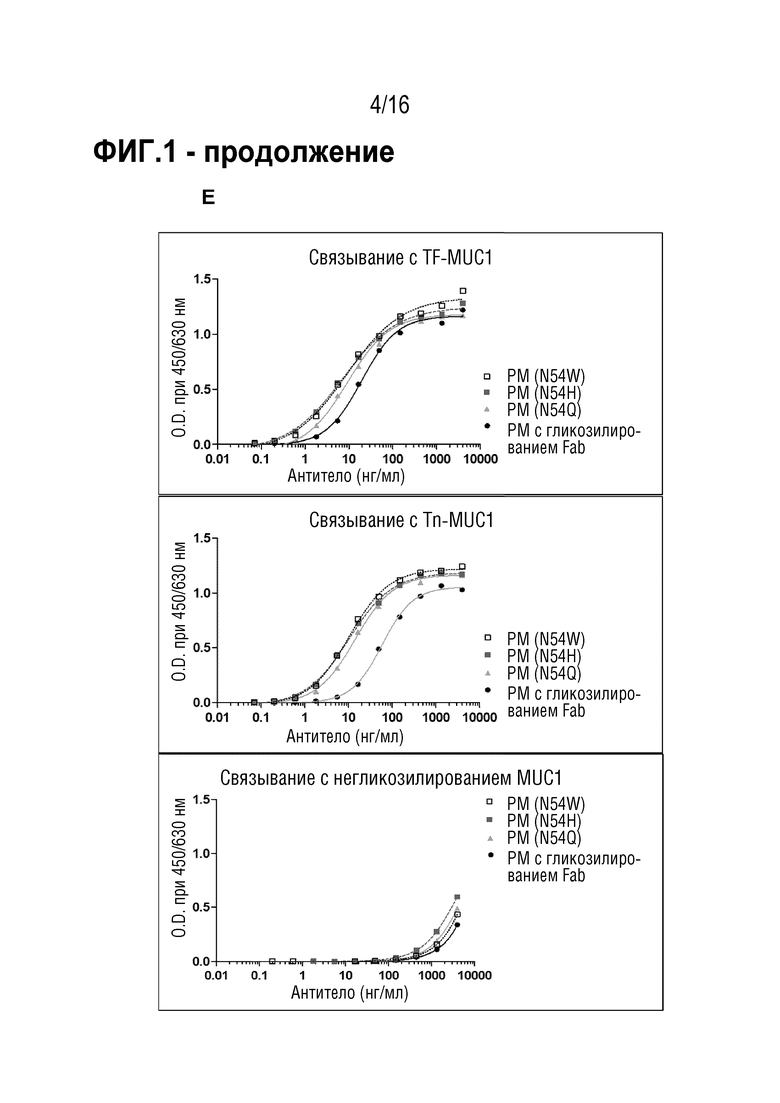
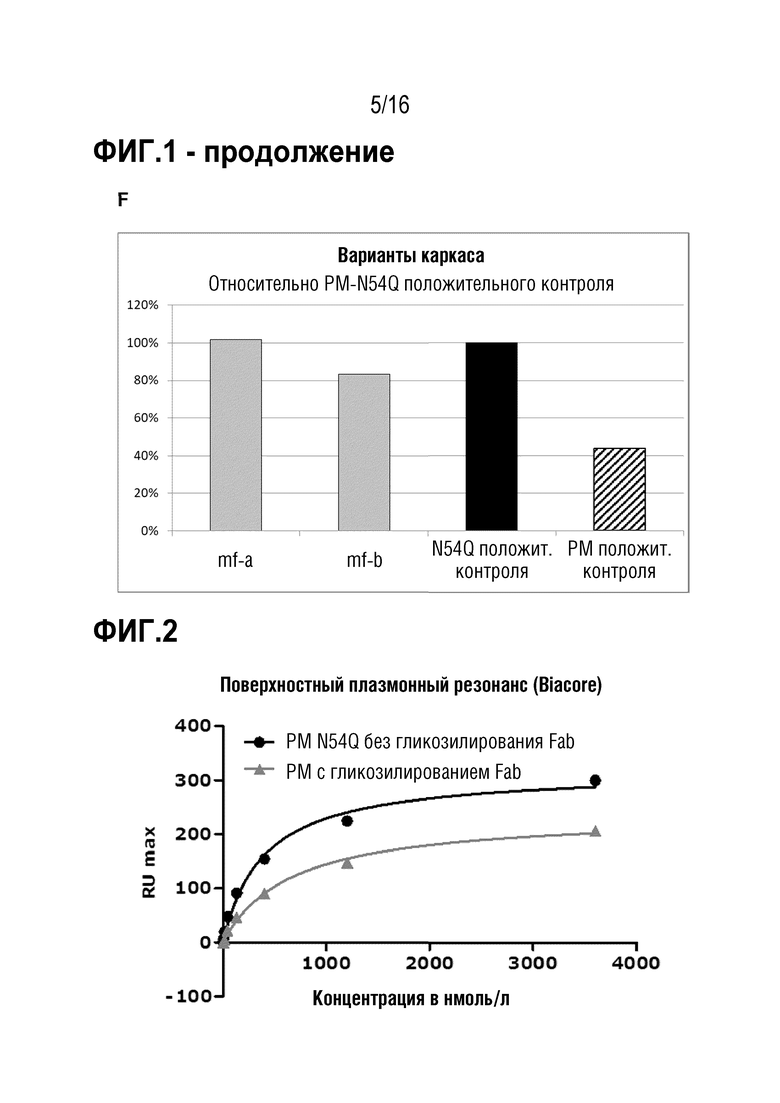
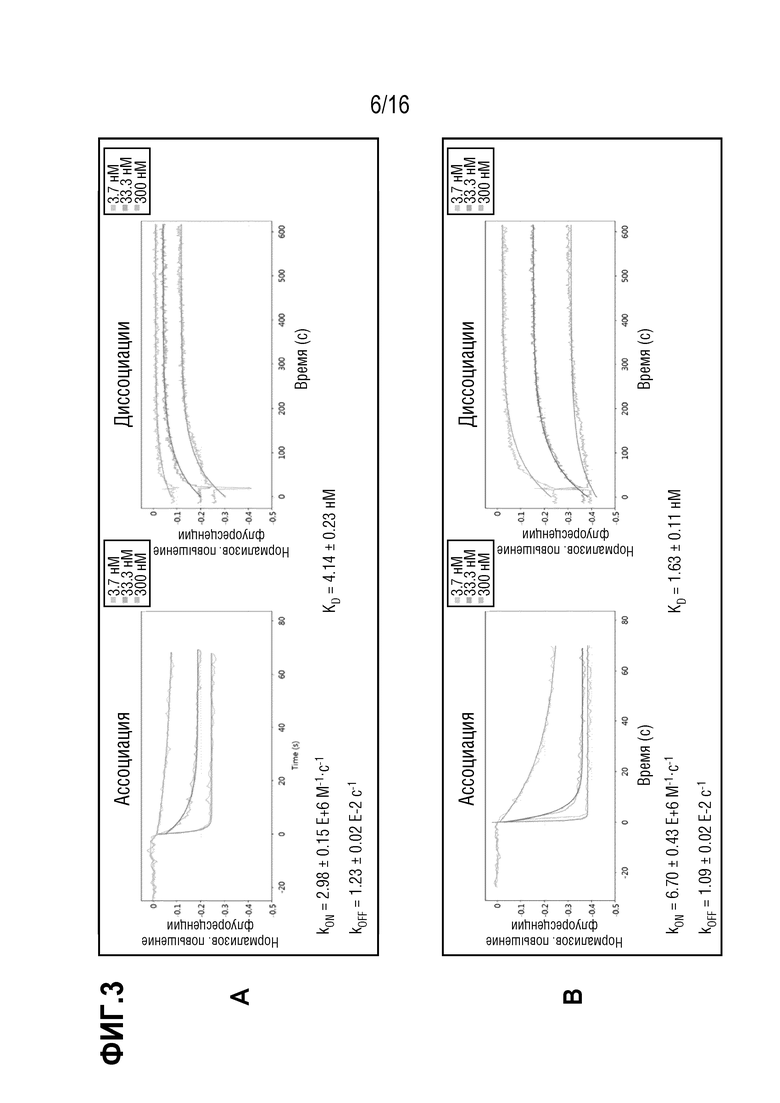
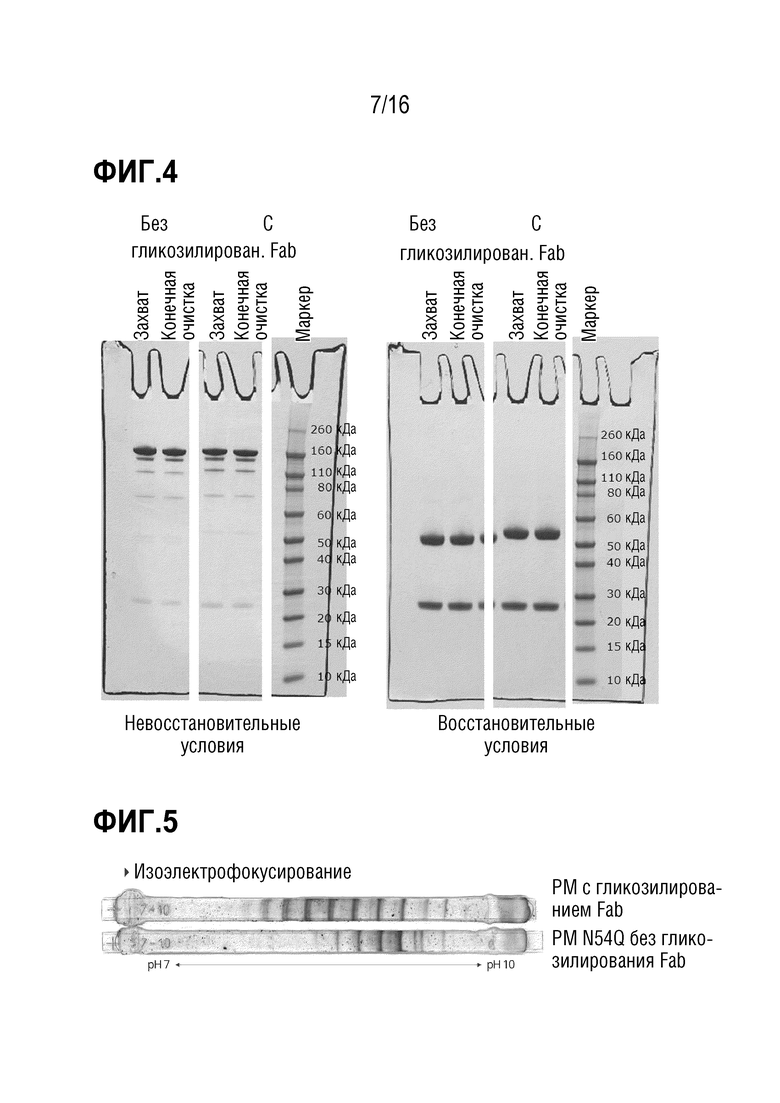
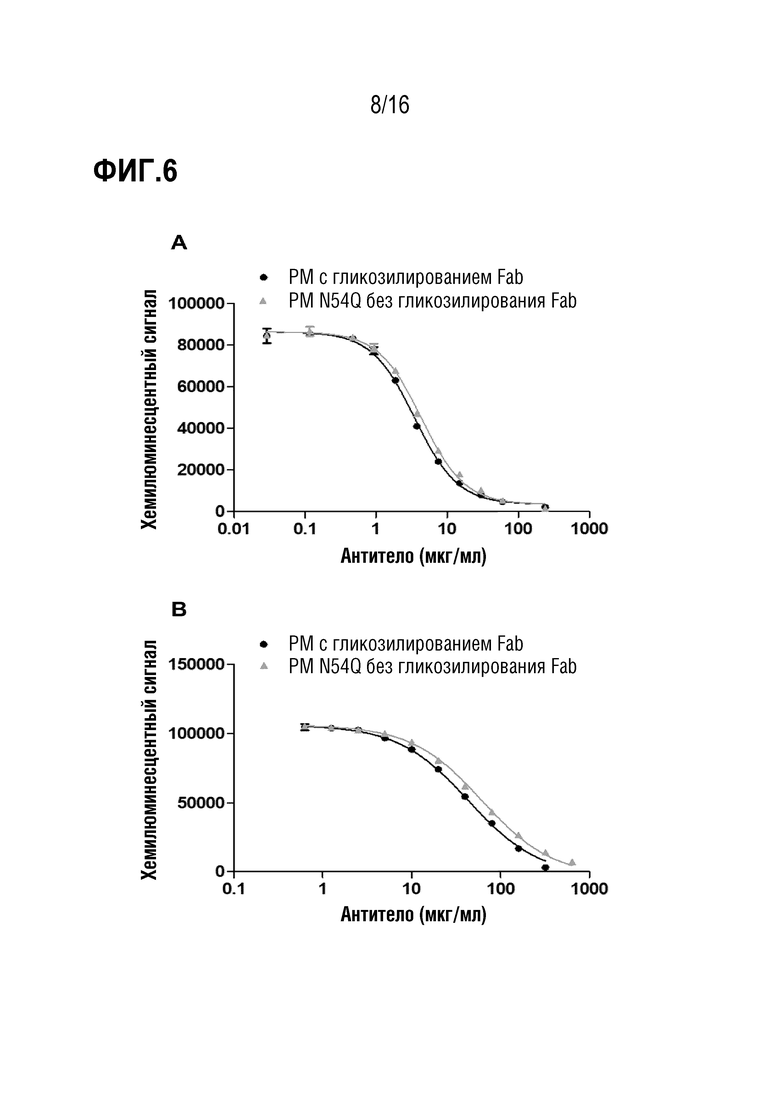
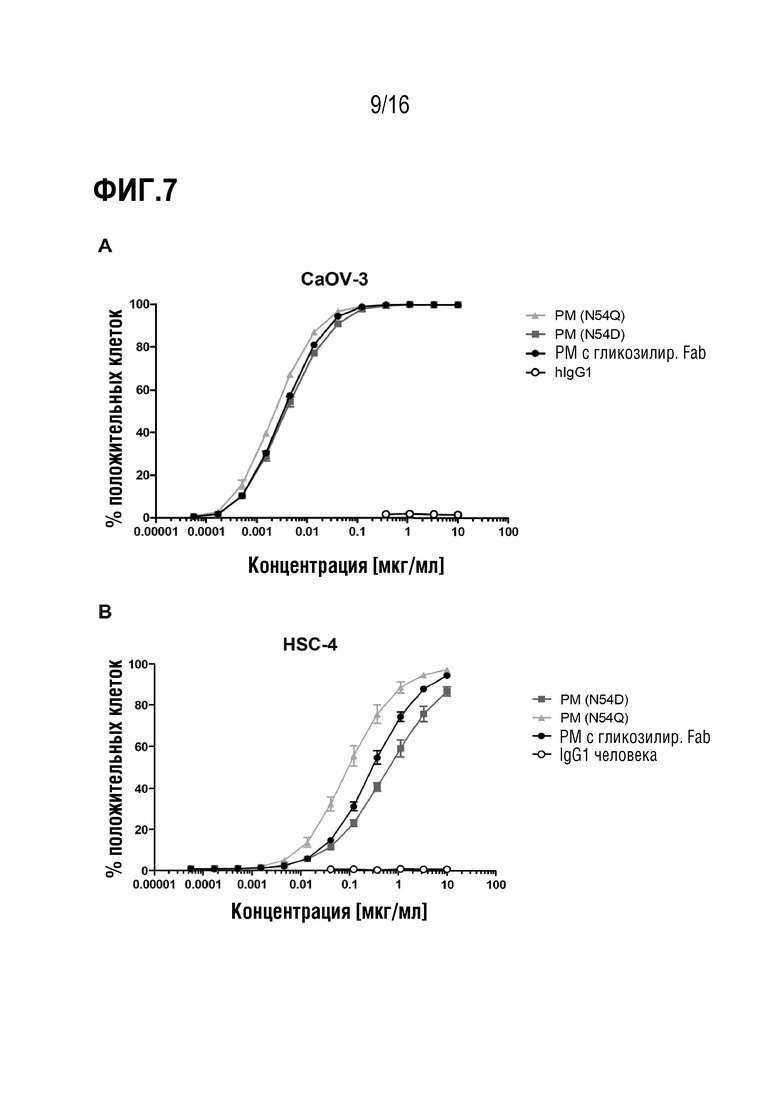
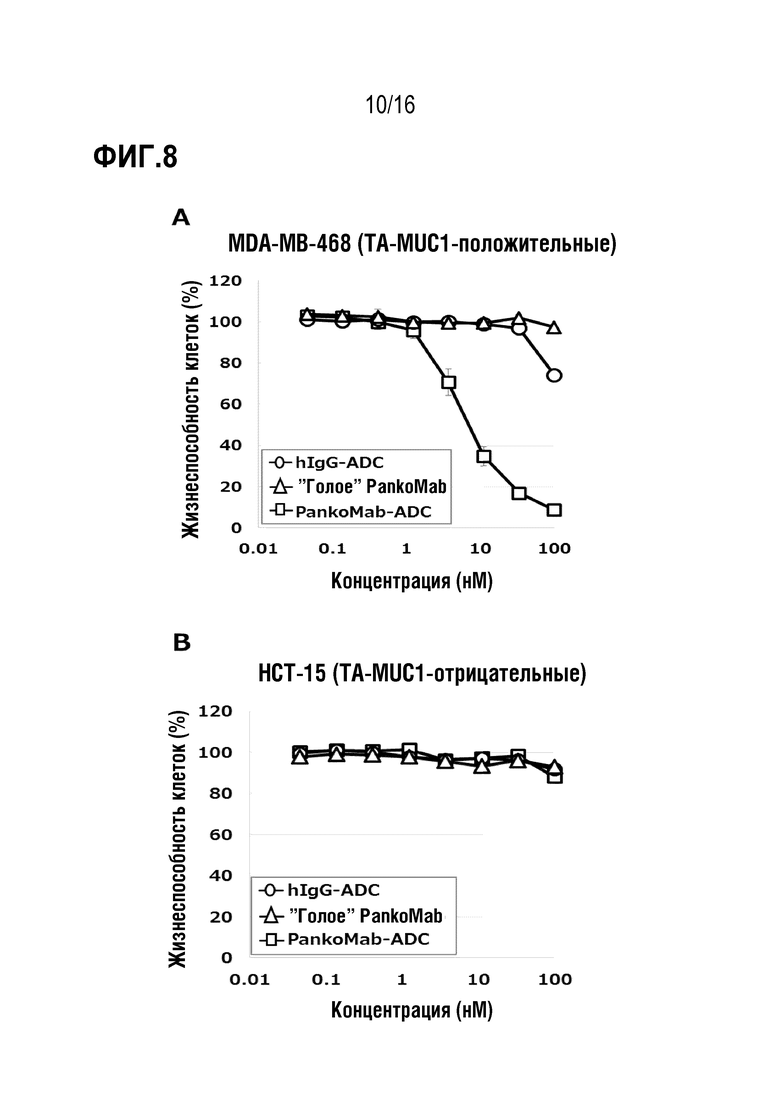
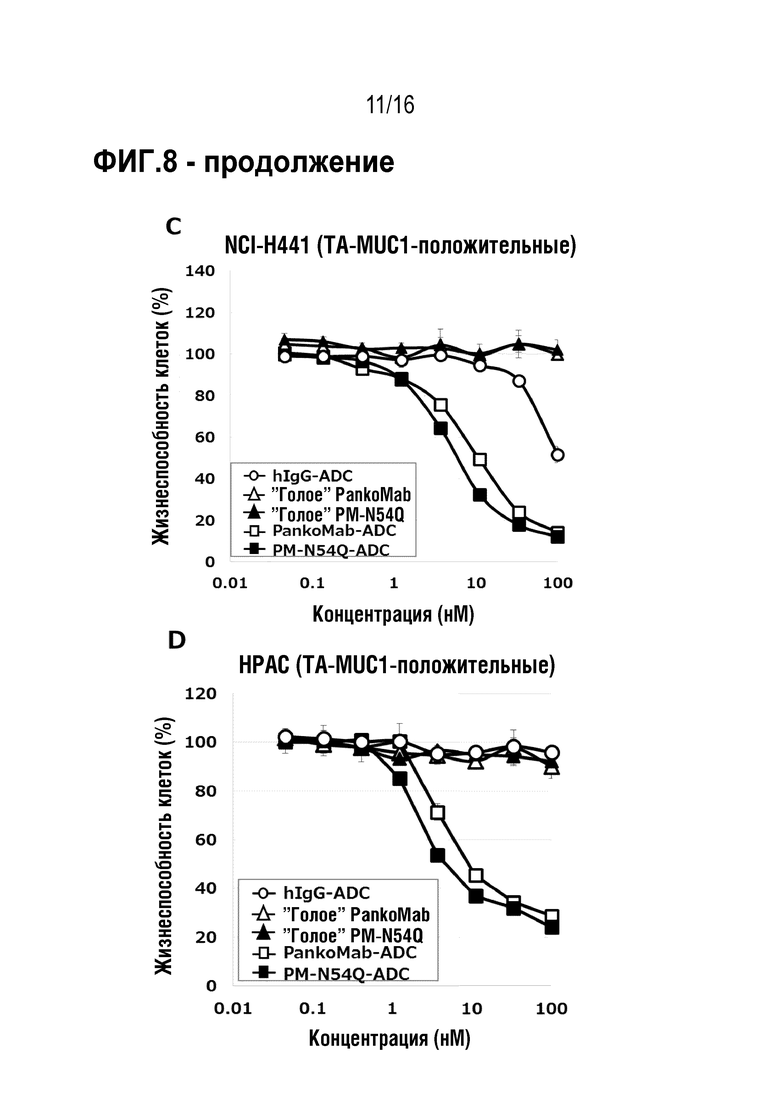
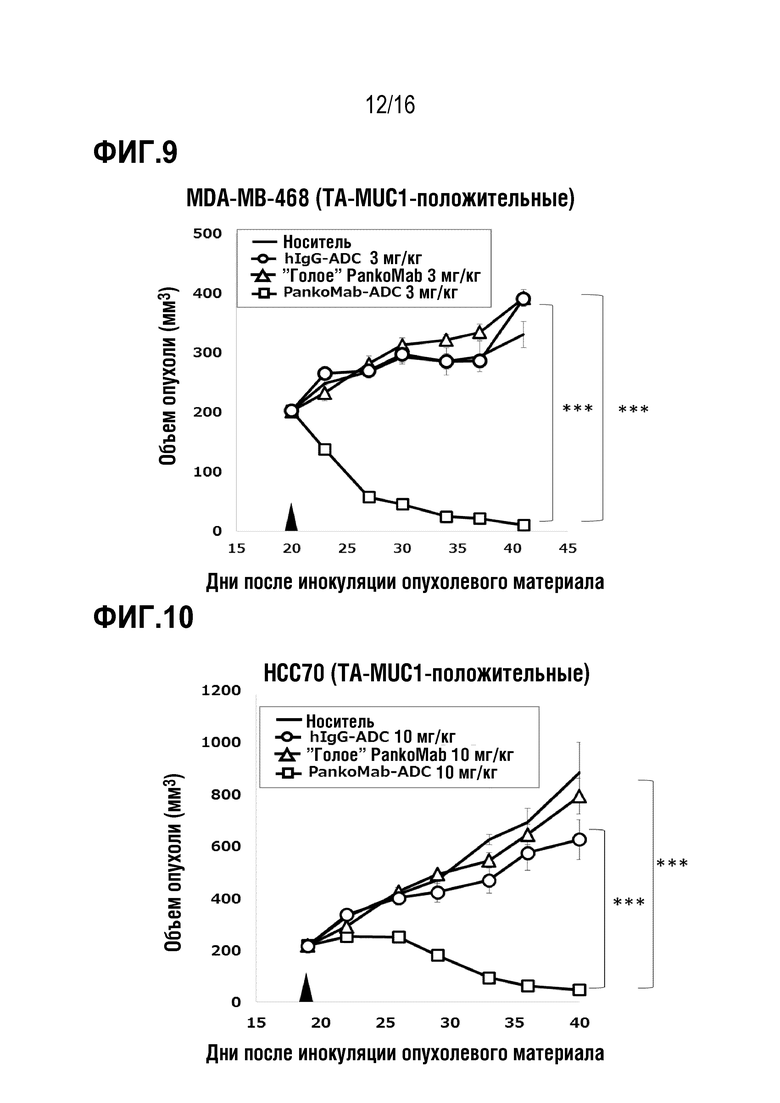
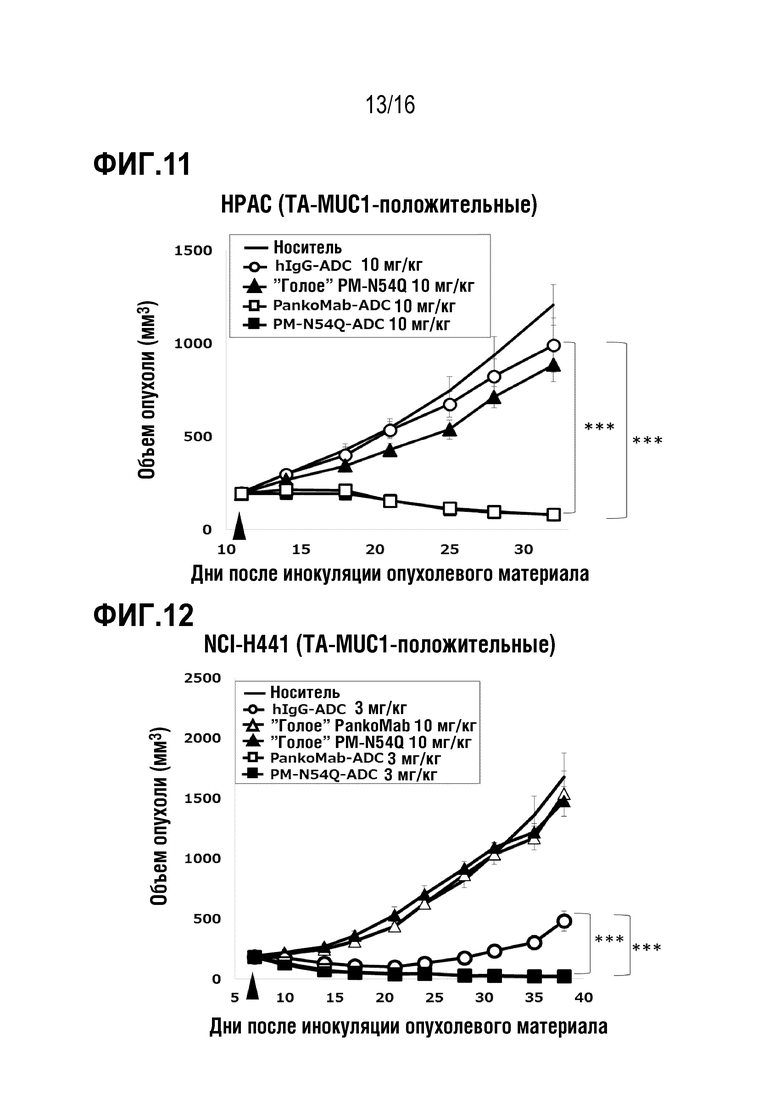
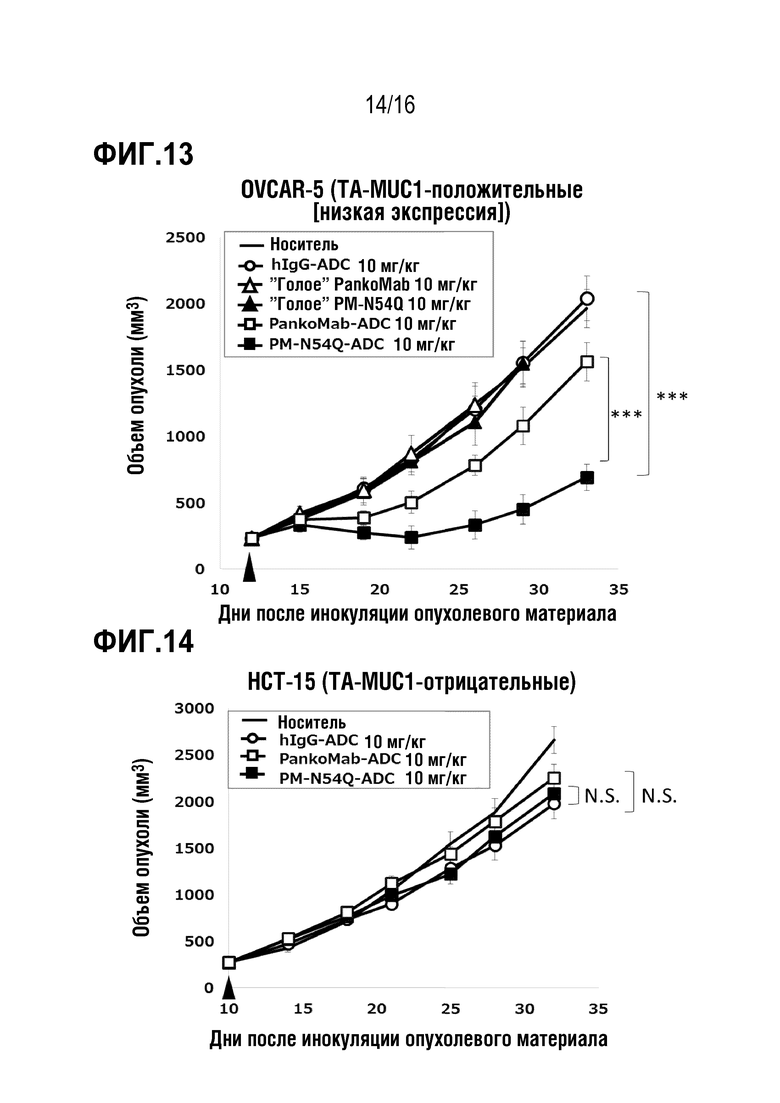

Настоящее изобретение относится к области биотехнологии и может быть применимо в медицине. Изобретение раскрывает новые конъюгаты антитело-лекарственное средство (ADC), содержащие антитело против MUC1. Такие конъюгаты демонстрируют значительную противоопухолевую эффективность в отношении различных злокачественных новообразований, клетки которых экспрессируют TA-MUC1, и могут быть использованы при их терапии. 6 н. и 43 з.п. ф-лы, 10 пр., 3 табл., 19 ил.
1. Конъюгат для лечения злокачественного новообразования, где конъюгат содержит антитело, конъюгированное с цитотоксическим средством, где антитело способно связываться с MUC1 или TA-MUC1 и где антитело содержит:
(i) вариабельную область тяжелой цепи, содержащую определяющие комплементарность области (CDR) CDR-H1, имеющую аминокислотную последовательность SEQ ID NO: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO: 3, и
(ii) вариабельную область легкой цепи, содержащую определяющие комплементарность области (CDR) CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 6, где аминокислота в положении 8 SEQ ID NO: 2 выбрана из группы, состоящей из глутамина, гистидина, триптофана, тирозина, лизина, аргинина, аспарагиновой кислоты и глутаминовой кислоты, или где CDR-H2 имеет аминокислотную последовательность SEQ ID NO: 7.
2. Конъюгат по п.1, где вариабельная область тяжелой цепи антитела имеет аминокислотную последовательность SEQ ID NO: 9 или аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 9.
3. Конъюгат по п.1, где вариабельная область тяжелой цепи антитела имеет аминокислотную последовательность SEQ ID NO: 10 или аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 10.
4. Конъюгат по п.1, где вариабельная область легкой цепи антитела имеет аминокислотную последовательность SEQ ID NO: 12 или аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 12.
5. Конъюгат по п.1, где вариабельная область тяжелой цепи антитела имеет аминокислотную последовательность SEQ ID NO: 10 и вариабельная область легкой цепи антитела имеет аминокислотную последовательность SEQ ID NO: 12.
6. Конъюгат по п.1, где антитело содержит Fc-область и предпочтительно является антителом IgG1-, IgG2- или IgG4-типа.
7. Конъюгат по п.1, где тяжелая цепь антитела имеет аминокислотную последовательность SEQ ID NO: 15, в частности SEQ ID NO: 22, и легкая цепь антитела имеет аминокислотную последовательность SEQ ID NO: 16.
8. Конъюгат по п.1, где вариабельная область тяжелой цепи антитела имеет аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 11.
9. Конъюгат по п.9, где вариабельная область легкой цепи антитела имеет аминокислотную последовательность SEQ ID NO: 12 или аминокислотную последовательность, являющуюся по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 12.
10. Конъюгат по п.1, где антитело содержит Fc-область и предпочтительно является антителом IgG1-, IgG2- или IgG4-типа.
11. Конъюгат по п.1, где тяжелая цепь антитела имеет аминокислотную последовательность SEQ ID NO: 19 и легкая цепь антитела имеет аминокислотную последовательность SEQ ID NO: 16.
12. Конъюгат по п.7, где антитело содержит профиль гликозилирования, имеющий одну или более из следующих характеристик:
(i) детектируемое количество гликанов, несущих остаток GlcNAc в точке ветвления;
(ii) относительное количество гликанов, несущих по меньшей мере один остаток галактозы, по меньшей мере 25% общего количества гликанов, соединенных с участками гликозилирования Fc антитела в композиции.
13. Конъюгат по п.1, где антитело было получено посредством продукции в клетке млекопитающего.
14. Конъюгат по п.1, где антитело было получено посредством продукции в линии клеток человека, выбранной из группы, состоящей из NM-H9D8 (DSM ACC 2806), NM-H9D8-E6 (DSM ACC 2807), NM-H9D8-E6Q12 (DSM ACC 2856) и линий клеток, полученных из них.
15. Конъюгат по п.1, где антитело было получено посредством продукции в линии клеток CHO или линии клеток, полученной из нее.
16. Конъюгат по п.1, где антитело было получено способом получения, включающим стадии (i) получения клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, определенное в п.1, (ii) культивирования клетки-хозяина в условиях, подходящих для экспрессии антитела, и (iii) получения антитела, экспрессируемого клеткой-хозяином.
17. Конъюгат по п.1, где антитело конкурирует с антителом, содержащим вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 10 и вариабельную область легкой цепи с аминокислотной последовательность SEQ ID NO: 12, или антителом, содержащим вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 11 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO: 12, за связывание с TA-MUC1.
18. Конъюгат по п.1, где антитело имеет активность, интернализуясь в MUC1 или TA-MUC1-экспрессирующие клетки посредством связывания с MUC1 или TA-MUC1.
19. Конъюгат по п.1, где цитотоксическое средство является противоопухолевым средством.
20. Конъюгат по п.1, где цитотоксическое средство является химиотерапевтическим средством.
21. Конъюгат по п.20, где химиотерапевтическое средство выбрано из группы, состоящей из ингибитора микротрубочек, ингибитора топоизомеразы I, ДНК-повреждающего средства, ДНК алкилирующего средства и средства, связывающегося с малой бороздкой ДНК.
22. Конъюгат по п.20, где химиотерапевтическое средство является ингибитором топоизомеразы I.
23. Конъюгат по п.22, где ингибитор топоизомеразы I является противоопухолевым соединением, представленным следующей формулой:
[Формула 1]
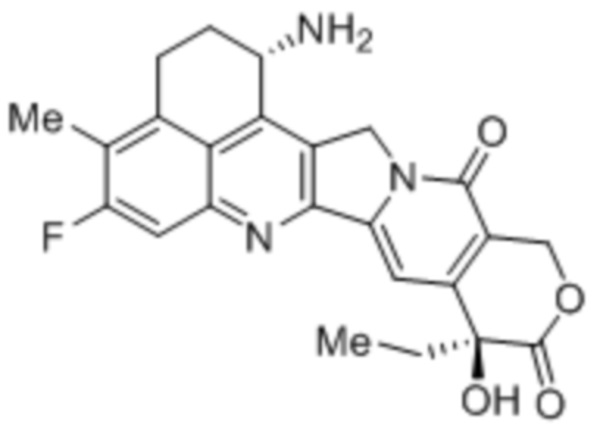 .
.
24. Конъюгат по п.23, где антитело конъюгируют с цитотоксическим средством через линкер, имеющий любую структуру, выбранную из группы, состоящей из следующих формул (a)-(f):
(a) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
(b) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
(c) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
(d) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
(e) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)- и
(f) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
где антитело соединяют с концом -(сукцинимид-3-ил-N), цитотоксическое средство соединяют с карбонильной группой в самой крайней из формул (a)-(f), GGFG представляет собой аминокислотную последовательность, состоящую из глицин-глицин-фенилаланин-глицин, соединенных пептидными связями, и
-(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
[Формула 2]
 ,
,
соединенную с антителом в положении 3 и соединенную с метиленовой группой в линкерной структуре, содержащей эту структуру на атоме азота в положении 1.
25. Конъюгат по п.24, где линкер представлен любой формулой, выбранной из группы, состоящей из следующих формул (a)-(c):
(a) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
(b) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)- и
(c) -(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
26. Конъюгат по п.24, где линкер представлен следующей формулой (a):
(a) -(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-.
27. Конъюгат по п. 23 или 24, где антитело конъюгируют с лекарственным средством-линкером, представленным следующей формулой (где символом "*" обозначена точка соединения с антителом) посредством тиоэфирной связи:
[Формула 3]
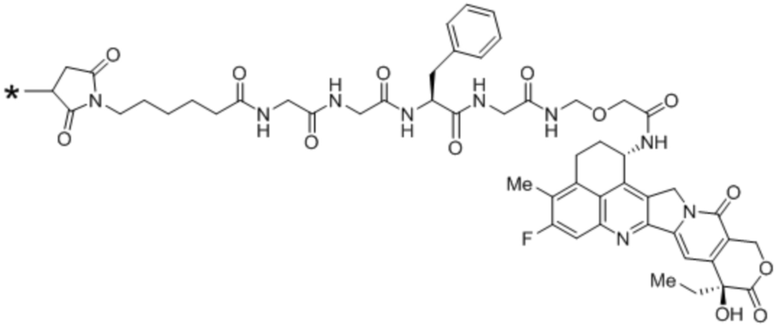 .
.
28. Конъюгат по п. 23 или 24, представленный следующей формулой:
[Формула 4]
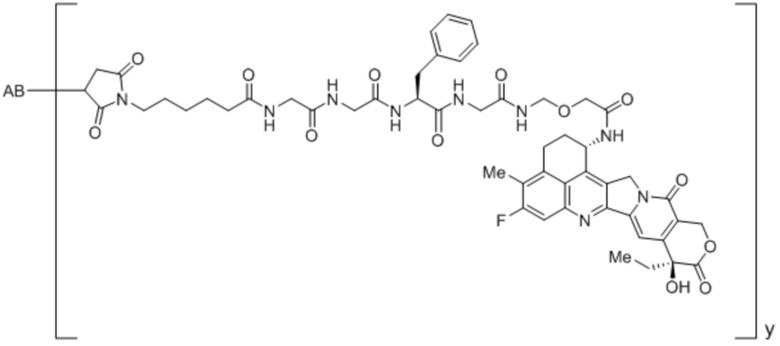
где AB представляет собой антитело, y представляет собой среднее количество единиц структуры лекарственное средство-линкер, конъюгированных с антителом, на антитело, и антитело конъюгируют с лекарственным средством-линкером, представленным указанной выше формулой, посредством тиоэфирной связи.
29. Конъюгат по п.27, где антитело содержит любую из следующих комбинаций (a)-(b) вариабельной области тяжелой цепи и вариабельной области легкой цепи или тяжелой цепи и легкой цепи:
(a) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 10 и вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 12 и
(b) тяжелая цепь имеет аминокислотную последовательность SEQ ID NO: 22 и легкая цепь имеет аминокислотную последовательность SEQ ID NO: 16.
30. Конъюгат для лечения злокачественного новообразования, представленный следующей формулой:
[Формула 5]

где AB представляет собой антитело, антитело содержит вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 10, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 12, y представляет собой среднее количество единиц структуры лекарственное средство-линкер, конъюгированных с антителом, на антитело, и антитело конъюгируют с лекарственным средством-линкером, представленным указанной выше формулой, посредством тиоэфирной связи.
31. Конъюгат для лечения злокачественного новообразования, представленный следующей формулой:
[Формула 7]

где AB представляет собой антитело, антитело содержит тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 22, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 16, y представляет собой среднее количество единиц структуры лекарственное средство-линкер, конъюгированных с антителом, на антитело, и антитело конъюгируют с лекарственным средством-линкером, представленным указанной выше формулой, посредством тиоэфирной связи.
32. Конъюгат по п.1, где антитело содержит одну или более модификаций, выбранных из группы, состоящей из дефукозилирования, сниженного содержания фукозы, N-связанного гликозилирования, O-связанного гликозилирования, N-концевого процессинга, C-концевого процессинга, дезамидирования, изомеризации аспарагиновой кислоты, окисления метионина, замены двух остатков лейцина (L) аланином (A) в положении 234 и 235 тяжелой цепи (LALA), амидирования остатка пролина и делеции или отсутствия одной или двух аминокислот на карбоксильном конце.
33. Конъюгат по п.32, где антитело содержит делецию или в нем отсутствуют одна или две аминокислоты на карбоксильном конце тяжелой цепи.
34. Конъюгат по п.33, где антитело содержит две тяжелые цепи, в обеих из которых отсутствует один карбокси-концевой аминокислотный остаток.
35. Конъюгат по п.1, где среднее количество y цитотоксических средств, в частности структур лекарственное средство-линкер, конъюгированных на антитело, составляет в диапазоне от 1 до 10.
36. Конъюгат по п.1, где среднее количество y цитотоксических средств, в частности единиц выбранной одной структуры лекарственное средство-линкер, конъюгированной на антитело, составляет в диапазоне от 2 до 8.
37. Конъюгат по п.1, где среднее количество y цитотоксических средств, в частности единиц выбранной одной структуры лекарственное средство-линкер, конъюгированной на антитело, составляет в диапазоне от 3 до 8.
38. Конъюгат по п.1, где среднее количество y цитотоксических средств, в частности единиц выбранной одной структуры лекарственное средство-линкер, конъюгированной на антитело, составляет в диапазоне от 7 до 8.
39. Конъюгат по п.1, где среднее количество y цитотоксических средств, в частности единиц выбранной одной структуры лекарственное средство-линкер, конъюгированной на антитело, составляет в диапазоне от 7,5 до 8.
40. Конъюгат по п.1, где количество конъюгированных цитотоксических средств на молекулу антитела составляет 8.
41. Композиция для лечения злокачественного новообразования, содержащая эффективное количество конъюгата по любому из пп. 1-40.
42. Применение конъюгата по любому из пп. 1-40 или композиции по п.41 в лечении злокачественного новообразования.
43. Применение по п. 42, где злокачественное новообразование отличается экспрессией TA-MUC1.
44. Применение по п.43, где злокачественное новообразование выбрано из группы, состоящей из рака яичников, рака молочной железы, рака поджелудочной железы, рака легких, рака толстого кишечника, рака желудка, рака печени, рака почки, гемобластоза, рака эндометрия, рака щитовидной железы, лейкозов, семином, меланом, карцином, тератом, лимфом, сарком, мезотелиом, нейробластом, глиом, рака прямой кишки, рака надпочечников, рака кожи, злокачественного новообразования головного мозга, рака шейки матки, злокачественного новообразования кишечника, злокачественного новообразования кишечника, рака головы и шеи, злокачественного новообразования желудочно-кишечного тракта, злокачественного новообразования лимфоузлов, рака пищевода, колоректального рака, злокачественного новообразования уха, носа и горла (ЛОР), рака предстательной железы, рака мочевого пузыря, рака матки и их метастазов.
45. Применение по пп. 42-44, где конъюгат или композицию применяют в комбинации с дополнительным средством.
46. Способ лечения злокачественного новообразования у нуждающегося в этом индивидуума, включающий введение индивидууму со злокачественным новообразованием терапевтически эффективного количества конъюгата по любому из пп. 1-40 или композиции по п.41.
47. Способ по п.46, где злокачественное новообразование отличается экспрессией TA-MUC1.
48. Способ лечения злокачественного новообразования по п.46, где злокачественное новообразование выбрано из группы, состоящей из рака яичников, рака молочной железы, рака поджелудочной железы, рака легких, рака толстого кишечника, рака желудка, рака печени, рака почки, гемобластоза, рака эндометрия, рака щитовидной железы, лейкозов, семином, меланом, карцином, тератом, лимфом, сарком, мезотелиом, нейробластом, глиом, рака прямой кишки, рака надпочечников, рака кожи, злокачественного новообразования головного мозга, рака шейки матки, злокачественного новообразования кишечника, злокачественного новообразования кишечника, рака головы и шеи, злокачественного новообразования желудочно-кишечного тракта, злокачественного новообразования лимфоузлов, рака пищевода, колоректального рака, злокачественного новообразования уха, носа и горла (ЛОР), рака предстательной железы, рака мочевого пузыря, рака матки и их метастазов.
49. Способ лечения злокачественного новообразования по п.48, дополнительно включающий введение дополнительного терапевтического средства.
| WO 2011012309 A1, 03.02.2011 | |||
| NAKADA T | |||
| et al.: "Novel antibody drug conjugates containing exatecan derivative-based cytotoxic payloads", Bioorg | |||
| Med | |||
| Chem | |||
| Lett., 2016, v | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| US 2015005474 A1, 01.01.2015 | |||
| LU J | |||
| et al.: "Linkers Having a Crucial Role in Antibody-Drug Conjugates", Int | |||
| J | |||
| Mol | |||
| Sci., 2016, v | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| RU | |||
Авторы
Даты
2023-10-04—Публикация
2019-05-17—Подача