Область техники
[0001]
Настоящее изобретение относится к соединению триазина, имеющему ингибирующую активность микросомальной простагландин Е2 синтазы-1 (mPGES-1), или его фармацевтически приемлемой соли, к фармацевтической композиции, содержащей вышеупомянутое, к их фармацевтическому применению и тому подобное.
Предпосылки создания изобретения
[0002]
Нестероидные противовоспалительные препараты (НПВП) часто используют для лечения заболеваний, сопровождающихся воспалением, лихорадкой и болью, например, ревматизма, остеоартрита, головной боли и тому подобное. НПВС проявляют противовоспалительное действие, жаропонижающее действие и обезболивающее действие, предотвращая выработку простаноидов путем ингибирования циклооксигеназы (COX).
[0003]
COX включает две изоформы, СОХ-1, которая повсеместно распространена и конститутивно экспрессируется, и СОХ-2, экспрессия которой индуцируется различными провоспалительными стимулами, например, цитокинами, такими как интерлейкин-1β (IL-1β) и тому подобное. COX-1 и COX-2 представляют собой ферменты, которые превращают арахидоновую кислоту, полученную из фосфолипидов клеточной мембраны в простагландин H2 (PGH2), который является предшественником простаноида. Конкретные простагландинсинтазы ответственны за превращение PGH2 в соответствующие простаноиды (простагландин Е2 (PGE2), простагландин F2α (PGF2α), простагландин I2 (PGI2), простагландина D2 (PGD2), тромбоксан А2 (ТХА2) и т.д.). Эти простаноиды имеют различные физиологические активности, например, индукция/подавление воспаления, вазодилатация/вазоконстрикция, бронходилатация/бронхоконстрикция, индукция/пробуждение от сна, развитие лихорадки и тому подобное. PGE2 является наиболее часто существующим простагландином в живых организмах, и, как известно, глубоко вовлечен в воспаление, боль и лихорадку. Таким образом, супрессия продукции PGE2 считается основным механизмом действия НПВП.
[0004]
Ингибирование COX-1 или COX-2 подавляет всю продукцию простаноидов в их прямом направлении. Это, как считают, является причиной побочных эффектов НПВП. Так как НПВП, которые неселективно ингибируют COX, также подавляют продукцию PGE2 СОХ-1 и PGE2 защитно действует на повреждения слизистой желудка, считают, НПВП подавляют секрецию желудочной слизи и кровоток слизистой желудка, тем самым увеличивая риск перфораций желудка, кровотечения и тому подобное. В то время как селективные ингибиторы COX-2 подавляют продукцию PGI2, имеющего вазодилатационное действие и ингибирующее действие на агрегацию тромбоцитов в эндотелиальных клетках сосудов, они не подавляют продукцию TXA2, который является фактором свертывания крови, продуцируемым тромбоцитами COX-1. Поэтому, они, как полагают, разрушают баланс системы свертывания крови, увеличивая риск сердечно-сосудистого заболевания.
[0005]
Микросомальная простагландин Е2 синтаза-1 (mPGES-1) представляет собой фермент, который катализирует конечную стадию биосинтеза PGE2, и относится к семейству связанных с мембраной белков в метаболизме эйкозаноида и глутатиона (семейство MAPEG). Ген mPGES-1 человека был клонирован в 1999 году, и было указано, что конститутивно экспрессируется в плаценте, простате, яичке и молочной железе (непатентный документ 1). В других органах, экспрессия гена mPGES-1 человека индуцируется различными провоспалительными стимулами, конъюгированными с COX-2. Например, воспалительный цитокин IL-1β и фактор некроза опухоли-α (TNF α) индуцирует экспрессию mPGES-1 в синовиальной клетке, остеобластах, клетке эндотелия, орбитальных фибробластах, десневой клетке, хондроцитах, эндотелиальной клетке, клетке миокарда и тому подобное. Например, липополисахарид (LPS), который представляет собой бактериальный эндотоксин, индуцирует экспрессию mPGES-1 в макрофагах, гладких мышцах и тому подобное.
[0006]
Ингибитор mPGES-1, как полагают, селективно подавляет продукцию PGE2 только в локальном участке воспаления или ткани, где mPGES-1 экспрессируется, и не подавляет продукцию простаноидов (PGI2, PGD2, PGF2α, TXA2 и т.д.) отличных от PGE2 (непатентные документы 2, 3). Таким образом, ингибитор mPGES-1 считается лекарственным средством, имеющим эффективность, эквивалентную таковой НПВП, но без побочных эффектов НПВП, полученных из уменьшения продукции простаноидов, отличных от PGE2.
[0007]
Известно также, что, когда один из метаболических путей в прямом направлении от PGH2 перекрывается в каскаде арахидоновой кислоты, PGH2 преобразуется в простаноиды, отличные от закрытого пути, или возникает шунтовый путь. То есть, известно, что в то время как количество продукции PGE2 в макрофагах, полученных от мышей, нокаутированных по mPGES-1, стимулированных LPS, становится ниже, чем количество продукции PGE2 в макрофагах, полученных от мышей дикого типа, стимулированных LPS, количества продукции TXB2, PGI2, PGD2 и PGF2α в макрофагах, полученных от мышей, нокаутированных по mPGES-1, стимулированных LPS, увеличиваются выше количества их продукции в макрофагах, полученных от мышей дикого типа, стимулированных LPS (непатентный документ 4). Поскольку ингибитор mPGES-1 увеличивает продукцию других простаноидов при одновременном подавлении продукции PGE2, он считается эффективным даже при заболеваниях, отличных от тех, которые лечат НПВП.
[0008]
Использование ингибитора mPGES-1 описано ниже.
(1) боль
У мышей, нокаутированных по mPGES-1, количество продукции PGE2 в брюшной полости и ноцицептивная реакция в единицу времени значительно уменьшаются по сравнению с мышами дикого типа, в оценке ноцицептивной реакции стимуляцией LPS, которая является моделью острой воспалительной боли. Таким образом, ингибитор mPGES-1 считается анальгетиком при острой воспалительной боли (непатентные документы 3, 6).
(2) ревматизм
Ген mPGES-1 шведских женщин содержит несколько однонуклеотидных полиморфизмов, которые увеличивают риск возникновения и тяжесть ревматизма. Увеличение экспрессии mPGES-1 подтверждено иммуногистологическими способами в синовии больных ревматизмом, показывающих однонуклеотидный полиморфизм (ссылочный SNP идентификационный номер: rs23202821), что увеличивает степень тяжести, по сравнению с пациентами без мутации (непатентный документ 5). У мышей, нокаутированных по mPGES-1, внутрисуставная инфильтрация воспалительных клеток, деструкция суставов и опухание всех четырех конечностей в значительной степени подавляются на модели индуцированного коллагеном артрита, который является животной моделью ревматизма, по сравнению с мышами дикого типа (непатентный документ 6). Таким образом, ингибитор mPGES-1 считается терапевтическим лекарственным средством при ревматизме.
(3) остеоартрит
Экспрессия мРНК mPGES-1 увеличивается в клетках мениска пациентов с остеоартритом (непатентный документ 7). Ингибитор mPGES-1 уменьшает ноцицептивные реакции в модели остеоартрита с использованием монойодуксусной кислоты, по сравнению с мышами дикого типа (патентный документ 1). Таким образом, ингибитор mPGES-1 считается терапевтическим лекарственным средством при остеоартрите.
(4) лихорадка
У мышей, нокаутированных по mPGES-1, повышение температуры тела за счет стимуляции LPS подавляется по сравнению с мышами дикого типа (непатентный документ 8). Таким образом, ингибитор mPGES-1 считается жаропонижающим лекарственным средством.
(5) болезнь Альцгеймера
Длительное применение НПВП уменьшает риск возникновения и прогрессирования болезни Альцгеймера. При терапии β-амилоидного пептида, продукция PGE2 в первичной культуре нейронов головного мозга мышей, нокаутированных по mPGES-1, уменьшается, по сравнению с нейронами головного мозга у мышей дикого типа, и гибель нервных клеток не наступает (непатентный документ 9). Таким образом, ингибитор mPGES-1 считается терапевтическим лекарственным средством для лечения болезни Альцгеймера.
(6) рассеянный склероз
Ген EP4 у больных рассеянным склерозом содержит несколько однонуклеотидных полиморфизмов, которые увеличивают риск начала (ссылочные SNP идентификационные номера: rs9292777, rs4613763, rs1044063, rs6896969). В макрофаге, присутствующем в перивентрикулярном очаге демиелинизации больных рассеянным склерозом, экспрессия mPGES-1 белка подтверждена. У мышей, нокаутированных по mPGES-1, продукция PGE2 в спинном мозге модели мыши экспериментального аутоиммунного энцефаломиелита, которая представляет собой животную модель рассеянного склероза, подавляется, и подавляется прогрессирование паралича, по сравнению с мышами дикого типа (непатентный документ 10). Таким образом, ингибитор mPGES-1 считается терапевтическим лекарственным средством для рассеянного склероза.
(7) артериосклероз
У мышей, нокаутированных по mPGES-1, продукция PGE2 в сосудистых эндотелиальных клетках мышей, дефицитных по рецептору липопротеинов низкой плотности (ЛПНП), откормленных богатой жиром пищей, которая представляет собой модель атеросклероза, уменьшается, и образование атеросклеротической бляшки замедляется по сравнению с мышами дикого типа. В эндотелиальных клетках сосудов, продукция PGI2, который, как известно, ингибирует тромбогенез, увеличивается (непатентный документ 11). Таким образом, ингибитор mPGES-1 считается профилактическим или терапевтическим лекарственным средством для артериосклероза.
(8) глаукома, глазная гипертензия
Глаукома представляет собой заболевание, показывающее характерное изменение зрительного нерва и поля зрения. Заболевание зрительного нерва можно в большинстве случаев улучшить или подавить путем существенного снижения внутриглазного давления. Глаукому можно разделить на открытоугольную глаукому и закрытоугольную глаукому.
Ген mPGES-1 конститутивно экспрессируется на высоком уровне в конъюнктиве человека (GEO No доступа: GSE2513 (Gene Expression Omnibus:http://www.ncbi.nlm.nih.gov/geo/)). В сетчатке у пациентов с глаукомой, экспрессия mPGES-1 увеличивается по сравнению со здоровыми индивидами. В сетчатке собак с высоким внутриглазным давлением и мышей с высоким внутриглазным давлением, которые являются моделями глаукомы, экспрессия mPGES-1 увеличивается по сравнению с нормальными животными (GEO No доступа: GSE2378 человека, GSE21879 собаки, GSE3554 мыши).
Когда PGE2 закапывают в глаза здоровых индивидов, внутриглазное давление увеличивается, наряду с расширением кровеносных сосудов, в течение 2 часов после закапывания (непатентный документ 12). Когда PGE2 вводят кроликам субконъюнктивально, внутриглазное давление повышается за счет дилатации цилиарного тела и повышения продукции внутриглазной жидкости (непатентный документ 13). PGF2α и PGD2, которые представляют собой простагландины, которые могут увеличиваться, когда mPGES-1 ингибируется, уменьшают внутриглазное давление кролика (непатентный документ 14). Препараты PGF2α увеличивают отток внутриглазной жидкости и используются в качестве терапевтических лекарственных средств при глаукоме для снижения внутриглазного давления. PGI2 не оказывает четкое действие на внутриглазное давление кроликов. То есть, внутриглазное давление, как полагают, уменьшается, так как уменьшение PGE2 подавляет продукцию внутриглазной жидкости ингибированием mPGES-1, и/или поскольку увеличение PGD2 и PGF2α способствует оттоку внутриглазной жидкости, вследствие шунта. Кроме того, PGE2 стимулирует экспрессию фактора роста эндотелия сосудов (VEGF) в сетчатке (непатентный документ 15). Так как VEGF, продуцируемый в сетчатке переносится к переднему сегменту глаза, вызывая ангиогенез глаукомы, которая представляет собой повышение внутриглазного давления, которое вызвано обструкцией величины угла из-за ангиогенеза в радужной оболочке глаза, ингибитор mPGES-1, как полагают, показывает положительный или профилактический эффекта на ангиогенез глаукомы, также. Кроме того, принимая во внимание противовоспалительное действие за счет ингибирования продукции PGE2, ингибитор mPGES-1 применим к пациентам, имеющим внутриглазное воспаление, которые требуют осторожного введения существующих составов простагландина (латанопрост и тому подобное). Таким образом, ингибитор mPGES-1 считается терапевтическим лекарственным средством также эффективным при глаукоме, имеющей различные фоновые заболевания.
(9) ишемическое заболевание сетчатки
Повышенная секреция VEGF играет ключевую роль в ишемических заболеваниях сетчатки, таких как диабетическая ретинопатия, диабетический макулярный отек, окклюзия вены сетчатки и тому подобное. Так как PGE2 способствует экспрессии VEGF (непатентный документ 15), считается, что ингибитор mPGES-1 улучшает эти заболевания.
(10) системная склеродермия
Экспрессия mPGES-1 увеличивается в коже пациентов с системной склеродермией, по сравнению со здоровыми индивидами. Аналогичным образом, экспрессия mPGES-1 увеличивается в коже мышиной модель склеродермии, индуцированной блеомицином, которая является моделью системной склеродермии, по сравнению с кожей нормальных мышей. По сравнению с мышами дикого типа, мыши, нокаутированные по mPGES-1, показали уменьшение накопления макрофагов в поражении кожи мышиной модель склеродермии, индуцированной блеомицином, и смягчение кожного утолщения, накопление внеклеточного матрикса и увеличение содержания коллагена (непатентный документ 16). Таким образом, ингибитор mPGES-1 считается терапевтическим лекарственным средством для системной склеродермии.
(11) рак
У мышей, нокаутированных по mPGES-1, количество и размер полипа были в значительной степени подавлены у азоксиметан-индуцированной мышиной модели колоректального рака, которая является животной моделью колоректального рака, по сравнению с мышами дикого типа. У мышей, нокаутированных по mPGES-1, продукция PGE2 в опухолевой ткани толстого кишечника уменьшилась и продуцируемое количество PGI2, который ингибирует адгезию раковых клеток, и PGD2, который индуцирует гибель клеток с помощью γ-рецептора, активируемого пролифератором пероксисом (PPARγ) увеличилось, по сравнению с мышами дикого типа. Когда клетки колоректального рака или рака легкого были пересажены в селезенку мышей, нокаутированных по mPGES-1, масса после трансплантации опухоли селезенки и скорость метастазирования в печени уменьшились по сравнению с мышами дикого типа. Рост раковых клеток легкого был уменьшен, когда их со-культивировали in vitro с макрофагами костного мозга, полученными у мышей, нокаутированных по mPGES-1, по сравнению с тем, когда их со-культивировали с макрофагами костного мозга, полученными у мышей дикого типа, что указывает на то, что PGE2, полученный из макрофага хозяина, участвует в росте раковой клетки (непатентный документ 17). Таким образом, ингибитор mPGES-1 считается противораковым лекарственным средством, которое подавляет рост и метастазирование рака, включая колоректальный рак.
(12) заболевание, для которого супрессия продукции PGE2 является эффективной
В качестве воспалительных симптомов и/или боли, относящихся к таким состояниям, для которых НПВП являются эффективными, могут быть упомянуты, например, артрит, подагра, нефролитиаз, уролитиаз, головная боль, менструальная боль, зубная боль, люмбаго, мышечная боль, плечелопаточный периартрит, цервикальный синдром, височно-нижнечелюстные нарушения, и послеоперационное или посттравматическое воспаление и боль, и воспаление и боль после удаления зуба. Помимо них, может быть упомянуто острое и хроническое небактериальное воспаление глаза и, например, могут быть упомянуты увеит, аллергический конъюнктивит и послеоперационное воспаление, и боль в глазу при внутриглазной операции.
Основным механизмом эффективности НПВП считается супрессия продукции PGE2, который является стимулятором воспаления. Так как ингибитор mPGES-1 также имеет супрессивное действие на продукцию PGE2, он считается терапевтическим лекарственным средством для этих заболеваний.
[0009]
Ингибитор mPGES-1, как полагают, эффективен для профилактики или лечения боли, ревматизма, остеоартрита, лихорадки, болезни Альцгеймера, рассеянного склероза, атеросклероза, глаукомы, глазной гипертензии, ишемического заболевания сетчатки, системной склеродермии, рака, включая колоректальный рак, и заболеваний для которых супрессия продукции PGE2 является эффективной.
[Перечень документов]
патентный документ
[0010]
патентный документ 1: WO 2012/161965
непатентные документы
[0011]
непатентный документ 1: JAKOBSSON, PJ et al. Identification of human prostaglandin E synthase: a microsomal, glutathione-dependent, inducible enzyme, constituting a potential novel drug target. Proc Natl Acad Sci U S A. Jun 22 1999, Vol.96, No.13, стр. 7220-7225.
непатентный документ 2: SAMUELSSON, B et al. Membrane prostaglandin E synthase-1: a novel therapeutic target. Pharmacol Rev. Sep 2007, Vol.59, No.3, стр. 207-224.
непатентный документ 3: KAMEI, D et al. Reduced pain hypersensitivity and inflammation in mice lacking microsomal prostaglandin e synthase-1. J Biol Chem. Aug 6 2004, Vol.279, No.32, стр. 33684-33695.
непатентный документ 4: TREBINO, CE et al. Redirection of eicosanoid metabolism in mPGES-1-deficient macrophages. J Biol Chem. Apr 29 2005, Vol.280, No.17, стр. 16579-16585.
непатентный документ 5: KOROTKOVA, M et al. Variants of gene for microsomal prostaglandin E2 synthase show association with disease and severe inflammation in rheumatoid arthritis. Eur J Hum Genet. Aug 2011, Vol.19, No.8, стр. 908-914.
непатентный документ 6: TREBINO, CE et al. Impaired inflammatory and pain responses in mice lacking an inducible prostaglandin E synthase. Proc Natl Acad Sci U S A. Jul 22 2003, Vol.100, No.15, стр. 9044-9049.
непатентный документ 7: SUN, Y et al. Analysis of meniscal degeneration and meniscal gene expression. BMC Musculoskelet Disord. 2010, Vol.11, стр. 19.
непатентный документ 8: ENGBLOM, D et al. Microsomal prostaglandin E synthase-1 is the central switch during immune-induced pyresis. Nat Neurosci. Nov 2003, Vol.6, No.11, стр. 1137-1138.
непатентный документ 9: KUROKI, Y et al. Deletion of microsomal prostaglandin E synthase-1 protects neuronal cells from cytotoxic effects of beta-amyloid peptide fragment 31-35. Biochem Biophys Res Commun. Aug 3 2012, Vol.424, No.3, стр. 409-413.
непатентный документ 10: KIHARA, Y et al. Targeted lipidomics reveals mPGES-1-PGE2 as a therapeutic target for multiple sclerosis. Proc Natl Acad Sci U S A. Dec 22 2009, Vol.106, No.51, стр. 21807-21812.
непатентный документ 11: WANG, M et al. Deletion of microsomal prostaglandin E synthase-1 augments prostacyclin and retards atherogenesis. Proc Natl Acad Sci U S A. Sep 26 2006, Vol.103, No.39, стр. 14507-14512.
непатентный документ 12: FLACH, AJ et al. Topical prostaglandin E2 effects on normal human intraocular pressure. J Ocul Pharmacol. Spring 1988, Vol.4, No.1, стр. 13-18.
непатентный документ 13: NAKAJIMA, T et al. [Effects of prostaglandin E2 on intraocular pressure, anterior chamber depth and blood flow volume of the iris and the ciliary body in rabbit eyes]. Nihon Ganka Gakkai Zasshi. Apr 1992, Vol.96, No.4, стр. 455-461.
непатентный документ 14: GOH, Y et al. Prostaglandin D2 reduces intraocular pressure. Br J Ophthalmol. Jun 1988, Vol.72, No.6, стр. 461-464.
непатентный документ 15: YANNI, SE et al. The role of PGE2 receptor EP4 in pathologic ocular angiogenesis. Invest Ophthalmol Vis Sci. Nov 2009, Vol.50, No.11, стр. 5479-5486.
непатентный документ 16: MCCANN, MR et al. mPGES-1 null mice are resistant to bleomycin-induced skin fibrosis. Arthritis Res Ther. 2011, Vol.13, No.1, стр. R6.
непатентный документ 17: SASAKI, Y et al. Microsomal prostaglandin E synthase-1 is involved in multiple steps of colon carcinogenesis. Oncogene. Jun 14 2012, Vol.31, No.24, стр. 2943-2952.
Сущность изобретения
[0012]
Настоящее изобретение относится к соединению триазина, имеющему ингибирующую активность mPGES-1, или его фармацевтически приемлемой соли, к фармацевтической композиции, содержащей вышеупомянутое, и к их фармацевтическому применению и тому подобное. В качестве целевого заболевания можно упомянуть, например, боль, ревматизм, остеоартрит, лихорадку, болезнь Альцгеймера, рассеянный склероз, атеросклероз, глаукому, глазную гипертензию, ишемическое заболевание сетчатки, системную склеродермию, рак, включая колоректальный рак, и заболевания, для которых супрессия продукции PGE2 является эффективной.
[0013]
Авторы настоящего изобретения обнаружили соединение триазина, имеющее ингибирующую активность mPGES-1, которое представлено следующей формулой [I], и завершили настоящее изобретение.
Соответственно, настоящее изобретение заключается в следующем.
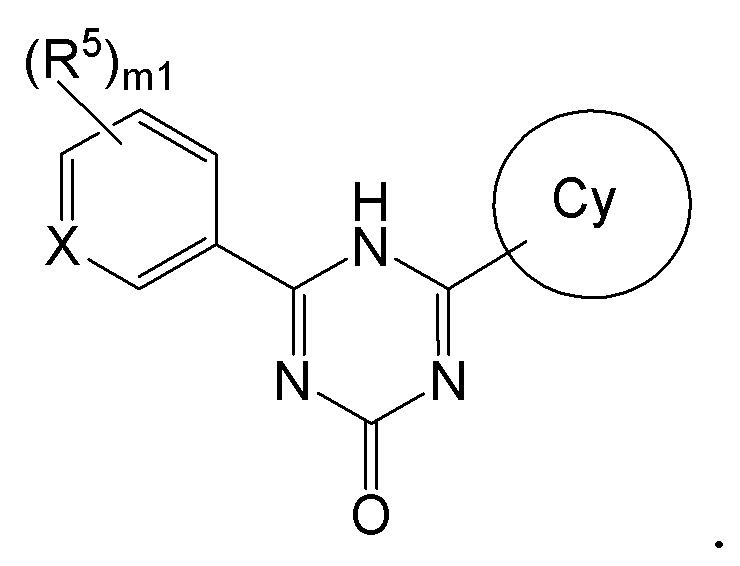
[0014][01]
Соединение, представленное формулой [I] или его фармацевтически приемлемая соль:
[0015]
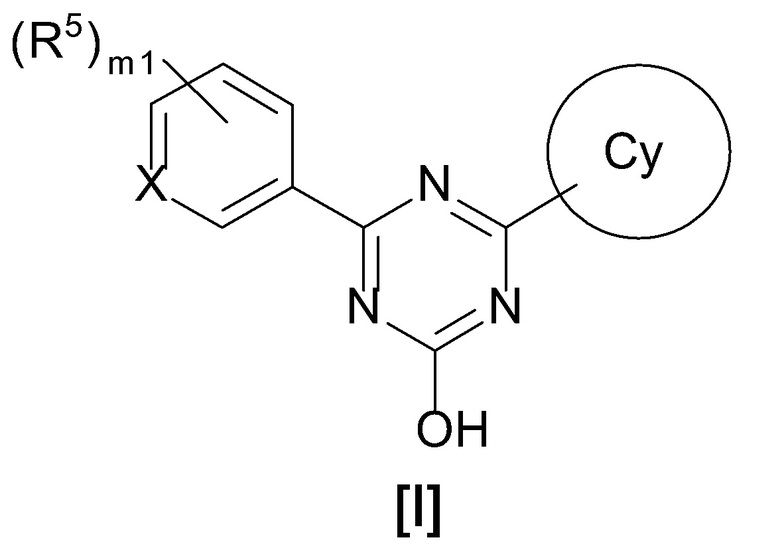
[0016]где
X представляет собой CH или N,
кольцо Cy представляет собой
формулу:
[0017]
[0018]или
формулу:
[0019]
[0020]
{где R1 представляет собой
(1) галоген,
(2) C1-6 алкил,
(3) циано или
(4) галогенC1-4 алкил,
R2 представляет собой
(1) галоген,
(2) гидрокси,
(3) карбокси,
(4) C1-6 алкил,
(5) C1-6 алкокси,
(6) галогенC1-4 алкокси,
(7) галогенC1-4 алкил,
(8) C1-6 алкил-карбонил,
(9) -C(O)NRa1Ra2 (Ra1 и Ra2 каждый независимо представляют собой водород или C1-6 алкил) или
(10) -(CnH2n)-Rb
(n равен 1, 2, 3 или 4, -(CnH2n)- может быть прямой или разветвленной цепью, и
Rb представляет собой
(a) гидрокси,
(b) карбокси,
(c) C1-6 алкокси,
(d) C1-6 алкил-карбонилокси,
(e) -C(O)NRb1Rb2 (Rb1 и Rb2 каждый независимо представляют собой водород или C1-6 алкил),
(f) -OC(O)NRb3Rb4 (Rb3 и Rb4 каждый независимо представляют собой водород или C1-6 алкил),
(g) -NRb5C(O)NRb6Rb7 (Rb5, Rb6 и Rb7 каждый независимо представляют собой водород или C1-6 алкил),
(h) -NRb8Rb9 (Rb8 и Rb9 каждый независимо представляют собой водород, C1-6 алкил или галогенC1-4 алкил),
(i) -NRb10S(O)2Rb11 (Rb10 и Rb11 каждый независимо представляют собой водород, C1-6 алкил или C3-7 циклоалкил),
(j) -NRb12C(O)ORb13 (Rb12 представляет собой водород или C1-6 алкил, и Rb13 представляет собой C1-6 алкил),
(k) -NRb14C(O)Rb15 (Rb14 представляет собой водород или C1-6 алкил, и
Rb15 представляет собой
(i) C6-10 арил,
(ii) C1-8 алкил (указанный C1-8 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из гидрокси, галогенC1-4 алкила, C1-6 алкокси и C6-10 арила),
(iii) адамантил или
(iv) C3-7 циклоалкил (указанный C3-7 циклоалкил необязательно замещен 1, 2, 3 или 4 заместителями, выбранными из группы, состоящей из C1-6 алкила, галогена, гидроксил C1-6 алкила и галоген C1-4 алкила, и/или необязательно образует конденсированное кольцо с бензольным кольцом), или
Rb14 и Rb15 необязательно образуют 4-, 5- или 6-членный лактам вместе с атомом азота, к которому Rb14 присоединен и атомом углерода, к которому Rb15 присоединен (указанный лактам необязательно замещен 1, 2 или 3 C1-6 алкилами, и/или необязательно образует конденсированное кольцо с бензольным кольцом),
(l) формулу:
[0021]
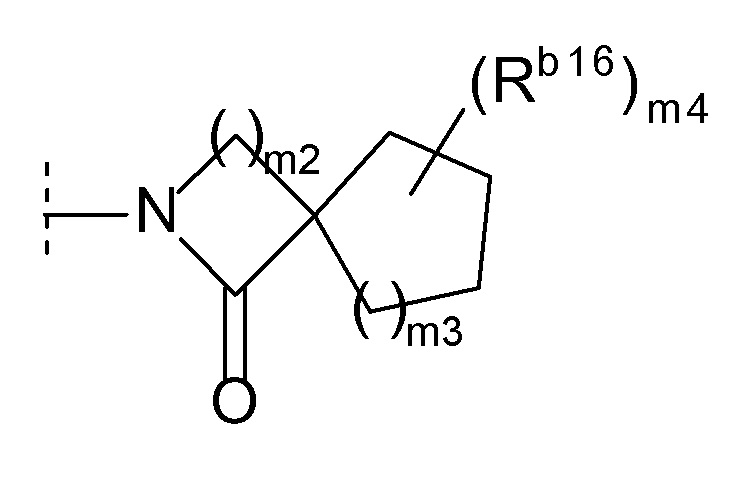
[0022]где m2 и m3 каждый независимо равен 1, 2 или 3, m4 равен 0, 1, 2, 3 или 4, Rb16 представляет собой C1-6 алкил или C1-6 алкокси, и когда m4 равен 2, 3 или 4, каждый Rb16 выбран независимо друг от друга, или
(m) формулу:
[0023]
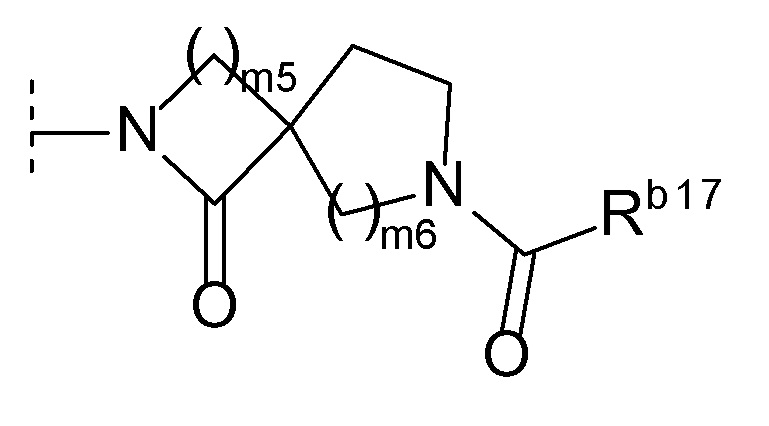
[0024]где m5 и m6 каждый независимо друг от друга равен 1, 2 или 3, и Rb17 представляет собой C1-6 алкил или C1-6 алкокси)),
R3 представляет собой
(1) галоген,
(2) гидрокси,
(3) C1-6 алкил или
(4) -ORc {Rc представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из следующих (а)-(f);
(a) галогена,
(b) гидрокси,
(c) C1-6 алкокси,
(d) -C(O)NRc1Rc2 (Rc1 и Rc2 каждый независимо представляют собой водород или C1-6 алкил),
(e) C6-10 арила (указанный C6-10 арил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) гидрокси,
(iii) C1-6 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкила), и
(f) 5- или 6-членного гетероарила, содержащего 1, 2 или 3 атома азота, атома кислорода или атома серы (указанный гетероарил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) гидрокси,
(iii) C1-6 алкил,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкила)}, и
R4 представляет собой
(1) водород,
(2) галоген,
(3) C1-6 алкил или
(4) C1-6 алкокси},
R5 представляет собой
(1) галоген,
(2) гидрокси,
(3) C1-6 алкилсульфанил,
(4) C1-6 алкил (указанный C1-6 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, C6-10 арила и C1-6 алкокси),
(5) C3-7 циклоалкил,
(6) -ORd {Rd представляет собой
(a) C2-6 алкинил,
(b) C3-7 циклоалкил, необязательно замещенный 1, 2 или 3 C1-6 алкилами или
(c) C1-8 алкил (указанный C1-8 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из следующих (i)-(v);
(i) галогена,
(ii) C6-10 арила,
(iii) C1-6 алкокси,
(iv) C3-7 циклоалкила (указанный C3-7 циклоалкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из C1-6 алкила и галогенC1-4 алкила), и
(v) 4-, 5- или 6-членный насыщенный гетероциклил, содержащий 1, 2 или 3 атома азота, атома кислорода или атома серы (указанный насыщенный гетероциклил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из C1-6 алкила и галогенC1-4 алкила))} или
(7) формулу:
[0025]
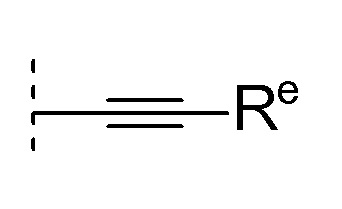
[0026]где Re представляет собой
(a) C1-6 алкил,
(b) C3-7 циклоалкил,
(c) 5- или 6-членный гетероарил, содержащий 1, 2 или 3 атома азота, атома кислорода или атома серы, или
(d) C6-10 арил (указанный C6-10 арил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) C1-6 алкила,
(iii) галогенC1-4 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкокси), и
m1 равен 0, 1, 2 или 3 и, когда m1 равен 2 или 3, каждый R5 выбран независимо друг от друга,
исключение 4,6-бис-(2,5-диметил-фенил)-1,3,5-триазин-2-ол.
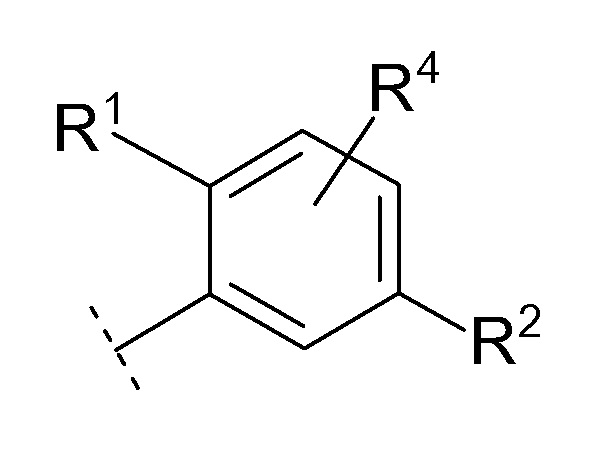
[0027][02]
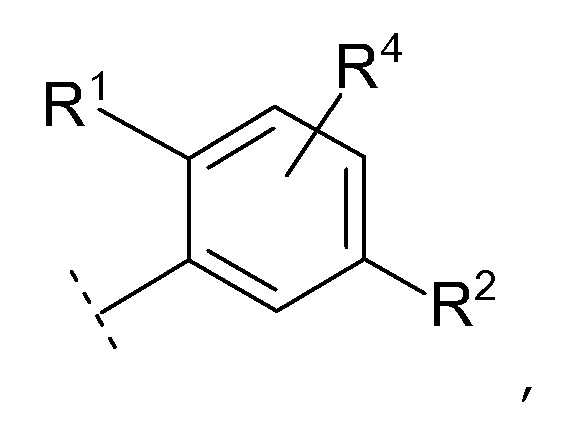
Соединение [01] или его фармацевтически приемлемая соль, где кольцо Cy представляет собой формулу:
[0028]
[0029]
где R1, R2 и R4 являются такими как определено в [01].
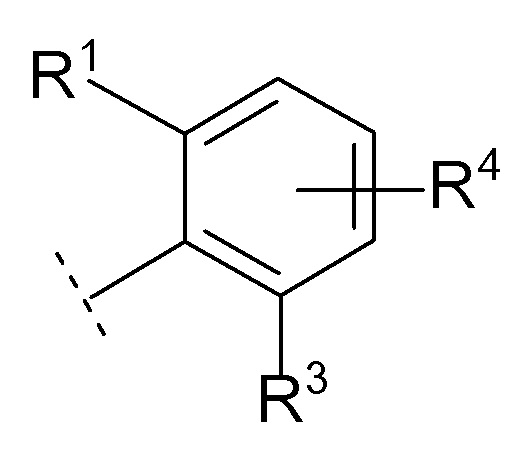
[0030][03]
Соединение [01] или его фармацевтически приемлемая соль, где кольцо Cy представляет собой формулу:
[0031]
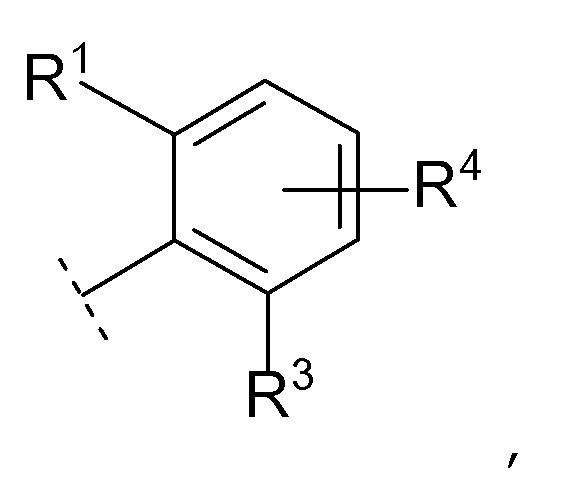
[0032]где R1, R3 и R4 являются такими как определено в [01].
[0033][04]
Соединение по любому из [01]-[03] или его фармацевтически приемлемая соль, где X представляет собой CH.
[0034][05]
Соединение по любому из [01]-[03] или его фармацевтически приемлемая соль, где X представляет собой N.
[0035][06]
Соединение по любому из [01]-[05] или его фармацевтически приемлемая соль, где R1 представляет собой
(1) хлор,
(2) метил,
(3) циано или
(4) трифторметил.
[0036][07]
Соединение по любому из [01]-[06] или его фармацевтически приемлемая соль, где R4 представляет собой водород.
[0037][08]
Соединение по любому из [01], [02] и [04]-[07] или его фармацевтически приемлемая соль, где R2 представляет собой
-(CnH2n)-Rb (n равен 1 или 2, -(CnH2n)- может быть прямой или разветвленной цепью, и Rb представляет собой
(a) -C(O)NRb1Rb2,
(b) -NRb5C(O)NRb6Rb7,
(c) -NRb10S(O)2Rb11 или
(d) -NRb14C(O)Rb15
(Rb1, Rb2, Rb5, Rb6, Rb7, Rb10, Rb11, Rb14 и Rb15 явлются такими, как определено в [01])).
[0038][09]
Соединение [08] или его фармацевтически приемлемая соль, где R2 представляет собой -CH2-Rb (Rb является таким, как определено в [08]).
[0039][10]
Соединение по любому из [01] и [03]-[09] или его фармацевтически приемлемая соль, где R3 представляет собой
(1) галоген,
(2) гидрокси,
(3) C1-6 алкил или
(4) -ORc {Rc представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из следующих (а)-(f)
(a) галогена,
(b) гидрокси,
(c) C1-6 алкокси,
(d) -C(O)NRc1Rc2 (Rc1 и Rc2 каждый независимо представляют собой водород или C1-6 алкил),
(e) фенила (указанный фенил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) гидрокси,
(iii) C1-6 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкила), и
(f) пиридила (указанный пиридил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) гидрокси,
(iii) C1-6 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкила)}.
[0040][11]
Соединение по любому из [01]-[10] или его фармацевтически приемлемая соль, где m1 равен 1, и
R5 представляет собой формулу:
[0041]
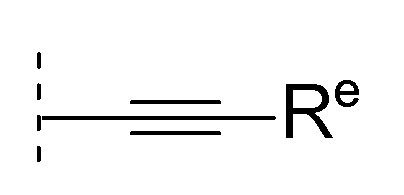
[0042]где Re является таким, как определено в [01].
[0043][12]
Соединение, выбранное из следующих формул:
[0044]
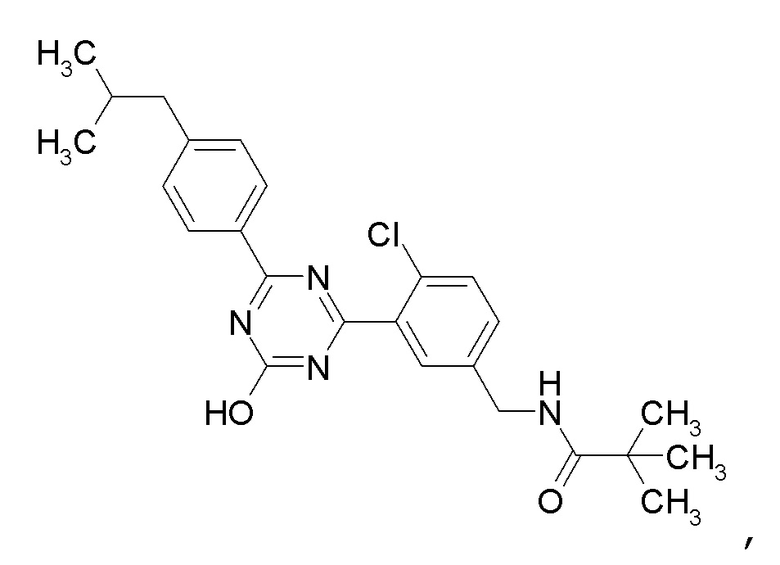
[0045]
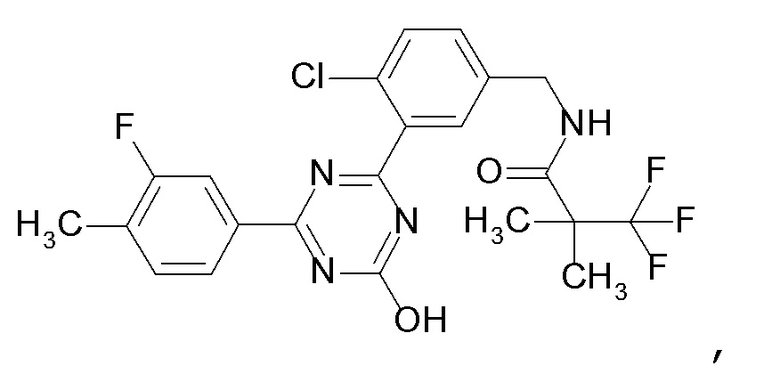
[0046]
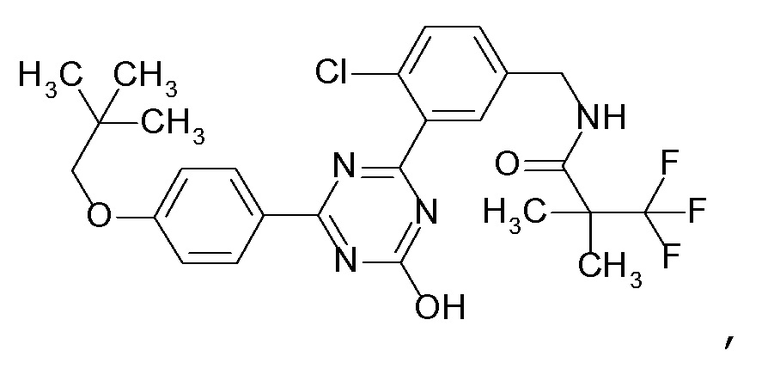
[0047]
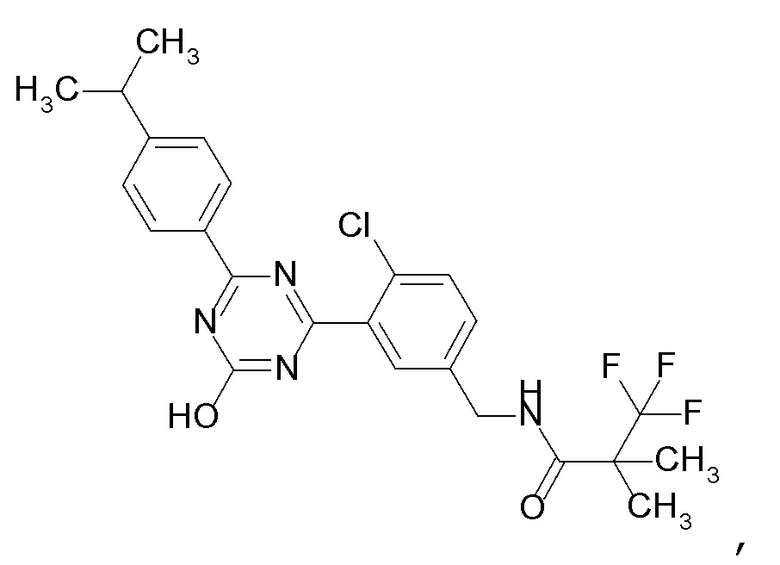
[0048]
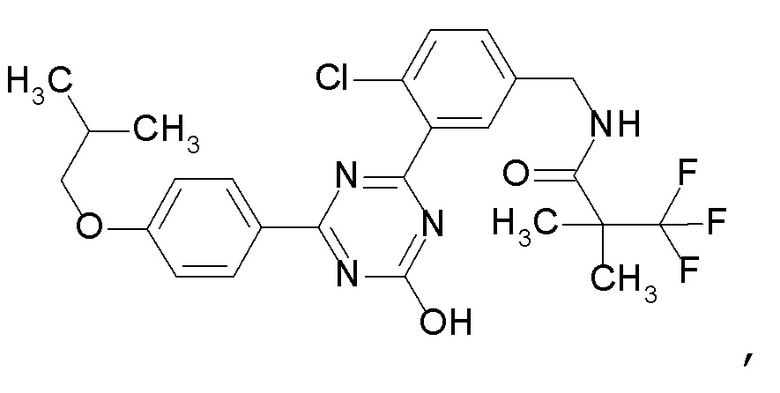
[0049]
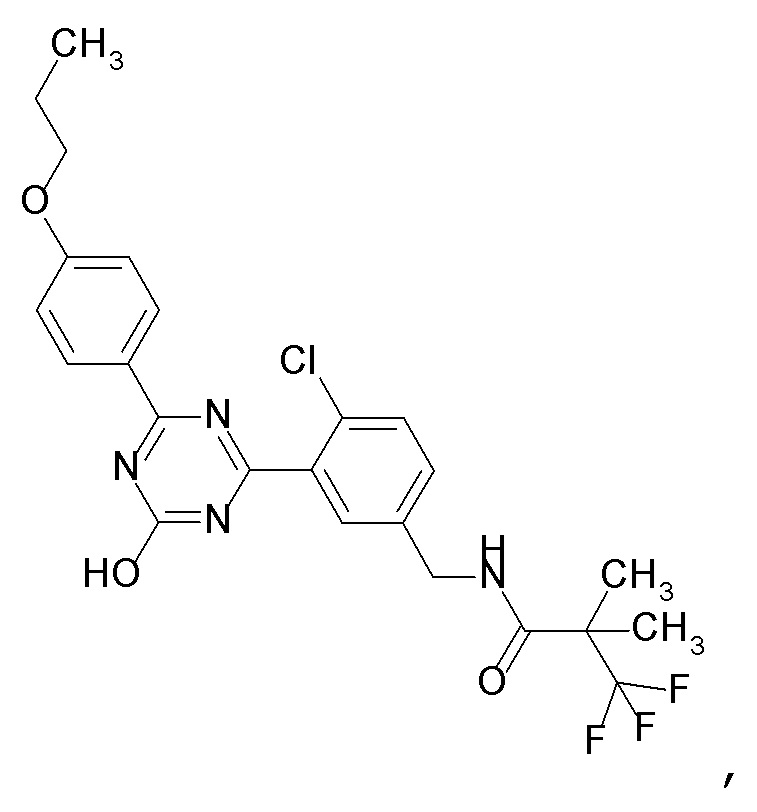
[0050]
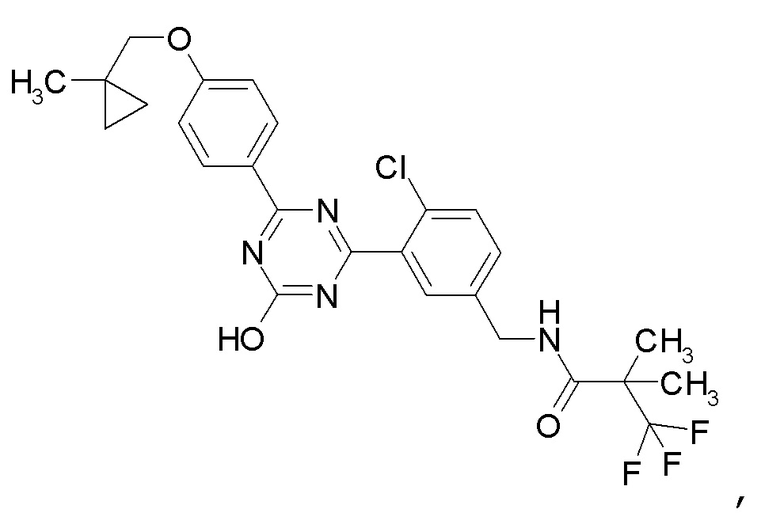
[0051]
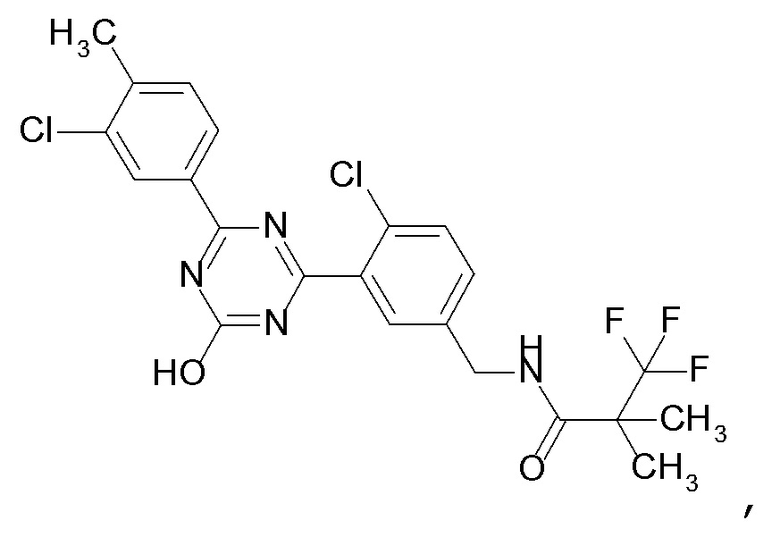
[0052]
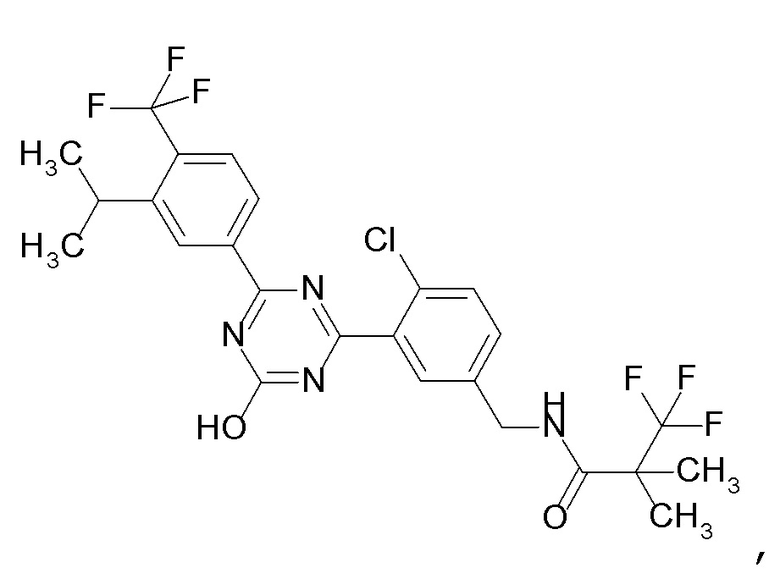
[0053]
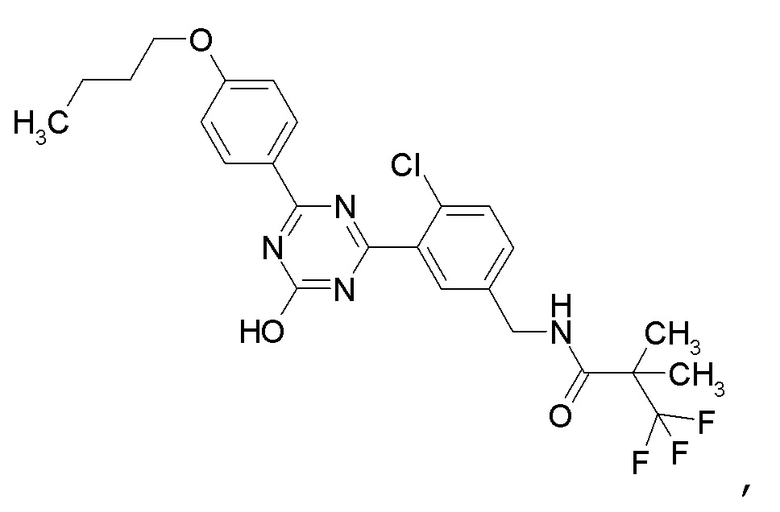
[0054]
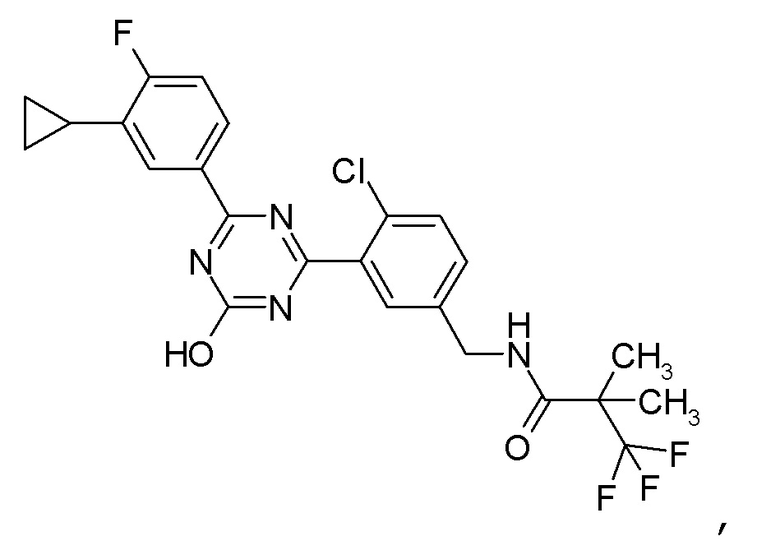
[0055]
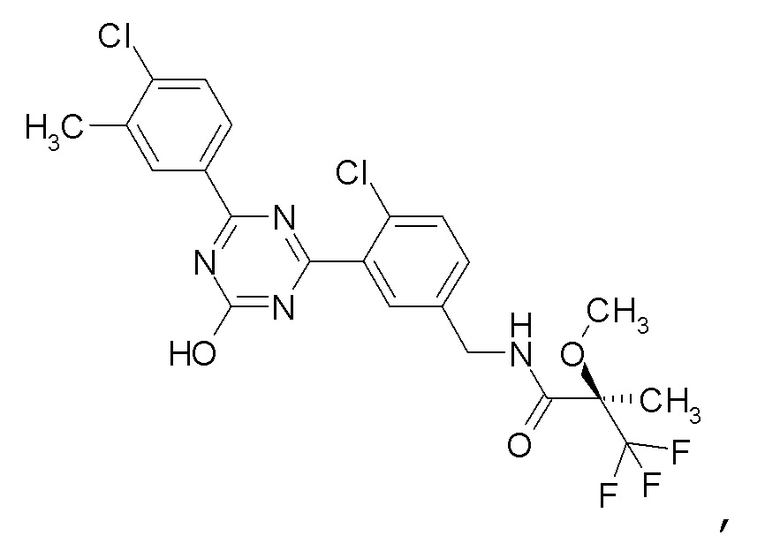
[0056]
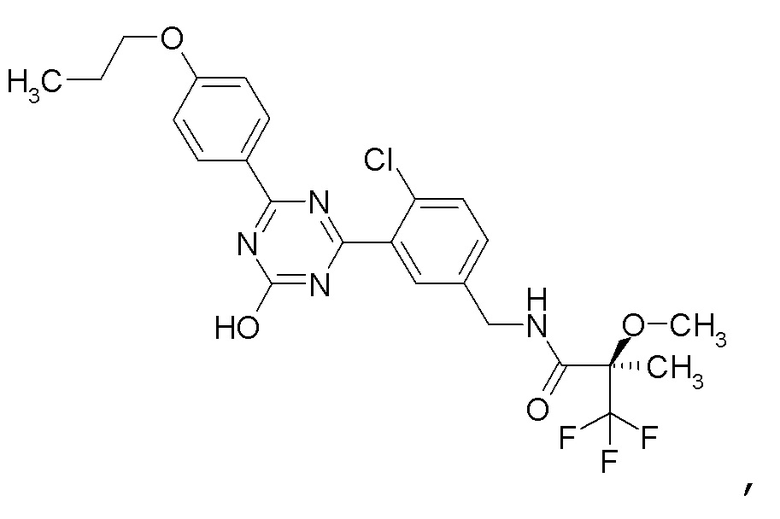
[0057]
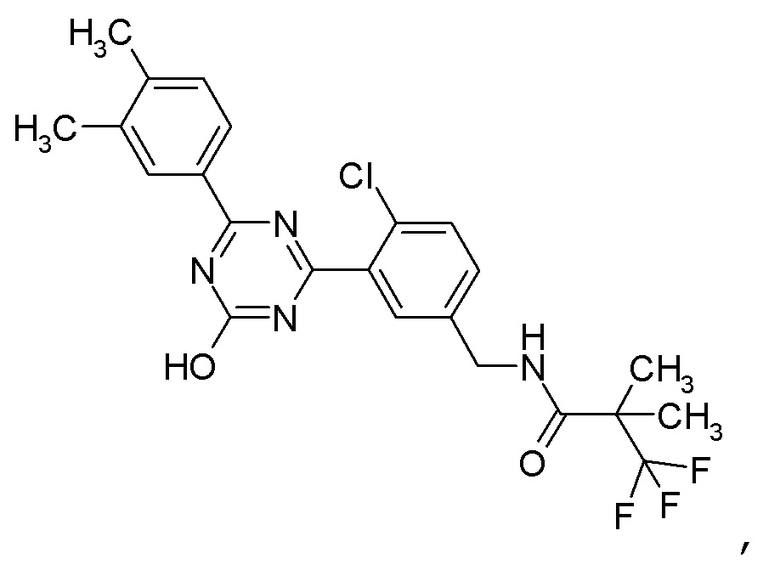
[0058]
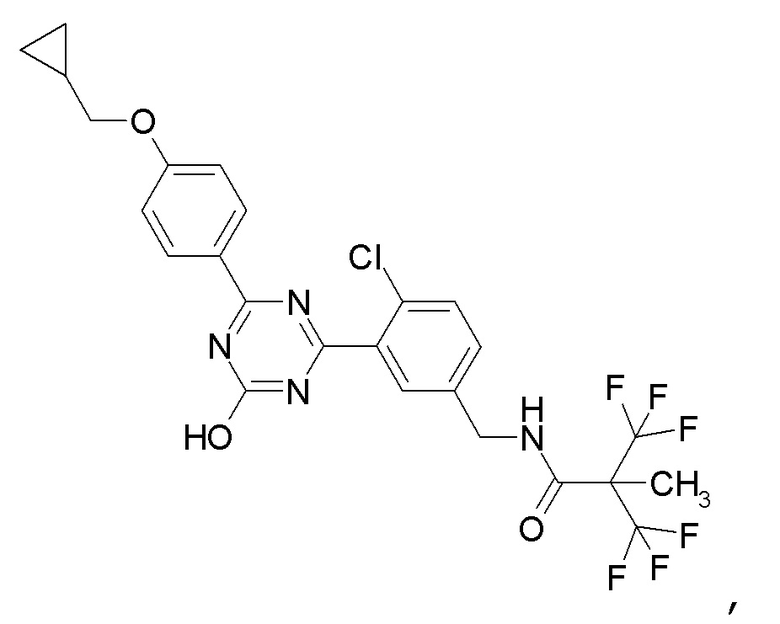
[0059]

[0060]
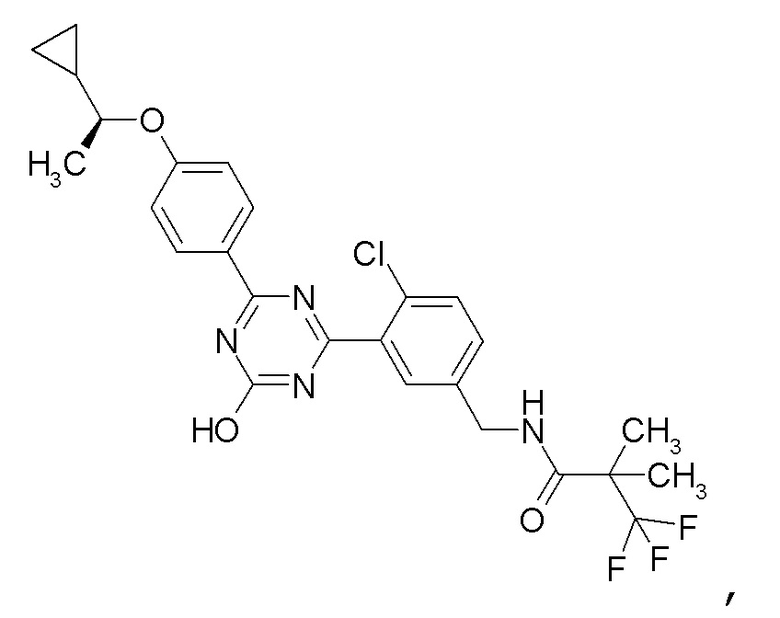
[0061]
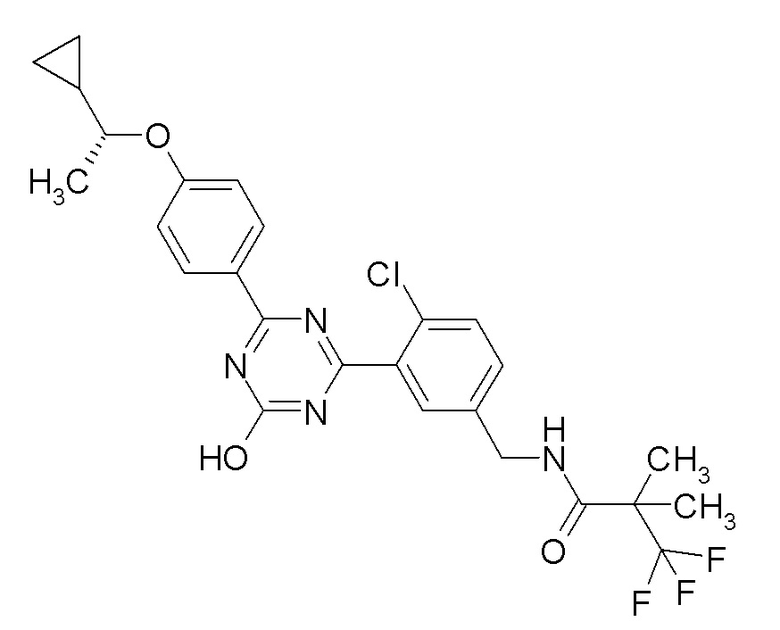
[0062]и
[0063]
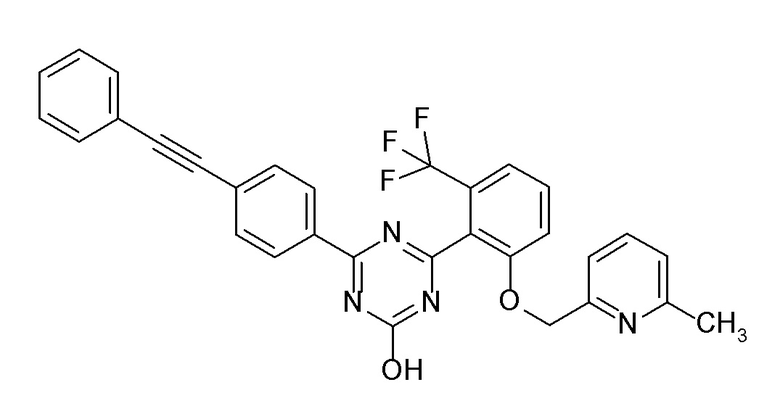
[0064] или его фармацевтически приемлемая соль.
[0065][13]
Фармацевтическая композиция, содержащая соединение по любому из [01]-[12] или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель.
[0066][14]
Ингибитор mPGES-1, содержащий соединение по любому из [01]-[12] или его фармацевтически приемлемую соль.
[0067][15]
Терапевтическое или профилактическое средство при боли, ревматизме, лихорадке, остеоартрите, атеросклерозе, болезни Альцгеймера, рассеянном склерозе, глаукоме, глазной гипертензии, ишемическом заболевании сетчатки, системной склеродермии, раке или заболевании, для которого супрессия продукции PGE2 является эффективной, содержащее соединение по любому из [01]-[12] или его фармацевтически приемлемую соль.
[0068][16]
Терапевтическое или профилактическое средство при глаукоме или глазной гипертензии, содержащее соединение по любому из [01]-[12] или его фармацевтически приемлемую соль, и одно или несколько видов других терапевтических средств для лечения глаукомы в комбинации.
[0069][17]
Способ ингибирования mPGES-1, включающий введение фармацевтически эффективного количества соединения по любому из [01]-[12] или его фармацевтически приемлемой соли человеку.
[0070][18]
Способ лечения или профилактики боли, ревматизма, лихорадки, остеоартрита, атеросклероза, болезни Альцгеймера, рассеянного склероза, глаукомы, глазной гипертензии, ишемического заболевания сетчатки, системной склеродермии, рака или заболевания, для которого супрессия продукции PGE2 является эффективной, включающий введение фармацевтически эффективного количества соединения по любому из [01]-[12] или его фармацевтически приемлемой соли человеку.
[0071][19]
Способ [18] лечения или профилактики глаукомы или глазной гипертензии, дополнительно включающий введение фармацевтически эффективного количества одного или нескольких видов других терапевтических средств для лечения глаукомы человеку.
[0072][20]
Применение соединения по любому из [01]-[12] или его фармацевтически приемлемой соли для получения ингибитора mPGES-1.
[0073][21]
Применение соединения по любому из [01]-[12] или его фармацевтически приемлемой соли для получения терапевтического или профилактического средства при боли, ревматизме, лихорадке, остеоартрите, атеросклерозе, болезни Альцгеймера, рассеянном склерозе, глаукоме, глазной гипертензии, ишемическом нарушении сетчатки, системной склеродермии, раке или заболевании, для которого супрессия продукции PGE2 является эффективной.
Эффект изобретения
[0074]
Соединение по настоящему изобретению является эффективным в качестве терапевтического или профилактического средства при боли, ревматизме, лихорадке, остеоартрите, атеросклерозе, болезни Альцгеймера, рассеянном склерозе, глаукоме, глазной гипертензии, ишемическом заболевании сетчатки, системной склеродермии, раке, включая колоректальный рак, заболевании, для которого супрессия продукции PGE2 является эффективной и тому подобное.
Краткое описание чертежей
[0075]
На фиг.1 показан эффект тестируемого препарата (соединения примера 2-98), контрольного препарата (ксалатан (зарегистрированный товарный знак)) или носителя (метилцеллюлоза, MC) на внутриглазного давления непосредственно перед и после введения Macaca fascicularis.
Описание вариантов осуществления
[0076]
Определения терминов, используемых в настоящем изобретении, являются следующими.
[0077]
ʺГалогенʺ представляет собой фтор, хлор, бром или йод.
[0078]
ʺC1-6 Алкилʺ означает алкил с линейной цепью или разветвленной цепью, имеющий 1-6 атомов углерода. Их примеры включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, 1-этилпропил, гексил, изогексил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилбутил, 2-этилбутил и тому подобное.
[0079]
ʺC1-8 Алкилʺ означает алкил с линейной цепью или разветвленной цепью, имеющий 1-8 атомов углерода. Их примеры включают метил, этил, пропил, изопропил, 1,1-диметилпропил, 1-этил-пропил, 1-метил-1-этил-пропил, бутил, изобутил, втор-бутил, трет-бутил, 1-метил-1-пропил-бутил, пентил, изопентил, неопентил, 1-этилпропил, гексил, изогексил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилбутил, 2-этилбутил и тому подобное.
[0080]
ʺC1-6 Алкоксиʺ означает алкокси, где алкильная группа представляет собой определенный выше ʺC1-6 алкилʺ. Их примеры включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, неопентилокси, 1,2-диметилпропилокси, 1-этилпропилокси, гексилокси, изогексилокси, 1,2,2-триметилпропилокси, 1,1-диметилбутилокси, 2,2-диметилбутилокси, 3,3-диметилбутилокси, 2-этилбутилокси и тому подобное.
[0081]
ʺГалогенC1-4 алкилʺ означает алкил с прямой цепью или разветвленной цепью, имеющий 1-4 атома углерода, который замещен 1-9 определенными выше ʺгалогенамиʺ. Когда имеет место замещение множеством галогенов, соответствующие галогены могут быть одинаковыми или различными. Их примеры включают 2-фторэтил, 2-хлорэтил, 2-бромэтил, 3-фторпропил, 3-хлорпропил, 4-фторбутил, 4-хлорбутил, 1,1-дифторэтил, 1,1-дифторпропил, 1,1-дифтор-2-метилпропил, трифторметил, 2,2,2-трифторэтил, 3,3,3-трифторпропил, 4,4,4-трифторбутил, пентафторэтил, 2,2,2-трифтор-1-трифторметил-этил и тому подобное.
[0082]
ʺГалогенC1-4 алкоксиʺ означает алкокси, где алкильная группа представляет собой определенный выше ʺгалогенC1-4 алкилʺ. Их примеры включают фторметокси, хлорметокси, бромметокси, 2-фторэтокси, 2-хлорэтокси, 2-бромэтокси, 3-фторпропокси, 3-хлорпропокси, 4-фторбутокси, 4-хлорбутокси, 1,1-дифторэтокси, 2,2-дифторэтокси, 1,1-дифторпропокси, 2,2-дифторпропокси, 3,3-дифторпропокси, 1,1-дифтор-2-метилпропокси, трифторметокси, 2,2,2-трифторэтокси, 3,3,3-трифторпропокси, 4,4,4-трифторбутокси, пентафторэтокси, 2,2,2-трифтор-1-трифторметил-этокси и тому подобное.
[0083]
ʺГидроксиC1-6 алкилʺ означает определенный выше ʺC1-6 алкилʺ, замещенный 1 или 2 гидроксигруппами. Их примеры включают гидроксиметил, 2-гидроксиэтил, 1-гидрокси-1-метилэтил, 1,2-дигидроксиэтил, 3-гидроксипропил, 1-гидрокси-2,2-диметилпропил, 4-гидроксибутил, 1-гидрокси-2,2-диметилбутил, 5-гидроксипентил, 6-гидроксигексил и тому подобное.
[0084]
ʺC1-6 Алкил-карбонилʺ означает карбонил, связанный с определенным выше ʺC1-6 алкиломʺ. Их примеры включают ацетил, пропионил, 2,2-диметилпропионил, бутирил, 3-метилбутирил, 2,2-диметилбутирил, пентаноил, 4-метилпентаноил, гексаноил и тому подобное.
[0085]
ʺC1-6 Алкил-карбонилоксиʺ означает карбонилокси, связанный с определенным выше ʺC1-6 алкиломʺ. Их примеры включают метилкарбонилокси, этилкарбонилокси, пропилкарбонилокси, изопропилкарбонилокси, бутилкарбонилокси, изобутилкарбонилокси, втор-бутилкарбонилокси, трет-бутилкарбонилокси, пентилкарбонилокси, изопентилкарбонилокси, 2-метилбутилкарбонилокси, 1,1-диметилпропилкарбонилокси, неопентилкарбонилокси, 3,3-диметилбутилкарбонилокси, 1-этилпропилкарбонилокси, гексилкарбонилокси и тому подобное.
[0086]
ʺC3-7 циклоалкилʺ означает 3-7-членный моноциклический циклоалкил. Их примеры включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
[0087]
ʺC6-10 Арилʺ означает 6-10-членный арил. Их примеры включают фенил, 1-нафтил, 2-нафтил и тому подобное. Из них предпочтительным является фенил.
[0088]
ʺ5- или 6-членный гетероарил, содержащий 1, 2 или 3 атома азота, атома кислорода или атома серыʺ означает 5- или 6-членный моноциклический гетероарил, содержащий, кроме атомов углерода, 1, 2 или 3 гетероатома, выбранные из атома азота, атома кислорода и атома серы. Их примеры включают фурил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, пиразолил, оксадиазолил(1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,4-оксадиазолил), тиадиазолил(1,2,5-тиадиазолил, 1,3,4-тиадиазолил, 1,2,4-тиадиазолил), триазолил(1,2,3-триазолил, 1,2,4-триазолил), пиридил, пиримидинил, пиридазинил, пиразинил, 1,3,5-триазинил и тому подобное. Из них предпочтительным является пиридил.
[0089]
ʺ4-, 5- или 6-членный насыщенный гетероциклил, содержащий 1, 2 или 3 атома азота, атома кислорода или атома серыʺ означает 4-, 5- или 6-членный моноциклический насыщенный гетероциклил, содержащий, кроме атомов углерода, 1, 2 или 3 гетероатома, выбранные из атома азота, атома кислорода и атома серы. Атом углерода гетероцикла необязательно замещен оксо. Когда атом серы содержится в качестве гетероатома, атом серы монооксидирован или диоксидирован. Их примеры включают оксетанил, азетидинил, тетрагидрофурил, тетрагидропиранил, тетрагидротиенил, тетрагидротиопиранил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолидинил, имидазолидинил, пиразолидинил, пирролидинил, пиперидил (включая пиперидино), морфолинил (включая морфолино), тиоморфолинил (включая тиоморфолино), пиперазинил, 1,1-диоксидоизотиазолидинил, 1,1-диоксидотетрагидротиенил, 1,1-диоксидотетрагидротиопиранил, 1,1-диоксидотиоморфолинил (включая 1,1-диоксидотиоморфолино) и тому подобное. Кроме того, насыщенный гетероциклил может быть частично насыщенным. Их примеры включают имидазолинил, оксазолинил, пиразолинил, тиазолинил и тому подобное. Из них предпочтительным является оксетанил.
[0090]
ʺC1-6 Алкилсульфанилʺ означает сульфанил, связанный с определенным выше ʺC1-6 алкиломʺ. Их примеры включают метилсульфанил, этилсульфанил, пропилсульфанил, изопропилсульфанил, н-бутилсульфанил, изобутилсульфанил, втор-бутилсульфанил, трет-бутилсульфанил, пентилсульфанил, 1,1-диметилпропилсульфанил, 2,2-диметилпропилсульфанил, гексилсульфанил и тому подобное.
[0091]
ʺC2-6 Алкинилʺ означает линейный или разветвленный углеводород, имеющий 2-6 атомов углерода и по меньшей мере одну тройную связь. Их примеры включают этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-метил-2-пропинил, 3,3-диметилбутинил (то есть, 3,3-диметилбут-1-инил) и тому подобное.
[0092]
ʺ-(CnH2n)-ʺ означает алкилен с прямой цепью или разветвленной цепью, имеющий n атомов углерода и 2n атомов водорода. Их примеры включают -CH2-, -CH2CH2-, -CH(CH3)-, -CH2CH2CH2-, -C(CH3)2-, -CH(CH3)CH2- и тому подобное.
[0093]
Когда R2 представляет собой (10) -(CnH2n)-Rb и Rb представляет собой (k) -NRb14C(O)Rb15, ʺ(ii) C1-8 алкил (указанный C1-8 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из гидрокси, галогенC1-4 алкила, C1-6 алкокси и C6-10 арила)ʺ для Rb15 означает определенный выше ʺC1-8 алкилʺ, замещенный или незамещенный одинаковыми или различными 1, 2 или 3 заместителями, выбранными из группы, состоящей из гидрокси, определенного выше ʺгалогенC1-4 алкилаʺ, определенного выше ʺC1-6 алкоксиʺ и определенного выше ʺC6-10 арилаʺ, в его положении(ях) замещения. Примеры Rb включают 2-этокси-3-метоксипропилкарбониламино, 1-метил-1-метокси-2,2,2-трифторэтилкарбониламино и тому подобное.
[0094]
Когда R2 представляет собой (10) -(CnH2n)-Rb и Rb представляет собой (k) -NRb14C(O)Rb15, ʺ(iv) C3-7 циклоалкил (указанный C3-7 циклоалкил необязательно замещен 1, 2, 3 или 4 заместителями, выбранными из группы, состоящей из C1-6 алкила, галогена, гидроксиC1-6 алкила и галогенC1-4 алкила, и/или необязательно образует конденсированное кольцо с бензольным кольцом)ʺ для Rb15 означает (1) определенный выше ʺC3-7 циклоалкилʺ, замещенный одинаковыми или различными 1, 2, 3 или 4 заместителями, выбранными из группы, состоящей из определенного выше ʺC1-6 алкилаʺ, определенного выше ʺгалогенаʺ, определенного выше ʺгидроксиC1-6 алкилаʺ и определенного выше ʺгалогенC1-4 алкилаʺ, в его положении(ях) замещения, (2) незамещенный C3-7 циклоалкил, или (3) C3-7 циклоалкил (1) или (2), конденсированный с одним бензольным кольцом в положении присоединения. Примеры Rb включают 1,2,3,4-тетрагидронафталин-2-илкарбониламино, 2-метил-индан-2-илкарбониламино и тому подобное.
[0095]
Когда R2 представляет собой (10) -(CnH2n)-Rb и Rb представляет собой (k) -NRb14C(O)Rb15, ʺRb14 и Rb15 необязательно образуют 4-, 5- или 6-членный лактам вместе с атомом азота, к которому Rb14 присоединен и атомом углерода, к которому Rb15 присоединен" означает, что Rb представляет собой 2-оксо-азетидин-1-ил, 2-оксопирролидин-1-ил, 2-оксо-пиперидин-1-ил или тому подобное.
[0096]
Кроме того, в этом случае, ʺуказанный лактам необязательно замещен 1, 2 или 3 C1-6 алкилами, и/или необязательно образует конденсированное кольцо с бензольным кольцомʺ означает, что, в дополнение к вышеупомянутому "лактаму", (1) одинаковые или различные 1, 2 или 3 C1-6 алкилы, определенные выше, присутствуют в положении(ях) замещения лактама, (2) одно бензольное кольцо конденсировано в положении присоединения лактама, и (3) одно бензольное кольцо конденсировано в положении присоединения лактама, замещенного C1-6 алкилом(ами). Примеры Rb включают 3,4-диметил-2-оксо-пирролидин-1-ил, 1-оксо-1,3-дигидро-изоиндол-2-ил, 3,3-диметил-2-оксо-2,3-дигидро-индол-1-ил и тому подобное.
[0097]
В соединении, представленном формулой [I], предпочтительные варианты осуществления соответствующих групп являются такими, как описано ниже.
[0098]
R1 предпочтительно представляет собой хлор, метил, циано или трифторметил, более предпочтительно, хлор или трифторметил, и наиболее предпочтительно, хлор.
[0099]
R2 предпочтительно представляет собой
(1) галоген,
(2) гидрокси,
(3) карбокси,
(5) C1-6 алкокси,
(6) галогенC1-4 алкокси,
(7) галогенC1-4 алкил,
(8) C1-6 алкил-карбонил,
(9) -C(O)NRa1Ra2 (Ra1 и Ra2 являются такими, как описано выше) или
(10) -(CnH2n)-Rb (Rb является таким, как описано выше),
более предпочтительно
(10) -(CnH2n)-Rb (Rb является такими, как описано выше).
Rb предпочтительно представляет собой
(g) -NRb5C(O)NRb6Rb7 (Rb5, Rb6 и Rb7 являются такими, как описано выше),
(h) -NRb8Rb9 (Rb8 и Rb9 являются такими, как описано выше),
(i) -NRb10S(O)2Rb11 (Rb10 и Rb11 являются такими, как описано выше),
(j) -NRb12C(O)ORb13 (Rb12 и Rb13 являются такими, как описано выше), или
(k) -NRb14C(O)Rb15 (Rb14 и Rb15 являются такими, как описано выше,
более предпочтительно
(k) -NRb14C(O)Rb15 (Rb14 и Rb15 являются такими, как описано выше).
n предпочтительно равен 1 или 2, более предпочтительно 1.
Rb14, предпочтительно, представляет собой водород или метил, более предпочтительно, водород.
Rb15, предпочтительно, представляет собой
(ii) C1-4 алкил (указанный C1-4 алкил необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из гидрокси, трифторметила, C1-4 алкокси и фенила) или
(iv) C3-7 циклоалкил (указанный C3-7 циклоалкил необязательно замещен 1, 2, 3 или 4 заместителями, выбранными из группы, состоящей из C1-4 алкила, галоген, гидроксиC1-4 алкила и трифторметила),
более предпочтительно, C1-4 алкил, необязательно замещенный 1 или 2 трифторметилами и C1-4 алкокси, или C3-7 циклоалкил, необязательно замещенный одним трифторметилом, еще более предпочтительно, трет-бутилом, 3,3,3-трифтор-2,2-диметилпропилом, 3,3,3-трифтор-2-метокси-2-метилпропилом, 3,3,3-трифтор-2-метил-2-трифторметилпропилом или 1-трифторметилциклопропил.
[0100]
R3 предпочтительно представляет собой
(3) C1-6 алкил или
(4) -ORc {Rc представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из следующих (а)-(f);
(a) галогена,
(b) гидрокси,
(c) C1-6 алкокси,
(d) -C(O)NRc1Rc2 (Rc1 и Rc2 являются такими, как описано выше),
(e) C6-10 арила (указанный C6-10 арил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) гидрокси,
(iii) C1-6 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкила), и
(f) 5- или 6-членного гетероарила, содержащего 1, 2 или 3 атома азота, атома кислорода или атома серы (указанный гетероарил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) гидрокси,
(iii) C1-6 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкила)}.
Rc предпочтительно представляет собой метил, необязательно замещенный 1 или 2 заместителями, выбранными из следующих (e) и (f);
(e) C6-10 арила (указанный C6-10 арил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) гидрокси,
(iii) C1-6 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкила), и
(f) 5- или 6-членного гетероарила, содержащего 1, 2 или 3 атома азота, атома кислорода или атома серы (указанный гетероарил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) гидрокси,
(iii) C1-6 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкила),
более предпочтительно, метил, необязательно замещенный 1 или 2 заместителями, выбранными из следующих (e1) и (f1);
(e1) фенила (указанный фенил необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) гидрокси,
(iii) C1-6 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкила), и
(f1) пиридила (указанный пиридил необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) гидрокси,
(iii) C1-6 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкила).
[0101]
R4 предпочтительно представляет собой водород, фтор, хлор или метил, более предпочтительно, водород.
[0102]
R5 предпочтительно представляет собой
(1) галоген,
(4) C1-6 алкил (указанный C1-6 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, C6-10 арила и C1-6 алкокси),
(5) C3-7 циклоалкил,
(6) -ORd {Rd представляет собой
(a) C2-6 алкинил,
(b) C3-7 циклоалкил, необязательно замещенный 1, 2 или 3 C1-6 алкилами или
(c) C1-8 алкил (указанный C1-8 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из следующих (i)-(v);
(i) галогена,
(ii) C6-10 арила,
(iii) C1-6 алкокси,
(iv) C3-7 циклоалкила (указанный C3-7 циклоалкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из C1-6 алкила и галогенC1-4 алкила), и
(v) 4-, 5- или 6-членного насыщенного гетероциклила, содержащего один атом кислорода (указанный насыщенный гетероциклил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из C1-6 алкила и галогенC1-4 алкила))}, или
(7) формулу:
[0103]
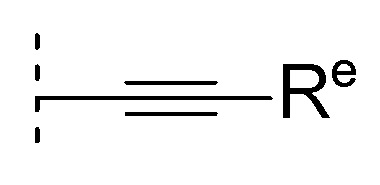
[0104]где Re представляет собой
(a) C1-6 алкил,
(b) C3-7 циклоалкил,
(c) 5- или 6-членный гетероарил, содержащий 1, 2 или 3 атома азота, атома кислорода или атома серы, или
(d) C6-10 арил (указанный C6-10 арил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) C1-6 алкила,
(iii) галогенC1-4 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкокси).
Rd предпочтительно представляет собой C1-8 алкил (указанный C1-8 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из следующих (i)-(v);
(i) галогена,
(ii) C6-10 арила,
(iii) C1-6 алкокси,
(iv) C3-7 циклоалкила (указанный C3-7 циклоалкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из C1-6 алкила и галогенC1-4 алкила), и
(v) 4-, 5- или 6-членного насыщенного гетероциклила, содержащего один атом кислорода (указанный насыщенный гетероциклил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из C1-6 алкила и галогенC1-4 алкила)).
Re предпочтительно представляет собой
(b) C3-7 циклоалкил,
(c) 5- или 6-членный гетероарил, содержащий 1, 2 или 3 атома азота, атома кислорода или атома серы, или
(d) C6-10 арил (указанный C6-10 арил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) C1-6 алкила,
(iii) галогенC1-4 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкокси).
[0105]
m1 предпочтительно равен 0, 1 или 2, более предпочтительно, 1 или 2.
[0106]
В соединении, представленном формулой [I], один из предпочтительных вариантов осуществления представляет собой соединение, представленное следующей формулой [I-A]:
[0107]
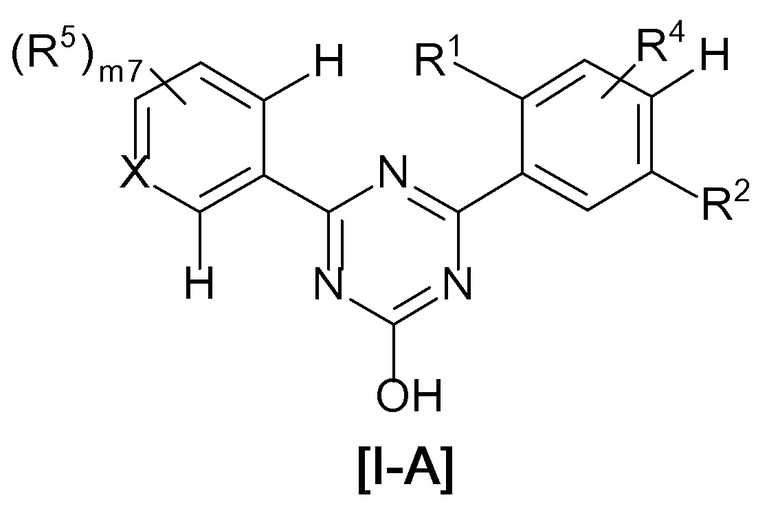
[0108]где
атом углерода с атомом водорода не замещены R4 и R5,
X, R1, R2 и R4 такие, как определено в вышеупомянутой формуле [I],
R5 представляет собой
(1) галоген,
(4) C1-6 алкил (указанный C1-6 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, C6-10 арила и C1-6 алкокси),
(5) C3-7 циклоалкил, или
(6) -ORd {Rd представляет собой
(a) C2-6 алкинил или
(c) C1-8 алкил (указанный C1-8 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из следующих (i)-(v);
(i) галогена,
(ii) C6-10 арила,
(iii) C1-6 алкокси,
(iv) C3-7 циклоалкила (указанный C3-7 циклоалкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из C1-6 алкила и галогенC1-4 алкила), и
(v) 4-, 5- или 6-членного гетероциклила, содержащего 1, 2 или 3 атома азота, атома кислорода или атома серы (указанный насыщенный гетероциклил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из C1-6 алкила и галогенC1-4 алкила))}, и
m7 равен 0, 1 или 2 и, когда m7 равен 2, каждый R5 выбран независимо друг от друга.
[0109]
В соединении, представленном формулой [I], один из предпочтительных вариантов осуществления представляет собой соединение, представленное следующей формулой [I-B]:
[0110]
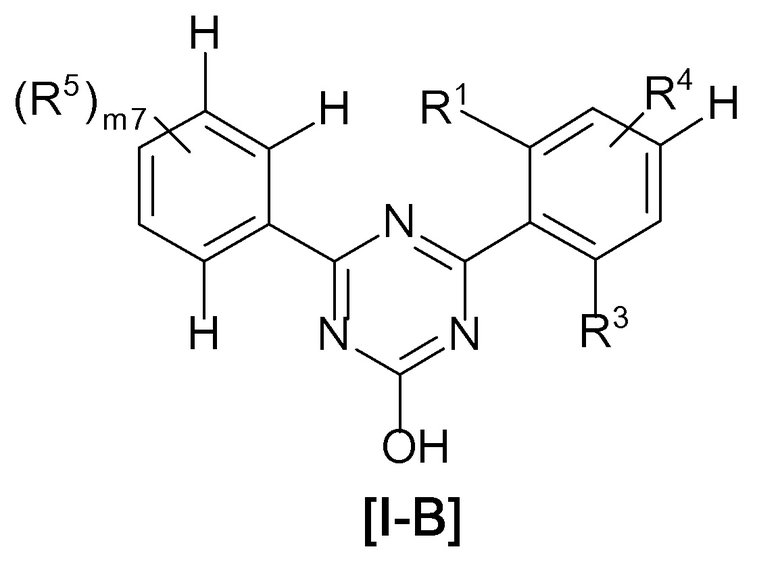
[0111]где
атом углерода с атомом водорода не замещены R4 и R5,
X, R3 и R4 такие, как определено в вышеуказанной формуле [I],
R1 представляет собой хлор или трифторметил,
R5 представляет собой
(4) C1-6 алкил (указанный C1-6 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, C6-10 арила и C1-6 алкокси),
(6) -ORd {Rd представляет собой
C1-8 алкил (указанный C1-8 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из следующих (i)-(iv);
(i) галогена,
(ii) C6-10 арила,
(iii) C1-6 алкокси, и
(iv) C3-7 циклоалкила (указанный C3-7 циклоалкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из C1-6 алкила и галогенC1-4 алкила))}, или
(7) формулу:
[0112]
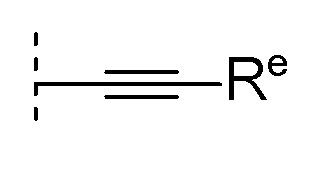
[0113]где Re представляет собой
(b) C3-7 циклоалкил, или
(d) C6-10 арил (указанный C6-10 арил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) C1-6 алкила,
(iii) галогенC1-4 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкокси), и
m7 равен 0, 1 или 2 и, когда m7 равен 2, каждый R5 выбран независимо друг от друга.
[0114]
В соединении, представленном формулой [I], один из предпочтительных вариантов осуществления представляет собой соединение, представленное следующей формулой [I-C]:
[0115]
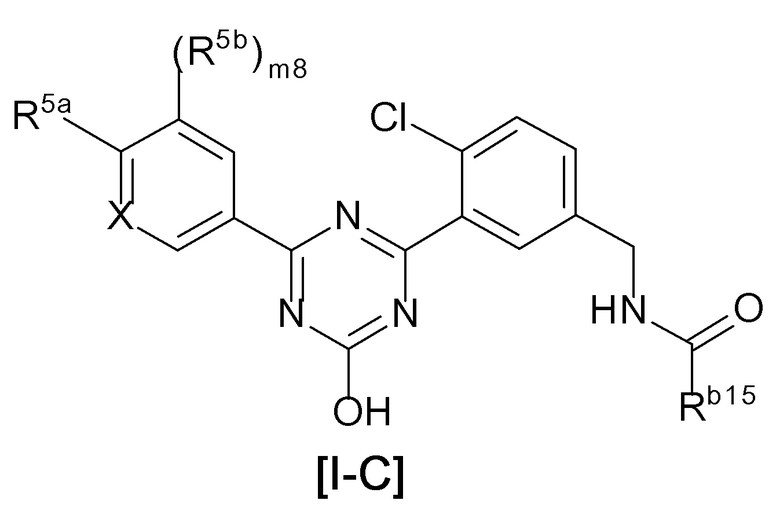
[0116]где
X представляет собой CH или N,
Rb15 представляет собой
(ii) C1-4 алкил (указанный C1-4 алкил необязательно замещен 1 или 2 заместителями, выбранными из трифторметила и метокси) или
(iv) C3-7 циклоалкил, необязательно замещенный трифторметилом,
R5a представляет собой
(1) фтор,
(4) метил (указанный метил необязательно замещен 3 атомами фтора), или
(6) -ORd {Rd представляет собой
(a) C2-4 алкинил или
(c) C1-4 алкил, необязательно замещенный одним C3-7 циклоалкилом (указанный C3-7 циклоалкил необязательно замещен трифторметилом)},
R5b представляет собой
(1) галоген,
(4) C1-4 алкил, или
(5) циклопропил, и
m8 равен 0 или 1.
[0117]
Фармацевтически приемлемой солью соединения, представленного формулой [I] (в дальнейшем также упоминается как соединение по настоящему изобретению), может быть любая соль, при условии, что она образует нетоксичную соль с соединением по настоящему изобретению, и примеры этих солей включают соли с неорганическими кислотами, соли с органическими кислотами, соли с неорганическим основанием, соли с органическим основанием, соли с аминокислотой и тому подобное.
Различные формы фармацевтически приемлемых солей хорошо известны в данной области и, например, они описаны в следующих документах.
(a) Berge et al., J. Pharm. Sci., 66, p 1-19 (1977),
(b) Stahl et al., ʺHandbook of Pharmaceutical Salt: Properties, Selection, and Useʺ (Wiley-VCH, Weinheim, Germany, 2002),
(c) Paulekuhn et al., J. Med. Chem., 50, p 6665-6672 (2007)
Примеры солей с неорганической кислотой включают соли с хлористоводородной кислотой, азотной кислотой, серной кислотой, фосфорной кислотой, бромисто-водородной кислотой и тому подобное.
Примеры солей с органической кислотой включают соли с щавелевой кислотой, малеиновой кислотой, лимонной кислотой, фумаровой кислотой, молочной кислотой, яблочной кислотой, янтарной кислотой, винной кислотой, уксусной кислотой, трифторуксусной кислотой, глюконовой кислотой, аскорбиновой кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой и тому подобное.
Примеры солей с органической кислотой включают соли с адипиновой кислотой, альгиновой кислотой, 4-аминосалициловой кислотой, ангидрометиленлимонной кислотой, бензойной кислотой, эдетатом кальция, камфорной кислотой, камфор-10-сульфоновой кислотой, угольной кислотой, этилендиаминтетрауксусной кислотой, этан-1,2-дисульфоновой кислотой, додецилсерной кислотой, этансульфоновой кислотой, глюкогептоновой кислотой, глюкуроновой кислотой, глюкогептоновой кислотой, гликолиларсаниловой кислоты, гексилрезорциновой кислотой, фтористоводородной кислотой, йодистоводородной кислотой, гидроксинафтойной кислотой, 2-гидрокси-1-этансульфоновой кислотой, лактобионовой кислотой, миндальной кислотой, метилсерной кислотой, метилазотной кислотой, метиленбис(салициловой кислотой), галактаровой кислотой, нафталин-2-сульфоновой кислотой, 2-нафтойной кислотой, 1,5-нафталиндисульфоновой кислотой, олеиновой кислотой, памовой кислотой, пантотеновой кислотой, пектиновой кислотой, пикриновой кислотой, пропионовой кислотой, полигалактуроновой кислотой, салициловой кислотой, стеариновой кислотой, дубильной кислотой, теоклиновой кислотой, тиоциановой кислотой, ундекановой кислотой и тому подобное.
Примеры солей с неорганическим основанием включают соль натрия, соль калия, соль кальция, соль магния, соль аммония и тому подобное.
Кроме того, примеры солей с неорганическим основанием включают соли с алюминием, барием, висмутом, литием или цинком.
Примеры солей с органическим основанием включают соли с метиламином, диэтиламином, триметиламином, триэтиламином, этаноламином, диэтаноламином, триэтаноламином, этилендиамином, трис(гидроксиметил)метиламином, дициклогексиламином, N,N'-дибензилэтилендиамином, гуанидином, пиридином, пиколином, холином, цинхонином, меглумином и тому подобное.
Кроме того, примеры солей с органическим основанием включают соли с ареколином, бетаином, клемизолем, N-метилглюкамином, N-бензилфенэтиламином или трис(гидроксиметил)метиламином.
Примерами солей с аминокислотой включают соли с лизином, аргинином, аспарагиновой кислотой, глутаминовой кислотой и тому подобное.
Среди вышеуказанных солей предпочтительными являются соли с хлористоводородной кислотой, серной кислотой или п-толуолсульфоновой кислотой.
Различные соли могут быть получены путем взаимодействия соединения, представленного формулой [I], с неорганическим основанием, органическим основанием, неорганической кислотой, органической кислотой или аминокислотой, в соответствии с известным способом.
[0118]
Соединение, представленное формулой [I], или его фармацевтически приемлемая соль может присутствовать в виде сольвата. "Сольват" представляет собой соединение, представленное формулой [I] или его фармацевтически приемлемую соль, которое координируется с молекулой растворителя, и также охватывает гидраты. Сольват, предпочтительно, представляет собой фармацевтически приемлемый сольват, примеры включают гидрат, этанолят, диметил сульфоксид и тому подобное соединения, представленного формулой [I], или его фармацевтически приемлемой соли. Конкретные примеры включают полугидрат, моногидрат, дигидрат или моноэтанолат соединения, представленного формулой [I], моногидрат соли натрия или 2/3-этанолат дигидрохлорида соединения, представленного формулой [I], и тому подобное.
Сольваты могут быть получены известным способом.
[0119]
Кроме того, соединение, представленное формулой [I], может быть мечено изотопом (например, 2H, 3H, 14C, 35S и тому подобное).
[0120]
Соединение по настоящему изобретению может существовать в виде таутомера. В этом случае, соединение по настоящему изобретению, может быть отдельным таутомером или смесью отдельных таутомеров. Например, соединение, представленное формулой [I], может содержать таутомер, показанный ниже
[0121]
[0122]
Такой таутомер также входит в соединение, представленное формулой [I].
Соединение по настоящему изобретению может иметь двойную углеродную связь. В этом случае, соединение по настоящему изобретению, может существовать в виде Е-формы, Z-формы или смеси Е-формы и Z-формы.
Соединение по настоящему изобретению может содержать стереоизомеры, которые должны быть признаны как цис/транс-изомер. В этом случае, соединение по настоящему изобретению, может быть представлено в виде цис-формы, транс-формы, или смеси цис-формы и транс-формы.
Соединение по настоящему изобретению может содержать один или несколько асимметричных атомов углерода. В этом случае, соединение по настоящему изобретению может присутствовать в виде единственного энантиомера, единственного диастереомера, смеси энантиомеров или смеси диастереомеров.
Соединение по настоящему изобретению может присутствовать в виде атропоизомера. В этом случае, соединение по настоящему изобретению может присутствовать в виде отдельного атропоизомера или смеси атропизомеров.
Соединение по настоящему изобретению может одновременно содержать множественные структурные характеристики, которые продуцируют вышеупомянутые изомеры. Кроме того, соединение по настоящему изобретению может содержать указанные выше изомеры в любом соотношении.
[0123]
В отсутствие другой ссылки, такой как аннотация и тому подобное, формулы, химические структуры и названия соединения, указанные в настоящем описании, без указания его стереохимии, охватывают все вышеупомянутые изомеры, которые могут существовать
[0124]
Диастереомерная смесь может быть разделена на каждый диастереомер обычными способами, такими как хроматография, кристаллизация и тому подобное. Кроме того, каждый диастереомер может быть также получен с использованием стереохимически отдельного исходного вещества, или способам синтеза с помощью стереоселективной реакции.
[0125]
Энантиомерная смесь может быть разделена на каждый отдельный энантиомер способом, хорошо известным в соответствующей области.
Например, энантиомерная смесь может быть получена путем взаимодействия энантиомерной смеси с по существу чистым энантиомером, который известен в качестве хирального вспомогательного реагента. Диастереомерную смесь можно разделить на каждый диастереомер, указанный выше. Диастереомерную смесь можно разделить на каждый диастереомер, как упоминалось выше. Отделенный диастереомер может быть превращен в желаемый энантиомер удалением добавленного хирального вспомогательного реагента расщеплением.
Кроме того, смесь энантиомеров соединения также может быть непосредственно разделена методом хроматографии с использованием хиральной твердой фазы, хорошо известным в данной области.
В качестве альтернативы, один из энантиомеров соединения также может быть получен с использованием в основном чистого оптически активного исходного вещества или стереоселективного синтеза (асимметричная индукция) прохирального промежуточного соединения с использованием хирального вспомогательного реагента и асимметричного катализатора.
[0126]
Абсолютная стерическая конфигурация может быть определена на основе рентгеноструктурного анализа полученного кристаллического продукта или промежуточного соединения. В этом случае полученный кристаллический продукт или промежуточное соединение, дериватизированные с реагентом, имеющим асимметричный центр с известной стерической конфигурацией, могут быть использованы в случае необходимости.
[0127]
В качестве соединения, представленного формулой [I], или его фармацевтически приемлемой соли, предпочтительным является по существу очищенное соединение, представленное формулой [I], или его фармацевтически приемлемая соль. Более предпочтительным является соединение, представленное формулой [I], или его фармацевтически приемлемая соль, или его сольват, который очищен так, чтобы он имел чистоту более 80%.
[0128]
Примеры ʺфармацевтической композицииʺ включают пероральные препараты, такие как таблетка, капсула, гранула, порошок, пастилка, сироп, эмульсия, суспензия и тому подобное, и парентеральные агенты, такие как препарат для наружного применения, суппозиторий, инъекция, глазные капли, назальные препараты, легочные препараты и тому подобное.
[0129]
Фармацевтическую композицию по настоящему изобретению получают согласно способу, известному в области фармацевтических препаратов, смешиванием и т.д. соединения, представленного формулой [I], или его фармацевтически приемлемой соли, или его сольвата с подходящим количеством по меньшей мере одного типа фармацевтически приемлемого носителя и при необходимости подобного ему компонента. Хотя содержание соединения, представленного формулой [I], или его фармацевтически приемлемой соли, или его сольвата, в фармацевтической композиции варьирует в зависимости от лекарственной формы, дозы и тому подобного, его содержание составляет, например, 0,00001-100% масс. всей композиции.
[0130]
Примеры ʺфармацевтически приемлемого носителяʺ включают различные органические или неорганические вещества-носители, обычно используемые в качестве компонентов препарата, например, эксципиент, дезинтегрирующее средство, связывающее вещество, вещество, придающее скольжение, смазывающее вещество и тому подобное для твердых препаратов и растворитель, солюбилизирующее средство, суспендирующее средство, изотоническое средство, буферное средство, успокаивающее средство, поверхностно-активное вещество, регулятор pH, средство для сгущения и тому подобное для жидких препаратов. Кроме того, когда необходимо, используют добавки, такие как консервант, антиокислитель, красящее вещество, подсластитель и тому подобное.
[0131]
Примеры ʺэксципиентаʺ включают лактозу, сахарозу, D-маннит, D-сорбит, кукурузный крахмал, декстрин, микрокристаллическую целлюлозу, кристаллическую целлюлозу, кармеллозу, кальциевую соль кармеллозы, натриевую соль карбоксиметилкрахмала, слабозамещенную гидроксипропилцеллюлозу, аравийскую камедь и тому подобное.
[0132]
Примеры ʺдезинтегрирующего средстваʺ включают кармеллозу, кальциевую соль кармеллозы, натриевую соль кармеллозы, натриевую соль карбоксиметилкрахмала, натриевую соль кроскармеллозы, кросповидон, слабозамещенную гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, кристаллическую целлюлозу и тому подобное.
[0133]
Примеры ʺсвязывающего веществаʺ включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, повидон, кристаллическую целлюлозу, сахарозу, декстрин, крахмал, желатин, натриевую соль кармеллозы, аравийскую камедь и тому подобное.
[0134]
Примеры ʺвещества, придающего скольжениеʺ включают легкую безводную кремниевую кислоту, стеарат магния и тому подобное.
[0135]
Примеры ʺсмазывающего веществаʺ включают стеарат магния, стеарат кальция, тальк и тому подобное.
[0136]
Примеры ʺрастворителяʺ включают очищенную воду, этанол, пропиленгликоль, макрогол, кунжутное масло, кукурузное масло, оливковое масло и тому подобное.
[0137]
Примеры ʺсолюбилизирующего средстваʺ включают пропиленгликоль, D-маннит, бензилбензоат, этанол, триэтаноламин, карбонат натрия, цитрат натрия и тому подобное.
[0138]
Примеры ʺсуспендирующего средстваʺ включают хлорид бензалкония, кармеллозу, гидроксипропилцеллюлозу, пропиленгликоль, повидон, метилцеллюлозу, моностеарат глицерина и тому подобное.
[0139]
Примеры ʺизотонического средстваʺ включают глюкозу, D-сорбит, хлорид натрия, D-маннит и тому подобное.
[0140]
Примеры ʺбуферного средстваʺ включают гидрофосфат натрия, ацетат натрия, карбонат натрия, цитрат натрия и тому подобное.
[0141]
Примеры ʺуспокаивающего средстваʺ включают бензиловый спирт и тому подобное.
[0142]
Примеры ʺповерхностно-активного веществаʺ включают полиоксиэтиленовое гидрогенизированное касторовое масло, моностеарат полиэтиленгликоля, полиоксиэтиленовый эфир сорбита и жирной кислоты, алкилдиаминоэтилглицин, алкилбензолсульфонат, бензетония хлорид и тому подобное.
[0143]
Примеры ʺрегулятора рНʺ включают соляную кислоту, серную кислоту, фосфорную кислоту, лимонную кислоту, уксусную кислоту, бикарбонат натрия, карбонат натрия, гидроксид калия, гидроксид натрия, моноэтаноламин, триэтаноламин и тому подобное.
[0144]
Примеры ʺсредства для сгущенияʺ включают поливиниловый спирт, карбоксивиниловый полимер, метилцеллюлозу, гидроксиэтилцеллюлозу, полиэтиленгликоль, декстран и тому подобное.
[0145]
Примеры ʺконсервантаʺ включают этилпарагидроксибензоат, хлорбутанол, бензиловый спирт, дегидроацетат натрия, сорбиновую кислоту и тому подобное.
[0146]
Примеры ʺантиоксидантаʺ включают сульфит натрия, аскорбиновую кислоту и тому подобное.
[0147]
Примеры ʺкрасящего веществаʺ включают пищевые красители (например, пищевой краситель красный No. 2 или 3, пищевой краситель желтый No. 4 или 5 и т.д.), β-каротин и тому подобное.
[0148]
Примеры ʺподсластителяʺ включают сахарин натрия, дикалийглицирризинат, аспартам и тому подобное.
[0149]
Фармацевтическую композицию по настоящему изобретению можно вводить перорально или парентерально (например, местным, ректальным, внутривенным введением и тому подобное) человеку, а также млекопитающим, отличным от человека (например, хомячку, морской свинке, кошке, собаке, свинье, корове, лошади, овце, обезьяне и тому подобное). Доза изменяется в зависимости от субъекта введения, заболевания, симптома, лекарственной формы, пути введения и тому подобного. Например, суточная доза для перорального введения взрослому пациенту (масса тела: приблизительно 60 кг) обычно находится в диапазоне приблизительно от 0,1 мкг до 1 г в расчете на соединение по настоящему изобретению в качестве активного ингредиента. Это количество можно вводить в виде от одной до нескольких порций.
[0150]
Вышеуказанное соединение, представленное формулой [I], или его фармацевтически приемлемую соль, или его сольват можно использовать в комбинации с одним или несколькими другими лекарственными средствами (в дальнейшем также упоминается как сопутствующее лекарственное средство) согласно способу, обычно используемому в медицинской области (в дальнейшем называемому как комбинированное использование).
[0151]
Период введения вышеуказанного соединения, представленного формулой [I], или его фармацевтически приемлемой соли и сопутствующего лекарственного средства не ограничивается, и их можно вводить индивиду введения в виде комбинированного препарата или оба препарата можно вводить одновременно или при заданных интервалах в виде отдельных препаратов. Кроме того, фармацевтическую композицию по настоящему изобретению и сопутствующее лекарственное средство можно применять в форме набора. Доза сопутствующего лекарственного средства аналогична клинически применяемой дозе, и ее можно подходящим образом выбрать согласно субъекту введения, заболеванию, симптому, лекарственной форме, пути введения, времени введения, комбинации и тому подобному. Форму введения сопутствующего лекарственного средства конкретно не ограничивают, и требуется только комбинирование соединения, представленного формулой [I], или его фармацевтически приемлемой соли, или его сольвата с сопутствующим лекарственным средством.
[0152]
Примеры сопутствующего лекарственного средства включают терапевтические средства для лечения глаукомы, такие как препарат простагландина, β-блокатор, агонист α-рецептора, средство, стимулирующее симпатический нерв, α-блокатор, ингибитор карбоангидразы, антихолинэстеразное средство, ингибитор Rho-киназы и тому подобное.
[0153]
Примеры препарата простагландина включают унопростон изопропил, латанопрост, травопрост, тафлупрост, биматопрост и тому подобное.
Примеры β-блокаторов включают малеат тимолола, гидрохлорид бефунолола, гидрохлорид картеолола, гидрохлорид бетаксолола, нипрадилол, гидрохлорид левобунолола и тому подобное.
[0154]
Примеры агониста α-рецептора включают бримонидин тартрат и тому подобное.
[0155]
Примеры средства, стимулирующего симпатический нерв, включают дипивефрин гидрохлорид, пилокарпина гидрохлорид и тому подобное.
[0156]
Примеры α-блокатора включают буназозин гидрохлорид и тому подобное.
[0157]
Примеры ингибитора карбоангидразы включают дорзоламида гидрохлорид, бринзоламид и тому подобное.
[0158]
Примеры антихолинэстеразного средства включают дистигмина бромид и тому подобное.
[0159]
Примеры ингибитора Rho-киназы включают рипасудил гидрохлорид гидрат и тому подобное.
[0160]
Примером конкретной комбинации лекарственных средств является сочетание одного лекарственного средства, выбранного из латанопроста, травопроста, тафлупроста, малеата тимолола, дорзоламида гидрохлорида и бринзоламида, и указанного выше соединения, представленного формулой [I], или его фармацевтически приемлемой соли, или его сольвата.
[0161]
Далее, ниже объясняется один пример способов получения соединения для осуществления на практике настоящего изобретения. Однако способ получения соединения по настоящему изобретению или фармацевтически приемлемой соли не ограничивается им.
Даже если непосредственное соответствующее описание не находится в нижеследующих способах получения, стадии можно модифицировать для эффективного получения соединения, например, введением защитной группы в функциональную группу с удалением защитной группы на следующей стадии, изменением порядка способов получения и стадий получения, надлежащим использованием реагентов, отличных от приведенных в качестве примера реагентов, для ускорения протекания реакций и тому подобное.
Обработкой после реакции в каждой стадии могут быть общепринятые обработки, где выделение и очистку можно проводить, если необходимо, согласно способу, подходящим образом выбранному из общепринятых способов, таких как кристаллизация, перекристаллизация, дистилляция, распределение, хроматография на силикагеле, препаративная ВЭЖХ и тому подобное, или комбинацией таких способов. В некоторых случаях, следующая стадия может быть проведена без выделения и очистки.
Промежуточное соединение, способное к образованию соли, может быть также получено в виде соли или использовать в виде соли для реакций. Примеры такой соли включают гидрохлорид промежуточного соединения, имеющего аминогруппу.
[0162][Способ получения 1-1]
[0163]
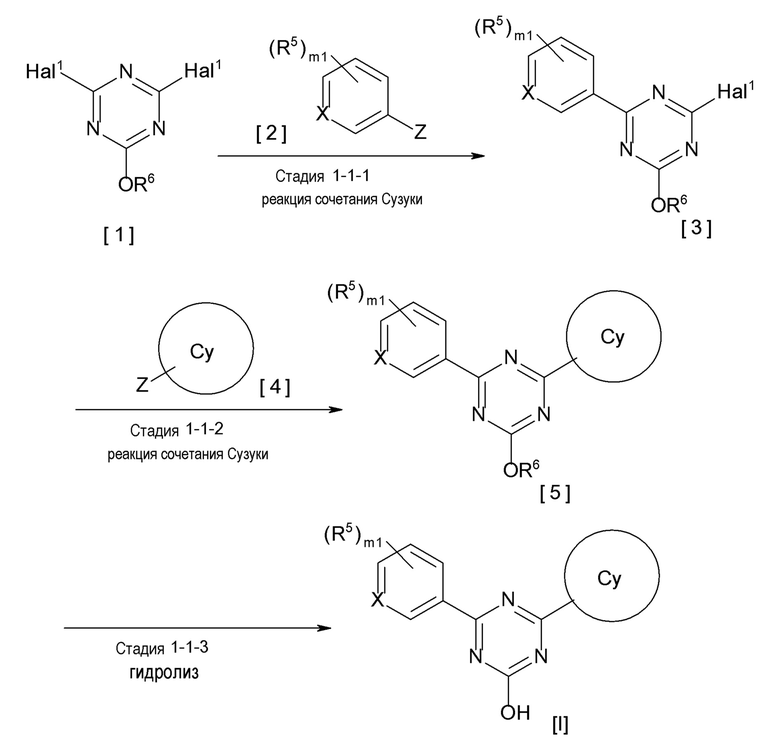
[0164]
где Hal1 представляет собой хлор или бром;
R6 представляет собой C1-6 алкил, такой как метил, этил и тому подобное или бензил;
Z представляет собой борсодержащий заместитель, используемый для реакции сочетания Сузуки, такой как -B(OH)2, -B(OR7)2 (где R7 представляет собой C1-4 алкил или один R7 может быть соединен с другими R7 с образованием кольца), -BF3, формула
[0165]
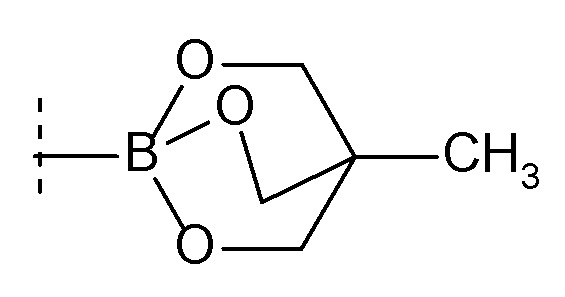
[0166]и тому подобное; и
X, Cy, R5 и m1 такие, как определено в вышеуказанной формуле [I].
[0167](Стадия 1-1-1)
Соединение [3] может быть получено реакцией сочетания Сузуки соединения [1] и соединения [2]. Например, соединение [3] может быть получено взаимодействием соединения [1] с соединением [2] при нагревании в растворителе в присутствии основания и палладиевого катализатора. При необходимости можно добавить лиганд. Предпочтительно, используют не менее чем 1,5 эквивалента соединения [1] по отношению к соединению [2] для предотвращения протекания реакции сочетания Сузуки дважды.
Примеры палладиевого катализатора, который используют для реакции, включают ацетат палладия, тетракистрифенилфосфинпалладий, бис(трифенилфосфин)палладий дихлорид, комплекс (бис(дифенилфосфино)ферроцен)палладий-дихлорид-метиленхлорид и тому подобное.
Примеры основания, которое используют для реакции, включают неорганические основания, такие как соли щелочных металлов (например, фосфат калия, карбонат натрия, гидрокарбонат натрия, карбонат калия, ацетат калия, ацетат натрия, фторид цезия и тому подобное) и тому подобное, и органические основания, такие как триэтиламин и тому подобное.
Примеры лиганда, который используют для реакции, включают органические фосфиновые лиганды (например, трифенилфосфин, трициклогексилфосфин, 2,2'-бис(дифенилфосфино)-1,1'-бинафталин, 2-дициклогексилфосфино-2',6'-диметоксибифенил и тому подобное) и тому подобное.
Примеры растворителя, который используют для реакции, включают растворители типа простых эфиров, такие как 1,4-диоксан, тетрагидрофуран, диэтиловый простой эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное; спиртовые растворители, такие как метанол, этанол, 1-пропанол, 2-пропанол и тому подобное; углеводородные растворители, такие как толуол, ксилол, гексан и тому подобное; полярные растворители, такие как N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил и тому подобное; смесь такого растворителя, и смесь такого растворителя с водой.
Соединение [1] может быть коммерчески доступным продуктом, таким как 2,4-дихлор-6-метокси-1,3,5-триазин, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
Что касается реакции сочетания Сузуки, например, известна следующая обзорная статья (SUZUKI, A et al. Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds. Chem Rev. 1995, Vol.95, pages 2457-2483).
[0168](Стадия 1-1-2)
Соединение [5] может быть получено реакцией сочетания Сузуки соединения [3] и соединения [4]. Например, соединение [5] может быть получено взаимодействием соединения [3] с соединением [4] при нагревании в растворителе в присутствии основания и палладиевого катализатора. При необходимости, можно добавить лиганд.
Примеры палладиевого катализатора, который используют для реакции включают ацетат палладия, тетракистрифенилфосфинпалладий, бис(трифенилфосфин)палладий дихлорид, комплекс (бис(дифенилфосфино)ферроцен)палладий-дихлорид-метиленхлорид и тому подобное.
Примеры основания, которое используют для реакции, включают неорганические основания, такие как соли щелочных металлов (например, фосфат калия, карбонат натрия, гидрокарбонат натрия, карбонат калия, ацетат калия, ацетат натрия, фторид цезия и тому подобное) и тому подобное, и органические основания, такие как триэтиламин и тому подобное.
Примеры лиганда, который используют для реакции, включают органические фосфиновые лиганды, такие как трифенилфосфин, трициклогексилфосфин, 2,2'-бис(дифенилфосфино)-1,1'-бинафталин, 2-дициклогексилфосфино-2',6'-диметоксибифенил и тому подобное, и тому подобное.
Примеры растворителя, который используют для реакции, включают растворители типа простых эфиров, такие как 1,4-диоксан, тетрагидрофуран, диэтиловый простой эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное; спиртовые растворители, такие как метанол, этанол, 1-пропанол, 2-пропанол и тому подобное; углеводородные растворители, такие как толуол, ксилол, гексан и тому подобное; полярные растворители, такие как N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил и тому подобное; смесь такого растворителя, и смесь такого растворителя с водой.
[0169](Стадия 1-1-3)
Соединение [I] может быть получено превращением алкоксигруппы соединения [5] в гидроксигруппу путем гидролиза. Например, когда R6 представляет собой C1-6 алкил, соединение [I] может быть получено реакцией соединения [5] в растворителе в присутствии основания при комнатной температуре при нагревании, и нейтрализации полученного раствора.
Примеры основания, которое используют для реакции, включают гидроксид лития, гидроксид натрия, гидроксид калия, метоксид натрия и тому подобное.
Примеры растворителя, который используют для реакции, включают смешанный растворитель из воды и спиртовых растворителей, таких как метанол, этанол, 1-пропанол, 2-пропанол и тому подобное; и смешанный растворитель такого растворителя с растворителями типа простых эфиров, такими как 1,4-диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное.
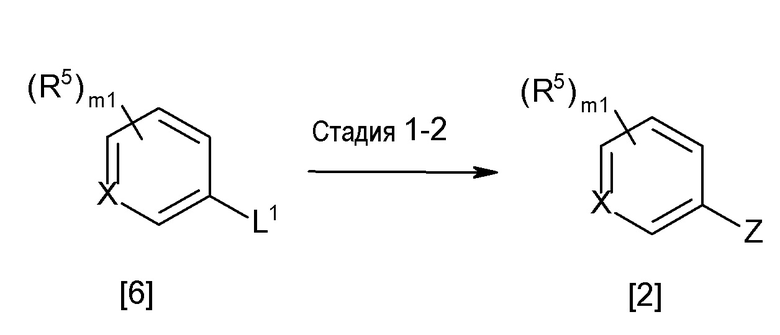
[0170][Способ получения 1-2]
Соединение [2] может быть получено, например, способом получения 1-2.
[0171][Способ получения 1-2]
[0172]
[0173]
где L1 представляет собой уходящую группу, такую как бром, йод, трифторметансульфонилокси и тому подобное, X, R5 и m1 такие, как определено в вышеупомянутой формуле [I], и Z является таким, как определено в вышеупомянутом способе получения 1-1.
[0174](Стадия 1-2)
Соединение [2] может быть получено борированием соединения [6]. Например, соединение [2] может быть получено взаимодействием соединения [6] с борсодержащим реагентом при нагревании в присутствии основания и палладиевого катализатора. При необходимости, можно добавить лиганд.
Примеры борсодержащего реагента, который используют для реакции, включают 4,4,4',4',5,5,5',5'-октаметил-2,2'-би-1,3,2-диоксаборолан, 5,5,5',5'-тетраметил-2,2'-би-1,3,2-диоксаборинан, тетрагидроксидиборон, 4,4,5,5-тетраметил-1,3,2-диоксаборолан и тому подобное.
Примеры палладиевого катализатора, который используют для реакции, включают ацетат палладия, тетракистрифенилфосфинпалладий, бис(трифенилфосфин)палладий дихлорид, комплекс (бис(дифенилфосфино)ферроцен)палладий дихлорид-метиленхлорид и тому подобное.
Примеры основания, которое используют для реакции, включают неорганические основания, такие как соли щелочных металлов (например, фосфат калия, карбонат натрия, гидрокарбонат натрия, карбонат калия, ацетат калия, ацетат натрия, фторид цезия и тому подобное) и тому подобное, и органические основания, такие как триэтиламин и тому подобное.
Примеры лиганда, который используют для реакции, включают органические фосфиновые лиганды (например, трифенилфосфин, трициклогексилфосфин, 2,2'-бис(дифенилфосфино)-1,1'-бинафталин, 2-дициклогексилфосфино-2',6'-диметоксибифенил и тому подобное) и тому подобное.
Примеры растворителя, который используют для реакции, включают растворители типа простых эфиров, такие как 1,4-диоксан, тетрагидрофуран, диэтиловый простой эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное; спиртовые растворители, такие как метанол, этанол, 1-пропанол, 2-пропанол и тому подобное; углеводородные растворители, такие как толуол, ксилол, гексан и тому подобное; полярные растворители, такие как N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил и тому подобное; смесь такого растворителя, и смесь такого растворителя с водой.
Соединение [2] также может быть получено добавлением металлорганического реагента к соединению [6] в растворителе при температуре -78°C до комнатной температуры, и взаимодействие продукта с соединением бора при -78°C до комнатной температуры.
Примеры металлорганического реагента, который используют для реакции, включают н-бутиллитий, трет-бутиллитий, изопропилмагнийхлорид и тому подобное.
Примеры борсодержащего реагента, который используют для реакции, включают триметилборат триизопропилборат, 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан и тому подобное.
Примеры растворителя, который используют для реакции, включают растворители типа простых эфиров, такие как 1,4-диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное; углеводородные растворители, такие как толуол, ксилол, гексан и тому подобное, и их смешанный растворитель.
В одном варианте осуществления соединение [6] может быть коммерчески доступным продуктом, таким, как показано ниже, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0175]
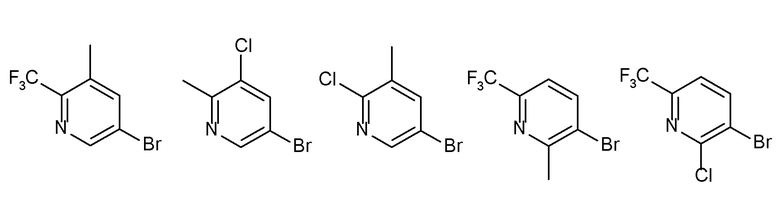
[0176]
В одном варианте осуществления соединение [2] может быть коммерчески доступным продуктом, таким, как показано ниже, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0177]
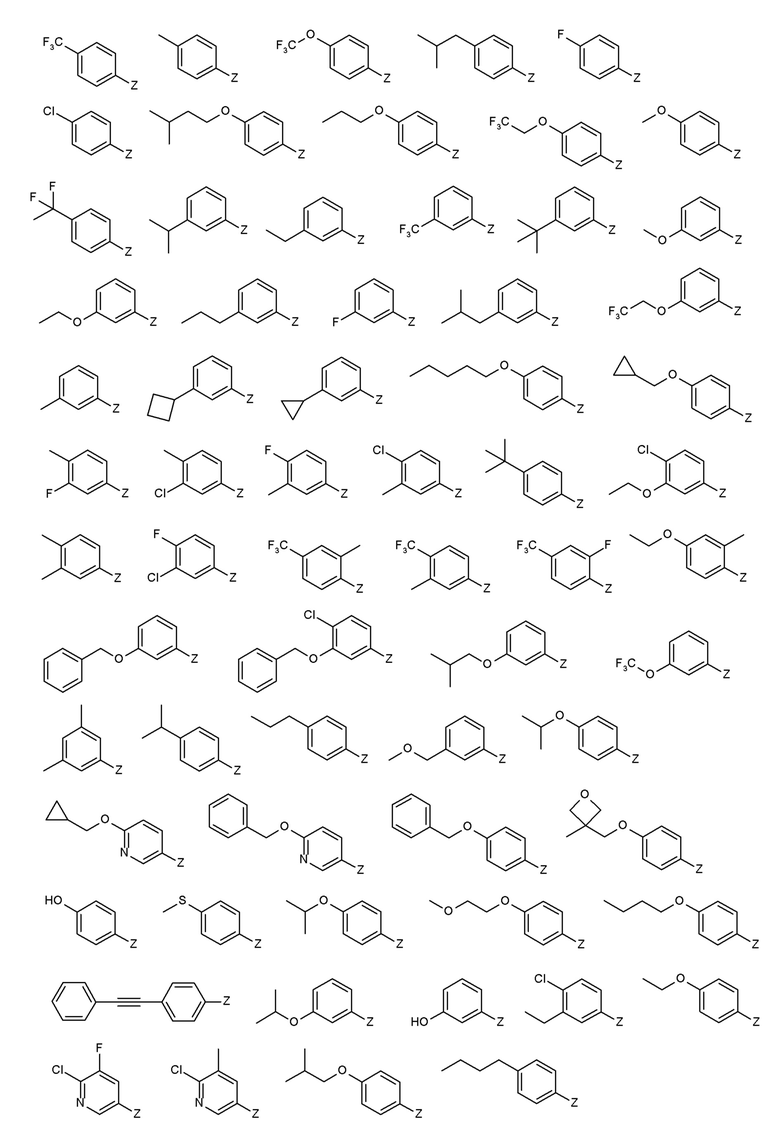
[0178]
где Z является таким, как определено в вышеупомянутом способе получения 1-1.
[0179][Способ получения 1-3]
Соединение [4] может быть получено, например, способом получения 1-3.
[0180][Способ получения 1-3]
[0181]
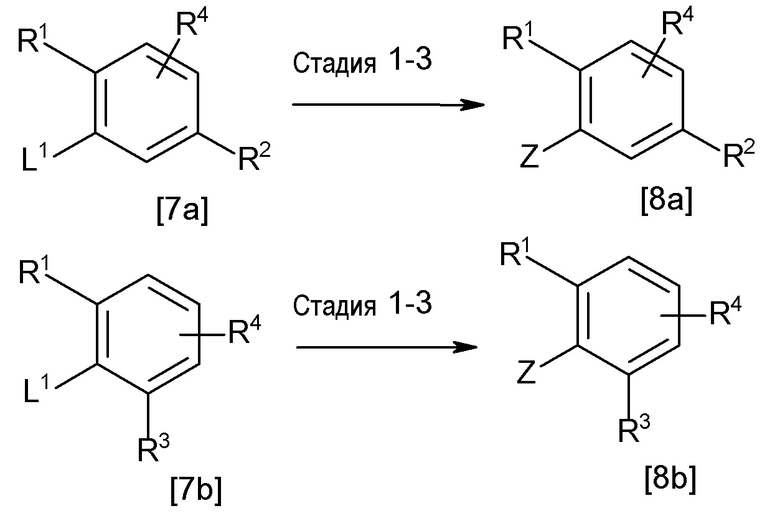
[0182]где R1, R2, R3 и R4 являются такими, как определено в вышеупомянутой формуле [I], L1 является таким, как определено в вышеупомянутом способе получения 1-2, и Z является таким, как определено в вышеупомянутом способе получения 1-1.
[0183]
(Стадия 1-3)
Соединение [4] представляет собой соединение [8a] или [8b]. Соединение [8a] или [8b], а именно, соединение [4], может быть получено борированием соединения [7а] или [7b] таким же образом, как в способе получения 1-2, стадия 1-2.
Соединения [7a] и [7b] могут быть коммерчески доступными продуктами, такими как 2-бром-4-метилбензонитрил и 2-бром-3-метилфенол, или могут быть получены превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0184]
В одном варианте осуществления соединение [4] может быть коммерчески доступным продуктом, таким, как показано ниже, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0185]
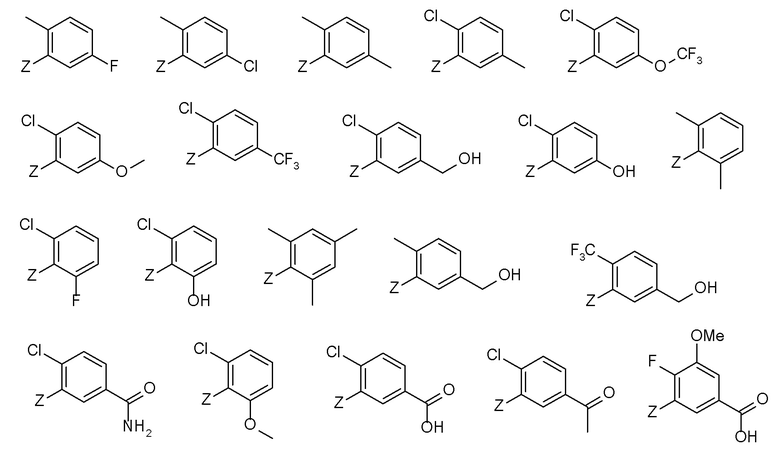
[0186]где Z является таким, как определено в вышеупомянутом способе получения 1-1.
[0187][Способ получения 2-1] или [Способ получения 2-3]
Например, соединение [I-a1], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0188]
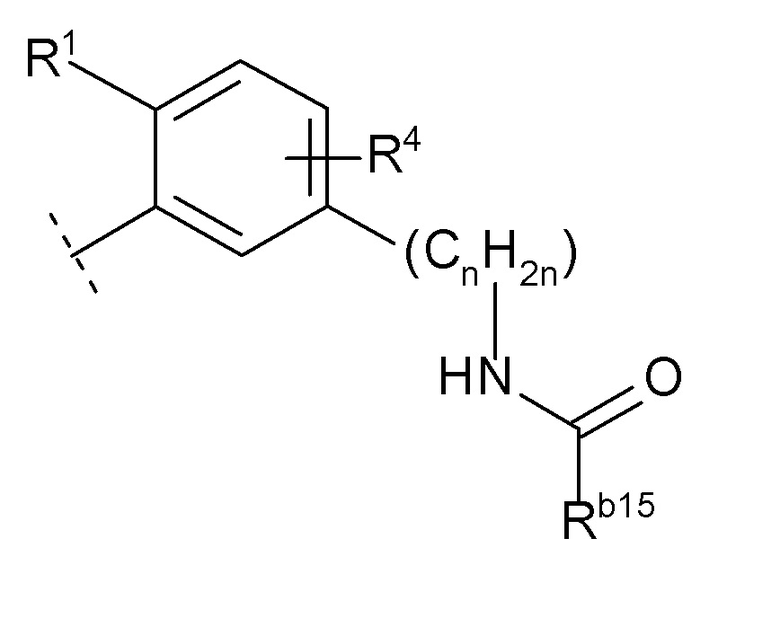
[0189]где R1, R4, Rb15 и n такие, как определено в вышеупомянутой формуле [I], может быть получено соответствующим преобразованием заместителя кольца Cy.
Когда CnH2n представляет собой прямую цепь, способ получения 2-1 является предпочтительным, и когда CnH2n представляет собой разветвленную цепь, способ получения 2-3 является предпочтительным.
[0190][Способ получения 2-1]
[0191]
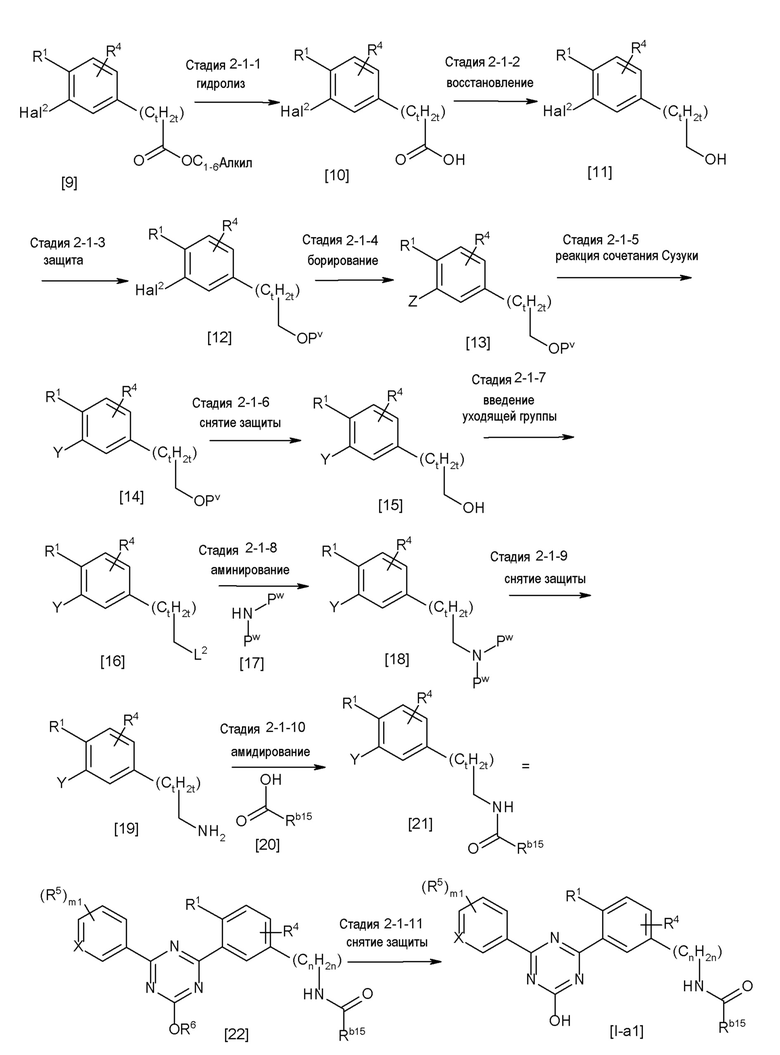
[0192]где Y представляет собой формулу
[0193]
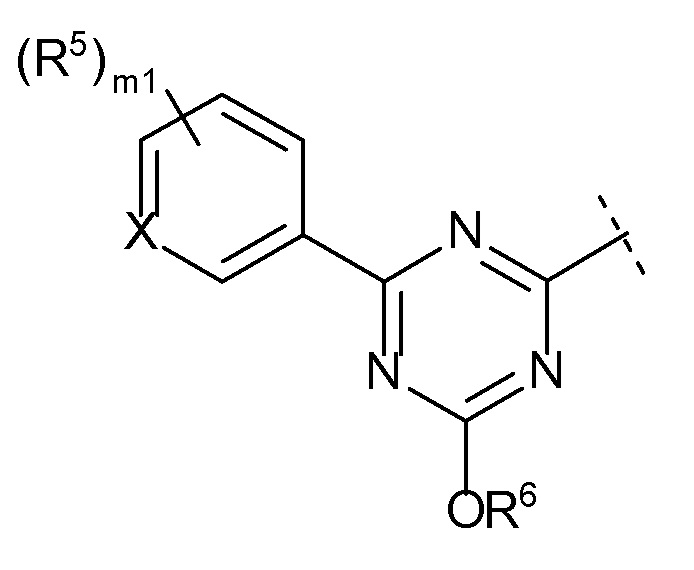
[0194]где R5, R6 и m1 такие, как определено в вышеупомянутой формуле [I];
C1-6 Алкил представляет собой C1-6 алкил;
t равен 0, 1, 2 или 3, -(CtH2t)- может быть прямой или разветвленной цепью;
Hal2 представляет собой бром или иод;
Pv представляет собой гидроксизащитную группу, такую как метоксиметил и тому подобное;
Pw представляет собой аминозащитную группу, такую как трет-бутоксикарбонил и тому подобное;
L2 представляет собой уходящую группу, такую как галоген (например, хлор, бром и тому подобное), метансульфонилокси, п-толуолсульфонилокси и тому подобное;
R1, R4, R6, Rb15 и n такие, как определено в вышеупомянутой формуле [I], и Z является таким, как определено в вышеупомянутом способе получения 1-1.
[0195](Стадия 2-1-1)
Соединение [10] может быть получено превращением сложного эфира соединения [9] в карбоксигруппу гидролизом. Например, соединение [10] может быть получено реакцией соединения [9] в растворителе в присутствии основания при комнатной температуре при нагревании, и нейтрализации полученного раствора.
Примеры основания, которое используют для реакции, включают гидроксид лития, гидроксид натрия, гидроксид калия, метоксид натрия и тому подобное.
Примеры растворителя, который используют для реакции, включают смешанный растворитель из воды и спиртовых растворителей, таких как метанол, этанол, 1-пропанол, 2-пропанол и тому подобное; и смешанный растворитель такого растворителя с растворителями типа простых эфиров, такими как 1,4-диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное.
Соединение [9] может быть коммерчески доступным продуктом, таким, как показано ниже, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0196]
[0197](Стадия 2-1-2)
Соединение [11] может быть получено превращением карбоксигруппы соединения [10] в гидроксильную группу восстановлением. Например, соединение [11] может быть получено взаимодействием соединения [10] с восстановителем в растворителе при охлаждении льдом до комнатной температуры.
Примеры восстановителя, который используют для реакции, включают литийалюминийгидрид, диизобутилалюминийгидрид, натрий бис(2-метоксиэтокси)алюминий, комплекс боран-тетрагидрофуран и тому подобное.
Примеры растворителя, который используют для реакции, включают тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир, толуол, гексан, ксилол и тому подобное, и их смешанный растворитель.
[0198](Стадия 2-1-3)
Соединение [12] может быть получено путем защиты гидроксильной группы соединения [11]. Реакцию защиты можно выполнить с помощью известного способа в соответствии с используемой защитной группой.
Например, когда Pv представляет собой метоксиметил, соединение [12] может быть получено взаимодействием соединения [11] с хлорметилметиловым эфиром в растворителе, таком как тетрагидрофуран, 1,2-диметоксиэтан, циклопентилметиловый эфир, N,N-диметилформамид и тому подобное, в присутствии основания, такого как гидрид натрия и тому подобное, от охлаждения льдом до комнатной температуры.
[0199](Стадия 2-1-4)
Соединение [13] может быть получено борированием соединения [12], таким же образом, как в способе получения 1-2, стадия 1-2.
[0200](Сталия 2-1-5)
Соединение [14] может быть получено реакцией сочетания Сузуки соединения [3] и соединения [13], таким же образом, как в способе получения 1-1, стадия 1-1-2.
[0201](Стадия 2-1-6)
Соединение [15] может быть получено путем удаления группы Pv соединения [14] удалением гидрокси-защитной группы обычным способом. Реакцию удаления защитной группы можно осуществить известным способом, в соответствии с используемой защитной группой.
Например, когда Pv представляет собой метоксиметил, обработку кислотой, такой как хлористоводородная кислота, трифторуксусная кислота, метансульфоновая кислота и тому подобное, только необходимо осуществлять в одном или смешанном растворителе из хлороформа, 1,4-диоксана, тетрагидрофурана, диэтилового эфира, 1,2-диметоксиэтана, циклопентил метилового эфира, этилацетата, этанола, метанола, воды и тому подобное.
Соединение [15] также может быть получено реакцией сочетания Сузуки соединения [3] и соединения [23], представленного формулой
[0202]
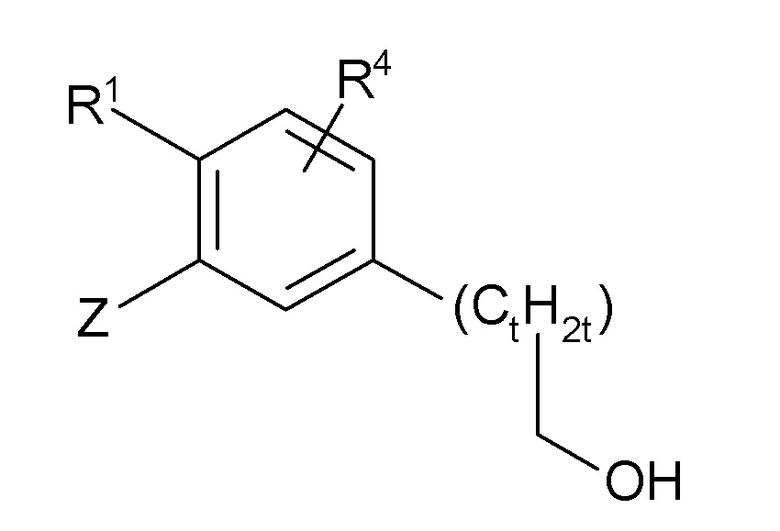
[0203]где R1 и R4 такие, как определено в вышеупомянутой формуле [I], Z является таким, как определено в вышеупомянутом способе получения 1-1, и t является таким, как определено в вышеупомянутом способе получения 2-1,
таким же образом, как в способе получения 1-1, стадия 1-1-2.
[0204](Стадия 2-1-7)
Соединение [16] может быть получено превращением гидроксильной группы соединения [15] в уходящую группу L2. Например, когда L2 представляет собой метансульфонилокси, соединение [16] может быть получено взаимодействием соединения [15] с метансульфонилхлоридом в растворителе в присутствии основания при комнатной температуре. Когда L2 представляет собой бром, соединение [16] может быть получено взаимодействием соединения [15] с четырехбромистым углеродом в растворителе в присутствии трифенилфосфина от охлаждения льдом до комнатной температуры.
Примеры основания, которое используют для реакции, включают триэтиламин, пиридин и тому подобное.
Примеры растворителя, который используют для реакции, включают растворители типа простых эфиров, такие как 1,4-диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное; углеводородные растворители, такие как толуол, гексан, ксилол и тому подобное; галогенированные растворители, такие как дихлорметан, хлороформ и тому подобное; и полярные растворители, такие как N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил и тому подобное.
Можно использовать диметилсульфид вместо указанного выше трифенилфосфина, и N-бромсукцинимид можно использовать вместо указанного выше четырехбромистого углерода.
п-Толуолсульфонилхлорид и бензолсульфонилхлорид можно использовать вместо указанного выше метансульфонилхлорида.
[0205](Стадия 2-1-8)
Соединение [18] может быть получено реакцией соединения [16] в растворителе в присутствии основания при комнатной температуре при нагревании соединения [17]. Примеры защитной группы Pw включают трет-бутоксикарбонил.
Примеры основания, которое используют для реакции, включают неорганические основания, такие как соли щелочных металлов (например, карбонат цезия, фосфат калия, карбонат натрия, карбонат калия и т.д.) и тому подобное.
Примеры растворителя, который используют для реакции, включают полярные растворители, такие как N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил и тому подобное.
[0206](Стадия 2-1-9)
Соединение [19] может быть получено путем удаления группы Pw соединения [18] удалением амино-защитной группы обычным способом. Реакцию удаления защитной группы можно осуществить известным способом, в соответствии с используемой защитной группой.
Например, когда Pw представляет собой трет-бутоксикарбонил, обработку кислотой, такой как хлористоводородная кислота, трифторуксусная кислота, метансульфоновая кислота и тому подобное, только необходимо осуществлять в растворителе.
Примеры растворителя, который используют для реакции, включают растворители типа простых эфиров, такие как 1,4-диоксан, тетрагидрофуран, диэтиловый простой эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное; углеводородные растворители, такие как толуол, гексан, ксилол и тому подобное; галогенированные растворители, такие как дихлорметан, хлороформ и тому подобное; сложноэфирные растворители, такие как этилацетат и тому подобное; и спиртовые растворители, такие как метанол, этанол, 1-пропанол, 2-пропанол и тому подобное.
[0207](Стадия 2-1-10)
Соединение [21] может быть получено путем обычной реакции образования амидной связи, например, путем взаимодействия соединения [19] с соединением [20] в растворителе в присутствии конденсирующего агента и добавки. Основание может быть добавлено по мере необходимости.
Примеры конденсирующего агента, который используют для реакции, включают дициклогексилкарбодиимид (DCC), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (WSC⋅HCl), диизопропилкарбодиимид, 1,1'-карбонилдиимидазол (CDI), гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), гексафторфосфат (бензотриазол-1-илокси)трис(пирролидинo)фосфония (РуВор), дифенилфосфорилазид и тому подобное.
Примеры добавки, которую используют для реакции, включают 1-гидроксибензотриазол (HOBt), 1-гидрокси-7-азабензотриазол (HOAt), N-гидроксисукцинимид (HOSu), 4-диметиламинопиридин и тому подобное.
Примеры основания, используемого для реакции, включают органические основания, такие как пиридин, триэтиламин и тому подобное.
Примеры растворителя, который используют для реакции, включают растворители типа простых эфиров, такие как 1,4-диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное; углеводородные растворители, такие как толуол, гексан, ксилол и тому подобное; галогенированные растворители, такие как дихлорметан, хлороформ и тому подобное; и полярные растворители, такие как N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил, пиридин и тому подобное. Они могут использоваться по отдельности или в виде смеси двух или более их видов.
Соединение [20] может быть коммерчески доступным продуктом, таким, как циклопентанкарбоновая кислота и 1-(трифторметил)циклопропан-1-карбоновая кислота, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0208](Стадия 2-1-11)
Соединение [21] может быть указано как соединение [22]. Соединение [I-a1] может быть получено путем превращения алкоксигруппы соединения [22] в гидроксигруппу путем гидролиза, таким же образом, как в способе получения 1-1, стадия 1-1-3.
[0209][Способ получения 2-2]
Соединение [10a], которое представляет собой соединение [10], где R1 представляет собой C1-6 алкил или хлор может быть получено [Способом получения 2-2].
[0210][Способ получения 2-2]
[0211]
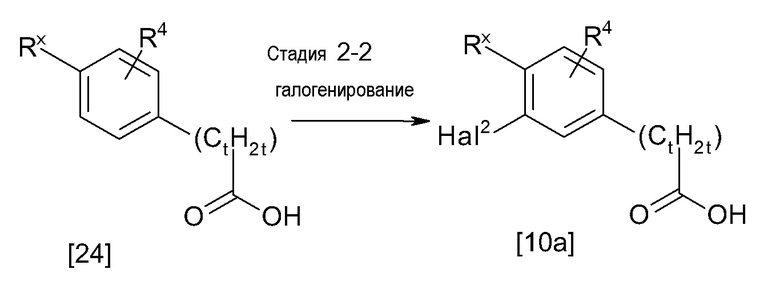
[0212]где Rx представляет собой C1-6 алкил или хлор;
R4 является таким, как определено в вышеупомянутой формуле [I], и Hal2 и t являются такими, как определено в вышеупомянутом способе получения 2-1.
[0213](Стадия 2-2)
Соединение [10a] может быть получено галогенированием соединения [24]. Например, когда Hal2 представляет собой йод, соединение [10a] может быть получено взаимодействием соединения [24] с N-иодсукцинимидом в кислоте при комнатной температуре.
Примеры кислоты, которую используют для реакции, включают концентрированную серную кислоту и тому подобное.
Соединение [24] может быть коммерчески доступным продуктом, таким, как 4-хлорфенилуксусная кислота, 3-(4-хлорфенил)пропионовая кислота, 4-(4-хлорфенил)бутановая кислота, 4-метилфенилуксусная кислота и 2-(4-метилфенил)пропионовая кислота, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0214][Способ получения 2-3]
[0215]
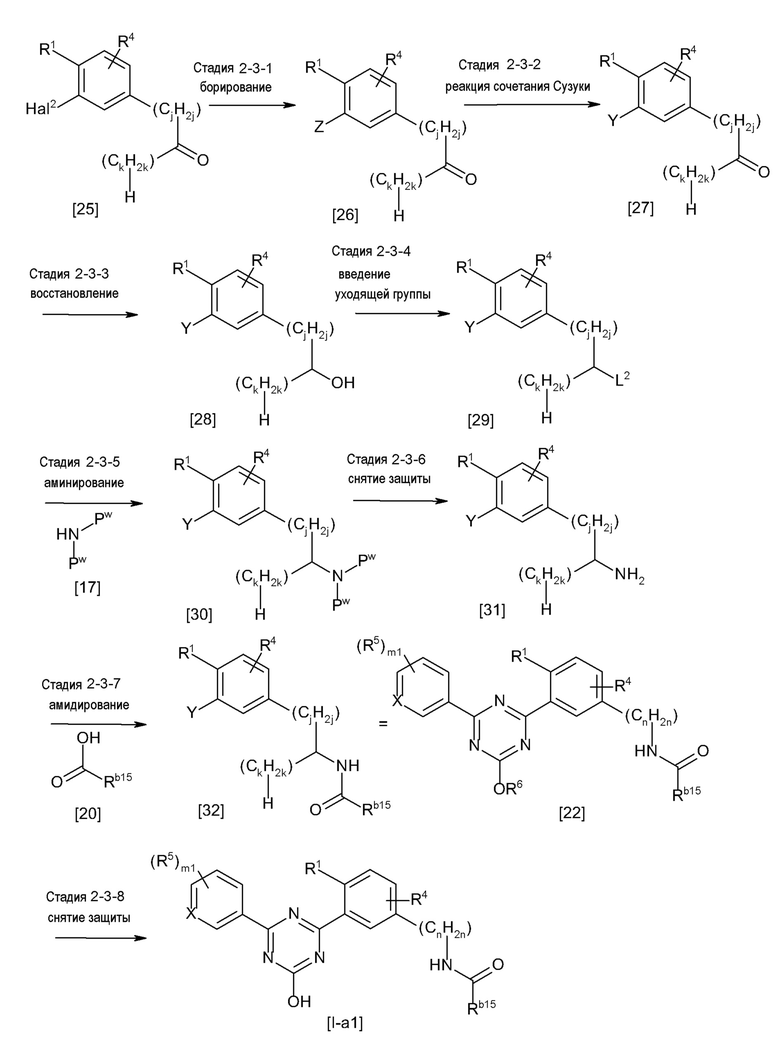
[0216]где j и k равны каждый 0, 1, 2 или 3, j+k=n-1;
R1, R4, R5, Rb15 и n такие, как определено в вышеупомянутой формуле [I],
Z является таким, как определено в вышеупомянутом способе получения 1-1, и
Hal2, Y, Pw и L2 являются такими, как определено в вышеупомянутом способе получения 2-1.
[0217](Стадия 2-3-1)
Соединение [26] может быть получено борированием соединения [25] таким же образом, как в способе получения 1-2, стадия 1-2.
Соединение [25] может быть коммерчески доступным продуктом, таким, как 1-(3-бром-4-хлорфенил)пропан-1-он и 1-(3-бром-4-хлорфенил)бутан-1-он, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0218](Стадия 2-3-2)
Соединение [27] может быть получено реакцией сочетания Сузуки соединения [3] и соединения [26] таким же образом, как в способе получения 1-1, стадия 1-1-2.
[0219](Стадия 2-3-3)
Соединение [28] может быть получено путем превращения карбоксигруппы соединения [27] в гидроксигруппу путем восстановления. Например, соединение [28] может быть получено взаимодействием соединения [27] с восстанавливающим агентом в растворителе при охлаждении льдом до комнатной температуры.
Примеры восстанавливающего агента, который используют для реакции, включают боргидрид натрия и тому подобное.
Примеры растворителя, который используют для реакции, включают метанол, этанол, 2-пропанол, 1,4-диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное.
[0220](Стадия 2-3-4)
Соединение [29] может быть получено превращением гидроксильной группы соединения [28] в уходящую группу L2, таким же образом, как в способе получения 2-1, стадия 2-1-7.
[0221](Стадия 2-3-5)
Соединение [30] может быть получено взаимодействием соединения [29] с соединением [17], таким же образом, как в способе получения 2-1, стадия 2-1-8.
[0222](Стадия 2-3-6)
Соединение [31] может быть получено путем удаления группы Pv соединения [30] таким же образом, как в способе получения 2-1, стадия 2-1-9.
[0223](Стадия 2-3-7)
Соединение [32] может быть получено взаимодействием соединения [31] с соединением [20] таким же образом, как в способе получения 2-1, стадия 2-1-10.
[0224](Стадия 2-3-8)
Соединение [32] может быть указано как соединение [22]. Соединение [I-a1] может быть получено превращением алкоксигруппы соединения [22] в гидроксигруппу путем гидролиза, таким же образом, как в способе получения 1-1, стадия 1-1-3.
[0225]
В способе получения 2-1, соединение [I-a2], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0226]
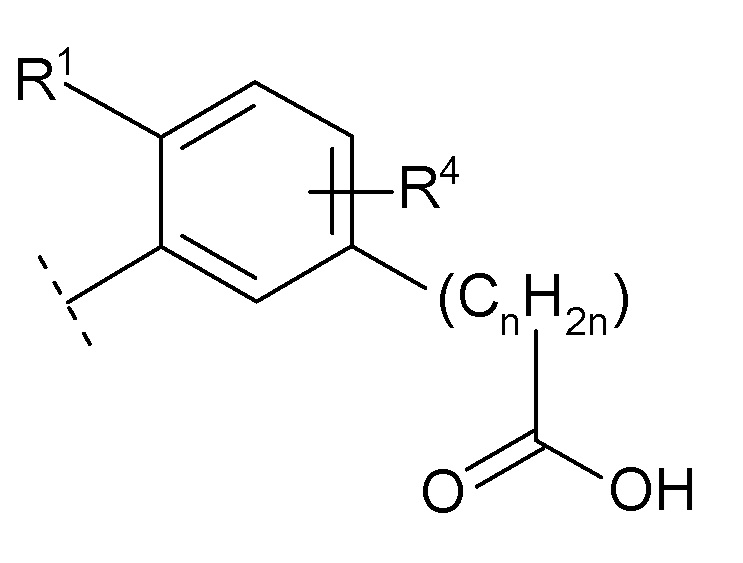
[0227]где R1, R4 и n такие, как определено в вышеупомянутой формуле [I], можно получить, подвергая соединение [9] реакциям стадии 2-1-4, стадии 2-1-5 и стадии 2-1-11.
[0228]
В способе получения 2-1, реакцию образования амидной связи осуществляют с использованием соединения [10] и HNRb1Rb2, такого как диметиламин, трет-бутиламин и тому подобное, и таким же образом, как на стадии 2-1-10. После этого полученный продукт подвергают реакциям стадии 2-1-4, стадии 2-1-5 и стадии 2-1-11, в результате чего соединение [I-a3], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0229]
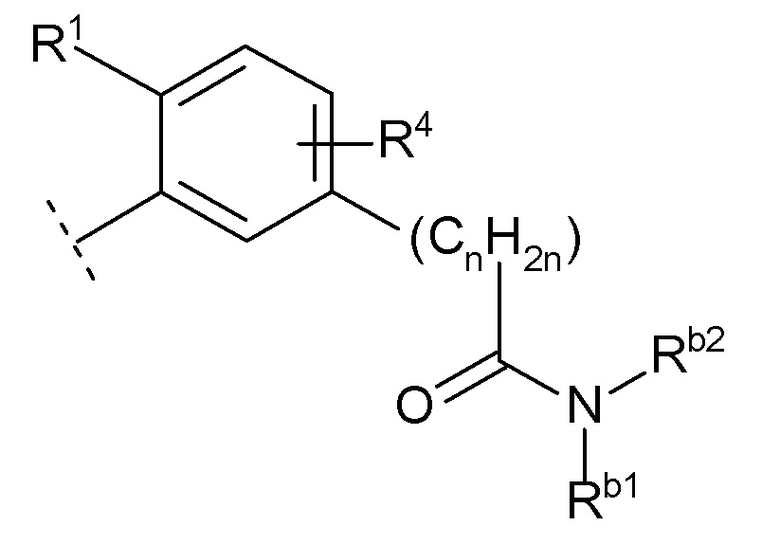
[0230]где R1, R4, Rb1, Rb2 и n такие, как определено в вышеупомянутой формуле [I], может быть получено.
[0231]
В способе получения 2-1, соединение [I-a4], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0232]
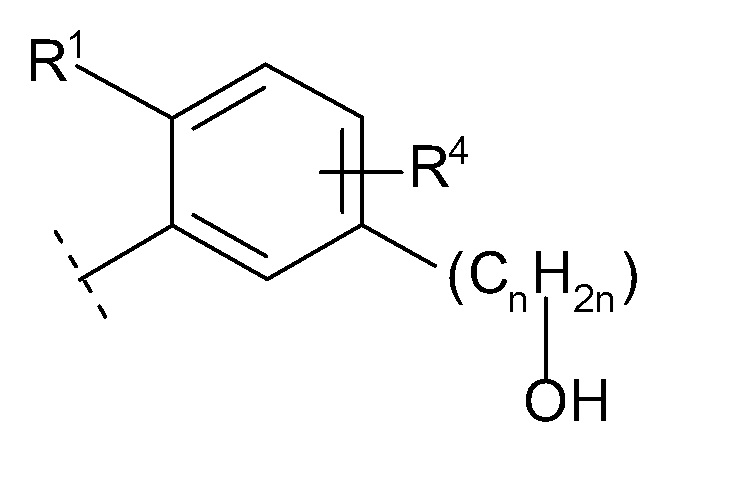
[0233]где R1, R4 и n такие, как определено в вышеупомянутой формуле [I], можно получить, подвергая соединение [15] реакции стадии 2-1-11.
[0234]
В способе получения 2-1, реакцию на стадии 2-1-11 осуществляли с использованием соединения [15]. После этого полученный продукт подвергали взаимодействию с ангидридом C1-6 алкил-карбоновой кислоты, таким как уксусный ангидрид, пропионовый ангидрид и тому подобное, в результате чего соединение [I-a5], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0235]
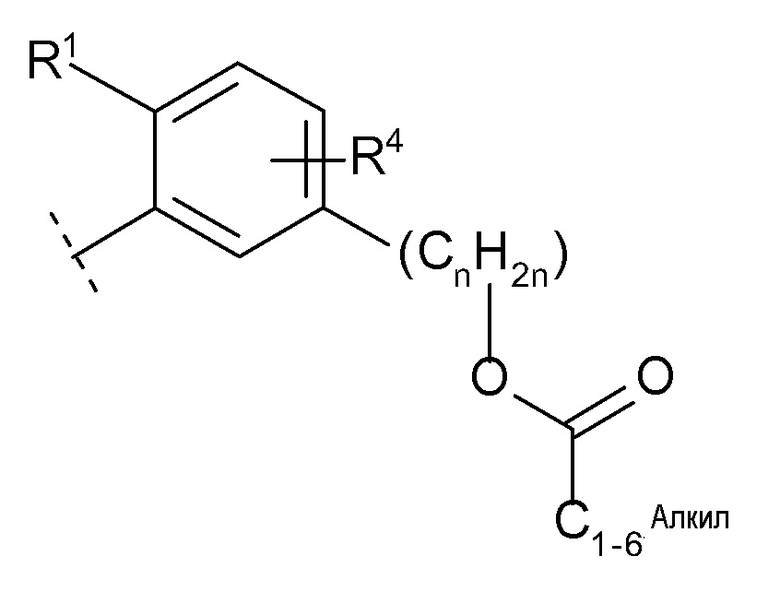
[0236]где R1, R4 и n являются такими, как определено в вышеупомянутой формуле [I] и C1-6 алкил является таким, как определено в вышеупомянутом способе получения 2-1, может быть получено.
[0237]
В способе получения 2-1, соединение [15] взаимодействует с ClC(O)NRb3Rb4, таким как диметилкарбамоилхлорид, диэтилкарбамоилхлорид и тому подобное в присутствии основания. После этого полученный продукт подвергают реакции стадии 2-1-11, в результате чего соединение [I-a6], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0238]
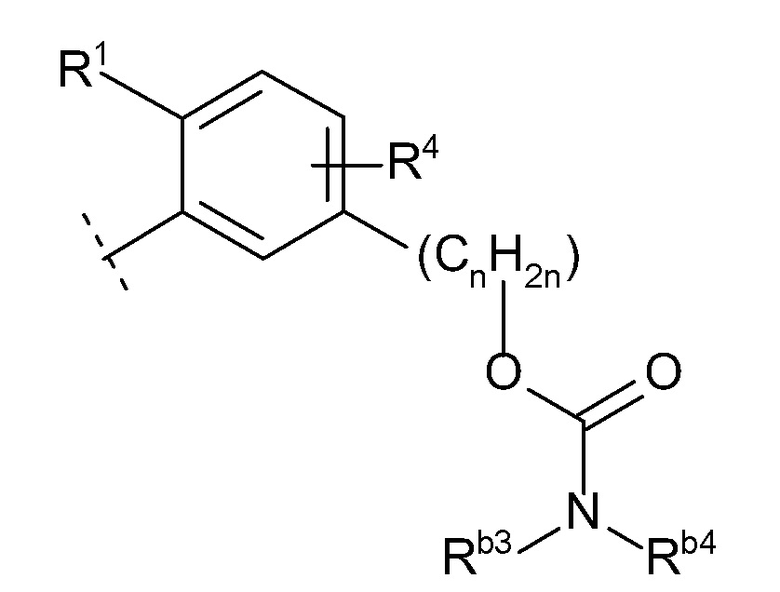
[0239]где R1, R4, Rb3, Rb4 и n такие, как определено в вышеуказанной формуле [I], может быть получено.
[0240]
В способе получения 2-1, соединение [15] подвергают реакции алкилирования с помощью гидрида натрия и C1-6 алкилгалогенида. После этого полученный продукт подвергают реакции стадии 2-1-11, в результате чего соединение [I-a7], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0241]
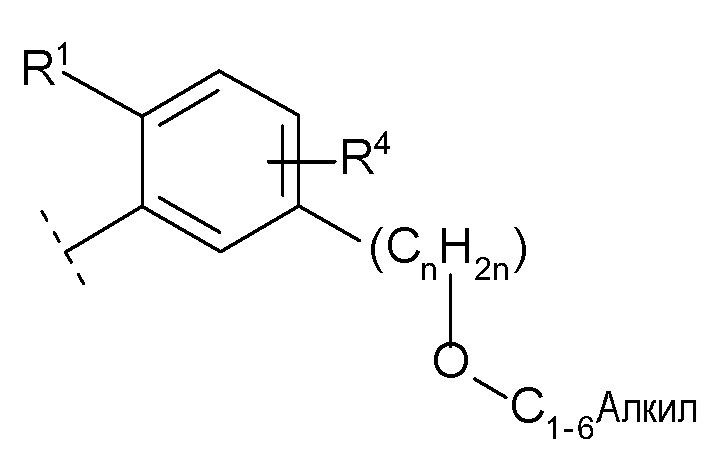
[0242]где R1, R4 и n являются такими, как определено в вышеупомянутой формуле [I] и C1-6 алкил является таким, как определено в вышеупомянутом способе получения 2-1, может быть получено.
[0243]
В способе получения 2-1, соединение [16] подвергают реакции аминирования с использованием HNRb8Rb9, такого как диметиламин, диэтиламин и тому подобное. После этого полученный продукт подвергают реакции стадии 2-1-11, в результате чего соединение [I-a8], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0244]
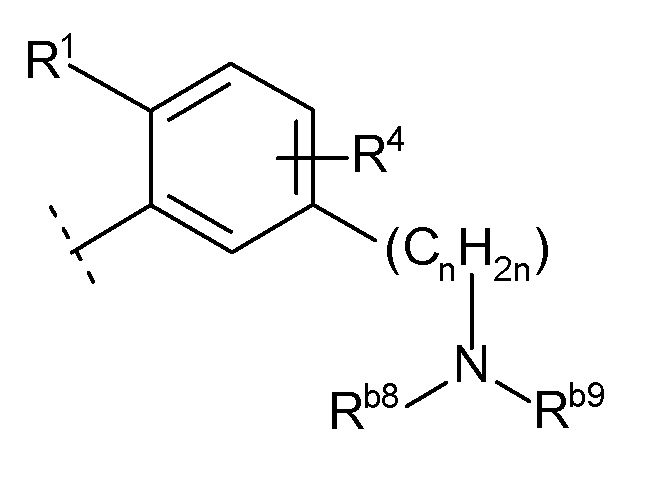
[0245]где R1, R4, Rb8, Rb9 и n такие, как определено в вышеуказанной формуле [I], может быть получено.
[0246]
В способе получения 2-1, соединение [16] вступает в реакцию с помощью гидрида натрия и HNRb14C(O)Rb15, такого как N-метилацетамид, 2-пирролидинон и тому подобное. После этого полученный продукт подвергают реакции стадии 2-1-11, в результате чего соединение [I-a9], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0247]
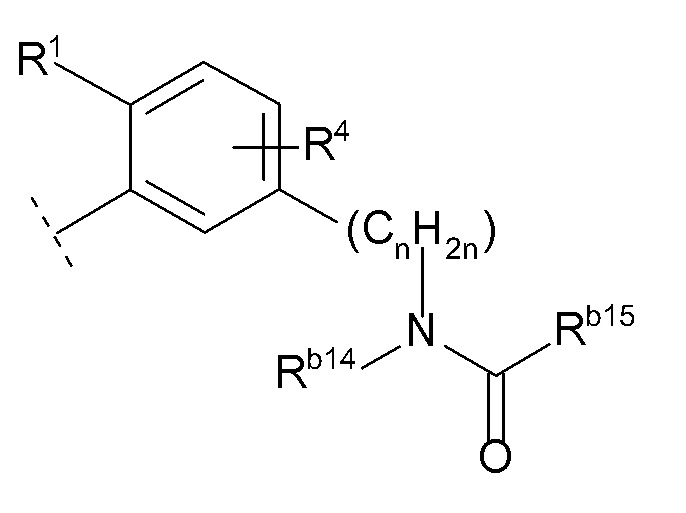
[0248]где R1, R4, Rb14, Rb15 и n такие, как определено в вышеуказанной формуле [I], может быть получено.
[0249]
В способе получения 2-1, соединение [16] вступает в реакцию с помощью гидрида натрия и соединения [33], представленного формулой
[0250]
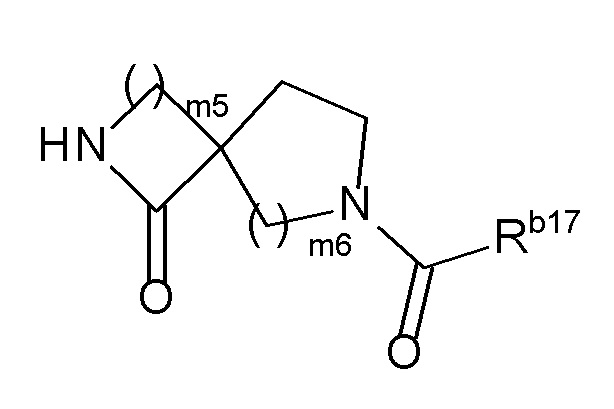
[0251]где Rb17, m5 и m6 такие, как определено в вышеуказанной формуле [I]. После этого полученный продукт подвергают реакции стадии 2-1-11, в результате чего соединение [I-a10], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0252]
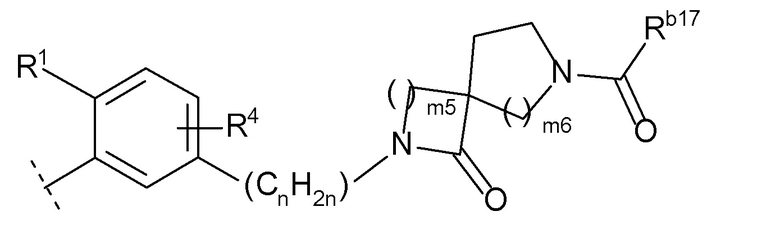
[0253]где R1, R4, Rb17, n, m5 и m6 такие, как определено в вышеуказанной формуле [I], может быть получено.
[0254]
В способе получения 2-1, соединение [19] взаимодействует с ClC(O)NRb6Rb7, таким как диметилкарбамоилхлорид, диэтилкарбамоилхлорид и тому подобное в присутствии основания. После этого полученный продукт подвергают реакции стадии 2-1-11, в результате чего соединение [I-a11], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0255]
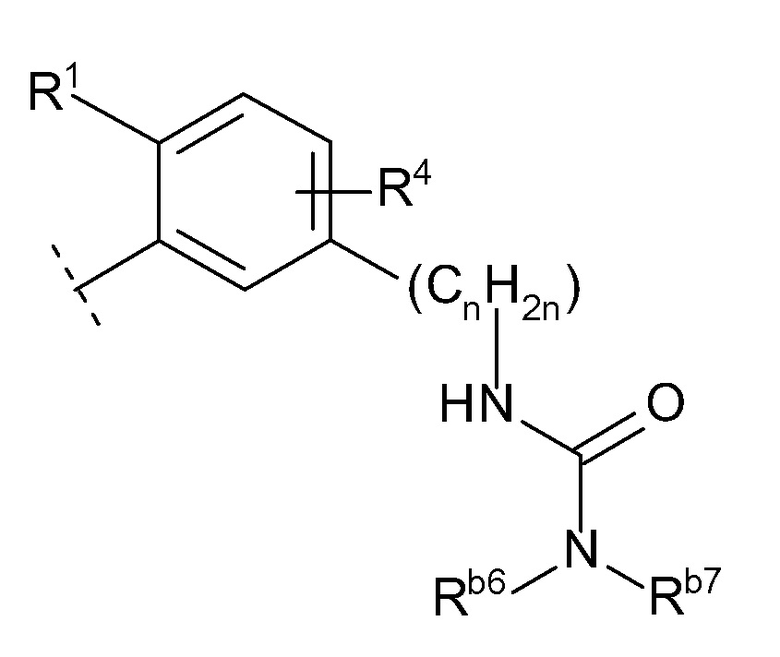
[0256]где R1, R4, Rb6, Rb7 и n такие, как определено в вышеуказанной формуле [I], может быть получено.
[0257]
В способе получения 2-1, соединение [19] взаимодействует с Rb11S(O)2Cl, такие как метансульфонилхлорид и тому подобное, в присутствии основания. После этого полученный продукт подвергают реакции стадии 2-1-11, в результате чего соединение [I-a12], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0258]
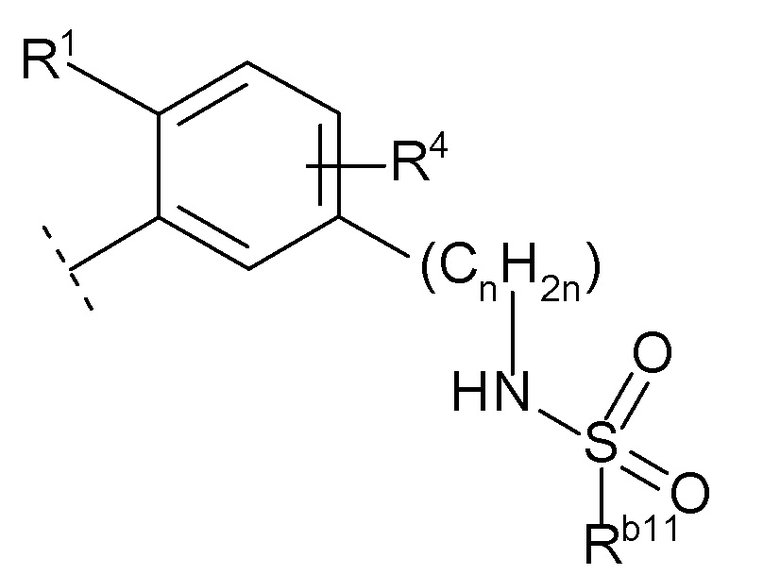
[0259]где R1, R4, Rb11 и n такие, как определено в вышеуказанной формуле [I], может быть получено.
[0260]
В способе получения 2-1, соединение [19] взаимодействует с Rb13OC(O)Cl, таким как этилхлорформиат и тому подобное, в присутствии основания. После этого полученный продукт подвергают реакции стадии 2-1-11, в результате чего соединение [I-a13], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0261]
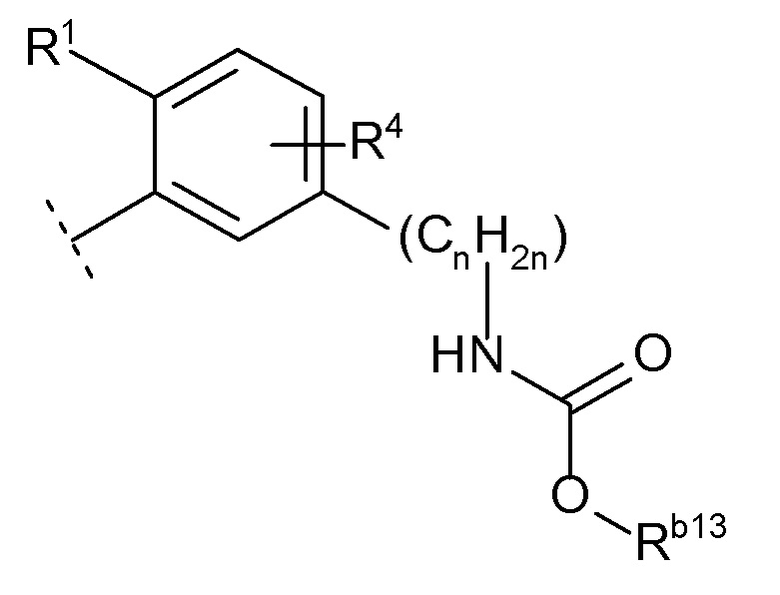
[0262]где R1, R4, Rb13 и n такие, как определено в вышеуказанной формуле [I], может быть получено.
[0263]
В способе получения 2-3, соединение [I-a14], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0264]
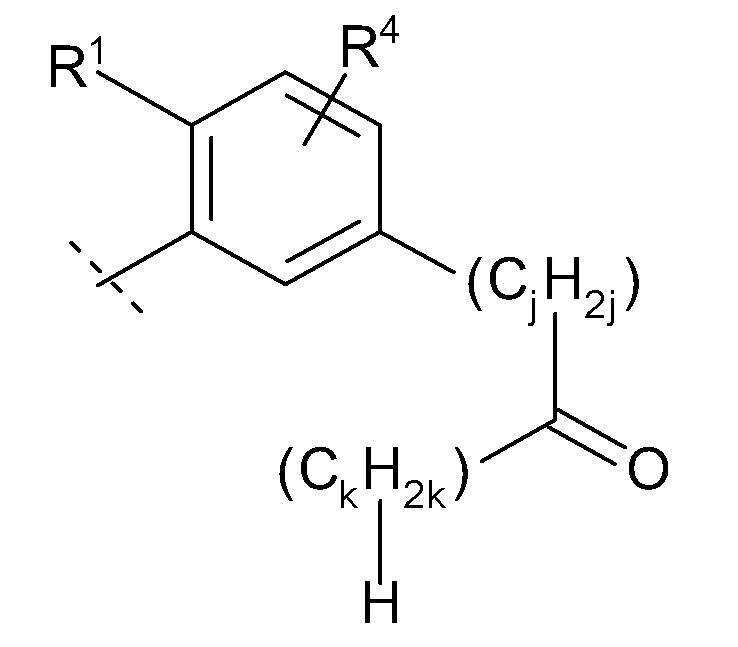
[0265]где R1 и R4 такие, как определено в вышеупомянутой формуле [I], j и k такие, как определено в вышеупомянутом способе получения 2-2, можно получить, подвергая соединение [27] реакции стадии 2-3-8.
[0266]
Способом получения 2-4, соединение [I-a15], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0267]
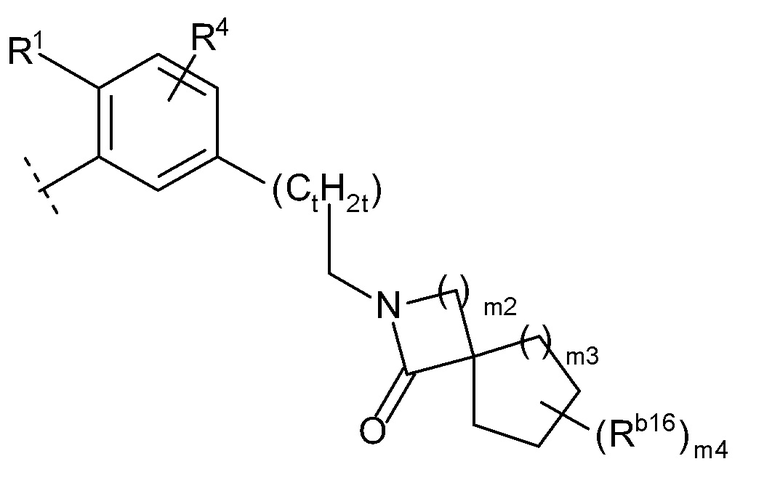
[0268]где R1, R4, Rb16, m2, m3 и m4 такие, как определено в вышеупомянутом способе получения 2-1, может быть получено.
[0269][Способ получения 2-4]
[0270]
[0271]где R1, R4, Rb16, m2, m3 и m4 такие, как определено в вышеупомянутой формуле [I] и C1-6 алкил, L2, Pv, t и Y такие, как определено в вышеупомянутом способе получения 2-1.
[0272](Стадия 2-4-1)
Соединение [36] может быть получено взаимодействием соединения [34] с соединением [35] в растворителе в присутствии основания.
Примеры основания, которое используют для реакции, включают, диизопропиламид лития, бис(триметилсилил)амид лития и аналогичные основания.
Примеры растворителя, который используют для реакции, включают растворители типа простых эфиров, такие как тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное; углеводородные растворители, такие как толуол, гексан, ксилол и тому подобное, и их смешанный растворитель.
Соединение [35] может быть коммерчески доступным продуктом, таким, как бензилхлорметиловый эфир, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0273](Стадия 2-4-2)
Соединение [37] может быть получено путем удаления группы Pv соединения [36] таким же образом, как в способе получения 2-1, стадия 2-1-6.
[0274](Стадия 2-4-3)
Соединение [38] может быть получено путем превращения сложного эфира соединения [37] в карбоксигруппу путем гидролиза, таким же образом, как в способе получения 2-1, стадия 2-1-1.
[0275](Стадия 2-4-4)
Соединение [39] может быть получено взаимодействием соединения [38] с соединением [19] в растворителе в присутствии конденсирующего средства и добавки, таким же образом, как в способе получения 2-1, стадия 2-1-10.
[0276](Стадия 2-4-5)
Соединение [40] может быть получено путем циклизации соединения [39] при помощи внутримолекулярной реакции Мицунобу. Например, соединение [40] может быть получено взаимодействием соединения [39] с диэфиром азодикарбоновой кислоты (например, диэтилазодикарбоксилатом, диизопропилазодикарбоксилатом, бис(2-метоксиэтил)азодикарбоксилатом и тому подобное) в растворителе в присутствии фосфина, такого как трифенилфосфин, трибутилфосфин и тому подобное.
Примеры растворителя, который используют для реакции, включают дихлорметан, хлороформ, 1,4-диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир, толуол, N,N-диметилформамид и тому подобное. Растворители можно использовать по отдельности или в виде смеси двух или более их видов.
[0277][Способ получения 3-1]
Другой способ преобразования соответствующего заместителя кольца Cy представляет собой, например, способ получения 3-1 для получения соединения [I-b1], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0278]
[0279]где R1, R4 и Rc такие, как определено в вышеупомянутой формуле [I].
[Способ получения 3-1]
Step 3-1-6
deprotection
[0280]
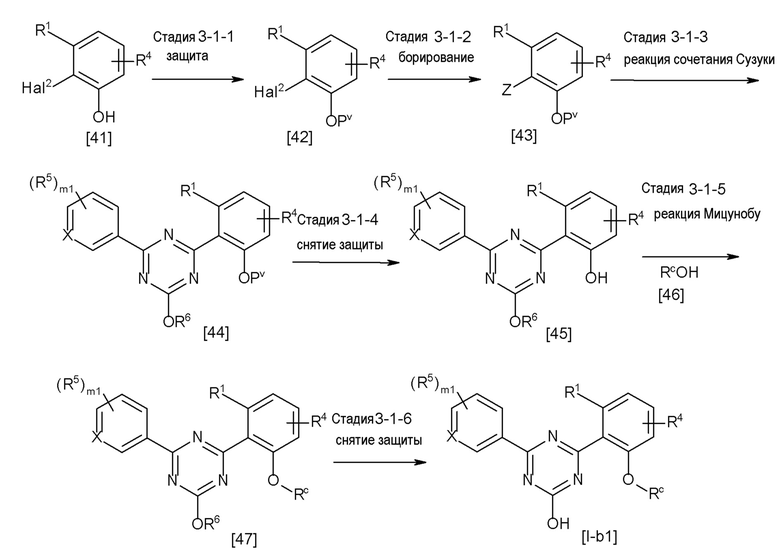
[0281]где R1, R4, R5, Rc, m1 и X являются такими, как определено в вышеупомянутой формуле [I], Z является таким, как определено в вышеупомянутом способе получения 1-1, и Hal2 и Pv такие, как определено в вышеупомянутом способе получения 2-1.
[0282](Стадия 3-1-1)
Соединение [42] может быть получено путем защиты гидроксильной группы соединения [41], таким же образом, как в способе получения 2-1, стадия 2-1-3.
Соединение [41] может быть коммерчески доступным продуктом, таким, как 2-бром-3-метилфенол, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0283](Стадия 3-1-2)
Соединение [43] может быть получено борированием соединения [42], таким же образом, как в способе получения 1-3, стадия 1-3.
[0284](Стадия 3-1-3)
Соединение [44] может быть получено реакцией сочетания Сузуки соединения [3] и соединения [43], таким же образом, как в способе получения 1-1, стадия 1-1-2.
[0285](Стадия 3-1-4)
Соединение [45] может быть получено путем удаления группы Pv соединения [44], таким же образом, как в способе получения 2-1, стадия 2-1-6.
[0286](Стадия 3-1-5)
Соединение [47] может быть получено с помощью реакции Мицунобу соединения [45] и соединения [46]. Например, соединение [47] может быть получено взаимодействием соединения [45] с соединением [46] в растворителе в присутствии диэфира азодикарбоновой кислоты (например, диэтилазодикарбоксилата, диизопропилазодикарбоксилата, бис(2-метоксиэтил) азодикарбоксилата и тому подобное) и фосфина, такого, как трифенилфосфин, трибутилфосфин и тому подобное.
Примеры растворителя, который используют для реакции, включают дихлорметан, хлороформ, 1,4-диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир, толуол, N,N-диметилформамид и тому подобное. Они могут быть использованы по отдельности или в виде смеси двух или более их видов.
Соединение [46] может быть коммерчески доступным продуктом, таким, как бензиловый спирт, 2-пиридинметанол и тому подобное, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0287](Стадия 3-1-6)
Соединение [I-b1] может быть получено путем превращения алкоксигруппы соединения [47] в гидроксигруппу путем гидролиза, таким же образом, как в способе получения 1-1, стадия 1-1-3.
[0288]
В способе получения 3-1, например, соединение [I-b2], которое представляет собой соединение, представленное формулой [I], где кольцо Cy представляет собой формулу
[0289]
[0290]где R1 и R4 такие, как определено в вышеуказанной формуле [I], можно получить, подвергая соединение [45] реакции стадии 3-1-6.
[0291][Способ получения 3-2]
Соединение [43a], которое представляет собой соединение [43], где R1 представляет собой хлор или трифторметил, также может быть получено [Способом получения 3-2].
[0292][Способ получения 3-2]
[0293]
[0294]где Ry представляет собой хлор или трифторметил;
R4 является таким, как определено в вышеупомянутой формуле [I], Z является таким, как определено в вышеупомянутом способе получения 1-1, и Pv является таким, как определено в вышеупомянутом способе получения 2-1.
[0295](Стадия 3-2-1)
Соединение [49] может быть получено путем защиты гидроксильной группы соединения [48], таким же образом, как в способе получения 2-1, стадия 2-1-3.
В одном варианте осуществления соединение [48] может быть коммерчески доступным продуктом, таким, как показано ниже, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0296]
[0297](Стадия 3-2-2)
Соединение [43a] может быть получено взаимодействием соединения [49] с соединением бора в растворителе в присутствии основания. Например, соединение [43a] может быть получено добавлением основания к соединению [49] в растворителе при температуре -78°C до комнатной температуры, и взаимодействием полученного продукта с борсодержащим реагентом при температуре -78°C до комнатной температуры.
Примеры основания, которое используют для реакции, включают н-бутиллитий, втор-бутиллитий и тому подобное.
Примеры борсодержашего реагента, который используют для реакции, включают 2-изопропокси-4,4,5,5-триметил-1,3,2-диоксаборолан, триметилборат и тому подобное.
Примеры растворителя, который используют для реакции, включают тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное.
[0298][Способ получения 4]
Например, соединение [I-c1] формулы
[0299]
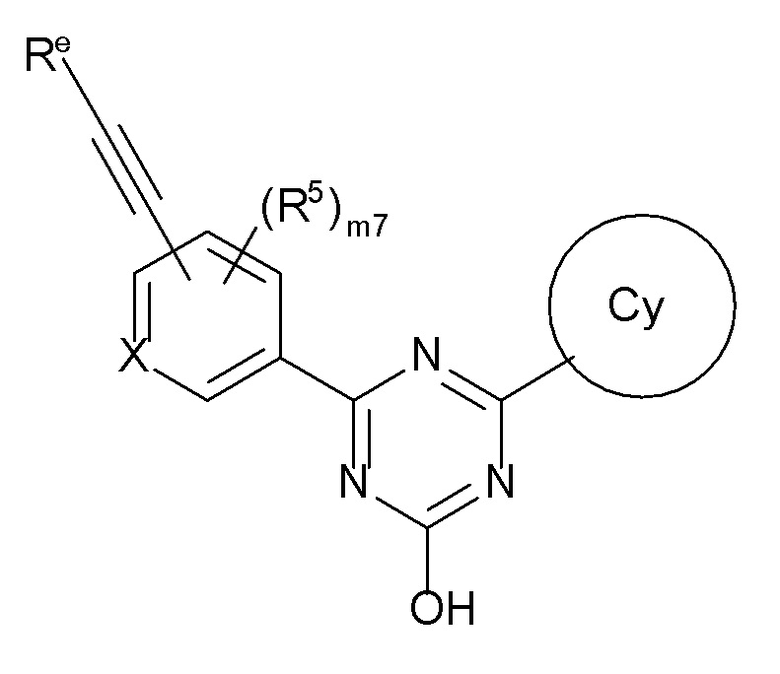
[0300]где R5, Re, X и Cy такие, как определено в вышеуказанной формуле [I], m7 равен 0, 1 или 2, и когда m7 равен 2, каждый R5 выбран независимо друг от друга, может быть получено соответствующим преобразованием заместителя соединения [2].
[Способ получения 4]
[0301]
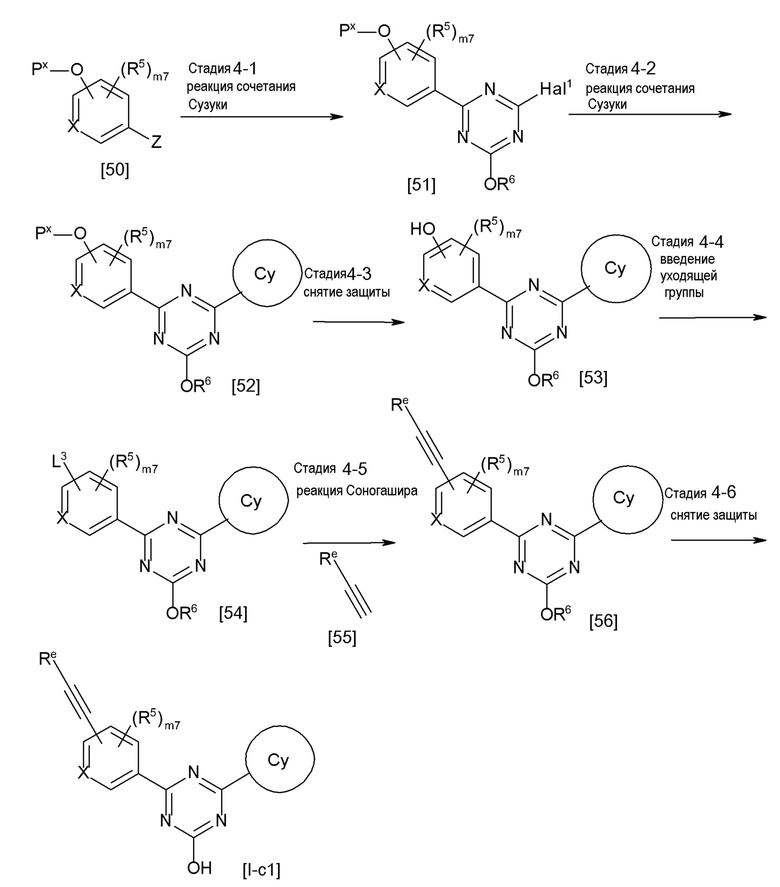
[0302]где L3 представляет собой уходящую группу, такую как трифторметансульфонилокси и тому подобное;
Px представляет собой гидроксизащитную группу, такую как бензил и тому подобное;
R5, R6, Re, X и Cy такие, как определено в вышеупомянутой формуле [I], Hal1 и Z такие, как определено в вышеупомянутом способе получения 1-1, и m7 является таким, как определено в вышеупомянутой формуле [I-A].
[0303](Step 4-1)
Соединение [51] может быть получено реакцией сочетания Сузуки соединения [1] и соединения [50], таким же образом, как в способе получения 1-1, стадия 1-1-1.
Соединение [50] может быть коммерчески доступным продуктом, таким, как 4-(бензилокси)фенилбороновая кислота, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
[0304](Стадия 4-2)
Соединение [52] может быть получено реакцией сочетания Сузуки соединения [4] и соединения [51], таким же образом, как в способе получения 1-1, стадия 1-1-2.
[0305](Стадия 4-3)
Соединение [53] может быть получено путем удаления защитной группы фенола PX соединения [52]. Удаление защитной группы может быть осуществлено известным способом, в соответствии с используемой защитной группой.
Например, когда PX представляет собой бензил, соединение [52] необходимо только подвергнуть реакции гидрирования в одном растворителе или смешанном растворителе, из тетрагидрофурана, этилацетата, этанола, метанола, воды и тому подобное, в присутствии катализатора, такого как палладий на угле, платиново-углеродный катализатор и тому подобное.
[0306](Стадия 4-4)
Соединение [54] может быть получено путем преобразования гидроксигруппы в уходящую группу L3. Например, когда уходящая группа представляет собой трифторметансульфонилокси, соединение [54] может быть получено взаимодействием соединения [53] с ангидридом трифторметансульфоновой кислоты, N-фенил-бис(трифторметансульфонимид) и тому подобное, в растворителе в присутствии основания, от охлаждения льдом до комнатной температуры.
Примеры основания, которое используют для реакции, включают органические основания, такие как пиридин, 2,6-лутидин, триэтиламин и тому подобное; неорганические основания, такие как соли щелочных металлов (например, карбонат цезия, гидрид натрия и тому подобное) и тому подобное.
Примеры растворителя, который используют для реакции, включают растворители типа простых эфиров, такие как 1,4-диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное; углеводородные растворители, такие как толуол, гексан, ксилол и тому подобное; галогенированные растворители, такие как дихлорметан, хлороформ и тому подобное; полярные растворители, такие как N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил, пиридин и тому подобное, и тому подобное. Они могут использоваться по отдельности или в виде смеси двух или более их видов.
[0307](Стадия 4-5)
Соединение [56] может быть получено реакцией Соногашира соединения [54] и соединения [55]. Например, соединение [56] может быть получиено взаимодействием соединения [54] с соединением [55] в растворителе, предпочтительно, при нагревании в присутствии основания, палладиевого катализатора и медного катализатора.
Примеры палладиевого катализатора, который используют для реакции, включают ацетат палладия, тетракистрифенилфосфинпалладий, бис(трифенилфосфин)палладий дихлорид, комплекс (бис(дифенилфосфино)ферроцен)палладий дихлорид-метиленхлорид и тому подобное.
Примеры медного катализатора, который используют для реакции, включают иодид меди, бромид меди и тому подобное.
Примеры основания, которое используют для реакции, включают диэтиламин, дициклогексиламин, триэтиламин, N-этилдиизопропиламин и тому подобное.
Примеры растворителя, который используют для реакции, включают растворители типа простых эфиров, такие как 1,4-диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное; углеводородные растворители, такие как толуол, гексан, ксилол и тому подобное; и полярные растворители, такие как N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил, пиридин и тому подобное, и тому подобное. Они могут использоваться по отдельности или в виде смеси двух или более их видов.
Соединение [55] может быть коммерчески доступным продуктом, таким, как циклогексилацетилен, 2-этинилпиридин и тому подобное, или может быть получено превращением коммерчески доступного продукта, при необходимости, способом, хорошо известным специалистам в данной области.
Что касается реакции сочетания Соногашира, например, известна следующая обзорная статья (NAJERA, C et al. The Sonogashira Reaction: A Booming Methodology in Synthetic Organic Chemistry. Chem Rev. 2007, Vol.107, pages 874-922.).
[0308](Стадия 4-6)
Соединение [I-c1] может быть получено путем превращения алкоксигруппы соединения [56] в гидроксигруппу гидролизом, таким же образом, как в способе получения 1-1, стадия 1-1-3.
[0309]
В способе получения 4, соединение [I-c2] формулы
[0310]
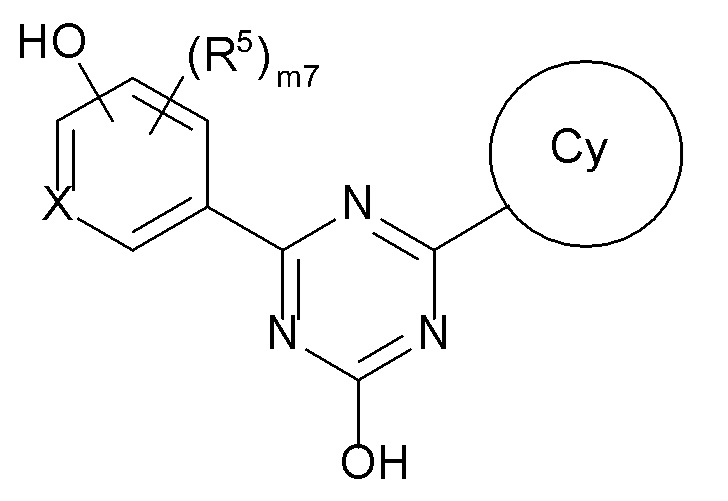
[0311]где R5, X и Cy такие, как определено в вышеупомянутой формуле [I], и m7 является таким, как определено в вышеупомянутой формуле [I-A], можно получить, подвергая соединение [53] реакции стадии 4-6.
[0312]
В способе получения 4, соединение [I-c3] формулы
[0313]
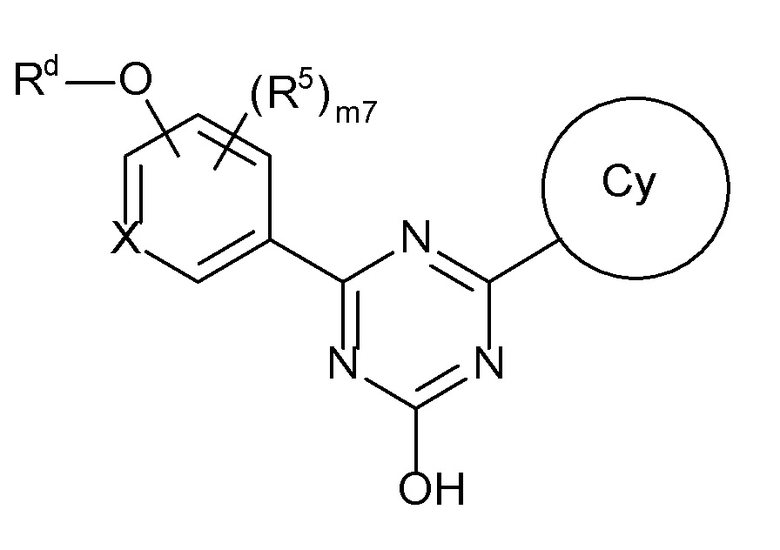
[0314]где R5, Rd, X и Cy являются такими, как определено в вышеупомянутой формуле [I], и m7 является таким, как определено в вышеупомянутой формуле [I-A], может быть получено с помощью реакции Мицунобу соединения [53] и RdOH, такого как циклогексилметанол и тому подобное, таким же образом, как в способе получения 3-1, стадия 3-1-5, и подвергая полученный продукт реакции стадии 4-6.
[0315]
В способе получения 4 реакцию сочетания Сузуки соединения [54] и соединения [57] формулы
[0316]
[0317]где Z является таким, как определено в вышеупомянутом способе получения 1-1, выполняли таким же образом, как и в способе получения 1-1, стадия 1-1-2. Полученный продукт подвергали реакции стадии 4-6, в результате чего соединение [I-с4] формулы
[0318]
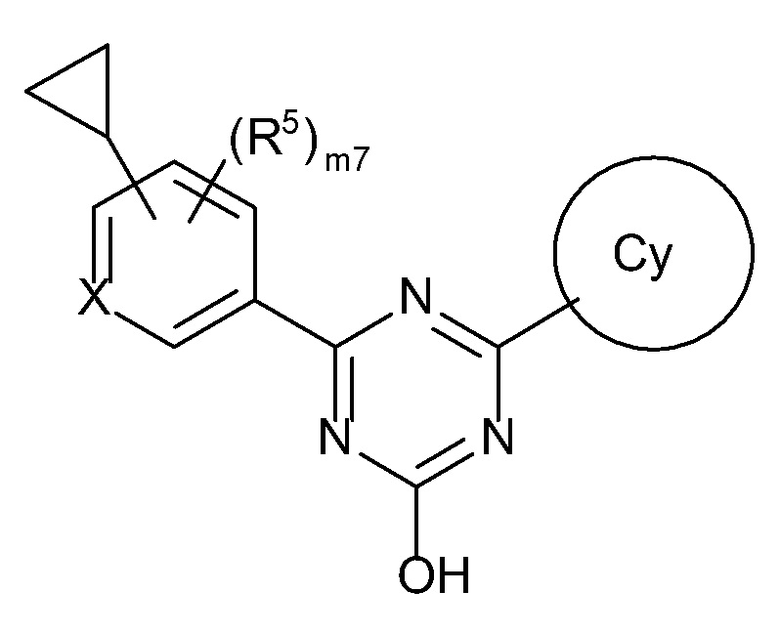
[0319]где R5, X и Cy являются такими, как определено в вышеупомянутой формуле [I] и m7 является таким, как определено в вышеупомянутой формуле [I-A], может быть получено.
[0320]
В способе получения 4, реакцию сочетания Сузуки соединения [54] и соединения [58] формулы
[0321]
[0322]где m9 равен 1, 2, 3, или 4, и Z является таким, как определено в вышеупомянутом способе получения 1-1, выполняли таким же образом, как и в способе получения 1-1, стадия 1-1-2. После восстановления олефина продукта реакции, полученный продукт подвергали реакции стадии 4-6, в результате чего соединение [I-с5] формулы
[0323]
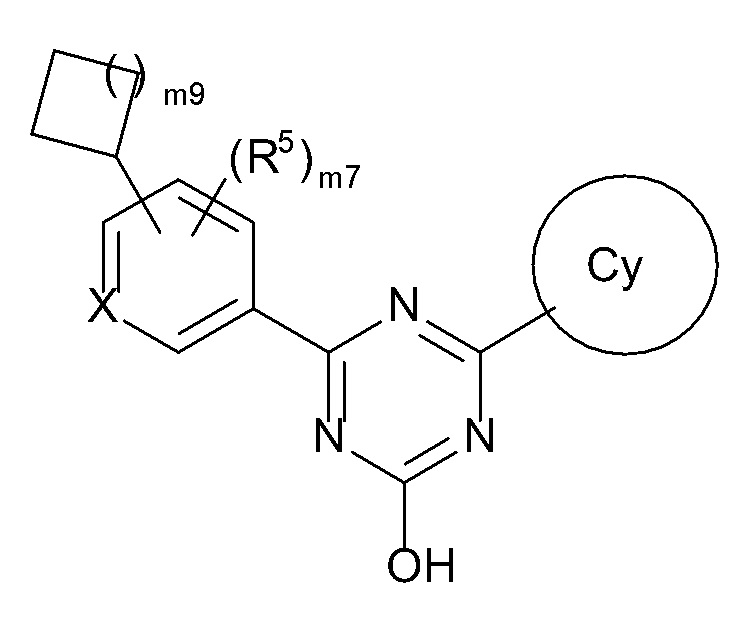
[0324]где m9 является таким, как описано выше, m7 является таким, как определено в вышеупомянутой формуле [I-A], и R5, X и Cy являются такими, как определено в вышеупомянутой формуле [I], может быть получено. Для реакции восстановления олефина, например, реакцию гидрирования только необходимо осуществлять в одном или смешанном растворителе из тетрагидрофурана, этилацетата, этанола, метанола, воды и тому подобное, в присутствии катализатора, такого как палладий на угле или платиново-углеродный катализатор и тому подобное.
Примеры
[0325]
Настоящее изобретение поясняется более подробно ниже со ссылкой на примеры и экспериментальные примеры, которые не следует рассматривать как ограничивающие.
Аббревиатуры в примерах являются следующими.
WSC・HCl: гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида
HOBt・H2O: 1-гидрокси-1H-бензотриазол моногидрат
ДМСО: диметилсульфоксид
M: моль/л
[0326]
[Пример получения 1]
Синтез N-(4-хлор-3-{4-[4-(2,2-диметилпропокси)фенил]-6-гидрокси-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-86)
[0327]
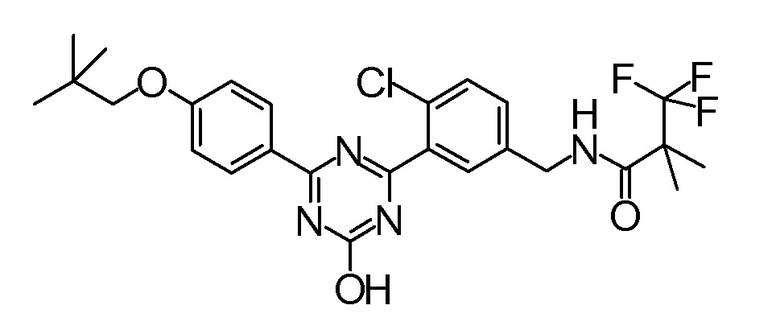
[0328]
(1) 2-хлор-4-[4-(2,2-диметилпропокси)фенил]-6-метокси-1,3,5-триазин
[0329]
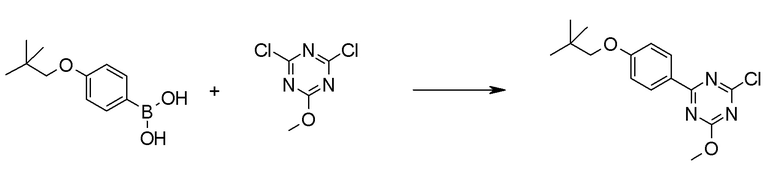
[0330]
В атмосфере аргона суспензию 4-(2,2-диметилпропокси)фенилбороновой кислоты (2,0 г, 9,6 ммоль), 2,4-дихлор-6-метокси-1,3,5-триазина (3,5 г, 19 ммоль), аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (1,1 г, 0,96 ммоль) и 2М водного раствора карбоната натрия (14 мл, 29 ммоль) в толуоле (20 мл) перемешивали при 100°C в течение 3,5 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=19/1-4/1) с получением указанного в заголовке соединения (2,3 г, выход 77%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,06 (9H, с), 3,68 (2H, с), 4,14 (3H, с), 6,94-7,02 (2H, м), 8,42-8,46 (2H, м).
[0331]
(2) (4-хлор-3-{4-[4-(2,2-диметилпропокси)фенил]-6-метокси-1,3,5-триазин-2-ил}фенил)метанол
[0332]
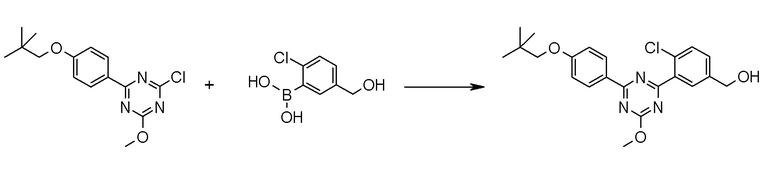
[0333]
В атмосфере аргона суспензию 2-хлор-4-[4-(2,2-диметилпропокси)фенил]-6-метокси-1,3,5-триазина (2,3 г, 7,4 ммоль), полученного в вышеупомянутом (1), 2-хлор-5-гидроксиметилфенилбороновой кислоты (1,7 г, 8,9 ммоль), аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,61 г, 0,74 ммоль) и 2 М водного раствора карбоната натрия (15 мл, 30 ммоль) в 1,4-диоксане (23 мл) перемешивали при 100°C в течение 1,5 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/1-1/1) с получением указанного в заголовке соединения (1,3 г, выход 43%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,06 (9H, с), 1,75 (1H, т, J=5,9 Гц), 3,69 (2H, с), 4,19 (3H, с), 4,77 (2H, д, J=5,9 Гц), 6,98-7,03 (2H, м), 7,46 (1H, дд, J=8,2, 2,2 Гц), 7,53 (1H, д, J=8,2 Гц), 8,00 (1H, д, J=2,2 Гц), 8,52-8,58 (2H, м).
[0334]
(3) трет-бутил N-(4-хлор-3-{4-[4-(2,2-диметилпропокси)фенил]-6-метокси-1,3,5-триазин-2-ил}бензил)-N-(трет-бутоксикарбонил)карбамат
[0335]
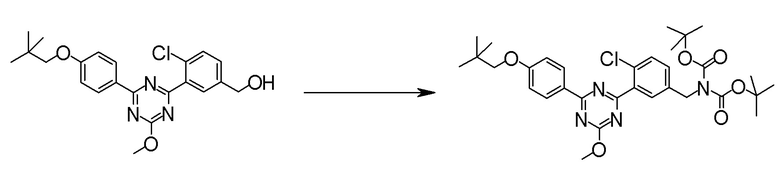
[0336]
В атмосфере аргона к раствору (4-хлор-3-{4-[4-(2,2-диметилпропокси)фенил]-6-метокси-1,3,5-триазин-2-ил}фенил)метанола (1,3 г, 3,2 ммоль), полученного в вышеупомянутом (2), и триэтиламина (0,58 мл, 4,2 ммоль) в тетрагидрофуране (13 мл) добавляли метансульфонилхлорид (0,29 мл, 3,8 ммоль) при охлаждении льдом, и смесь нагревали до комнатной температуры. После перемешивания в течение 0,5 часа, реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К раствору остатка в N,N-диметилформамиде (13 мл) добавляли карбонат цезия (3,1 г, 9,5 ммоль) и ди-трет-бутил-иминодикарбоксилат (0,83 г, 3,8 ммоль), и смесь перемешивали в течение 3 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=9/1-7/3) с получением указанного в заголовке соединения (1,6 г, выход 82%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,06 (9H, с), 1,48 (18H, с), 3,69 (2H, с), 4,18 (3H, с), 4,83 (2H, с), 6,96-7,01 (2H, м), 7,39 (1H, дд, J=8,2, 2,2 Гц), 7,48 (1H, д, J=8,2 Гц), 7,98 (1H, д, J=2,2 Гц), 8,51-8,57 (2H, м).
[0337]
(4) гидрохлорид 4-хлор-3-{4-[4-(2,2-диметилпропокси)фенил]-6-метокси-1,3,5-триазин-2-ил}бензиламина
[0338]
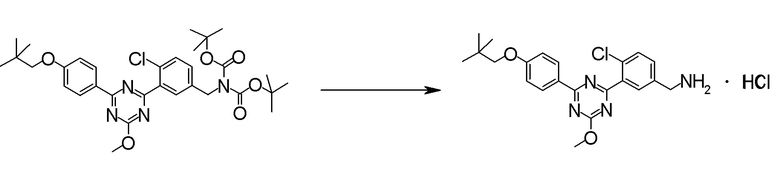
[0339]
В атмосфере аргона к раствору трет-бутил N-(4-хлор-3-{4-[4-(2,2-диметилпропокси)фенил]-6-метокси-1,3,5-триазин-2-ил}бензил)-N-(трет-бутоксикарбонил)карбамата (1,3 г, 2,2 ммоль), полученного в вышеупомянутом (3), в 1,4-диоксане (2,8 мл) добавляли 4 M раствора хлористый водород/1,4-диоксан (11 мл) при комнатной температуре, и смесь перемешивали в течение 3 часов. Твердое вещество собирали фильтрацией из суспензии, и сушили при пониженном давлении с получением указанного в заголовке соединения (0,97 г, выход 99%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 1,03 (9H, с), 3,76 (2H, с), 4,10-4,18 (2H, м), 4,14 (3H, с), 7,11-7,17 (2H, м), 7,72 (2H, д, J=0,9 Гц), 8,13 (1H, ушир. с), 8,40-8,58 (5H, м).
[0340]
(5) N-(4-хлор-3-{4-[4-(2,2-диметилпропокси)фенил]-6-метокси-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамид
[0341]
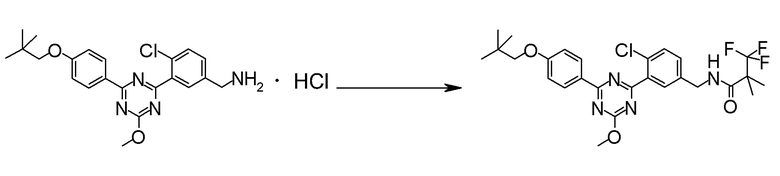
[0342]
В атмосфере аргона к раствору гидрохлорида 4-хлор-3-{4-[4-(2,2-диметилпропокси)фенил]-6-метокси-1,3,5-триазин-2-ил}бензиламина (0,97 г, 2,2 ммоль), полученного в вышеупомянутом (4), и 3,3,3-трифтор-2,2-диметилпропионовой кислоты (0,41 г, 2,6 ммоль) в N,N-диметилформамиде (10 мл) добавляли HOBt・H2O (0,43 г, 2,8 ммоль), WSC・HCl (2,8 г, 2,8 ммоль) и триэтиламин (0,91 мл, 6,5 ммоль) при комнатной температуре, и смесь перемешивали в течение 3,5 часов. Добавляли 3,3,3-трифтор-2,2-диметилпропионовую кислоту (0,067 г, 0,43 ммоль), HOBt・H2O (0,066 г, 0,43 ммоль) и WSC・HCl (0,082 г, 0,43 ммоль), и смесь перемешивали в течение 1,5 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=9/1-7/3) с получением указанного в заголовке соединения (0,97 г, выход 81%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,07 (9H, с), 1,44 (6H, с), 3,69 (2H, с), 4,19 (3H, с), 4,55 (2H, д, J=5,8 Гц), 6,22 (1H, ушир. с), 6,96-7,03 (2H, м), 7,34 (1H, дд, J=8,3, 2,3 Гц), 7,51 (1H, д, J=8,3 Гц), 7,91 (1H, д, J=2,3 Гц), 8,50-8,57 (2H, м).
[0343]
(6) N-(4-хлор-3-{4-[4-(2,2-диметилпропокси)фенил]-6-гидрокси-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-86)
[0344]
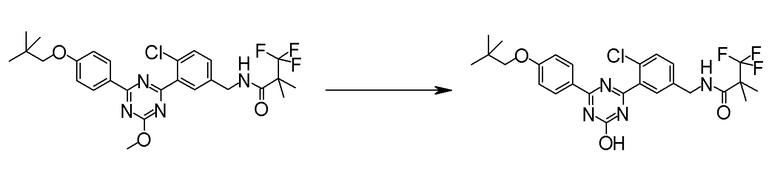
[0345]
В атмосфере аргона к раствору N-(4-хлор-3-{4-[4-(2,2-диметилпропокси)фенил]-6-метокси-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамида (0,97 г, 1,76 ммоль), полученного в вышеупомянутом (5), в метаноле (10 мл) добавляли 4 M водного раствора гидроксида натрия (3,5 мл, 14 ммоль) при комнатной температуре, и смесь перемешивали при 65°C в течение 1,5 часов. К реакционной смеси добавляли 2 М хлористоводородной кислоты (7,0 мл, 14 ммоль) и воду при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,87 г, выход 92%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 1,02 (9H, с), 1,37 (6H, с), 3,73 (2H, с), 4,35 (2H, д, J=5,8 Гц), 7,08 (2H, д, J=9,1 Гц), 7,40 (1H, дд, J=8,3, 2,2 Гц), 7,58 (1H, д, J=8,3 Гц), 7,62 (1H, д, J=1,9 Гц), 8,29 (2H, д, J=9,1 Гц), 8,62 (1H, т, J=5,8 Гц), 13,13 (1H, с).
[0346]
[Пример получения 2]
Синтез 1-[4-хлор-3-(4-гидрокси-6-фенил-1,3,5-триазин-2-ил)-бензил]-3,3-диметил-1,3-дигидроиндол-2-она (Пример No.1-258)
[0347]
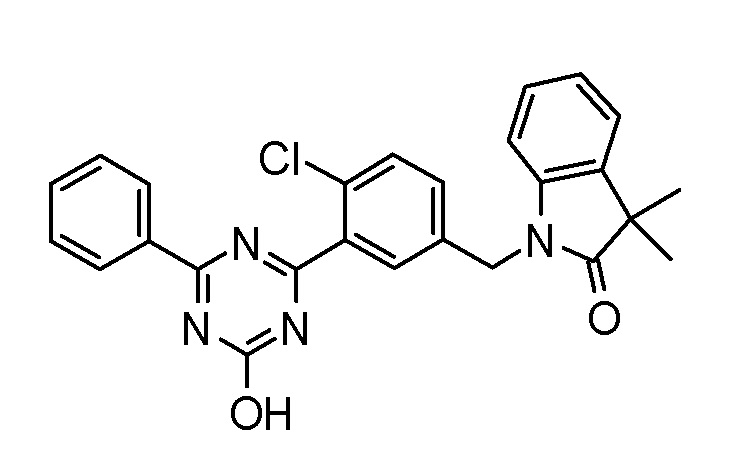
[0348]
(1) 2-(5-бромметил-2-хлорфенил)-4-метокси-6-фенил-1,3,5-триазин
[0349]
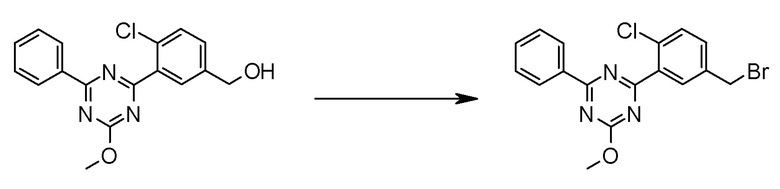
[0350]
Способом, аналогичным способу в Примере получения 1 (1) и (2), и с использованием 2,4-дихлор-6-метокси-1,3,5-триазина, 2-хлор-5-гидроксиметилфенилбороновой кислоты и фенилбороновой кислоты вместо 4-(2,2-диметилпропокси)фенилбороновой кислоты, получали [4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)фенил]метанол.
В атмосфере аргона к раствору полученного [4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)фенил]метанола (0,47 г, 1,4 ммоль) и трифенилфосфина (0,56 г, 2,1 ммоль) в хлороформе (4,5 мл) добавляли четырехбромистый углерод (0,71 г, 2,1 ммоль) при охлаждении льдом. Реакционную смесь перемешивали при комнатной температуре в течение 10 минут, и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=30/1-9/1) с получением указанного в заголовке соединения (0,49 г, выход 87%).
1H-ЯМР (400 МГц, CDCl3) δ: 4,22 (3H, с), 4,53 (2H, с), 7,45-7,64 (5H, м), 8,06 (1H, ушир. с), 8,57-8,63 (2H, м).
[0351]
(2) 1-[4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)бензил]-3,3-диметил-1,3-дигидроиндол-2-он
[0352]
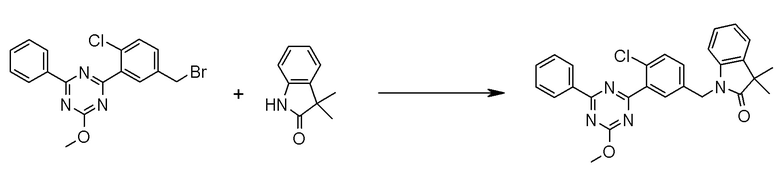
[0353]
В атмосфере аргона к раствору 3,3-диметилиндолин-2-она (0,050 г, 0,31 ммоль) в N,N-диметилформамиде (1,0 мл) добавляли гидрид натрия (0,012 г, 60% масс. дисперсия в масле) при охлаждении льдом. После перемешивания в течение 30 минут, добавляли 2-(5-бромметил-2-хлорфенил)-4-метокси-6-фенил-1,3,5-триазин (0,10 г, 0,26 ммоль), полученный в вышеупомянутом (1), и смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=7/2) с получением указанного в заголовке соединения (0,11 г, выход 89%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (6H, с), 4,18 (3H, с), 4,98 (2H, с), 6,72-6,76 (1H, м), 7,02-7,08 (1H, м), 7,13-7,19 (1H, м), 7,21-7,25 (1H, м), 7,31-7,36 (1H, м), 7,46-7,53 (3H, м), 7,55-7,61 (1H, м), 8,00 (1H, ушир. с), 8,51-8,58 (2H, м).
[0354]
(3) 1-[4-хлор-3-(4-гидрокси-6-фенил-1,3,5-триазин-2-ил)бензил]-3,3-диметил-1,3-дигидроиндол-2-он (Пример No.1-258)
[0355]
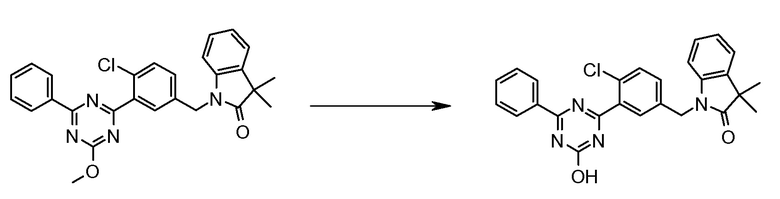
[0356]
В атмосфере аргона к раствору 1-[4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)бензил]-3,3-диметил-1,3-дигидроиндол-2-она (0,11 г, 0,23 ммоль), полученного в вышеупомянутом (2), в метаноле (10 мл) добавляли 4 M водного раствора гидроксида натрия (0,34 мл, 1,4 ммоль) при комнатной температуре, и смесь перемешивали при 65°C в течение 2 часов. К реакционной смеси добавляли 10% мас. водного раствора лимонной кислоты (1,4 мл) и воду (7,0 мл) при комнатной температуре, и смесь перемешивали в течение 30 минут. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,10 г, выход 96%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 1,34 (6H, с), 4,99 (2H, с), 6,97 (1H, д, J=7,6 Гц), 7,05 (1H, т, J=7,6 Гц), 7,20 (1H, т, J=7,6 Гц), 7,39 (1H, д, J=7,6 Гц), 7,48 (1H, дд, J=8,3, 1,8 Гц), 7,55 (2H, т, J=7,6 Гц), 7,59-7,68 (2H, м), 7,75 (1H, д, J=1,8 Гц), 8,29 (2H, д, J=7,6 Гц), 13,32 (1H, ушир. с).
[0357]
[Пример получения 3]
Синтез N-[4-хлор-3-(4-гидрокси-6-фенил-1,3,5-триазин-2-ил)бензил]-N-этил-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-263)
[0358]
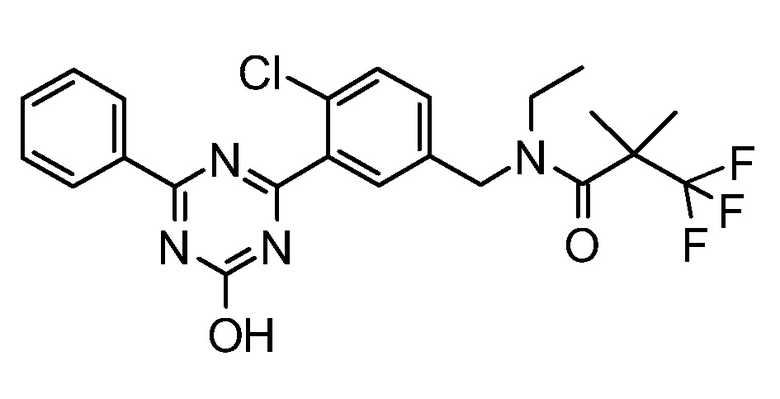
[0359]
(1) [4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)бензил]этиламин
[0360]
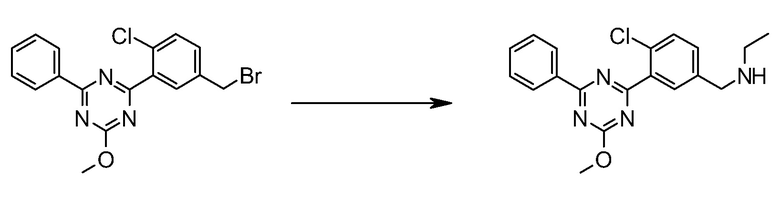
[0361]
В атмосфере аргона, к 2-(5-бромметил-2-хлорфенил)-4-метокси-6-фенил-1,3,5-триазину (0,20 г, 0,51 ммоль), полученному таким же образом, как и в Примере получения 2 (1), добавляли раствор 2М этиламина тетрагидрофурана (2,5 мл) при комнатной температуре, и полученную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,28 г) в виде сырого продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,14 (3H, т, J=7,2 Гц), 2,70 (2H, кв, J=7,2 Гц), 3,86 (2H, с), 4,22 (3H, с), 7,44 (1H, дд, J=8,2, 2,2 Гц), 7,48-7,55 (3H, м), 7,57-7,62 (1H, м), 7,97 (1H, д, J=2,2 Гц), 8,58-8,64 (2H, м).
[0362]
(2) N-[4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)бензил]-N-этил-3,3,3-трифтор-2,2-диметилпропионамид
[0363]
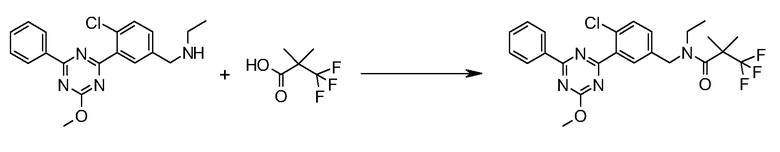
[0364]
В атмосфере аргона к раствору [4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)бензил]этиламина (0,18 г, 0,38 ммоль), полученного в вышеупомянутом (1), и 3,3,3-трифтор-2,2-диметилпропионовой кислоты (0,12 г, 0,76 ммоль) в хлороформе (2,0 мл) добавляли WSC・HCl (0,15 г, 0,76 ммоль) и 4-диметиламинопиридин (0,93 мг, 0,76 ммоль) при комнатной температуре, и полученную смесь перемешивали в течение 16 часов. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=8/3) с получением указанного в заголовке соединения (0,086 г, выход 46%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,20 (3H, т, J=6,9 Гц), 1,55 (6H, с), 3,47 (2H, кв, J=6,9 Гц), 4,21 (3H, с), 4,71 (2H, с), 7,24-7,30 (1H, м), 7,45-7,63 (4H, м), 7,88 (1H, ушир. с), 8,56-8,64 (2H, м).
[0365]
(3) N-[4-хлор-3-(4-гидрокси-6-фенил-1,3,5-триазин-2-ил)бензил]-N-этил-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-263)
[0366]
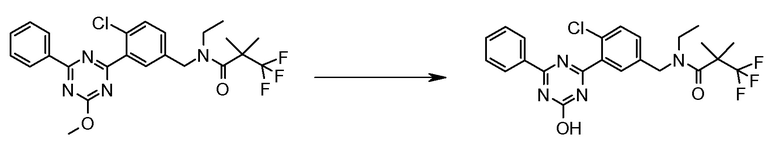
[0367]
В атмосфере аргона к раствору N-[4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)бензил]-N-этил-3,3,3-трифтор-2,2-диметилпропионамида (0,086 г, 0,17 ммоль), полученному в вышеупомянутом (2), в метаноле (1,5 мл) добавляли 4 M водного раствора гидроксида натрия (0,26 мл, 1,0 ммоль) при комнатной температуре, и смесь перемешивали при 65°C в течение 2 часов. При комнатной температуре, добавляли 10% масс. водный раствор лимонной кислоты (1,2 мл) и воды (6 мл), и смесь перемешивали в течение 30 минут. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением сырого продукта. К суспензии сырого продукта в этилацетате (1,5 мл) добавляли н-гексан (1,5 мл), и смесь перемешивали в течение 30 минут. Твердое вещество собирали фильтрацией, сушили при пониженном давлении с получением указанного в заголовке соединения (0,067 г, выход 80%).
1H-ЯМР (400 МГц, ДМСО-d6) δ:1,13 (3H, т, J=6,9 Гц), 1,50 (6H, с), 3,42 (2H, ушир. с), 4,66 (2H, с), 7,41 (1H, дд, J=8,3, 1,8 Гц), 7,56 (2H, т, J=7,9 Гц), 7,61-7,69 (3H, м), 8,34 (2H, д, J=7,9 Гц), 13,33 (1H, ушир.с).
[0368]
[Пример получения 4]
Синтез 7-трет-бутил-2-[4-хлор-3-(4-гидрокси-6-фенил-1,3,5-триазин-2-ил)бензил]-2-азаспиро[3.5]нонан-1-она (Пример No.1-266)
[0369]
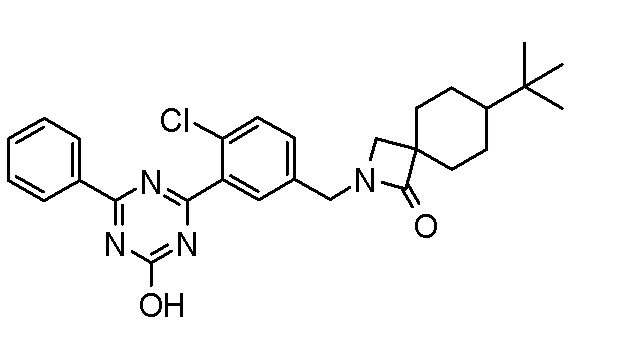
[0370](1) метил 1-бензилоксиметил-4-трет-бутил-циклогексанкарбоксилат
[0371]
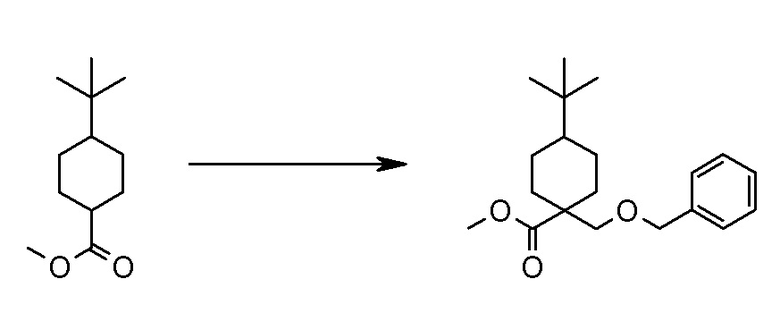
[0372]
В атмосфере аргона к раствору метил 4-трет-бутил-циклогексанкарбоксилата (0,46 г, 2,3 ммоль) в тетрагидрофуране (2,5 мл) добавляли по каплям 2 М раствор гептан/тетрагидрофуран/этилбензол (1,4 мл, 2,8 ммоль) диизопропиламида лития при -78°C в течение 5 минут. После перемешивания в течение 1 часа, бензилхлорметиловый эфир (0,38 мл, 2,8 ммоль) добавляли по каплям в течение 1 минуты. При охлаждении льдом, смесь перемешивали в течение 1 часа. К реакционной смеси добавляли 10% мас. водного раствора лимонной кислоты (3,0 мл) и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=30/1) с получением указанного в заголовке соединения (0,49 г, выход 66%). В то время как указанное в заголовке соединение получали в виде единственного стереоизомера, его относительная конфигурация была не определена. В частности, является ли метоксикарбонильная группа цис/транс по отношению к трет-бутильной группе, не определено.
1H-ЯМР (400 МГц, CDCl3) δ: 0,81 (9H, с), 0,88-0,99 (1H, м), 1,00-1,21 (4H, м), 1,68 (2H, д, J=12,0 Гц), 2,29 (2H, д, J=12,0 Гц), 3,36 (2H, с), 3,69 (3H, с), 4,48 (2H, ушир. с), 7,22-7,38 (5H, м).
[0373]
(2) метил 4-трет-бутил-1-гидроксиметил-циклогексанкарбоксилат
[0374]
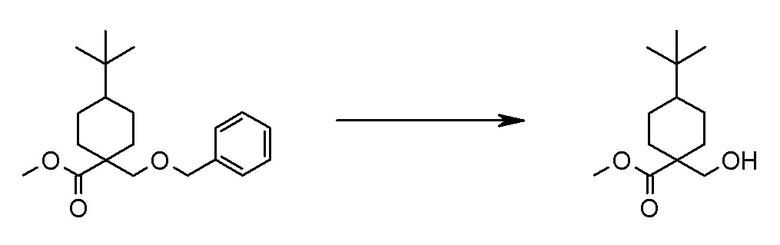
[0375]
В атмосфере аргона к раствору метил 1-бензилоксиметил-4-трет-бутил-циклогексанкарбоксилата (0,49 г, 1,5 ммоль), полученному в вышеупомянутом (1), в метаноле (5,5 мл) добавляли ASCA-2 (катализатор 4,5% палладий на подложке из активированного угля-0,5% платина (см. N.E. CHEMCAT, Fine chemical October 1, 2002, стр. 5-14), 0,20 г) при комнатной температуре. Под давлением водорода 1 атм, смесь перемешивали в течение 4 часов. В атмосфере аргона, реакционную смесь фильтровали через целит, и фильтрат элюировали этилацетатом. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,27 г, выход 75%). В то время как указанное в заголовке соединение представляет собой единственный стереоизомер, его относительная конфигурация не определена.
1H-ЯМР (400 МГц, CDCl3) δ: 0,83 (9H, с), 0,91-1,17 (5H, м), 1,64-1,78 (3H, м), 2,20-2,31 (2H, м), 3,53 (2H, д, J=6,0 Гц), 3,73 (3H, с).
[0376]
(3) 4-трет-бутил-1-гидроксиметил-циклогексанкарбоновая кислота
[0377]
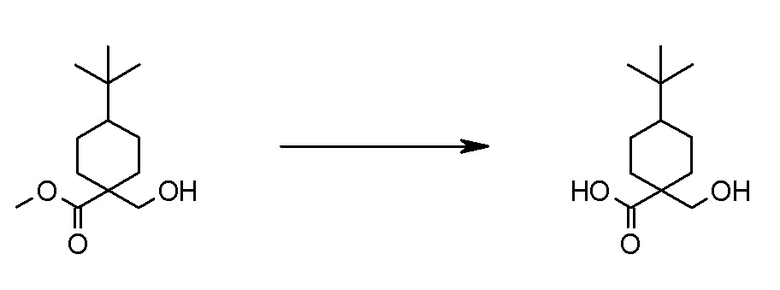
[0378]
В атмосфере аргона к раствору метил 4-трет-бутил-1-гидроксиметил-циклогексанкарбоксилата (0,27 г, 1,2 ммоль), полученного в вышеупомянутом (2), в метаноле (1,7 мл) добавляли тетрагидрофуран (1,7 мл) и 4M водный раствор гидроксида натрия (1,7 мл, 7,0 ммоль) при комнатной температуре, и смесь перемешивали при 65°C в течение 1,5 часов. Метанол (1,7 мл), тетрагидрофуран (1,7 мл) и 4M водный раствор гидроксида натрия (1,7 мл, 7,0 ммоль) добавляли, и смесь перемешивали при 65°C в течение 2 часов. К реакционной смеси добавляли 2 М хлористоводородной кислоты (7,5 мл, 15 ммоль) и воду при комнатной температуре, и смесь перемешивали. Добавляли этилацетат и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=12/1) с получением указанного в заголовке соединения (0,24 г, выход 94%). В то время как указанное в заголовке соединение представляет собой единственный стереоизомер, его относительная конфигурация не определена.
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,80 (9H, с), 0,86-1,12 (5H, м), 1,53-1,66 (2H, м), 2,00-2,13 (2H, м), 3,31 (2H, с).
[0379]
(4) 4-трет-бутил-1-гидроксиметил-циклогексанкарбоновой кислоты 4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)бензиламид
[0380]
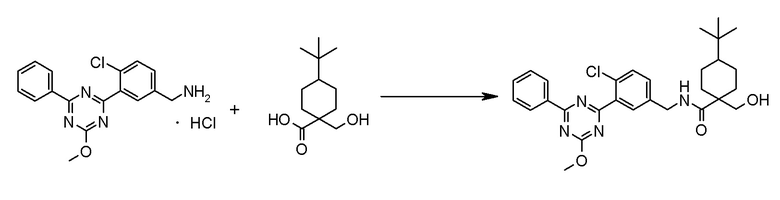
[0381]
Способом, аналогичным способу в Примере получения 1 (1)-(4), и используя 2,4-дихлор-6-метокси-1,3,5-триазин, 2-хлор-5-гидроксиметилфенилбороновую кислоту, и фенилбороновую кислоту вместо 4-(2,2-диметилпропокси)фенилбороновой кислоты, получали гидрохлорид 4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)бензиламина.
В атмосфере аргона к раствору полученного гидрохлорида 4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)бензиламина (0,90 г, 0,25 ммоль) и 4-трет-бутил-1-гидроксиметил-циклогексанкарбоновой кислоты (0,080 г, 0,37 ммоль), полученной в вышеупомянутом (3), в N,N-диметилформамиде (2,0 мл) добавляли HOBt・H2O (0,057 г, 0,37 ммоль), WSC・HCl (0,071 г, 0,37 ммоль) и триэтиламин (0,10 мл, 0,74 ммоль) при комнатной температуре, и смесь перемешивали в течение 13 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/2-1/3) с получением указанного в заголовке соединения (0,11 г, выход 81%). В то время как указанное в заголовке соединение представляет собой единственный стереоизомер, его относительная конфигурация является неопределенной.
1H-ЯМР (400 МГц, CDCl3) δ: 0,78 (9H, с), 0,94-1,22 (5H, м), 1,66-1,75 (2H, м), 2,22-2,30 (2H, м), 2,42 (1H, т, J=5,0 Гц), 3,52 (2H, д, J=5,0 Гц), 4,21 (3H, с), 4,57 (2H, д, J=5,8 Гц), 6,46 (1H, т, J=5,8 Гц), 7,38 (1H, дд, J=8,3, 2,3 Гц), 7,47-7,55 (3H, м), 7,57-7,62 (1H, м), 7,97 (1H, д, J=2,3 Гц), 8,57-8,62 (2H, м).
[0382]
(5) 7-трет-бутил-2-[4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)бензил]-2-азаспиро[3.5]нонан-1-он
[0383]
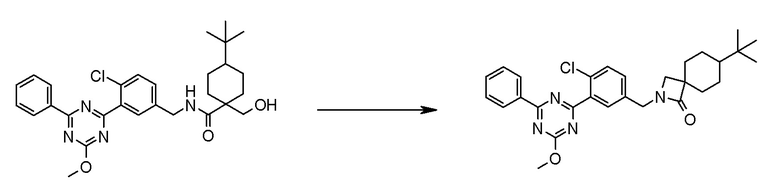
[0384]
В атмосфере аргона к раствору 4-трет-бутил-1-гидроксиметил-циклогексанкарбоновой кислоты 4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)бензиламида (0,11 г, 0,20 ммоль), полученной в вышеупомянутом (4), и трифенилфосфина (0,080 г, 0,30 ммоль) в тетрагидрофуране (1,0 мл) добавляли бис(2-метоксиэтил) азодикарбоксилат (0,071 г, 0,30 ммоль) при комнатной температуре, и смесь перемешивали в течение 1,5 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали с помощью препаративной тонкослойной хроматографии (элюент: н-гексан/этилацетат=4/1) с получением указанного в заголовке соединения (0,068 г, выход 66%). В то время как указанное в заголовке соединение представляет собой единственный стереоизомер, относительная конфигурация трет-бутильной группы не определена.
1H-ЯМР (400 МГц, CDCl3) δ: 0,81-1,77 (7H, м), 0,87 (9H, с), 2,03-2,12 (2H, м), 2,87 (2H, ушир. с), 4,21 (3H, с), 4,40 (2H, ушир. с), 7,30-7,37 (1H, м), 7,48-7,64 (4H, м), 7,90 (1H, ушир. с), 8,57-8,63 (2H, м).
[0385]
(6) 7-трет-бутил-2-[4-хлор-3-(4-гидрокси-6-фенил-1,3,5-триазин-2-ил)бензил]-2-азаспиро[3.5]нонан-1-он (Пример No.1-266)
[0386]
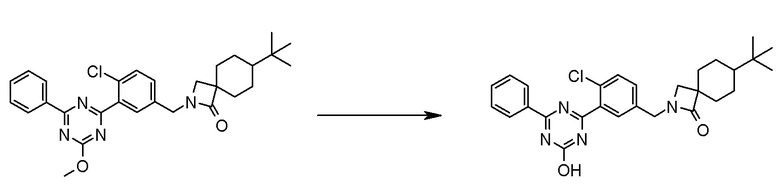
[0387]
В атмосфере аргона к раствору 7-трет-бутил-2-[4-хлор-3-(4-метокси-6-фенил-1,3,5-триазин-2-ил)бензил]-2-азаспиро[3.5]нонан-1-она (0,068 г, 0,13 ммоль), полученного в вышеупомянутом (5), в метаноле (1,2 мл) добавляли 4 M водного раствора гидроксида натрия (0,20 мл, 0,81 ммоль) при комнатной температуре, и смесь перемешивали при 65°C в течение 1,5 часов. При комнатной температуре, к реакционной смеси добавляли 10% мас. водного раствора лимонной кислоты (0,82 мл) и воду (4,0 мл), и смесь перемешивали в течение 30 минут. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,062 г, выход 94%). В то время как указанное в заголовке соединение представляет собой единственный стереоизомер, относительная конфигурация трет-бутильной группы не определена.
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,83 (9H, с), 0,90-0,99 (1H, м), 1,41-1,67 (6H, м), 1,96-2,03 (2H, м), 2,92 (2H, с), 4,38 (2H, с), 7,47 (1H, дд, J=8,3, 1,8 Гц), 7,56 (2H, т, J=7,6 Гц), 7,63-7,69 (3H, м), 8,34 (2H, д, J=7,6 Гц), 13,34 (1H, ушир.с).
[0388]
[Пример получения 5]
Синтез гидрохлорида 4-[2-(6-метилпиридин-2-илметокси)-6-трифторметилфенил]-6-(4-фенилэтинилфенил)-1,3,5-триазин-2-ола (Пример No.2-98)
[0389]
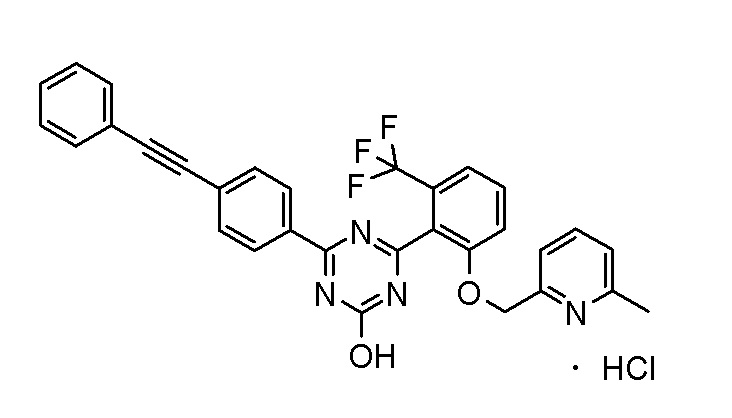
[0390]
(1) 2-бром-1-метоксиметокси-3-трифторметил-бензол
[0391]
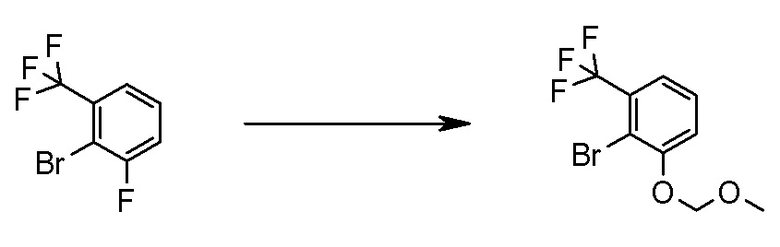
[0392]
В атмосфере аргона к раствору 2-бром-3-фторбензотрифторида (6,0 г, 25 ммоль) и 2-(метилсульфонил)этанола (4,3 г, 35 ммоль) в N,N-диметилформамиде (10 мл) добавляли гидрид натрия (2,8 г, 60% масс. дисперсия в масле) в 3 порции при охлаждении льдом. После перемешивания при комнатной температуре в течение 10 минут, добавляли хлорметилметиловый эфир (5,3 мл, 69 ммоль) по каплям при охлаждении льдом. После перемешивания в течение 30 минут, смесь перемешивали при комнатной температуре в течение 15 минут. При охлаждении льдом, к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=12/1) с получением указанного в заголовке соединения (5,0 г, выход 70%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,53 (3H, с), 5,29 (2H, с), 7,31-7,38 (3H, м).
[0393]
(2) 2-(2-метоксиметокси-6-трифторметилфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
[0394]
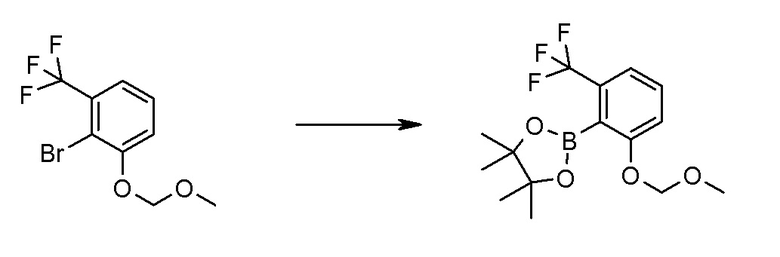
[0395]
В атмосфере аргона к раствору 2-бром-1-метоксиметокси-3-трифторметил-бензола (4,9 г, 17 ммоль), полученного в вышеупомянутом (1), в тетрагидрофуране (90 мл) добавляли по каплям н-бутиллитий (1,6 М раствор н-гексана, 11 мл, 17 ммоль) при температуре -78°C в течение 30 минут. 2-Изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан (3,5 мл, 17 ммоль) добавляли по каплям в течение 15 минут, и смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=9/1) с получением указанного в заголовке соединения (2,8 г, выход 48%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,39 (12H, с), 3,47 (3H, с), 5,18 (2H, с), 7,20 (1H, д, J=8,4 Гц), 7,24-7,28 (1H, м), 7,36-7,42 (1H, м).
[0396]
(3) 2-(4-бензилоксифенил)-4-метокси-6-(2-метоксиметокси-6-трифторметилфенил)-1,3,5-триазин
[0397]
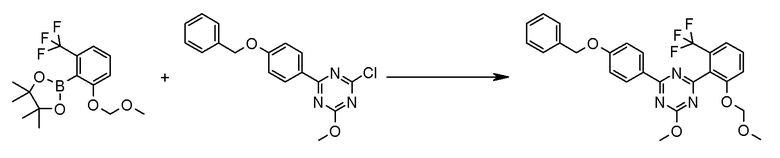
[0398]
Способом, аналогичным способу в Примере получения 1 (1), и используя 2,4-дихлор-6-метокси-1,3,5-триазин, и 4-(бензилокси)фенилбороновую кислоту вместо 4-(2,2-диметилпропокси)фенилбороновой кислоты, получали 2-(4-бензилоксифенил)-4-хлор-6-метокси-1,3,5-триазин.
В атмосфере аргона к раствору полученного 2-(4-бензилоксифенил)-4-хлор-6-метокси-1,3,5-триазина (3,0 г, 9,2 ммоль) и 2-(2-метоксиметокси-6-трифторметилфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (2,8 г, 8,4 ммоль), полученного в вышеупомянутом (2), в N,N-диметилформамиде (25 мл) добавляли аддукт [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (1,4 г, 1,7 ммоль), йодид меди (I) (0,48 г, 2,5 ммоль) и 2М водного раствора карбоната натрия (13 мл, 25 ммоль), и смесь перемешивали при 115°C в течение 45 минут. К реакционной смеси добавляли воду и этилацетат. После перемешивания, нерастворимое вещество удаляли фильтрованием через целит и фильтрат элюировали этилацетатом. Фильтрат разделяли, и органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=7/2) с получением указанного в заголовке соединения (2,0 г, выход 47%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 3,39 (3H, с), 4,14 (3H, с), 5,13 (2H, с), 5,15 (2H, с), 7,02-7,08 (2H, м), 7,30-7,46 (7H, м), 7,48-7,55 (1H, м), 8,47-8,52 (2H, м).
[0399]
(4) 4-[4-метокси-6-(2-метоксиметокси-6-трифторметилфенил)-1,3,5-триазин-2-ил]фенол
[0400]
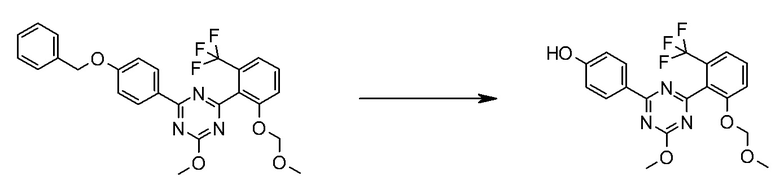
[0401]
В атмосфере аргона к раствору 2-(4-бензилоксифенил)-4-метокси-6-(2-метоксиметокси-6-трифторметилфенил)-1,3,5-триазина (2,0 г, 4,0 ммоль), полученного в вышеупомянутом (3), в этилацетате (10 мл) добавляли метанол (10 мл) и 10% масс. палладия на углероде (0,49 г) при комнатной температуре. При давлении водорода 1 атм, смесь перемешивали в течение 2 часов. В атмосфере аргона, реакционную смесь фильтровали через целит, и фильтрат элюировали этилацетатом. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,6 г, выход 97%).
1H-ЯМР (400 МГц, CDCl3)δ:3,39 (3H, с), 4,14 (4H, с), 5,13 (2H, с), 5,39 (1H, ушир. с), 6,87-6,93 (2H, м), 7,40-7,45 (2H, м), 7,48-7,55 (1H, м), 8,43-8,48 (2H, м).
[0402]
(5) трифторметансульфоновой кислоты 4-[4-метокси-6-(2-метоксиметокси-6-трифторметилфенил)-1,3,5-триазин-2-ил]фениловый эфир
[0403]
[0404]
В атмосфере аргона к раствору 4-[4-метокси-6-(2-метоксиметокси-6-трифторметилфенил)-1,3,5-триазин-2-ил]фенола (1,6 г, 3,9 ммоль), полученного в вышеупомянутом (4), в пиридине (15 мл) добавляли по каплям ангидрид трифторметансульфоновой кислоты (13 мл, 7,7 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1) с получением указанного в заголовке соединения (2,0 г, выход 95%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,39 (3H, с), 4,17 (3H, с), 5,13 (2H, с), 7,37-7,48 (4H, м), 7,51-7,58 (1H, м), 8,61-8,67 (2H, м).
[0405]
(6) 2-метокси-4-(2-метоксиметокси-6-трифторметилфенил)-6-(4-фенилэтинилфенил)-1,3,5-триазин
[0406]
[0407]
В атмосфере аргона к раствору трифторметансульфоновой кислоты 4-[4-метокси-6-(2-метоксиметокси-6-трифторметилфенил)-1,3,5-триазин-2-ил]фенилового эфира (0,50 г, 0,93 ммоль), полученной в вышеупомянутом (5), бис(трифенилфосфин)палладий(II)дихлорида (0,098 г, 0,139 ммоль) и йодид меди (I) (0,053 г, 0,28 ммоль) в N,N-диметилформамиде (5,0 мл) добавляли триэтиламин (0,39 мл, 2,8 ммоль) и этинилбензол (0,51 мл, 4,6 ммоль), и смесь перемешивали при 65°C в течение 2,5 часов. К реакционной смеси добавляли воду и этилацетат. После перемешивания в течение 1 часа, нерастворимое вещество удаляли фильтрованием через целит и фильтрат элюировали этилацетатом. Фильтрат разделяли, и органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=5/1-4/1) с получением указанного в заголовке соединения (0,45 г, выход 98%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 3,40 (3H, с), 4,17 (3H, с), 5,14 (2H, с), 7,34-7,39 (3H, м), 7,42-7,47 (2H, м), 7,50-7,59 (3H, м), 7,62-7,67 (2H, м), 8,50-8,55 (2H, м).
[0408]
(7) 2-[4-метокси-6-(4-фенилэтинилфенил)-1,3,5-триазин-2-ил]-3-трифторметилфенол
[0409]
[0410]
В атмосфере аргона к раствору 2-метокси-4-(2-метоксиметокси-6-трифторметилфенил)-6-(4-фенилэтинилфенил)-1,3,5-триазина (0,45 г, 0,92 ммоль), полученного в вышеупомянутом (6), в метаноле (4,5 мл) добавляли 1,4-диоксан (4,5 мл) и метансульфоновую кислоту (0,030 мл, 0,46 ммоль) при комнатной температуре. Смесь перемешивали при 70°C в течение 5 часов, и триэтиламин (0,13 мл, 0,92 ммоль) добавляли к реакционной смеси при комнатной температуре. К реакционной смеси добавляли воду (45 мл), и смесь перемешивали в течение 30 минут. Выпавшее в осадок твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения (0,38 г, выход 93%).
1H-ЯМР (400 МГц, CDCl3) δ: 4,23 (3H, с), 7,25-7,30 (1H, м), 7,36-7,40 (3H, м), 7,43-7,47 (1H, м), 7,50-7,60 (3H, м), 7,67-7,72 (2H, м), 8,48-8,52 (2H, м), 12,43 (1H, ушир.с)
[0411]
(8) 2-метокси-4-[2-(6-метилпиридин-2-илметокси)-6-трифторметилфенил]-6-(4-фенилэтинилфенил)-1,3,5-триазин
[0412]
[0413]
В атмосфере аргона к раствору 2-[4-метокси-6-(4-фенилэтинилфенил)-1,3,5-триазин-2-ил]-3-трифторметилфенола (0,24 г, 0,54 ммоль), полученного в вышеупомянутом (7), 6-метил-2-пиридинметанола (0,099 г, 0,80 ммоль) и трифенилфосфина (0,21 г, 0,80 ммоль) в тетрагидрофуране (6,0 мл) добавляли бис(2-метоксиэтил)азодикарбоксилат (0,19 г, 0,80 ммоль) в 3 порции при охлаждении льдом. Реакционную смесь перемешивали в течение 20 минут и при комнатной температуре в течение 20 часов. После этого, к реакционной смеси добавляли 6-метил-2-пиридинметанол (0,099 г, 0,80 ммоль) и трифенилфосфин (0,21 г, 0,80 ммоль), и бис(2-метоксиэтил) азодикарбоксилат (0,19 г, 0,80 ммоль) в 2 порции при охлаждении льдом. После перемешивания в течение 20 минут, реакционную смесь перемешивали в течение 10 минут при комнатной температуре. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/3) с получением указанного в заголовке соединения (0,28 г, выход 95%).
1H-ЯМР (400 МГц, CDCl3) δ: 2,51 (3H, с), 4,17 (3H, с)5,21 (2H, с), 6,96-7,01 (1H, м), 7,02-7,07 (1H, м), 7,20-7,25 (1H, м), 7,33-7,42 (5H, м), 7,47-7,59 (3H, м), 7,62-7,68 (2H, м), 8,52-8,57 (2H, м).
[0414]
(9) 4-[2-(6-метилпиридин-2-илметокси)-6-трифторметилфенил]-6-(4-фенилэтинилфенил)-1,3,5-триазин-2-ол
[0415]
[0416]
В атмосфере аргона, к суспензии 2-метокси-4-[2-(6-метилпиридин-2-илметокси)-6-трифторметилфенил]-6-(4-фенилэтинилфенил)-1,3,5-триазина (0,28 г, 0,52 ммоль), полученного в вышеупомянутом (8), в метаноле (4,6 мл) добавляли 4M водный раствор гидроксида натрия (0,77 мл, 3,1 ммоль) и тетрагидрофуран (0,46 мл) при комнатной температуре. При 65°C, реакционную смесь перемешивали в течение 3,5 часов. К реакционной смеси добавляли 10% мас. водного раствора лимонной кислоты (3,2 мл) и воду (16 мл) при комнатной температуре, и смесь перемешивали в течение 30 минут. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,27 г, выход 95%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 2,43 (3H, с), 5,31 (2H, с), 7,07-7,17 (2H, м), 7,43-7,49 (3H, м), 7,50-7,68 (5H, м), 7,69-7,82 (3H, м), 8,32-8,38 (2H, м), 13,63 (1H, ушир. с).
[0417]
(10) гидрохлорид 4-[2-(6-метилпиридин-2-илметокси)-6-трифторметилфенил]-6-(4-фенилэтинилфенил)-1,3,5-триазин-2-ола (Пример No.2-98)
[0418]
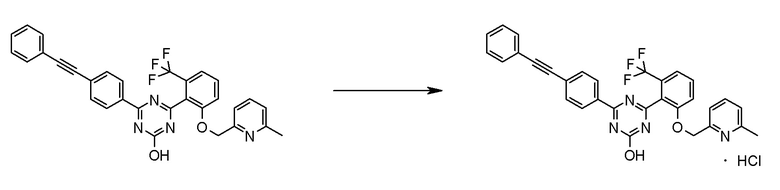
[0419]
В атмосфере аргона к раствору 4-[2-(6-метилпиридин-2-илметокси)-6-трифторметилфенил]-6-(4-фенилэтинилфенил)-1,3,5-триазин-2-ола (0,27 г, 0,49 ммоль), полученного в вышеупомянутом (9), в 1,4-диоксане (5,3 мл) добавляли 4 M раствора хлористый водород/1,4-диоксан (0,37 мл, 1,5 ммоль) при комнатной температуре. К реакционной смеси добавляли н-гексан (21 мл), и смесь перемешивали в течение 30 минут. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали н-гексаном и сушили при пониженном давлении с получением указанного в заголовке соединения (0,26 г, выход 91%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 2,48 (3H, с), 5,37 (2H, с), 7,23 (1H, д, J=7,3 Гц), 7,28 (1H, д, J=7,3 Гц), 7,48-7,45 (3H, м), 7,56 (1H, д, J=7,9 Гц), 7,64-7,59 (2H, м), 7,67 (1H, д, J=8,6 Гц), 7,82-7,72 (4H, м), 8,35 (2H, дд, J=6,8, 2,0 Гц).
[0420]
[Пример получения 6]
Синтез 2-[4-хлор-2-метил-5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензилокси]тетрагидропирана
[0421]
(1) 4-хлор-5-иод-2-метилбензойная кислота
[0422]
[0423]
В атмосфере аргона, к 4-хлор-2-метилбензойной кислоте (1,9 г, 11 ммоль) добавляли концентрированную серную кислоту (16 мл) и N-йодсукцинимид (2,7 г, 12 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь осторожно выливали в ледяную воду и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (3,3 г, выход 99%).
1H-ЯМР (CDCl3) δ: 2,58 (3H, с), 7,38 (1H, ушир. с), 8,50 (1H, с).
[0424]
(2) (4-хлор-5-иод-2-метилфенил)метанол
[0425]
[0426]
В атмосфере аргона к раствору 4-хлор-5-иод-2-метилбензойной кислоты (2,4 г, 8,1 ммоль) в тетрагидрофуране (12 мл) добавляли триэтиламин (1,2 мл, 8,9 ммоль) и изобутилхлорформиат (1,2 мл, 8,9 ммоль) при охлаждении льдом, и смесь перемешивали в течение 30 минут. При комнатной температуре, нерастворимое вещество удаляли фильтрацией и промывали тетрагидрофураном (36 мл). Фильтрат добавляли по каплям к раствору полученного боргидрида натрия (0,92 г, 24 ммоль) в воде (4,5 мл) в течение 10 мин при охлаждении льдом. После перемешивания при комнатной температуре в течение 2 часов, к реакционной смеси добавляли боргидрид натрия (0,30 г, 8,1 ммоль), и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: хлороформ/этилацетат=100/0-95/5) с получением указанного в заголовке соединения (2,0 г, выход 88%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,60 (1H, т, J=5,7 Гц), 2,26 (3H, с), 4,63 (2H, д, J=5,6 Гц), 7,25-7,26 (1H, м), 7,84 (1H, ушир.с).
[0427]
(3) 2-(4-хлор-5-иод-2-метилбензилокси)тетрагидропиран
[0428]
[0429]
В атмосфере аргона к раствору (4-хлор-5-иод-2-метилфенил)метанола (2,0 г, 7,1 ммоль), полученного в вышеупомянутом (1), в хлороформе (20 мл) добавляли пиридиния п-толуолсульфонат (0,27 мг, 1,1 ммоль) и 3,4-дигидро-2H-пиран (0,97 мл, 11 ммоль) при комнатной температуре, и смесь перемешивали в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=9/1) с получением указанного в заголовке соединения (2,6 г, выход 99%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,51-1,92 (6H, м), 2,26 (3H, с), 3,52-3,59 (1H, м), 3,85-3,91 (1H, м), 4,38 (1H, д, J=12,6 Гц), 4,67-4,72 (2H, м), 7,25 (1H, ушир.с), 7,82 (1H, ушир. с).
[0430]
(4) 2-[4-хлор-2-метил-5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензилокси]тетрагидропиран
[0431]
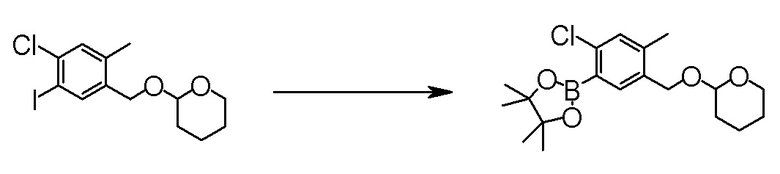
[0432]
В атмосфере аргона к раствору 2-(4-хлор-5-иод-2-метилбензилокси)тетрагидропирана (2,3 г, 6,2 ммоль), полученного в вышеупомянутом (2), в 1,4-диоксане (23 мл) добавляли бифенил-2-ил-дициклогексилфосфин (0,43 г, 1,2 ммоль), ацетат палладия (II) (0,070 г, 0,31 ммоль), триэтиламин (3,4 мл, 25 ммоль) и 4,4,5,5-тетраметил-1,3,2-диоксаборолан (2,7 мл, 18 ммоль) при комнатной температуре, и смесь перемешивали при 80°C в течение 5 часов. При охлаждении льдом, к реакционной смеси добавляли по каплям воду, и добавляли этилацетат. После разделения, органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=98/2-80/20) с получением указанного в заголовке соединения (1,3 г, выход 60%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,36 (12H, с), 1,47-1,90 (6H, м), 2,34 (3H, с), 3,52-3,59 (1H, м), 3,88-3,95 (1H, м), 4,42 (1H, д, J=11,6 Гц), 4,67 (1H, т, J=3,5 Гц), 4,74 (1H, д, J=11,6 Гц), 7,18 (1H, ушир. с), 7,63 (1H, ушир.с).
[0433]
[Пример получения 7]
Синтез трет-бутил-(4-хлор-3-иод-2-метилбензилокси)диметилсилана
[0434]
(1) 3-(трет-бутил-диметилсиланилоксиметил)-6-хлор-2-метилфениламин
[0435]
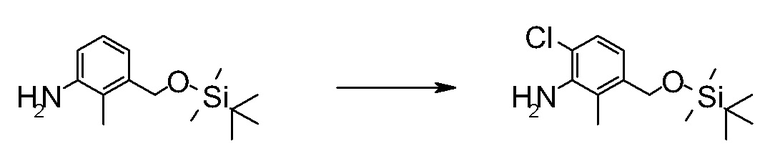
[0436]
В атмосфере аргона, к раствору 3-(трет-бутил-диметилсиланилоксиметил)-2-метил-фениламина (0,91 г, 3,6 ммоль) в тетрагидрофуране (5,0 мл) добавляли N-хлорсукцинимид (0,48 г, 3,6 ммоль) при комнатной температуре. После перемешивания в течение 22 часов, к реакционной смеси добавляли н-гексан (10 мл) и нерастворимое вещество отфильтровывали. Фильтрат концентрировали и очищали с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат=20/1) с получением указанного в заголовке соединения (0,18 г, выход 17%).
1H-ЯМР(400 МГц, CDCl3)δ:0,08 (6H, с), 0,92 (9H, с), 2,11 (3H, с), 4,01 (2H, ушир. с), 4,60-4,69 (2H, м), 6,77 (1H, д, J=8,4 Гц), 7,11 (1H, д, J=8,4 Гц).
[0437]
(2) трет-бутил-(4-хлор-3-иод-2-метилбензилокси)диметилсилан
[0438]
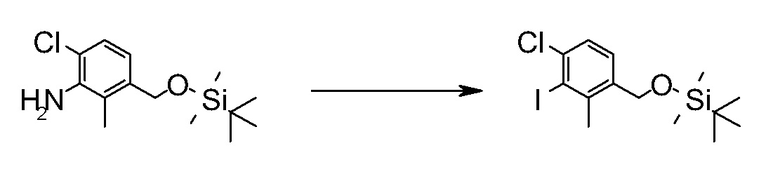
[0439]
В атмосфере аргона, к раствору 3-(трет-бутил-диметилсиланилоксиметил)-6-хлор-2-метилфениламина (0,18 г, 0,63 ммоль), полученного в вышеупомянутом (1), в ацетонитриле (2,0 мл) добавляли йод (0,19 г, 0,76 ммоль) и трет-бутилнитрит (0,11 мл, 0,94 ммоль) при комнатной температуре, и смесь перемешивали при 65°C в течение 30 минут. При комнатной температуре, к реакционной смеси добавляли воду и этилацетат. После разделения, органический слой промывали насыщенным водным раствором гидрокарбоната натрия, 10% масс. водного раствора тиосульфата натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия, и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=40/1) с получением указанного в заголовке соединения (0,099 г, выход 40%).
1H-ЯМР(400 МГц, CDCl3)δ:0,10 (6H, с), 0,93 (9H, с), 2,47 (3H, с), 4,68 (2H, с), 7,30 (1H, д, J=8,4 Гц), 7,35 (1H, д, J=8,1 Гц).
[0440]
[Пример получения 8]
Синтез 2-(6-хлор-2-метоксиметокси-3-метилфенил)-4,4,5,5-тетраметил[1,3,2]диоксаборолана
[0441]
(1) 4-хлор-2-метоксиметокси-1-метилбензол
[0442]
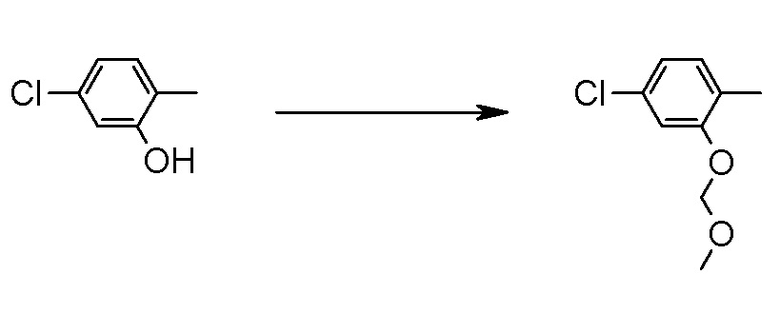
[0443]
В атмосфере аргона к раствору 5-хлор-2-метилфенола (1,0 г, 7,0 ммоль) в N,N-диметилформамиде (20 мл) добавляли гидрид натрия (0,34 г, 60% масс. дисперсия в масле) при охлаждении льдом. После перемешивания в течение 15 минут, смесь перемешивали при комнатной температуре в течение 30 минут. При охлаждении льдом, добавляли хлорметилметиловый эфир (0,64 мл, 8,4 ммоль), и смесь перемешивали в течение 30 минут. К реакционной смеси добавляли воду и диэтиловый эфир, и смесь разделяли при комнатной температуре. Органический слой промывали водой, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: н-гексан/диэтиловый эфир=25/1) с получением указанного в заголовке соединения (1,3 г, выход 96%).
1H-ЯМР(400 МГц, CDCl3)δ:2,20 (3H, с), 3,48 (3H, с), 5,18 (2H, с), 6,89 (1H, дд, J=7,9, 2,0 Гц), 7,03-7,07 (2H, м).
[0444]
(2) 2-(6-хлор-2-метоксиметокси-3-метилфенил)-4,4,5,5-тетраметил[1,3,2]диоксаборолан
[0445]
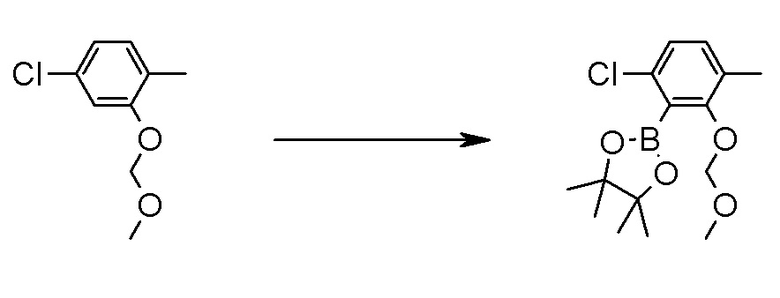
[0446]
В атмосфере аргона к раствору 4-хлор-2-метоксиметокси-1-метилбензола (0,75 г, 4,0 ммоль), полученного в вышеупомянутом (1), в тетрагидрофуране (20 мл) добавляли по каплям н-бутиллитий (1,6 М раствор н-гексана, 2,5 мл, 4,0 ммоль) при температуре -78°C в течение 5 минут. После перемешивания в течение 30 минут, добавляли 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан (0,81 мл, 4,0 ммоль). После перемешивания в течение 2 часов, перемешивание прекращали, и смесь нагревали до комнатной температуры. Через 13 часов, к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и этилацетат, и смесь разделяли. После этого органический слой промывали водой, промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=12/1) с получением указанного в заголовке соединения (0,20 г, выход 15%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,40 (12H, с), 2,27 (3H, с), 3,55 (3H, с), 5,03 (2H, с), 7,01 (1H, д, J=8,2 Гц), 7,07-7,11 (1H, м).
[0447]
[Пример получения 9]
Синтез N-{4-хлор-3-[4-(4-изобутилфенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-2,2-диметилпропионамида (Пример No.1-51)
[0448]
[0449]
(1) 2-хлор-4-(4-изобутилфенил)-6-метокси-1,3,5-триазин
[0450]
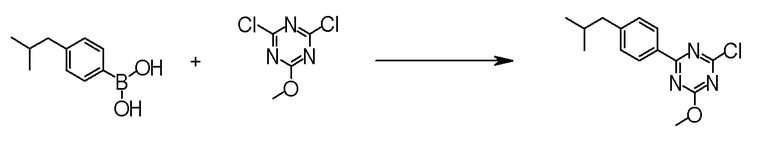
[0451]
В атмосфере аргона суспензию 4-(2-метилпропил)фенилбороновой кислоты (35 г, 200 ммоль), 2,4-дихлор-6-метокси-1,3,5-триазина (46 г, 260 ммоль), тетракис(трифенилфосфин)палладия(0) (2,3 г, 2,0 ммоль) и карбоната натрия (63 г, 590 ммоль) в толуоле (280 мл) и дистиллированной воде (280 мл) перемешивали при температуре 70°C в течение 3,5 часов. При комнатной температуре, к реакционной смеси добавляли воду, этилацетат и н-гексан, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения (60 г) в виде сырого продукта.
[0452]
(2) {4-хлор-3-[4-(4-изобутилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанол
[0453]
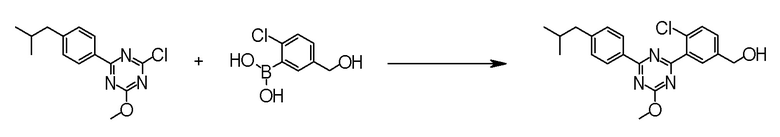
[0454]
В атмосфере аргона суспензию сырого продукта (60 г) 2-хлор-4-(4-изобутилфенил)-6-метокси-1,3,5-триазина, полученного в вышеупомянутом (1), 2-хлор-5-гидроксиметилфенилбороновой кислоты (44 г, 240 ммоль), аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (3,2 г, 3,9 ммоль) и фторида цезия (90 г, 590 ммоль) в ацетонитриле (440 мл) и дистиллированной воды (130 мл) перемешивали при 67°C в течение 2 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали водой, и органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=7/3-6/4) с получением указанного в заголовке соединения (57 г).
1H-ЯМР (CDCl3) δ: 0,93 (6H, д, J=6,6 Гц), 1,77 (1H, т, J=6,1 Гц), 1,90-1,97 (1H, м), 2,57 (2H, д, J=7,3 Гц), 4,21 (3H, с), 4,77 (2H, д, J=6,1 Гц), 7,29 (2H, д, J=8,3 Гц), 7,47 (1H, дд, J=8,3, 2,1 Гц), 7,54 (1H, д, J=8,3 Гц), 8,01 (1H, д, J=2,1 Гц), 8,51 (2H, д, J=8,3 Гц).
[0455]
(3) трет-бутил N-{4-хлор-3-[4-(4-изобутилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамат
[0456]
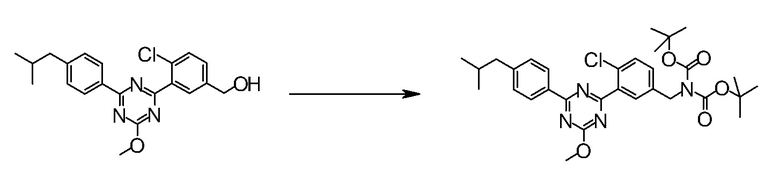
[0457]
В атмосфере аргона к раствору {4-хлор-3-[4-(4-изобутилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанола (0,25 г, 0,64 ммоль), полученного в вышеупомянутом (2), и трифенилфосфина (0,25 г, 0,96 ммоль) в хлороформе (2,4 мл) добавляли четырехбромистый углерод (0,32 г, 0,96 ммоль) при охлаждении льдом. Реакционную смесь перемешивали при комнатной температуре в течение 10 минут. Реакционную смесь подвергали колоночной хроматографии на силикагеле (элюент: н-гексан/этилацетат=30/1-10/1), и концентрировали при пониженном давлении. Раствор остатка в N,N-диметилформамиде (2,0 мл) добавляли к раствору ди-трет-бутил-иминодикарбоксилата (0,140 г, 0,64 ммоль) и гидрида натрия (0,026 г, 60% масс. дисперсия в масле) в N,N-диметилформамиде (1,0 мл) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 15 минут. В реакционную смесь добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали водой, и органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=6/1) с получением указанного в заголовке соединения (0,27 г, выход 72%).
1H-ЯМР (CDCl3) δ: 0,93 (6H, д, J=6,6 Гц), 1,47 (18H, с), 1,88-1,98 (1H, м), 2,57 (2H, д, J=7,3 Гц), 4,19 (3H, с), 4,83 (2H, с), 7,28 (2H, д, J=8,4 Гц), 7,39 (1H, дд, J=8,4, 2,3 Гц), 7,48 (1H, д, J=8,4 Гц), 8,00 (1H, д, J=2,3 Гц), 8,50 (2H, dt, J=8,4, 1,8 Гц).
[0458]
(4) гидрохлорид 4-хлор-3-[4-(4-изобутилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина
[0459]
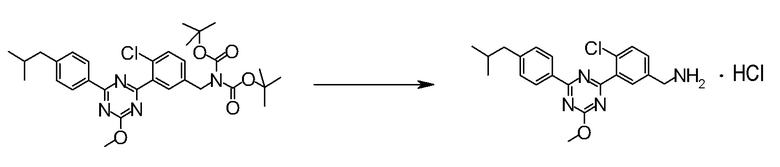
[0460]
В атмосфере аргона, к трет-бутил N-{4-хлор-3-[4-(4-изобутилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамату (0,27 г, 0,46 ммоль), полученному в вышеупомянутом (3), добавляли 4 M раствора хлористый водород/1,4-диоксан (2,0 мл) при комнатной температуре, и смесь перемешивали в течение 30 минут. Твердое вещество собирали фильтрацией из суспензии, и сушили при пониженном давлении с получением указанного в заголовке соединения (0,16 г).
[0461]
(5) N-{4-хлор-3-[4-(4-изобутилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-2,2-диметилпропионамид
[0462]
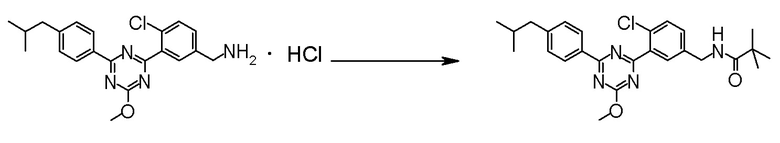
[0463]
В атмосфере аргона к раствору сырого продукта (0,035 г) гидрохлорида 4-хлор-3-[4-(4-изобутилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина, полученного в вышеупомянутом (4), HOBt・H2O (0,019 г, 0,12 ммоль) и WSC・HCl (0,024 г, 0,13 ммоль) в N,N-диметилформамиде (1,0 мл) добавляли 2,2-диметилпропионовую кислоту (0,014 мл, 0,12 ммоль) и триэтиламин (0,035 мл, 0,25 ммоль) при комнатной температуре, и смесь перемешивали в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным гидрокарбонатом натрия, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/2) с получением указанного в заголовке соединения (0,030 г).
1H-ЯМР (CDCl3) δ: 0,93 (6H, д, J=6,6 Гц), 1,24 (9H, с), 1,88-1,99 (1H, м), 2,57 (2H, д, J=7,1 Гц), 4,20 (3H, с), 4,50 (2H, д, J=6,0 Гц), 5,98 (1H, ушир. с), 7,29 (2H, д, J=8,3 Гц), 7,36 (1H, дд, J=8,2, 2,3 Гц), 7,51 (1H, д, J=8,2 Гц), 7,92 (1H, д, J=2,3 Гц), 8,50 (2H, д, J=8,3 Гц).
[0464]
(6) N-{4-хлор-3-[4-гидрокси-6-(4-изобутилфенил)-1,3,5-триазин-2-ил]бензил}-2,2-диметилпропионамид (Пример No.1-51)
[0465]
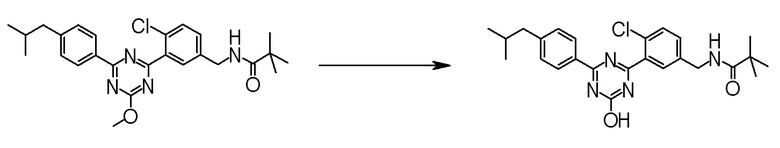
[0466]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(4-изобутилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-2,2-диметилпропионамида (0,030 г, 0,064 ммоль), полученного в вышеупомянутом (5), в метаноле (10 мл) добавляли 4 M водного раствора гидроксида натрия (0,096 мл) при комнатной температуре, и смесь перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли 10% водный раствор лимонной кислоты (0,38 мл) и воды (2,3 мл) при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,026 г, выход 90%). Суспензию указанного в заголовке соединения (0,030 г) в DME (0,60 мл) перемешивали при комнатной температуре, и твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения в виде кристаллов (0,026 г).
[0467]
[Пример получения 10]
Синтез N-{4-хлор-3-[4-(3-фтор-4-метилфенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-81)
[0468]
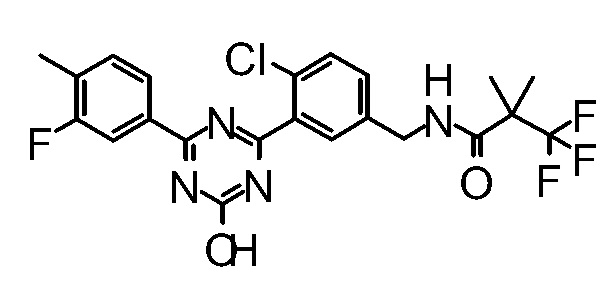
[0469]
(1) 2-хлор-4-(3-фтор-4-метилфенил)-6-метокси-1,3,5-триазин
[0470]
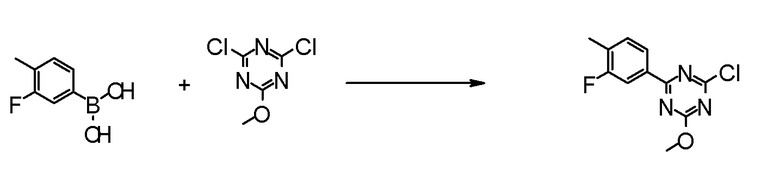
[0471]
В атмосфере аргона, к суспензии 3-фтор-4-метилфенилбороновой кислоты (0,43 г, 2,8 ммоль), 2,4-дихлор-6-метокси-1,3,5-триазина (1,0 г, 5,6 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,16 г, 0,14 ммоль) в толуоле (8 мл) добавляли 2М водного раствора трикалийфосфата (4,0 мл) при комнатной температуре, и смесь перемешивали при 100°C в течение 3 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали водой, разделяли, промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: н-гексан/хлороформ=2/3-1/2) с получением указанного в заголовке соединения (0,58 г, выход 81%).
1H-ЯМР (CDCl3) δ: 2,37 (3H, д, J=2,1 Гц), 4,17 (3H, с), 7,32 (1H, т, J=7,9 Гц), 8,12 (1H, дд, J=10,7, 1,7 Гц), 8,19 (1H, дд, J=7,9, 1,7 Гц).
[0472]
(2) {4-хлор-3-[4-(3-фтор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанол
[0473]
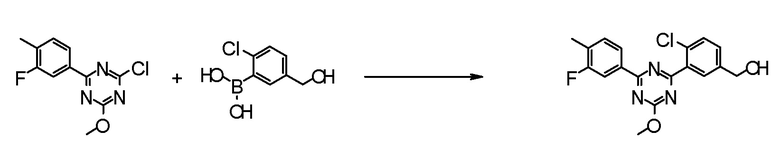
[0474]
В атмосфере аргона к раствору 2-хлор-4-(3-фтор-4-метилфенил)-6-метокси-1,3,5-триазина (0,58 г, 2,3 ммоль), полученного в вышеупомянутом (1), 2-хлор-5-гидроксиметилфенилбороновой кислоты (0,51 г, 2,7 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,18 г, 0,23 ммоль) в 1,4-диоксане (9,0 мл) добавляли 2М водного раствора карбоната натрия (4,5 мл), и смесь перемешивали при 100°C в течение 2 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/3) с получением указанного в заголовке соединения (0,44 г, выход 53%).
1H-ЯМР (CDCl3) δ: 1,76 (1H, т, J=5,8 Гц), 2,37 (3H, д, J=1,9 Гц), 4,21 (3H, с), 4,78 (2H, д, J=5,8 Гц), 7,33 (1H, т, J=7,9 Гц), 7,47 (1H, дд, J=8,1, 2,2 Гц), 7,54 (1H, д, J=8,1 Гц), 8,02 (1H, д, J=2,2 Гц), 8,23 (1H, дд, J=10,7, 1,6 Гц), 8,29 (1H, дд, J=7,9, 1,6 Гц).
[0475]
(3) трет-бутил N-{4-хлор-3-[4-(3-фтор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамат
[0476]
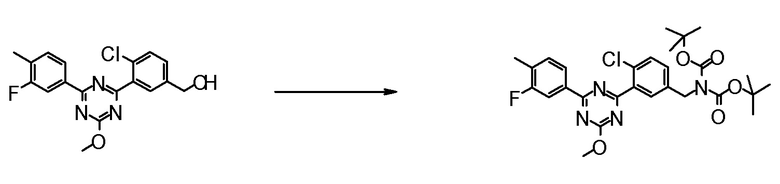
[0477]
В атмосфере аргона к раствору {4-хлор-3-[4-(3-фтор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанола (0,44 г, 1,2 ммоль), полученного в вышеупомянутом (2), в тетрагидрофуране (13 мл) добавляли триэтиламин (0,22 мл, 1,6 ммоль) и метансульфонилхлорид (0,10 мл, 1,3 ммоль) при охлаждении льдом, и смесь перемешивали в течение 0,5 часа. Реакционную смесь добавляли к ди-трет-бутил-иминодикарбоксилату (0,32 г, 1,5 ммоль) и карбонату цезия (1,2 г, 3,6 ммоль) в N,N-диметилформамиде (3,0 мл) при комнатной температуре, и полученную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=6/1) с получением указанного в заголовке соединения (0,64 г, выход 94%).
1H-ЯМР (CDCl3) δ: 1,48 (18H, с), 2,37 (3H, д, J=1,6 Гц), 4,19 (3H, с), 4,83 (2H, с), 7,31 (1H, т, J=7,9 Гц), 7,40 (1H, дд, J=8,4, 2,3 Гц), 7,49 (1H, д, J=8,4 Гц), 8,00 (1H, д, J=2,3 Гц), 8,22 (1H, дд, J=10,7, 1,6 Гц), 8,28 (1H, дд, J=7,9, 1,6 Гц).
[0478]
(4) гидрохлорид 4-хлор-3-[4-(3-фтор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина
[0479]
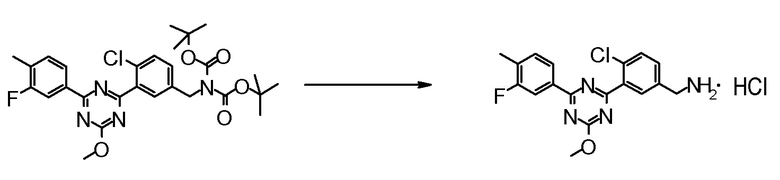
[0480]
В атмосфере аргона к раствору трет-бутил N-{4-хлор-3-[4-(3-фтор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамата (0,64 г, 1,1 ммоль), полученного в вышеупомянутом (3), в 1,4-диоксане (2,0 мл) добавляли 4 M раствора хлористый водород/1,4-диоксан (6,0 мл) при комнатной температуре, и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли н-гексан (32 мл), и смесь перемешивали в течение 45 минут. Твердое вещество собирали фильтрацией из суспензии, и сушили при пониженном давлении с получением указанного в заголовке соединения (0,45 г, выход 99%).
1H-ЯМР (ДМСО-D6) δ: 2,36 (3H, д, J=1,4 Гц), 4,13-4,19 (2H, м), 4,17 (3H, с), 7,55 (1H, т, J=8,0 Гц), 7,71 (1H, дд, J=8,1, 2,1 Гц), 7,75 (1H, д, J=8,1 Гц), 8,16-8,20 (2H, м), 8,27 (1H, дд, J=7,9, 1,6 Гц), 8,38 (3H, ушир. с).
[0481]
(5) N-{4-хлор-3-[4-(3-фтор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид
[0482]
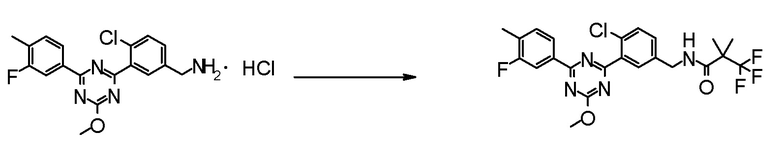
[0483]
В атмосфере аргона к раствору гидрохлорида 4-хлор-3-[4-(3-фтор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина (0,070 г, 0,18 ммоль), полученного в вышеупомянутом (4), HOBt・H2O (0,041 г, 0,27 ммоль) и 3,3,3-трифтор-2,2-диметилпропионовой кислоты (0,042 г, 0,27 ммоль) в N,N-диметилформамиде (1,0 мл) добавляли WSC・HCl (0,051 г, 0,27 ммоль) и триэтиламин (0,037 мл, 0,027 ммоль) при комнатной температуре, и смесь перемешивали в течение 1,5 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия, промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=2/1) с получением указанного в заголовке соединения (0,080 г, выход 90%).
1H-ЯМР (CDCl3) δ: 1,45 (6H, с), 2,37 (3H, д, J=1,9 Гц), 4,20 (3H, с), 4,55 (2H, д, J=5,8 Гц), 6,23 (1H, ушир. с), 7,30-7,37 (2H, м), 7,52 (1H, д, J=8,4 Гц), 7,93 (1H, д, J=2,3 Гц), 8,22 (1H, дд, J=10,7, 1,6 Гц), 8,28 (1H, дд, J=7,9, 1,6 Гц).
[0484]
(6) N-{4-хлор-3-[4-(3-фтор-4-метил-фенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-81)
[0485]
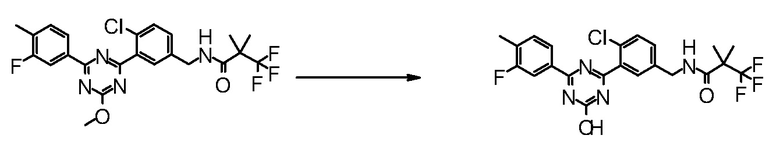
[0486]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(3-фтор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,077 г, 0,16 ммоль), полученного в вышеупомянутом (5), в метаноле (1,4 мл) добавляли 4 M водного раствора гидроксида натрия (0,23 мл) при комнатной температуре, и смесь перемешивали при 60°C в течение 2 часов. К реакционной смеси добавляли 10% водный раствор лимонной кислоты (0,070 мл) и воду при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,070 г, выход 92%).
[0487]
[Пример получения 11]
Синтез N-{4-хлор-3-[4-гидрокси-6-(4-изопропилфенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-98)
[0488]
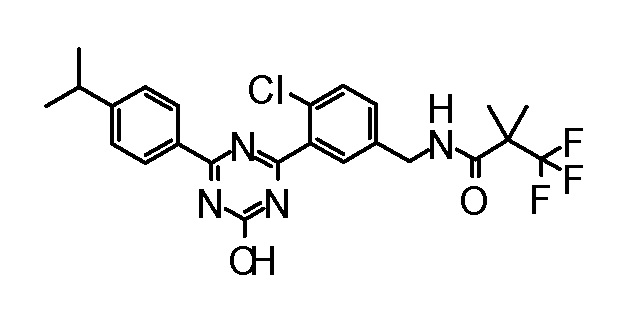
[0489]
(1) 2-хлор-4-(4-изопропилфенил)-6-метокси-1,3,5-триазин
[0490]
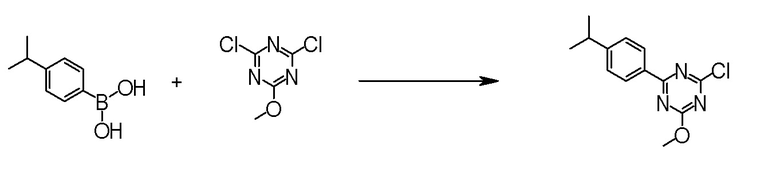
[0491]
В атмосфере аргона, к суспензии 4-изопропилфенилбороновой кислоты (0,30 г, 1,7 ммоль), 2,4-дихлор-6-метокси-1,3,5-триазина (0,23 г, 1,4 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,11 г, 0,14 ммоль) в 1,4-диоксане (4,0 мл) добавляли 2М водного раствора карбоната натрия (2,0 мл) при комнатной температуре, и смесь перемешивали при 100°C в течение 1,5 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=20/1) с получением указанного в заголовке соединения (0,21 г, выход 57%).
1H-ЯМР (CDCl3) δ: 1,29 (6H, д, J=7,1 Гц), 2,99-3,02 (1H, м), 4,16 (3H, с), 7,34-7,38 (2H, м), 8,39-8,43 (2H, м).
[0492]
(2) {4-хлор-3-[4-(4-изопропилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанол
[0493]
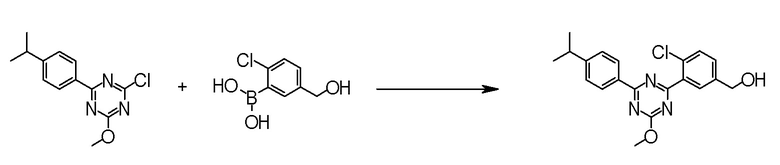
[0494]
В атмосфере аргона, к суспензии 2-хлор-4-(4-изопропилфенил)-6-метокси-1,3,5-триазина (0,21 г), полученного в вышеупомянутом (1), 2-хлор-5-гидроксиметилфенилбороновой кислоты (0,15 г, 0,80 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,066 г, 0,080 ммоль) в 1,4-диоксане (2,4 мл) добавляли 2М водного раствора карбоната натрия (1,2 мл) при комнатной температуре, и смесь перемешивали при 100°C в течение 2 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали водой, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=5/3) с получением указанного в заголовке соединения (0,15 г, выход 51%).
1H-ЯМР (CDCl3) δ: 1,30 (6H, д, J=7,1 Гц), 1,77 (1H, т, J=6,1 Гц), 2,95-3,07 (1H, м), 4,20 (3H, с), 4,77 (2H, д, J=6,1 Гц), 7,35-7,39 (2H, м), 7,46 (1H, дд, J=8,2, 2,2 Гц), 7,54 (1H, д, J=8,2 Гц), 8,01 (1H, дд, J=2,2, 0,4 Гц), 8,50-8,54 (2H, м).
[0495]
(3) трет-бутил N-{4-хлор-3-[4-(4-изопропилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамат
[0496]
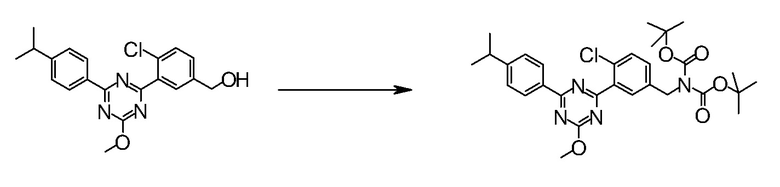
[0497]
В атмосфере аргона к раствору {4-хлор-3-[4-(4-изопропилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанола (0,15 г, 0,41 ммоль), полученного в вышеупомянутом (2), и трифенилфосфина (0,16 г, 0,62 ммоль) в хлороформе (1,5 мл) добавляли четырехбромистый углерод (0,20 г, 0,62 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 10 минут. Реакционную смесь наносили на хроматографическую колонку с силикагелем (элюент: н-гексан/этилацетат=30/1-10/1) и концентрировали при пониженном давлении.
Раствор остатка в N,N-диметилформамиде (1,5 мл) добавляли к раствору ди-трет-бутил-иминодикарбоксилата (0,089 г, 0,41 ммоль) и гидрида натрия (0,016 г, 60% масс. дисперсия в масле) в N,N-диметилформамиде (0,70 мл) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 15 минут. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали водой, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=5/1) с получением указанного в заголовке соединения (0,20 г, выход 85%).
1H-ЯМР (CDCl3) δ: 1,30 (6H, д, J=7,0 Гц), 1,47 (18H, с), 2,94-3,05 (1H, м), 4,19 (3H, с), 4,83 (2H, с), 7,34-7,41 (3H, м), 7,48 (1H, д, J=8,4 Гц), 8,00 (1H, д, J=2,3 Гц), 8,49-8,53 (2H, м).
[0498]
(4) гидрохлорид 4-хлор-3-[4-(4-изопропилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина
[0499]
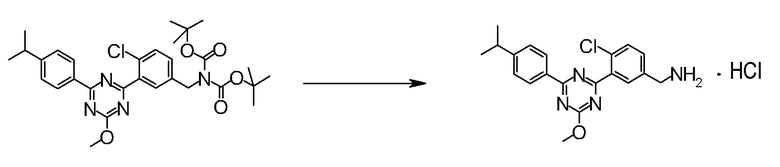
[0500]
В атмосфере аргона, к трет-бутил N-{4-хлор-3-[4-(4-изопропилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамату (0,20 г, 0,35 ммоль), полученному в вышеупомянутом (3), добавляли 4 M раствора хлористый водород/1,4-диоксан (2,0 мл) при комнатной температуре, и полученную смесь перемешивали в течение 1 часа. Суспензию концентрировали при пониженном давлении, и подвергали азеотропной перегонке с этилацетатом (дважды) с получением указанного в заголовке соединения в виде сырого продукта (0,14 г).
[0501]
(5) N-{4-хлор-3-[4-(4-изопропилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид
[0502]
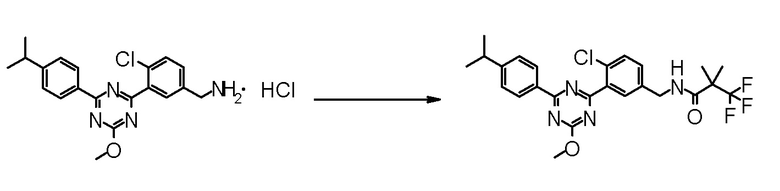
[0503]
В атмосфере аргона к раствору сырого продукта (0,10 г) гидрохлорида 4-хлор-3-[4-(4-изопропилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина, полученного в вышеупомянутом (4), HOBt・H2O (0,052 г, 0,34 ммоль) и WSC・HCl (0,066 г, 0,34 ммоль) в N,N-диметилформамиде (1,0 мл) добавляли 3,3,3-трифтор-2,2-диметилпропионовую кислоту (0,042 г, 0,27 ммоль) и триэтиламин (0,069 мл, 0,49 ммоль) при комнатной температуре, и смесь перемешивали в течение 4 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1) с получением указанного в заголовке соединения (0,054 г).
1H-ЯМР (CDCl3) δ: 1,30 (6H, д, J=6,8 Гц), 1,44 (6H, с), 2,95-3,05 (1H, м), 4,18 (3H, с), 4,53 (2H, д, J=5,7 Гц), 6,34 (1H, ушир. с), 7,30-7,39 (3H, м), 7,50 (1H, д, J=8,4 Гц), 7,91 (1H, д, J=2,2 Гц), 8,49-8,53 (2H, м).
[0504]
(6) N-{4-хлор-3-[4-гидрокси-6-(4-изопропилфенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-98)
[0505]
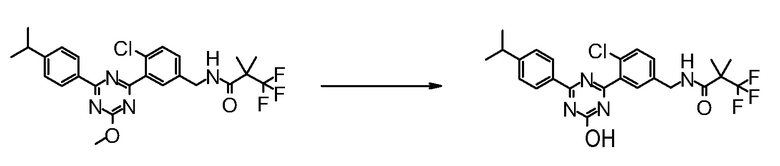
[0506]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(4-изопропилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,050 г, 0,099 ммоль), полученного в вышеупомянутом (5), в метаноле (0,50 мл) добавляли 4 M водного раствора гидроксида натрия (0,20 мл) при комнатной температуре, и смесь перемешивали при 60°C в течение 2 часов. К реакционной смеси добавляли 2 н соляной кислоты (0,40 мл) и воду при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,043 г, выход 89%).
[0507]
[Пример получения 12]
Синтез N-{4-хлор-3-[4-гидрокси-6-(4-изобутоксифенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-109)
[0508]
[0509]
(1) 2-хлор-4-(4-изобутоксифенил)-6-метокси-1,3,5-триазин
[0510]
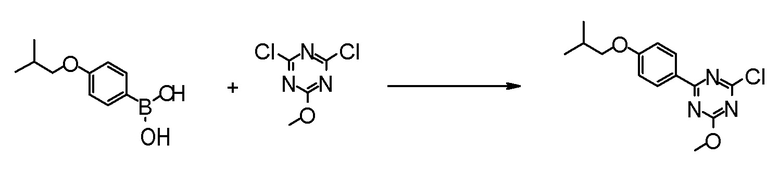
[0511]
В атмосфере аргона, к суспензии 4-изобутоксифенилбороновой кислоты (0,50 г, 2,58 ммоль), 2,4-дихлор-6-метокси-1,3,5-триазина (0,93 г, 5,15 ммоль), тетракис(трифенилфосфин)палладия(0) (0,15 г, 0,129 ммоль) и карбоната натрия (0,819 г, 7,73 ммоль) в толуоле (5,0 мл) добавляли дистиллированную воду (3,5 мл), и смесь перемешивали при температуре 86°C в течение 2 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=10/1) с получением указанного в заголовке соединения (0,606 г, выход 80%).
1H-ЯМР (CDCl3) δ: 1,05 (6H, д, J=6,7 Гц), 2,07-2,17 (1H, м), 3,81 (2H, д, J=6,5 Гц), 4,14 (3H, с), 6,95-7,00 (2H, м), 8,42-8,46 (2H, м).
[0512]
(2) {4-хлор-3-[4-(4-изобутоксифенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанол
[0513]
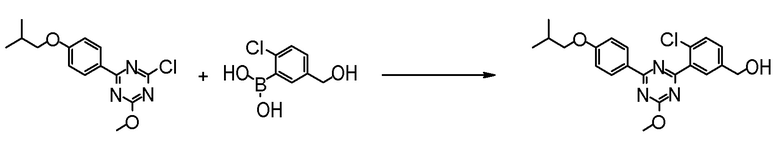
[0514]
В атмосфере аргона суспензию 2-хлор-4-(4-изобутоксифенил)-6-метокси-1,3,5-триазина (0,60 г, 2,0 ммоль), полученного в вышеупомянутом (1), 2-хлор-5-гидроксиметилфенилбороновой кислоты (0,57 г, 3,1 ммоль), аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,083 г, 0,10 ммоль) и трикалийфосфата (1,3 г, 6,1 ммоль) в N,N-диметилформамиде (6,0 мл) перемешивали при 60°C в течение 1,5 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали водой и разделяли, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия, и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/2) с получением указанного в заголовке соединения (0,32 г, выход 39%).
1H-ЯМР (CDCl3) δ: 1,05 (6H, д, J=6,7 Гц), 1,77 (1H, т, J=5,9 Гц), 2,08-2,18 (1H, м), 3,82 (2H, д, J=6,5 Гц), 4,19 (3H, с), 4,77 (2H, д, J=5,9 Гц), 6,98-7,01 (2H, м), 7,46 (1H, дд, J=8,2, 2,2 Гц), 7,53 (1H, д, J=8,2 Гц), 8,00 (1H, д, J=2,2 Гц), 8,55 (2H, м).
[0515]
(3) трет-бутил N-{4-хлор-3-[4-(4-изобутоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамат
[0516]
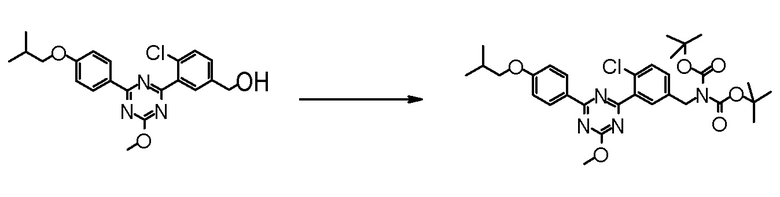
[0517]
В атмосфере аргона к раствору {4-хлор-3-[4-(4-изобутоксифенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанола (0,24 г, 0,61 ммоль), полученного в вышеупомянутом (2), в тетрагидрофуране (2,0 мл) добавляли триэтиламин (0,11 мл, 0,79 ммоль) и метансульфонилхлорид (0,052 мл, 0,67 ммоль) при охлаждении льдом, и смесь перемешивали в течение 0,5 часа. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К раствору остатка в N,N-диметилформамиде (1,5 мл) добавляли карбонат цезия (0,59 г, 1,8 ммоль) и ди-трет-бутил-иминодикарбоксилат (0,16 г, 0,73 ммоль) при комнатной температуре, и смесь перемешивали в течение 1,5 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=6/1) с получением указанного в заголовке соединения (0,34 г, выход 92%).
1H-ЯМР (CDCl3) δ: 1,05 (6H, д, J=6,7 Гц), 1,47 (18H, с), 2,08-2,18 (1H, м), 3,82 (2H, д, J=6,5 Гц), 4,18 (3H, с), 4,82 (2H, с), 6,96-7,00 (2H, м), 7,39 (1H, дд, J=8,3, 2,3 Гц), 7,48 (1H, д, J=8,3 Гц), 7,99 (1H, д, J=2,3 Гц), 8,52-8,56 (2H, м).
[0518]
(4) гидрохлорид 4-хлор-3-[4-(4-изобутоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина
[0519]

[0520]
В атмосфере аргона к раствору трет-бутил N-{4-хлор-3-[4-(4-изобутоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамата (0,34 г, 0,56 ммоль), полученного в вышеупомянутом (3), в 1,4-диоксане (1,0 мл) добавляли 4 M раствора хлористый водород/1,4-диоксан (3,0 мл) при комнатной температуре, и смесь перемешивали в течение 2,5 часов. К реакционной смеси добавляли н-гексан (20 мл), и смесь перемешивали. Твердое вещество собирали фильтрацией из суспензии, и сушили при пониженном давлении с получением указанного в заголовке соединения (0,24 г, выход 95%).
1H-ЯМР (ДМСО-D6) δ: 1,01 (6H, д, J=6,8 Гц), 2,01-2,11 (1H, м), 3,88 (2H, д, J=6,4 Гц), 4,14 (3H, с), 4,12-4,17 (2H, м), 7,12-7,15 (2H, м), 7,72 (2H, ушир. с), 8,13 (1H, ушир. с), 8,40-8,51 (5H, м).
[0521]
(5) N-{4-хлор-3-[4-(4-изобутоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид
[0522]
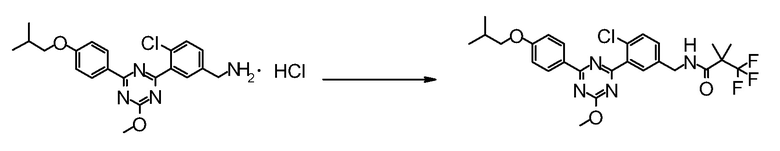
[0523]
В атмосфере аргона к раствору гидрохлорида 4-хлор-3-[4-(4-изобутоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина (0,065 г, 0,14 ммоль), полученного в вышеупомянутом (4), HOBt・H2O (0,033 г, 0,22 ммоль) и 3,3,3-трифтор-2,2-диметилпропионовой кислоты (0,034 г, 0,22 ммоль) в N,N-диметилформамиде (0,70 мл) добавляли WSC・HCl (0,042 г, 0,22 ммоль) и триэтиламин (0,030 мл, 0,22 ммоль) при комнатной температуре, и смесь перемешивали в течение 5 часов. К реакционной смеси добавляли 3,3,3-трифтор-2,2-диметилпропионовую кислоту (0,034 г, 0,22 ммоль), WSC・HCl (0,042 г, 0,22 ммоль), HOBt・H2O (0,033 г, 0,22 ммоль) и триэтиламин (0,030 мл, 0,22 ммоль), и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1) с получением указанного в заголовке соединения (0,068 г, выход 86%).
1H-ЯМР (CDCl3) δ: 1,06 (6H, д, J=6,8 Гц), 1,44 (6H, ушир. с), 2,08-2,18 (1H, м), 3,82 (2H, д, J=6,6 Гц), 4,19 (3H, с), 4,55 (2H, д, J=5,7 Гц), 6,21 (1H, ушир. с), 6,97-7,01 (2H, м), 7,34 (1H, дд, J=8,3, 2,3 Гц), 7,51 (1H, д, J=8,3 Гц), 7,91 (1H, д, J=2,3 Гц), 8,53-8,55 (2H, м).
[0524]
(6) N-{4-хлор-3-[4-гидрокси-6-(4-изобутоксифенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-109)
[0525]
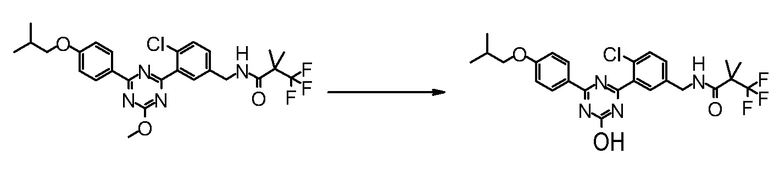
[0526]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(4-изобутоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,066 г, 0,12 ммоль), полученного в вышеупомянутом (5), в метаноле (1,1 мл) добавляли 4 M водного раствора гидроксида натрия (0,18 мл) при комнатной температуре, и смесь перемешивали при 60°C в течение 2 часов. К реакционной смеси добавляли 10% водный раствор лимонной кислоты (0,55 мл) и воду при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,057 г, выход 88%). Суспензию указанного в заголовке соединения (0,030 г) в ацетонитриле (0,60 мл) перемешивали при комнатной температуре, и твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения в виде кристаллов (0,011 г).
[0527]
[Пример получения 13]
Синтез N-{4-хлор-3-[4-гидрокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-122)
[0528]
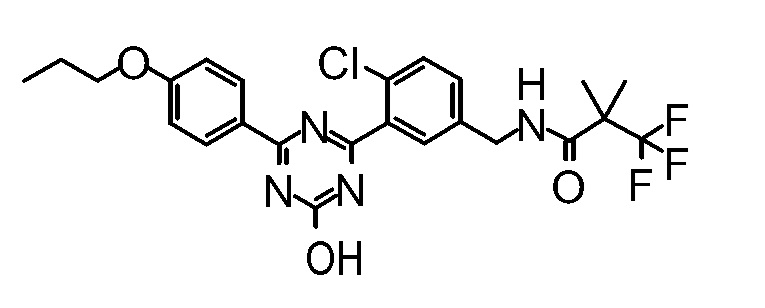
[0529]
(1) 2-хлор-4-метокси-6-(4-пропоксифенил)-1,3,5-триазин
[0530]
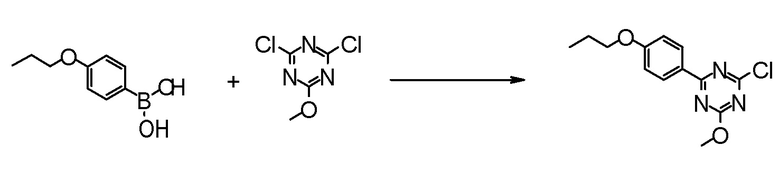
[0531]
В атмосфере аргона, к суспензии 4-пропоксифенилбороновой кислоты (1,0 г, 5,6 ммоль), 2,4-дихлор-6-метокси-1,3,5-триазина (2,0 г, 11 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,65 г, 0,56 ммоль) в толуоле (25 мл) добавляли 2М водного раствора карбоната натрия (8,4 мл), и смесь перемешивали при 100°C в течение 1 часа. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=20/1) с получением указанного в заголовке соединения (1,1 г, выход 70%).
1H-ЯМР (CDCl3) δ: 1,06 (3H, т, J=7,4 Гц), 1,83-1,87 (2H, м), 4,02 (2H, т, J=6,6 Гц), 4,14 (3H, с), 6,96-6,99 (2H, м), 8,43-8,45 (2H, м).
[0532]
(2) {4-хлор-3-[4-метокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]фенил}метанол
[0533]
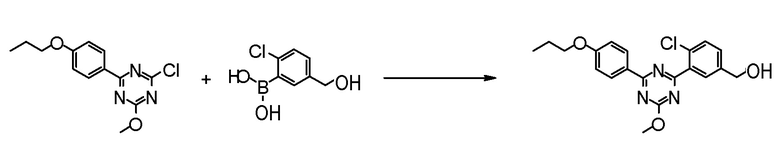
[0534]
В атмосфере аргона к раствору 2-хлор-4-метокси-6-(4-пропоксифенил)-1,3,5-триазина (0,75 г, 2,7 ммоль), полученного в вышеупомянутом (1), 2-хлор-5-гидроксиметилфенилбороновой кислоты (0,60 г, 3,2 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,22 г, 0,27 ммоль) в 1,4-диоксане (15 мл) добавляли 2М водного раствора карбоната натрия (5,4 мл), и смесь перемешивали при 100°C в течение 3 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали водой и разделяли, промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния, и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: хлороформ/этилацетат=10/1) с получением указанного в заголовке соединения (0,95 г, выход 91%).
1H-ЯМР (CDCl3) δ: 1,07 (3H, т, J=7,4 Гц), 1,77 (1H, т, J=5,8 Гц), 1,84-1,87 (2H, м), 4,02 (2H, т, J=6,6 Гц), 4,19 (3H, с), 4,77 (2H, д, J=5,8 Гц), 7,00 (2H, д, J=8,7 Гц), 7,45 (1H, дд, J=8,3, 1,9 Гц), 7,53 (1H, д, J=8,3 Гц), 8,00 (1H, д, J=1,9 Гц), 8,55 (2H, д, J=8,7 Гц).
[0535]
(3) трет-бутил N-{4-хлор-3-[4-метокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамат
[0536]
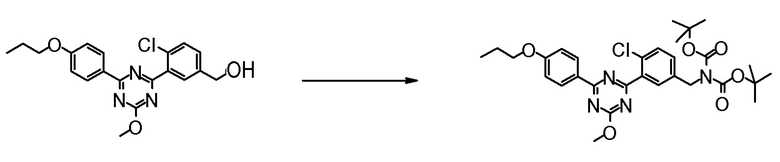
[0537]
В атмосфере аргона к раствору {4-хлор-3-[4-метокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]фенил}метанола (0,95 г, 2,5 ммоль), полученного в вышеупомянутом (2), в тетрагидрофуране (13 мл) добавляли триэтиламин (0,45 мл, 3,2 ммоль) и метансульфонилхлорид (0,23 мл, 3,0 ммоль) при охлаждении льдом, и смесь перемешивали в течение 0,5 часа. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К раствору остатка в N,N-диметилформамиде (13 мл) добавляли карбонат цезия (2,4 г, 7,4 ммоль) и ди-трет-бутил-иминодикарбоксилат (0,64 г, 3,0 ммоль) при комнатной температуре, и полученную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=10/1) с получением указанного в заголовке соединения (1,3 г, выход 90%).
[0538]
(4) гидрохлорид 4-хлор-3-[4-метокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензиламина
[0539]
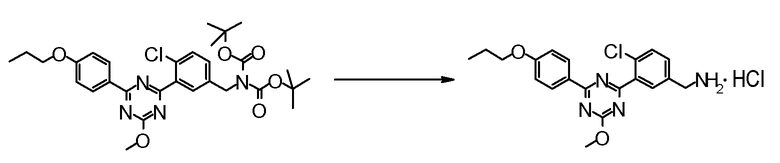
[0540]
В атмосфере аргона, к трет-бутил N-{4-хлор-3-[4-метокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамату (1,3 г, 2,2 ммоль), полученному в вышеупомянутом (3), добавляли 4 M раствора хлористый водород/1,4-диоксан (5,0 мл) при комнатной температуре, и смесь перемешивали в течение 30 минут. К реакционной смеси добавляли 1,4-диоксан (2,0 мл) и н-гексан (5,0 мл), и смесь перемешивали в течение 45 минут. Твердое вещество собирали фильтрацией из суспензии, и сушили при пониженном давлении с получением указанного в заголовке соединения (0,68 г, выход 73%). 1H-ЯМР (ДМСО-D6) δ: 1,00 (3H, т, J=7,4 Гц), 1,73-1,83 (2H, м), 4,06 (2H, т, J=6,5 Гц), 4,12-4,18 (2H, м), 4,14 (3H, с), 7,12-7,16 (2H, м), 7,69-7,74 (2H, м), 8,13 (1H, ушир. с), 8,44 (3H, ушир. с), 8,45-8,50 (2H, м).
[0541]
(5) N-{4-хлор-3-[4-метокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид
[0542]
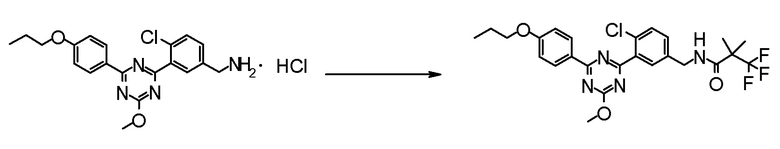
[0543]
В атмосфере аргона к раствору гидрохлорида 4-хлор-3-[4-метокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензиламина (0,10 г, 0,24 ммоль), полученного в вышеупомянутом (4), HOBt・H2O (0,054 г, 0,36 ммоль) и WSC・HCl (0,068 г, 0,36 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли 3,3,3-трифтор-2,2-диметилпропионовую кислоту (0,056 г, 0,36 ммоль) и триэтиламин (0,099 мл, 0,71 ммоль) при комнатной температуре, и смесь перемешивали в течение 4 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=10/3) с получением указанного в заголовке соединения (0,096 г, выход 78%).
1H-ЯМР (ДМСО-D6) δ: 1,00 (3H, т, J=7,3 Гц), 1,39 (6H, с), 1,73-1,83 (2H, м), 4,05 (2H, т, J=6,5 Гц), 4,11 (3H, с), 4,39 (2H, д, J=5,9 Гц), 7,10-7,14 (2H, м), 7,44 (1H, дд, J=8,1, 2,3 Гц), 7,61 (1H, д, J=8,1 Гц), 7,86 (1H, д, J=2,3 Гц), 8,42-8,47 (2H, м), 8,66 (1H, т, J=5,9 Гц).
[0544]
(6) N-{4-хлор-3-[4-гидрокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-122)
[0545]
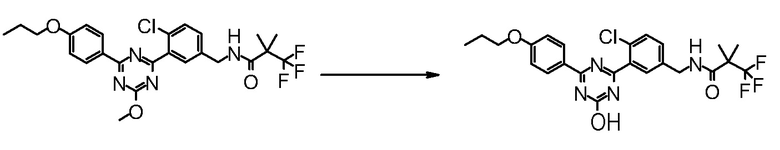
[0546]
В атмосфере аргона к раствору N-{4-хлор-3-[4-метокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,094 г, 0,18 ммоль), полученного в вышеупомянутом (5), в метаноле (0,94 мл) добавляли 4 M водного раствора гидроксида натрия (0,27 мл) при комнатной температуре, и смесь перемешивали при 65°C в течение 2 часов. К реакционной смеси добавляли 2 н соляной кислоты (0,54 мл) и воду при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,069 г, выход 75%). Суспензию указанного в заголовке соединения (0,050 г) в ацетоне (1,0 мл) растворяли при нагревании с обратным холодильником, и твердое вещество собирали фильтрацией при комнатной температуре и сушили с получением указанного в заголовке соединения в виде кристаллов (0,012 г).
[0547]
[Пример получения 14]
Синтез N-(4-хлор-3-{4-гидрокси-6-[4-(1-метилциклопропилметокси)фенил]-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-128)
[0548]

[0549]
(1) 2-хлор-4-метокси-6-(4-метоксиметоксифенил)-1,3,5-триазин
[0550]
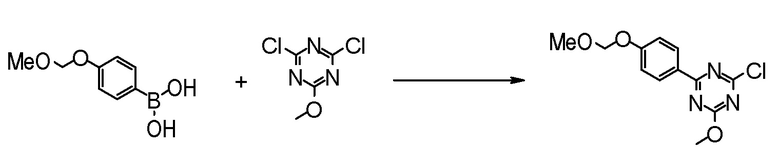
[0551]
В атмосфере аргона, к суспензии 4-(метоксиметокси)фенилбороновой кислоты (1,0 г, 5,5 ммоль), 2,4-дихлор-6-метокси-1,3,5-триазина (2,0 г, 11 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,64 г, 0,55 ммоль) в толуоле (25 мл) добавляли 2М водного раствора карбоната натрия (8,3 мл), и смесь перемешивали при 100°C в течение 1 часа. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=20/1-10/1) с получением указанного в заголовке соединения (1,3 г, выход 84%).
[0552]
(2) {4-хлор-3-[4-метокси-6-(4-метоксиметоксифенил)-1,3,5-триазин-2-ил]фенил}метанол
[0553]
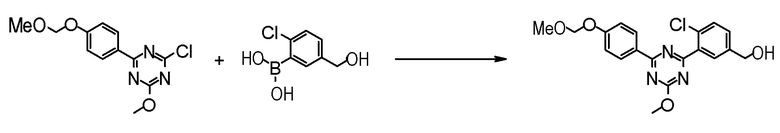
[0554]
В атмосфере аргона к раствору 2-хлор-4-метокси-6-(4-метоксиметоксифенил)-1,3,5-триазина (1,3 г, 4,4 ммоль), полученного в вышеупомянутом (1), 2-хлор-5-гидроксиметилфенилбороновой кислоты (0,99 г, 5,3 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,36 г, 0,44 ммоль) в 1,4-диоксане (25 мл) добавляли 2М водного раствора карбоната натрия (8,8 мл), и смесь перемешивали при 100°C в течение 3 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали водой, промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния, и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: хлороформ/этилацетат=10/1) с получением указанного в заголовке соединения (0,98 г, выход 56%).
[0555]
(3) трет-бутил N-{4-хлор-3-[4-метокси-6-(4-метоксиметоксифенил)-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамат
[0556]
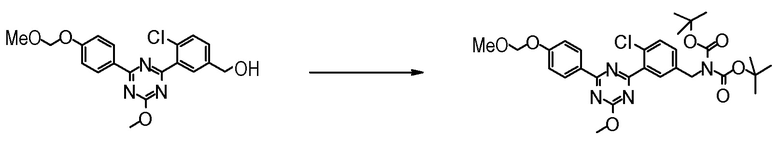
[0557]
В атмосфере аргона к раствору {4-хлор-3-[4-метокси-6-(4-метоксиметоксифенил)-1,3,5-триазин-2-ил]фенил}метанола (0,78 г, 2,0 ммоль), полученного в вышеупомянутом (2), в тетрагидрофуране (7,8 мл) добавляли триэтиламин (0,36 мл, 2,6 ммоль) и метансульфонилхлорид (0,19 мл, 2,4 ммоль) при охлаждении льдом, и смесь перемешивали в течение 0,5 часа. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К раствору остатка в N,N-диметилформамиде (10 мл) добавляли карбонат цезия (2,0 г, 6,0 ммоль) и ди-трет-бутил-иминодикарбоксилат (0,53 г, 2,4 ммоль), и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=10/1) с получением указанного в заголовке соединения (0,80 г, выход 68%).
1H-ЯМР (ДМСО-D6) δ: 1,42 (18H, с), 3,41 (3H, с), 4,12 (3H, с), 4,77 (2H, с), 5,32 (2H, с), 7,18-7,23 (2H, м), 7,45 (1H, дд, J=8,2, 2,3 Гц), 7,65 (1H, д, J=8,2 Гц), 7,91 (1H, д, J=2,3 Гц), 8,43-8,47 (2H, м).
[0558]
(4) гидрохлорид 4-[4-(5-аминометил-2-хлорфенил)-6-метокси-1,3,5-триазин-2-ил]фенола
[0559]
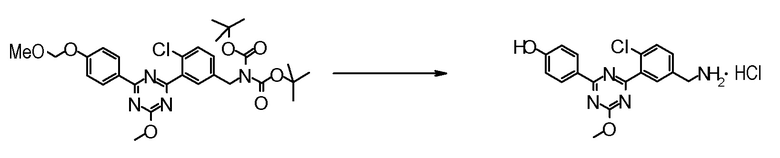
[0560]
В атмосфере аргона, к трет-бутил N-{4-хлор-3-[4-метокси-6-(4-метоксиметоксифенил)-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамату (0,40 г, 0,68 ммоль), полученному в вышеупомянутом (3), добавляли 4 M раствора хлористый водород/1,4-диоксан (2,0 мл) при комнатной температуре, и полученную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли н-гексан (3,0 мл), и смесь перемешивали в течение 45 минут. Твердое вещество собирали фильтрацией и высушивали при пониженном давлении с получением указанного в заголовке соединения в виде сырого продукта (0,26 г).
[0561]
(5) 4-(4-{2-хлор-5-[(3,3,3-трифтор-2,2-диметилпропиониламино)метил]фенил}-6-метокси-1,3,5-триазин-2-ил)фенил 3,3,3-трифтор-2,2-диметилпропионат
[0562]
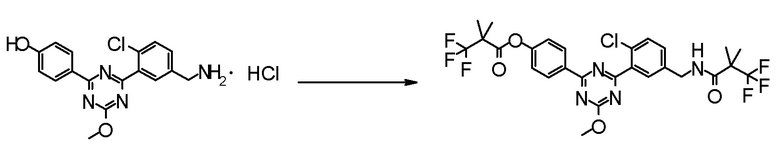
[0563]
В атмосфере аргона к раствору сырого продукта (0,10 г) гидрохлорида 4-[4-(5-аминометил-2-хлорфенил)-6-метокси-1,3,5-триазин-2-ил]фенола, полученного в вышеупомянутом (4), HOBt・H2O (0,061 г, 0,40 ммоль) и WSC・HCl (0,076 г, 0,40 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли 3,3,3-трифтор-2,2- диметилпропионовую кислоту (0,066 г, 0,40 ммоль) и триэтиламин (0,11 мл, 0,79 ммоль) при комнатной температуре, и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: хлороформ/этилацетат=10/1) с получением указанного в заголовке соединения (0,090 г).
1H-ЯМР (ДМСО-D6) δ: 1,39 (6H, с), 1,59 (6H, с), 4,15 (3H, с), 4,40 (2H, д, J=6,0 Гц), 7,39-7,47 (3H, м), 7,62 (1H, д, J=8,4 Гц), 7,88 (1H, д, J=2,1 Гц), 8,55-8,60 (2H, м), 8,66 (1H, т, J=6,0 Гц).
[0564]
(6) N-{4-хлор-3-[4-(4-гидроксифенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид
[0565]
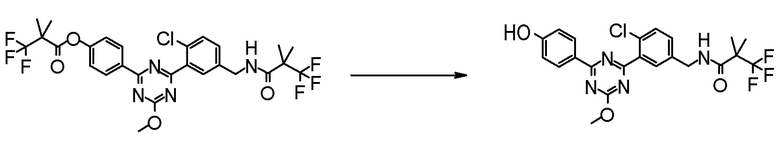
[0566]
В атмосфере аргона к раствору 4-(4-{2-хлор-5-[(3,3,3-трифтор-2,2-диметилпропиониламино)метил]фенил}-6-метокси-1,3,5-триазин-2-ил)фенил 3,3,3-трифтор-2,2-диметилпропионата (0,070 г, 0,15 ммоль), полученного в вышеупомянутом (5), в метаноле (0,70 мл) добавляли 5M раствор метоксид натрия/метанол (0,032 мл) при комнатной температуре, и полученную смесь перемешивали в течение 1 часа. Значение рН реакционной смеси доводили до pH=2 с помощью 2 н соляной кислоты при охлаждении льдом. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: хлороформ/этилацетат=4/1) с получением указанного в заголовке соединения (0,036 г, выход 51%).
1H-ЯМР (ДМСО-D6) δ: 1,38 (6H, с), 4,10 (3H, с), 4,39 (2H, д, J=6,2 Гц), 6,91-6,95 (2H, м), 7,42 (1H, дд, J=8,3, 2,3 Гц), 7,60 (1H, д, J=8,3 Гц), 7,84 (1H, д, J=2,3 Гц), 8,34-8,39 (2H, м), 8,65 (1H, т, J=6,2 Гц), 10,38 (1H, ушир.с).
[0567]
(7) N-(4-хлор-3-{4-метокси-6-[4-(1-метилциклопропилметокси)фенил]-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамид
[0568]
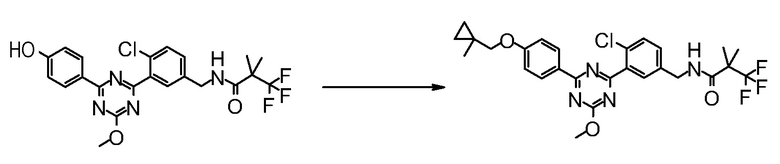
[0569]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(4-гидроксифенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,036 г, 0,075 ммоль), полученного в вышеупомянутом (6), 1-метил-циклопропанметанола (0,0087 мл, 0,090 ммоль) и трифенилфосфина (0,024 г, 0,090 ммоль) в тетрагидрофуране (0,50 мл) добавляли 1,9 M раствора диэтилазодикарбоксилат/толуол (0,051 мл, 0,098 ммоль) при охлаждении льдом, и смесь перемешивали в течение 1 часа. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, и добавляли 1,9 M раствора диэтилазодикарбоксилат/толуол (0,028 мл, 0,053 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, и очищали с помощью препаративной тонкослойной хроматографии (элюент: хлороформ/этилацетат=19/1) с получением указанного в заголовке соединения (0,029 г, выход 70%).
1H-ЯМР (ДМСО-D6) δ: 0,42 (2H, дд, J=5,6, 4,0 Гц), 0,56 (2H, дд, J=5,4, 4,2 Гц), 1,20 (3H, с), 1,39 (6H, с), 3,88 (2H, с), 4,11 (3H, с), 4,39 (2H, д, J=5,9 Гц), 7,09-7,14 (2H, м), 7,43 (1H, дд, J=8,2, 2,1 Гц), 7,60 (1H, д, J=8,2 Гц), 7,85 (1H, д, J=2,1 Гц), 8,41-8,46 (2H, м), 8,66 (1H, т, J=5,9 Гц).
[0570]
(8) N-(4-хлор-3-{4-гидрокси-6-[4-(1-метилциклопропилметокси)фенил]-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-128)
[0571]
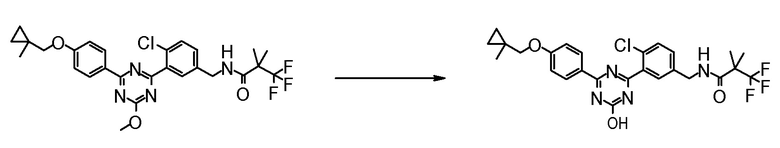
[0572]
В атмосфере аргона к раствору N-(4-хлор-3-{4-метокси-6-[4-(1-метилциклопропилметокси)фенил]-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамида (0,028 г, 0,051 ммоль), полученного в вышеупомянутом (7), в метаноле (0,28 мл) добавляли 4 M водного раствора гидроксида натрия (0,077 мл) при комнатной температуре, и смесь перемешивали при 60°C в течение 1 часа. К реакционной смеси добавляли 2 н соляной кислоты (0,16 мл) и воду при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,019 г, выход 69%).
[0573]
[Пример получения 15]
Синтез N-{4-хлор-3-[4-(3-хлор-4-метилфенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-129)
[0574]
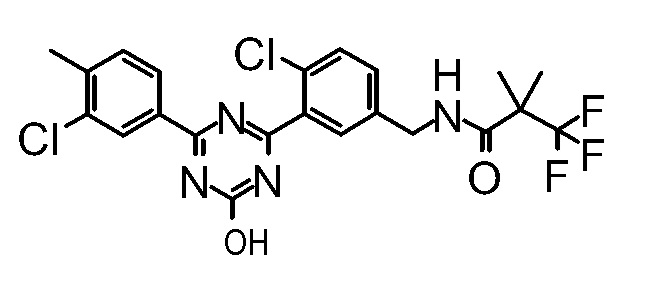
[0575]
(1) 2-хлор-4-(3-хлор-4-метилфенил)-6-метокси-1,3,5-триазин
[0576]
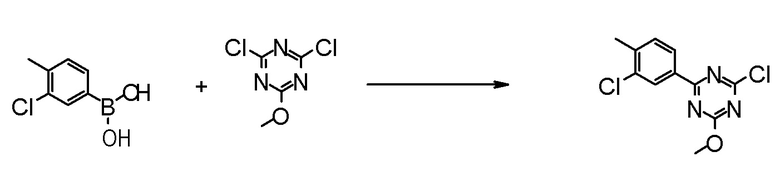
[0577]
В атмосфере аргона, к суспензии 3-хлор-4-метилфенилбороновой кислоты (0,47 г, 2,8 ммоль), 2,4-дихлор-6-метокси-1,3,5-триазина (1,0 г, 5,6 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,32 г, 0,28 ммоль) в толуоле (5,0 мл) добавляли 2М водного раствора карбоната натрия (4,2 мл), и смесь перемешивали при 100°C в течение 2 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=97/3-94/6) с получением указанного в заголовке соединения (0,61 г, выход 81%).
1H-ЯМР (CDCl3) δ: 2,47 (3H, с), 4,17 (3H, с), 7,37 (1H, д, J=8,0 Гц), 8,28 (1H, дд, J=8,0, 1,8 Гц), 8,47 (1H, д, J=1,8 Гц).
[0578]
(2) {4-хлор-3-[4-(3-хлор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанол
[0579]
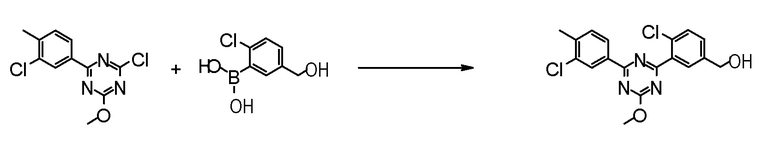
[0580]
В атмосфере аргона к раствору 2-хлор-4-(3-хлор-4-метилфенил)-6-метокси-1,3,5-триазина (0,61 г, 2,3 ммоль), полученного в вышеупомянутом (1), 2-хлор-5-гидроксиметилфенилбороновой кислоты (0,51 г, 2,7 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,19 г, 0,23 ммоль) в 1,4-диоксане (6,0 мл) добавляли 2М водного раствора карбоната натрия (4,5 мл), и смесь перемешивали при 100°C в течение 1,5 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=8/2-6/4) с получением указанного в заголовке соединения (0,61 г, выход 71%).
1H-ЯМР (CDCl3) δ: 1,81 (1H, т, J=5,9 Гц), 2,47 (3H, с), 4,21 (3H, с), 4,78 (2H, д, J=5,9 Гц), 7,37 (1H, д, J=7,9 Гц), 7,47 (1H, дд, J=8,1, 2,2 Гц), 7,54 (1H, д, J=8,1 Гц), 8,01 (1H, д, J=2,2 Гц), 8,38 (1H, дд, J=7,9, 1,8 Гц), 8,57 (1H, д, J=1,8 Гц).
[0581]
(3) гидрохлорид 4-хлор-3-[4-(3-хлор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина
[0582]
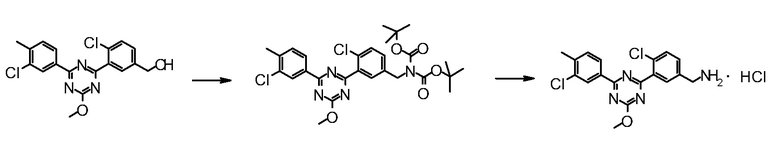
[0583]
В атмосфере аргона к раствору {4-хлор-3-[4-(3-хлор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанола (0,61 г, 1,6 ммоль), полученного в вышеупомянутом (2), в тетрагидрофуране (6,0 мл) добавляли триэтиламин (0,29 мл, 2,1 ммоль) и метансульфонилхлорид (0,15 мл, 1,9 ммоль) при охлаждении льдом, и смесь перемешивали в течение 1 часа. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К раствору остатка в N,N-диметилформамиде (6,0 мл) добавляли карбонат цезия (1,6 г, 4,8 ммоль) и ди-трет-бутил-иминодикарбоксилат (0,42 г, 1,9 ммоль) при комнатной температуре, и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=95/5-80/20). В атмосфере аргона к раствору очищенного продукта в 1,4-диоксане (2,0 мл) добавляли 4 M раствора хлористый водород/1,4-диоксан (8,0 мл) при комнатной температуре, и смесь перемешивали в течение 2,5 часов. К реакционной смеси добавляли н-гексан, и твердое вещество собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (0,67 г, выход 99%).
1H-ЯМР (ДМСО-D6) δ: 2,46 (3H, с), 4,12-4,21 (5H, м), 7,62 (1H, д, J=8,0 Гц), 7,73-7,75 (2H, м), 8,17 (1H, ушир. с), 8,38 (1H, дд, J=8,0, 1,6 Гц), 8,47 (1H, д, J=1,6 Гц), 8,48 (3H, ушир.с).
[0584]
(4) N-{4-хлор-3-[4-(3-хлор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид
[0585]
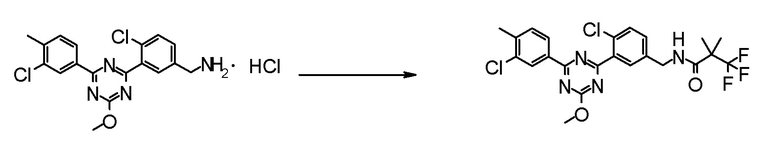
[0586]
В атмосфере аргона к раствору гидрохлорида 4-хлор-3-[4-(3-хлор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина (0,070 г, 0,17 ммоль), полученного в вышеупомянутом (3), HOBt・H2O (0,039 г, 0,26 ммоль) и WSC・HCl (0,049 г, 0,26 ммоль) в N,N-диметилформамиде (0,70 мл) добавляли 3,3,3-трифтор-2,2-диметилпропионовую кислоту (0,037 г, 0,24 ммоль) и триэтиламин (0,071 мл, 0,51 ммоль) при комнатной температуре, и полученную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=9/1-8/2) с получением указанного в заголовке соединения (0,072 г, выход 82%).
1H-ЯМР (CDCl3) δ: 1,45 (6H, с), 2,47 (3H, с), 4,21 (3H, с), 4,56 (2H, д, J=5,6 Гц), 6,24 (1H, ушир. с), 7,34-7,39 (2H, м), 7,52 (1H, д, J=8,2 Гц), 7,92 (1H, д, J=2,3 Гц), 8,38 (1H, дд, J=8,2, 1,8 Гц), 8,56 (1H, д, J=1,8 Гц).
[0587]
(5) N-{4-хлор-3-[4-(3-хлор-4-метилфенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-129)
[0588]

[0589]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(3-хлор-4-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,072 г, 0,14 ммоль), полученного в вышеупомянутом (4), в метаноле (0,70 мл) добавляли 4 M водного раствора гидроксида натрия (0,28 мл) при комнатной температуре, и смесь перемешивали при 60°C в течение 1 часа. К реакционной смеси добавляли 2 н соляной кислоты (0,56 мл) и воду при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,057 г, выход 82%).
[0590]
[Пример получения 16]
Синтез N-{4-хлор-3-[4-гидрокси-6-(3-изопропил-4-трифторметилфенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-130)
[0591]
[0592]
(1) 4-бензилокси-2-бром-1-трифторметилбензол
[0593]
[0594]
В атмосфере аргона к раствору 2-бром-4-фтор-1-трифторметилбензола (1,5 г, 6,2 ммоль) и гидрида натрия (0,74 г, 60% масс. дисперсия в масле) в N,N-диметилформамиде (15 мл) добавляли бензиловый спирт (0,64 мл, 6,2 ммоль) при охлаждении льдом, и смесь перемешивали в течение 0,5 часа. Реакционную смесь перемешивали при 60°C в течение 2 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=99/1-98/2) с получением указанного в заголовке соединения (1,3 г, выход 69%).
1H-ЯМР (CDCl3) δ: 5,08 (2H, с), 6,93 (1H, дд, J=8,8, 2,4 Гц), 7,30 (1H, д, J=2,4 Гц), 7,33-7,41 (5H, м), 7,57 (1H, д, J=8,8 Гц).
[0595]
(2) 4-бензилокси-2-изопропенил-1-трифторметилбензол
[0596]

[0597]
В атмосфере аргона к раствору 4-бензилокси-2-бром-1-трифторметилбензола (1,3 г, 3,9 ммоль), полученного в вышеупомянутом (1), в 1,4-диоксане (13 мл) добавляли 2-изопропенил-4,4,5,5-тетраметил-[1,3,2]диоксаборолан (0,99 г, 5,9 ммоль), аддукт [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,32 г, 0,39 ммоль) и 2М водного раствора карбоната натрия (5,9 мл) при комнатной температуре, и смесь перемешивали при 100°C в течение 2 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=99/1-97/3) с получением указанного в заголовке соединения (1,1 г, выход 99%).
1H-ЯМР (CDCl3) δ: 2,04 (3H, с), 4,88 (1H, ушир. с), 5,08 (2H, с), 5,18 (1H, ушир. с), 6,82 (1H, д, J=2,6 Гц), 6,89 (1H, дд, J=8,8, 2,6 Гц), 7,31-7,42 (5H, м), 7,54 (1H, д, J=8,8 Гц).
[0598]
(3) 3-изопропил-4-трифторметилфенол
[0599]
[0600]
В атмосфере аргона к раствору 4-бензилокси-2-изопропенил-1-трифторметилбензола (1,2 г, 3,9 ммоль), полученного в вышеупомянутом (2), в тетрагидрофуране (12 мл) добавляли 10% масс. палладий на угле (0,23 г) при комнатной температуре, и смесь перемешивали под давлением 1 атм в атмосфере водорода в течение 5 часов. В атмосфере азота, реакционную смесь фильтровали через целит и элюировали этилацетатом. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,76 г, выход 96%).
1H-ЯМР (CDCl3) δ: 1,23 (6H, д, J=6,7 Гц), 3,24-3,35 (1H, м), 5,04 (1H, ушир. с), 6,66 (1H, дд, J=8,6, 2,6 Гц), 6,87 (1H, д, J=2,6 Гц), 7,46 (1H, д, J=8,6 Гц).
[0601]
(4) 3-изопропил-4-трифторметилфенил трифторметансульфонат
[0602]
[0603]
В атмосфере аргона к раствору 3-изопропил-4-трифторметилфенола (0,77 г, 3,8 ммоль), полученного в вышеупомянутом (3), в хлороформе (8,0 мл) добавляли триэтиламин (0,58 мл, 4,1 ммоль) и ангидрид трифторметансульфоновой кислоты (0,67 мл, 4,0 ммоль) при охлаждении льдом, и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли воду и хлороформ, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=98/2) с получением указанного в заголовке соединения (0,78 г, выход 62%).
1H-ЯМР (CDCl3) δ: 1,28 (6H, д, J=6,7 Гц), 3,34-3,46 (1H, м), 7,19 (1H, дд, J=8,8, 2,4 Гц), 7,34 (1H, д, J=2,4 Гц), 7,70 (1H, д, J=8,8 Гц).
[0604]
(5) 2-(3-изопропил-4-трифторметилфенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан
[0605]

[0606]
В атмосфере аргона к раствору 3-изопропил-4-трифторметилфенил трифторметансульфоната (0,78 г, 2,3 ммоль), полученного в вышеупомянутом (4), в ДМСО (8,0 мл) добавляли бис(пинаколато)диборон (0,71 г, 2,8 ммоль), ацетат калия (0,68 г, 7,0 ммоль) и аддукт [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,095 г, 0,12 ммоль) при комнатной температуре, и смесь перемешивали при 80°C в течение 2 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=98/2) с получением указанного в заголовке соединения (0,48 г, выход 66%).
1H-ЯМР (CDCl3) δ: 1,29 (6H, д, J=7,0 Гц), 1,36 (12H, с), 3,29-3,40 (1H, м), 7,57 (1H, д, J=7,9 Гц), 7,68 (1H, д, J=7,9 Гц), 7,88 (1H, ушир.с).
[0607]
(6) 2-хлор-4-(3-изопропил-4-трифторметилфенил)-6-метокси-1,3,5-триазин
[0608]
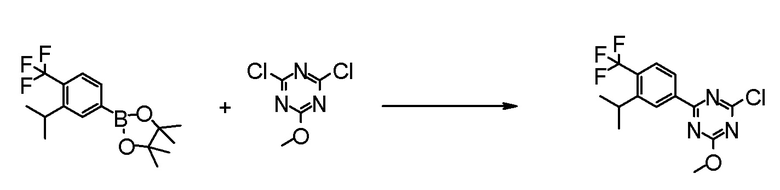
[0609]
В атмосфере аргона, к суспензии 2-(3-изопропил-4-трифторметилфенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолана (0,48 г, 1,5 ммоль), полученного в вышеупомянутом (5), 2,4-дихлор-6-метокси-1,3,5-триазина (0,69 г, 3,8 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,13 г, 0,15 ммоль) в 1,4-диоксане (5,0 мл) добавляли 2М водного раствора карбоната натрия (3,1 мл), и смесь перемешивали при 100°C в течение 1 часа. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=97/3-94/6) с получением указанного в заголовке соединения (0,36 г, выход 71%).
[0610]
(7) {4-хлор-3-[4-(3-изопропил-4-трифторметилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанол
[0611] 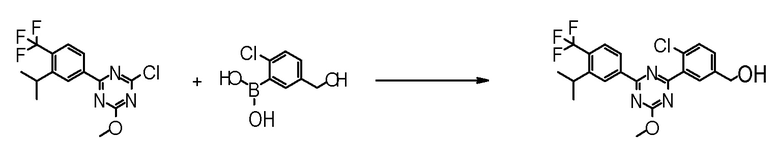
[0612]
В атмосфере аргона к раствору 2-хлор-4-(3-изопропил-4-трифторметилфенил)-6-метокси-1,3,5-триазина (0,36 г, 1,1 ммоль), полученного в вышеупомянутом (6), 2-хлор-5-гидроксиметилфенилбороновой кислоты (0,25 г, 1,3 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,089 г, 0,11 ммоль) в 1,4-диоксане (3,6 мл) добавляли 2М водного раствора карбоната натрия (2,2 мл), и смесь перемешивали при 100°C в течение 1,5 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=8/2-1/1) с получением указанного в заголовке соединения (0,30 г, выход 62%).
1H-ЯМР (CDCl3) δ: 1,36 (6H, д, J=6,8 Гц), 1,79 (1H, т, J=6,0 Гц), 3,37-3,48 (1H, м), 4,24 (3H, с), 4,79 (2H, д, J=6,0 Гц), 7,49 (1H, дд, J=8,4, 2,2 Гц), 7,57 (1H, д, J=8,4 Гц), 7,75 (1H, д, J=8,4 Гц), 8,07 (1H, д, J=2,2 Гц), 8,47 (1H, д, J=8,4 Гц), 8,73 (1H, ушир.с).
[0613]
(8) гидрохлорид 4-хлор-3-[4-(3-изопропил-4-трифторметилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина
[0614]
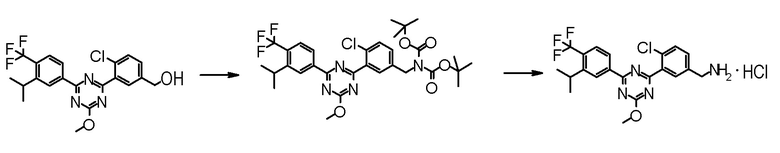
[0615]
В атмосфере аргона к раствору {4-хлор-3-[4-(3-изопропил-4-трифторметилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанола (0,30 г, 0,68 ммоль), полученного в вышеупомянутом (7), в тетрагидрофуране (3,0 мл) добавляли триэтиламин (0,12 мл, 0,89 ммоль) и метансульфонилхлорид (0,063 мл, 0,82 ммоль) при охлаждении льдом, и смесь перемешивали в течение 0,5 часа. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К раствору остатка в N,N-диметилформамиде (3,0 мл) добавляли карбонат цезия (0,67 г, 2,0 ммоль) и ди-трет-бутил-иминодикарбоксилат (0,18 г, 0,82 ммоль) при комнатной температуре, и смесь перемешивали в течение 1,5 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=95/5-80/20). В атмосфере аргона, к раствору (1,0 мл) очищенного продукта в 1,4-диоксане добавляли 4 M раствора хлористый водород/1,4-диоксан (4,0 мл) при комнатной температуре, и смесь перемешивали в течение 1,5 часов. К реакционной смеси добавляли н-гексан, и твердое вещество собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (0,24 г, выход 74%).
1H-ЯМР (ДМСО-D6) δ: 1,33 (6H, д, J=6,7 Гц), 3,28-3,40 (1H, м), 4,13-4,22 (5H, м), 7,73 (1H, дд, J=8,2, 2,2 Гц), 7,77 (1H, д, J=8,3 Гц), 7,92 (1H, д, J=8,3 Гц), 8,20 (1H, д, J=2,2 Гц), 8,35 (3H, ушир. с), 8,48 (1H, д, J=8,8 Гц), 8,70 (1H, с).
[0616]
(9) N-{4-хлор-3-[4-(3-изопропил-4-трифторметилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид
[0617]

[0618]
В атмосфере аргона к раствору гидрохлорида 4-хлор-3-[4-(3-изопропил-4-трифторметилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина (0,080 г, 0,17 ммоль), полученного в вышеупомянутом (8), HOBt・H2O (0,039 г, 0,26 ммоль) и WSC・HCl (0,049 г, 0,26 ммоль) в N,N-диметилформамиде (0,80 мл) добавляли 3,3,3-трифтор-2,2-диметилпропионовую кислоту (0,037 г, 0,24 ммоль) и триэтиламин (0,071 мл, 0,51 ммоль) при комнатной температуре, и полученную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=19/1-8/2) с получением указанного в заголовке соединения (0,077 г, выход 79%).
1H-ЯМР (CDCl3) δ: 1,35 (6H, д, J=6,0 Гц), 1,44 (6H, ушир. с), 3,37-3,49 (1H, м), 4,23 (3H, с), 4,56 (2H, д, J=5,8 Гц), 6,25 (1H, ушир. с), 7,37 (1H, дд, J=8,4, 2,3 Гц), 7,54 (1H, д, J=8,4 Гц), 7,74 (1H, д, J=8,4 Гц), 7,96 (1H, д, J=2,3 Гц), 8,46 (1H, д, J=8,4 Гц), 8,72 (1H, ушир.с).
[0619]
(10) N-{4-хлор-3-[4-гидрокси-6-(3-изопропил-4-трифторметилфенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-130)
[0620]
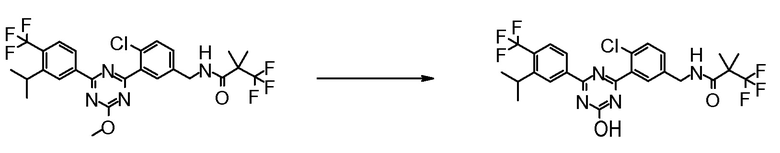
[0621]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(3-изопропил-4-трифторметилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,077 г, 0,13 ммоль), полученного в вышеупомянутом (9), в метаноле (0,80 мл) добавляли 4 M водного раствора гидроксида натрия (0,27 мл) при комнатной температуре, и смесь перемешивали при 60°C в течение 1 часа. К реакционной смеси добавляли 2 н соляной кислоты (0,54 мл) и воду при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,066 г, выход 88%).
[0622]
[Пример получения 17]
Синтез N-{3-[4-(4-бутоксифенил)-6-гидрокси-1,3,5-триазин-2-ил]-4-хлорбензил}-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-131)
[0623]
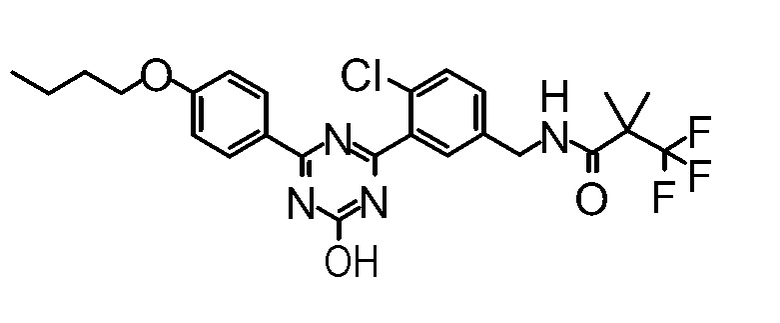
[0624]
(1) N-{3-[4-(4-бутоксифенил)-6-метокси-1,3,5-триазин-2-ил]-4-хлорбензил}-3,3,3-трифтор-2,2-диметилпропионамид
[0625]
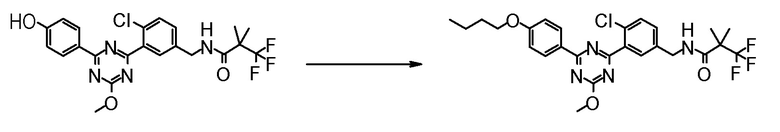
[0626]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(4-гидроксифенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,10 г, 0,21 ммоль), полученного в вышеупомянутом [Примере получения 14] (6), н-бутанола (0,023 мл, 0,25 ммоль) и трифенилфосфина (0,066 г, 0,25 ммоль) в тетрагидрофуране (1,0 мл) добавляли бис(2-метоксиэтил)азодикарбоксилат (0,059 г, 0,25 ммоль) при охлаждении льдом, и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли н-бутанол (0,019 мл, 0,21 ммоль), трифенилфосфин (0,055 г, 0,21 ммоль) и бис(2-метоксиэтил) азодикарбоксилат (0,049 г, 0,21 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1) с получением указанного в заголовке соединения (0,096 г, выход 85%).
[0627]
(2) N-{3-[4-(4-бутоксифенил)-6-гидрокси-1,3,5-триазин-2-ил]-4-хлорбензил}-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-131)
[0628]
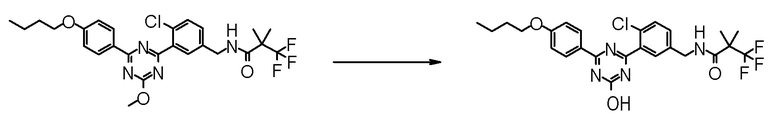
[0629]
В атмосфере аргона к раствору N-{3-[4-(4-бутоксифенил)-6-метокси-1,3,5-триазин-2-ил]-4-хлорбензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,096 г, 0,18 ммоль), полученного в вышеупомянутом (1), в метаноле (0,96 мл) добавляли 4 M водного раствора гидроксида натрия (0,27 мл) при комнатной температуре, и смесь перемешивали при 65°C в течение 2 часов. К реакционной смеси добавляли 2 н соляной кислоты (0,54 мл) и воду, и смесь перемешивали при комнатной температуре. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,086 г, выход 93%).
[0630]
[Пример получения 18]
Синтез N-{4-хлор-3-[4-(3-циклопропил-4-фторфенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-135)
[0631]
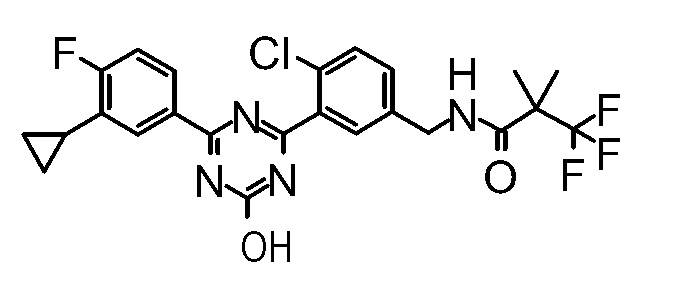
[0632]
(1) 2-хлор-4-(3-циклопропил-4-фторфенил)-6-метокси-1,3,5-триазин
[0633]
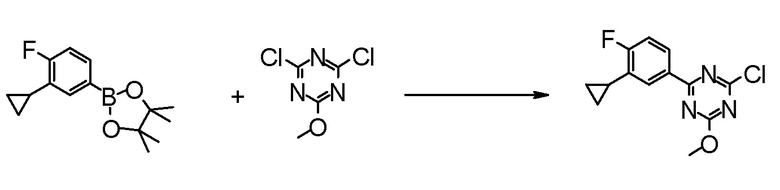
[0634]
В атмосфере аргона, к суспензии 2-(3-циклопропил-4-фторфенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолана (0,59 г, 2,2 ммоль), 2,4-дихлор-6-метокси-1,3,5-триазина (0,81 г, 4,5 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,18 г, 0,22 ммоль) в 1,4-диоксане (3,0 мл) добавляли 2М водного раствора карбоната натрия (3,4 мл), и смесь перемешивали при 100°C в течение 1 часа. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=25/1-20/1) с получением указанного в заголовке соединения в виде сырого продукта (0,44 г).
[0635]
(2) {4-хлор-3-[4-(3-циклопропил-4-фторфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанол
[0636]
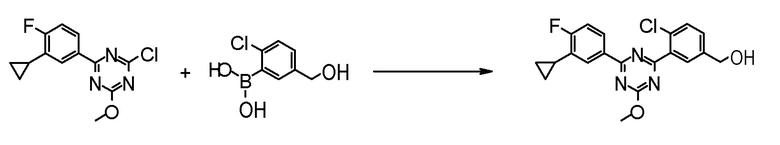
[0637]
В атмосфере аргона к раствору сырого продукта (0,44 г) 2-хлор-4-(3-циклопропил-4-фторфенил)-6-метокси-1,3,5-триазина, полученного в вышеупомянутом (1), 2-хлор-5-гидроксиметилфенилбороновой кислоты (0,31 г, 1,6 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,11 г, 0,13 ммоль) в 1,4-диоксане (5,4 мл) добавляли 2М водного раствора карбоната натрия (2,7 мл), и смесь перемешивали при 100°C в течение 1 часа. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=5/3) с получением указанного в заголовке соединения (0,32 г).
1H-ЯМР (CDCl3) δ: 0,83-0,88 (2H, м), 1,01-1,07 (2H, м), 1,79 (1H, т, J=6,0 Гц), 2,10-2,19 (1H, м), 4,20 (3H, с), 4,77 (2H, д, J=6,0 Гц), 7,13 (1H, т, J=9,2 Гц), 7,47 (1H, д, J=8,1 Гц), 7,54 (1H, д, J=8,1 Гц), 8,01 (1H, ушир. с), 8,20 (1H, д, J=7,6 Гц), 8,38-8,41 (1H, м).
[0638]
(3) трет-бутил N-{4-хлор-3-[4-(3-циклопропил-4-фторфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамат
[0639]
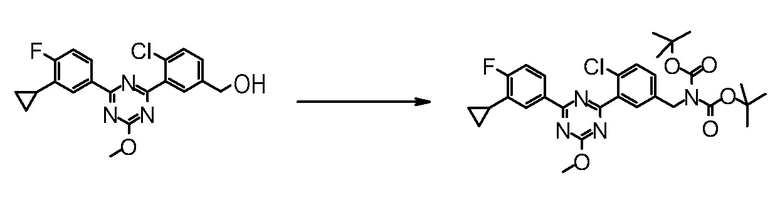
[0640]
В атмосфере аргона к раствору {4-хлор-3-[4-(3-циклопропил-4-фторфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанола (0,32 г, 0,82 ммоль), полученного в вышеупомянутом (2), в тетрагидрофуране (3,3 мл) добавляли триэтиламин (0,15 мл, 1,1 ммоль) и метансульфонилхлорид (0,076 мл, 0,98 ммоль) при охлаждении льдом, и смесь перемешивали в течение 0,5 часа. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К раствору остатка в N,N-диметилформамиде (3,3 мл) добавляли карбонат цезия (0,80 г, 2,5 ммоль) и ди-трет-бутил-иминодикарбоксилат (0,21 г, 0,98 ммоль) при комнатной температуре, и полученную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали для удаления сульфата магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=7/1) с получением указанного в заголовке соединения (0,40 г, выход 83%).
1H-ЯМР (CDCl3) δ: 0,84-0,88 (2H, м), 1,01-1,07 (2H, м), 1,47 (18H, с), 2,09-2,18 (1H, м), 4,18 (3H, с), 4,83 (2H, с), 7,11 (1H, дд, J=9,7, 8,6 Гц), 7,40 (1H, дд, J=8,3, 2,2 Гц), 7,49 (1H, д, J=8,3 Гц), 8,00 (1H, д, J=2,2 Гц), 8,19 (1H, дд, J=7,5, 2,2 Гц), 8,36-8,41 (1H, м).
[0641]
(4) гидрохлорид 4-хлор-3-[4-(3-циклопропил-4-фторфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина
[0642]
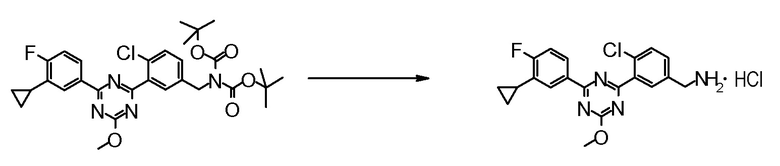
[0643]
В атмосфере аргона, к трет-бутил N-{4-хлор-3-[4-(3-циклопропил-4-фторфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-N-(трет-бутоксикарбонил)карбамату (0,40 г, 0,68 ммоль), полученному в вышеупомянутом (3), добавляли 4M раствора хлористый водород/1,4-диоксан (3,3 мл) при комнатной температуре, и полученную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли этилацетат (35 мл), и смесь перемешивали. Твердое вещество собирали фильтрацией и высушивали при пониженном давлении с получением указанного в заголовке соединения (0,26 г, выход 89%).
1H-ЯМР (ДМСО-D6) δ: 0,78-0,83 (2H, м), 1,05-1,10 (2H, м), 2,10-2,19 (1H, м), 4,16 (3H, с), 4,16 (2H, с), 7,39 (1H, дд, J=9,9, 8,7 Гц), 7,71 (1H, дд, J=8,4, 2,1 Гц), 7,75 (1H, д, J=8,4 Гц), 8,13 (1H, дд, J=7,7, 2,1 Гц), 8,16 (1H, д, J=2,1 Гц), 8,35-8,37 (4H, м).
[0644]
(5) N-{4-хлор-3-[4-(3-циклопропил-4-фторфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид
[0645]
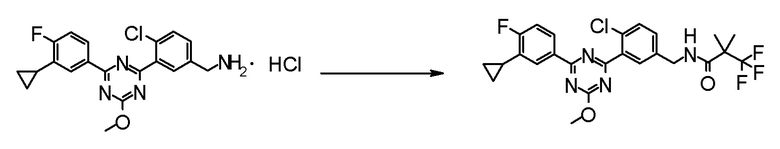
[0646]
В атмосфере аргона к раствору гидрохлорида 4-хлор-3-[4-(3-циклопропил-4-фторфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина (0,070 г, 0,17 ммоль), полученного в вышеупомянутом (4), HOBt・H2O (0,033 г, 0,22 ммоль) и WSC・HCl (0,041 г, 0,22 ммоль) в N,N-диметилформамиде (2,0 мл) добавляли 3,3,3-трифтор-2,2-диметилпропионовую кислоту (0,034 г, 0,22 ммоль) и триэтиламин (0,069 мл, 0,48 ммоль) при комнатной температуре, и смесь перемешивали в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=5/3) с получением указанного в заголовке соединения (0,082 г, выход 94%).
1H-ЯМР (CDCl3) δ: 0,82-0,87 (2H, м), 1,01-1,05 (2H, м), 1,43 (6H, с), 2,10-2,16 (1H, м), 4,18 (3H, с), 4,54 (2H, д, J=5,6 Гц), 6,21 (1H, ушир. с), 7,11 (1H, т, J=9,2 Гц), 7,34 (1H, д, J=8,3 Гц), 7,51 (1H, д, J=8,3 Гц), 7,90 (1H, с), 8,18 (1H, д, J=7,7 Гц), 8,36-8,40 (1H, м).
[0647]
(6) N-{4-хлор-3-[4-(3-циклопропил-4-фторфенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-135)
[0648]
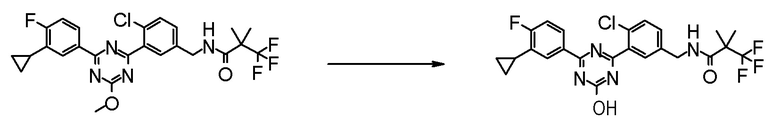
[0649]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(3-циклопропил-4-фторфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,082 г, 0,16 ммоль), полученного в вышеупомянутом (5), в метаноле (1,8 мл) добавляли 4 M водного раствора гидроксида натрия (0,24 мл) при комнатной температуре, и смесь перемешивали при 60°C в течение 3 часов. К реакционной смеси добавляли 10% водный раствор лимонной кислоты (1,0 мл) и воду, и смесь перемешивали при комнатной температуре. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,065 г, выход 81%).
[0650]
[Пример получения 19]
Синтез (R)-N-{4-хлор-3-[4-(4-хлор-3-метилфенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2-метокси-2-метилпропионамида (Пример No.1-136)
[0651]
[0652]
(1) бензил (R)-3,3,3-трифтор-2-гидрокси-2-метилпропионат
[0653]
[0654]
В атмосфере аргона, к суспензии (R)-3,3,3-трифтор-2-гидрокси-2-метилпропионовой кислоты (2,2 г, 14 ммоль) и карбонат калия (2,3 г, 16 ммоль) в N,N-диметилформамиде (30 мл) добавляли бензилбромид (1,8 мл, 15 ммоль) при комнатной температуре, и смесь перемешивали в течение 4 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=6/1) с получением указанного в заголовке соединения (3,0 г, выход 90%).
1H-ЯМР (CDCl3) δ: 1,60 (3H, с), 3,78 (1H, с), 5,31 (2H, с), 7,33-7,42 (5H, м).
[0655]
(2) бензил (R)-3,3,3-трифтор-2-метокси-2-метилпропионат
[0656]
[0657]
В атмосфере аргона к раствору бензил (R)-3,3,3-трифтор-2-гидрокси-2-метилпропионата (3,4 г, 14 ммоль), полученного в вышеупомянутом (1), в N,N-диметилформамиде (40 мл) добавляли гидрид натрия (0,60 г, 60% масс. дисперсия в масле) при охлаждении льдом, и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли метилиодид (1,3 мл, 20 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=15/1) с получением указанного в заголовке соединения (2,8 г, выход 78%).
1H-ЯМР (CDCl3) δ: 1,59 (3H, с), 3,40 (3H, с), 5,26 (2H, с), 7,31-7,37 (5H, м).
[0658]
(3) (R)-3,3,3-трифтор-2-метокси-2-метилпропионовая кислота
[0659]
[0660]
В атмосфере аргона к раствору бензил (R)-3,3,3-трифтор-2-метокси-2-метилпропионата (2,8 г, 11 ммоль), полученного в вышеупомянутом (2), в этилацетате (50 мл) добавляли 10% масс. палладия на угле (0,23 г) при комнатной температуре, и смесь перемешивали под давлением 1 атм. в атмосфере водорода в течение 5 часов. В атмосфере азота, реакционную смесь фильтровали через целит и элюировали этилацетатом. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,4 г, выход 78%).
1H-ЯМР (CDCl3) δ: 1,68 (3H, с), 3,54 (3H, с).
[0661]
(4) 2-хлор-4-(4-хлор-3-метилфенил)-6-метокси-1,3,5-триазин
[0662]
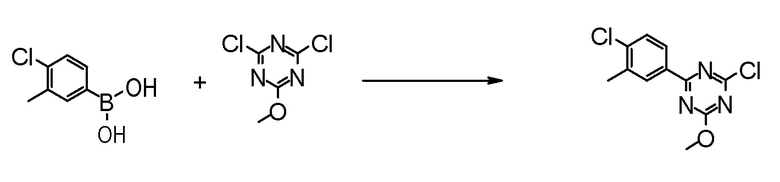
[0663]
В атмосфере аргона, к суспензии 4-хлор-3-метилфенилбороновой кислоты (0,47 г, 2,8 ммоль), 2,4-дихлор-6-метокси-1,3,5-триазина (1,0 г, 5,6 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,32 г, 0,28 ммоль) в толуоле (5,0 мл) добавляли 2М водного раствора карбоната натрия (4,2 мл), и смесь перемешивали при 100°C в течение 2 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=98/2-95/5) с получением указанного в заголовке соединения (0,50 г, выход 48%).
1H-ЯМР (CDCl3) δ: 2,47 (3H, с), 4,17 (3H, с), 7,47 (1H, д, J=8,4 Гц), 8,26 (1H, дд, J=8,4, 2,1 Гц), 8,36 (1H, д, J=2,1 Гц).
[0664]
(5) {4-хлор-3-[4-(4-хлор-3-метилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанол
[0665]
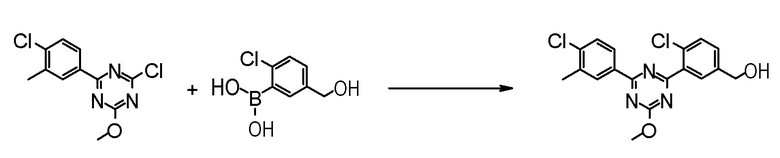
[0666]
В атмосфере аргона к раствору 2-хлор-4-(4-хлор-3-метилфенил)-6-метокси-1,3,5-триазина (0,50 г, 1,3 ммоль), полученного в вышеупомянутом (4), 2-хлор-5-гидроксиметилфенилбороновой кислоты (0,30 г, 1,6 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,11 г, 0,13 ммоль) в 1,4-диоксане (5,0 мл) добавляли 2М водного раствора карбоната натрия (2,6 мл), и смесь перемешивали при 100°C в течение 1,5 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=8/2-6/4) с получением указанного в заголовке соединения (0,40 г, выход 80%).
1H-ЯМР (CDCl3) δ: 1,79 (1H, т, J=5,3 Гц), 2,48 (3H, с), 4,21 (3H, с), 4,78 (2H, д, J=5,3 Гц), 7,45-7,50 (2H, м), 7,54 (1H, д, J=8,1 Гц), 8,01 (1H, д, J=2,1 Гц), 8,37 (1H, дд, J=8,4, 2,1 Гц), 8,46 (1H, д, J=2,1 Гц).
[0667]
(6) гидрохлорид 4-хлор-3-[4-(4-хлор-3-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина
[0668]
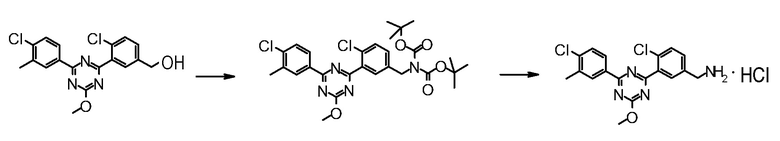
[0669]
В атмосфере аргона к раствору {4-хлор-3-[4-(4-хлор-3-метилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанола (0,40 г, 1,1 ммоль), полученного в вышеупомянутом (5), в тетрагидрофуране (4,0 мл) добавляли триэтиламин (0,19 мл, 1,4 ммоль) и метансульфонилхлорид (0,098 мл, 1,3 ммоль) при охлаждении льдом, и смесь перемешивали в течение 1 часа. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К раствору остатка в N,N-диметилформамиде (2,0 мл) добавляли карбонат цезия (1,0 г, 3,2 ммоль) и ди-трет-бутил-иминодикарбоксилат (0,37 г, 1,7 ммоль) при комнатной температуре, и смесь перемешивали в течение 3 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=95/5-80/20). В атмосфере аргона, к раствору (2,0 мл) очищенного продукта в 1,4-диоксане добавляли 4 M раствора хлористый водород/1,4-диоксан (4,0 мл) при комнатной температуре, и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли н-гексан, и твердое вещество собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (0,43 г, выход 99%).
1H-ЯМР (ДМСО-D6) δ: 2,47 (3H, с), 4,13-4,19 (5H, м), 7,67 (1H, д, J=8,3 Гц), 7,71-7,76 (2H, м), 8,16 (1H, д, J=1,6 Гц), 8,35 (1H, дд, J=8,3, 1,6 Гц), 8,41-8,50 (4H, м).
[0670]
(7) (R)-N-{4-хлор-3-[4-(4-хлор-3-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2-метокси-2-метилпропионамид
[0671]

[0672]
В атмосфере аргона к раствору гидрохлорида 4-хлор-3-[4-(4-хлор-3-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина (0,070 г, 0,17 ммоль), полученного в вышеупомянутом (6), HOBt・H2O (0,039 г, 0,26 ммоль) и WSC・HCl (0,049 г, 0,26 ммоль) в N,N-диметилформамиде (0,70 мл) добавляли (R)-3,3,3-трифтор-2-метокси-2-метилпропионовую кислоту (0,038 г, 0,22 ммоль), полученную в вышеупомянутом (3), и триэтиламин (0,071 мл, 0,51 ммоль) при комнатной температуре, и смесь перемешивали в течение 18 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/2) с получением указанного в заголовке соединения (0,058 г, выход 65%).
1H-ЯМР (CDCl3) δ: 1,66 (3H, с), 2,48 (3H, с), 3,45 (3H, с), 4,20 (3H, с), 4,48 (1H, дд, J=15,1, 5,8 Гц), 4,63 (1H, дд, J=15,1, 6,5 Гц), 7,16 (1H, ушир. с), 7,37 (1H, дд, J=8,3, 2,3 Гц), 7,48 (1H, д, J=8,3 Гц), 7,53 (1H, д, J=8,3 Гц), 7,92 (1H, д, J=2,3 Гц), 8,36 (1H, дд, J=8,3, 2,0 Гц), 8,46 (1H, д, J=2,0 Гц).
[0673]
(8) (R)-N-{4-хлор-3-[4-(4-хлор-3-метилфенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2-метокси-2-метилпропионамид (Пример No.1-136)
[0674]
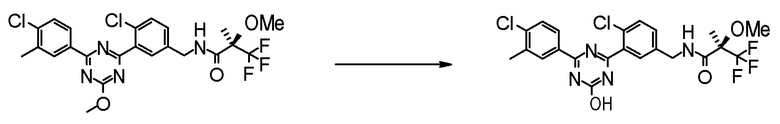
[0675]
В атмосфере аргона к раствору (R)-N-{4-хлор-3-[4-(4-хлор-3-метилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2-метокси-2-метилпропионамида (0,058 г, 0,11 ммоль), полученного в вышеупомянутом (7), в метаноле (1,3 мл) добавляли 4 M водного раствора гидроксида натрия (0,17 мл) при комнатной температуре, и смесь перемешивали при 60°C в течение 3 часов. К реакционной смеси добавляли 10% водный раствор лимонной кислоты (0,68 мл) и воду, и смесь перемешивали при комнатной температуре. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,051 г, выход 88%).
[0676]
[Пример получения 20]
Синтез (R)-N-{4-хлор-3-[4-гидрокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2-метокси-2-метилпропионамида (Пример No.1-137)
[0677]
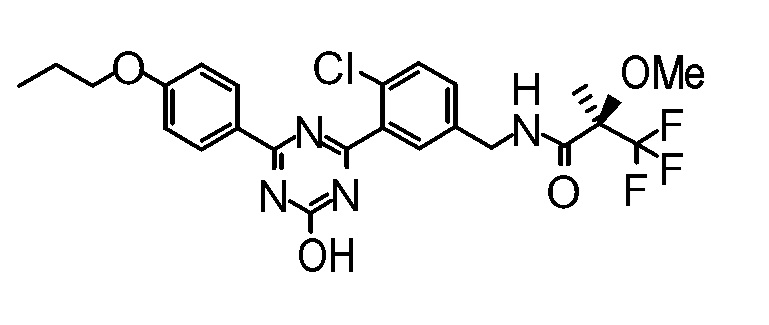
[0678]
(1) (R)-N-{4-хлор-3-[4-метокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2-метокси-2-метилпропионамид
[0679]
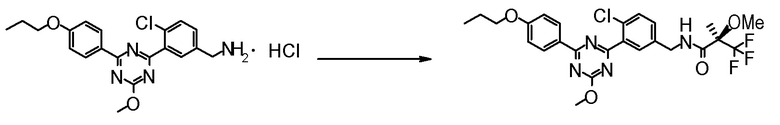
[0680]
В атмосфере аргона к раствору гидрохлорида 4-хлор-3-[4-метокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензиламина (0,80 г, 0,19 ммоль), полученного в [Примере получения 13] (4), HOBt・H2O (0,044 г, 0,28 ммоль) и WSC・HCl (0,055 г, 0,28 ммоль) в N,N-диметилформамиде (1,0 мл) добавляли (R)-3,3,3-трифтор-2-метокси-2-метилпропионовую кислоту (0,046 г, 0,27 ммоль), полученную в [Примере получения 19] (3), и триэтиламин (0,080 мл, 0,57 ммоль) при комнатной температуре, и смесь перемешивали в течение 18 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=8/2-3/2) с получением указанного в заголовке соединения (0,084 г, выход 82%).
1H-ЯМР (CDCl3) δ: 1,07 (3H, т, J=7,4 Гц), 1,66 (3H, ушир. с), 1,81-1,90 (2H, м), 3,45 (3H, ушир. с), 4,02 (2H, т, J=6,5 Гц), 4,19 (3H, с), 4,50 (1H, дд, J=15,0, 5,8 Гц), 4,59 (1H, дд, J=15,0, 6,3 Гц), 6,97-7,02 (2H, м), 7,14 (1H, ушир. с), 7,35 (1H, дд, J=8,3, 2,3 Гц), 7,51 (1H, д, J=8,3 Гц), 7,92 (1H, д, J=2,3 Гц), 8,52-8,56 (2H, м).
[0681]
(2) (R)-N-{4-хлор-3-[4-гидрокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2-метокси-2-метилпропионамид (Пример No.1-137)
[0682]
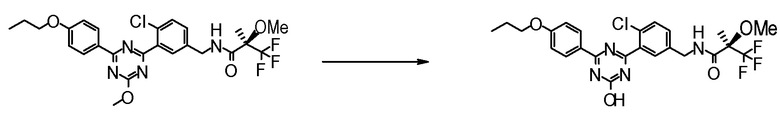
[0683]
В атмосфере аргона к раствору (R)-N-{4-хлор-3-[4-метокси-6-(4-пропоксифенил)-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2-метокси-2-метилпропионамида (0,084 г, 0,16 ммоль), полученного в вышеупомянутом (1), в метаноле (0,80 мл) добавляли 4 M водного раствора гидроксида натрия (0,30 мл) при комнатной температуре, и смесь перемешивали при 65°C в течение 1,5 часов. К реакционной смеси добавляли 2 н соляной кислоты (0,60 мл) и воду, и смесь перемешивали при комнатной температуре. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,072 г, выход 89%).
[0684]
[Пример получения 21]
Синтез N-{4-хлор-3-[4-(3,4-диметилфенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-150)
[0685]
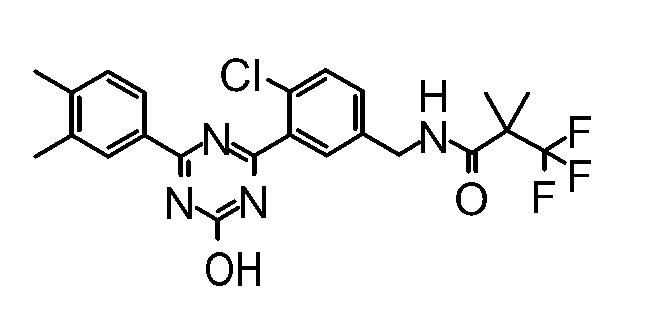
[0686]
(1) 2-хлор-4-(3,4-диметилфенил)-6-метокси-1,3,5-триазин
[0687]
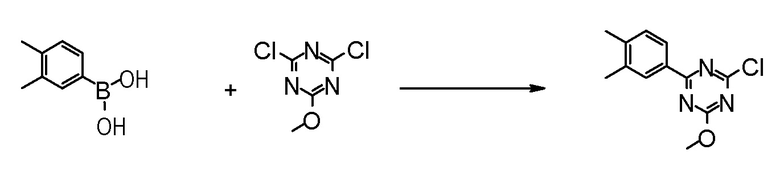
[0688]
В атмосфере аргона, к суспензии 3,4-диметилбензолбороновой кислоты (0,42 г, 2,8 ммоль), 2,4-дихлор-6-метокси-1,3,5-триазина (1,0 г, 5,6 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,32 г, 0,28 ммоль) в толуоле (8,4 мл) добавляли 2М водного раствора карбоната натрия (4,2 мл), и смесь перемешивали при 100°C в течение 2 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=20/1) с получением указанного в заголовке соединения (0,64 г, 92%).
1H-ЯМР (CDCl3) δ: 2,35 (6H, с), 4,16 (3H, с), 7,26 (3H, д, J=7,8 Гц), 8,22 (1H, дд, J=7,8, 2,1 Гц), 8,25 (1H, д, J=2,1 Гц).
[0689]
(2) {4-хлор-3-[4-(3,4-диметилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанол
[0690]
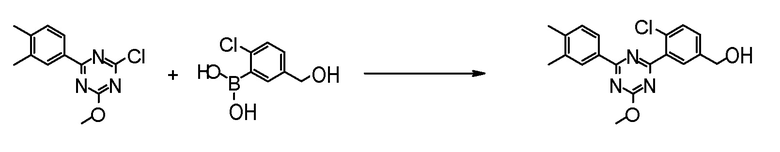
[0691]
В атмосфере аргона к раствору 2-хлор-4-(3,4-диметилфенил)-6-метокси-1,3,5-триазина (0,64 г, 2,6 ммоль), полученного в вышеупомянутом (1), 2-хлор-5-гидроксиметилфенилбороновой кислоты (0,57 г, 3,1 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,21 г, 0,26 ммоль) в 1,4-диоксане (10 мл) добавляли 2М водного раствора карбоната натрия (5,1 мл), и смесь перемешивали при 100°C в течение 1 часа. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=5/3) с получением указанного в заголовке соединения (0,54 г, выход 59%).
1H-ЯМР (CDCl3) δ: 1,87 (1H, т, J=5,0 Гц), 2,35 (3H, с), 2,36 (3H, с), 4,20 (3H, с), 4,76 (2H, д, J=5,0 Гц), 7,27 (2H, д, J=8,2 Гц), 7,45 (1H, дд, J=8,4, 1,6 Гц), 7,53 (1H, д, J=8,4 Гц), 7,99 (1H, д, J=1,6 Гц), 8,33 (1H, д, J=8,2 Гц), 8,35 (1H, ушир.с).
[0692]
(3) гидрохлорид 4-хлор-3-[4-(3,4-диметилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина
[0693]
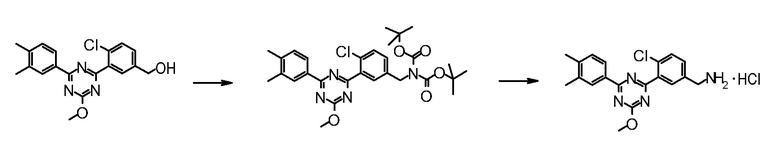
[0694]
В атмосфере аргона к раствору {4-хлор-3-[4-(3,4-диметилфенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанола (0,54 г, 1,5 ммоль), полученного в вышеупомянутом (2), в тетрагидрофуране (5,5 мл) добавляли триэтиламин (0,28 мл, 2,0 ммоль) и метансульфонилхлорид (0,14 мл, 1,8 ммоль) при охлаждении льдом, и смесь перемешивали в течение 0,5 часа. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К раствору остатка в N,N-диметилформамиде (5,5 мл) добавляли карбонат цезия (1,5 г, 4,6 ммоль) и ди-трет-бутил-иминодикарбоксилат (0,40 г, 1,8 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=7/1). В атмосфере аргона, r очищенному продукту добавляли 4 M раствора хлористый водород/1,4-диоксан (6,5 мл) при комнатной температуре, и смесь перемешивали в течение 0,5 часа. К реакционной смеси добавляли этилацетат, и твердое вещество собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (0,56 г, выход 94%).
1H-ЯМР (ДМСО-D6) δ: 2,34 (3H, с), 2,35 (3H, с), 4,12-4,19 (5H, м), 7,38 (1H, д, J=7,9 Гц), 7,69-7,75 (2H, м), 8,12 (1H, д, J=1,9 Гц), 8,26 (1H, дд, J=7,9, 1,6 Гц), 8,29 (1H, ушир. с), 8,44 (3H, ушир.с).
[0695]
(4) N-{4-хлор-3-[4-(3,4-диметилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид
[0696]
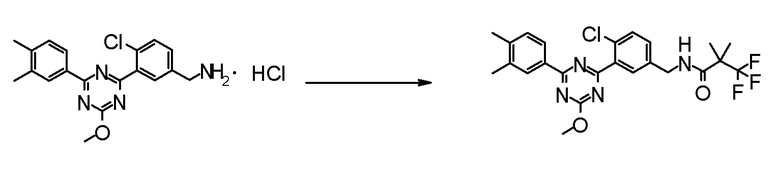
[0697]
В атмосфере аргона к раствору гидрохлорида 4-хлор-3-[4-(3,4-диметилфенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина (0,070 г, 0,18 ммоль), полученного в вышеупомянутом (3), HOBt・H2O (0,035 г, 0,23 ммоль) и WSC・HCl (0,044 г, 0,23 ммоль) в N,N-диметилформамиде (2,0 мл) добавляли 3,3,3-трифтор-2,2-диметилпропионовую кислоту (0,036 г, 0,23 ммоль) и триэтиламин (0,075 мл, 0,54 ммоль) при комнатной температуре, и смесь перемешивали в течение 4 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=2/1) с получением указанного в заголовке соединения (0,075 г, выход 85%).
1H-ЯМР (CDCl3) δ: 1,44 (6H, с), 2,36 (3H, с), 2,37 (3H, с), 4,20 (3H, с), 4,55 (2H, д, J=5,7 Гц), 6,22 (1H, ушир. с), 7,27 (3H, д, J=7,8 Гц), 7,35 (1H, дд, J=8,2, 2,2 Гц), 7,52 (1H, д, J=8,2 Гц), 7,91 (1H, д, J=2,2 Гц), 8,32 (1H, дд, J=7,8, 1,7 Гц), 8,35 (1H, ушир.с).
[0698]
(5) N-{4-хлор-3-[4-(3,4-диметилфенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-150)
[0699]
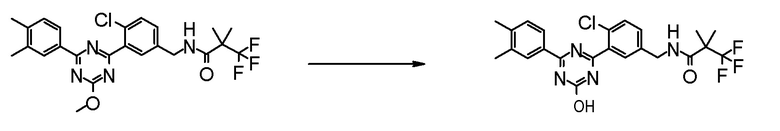
[0700]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(3,4-диметилфенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,075 г, 0,15 ммоль), полученного в вышеупомянутом (4), в метаноле (1,8 мл) добавляли 4 M водного раствора гидроксида натрия (0,23 мл) при комнатной температуре, и смесь перемешивали при 60°C в течение 4 часов. К реакционной смеси добавляли 10% водный раствор лимонной кислоты (1,0 мл) и воду при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,063 г, выход 86%).
[0701]
[Пример получения 22]
Синтез N-{4-хлор-3-[4-(4-циклопропилметоксифенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2-метил-2-трифторметилпропионамида (Пример No.1-169)
[0702]
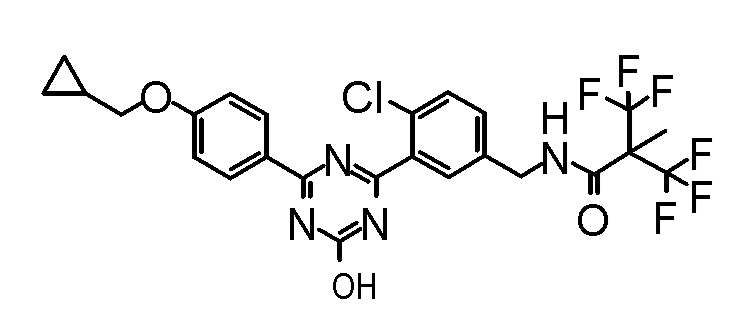
[0703]
(1) 2-хлор-4-(4-циклопропилметоксифенил)-6-метокси-1,3,5-триазин
[0704]

[0705]
В атмосфере аргона, к суспензии 4-(циклопропилметокси)бензолбороновой кислоты (2,5 г, 13 ммоль), 2,4-дихлор-6-метокси-1,3,5-триазина (4,7 г, 26 ммоль) и тетракис(трифенилфосфин)палладия(0) (1,5 г, 1,3 ммоль) в толуоле (25 мл) добавляли 2М водного раствора карбоната натрия (20 мл), и смесь перемешивали при 100°C в течение 2 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=90/10-80/20) с получением указанного в заголовке соединения (3,0 г, 79%).
1H-ЯМР (CDCl3) δ: 0,36-0,41 (2H, м), 0,65-0,71 (2H, м), 1,25-1,36 (1H, м), 3,90 (2H, д, J=7,0 Гц), 4,14 (3H, с), 6,96-7,00 (2H, м), 8,42-8,47 (2H, м).
[0706]
(2) {4-хлор-3-[4-(4-циклопропилметоксифенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанол
[0707]
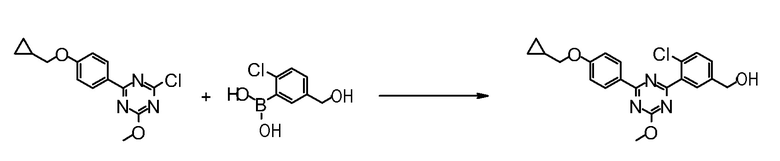
[0708]
В атмосфере аргона к раствору 2-хлор-4-(4-циклопропилметоксифенил)-6-метокси-1,3,5-триазина (3,0 г, 10 ммоль), полученного в вышеупомянутом (1), 2-хлор-5-гидроксиметилфенилбороновой кислоты (2,3 г, 12 ммоль) и аддукта [1,1'-бис(дифенилфосфино)ферроцен]палладия(II)дихлорида дихлорметана (0,84 г, 1,0 ммоль) в 1,4-диоксане (30 мл) добавляли 2М водного раствора карбоната натрия (21 мл), и смесь перемешивали при 100°C в течение 3 часов. При комнатной температуре к реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=8/2-1/1) с получением указанного в заголовке соединения (2,9 г, выход 71%).
1H-ЯМР (CDCl3) δ: 0,37-0,41 (2H, м), 0,65-0,71 (2H, м), 1,27-1,36 (1H, м), 1,76 (1H, т, J=6,0 Гц), 3,90 (2H, д, J=6,7 Гц), 4,19 (3H, с), 4,77 (2H, д, J=6,0 Гц), 6,98-7,02 (2H, м), 7,46 (1H, дд, J=8,1, 1,9 Гц), 7,53 (1H, д, J=8,1 Гц), 8,00 (1H, д, J=1,9 Гц), 8,53-8,57 (2H, м).
[0709]
(3) гидрохлорид 4-хлор-3-[4-(4-циклопропилметоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина
[0710]
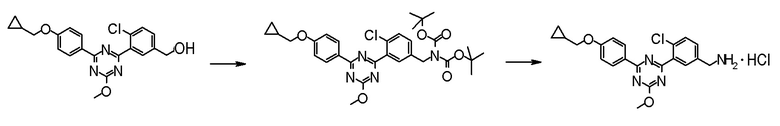
[0711]
В атмосфере аргона к раствору {4-хлор-3-[4-(4-циклопропилметоксифенил)-6-метокси-1,3,5-триазин-2-ил]фенил}метанола (2,9 г, 7,3 ммоль), полученного в вышеупомянутом (2), в тетрагидрофуране (29 мл) добавляли триэтиламин (1,3 мл, 9,5 ммоль) и метансульфонилхлорид (0,68 мл, 8,7 ммоль) при охлаждении льдом, и смесь перемешивали в течение 0,5 часа. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К раствору остатка в N,N-диметилформамиде (29 мл) добавляли карбонат цезия (7,1 г, 22 ммоль) и ди-трет-бутил-иминодикарбоксилат (1,9 г, 8,7 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=95/5-70/30). В атмосфере аргона, к раствору (9,3 мл) очищенного продукта в 1,4-диоксане добавляли 4 M раствора хлористый водород/1,4-диоксан (37 мл) при комнатной температуре, и смесь перемешивали в течение 3 часов. К реакционной смеси добавляли этилацетат, и твердое вещество собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (3,1 г, выход 97%).
1H-ЯМР (ДМСО-D6) δ: 0,34-0,39 (2H, м), 0,57-0,63 (2H, м), 1,21-1,32 (1H, м), 3,95 (2H, д, J=7,0 Гц), 4,11-4,18 (5H, м), 7,11-7,15 (2H, м), 7,70-7,74 (2H, м), 8,13 (1H, ушир. с), 8,42-8,53 (5H, м).
[0712]
(4) N-{4-хлор-3-[4-(4-циклопропилметоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2-метил-2-трифторметилпропионамид
[0713]
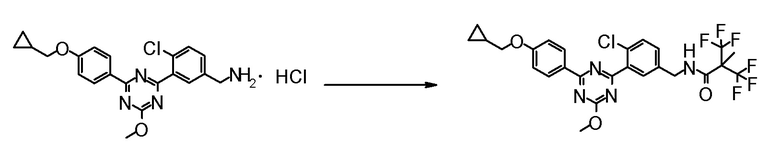
[0714]
В атмосфере аргона к раствору гидрохлорида 4-хлор-3-[4-(4-циклопропилметоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина (0,080 г, 0,18 ммоль), полученного в вышеупомянутом (3), HOBt・H2O (0,037 г, 0,24 ммоль) и WSC・HCl (0,046 г, 0,24 ммоль) в N,N-диметилформамиде (2,0 мл) добавляли 2,2-бис(трифторметил)пропионовую кислоту (0,050 г, 0,24 ммоль) и триэтиламин (0,077 мл, 0,55 ммоль) при комнатной температуре, и смесь перемешивали в течение 1,5 часов. К реакционной смеси добавляли HOBt・H2O (0,037 г, 0,24 ммоль), WSC・HCl (0,046 г, 0,24 ммоль), 2,2-бис(трифторметил)пропионовую кислоту (0,050 г, 0,24 ммоль) и триэтиламин (0,077 мл, 0,55 ммоль), и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли HOBt・H2O (0,037 г, 0,24 ммоль), WSC・HCl (0,046 г, 0,24 ммоль), 2,2-бис(трифторметил)пропионовую кислоту (0,050 г, 0,24 ммоль) и триэтиламин (0,077 мл, 0,55 ммоль), и смесь перемешивали в течение 1,5 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1) с получением указанного в заголовке соединения (0,045 г, выход 41%).
1H-ЯМР (CDCl3) δ: 0,36-0,41 (2H, м), 0,65-0,71 (2H, м), 1,26-1,35 (2H, м), 1,70 (3H, с), 3,90 (2H, д, J=6,7 Гц), 4,19 (3H, с), 4,61 (2H, д, J=5,8 Гц), 6,49 (1H, ушир. с), 6,98-7,02 (2H, м), 7,32 (1H, дд, J=8,5, 2,1 Гц), 7,53 (1H, д, J=8,5 Гц), 7,92 (1H, д, J=2,1 Гц), 8,52-8,56 (2H, м).
[0715]
(5) N-{4-хлор-3-[4-(4-циклопропилметоксифенил)-6-гидрокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2-метил-2- трифторметилпропионамид (Пример No.1-169)
[0716]
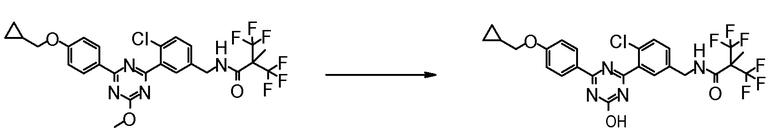
[0717]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(4-циклопропилметоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2-метил-2-трифторметилпропионамида (0,045 г, 0,076 ммоль), полученного в вышеупомянутом (4), в метаноле (0,70 мл) добавляли 4 M водного раствора гидроксида натрия (0,11 мл) при комнатной температуре, и смесь перемешивали при 60°C в течение 4 часов. К реакционной смеси добавляли 10% водный раствор лимонной кислоты (0,50 мл) и воду, и смесь перемешивали при комнатной температуре. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,039 г, выход 89%).
[0718]
[Пример получения 23]
Синтез 1-трифторметилциклопропанкарбоновой кислоты 4-хлор-3-[4-гидрокси-6-(4-изобутоксифенил)-1,3,5-триазин-2-ил]бензиламида (Пример No.1-178)
[0719]
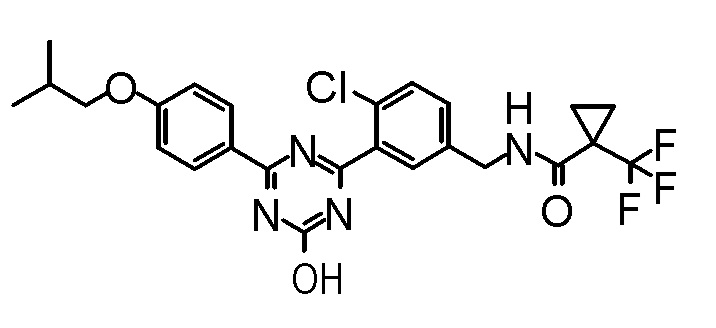
[0720]
(1) 1-трифторметилциклопропанкарбоновой кислоты 4-хлор-3-[4-(4-изобутоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензиламид
[0721]
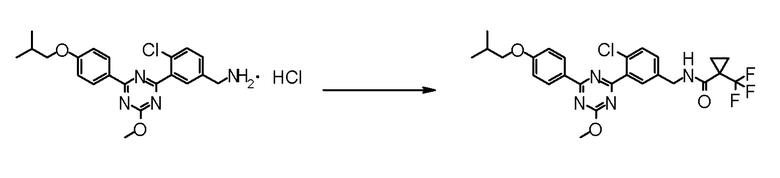
[0722]
В атмосфере аргона к раствору гидрохлорида 4-хлор-3-[4-(4-изобутоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензиламина (0,10 г, 0,23 ммоль), полученного в [Примере получения 12] (4), HOBt・H2O (0,049 г, 0,32 ммоль) и WSC・HCl (0,061 г, 0,32 ммоль) в N,N-диметилформамиде (0,75 мл) добавляли 1-трифторметилциклопропан-1-карбоновую кислоту (0,050 г, 0,32 ммоль) и триэтиламин (0,064 мл, 0,46 ммоль) при комнатной температуре, и смесь перемешивали в течение 1,5 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=2/1, затем хлороформ/этилацетат=9/1) с получением указанного в заголовке соединения (0,068 г, выход 55%).
1H-ЯМР (ДМСО-D6) δ: 1,01 (6H, д, J=6,9 Гц), 1,23-1,27 (2H, м), 1,30-1,36 (2H, м), 2,00-2,11 (1H, м), 3,87 (2H, д, J=6,4 Гц), 4,12 (3H, с), 4,37 (2H, д, J=5,9 Гц), 7,11-7,15 (2H, м), 7,43 (1H, дд, J=8,2, 2,1 Гц), 7,60 (1H, д, J=8,2 Гц), 7,85 (1H, д, J=2,1 Гц), 8,43-8,47 (2H, м), 8,50 (1H, т, J=5,9 Гц).
[0723]
(2) 1-трифторметилциклопропанкарбоновой кислоты 4-хлор-3-[4-гидрокси-6-(4-изобутоксифенил)-1,3,5-триазин-2-ил]бензиламид (Пример No.1-178)
[0724]

[0725]
В атмосфере аргона к раствору 1-трифторметилциклопропанкарбоновой кислоты 4-хлор-3-[4-(4-изобутоксифенил)-6-метокси-1,3,5-триазин-2-ил]бензиламида (0,065 г, 0,12 ммоль), полученного в вышеупомянутом (1), в метаноле (1,0 мл) добавляли 4 M водного раствора гидроксида натрия (0,12 мл) при комнатной температуре, и смесь перемешивали при 60°C в течение 3 часов. К реакционной смеси добавляли 2 н соляной кислоты (0,24 мл) и воду при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,060 г, выход 94%).
[0726]
[Пример получения 24]
Синтез N-(4-хлор-3-{4-[4-((S)-1-циклопропилэтокси)фенил]-6-гидрокси-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-184)
[0727]
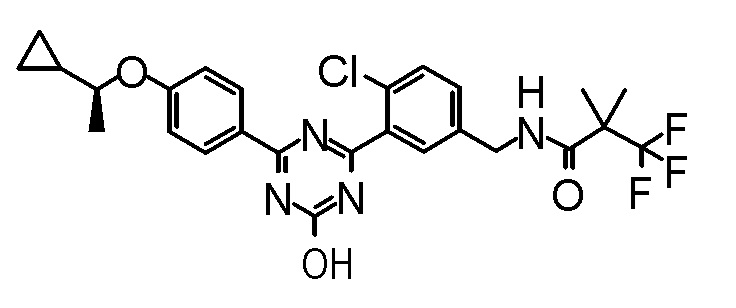
[0728]
(1) N-(4-хлор-3-{4-[4-((S)-1-циклопропилэтокси)фенил]-6-метокси-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамид
[0729]
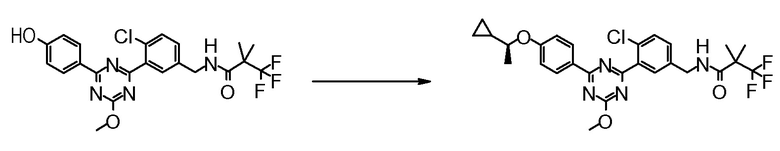
[0730]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(4-гидроксифенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,080 г, 0,17 ммоль), полученного в вышеупомянутом [Примере получения 14] (6), (1R)-1-циклопропилэтан-1-ола (0,029 г, 0,33 ммоль) и трифенилфосфина (0,087 г, 0,33 ммоль) в тетрагидрофуране (1,0 мл) добавляли бис(2-метоксиэтил)азодикарбоксилат (0,078 г, 0,33 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 17 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=2/1) с получением указанного в заголовке соединения (0,079 г, выход 86%).
1H-ЯМР (CDCl3) δ: 0,28-0,36 (1H, м), 0,38-0,45 (1H, м), 0,53-0,63 (2H, м), 1,12-1,21 (1H, м), 1,41 (3H, д, J=6,0 Гц), 1,44 (6H, с), 3,95-4,05 (1H, м), 4,18 (3H, с), 4,54 (2H, д, J=5,6 Гц), 6,20 (1H, ушир. с), 6,95-7,00 (2H, м), 7,34 (1H, дд, J=8,3, 1,9 Гц), 7,51 (1H, д, J=8,3 Гц), 7,91 (1H, д, J=1,9 Гц), 8,50-8,55 (2H, м).
[0731]
(2) N-(4-хлор-3-{4-[4-((S)-1-циклопропилэтокси)фенил]-6-гидрокси-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-184)
[0732]
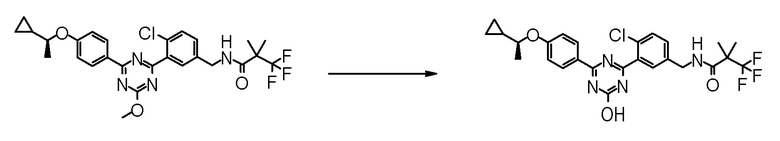
[0733]
В атмосфере аргона к раствору N-(4-хлор-3-{4-[4-((S)-1-циклопропилэтокси)фенил]-6-метокси-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамида (0,079 г, 0,14 ммоль), полученного в вышеупомянутом (1), в метаноле (1,3 мл) добавляли 4 M водного раствора гидроксида натрия (0,22 мл) при комнатной температуре, и смесь перемешивали при 65°C в течение 4 часов. К реакционной смеси добавляли 10% водный раствор лимонной кислоты (0,90 мл) и воду при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,072 г, выход 93%).
[0734]
[Пример получения 25]
Синтез N-(4-хлор-3-{4-[4-((R)-1-циклопропилэтокси)фенил]-6-гидрокси-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамида (Пример No.1-185)
[0735]
[0736]
(1) N-(4-хлор-3-{4-[4-((R)-1-циклопропилэтокси)фенил]-6-метокси-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамид
[0737]
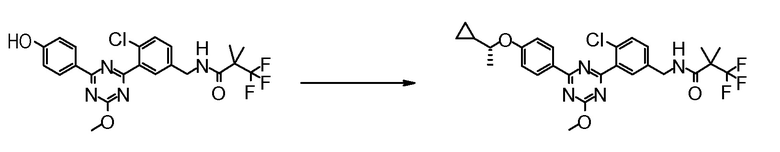
[0738]
В атмосфере аргона к раствору N-{4-хлор-3-[4-(4-гидроксифенил)-6-метокси-1,3,5-триазин-2-ил]бензил}-3,3,3-трифтор-2,2-диметилпропионамида (0,080 г, 0,17 ммоль), полученного в вышеупомянутом [Примере получения 14] (6), (1S)-1-циклопропилэтан-1-ола (0,029 г, 0,33 ммоль) и трифенилфосфина (0,087 г, 0,33 ммоль) в тетрагидрофуране (1,0 мл) добавляли бис(2-метоксиэтил)азодикарбоксилат (0,078 г, 0,33 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 17 часов. К реакционной смеси добавляли воду и этилацетат, и смесь разделяли. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали для удаления сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=2/1) с получением указанного в заголовке соединения (0,038 г, выход 41%).
1H-ЯМР (CDCl3) δ: 0,28-0,36 (1H, м), 0,38-0,45 (1H, м), 0,53-0,63 (2H, м), 1,12-1,21 (1H, м), 1,41 (3H, д, J=6,0 Гц), 1,44 (6H, с), 3,95-4,05 (1H, м), 4,18 (3H, с), 4,54 (2H, д, J=5,6 Гц), 6,20 (1H, ушир. с), 6,95-7,00 (2H, м), 7,34 (1H, дд, J=8,3, 1,9 Гц), 7,51 (1H, д, J=8,3 Гц), 7,91 (1H, д, J=1,9 Гц), 8,50-8,55 (2H, м).
[0739]
(2) N-(4-хлор-3-{4-[4-((R)-1-циклопропилэтокси)фенил]-6-гидрокси-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамид (Пример No.1-185)
[0740]
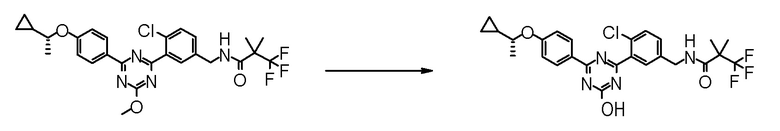
[0741]
В атмосфере аргона к раствору N-(4-хлор-3-{4-[4-((R)-1-циклопропилэтокси)фенил]-6-метокси-1,3,5-триазин-2-ил}бензил)-3,3,3-трифтор-2,2-диметилпропионамида (0,038 г, 0,069 ммоль), полученного в вышеупомянутом (1), в метаноле (0,62 мл) добавляли 4 M водного раствора гидроксида натрия (0,10 мл) при комнатной температуре, и смесь перемешивали при 65°C в течение 4 часов. К реакционной смеси добавляли 10% водный раствор лимонной кислоты (0,42 мл) и воду при комнатной температуре, и смесь перемешивали. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,034 г, выход 91%).
[0742]
Соединения примера 1-1 до примера 1-267, примера 2-1 до примера 2-130 и примера 3-1 до примера 3-23, были получены в соответствии с вышеупомянутыми способами получения. Структурные формулы и данные о свойствах соединений примеров приведены в таблице 1-1 - таблице 1-34, в таблице 2-1 - таблице 2-15 и в таблице 3-1 - таблице 3-3. В таблицах, примечания показывают следующее.
[0743]
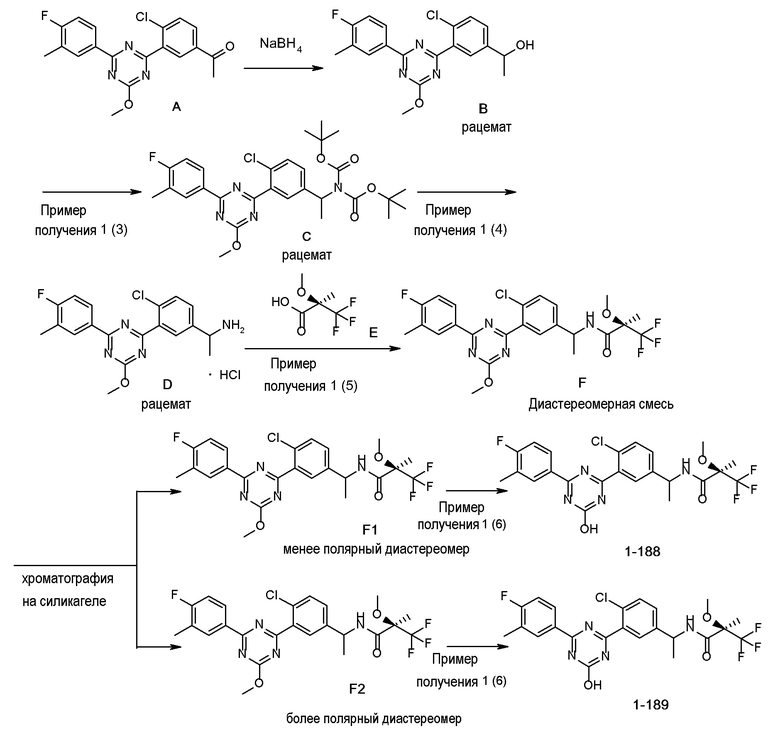
[0744]
Примечание 1 (Пример No. 1-188, 1-189)
Используя 2,4-дихлор-6-метокси-1,3,5-триазин, 4-фтор-3-метилфенилбороновую кислоту вместо 4-(2,2-диметилпропокси)фенилбороновой кислоты, и 5-ацетил-2-хлорфенилбороновую кислоту вместо 2-хлор-5-гидроксиметилфенилбороновой кислоты, и способом, аналогичным способу в Примере получения 1 (1) и (2), получали соединение A.
Рацемическое соединение B получали восстановлением карбонильной группы соединения А боргидридом натрия.
Рацемическое соединение D получали обработкой соединения В таким же образом, как в Примере получения 1 (3) и (4).
Соединение F, как диастереомерную смесь получали путем взаимодействия рацемического соединения D с энантиомерно чистым соединением E.
Соединение F1, которое представляет собой менее полярный диастереомер (Merck ТСХ на силикагеле 60G F254 25 Glassplates, элюент: н-гексан/этилацетат=2/1), и соединение F2, которое представляет собой более полярный диастереомер, получали путем очистки соединения F колоночной хроматографией на силикагеле. В то время как соединение F1 и соединение F2 являются отдельными стереоизомерами, абсолютная конфигурация асимметричного атома углерода в положении бензила является неопределенной.
Соединение примера No. 1-188 получали гидролизом соединения F1 таким же образом, как и в Примере получения 1 (6). Аналогичным образом, соединение примера No. 1-189 получали из соединения F2. В то время как соединение примера No. 1-188 и соединение примера No. 1-189 являются отдельными стереоизомерами, абсолютная конфигурация асимметричного атома углерода в положении бензила является неопределенной.
[0745]
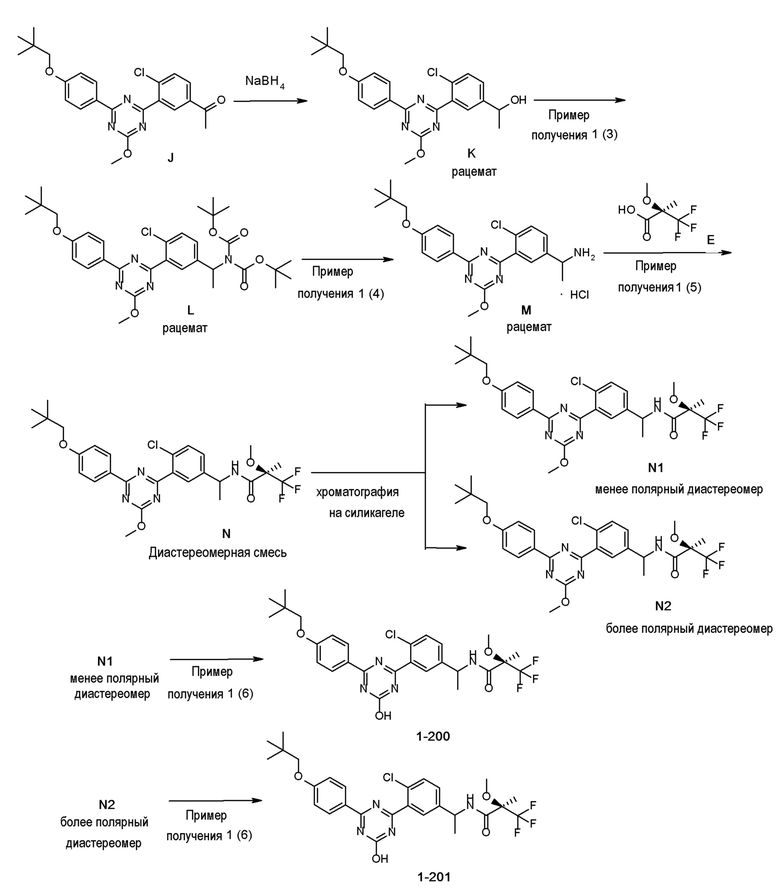
[0746]
Примечание 2 (Пример No. 1-200, 1-201)
Используя 2,4-дихлор-6-метокси-1,3,5-триазин, 4-(2,2-диметилпропокси)фенилбороновую кислоту, и 5-ацетил-2-хлорфенилбороновую кислоту вместо 2-хлор-5-гидроксиметилфенилбороновой кислоты, и способом, аналогичным способу в Примере получения 1 (1) и (2), получали соединение J.
Рацемическое соединение K получали восстановлением карбонильной группы соединения J боргидридом натрия.
Рацемическое соединение М получали обработкой соединения К таким же образом, как в Примере получения 1 (3) и (4).
Соединение N, как диастереомерную смесь получали путем взаимодействия рацемического соединения M с энантиомерно чистым соединением E.
Соединение N очищали с помощью колоночной хроматографии на силикагеле, таким же образом, как указано в примечании 1, способом, аналогичным способу в Примере получения 1 (6), соединение примера No. 1-200 получали из соединения N1, которое представляет собой менее полярный диастереомер (Merck ТСХ на силикагеле 60G F254 25 Glassplates, элюент: н-гексан/этилацетат=2/1), и соединение примера No. 1-201 получали из соединения N2, которое представляет собой более полярный диастереомер. В то время как соединения примера No. 1-200 и 1-201 являются отдельными стереоизомерами, абсолютная конфигурация асимметричного атома углерода в положении бензила является неопределенной.
[0747]Примечание 3 (Пример No. 1-256, 1-257)
В то время как соединения представляют собой отдельные стереоизомеры, их относительная конфигурация является неопределенной.
[0748]Примечание 4 (Пример No. 1-266)
В то время как соединение представляют собой отдельный стереоизомер, относительная конфигурация трет-бутильной группы является неопределенной.
[0749] Примечание 5 (Пример No. 1-267)
В то время как соединение представляют собой отдельный стереоизомер, относительная конфигурация метоксигруппы является неопределенной.
[0750]
(M+H)
(M-H)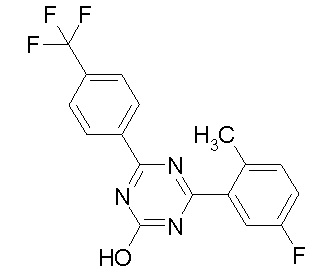

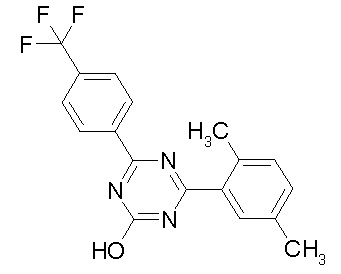

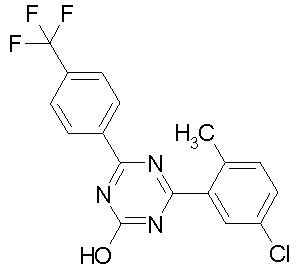

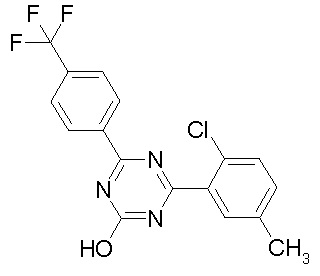

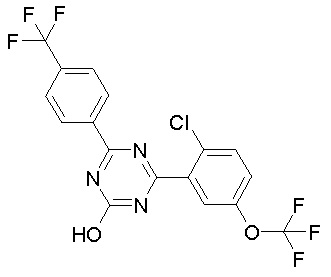

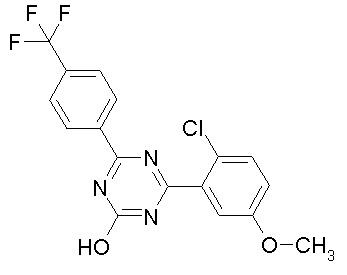

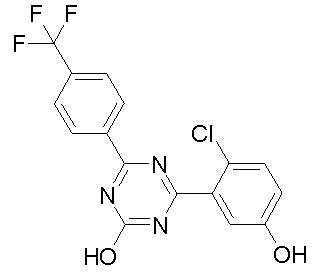

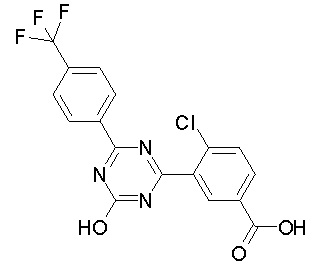

[0751]
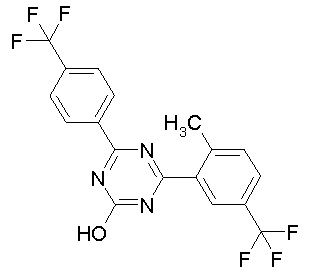

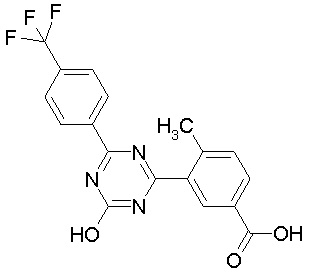

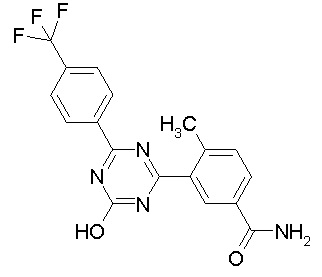

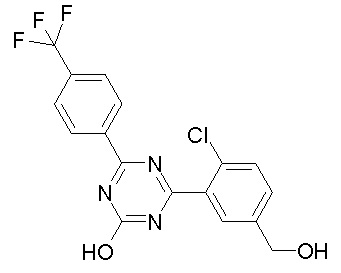

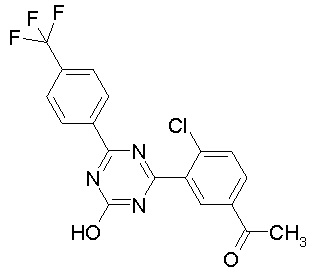

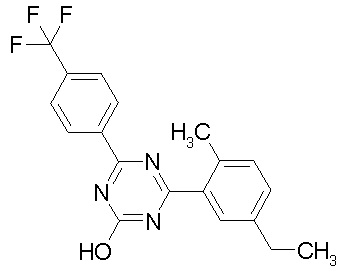

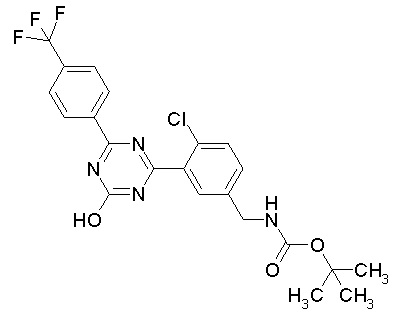

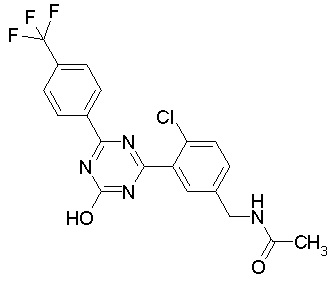

[0752]
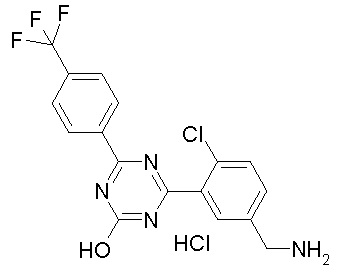

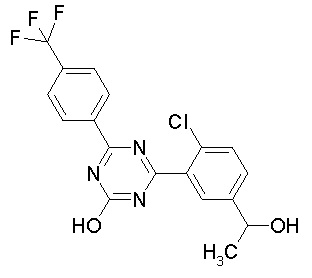

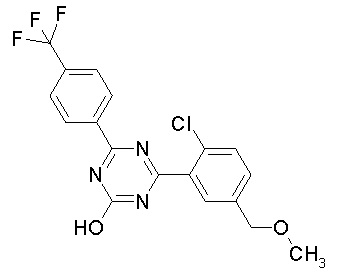

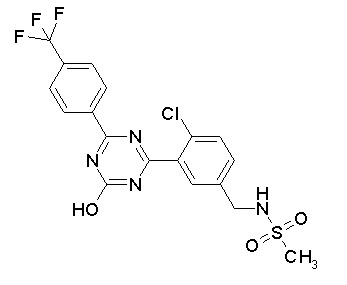

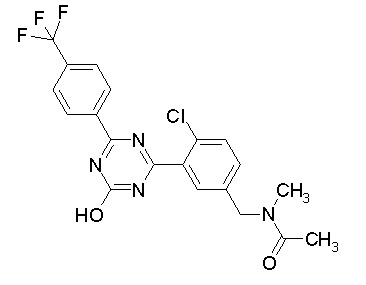

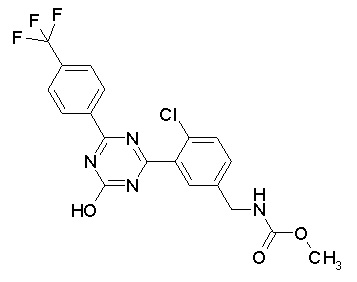

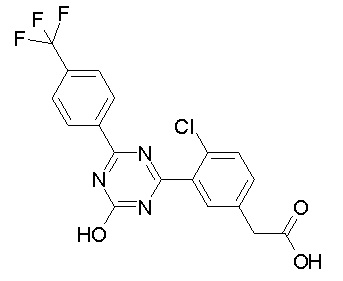

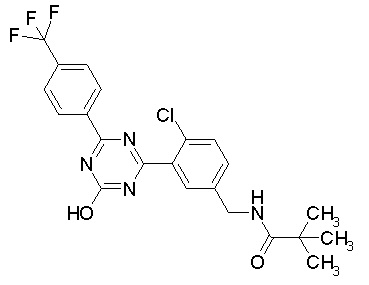

[0753]
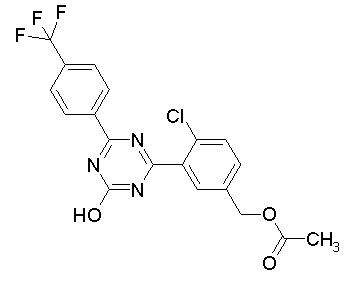

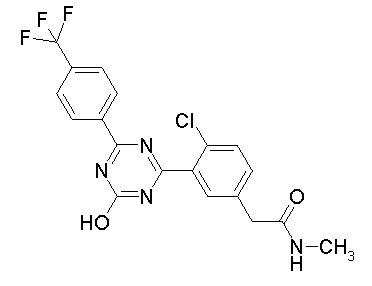

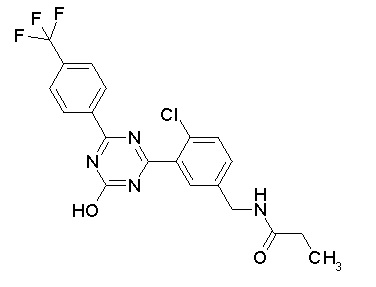

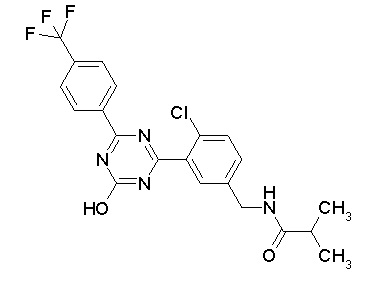

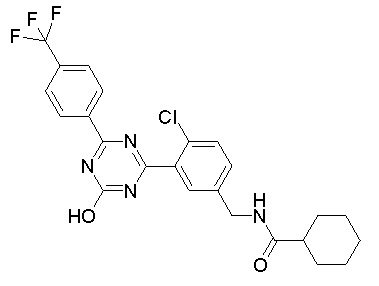

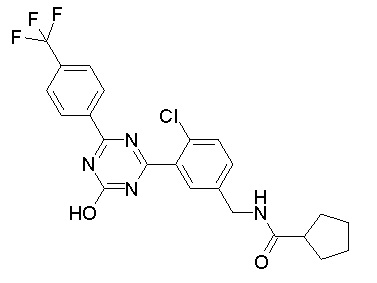

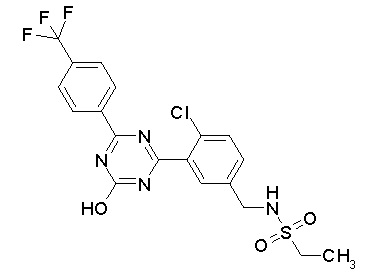

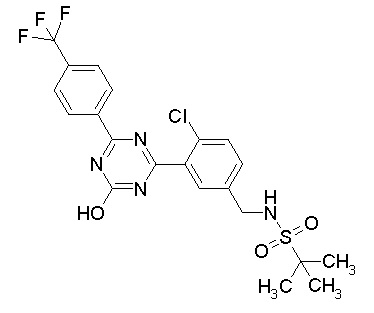

[0754]
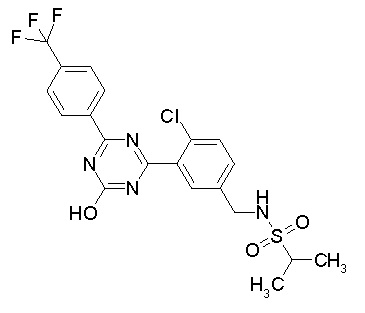

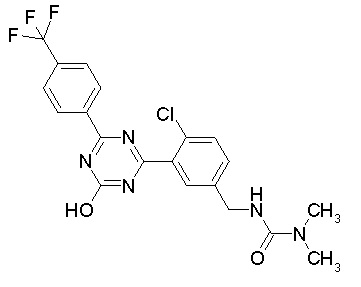

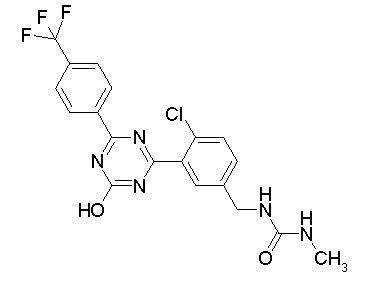

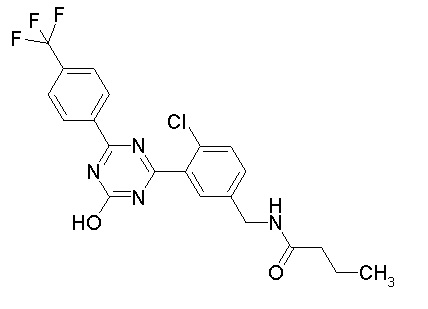

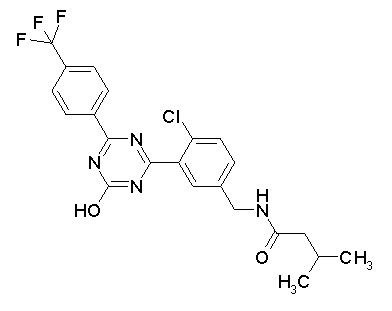

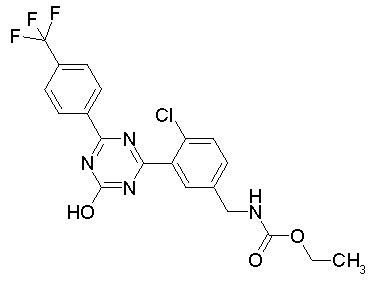

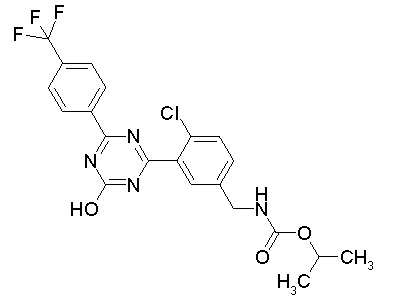

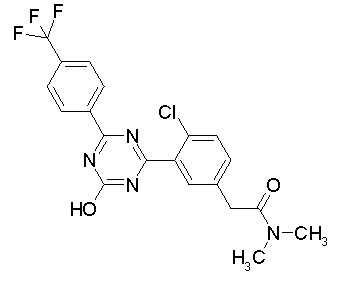

[0755]
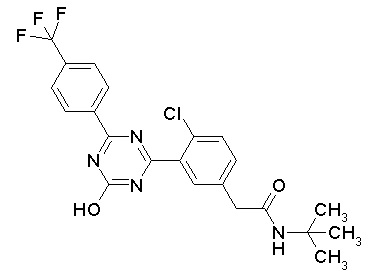

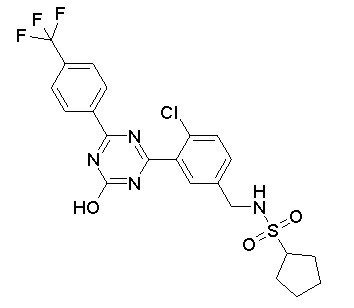

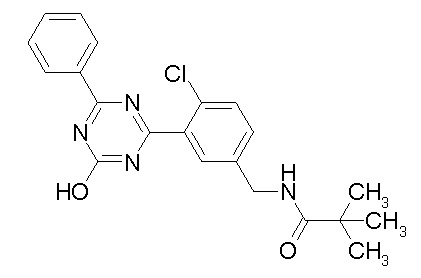

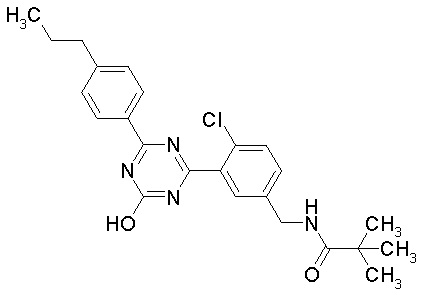

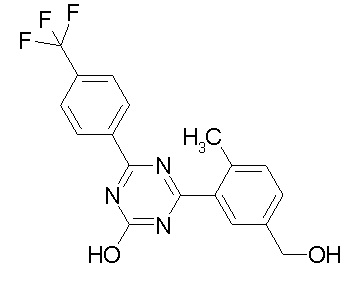

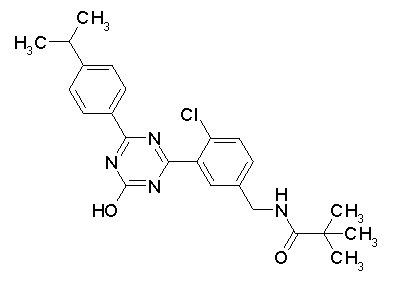

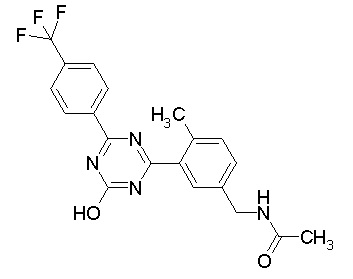

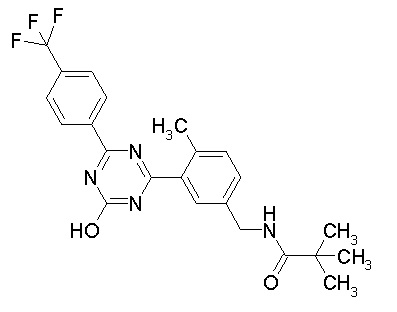

[0756]
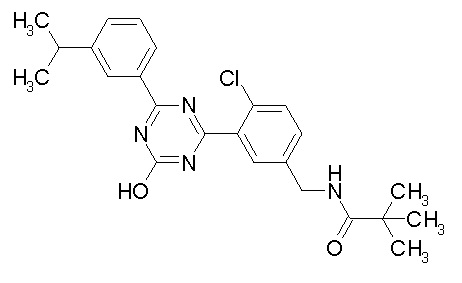

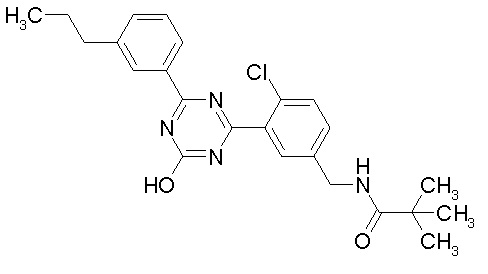

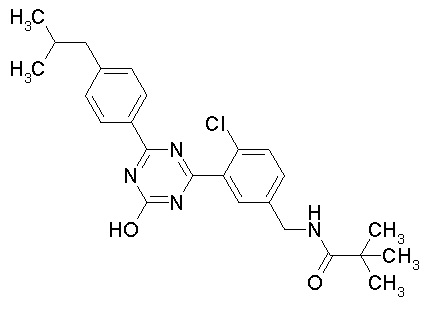

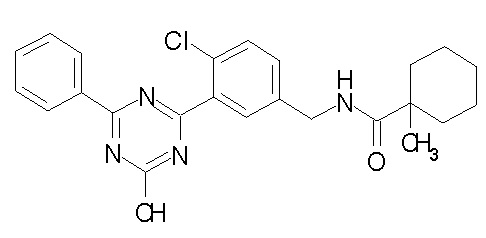

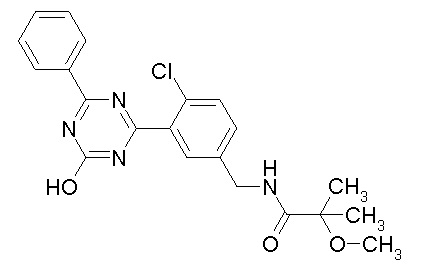

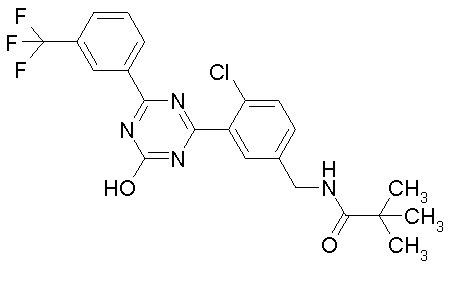

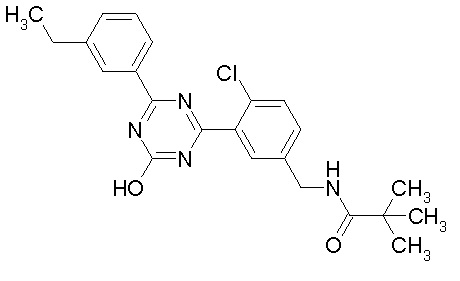

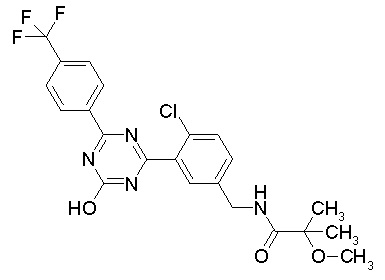

[0757]
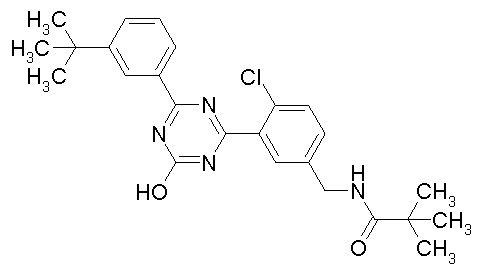

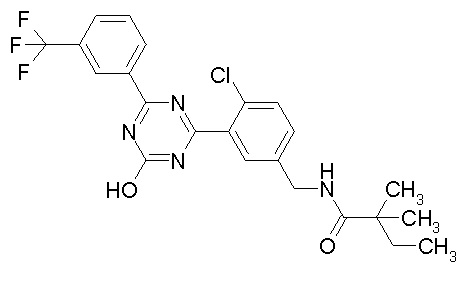





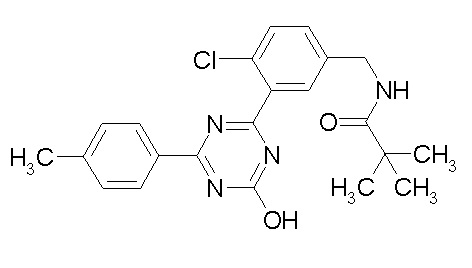

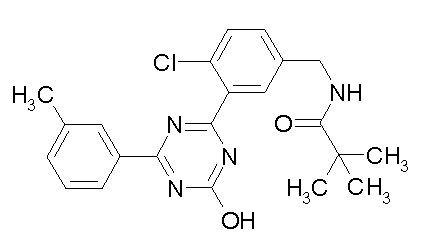
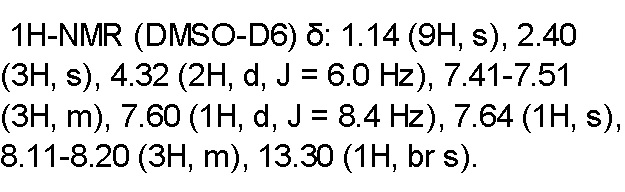
[0758]
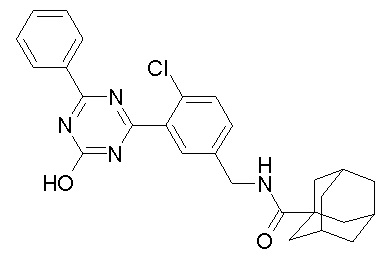

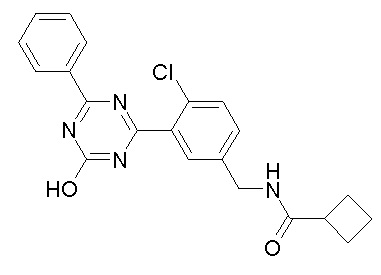

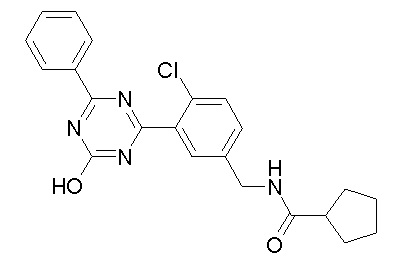

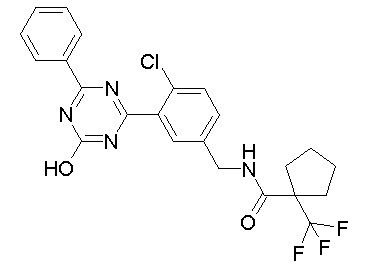

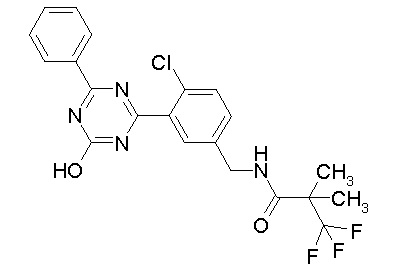

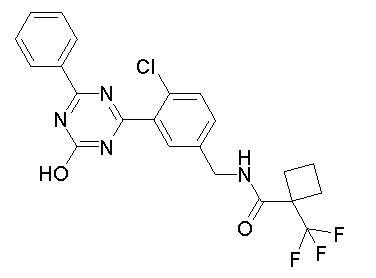

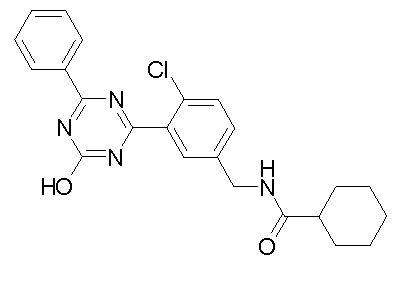

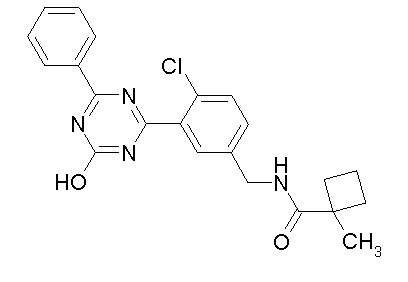

[0759]
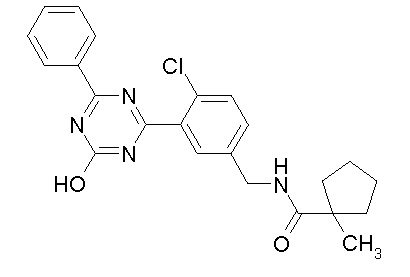

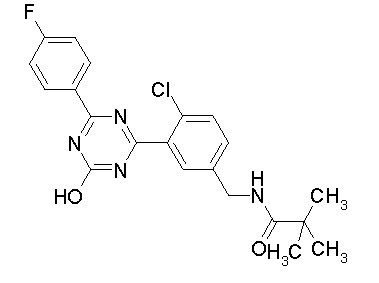

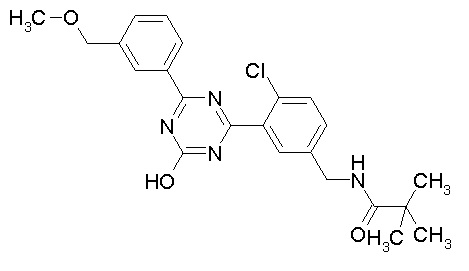

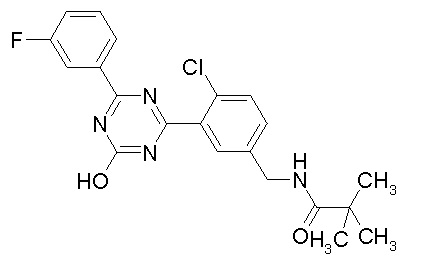

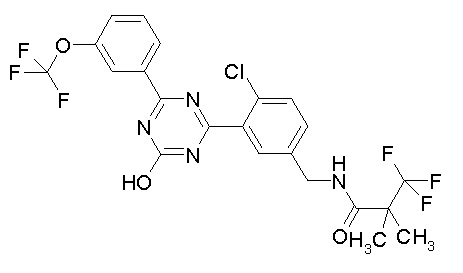

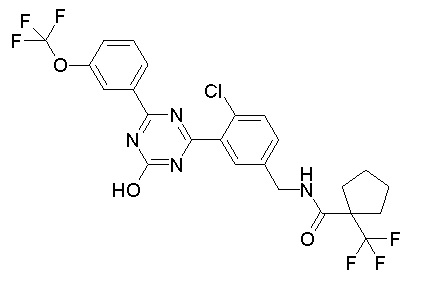

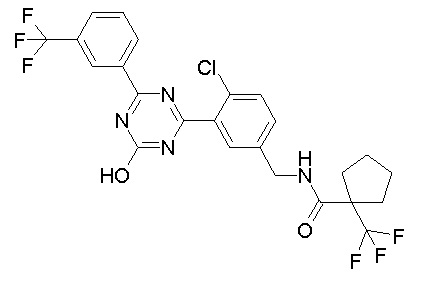

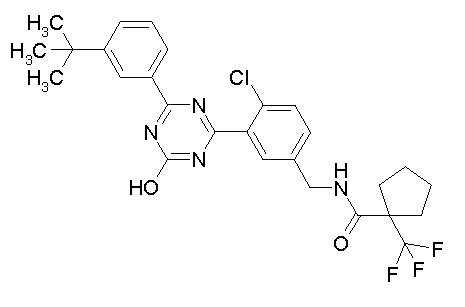

[0760]
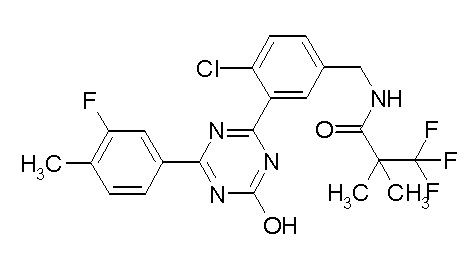

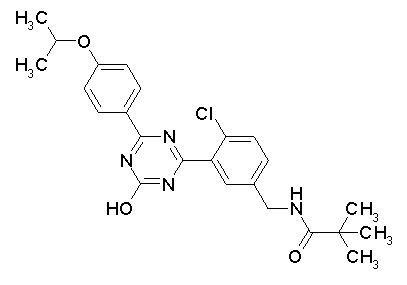

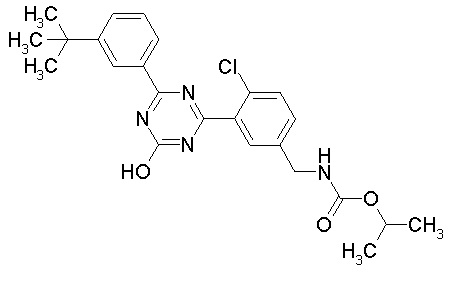

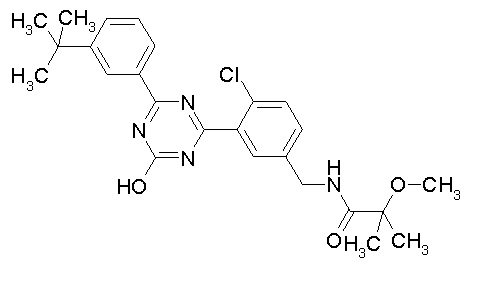

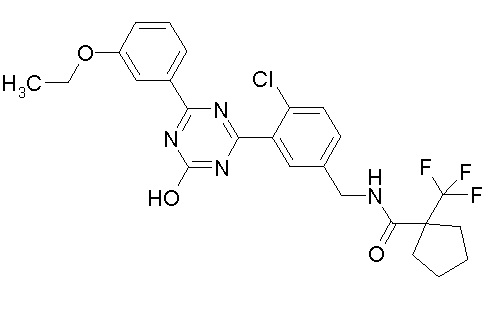

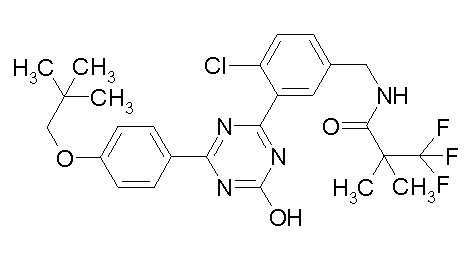

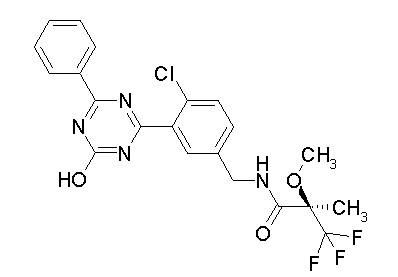

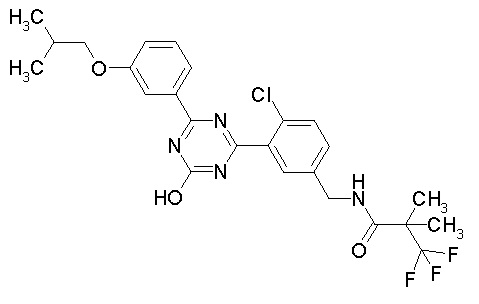

[0761]
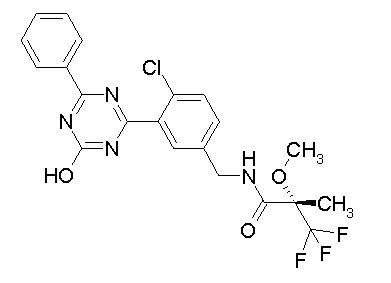

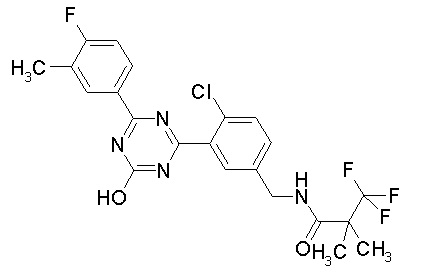

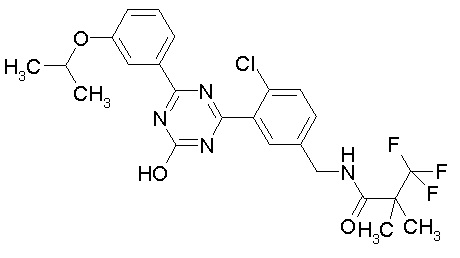

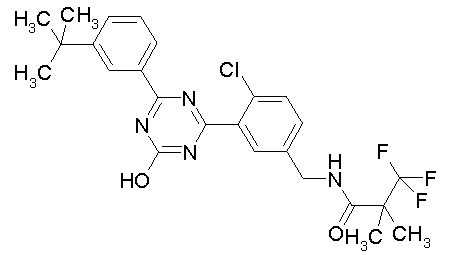

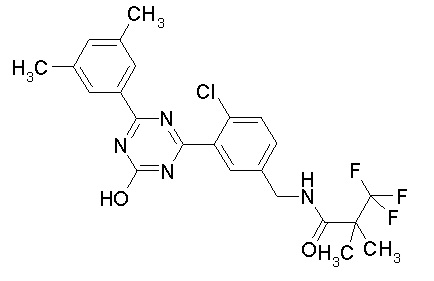

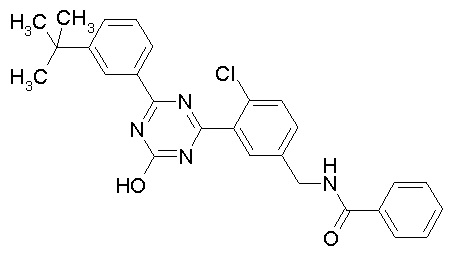

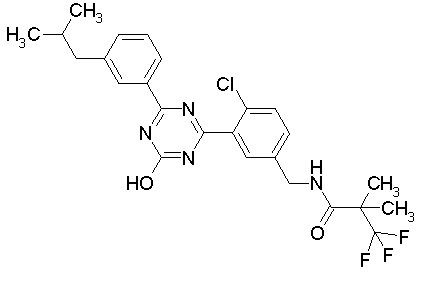

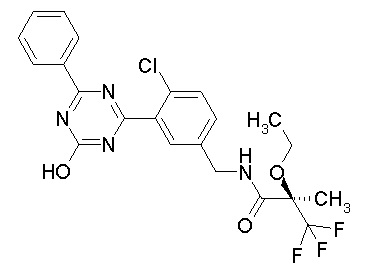

[0762]
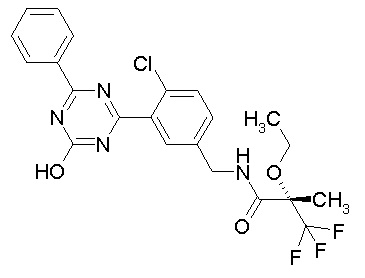

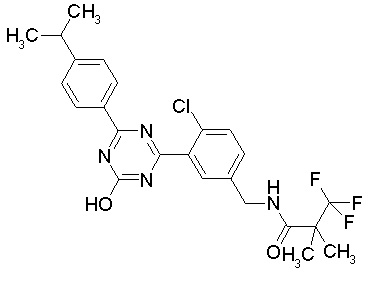

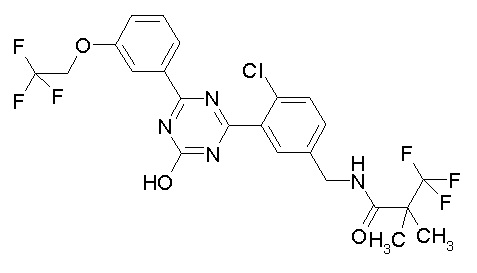

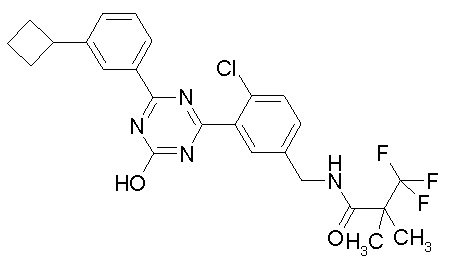

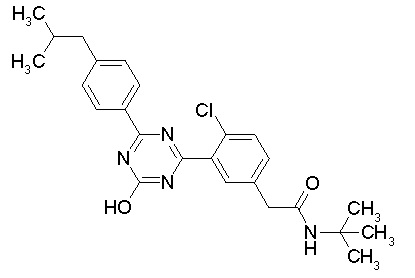

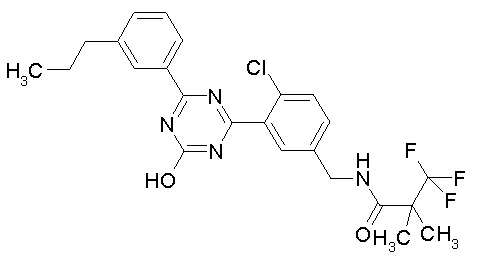

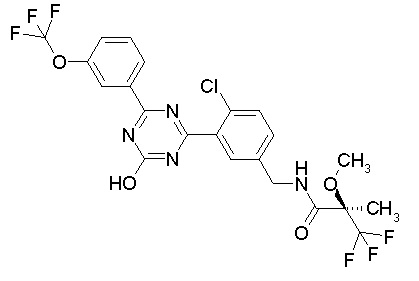

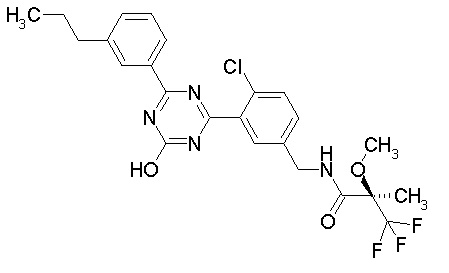

[0763]
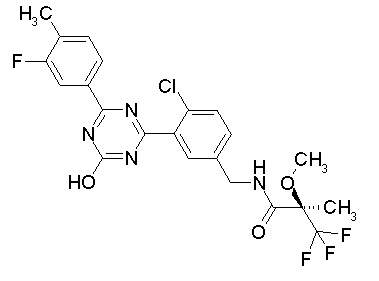

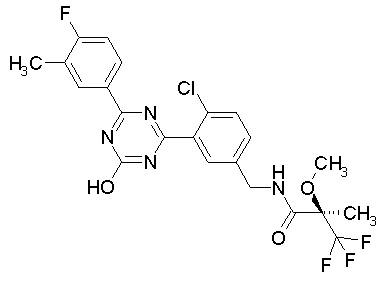

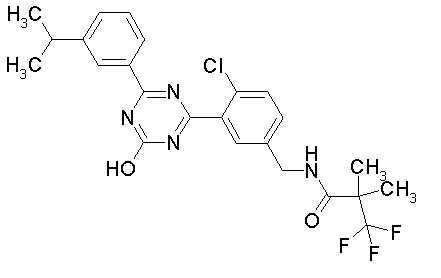

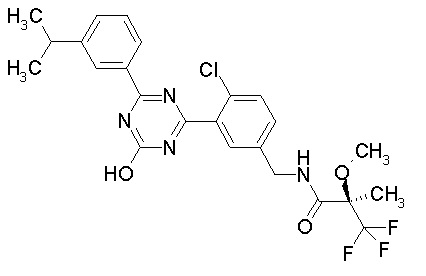

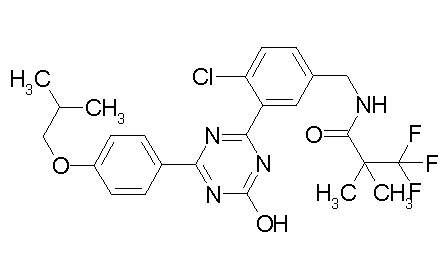

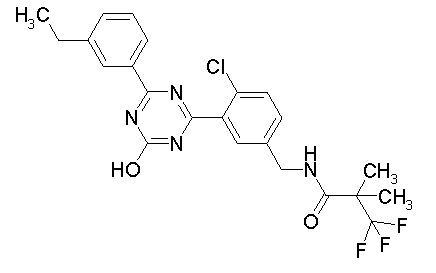

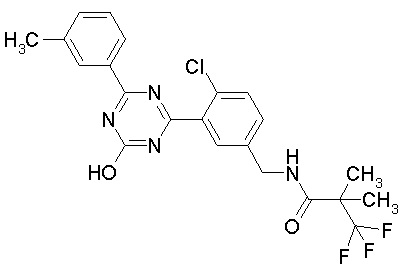

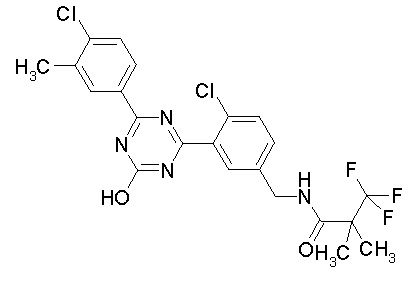

[0764]
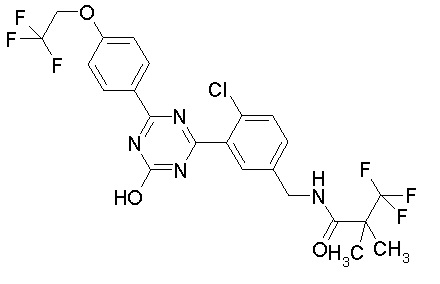

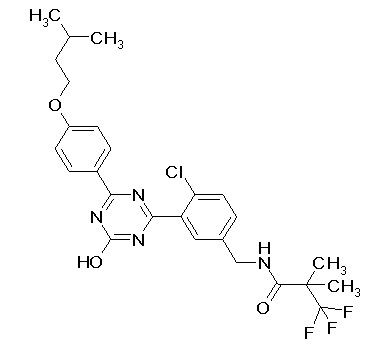

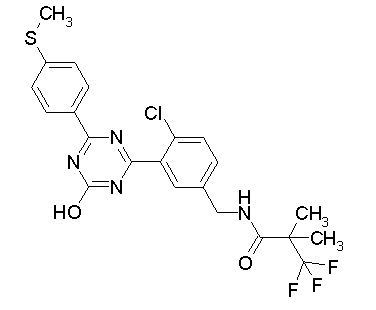

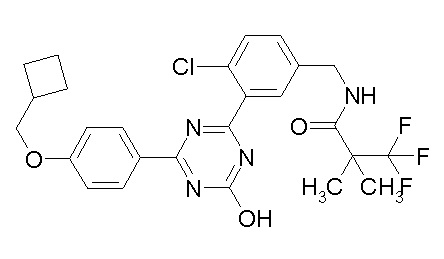

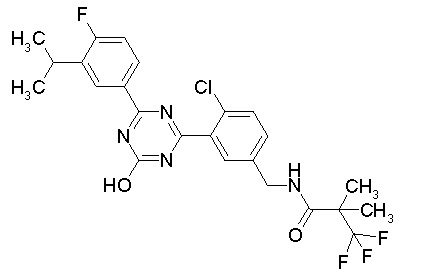

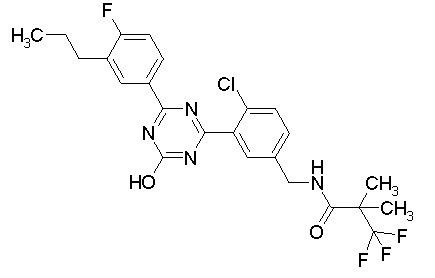

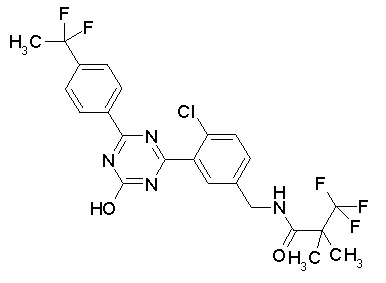

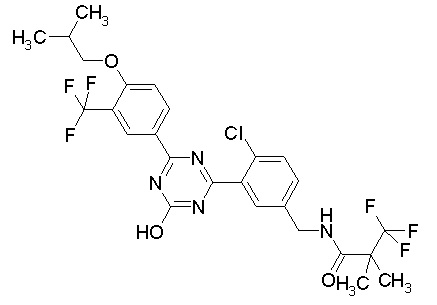

[0765]
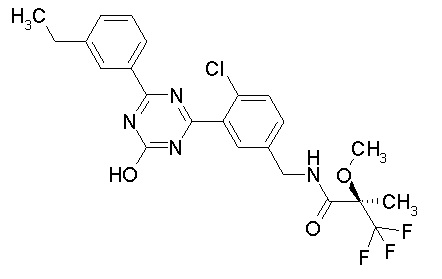

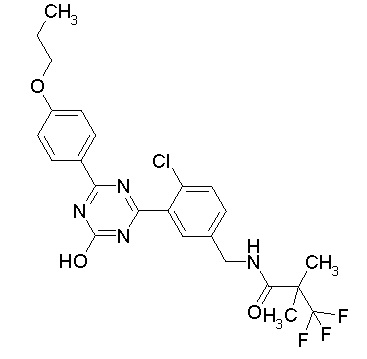

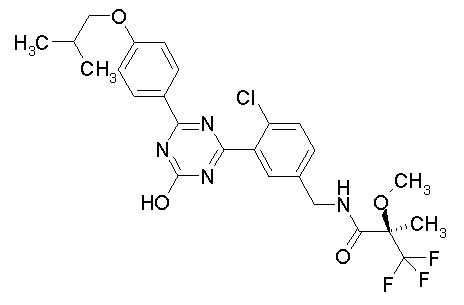

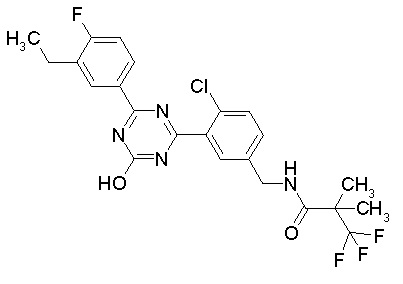

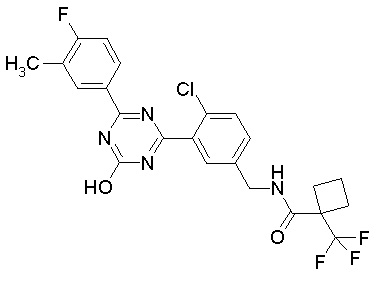

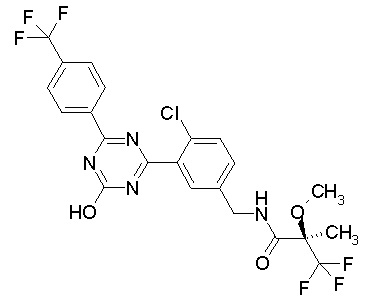

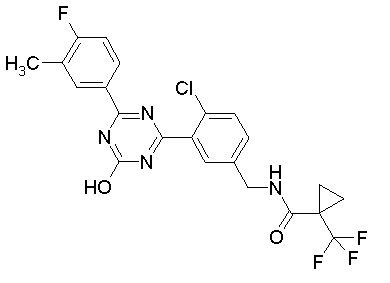

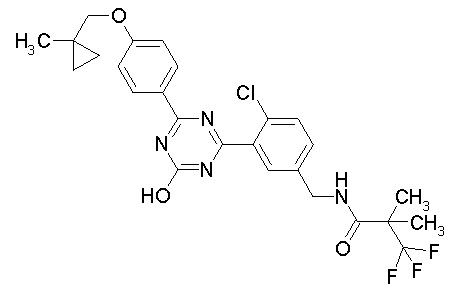

[0766]
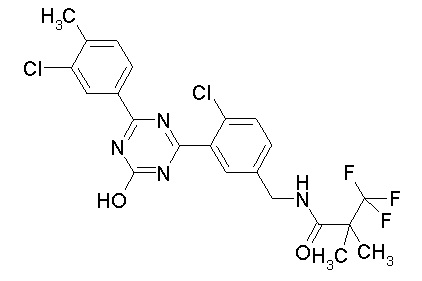

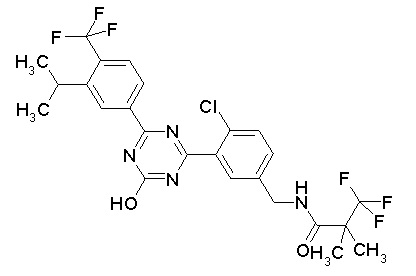

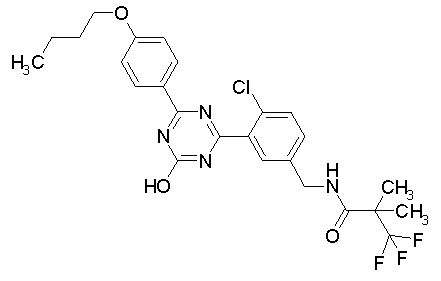

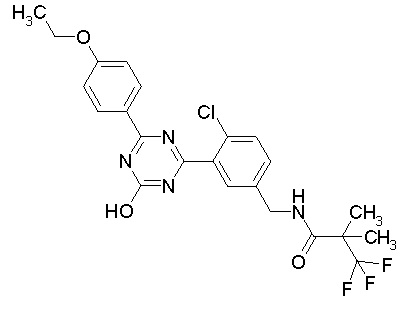

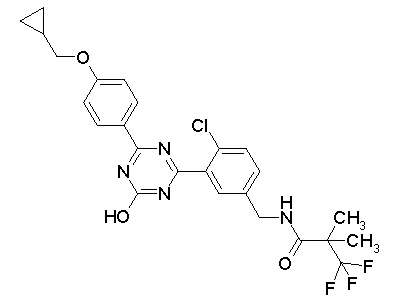

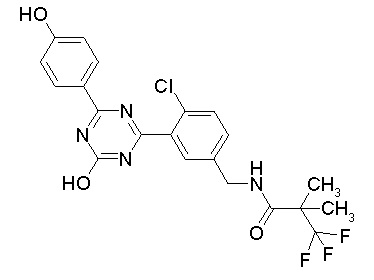

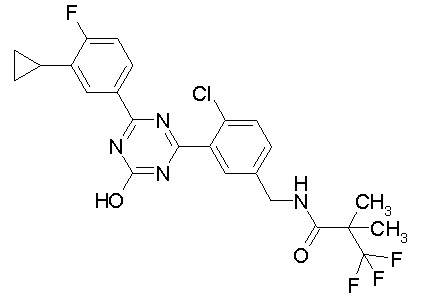

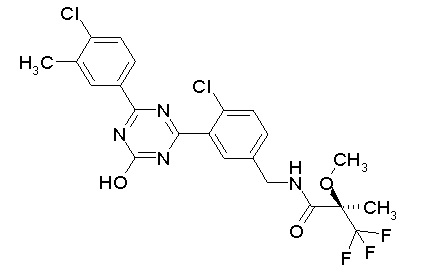

[0767]
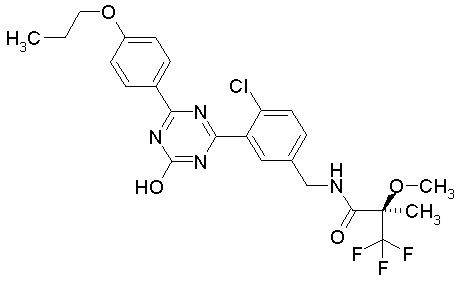

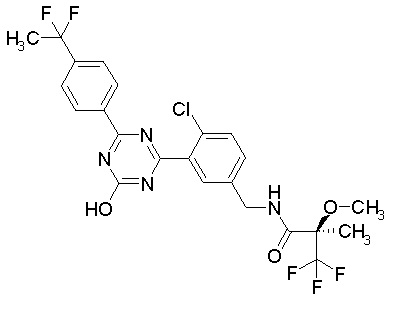

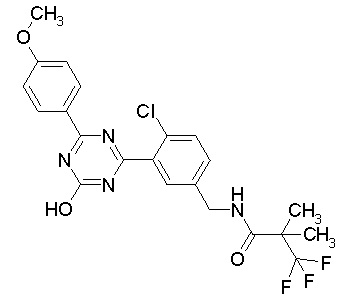

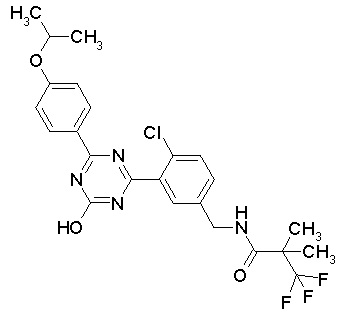

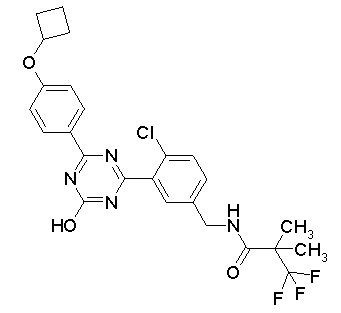

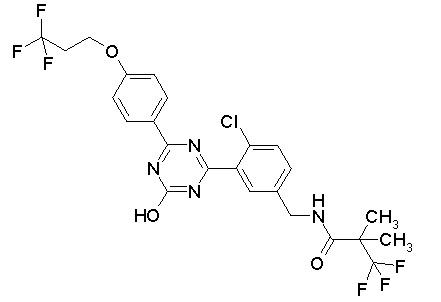

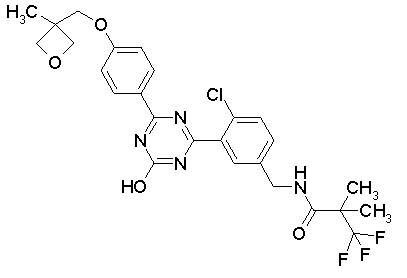

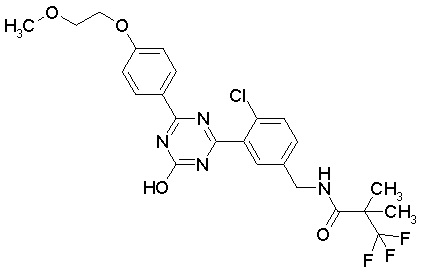

[0768]
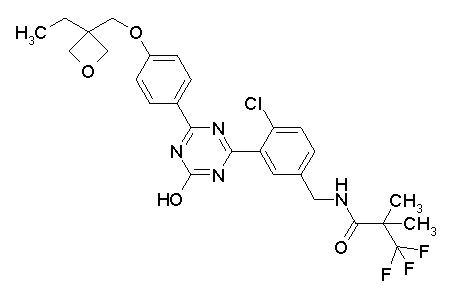

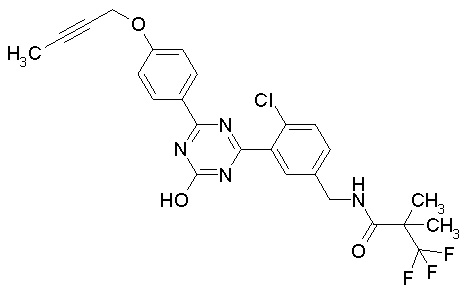

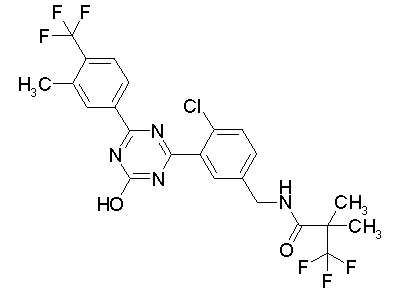

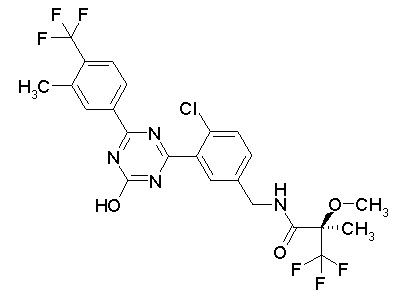

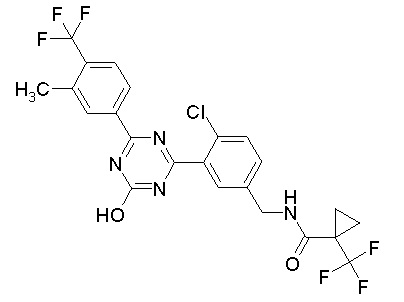

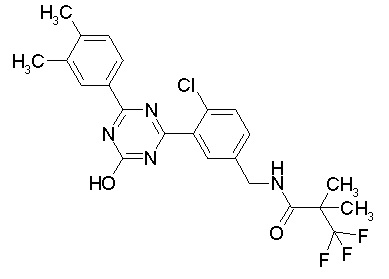

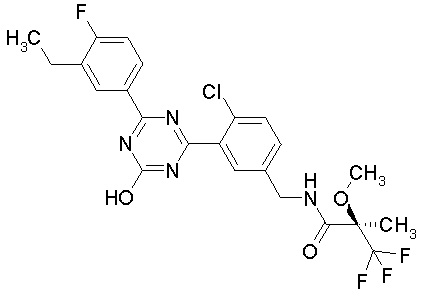

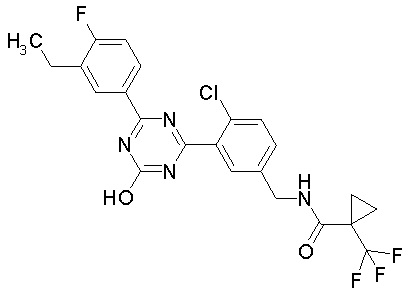

[0769]
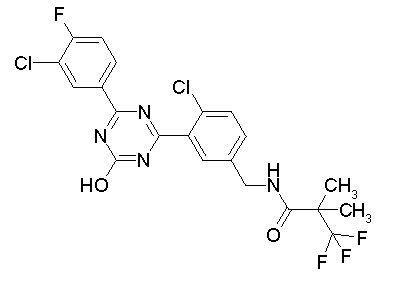

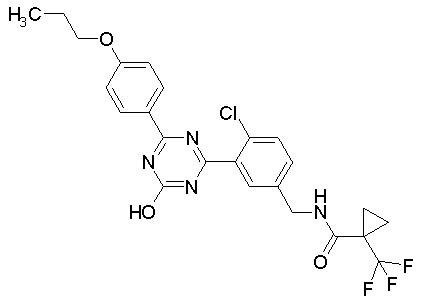

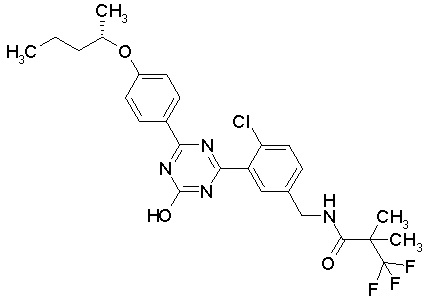

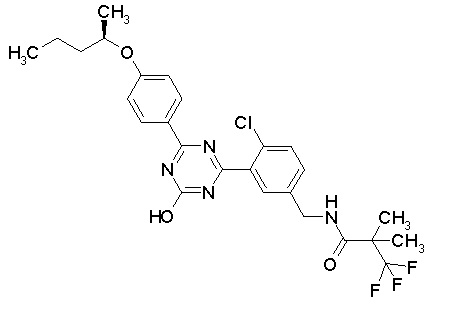

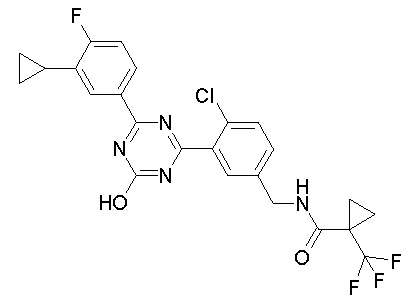

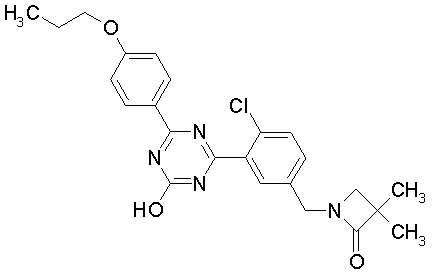

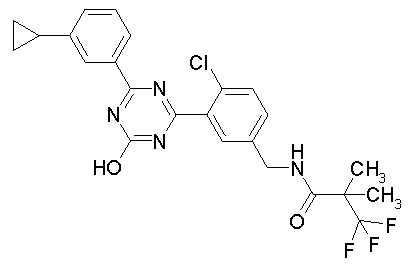

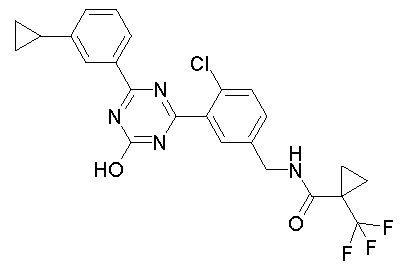

[0770]
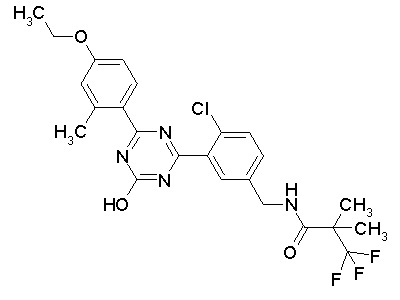

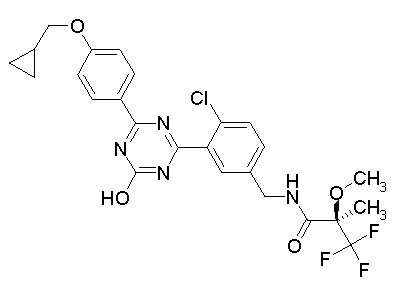

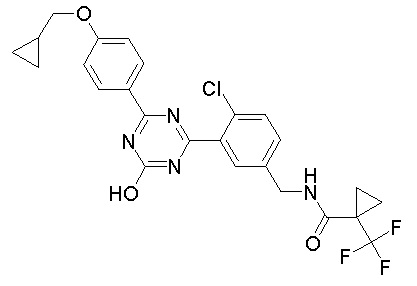

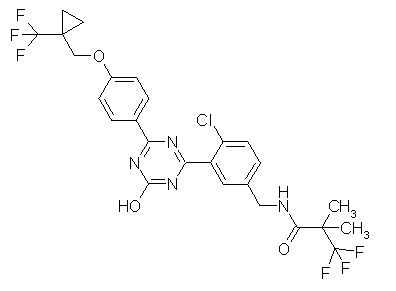

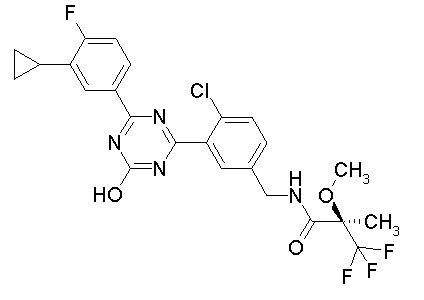

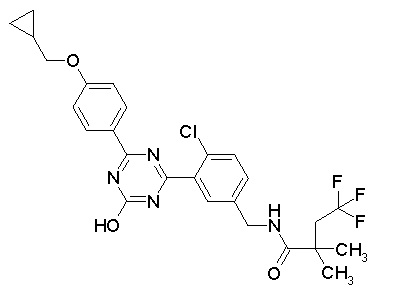

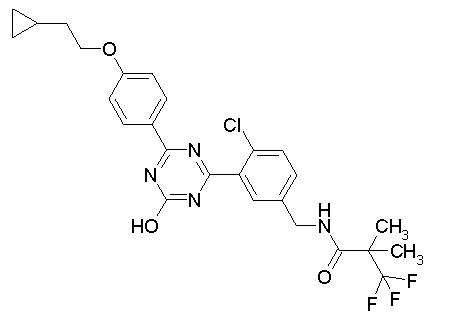

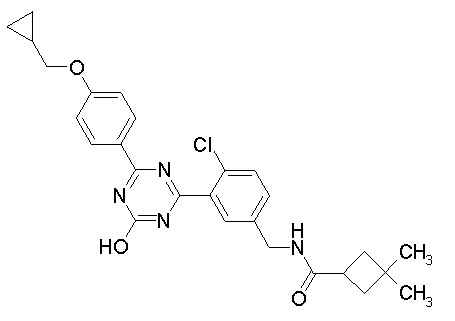

[0771]
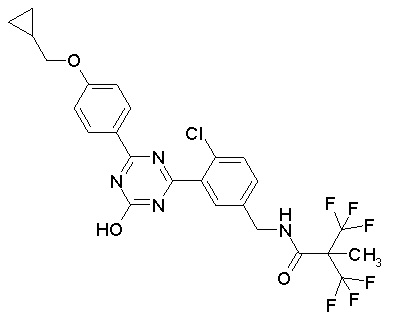

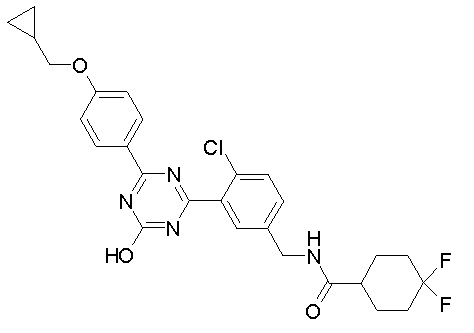

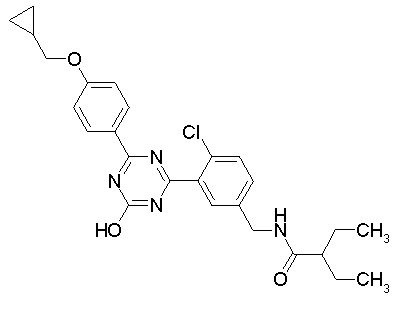

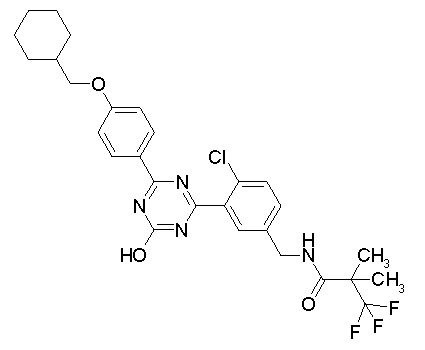

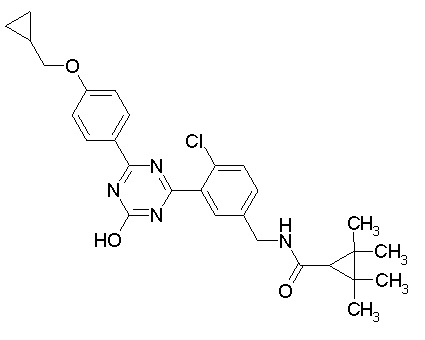

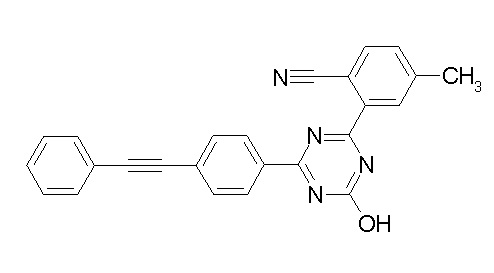

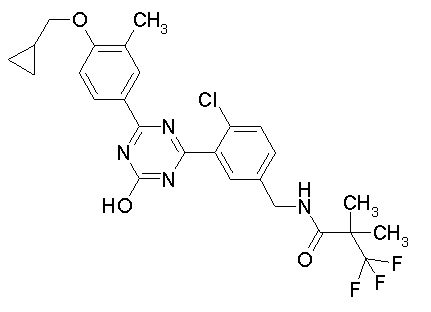

[0772]
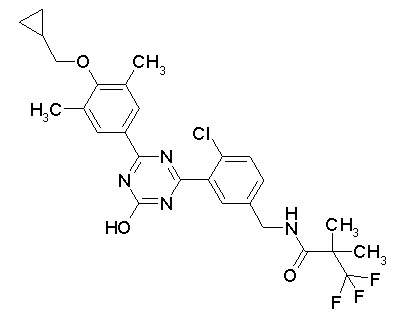

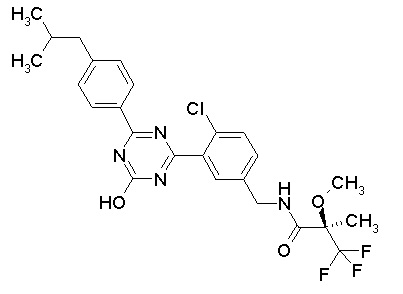

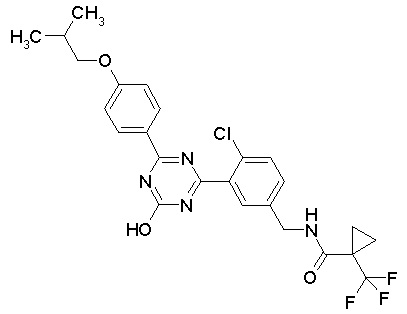

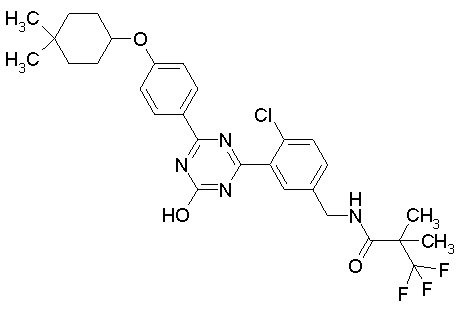

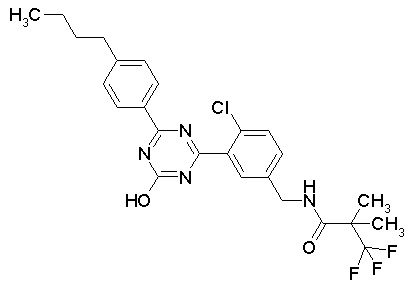

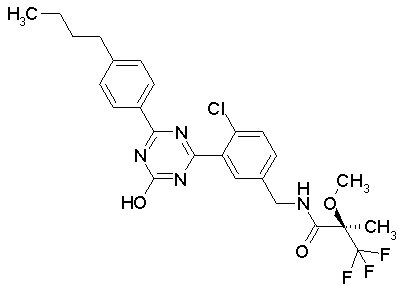

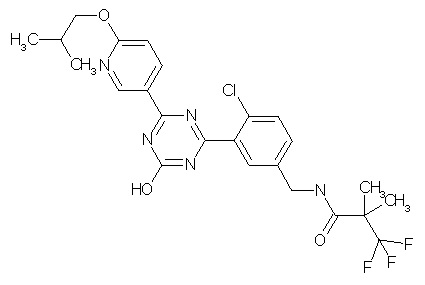

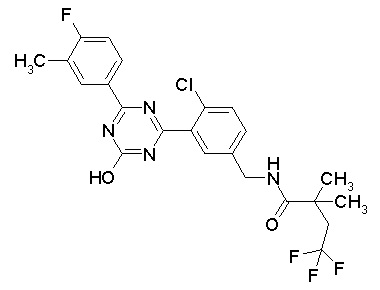

[0773]
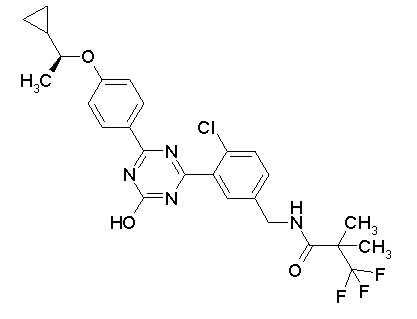

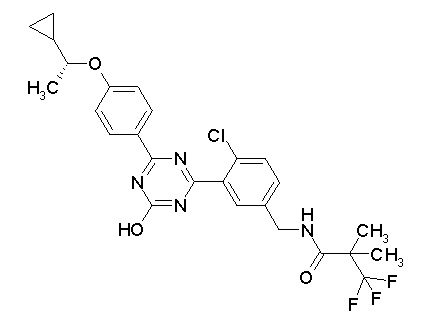

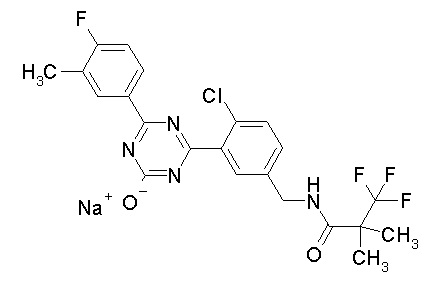

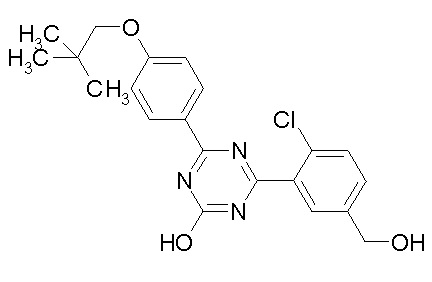

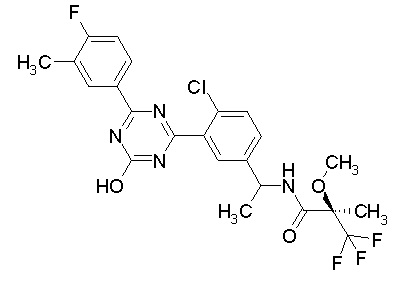

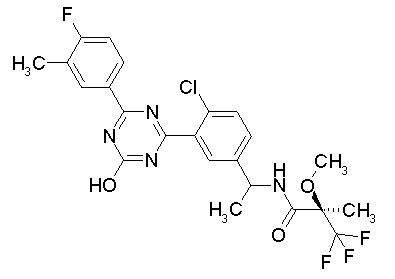

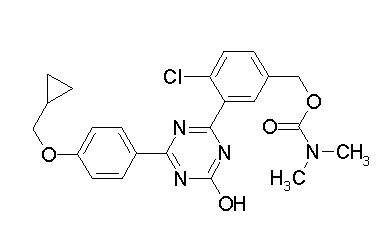

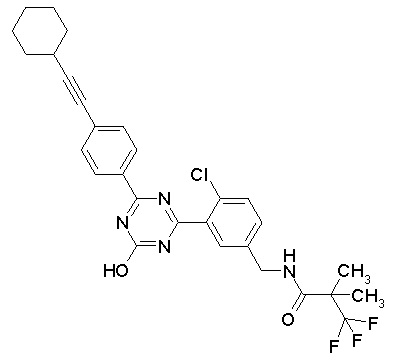

[0774]
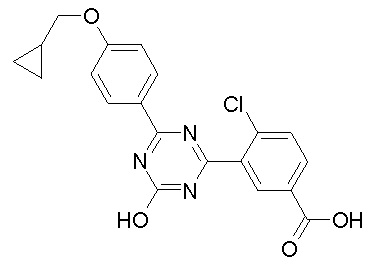

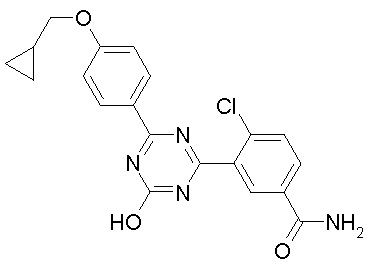

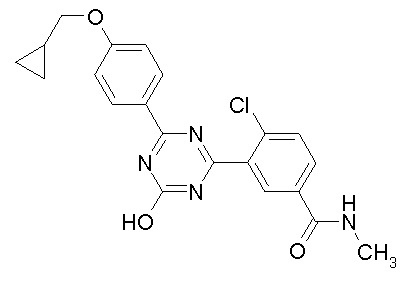

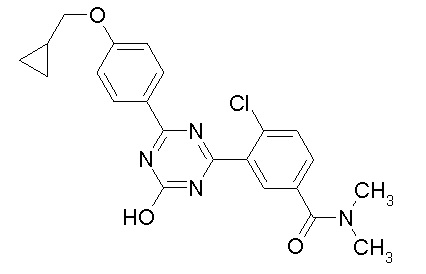

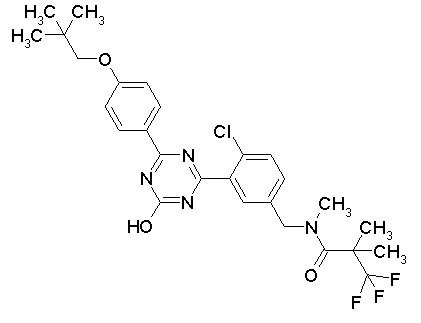

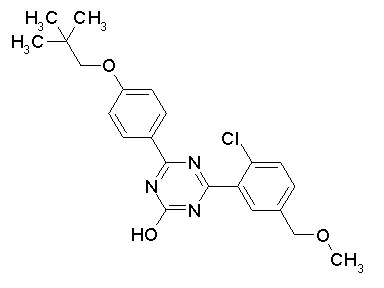

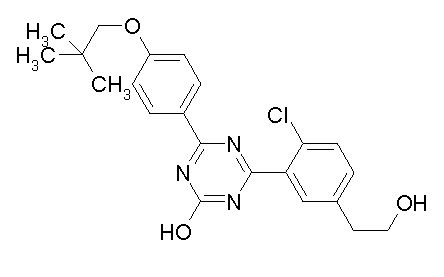

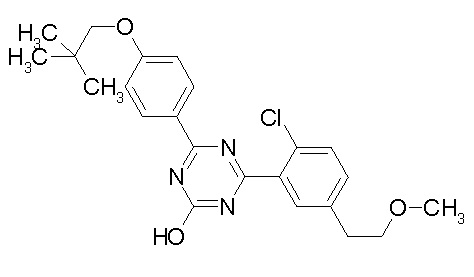

[0775]
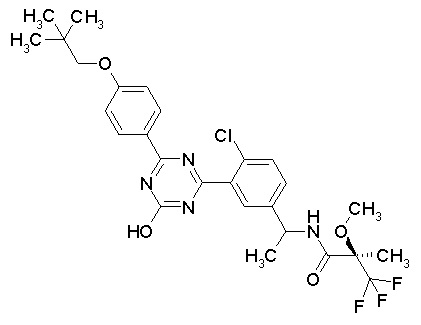

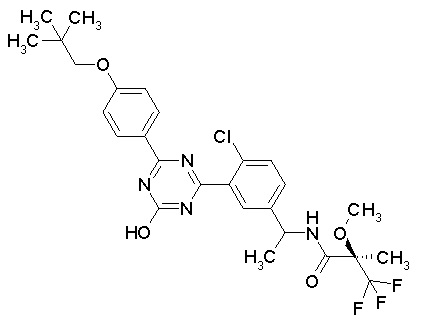

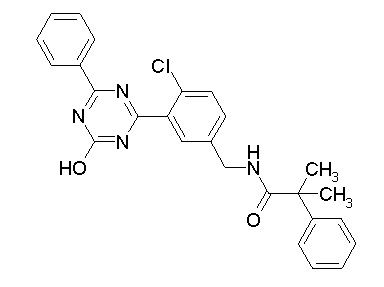

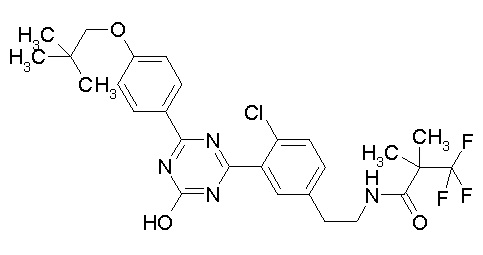

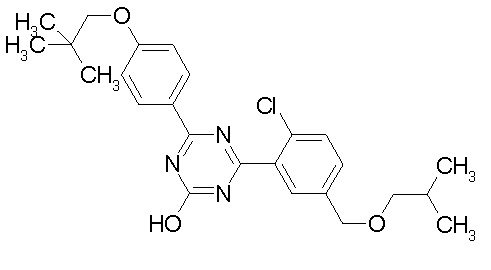

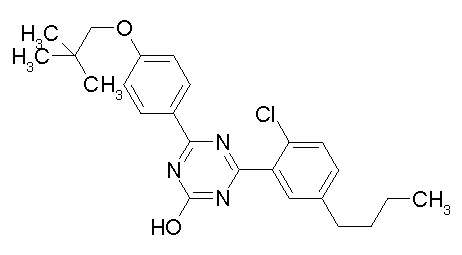

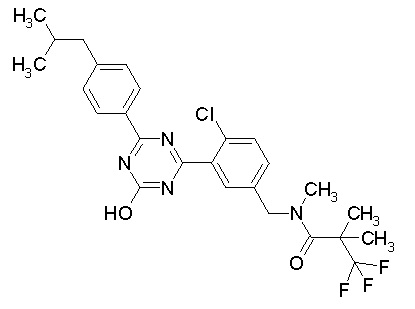

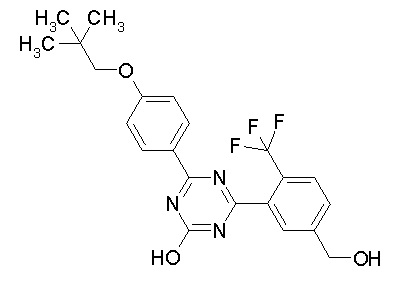

[0776]
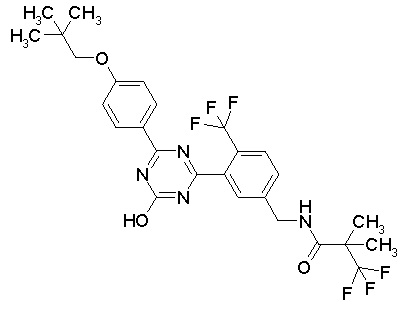

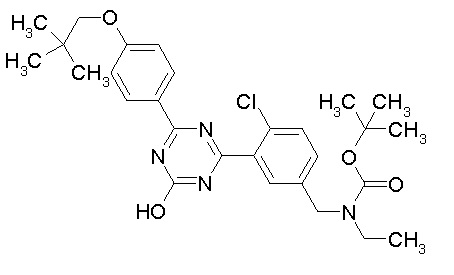

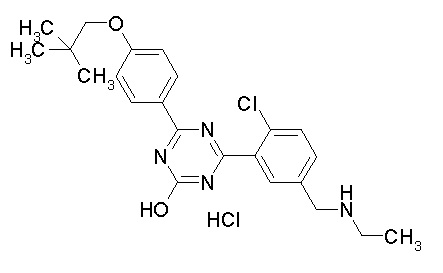

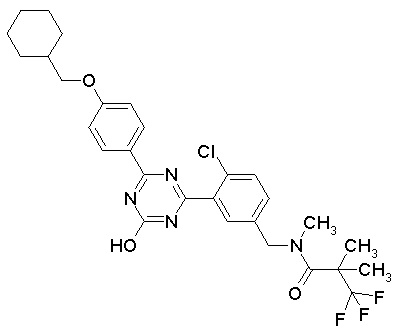

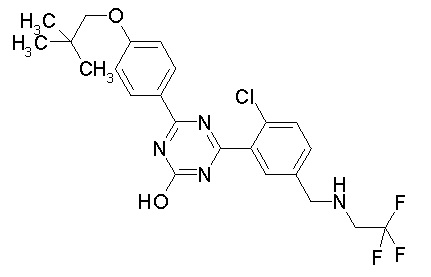

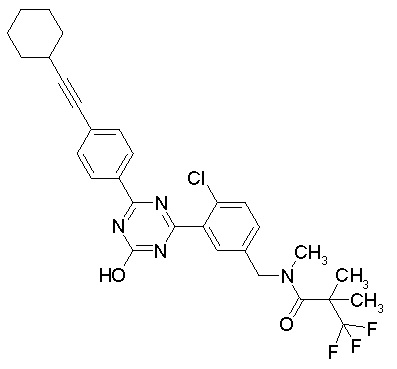

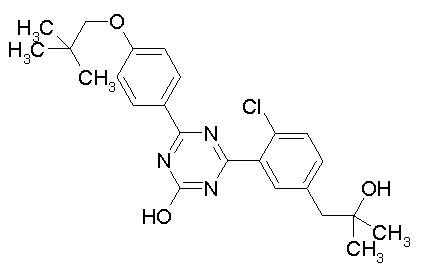

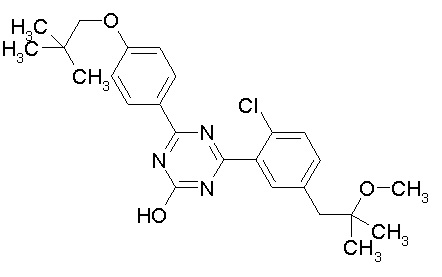

[0777]
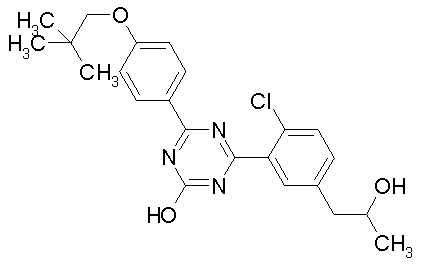

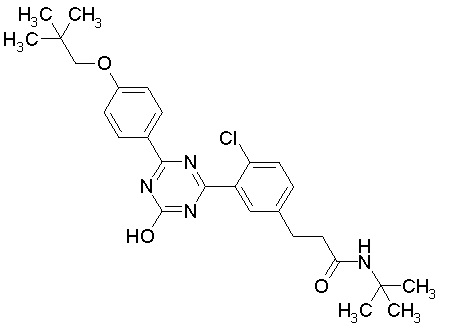

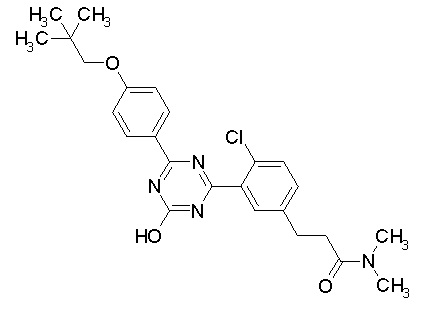

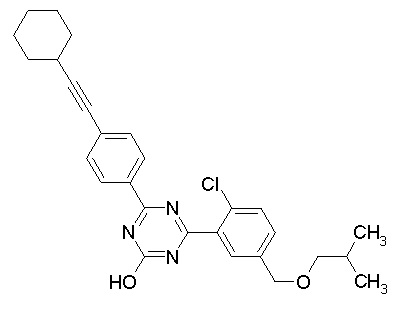

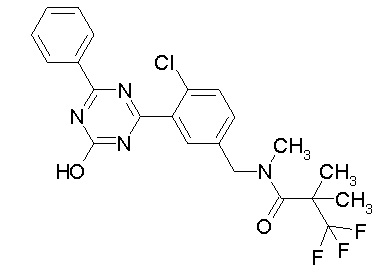

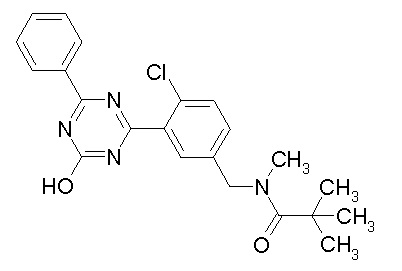

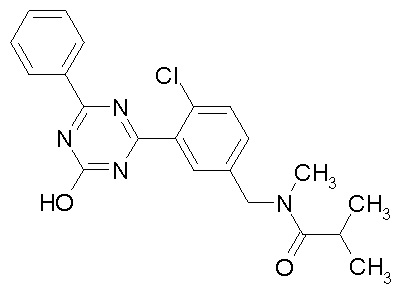

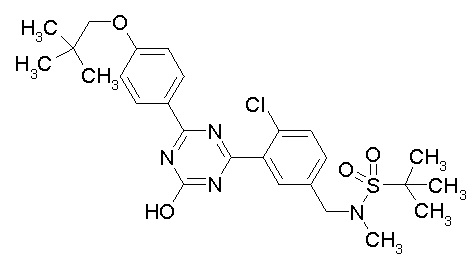

[0778]
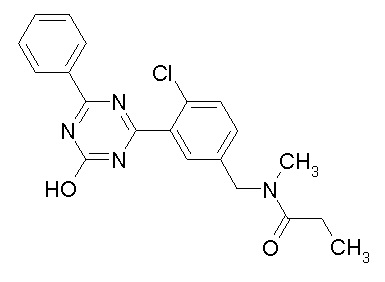

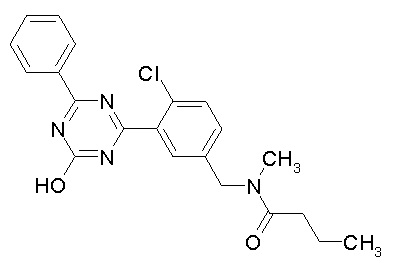

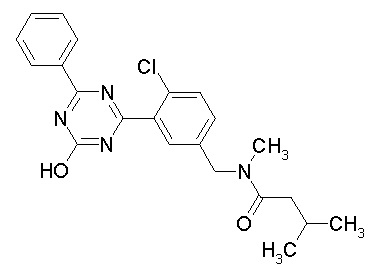

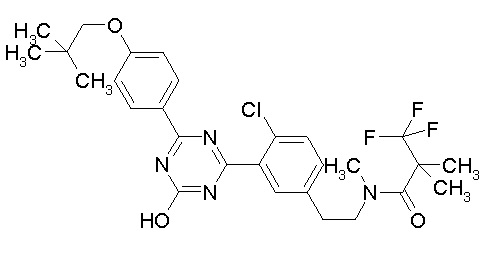

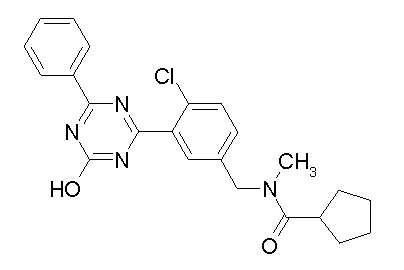

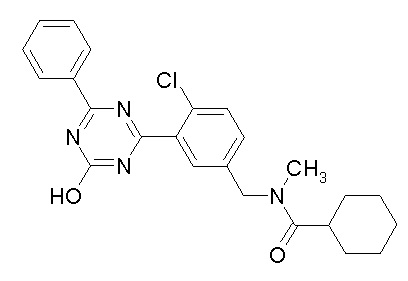

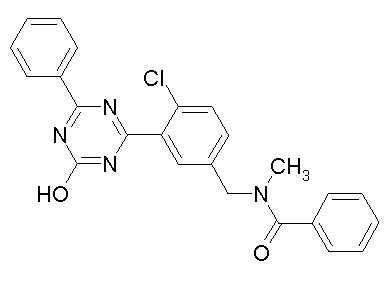

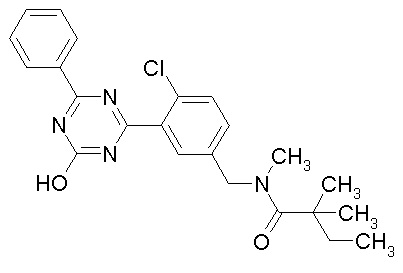

[0779]
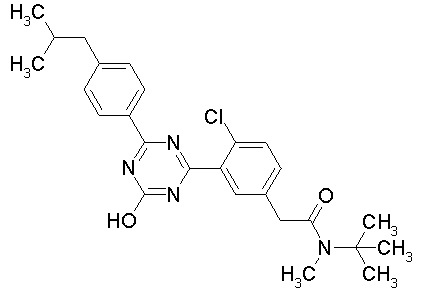

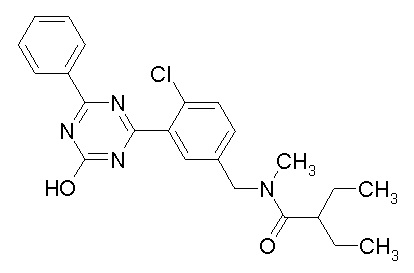

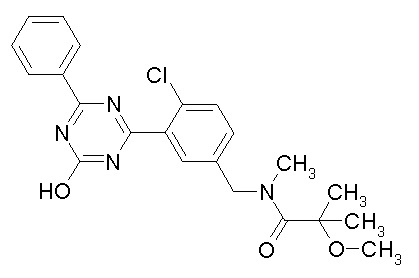

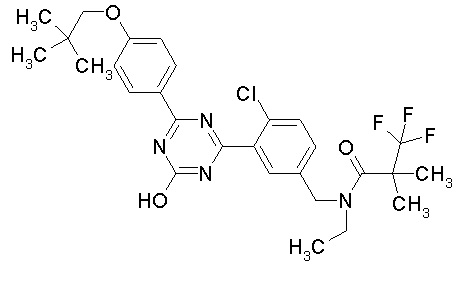

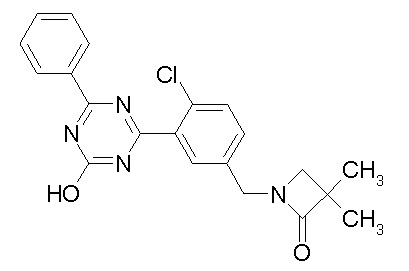

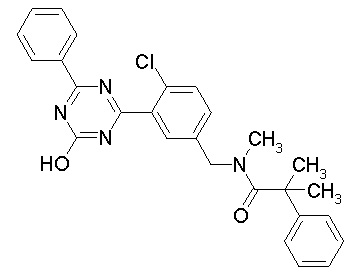

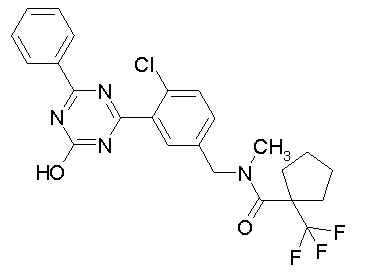

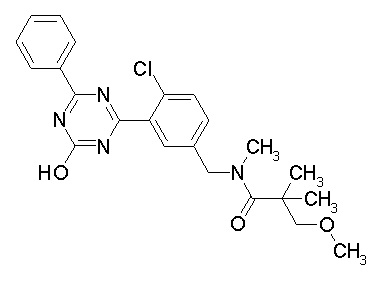

[0780]
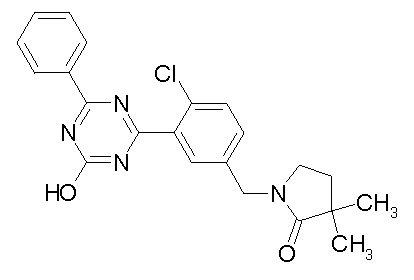

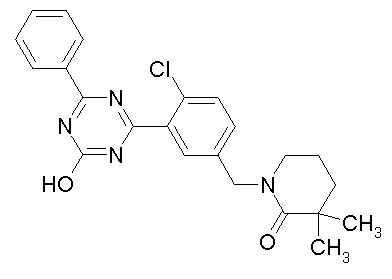

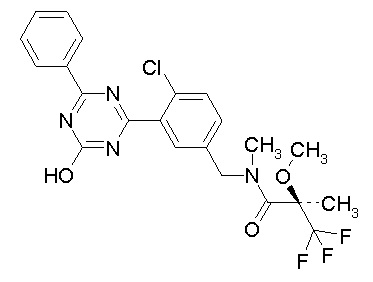

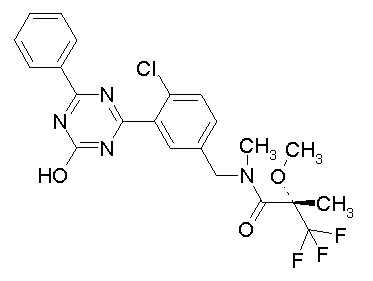

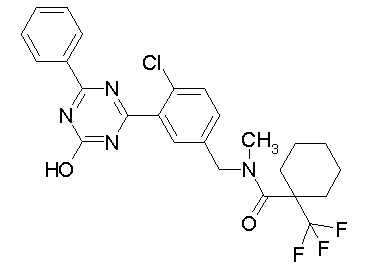

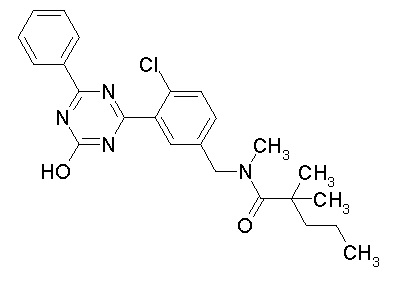

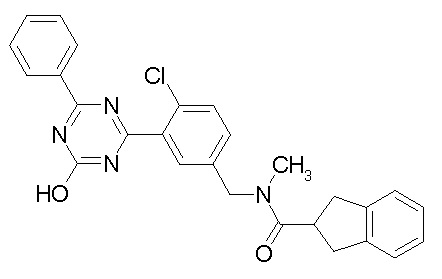

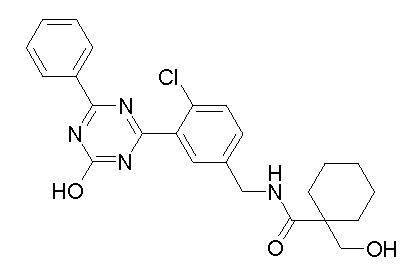

[0781]
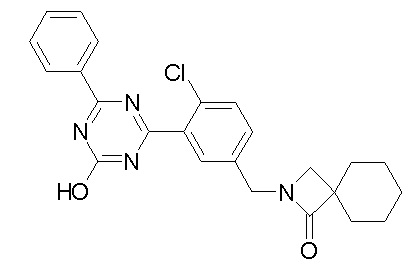

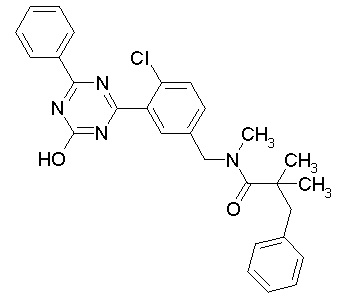

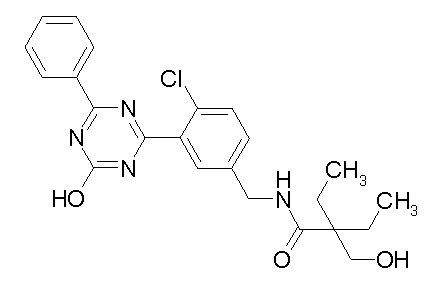

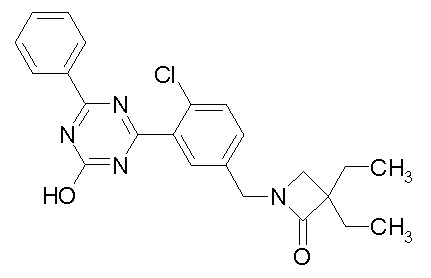

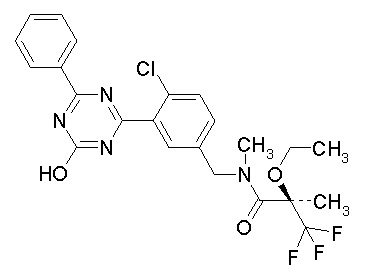

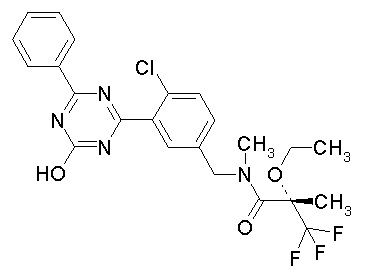

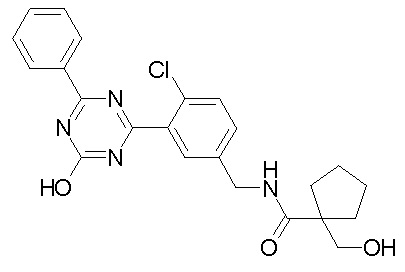

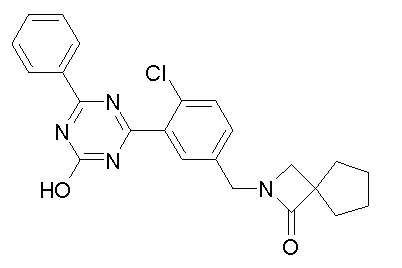

[0782]
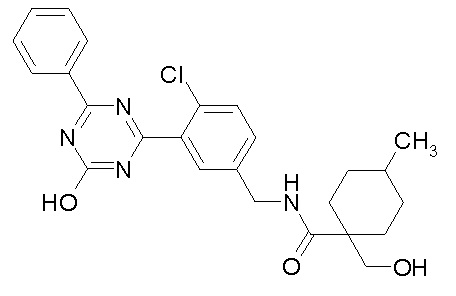

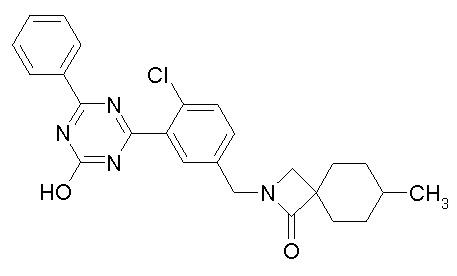





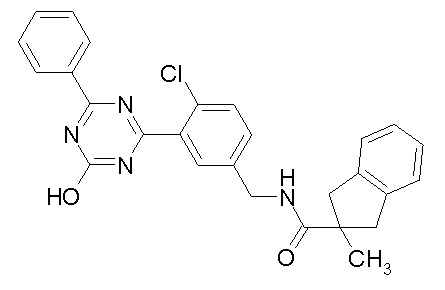

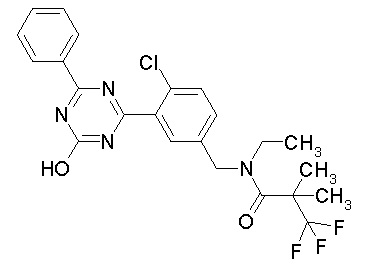

[0783]
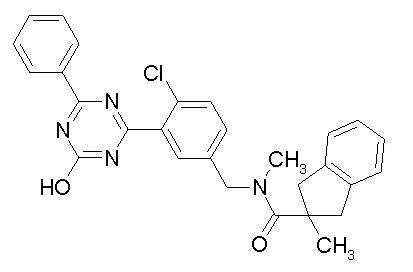

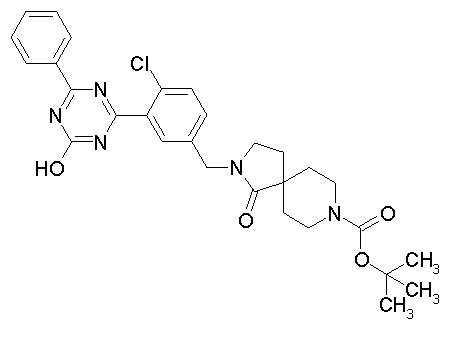

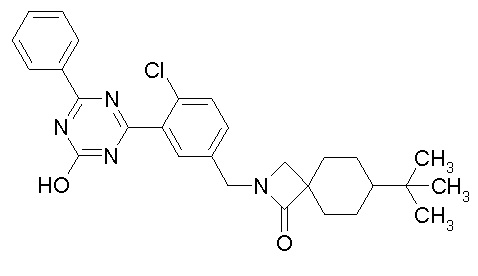

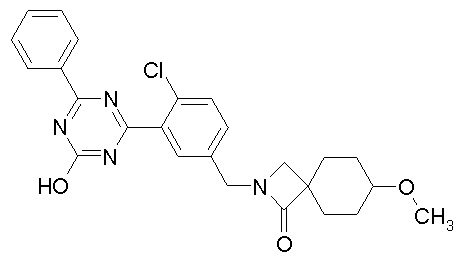

[0784]
(M+H)
(M-H)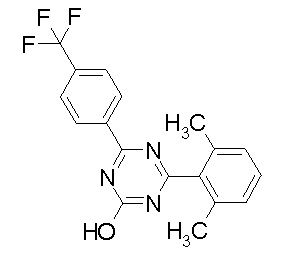

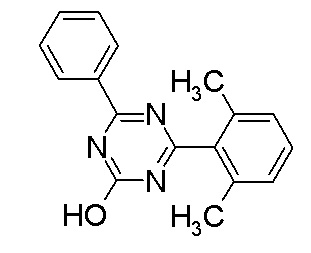

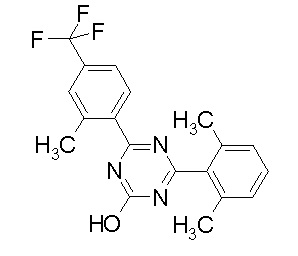

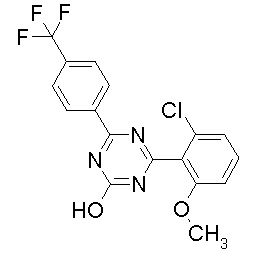

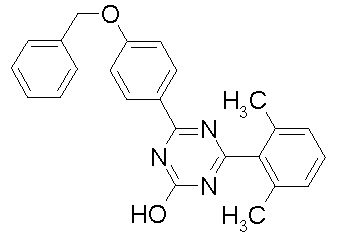

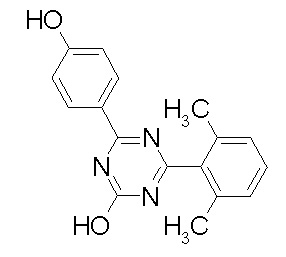

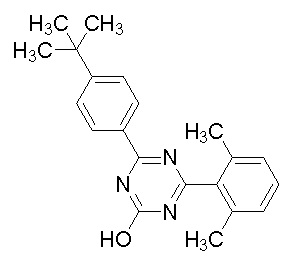

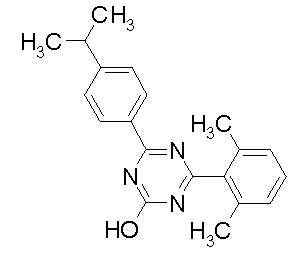

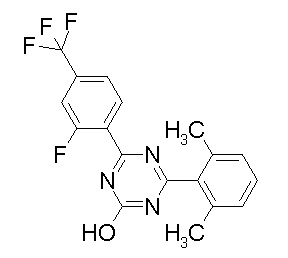

[0785]
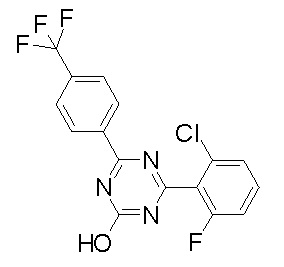

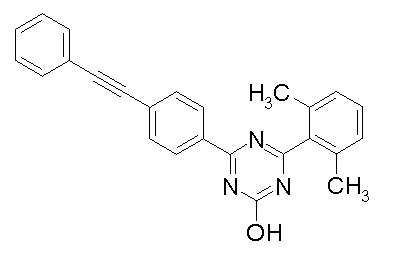

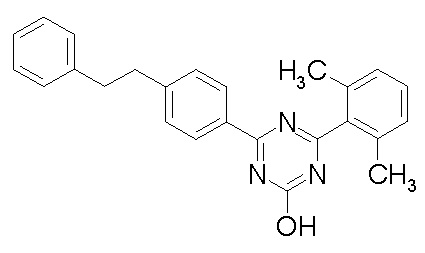

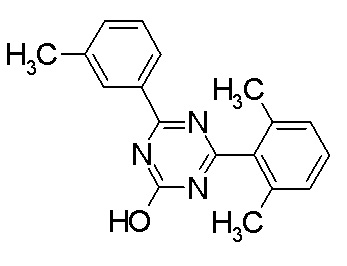

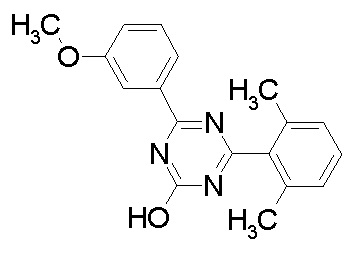

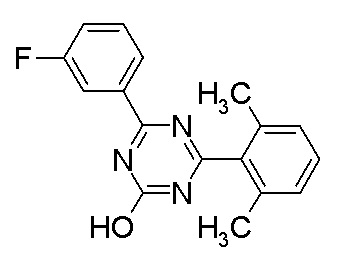

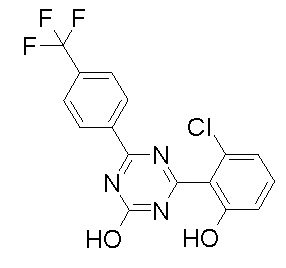

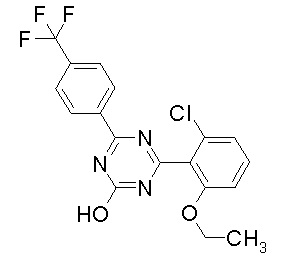

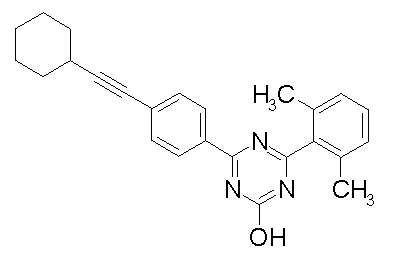

[0786]
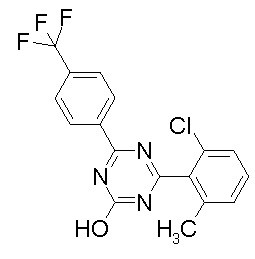

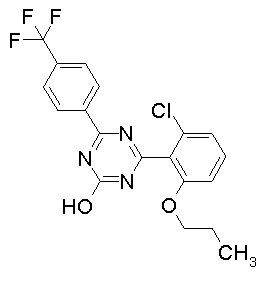

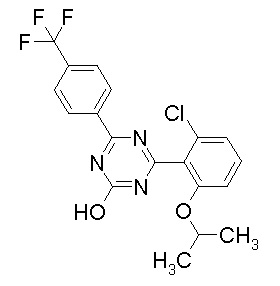

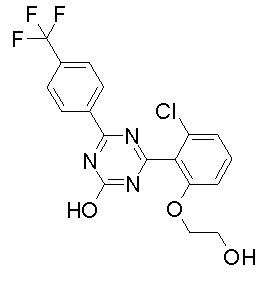

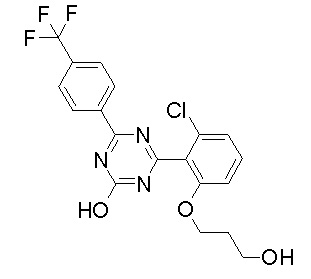

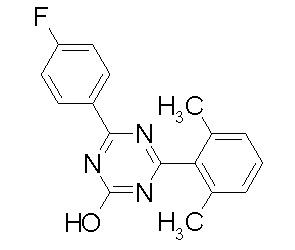

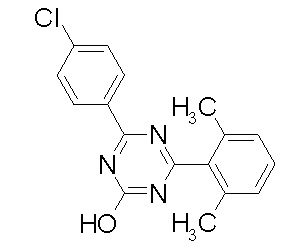

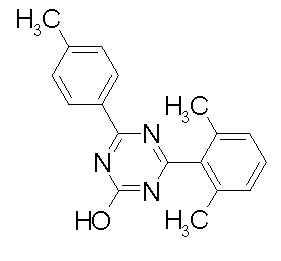
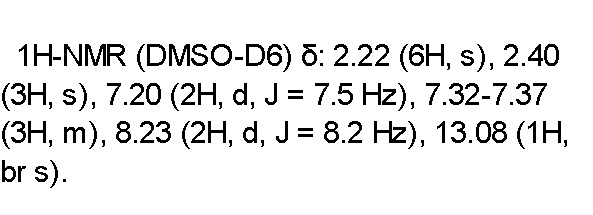
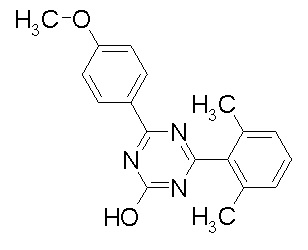

[0787]
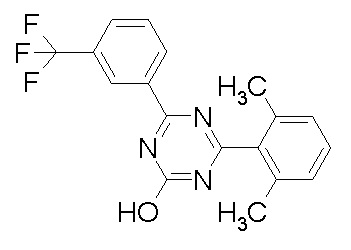

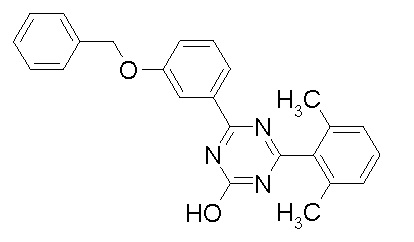

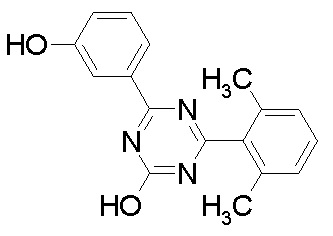

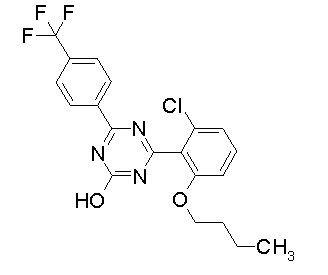

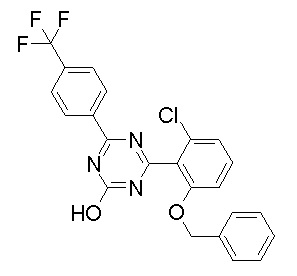

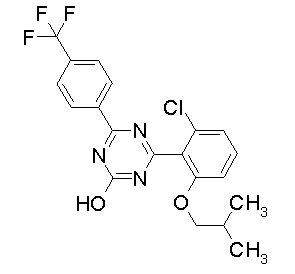

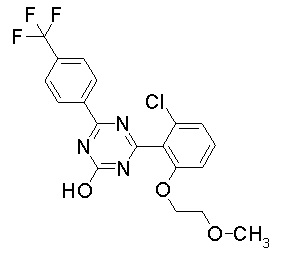

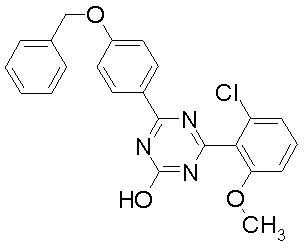

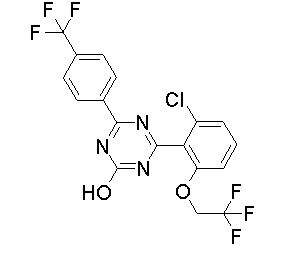

[0788]
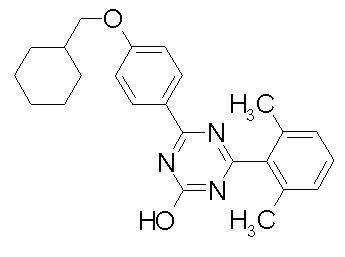

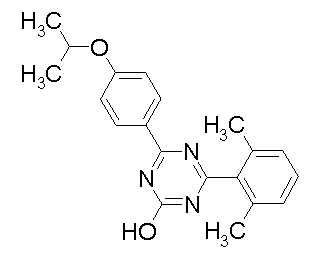

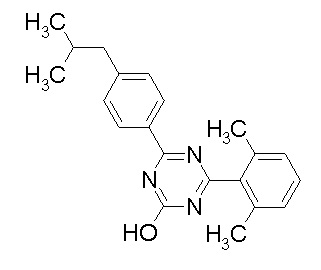

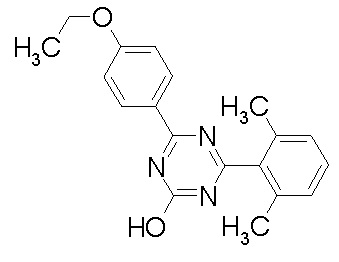

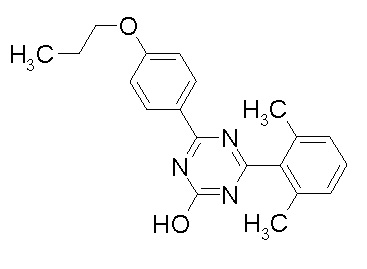

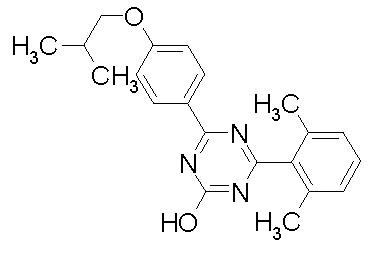

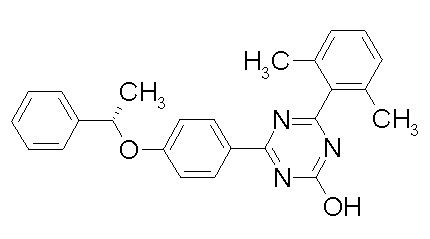

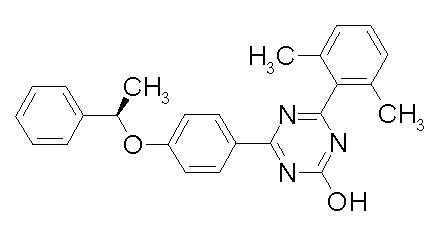

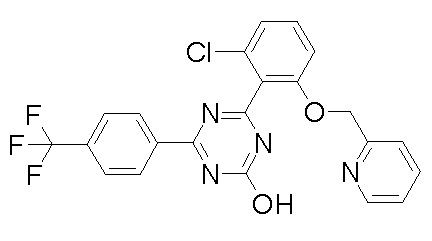

[0789]
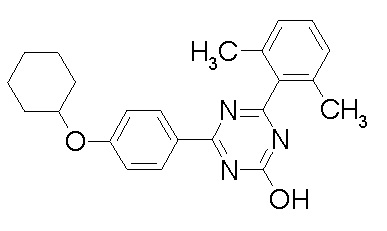

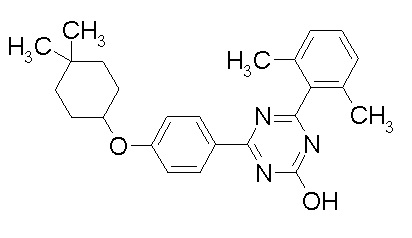

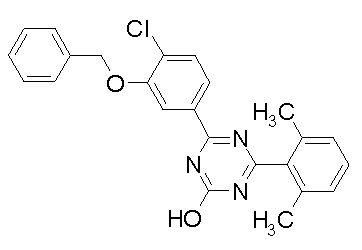

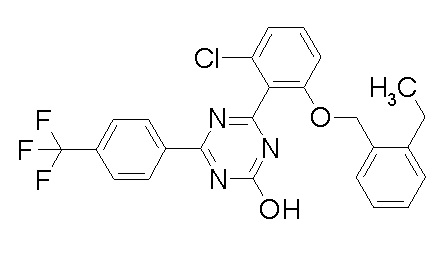

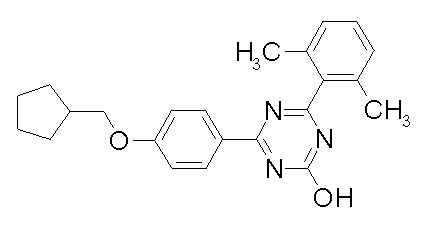

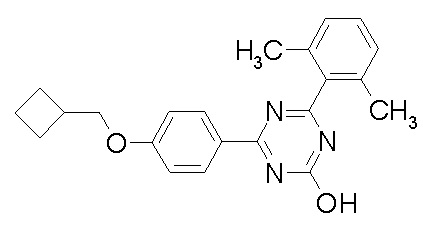

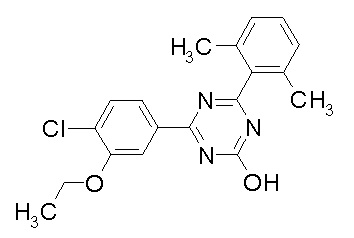

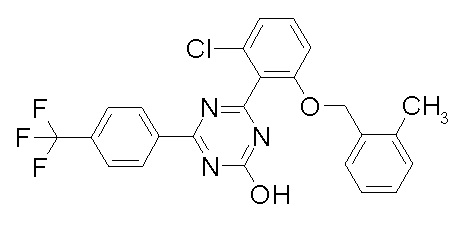

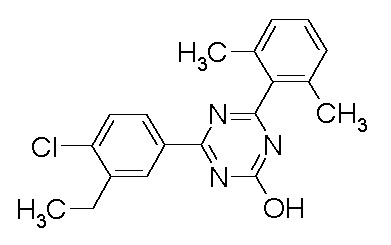

[0790]
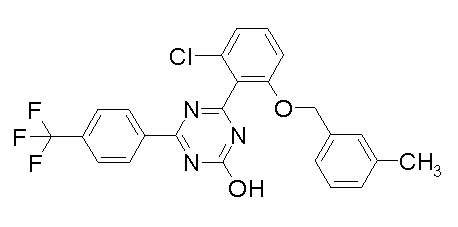

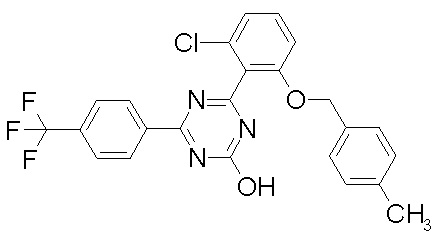

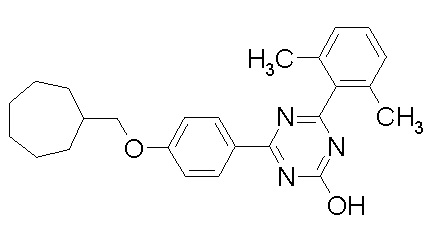

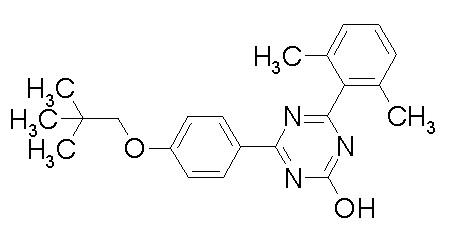

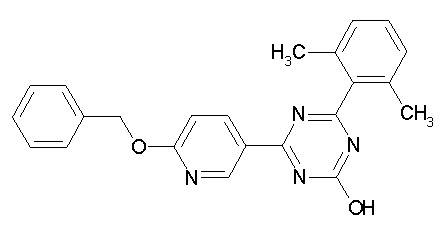

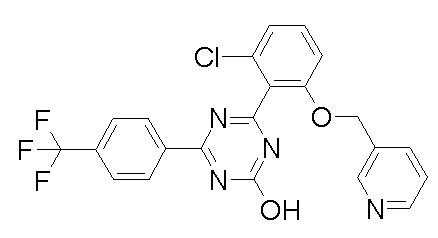

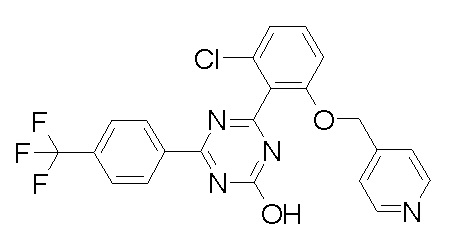

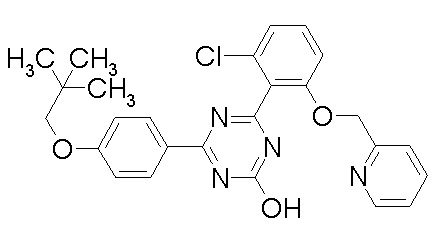

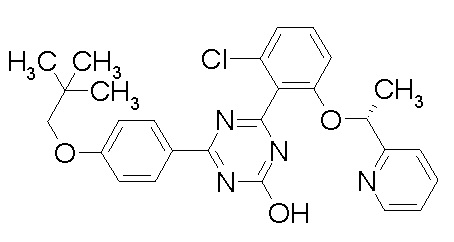

[0791]
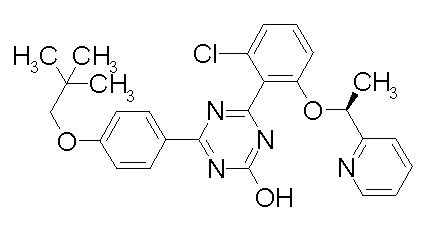

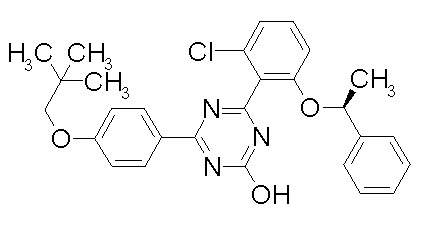

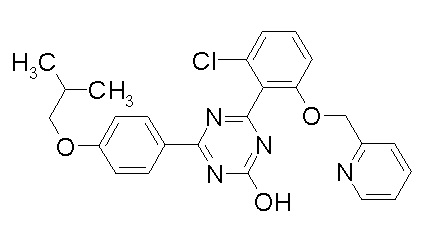

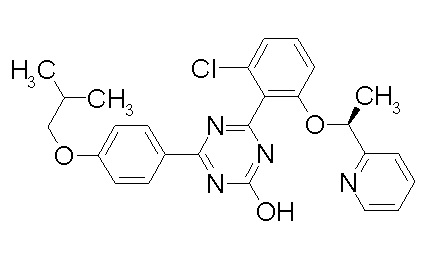

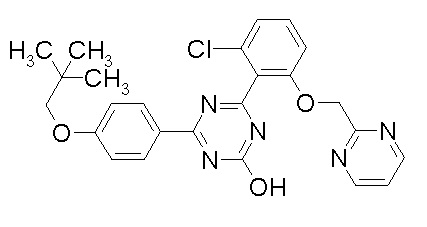

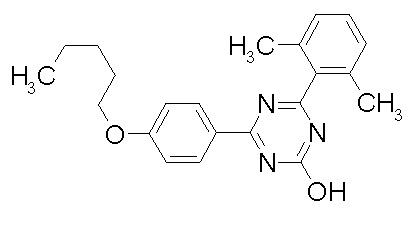

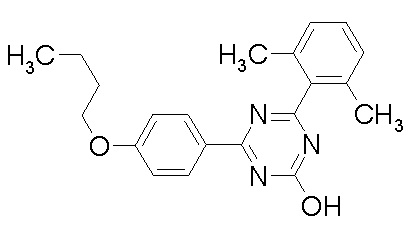

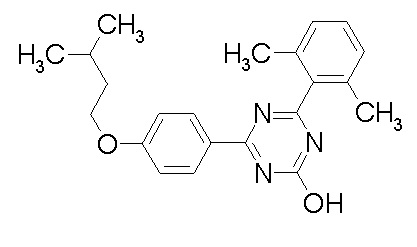

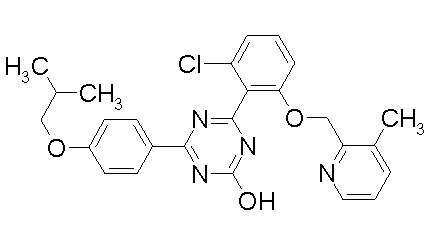

[0792]
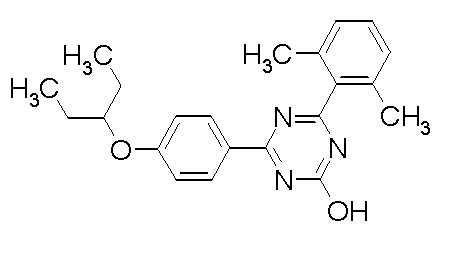

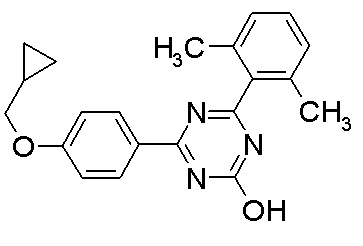

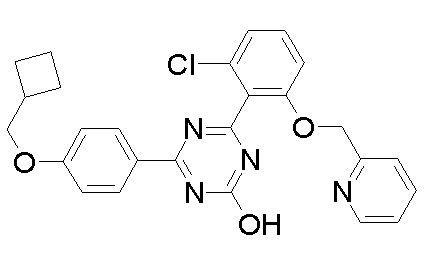

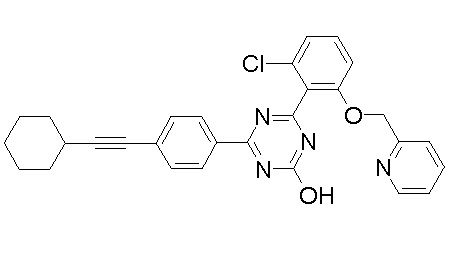

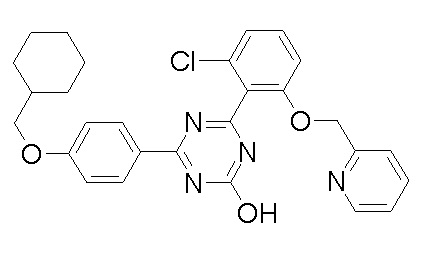

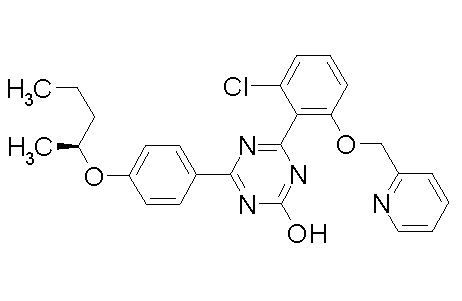

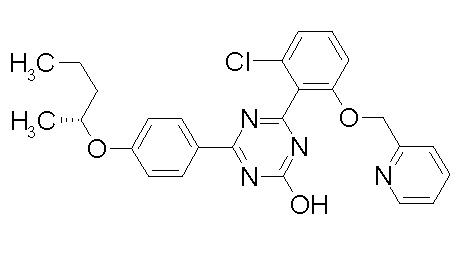

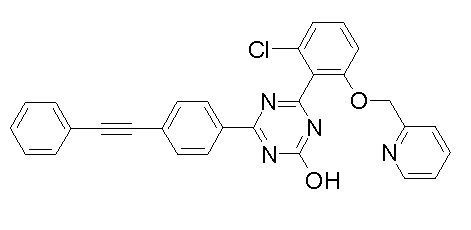

[0793]
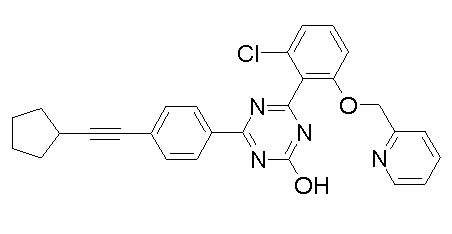

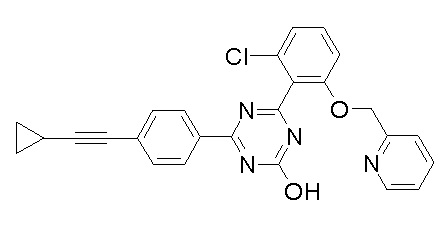

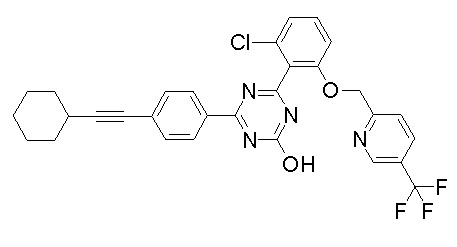

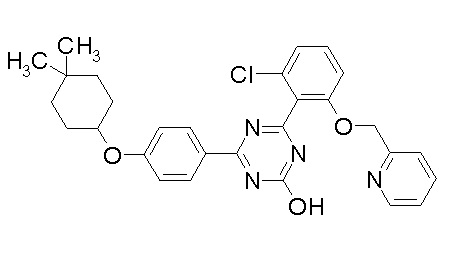

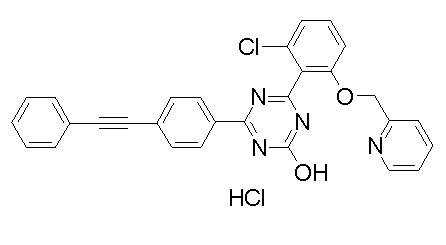

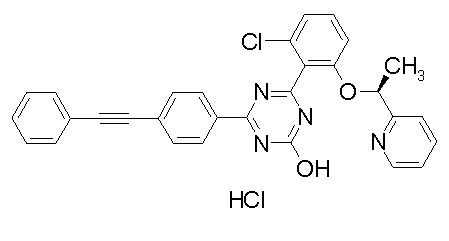

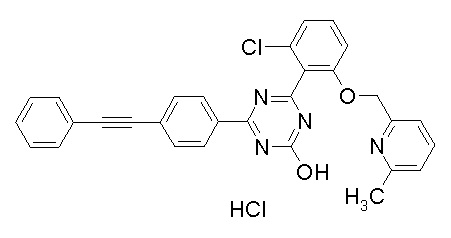

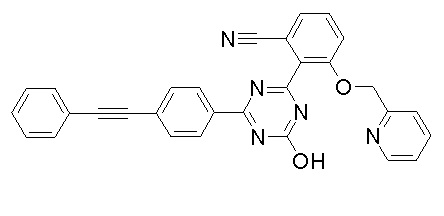

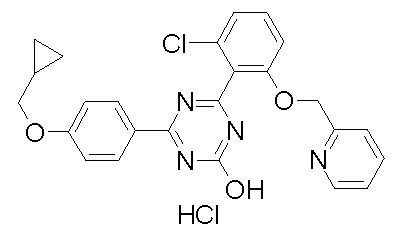

[0794]
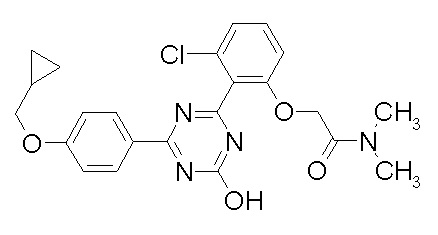

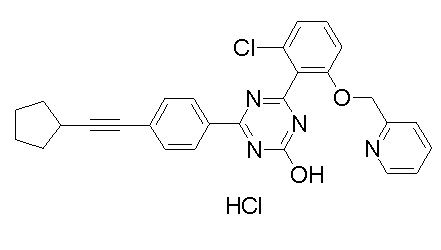

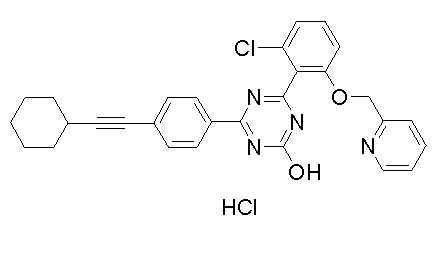

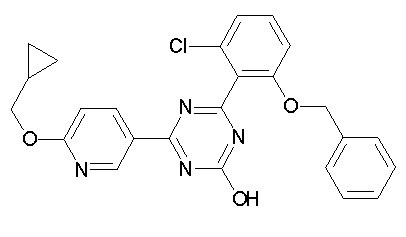

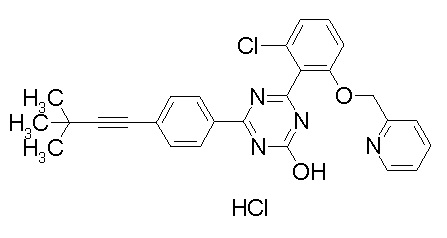

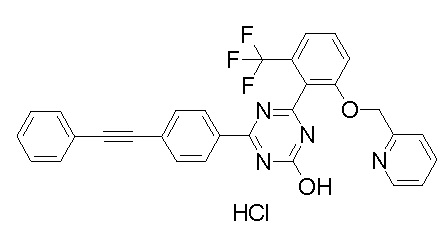

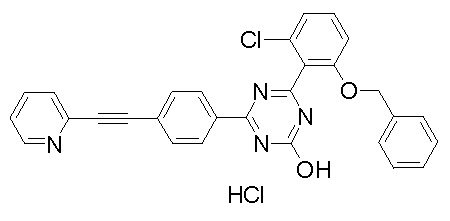

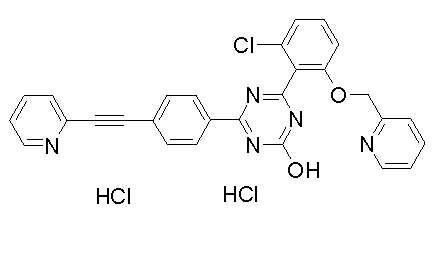

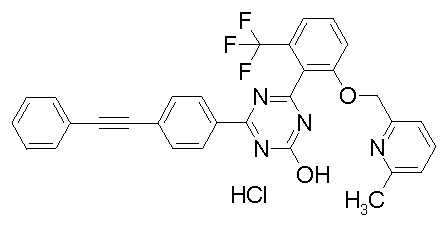

[0795]
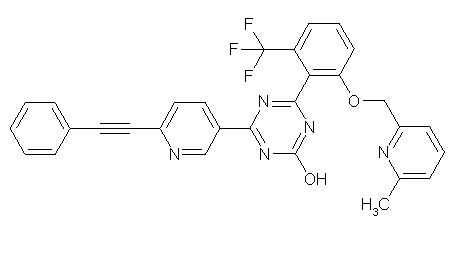

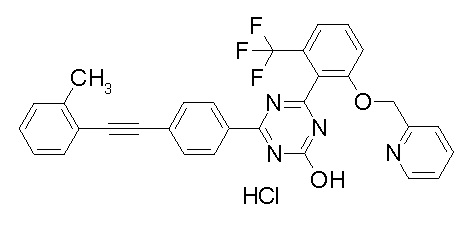

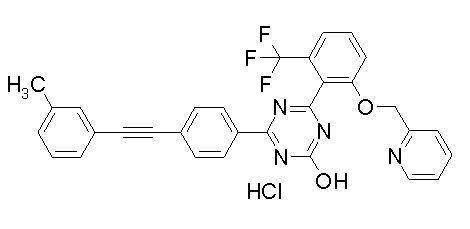

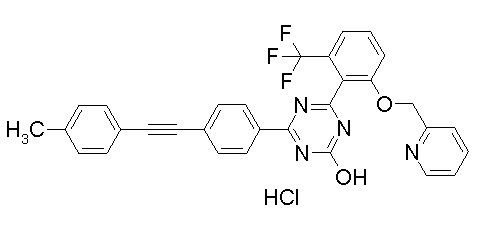

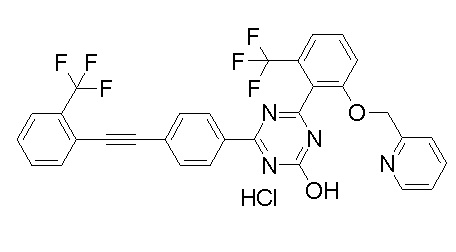

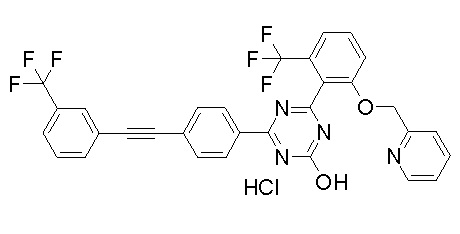

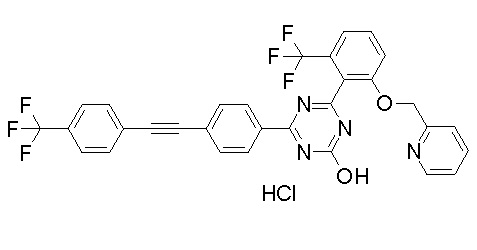

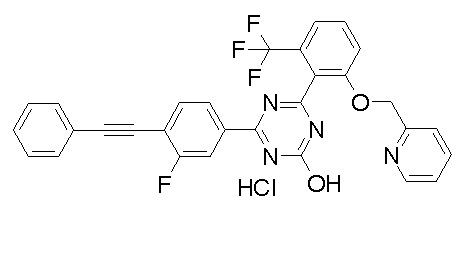

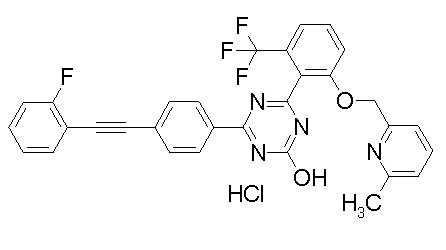

[0796]
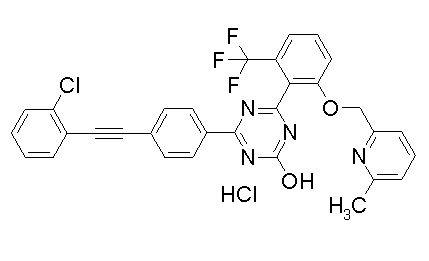

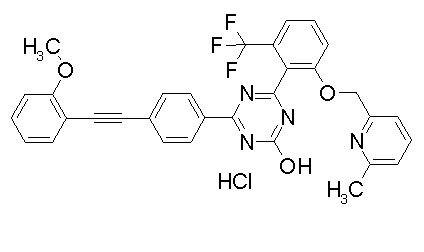

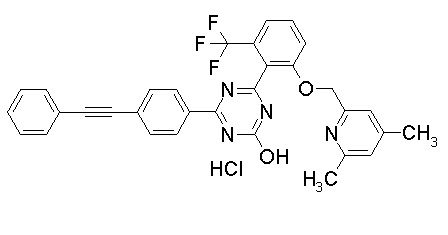

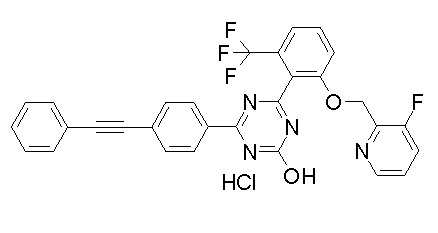

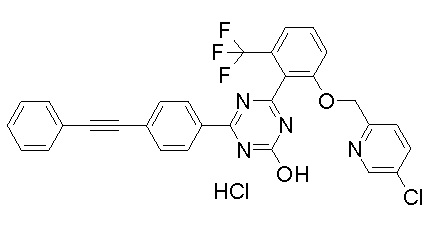

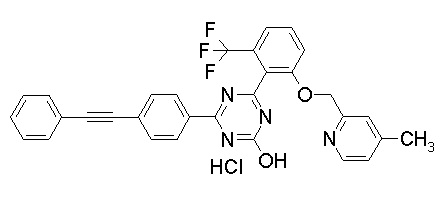

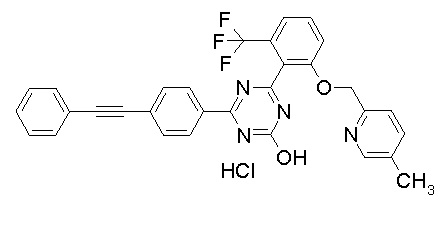

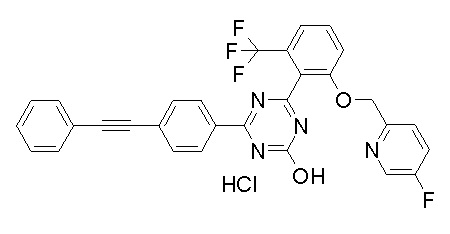

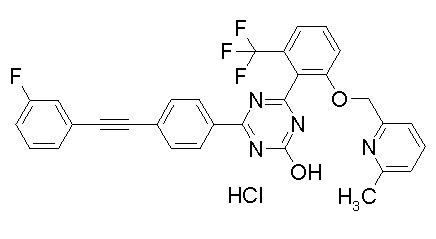

[0797]
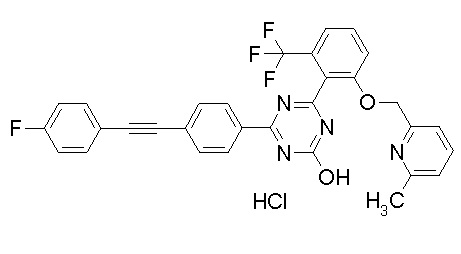

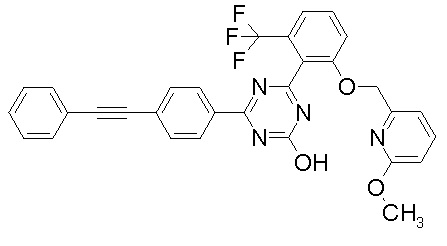

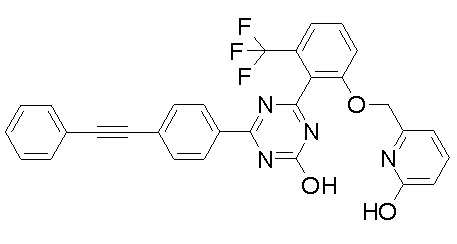

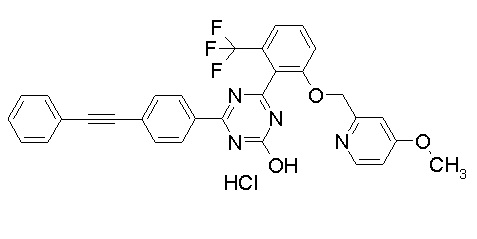

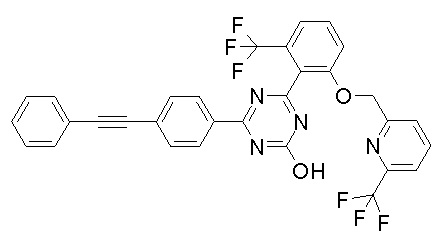

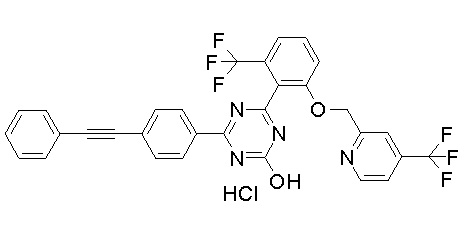

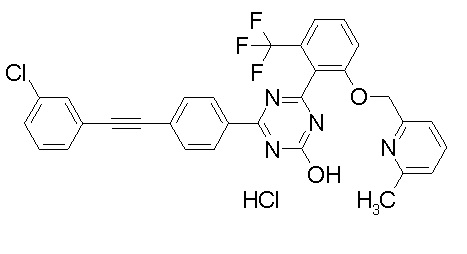

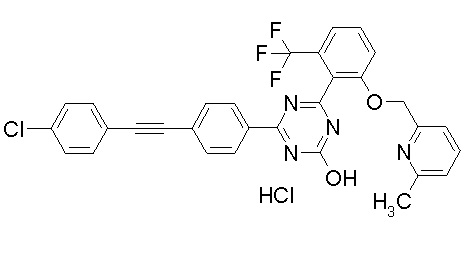

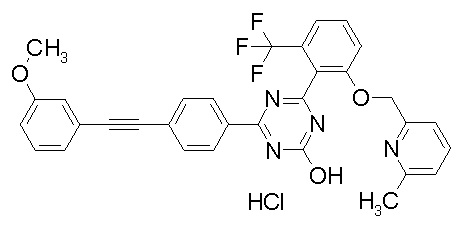

[0798]
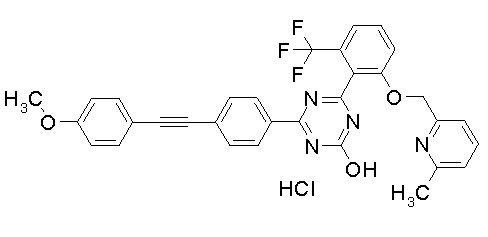

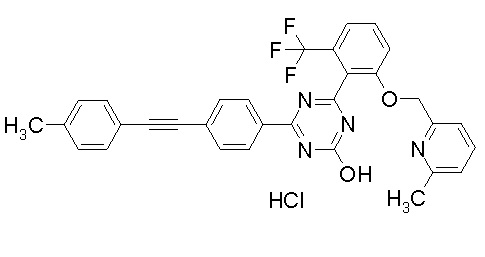

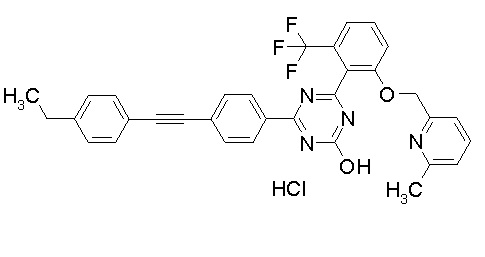

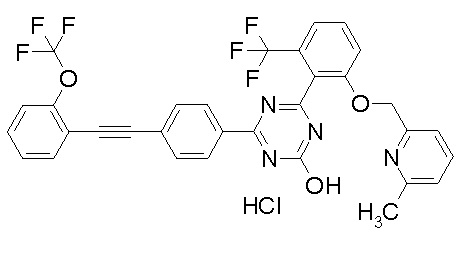

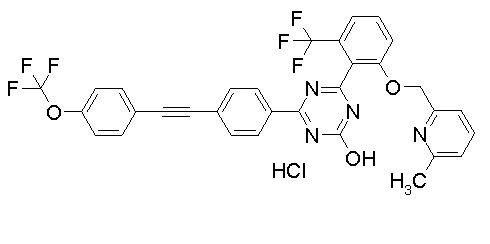

[0799]
(M+H)
(M-H)

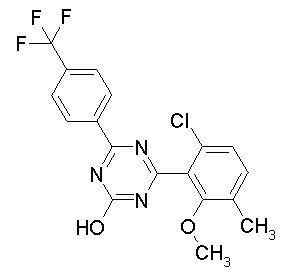

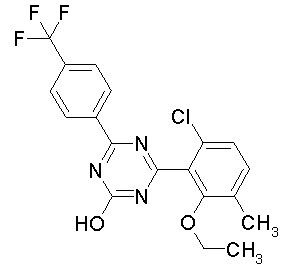

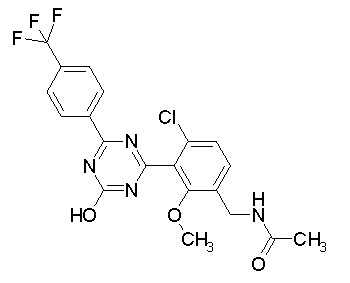

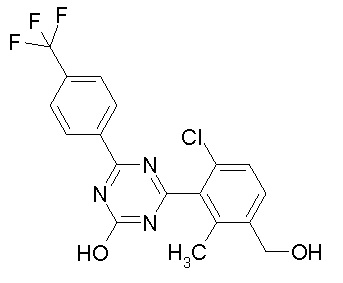

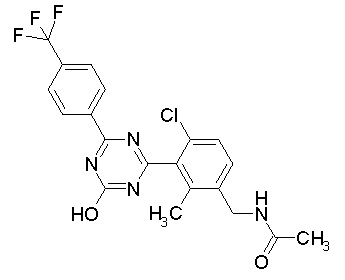

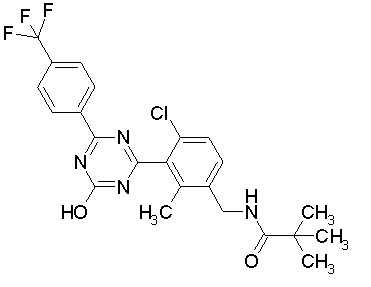

[0800]
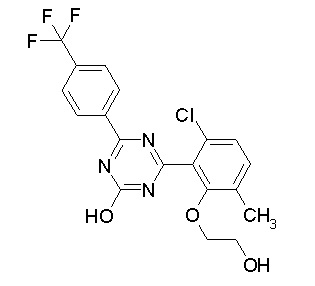

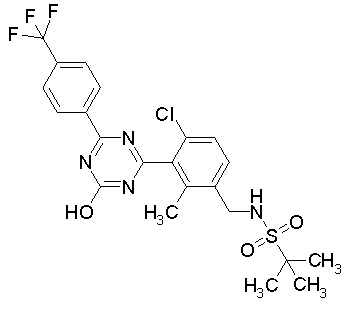

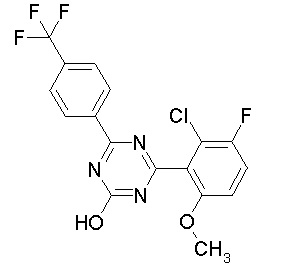

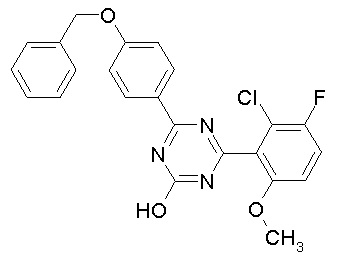

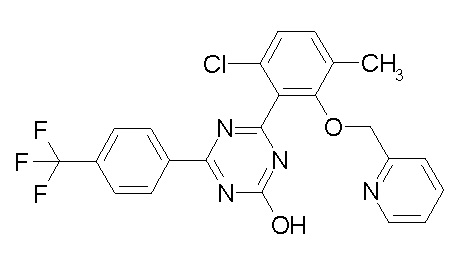

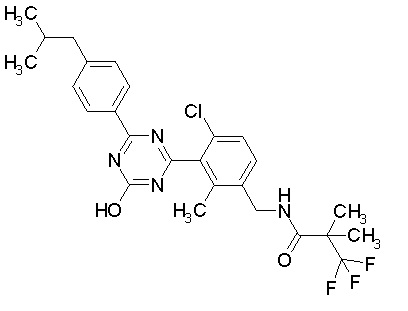

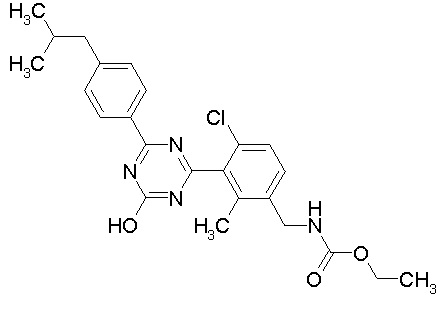

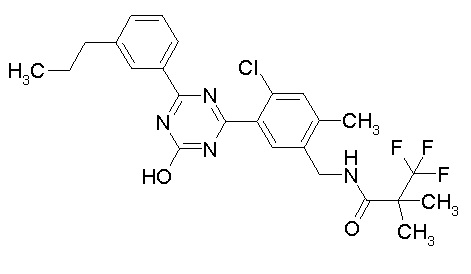

[0801]
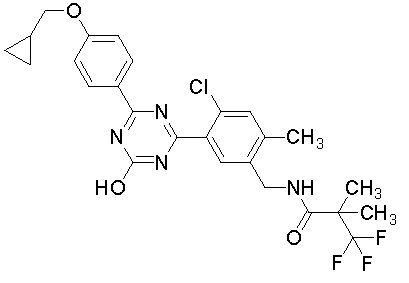

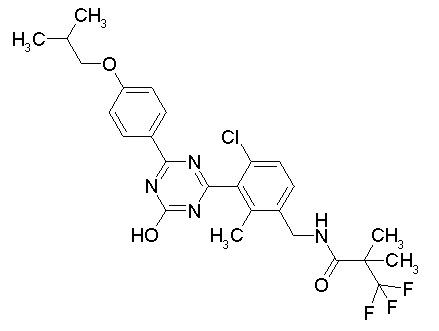

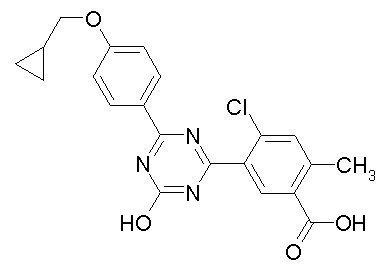

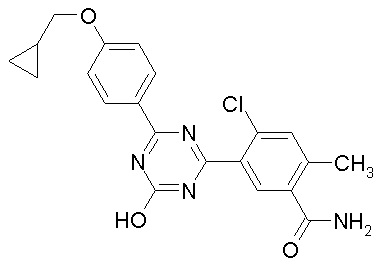

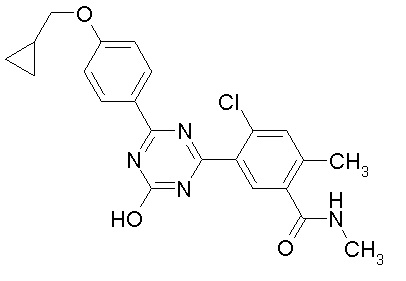

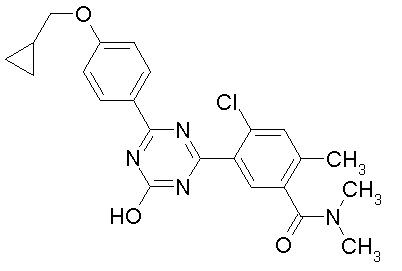

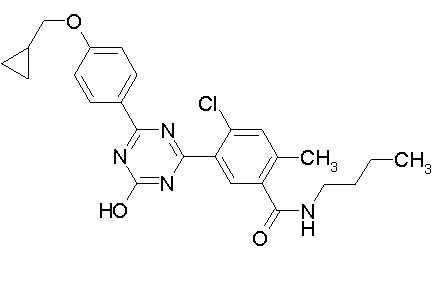

[0802]
Экспериментальный пример 1: Оценка ингибирующей активности фермента mPGES-1 человека
Ингибирующая активность фермента mPGES-1 человека тестируемого препарата оценивали в соответствии с докладом Xu et al. (XU, D et al. MF63 [2-(6-chloro-1H-phenanthro[9,10-d]imidazol-2-yl)-isophthalonitrile], a selective microsomal prostaglandin E synthase-1 inhibitor, relieves pyresis and pain in preclinical models of inflammation. J Pharmacol Exp Ther. Sep 2008, Vol.326, No.3, pages 754-763). То есть, количество PGE2, продуцируемое mPGES-1 человека в присутствии тестируемого препарата измеряли с помощью способа HTRF (гомогенная флуоресценция с временным разрешением), на основе которого определяли ингибирующую активность фермента mPGES-1 человека тестируемого препарата.
[0803]
1) Получение микросомной фракции клетки, экспрессирующей mPGES-1 человека
Фрагмент ДНК, содержащий mPGES-1 человека, который добавляли с последовательностью расщепления распознавания BamHI непосредственно перед инициирующим кодоном трансляции и последовательностью расщепления распознавания EcoRI, сразу после кодона терминации трансляции, амплифицировали методом ПЦР (полимеразной цепной реакции) с использованием экспрессионной плазмиды ДНК mPGES-1 человека (pME-18S/iPGES-1), полученной в лаборатории в качестве матрицы. Очищенный фрагмент ДНК расщепляли BamHI и EcoRI, и лигировали с pcDNA3.1(+) (Invitrogen, номер модели V790-20), аналогично получению с BamHI и EcoRI, с помощью набора для лигирования ДНК ver.2.1 (DNA Ligation kit ver.2.1) (Takara Bio, номер модели 6022). Экспрессионную плазмиду ДНК mPGES-1 человека выделили из Escherichia coli DH5α (TOYOBO, номер образца DNA-903), трансформированной с полученным продуктом лигирования. Нуклеотидную последовательность mPGES-1 человека клонировали в вектор с помощью метода Dye Terminator с использованием набора для сиквенса BigDye Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems, #4337455). Определенная последовательность была идентична последовательности белка области трансляции mPGES-1 человека (номер доступа NM_004878), зарегистрированной в NCBI справочной базе данных.
Экспрессионную плазмиду ДНК mPGES-1 трансфицировали в клетки яичника китайского хомячка (FreeStyle CHO-S Cell, Invitrogen, #R800-07) с использованием трансгенного реагента (FreeStyle MAX Reagent (Invitrogen, #16447-100)), и культивировали при встряхивании (8% CO2, 37°C) в среде, содержащей 8 ммоль/л L-глутамина (среда для экспрессии GIBCO FreeStyle CHO Expression Medium, Invitrogen, #12651-022) в течение 48 часов.
Клетки CHO-S суспендировали в буфере гомогената (100 ммоль/л фосфата калия (рН 7,4), 250 ммоль/л сахароза, 100 ммоль/л ЭДТА, complete EDTA free (Roche, #1873580)). С помощью ультразвукового дезинтегратора UD-201 (Tomy Seiko), суспендированные клетки разрушали на выходе:3, рабочий цикл: 50 в течение 30 секунд. Осадок удаляли центрифугированием (1000×g, 5 минут, 4°C), и супернатант центрифугировали (5000×g, 10 минут, 4°C). Супернатант дополнительно центрифугировали (105000×g, 60 минут, 4°C). Полученный осадок суспендировали в буфере для ресуспендирования (100 ммоль/л фосфата калия (рН 7,4), 250 ммоль/л сахарозы, 100 ммоль/л ЭДТА, 10% глицерина) с получением микросомальной фракции.
Концентрацию белка в микросомальной фракции измеряли по методу Брэдфорда (Protein Assay Kit, Bio-Rad). Микросомальную фракцию быстро замораживали в жидком азоте и хранили при -80°C. mPGES-1 человека в микросомальной фракции определяли с помощью Вестерн-блоттинга с использованием поликлонального антитела кролика против mPGES-1 (ThermoFisher Scientific, #PA1-10264).
[0804]
2) Оценка ингибирующей активности фермента mPGES-1 человека
Раствор тестируемого препарата разбавляли 0,1 моль/л фосфата калия, pH 7,4 (в дальнейшем упоминается как KPB) или ДМСО (Nacalai Tesque, #13407-45) добавляли при 5 мкл/лунку в 96-луночный V-образный планшет (Corning, #3363). Конечная концентрация ДМСО во время реакции была установлена до 2%(об./об.). Кроме того, микросомную фракцию клеток СНО-S, экспрессирующих mPGES-1 человека, которую разбавляли редуцированным GSH (12,5 ммоль/л раствор KPB, SIGMA, #G6529-25G) таким образом, чтобы концентрация белка составляла 5 мкг/мл, добавляли при 20 мкл/лунку. Количество используемой микросомной фракции представляет собой количество микросомной фракции в пределах диапазона, где количество PGE2, продуцируемое в условиях реакции, показано ниже, и количество используемой микросомной фракции показывает линейность. К пустому раствору добавляли редуцированный GSH (12,5 ммоль/л раствора KPB) при 20 мкл/лунку. После перемешивания при комнатной температуре в течение 10 минут, PGH2 (PGH2 растворяли в холодном ацетоне при 100 мкг/мл и разбавляли D-PBS(-) (Nikken biomedical laboratory, #CM6201) до 10 мкг/мл, Cayman Chemical, #17020) добавляли 25 мкл/лунку, и смесь выдерживали при комнатной температуре в течение 45 секунд. Дигидрат хлорида олова (II), (2 мг/мл 10 ммоль/л раствора лимонной кислоты, Wako Pure Chemical Industries, Ltd., #204-01562) добавляли 50 мкл/лунку, и планшет осторожно встряхивали для прекращения ферментативной реакции.
Концентрацию PGE2 в указанной выше реакционной смеси фермента измеряли с помощью анализа Prostaglandin E2 (CISbio Bioassays, #62P2APEC) в соответствии с инструкцией. В качестве эталонного стандарта для аналитической кривой, использовали PGE2 (Cayman Chemical, #14010). Используя RUBYstar (BMG Labtech), измеряли флуоресценцию с временным разрешением при 620 нм и 665 нм относительно возбуждающего света при 337 нм. Концентрация PGE2 была экстраполирована из аналитической кривой PGE2. Среднее значение концентраций PGE2 соответственно-обработанных лунок использовали в качестве данных.
Ингибирующую активность фермента mPGES-1 (%) тестируемого препарата рассчитывали в соответствии со следующей формулой 1.
[формула 1]
ингибирующая активность фермента mPGES-1 (%)=(PGE2A-PGE2X)/(PGE2A-PGE2B)×100
PGE2A: концентрация PGE2 лунки, обработанной носителем
PGE2B: концентрация PGE2 лунки с контрольным раствором
PGE2X: концентрация PGE2 лунки, обработанной тестируемым препаратом
Значение IC50 (50% ингибирующая концентрация) тестируемого препарата рассчитывали в соответствии со следующей формулой 2.
[формула 2]
Значение IC50=10{log10(D/E)×(50-G)/(F-G)+log10(E)}
D: концентрация тестируемого препарата, которая показывает активность не менее 50% ингибирования между двумя точками по 50% ингибированию
E: концентрация тестируемого препарата, которая показывает активность не более 50% ингибирования между двумя точками по 50% ингибированию
F: ингибирующая активность фермента mPGES-1 (%), когда концентрация тестируемого препарата представляет собой D
G: Ингибирующую активность фермента mPGES-1 (%), когда концентрация тестируемого препарата представляет собой E
Результаты показаны в таблице 4-1 - таблице 4-9.
[0805]
[0806]
[0807]
[0808]
[0809]
[0810]
(при 30 мкМ)
(при 30 мкМ)
(при 30 мкМ)
[0811]
[0812]
[0813]
[0814]
Экспериментальный пример 2: Оценка действия ингибитора mPGES-1 на нормальное внутриглазное давление Macaca fascicularis
Этот тест выполняли с использованием самцов Macaca fascicularis. Для устранения межиндивидуальную различия и влияние разницы в дни введения, использовали перекрестный тест для оценки, как это показано в таблице 5.
[0815]
[Таблица 5]
10 мг/кг
30 мг/кг
30 мг/кг
30 мг/кг
30 мг/кг
[0816]
Для того, чтобы исключить влияние оставшегося тестируемого препарата, период вымывания 1-неделя был установлен между тестами. В день теста, обезьян кормили после окончательного измерения.
Тестируемый препарат (соединение Примеров 2-98) суспендировали в 0,5% метилцеллюлозы (Wako Pure Chemical Industries, Ltd.), и вводили через желудочный зонд с помощью полипропиленового шприца (стерилизованный продукт одноразового использования, Nipro Corporation) и катетер желудочный (Нелатон типа А No. 9, Izumo health). Доза была установлена в 10 мг/кг/5 мл (N=1) или 30 мг/кг/5 мл (N=4), в расчете на массу тела каждого индивидуума за день до введения. Группе, получающей носитель, вводили носитель (0,5% метилцеллюлозы (MC)) способом, аналогичным способу, для тестируемого препарата. В качестве контрольного препарата использовали ксалатан (зарегистрированная торговая марка), офтальмологический раствор 0,005% (Pfizer Inc., общее название: латанопрост). Контрольный препарат вводили путем закапывания 20 мкл в один глаз с помощью микропипетки. После закапывания слезную часть слегка фиксировали, осторожно нажимая на нижнее веко в течение приблизительно 15 секунд. Противоположный глаз обрабатывали таким же образом. Внутриглазное давление измеряли непосредственно перед введением, и через 2, 4, 8, 12 и 24 часа после введения. Перед измерением внутриглазного давления, животное фиксировали на специальном стуле для обезьян, и анестезировали местно путем закапывания офтальмологического местного анестетика (Беноксил, (зарегистрированная торговая марка) офтальмологический раствор 0,4%, Santen Pharmaceutical Co., Ltd., общее название: оксибупрокаина гидрохлорид). Устанавливали векорасширитель (Handaya Co., Ltd), и измеряли внутриглазное давление обоих глаз с помощью пневматического аппланационного тонометра (Model30 Classic, Reichert Inc.).
Для подтверждения исчезновения тестируемого препарата, после измерения внутриглазного давления через 24 часа после третьего курса введения, образцы крови (1 мл) собирали из бедренной вены без анестезии с помощью полипропиленового шприца и инъекционной иглы 23 калибра (оба стерилизованные одноразовые продукты), обработанной гепарином натрия, и измеряли концентрацию неизмененного соединения в плазме, содержащей тестовый препарат.
Разница внутриглазного давления (Δмм рт.ст.; в первом знаке после запятой) от значения непосредственно перед введением определяли для каждого измерения глаза в каждый момент измерения, рассчитывали среднее для обоих глаз и принимали в качестве оценки данных индивида. Среднее значение и стандартное отклонение (в двух знаках после запятой) разности внутриглазного давления вычисляли для каждой группы, и группа с введением тестируемого препарата или группа с введением контрольного препарата была подвергнуты испытанию на гомоскедастичность (уровень значимости 5%) на основе F-теста с группой, получавшей носитель. Когда дисперсия была равной, выполняли t-критерий Стьюдента, и, когда дисперсия не была равной, выполняли t-критерий Аспина-Уэлча. Кроме того, максимальный глазной гипотензивный эффект (Δмм рт.ст.; максимальное снижение значения от значения непосредственно перед введением, в первом знаке после запятой) определяли для каждой группы, и группы сравнивали таким же образом. Выполняли двусторонний критерий. Это является значимым изменением, когда разница от группы, получавший носитель, была найдена на уровне значимости 5% и показано на фиг. 1, отдельно, как 5% и 1%. Поскольку группа с введением тестируемого препарата 10 мг/кг содержала только одно животное, она была исключена из статистического анализа.
[0817]
Внутриглазное давление Macaca fascicularis, используемых для этого теста, до введения тестируемого препарата было равно 19,6±1,7 мм рт.ст. После измерения внутриглазного давления через 24 часа после введения третьего курса, концентрация неизмененного тестируемого препарата в плазме группы, получавшей носитель, и группы, которой вводили тестируемый препарат, была меньше нижнего предела обнаружения. Результаты показаны на фиг.1.
[0818]
Экспериментальный пример 3: Оценка влияния на простагландин состава в водянистой влаге морской свинки
Тестируемый препарат растворяли в солевом растворе, содержащем 0,5% полисорбат80 (Fluka) и получали 0,003% офтальмологический раствор (рН 7,0-8,0). Тестируемый препарат вводили самцу морской свинки Hartley путем инстилляции 20 мкл его в один глаз с помощью микропипетки. После инстилляции, слезную часть слегка фиксировали, осторожно нажимая на нижнее веко в течение приблизительно 15 секунд. Противоположный глаз обрабатывали таким же образом. Группе, получавшей носитель, вводили среду (0,5% полисорбат-содержащий солевой раствор) способом, аналогичным для тестируемого препарата. Через 23 часа после инстилляции, Mydrin P (зарегистрированная торговая марка) 0,5% офтальмологического раствора (Santen Pharmaceutical Co., Ltd., общее название: тропикамид/фенилэфрин гидрохлорид) добавляли по каплям по одной капле в оба глаза морской свинки, чтобы вызвать мидриаз. Морскую свинку анестезировали Escain (зарегистрированная торговая марка) ингаляционным анестетиком (Pfizer Inc., общее название изделия: изофлуран), роговицы обоих глаз выстукивали инъекционной иглой 30G, и собирали вытекшую водянистую влагу (первичная водянистая влага). Через один час (24 часа после инстилляции), морскую свинку снова анестезировали изофлураном, и вторичную водянистую влагу собирали таким же образом. Концентрацию простагландинов во вторичной водянистой влаге, полученной от каждой группы (4 морских свинки, 8 глаз), измеряли с помощью системы ЖХ/МС/МС (ультра высокоэффективная жидкостная хроматография: Nexera (зарегистрированная торговая марка) производства Shimadzu Corporation, масс-спектрометр: AB SCIEX производства QTRAP (зарегистрированная торговая марка) 5500), и рассчитывали отношение концентрации каждой концентрации простагландина относительно общего количества всех концентраций простагландина. Результаты показаны в таблице 6.
[0819]
[Таблица 6]
[0820]
Экспериментальный пример 4: Оценка действия ингибитора mPGES-1 на нормальное внутриглазное давление Macaca fascicularis
Этот тест выполняли с использованием самцов Macaca fascicularis. Для устранения межиндивидуальную различия и влияние разницы в дни введения, использовали перекрестный тест для оценки, как это показано в таблице 7.
[0821]
[Таблица 7]
[0822]
Для того, чтобы исключить влияние оставшегося тестируемого препарата, период вымывания 1-неделя был установлен между тестами. В день теста, обезьян кормили после окончательного измерения.
Тестируемый препарат растворяли в солевом растворе, содержащем 0,5% полисорбат80 (Fluka) и получали 0,1% офтальмологический раствор (рН 7,9-8,1). Группе, получавшей носитель, вводили среду (0,5% полисорбат-содержащий солевой раствор) способом, аналогичным для тестируемого препарата. В качестве контрольного препарата использовали ксалатан (зарегистрированная торговая марка), офтальмологический раствор 0,005% (Pfizer Inc., общее название: латанопрост). Тестируемый препарат вводили путем закапывания 30 мкл его в один глаз 5 раз и 1 раз носителя с интервалами 5 минут с помощью микропипетки (всего 6 раз закапывания для каждого глаза). Каждый из носителя и контрольного препарата вводили 1 раз, и затем носитель закапывали 5 раз (всего 6 раз закапывания для каждого глаза). В комбинированной группе, получавшей тестируемый препарат+контрольный препарат, тестируемый препарат закапывали 5 раз после закапывания контрольного препарата (всего 6 раз закапывания для каждого глаза). После закапывания каждый раз, слезную часть слегка фиксировали, осторожно нажимая на нижнее веко в течение приблизительно 15 секунд. Внутриглазное давление измеряли непосредственно перед введением, и через 2, 4, 8, 12 и 24 часа после введения. Перед измерением внутриглазного давления, животное фиксировали на специальном стуле для обезьян, и анестезировали местно путем закапывания офтальмологического местного анестетика (Беноксил, (зарегистрированная торговая марка) офтальмологический раствор 0,4%, Santen Pharmaceutical Co., Ltd., общее название: оксибупрокаина гидрохлорид). Устанавливали векорасширитель (Handaya Co., Ltd), и измеряли внутриглазное давление обоих глаз с помощью пневматического аппланационного тонометра (Model30 Classic, Reichert Inc.).
Разница внутриглазного давления (Δмм рт.ст.; в первом знаке после запятой) от значения непосредственно перед введением определяли для каждого измерения глаза в каждый момент измерения, рассчитывали среднее для обоих глаз и принимали в качестве оценки данных индивида. Среднее значение и стандартное отклонение (в двух знаках после запятой) разности внутриглазного давления вычисляли для каждой группы, и группа с введением тестируемого препарата или группа с введением контрольного препарата была подвергнуты испытанию на гомоскедастичность (уровень значимости 5%) на основе F-теста с группой, получавшей носитель. Когда дисперсия была равной, выполняли t-критерий Стьюдента, и, когда дисперсия не была равной, выполняли t-критерий Аспина-Уэлча. Кроме того, максимальный глазной гипотензивный эффект (Δмм рт.ст.; максимальное снижение значения от значения непосредственно перед введением, в первом знаке после запятой) определяли для каждой группы, и группы сравнивали таким же образом. Выполняли двусторонний критерий. Это является значимым изменением, когда разница от группы, получавший носитель, была найдена на уровне значимости 5%.
[0823]
Примеры составов по настоящему изобретению включают следующие составы. Тем не менее, настоящее изобретение не ограничивается такими примерами составов.
Пример состава 1 (Получение капсулы)
1), 2), 3) и 4) смешивали и наполняли желатиновую капсулу.
Пример состава 2 (Получение таблетки)
Общее количество 1), 2), 3) и 30 г 4) замешивали с водой, сушили в вакууме и просеивают через сито. Просеянный порошок смешивали с 14 г 4) и 1 г 5), и смесь таблетировали с помощью таблетировочной машины. Таким образом, получали 1000 таблеток, содержащих 10 мг соединения, полученного в примере 1-86 на таблетку.
Пример состава 3 (получение глазных капель)
в 100 мл глазных капель
Вышеуказанные компоненты смешивали в стерильных условиях с рН 7,9-8,1, с получением глазные капель.
Пример состава 4 (получение глазных капель)
в 100 мл глазных капель
Вышеуказанные компоненты смешивали в стерильных условиях с рН 7,9-8,1, с получением глазные капель.
Пример состава 5 (получение глазных капель)
в 100 мл глазных капель
Вышеуказанные компоненты смешивали в стерильных условиях с рН 7,9-8,1, с получением глазные капель.
Промышленная применимость
[0824]
Поскольку соединение по настоящему изобретению и его фармацевтически приемлемая соль, имеют ингибирующую активность mPGES-1, они могут обеспечить лекарственное средство, эффективное для профилактики или лечения боли, ревматизма, остеоартрита, лихорадки, болезни Альцгеймера, рассеянного склероза, атеросклероза, глаукомы, глазной гипертензии, ишемического заболевания сетчатки, системной склеродермии, рака, включая колоректальный рак, и заболеваний, для которых супрессия продукции PGE2 является эффективной.
Настоящая заявка основана на заявке на патент No. 2014-031035, поданной в Японии 20 февраля 2014 г., содержание которой включено в настоящее описание в полном объеме.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЕ ГИДРОКСИТРИАЗИНА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНСКИХ ЦЕЛЯХ | 2016 |
|
RU2772907C2 |
| ТРИАЗИНОВОЕ ПРОИЗВОДНОЕ И ВКЛЮЧАЮЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2565073C2 |
| ИНГИБИТОРЫ ПРОТЕИНТИРОЗИНФОСФАТАЗЫ | 2020 |
|
RU2799449C2 |
| АРИЛ- И ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ТЕТРАГИДРОИЗОХИНОЛИНЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ БЛОКИРОВАНИЯ ОБРАТНОГО ЗАХВАТА НОРЭПИНЕФРИНА, ДОПАМИНА И СЕРОТОНИНА | 2005 |
|
RU2388751C2 |
| КОНДЕНСИРОВАННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2006 |
|
RU2408586C2 |
| НОВОЕ ПРОИЗВОДНОЕ ФЕНИЛПИРРОЛА | 2009 |
|
RU2470917C2 |
| СПОСОБ ПОЛУЧЕНИЯ НЕКОТОРЫХ 2-(ПИРИДИН-3-ИЛ)ТИАЗОЛОВ | 2013 |
|
RU2649000C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ОПРЕДЕЛЕННЫХ 2-(ПИРИДИН-3-ИЛ)ТИАЗОЛОВ | 2013 |
|
RU2647853C2 |
| ИНГИБИТОР CD73, МЕТОД ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2787428C1 |
| СОЕДИНЕНИЕ ТРИАЗИНОНА И ИНГИБИТОР КАЛЬЦИЕВЫХ КАНАЛОВ Т-ТИПА | 2013 |
|
RU2645158C2 |
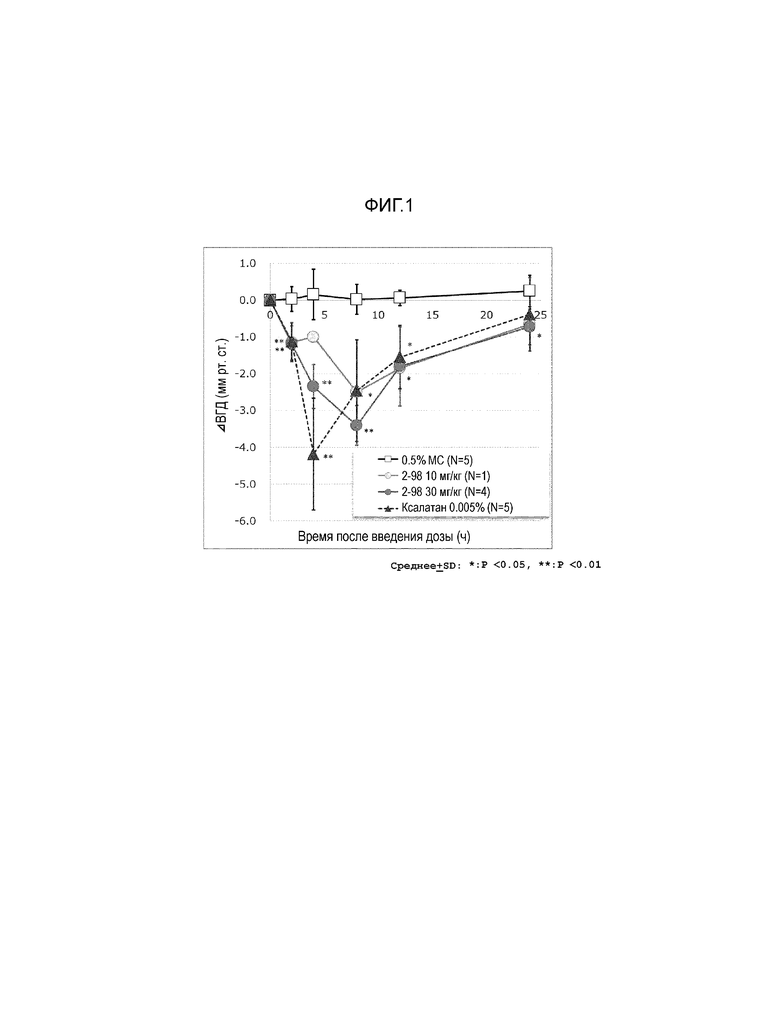
Изобретение относится к соединению, представленному формулой [I], или его фармацевтически приемлемой соли. В формуле [I] X представляет собой CH или N, кольцо Cy представляет собой формулу
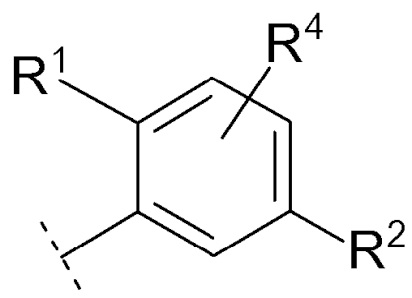
или формулу
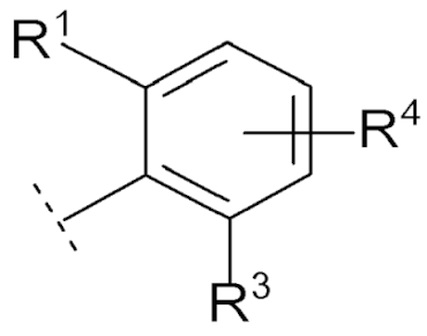 ,
,
R5 представляет собой (1) галоген, (2) гидрокси, (3) C1-6 алкилсульфанил, (4) C1-6 алкил (указанный C1-6 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, C6 арила и C1-6 алкокси), (5) C3-7 циклоалкил, (6) -ORd или (7) формулу
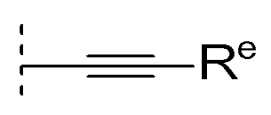 , m1 равен 0, 1, 2 или 3 и, когда m1 равен 2 или 3, каждый R5 выбран независимо друг от друга. Значения остальных радикалов представлены в формуле изобретения. Изобретение относится также к индивидуальным соединениям, к фармацевтической композиции, к ингибитору mPGES-1, к терапевтическому или профилактическому средству, к способу ингибирования mPGES-1, к способу лечения или профилактики, к применениям соединения. Технический результат: получены новые соединения формулы [I], обладающие свойствами ингибитора PGES-1. 9 н. и 10 з.п. ф-лы, 1 ил., 64 табл., 34 пр.
, m1 равен 0, 1, 2 или 3 и, когда m1 равен 2 или 3, каждый R5 выбран независимо друг от друга. Значения остальных радикалов представлены в формуле изобретения. Изобретение относится также к индивидуальным соединениям, к фармацевтической композиции, к ингибитору mPGES-1, к терапевтическому или профилактическому средству, к способу ингибирования mPGES-1, к способу лечения или профилактики, к применениям соединения. Технический результат: получены новые соединения формулы [I], обладающие свойствами ингибитора PGES-1. 9 н. и 10 з.п. ф-лы, 1 ил., 64 табл., 34 пр.
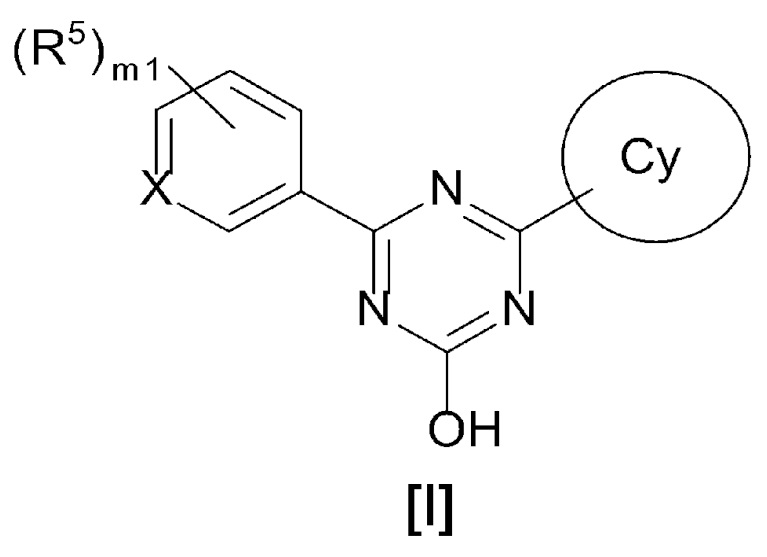
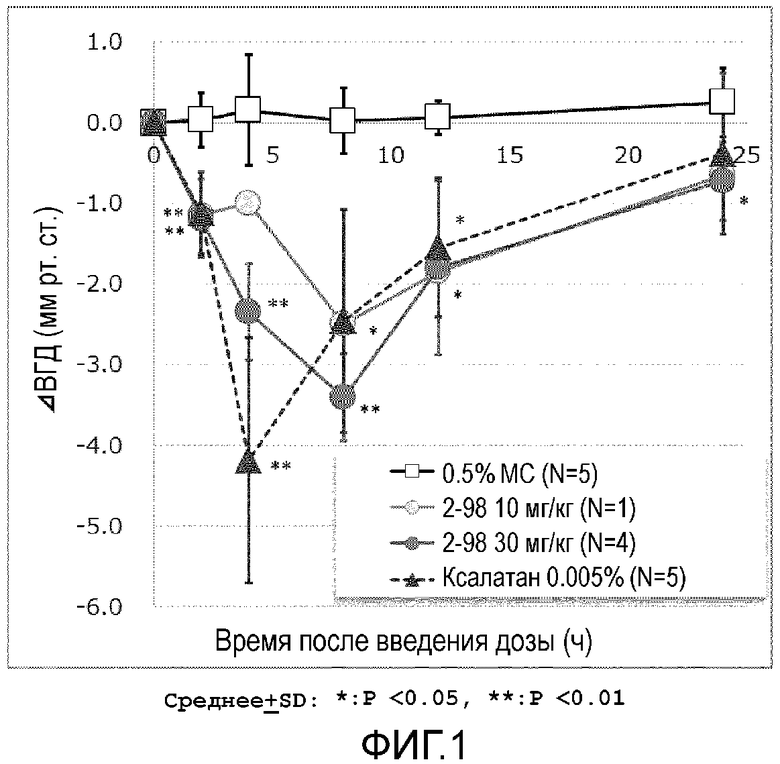
1. Соединение, представленное формулой [I], или его фармацевтически приемлемая соль:
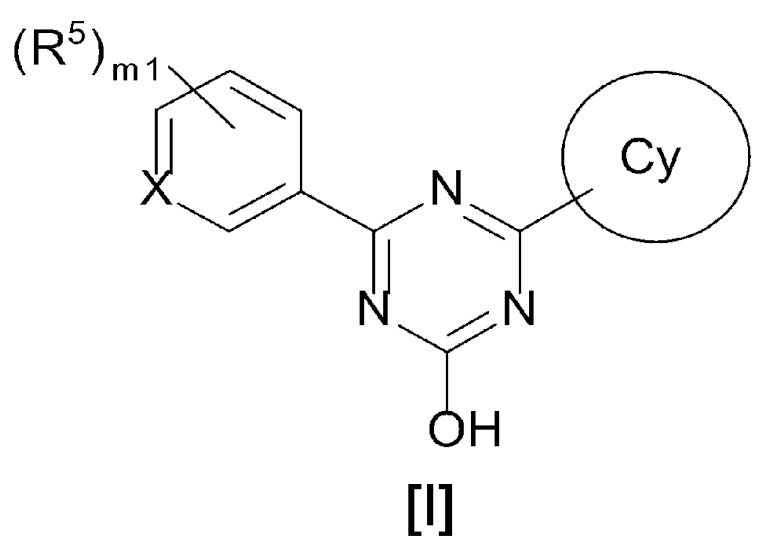 ,
,
где X представляет собой CH или N,
кольцо Cy представляет собой
формулу
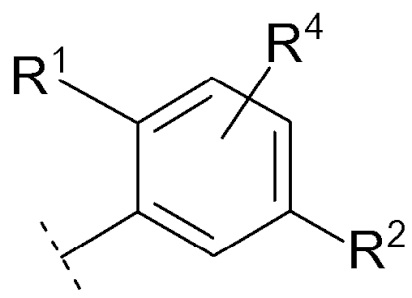
или формулу
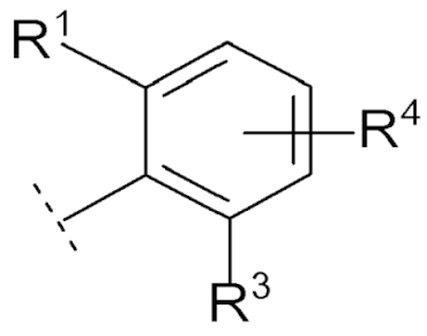
{где R1 представляет собой
(1) галоген,
(2) C1-6 алкил,
(3) циано или
(4) галогенC1-4 алкил,
R2 представляет собой
(1) галоген,
(2) гидрокси,
(3) карбокси,
(4) C1-6 алкил,
(5) C1-6 алкокси,
(6) галогенC1-4 алкокси,
(7) галогенC1-4 алкил,
(8) C1-6 алкил-карбонил,
(9) -C(O)NRa1Ra2 (Ra1 и Ra2, каждый, независимо представляют собой водород или C1-6 алкил) или
(10) -(CnH2n)-Rb,
(n равен 1, 2, 3 или 4, -(CnH2n)- может быть прямой или разветвленной цепью, и
Rb представляет собой
(a) гидрокси,
(b) карбокси,
(c) C1-6 алкокси,
(d) C1-6 алкил-карбонилокси,
(e) -C(O)NRb1Rb2 (Rb1 и Rb2, каждый, независимо представляют собой водород или C1-6 алкил),
(f) -OC(O)NRb3Rb4 (Rb3 и Rb4, каждый, независимо представляют собой водород или C1-6 алкил),
(g) -NRb5C(O)NRb6Rb7 (Rb5, Rb6 и Rb7, каждый, независимо представляют собой водород или C1-6 алкил),
(h) -NRb8Rb9 (Rb8 и Rb9, каждый, независимо представляют собой водород, или C1-6 алкил, или галогенC1-4 алкил),
(i) -NRb10S(O)2Rb11 (Rb10 и Rb11, каждый, независимо представляют собой водород, C1-6 алкил или C3-7 циклоалкил),
(j) -NRb12C(O)ORb13 (Rb12 представляет собой водород или C1-6 алкил и Rb13 представляет собой C1-6 алкил),
(k) -NRb14C(O)Rb15 (Rb14 представляет собой водород или C1-6 алкил и Rb15 представляет собой
(i) C6 арил,
(ii) C1-8 алкил (указанный C1-8 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из гидрокси, галогенC1-4 алкила, C1-6 алкокси и C6-10 арила),
(iii) адамантил или
(iv) C3-7 циклоалкил (указанный C3-7 циклоалкил необязательно замещен 1, 2, 3 или 4 заместителями, выбранными из группы, состоящей из C1-6 алкила, галогена, гидроксил C1-6 алкила и галогенC1-4 алкила, и/или необязательно образует конденсированное кольцо с бензольным кольцом), или
Rb14 и Rb15 необязательно образуют 4-, 5- или 6-членный лактам вместе с атомом азота, к которому Rb14 присоединен, и атомом углерода, к которому Rb15 присоединен (указанный лактам необязательно замещен 1, 2 или 3 C1-6 алкилами и/или необязательно образует конденсированное кольцо с бензольным кольцом),
(l) формулу
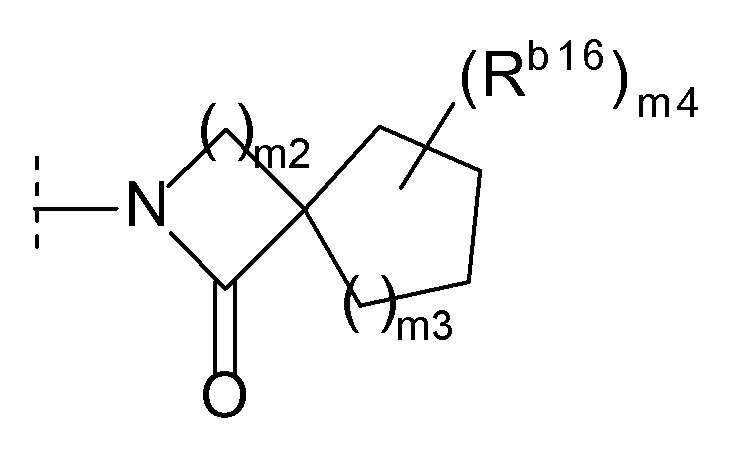 ,
,
где m2 и m3 каждый независимо друг от друга равен 1 или 2, m4 равен 0 или 1, Rb16 представляет собой C1-6 алкил или C1-6 алкокси, или
(m) формулу
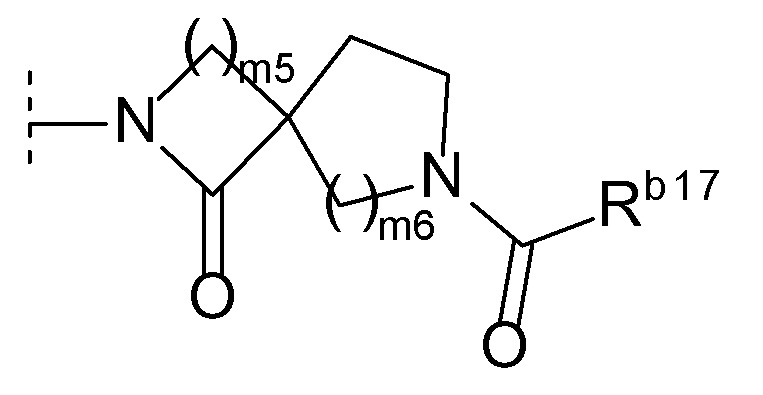 ,
,
где m5 и m6 каждый независимо друг от друга равен 2 и Rb17 представляет собой C1-6 алкил или C1-6 алкокси),
R3 представляет собой
(1) галоген,
(2) гидрокси,
(3) C1-6 алкил или
(4) -ORc {Rc представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из следующих (а)-(f):
(a) галогена,
(b) гидрокси,
(c) C1-6 алкокси,
(d) -C(O)NRc1Rc2 (Rc1 и Rc2, каждый, независимо представляют собой водород или C1-6 алкил),
(e) C6 арила (указанный C6 арил необязательно замещен 1 заместителем, выбранным из группы, состоящей из
(iii) C1-6 алкила, и
(f) 6-членного гетероарила, содержащего 1 или 2 атома азота (указанный гетероарил необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) гидрокси,
(iii) C1-6 алкила,
(iv) C1-6 алкокси, и
(v) галогенC1-4 алкила)}, и
R4 представляет собой
(1) водород,
(2) галоген,
(3) C1-6 алкил или
(4) C1-6 алкокси},
R5 представляет собой
(1) галоген,
(2) гидрокси,
(3) C1-6 алкилсульфанил,
(4) C1-6 алкил (указанный C1-6 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, C6 арила и C1-6 алкокси),
(5) C3-7 циклоалкил,
(6) -ORd {Rd представляет собой
(a) C2-6 алкинил,
(b) C3-7 циклоалкил, необязательно замещенный 1, 2 или 3 C1-6 алкилами, или
(c) C1-8 алкил (указанный C1-8 алкил необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из следующих (i)-(v):
(i) галогена,
(ii) C6 арила,
(iii) C1-6 алкокси,
(iv) C3-7 циклоалкила (указанный C3-7 циклоалкил необязательно замещен 1 заместителем, выбранным из группы, состоящей из C1-6 алкила и галогенC1-4 алкила), и
(v) 4-членного насыщенного гетероциклила, содержащего 1 атом кислорода (указанный насыщенный гетероциклил необязательно замещен 1 заместителем, выбранным из группы, состоящей из C1-6 алкила))} или
(7) формулу
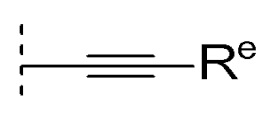 ,
,
где Re представляет собой
(a) C1-6 алкил,
(b) C3-7 циклоалкил,
(c) 6-членный гетероарил, содержащий 1 атом азота, или
(d) C6 арил (указанный C6 арил необязательно замещен 1 заместителем, выбранным из группы, состоящей из
(i) галогена,
(ii) C1-6 алкила,
(iii) галогенC1-4 алкила,
(iv) C1-6 алкокси и
(v) галогенC1-4 алкокси), и
m1 равен 0, 1, 2 или 3 и, когда m1 равен 2 или 3, каждый R5 выбран независимо друг от друга,
исключение 4,6-бис-(2,5-диметил-фенил)-1,3,5-триазин-2-ол.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где кольцо Cy представляет собой формулу
 ,
,
где R1, R2 и R4 являются такими, как определено в п.1.
3. Соединение по п.1 или его фармацевтически приемлемая соль, где кольцо Cy представляет собой формулу
 ,
,
где R1, R3 и R4 являются такими, как определено в п.1.
4. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, где X представляет собой CH.
5. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, где X представляет собой N.
6. Соединение по п.1 или его фармацевтически приемлемая соль, где R1 представляет собой
(1) хлор,
(2) метил,
(3) циано или
(4) трифторметил.
7. Соединение по п.1 или его фармацевтически приемлемая соль, где R4 представляет собой водород.
8. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой
-(CnH2n)-Rb (n равен 1 или 2, -(CnH2n)- может быть прямой или разветвленной цепью, и Rb представляет собой
(a) -C(O)NRb1Rb2,
(b) -NRb5C(O)NRb6Rb7,
(c) -NRb10S(O)2Rb11 или
(d) -NRb14C(O)Rb15
(Rb1, Rb2, Rb5, Rb6, Rb7, Rb10, Rb11, Rb14 и Rb15 являются такими, как определено в п.1)).
9. Соединение по п.8 или его фармацевтически приемлемая соль, где R2 представляет собой -CH2-Rb (Rb является таким, как определено в п.8).
10. Соединение по п.1 или его фармацевтически приемлемая соль, где R3 представляет собой
(1) галоген,
(2) гидрокси,
(3) C1-6 алкил или
(4) -ORc {Rc представляет собой C1-6 алкил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из следующих (а)-(f):
(a) галогена,
(b) гидрокси,
(c) C1-6 алкокси,
(d) -C(O)NRc1Rc2 (Rc1 и Rc2, каждый, независимо представляют собой водород или C1-6 алкил),
(e) фенила (указанный фенил необязательно замещен 1 заместителем, выбранным из группы, состоящей из
(iii) C1-6 алкила,
(f) пиридила (указанный пиридил необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из
(i) галогена,
(ii) гидрокси,
(iii) C1-6 алкила,
(iv) C1-6 алкокси и
(v) галогенC1-4 алкила)}.
11. Соединение по п.1 или его фармацевтически приемлемая соль, где m1 равен 1 и
R5 представляет собой формулу
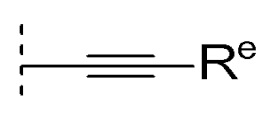 ,
,
где Re является таким, как определено в п.1.
12. Соединение, выбранное из следующих формул:
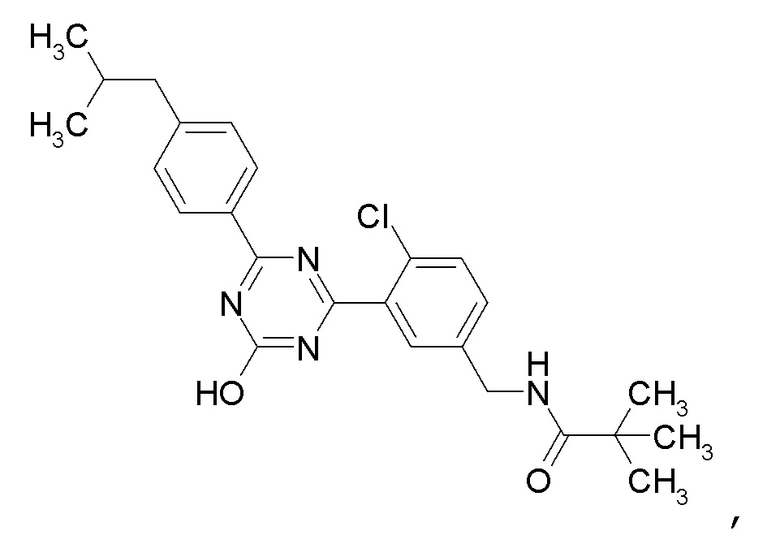
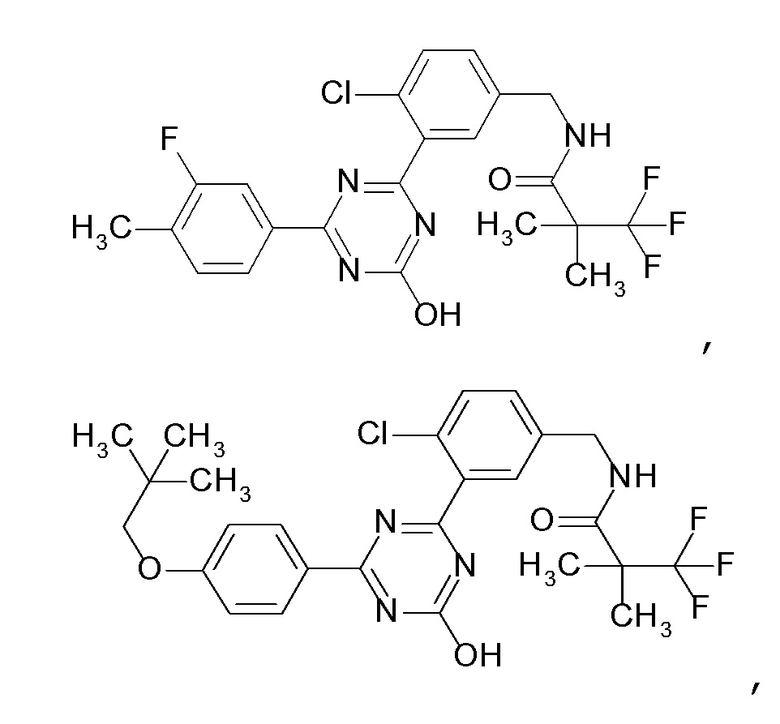
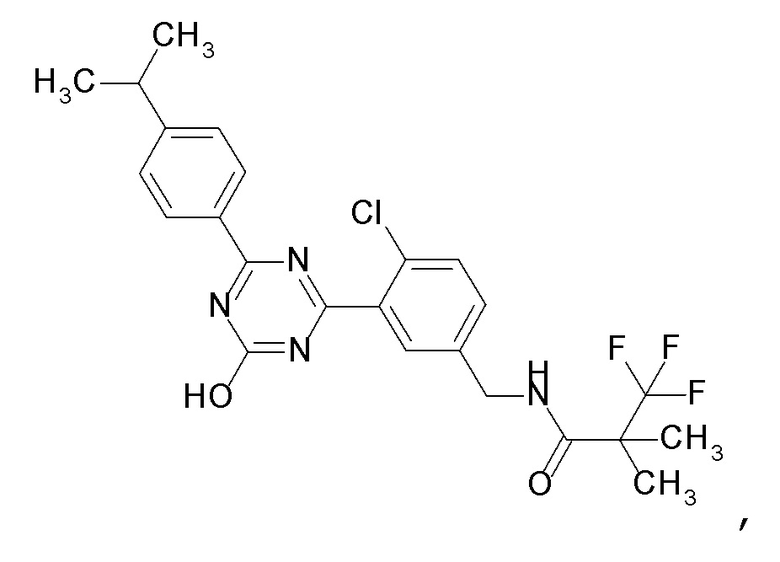
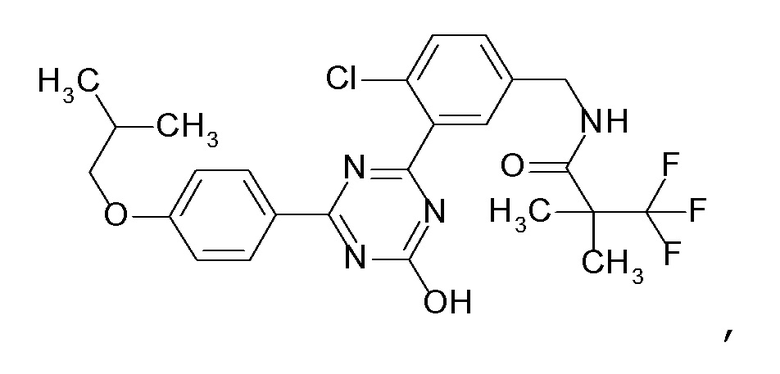
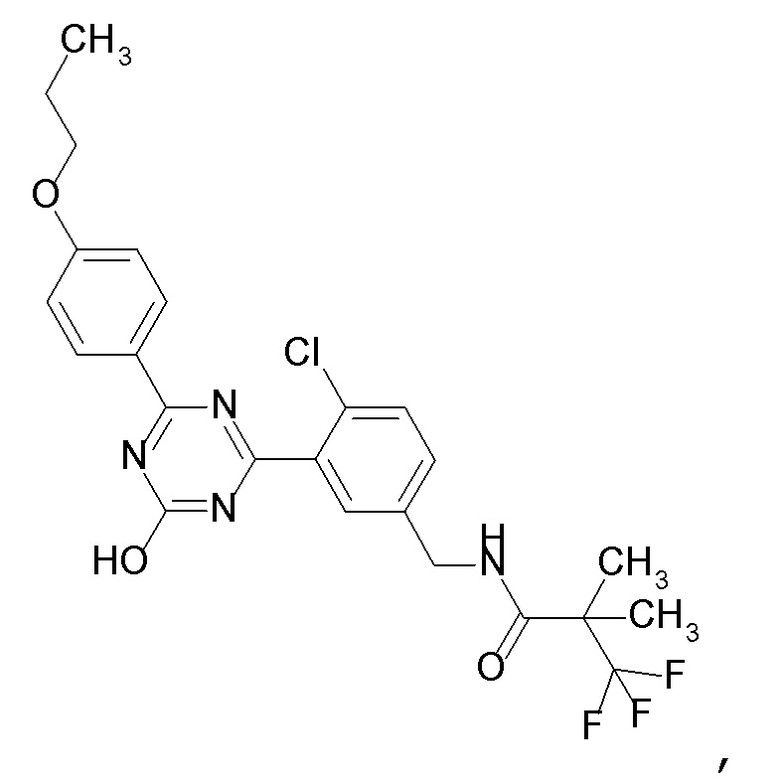
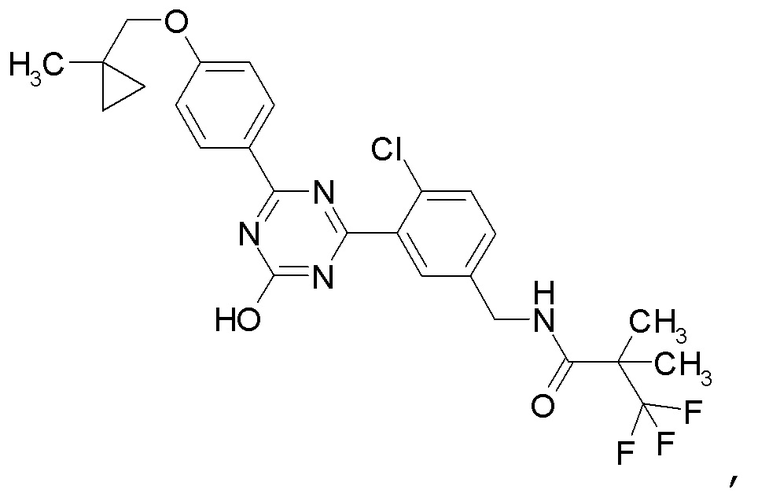
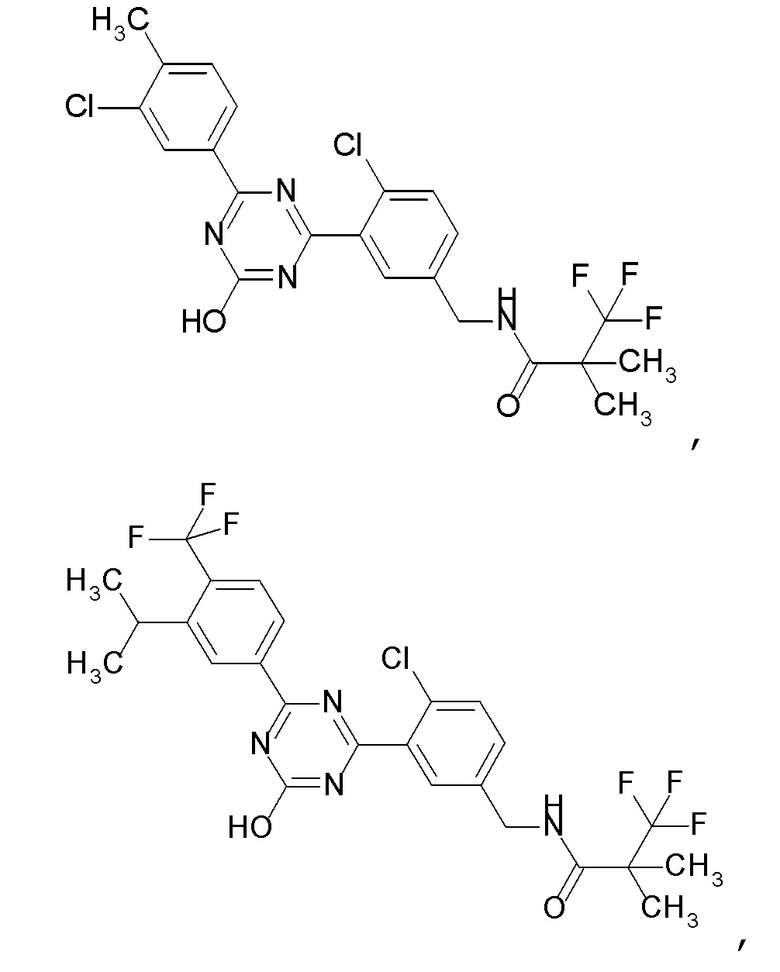
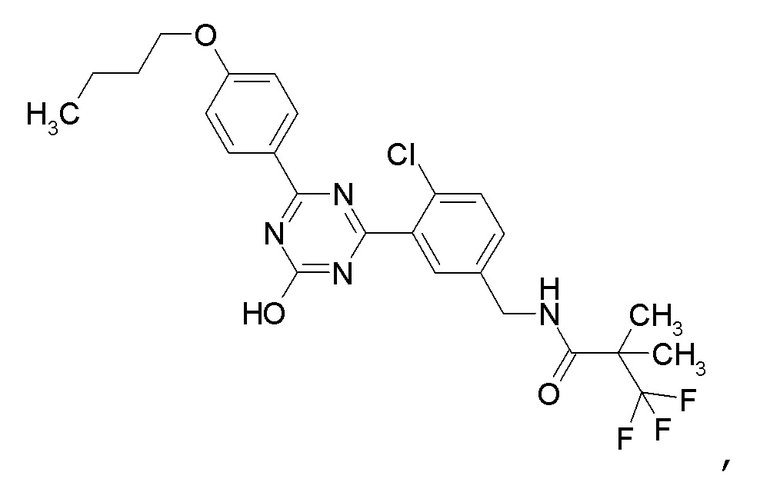
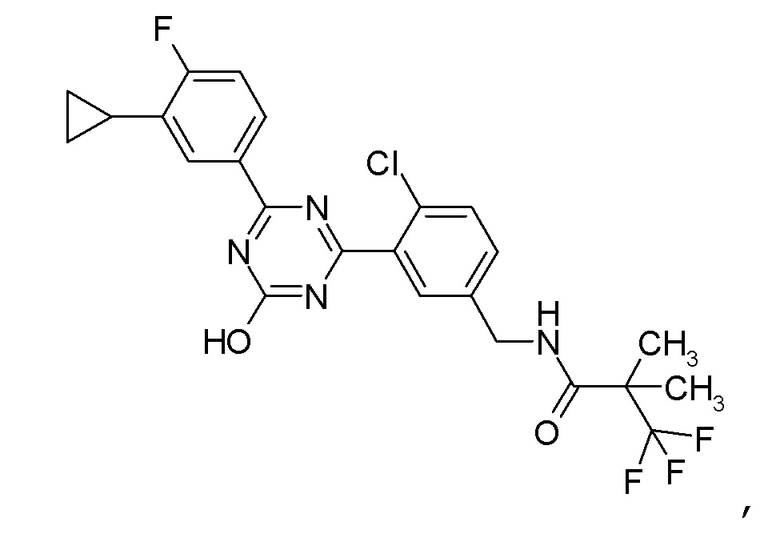
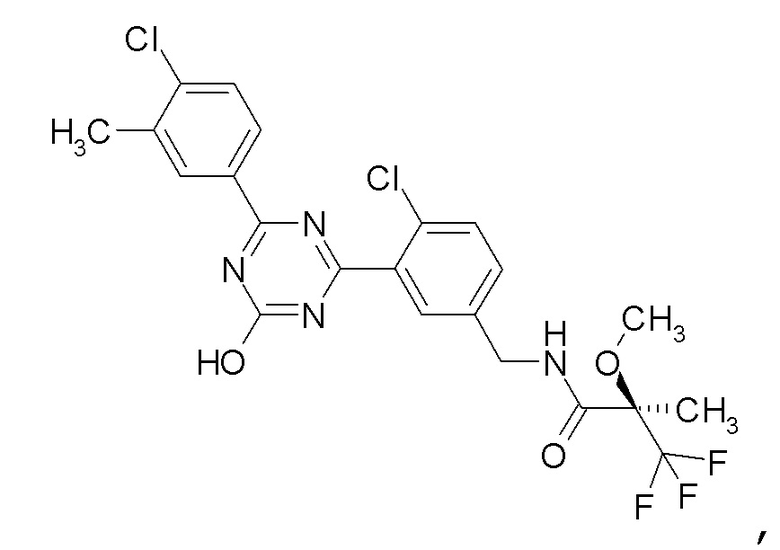
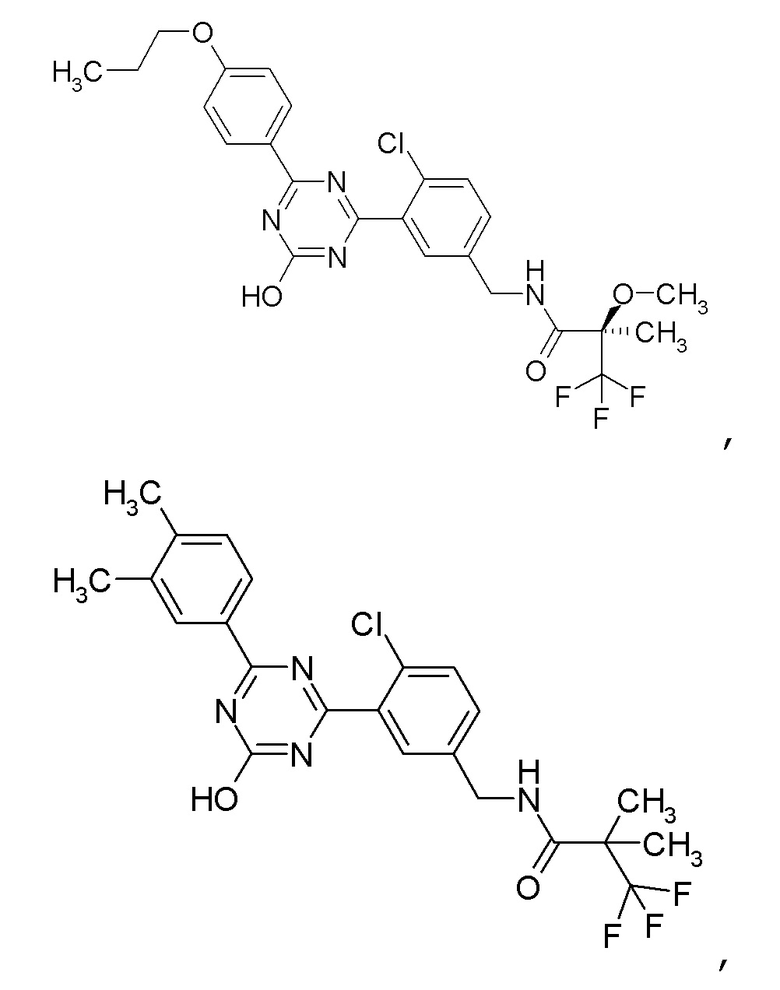
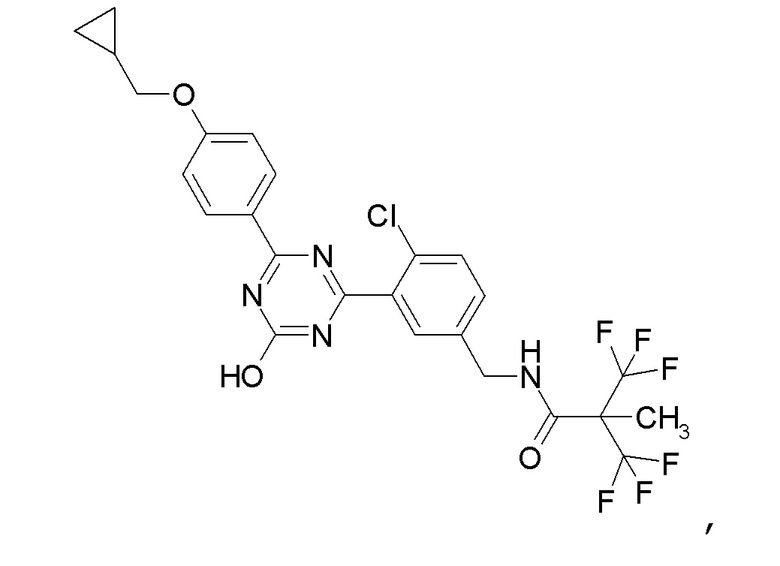
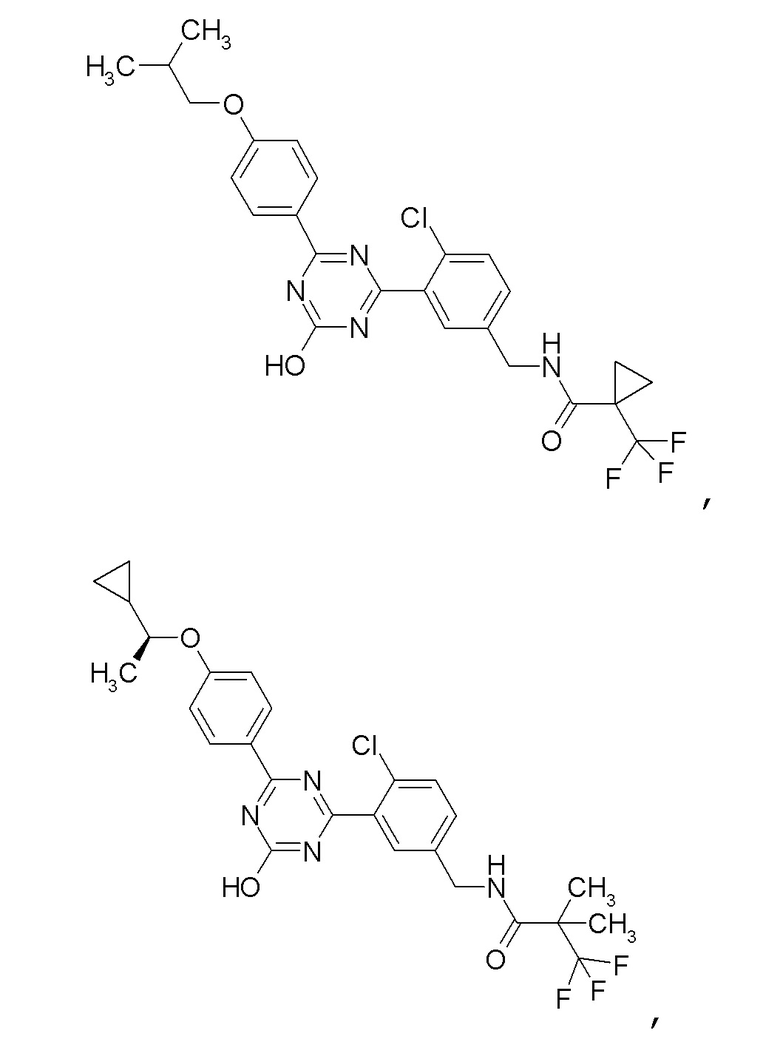
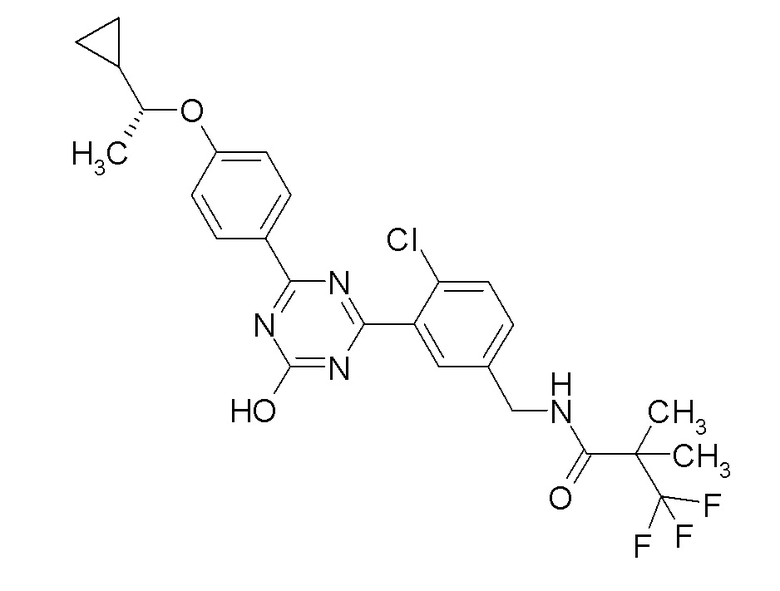
и
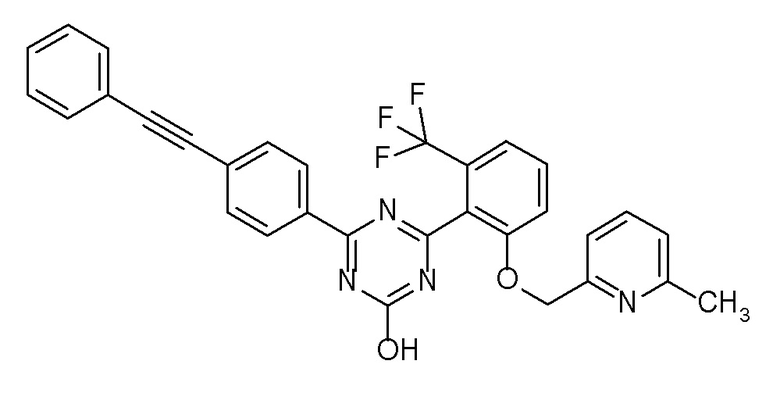 ,
,
или его фармацевтически приемлемая соль.
13. Фармацевтическая композиция, обладающая свойствами ингибитора mPGES-1, содержащая эффективное количество соединения по любому из пп.1-12 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
14. Ингибитор mPGES-1, содержащий соединение по любому из пп.1-12 или его фармацевтически приемлемую соль.
15. Терапевтическое или профилактическое средство, обладающее свойствами ингибитора PGES-1, при боли, ревматизме, лихорадке, остеоартрите, атеросклерозе, болезни Альцгеймера, рассеянном склерозе, глаукоме, глазной гипертензии, ишемическом заболевании сетчатки или системной склеродермии, содержащее соединение по любому из пп.1-12 или его фармацевтически приемлемую соль.
16. Способ ингибирования mPGES-1, включающий введение фармацевтически эффективного количества соединения по любому из пп.1-12 или его фармацевтически приемлемой соли человеку.
17. Способ лечения или профилактики боли, ревматизма, лихорадки, остеоартрита, атеросклероза, болезни Альцгеймера, рассеянного склероза, глаукомы, глазной гипертензии, ишемического заболевания сетчатки или системной склеродермии, включающий введение фармацевтически эффективного количества соединения по любому одному из пп.1-12 или его фармацевтически приемлемой соли, обладающего свойствами ингибитора PGES-1, человеку.
18. Применение соединения по любому из пп.1-12 или его фармацевтически приемлемой соли для получения ингибитора mPGES-1.
19. Применение соединения по любому одному из пп.1-12 или его фармацевтически приемлемой соли, обладающего свойствами ингибитора PGES-1, для получения терапевтического или профилактического средства при боли, ревматизме, лихорадке, остеоартрите, атеросклерозе, болезни Альцгеймера, рассеянном склерозе, глаукоме, глазной гипертензии, ишемическом заболевании сетчатки или системной склеродермии.
Авторы
Даты
2019-06-27—Публикация
2015-02-19—Подача