ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области фармацевтического синтеза и, в частности, к ингибитору CD73, способу его получения и его применению.
УРОВЕНЬ ТЕХНИКИ
CD73, также известный как экто-5'-нуклеотидаза (eNT), представляет собой белок с молекулярной массой 70 кДа. Он экспрессируется на эндотелиальных клетках и определенных лейкоцитах при обычных условиях. Этот белок, прикрепляемый к поверхности клеточной мембраны посредством связанного гликозил фосфатидилинозитольного (ГФИ) якоря, играет важную роль в метаболической регуляции аденозинтрифосфата (АТФ) вместе с CD39, который известен как эктонуклеозидтрифосфатдифосфогидролаза-1 (NTPDase), катализирующий гидролиз АТФ с образованием аденозинмонофосфата (AМФ) и аденозиндифосфата (АДФ), в то время как CD73 играет главную роль в ускорении преобразования внеклеточных монофосфатов (например 5'- АМФ) в их соответствующие нуклеозиды (например, аденозин).
Нуклеозиды, продуцируемые посредством CD73, в частности аденозин, считаются эндогенными модуляторами разнообразных физиологических функций, включая сердечно-сосудистую систему, центральную нервную систему, дыхательную систему, почки, жировые клетки, тромбоциты и иммунную систему. В иммунной системе внеклеточный аденозин оказывает воздействие на разнообразные иммунные клетки и задействуется в опосредовании противовоспалительного ответа. В различных тканях аденозин также может способствовать появлению фиброза.
Экспрессия CD73 обнаружена в клетках многих типов рака, включая лейкоз, рак мочевого пузыря, глиому, глиобластому, рак яичника, меланому, рак простаты, рак щитовидной железы, рак пищевода и рак молочной железы. Вместе с тем, экспрессия CD73 также обнаружена на поверхности иммуносупрессорных клеток (включая регуляторные Т-клетки (Treg) и миелоидные супрессорные клетки (MDSC). Также обнаружено, что высокий уровень экспрессии CD73 взаимосвязан с ангиогенезом, инвазивностью, устойчивостью к химиотерапии, метастазами опухоли, а также более короткой продолжительностью жизни пациентов, больных различными типами рака, включая рак молочной железы и меланому.
Основанные на механизмах исследования показали, что клетки злокачественной опухоли могут выделять большое количество АТФ под воздействием химиотерапии и прочих стрессов, а АТФ может быстро превращаться в аденозин и накапливаться в микроокружении опухоли. Выделяющийся вследствие гибели клеток или внутриклеточных стрессов внеклеточный АТФ может вызывать иммунный ответ, но аденозин, являющийся метаболитом АТФ, представляет собой иммуносупрессор. Наиболее важно то, что в опухолях аденозин, активируя аденозиновые рецепторы (такой как А2А), способен подавлять действие инфильтрирующих опухоль эффекторных Т-лимфоцитов, тем самым способствуя прогрессии опухоли. Именно поэтому, накопление внеклеточного аденозина в опухолевых тканях является важным механизмом ускользания опухоли от иммунологического надзора.
Снижение экспрессии CD73 с помощью РНК-интерференции или путем чрезмерной экспрессии CD73 в опухолевых клетках способно замедлять рост и подвижность опухоли; мыши с нокаутом CD73 менее склонны к отторжению трансплантата и спонтанному опухолеобразованию; а делеция рецепторов А2А может спровоцировать Т-клеточное отторжение опухоли. В мышиной модели лечение антителом, которое связывается с мышиным CD73, способно замедлять рост опухоли и метастазирование рака молочной железы.
Следовательно, нацеливание на CD73 представляет собой потенциальную стратегию лечения, которая может повысить эффективность противоопухолевой терапии и обеспечить новую терапевтическую стратегию, направленную на ингибирование прогрессии опухоли. Более того, нацеливание на CD73 может применяться для лечения опосредованных аденозином заболеваний, таких как усиление иммунного ответа, возникновение иммунного ответа и воспалительных реакций; а также может применяться для лечения неврологических расстройств, нейродегенеративных заболеваний, заболеваний центральной нервной системы (ЦНС), таких как депрессивный синдром, болезнь Паркинсона, нарушение сна, фиброз, и для прочих иммуновоспалительных заболеваний.
Таким образом, разработка потенциальных лекарственных препаратов, нацеленных на CD73, будет удовлетворять потребностям таргетной терапии при лечении рака и прочих связанных с ним заболеваний, а также обеспечит большую безопасность и специфичность.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В результате всестороннего и глубокого исследования автор настоящего изобретения разработал ингибитор CD73 со структурой, показанной в формуле (I), способ его получения и его применение. Соединения, описанные в настоящем изобретении, оказывают сильное ингибирующее воздействие на ферментативную активность CD73, могут широко применяться для получения лекарственных средств для лечения опухолей или злокачественных новообразований, иммунозависимых заболеваний и расстройств, а также метаболических заболеваний , которые по крайней мере частично опосредуются CD73, а также, в частности, для лечения меланомы, рака толстой кишки, рака поджелудочной железы, рака молочной железы, рака простаты, рака легкого, лейкоза, опухоли головного мозга, лимфомы, рака яичника и саркомы Капоши; а также демонстрируют перспективность разработки лекарственных препаратов с ингибитором CD73 нового поколения. Настоящее изобретение осуществлено на этой основе.
Первый аспект настоящего изобретения относится к соединению формулы (I), стереоизомеру, пролекарству или его фармацевтически приемлемой соли:

где “ ” представляет собой двойную связь или одинарную связь;
” представляет собой двойную связь или одинарную связь;
X1 представляет собой N или CR17;
X2 и X3 каждый независимо представляют собой N или C;
X4 и X5 каждый независимо представляют собой N или CR18;
Y представляет собой CH2, NH, O или S;
m выбран из 0, 1, 2 или 3, а n выбран из 0, 1, 2 или 3 таким образом, что m+n ≤5;
R1 выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, -C0-8-SF5, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21, или при m≥2, два R1 вместе с фрагментом, непосредственно присоединенным к ним, образуют 4-10-членный циклоалкил, 4-10-членный арил, 4-10-членный гетероциклил или 4-10-членный гетероарил, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероалкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21;
R2 и R3 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-C(O)NR22R23 и -C0-8-NR22R23, или R2 и R3 вместе с атомом углерода, непосредственно присоединенным к ним, образуют 3-10-членный циклоалкил или 3-10-членный гетероциклил, или один из R2 и R3 вместе с R1 и группой, непосредственно присоединенной к ним, образует 4-10-членный циклоалкил или 4-10-членный гетероциклил, а другой выбран из группы, состоящей из водорода, дейтерия, галогена или С1-10 алкила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероалкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арила, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21;
R4 выбран из группы, состоящей из водорода, дейтерия, C1-10 алкилa, C2-10 алкенилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, -C0-8-S(O)rR19, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-C(=NR22)R21 и -C0-8-C(O)NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероалкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21;
R5 выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, -SF5, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероалкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21;
R6 и R7 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-C(O)NR22R23 и -C0-8-NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероалкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21;
R8 и R9 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-C(O)NR22R23 и -C0-8-NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероалкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21;
R10, R11 и R12 каждый независимо выбран из группы, состоящей из водорода, дейтерия, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинила, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, -C0-8-C(O)OR20, -C0-8-C(O)R21 и -C0-8-C(O)NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-4 дейтероалкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21;
R13 и R14 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-C(O)NR22R23 и -C0-8-NR22R23, или R13 и R14 вместе с атомом углерода, непосредственно присоединенным к ним, образуют 3-10-членный циклоалкил или 3-10-членный гетероциклил вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероалкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21;
R15 и R16 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21, или R15 и R16 вместе с атомом углерода, непосредственно присоединенным к ним, образуют 3-10-членный циклоалкил или 3-10-членный гетероциклил, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероалкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21;
R17 и R18 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, -SF5, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероалкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21;
каждый R19 независимо выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-10 алкилa, C2-10 алкенилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa и-NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, гидрокси, =O, C1-10 алкилa, C1-10 алкокси, C3-10 циклоалкилa, C3-10 циклоалкокси, 3-10-членного гетероциклилa, 3-10-членного гетероциклилокси, C5-10 арила, C5-10 арилокси, 5-10-членного гетероарилa, 5-10-членного гетероарилокси и -NR22R23;
каждый R20 независимо выбран из группы, состоящей из водорода, дейтерия, C1-10 алкилa, C2-10 алкенилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa и5-10-членного гетероарилa, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, гидрокси, =O, циано, C1-10 алкилa, C1-10 алкокси, C3-10 циклоалкилa, C3-10 циклоалкокси, 3-10-членного гетероциклилa, 3-10-членного гетероциклилокси, C5-10 арила, C5-10 арилокси, 5-10-членного гетероарилa, 5-10-членного гетероарилокси и -NR22R23;
каждый R21 независимо выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-10 алкилa, C1-10 алкокси, C2-10 алкенилa, C2-10 алкинила, C3-10 циклоалкилa, C3-10 циклоалкокси, 3-10-членного гетероциклилa, 3-10-членного гетероциклилокси, C5-10 арилa, C5-10 арилокси, 5-10-членного гетероарилa, 5-10-членного гетероарилокси и -NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, гидрокси, циано, C1-10 алкилa, C1-10 алкокси, C3-10 циклоалкилa, C3-10 циклоалкокси, 3-10-членного гетероциклилa, 3-10-членного гетероциклилокси, C5-10 арила, C5-10 арилокси, 5-10-членного гетероарилa, 5-10-членного гетероарилокси и -NR22R23;
R22 и R23 каждый независимо выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C3-10 циклоалкилa, 3-10-членного гетероциклила, C5-10 арилa, 5-10-членного гетероарилa, сульфонилa, метилсульфонилa, изопропилсульфонилa, циклопропилсульфонилa, п-толуолсульфонилa, амино, моноалкиламино, диалкиламино и C1-10 алканоилa, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, гидрокси, C1-8 алкилa, C1-10 алкокси, C3-10 циклоалкилa, C3-10 циклоалкокси, 3-10-членного гетероциклилa, 3-10-членного гетероциклилокси, C5-10 арилa, C5-10 арилокси, 5-10-членного гетероарила, 5-10-членного гетероарилокси, амино, моноалкиламино, диалкиламино и C1-10 алканоилa,
или R22 и R23 вместе с атомом азота, непосредственно присоединенным к ним, образуют 4-10-членный гетероциклил, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, гидрокси, C1-10 алкила, C1-10 алкокси, C3-10 циклоалкила, C3-10 циклоалкокси, 3-10-членного гетероциклила, 3-10-членного гетероциклилокси, C5-10 арила, C5-10 арилокси, 5-10-членного гетероарила, 5-10-членного гетероарилокси, амино, моноалкиламино, диалкиламино и C1-10 алканоилa; и каждый r независимо выбран из 0, 1 или 2.
В предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли каждый R15 и R16 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, -C0-4-O-R20, -C0-4-C(O)OR20 и -C0-4-NR22R23, или R15 и R16 вместе с атомом углерода, непосредственно присоединенным к ним, образуют 3-8-членный циклоалкил или 3-8-членный гетероциклил, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, -C0-4-O-R20, -C0-4-C(O)OR20 и -C0-4-NR22R23, где R20, R22 и R23 соответствуют таковым в соединении формулы (I).
В предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли каждый R15 и R16 независимо выбран из группы, состоящей из водорода, дейтерия, F, циано, метилa, этила, изопропила, аллила, этинила, циклопропилa, трифторметилa, тридейтерометилa, метокси, трифторметокси, тридейтерометокси, амино или диметиламино, или R15 и R16 вместе с атомом углерода, непосредственно присоединенным к ним, образуют 3-4-членный циклоалкил или 4-5-членный гетероциклил.
В предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли каждый R13 и R14 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, -C0-4-O-R20, -C0-4-C(O)OR20 и -C0-4-NR22R23, или R13 и R14 вместе с атомом углерода, непосредственно присоединенным к ним, образуют 3-8-членный циклоалкил или 3-8-членный гетероциклил, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, -C0-4-O-R20, -C0-4-C(O)OR20 и -C0-4-NR22R23, где R20, R22 и R23 соответствуют таковым в соединении формулы (I).
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли каждый R13 и R14 независимо выбран из группы, состоящей из водорода, дейтерия, F, циано, метилa, этила, изопропила, аллила, этинила, циклопропилa, трифторметилa, тридейтерометилa, метокси, трифторметокси, тридейтерометокси, амино идиметиламино, или R13 и R14 вместе с атомом углерода, непосредственно присоединенным к ним, образуют 3-4-членный циклоалкил или 4-5-членный гетероциклил.
В предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли каждый R17 и R18 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, C5-8 арилa, 5-8-членного гетероарилa, -SF5, -C0-4-S(O)rR19, -C0-4-O-R20, -C0-4-C(O)OR20, -C0-4-C(O)R21, -C0-4-O-C(O)R21, -C0-4-NR22R23, -C0-4-C(=NR22)R21, -C0-4-N(R22)-C(=NR23)R21, -C0-4-C(O)NR22R23 и -C0-4-N(R22)-C(O)R21, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, C5-8 арилa, 5-8-членного гетероарилa, =O, -C0-4-S(O)rR19, -C0-4-O-R20, -C0-4-C(O)OR20, -C0-4-C(O)R21, -C0-4-O-C(O)R21, -C0-4-NR22R23, -C0-4-C(=NR22)R21, -C0-4-N(R22)-C(=NR23)R21, -C0-4-C(O)NR22R23 и -C0-4-N(R22)-C(O)R21, где R19, R20, R21, R22, R23 и r соответствуют таковым в соединении формулы (I).
В предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли каждый R6 и R7 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, -C0-4-S(O)rR19, -C0-4-O-R20, -C0-4-C(O)OR20, -C0-4-C(O)R21, -C0-4-O-C(O)R21, -C0-4-NR22R23 и -C0-4-C(O)NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, C5-8 арилa, 5-8-членного гетероарилa, =O, -C0-4-S(O)rR19, -C0-4-O-R20, -C0-4-C(O)OR20, -C0-4-C(O)R21, -C0-4-O-C(O)R21, -C0-4-NR22R23, -C0-4-C(=NR22)R21, -C0-4-N(R22)-C(=NR23)R21, -C0-4-C(O)NR22R23 и -C0-4-N(R22)-C(O)R21;
R8 и R9 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, -C0-4-S(O)rR19, -C0-4-O-R20, -C0-4-C(O)OR20, -C0-4-C(O)R21, -C0-4-O-C(O)R21, -C0-4-NR22R23 и -C0-4-C(O)NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, C5-8 арилa, 5-8-членного гетероарилa, =O, -C0-4-S(O)rR19, -C0-4-O-R20, -C0-4-C(O)OR20, -C0-4-C(O)R21, -C0-4-O-C(O)R21, -C0-4-NR22R23, -C0-4-C(=NR22)R21, -C0-4-N(R22)-C(=NR23)R21, -C0-4-C(O)NR22R23 и -C0-4-N(R22)-C(O)R21, где R19, R20, R21, R22, R23 и r соответствуют таковым в соединении формулы (I).
В предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли каждый R10, R11 и R12 каждый независимо выбран из группы, состоящей из водорода, дейтерия, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, C5-8 арилa, 5-8-членного гетероарилa, -C0-4-C(O)OR20, -C0-4-C(O)R21 и -C0-4-C(O)NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, C5-8 арилa, 5-8-членного гетероарилa, =O, -C0-4-S(O)rR19, -C0-4-O-R20, -C0-4-C(O)OR20, -C0-4-C(O)R21, -C0-4-O-C(O)R21, -C0-4-NR22R23, -C0-4-C(=NR22)R21, -C0-4-N(R22)-C(=NR23)R21, -C0-4-C(O)NR22R23 и -C0-4-N(R22)-C(O)R21, где R19, R20, R21, R22, R23 и r соответствуют таковым в соединении формулы (I).
В предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли каждый R2 и R3 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, -C0-4-O-R20, -C0-4-C(O)OR20 и -C0-4-NR22R23, или R2 и R3 вместе с атомом углерода, непосредственно присоединенным к ним, образуют 3-8-членный циклоалкил или 3-8-членный гетероциклил или один из R2 и R3 вместе с R1 и группой, непосредственно присоединенной к ним, образуют 4-10-членный циклоалкил или 4-10-членный гетероциклил, а другой выбран из группы, состоящей из водорода, дейтерия, F или C1-4 алкила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, -C0-4-O-R20, -C0-4-C(O)OR20 и -C0-4-NR22R23, где R1, R20, R22 и R23 соответствуют таковым в соединении формулы (I);
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли каждый R2 и R3 независимо выбран из группы, состоящей из водорода, дейтерия, F, Cl, циано, метилa, этила, изопропила, аллила, этинила, циклопропилa, гидроксиметила, цианометила, трифторметилa, тридейтерометилa, метокси, трифторметокси, тридейтерометокси, амино, метиламино и диметиламино, или R2 и R3 вместе с атомом углерода, непосредственно присоединенным к ним, образуют 3-4-членный циклоалкил или 4-5-членный гетероциклил или один из R2 и R3 вместе с R1 и группой, непосредственно присоединенной к ним, образуют 4-6-членный циклоалкил или 4-6-членный гетероциклил, а другой выбран из группы, состоящей из водорода, дейтерия или метила; где R1 соответствует таковому в соединении формулы (I),
В предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли R4 выбран из группы, состоящей из водорода, дейтерия, C1-4 алкилa, C2-4 алкенилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, C5-8 арилa, 5-8-членного гетероарилa, -C0-4-S(O)rR19, -C0-4-C(O)OR20, -C0-4-C(O)R21, -C0-4-C(=NR22)R21 и -C0-4-C(O)NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-4 алкила, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, C5-8 арилa, 5-8-членного гетероарилa, =O, -C0-4-S(O)rR19, -C0-4-O-R20, -C0-4-C(O)OR20, -C0-4-C(O)R21, -C0-4-O-C(O)R21, -C0-4-NR22R23, -C0-4-C(=NR22)R21, -C0-4-N(R22)-C(=NR23)R21, -C0-4-C(O)NR22R23 и -C0-4-N(R22)-C(O)R21, где R19, R20, R21, R22, R23 и r соответствуют таковым в соединении формулы (I).
В предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли R1 выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, C5-8 арилa, 5-8-членного гетероарилa, -C0-4-SF5, -C0-4-S(O)rR19, -C0-4-O-R20, -C0-4-C(O)OR20, -C0-4-C(O)R21, -C0-4-O-C(O)R21, -C0-4-NR22R23, -C0-4-C(=NR22)R21, -C0-4-N(R22)-C(=NR23)R21, -C0-4-C(O)NR22R23 и -C0-4-N(R22)-C(O)R21, или при m≥2 два R1 вместе с фрагментом, непосредственно присоединенным к ним, образуют 4-8-членный циклоалкил, 5-8-членный арил, 4-8-членный гетероциклил или 5-8-членный гетероарил, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-8 циклоалкилa, 3-8-членного гетероциклилa, C5-8 арилa, 5-8-членного гетероарилa, =O, -C0-4-S(O)rR19, -C0-4-O-R20, -C0-4-C(O)OR20, -C0-4-C(O)R21, -C0-4-O-C(O)R21, -C0-4-NR22R23, -C0-4-C(=NR22)R21, -C0-4-N(R22)-C(=NR23)R21, -C0-4-C(O)NR22R23 и -C0-4-N(R22)-C(O)R21, где R19, R20, R21, R22, R23 и r соответствуют таковым в соединении формулы (I).
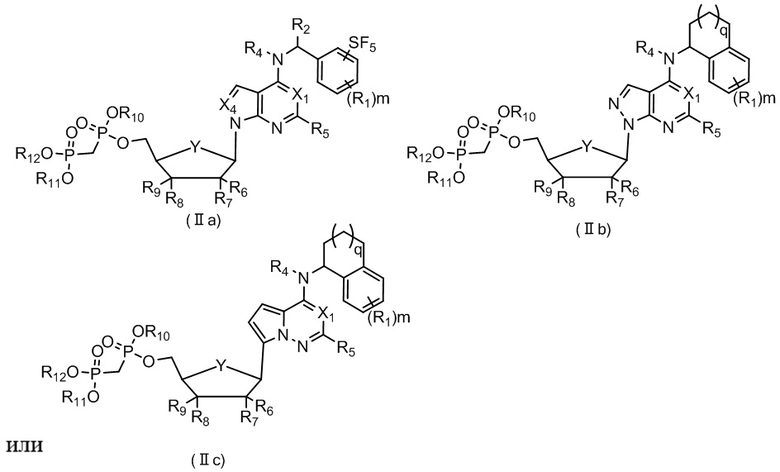
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли соединение формулы (I) представляет собой соединение, структура которого описывается формулой (IIa), формулой (IIb) или формулой (IIc);
 ,
,
где каждый X1 независимо представляет собой N или CH; каждый X4 независимо представляет собой N или CH; каждый Y независимо представляет собой из CH2 или O;
каждый R1 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, C1-4 алкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, C5-6 арилa, 5-6-членного гетероарилa, -SF5, -S(O)rR19, -O-R20, -C(O)OR20, -C(O)R21, -O-C(O)R21 и-NR22R23, или при m≥2, два R1 вместе с фрагментом, непосредственно присоединенным к ним, образуют 5-6-членный циклоалкил, 5-6-членный арил, 5-6-членный гетероциклил или 5-6-членный гетероарил, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, C5-6 арилa, 5-6-членного гетероарилa, =O, -S(O)rR19, -O-R20, -C(O)OR20, -C(O)R21, -O-C(O)R21 и -NR22R23;
R2 выбран из группы, состоящей из водорода, дейтерия, F, Cl, циано, метилa, этила, изопропила, аллила, этинила, циклопропилa, гидроксиметила, цианометила, трифторметилa, тридейтерометилa, метокси, трифторметокси, тридейтерометокси, амино, метиламино и диметиламино;
каждый R4 независимо выбран из группы, состоящей из водорода, дейтерия, C1-4 алкилa, C2-4 алкенилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, C5-6 арилa или 5-6-членного гетероарилa, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, C5-6 арилa, 5-6-членного гетероарилa, =O, -S(O)rR19, -O-R20, -C(O)OR20, -C(O)R21, -O-C(O)R21 и -NR22R23;
каждый R5 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, C1-4 алкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, фенила, 5-6-членного гетероарилa, -SF5, метилтио, метилсульфонилa, изопропилсульфонилa, аминосульфонилa, метокси, этиоксила, изопропокси, гидрокси, -C(O)OH, метоксикарбонилa, этоксикарбонилa, формила, ацетила, ацетоксила, амино, диметиламино, -C(=NR22)R21, -N(R22)-C(=NR23)R21, аминокарбонилa, диметиламинокарбонилa и ацетиламино, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, фенила, 5-6-членного гетероарилa, =O, метилтио, метилсульфонилa, изопропилсульфонилa, аминосульфонилa, метокси, этиоксила, изопропокси, гидрокси, -C(O)OH, метоксикарбонилa, этоксикарбонилa, формила, ацетила, ацетоксила, амино, диметиламино, аминокарбонилa, диметиламинокарбонилa и ацетиламино;
R6 и R7 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, метила, этила, н-пропила, изопропила, винила, 1-пропенила, 2-пропенила, этинила, гидрокси, метокси и ацетоксила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, метила, этила, н-пропила, изопропила, винила, этинила, циклопропилa, трифторметилa, тридейтерометилa, гидрокси, метокси и ацетоксила;
R8 и R9 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, метила, этила, н-пропила, изопропила, винила, 1-пропенила, 2-пропенила, этинила, циклопропилa, гидрокси, метокси или ацетоксила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, метила, этила, н-пропила, изопропила, винила, этинила, циклопропилa, трифторметилa, тридейтерометилa, гидрокси, метокси или ацетоксила;
R10, R11 и R12 каждый независимо выбран из группы, состоящей из водорода, дейтерия, C1-4 алкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, C5-6 арилa, 5-6-членного гетероарилa, -C(O)OR20, -C(O)R21 и -C(O)NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, C5-6 арилa, 5-6-членного гетероарилa, =O, -S(O)rR19, -O-R20, -C(O)OR20, -C(O)R21, -O-C(O)R21, -NR22R23, -C(O)NR22R23 и -N(R22)-C(O)R21;
каждый R19 независимо выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-4 алкилa, C2-6 алкенилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, C5-6 арилa, 5-6-членного гетероарилa и -NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, гидрокси, =O, C1-4 алкилa, C1-4 алкокси, C3-6 циклоалкилa, C3-6 циклоалкокси, 3-6-членного гетероциклилa, 3-6-членного гетероциклилокси, C5-6 арила, C5-6 арилокси, 5-6-членного гетероарилa, 5-6-членного гетероарилокси и -NR22R23;
каждый R20 независимо выбран из группы, состоящей из водорода, дейтерия, C1-4 алкилa, C2-4 алкенилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, C5-6 арилa или 5-6-членного гетероарилa, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, гидрокси, =O, циано, C1-4 алкилa, C1-4 алкокси, C3-6 циклоалкилa, C3-6 циклоалкокси, 3-6-членного гетероциклилa, 3-6-членного гетероциклилокси, C5-6 арила, C5-6 арилокси, 5-6-членного гетероарилa, 5-6-членного гетероарилокси и -NR22R23;
каждый R21 независимо выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-4 алкилa, C1-4 алкокси, C2-4 алкенилa, C2-4 алкинила, C3-6 циклоалкилa, C3-6 циклоалкокси, 3-6-членного гетероциклилa, 3-6-членного гетероциклилокси, C5-6 арилa, C5-6 арилокси, 5-6-членного гетероарилa, 5-6-членного гетероарилокси и -NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, гидрокси, циано, C1-4 алкилa, C1-4 алкокси, C3-6 циклоалкилa, C3-6 циклоалкокси, 3-6-членного гетероциклилa, 3-6-членного гетероциклилокси, C5-6 арила, C5-6 арилокси, 5-6-членного гетероарилa, 5-6-членного гетероарилокси и -NR22R23;
R22 и R23 каждый независимо выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-4 алкилa, C2-4 алкенилa, C2-4 алкинилa, C3-6 циклоалкилa, 3-6-членного гетероциклила, C5-6 арилa, 5-6-членного гетероарилa, сульфонилa, метилсульфонилa, изопропилсульфонилa, циклопропилсульфонилa, п-толуолсульфонилa, амино, моноалкиламино, диалкиламино и C1-4 алканоилa, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, гидрокси, C1-4 алкилa, C1-4 алкокси, C3-6 циклоалкилa, C3-6 циклоалкокси, 3-6-членного гетероциклилa, 3-6-членного гетероциклилокси, C5-6 арилa, C5-6 арилокси, 5-6-членного гетероарила, 5-6-членного гетероарилокси, амино, моноалкиламино, диалкиламино и C1-4 алканоилa,
или R22 и R23 вместе с атомом азота, непосредственно присоединенным к ним, образуют 4-6-членный гетероциклил, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, гидрокси, C1-4 алкила, C1-4 алкокси, C3-6 циклоалкила, C3-6 циклоалкокси, 3-6-членного гетероциклила, 3-6-членного гетероциклилокси, C5-6 арила, C5-6 арилокси, 5-6-членного гетероарила, 5-6-членного гетероарилокси, амино, моноалкиламино, диалкиламино и C1-4 алканоилa;
каждый q независимо выбран из 0, 1, 2 или 3;
каждый m независимо выбран из 0, 1, 2 или 3; и
каждый r независимо выбран из 0, 1 или 2.
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли каждый R1 независимо выбран из группы, состоящей из водорода, дейтерия, галогенa, циано, нитро, C1-4 алкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, C5-6 арилa, 5-6-членного гетероарилa, -SF5, -S(O)rR19, -O-R20, -C(O)OR20, -C(O)R21, -O-C(O)R21 и -NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, C1-4 алкилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, =O, -O-R20, -C(O)OR20 и -C(O)R21;
каждый R4 независимо выбран из группы, состоящей из водорода, дейтерия, C1-4 алкилa, C2-4 алкенилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, C5-6 арилa и 5-6-членного гетероарилa, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, C1-4 алкилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, =O, -O-R20, -C(O)OR20 и -C(O)R21;
каждый R5 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, C1-4 алкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, фенила, 5-6-членного гетероарилa, -SF5, метилтио, метилсульфонилa, изопропилсульфонилa, аминосульфонилa, метокси, этиоксила, изопропокси, гидрокси, -C(O)OH, метоксикарбонилa, этоксикарбонилa, формила, ацетила, ацетоксила, амино, диметиламино, аминокарбонилa, диметиламинокарбонилa и ацетиламино, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, C1-4 алкилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, =O, метокси, этиоксила, изопропокси, гидрокси, -C(O)OH, метоксикарбонилa, этоксикарбонилa, формила, ацетила и ацетоксила;
R6 и R7 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, метила, этила, н-пропила, изопропила, гидрокси, метокси и ацетоксила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, метила, этила, н-пропила, изопропила, винила, этинила, циклопропилa, трифторметилa, тридейтерометилa, гидрокси, метокси и ацетоксила;
R8 и R9 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, метила, этила, н-пропила, изопропила, циклопропилa, гидрокси, метокси и ацетоксила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, метила, этила, н-пропила, изопропила, циклопропилa, трифторметилa, тридейтерометилa, гидрокси, метокси и ацетоксила;
R10, R11 и R12 каждый независимо выбран из группы, состоящей из водорода, дейтерия, C1-4 алкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, C5-6 арилa, 5-6-членного гетероарилa, -C(O)OR20, -C(O)R21 и -C(O)NR22R23, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, циано, C1-4 алкилa, C1-4 галоалкилa, C1-4 дейтероалкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa, =O, -S(O)rR19, -O-R20, -C(O)OR20, -C(O)R21 и -O-C(O)R21;
каждый R19 независимо выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-4 алкила и C3-6 циклоалкила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, гидрокси, =O, C1-4 алкила, C1-4 алкокси и C3-6 циклоалкила;
каждый R20 независимо выбран из группы, состоящей из водорода, дейтерия, C1-4 алкила или C3-6 циклоалкила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, гидрокси, =O, циано, C1-4 алкила, C1-4 алкокси и C3-6 циклоалкила;
каждый R21 независимо выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-4 алкила и C1-4 алкокси, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, гидрокси, циано, C1-4 алкила, C1-4 алкокси и C3-6 циклоалкила;
R22 и R23 каждый независимо выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-4 алкилa, C3-6 циклоалкилa, 3-6-членного гетероциклилa или C1-4 алканоилa, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогенa, гидрокси, C1-4 алкилa, C1-4 алкокси, C3-6 циклоалкилa, C3-6 циклоалкокси, 3-6-членного гетероциклилa и C1-4 алканоилa.
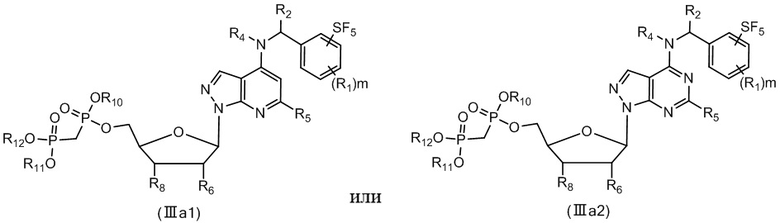
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли соединение формулы (I) представляет собой соединение, структура которого описывается формулой (IIIa1) или формулой (IIIa2):
 ,
,
где каждый R1 независимо выбран из группы, состоящей из водорода, дейтерия, F, Cl, циано, метилa, этила, н-пропила, изопропила, дифторметилa, трифторметилa, дидейтерометилa, тридейтерометилa, C3-6 циклоалкила и3-6-членного гетероциклила;
каждый R2 независимо выбран из группы, состоящей из водорода, дейтерия, F, Cl, циано, метилa, этила, н-пропила, изопропила, аллила, этинила, циклопропилa и гидроксиметила;
каждый R4 независимо выбран из группы, состоящей из водорода, дейтерия, метила, этила, н-пропила, изопропила, C2-4 алкенилa и C3-6 циклоалкилa;
каждый R5 независимо выбран из группы, состоящей из водорода, дейтерия, F, Cl, циано, азидо, метила, этила, н-пропила, изопропила, C2-6 алкенилa, C2-6 алкинилa и C3-6 циклоалкилa;
каждый R6 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, метила, этила, н-пропила, изопропила и гидрокси;
каждый R8 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, метила, этила, н-пропила, изопропила и гидрокси;
R10, R11 и R12 каждый независимо выбран из группы, состоящей из водорода, дейтерия, метила, этила, н-пропила и изопропила; и
каждый m независимо выбран из 0, 1, 2 или 3.
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли соединение формулы (I) представляет собой соединение, структура которого описывается формулой (IIIb):
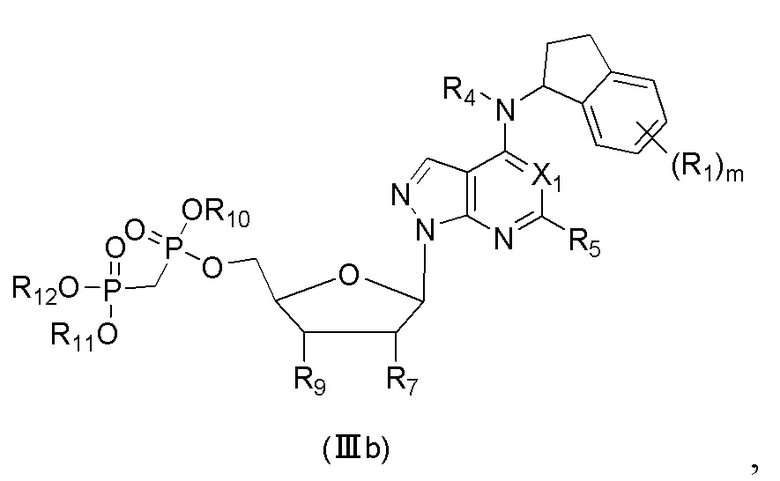
где X1 представляет собой N или CH;
где R1 выбран из группы, состоящей из водорода, дейтерия, F, Cl, циано, метилa, этила, н-пропила, изопропила, дифторметилa, трифторметилa, дидейтерометилa, тридейтерометилa, C3-6 циклоалкила и 3-6-членного гетероциклила;
R4 выбран из группы, состоящей из водорода, дейтерия, метила, этила, н-пропила, изопропила, C2-4 алкенилa и C3-6 циклоалкилa;
R5 выбран из группы, состоящей из водорода, дейтерия, F, Cl, циано, азидо, метила, этила, н-пропила, изопропила, C2-6 алкенилa, C2-6 алкинилa и C3-6 циклоалкилa;
R7 выбран из группы, состоящей из водорода, дейтерия, галогена, метила, этила, н-пропила, изопропила и гидрокси;
R9 выбран из группы, состоящей из водорода, дейтерия, галогена, метила, этила, н-пропила, изопропила и гидрокси;
R10, R11 и R12 каждый независимо выбран из группы, состоящей из водорода, дейтерия, метила, этила, н-пропила и изопропила; и
m выбран из 0, 1, 2 или 3.
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли соединение формулы (I) представляет собой соединение, структура которого описывается формулой (IIIc):
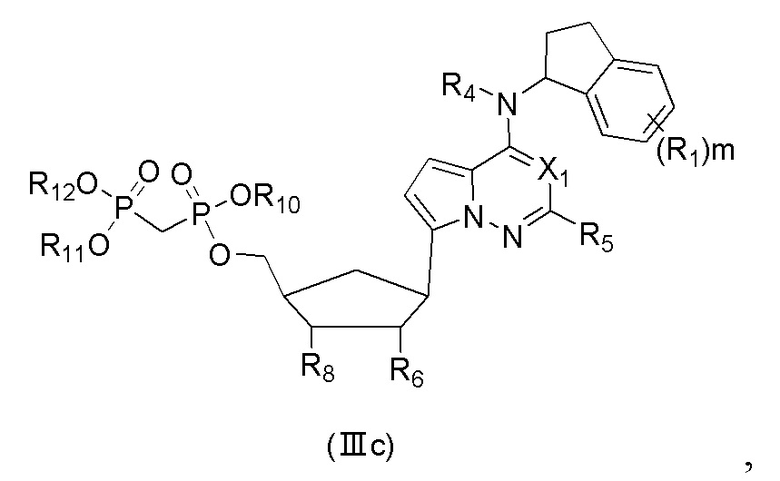
где X1 представляет собой N или CH;
R1 выбран из группы, состоящей из водорода, дейтерия, F, Cl, циано, метилa, этила, н-пропила, изопропила, дифторметилa, трифторметилa, дидейтерометилa, тридейтерометилa, C3-6 циклоалкила и 3-6-членного гетероциклила;
R4 выбран из группы, состоящей из водорода, дейтерия, метила, этила, н-пропила, изопропила, C2-4 алкенилa и C3-6 циклоалкилa;
R5 выбран из группы, состоящей из водорода, дейтерия, F, Cl, циано, азидо, метила, этила, н-пропила, изопропила, C2-6 алкенилa, C2-6 алкинилa и C3-6 циклоалкилa;
R6 выбран из группы, состоящей из водорода, дейтерия, галогена, метила, этила, н-пропила, изопропила и гидрокси;
R8 выбран из группы, состоящей из водорода, дейтерия, галогена, метила, этила, н-пропила, изопропила и гидрокси;
R10, R11 и R12 каждый независимо выбран из группы, состоящей из водорода, дейтерия, метила, этила, н-пропила и изопропила; и
m выбран из 0, 1, 2 или 3.
В наиболее предпочтительном варианте осуществления изобретения соединение формулы (I), его стереоизомер, пролекарство или фармацевтически приемлемая соль включает, помимо прочего, следующие соединения:
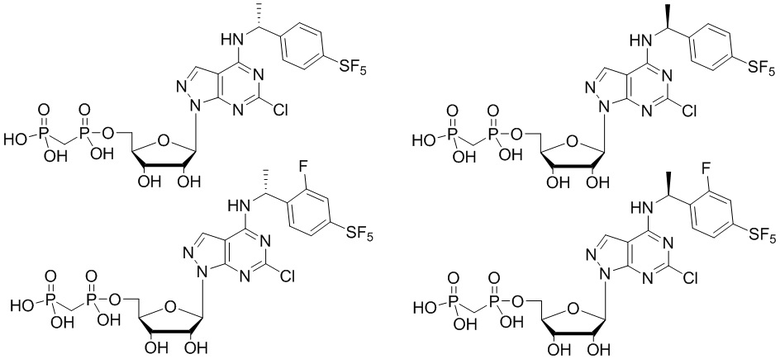
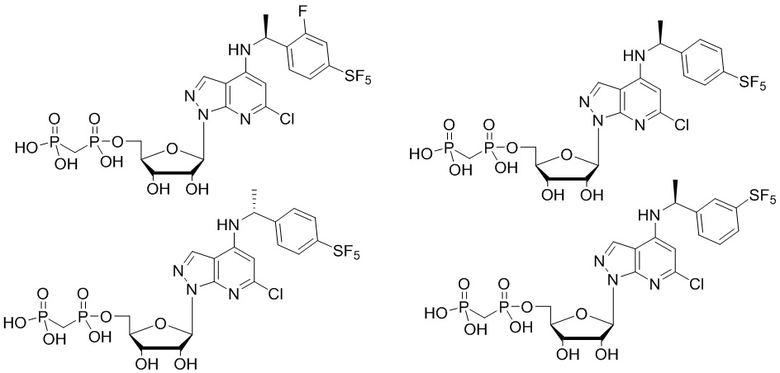
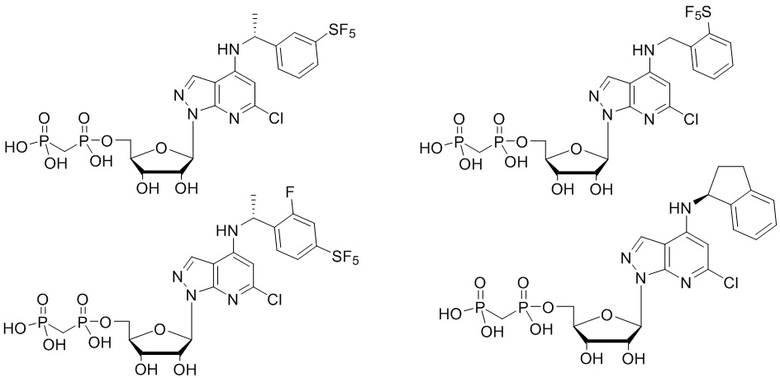
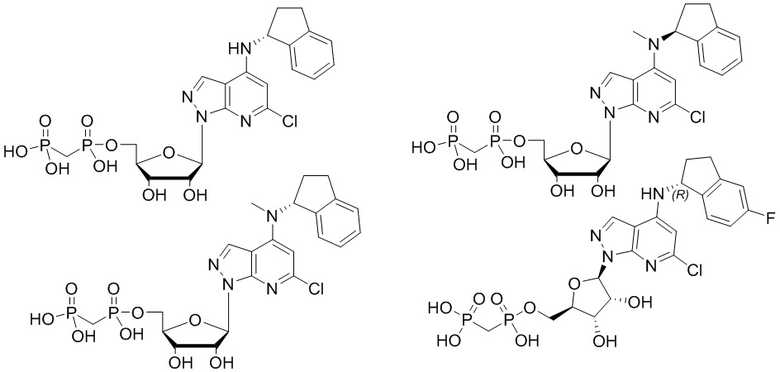
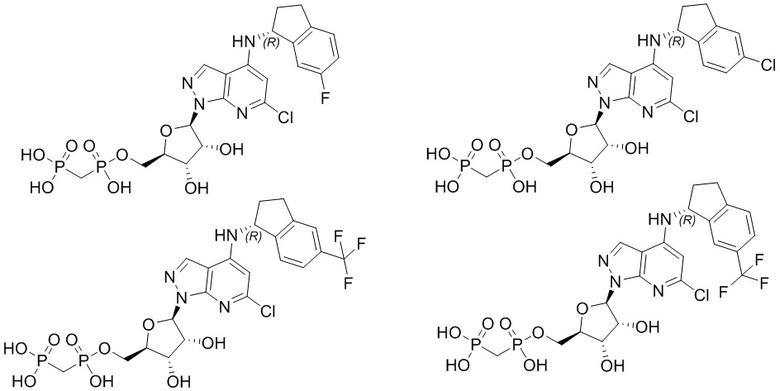
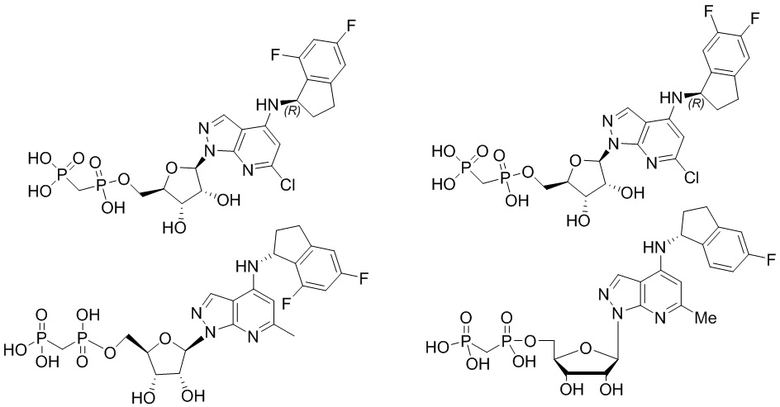
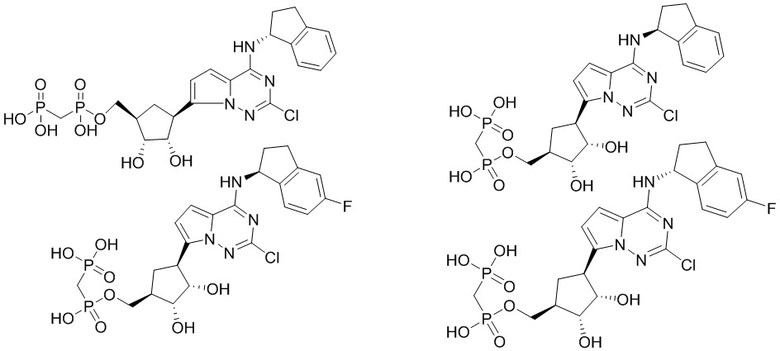
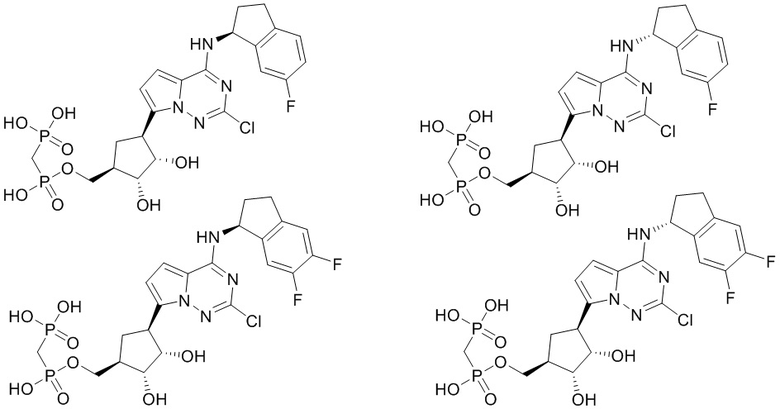
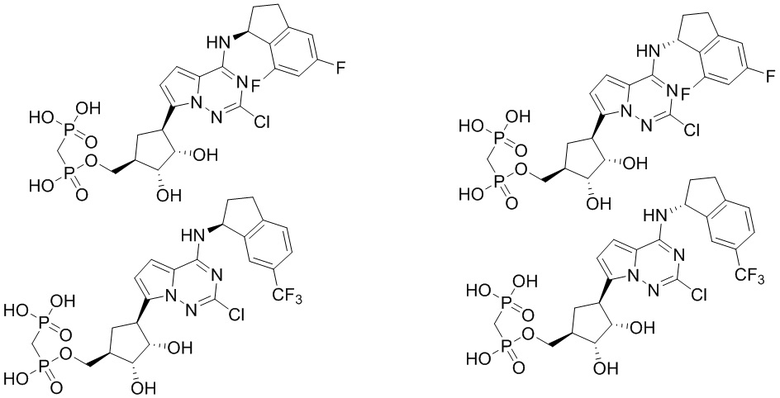
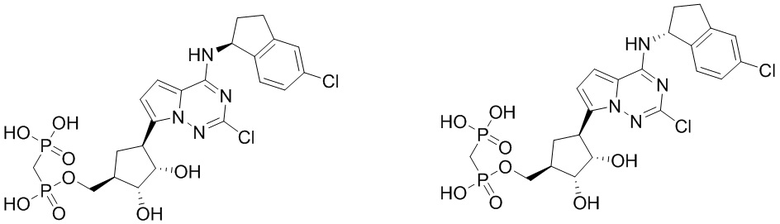
 .
.
Вторым аспектом настоящего изобретения является способ получения соединения формулы (I), его стереоизомера, пролекарства или фармацевтически приемлемой соли, включающий следующие стадии:

где Pg представляет собой защитную группу для гидроксильной группы, предпочтительно выбранную из группы, состоящей из алканоильной или кремниевой защитной группы; X1, X2, X3, X4, X5, Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, m и n соответствуют таковым в соединении формулы (I).
Третьим аспектом настоящего изобретения является фармацевтическая композиция, содержащая соединение формулы (I), его стереоизомер, пролекарство или фармацевтически приемлемую соль, и фармацевтически приемлемый носитель.
Четвертым аспектом настоящего изобретения является применение вышеупомянутого соединения формулы (I), его стереоизомера, пролекарства или фармацевтически приемлемой соли для получения лекарственных средств для лечения злокачественных новообразований или опухолей, иммунозависимых заболеваний и расстройств, а также метаболических заболеваний, которые по крайней мере частично опосредуются CD73.
В предпочтительном варианте осуществления изобретения, злокачественные новообразования или опухоли выбраны из группы, включающей рак простаты, рак толстой кишки, рак прямой кишки, рак поджелудочной железы, рак желудка, рак эндометрия, рак шейки матки, рак головного мозга, рак печени, рак мочевого пузыря, рак яичника, рак яичка, рак головы и шеи, рак кожи (включая меланому и базалиому), рак мезотелия, рак крови (включая лимфому и лейкоз), рак пищевода , рак молочной железы, опухоль мышечной ткани, опухоль соединительной ткани, рак легкого (включая мелкоклеточный рак легкого и немелкоклеточный рак легкого), рак надпочечника, рак щитовидной железы, рак почки, рак костей, опухоль головного мозга, глиобластому, мезотелиому, почечно-клеточный рак, саркому (включая саркому Капоши), хориокарциному, эпидермальный базально-клеточный рак и семиному.
В еще одном предпочтительном варианте осуществления изобретения, злокачественные новообразования или опухоли выбраны из группы, включающей меланому, рака толстой кишки, рака поджелудочной железы, рака молочной железы, рака простаты, рака легкого, лейкоза, опухоль головного мозга, лимфомы, рака яичника и саркомы Капоши.
В предпочтительном варианте осуществления изобретения, иммунозависимые заболевания и расстройства выбраны из группы, включающей ревматоидный артрит, почечную недостаточность, красную волчанку, астму, псориаз, язвенный колит, панкреатит, аллергию, фиброз, анемию, фибромиалгию, болезнь Альцгеймера, хроническую сердечную недостаточность, инсульт, аортальный стеноз, атеросклероз, остеопороз, болезнь Паркинсона, инфекцию, болезнь Крона, язвенный колит, аллергический контактный дерматит и аллергическую контактную экзему, системную склеродермию и рассеянный склероз.
Пятым аспектом настоящего изобретения является вышеупомянутое соединение формулы (I), его стереоизомер, пролекарство или фармацевтически приемлемая соль, используемые в качестве лекарственного средства для лечения злокачественных новообразований или опухолей, аутоиммунных заболеваний и расстройств, а также метаболических заболеваний, которые по крайней мере частично опосредуются CD73.
Шестым аспектом настоящего изобретения является вышеупомянутое соединение формулы (I), его стереоизомер, пролекарство или фармацевтически приемлемая соль, используемые в качестве лекарственного средства для лечения рака простаты, рака толстой кишки, рака прямой кишки, рака поджелудочной железы, рака желудка, рака эндометрия, рака шейки матки, рака головного мозга, рака печени, рака мочевого пузыря, рака яичника, рака яичка, рака головы и шеи, рака кожи (включая меланому и базалиому), рака мезотелия, рака крови (включая лимфому и лейкоз), рака пищевода, рака молочной железы, опухоли мышечной ткани, опухоли соединительной ткани, рака легкого (включая мелкоклеточный рак легкого и немелкоклеточный рак легкого), рака надпочечника, рака щитовидной железы, рака почки, рака костей, опухоли головного мозга, глиобластомы, мезотелиомы, почечно-клеточного рака, саркомы (включая саркому Капоши), хориокарциномы, эпидермального базально-клеточного рака, семиномы, ревматоидного артрита, почечной недостаточности, красной волчанки, астмы, псориаза, язвенного колита, панкреатита, аллергии, фиброза, анемии, фибромиалгии, болезни Альцгеймера, хронической сердечной недостаточности, инсульта, аортального стеноза, атеросклероза, остеопороза, болезни Паркинсона, инфекции, болезни Крона, язвенного колита, аллергического контактного дерматита и аллергической контактной экземы, системной склеродермии и рассеянного склероза.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Подробное описание: Если не указано иное, следующие термины, используемые в описании и формуле изобретения, имеют следующие значения.
«Алкил» относится к прямой или разветвленной насыщенной алифатической углеводородной группе, например «C1-10 алкил» относится к прямому алкилу или разветвленному алкилу, содержащему от 1 до 10 атомов углерода, включая, помимо прочего, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, 2-метилбутил, 3-метилбутил, н-гексил, 1-этил-2-метилпропил, 1,1,2-триметилпропил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2-этилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3-диметилбутил, н-гептил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилпентил, 2,4- диметилпентил, 2,2-диметилпентил, 3,3-диметилпентил, 2-этилпентил, 3-этилпентил, н-октил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилгексил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил или его различные разветвленные изомеры и т.д. «C0-8» означает C0-8 алкил, «C0-4» означает C0-4 алкил, C0 означает 0 атомов углерода, «C1-4» означает C1-4 алкил, алкил соответствует вышеприведенному определению.
Алкильная группа может быть опционально замещенной или незамещенной, и когда она замещена, то заместителем предпочтительно могут быть одна или несколько следующих групп (предпочтительно 1, 2, 3 или 4), независимо выбранных из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероaлкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и-C0-8-N(R22)-C(O)R21.
«Циклоалкил» относится к насыщенным или частично ненасыщенным моноциклическим или полициклическим углеводородным заместителям, например «C3-10 циклоалкил» относится к циклоалкилу, содержащему от 3 до 10 атомов углерода, который может быть моноциклическим циклоалкилом и полициклическим циклоалкилом, где
моноциклический циклоалкил включает, помимо прочего, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогексадиенил, циклогептил, циклогептатриенил, циклооктил и тому подобные;
а полициклический циклоалкил включает спироциклические, конденсированные и мостиковые циклоалканы. «Спироциклоалкил» относится к полициклической группе, в которой атом углерода (называемый спироатомом) является общим для моноциклических колец. Эти группы могут содержать одну или несколько (предпочтительно 1, 2 или 3) двойных связей, но ни у одного из колец нет полностью сопряженной π-электронной системы. Спироциклоалкил может быть моноспироциклоалкилом, биспироциклоалкилом или полиспироциклоалкилом в соответствии с числом общих для колец спироатомов, спироциклоалкил включает, помимо прочего:
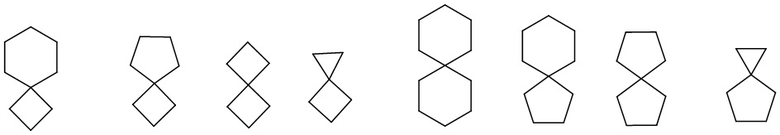 .
.
«Конденсированный циклоалкил» относится к полностью углеродной полициклической группе, в которой каждое кольцо имеет пару соседних атомов углерода с другими кольцами в системе, причем одно или несколько колец могут содержать одну или несколько (предпочтительно 1, 2 или 3) двойных связей, но ни у одной из них нет полностью сопряженной π-электронной системы. В зависимости от количества колец он может быть бициклическим, трициклическим, тетрациклическим или полициклическим, конденсированный циклоалкил включает, помимо прочего:
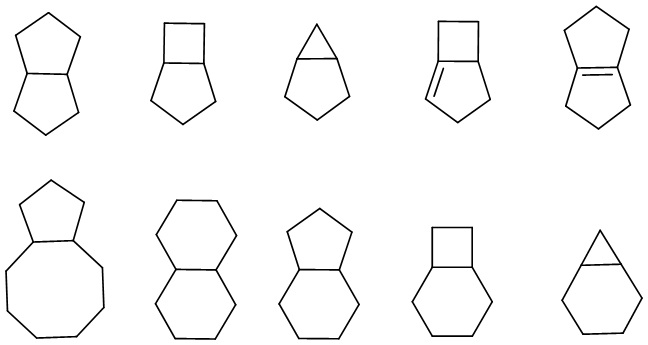 .
.
«Мостиковый циклоалкил» относится к полностью углеродной полициклической группе, в которой любые два кольца имеют два атома углерода, которые непосредственно не связаны, они могут содержать одну или несколько (предпочтительно 1, 2 или 3) двойных связей, но ни у одного из колец нет полностью сопряженной π-электронной системы. В зависимости от количества колец он может быть бициклическим, трициклическим, тетрациклическим или полициклическим, мостиковый циклоалкил включает, помимо прочего: В зависимости от количества колец он может быть бициклическим, трициклическим, тетрациклическим или полициклическим, конденсированный циклоалкил включает, помимо прочего:
 .
.
Кольцо циклоалкила может быть конденсировано с кольцом арила, гетероарила или гетероциклоалкила, где кольцо, присоединенное к исходной структуре, представляет собой циклоалкил, включающий, помимо прочего, инданил, тетрагидронафтил, бензоциклогептил и тому подобное.
Циклоалкильная группа может быть опционально замещенной или незамещенной, и когда она замещена, то заместителем предпочтительно могут быть одна или несколько следующих групп (предпочтительно 1, 2, 3 или 4), независимо выбранных из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероaлкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21.
«Гетероциклил» относится к насыщенному или частично ненасыщенному моноциклическому или полициклическому циклическому углеводородному заместителю, где один или несколько (предпочтительно 1, 2, 3 или 4) атомов кольца представляют собой гетероатомы, выбранные из азота, кислорода или S(O)r (где r представляет собой целое число 0, 1, 2), исключая части кольца -O-O-, -O-S- или -S-S-, а остальные атомы кольца являются атомами углерода. Например, «5-10-членный гетероциклил» относится к циклической группе, содержащей от 5 до 10 атомов кольца, а «3-10-членный гетероциклил» означает циклическую группу, содержащую от 3 до 10 атомов кольца.
Моноциклический гетероциклил включает, помимо прочего, пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперазинил и тому подобное.
а полициклический гетероциклил включает спироциклические, конденсированные и мостиковые гетероциклилы. «Спирогетероциклил» относится к полициклической гетероциклильной группе, в которой атом (называемый спироатомом) является общим для моноциклических колец, где один или несколько (предпочтительно 1, 2, 3 или 4) кольцевых атомов представляют собой гетероатомы, выбранные из азота, кислорода или S(O)r (где r представляет собой целое число 0, 1, 2), а остальные атомы кольца являются атомами углерода. Эти группы могут содержать одну или несколько двойных связей, но ни у одного из колец нет полностью сопряженной π-электронной системы. Спирогетероциклил может быть моноспирогетероциклилом, биспирогетероциклилом или полиспирогетероциклилом в соответствии с числом общих для колец спироатомов, спирогетероциклил включает, помимо прочего:
 .
.
«Конденсированный гетероциклил» относится к полициклическому гетероциклилу, в котором каждое кольцо имеет общую пару соседних атомов с другими кольцами в системе, причем одно или несколько (предпочтительно 1, 2, 3 или 4) колец могут содержать одну или несколько (предпочтительно 1, 2 или 3) двойных связей, но ни у одного из колец нет полностью сопряженной π-электронной системы, в которой один или несколько (предпочтительно 1, 2, 3 или 4) атомов кольца представляют собой гетероатомы, выбранные из азота, кислорода или S(O)r (где r представляет собой целое число 0, 1, 2), а остальные атомы кольца представляют собой атомы углерода. В зависимости от количества колец он может быть бициклическим, трициклическим, тетрациклическим или полициклическим, конденсированный гетероциклил включает, помимо прочего:
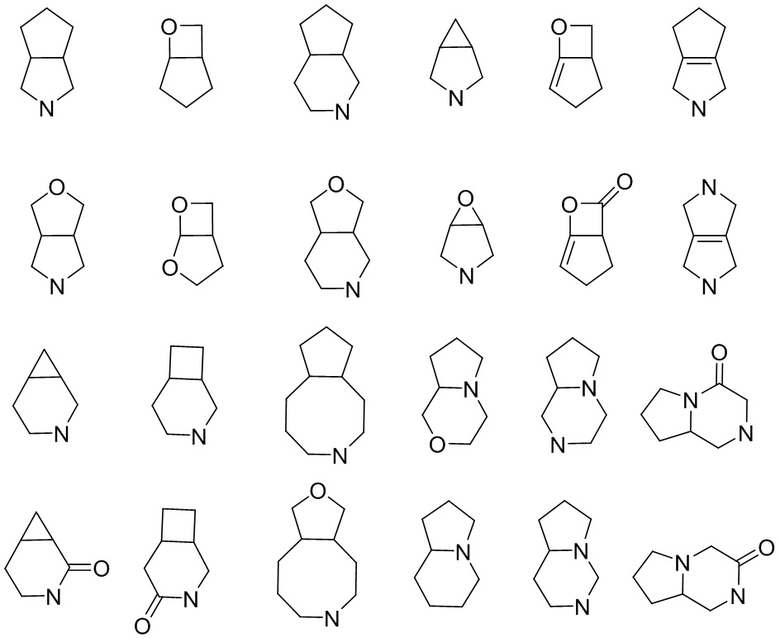 .
.
«Мостиковый гетероциклил» относится к полициклическому гетероциклилу, в котором любые два кольца имеют два атома углерода, которые не связаны непосредственно друг с другом, могут содержать одну или несколько (предпочтительно 1, 2 или 3) двойных связей, но ни у одной из них нет полностью сопряженной π-электронной системы, где один или несколько (предпочтительно 1, 2, 3 или 4) атомов кольца представляют собой гетероатомы, выбранные из азота, кислорода или S(O)r (где r представляет собой целое число 0, 1, 2), а остальные атомы кольца представляют собой атомы углерода. В зависимости от количества колец он может быть бициклическим, трициклическим, тетрациклическим или полициклическим, мостиковый гетероциклил включает, помимо прочего:
 .
.
Кольцо гетероциклила может быть конденсировано с кольцом арила, гетероарила или циклоалкила, где кольцо, присоединенное к исходной структуре, представляет собой гетероциклил, включающий, помимо прочего:
 .
.
Гетероциклильная группа может быть опционально замещенной или незамещенной, и когда она замещена, то заместителем предпочтительно могут быть одна или несколько следующих групп (предпочтительно 1, 2, 3 или 4), независимо выбранных из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероaлкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21.
«Арил» относится к полностью углеродной моноциклической или конденсированной полициклической (т.е. кольцо, которое имеет пару соседних атомов углерода) группе, и полициклической группе, имеющей сопряженную π-электронную систему (т.е. кольцо с соседними парами атомов углерода), например «C5-10 арил» означает полностью углеродный арил, содержащий от 5 до 10 атомов углерода, и «5-10-членный арил» означает полностью углеродный арил, содержащий от 5 до 10 атомов углерода, включая, помимо прочего, фенил и нафтил. Арильное кольцо может быть конденсировано с кольцом гетероарила, гетероциклила или циклоалкила, где кольцо, присоединенное к исходной структуре, представляет собой арильное кольцо, включающее, помимо прочего:
 .
.
Арильная группа может быть замещенной или незамещенной, и когда она замещена, то заместителем предпочтительно могут быть одна или несколько следующих групп (предпочтительно 1, 2, 3 или 4), независимо выбранных из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероaлкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21.
«Гетероарил» относится к гетероароматической системе, содержащей один или несколько (предпочтительно 1, 2, 3 или 4) гетероатомов, включая гетероатом, выбранный из азота, кислорода или S(O)r (где r представляет собой целое число 0, 1, 2), например 5-8-членный гетероарил означает гетероароматическую систему, содержащую от 5 до 8 атомов кольца, а 5-10-членный гетероарил означает гетероароматическую систему, содержащую от 5 до 10 атомов кольца, включая, помимо прочего, фурил, тиофенил, пиридил, пирролил, N-алкилпирролил, пиримидинил, пиразинил, имидазолил, тетразолильная группа и тому подобное. Кольцо гетероарила может быть конденсировано с кольцом арила, гетероциклила или циклоалкила, где кольцо, присоединенное к исходной структуре, представляет собой гетероарильное кольцо, включающее, помимо прочего:
 .
.
Гетероарильная группа может быть опционально замещенной или незамещенной, и когда она замещена, то заместителем предпочтительно могут быть одна или несколько следующих групп (предпочтительно 1, 2, 3 или 4), независимо выбранных из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероaлкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21.
«Алкенил» относится к алкильной группе, определенной выше, содержащей не менее двух атомов углерода и не менее одной двойной связи углерод-углерод, например «C2-10» означает прямой или разветвленный алкенил, содержащий от 2 до 10 атомов углерода. Алкенил включает, помимо прочего, винил, 1-пропенил, 2-пропенил, 1-, 2-или 3-бутенил и тому подобное.
Алкенильная группа может быть опционально замещенной или незамещенной, и когда она замещена, то заместителем предпочтительно могут быть одна или несколько следующих групп (предпочтительно 1, 2, 3 или 4), независимо выбранных из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероaлкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21.
«Алкинил» относится к алкильной группе, определенной выше, содержащей не менее двух атомов углерода и не менее одной тройной связи углерод-углерод, например «C2-10 алкинил» означает прямой или разветвленный алкинил, содержащий от 2 до 10 атомов углерода. Алкинил включает, помимо прочего, этинил, 1-пропинил, 2-пропинил, 1-, 2-или 3-бутинил и тому подобное.
Алкинильная группа может быть опционально замещенной или незамещенной, и когда она замещена, то заместителем предпочтительно могут быть одна или несколько следующих групп (предпочтительно 1, 2, 3 или 4), независимо выбранных из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероaлкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21.
«Алкокси» относится к -O-(алкилу), где алкил соответствует вышеприведенному определению, например «C1-10 алкокси» означает алкилокси, содержащий от 1 до 10 атомов углерода. Алкокси включает, помимо прочего, метокси, этокси, пропокси, бутокси и тому подобное.
Алкоксильная группа может быть опционально замещенной или незамещенной, и когда она замещена, то заместителем предпочтительно могут быть одна или несколько следующих групп (предпочтительно 1, 2, 3 или 4), независимо выбранных из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероaлкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарила, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21.
«Циклоалкилокси» относится к -O-(незамещенному циклоалкилу), где циклоалкил соответствует вышеприведенному определению, например «С3-10 циклоалкилокси» означает циклоалкилокси, содержащий от 3 до 10 атомов углерода. Циклоалкилокси включает, помимо прочего, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и тому подобное.
Циклоалкоксильная группа может быть опционально замещенной или незамещенной, и когда она замещена, то заместителем предпочтительно могут быть одна или несколько следующих групп (предпочтительно 1, 2, 3 или 4), независимо выбранных из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероaлкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарила, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21.
«3-10-членный гетероциклилокси» относится к -O-(незамещенному 3-10-членному гетероциклилу), где 3-10-членный гетероциклил соответствует вышеприведенному определению; 3-10-членный гетероциклилокси может быть опционально замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно могут быть одна или несколько следующих групп (предпочтительно 1, 2, 3 или 4), независимо выбранных из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероaлкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21.
«C5-10 арилокси» относится к -O-(незамещенному C5-10 арилу), где C5-10 арил соответствует вышеприведенному определению; C5-10 арилокси может быть опционально замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно могут быть одна или несколько следующих групп (предпочтительно 1, 2, 3 или 4), независимо выбранных из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероaлкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21.
«5-10-членный гетероарилокси» относится к -O-(незамещенному 5-10-членному гетероарилу), где 5-10-членный гетероарил соответствует вышеприведенному определению; 5-10-членный гетероарилокси может быть опционально замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно могут быть одна или несколько следующих групп (предпочтительно 1, 2, 3 или 4), независимо выбранных из группы, состоящей из дейтерия, галогенa, циано, нитро, азидо, C1-10 алкилa, C2-10 алкенилa, C2-10 алкинилa, C1-10 галоалкилa, C1-10 дейтероaлкилa, C3-10 циклоалкилa, 3-10-членного гетероциклилa, C5-10 арилa, 5-10-членного гетероарилa, =O, -C0-8-S(O)rR19, -C0-8-O-R20, -C0-8-C(O)OR20, -C0-8-C(O)R21, -C0-8-O-C(O)R21, -C0-8-NR22R23, -C0-8-C(=NR22)R21, -C0-8-N(R22)-C(=NR23)R21, -C0-8-C(O)NR22R23 и -C0-8-N(R22)-C(O)R21.
«C1-8 алканоил» относится к одновалентной атомной группе, которая получается после удаления гидроксила из C1-8 алкильной кислоты, и также обычно обозначается как «C0-7-C(O)-», например «C1-C(O)-» относится к ацетилу; «C2-C(O)-» относится к пропионилу; «C3-C(O)-» относится к бутирилу или изобутирилу.
«-C0-8-S(O)rR19» означает, что атом серы в -S(O)rR19 связан с C0-8 алкилом, где C0 алкила означает связь, а C1-8 алкила соответствует вышеприведенному определению.
«-C0-8-O-R20» означает, что атом кислорода в -O-R20 связан с C0-8 алкилом, где C0 алкила относится к связи, а C1-8 алкилa соответствует вышеприведенному определению.
«-C0-8-C(O)OR20» означает, что карбонильная группа в -C(O)OR20 связана с C0-8 алкилом, где C0 алкилa означает связь, а C1-8 алкилa соответствует вышеприведенному определению.
«-C0-8-C(O)R21» означает, что карбонильная группа в -C(O)R21 связана с C0-8 алкилом, где C0 алкилa означает связь, а C1-8 алкилa соответствует вышеприведенному определению.
«-C0-8-O-C(O)R21» означает, что атом кислорода в -O-C(O)R21 связан с C0-8 алкилом, где C0 алкилa означает связь, а C1-8 алкилa соответствует вышеприведенному определению.
«-C0-8-NR22R23» означает, что атом азота в -NR22R23 связан с C0-8 алкилом, где C0 алкилa означает связь, а C1-8 алкилa соответствует вышеприведенному определению.
«-C0-8-C(=NR22)R21» означает, что карбонил в -C(=NR22)R21 связан с C0-8 алкилом, где C0 алкилa означает связь, а C1-8 алкилa соответствует вышеприведенному определению.
«-C0-8-N(R22)-C(=NR23)R21» означает, что карбонил в -N(R22)-C(=NR23)R21 связан с C0-8 алкилом, где C0 алкилa означает связь, а C1-8 алкилa соответствует вышеприведенному определению.
«-C0-8-C(O)NR22R23» означает, что карбонил в -C(O)NR22R23 связан с C0-8 алкилом, где C0 алкилa означает связь, а C1-8 алкилa соответствует вышеприведенному определению.
«-C0-8-N(R22)-C(O)R21» означает, что атом азота в -N(R22)-C(O)R21 связан с C0-8 алкилом, где C0 алкилa означает связь, а C1-8 алкилa соответствует вышеприведенному определению.
«C1-10 галоалкил» относится к алкильной группе, содержащей от 1 до 10 атомов углерода, в которой любые атомы водорода опционально замещены атомом F, Cl, Br или I, включая, помимо прочего, дифторметила, дихлорметила, дибромметила, трифторметила, трихлорметила, трибромметила и тому подобное.
«C1-10 галоалкокси» означает алкокси, содержащий от 1 до 10 атомов углерода, в котором любые атомы водорода опционально замещены атомом F, Cl, Br или I, включая, помимо прочего, дифторметокси, дихлорметокси, дибромметокси, трифторметокси, трихлорметокси, трибромметокси и тому подобное.
«Галоген» относится к F, Cl, Br или I.
«МеОН» означает метанол. «ДМФ» означает N,N-диметилформамид. «ДХЭ» означает 1,2-дихлорэтан. «ТГФ» означает тетрагидрофуран. «ПЭ» означает петролейный эфир. «ЭА»/«ЭтАц» означает этилацетат. «ДХМ» означает дихлорметан. «LiOH» означает гидроксид лития. «NaOH» означает гидроксид натрия. «NaNO2» означает нитрит натрия. «CuI» означает иодид меди. «Na2SO4» означает сульфат натрия. «УкКс» означает уксусную кислоту. «NH4Oac» означает ацетат аммония. «Et3N» означает триэтиламин. «NH4Cl» означает хлорид аммония. «TFA» означает трифторуксусную кислоту. «m-CPBA» означает мета-хлорнадбензойную кислоту. «Pd(PPh3)4» означает тетракис(трифенилфосфин)палладий. «Pd(PPh3)2Cl2» означает бис(трифенилфосфин) дихлорид палладия.
Термин «опциональный» или «опционально» означает, что описанное событие или обстоятельство может происходить, но не обязательно произойдет, включая случаи, когда событие или обстоятельство происходит или не происходит, что касается и ситуаций замещения и незамещения. Например, «гетероциклильная группа, опционально замещенная алкилом» означает, что алкильная группа может, но не обязательно, присутствовать, и что описание включает случаи, когда гетероциклил замещен или не замещен алкилом.
Термин «замещенный» означает, что один или несколько атомов водорода в группе независимо замещены соответствующим числом заместителей. Само собой разумеется, что заместитель находится только в своем возможном химическом положении, и специалисты в данной области смогут определить (экспериментально или на основе теории) возможную или невозможную замену без приложения чрезмерных усилий. Например, возможна нестабильность в случае, если аминогруппа или гидроксильная группа, имеющие свободный водород, связаны с атомом углерода, имеющим ненасыщенную связь (например, олефин).
Термин «стереоизомер» означает изомер, образованный в результате различного пространственного расположения атомов в молекулах, и может быть подразделен либо на цис-транс-изомеры и энантиомеры, либо на энантиомеры и диастереомеры. Стереоизомеры, появившиеся в результате вращения вокруг одинарной связи, называются конформационными стереоизомерами, а также иногда называются ротамерами. Стереоизомеры, образовавшиеся по таким причинам, как длины связей, углы связей, наличие двойных связей в молекулах и кольцах, называются конфигурационными стереоизомерами, которые также подразделяются на две категории. Среди них есть изомеры, образованные двойными связями или одинарными связями формирующих кольца атомов углерода, которые не могут свободно вращаться и называются геометрическими изомерами, также известными как цис-транс-изомеры, подразделяющиеся на две конфигурации: Z и E. Например: цис-2-бутен и транс-2-бутен являются парой геометрических изомеров. Стереоизомеры с различной оптической активностью вследствие отсутствия противоположной осевой симметрии в молекулах называются оптическими изомерами, которые подразделяются на две конфигурации: R и S. Если не указано иное, то в настоящем изобретении под «стереоизомером» могут пониматься один или несколько из вышеупомянутых энантиомеров, конфигурационных изомеров и конформационных изомеров.
«Фармацевтически приемлемая соль» в настоящем изобретении относится к фармацевтически приемлемым солям присоединения кислоты, включая неорганические кислые соли и органические кислые соли, и эти соли могут быть получены методами, известными в данной области техники.
«Фармацевтическая композиция» относится к смеси, содержащей одно или несколько соединений, описанных в настоящем документе, или его физиологически/ фармацевтически приемлемой соли или пролекарству, а также другим химическим компонентам, например физиологически/фармацевтически приемлемым носителям и вспомогательным веществам. Цель этой фармацевтической композиции состоит в том, чтобы облегчать введение препарата в организм, улучшая всасывание действующего вещества и тем самым способствуя проявлению его биологической активности.
Далее представлено подробное описание настоящего изобретения в соответствии с вариантами его осуществления, которые не предназначены для ограничения настоящего изобретения. Настоящее изобретение также не ограничивается представленными вариантами осуществления.
Структура соединения по настоящему изобретению определяется с помощью ядерного магнитного резонанса (ЯМР) и/или жидкостной хроматографии в комбинации с масс-спектрометрией (ЖХ-МС). Химические сдвиги ЯМР-спектров (δ) приведены в частях на миллион (ppm). ЯМР определяется с использованием ядерной магнитной установки Bruker AVANCE-400 с дейтерированным диметилсульфоксидом (ДМСО-d6), дейтерированным метанолом (CD3OD) и дейтерированным хлороформом (CDCl3) в качестве растворителей и тетраметилсиланом (ТМС) в качестве внутреннего стандарта.
Определение с помощью ЖХ-МС проводят с использованием масс-спектрометра Agilent 6120. Определение с помощью ВЭЖХ проводят с использованием жидкостного хроматографа высокого давления Agilent 1200 DAD (колонка Sunfire C18 150 × 4,6 мм) и жидкостного хроматографа высокого давления Waters 2695-2996 (колонка Gimini C18 150 × 4,6 мм).
В качестве пластины для тонкослойной хроматографии используется пластина с силикагелем Yantai Yellow Sea HSGF254 или Qingdao GF254. В спецификации для ТСХ установлено значение 0,15-0,20 мм, а в спецификации для тонкослойной хроматографии для разделения и выделения установлено значение 0,4-0,5 мм. В качестве носителя для колоночной хроматографии обычно используют силикагель (Yantai Huanghai silica gel) с размером частиц 200–300 меш.
Исходные материалы в примерах осуществления настоящего изобретения известны и имеются в продаже или могут быть синтезированы методами, известными в данной области техники или в соответствии с ними.
Если не указано иное, то все реакции по настоящему изобретению проводят в атмосфере сухого азота или аргона с непрерывным перемешиванием на магнитной мешалке, где растворитель представляет собой сухой растворитель, а температура реакции указана в градусах Цельсия (°C).
I. Получение промежуточных веществ
Получение промежуточного вещества 1(R)-1-(3-(пентафтор-λ6-сульфанил)фенил)этан-1-амина

Стадия 1: Синтез (3-(1-этоксивинил)фенил)пентафтор-λ6-сульфана

(3-бромфенил)пентафтор-λ6-сульфан (1,0 г, 3,53 ммоль) растворяли в N,N-диметилформамиде (20 мл), а затем добавляли трибутил(1-этоксивинил)тин (1,4 г, 3,89 ммоль) и бис(трифенилфосфин)дихлорид палладия (248 мг, 0,353 ммоль). Реакционный раствор нагревали до 80°C и перемешивали в течение 18 часов. После завершения реакции реакционный раствор использовали в полученном виде на следующей стадии.
Стадия 2: Синтез 1-(3-(пентафтор-λ6-сульфанил)фенил)этан-1-он
Раствор гидрохлорида диоксана (4 н, 2 мл) по каплям добавляли в реакционный раствор, который затем перемешивали при температуре 0°C в течение 2 часов. После завершения реакции реакцию останавливали насыщенным раствором бикарбоната натрия и два раза экстрагировали этилацетатом. Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, концентрировали до сухого состояния и разделяли колоночной хроматографией [элюент: этилацетат/петролейный эфир = 0-10%] с получением 1-(3-(пентафтор-λ6-сульфанил)фенил)этан-1-он (670 мг, выход: 77%).
Стадия 3: Синтез (R,Z)-2-метил-N-(1-(3-(пентафтор-λ6-сульфанил)фенил)этилиден)пропан-2-сульфинамида
1-(3-(пентафтор-λ6-сульфанил)фенил)этан-1-он (670 мг, 2,72 ммоль), (R)-(+)-трет-бутилсульфинамид (396 мг, 3,27 ммоль) и тетраэтил титанат (3,76 г, 5,44 ммоль) растворяли в тетрагидрофуране (10 мл) и затем нагревали до 70°C и перемешивали в течение 2 часов. После завершения реакции реакционный раствор разбавляли этилацетатом (150 мл), останавливали насыщенным раствором бикарбоната натрия и фильтровали. Фильтрат промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, концентрировали до сухого состояния и разделяли колоночной хроматографией [элюент: этилацетат/петролейный эфир = 0-30%] с получением (R,Z)-2-метил-N-(1-(3-(пентафтор-λ6-сульфанил)фенил)этилиден)пропан-2-сульфинамида (789 мг, выход: 83%). МС, m/z (ESI): 350 [M+H]+.
Стадия 4: Синтез (R)-2-метил-N-((R)-(1-(3-(пентафтор-λ6-сульфанил)фенил)этил)пропан-2-сульфинамида
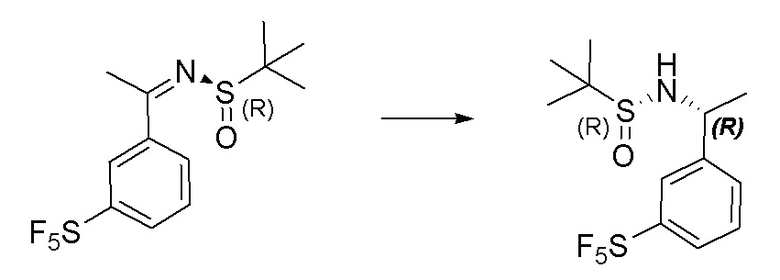
(R,Z)-2-метил-N-(1-(3-(пентафтор-λ6-сульфанил)фенил)этилиден)пропан-2-сульфинамид (400 мг, 1,15 ммоль) растворяли в тетрагидрофуране (10 мл, содержание воды: 20%) и охлаждали до -50°C. Добавляли борогидрид натрия (130 мг, 3,44 ммоль). Реакционный раствор перемешивали при поддерживаемой текущей температуре в течение 1 часа, а затем снова перемешивали при комнатной температуре в течение 1 часа. После завершения реакции реакционный раствор разбавляли дихлорметаном, фильтровали с удалением нерастворимых веществ, сушили над безводным сульфатом натрия, концентрировали до сухого состояния и затем разделяли колоночной хроматографией [элюент: этилацетат/петролейный эфир = 0-80%] с получением (R)-2-метил-N-((R)-(1-(3-(пентафтор-λ6-сульфанил)фенил)этил)пропан-2-сульфинамида (300 мг, выход: 74%). МС, m/z (ESI): 352 [M+H]+.
Стадия 5: Синтез (R)-1-(3-(пентафтор-λ6-сульфанил)фенил)этан-1-амин гидрохлорида

(R)-2-метил-N-((R)-(1-(3-(пентафтор-λ6-сульфанил)фенил)этил)пропан-2-сульфинамид (300 мг, 0,85 ммоль) растворяли в растворе гидрохлорида диоксана (4 н, 5 мл) и перемешивали в течение ночи при комнатной температуре. После завершения реакции реакционный раствор концентрировали до сухого состояния с получением (R)-1-(3-(пентафтор-λ6-сульфанил)фенил)этан-1-амин гидрохлорида (270 мг), который использовали в полученном виде на следующей стадии. МС, m/z (ESI): 248 [M+H]+.
Промежуточные вещества 2-4 были получены в соответствии с методом синтеза промежуточного вещества 1.
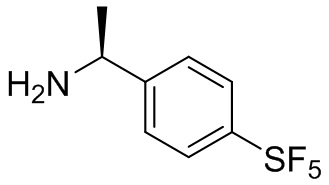
Получение промежуточного вещества 5 (S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этан-1-амина
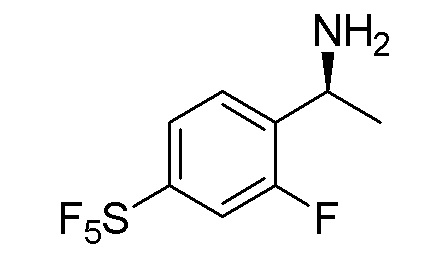
Стадия 1: Синтез 2-фтор-N-метокси-N-метил-4-(пентафтор-λ6-сульфанил)бензамида

2-фтор-4-(пентафтор--λ6-сульфанил) бензойную кислоту (2 г, 7,6 ммоль) растворяли в N-метилпирролидоне (10 мл) и затем добавляли O-(7-азабензотриазол)-1-YL)-N,N,N,N-тетраметилальдегид катионный гексафторфосфат (4,32 г, 11,3 ммоль), меткосиметиламина гидрохлорид (1,08 г, 11,3 ммоль) и триэтиламин (1,53 г, 15,2 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 16 часов. После завершения реакции реакцию останавливали водой и два раза экстрагировали этилацетатом. Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Реакционный раствор концентрировали до сухого состояния и затем разделяли колоночной хроматографией [элюент: петролейный эфир/этилацетат (30%)] с получением 2-фтор-N-метокси-N-метил-4-(пентафтор-λ6-сульфанил)бензамида (1,8 г, выход: 76%). МС, m/z (ESI): 309,8 [M+H]+.
Стадия 2: Синтез 1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этан-1-он

2-фтор-N-метокси-N-метил-4-(пентафтор-λ6-сульфанил)бензамид (1,8 г, 5,8 ммоль) растворяли в тетрагидрофуране (40 мл). Добавляли раствор метилмагнийбромида (12 мл, 12 ммоль) при охлаждении в ледяной бане. Реакционный раствор перемешивали в течение 1 часа. После завершения реакции реакцию останавливали насыщенным раствором хлорида аммония и два раза экстрагировали этилацетатом. Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Реакционный раствор концентрировали до сухого состояния и затем разделяли колоночной хроматографией [элюент: петролейный эфир/этилацетат (5%)] с получением 1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этан-1-он (1,2 г, выход: 78%).
Стадия 3: Синтез (S,E)-N-(1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этилиден)-2-метилпропан-2-сульфинамида

1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этан-1-он (700 мг, 2,65 ммоль), (S)-2-метилпропан-2-сульфинамид (417 мг, 3,44 ммоль) и тетраэтил титанат (2 мл) растворяли в тетрагидрофуране (30 мл), а затем нагревали до 50°C и перемешивали в течение 5 часов. После завершения реакции реакцию останавливали насыщенным раствором карбоната натрия, фильтровали и два раза экстрагировали этилацетатом. Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, концентрировали до сухого состояния и разделяли колоночной хроматографией [элюент: петролейный эфир-петролейный эфир/этилацетат (30%)] с получением (S,E)-N-(1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этилиден)-2-метилпропан-2-сульфинамида (700 мг, выход: 72%). МС, m/z (ESI): 367 [M+H]+.
Стадия 4: (S)-N-((S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)-2-метилпропан-2-сульфинамида

(S,E)-N-(1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этилиден)-2-метилпропан-2-сульфинамид (700 мг, 1,91 ммоль) растворяли в тетрагидрофуране (20 мл) и охлаждали до -50°C. Добавляли борогидрид натрия (195 мг, 5,73 ммоль). Реакционный раствор перемешивали при поддерживаемой текущей температуре в течение получаса. После завершения реакции реакцию останавливали насыщенным солевым раствором и два раза экстрагировали этилацетатом. Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, концентрировали до сухого состояния и разделяли колоночной хроматографией [элюент: петролейный эфир-петролейный эфир/этилацетат (60%)] с получением (S)-N-((S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)-2-метилпропан-2-сульфинамида (700 мг, выход: 99%). МС, m/z (ESI): 370 [M+H]+.
Стадия 5: Синтез (S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этан-1-амина

(S)-N-((S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)-2-метилпропан-2-сульфинамид (700 мг, 1,89 ммоль) растворяли в растворе гидрохлорида диоксана (2 н, 30 мл) и перемешивали при комнатной температуре в течение 4 часов. После завершения реакции реакционный раствор концентрировали до сухого состояния с получением (S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этан-1-амина (600 мг, выход: 95%). МС, m/z (ESI): 266 [M+H]+.
Получение промежуточного вещества 6 (R)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этан-1-амина
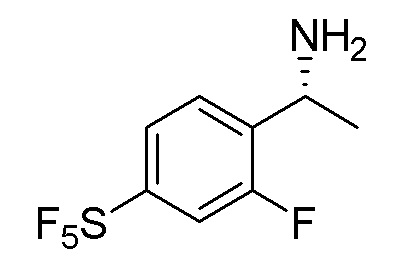
Стадия 1: Синтез (R,E)-N-(1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этилиден)-2-метилпропан-2-сульфинамида

1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этан-1-он (500 мг, 1,89 ммоль), (R)-2-метилпропан-2-сульфинамид (291 мг, 2,46 ммоль) и тетраэтил титанат (2 мл) растворяли в тетрагидрофуране (30 мл), а затем нагревали до 50°C и перемешивали в течение 5 часов. После завершения реакции реакцию останавливали насыщенным раствором карбоната натрия, фильтровали и два раза экстрагировали этилацетатом. Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, концентрировали до сухого состояния и разделяли колоночной хроматографией [элюент: петролейный эфир-петролейный эфир/этилацетат (30%)] с получением (R,E)-N-(1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этилиден)-2-метилпропан-2-сульфинамида (450 мг, выход: 65%). МС, m/z (ESI): 368 [M+H]+.
Стадия 2: Синтез (R)-N-((R)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)-2-метилпропан-2-сульфинамида

(R,E)-N-(1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этилиден)-2-метилпропан-2-сульфинамид (450 мг, 1,22 ммоль) растворяли в тетрагидрофуране (20 мл) и охлаждали до -50°C. Добавляли борогидрид натрия (125 мг, 3,67 ммоль). Смесь перемешивали при поддерживаемой текущей температуре в течение получаса. После завершения реакции реакцию останавливали насыщенным солевым раствором и два раза экстрагировали этилацетатом. Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, концентрировали до сухого состояния и разделяли колоночной хроматографией [элюент: петролейный эфир-петролейный эфир/этилацетат (60%)] с получением (R)-N-((R)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)-2-метилпропан-2-сульфинамида (380 мг, выход: 84%). МС, m/z (ESI): 370 [M+H]+.
Стадия 3: Синтез (R)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этан-1-амина

(R)-N-((R)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)-2-метилпропан-2-сульфинамид (380 мг, 1,03 ммоль) растворяли в растворе гидрохлорида диоксана (2 н, 30 мл) и перемешивали при комнатной температуре в течение 4 часов. После завершения реакции реакционный раствор концентрировали до сухого состояния с получением (R)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этан-1-амина (300 мг, выход: 96%). МС, m/z (ESI): 266 [M+H]+.
Получение промежуточного вещества 7 (2-(пентафтор-λ6-сульфанил)фенил)метиламин гидрохлорида

Стадия 1: Синтез (2-(пентафтор-λ6-сульфанил)фенил)гидразин гидрохлорида
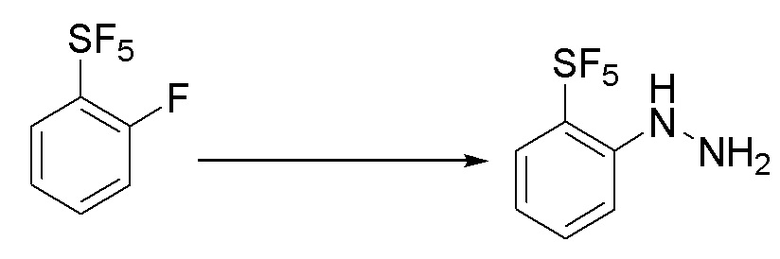
Пентафтор(2-фторфенил)-λ6-сульфан (3,0 г, 13,5 ммоль) растворяли в диметилсульфоксиде (15 мл). Добавляли гидразин-гидрат (30 мл). Проводили реакцию реакционного раствора в запаянной трубке при температуре 100°C в течение 20 часов. Реакционный раствор охлаждали до комнатной температуры. Добавляли 1 н. водный раствор гидроксида натрия (150 мл) и насыщенную воду (150 мл). Смесь экстрагировали метил-трет-бутиловым эфиром (2 * 100 мл), промывали насыщенным солевым раствором (3 * 100 мл), сушили над безводным сульфатом натрия и фильтровали. В фильтрат добавляли раствор гидрохлорида диоксана (4 н, 5 мл, 20 ммоль), перемешивали при комнатной температуре в течение 20 минут, а затем концентрировали до сухого состояния с получением (2-(пентафтор-λ6-сульфанил)фенил)гидразин гидрохлорида (3,5 г, выход: 96%). МС, m/z (ESI): 235 [M+H]+.
Стадия 2: Синтез 2-(пентафтор-λ6-сульфанил)анилин гидрохлорида

(2-(пентафтор-λ6-сульфанил)фенил)гидразин гидрохлорид растворяли в метаноле (50 мл). Добавляли никель Ренея. Реакционный раствор перемешивали в течение ночи при комнатной температуре в присутствии водорода. Реакционный раствор фильтровали. Отфильтрованный осадок промывали метанолом (20 мл). В фильтрат добавляли раствор гидрохлорида диоксана (4 н, 5 мл, 20 ммоль), перемешивали при комнатной температуре в течение 20 минут, а затем концентрировали до сухого состояния с получением 2-(пентафтор-λ6-сульфанил)анилин гидрохлорида (3,7 г, неочищенный продукт), который использовали в полученном виде на следующей стадии. МС, m/z (ESI): 220 [M+H]+.
Стадия 3: Синтез пентафтор(2-йодофенил)-λ6-сульфана
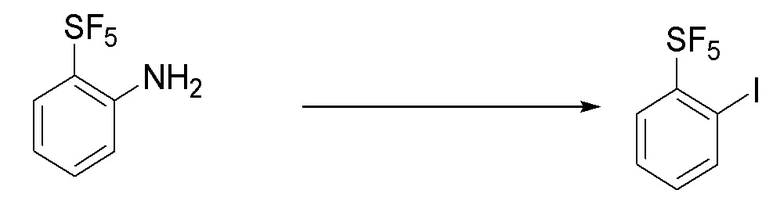
2-(пентафтор-λ6-сульфанил)анилин гидрохлорид (3,7 г, неочищенный продукт) растворяли в растворе тетрафтороборной кислоты (30 мл) и нагревали до полного растворения. Реакционный раствор охлаждали до 0° C (при охлаждении в ледяной бане). Раствор нитрита натрия (2,0 г, 29 ммоль, 10 мл воды) по каплям добавляли при охлаждении и перемешивании в ледяной бане, после чего реакционный раствор постоянно перемешивали в течение 30 минут в ледяной бане. Медленно добавляли раствор иодида калия (7,2 г, 43,4 ммоль, 15 мл воды), после чего убирали ледяную баню. Реакционный раствор перемешивали при комнатной температуре в течение 30 минут для проведения реакции. Реакционный раствор экстрагировали этилацетатом (2 * 100 мл) и промывали насыщенным раствором бикарбоната натрия и раствором тиосульфата натрия (2 * 100 мл). Органическую фазу концентрировали, а остаток разделяли колоночной хроматографией [элюент: петролейный эфир/этилацетат = 0-5%] с получением пентафтор(2-йодофенил)-λ6-сульфана (3,3 г, выход за две стадии: 77%).
1H ЯМР (400 МГц, Хлороформ-d) δ 8,15 (d, J = 7,9 Гц, 1H), 7,81 (dd, J = 8,4, 1,5 Гц, 1H), 7,45 (t, J = 8,0 Гц, 1H), 7,13 (t, J = 7,6 Гц, 1H).
Стадия 4: Синтез 2-(пентафтор-λ6-сульфанил) бензонитрила

Смесь (12 мл) пентафтор(2-йодофенил)-λ6-сульфана (1,85 г, 5,6 ммоль) и цианида меди (2,0 г, 22,4 ммоль) в N-метилпирролидоне подвергали микроволновому облучению при температуре 100°С в течение 2,5 часов. Этилацетат (100 мл), концентрированный водный аммиак (15 мл) и воду (100 мл) добавляли в реакционный раствор, который перемешивали при комнатной температуре в течение 10 минут и затем распределяли. Органический слой промывали насыщенным солевым раствором (100 мл) и концентрировали, а остаток разделяли колоночной хроматографией [элюент: петролейный эфир/этилацетат = 0-10%] с получением 2-(пентафтор-λ6-сульфанил) бензонитрила (0,94 г, выход: 73%).
1H ЯМР (400 МГц, Хлороформ-d) δ 7,95 (d, J=8,3 Гц, 1H), 7,86 (d, J=7,6 Гц, 1H), 7,74 (t, J=8,0 Гц, 1H), 7,66 (t, J=7,6 Гц, 1H).
Стадия 5: Синтез (2-(пентафтор-λ6-сульфанил)фенил)метиламин гидрохлорида
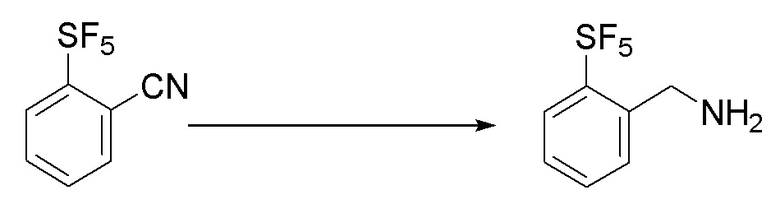
2-(пентафтор-λ6-сульфанил) бензонитрил (1,88 г, 8,2 ммоль) растворяли в тетрагидрофуране (5 мл). Добавляли раствор комплекса боран-тетрагидрофуран (1 н, 50 мл, 50 ммоль). Реакционный раствор кипятили с обратным холодильником в течение 20 часов для проведения реакции. Раствор комплекса боран-тетрагидрофуран (1 н, 50 мл, 50 ммоль) восполнили, а реакционный раствор постоянно кипятили с обратным холодильником в течение 20 часов для выполнения реакции. Реакционный раствор охлаждали до комнатной температуры, медленно добавляли метанол (30 мл) и раствор гидрохлорида диоксана (4 н, 4 мл, 16 ммоль), после чего реакционный раствор постоянно кипятили с обратным холодильником в течение 1 часа для выполнения реакции, а затем концентрировали методом ротационного выпаривания. Н-пентан (50 мл) добавляли в остаток, который перемешивали при комнатной температуре в течение получаса и фильтровали под вакуумом. Отфильтрованный осадок промывали н-пентаном (20 мл) и высушивали с получением 2-(пентафтор-λ6-сульфанил)фенил)метиламин гидрохлорида (2,22 г), который использовали в полученном виде на следующей стадии. МС, m/z (ESI): 234 [M+H]+.
Получение промежуточного вещества 8 (R)-5-фтор-2,3-дигидро-1H-инден-1-амина
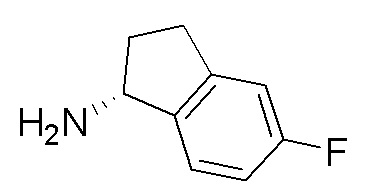
Стадия 1: Синтез (R)-N-((R)-5-фтор-2,3-дигидро-1H-инден-1-ил)-2-метилпропан-2-сульфинамида
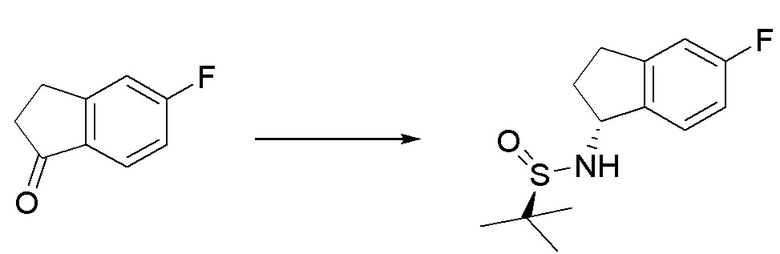
5-фтор-2,3-дигидро-1H-инден-1-он (5,0 г, 33,3 ммоль) растворяли в безводном тетрагидрофуране (100 мл). Добавляли (R)-2-метилпропан-2-сульфинамид (8,07 г, 66,6 ммоль) и тетраизопропил титанат (37,86 г, 133,2 ммоль). Реакционный раствор нагревали до кипячения с обратным холодильником в течение 24 часов в атмосфере азота. После завершения реакции реакционный раствор охлаждали до 0°С, порциями добавляли борогидрид натрия (5,04 г, 133,2 ммоль) и перемешивали при температуре 0°C в течение 3 часов. После завершения реакции промежуточного вещества по каплям добавляли насыщенный солевой раствор для остановки реакции. После фильтрования реакционной системы фильтрат концентрировали, а неочищенный продукт разделяли колоночной хроматографией на силикагеле [элюент: петролейный эфир/этилацетат=70/30] с получением (R)-N-((R)-5-фтор-2,3-дигидро-1H-инден-1-ил)-2-метилпропан-2-сульфинамида (2,4 г, выход: 28%), МС m/z (ESI): 256 [M+H]+.
Стадия 2: Синтез (R)-5-фтор-2,3-дигидро-1H-инден-1-амина
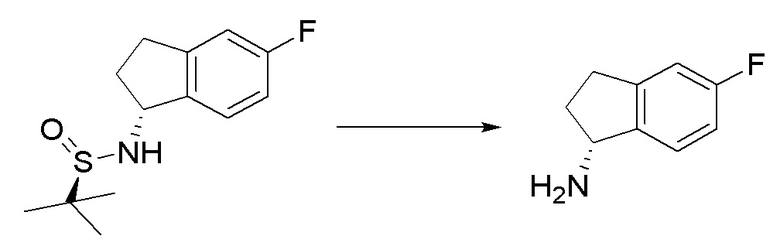
(R)-N-((R)-5-фтор-2,3-дигидро-1H-инден-1-ил)-2-метилпропан-2-сульфинамид (2,4 г, 9,40 ммоль) растворяли в метаноле (10 мл). Раствор гидрохлорида метанола (4 М, 10 мл) добавляли при перемешивании. Реакционный раствор постоянно перемешивали при комнатной температуре в течение 1 часа. После концентрирования реакционной системы добавляли воду (10 мл) и этилацетат (10 мл), а водную фазу разделяли и лиофилизировали с получением (R)-5-фтор-2,3-дигидро-1H-инден-1-амин гидрохлорида (1,6 г, выход: 91%), МС m/z (ESI): 135 [M+H-NH3]+.
Промежуточные вещества 9-12 были получены в соответствии с методом синтеза промежуточного вещества 8.
формула
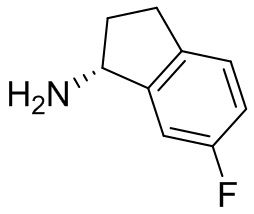
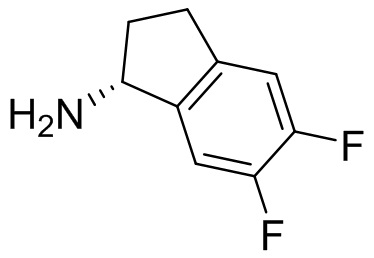
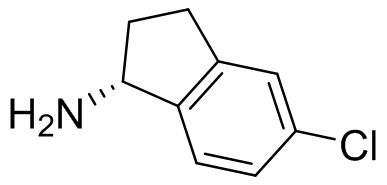
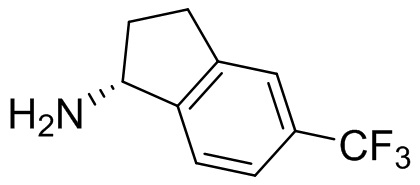
Получение промежуточного вещества 13 (S)-5-фтор-2,3-дигидро-1H-инден-1-амина

Стадия 1: Синтез (S)-N-((S)-5-фтор-2,3-дигидро-1H-инден-1-ил)-2-метилпропан-2-сульфинамида

5-фтор-2,3-дигидро-1H-инден-1-он (5,0 г, 33,3 ммоль) растворяли в безводном тетрагидрофуране (100 мл). Добавляли (S)-2-метилпропан-2-сульфинамид (8,07 г, 66,6 ммоль) и тетраизопропил титанат (37,86 г, 133,2 ммоль). Реакционный раствор нагревали до кипячения с обратным холодильником в течение 24 часов в атмосфере азота. После завершения реакции реакционный раствор охлаждали до 0°С и порциями добавляли борогидрид натрия (5,04 г, 133,2 ммоль). Реакционный раствор перемешивали при температуре 0°C в течение 3 часов. После завершения реакции промежуточного вещества по каплям добавляли насыщенный солевой раствор для остановки реакции. После фильтрования реакционной системы фильтрат концентрировали, а неочищенный продукт разделяли колоночной хроматографией на силикагеле [элюент: петролейный эфир/этилацетат (70/30)] с получением (S)-N-((S)-5-фтор-2,3-дигидро-1H-инден-1-ил)-2-метилпропан-2-сульфинамида (2,4 г, выход: 28%), МС m/z (ESI): 256 [M+H]+.
Стадия 2: Синтез (S)-5-фтор-2,3-дигидро-1H-инден-1-амина
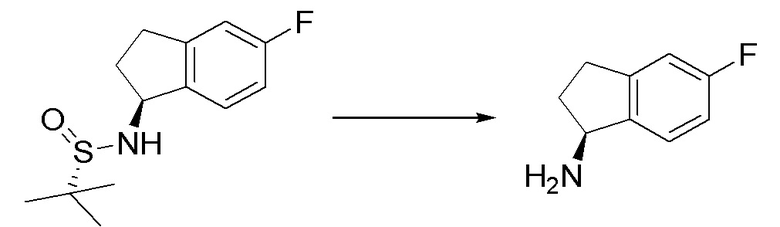
(S)-N-((S)-5-фтор-2,3-дигидро-1H-инден-1-ил)-2-метилпропан-2-сульфинамид (2,4 г, 9,40 ммоль) растворяли в метаноле (10 мл). Раствор гидрохлорида метанола (4 М, 10 мл) добавляли при перемешивании. Реакционный раствор постоянно перемешивали при комнатной температуре в течение 1 часа. После концентрирования реакционной системы добавляли воду (10 мл) и этилацетат (10 мл), а водную фазу разделяли и лиофилизировали с получением (S)-5-фтор-2,3-дигидро-1H-инден-1-амин гидрохлорида (1,5 г, выход: 85%), МС m/z (ESI): 135 [M+H-NH3]+.
Промежуточные вещества 14-17 были получены в соответствии с методом синтеза промежуточного вещества 13.
формула
(ESI):
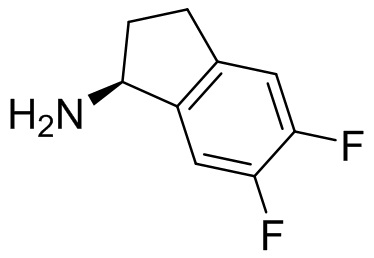
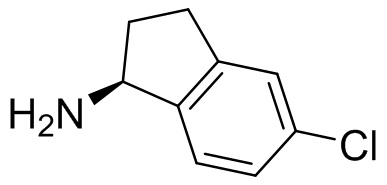
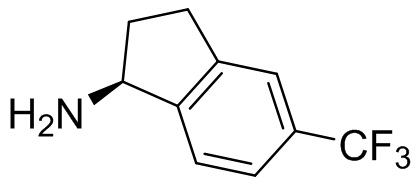
Получение промежуточного вещества 18 (R)-N-метил-2,3-дигидро-1H-инден-1-амина
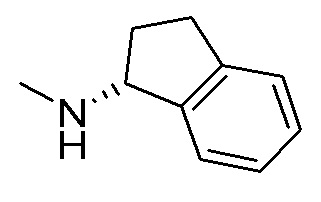
Стадия 1: Синтез (R)-N-Boc-2,3-дигидро-1H-инден-1-амина
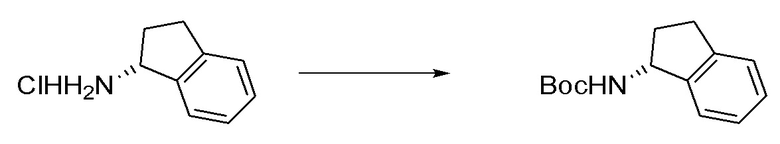
(R)-2,3-дигидро-1H-инден-1-амин гидрохлорид (1,0 г, 5,89 ммоль) растворяли в тетрагидрофуране (15 мл). Добавляли триэтиламин (1,79 г, 17,68 ммоль) и Boc-ангидрид (1,42 г, 6,48 ммоль). Реакционный раствор последовательно перемешивали в течение ночи при комнатной температуре. После завершения реакции реакционную систему в полученном виде концентрировали, а неочищенный продукт разделяли колоночной хроматографией [элюент: этилацетат/петролейный эфир (5/95)] с получением (R)-N-Boc-2,3-дигидро-1H-инден-1-амина (1,38 г, выход: 100%).
Стадия 2: Синтез трет-бутил (R)-(2,3-дигидро-1H-инден-1-ил)(метил)карбамата
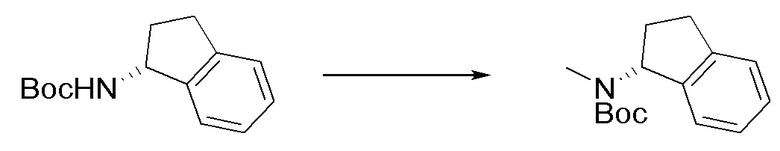
(R)-N-Boc-2,3-дигидро-1H-инден-1-амин (1,38 г, 5,89 ммоль) растворяли в безводном N,N-диметилформамиде (8 мл). Добавляли гидрид натрия (60%, 355 мг, 8,87 ммоль) при температуре 0°C. Затем реакционный раствор перемешивали при температуре 0°C в течение 30 минут, добавляли йодметан (2,52 г, 17,74 ммоль) и потом реакционный раствор нагревали до комнатной температуры и постоянно перемешивали в течение трех часов. Реакцию останавливали водой (50 мл), а реакционный раствор экстрагировали этилацетатом (50 мл *3). Органические фазы объединяли, промывали водой, сушили и концентрировали. Неочищенный продукт разделяли колоночной хроматографией [элюент: этилацетат/петролейный эфир (10/90)] с получением трет-бутил (R)-(2,3-дигидро-1H-инден-1-ил)(метил)карбамата (1,3 г, выход: 89%).
Стадия 3: Синтез (R)-N-метил-2,3-дигидро-1H-инден-1-амина

Трет-бутил (R)-(2,3-дигидро-1H-инден-1-ил)(метил)карбамат (1,3 г, 5,26 ммоль) растворяли в ацетонитриле (10 мл). Добавляли концентрированную соляную кислоту (5 мл). Реакционный раствор перемешивали при комнатной температуре в течение трех часов, а затем подвергали понижению давления для удаления большей части ацетонитрила. Водную фазу лиофилизировали с получением (R)-N-метил-2,3-дигидро-1H-инден-1-амина (950 мг, выход: 98%), МС m/z (ESI): 148 [M+H]+.
Промежуточное вещество 19 было получено в соответствии с методом синтеза промежуточного вещества 18.
вещества
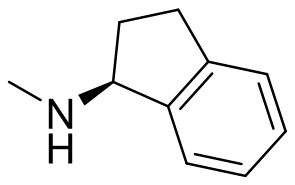
Получение промежуточного вещества 20 7-((3aR,4R,6aS)-4-(трет-бутоксиметил)-2,2-диметил-3a,6a-дигидро-4H-циклопента[d][1,3]диоксол-6-ил)-2,4-дихлорпирроло[2,1-f][1,2,4]триазина
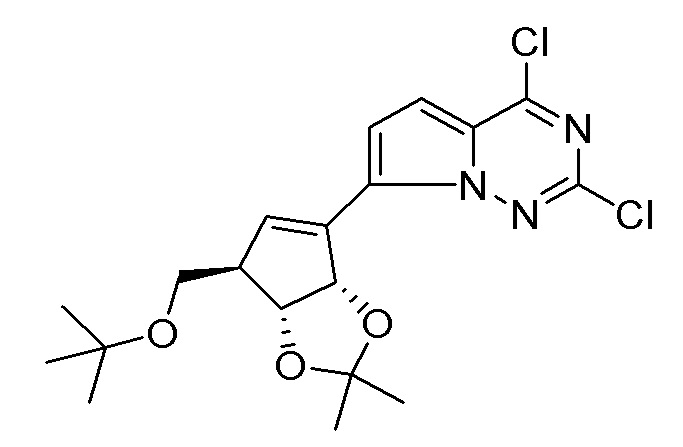
Стадия 1: Синтез (3aR,6R,6aR)-6-(трет-бутоксиметил)-2,2-диметилтетрагидро-4H-циклопента[d][1,3]диоксол-4-он
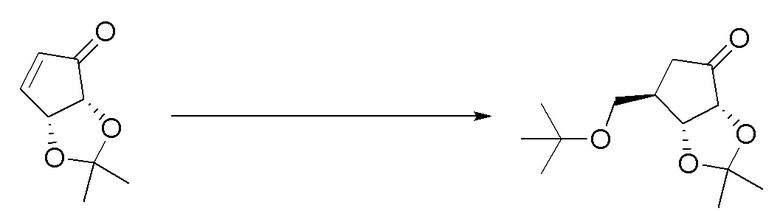
В трет-бутоксид калия (10,9 г, 97 ммоль) в растворе метил-трет-бутилового эфира (400 мл) по каплям добавляли втор-бутиллитий (74,6 мл, 97 ммоль) при температуре -70°C в защитной среде азота. Затем реакционный раствор перемешивали при температуре -70°C в течение 3 часов, в раствор тетрагидрофурана (100 мл) добавляли бромид лития (16,82 г, 190 ммоль). Реакционный раствор нагревали до -15°C и перемешивали в течение 30 минут. Температуру реакционного раствора снова понижали до -70℃ и в раствор диизопропилсульфида (70 мл) добавляли комплекс бромид меди-диметилсульфид (9,98 г, 48 ммоль). Реакционный раствор перемешивали в течение 10 минут, и затем в раствор тетрагидрофурана (50 мл) добавляли (3aR,6aR)-2,2-диметил-3a,6a-дигидро-4H-циклопента[d][1,3]диоксол-4-он (5 г, 32 ммоль). Реакционный раствор нагревали до -30°C и перемешивали в течение 30 минут. После завершения реакции смешанный раствор (50 мл) метанола и уксусной кислоты (1:1) использовали для остановки реакции, вливали смешанный раствор хлорида аммония и 3% водный аммиак (1:1). Водный слой убирали. Органический слой промывали смешанным раствором насыщенного раствора хлорида аммония, 3% водного аммиака (1:1) и соленой воды, сушили над безводным сульфатом натрия, концентрировали и затем разделяли колоночной хроматографией [элюент: петролейный эфир-петролейный эфир/этилацетат (15%)] с получением (3aR,6R,6aR)-6-(трет-бутоксиметил)-2,2-диметилтетрагидро-4H-циклопента[d][1,3]диоксол-4-он (6,8 г, выход: 85%).
Стадия 2: Синтез (3aR,6R,6aR)-6-(трет-бутоксиметил)-4-(2,4-дихлорпирроло[2,1-f][1,2,4]триазин-7-ил)-2,2-диметилтетрагидро-4H-циклопента[d][1,3]диоксол-4-ола
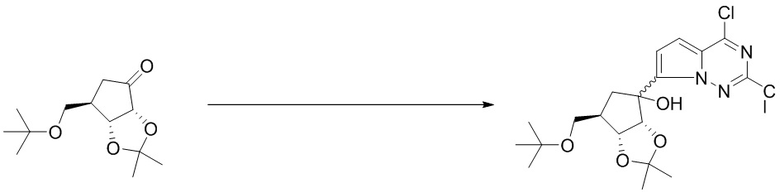
В 2,4-дихлор-7-йодопирроло[2,1-f][1,2,4]триазин (13,7 г, 43,8 ммоль) в тетрагидрофуране (300 мл) по каплям добавляли Н-бутиллитий (22,8 мл, 56,9 ммоль) при температуре -70°C в защитной среде азота. Затем реакционный раствор перемешивали при температуре -70°C в течение 2 часов, добавляли (3aR,6R,6aR)-6-(трет-бутоксиметил)-2,2-диметилтетрагидро-4H-циклопента[d][1,3]диоксол-4-он (10,6 г, 43,8 ммоль) в растворе тетрагидрофурана (40 мл) и реакционный раствор постоянно перемешивали при температуре -70°C в течение 1 часа. После завершения реакции насыщенный раствор хлорида аммония использовали для остановки реакции. Реакционный раствор экстрагировали этилацетатом, а органический слой концентрировали и затем разделяли колоночной хроматографией [элюент: петролейный эфир-петролейный эфир/этилацетат (15%)] с получением (3aR,6R,6aR)-6-(трет-бутоксиметил)-4-(2,4-дихлорпирроло[2,1-f][1,2,4]триазин-7-ил)-2,2-диметилтетрагидро-4H-циклопента[d][1,3]диоксол-4-ол (12 г, выход: 64%). МС, m/z (ESI): 430 [M+H]+.
Стадия 3: Синтез 7-((3aR,4R,6aS)-4-(трет-бутоксиметил)-2,2-диметил-3a,6a-дигидро-4H-циклопента[d][1,3]диоксол-6-ил)-2,4-дихлорпирроло[2,1-f][1,2,4]триазина 
Реактив Берджесса (14,3 г, 56 ммоль) добавляли в (3aR,6R,6aR)-6-(трет-бутоксиметил)-4-(2,4-дихлорпирроло[2,1-f][1,2,4]триазин-7-ил)-2,2-диметилтетрагидро-4H-циклопента[d][1,3]диоксол-4-ол (12 г, 28 ммоль) в растворе тетрагидрофурана (200 мл), который затем нагревали до 50°C и перемешивали в течение 4 часов. После завершения реакции реакционный раствор концентрировали до сухого состояния и разделяли колоночной хроматографией [петролейный эфир-петролейный эфир/этилацетат (15%)] с получением 7-((3aR,4R,6aS)-4-(трет-бутоксиметил)-2,2-диметил-3a,6a-дигидро-4H-циклопента[d][1,3]диоксол-6-ил)-2,4-дихлорпирроло[2,1-f][1,2,4]триазина (7 г, выход: 61%). МС m/z (ESI):412 [M+H]+.
Получение промежуточного вещества 21 (2R,3R,4R,5R)-2-(ацетоксиметил)-5-(4,6-дихлор-1H-пиразоло[3,4-b]пиридин-1-ил)тетрагидрофуран-3,4-диил диацетата

Стадия 1: Синтез этил 5-амино-1-(4-метоксибензил)-1H-пиразол-4-карбоксилата
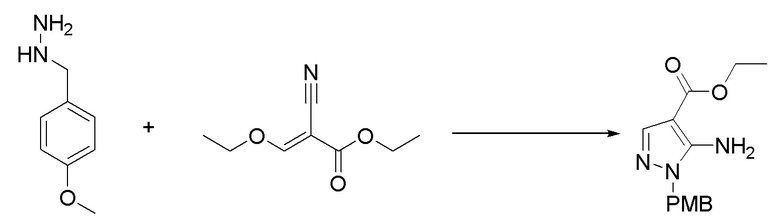
(4-метоксибензил)гидразин гидрохлорид (100,0 г, 0,53 моль) растворяли в абсолютном этаноле (1,6 л) и добавляли триэтиламин (81,0 г, 0,80 моль). Реакционный раствор перемешивали при комнатной температуре в течение 30 минут и добавляли этил (этоксиметилен)цианоацетат (98,0 г, 0,58 моль). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение ночи и концентрировали для удаления этанола. Воду (500 мл) добавляли в сухой остаток, который затем экстрагировали этилацетатом (2*500 мл). Органические фазы объединяли, промывали насыщенным солевым раствором (300 мл), сушили при помощи безводного сульфата натрия и фильтровали под вакуумом. Фильтрат концентрировали с получением этил 5-амино-1-(4-метоксибензил)-1H-пиразол-4-карбоксилата (135,0 г, выход: 92%). МС, m/z (ESI): 276 [M+H]+.
Стадия 2: Синтез этил 1-(4-метоксибензил)-4,6-диоксо-4,5,6,7-тетрагидро-1H-пиразоло[3,4-b]пиридин-5-карбоксилата
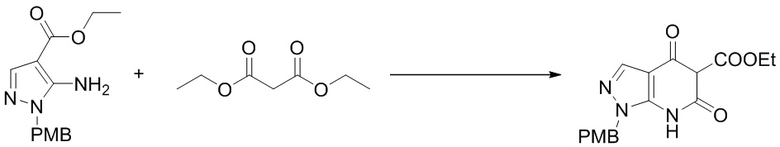
Этоксид натрия (84,0 г, 1,24 ммоль) растворяли в этаноле (600 мл) и охлаждали до 0°C (в ледяной бане). Добавляли диэтилмалонат (198 г, 1,24 моль) и убирали ледяную баню. Реакционный раствор перемешивали при комнатной температуре в течение 20 минут. Добавляли этил 5-амино-1-(4-метоксибензил)-1H-пиразол-4-карбоксилат (85 г, 0,31 моль) и реакционный раствор перемешивали при кипячении с обратным холодильником в течение 4 дней. Реакционный раствор концентрировали при сниженном давлении для удаления этанола. В остаток добавляли воду (1,5 л) и нейтрализовали его уксусной кислотой до pH -5. Получившийся белый сухой остаток фильтровали под вакуумом, промывали водой (500 мл), сушили под вакуумом с получением этил 1-(4-метоксибензил)-4,6-диоксо-4,5,6,7-тетрагидро-1H-пиразоло[3,4-b]пиридин-5-карбоксилата (100,8 г, выход: 95%). МС, m/z (ESI): 344 [M+H]+.
Стадия 3: Синтез 1-(4-метоксибензил)-1H-пиразоло[3,4-b]пиридин-4,6-диола
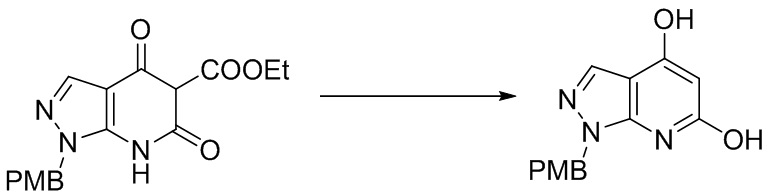
Этил 1-(4-метоксибензил)-4,6-диоксо-4,5,6,7-тетрагидро-1H-пиразоло[3,4-b]пиридин-5-карбоксилат (100,8 г, 0,29 моль) растворяли в 25% водном растворе NaOH (700 мл) и проводили реакцию при кипячении с обратным холодильником в течение 15 часов. Реакционный раствор охлаждали до 0℃, разбавляли водой (1 л) и медленно нейтрализовали уксусной кислотой до pH -5. Получившийся белый сухой остаток фильтровали под вакуумом и промывали водой (1 л). Отфильтрованный осадок высушивали под вакуумом с получением 1-(4-метоксибензил)-1H-пиразоло[3,4-b]пиридин-4,6-диола (78,0 г, выход: 98%). МС, m/z (ESI): 272 [M+H]+.
Стадия 4: Синтез 4,6-дихлор-1-(4-метоксибензил)-1H-пиразоло[3,4-b]пиридина

1-(4-метоксибензил)-1H-пиразоло[3,4-b]пиридин-4,6-диол (30,0 г, 110 ммоль) и фенилфосфонилдихлорид (62,7 мл, 442 ммоль) перемешивали при температуре 170°C в течение 7 часов для проведения реакции. Реакционный раствор охлаждали до комнатной температуры и разбавляли дихлорметаном (200 мл). Получившийся смешанный раствор медленно вливали в водоледяную смесь, которую интенсивно перемешивали, и нейтрализовали концентрированным водным аммиаком до PH -7, экстрагировали дихлорметаном (2*300 мл), сушили при помощи безводного сульфата натрия и фильтровали. Фильтрат концентрировали. Остаток разделяли колоночной хроматографией [петролейный эфир/этилацетат=0-8%] с получением 4,6-дихлор-1-(4-метоксибензил)-1H-пиразоло[3,4-b]пиридина (18,3 г, выход: 53%). МС, m/z (ESI): 308/310 [M+H]+.
Стадия 5: Синтез 4,6-дихлор-1H-пиразоло[3,4-b]пиридина
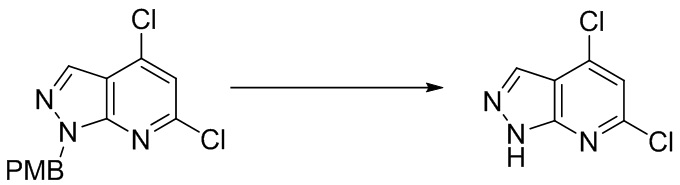
4,6-дихлор-1-(4-метоксибензил)-1H-пиразоло[3,4-b]пиридин (28,0 г, 90,9 ммоль) растворяли в трифторуксусной кислоте (84 мл) и перемешивали при температуре 60°C в течение 17 часов для проведения реакции. Реакционный раствор концентрировали, остаток разбавляли этилацетатом (500 мл) и промывали насыщенным раствором бикарбоната натрия (200 мл), а органическую фазу сушили над безводным сульфатом натрия и фильтровали под вакуумом. Фильтрат концентрировали, остаток разделяли колоночной хроматографией [элюент: петролейный эфир/этилацетат = 0-8%] с получением 4,6-дихлор-1H-пиразоло[3,4-b]пиридина (15,3 г, выход: 90%). МС, m/z (ESI): 188/190 [M+H]+.
Стадия 6: Синтез (2R,3R,4R,5R)-2-(ацетоксиметил)-5-(4,6-дихлор-1H-пиразоло[3,4-b]пиридин-1-ил)тетрагидрофуран-3,4-диил диацетата
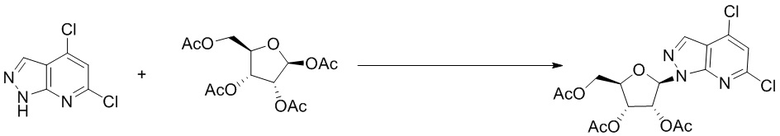
4,6-дихлор-1H-пиразоло[3,4-b]пиридин (3,0 г, 16,0 ммоль) растворяли в гексаметилдисилазане (30 мл). Добавляли сульфат аммония (421 мг, 3,2 ммоль). Реакционный раствор перемешивали при температуре 150°C в течение 3,5 часов для проведения реакции, подвергали ротационному выпариванию под сниженным давлением для удаления гексаметилдисилазана. Остаток растворяли в ацетонитриле (60 мл) и добавляли (2S,3R,4R,5R)-5-(ацетоксиметил)тетрагидрофуран-2,3,4-триилтриацетат (5,59 г, 17,6 ммоль). Реакционный раствор охлаждали до 0°C (в ледяной бане), медленно по каплям добавляли триметилсилилтрифторметансульфонат (4,33 мл, 24,0 ммоль), после чего реакционный раствор медленно нагревали до комнатной температуры и перемешивали в течение ночи. Реакционный раствор концентрировали при сниженном давлении, добавили этилацетат (150 мл) в остаток и промыли его насыщенным раствором бикарбоната натрия (150 мл) для распределения. Водную фазу экстрагировали этилацетатом (2*100 мл). Органические фазы объединяли, сушили над безводным сульфатом натрия и фильтровали под вакуумом. Фильтрат концентрировали, а остаток подвергали колоночной хроматографии [элюент: петролейный эфир/этилацетат = 0-15%] с получением (2R,3R,4R,5R)-2-(ацетоксиметил)-5-(4,6-дихлор-1H-пиразоло[3,4-b]пиридин-1-ил)тетрагидрофуран-3,4-диил диацетата (4,98 г, выход: 70%). МС, m/z (ESI): 446/448 [M+H]+.
Получение промежуточного вещества 22 (2R,3R,4R,5R)-2-(ацетоксиметил)-5-(4,6-дихлор-1H-пиразоло[3,4-d]пиримидин-1-ил)тетрагидрофуран-3,4-диил диацетата
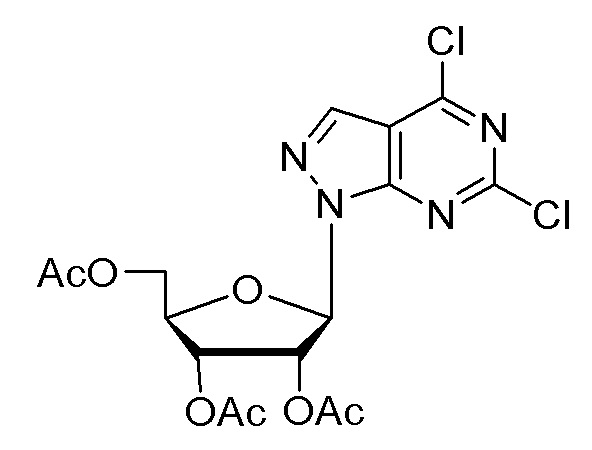
Стадия 1: Синтез (2R,3R,4R,5R)-2-(ацетоксиметил)-5-(4,6-дихлор-1H-пиразоло[3,4-d]пиримидин-1-ил)тетрагидрофуран-3,4-диил диацетата
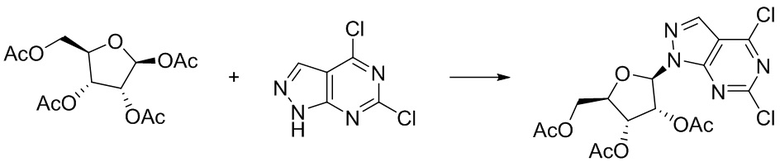
4,6-дихлор-1H-пиразоло[3,4-d]пиримидин (2,5 г, 13,2 ммоль) растворяли в гексаметилдисиламине (15 мл). Добавляли сульфат аммония (20 мг, 0,15 ммоль) в каталитическом количестве. Затем реакционный раствор нагревали до кипячения с обратным холодильником (при 135°C) в течение 3 часов. Затем реакционный раствор центрифугировали до сухого состояния. Добавляли ацетонитрил (30 мл) и (2S,3R,4R,5R)-5-(ацетоксиметил)тетрагидрофуран-2,3,4-триилтриацетат (5,06 г, 15,9 ммоль). Реакционный раствор охлаждали до 0°C. Добавляли триметилсилилтрифторметансульфонат (2,7 мл). Затем реакционный раствор нагревали до комнатной температуры и перемешивали в течение 24 часов. После завершения реакции насыщенный солевой раствор использовали для остановки реакции. Реакционный раствор два раза экстрагировали этилацетатом. Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, концентрировали и подвергали колоночной хроматографии с получением (2R,3R,4R,5R)-2-(ацетоксиметил)-5-(4,6-дихлор-1H-пиразоло[3,4-d]пиримидин-1-ил)тетрагидрофуран-3,4-диил диацетата (5,0 г, выход: 84%). МС, m/z (ESI): 447 [M+H]+.
II. Получение соединений в качестве примеров
Пример 1. Получение (((((2R,3S,4R,5R)-5-(6-хлор-4-(((R)-1-(4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-d]пиримидин-1-ил)-3,4-дигидрокситетрагидрофуран-2-ил)метокси)(гидрокси)фосфорил)метил)фосфоновой кислоты
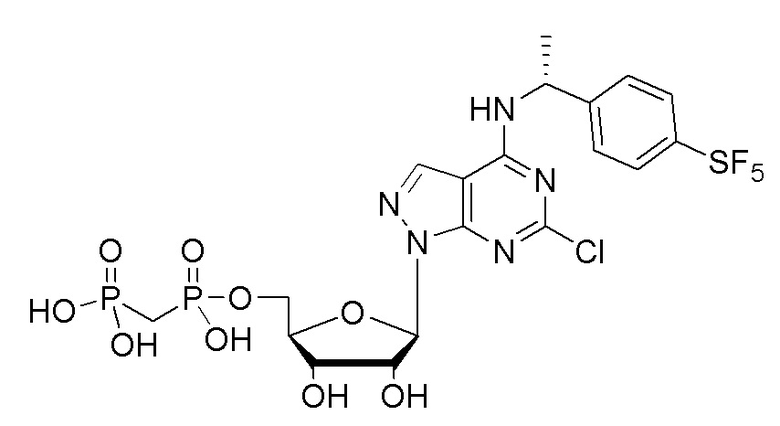
Стадия 1: Синтез (2R,3R,4R,5R)-2-(ацетоксиметил)-5-(6-хлор-4-(((R)-1-(4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-d]пиримидин-1-ил)тетрагидрофуран-3,4-диил диацетата
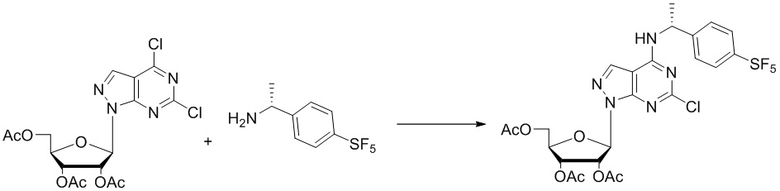
(2R,3R,4R,5R)-2-(ацетоксиметил)-5-(4,6-дихлор1H-пиразоло[3,4-d]пиримидин-1-ил)тетрагидрофуран-3,4-диилдиацетат (200 мг, 0,55 ммоль) и R)-1-(4-(пентафтор-λ6-сульфанил)фенил)этан-1-амин (140 мг, 0,46 ммоль) растворяли в тетрагидрофуране (5 мл). Затем добавляли N,N-диизопропилэтиламин (217 мг, 1,68 ммоль). Реакционный раствор нагревали до 60℃ и перемешивали в течение 2 часов. После завершения реакции реакционный раствор концентрировали до сухого состояния с получением (2R,3R,4R,5R)-2-(ацетоксиметил)-5-(6-хлор-4-(((R)-1-(4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-d]пиримидин-1-ил)тетрагидрофуран-3,4-диил диацетата, который использовали в полученном виде на следующей стадии. МС, m/z (ESI): 658 [M+H]+.
Стадия 2: Синтез (2R,3R,4S,5R)-2-(6-хлор-4-(((R)-1-(4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-d]пиримидин-1-ил)-5-(гидроксиметил)тетрагидрофуран-3,4-диола
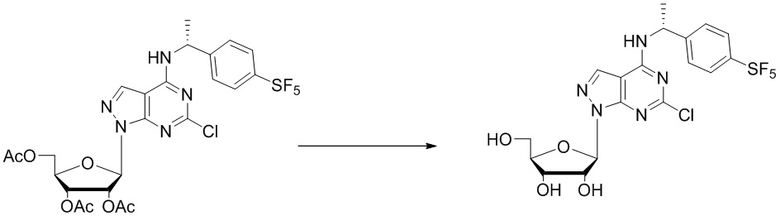
((2R,3R,4R,5R)-2-(ацетоксиметил)-5-(6-хлор-4-(((R)-1-(4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-d]пиримидин-1-ил)тетрагидрофуран-3,4-диилдиацетат (0,30 г, 0,45 ммоль) растворяли в метаноле (5 мл). Добавляли излишек сухого остатка метоксида натрия для проведения реакции при комнатной температуре в течение 3 часов. Затем 1/1000 водный раствор муравьиной кислоты (200 мл) добавляли для остановки реакции. Получившийся реакционный раствор лиофилизировали и затем разделяли обращенно-фазовой колоночной хроматографией [колонка C18, элюент: вода-вода/ацетонитрил (0-100)] с получением (2R,3R,4S,5R)-2-(6-хлор-4-(((R)-1-(4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-d]пиримидин-1-ил)-5-(гидроксиметил)тетрагидрофуран-3,4-диола (120 мг, выход: 49%). МС, m/z (ESI): 532 [M+H]+.
Стадия 3: Синтез (((((2R,3S,4R,5R)-5-(6-хлор-4-(((R)-1-(4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-d]пиримидин-1-ил)-3,4-дигидрокситетрагидрофуран-2-ил)метокси)(гидрокси)фосфорил)метил)фосфоновой кислоты

(2R,3R,4S,5R)-2-(6-хлор-4-(((R)-1-(4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-d]пиримидин-1-ил)-5-(гидроксиметил)тетрагидрофуран-3,4-диол (60 мг, 0,12 ммоль) растворяли в триметилфосфате (2,5 мл). Метиленфосфоний бисхлорид (112 мг, 0,48 ммоль) в растворе триметилфосфата (0,5 мл) по каплям добавляли при температуре 0°C, после чего поддерживали температуру в течение 3 часов для проведения реакции. Добавляли небольшое количества льда для остановки реакции. Затем реакционный раствор разделяли обращенно-фазовой колоночной хроматографией [колонка C18, элюент: вода-вода/ацетонитрил (5:1)] с получением (((((2R,3S,4R,5R)-5-(6-хлор-4-(((R)-1-(4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-d]пиримидин-1-ил)-3,4-дигидрокситетрагидрофуран-2-ил)метокси)(гидрокси)фосфорил)метил)фосфоновой кислоты (30 мг, выход: 18%). МС, m/z (ESI): 690 [M+H]+.
1H ЯМР (400 МГц, D2O) δ 8,14 (s, 1H), 7,81–7,60 (m, 2H), 7,57–7,35 (m, 2H), 6,21-5,88 (m, 1H), 5,44-5,16 (m, 1H), 4,99-4,76 (m, 1H), 4,54-4,40 (m, 1H), 4,26-4,11 (m, 1H), 4,02-3,83 (m, 2H), 2,13 (t, J = 20,1 Гц, 2H), 1,73-1,30 (m, 3H).
Соединения примеров 2-4 были получены в соответствии с методом синтеза примера 1:
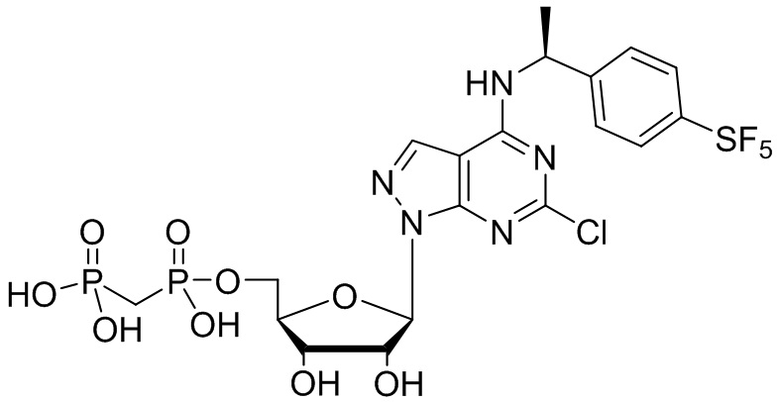
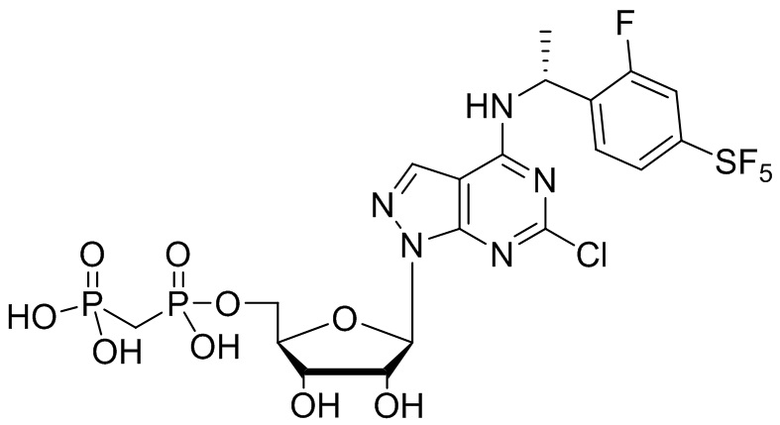
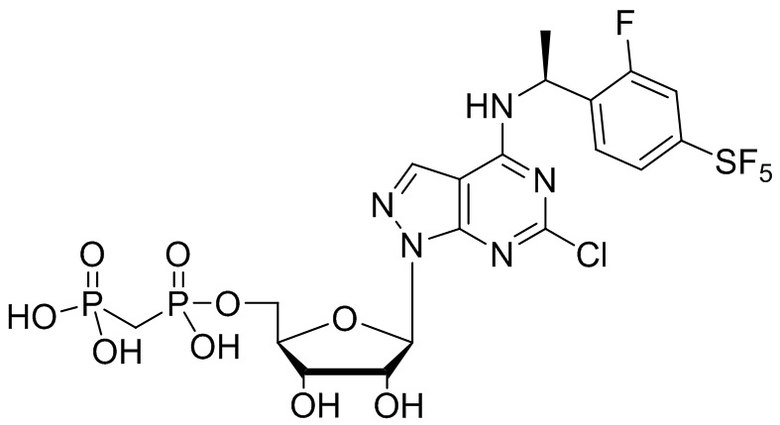
Данные о соединениях, полученных методом ЯМР-спектроскопии, полученных в вышеуказанных примерах:
Пример 5. Получение (((((2R,3S,4R,5R)-5-(6-хлор-4-(((S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-b]пиридин-1-ил)-3,4-дигидрокситетрагидрофуран-2-ил)метокси)(гидрокси)фосфорил)метил)фосфоновой кислоты
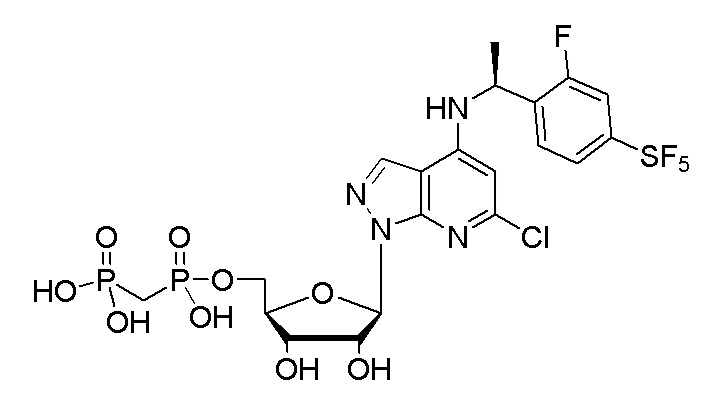
Стадия 1: Синтез (2R,3R,4R,5R)-2-(ацетоксиметил)-5-(6-хлор-4-(((S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-b]пиридин-1-ил)тетрагидрофуран-3,4-диил диацетата
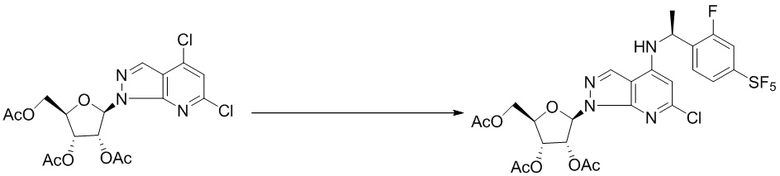
(2R,3R,4R,5R)-2-(ацетоксиметил)-5-(4,6-дихлор-1H-пиразоло[3,4-b]пиридин-1-ил)тетрагидрофуран-3,4-диил диацетат (730 мг, 1,65 ммоль) и (S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этан-1-амин (600 мг, 1,98 ммоль) растворяли в N-метилпирролидоне (15 мл), а затем добавляли N,N-диизопропилэтиламин (608 мг, 4,95 ммоль). Реакционный раствор нагревали до 90℃ и перемешивали в течение 40 часов. После завершения реакции реакционный раствор разбавляли водой и экстрагировали этилацетатом. Органические фазы объединяли, концентрировали и разделяли колоночной хроматографией [элюент: петролейный эфир-петролейный эфир/этилацетат (40%)] с получением (2R,3R,4R,5R)-2-(ацетоксиметил)-5-(6-хлор-4-(((S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-b]пиридин-1-ил)тетрагидрофуран-3,4-диил диацетата (360 мг, выход: 32%). МС, m/z (ESI): 675 [M+H]+.
Стадия 2: Синтез (2R,3R,4S,5R)-2-(6-хлор-4-(((S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-b]пиридин-1-ил)-5-(гидроксиметил)тетрагидрофуран-3,4-диола

(2R,3R,4R,5R)-2-(ацетоксиметил)-5-(6-хлор-4-(((S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-b]пиридин-1-ил)тетрагидрофуран-3,4-диил диацетат (0,32 г, 0,48 ммоль) растворяли в метаноле (20 мл). Добавляли карбонат калия (0,19 г, 1,44 ммоль) для проведения реакции при комнатной температуре в течение 1 часа. Затем 1/1000 водный раствор муравьиной кислоты (200 мл) добавляли для остановки реакции. Получившийся реакционный раствор лиофилизировали и затем разделяли обращенно-фазовой колоночной хроматографией [колонка C18 , элюент: вода-вода/ацетонитрил (0-70%)] с получением (2R,3R,4S,5R)-2-(6-хлор-4-(((S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-b]пиридин-1-ил)-5-(гидроксиметил)тетрагидрофуран-3,4-диола (240 мг, выход: 91%). МС, m/z (ESI): 549 [M+H]+.
Стадия 3: Синтез (((((2R,3S,4R,5R)-5-(6-хлор-4-(((S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-b]пиридин-1-ил)-3,4-дигидрокситетрагидрофуран-2-ил)метокси)(гидрокси)фосфорил)метил)фосфоновой кислоты
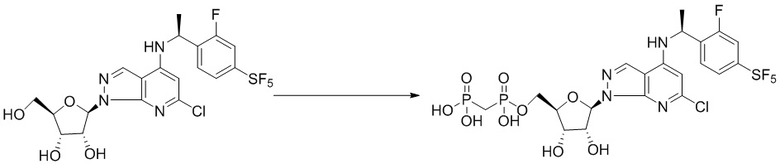
(2R,3R,4S,5R)-2-(6-хлор-4-(((S)1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-b]пиридин-1-ил)-5-(гидроксиметил)тетрагидрофуран-3,4-диол (240 мг, 0,44 ммоль) растворяли в триметилфосфате (3 мл). Метиленфосфоний бисхлорид (436 мг, 1,75 ммоль) в растворе триметилфосфата (0,5 мл) по каплям добавляли при температуре 0°C, после чего поддерживали температуру в течение 3 часов для проведения реакции. Добавляли небольшое количества льда для остановки реакции. Затем реакционный раствор разделяли обращенно-фазовой колоночной хроматографией [колонка C18, элюент: вода-вода/ацетонитрил (5:1)] с получением (((((2R,3S,4R,5R)-5-(6-хлор-4-(((S)-1-(2-фтор-4-(пентафтор-λ6-сульфанил)фенил)этил)амино)-1H-пиразоло[3,4-b]пиридин-1-ил)-3,4-дигидрокситетрагидрофуран-2-ил)метокси)(гидрокси)фосфорил)метил)фосфоновой кислоты (90 мг, выход: 29%). МС, m/z (ESI): 707 [M+H]+.
1H ЯМР (400 МГц, ДМСО-d6+D2O) δ 8,38 (s, 1H), 7,96 (dd, J=10,4, 1,6 Гц, 1H), 7,76 (dd, J=8,4, 1,6 Гц, 1H), 7,62 (t, J=8,0 Гц, 1H), 6,08 (d, J=4,4 Гц, 1H), 6,03 (s, 1H), 5,15 - 5,13 (m, 1H), 4,53 (t, J=4,8 Гц, 1H), 4,26 (t, J=4,0 Гц, 1H), 4,04 - 4,02 (m, 2H), 3,86-3,83 (m, 1H), 2,12 (t, J= 20,0 Гц, 2H), 1,59 (d, J=6,8 Гц, 3H).
Соединения примеров 6-22 были получены в соответствии с методом синтеза примера 5:

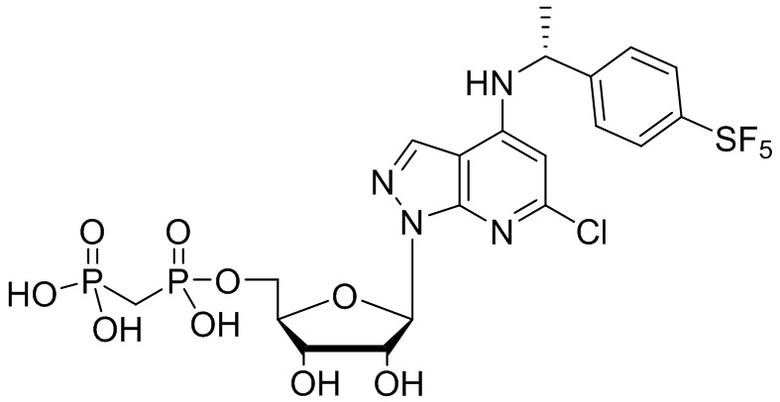
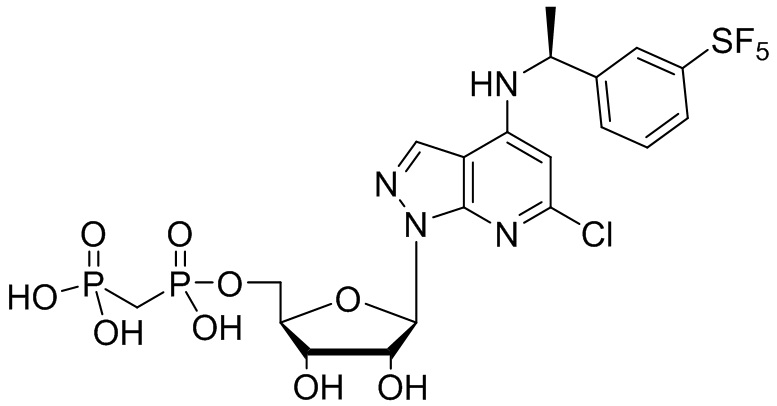
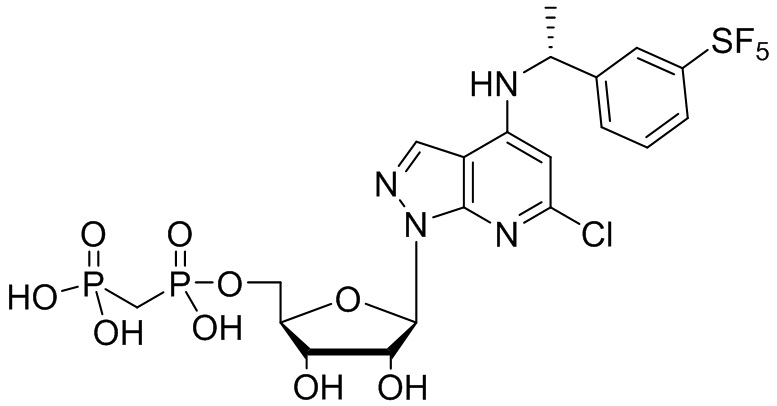
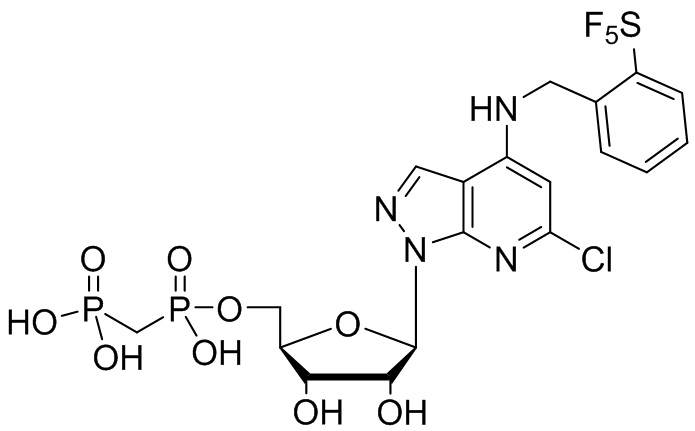
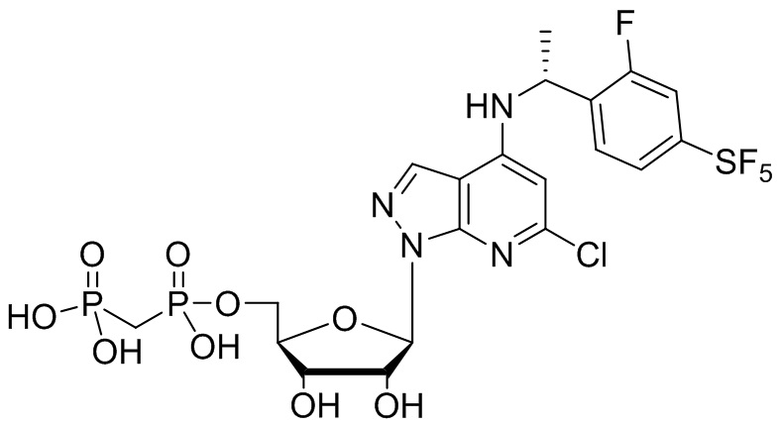

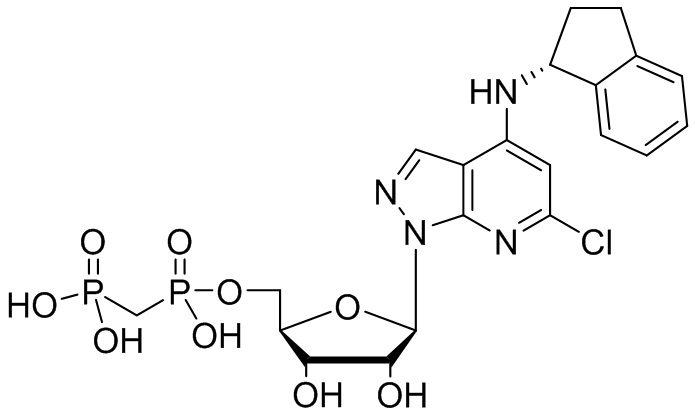
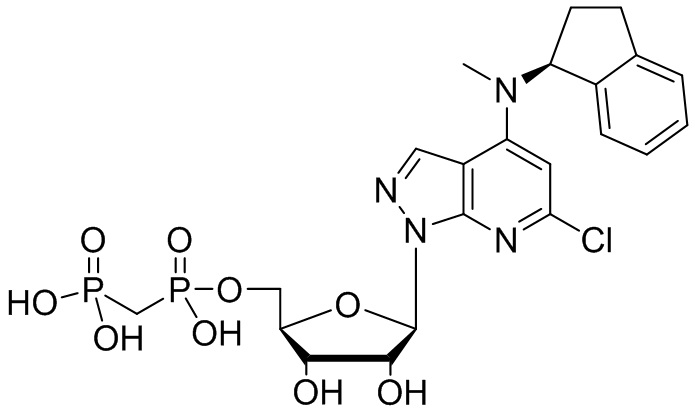
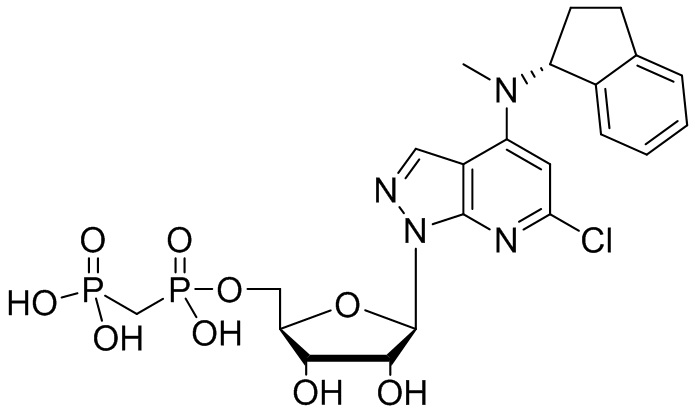
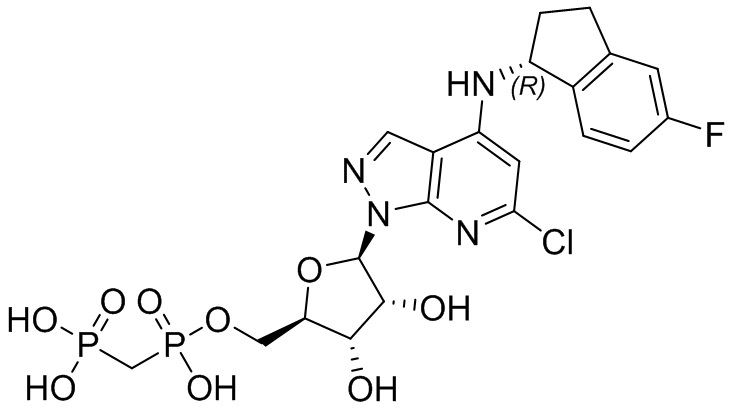
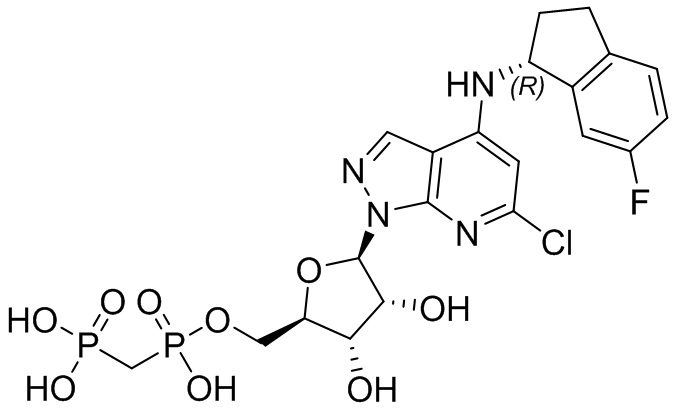
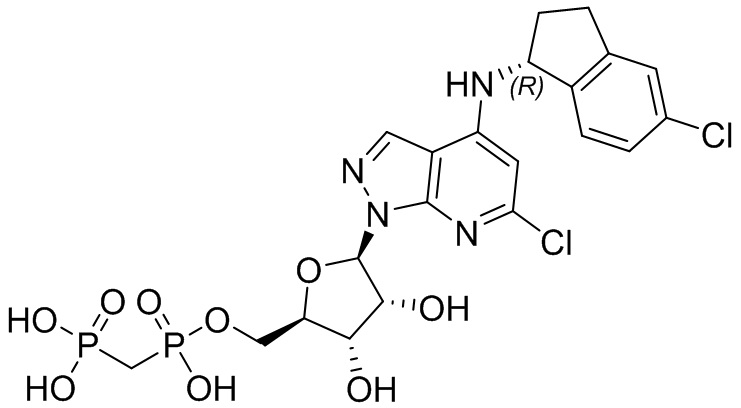
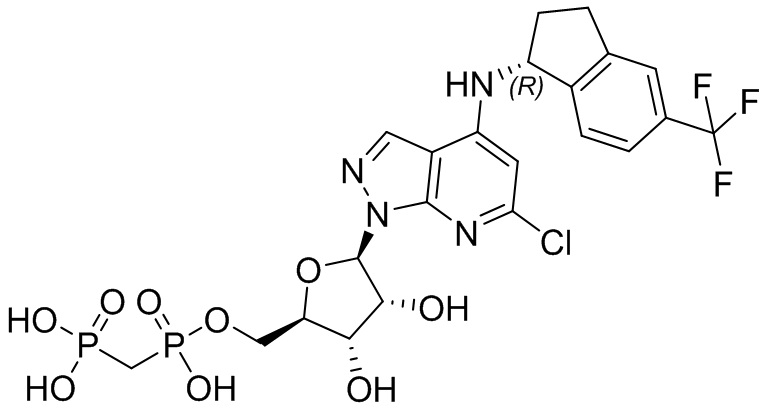

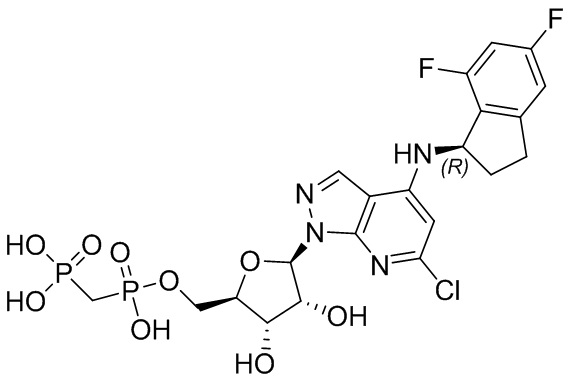
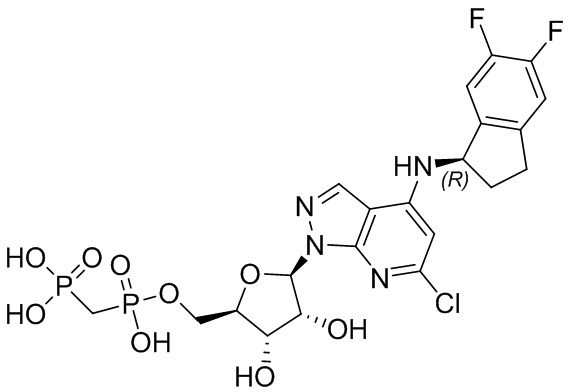
Данные о соединениях, полученных методом ЯМР-спектроскопии, полученных в вышеуказанных примерах:
Пример 23. Получение (((((2R,3S,4R,5R)-5-(4-(((R)-5,7-дифтор-2,3-дигидро-1H-инден-1-ил)амино)-6-метил-1H-пиразоло[3,4-b]пиридин-1-ил)-3,4-дигидрокситетрагидрофуран-2-ил)метокси)(гидрокси)фосфорил)метил)фосфоновой кислоты
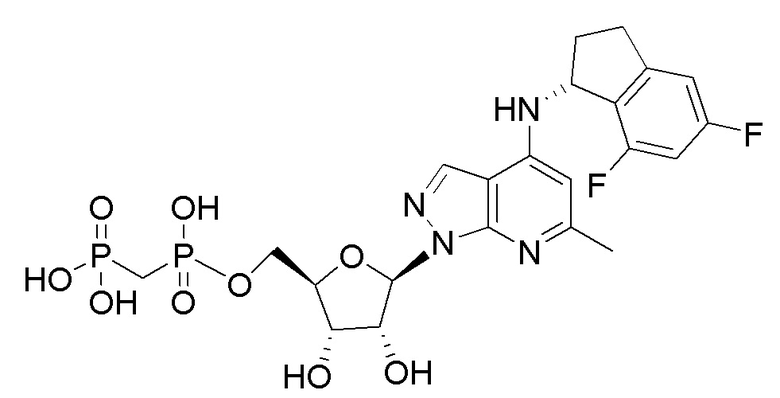
Стадия 1: Синтез (2R,3R,4S,5R)-2-(4-(((R)-5,7-дифтор-2,3-дигидро-1H-инден-1-ил)амино)-6-метил-1H-пиразоло[3,4-b]пиридин-1-ил)-5-(гидроксиметил)тетрагидрофуран-3,4-диола
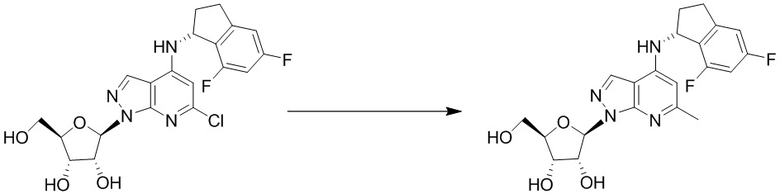
(2R,3R,4S,5R)-2-(6-хлор-4-(((R)-5,7-дифтор-2,3-дигидро-1H-инден-1-ил)амино)-1H-пиразоло[3,4-b]пиридин-1-ил)-5-(гидроксиметил)тетрагидрофуран-3,4-диол (0,48 г, 1,06 ммоль) растворяли в диоксане/воде (8 мл/2 мл). Добавляли карбонат калия (0,44 г, 3,18 ммоль), тетракистрифенилфосфин палладий (0,37 г, 0,32 ммоль) и 2,4,6-триметил-1,3,5,2,4,6-триоксатрибороциклогексан (0,40 г, 3,18 ммоль) в присутствии азота. Реакционный раствор запаивали и подвергали микроволновому облучению при температуре 130°C в течение 3 часов. Этилацетат (30 мл) добавляли в реакционный раствор, который затем промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали, концентрировали и затем разделяли обращенно-фазовой колоночной хроматографией [колонка C18, элюент: вода-вода/ацетонитрил (0-100%)] с получением (2R,3R,4S,5R)-2-(4-(((R)-5,7-дифтор-2,3-дигидро-1H-инден-1-ил)амино)-6-метил-1H-пиразоло[3,4-b]пиридин-1-ил)-5-(гидроксиметил)тетрагидрофуран-3,4-диола (255 мг, выход: 53%). МС, m/z (ESI): 433 [M+H]+.
Стадия 2: Синтез (((((2R,3S,4R,5R)-5-(4-(((R)-5,7-дифтор-2,3-дигидро-1H-инден-1-ил)амино)-6-метил-1H-пиразоло[3,4-b]пиридин-1-ил)-3,4-дигидрокситетрагидрофуран-2-ил)метокси)(гидрокси)фосфорил)метил)фосфоновой кислоты
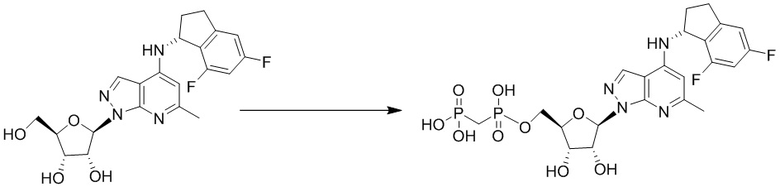
(2R,3R,4S,5R)-2-(4-(((R)-5,7-дифтор-2,3-дигидро-1H-инден-1-ил)амино)-6-метил-1H-пиразоло[3,4-b]пиридин-1-ил)-5-(гидроксиметил)тетрагидрофуран-3,4-диол (255 мг, 0,59 ммоль) растворяли в триметилфосфате (3,0 мл). Метиленфосфоний бисхлорид (515 мг, 2,06 ммоль) в растворе триметилфосфата (2,0 мл) по каплям добавляли при температуре 0°C, после чего поддерживали температуру в течение 3 часов для проведения реакции. Добавляли небольшое количество льда для остановки реакции, а реакционный раствор перемешивали при поддерживаемой текущей температуре в течение 10 минут. Добавляли насыщенный раствор бикарбоната натрия для урегулирования уровня pH ≥ 8, реакционный раствор перемешивали при комнатной температуре в течение 5 часов, а затем разделяли обращенно-фазовой колоночной хроматографией [колонка C18, элюент: вода-вода/ацетонитрил (5:1)] с получением (((((2R,3S,4R,5R)-5-(4-(((R)-5,7-дифтор-2,3-дигидро-1H-инден-1-ил)амино)-6-метил-1H-пиразоло[3,4-b]пиридин-1-ил)-3,4-дигидрокситетрагидрофуран-2-ил)метокси)(гидрокси)фосфорил)метил)фосфоновой кислоты (136,5 мг, выход: 35%). МС, m/z (ESI): 591 [M+H]+.
1H ЯМР (400 МГц, D2O) δ 8,15 (s, 1H), 6,99 (d, J=8,8 Гц, 1H), 6,83 (t, J=9,8 Гц, 1H), 6,48 (d, J=3,0 Гц, 1H), 6,39 (d, J=5,4 Гц, 1H), 5,51 (s, 1H), 4,93 (t, J=5,6 Гц, 1H), 4,62 (t, J=5,0 Гц, 1H), 4,33 (q, J=4,9 Гц, 1H), 4,07 (hept, J=5,4 Гц, 2H), 3,24 – 3,11 (m, 1H), 3,04 – 2,93 (m, 1H), 2,64 (dq, J=15,4, 8,1, 7,4 Гц, 1H), 2,53 (s, 3H), 2,25 – 2,15 (m, 1H), 2,05 (t, J=19,6 Гц, 2H).
Соединение примера 24 было получено в соответствии с методом синтеза примера 23:
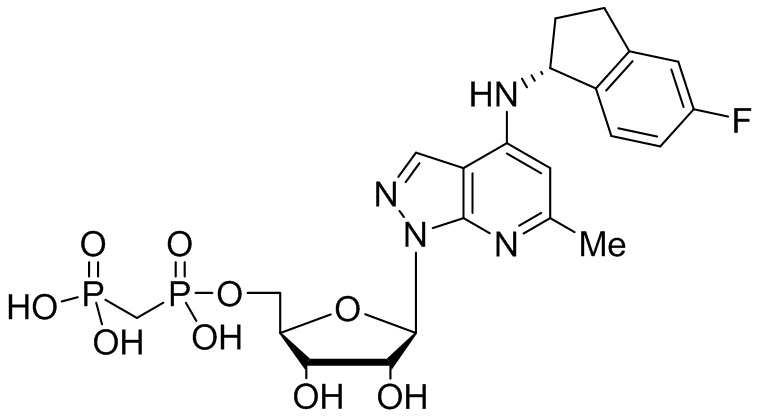
Данные о соединениях, полученных методом ЯМР-спектроскопии, полученных в вышеуказанных примерах:
Пример 25. Получение (((((1R,2R,3S,4S)-4-(2-хлор-4-(((R)-2,3-дигидро-1H-инден-1-ил)амино)пирроло[2,1-f][1,2,4]триазин-7-ил)-2,3-дигидроксициклопентил)метокси)(гидрокси)фосфорил)метил)фосфоновой кислоты
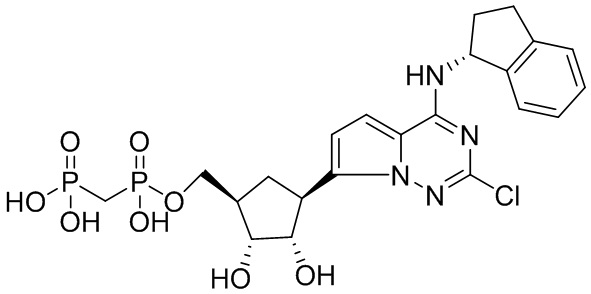
Стадия 1: Синтез 7-((3aR,4R,6aS)-4-(трет-бутоксиметил)-2,2-диметил-3a,6a-дигидро-4H-циклопента[d][1,3]диоксол-6-ил)-2-хлор-N-((R)-2,3-дигидро-1H-инден-1-ил)пирроло[2,1-f][1,2,4]триазин-4-амина
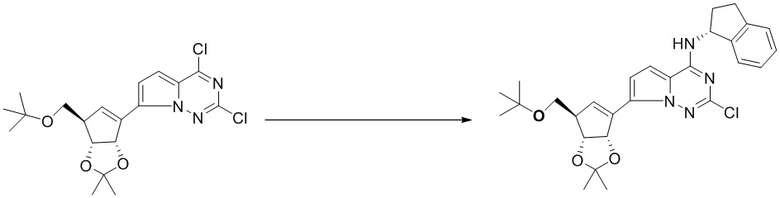
7-((3aR,4R,6aS)-4-(трет-бутоксиметил)-2,2-диметил-3a,6a-дигидро-4H-циклопента[d][1,3]диоксол-6-ил)-2,4-дихлорпирроло[2,1-f][1,2,4]триазин (500 мг, 1,21 ммоль) и (R)-2,3-дигидро-1H-инден-1-амин (326 мг, 2,42 ммоль) растворяли в 1,4-диоксане (20 мл), а затем добавляли N,N-диизопропилэтиламин (446 мг, 3,63 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 4 часов. После завершения реакции получившийся реакционный раствор разбавляли водой и экстрагировали этилацетатом. Органические фазы объединяли, концентрировали и разделяли колоночной хроматографией [элюент: петролейный эфир-петролейный эфир/этилацетат (20%)] с получением 7-((3aR,4R,6aS)-4-(трет-бутоксиметил)-2,2-диметил-3a,6a-дигидро-4H-циклопента[d][1,3]диоксол-6-ил)-2-хлор-N-((R)-2,3-дигидро-1H-инден-1-ил)пирроло[2,1-f][1,2,4]триазин-4-амина (670 мг, выход: 91%). МС, m/z (ESI): 509 [M+H]+.
Стадия 2: Синтез (1R,2S,5R)-5-(трет-бутоксиметил)-3-(2-хлор-4-(((R)-2,3-дигидро-1H-инден-1-ил)амино)пирроло[2,1-f][1,2,4]триазин-7-ил)циклопент-3-ен-1,2-диола
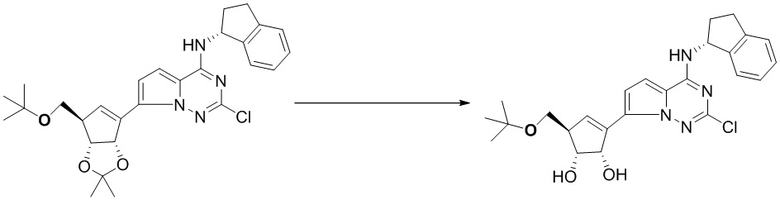
7-((3aR,4R,6aS)-4-(трет-бутоксиметил)-2,2-диметил-3a,6a-дигидро-4H-циклопента[d][1,3]диоксол-6-ил)-2-хлор-N-((R)-2,3-дигидро-1H-инден-1-ил)пирроло[2,1-f][1,2,4]триазин-4-амин (670 мг, 1,31 ммоль) растворяли в 90% уксусной кислоте (40 мл), нагревали до 60℃ и перемешивали в течение 16 часов. После завершения реакции реакционный раствор концентрировали, а затем разделяли колоночной хроматографией [элюент: дихлорметан-дихлорметан/метанол (10%)] с получением (1R,2S,5R)-5-(трет-бутоксиметил)-3-(2-хлор-4-(((R)-2,3-дигидро-1H-инден-1-ил)амино)пирроло[2,1-f][1,2,4]триазин-7-ил)циклопент-3-ен-1,2-диола (600 мг, выход: 97%). МС, m/z (ESI): 469 [M+H]+.
Стадия 3: Синтез (1S,2R,3R,5S)-3-(трет-бутоксиметил)-5-(2-хлор-4-(((R)-2,3-дигидро-1H-инден-1-ил)амино)пирроло[2,1-f][1,2,4]триазин-7-ил)циклопентан-1,2-диола

(1R,2S,5R)-5-(трет-бутоксиметил)-3-(2-хлор-4-(((R)-2,3-дигидро-1H-инден-1-ил)амино)пирроло[2,1-f][1,2,4]триазин-7-ил)циклопент-3-ен-1,2-диол (600 мг, 1,28 ммоль) и катализатор Крэбтри (100 мг) растворяли в дихлорметане (100 мл), а затем гидрогенизовали при комнатной температуре и перемешивали в течение 16 часов. После завершения реакции реакционный раствор концентрировали, а затем разделяли колоночной хроматографией [элюент: петролейный эфир-петролейный эфир/этилацетат (50%)] с получением (1S,2R,3R,5S)-3-(трет-бутоксиметил)-5-(2-хлор-4-(((R)-2,3-дигидро-1H-инден-1-ил)амино)пирроло[2,1-f][1,2,4]триазин-7-ил)циклопентан-1,2-диола (500 мг, выход: 83%). МС, m/z (ESI): 471 [M+H]+.
Стадия 4: Синтез (1R,2S,3S,5R)-3-(2-хлор-4-(((R)-2,3-дигидро-1H-инден-1-ил)амино)пирроло[2,1-f][1,2,4]триазин-7-ил)-5-(гидроксиметил)циклопентан-1,2-диола
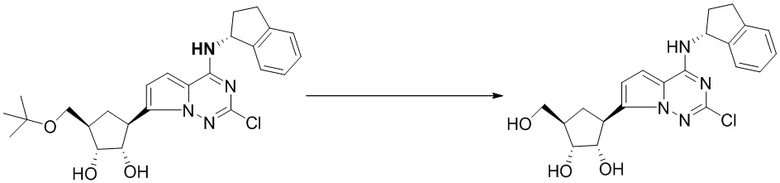
(1S,2R,3R,5S)-3-(трет-бутоксиметил)-5-(2-хлор-4-(((R)-2,3-дигидро-1H-инден-1-ил)амино)пирроло[2,1-f][1,2,4]триазин-7-ил)циклопентан-1,2-диол (500 мг, 1,06 ммоль) растворяли в ацетонитриле (4 мл). Добавляли раствор гидрохлорида диоксана (4 мл, 1 н) добавляли для проведения реакции при комнатной температуре в течение 1 часа. Затем реакционный раствор концентрировали и затем разделяли обращенно-фазовой колоночной хроматографией [колонка C18, элюент: вода-вода/ацетонитрил (0-50%)] с получением (1R,2S,3S,5R)-3-(2-хлор-4-(((R)-2,3-дигидро-1H-инден-1-ил)амино)пирроло[2,1-f][1,2,4]триазин-7-ил)-5-(гидроксиметил)циклопентан-1,2-диола (200 мг, выход: 46%). МС, m/z (ESI): 415 [M+H]+.
Стадия 5: Синтез (((((1R,2R,3S,4S)-4-(2-хлор-4-(((R)-2,3-дигидро-1H-инден-1-ил)амино)пирроло[2,1-f][1,2,4]триазин-7-ил)-2,3-дигидроксициклопентил)метокси)(гидрокси)фосфорил)метил)фосфоновой кислоты
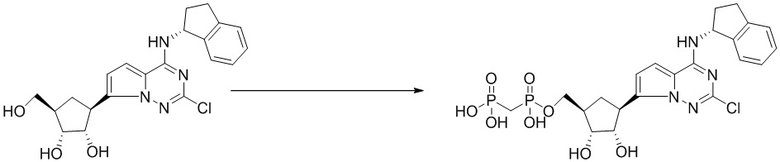
(1R,2S,3S,5R)-3-(2-хлор-4-(((R)-2,3-дигидро-1H-инден-1-ил)амино)пирроло[2,1-f][1,2,4]триазин-7-ил)-5-(гидроксиметил)циклопентан-1,2-диол (200 мг, 0,48 ммоль) растворяли в триметилфосфате (3 мл). Метиленфосфоний бисхлорид (481 мг, 1,93 ммоль) в растворе триметилфосфата (0,5 мл) по каплям добавляли при температуре 0°C, после чего поддерживали температуру в течение 3 часов для проведения реакции. Добавляли небольшое количества льда для остановки реакции. Затем реакционный раствор разделяли обращенно-фазовой колоночной хроматографией [колонка C18, элюент: вода-вода/ацетонитрил (5:1)] с получением (((((1R,2R,3S,4S)-4-(2-хлор-4-(((R)-2,3-дигидро-1H-инден-1-ил)амино)пирроло[2,1-f][1,2,4]триазин-7-ил)-2,3-дигидроксициклопентил)метокси)(гидрокси)фосфорил)метил)фосфоновой кислоты (65 мг, выход: 24%). МС, m/z (ESI): 573 [M+H]+.
1H ЯМР (400 МГц, ДМСО-d6+D2O) δ 7,31 - 7,17 (m, 4H), 6,99 (d, J=4,4 Гц, 1H), 6,54 (d, J=4,4 Гц, 1H), 5,82 (t, J=8,0 Гц, 1H), 4,00 - 3,90 (m, 3H), 3,80 - 3,78 (m, 1H), 3,59 - 3,51 (m, 1H), 3,05 - 3,00 (m, 1H), 2,93 - 2,85 (m, 1H), 2,56 - 2,51 (m, 2H), 2,33 - 2,19 (m, 3H), 2,04 - 2,00 (m, 1H), 1,30 - 1,27 (m, 1H).
Соединения примеров 26-39 были получены в соответствии с методом синтеза примера 25:
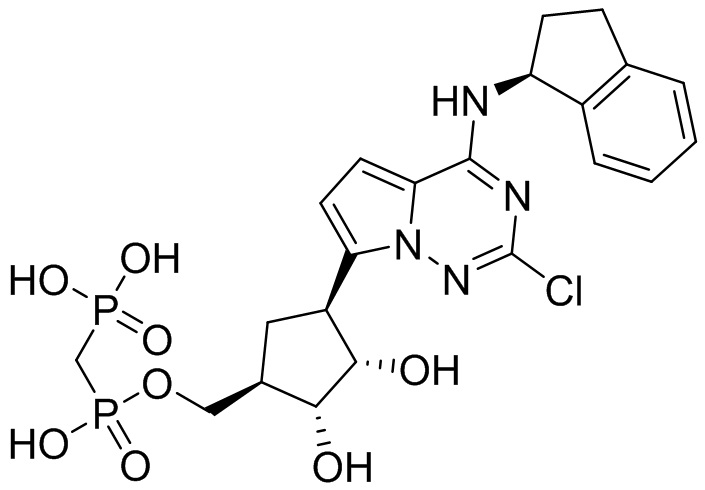

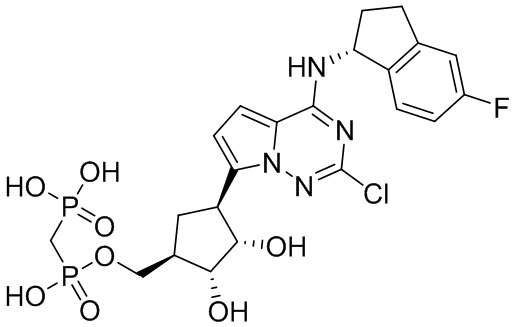
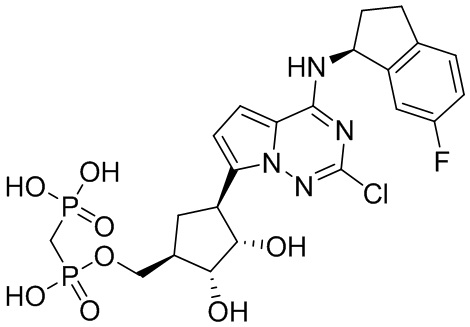
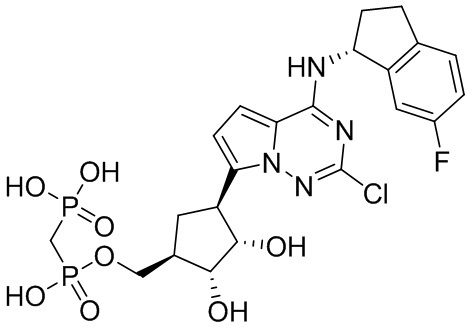
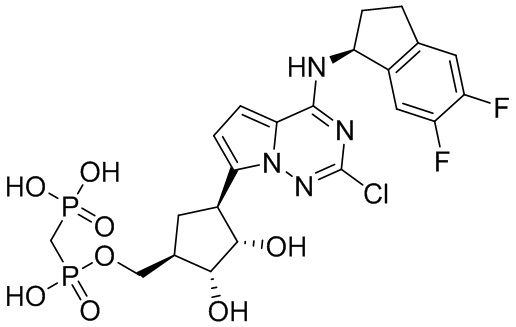
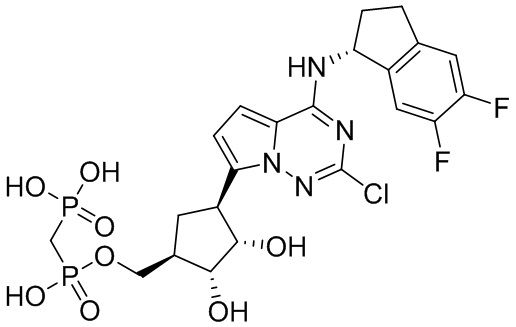
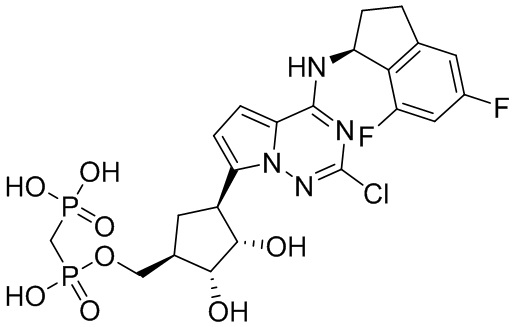
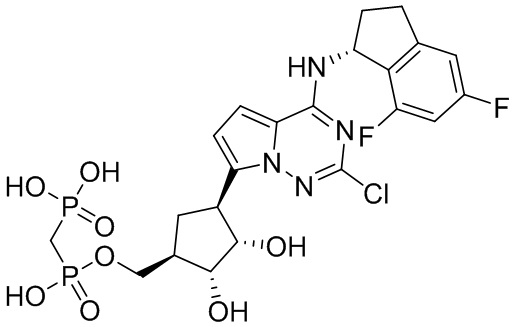
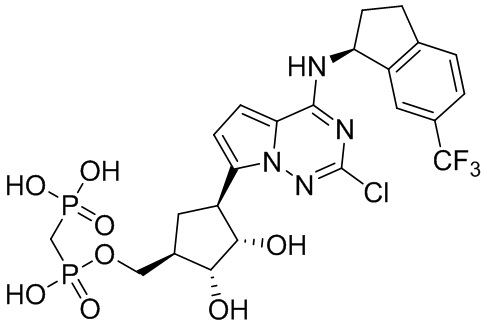
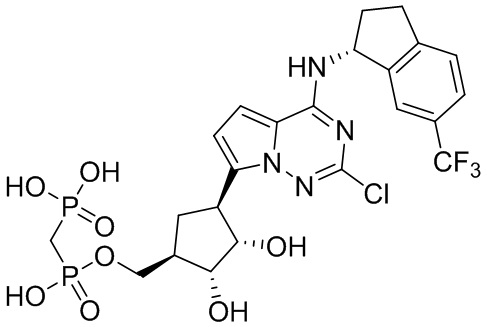
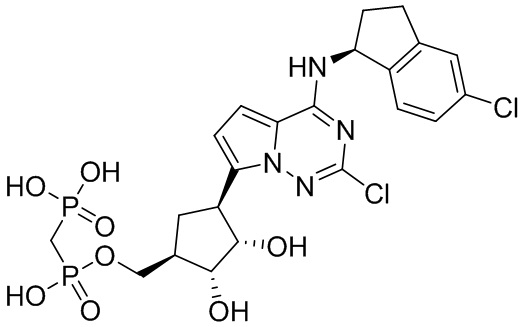

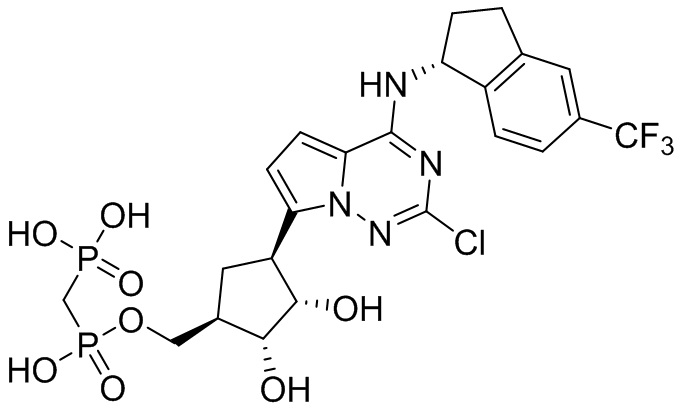
Данные о соединениях, полученных методом ЯМР-спектроскопии, полученных в вышеуказанных примерах:
Оценка в ходе биологического анализа
I. Ферментативная активность in vitro в отношении CD73
В настоящем изобретении для определения характеристик ингибирующей активности соединений по отношению к CD73 проводили тест с малахитовым зеленым и использованием растворимого CD73, синтезируемого in vitro. Конкретная экспериментальная процедура была следующей:
1. В данном эксперименте ферментативную реакцию проводили в 384-луночных планшетах, CD73 (R&D systems #5795-EN-010) в концентрации 36 нг/мл, соединения в различных концентрациях и АМФ в концентрации 50 мкмоль инкубировали при температуре 25°C в течение 30 минут в реакционной системе 40 мкл (состоящей из Трис-буфера 25 мМ с pH 7,5, MgCl2 5 мМ и 0,005% Tween-20);
2. Затем добавляли 10 мкл раствора малахитового зеленого (Sigma) в каждую лунку для остановки реакции;
3. Определяли концентрацию получившегося неорганического фосфата в соответствии с инструкциями производителя реагентов;
4. На основе концентрации продукта рассчитывали ферментативную активность CD73, а затем определяли значения IC50 методом нелинейного регрессионного анализа процента ингибирования при различных концентрациях соединений настоящего изобретения. Результаты примеров настоящего изобретения показаны в Таблице 1.
II. Ингибирование ферментативной активности CD73 на поверхности клеток (эксперимент с помощью анализа CellTiter-Glo (CTG))
В настоящем изобретении клетки рака молочной железы человека MDA-MB-231, которые эндогенно экспрессируют CD73, использовали для оценки способности соединения ингибировать ферментативную активность CD73, который экспрессируется на поверхности клеток. Использованные в эксперименте клетки были взяты из банка клеток Китайской академии наук. Конкретная экспериментальная процедура была следующей:
1. Перед испытанием клетки MDA-MB231 засеяли в 96-луночный планшет по 20000 клеток в одну лунку;
2. Клетки культивировали в среде RPMI1640 с 10% фетальной бычьей сывороткой (Gibco, 10099-141) и инкубировали в атмосфере с 5% CO2 при температуре 37°C в течение ночи (перед испытание клетки промывали три раза с помощью бессывороточной среды RPMI);
3. К клеткам добавляли 50 мкл бессывороточной среды, содержащей соединения в различных концентрациях, и затем инкубировали клетки в течение 15 минут;
4. Добавляли 25 мкл АМФ 1,2 мМ для инкубации при температуре 37°C в течение 2 часов, затем с клеток собрали 25 мкл кондиционированной среды и перемешали с 25 мкл АТФ 100 мМ, после чего с помощью CTG (Promega, #G7573) определяли концентрацию АМФ в пробах.
5. Затем количественно определяли коэффициент уменьшения уровня субстратного уровня АМФ в собранной после реакции кондиционированной клеточной культуральной среде, чтобы оценить ингибирующее действие примеров настоящего изобретения и положительных соединений в отношении ферментативной активности CD73 на поверхности клеток;
6. В итоге с помощью кривой четырехпараметрической нелинейной логистической модели, подобранной в Graphpad Prism, определяли концентрацию соединения, при которой происходит половинное максимальное ингибирование ферментативной активности (IC50). Результаты примеров настоящего изобретения показаны в Таблице 1.
Таблица 1 Результаты биологического анализа
примера
примера
По данным активности определенных примеров можно заметить, что соединения, описанные в настоящем изобретении, оказывают сильное ингибирующее действие на ферментативную и клеточную активности CD73.
Все документы, упомянутые в настоящем изобретении, включены посредством ссылки, так же как каждый документ цитируется отдельно в виде ссылки. Кроме того, следует понимать, что специалисты в данной области, ознакомившись с вышеизложенными идеями настоящего изобретения, могут внести различные модификации или изменения, и эти эквивалентные формы также входят в объем формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ БИАРИЛА, МЕТОД ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2768830C2 |
| ИНГИБИТОР FGFR, МЕТОД ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2771526C1 |
| ПРОИЗВОДНОЕ N-(АЗААРИЛ)ЦИКЛОЛАКТАМ-1-КАРБОКСАМИДА, МЕТОД ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2765785C2 |
| FGFR И ЕГО ИНГИБИТОР МУТАЦИЙ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2811207C1 |
| АРИЛЬНЫЕ, ГЕТЕРОАРИЛЬНЫЕ И ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ОПОСРЕДОВАННЫХ КОМПЛЕМЕНТОМ РАССТРОЙСТВ | 2015 |
|
RU2707749C2 |
| ПРОИЗВОДНОЕ 1,2,3,4-ТЕТРАГИДРОХИНОКСАЛИНА, МЕТОД ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2804127C2 |
| СОЕДИНЕНИЕ, ИНГИБИРУЮЩЕЕ ОБРАЗОВАНИЕ КОМПЛЕКСА С-MYC/MAX/ДНК | 2017 |
|
RU2727177C1 |
| ПРОИЗВОДНЫЕ 2-АМИНОПИРИДИНА ИЛИ 2-АМИНОПИРИМИДИНА В КАЧЕСТВЕ ЦИКЛИНЗАВИСИМЫХ ИНГИБИТОРОВ КИНАЗЫ | 2019 |
|
RU2790006C2 |
| ПРОИЗВОДНЫЕ 2-АМИНОПИРИДИНА ИЛИ 2-АМИНОПИРИМИДИНА В КАЧЕСТВЕ ЦИКЛИНЗАВИСИМЫХ ИНГИБИТОРОВ КИНАЗЫ | 2019 |
|
RU2762557C1 |
| Регулятор на основе азотсодержащего гетероциклического производного, способ его получения и его применение | 2020 |
|
RU2829553C2 |
Группа изобретений относится к области органической химии и фармацевтики и направлена на соединения, которые представляют собой ингибиторы CD73. Раскрыто соединение формулы (IIb) или формулы (IIc), его стереоизомер или фармацевтически приемлемая соль, где X1 представляет собой СН в формуле (IIb); Y представляет собой О в формуле (IIb); где X1 представляет собой N в формуле (IIc); Y представляет собой CH2 в формуле (IIc); каждый R1 независимо выбран из водорода, галогена, С1-4 алкила, где С1-4 алкил опционально замещен одним или несколькими галогенами; R4 представляет собой водород или С1-4 алкил; R5 представляет собой водород, галоген или С1-4 алкил; R6 и R7 каждый независимо выбран из водорода или гидрокси; R8 и R9 каждый независимо выбран из водорода или гидрокси; R10, R11 и R12 представляет собой водород; q независимо выбран из 0, 1, 2 или 3; и m независимо выбран из 0, 1 или 2. Кроме того, раскрыт способ получения указанных выше соединений, фармацевтическая композиция для лечения заболеваний, которые по крайней мере частично опосредуются CD73, включающая соединение формулы (IIb) или формулы (IIc), и применение указанных соединений для получения лекарственных средств для заболеваний, которые по крайней мере частично опосредуются CD73. Группа изобретений обеспечивает эффективное лечение заболеваний, которые, по крайней мере частично, опосредуются CD73. 5 н. и 15 з.п. ф-лы, 1 табл., 39 пр.
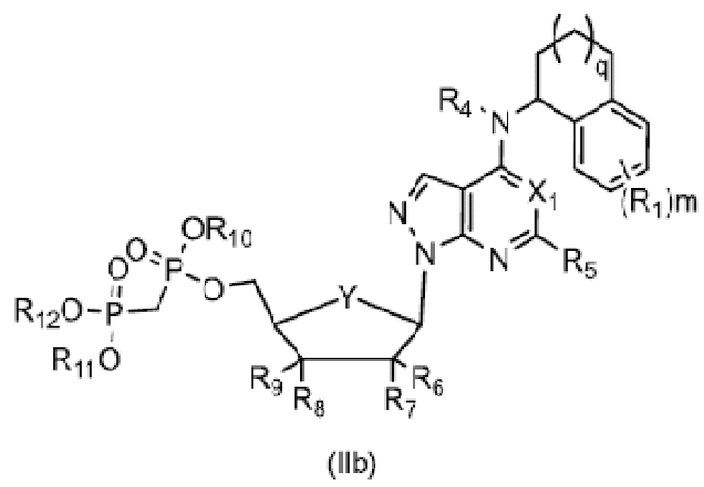
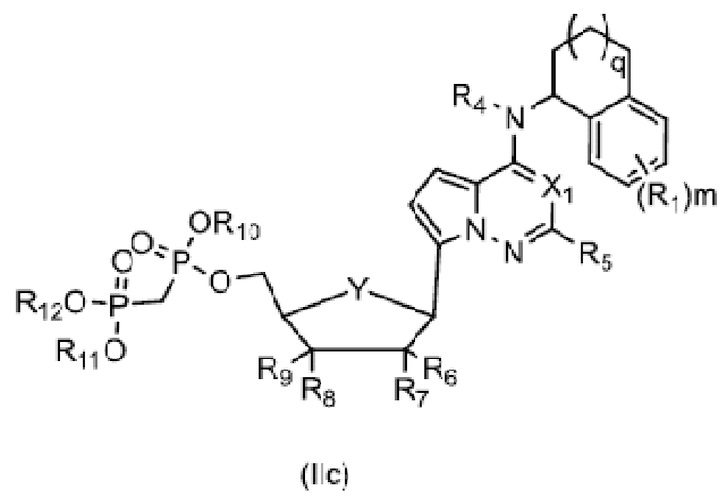
1. Соединение формулы (IIb) или формулы (IIc), его стереоизомер или фармацевтически приемлемая соль формулы

где X1 представляет собой СН в формуле (IIb); Y представляет собой О в формуле (IIb);
где X1 представляет собой N в формуле (IIc); Y представляет собой CH2 в формуле (IIc);
каждый R1 независимо выбран из водорода, галогена, С1-4 алкила, где С1-4 алкил опционально замещен одним или несколькими галогенами;
R4 представляет собой водород или С1-4 алкил;
R5 представляет собой водород, галоген или С1-4 алкил;
R6 и R7 каждый независимо выбран из водорода или гидрокси;
R8 и R9 каждый независимо выбран из водорода или гидрокси;
R10, R11 и R12 представляет собой водород;
q независимо выбран из 0, 1, 2 или 3; и
m независимо выбран из 0, 1 или 2.
2. Соединение формулы (IIb) или формулы (IIc), его стереоизомер или фармацевтически приемлемая соль по п. 1, где соединение формулы (IIb) представляет собой соединение, структура которого описывается формулой (IIIb)
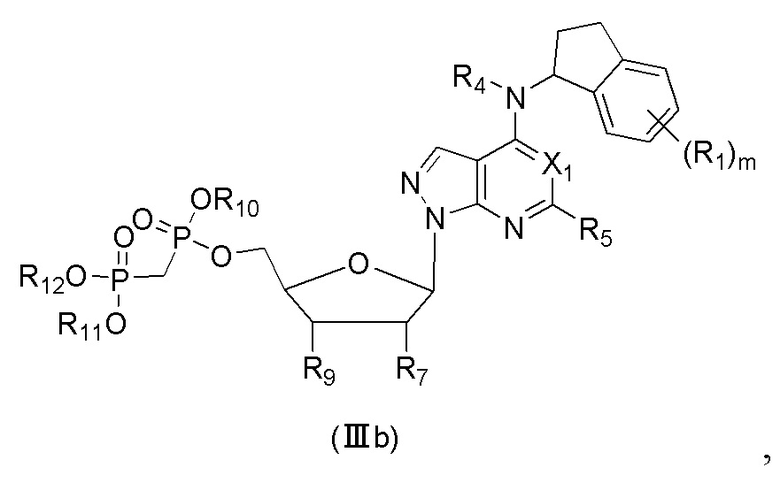
где X1 представляет собой CH;
каждый R1 выбран из водорода, F, Cl, метилa, этила, н-пропила, изопропила, дифторметилa или трифторметилa;
R4 выбран из водорода, метила, этила, н-пропила или изопропила;
R5 выбран из водорода, F, Cl, метила, этила, н-пропила или изопропила;
R7 выбран из водорода или гидрокси;
R9 выбран из водорода или гидрокси;
R10, R11 и R12 представляют собой водород; и
m выбран из 0, 1 или 2.
3. Соединение формулы (IIb) или формулы (IIc), его стереоизомер или фармацевтически приемлемая соль по п. 1, где соединение формулы (IIc) представляет собой соединение, структура которого описывается формулой (IIIс)
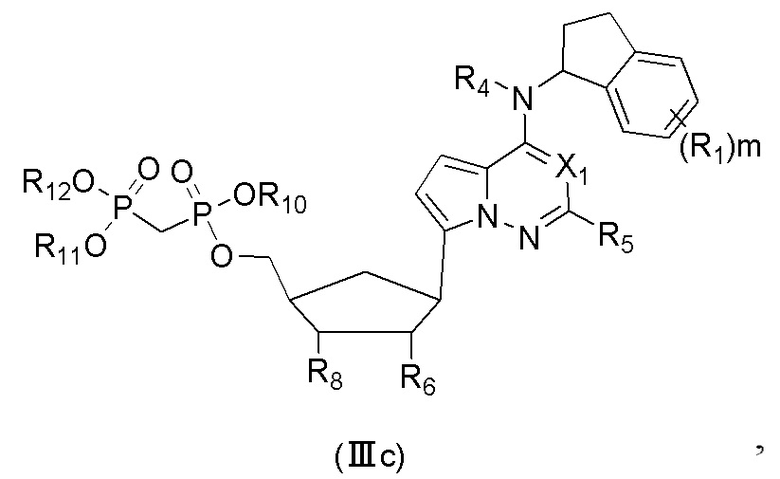
где X1 представляет собой N;
каждый R1 выбран из водорода, F, Cl, метилa, этила, н-пропила, изопропила, дифторметилa или трифторметилa;
R4 выбран из водорода, метила, этила, н-пропила, или изопропила;
R5 выбран из водорода, F, Cl, метила, этила, н-пропила или изопропила;
R6 выбран из водорода или гидрокси;
R8 выбран из водорода или гидрокси;
R10, R11 и R12 представляют собой водород; и
m выбран из 0, 1, 2 или 3.
4. Соединение формулы (IIb) или формулы (IIc), его стереоизомер или фармацевтически приемлемая соль по любому из пп. 1-3, где соединение выбрано из следующих соединений:
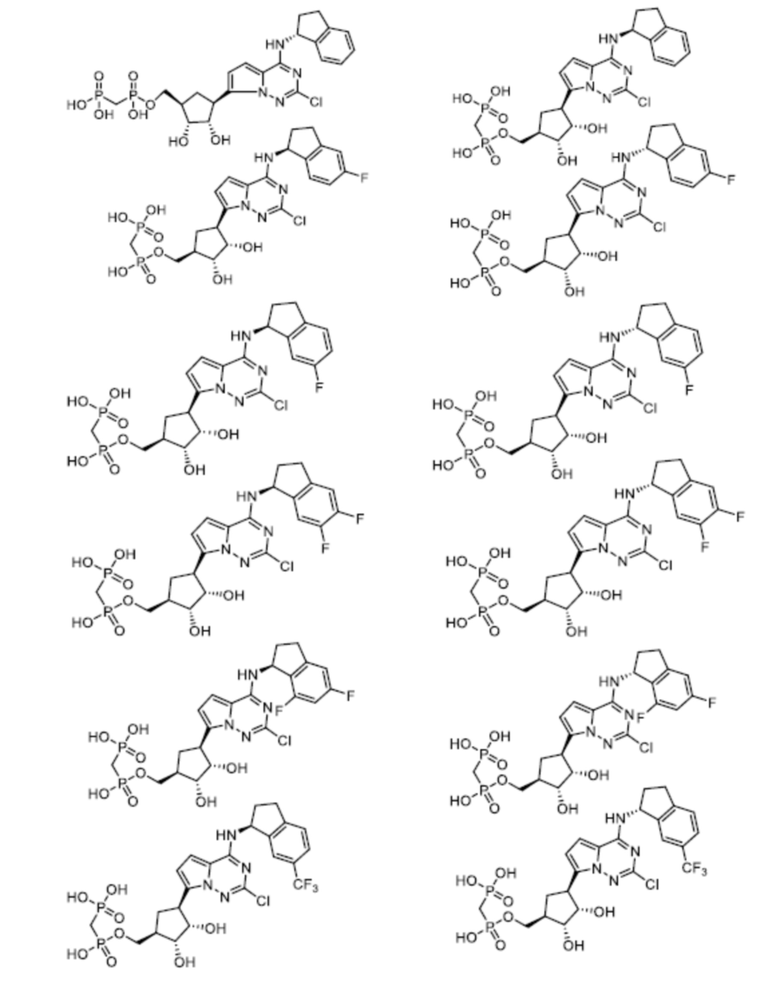
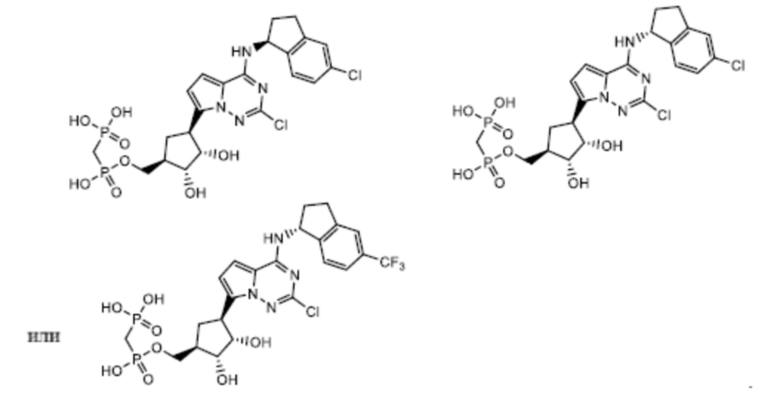
5. Способ получения соединения формулы (IIb) или формулы (IIc) его стереоизомера или фармацевтически приемлемой соли по п. 1, включающий следующие стадии:
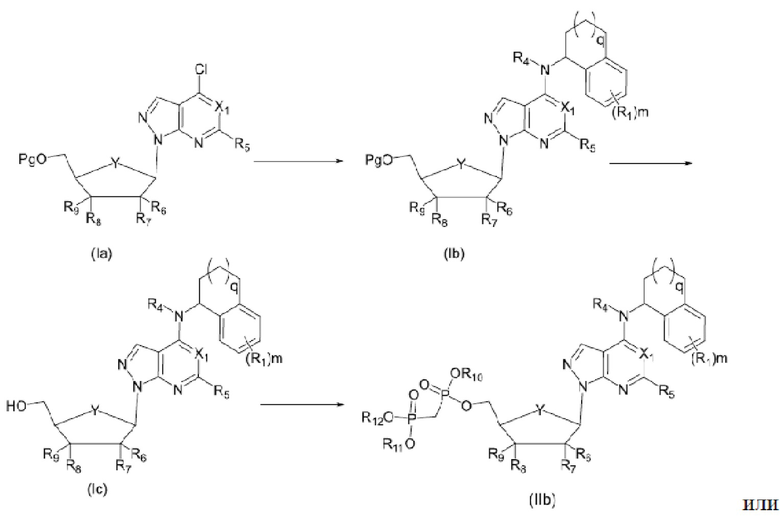
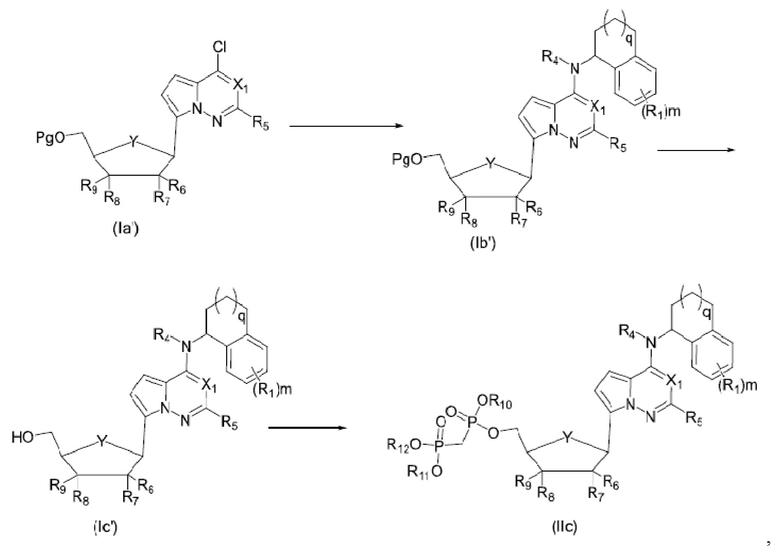
где Pg представляет собой защитную группу для гидроксильной группы, выбранную из группы, состоящей из алканоильной или кремниевой защитной группы; X1, Y, R1, R4, R5, R6, R7, R8, R9, R10, R11, R12, m и q соответствуют таковым в п.1.
6. Фармацевтическая композиция для лечения заболеваний, которые по крайней мере частично опосредуются CD73, включающая соединение формулы (IIb) или формулы (IIc), его стереоизомер или фармацевтически приемлемую соль по любому из пп. 1-4, а также фармацевтически приемлемый носитель.
7. Применение соединения формулы (IIb) или формулы (IIc), его стереоизомера или фармацевтически приемлемой соли по любому из пп. 1-4 для получения лекарственных средств для лечения злокачественных новообразований или опухолей, иммунозависимых заболеваний и расстройств, а также метаболических заболеваний, которые по крайней мере частично опосредуются CD73.
8. Применение по п. 7, где злокачественные новообразования или опухоли выбраны из группы, включающей рак простаты, рак толстой кишки, рак прямой кишки, рак поджелудочной железы, рак желудка, рак эндометрия, рак шейки матки, рак головного мозга, рак печени, рак мочевого пузыря, рак яичника, рак яичка, рак головы и шеи, рак кожи, рак мезотелия, рак крови, рак пищевода, рак молочной железы, опухоль мышечной ткани, опухоль соединительной ткани, рак легкого, рак надпочечника, рак щитовидной железы, рак почки, рак костей, опухоль головного мозга, глиобластому, мезотелиому, почечно-клеточный рак, саркому, хориокарциному, эпидермальный базально-клеточный рак и семиному.
9. Применение по п. 8, где злокачественное новообразование или опухоль выбирают из группы, состоящей из меланомы, рака толстой кишки, рака поджелудочной железы, рака молочной железы, рака предстательной железы, рака легких, лейкоза, опухоли головного мозга, лимфомы, рака яичников и саркомы Капоши.
10. Применение по п. 8, где злокачественное новообразование или опухоль представляет собой рак кожи, при этом рак кожи представляет собой меланому или базально-клеточную карциному.
11. Применение по п. 8, где злокачественное новообразование или опухоль представляет собой рак крови, при этом рак крови представляет собой лимфому или лейкоз.
12. Применение по п. 8, где злокачественное новообразование или опухоль представляет собой рак легкого, при этом рак легкого представляет собой мелкоклеточный рак легкого или немелкоклеточный рак легкого.
13. Применение по п. 8, где злокачественное новообразование или опухоль представляет собой саркому, при этом саркома представляет собой саркому Капоши.
14. Применение по п. 7, где иммунозависимые заболевания и расстройства выбраны из группы, включающей ревматоидный артрит, почечную недостаточность, красную волчанку, астму, псориаз, язвенный колит, панкреатит, аллергию, фиброз, анемию, фибромиалгию, болезнь Альцгеймера, хроническую сердечную недостаточность, инсульт, аортальный стеноз, атеросклероз, остеопороз, болезнь Паркинсона, инфекцию, болезнь Крона, язвенный колит, аллергический контактный дерматит и аллергическую контактную экзему, системную склеродермию и рассеянный склероз.
15. Применение соединения формулы (IIb) или формулы (IIc), его стереоизомера или фармацевтически приемлемой соли по любому из пп. 1-4 в качестве лекарственных средств для лечения злокачественных новообразований или опухолей, аутоиммунных заболеваний и расстройств, а также метаболических заболеваний, которые по крайней мере частично опосредуются CD73.
16. Применение по п. 15, где злокачественное новообразование или опухоль, аутоиммунное заболевание и расстройство, а также метаболическое заболевание, которые по крайней мере частично опосредуются CD73, выбирается из рака простаты, рака толстой кишки, рака прямой кишки, рака поджелудочной железы, рака желудка, рака эндометрия, рака шейки матки, рака головного мозга, рака печени, рака мочевого пузыря, рака яичника, рака яичка, рака головы и шеи, рака кожи, рака мезотелия, рака крови, рака пищевода, рака молочной железы, опухоли мышечной ткани, опухоли соединительной ткани, рака легкого, рака надпочечника, рака щитовидной железы, рака почки, рака костей, опухоли головного мозга, глиобластомы, мезотелиомы, почечно-клеточного рака, саркомы, хориокарциномы, эпидермального базально клеточного рака, семиномы, ревматоидного артрита, почечной недостаточности, красной волчанки, астмы, псориаза, язвенного колита, панкреатита, аллергии, фиброза, анемии, фибромиалгии, болезни Альцгеймера, хронической сердечной недостаточности, инсульта, аортального стеноза, атеросклероза, остеопороза, болезни Паркинсона, инфекции, болезни Крона, язвенного колита, аллергического контактного дерматита и аллергической контактной экземы, системной склеродермии и рассеянного склероза.
17. Применение по п. 16, где рак кожи представляет собой меланому или базально-клеточную карциному.
18. Применение по п. 16, где рак крови представляет собой лимфому или лейкоз.
19. Применение по п. 16, где рак легкого представляет собой мелкоклеточный рак легкого или немелкоклеточный рак легкого.
20. Применение по п. 16, где саркома представляет собой саркому Капоши.
| WO 2018208980 A1, 15.11.2018 | |||
| WO 2017120508 A1, 13.07.2017 | |||
| WO 2018067424 A1, 12.04.2018 | |||
| RU 2014112319 A, 10.10.2015 | |||
| Свеклоуборочная машина | 1931 |
|
SU25341A1 |
Авторы
Даты
2023-01-09—Публикация
2020-04-27—Подача