Область техники
Изобретение относится к области фармакологии, а именно составу и способу получения противовоспалительного препарата, содержащего кетопрофен, в виде лиофилизата для приготовления суспензии частиц.
Уровень техники
Ревматоидный артрита (РА) - хроническое системное воспалительное заболевание, характеризующееся поражением суставов. Средняя распространенность заболевания в развитых странах колеблется в районе 0,5-1,0%. (Фоломеева О.М., Насонов Е.Л., Андрианова И.А., Галушко Е.А. и др. Ревматоидный артрит в ревматологической практике России: тяжесть заболевания в Российской популяции больных. Одномоментное (поперечное) эпидемиологическое исследование // Научно-практическая ревматология, 2010, №1, С. 51). Клиническая картина РА состоит из следующих проявлений: артралгия, припухлость, местное повышение температуры, снижение подвижности суставов, хронической боли, деформация суставов (повреждение суставных хрящей и краевых зон кости) и нарушение их двигательной активности.
Для терапии ревматоидного артрита используются три группы препаратов: базисные противовоспалительные препараты, глюкокортикоиды, нестероидные противовоспалительные препараты (НПВС). Группу НПВС применяют для симптоматического лечения РА. Механизм анальгезирующего и анестезирующего действия НПВС обусловлен ингибированием активности циклооксигеназ (ЦОГ-1 и ЦОГ-2). К числу наиболее эффективных НПВС относится кетопрофен, обладающий противовоспалительным, анальгезирующим и жаропонижающим действием (Чичасова Н.В., Имамединова Г.Р., Каратеев А.Е. и др. Эффективность и безопасность кетопрофена (кетонала) при ревматоидном артрите (клинико-эндоскопическое исследование) // Научно-практическая ревматология, 2001, №1, С. 46-49). Кетопрофен, ингибируя активность ЦОГ, приводит к угнетению синтеза простогландинов, которые играют главную роль в патогенезе воспаления и боли. Кроме того, препарат имеет антибрадикининовую активность, стабилизирует лизосомальные мембраны и задерживает высвобождение из них ферментов, способствующих разрушению тканей при хроническом воспалении. Также кетопрофен вызывает значительное торможение активности нейтрофилов, снижает выделение цитокинов.
При приеме внутрь кетопрофен достаточно быстро всасывается. Биодоступность составляет около 90%, Cmax в крови достигается через 0,5-2 ч после приема внутрь, через 1,4-4 ч - при ректальном введении, через 15-30 мин - при парентеральном введении и через 5-8 ч - после нанесения на кожу. Уровень кетопрофена в синовиальной жидкости ниже, чем в крови, но в пределах терапевтического, сохраняется на протяжении 6-8 ч (Регистр лекарственных средств России URL: https://www.rlsnet.ru/mnn_index_id_515.htm). Противовоспалительный эффект наступает к концу 1-й недели приема.
Кетопрофен относится к неселективным НПВС, так как не является селективным специфическим ингибитором ЦОГ-2 (Чичасова Н.В., Имамединова Г.Р., Каратеев А.Е. и др. Эффективность и безопасность кетопрофена (кетонала) при ревматоидном артрите (клинико-эндоскопическое исследование) // Научно-практическая ревматология, 2001, №1, С. 46-49). Неселективные НПВС ингибируют обе изоформы ЦОГ, поэтому их применение сопровождается высоким риском развития побочных эффектов, связанных с угнетением ЦОГ-1, изоформы, участвующей в синтезе простаноидов (простагландины, иростациклины, тромбоксаны). Причиной ульцерогенного действия является угнетение синтеза простагландинов группы Е, обладающих гастропротекторными свойствами за счет увеличения секреции слизи и гидрокарбонатного иона, уменьшения секреции соляной кислоты, улучшения кровообращения в слизистой оболочке желудка (Р.Н. Аляутдин. Фармакология. Изд. 2-е испр. Москва, 2004). Кроме того, за счет угнетения ЦОГ-1 подавляется агрегация тромбоцитов, что приводит к кровоизлиянию в желудочно-кишечный тракт (ЖКТ). Существуют и другие побочные эффекты препарата кетопрофена, которые достаточно ярко выражены со стороны ЖКТ - диспепсия, тошнота, рвота, абдоминальная боль, диарея/запор, метеоризм; анорексия, стоматит; гастрит, пептическая язва, изъязвление кишечника, кровотечение и перфорация ЖКТ, дисфункция печени, гепатит, холестатический гепатит, желтуха (Регистр лекарственных средств России URL: https://www.rlsnet.ru/mnn_index_id_515.htm).
Терапию НПВС назначают с учетом факторов риска, а именно, с учетом гастроинстенальных эффектов. Для приема внутрь для взрослых начальная суточная доза составляет 300 мг в 2-3 приема. Для поддерживающего лечения доза зависит от используемой лекарственной формы. Для лечения острых состояний или купирования обострения хронического процесса вводят 100 мг в виде однократной в/м инъекции. Режим дозирования устанавливают индивидуально с учетом тяжести течения заболевания и степени проявления побочных эффектов.
Сложность назначения рационального обезболивания при этом заключается в учете степени проявления побочных эффектов, тяжести заболевания, а также лекарственного взаимодействия, что затрудняет подбор оптимальных доз кетопрофена. Кроме того, при ведении больных ревматоидным артритом, принимающих комплексное лечения тремя и более препаратами, часто наблюдается несоблюдение рекомендованного режима фармакотерапии (кратности и дозировок лекарственных препаратов, как в сторону увеличения, так и уменьшения).
В последнее время ведутся разработки новых лекарственных форм кетопрофена пролонгированного или контролируемого высвобождения, направленные на повышение эффективности терапии, оптимизацию условий приема препарата пациентами, снижение риска побочных эффектов.
В патенте РФ №2448690 описано изобретение, касающееся разработки таблетированной формы пролонгированного действия с целью увеличения времени воздействия кетопрофена. Задачей изобретения являлось поддержание постоянной концентрации кетопрофена в крови и синовиальной жидкости при двухразовом приеме таблеток с интервалом 12 часов. Это достигается за счет включения в лекарственную форму двух компонентов, замедляющих высвобождение активного вещества: гидроксипропилметилцеллюлозы (ГПМЦ) и Коллидона® SR. Предложенная комбинация пролонгирующих веществ позволила получить оптимальное высвобождение активного компонента. Получаемый лекарственный препарат стабилен при хранении. Однако в описании изобретения не содержится информации об анальгетической и противовоспалительной активности разработанной лекарственной формы.
В заявке РФ №2011133020 описаны фармацевтические суспензии модифицированного высвобождения для перорального введения. Данные суспензии содержат микрочастицы, состоящие из ядра, содержащего активное вещество, и покрытия из нерастворимого в воде полимера; В качестве покрытия используют полиакрилаты Eudragit® RS, Eudragit® RSPO, Eudragit® RL или полимеры целлюлозы, например, этилцеллюлозу, гидроксилэтилцеллюлозу, ацетат целлюлозы или их смеси. В составе ядра используют липидное вещество: пчелиный воск, карнаубский воск, цетил пальмитат, Compritol® 888 АТО (глицерил бегенат), глицерил моностеарат, прецирол АТО (глицерил пальмитостеарат), гидрогенизированное касторовое масло, парафин, стеариновую кислоту, стериловый спирт, глицерил тримиристат (Dynasan® 114), гелюцир, Sterotex® К или их смеси. Лекарственное вещество выбирается из широкой группы, включающей такие препараты как парацетамол, нимесулид, диклофенак натрия, индометацин, кетопрофен, дифлунизал, пироксикам, напроксен, левоцетиризин, дезлоратадин, фексофенадин, аспирин, глипизид, глибурид, глимепирид, гликлазид, метформин, розиглитазон, пиоглитазон. В состав композиции также входят вспомогательные вещества такие как модификаторы вязкости, ингибиторы комкования, in situ загуститель, тиксотропные средства, антиоксиданты, красители, вкусовые добавки, подсластители, консерванты, средства, способствующие скольжению, хелатирующие средства, пластификаторы, наполнители, смачивающие средства, комплексообразователи, буферные средства, консерванты, суспендирующие средства, модификаторы высвобождения, используемые либо отдельно, либо в их комбинации. Размер микрочастиц варьируется в диапазоне от 0,5 мкм до 2000 мкм. Частицы данного диапазона не проходят через ЖКТ, что позволяет сделать предположение об их низкой эффективности. Кроме того, недостатком данного изобретения является сложная структура композиций, которая повышает стоимость и усложняют технологию получения лекарственного средства.
В заявке РФ №2005108611 раскрывается дозированная форма с двумя ядрами, в каждом из которых содержится активный ингредиент. Указанные ядра окружены отдельной оболочкой, которая при соприкосновении с жидкой средой разрушается, высвобождая, тем самым, активное вещество. Первый и второй активные ингредиенты выбираются из группы, состоящей из ибупрофена, кетопрофена и их фармацевтически приемлемых солей, сложных эфиров, изомеров и солей. Данная дозированная форма обеспечивает модифицированное высвобождение - по меньшей мере один час задержки между начальным высвобождением первого активного ингредиента и начальным высвобождением второго активного ингредиента.
В заявке РФ №2012131158 описана фармацевтическая композиция с контролируемым высвобождением плохо растворимого лекарственного вещества для перорального приема, состоящая или из сердцевины с инертным наполнителем, «покрытой» лекарственным средством, или из сердцевины, «загруженной» лекарственным средством и фармацевтически приемлемым наполнителем, выбранным из представленной группы: этилцеллюлозы, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, натриевого производного карбоксиметилцеллюлозы, полиакрилатов, нейтральных сополимеров на основе этилакрилата и метилметакрилата, сополимеров акрилата и метакрилатов, полиметилметакрилатов и поливинилацетата. В качестве лекарственного средства рассматриваются такие вещества как зипразидон, карбамазепин, ондансетрон, лорноксикам, диазепам, алпразолам, кетопрофен, напроксен, оксазепам, преднизолон, прогестерон и финастерид.
В заявке РФ №2012127867 описана пенообразующая композиция для местного применения, содержащая: пенообразующий агент; масло (оливковое, каноловое, кукурузное, подсолнечное, кунжутное, касторовое, сафлоровое, масло аргании колючей, льняное, виноградное, масло авокадо или их комбинацию); спирт (этанол, изопропанол, пропанол, метанол или их комбинацию); фармацевтически приемлемый носитель. Обезболивающее лекарственное вещество выбирается из следующей группы: метилсалицилат, салициловая кислота, аспирин, индометацин, диклофенак, ибупрофен, кетопрофен, напроксен, кеторолак, мефенаминовая кислота, пироксикам, мелоксикам, целекоксиб, рофекоксиб, парекоксиб, этококсиб, нимесулид, кодеин, экстракт ромашки, экстракт ивы, экстракт хмеля обыкновенного, экстракт калофилла или их комбинации. Недостатком данного изобретения является лекарственная форма в виде пены, которую сложно дозировать, а также следует учитывать ее ограниченную стабильность.
В публикации P.P. Shah и соавторов (Shah P.P., Desai P.R., Singh M. Effect of oleic acid modified polymeric bilayered nanoparticles on percutaneous delivery of spantide II and ketoprofen // J. Controll. Release. 2012. V. 158. P. 336-345) описаны частицы с кетопрофеном для наружного нанесения, содержащие внутреннее ядро из PLGA и внешнюю оболочку из хитозана. Данные частицы были получены методом эмульгирования. Поверхность частиц модифицировали пэгилированной олеиновой кислотой для лучшего проникновения в глубокие слои кожи. Размер частиц был в субмикронном диапазоне, эффективность включения кетопрофена составляла 92,81±2,17%. Опыты in vivo на модели аллергического контактного дерматита показали эффективность данных частиц по сравнению с субстанцией кетопрофена.
Таким образом, все вышеперечисленные композиции, составы и способы получения в той или иной степени направлены на создание лекарственных форм с модифицированным или пролонгированным высвобождением лекарственного вещества, в том числе кетопрофена. Такие лекарственные формы упрощают условия приема препарата пациентами. Кроме того данный подход позволяет снизить риск побочных эффектов. В представленных публикациях описываются пероральные и наружные лекарственные формы на основе кетопрофена. Однако при купировании болевого синдрома наиболее эффективным и быстродействующим способом является парентеральное введение, что создает высокую потребность в разработке лекарственных форм кетопрофена модифицированного высвобождения, предназначенных для инъекционного введения.
Наиболее перспективным подходом при разработке таких форм является создание систем доставки кетопрофена в виде полимерных частиц на основе биодеградируемых сополимеров молочной и гликолевой кислот (PLGA) или молочной кислоты (PLA), одобренных для применения в составе лекарственных средств Food and Drug Administration (FDA) и European Medicines Agency (EMA). Полимерные частицы обеспечивают модифицированное или пролонгированное высвобождение, а также могут быть снабжены векторной системой доставки в очаг воспаления. Известно, что активированные макрофаги в очаге воспаления экспрессируют на поверхности рецептор фолиевой кислоты (ФК) и захватывают ФК в повышенных количествах. Для популяции активированных макрофагов при ряде воспалительных заболеваний с аутоиммунным патогенезом, таких как ревматоидный артрит, атеросклероз, системная красная волчанка, болезнь Крона, остеоартрит, характерна экспрессия рецептора фолиевой кислоты типа β (ФКР-β), что делает активированные макрофаги подходящей мишенью в терапии воспалительных заболеваний (Paulos С.М., Turk M.J., Breur G.J., Low P.S. Folate receptor-mediated targeting of therapeutic and imaging agents to activated macrophages in rheumatoid arthritis // Adv. Drug Deliver. Rev. 2004. V. 56 (8). P. 1205-1217). ФКР-β экспрессируется в организме очень ограниченно - в нескольких типах нормальных клеток человека (клетки почек, плаценты, некоторые типы гемопоэтических клеток миелоидного происхождения), а также в активированных макрофагах при воспалительных патологиях. При данных патологиях активированные макрофаги высвобождают цитокины (IL-1, IL-6, TNFα), хемокины (МСР-1), коллагеназу, простогландины, активные формы кислорода, приводящие к усилению воспалительного процесса и повреждению нормальных тканей. Активированные синовиальные макрофаги являются критическим звеном в патогенезе ревматоидного артрита. В синовиальной мембране при ревматоидном артрите значительно увеличивается популяция активированных макрофагов, которые участвуют в патогенезе РА за счет высвобождения цитокинов (IL-1, TNFα), хемокинов (МСР-1/CCL2), протеаз (эластаза, матриксные металлопротеиназы, включая ММР-1, ММР-3, ММР-9), простогландинов, активных форм кислорода, что приводит к воспалению и деструкции нормальных тканей сустава (Nogueira Е., Gomes А.С., Preto A., Cavaco-Paulo А. Folate-targeted nanoparticles for rheumatoid arthritis therapy // Nanomed-Nanotechnol. 2016. V. 12 (4). P. 1113-1126). В связи с этим целенаправленное устранение данной популяций клеток в организме может способствовать снижению интенсивности воспалительного процесса. Фолиевая кислота обладает высокой степенью аффинности к рецептору ФКР-β, которая составляет Kd=1 нМ. Таким образом, наличие ограниченной экспрессии ФКР-β в организме - на поверхности активированных макрофагов, наряду с высоким аффинитетом рецептора позволяют использовать его в качестве мишени для избирательной доставки противовоспалительных лекарственных препаратов, связанных с фолиевой кислотой.
В качестве систем доставки могут выступать конъюгаты противовоспалительных препаратов с фолиевой кислотой, а также липосомы, наночастицы, дендримеры, поверхность которых функционализирована молекулами фолиевой кислоты в качестве вектора. Проникновение систем доставки, связанных с фолиевой кислотой, в макрофаги происходит по механизму рецептор-опосредованного эндоцитоза (Nogueira Е., Gomes А.С, Preto A., Cavaco-Paulo A. Folate-targeted nanoparticles for rheumatoid arthritis therapy // Nanomed-Nanotechnol. 2016. V. 12 (4). P. 1113-1126). Предложены варианты применения конъюгатов ФК с рядом препаратов (например, метотрексат, кортикостероиды) для таргетной противовоспалительной терапии.
В работе Thomas Т. и соавторов (Thomas Т.Р., Goonewardena S.N., Majoros I.J., et al. Folate-Targeted Nanoparticles Show Efficacy in the Treatment of Inflammatory Arthritis // Arthritis Rheum-Us. 2011. V. 63 (9). P. 2671-2680) показана эффективность фолат-конъюгированных дендримеров (РАМАМ), в качестве системы доставки метотрексата в активированные макрофаги. Было показано, что такой комплекс связывается и интернализуется клетками макрофагальной клеточной линии RAW 264.7, экспрессирующей ФКР-β, а также первичными мышиными макрофагами. Терапевтическая эффективность дендримеров продемонстрирована на модели коллаген-индуцированного артрита крыс.
В работе Nogueira Е. и соавторов (Nogueira Е., Lager F., Le Roux D., Nogueira P., et al. Enhancing Methotrexate Tolerance with Folate Tagged Liposomes in Arthritic Mice // J. Biomed. Nanotechnol. 2015. V. 11 (12). P. 2243-2252) описана система доставки метотрексата в виде ПЭГилированных липосом, на поверхности которых присутствует производное фолиевой кислоты. На трансфицированной линии моноцитов ТНР-1 показано, что липосомы с фолиевой кислотой эффективно интернализуются. В эксперименте с использованием системы in vivo визуализации при введении животным флуоресцентно меченных Alexa Fluor® 647 липосом показано их избирательное накопление в области пораженных суставов животных. Терапевтическая эффективность липосом продемонстрирована на модели коллаген-индуцированного артрита мышей.
В описанных выше публикациях представлены системы адресной доставки на основе дендримеров и липосом, содержащих в качестве векторной молекулы фолиевую кислоту, а в качестве активного компонента метотрексат. Однако для купировании болевого синдрома существует высокая потребность в разработке и испытании на моделях ревматоидного артрита инъекционных лекарственных форм, в виде адресных систем доставки, содержащих в качестве активного компонента противовоспалительные препараты из группы нестероидных противовоспалительных препаратов, в том числе кетопрофена. Наиболее предпочтительны такие системы в виде полимерных частиц на основе биодеградируемого биосовместимого полимера PLGA, так, как по сравнению с липосомами и дендримерами они обладают большей стабильностью, более высокой емкостью включения активных фармакологических субстанций и возможностью создания систем модифицированного/пролонгированного высвобождения, что имеет большое практическое значение.
Следовательно, существует необходимость в разработке состава и способа получения инъекционной формы кетопрофена с модифицированным высвобождением на основе полимерных частиц, обладающей высокой эффективностью, а именно выраженным противовоспалительным и анальгетическим действием.
Раскрытие изобретения
Задачей настоящего изобретения является разработка состава и способа получения препарата на основе кетопрофена, представляющего собой полимерный комплекс для молекулярно-прицельной терапии (ПКМПТ-К) воспалительных процессов, и предназначенного для инъекционного введения. Отличием от известных композиций и препаратов с кетопрофеном является включение его в состав полимерных частиц со средним размером от 200 до 300 нм. За счет включения в состав препарата сополимера молочной и гликолиевой кислот полученные частицы характеризуются модифицированным/пролонгированным высвобождением кетопрофена, длительность которого составляет около 12 часов, что приводит модификации профиля фармакологической активности. Кроме того, представленный способ получения и состав препарата подразумевает включение в его состав векторной молекулы – трудно растворимого додециламида фолиевой кислоты, чем достигается высокий терапевтический и адресный эффект. Для кетопрофен-содержащих полимерных частиц, описанных настоящим изобретением, показано выраженное противовоспалительное (противоотечное) действие при сохранении высокой анальгетической активности. Известные препараты с кетопрофеном характеризуются главным образом анальгетической активностью и не демонстрируют столь выраженного противоотечного действия. Таким образом, расширяется терапевтическая ниша применения кетопрофена. Кроме того, достигаемое препаратом пролонгированное действие обуславливает кумулятивный эффект, что позволяет снизить дозировку препарата и, как следствие, уменьшить выраженность побочных эффектов.
Технический результат заявленного изобретения заключается в том, что предложен состав и способ получения кетопрофен-содержащего противовоспалительного препарата в виде полимерных частиц, функционализированных производным фолиевой кислоты, что позволило создать эффективную инъекционную лекарственную форму в виде лиофилизата. Использование такой лекарственной формы приводит к модификации профиля фармакологической активности кетопрофена - достигается высокий адресный эффект, длительное высвобождение и, как следствие, накопительный эффект в области воспалительного процесса, повышение терапевтической эффективности (противовоспалительной и анальгетической) и снижение побочной токсичности.
Для достижения указанного технического результата предложен противовоспалительный препарат на основе кетопрофена в виде лиофилизата для приготовления суспензии частиц со средним размером от 200 до 300 нм, содержащий активный компонент - кетопрофен, полимерный компонент - сополимер молочной и гликолевой кислот с соотношением полимерных звеньев 50:50, векторный компонент - додециламид фолиевой кислоты, поверхностно-активное вещество - поливиниловый спирт и хлорид натрия, при следующем соотношении компонентов, % масс:
Также предложен способ получения препарата, характеризующийся тем, что он включает стадии: растворения кетопрофена и сополимера молочной и гликолевой кислот в органическом растворителе метиленхлориде при соотношении массовых долей кетопрофена и сополимера в растворе равном 1:9,5; внесения в полученный раствор додециламида фолиевой кислоты; добавления полученной смеси в 0,25% раствор поливинилового спирта в воде при объемном соотношении органической и водной фаз равном 1:7; обработки смеси ультразвуком с образованием эмульсии; удаления из полученной эмульсии метиленхлорида путем перемешивания до получения суспензии частиц; добавления к полученной суспензии 20% водного раствора хлорида натрия при массовом соотношении хлорида натрия к сополимеру от 1:2,5 до 1:4; замораживания суспензии и последующей ее лиофилизации с получением лиофилизата; гамма-стерилизации полученного лиофилизата в дозе 10 кГр.
Краткое описание чертежей
На фиг. 1 представлено распределение частиц по размерам (водная суспензия образца Кето-ФК-НЧ-01). По оси абсцисс - диаметр частиц, нм; по оси ординат - интенсивность светорассеяния, %.
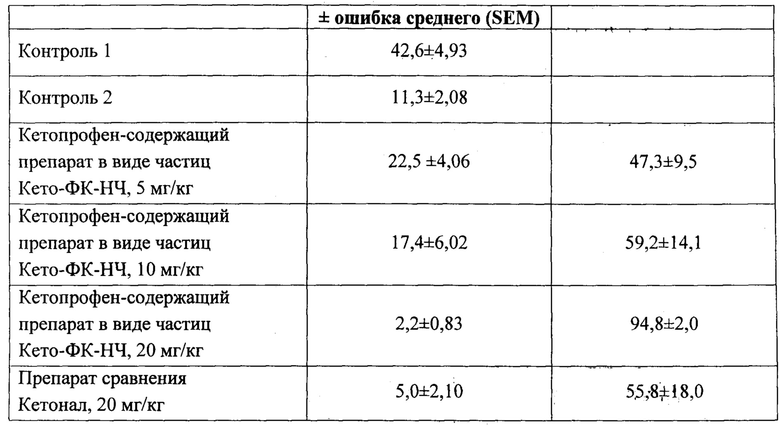
На фиг. 2 представлена фотография частиц (образец Кето-ФК-НЧ-01), полученная методом просвечивающей криоэлектронной микроскопии.
Осуществление и примеры реализации
Для получения заявляемого противовоспалительного препарата на основе кетопрофена в первую очередь необходимо было разработать состав и технологически приемлемый способ получения. Препарат представляет собой полимерный комплекс для молекулярно-прицельной терапии (ПКМПТ-К) в виде полимерных частиц, функционализированных производным фолиевой кислоты. Полимерные частицы являются субмикронными со средним размером от 200 до 300 нм. Полимер-носитель представляет собой коммерчески доступный сополимер молочной и гликолевой кислоты с соотношением полимерных звеньев молочной и гликолевой кислот 50:50, в который включено активное вещество кетопрофен и векторный компонент, в качестве которого использовалось производное фолиевой кислоты - додециламид фолиевой кислоты (Санжаков М.А., Игнатов Д.В., Прозоровский В.Н. и др. Синтез адресного коньюгата для фосфолипидной системы транспорта лекарств // Биомед. химия, 2014. Т. 60, вып. 6. С. 713-716).
Для получения полимерных частиц применяли известный метод эмульгирования. В качестве органической фазы для полимера, кетопрофена и додециламида фолиевой кислоты использовался метиленхлорид. Были подобраны условия, позволяющие получать полимерные частицы с содержанием включенного кетопрофена 5-6% масс. Для достижения этого показателя наиболее оптимальным оказалось соотношение массовой доли кетопрофена по отношению к массовой доле полимера в исходном растворе органического растворителя равное 1:9,5. Додециламид фолиевой кислоты вводился в состав органической среды в виде раствора в апротонном растворителе (ДМФА). Данный подход позволил включить трудно растворимый амфифильный векторный компонент в состав частиц. За счет свойств векторного компонента отмечалось его присутствие на поверхности частиц. Для стабилизации эмульсии использовался 0,25% водный раствор поливинилового спирта, в который вносили органическую фазу с растворенными в ней компонентами. При этом оптимальное соотношение органической и водной фаз составляло 1:7. Смешивание водной и органической фаз происходило в условиях обработки ультразвуком с образованием эмульсии. Метиленхлорид удаляли из полученной эмульсии путем перемешивания до получения суспензии частиц. К полученной суспензии вносили 20% водный раствор хлорида натрия при массовом соотношении хлорида натрия к сополимеру от 1:2,5 до 1:4. Полученную суспензию замораживали и подвергали лиофилизации. Далее полученный лиофилизат подвергали гамма-стерилизации в дозе 10 кГр от источника с изотопом кобальта-60.
Важной стадией описанного способа является внесение в суспензию частиц хлорида натрия, что позволило добиться повышения стабильности частиц и их хорошей ресуспендируемости, в том числе при длительном хранении. Таким образом, применение хлорида натрия позволило получить лиофилизат с хорошими технологическими свойствами, который удобно собирать, дозировать по массе и хранить.
Особенностью описанного процесса является использование для стерилизации лиофилизата гамма-излучения от источника с изотопом 60Со. Результаты гамма-стерилизации показали, что это удобный и надежный метод стерилизации, вполне применимый к лиофилизатам, содержащим полимерные частицы. Образцы, подвергшиеся гамма-стерилизации (накопленная доза 10 кГр) оказались стерильными и не имели отклонений в качестве.
Таким образом, подобранные условия описанного выше способа позволяют стабильно и с высоким выходом получать продукт, представляющий собой лиофилизат, предназначенный для инъекционного введения. При добавлении к нему фармакологически приемлемого водного растворителя, например стерильной воды для инъекций, и последующем встряхивании образует суспензию частиц, характеризующихся средним размером от 200 до 300 нм, индексом полидисперсности не более 0,15 и содержанием кетопрофена не менее 5% масс. Подробное описание получения препарата, представлено ниже в Примере 1. Для образцов полученных частиц оценивался размер, индекс полидисперсности, дзета-потенциал, морфология поверхности и содержание кетопрофена.
Распределение частиц по размеру, индекс полидисперсности и дзета-потенциал определяли на анализаторе Zetasizer Nano ZS ZEN 3600 (Malvern Instruments Inc., Великобритания) методом динамического светорассеяния. Для анализа готовили суспензию образца частиц 0,2 мг/мл и проводили измерения при 25 °С троекратно для каждого образца.
Форма и морфология частиц определялись методом просвечивающей криоэлектронной микроскопии на оборудовании Titan Krios TEM FEI (Thermo Fisher Scientific, США). Образцы частиц разводились 1 мл воды, перемешивались в течение 1 мин и помещались на специальные поддерживающие сетки. После витрификации в жидком этане образцы переносились в жидком азоте в станцию для запрессовки, после чего помещались в кассету-держатель при криогенных условиях. Изображения были получены при увеличениях 5000Х-18000Х в режиме малой дозы с использованием детектора электронов Falcon II.
Содержание кетопрофена в полимерных частицах определяли методом ВЭЖХ с использованием системы Agilent 1200 series с УФ-детектором (Agilent Technologies, США). Хроматографическое разделение проводили в изократическом режиме на колонке Kromasil® 100-5-С18, 150×4,6 мм, 5 мкм. Состав элюента: фосфатный буферный раствор рН 2,5: ацетонитрил и вода Milli-Q в соотношении 2/43/55. Скорость потока: 1 мл/мин. Термостатирование колонки при 30 °С. Препарат в количестве 20 мг, помещенный в мерную колбу на 10 мл, растворяли в 1 мл ДМСО, доводили объем до метки элюентом. Пробу полученного раствора в количестве 1 мл центрифугируют при 16 тыс. об/мин 5 мин. Затем анализируют. Объем вводимой пробы 25 мкл. Длина волны 232±4 нм. Время удерживания пика кетопрофена в этих условиях около 9 минут.
В таблице 1 приведены данные размера частиц и индекса полидисперсности по трем образцам частиц, полученных описанным способом. Образцы Кето-ФК-НЧ-01, Кето-ФК-НЧ-02, Кето-НЧ-01 были получены в соответствии с методикой, описанной в Примере 1. Образцы препаратов Кето-ФК-НЧ-01 и Кето-ФК-НЧ-02 имеют в своем составе векторный компонент (додециламид фолиевой кислоты), а в образце Кето-НЧ-01 его нет. Среднее значение дзета-потенциалов частиц в восстановленных из лиофилизатов суспензиях составило около минус 1,0±0,09 мВ.
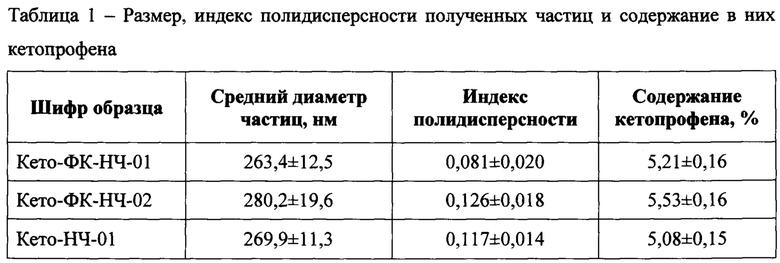
На фиг. 1 приведен пример распределения частиц по размеру (образец Кето-ФК-НЧ-01). В соответствии с представленными данными распределение носит мономодальный характер.
На фиг. 2 представлена фотография (ТЕМ), демонстрирующая сферическую форму и гладкую поверхность полученных частиц (образец Кето-ФК-НЧ-01).
Изучения динамики высвобождения кетопрофена из состава частиц в условиях in vitro проводили методом равновесного диализа. В мешки для диализа с диаметром пор 12-14 кДа вносили по 1 мл суспензии, содержащей 77,85 мг частиц и диализовали против 2 л фосфатно-солевого буферного раствора рН 7,4, содержащего 0,5% Tween 80 при 37 °С с перемешиванием на шейкере (50 об/мин). Через определенные временные интервалы (общее время инкубации 48 ч), образцы количественно переносили из мешков для диализа в стеклянные флаконы, замораживали и лиофилизовали. Содержание кетопрофена в лиофилизованных образцах определяли методом ВЭЖХ. Было показано, что в данных условиях за 12 ч в раствор высвобождается около 90% кетопрофена от взятого в опыт.
Так как в качестве органического растворителя в описанном способе получения препарата использовался метиленхлорид, то важной характеристикой являлось определение содержание остаточного растворителя (метиленхлорида) и установление его соответствия требованиям ГФ XIII (Государственная Фармакопея Российской Федерации. XIII издание. Т. I. ОФС.1.1.0008.15 Остаточные органические растворители. Москва, 2015), согласно которым допустимое содержание метиленхлорида в образце не должно превышать 600 ppm. Исследование проводили методом газовой хроматографии (анализ равновесного пара) с применением газового хроматографа Agilent Technologies, модель 7820А с пламенно-ионизационным детектором и колонки DB-624 (6% цианопропилфенил - 94% диметилполисилоксан) 30 м × 0,32 мм × 1,8 мкм. Условия хроматографирования. Газ-носитель: азот. Кондиционирование колонки: начальная температура 50 °С, выдержка 10 мин, далее подъем температуры до 240 °С со скоростью 20 °С/мин, выдержка 5 мин. Температура инжектора: 140 °С. Температура детектора: 250 °С. Расход газа-носителя: 1 мл/мин. Время хроматографирования: 25 мин. Время удерживания метиленхлорида в приведенных условиях составляет 6-7 минут. Исследование показало, что содержание метиленхлорида в образцах не превышало 600 ppm.
Таким образом, результаты исследований показали, что описанный способ получения препарата характеризуется высокой воспроизводимостью основных показателей качества в полученных образцах лиофилизатов. Было установлено постоянство содержания кетопрофена, среднего размера частиц и индекса полидисперсности в образцах. Кроме того, описанный процесс обладает возможностью масштабирования, позволяя нарабатывать образцы в достаточном объеме, что имеет большое практическое значение.
Исследования анальгетической активности разработанного кетопрофен-содержащего препарата проводились на самках мышей линии C57bl/6 методом оценки перитовисцеральной боли - тест корчей. Суть метода заключается во введении веществ, раздражающих серозные оболочки, вызывая у животных сокращение абдоминальной мускулатуры. В качестве раздражающего агента использовали 1% раствор уксусной кислоты. В тесте подсчитывали количество реакций типа «корчи» - характерные движения животных, включающие сокращения брюшных мышц, чередующиеся с их расслаблением, вытягиванием задних конечностей и прогибанием спины, в течение 30 мин после введения уксусной кислоты. Анальгетический эффект оценивали по способности препарата уменьшать количество корчей у мышей в сравнении с контролем и препаратом сравнения. Кетопрофен-содержащий препарат (кетопрофен-содержащие полимерные частицы, функционализированные производным фолиевой кислоты - Кето-ФК-НЧ) вводили внутрибрюшинно за 5 мин до проведения теста в дозах 10 и 20 мг/кг. В качестве препарата сравнения выступал коммерчески доступный препарат кетопрофена Кетонал для инъекций (Сандоз, Лек д.д., Словения) в эквивалентной дозе. Контрольным животным вводили воду для инъекций (Контроль 1 - контроль для группы с введением исследуемого препарата Кето-ФК-НЧ) и растворитель, аналогичный по составу растворителю препарата Кетонал (Контроль 2 - контроль для группы с введением препарата сравнения Кетонала). Выраженность анальгетического эффекта препаратов оценивали по уменьшению среднего количества реакций типа «корчи» относительно контроля и коэффициенту анальгезии. Подробное описание эксперимента представлено в Примере 2.
Необходимость формирования группы Контроль 2 с введением растворителя, аналогичного по составу растворителю препарата Кетонал, была обусловлена наличием в его составе смеси спиртов, которые могли потенциально обладать анальгезирующей активностью, что и было показано в эксперименте - в группе Контроль 2 наблюдался анальгезирующий эффект (по сравнению группой Контроль 1).

Результаты исследования показали, что при введении кетопрофен-содержащего препарата в виде частиц Кето-ФК-НЧ наблюдается дозозависимый анальгетический эффект. Самой эффективной оказалась доза 20 мг/кг, при введении которой болевая реакция у мышей снижалась на 94,8%, что соответствует критерию эффективности для анальгетических препаратов (коэффициент анальгезии более 50%). При этом, анальгетическая активность кетопрофен-содержащего препарата в виде частиц превышала активность препарата сравнения Кетонала, который в дозе 20 мг/кг снижал болевую реакцию у животных на 55,8%.
Исследование противовоспалительного эффекта разработанного препарата проводили по оценке его противоотечной активности на модели адъювантного артрита, являющегося моделью хронического иммунного воспаления. Адъювантный артрит индуцировали субплантарным введением в правую заднюю лапу крыс 0,1 мл полного адъюванта Фрейнда (АФ). Исследование проводили в соответствии со стандартной схемой оценки лечебного действия противовоспалительных препаратов, которые вводили ежедневно в течение 12 дней, начиная с 14-го дня после инъекции адъюванта Фрейнда. Кетопрофен-содержащий препарат (кетопрофен-содержащие полимерные частицы, функционализированные производным фолиевой кислотой - Кето-ФК-НЧ) вводили внутрибрюшинно в дозах 5 и 15 мг/кг. В качестве препаратов сравнения использовали два препарата: кетопрофен-содержащие полимерные частицы без производного фолиевой кислоты (Кето-НЧ) и коммерчески доступный препарат кетопрофена Кетонал для инъекций (Сандоз, Лек д.д., Словения), которые вводили внутрибрюшинно в эквивалентных дозах - 5 и 15 мг/кг. Контрольным животным вводили внутрибрюшинно воду для инъекций.
Противовоспалительную активность препаратов оценивали по динамике развития отека пораженной конечности и по противоотечному эффекту в отношении отека конечности опытных животных по сравнению с контрольными нелечеными животными. Определяли толщину пораженной конечности в области плюсневых костей. Оценивали выраженность противоотечного эффекта по приросту отека лап (показатель ПО, %) по сравнению с исходными показателями в группах и по степени угнетения отека лап (показатель СУО, %) по сравнению с контрольными нелечеными животными. Подробное описание эксперимента представлено в Примере 3.
В таблице 3 приведены результаты исследования противовоспалительной активности кетопрофен-содержащего препарата в виде частиц.
В течение первых 24 часов после субплантарного введения АФ у всех крыс визуально наблюдалась воспалительная реакция: гиперемия и отек задней правой конечности (место инъекции АФ). К 14-м суткам после введения АФ развивался выраженный отек и припухлость в области пораженных суставов - межфаланговых, плюснефаланговых и голеностопного. При движении крысы избегали наступать на больную конечность. Максимальное увеличение отека конечности отмечали на 3 сутки после введения АФ - прирост отека лап (ПО) составлял в группах 63,2-86,5%.
Результаты исследования показали, что введение кетопрофен-содержащего препарата в виде частиц (Кето-ФК-НЧ) в дозе 5 мг/кг приводило к значительному снижению отека пораженной конечности по показателю степень угнетения отека (СУО) на 4 и 12-е сутки лечения - на 65,3% и 37,1% соответственно. При этом спустя 4 и 12 суток введения ПКМПТ-К в дозе 5 мг/кг было зарегистрировано уменьшение отека в 2-3 раза (по показателю СУО) по сравнению с группой животных, получавших препарат сравнения Кетонал в аналогичной дозе (СУО 20,6% и 16,7% на 4 и 12-е сутки лечения соответственно), что свидетельствует о большем противоотечном эффекте препарата Кето-ФК-НЧ при введении дозы 5 мг/кг. При введении дозы 15 мг/кг противоотечный эффект был выше в случае препарата сравнения Кетонала по сравнению с препаратом Кето-ФК-НЧ. Полученные результаты свидетельствуют о преимуществе противовоспалительного действия разработанного кетопрофен-содержащего препарата Кето-ФК-НЧ именно в диапазоне более низких доз (5 мг/кг), что имеет большое практическое значение, учитывая побочные эффекты кетопрофена, более выраженные на высоких дозах. В исследовании была отмечена худшая переносимость животными в случае более высокой из сравниваемых доз 15 мг/кг как для группы с введением Кето-ФК-НЧ, так и препарата Кетонал - отмечалась потеря в весе и гибель животных в конце курса лечения. Картина вскрытия показала высокую гастроинтестинальную токсичность на данной дозе - изъязвление и кровоизлияния в желудке и кишечнике. У крыс, которым вводился препарат сравнения Кетонал на дозе 15 мг/кг, кроме перечисленных побочных эффектов, наблюдались также признаки токсического поражения печени: увеличение размеров и признаки фиброза печени. Стоит отметить, что у препарата Кето-ФК-НЧ в эквивалентной дозе отсутствовали гепатотоксические эффекты. Переносимость курсового введения дозы 5 мг/кг была лучше в случае введения кетопрофен-содержащего препарата Кето-ФК-НЧ, по сравнению с препаратом сравнения Кетонал. В случае введения Кетонала в данной дозе отмечалась потеря массы тела на 20%, чего не наблюдалось в группе с введением Кето-ФК-НЧ. Таким образом, проведенные исследования свидетельствует о меньшей побочной токсичности разработанного препарата. Следует отметить, что второй препарат сравнения - кетопрофен-содержащие полимерные частицы без производного фолиевой кислоты (Кето-НЧ) оказался менее эффективным по сравнению с препаратом Кето-ФК-НЧ, особенно в дозе 5 мг/кг. Это свидетельствует о преимуществе частиц с введенным векторным компонентом в отношении воспалительного процесса, обусловленного селективностью накопления в очаге воспаления полимерных частиц, функционализированных производным фолиевой кислоты.
Предлагаемое изобретение иллюстрируется нижеследующими примерами
Пример 1. Получение кетопрофен-содержащего противовоспалительного препарата в виде частиц
Навески 200 мг сополимера молочной и гликолевой кислот с соотношением полимерных звеньев молочной и гликолевой кислоты 50:50 (PURASORB® PDLG 5004, Inherent viscosity 0,41 dL/g; PURAC Biochemicals, Нидерланды) и 21 мг кетопрофена (98,7%, Prod. Number K1751, Sigma, США) растворяли в 5,0 мл хлористого метилена. К раствору полимера и кетопрофена прибавляли раствор 0,2 мг додециламида фолиевой кислоты в ДМФА. Полученный раствор вносили в 35,0 мл 0,25% раствора поливинилового спирта в воде. Смесь дважды обрабатывали ультразвуком с энергией 45 Дж в течение 1 мин с перерывом в 1 мин. В полученную эмульсию вносили якорь магнитной мешалки и оставляли перемешиваться в открытом стакане при комнатной температуре на ночь. К сформировавшейся суспензии добавляли 20% водный раствор, содержащий 75 мг хлорида натрия. Затем суспензию замораживали и лиофилизировали в течение суток. Полученный лиофилизат подвергали гамма-стерилизации в дозе 10 кГр с помощью источника гамма-облучения с изотопом кобальта-60.
Пример 2. Определение анальгетической активности
Исследование анальгетической активности исследуемого препарата по его влиянию на висцеральную боль в условиях модели уксуснокислых корчей проводили на самках мышей линии C57bl/6 массой около 20 г. Для воспроизведения висцеральной боли использовали модель корчей, которые вызывали внутрибрюшинным введением 1% раствора уксусной кислоты (1 мл/100 г массы тела животного) (Д.А. Бондаренко, И.А. Дьяченко, Д.И. Скобцов, А.Ш. Мурашев. In vivo модели для изучения анальгетической активности. // Биомедицина, 2011, №2. С. 84-94). Для испытания было сформировано 6 групп мышей, по 5 особей в каждой - четыре опытные группы (исследуемый препарат в трех дозах и препарат сравнения в одной дозе) и две контрольные группы. Кетопрофен-содержащий препарат вводили в виде суспензии в воде (вода для инъекций) в дозах 5, 10 и 20 мг/кг внутрибрюшинно. Препарат сравнения - коммерчески доступный препарат кетопрофена Кетонал для инъекций (Сандоз, Лек д.д., Словения) вводили внутрибрюшинно в дозе 20 мг/кг. Контрольным животным вводили внутрибрюшинно в эквивалентном объеме воду для инъекций (Контроль 1) или растворитель, аналогичный по составу растворителю препарата Кетонал (состав: пропиленгликоль 400 мг, этанол ректификованный "Экстра" 100 мг, бензиновый спирт 20 мг, натрия гидроксид 1 М до рН 6,5-7,5, вода для инъекций до 1 мл) (контроль 2). При моделировании теста «корчи» раствор уксусной кислоты вводили сразу, после введения препаратов. Через 15 минут после инъекции раствора уксусной кислоты в течение 30 минут регистрировали количество реакций типа «корчи» у контрольных и опытных животных.
Выраженность анальгетической активности оценивали по уменьшению среднего количества реакций типа «корчи» в группах с введением препаратов относительно контрольных групп и по коэффициенту анальгезии (%), который рассчитывали по формуле (1):

где
А - коэффициент анальгезии;
Nк - количества реакций типа «корчи» за 30 мин в контрольной группе;
No - количества реакций типа «корчи» за 30 мин в опытной группе.
Статистическую обработку проводили с использованием описательной статистики.
Пример 3. Определение противовоспалительной (противоотечной) активности Исследование противовоспалительной активности исследуемого препарата проводили по оценке его противоотечной активности на модели адъювантного артрита на самцах крыс линии Sprague Dawley массой около 300 г. Адъювантный артрит индуцировали субплантарным введением в правую заднюю лапу крыс 0,1 мл полного адъюванта Фрейнда (АФ). Исследование проводили в соответствии, со стандартной схемой оценки лечебного действия противовоспалительных препаратов, которые вводили ежедневно в течение 12 дней, начиная с 14-го дня после инъекции адъюванта Фрейнда проводили в соответствии с требованиями Руководства по проведению доклинических исследований лекарственных средств (А.Н. Миронов. Руководство по проведению доклинических исследований лекарственных средств. Москва, 2012). Для испытания было сформировано 7 групп крыс, по 5 особей в каждой - шесть опытных групп (исследуемый препарат и препараты сравнения в двух дозах 5 и 15 мг/кг) и одна контрольная группа с нелечеными животными. Кетопрофен-содержащий препарат (кетопрофен-содержащие полимерные частицы, функционализированные производным фолиевой кислоты - Кето-ФК-НЧ) вводили ежедневно внутрибрюшинно в дозах 5 и 15 мг/кг в течение 12 дней, начиная с 14-го дня после инъекции АФ. В качестве препаратов сравнения использовали два препарата: кетопрофен-содержащие полимерные частицы без фолиевой кислоты (Кето-НЧ) и коммерчески доступный препарат кетопрофена Кетонал для инъекций (Сандоз, Лек д.д., Словения), которые вводили внутрибрюшинно в эквивалентных дозах 5 и 15 мг/кг по схеме описанной выше. Контрольным животным вводили внутрибрюшинно воду для инъекций по схеме описанной выше.
Выраженность противовоспалительного действия препаратов оценивали по динамике развития отека пораженной конечности и по противоотечному эффекту в отношении отека конечностей опытных животных по сравнению с контрольными нелечеными животными. Определяли толщину (Т, мм) пораженной конечности в области плюсневых костей. Оценивали выраженность противоотечного эффекта по приросту отека лап (показатель ПО, %) по сравнению с исходными показателями в группах и по степени угнетения отека лап (показатель СУО, %) по сравнению с контрольными нелечеными животными. Показатели рассчитывали по формулам (2) и (3):

где
Ти - толщина конечности исходная (до введения АФ), мм;
Т - толщина конечности после введения АФ, мм.

где
ПОо - прирост отека лап опытной группы, %;
ПОк - прирост отека лап контрольной группы, %.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМЕРНЫЙ КОМПЛЕКС ДЛЯ МОЛЕКУЛЯРНО-ПРИЦЕЛЬНОЙ ТЕРАПИИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2017 |
|
RU2675810C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНЫХ ПРОТИВООПУХОЛЕВЫХ ЧАСТИЦ В ПРОТОЧНОМ МИКРОРЕАКТОРЕ И ЛИОФИЛИЗАТА НА ИХ ОСНОВЕ | 2018 |
|
RU2681933C1 |
| Гетероциклические амиды тирозина, обладающие анальгетическим, противовоспалительным и противоотечным действием | 2018 |
|
RU2685505C1 |
| Водорастворимые производные тирозина, обладающие анальгетическим, противовоспалительным и противоотечным действием | 2017 |
|
RU2678563C1 |
| СПОСОБ МОДИФИКАЦИИ ФОТОДИНАМИЧЕСКОГО ЛЕЧЕНИЯ | 2010 |
|
RU2449821C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ НАРУЖНОГО ПРИМЕНЕНИЯ, СОДЕРЖАЩАЯ СОЛЬ ДЕКСКЕТОПРОФЕНА, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2667465C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРСОДЕРЖАЩЕЙ КОМПОЗИЦИИ СИЛИБИНА | 2019 |
|
RU2716706C1 |
| КОМБИНИРОВАННЫЙ ПРЕПАРАТ ДЛЯ УСТРАНЕНИЯ СИМПТОМОВ ПРОСТУДНЫХ ЗАБОЛЕВАНИЙ И ГРИППА (ВАРИАНТЫ) | 2003 |
|
RU2237470C1 |
| ПРОТИВОВОСПАЛИТЕЛЬНОЕ И АНАЛЬГЕТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ ИЗОПРОПИЛАМИДА 1,2-ДИГИДРО-1Н-2-ОКСОЦИНХОНИНОВОЙ КИСЛОТЫ | 2012 |
|
RU2545056C2 |
| 1-ГЕКСАДЕЦИЛ-4,6-ДИМЕТИЛ-2-ОКСОНИКОТИНАМИД, ПРОЯВЛЯЮЩИЙ ПРОТИВОВОСПАЛИТЕЛЬНУЮ И АНАЛЬГЕТИЧЕСКУЮ АКТИВНОСТЬ | 2008 |
|
RU2396258C2 |
Изобретение относится к области фармакологии, а именно к составу и способу получения противовоспалительного препарата на основе кетопрофена в виде лиофилизата для приготовления суспензии частиц с размером от 200 до 300 нм. Противовоспалительный препарат содержит, масс. %: активный компонент - кетопрофен (5-6%), полимерный компонент - сополимер молочной и гликолевой кислот (60-64%), векторный компонент - додециламид фолиевой кислоты (0,006-0,007%); поверхностно-активное вещество - поливиниловый спирт (10-12%) и хлорид натрия (20-24%). Предложенный способ позволяет стабильно, воспроизводимо и с высоким выходом получать препарат, представляющий собой лиофилизат, предназначенный для инъекционного введения. Использование препарата приводит к модификации профиля фармакологической активности кетопрофена - достигается высокий адресный эффект в области воспалительного процесса, пролонгированное высвобождение и, как следствие, повышение терапевтической активности (противовоспалительной и анальгетической) и снижение побочной токсичности. 2 н.п. ф-лы, 2 ил., 3 табл.
1. Противовоспалительный препарат на основе кетопрофена в виде лиофилизата для приготовления суспензии частиц со средним размером от 200 до 300 нм, содержащий активный компонент - кетопрофен, полимерный компонент - сополимер молочной и гликолевой кислот с соотношением полимерных звеньев 50:50, векторный компонент - додециламид фолиевой кислоты, поверхностно-активное вещество - поливиниловый спирт и хлорид натрия, при следующем соотношении компонентов, мас.%:
2. Способ получения препарата по п. 1, характеризующийся тем, что он включает стадии: растворения кетопрофена и сополимера молочной и гликолевой кислот в органическом растворителе метиленхлориде при соотношении массовых долей кетопрофена и сополимера в растворе равном 1:9,5; внесения в полученный раствор додециламида фолиевой кислоты; добавления полученной смеси в 0,25% раствор поливинилового спирта в воде при объемном соотношении органической и водной фаз равном 1:7; обработки смеси ультразвуком с образованием эмульсии; удаления из полученной эмульсии метиленхлорида путем перемешивания до получения суспензии частиц; добавления к полученной суспензии 20% водного раствора хлорида натрия при массовом соотношении хлорида натрия к сополимеру от 1:2,5 до 1:4; замораживания суспензии и последующей ее лиофилизации с получением лиофилизата; гамма-стерилизации полученного лиофилизата в дозе 10 кГр.
| WO 2014101743 A1, 2014.07.03 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ОБЕЗБОЛИВАЮЩИМ И ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ | 2003 |
|
RU2238722C1 |
| WO 2008126797 A1, 23.10.2008 | |||
| ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ НЕСТЕРОИДНОГО ПРОТИВОВОСПАЛИТЕЛЬНОГО СРЕДСТВА КЕТОПРОФЕН, СПОСОБ ПОЛУЧЕНИЯ | 2011 |
|
RU2448690C1 |
| Topaloglu Y | |||
| и др., Inclusion of ketoprofen with skimmed milk by freeze-drying, Farmaco, 1999 Oct 30;54(10):648-52, Найдено онлайн 24.04.2019, найдено в интернет: https://www.sciencedirect.com/science/article/pii/S0014827X99000658?via%3Dihub | |||
| Чичасова.Н.В., ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ КЕТОПРОФЕНА (КЕТОНАЛА) ПРИ РЕВМАТОИДНОМ АРТРИТЕ (КЛИНИКО-ЭНДОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ), 2001 год, Найдено в интернет: https://cyberleninka.ru/article/n/effektivnost-i-bezopasnost-ketoprofena-ketonala-pri-revmatoidnom-artrite-kliniko-endoskopicheskoe-issledovanie | |||
| Chao Zhou и др., Preparation and characterization of ketoprofen-loaded microspheres for embolization, Ноябрь 2011, найдено в интернет https://www.researchgate.net/publication/51817133_Preparation_and_characterization_of_ketoprofen-loaded_microspheres_for_embolization. | |||
Авторы
Даты
2019-07-10—Публикация
2018-12-14—Подача