Изобретение относится к эстетической медицине и может быть использовано для лечения алопеций.
Известен способ лечения нарушения роста волос [RU 2381786, С2, А61К 8/37, 20.02.2010], включающий введение пациенту алкилового эфира никотиновой кислоты с алкильной группой с прямой цепью или разветвленной цепью, содержащей от приблизительно 6 до приблизительно 22 СН2 групп в количестве, достаточном для снижения или для прекращения выпадения волос у указанного субъекта.
Недостатком способа является относительно низкая эффективность лечения.
Известен также способ [RU 2295304, С2, А61В 17/00, 20.03.2007], основанный на том, что в затылочной области головы пациента вырезают кожную полоску с волосяными фолликулами, ушивают донорскую рану, из кожной полоски формируют фолликулярные объединения-графты, для пересадки заготовленных графтов в затылочной области головы и на макушке формируют микроотверстия, направления каналов которых соответствуют направлению роста волос, причем для формирования отверстий разрезы производят параллельно донорской ране.
Недостатком этого способа также является относительно низкая эффективность лечения.
Кроме того, известен способ [RU 2550428, CI, А61В 17/00, 10.05.2015], включающий забор фрагмента кожного имплантата из волосистой области, наложение на образовавшийся дефект косметического шва, деление вырезанного фрагмента на фолликулярные графты, образование микронадрезов на реципиентной области и пересадку в них фолликулярных графтов, при этом перед забором фрагмента кожного имплантата с помощью компьютерной программы TrichoSciencePro v 1.1 рассчитывают площадь реципиентной области, проводят фототрихограмму, оценивая жизнеспособность волосяных фолликулов, на основании полученных данных определяют требуемое количество волосяных фолликулов, затем на реципиентную область наносят «шаблон», после чего на 30% реципиентной области формируют микронадрезы диаметром 1,0 мм для пересадки 2-х и 3-х жизнеспособных фолликулярных графтов и одиночных волосяных фолликулов, которые вводят с помощью одноразовых игл диаметром 0,8-1,0 мм.
Недостатком этого технического решения является относительно низкая эффективность, обусловленная малой приживаемостью волос.
Еще одним аналогом предложенного является способ [IBRAHIM ZA et al. Stem cell therapy as a novel therapeutic intervention for resistant cases of alopecia areata and androgenetic alopecia. J. Dermatolog Treat. 2016, Aug., 24:1-30; ZHAO J. et al. Treatment of alopecia by transplantation of hair follicle steam cells and dermal papilla cells encapsulated in algenate gels. Med. Hypotheses. 2008; 70(5): 1014-6], включающий использование мезенхимальных стволовых клеток, в том числе из волосяных фолликулов кожи, в т.ч. для интрадермального введения.
Недостатком указанных выше технических решений является относительно узкий арсенал способов лечения нерубцовой алопеции, что не всегда обеспечивает выбор эффективного способа.
В эстетической медицине для лечения различного вида алопеций все чаще и чаще используются методы клеточной терапии. Они демонстрируют высокую эффективность и являются хорошей альтернативой лечения облысения пересадкой волос, позволяющей вырастить новые волосы. Полное восстановление нормально функционирующего волосяного фолликула из выделенных и культивированных стволовых клеток ростовых зон волоса представляет собой проблему, которая еще не решена в тканевой инженерии.
Однако показано, что при введении в мезослой кожи головы собственных аутологичных клеток, выделенных из дермальной папиллы и зоны bulge волосяного фолликула в смеси с донорскими мезенхимальными клетками, выделенными из интимы стенки вены и Вартонева студня пуповины человека, стимулируется рост новых волос, улучшается состояние растущих волос, а также предотвращается их преждевременная потеря. Такие клетки способны встраиваться в поврежденные волосяные луковицы, тем самым восстанавливая их, способствовать сборке волосяных фолликулов de novo, как за счет клеток волосяного фолликула, так и за счет аллогенных клеток, которые улучшают трофику кожного покрова, индуцируя формирование новой капиллярной сети. Потеря волос, вызванная травмами или патологиями, такими, как алопеция, сказывается не только на психологическое благополучие пациентов, но и ухудшает нормальное функционирование кожи. Предложенный способ предлагает стратегию регенерации и неогенеза волосяного фолликула у взрослого человека.
Наиболее близким по технической сущности к предложенному является способ лечения нерубцовой алопеции [RU 2631642, C1, А61М 5/00, А61К 35/28, А61Р 17/14, 25.09.2017], включающий введение в мезодермальный слой кожи мезенхимальных стволовых клеток, которые выделяют из биоптата кожи с волосистой части головы взрослого донора, при этом, дополнительно выделяют мезенхимальные стволовые клетки из плаценты, после чего указанные клетки смешивают в соотношении от 3:1 до 1:3, доводят объем смеси до 2-4 мл и вводят ее в мезодермальный слой кожи человека в зоне облысения на глубину 2-3 мм через каждые 2-3 мм при объеме каждой инъекции, равном 0,02 мл.
Недостатком наиболее близкого технического решения является относительно низкая эффективность лечения.
Задачей предложенного способа является расширение арсенала способов лечения нерубцовой алопеции и повышение эффективности лечения.
Требуемый технический результат заключается в повышении эффективности лечения нерубцовой алопеции и расширение арсенала технических средств лечения алопеции.
Поставленная задача решается, а требуемый технический результат достигается тем, что, в способе лечения нерубцовой алопеции, включающем введение в мезодермальный слой кожи в зоне облысения клеточного материала на глубину 2-3 мм, согласно изобретению, предварительно получают клеточный материал в виде аутологичных клеток волосяного фолликула, для чего выдергивают волосы из волосистой части головы взрослого донора и помещают их в раствор Хенкса с антибиотиком и антимикотиком, отбирают волосы, находящиеся в стадии анагена и отсекают от них волосяные фолликулы, которые промывают раствором Хенкса с добавлением антибиотика и антимикотика и переносят в 0,1% раствор коллагеназы 1-го типа, где их и инкубируют в течением 1-2 ч при 37°С и переносят в культуральные флаконы с коллагеновым покрытием с DMEM:F12, содержащей 10% фетальной телячьей сыворотки в растворе гентамицин/стрептомицин/глутамина с равным их соотношением, а через 21 день клеточный материал диссоциируют из сфероидов, образованных в культуральных флаконах, получая окончательно клеточный материал в виде аутологичных клеток волосяного фолликула, и получают также клеточный материал в виде мезенхимальных стромальных клетоки плаценты человека и клеточный материал в виде эндотелиоцитов пуповинной вены, после чего каждый вид клеточного материала переносят в суспензию с использованием 0,25%-ного раствора трипсина с версеном (1: 1), материал промывают его физиологическим раствором путем двухкратного центрифугирования в по 5 минут при 300g с последующим переносом в стерильной среде в вакуумную пробирку, затем клеточный материал трех полученных видов смешивают в соотношении 1-3:1-3:1-3, переносят в пробирку и доводят объем смеси в ней до объема 2-4 мл и содержаат при температуре +2 - +8°С для последующего введения через иглу в мезодермальный слой кожи в виде папул с размером от 2 до 4 мм при угле наклона иглы в 45°.
На графических материалах представлены:
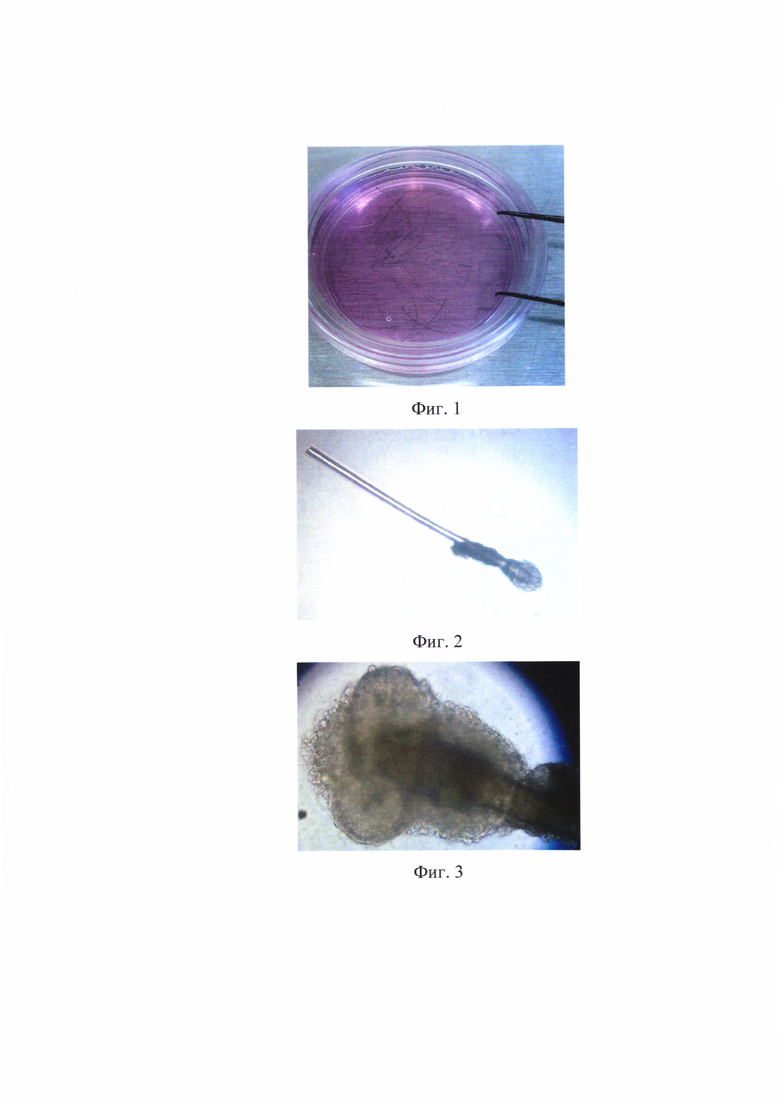
на фиг. 1 - чашка Петри с волосами донора в растворе Хенкса с добавлением антибиотика и антимикотика;
на фиг. 2 - волосяной фолликул в стадии анагена;
на фиг. 3 - пример формирования сфероидов из клеток ростовых зон волосяного фолликула и зоны bulge волосяных фолликулов;
на фиг. 4 - пример манипуляций для выделению и культивирования эндотелиоцитлов из интимы вены пуповины человека;
на фиг. 5 - пример манипуляций для обработки куска пуповины.
Предложенный способ лечения нерубцовой алопеции реализуется следующим образом.
Материально-техническое обеспечение.
1. Помещение для использования под лабораторию, отвечающее лицензионным требованиям.
2. Оборудование: центрифуга, СО2-инкубатор, ламинарный шкаф, инвертированный микроскоп, автоматическая пипетка, микропипетка, замораживатель, сосуд Дьюара, низкотемпературный холодильник, бытовой холодильник, камера Горяева, водяная баня, термос.
3. Реактивы: антибиотики, антимикотики, питательная среда ДМЕМ/Р12, фетальная телячья сыворотка, Версен, 0,25%-ный раствор трипсина, ДМСО, раствор Хенкса, физиологический раствор, коллагеназа 1-го типа, трипановый синий.
4. Расходные материалы: одноразовая культуральная пластиковая посуда (флаконы, пробирки, серологические пипетки, чашки Петри, наконечники для микропипеток, криопробирки); покровные стекла, набор медицинских инструментов (пинцет, хирургические ножницы, глазные ножницы, скальпель, шпатель, карцанг), вакутейнеры.
Получение аутологичных клеток из волосяных фолликулов кожи головы человека.
Получение образцов волос.
А. Волосы выдергиваются с разных областей волосистой части головы взрослого донора при помощи пинцета и помещаются в раствор Хенкса с антибиотиком и антимикотиком (см. фиг. 1), где представлена чашка Петри с волосами пациента в растворе Хенкса.
Б. При помощи микроскопа отбираются волосы, находящиеся в стадии анагена, у которых затем отсекаются волосяные фолликулы (см. фиг. 2).
Выделение аутологичных клеток из волосяных фолликулов кожи человека и их культивирование.
A. Все манипуляции по выделению и культивированию аутологичных клеток из волосяных фолликулов головы человека проводятся стерильно в условиях специально оборудованного культурального бокса.
Б. Отсеченные волосяные фолликулы промываются раствором Хенкса (ПанЭко, РФ) с добавлением антибиотика/антимикотика («Gibco», США).
B. Промытые луковицы переносятся в 0,1% раствор коллагеназы 1-го типа и инкубируются 1-2 ч при 37°С.
Г. После этого волосяные фолликулы переносятся в культуральные флаконы с коллагеновым покрытием с DMEM:F12, содержащей 10% фетальной телячьей сыворотки и р-р гентамицин/стрептомицин/глутамина (все - Gibco, США).
Д. Через две недели происходит образование сфероидов из клеток на поверхности волосяных фолликулов, в зоне дермальной папуллы и зоны bulge, (см. фиг. 3), где иллюстрируется формирование сфероидов из клеток ростовых зон волосяного фолликула.
Е. Спустя 21 день, когда происходит остановка роста сфероидов, клетки диссоциируют из сфероидов, и переводят в суспензию с использованием раствора 0,25%-го трипсина с версеном (1: 1).
Получение эндотелиоцитов из интимы стенки вены пуповины человека.
Получение пуповины.
А. Забор пуповины должен осуществляться сразу после родов.
Б. Пуповина помещается в стерильный герметичный контейнер,
о
который помещается на лед в сумку-холодильник (температура+2° - +8°С).
В. Транспортировка пуповины может осуществляться до трех суток при условии соблюдения герметичности, стерильности и температурного режима.
Г. К транспортируемой пуповине прилагается следующий пакет документов:
1. Анамнез донора (матери) пуповины.
2. Результаты диагностики крови донора (матери) пуповины на вирусы (в соответствии с приказным списком).
3. Информированное согласие донора.
Выделение эндотелиоцитов из интимы вены пуповины человека и их культивирование.
A. Все манипуляции по выделению и культивированию эндотелиоцитов из интимы вены пуповины человека проводятся стерильно в условиях специально оборудованного культурального бокса. Пример манипуляций для выделению и культивирования эндотелиоцитлов из интимы вены пуповины человека представлен на фиг. 4.
Б. Кусок пуповины, длиной 10-12 см промывается раствором Хенкса с добавлением антибиотика/антимикотика и помещается в чашку Петри 10 см.
B. С помощью шприца вена промывается еще несколько раз тем же раствором, до тех пор, пока сосуд не освободится от сгустков крови полностью (см. фиг. 5).
Г. Далее вена заполняется 0,1%-ным раствором коллагеназы I типа, пуповина с двух сторон зажимается корнцангами и помещается в СО2-инкубатор на 30 минут.
Д. После инкубации пуповину, не снимая зажимов, следует немного помять, а затем корнцанги разжать и слить все содержимое в центрифужную пробирку.
Е. Вена пуповины промывается раствором Хенкса еще несколько раз, все смывы также тщательно собираются в центрифужную пробирку.
Ж. Полученная суспензия центрифугируется 5 минут 200 g.
3. Осадки, полученные в соответствии с п. Д, ресуспендируются каждый в 15 мл ростовой среды: MEM 200; 10% фетальная телячья сыворотка; р-р гентамицин/стрептомицин/глутамина (все - Gibco, США); 0,25 мг ципрофлоксацина.
И. Содержимое каждой пробирки, полученное в соответствии с п. Ж, З, переносится в отдельный культуральный флакон площадью 75 см и культивируется со сменой ростовой среды (состав см. выше) каждые 3 дня до достижения полученной первичной культурой клеток 80%-ой конфлюэнтности.
К. При достижении монослоем 80%-ой конфлюэнтности, клетки переводятся в суспензию с использованием раствора 0,25%-го трипсина с версеном (1:1) и рассеваются в культуральные флаконы площадью 75 см в соотношении 1:3.
Получение мезенхимальных стромальных клеток из плаценты человека.
Получение плаценты.
A. Забор плаценты должен осуществляться сразу после родов.
Б. Плацента помещается в стерильный герметичный контейнер, который помещается на лед в сумку-холодильник (температура +2° - +8°С).
B. Транспортировка плаценты может осуществляться до трех суток при условии соблюдения герметичности, стерильности и температурного режима.
Г. К транспортируемой плаценте прилагается следующий пакет документов:
1. анамнез донора (матери) плаценты;
2. результаты диагностики крови донора (матери) плаценты на вирусы (в соответствии с приказным списком);
Выделение мезенхимальных стромальных клеток из плаценты человека и их культивирование.
A. Все манипуляции по выделению и культивированию мезенхимальных стромальных клеток из плаценты человека проводятся стерильно в условиях специально оборудованного культурального бокса.
Б. Амнион плаценты, вместе с неглубоким захватом хориона, нарезается на небольшие кусочки, достаточные для помещения в изопропиленовую пробирку объемом 50 мл.
B. Кусочки ткани, полученные в соответствии с п. Б, энергично промываются от крови. Для этого каждый кусочек помещается в отдельную изопропиленовую пробирку объемом 50 мл, заполненную 40 мл раствора Хенкса с добавлением антибиотика и антимикотика (Gibco, США) и энергично встряхивается.
Г. Промытые кусочки ткани измельчаются и инкубируются 1-2 ч при 370С в 0,1% растворе коллагеназы I го типа в чашках Петри диаметром 10 см из расчета 1 кусочек ткани: 1 чашка Петри: 10 мл раствора фермента.
Д. Полученная в соответствии с п. Г суспензия из каждой чашки Петри, переносится в отдельную изопропиленовую пробирку объемом 50 мл и осаждается центрифугированием (5 мин, 300 g).
Е. Осадки, полученные в соответствии с п. Д, ресуспендируются каждый в 15 мл ростовой среды: DMEM:F12; 10% фетальная телячья сыворотка; р-р гентамицин/стрептомицин/глутамина (все - Gibco, США); 0,25 мг ципрофлоксацина.
Ж. Содержимое каждой пробирки, полученное в соответствии с п. Д, Е переносится в отдельный культуральный флакон площадью 75 см и культивируется со сменой ростовой среды (состав см. выше) каждые 3 дня до достижения полученной первичной культурой клеток 80% ой конфлюэнтности.
3. При достижении монослоем 80% ой конфлюэнтности, клетки переводятся в суспензию с использованием раствора 0,25% го трипсина с версеном (1:1) и рассеваются в культуральные флаконы площадью 75 см в соотношении 1:3.
Подготовка и длительное хранение (криоконсервация) мезенхимальных стромальных клеток, выделенных из плаценты человека.
Замораживание клеток проводят на уровне не старше V пассажа для создания запаса клеток, которые можно впоследствии восстановить, или для сохранения невостребованных клеток. Все манипуляции по криоконсервации клеточных линий, предназначенных для длительного хранения, проводятся стерильно в условиях специально оборудованного культурального бокса.
Подготовка клеток к замораживанию.
Клетки отделяют от пластика смесью растворов версена и трипсина в отношении 1:1 и переносят в центрифужную пробирку (15-50 мл в зависимости от полученного обьема клеточной суспензии) и центрифугируют (5 мин, 300 g). Осадок ресуспендируют в среде для криозаморозки (90% фетальной телячьей сыворотки, 10% диметилсульфоксида (DMSO).
Подсчитывают количество клеток в полученной суспензии и разбавляют ее средой для криозаморозки до конечной концентрации 1 млн. клеток/мл. Полученную клеточную суспензию разливают в криопробирки требуемых объемов и сразу начинают процесс замораживания.
Режим криозамораживания.
А. Для замораживания криопробирки с клетками переносят в контейнер для замораживания пробирок Mr. Frosty™ (Thermo Scientific, США) и помещают его в низкотемпературный холодильник (-80°С).
Б. Через сутки ампулы с клетками переносят в сосуд Дьюара с жидким азотом (-196°С).
Разморозка криоконсервированного клеточного материала.
А. Клетки восстанавливают при температуре 37- 40° на водяной бане до таяния льда. Замороженные клетки достаточно хрупкие, плохо переносят пипетирование, взбалтывание и потому требуют особенно аккуратного обращения.
Б. Все манипуляции, связанные с размораживанием клеток, следует проводить максимально быстро и не допускать передержки клеток в размороженном криоконсерванте.
В. Содержимое криопробирки переносится в культуральный флакон 75 см2 с фильтром, содержащий 10 мл полной ростовой среды.
Д. Клетки культивируются 24 ч в СO2-инкубаторе (37°С, 5% СO2, 80% влажности), затем старая среда, содержащая криоконсервант, удаляется и заменяется на 10 мл свежей полной ростовой среды.
Е. Полученные клетки культивируются со сменой ростовой среды каждые 3 дня до достижения полученной первичной культурой клеток 80%-ой конфлюэнтности.
З. Далее работы с размороженными мезенхимальными стромальными клетками производятся в соответствии с п. З получения клеток.
Паспортизация клеточного материала.
Паспортизация является необходимой процедурой, документирующей результаты контроля состава, качества и безопасности клеточного материала.
Общая структура паспорта клеточного материала включает в себя четыре обязательных блока:
1. Общая информация: научное название клеток; происхождение клеточного материала; маркировка образца; информация о доноре клеток.
2. Жизнеспособность клеток, внешний вид образца: жизнеспособность клеток, %; стерильность; величина рН; цвет и консистенция образца; общая концентрация клеток, кл/мл; объем образца; время выдачи; срок годности, условия хранения.
3. Результаты тестирования образца на отсутствие инфекционных агентов из списка, общего для всех типов клеток.
4. Результаты тестирования образца на отсутствие инфекционных агентов, специфических для данного типа клеток.
Стандартное обследование клеточного материала после пассирования in vitro включает в себя тестирование методом ПЦР мезенхимальных клеток, выделенных из кожи и плаценты человека на отсутствие следующих инфекционных агентов:
- вирусов иммунодефицита 1 го и 2 го типов (Retroviridae, Orthoretrovirinae, Lentivirus);
- вирусов гепатита В (Hepadnaviridae, Orthohepadnavirus) и гепатита С (Flaviviridae, Hepacivirus);
- вирусов простого герпеса 1 го и 2 го типов (Herpesviridae, Alphaherpesvirinae, Simplexvirus); цитомегаловируса (Herpesviridae, Betaherpesvirinae, Cytomegalovirus); вируса Эпштейна-Барр (Herpesviridae, Gammaherpesvirinae, Lymphocryptovirus);
- Treponema pallidum (Spirochaetales, Spirochaetacea); Mycoplasma sp.(Mycoplasmatales, Mycoplasmataceae); Toxoplasma sp.(Eucoccidiorida, Sarcocystidae).
- папилломавирусов человека (Papillomaviridae) из рода Alphapapillomavirus (типы: 2, 6, 7, 10, 16, 18, 26, 32, 34, 53, 54, 61, 71, cand90);
- Ureaplasma sp.(Mycoplasmatales, Mycoplasmataceae);
- Chlamydia sp.(Chlamydiales, Chlamydiaceae).
Исключение инфекционных агентов в мезенхимальных стромальных клетках выполняется в клинико-диагностической лаборатории однократно. Стандартное обследование проводится после пассирования in vitro образца клеточной линии в количестве не менее 500 тыс.клеток.
Приготовление клеточного материала для транспортировки и медицинского применения.
А. Отобранные образцы клеточных культур, не старше V пассажа, переводятся в суспензию с использованием раствора 0,25%-го трипсина с версеном (1:1). Для этого ростовая среда удаляется, а монослой дважды промывается физиологическим раствором, а затем инкубируется в растворе 0,25%-го трипсина с версеном (1:1) при 37°С из расчета 3мл раствора на культуральный флакон площадью 75 см2.
Б. Полученная в соответствии с п. А суспензия переносится в изопропиленовую пробирку объемом 50 мл, после чего осуществляется подсчет количества в ней клеток при помощи камеры Горяева.
В. Далее суспензия промывается физиологическим раствором. Для этого клетки осаждаются центрифугированием (5 мин 300g), а осадок ресуспендируется в физиологическом растворе. Манипуляция повторяется дважды.
Г. Полученный в п. В осадок клеток, ресуспендируется в стерильной среде транспортировки, состоящей из физиологического раствора и разрешенного к применению лекарственного средства, обеспечивающего лучшую выживаемость клеток и улучшение лечебных характеристик технологии.
Д. Процент жизнеспособных клеток в препарате определяется с помощью окраски трипановым синим и подсчетом в камере Горяева. Для медицинского применения необходим уровень не ниже 80% жизнеспособных клеток в суспезии.
Е. Полученная в п. Г суспензия (далее клеточный материал) переносится стерильно в вакуумную пробирку для забора крови (вакутейнер, Gibco, США).
Ж. Все манипуляции, пп. А-Е, проводятся отдельно для каждого вида клеток.
3. Затем клеточный материал в виде аутологичных клеток волосяного фолликула, клеточный материал в виде мезенхимальных стромальных клетоки плаценты человека и клеточный материал в виде эндотелиоцитов пуповинной вены смешивается в соотношении от 1-3:1-3:1-3 (аутологичные клетки волосяного фолликула: мезенхимальные стромальные клетки плаценты человека: эндотелиоциты пуповинной вены) в зависимости от показаний врача, который учитывает возраст пациента и степень тяжести заболевания.
И. Смесь, полученная в п. З, доводится до объема 2-4 мл. Объем зависит от площади очага облысения.
Транспортировка и временное хранение клеточного материала.
A. Вакутейнер с готовым клеточным материалом помещается в термос со льдом и транспортируется к месту назначения.
Б. Транспортировка и хранение клеточного материала осуществляется стерильно при температурном режиме +2 - +8°С.
B. Срок годности клеточного материала для медицинского применения не более 6 ч.
Введение клеточного материала.
Клеточный материал вводится в мезодермальный слой кожи в зоне облысения, как обычный мезотерапевтический коктейль. При введении используется папульная техника, при этом формируются папулы различного диаметра, что позволяет клеточному материалу действовать постепенно, поступая малыми порциями из депо, максимально пролонгируя свой регенеративный эффект. Рассасывание папул при процедуре происходит от нескольких часов до нескольких дней. Размер папул может колебаться от 2 до 4 мм, глубина введения клеточного материала 2-3 мм, угол наклона иглы составляет 45 градусов.
В предложенном способе лечения аутологичные клетки волосяного фолликула выделяются, культивируются и далее при минимальном масштабировании и без пассирования вводятся в очаг облысения пациента. Особенно важным является то, что значительная часть клеток выращивается в сфероидах. Многочисленные научные исследования продемонстрировали, что двухмерное культивирование в значительной мере снижает активность аутологичных клеток волосяного фолликула, а также приводит к потере их плюрипотентных свойств, что ухудшает их регенеративный потенциал. Этого не происходит при трехмерном культивировании в сфероидах, так как это естественная ориентация клеток, наиболее близко воспроизводящая их модель деления и существования in vivo. Клетки при этом, в условиях культуры, когда на них не оказывается воздействие организма в целом, значительно омолаживаются, становятся ювенильными. Возвращаясь в кожу, они не только сами оказывают омолаживающее воздействие, но и способны запустить обратные процессы у стареющих или поврежденных клеток кожи. Полученные и размноженные in vitro клетки дермальной папилы и зоны bulge способны встраиваться в поврежденные участки волосяного фолликула и собирать их de novo. Эффект от клеточной терапии аутологичными клетками усиливается совместным введением с донорскими эндотелиоцитами, выделенными из интимы стенки пуповинной вены и стромальными плацентарными клетками. Эндотелиоциты способны стимулировать рост кровеносных капилляров в коже, а совместное их введение со стромальными клетками, выделенными из плаценты человека, в значительной степени усиливают это свойство.
Таким образом, мы получаем улучшение трофики кожи в зоне облысения за счет образования в ней новых капилляров, что усиливает кровообращение. Нерубцовая алопеция - самый распространенный вид облысения на сегодняшний день, который не всегда хорошо поддается лечению обычными методами в трихологии, но при этом доставляет пациенту массу неудобств и проблем эстетического характера. Клеточная мезотерапия данного заболевания показала очень хороший результат и сегодня является альтернативой медикаментозному лечению нерубцовой алопеции. Суть самого способа подразумевает доставку клеточного материала непосредственно в мезодерму, что позволяет введенным клеткам различного происхождения запустить регенеративные процессы в проблемной зоне. Результаты фототрихограммы пациентов, применивших данный способ лечения, показывают переход веллусных волос в терминальные, утолщение волос в зоне проведенной процедуры и остановка их потери, а также появление новых волос в зоне облысения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ НЕРУБЦОВОЙ АЛОПЕЦИИ | 2018 |
|
RU2681854C1 |
| Способ лечения нерубцовой алопеции | 2016 |
|
RU2631642C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОЧНОГО МАТЕРИАЛА ИЗ ПЛАЦЕНТЫ ЧЕЛОВЕКА | 2015 |
|
RU2599418C1 |
| Способ оценки качества клеточного материала | 2016 |
|
RU2620969C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ АЛОПЕЦИИ | 2004 |
|
RU2271819C1 |
| СПОСОБ ЛЕЧЕНИЯ АРТРОЗА | 2007 |
|
RU2360691C1 |
| Способ лечения ишемической ангиопатии сосудов нижних конечностей | 2017 |
|
RU2649498C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИЧЕСКОГО ИЛИ ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ СОСТОЯНИЙ, СВЯЗАННЫХ С ИЗМЕНЕНИЕМ КОЛИЧЕСТВА ВОЛОС | 2018 |
|
RU2716159C2 |
| Способ лечения нерубцовой алопеции | 2023 |
|
RU2823154C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАРОДОНТИТА | 2010 |
|
RU2440060C1 |

Изобретение относится к эстетической медицине и может быть использовано для лечения нерубцовой алопеции. Способ лечения нерубцовой алопеции, заключающийся в том, что предварительно получают клеточный материал в виде аутологичных клеток волосяного фолликула, для чего выдергивают волосы из волосистой части головы взрослого донора и помещают их в раствор Хенкса с антибиотиком и антимикотиком, отбирают волосы, находящиеся в стадии анагена, и отсекают от них волосяные фолликулы, которые промывают раствором Хенкса с добавлением антибиотика и антимикотика и переносят в раствор коллагеназы I-го типа, где их инкубируют, и переносят в культуральные флаконы, а через 21 день клеточный материал диссоциируют из сфероидов, образованных в культуральных флаконах, получая окончательно клеточный материал в виде аутологичных клеток волосяного фолликула, и получают также клеточный материал в виде мезенхимальных стромальных клеток плаценты человека и клеточный материал в виде эндотелиоцитов пуповинной вены, после чего каждый вид клеточного материала переносят в суспензию с использованием раствора трипсина с версеном, материал промывают физиологическим раствором с последующим переносом в стерильной среде в вакуумную пробирку, затем клеточный материал трех полученных видов, полученный при определенных условиях, смешивают, переносят в пробирку и хранят, при определенных условиях, для последующего введения через иглу в мезодермальный слой кожи в виде папул с размером от 2 до 4 мм при угле наклона иглы в 45°. Вышеописанный способ позволяет расширить арсенал способов лечения нерубцовой алопеции. 5 ил.
Способ лечения нерубцовой алопеции, включающий введение в мезодермальный слой кожи в зоне облысения клеточного материала на глубину 2-3 мм, отличающийся тем, что предварительно получают клеточный материал в виде аутологичных клеток волосяного фолликула, для чего выдергивают волосы из волосистой части головы взрослого донора и помещают их в раствор Хенкса с антибиотиком и антимикотиком, отбирают волосы, находящиеся в стадии анагена, и отсекают от них волосяные фолликулы, которые промывают раствором Хенкса с добавлением антибиотика и антимикотика и переносят в 0,1% раствор коллагеназы I-го типа, где их инкубируют в течение 1-2 ч при 37°С, и переносят в культуральные флаконы с коллагеновым покрытием с DMEM:F12, содержащей 10% фетальной телячьей сыворотки в растворе гентамицин/стрептомицин/глутамин с равным их соотношением, а через 21 день клеточный материал диссоциируют из сфероидов, образованных в культуральных флаконах, получая окончательно клеточный материал в виде аутологичных клеток волосяного фолликула, и получают также клеточный материал в виде мезенхимальных стромальных клеток плаценты человека и клеточный материал в виде эндотелиоцитов пуповинной вены, после чего каждый вид клеточного материала переносят в суспензию с использованием 0,25%-ного раствора трипсина с версеном 1:1, материал промывают физиологическим раствором путем двухкратного центрифугирования по 5 минут при 300 g с последующим переносом в стерильной среде в вакуумную пробирку, затем клеточный материал трех полученных видов смешивают в соотношении 1-3:1-3:1-3, переносят в пробирку и доводят объем смеси в ней до объема 2-4 мл и хранят при температуре +2-+8°С для последующего введения через иглу в мезодермальный слой кожи в виде папул с размером от 2 до 4 мм при угле наклона иглы в 45°.
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ АЛОПЕЦИИ | 2004 |
|
RU2271819C1 |
| Способ лечения нерубцовой алопеции | 2016 |
|
RU2631642C1 |
| IBRAHIM Z.A | |||
| et al | |||
| Stem cell therapy as a novel therapeutic intervention for resistant cases of alopecia areata and androgenetic alopecia | |||
| J Dermatolog Treat | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| US 9533012 B2, 03.01.2017 | |||
| CN 105769911 A, 20.07.2016 | |||
| ОЛИСОВА О.Ю | |||
| Богатая тромбоцитами плазма в терапии нерубцовых алопеций// Российский журнал кожных и венерических болезней, 2014, N 6, С | |||
| Способ получения молочной кислоты | 1922 |
|
SU60A1 |
Авторы
Даты
2019-07-23—Публикация
2018-11-08—Подача