Настоящее изобретение относится к композиции, включающей: (а) кондиционированную среду, обогащенную биологически активными соединениями, полученными в результате культивирования мезенхимальных стволовых клеток (МСК) в присутствии монооксида углерода СО и/или монооксида азота NO и/или H2S в газовой среде; (b) лизат культивируемых МСК. Кондиционированная среда обогащена биологически активными соединениями, по меньшей мере, Galectin-1, Thioredoxin, VEGF, Cystatin-b, IGFBP, MMIF, CRABP1, IL-6, IL-8. Композицию используют профилактического или терапевтического лечения состояний, связанных с изменением количества волос.
Алопеция - патологическое выпадение волос, приводящее к их выпадению или полному исчезновению в определенных областях головы или туловища. Одним из факторов, который вносит вклад в конечный результат лечения является изменения в цикле роста волос.
В процессе роста волосы претерпевают превращение в ходе трех отдельных стадий: (1) во время фазы роста (анагена) фолликул (т.е. корень волоса) проникает глубоко в дерму; при этом клетки фолликула быстро делятся и дифференцируются в процессе синтеза кератина, главного компонента волос. У не лысеющих людей указанная фаза роста продолжается от одного до пяти лет; (2) промежуточная фаза (катаген) характеризуется приостановкой митоза и продолжается от двух до трех недель; и (3) фаза покоя (телоген), во время которой волос остается на волосистой части головы до 12 недель, пока он не замещается новым фолликулярным ростом из нижележащего слоя волосистой части головы.
Несмотря на то что этиология и патогенез алопеции до конца не ясен, алопецию принято разделять на две формы: рубцовою и нерубцовую.
Рубцовая форма - характеризуется необратимой потерей волос и ее можно рассматривать как финал воспалительных процессов различной этиологии. В качестве причины может быть генетически обусловленные наследственные или приобретенные заболевания, приводящие к атрофии и/или дистрофии - некрозу и последующему фиброзу кожи. Разрастание соединительной ткани, нарушение адекватной трофики волосяных фолликул приводит к их необратимой гибели.
Нерубцовая алопеция наиболее часто встречающаяся форма данного заболевания. В качестве основных причин нерубцовой алопеции можно выделить: иммуно-воспалительные (аутоиммунный) процессы; нарушение биохимического баланса микроэлементов и витаминов, участвующих в процессе роста и формирования волоса; нарушение гормональной регуляции, в том числе снижение уровня рецепторов на поверхности клеток, формирующих фолликулы; системные заболевания (такие как атеросклероз, сахарный диабет), приводящие к нарушению микроциркуляции в зоне роста волос; острые и хронические состояния, сопровождающиеся повышенной продукцией нейроэндокринных факторов, вызывающих спазм сосудов микроциркуляторного русла.
Также следует отметить, что при нерубцовой алопеции аутоиммунный процесс, приводящий к отложению иммунных комплексов в стенках сосудов кожи, запускает воспалительную реакцию, которая в свою очередь приводит к нарушению микроциркуляции, развитию отека и гипоксии, в результате происходит активация клеток соединительной ткани и развития фиброза, что в свою очередь приводит к необратимым потерям волос, как при рубцовой алопеции.
В настоящее время наиболее распространенной формой является андрогенная алопеция. В зависимости от тендерной принадлежности она имеет существенные различия у мужчин и женщин. Однако, стоит выделить общие признаки данного заболевания. Вне зависимости от пола данная форма алопеции протекает как дерматоз. Отмечается неуклонное уменьшение продолжительности фазы анагена, увеличение латентной фазы и нарушение размеров сально-волосяного аппарата («фолликулярная миниатюризация»). При этом наблюдается уменьшение объема терминального волоса до размера пушкового.
Проведенные исследования показали, что временной интервал, в течение которого происходит фолликулярная миниатюризация - это ранний катаген или ранний анаген. В поздний анаген и телоген фолликулярная миниатюризация не происходит. При этом клетки, ответственные за фолликулярную миниатюризацию расположены в дермальном сосочке и соединительнотканной капсуле. Также в данном процессе участвуют клетки матрикса волосяной луковицы. Уменьшение размера дермального сосочка ускоряется за счет возмещение клеток соединительнотканной сумки, потерянных фолликулами при катагене или раннем анагене.
Следует считать доказанным, что ускорение фазы анагена недостаточно для развития алопеции. Для этого необходим увеличенный период латентной фазы, которая определяется условиями местного микроокружения, концентрацией ростовых факторов, уровнем нейротрофических гормонов, устойчивостью клеток к гипоксии. При этом, именно условия микроокружения определяется функциональной активностью клеток матрикса волосяной луковицы и изменяя метаболизм клеток дермального сосочка. Клетки матрикса, также могут воспринять сигнал от клеток фолликула в позднем анагене или катагене, что и предопределит развитие или регрессию фолликулярной миниатюризации. Предположительно, что именно низкий уровень сигнальных молекул, воздействующих на дермальный сосочек, приводит к развитию пушковых волос, а высокая концентрация молекул активирует большее количество клеток, что приводит к образованию длинного терминального волоса.
В целом, в настоящее время существует ряд вариантов лечения для людей с алопецией, хотя клинические данные показывает, что их использование зачастую весьма ограничено. Финастерид и миноксидил по-прежнему являются наиболее распространенными терапевтическими средствами, предназначенными для лечения андрогенной алопеции.
Миноксидил (Rogaine®) первоначально предназначался для антигипертензивной терапии, но впоследствии был разработан в качестве местного препарата для лечения (в виде доступных 2% и 5% растворов) при выпадении волос. Несмотря на то, что точный механизм действия миноксидила не известен, его влияние на цикл роста волос хорошо подтвержден документально. Миноксидил стимулирует рост волосяного фолликула и увеличивает период времени, в течение которого волосяной фолликул находится в фазе анагена (т.е. увеличивает соотношение анагена и телогена).
Было изучено влияние миноксидила на синтез белка VEGF как в клеточных экстрактах, так и в кондиционированной клетками дермального сосочка (DPC) среде. Инкубирование DPC с увеличением концентрации миноксидила (0,2, 2, 6, 12 и 24 мкмоль/л) индуцировало дозозависимую экспрессию мРНК VEGF [Minoxidil upregulates the expression of vascular endothelial growth factor in human hair dermal papilla cells // Lachgar S, Charveron M, Gall Y, Bonafe JL // Br J Dermatol. 1998 Mar; 138 (3): 407-11]. Однако, после прекращения применения препарата клинический эффект роста волос исчезают в течение месяцев.
Финастерид (Propecia®) является наиболее распространенным методом лечения андрогенной алопеции. Это синтетический тип II 5α редуктазы, который уменьшает превращение тестостерона в ДГТ. Увеличение роста и толщины волос можно наблюдать в течение 6 месяцев - 1 года при суточной дозе 1 мг. Среди побочных эффектов следует указать: развитие половой дисфункции у мужчин; тератогенное влияние на мужские эмбрионы и как следствие отсутствие официального разрешения к применению Финастерида у женщин.
Новые подходы к лечению являются предметом активного изучения.
Известно, что волосковые сосочковые клетки являются разновидностью мезенхимальной стволовой клетки, которая играет ключевую роль в формировании, росте и восстановлении волос [Matsuzaki et al. // Wound Repair Regen, 1998, 6: 524-530].
Однако главной их особенностью является способность индуцировать эпидермальный морфогенез in vitro и in vivo [Oliver RF. The induction of hair follicle formation in the adult hooded rat by vibrissa dermal papillae // J. Embryol. Exp. Morphol, 1970; 23: 219-236]. При внутридермальной трансплантации животным в смеси с эпидермальными стволовыми клетками они способствуют формированию волосяных фолликулов de novo. В последнее время появляются экспериментальные данные, свидетельствующие о возможном более широком потенциале стволовых клеток дермальной папиллы, что позволяет считать ее нишей мультипотентных стволовых клеток [Sieber-Blum М, Grim М, Hu GYF, and Szeder V. // Pluripotent neural crest stem cells in the adult hair follicle // Dev. Dyn, 2004;23 1: 258-269].
Эксперименты, проделанные Oshima с соавт. [Morphogenesis and renewal of hair follicles from adult multipotent stem cells // Cell, 2001;104: 233-245], однозначно доказали, что стволовые эпидермальные клетки располагаются в особом выпячивании наружного волосяного влагалища, по-английски называемого bulge. В дальнейшем было показано, что эти клетки обладают разнообразными потенциями и могут восстанавливать межфолликулярный эпидермис. Внутри этой популяции были обнаружены клетки, различающиеся по своим свойствам, но одинаково способные к генерации волоса.
Одним из подходов к лечению алопеции является методика по пересадке волос -трансплантация фолликулярной единицы (FUT). Волосяные фолликулы на волосистой части головы затылка относительно устойчивы к воздействию андрогенов, что позволяет их трансплантировать в лысеющие области. Совсем недавно были разработаны специализированные методы по пересадке волосяных фолликулов и разработан комбайн для этого (FUE), позволяющий одновременно пересаживать группу фолликулов без риска образования рубцов. Однако расходы при пересадке волос варьируют от $5000 до $20000 за курс лечения, а иногда и больше, в зависимости от количества трансплантатов и стоимости услуг хирурга. В зависимости от степени потери волос может потребоваться один или два сеанса пересадок волос. Хирургическое лечение ограничивается плотностью волос в области, откуда берутся донорские волосы и нежеланием некоторых пациентов подвергнуться достаточно инвазивной процедуре.
Наиболее перспективных методов лечения различных форм облысения (алопеции) становится использование в процессе восстановления волос клеточных технологий. Используются два основных подхода: прямые введения в очаги облысения культивируемых клеток или использование секретируемых клетками стимулирующих рост волос факторов.
Для лечения снижения количества волос проводят имплантацию или трансплантацию de novo сосочков. Способ получения de novo сосочков включает этапы: (а) получение, по меньшей мере, одного кожного сосочка из одного волосяного фолликула млекопитающего, (b) выделение фибробластов кожного волосяного сосочка из кожного сосочка механическим фиксированием указанного кожного сосочка на поверхности сосуда для клеточной культуры, посредством чего базальная пластинка перфорируется, чтобы позволить указанным кожным волосяным сосочкам выходить, (с) наращивание выделенных кожных волосяных сосочков в монослойной культуре без коллагенового покрытия, (d) сгущивание нарощенных кожных волосяных сосочков в клеточные совокупности, которые проявляют размер и форму физиологического кожного сосочка, где указанные кожные волосяные сосочки дифференцируются в сосудах с отсутствием адгезии культуры при концентрации клеток на поверхности сосуда от 1000 до 100000 кожных волосяных сосочков/см2, и (е) покрывают de novo сосочки внеклеточными матричными белками, предпочтительно коллагеном IV, фибронектином и/или ламинином [RU 2507254,20.02.2014].
Биотрансплантат для лечения алопеции, характеризующийся тем, что он содержит суспензию культуры фибробластов, в том числе фибробластов дермального сосочка волосяного фолликула и эпителиальных клеток, полученную из кожи эмбрионов на 5-8 неделях гестации или кожи взрослого человека, полученной в результате пластических операций, биопсий, липоаспиратов. [RU 2271819, 20.03.2006].
Известен способ индуцирования роста волос у млекопитающего путем введения млекопитающему популяции клеток, при этом по меньшей мере 30% указанных клеток являются мультипотентными стволовыми клетками, и в которых указанные мультипотентные стволовые клетки получены от волосяного фолликула [WO 2005071063 А1, 04.08.2005].
Одним из возможных способов лечения алопеции является также восстановления нормального микроокружения за счет использования ростовых факторов, которые продуцируют стромальные элементы, такие как стволовые клетки.
В настоящее время известен способ стимуляции роста волос субъекта, страдающего от выпадения волос, включающий введение внутрикожного или подкожно целевого участка субъекта агенту, содержащему в качестве активных ингредиентов эффективные количества bFGF, плазмы, богатой тромбоцитами (PRP), выделенные из цельной крови [US 0009173921, 03.11.2015].
Прототипом предлагаемого изобретения является композиция, для стимуляции роста волос, содержащая кондиционированную клеточную культуральную среду, полученную при культивировании эукариотических клеток в трех измерениях, а также способ предусматривающий местное нанесение индивидууму средства для изменения скорости роста и репродукции клеток [WO 2000069449, 23.11.2000]. В данном изобретении показано, что использование трехмерной культуральной системы позволяет эффективно воссоздавать микроокружение тканей, что приводит к образованию превосходной кондиционированной среды вследствие следующих факторов:
(a) трехмерный каркас обеспечивает большую площадь поверхности для прикрепления белков, а, следовательно, для адгезии стромальных клеток; и
(b) вследствие трехмерности каркаса стромальные клетки продолжают активный рост, в противоположность клеткам в монослойных культурах, которые растут до конфлюентности, испытывают контактное ингибирование и прекращают рост и деление. Продуцирование факторов роста и регуляторных факторов благодаря репликации стромальных клеток может быть частично ответственно за стимуляцию пролиферации и регуляцию дифференцировки клеток в культуре;
(c) этот трехмерный каркас позволяет осуществлять пространственное распределение клеточных элементов, которые являются более схожими с элементами, обнаруживаемыми в ткани-аналоге in vivo;
(d) увеличение потенциального объема роста для клеток в трехмерной системе может способствовать созданию локального микроокружения, стимулирующего созревание клеток;
(e) трехмерный каркас максимизирует межклеточное взаимодействие благодаря тому, что он дает больше возможностей для перемещения мигрирующих клеток, таких как макрофаги, моноциты и, возможно, лимфоциты в адгезивном слое;
(f) было установлено, что поддержание фенотипа дифференцированных клеток требует не только присутствия факторов роста/дифференцировки, но также и соответствующих клеточных взаимодействий.
Однако данная композиция не учитывает механизмов развития стимулирования роста волос, поскольку не обеспечивает получения ростовых факторов, влияющих на цикл роста волос.
Известно, что когда используются МСК из одного и того же источника, различные способы выделения и условия культивирования in vitro могут повлиять на продуцирование секретируемых биологических продуктов. Кроме того, известно, что изменения условий культивирования клеток может привести к улучшению, так и к ухудшению функционирования клеток и гибели культуры.
Поэтому целью настоящего изобретения было создать условия культивирования МСК in vitro, позволяющие получить новый качественный и количественный состав компонентов кондиционированной культуральной среды для разработки композиции для стимулирования волос, позволяющей оптимизировать стратегию и тактику ее применения.
Известно, семейство β-галактозид-связывающих белков, галектины, которые продуцируются МСК и выделяются в культуральную среду. Галектины играют важную роль в поддержании тканевого гомеостаза и регуляции врожденных и адаптивных иммунных реакций. Галектин-1, как было показано, обладает выраженным противовоспалительным эффектом и имеет две формы: одна из которых является растворимой, другая - экспрессируется на поверхности клеток. Генетическое ингибирование продукции галектина-1 в МСК приводит к ингибированию их иммуносупрессивного эффекта и восстанавливает пролиферацию Т-клеток и продукцию IFN-γ.
В ряде работ было изучено значение галектинов в процессе роста и созревания волосяных фолликул. Так в работе Wollina U. et al. [Expression of galectin-1 and -3 and of accessible binding sites during murine hair cycle // Histol Histopathol., 2000, Jan; 15 (l):85-94] было показано, что эндогенные лектины galectin-1 и galectin-3 идентифицируются в коже, включая волосяные фолликулы. В работе было проанализирована экспрессия и распределение этих галектинов и рецепторов для их связывания у мышей C57BL / 6 во время цикла волос. Было обнаружено, что экспрессия рецепторов связывания galectin-1 и galectin-3 преимущественно зависит от цикла волос.Наружная корневая оболочка (ORS) экспрессировала рецепторы к galectin-1 во время анагена IV-VI и в раннем катагенезе, при этом galectin-1 экспрессировался от раннего анагена до позднего катагена.
В другой работе было проанализирован пул эпидермальных стволовых клеток расположенных в области выпячивания корневой оболочки волосяного фолликула [Comparative phenotypic characterization of keratinocytes originating from hair follicles // Klнmа J. Et al. //J Mol Histol., 2005 Feb; 36 (l-2): 89-96]. Было показано, что кератиноциты, происходящие из волосяных фолликулов в условиях in vitro экспрессируют как галектин-1, так и рецепторы для связывания галектину-1. Обнаружение галектина-1, а также рецепторов для его ядерного связывания, указывает на внутриклеточную функцию этого лектина.
Таким образом, галектин-1 можно считать потенциальным маркером отдельной клеточной популяции, которая принимает участие в процессах дифференцировки кератиноцитов фолликула, и, следовательно, возможно использовать для регулирования фазы роста волос.
Одним из биологически активных соединений, стимулирующих рост является сосудистый эндотелиальный фактора роста VEGF, экспрессия которого изменяется во время цикла волос.VEGF мРНК сильно экспрессируется в дермальных сосочковых клетках (DPC) в фазе анагена, но во время фаз катагена и телогена VEGF уровень мРНК менее выражен. При этом перифолликулярный ангиогенез коррелирует с повышением экспрессии мРНК VEGF фолликулярными кератиноцитами наружной оболочки корня [Control of hair growth and follicle size by VEGF-mediated angiogenesis // Kiichiro Yano et al. // J Clin Invest, 2001;107 (4): 409-417].
В ряде работ показано, что тиоредоксин является важнейшим фактором защиты кожи от повреждающего действия гипоксии и гипоксии-реперфузии. Предварительное введение данного фактора или трансфецированных клеток, которые продуцируют данный фактор, вызывает анти-апоптотический и антифиброзный эффект [Thioredoxin Protects Skin Flaps from Ischemia-Reperfusion Injury: A Novel Prognostic and Therapeutic Target.// Yin Z. et al.// Plast Reconstr Surg., 2016, Feb; 137 (2): 511-21; Bone marrow-derived mesenchymal stem cells expressing thioredoxin 1 attenuate bleomycin-induced skin fibrosis and oxidative stress in scleroderma // Jiang M. et al. // J Invest Dermatol., 2017 Jan 26. pii: S0022-202X (17) 30049-0].
Следовательно, секреция биологически активных соединений, активных в отношении регуляции цикла и индукции роста волос в кондиционированную клеточную среду, открывает новые возможности в получении композиции для стимулирования роста волос и/или предотвращения выпадения волос.
Техническими результатами настоящего изобретениями является получение композиции, включающей кондиционированную среду, полученную при культивировании мезенхимальных стволовых клеток в подходящей культуральной среде в нормоксических или гипоксических условиях в присутствии СО и/или NO и/или H2S в газовой среде, и лизат культивируемых клеток, с получением тем самым кондиционированной среды, которая отличается по спектру синтезируемых белков: Galectin-1 (галектин-1), Thioredoxin (тиоредоксин), VEGF, Cystatin-b, IGFBP (Insulin-like growth factor-binding protein 4), MMIF (Macrophage migration inhibitory factor), CRABP1 (Cellular retinoic acid-binding protein 1), IL-6, IL-8 и их количественному составу, по меньшей мере, в 1,5-15 раз выше по сравнению с культивированием в нормальных условиях.
Кроме того, неожиданно было обнаружено, что повышение уровня указанных биологически активных соединений носит не линейный характер зависимости от газового состава, а концентрация их возрастает экспоненциально.
Полученное оптимальное количественное сочетание в кондиционированной среде биологически активных соединений, по меньшей мере, Galectin-1, Thioredoxin, VEGF, Cystatin-b, IGFBP, MMIF, CRABP1, IL-6, IL-8, секретированных МСК в нормоксических или гипоксических условиях в присутствии СО и/или NO и/или H2S в комплексе с лизатом культивируемых клеток оказывает выраженный стимулирующий эффект роста волос, за счет регуляции цикла роста волос: пролиферации дермальных сосочковых клеток, увеличения количества и размера фолликулов, в том числе за счет стимуляции васкуляризации.
Использование композиции, полученной при культивировании МСК с тканеспецифическим антигеном в присутствии СО и/или NO и/или H2S в газовой среде приводит к достоверно более выраженному результату, индуцируя стволовые клетки волосяных фолликулов для вхождения в фазу анагена, что проявляется в повышении количества волосяных фолликул на единицу площади.
Применение композиции, обогащенной в большей степени галектином-1, являющимся иммуносупрессантом, позволяет при аутоиммунных формах алопеции добиться эффекта иммуномодуляции, снижая уровень воспалительной реакции, остановить разрушение фолликулов клетками иммунной системой и нормализовать рост волос.
В настоящем изобретении описаны новые композиции, содержащими кондиционированную среду, обогащенную биологическими активными соединениями, влияющих на цикл роста волос, и способы их получения.
Композиция для профилактического или терапевтического лечения состояний, связанных с изменением количества волос, включает: (а) кондиционированную среду, обогащенную биологически активными соединениями, полученными в результате культивирования мезенхимальных стволовых клеток (МСК) в присутствии монооксида углерода СО и/или монооксида азота NO и/или H2S в газовой среде; (b) лизат культивируемых МСК.
Композиция для профилактического или терапевтического лечения состояний, связанных с изменением количества волос, включает: кондиционированную среду, обогащенную биологически активными соединениями, получают в результате культивирования мезенхимальных стволовых клеток (МСК) в гипоксических условиях в присутствии монооксида углерода СО и/или монооксида азота NO и/или H2S в газовой среде. (b) лизат культивируемых МСК. Гипоксические условия культивирования: концентрация кислорода составляет от 1% до 20%.
Кондиционированная среда, обогащенная биологически активными соединениями, и может быть получена в результате культивирования мезенхимальных стволовых клеток (МСК), по меньшей мере, с одним тканеспецифическим антигеном в присутствии СО и/или NO и/или H2S в газовой среде. Где в качестве источника тканеспецифического антигена могут быть, по меньшей мере, клеточные популяции: фибробласты соединительнотканной оболочки, кератиноциты, эпидеральные клетки волосяной матрицы, меланоциты или их лизат.
Кондиционированная среда обогащена биологически активными соединениями, по меньшей мере, Galectin-1, Thioredoxin, VEGF, Cystatin-b, IGFBP, MMIF, CRABP1, IL-6, IL-8.
Композиции могут бать адсорбированы на поверхности частиц перфторуглеродной эмульсии, стабилизированной плюроником.
Кроме того, эта композиция может быть приготовлена в сочетании с фармацевтически приемлемым веществом.
Настоящее изобретение относится к применению этих новых композиций для профилактического или терапевтического лечения состояний, связанных с изменением количества волос.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1. Гистология кожи мыши (контрольная группа). Окраска гемотоксилин-эозином:
A - Увеличение ×200; Б - Увеличение ×100. На гистологических срезах представлена кожа животных контрольной группы, которым наносили композицию, полученную при культивировании клеток в условиях нормоксии (5% CO2, 21% O2, 74% N2).
Фиг. 2. Гистология кожи мыши (опытная группа). Окраска гемотоксилин-эозином:
А - Увеличение ×100; Б - Увеличение ×200. На гистологических срезах представлена кожа животных опытной группы в зоне нанесения композиции.
Фиг. 3. Гистология кожи мыши (опытная группа). А - Увеличение ×100; Б - Увеличение ×200. На гистологических срезах видно формирование новых волосяных фолликул в ассоциации с имеющимися фолликулами (указано стрелкой).
Фиг. 4. Гистология кожи мыши (опытная группа). Окраска гемотоксилин-эозином. А -Увеличение ×200; Б - Увеличение ×200. На гистологических срезах представлены последовательные стадии формирования волосяных фолликул de novo.
Фиг. 5. Кожа мыши через 14 дней после нанесения композиции, содержащей кондиционированную среду, обогащенную биологически активными соединениями, полученными в результате культивирования МСК с тканеспецифическим антигеном в присутствии СО (гель наносился радиально по расходящимся от центральной точки лучам).
Фиг. 6. Гистология кожи мыши. Окраска гемотоксилин-эозин. А - контрольная группа животных (условия культивирования 5% CO2, 15% O2, 79,975% N2, 250 ppm СО (полученная по примеру 1)), увеличение ×100; Б - опытная группа животных (условия культивирования 5% CO2, 15% O2, 79,975% N2, 250 ppm СО и добавление тканеспецифического антигена (полученная по примеру 3)), увеличение ×100. На гистологических срезах представлены последовательные стадии формирования волосяных фолликул de novo.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Композиция для профилактического или терапевтического лечения состояний, связанных с изменением количества волос включает: (а) кондиционированную среду, обогащенную биологически активными соединениями, полученными в результате культивирования мезенхимальных стволовых клеток (МСК) в присутствии монооксида углерода (СО) и/или монооксида азота (NO), и/или сероводорода (H2S); (b) лизат культивируемых МСК.
В другом варианте, композиция для профилактического или терапевтического лечения состояний, связанных с изменением количества волос включает: (а) кондиционированную среду, обогащенную биологически активными соединениями, получают в результате культивирования мезенхимальных стволовых клеток (МСК) в гипоксических условиях в присутствии монооксида углерода СО и/или монооксида азота NO и/или H2S в газовой среде.
Настоящее изобретение относится к кондиционированной среде, обогащенной биологически активными соединениями, секретируемыми мезенхимальными стволовыми клетками. Биоактивные соединения включают факторы роста, цитокины, хемокины, антиоксиданты и другие факторы, которые, как известно, участвуют или опосредуют биологический процесс, где биологический процесс включает клеточную пролиферацию и миграцию клеток.
Биологически активные соединения, выбраны из группы, включающей, по меньшей мере, Galectin-1 (галектин-1), Thioredoxin (тиоредоксин), VEGF, Cystatin-b, IGFBP (Insulin-like growth factor-binding protein 4), MMIF (Macrophage migration inhibitory factor), CRABP1 (Cellular retinoic acid-binding protein 1), PGE-2, PDGF, KGF, IL-6, IL-8, IL-10 или любую их комбинацию. Следует отметить, что данный список, не является полным перечнем факторов и приводится лишь для дополнительной характеристики кондиционированной среды в отношении концентрации некоторых из биологически активных факторов, присутствующих в среде настоящего изобретения.
В одном воплощении настоящего изобретения, концентрация галектина-1 в кондиционированной среде полученная в результате культивирования МСК в условиях нормоксии или гипоксии в присутствии СО и/или NO и/или H2S по сравнению с вырабатываемым количеством этого фактора в нормальных условиях культивирования повышается в диапазоне от около 1,1 до около 15 раз.
В другом воплощении настоящего изобретения, концентрация тиоредоксина в кондиционированной среде полученная в результате культивирования МСК в условиях нормоксии или гипоксии в присутствии СО и/или NO и/или H2S по сравнению с вырабатываемым количеством этого фактора в нормальных условиях культивирования повышается в диапазоне в диапазоне от около 1,4 до около 9,5 раз.
В еще одном воплощении настоящего изобретения, концентрация VEGF в кондиционированной среде полученная в результате культивирования МСК в условиях нормоксии или гипоксии в присутствии СО и/или NO и/или H2S по сравнению с вырабатываемым количеством этого фактора в нормальных условиях культивирования повышается в диапазоне от около 1,8 до около 7,5 раз.
В еще одном воплощении настоящего изобретения, концентрация IL-6 кондиционированной среде полученная в результате культивирования МСК в условиях нормоксии или гипоксии в присутствии СО и/или NO и/или H2S по сравнению с вырабатываемым количеством этого фактора в нормальных условиях культивирования повышается в диапазоне от около 1,2 до около 8,8 раз.
В еще одном воплощении настоящего изобретения, концентрация IGFBP кондиционированной среде полученная в результате культивирования МСК в условиях нормоксии или гипоксии в присутствии СО и/или NO и/или H2S по сравнению с вырабатываемым количеством этого фактора в нормальных условиях культивирования повышается в диапазоне от около 1,3 до около 9,7 раз.
В еще одном воплощении настоящего изобретения, концентрация MMIF кондиционированной среде полученная в результате культивирования МСК в условиях нормоксии или гипоксии в присутствии СО и/или NO и/или H2S по сравнению с вырабатываемым количеством этого фактора в нормальных условиях культивирования повышается в диапазоне от около 1,2 до около 9,1 раз.
В еще одном воплощении настоящего изобретения, концентрация CRABP1 кондиционированной среде полученная в результате культивирования МСК в условиях нормоксии или гипоксии в присутствии СО и/или NO и/или H2S по сравнению с вырабатываемым количеством этого фактора в нормальных условиях культивирования повышается в диапазоне от около 1,5 до около 7,3 раз.
Следует отметить, что данный список биологически активных соединений не является полным перечнем факторов и приводится лишь для дополнительной характеристики кондиционированной среды в отношении концентрации некоторых из биологически активных соединений, присутствующих в среде настоящего изобретения.
Для определения состава кондиционированной среды могут быть использованы методы мембранной фильтрации, потенциометрического титрования, денситометрического анализа, иммуноферментного анализа (ELISA) и масс-спектроскопического анализа.
Композиция для профилактического или терапевтического лечения состояний, связанных с изменением количества волос включает: (а) кондиционированную среду, обогащенную биологически активными соединениями, полученную в результате культивирования МСК, по меньшей мере, с одним тканеспецифическим антигеном в нормоксических или гипоксических условиях в присутствии монооксида углерода (СО) и/или монооксида азота (NO), и/или сероводорода (H2S); (б) лизат культивируемых МСК.
В качестве источника тканеспецифического антигена могут быть различные клеточные популяции, по меньшей мере: фибробласты соединительнотканной оболочки, кератиноциты, эпидеральные клетки волосяной матрицы и меланоциты или их лизат. Человеческие клетки волосяных фолликулов, растущие в культуре, включают фибробласты фолликулярных сосочков, кератиноциты наружной корневой оболочки (ORS) и герминативные эпидермальные клетки из волосяной матрицы [Tobin et al. // J. Invest. Dermatology, 1995, 104 (1), 86-88].
Кондиционированная среда может быть адсорбирована на поверхности частиц перфторуглеродной эмульсии, что обеспечивает:
1. Улучшение трансдермального переноса белков в глубокие слои кожи;
2. Защищает биологически активные белки и факторы роста от инактивации гидролитическими ферментами, находящимися на поверхности клеток кожи и в межклеточном веществе;
3. За счет процесса десорбции с поверхности перфторуглеродной частицы обеспечивает поддержание высокой концентрации белков и факторов роста в коже;
4. Повышает функциональную активность сорбированных белков за счет эффекта иммобилизации в поверхностно-активном слое.
В частности, композиция адсорбирована на поверхности частиц перфторуглеродной эмульсии, стабилизированных поверхностно-активными веществами. В качестве перфторуглеродов, может быть использованы, но не ограничиваться перфтордекалин и/или перфторметилциклогексилпиперидин и/или перфтортрибутиламин и/или перфтороктилбромид. В качестве поверхностно-активного вещества могут быть ионногенные и неионогенные вещества, могут быть использованы, но не ограничиваться: Проксанол 268 и/или Pluronic 10R5 и/или Pluronic F-127 и/или Tetronic 90R4 и/или Tetronic 701 и/или фософолипиды.
Частицы перфторуглеродной эмульсии получают, смешивая водно-солевую основу (например раствор Хенкса), перфторуглерод (например перфтороктилбромид) или смесь перфторуглеродов и поверхностно-активное вещество (например проксанол 268) или смесь поверхностно-активных веществ. Полученную смесь пропускают через гомогенизатор высокого давления (например «Донор-2») для получения стабильной и гомогенной эмульсии.
Композиция по настоящему изобретению дополнительно содержит, по меньшей мере, одно фармацевтически приемлемое вещество. В качестве фармацевтически приемлемого вещества может выступать фармацевтически приемлемый носитель, при этом в качестве фармацевтически приемлемого носителя может быть дерматологически приемлемый носитель.
Фармацевтически приемлемый означает подходящий для использования у млекопитающих. Дерматологически приемлемый носитель относится к носителю, который можно наносить на кожу или волосы и который будет позволять композиции диффундировать к месту своего действия.
В одном из воплощений настоящего изобретения, в качестве фармацевтически приемлемого вещества может быть наполнитель выбранный из группы, включающей добавку, носитель, гранулирующие агенты, связующие агенты, смазывающие агенты, агенты, способствующие распаду, подсластители, глиданты, антиадгезивы, антистатики, поверхностно-активные вещества, антиоксиданты, камеди, покрывающие агенты, окрашивающие агенты, ароматизирующие агенты, покрывающие агенты, пластификаторы, консерванты, суспендирующие агенты, эмульгирующие агенты, растительный целлюлозный материал и агенты сфероидизации или любые их комбинации.
В другом воплощении настоящего изобретения, наполнитель выбран из группы, включающей гидроксиэтилцеллюлозу, метилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, карбопол, ЭДТА, метилпарабен, пропилпарабен, деионизированную воду, глицерин, DL-пантенол, D-пантенол, феноксиэтанол, аллантоин, ПЭГ, очищенную воду, ксантановая камедь, натрия РСА, глюконолактон, бензоат натрия, гидроксид натрия, феноксиэтанол, этилгексилглицерин, натрия полиакрилат, каприловый или каприновый триглицерид, минеральное масло, три (PPG-3 миристиловый эфир) цитрат, сорбитан лаурат, тридецет-6, PEG-75 ланолин, бета глюкан, гиалуронат натрия, фосфатидилхолин, холестерин, эфирное масло, DL-a-токоферол ацетат и циклодекстрин или любую их комбинацию.
Полученную композицию, состоящую из обогащенной кондиционированной среды и разрушенных культивированных МСК, можно использовать для приготовления инъекционных форм, местных лекарственных форм, можно высушивать, лиофилизировать, замораживать и т.д.
Общее количество кондиционированной среды в композиции может изменяться от 0,1 до 99,9% по объему. Общее количество белка в композиции может изменяться от 5 мг до 10 мг белка в 1 мл фармацевтически приемлемого носителя.
Лиофилизированную композицию в виде фармацевтических композиций с различными фармацевтически приемлемыми наполнителями, растворителями или носителями. Для внутрикожного, подкожного или внутримышечного введения композиции можно приготовить в виде стерильных суспензий, растворов или эмульсий. Альтернативно композиции могут находиться в виде порошка для последующего восстановления подходящим растворителем, включая в качестве примера и без ограничения, стерильную непирогенную воду, солевой раствор, буфер или декстрозу.
Дополнительно композиция может быть получена с добавлением антибиотика, противовоспалительного агента, противовирусного агента, противогрибкового агента, гормона, противоопухолевого агента, анальгетика, анестезирующего средства или любой их комбинации. При этом добавление того или иного агента производится с учетом необходимого терапевтического эффекта, определяемого специалистом.
Композиция представляет собой композицию вводимую парентерально или местно, вводимая парентерально, по меньшей мере, вводится внутримышечно, внутривенно, подкожно.
В еще одном воплощении настоящего изобретения, композицию приготавливают в виде дозированных форм, выбранных из группы, содержащей масляные суспензии, гидрогели, мази, гели, лосьоны, сыворотки, эмульсии, кремы, спреи, капли или любые их комбинации. Композицию применяют для стимулирования роста волос.
Настоящего изобретения относится к набору для профилактического или терапевтического лечения состояний, связанных с изменением количества волос, содержащему композицию, включающую: (а) кондиционированную среду, обогащенную биологически активными соединениями, полученными в результате культивирования мезенхимальных стволовых клеток (МСК) в присутствии монооксида углерода (СО) и/или монооксида азота (NO), и/или сероводорода (H2S); (b) лизат культивируемых МСК и (с) инструкцию по применению.
Еще один вариант осуществления настоящего изобретения относится к набору для профилактического или терапевтического лечения состояний, связанных с изменением количества волос, содержащему композицию, включающую: (а) кондиционированную среду, обогащенную биологически активными соединениями, полученную в результате культивирования мезенхимальных стволовых клеток (МСК) в гипоксических условиях в присутствии монооксида углерода (СО) и/или монооксида азота (NO), и/или сероводорода (H2S); (b) лизат культивируемых МСК и (с) инструкцию по применению.
Еще один вариант осуществления настоящего изобретения относится к набору для профилактического или терапевтического лечения состояний, связанных с изменением количества волос, содержащему композицию, включающую: (а) кондиционированную среду, обогащенную биологически активными соединениями, полученную в результате культивирования мезенхимальных стволовых клеток (МСК), по меньшей мере, с одним тканеспецифическим антигеном в гипоксических условиях в присутствии монооксида углерода (СО) и/или монооксида азота (NO), и/или сероводорода (H2S); (b) лизат культивируемых МСК и (с) инструкцию по применению.
Настоящее изобретение включает способ получения композиции для профилактического или терапевтического лечения состояний, связанных с изменением количества волос, включающий:
(1) культивирование мезенхимальных стволовых клеток в присутствии СО и/или NO и/или H2S в газовой среде на подходящей культуральной среде, с получением кондиционированной среды, обогащенной биологически активными соединениями;
(2) удаление кондиционированной среды;
(3) получение лизата культивируемых МСК;
(4) объединение кондиционированной среды с лизатом культивируемых МСК;
(5) стерилизация полученной кондиционированной среды.
В другом варианте кондиционированную среду, обогащенную биологически активными соединениями, получают в результате культивирования мезенхимальных стволовых клеток (МСК) в гипоксических условиях в присутствии монооксида углерода СО и/или монооксида азота NO и/или H2S в газовой среде.
Мезенхимальные стволовые клетки, или МСК, предназначенные для кондиционирования культуральной питательной среды и использования в качестве одного из компонентов композиции, могут быть выделены хорошо известными способами в данной области техники [Mackay et al. // Tissue Eng., 1988, 4: 415-428; William et al // Am.Surg., 1999, 65: 22-26].
Мезенхимальные стволовые клетки могут быть получены, по меньшей мере, из костного мозга, жировой ткани, слизистой оболочки десны, пульпы зуба, пуповины, плаценты, пуповинной крови.
Мезенхимальные стволовые клетки могут быть коммитированными или некоммитированными в отношении направления дифференцировки.
Для специалиста в данной области представляется очевидным использование подходящей питательной среды для культивирования мезенхимальных стволовых клеток и получения эффективной системы и кондиционированной среды по настоящему изобретению. В настоящем изобретении используют множество коммерческих питательных сред, содержащих неорганические соли, источник энергии, аминокислоты, витамины В, такие как среда Дульбекко, модифицированная Иглом (DMEM), среда Minimal Essential Medium (MEM), M199, RPMI 1640, среда Дульбекко, модифицированная Исковом (EDMEM).
Изобретение также включает способ получения композиции, где кондиционированная среда, обогащенна биологически активными соединениями, получена в результате культивирования мезенхимальных стволовых клеток (МСК), по меньшей мере, с одним тканеспецифическим антигеном в присутствии СО и/или NO и/или H2S в газовой среде.
В качестве источника тканеспецифического антигена может быть использованы как жизнеспособные клетки, так и клетки, подвергнутые разрушению с использованием механических, физических или химических воздействий. Клетки могут быть получены при пункционной биопсия донорной кожи млекопитающего и выделены определенным способами известными специалисту.
Так, например, ткань может быть дезинтегрированы механически и/или обработаны расщепляющими ферментами и/или хелатообразующими агентами, которые ослабляют связи между соседними клетками, что дает возможность диспергировать данную ткань в суспензию отдельных клеток без значительного разрушения клетки. Ферментативная диссоциация может быть осуществлена путем измельчения ткани и обработки указанной измельченной ткани любыми из ряда расщепляющих ферментов, взятых либо отдельно, либо в комбинации. Такими ферментами являются, но не ограничиваются ими, трипсин, хемотрипсин, коллагеназа, эластаза и/или гиалуронидаза, ДНКаза, проназа, диспаза и т.п. Механическое разрушение может быть также осуществлено рядом способов, включая, но не ограничиваясь ими, использование дезинтеграторов, смесителей, сит, гомогенизаторов, ячеек под давлением или ультразвуковых устройств и т.п.
Добавление меланоцитов способствует пигментации волос, образующихся de novo. Фибробласты кожного волосяного сосочка и соединительнотканной оболочки подобны стволовым клеткам по характеру и обладают специфическими индуцирующими рост волоса свойствами. Волосяной фолликул восстанавливает себя посредством взаимодействий между компетентными эпителиальными стволовыми клетками и мощными индуктивными кожными клетками в течение их цикла роста.
При этом дополнительное добавление тканеспецифического антигена, состоящего из клеточных популяций или их лизата (фибробласты соединительнотканной оболочки, кератиноциты, эпидеральные клетки волосяной матрицы и меланоциты, полученных при пункционной биопсии кожи), в культуральную среду приводит к изменению метаболической активности культивированных клеток, что проявляется в изменении внутриклеточного синтеза и секреции клеточных метаболитов.
Супернатант тканеспецифического антигена добавлялся в культуральную среду в соотношении в среднем 1:30 (проверялся диапазон от 1:10 до 1:80).
Совместное культивирование МСК с тканеспецифическим антигеном длится, по меньшей мере, 72 часа, предпочтительно от 3-х до 7-суток.
Условия культивирования мезенхимальных стволовых клеток.
Нормоксические условия характеризуются инкубацией клеточных культур при содержании 21% кислорода (условия нормоксии) и 5% CO2.
Для создания гипоксии в среде культивирования использовали герметичную камеру (Stem Cell Technologies, Канада), в которую подавали газовую смесь (95% N2, 5% CO2) до установления в среде необходимой концентрации кислорода. Содержание кислорода и давление в газовой среде контролировали с помощью встроенных в камеру датчиков.
Гипоксические условия характеризуются более низкой концентрацией кислорода по сравнению с нормоксическими условиями культивирования. В частности, характеризуются концентрацией кислорода от примерно 1% до 20%, от 1% до 19%, от 1% до 18%, от 1% до 17%, от 1% до 16%, 1% до 15%, от 1% до 14%, от 1% до 13%, от 1% до 12%, 1% до 11%, 1% до 10%, от 1% до 9%, от 1% до 8%, от 1% до 7%, от 1% до 6%, 1% до 5%, от 1% до 4%, от 1% до 3%, от 1% до 2%. Наиболее оптимальным является культивирование клеток при концентрации кислорода от 5% до 16%.
Эффективные количества монооксида углерода (окиси углерода, СО) для использования в настоящем изобретении включают в себя, например, количества, которые для нетоксичны для культивируемых клеток in vitro (поддерживается стабильная выживаемость культуры, сохранность клеток) и которые усиливают функциональную активность МСК, повышая уровень секретируемых ростовых факторов МСК по сравнению с вырабатываемым количеством этих факторов в нормальных условиях культивирования, т.е. в условиях нормоксии.
Основной газовый состав, это 1-21% О2, 5% CO2, остальное инертные газы, основной из которых N2. Для получения композиции в основной газовый состав добавляются изолировано или в комбинации следующие газы: NO, СО, H2S. При культивировании в основном газовом составе может снижаться уровень О2 с 21% до 1%. Концентрация NO, H2S, СО может быть, как стабильной, так и изменяться в процессе культивирования как в сторону повышения, так и в сторону понижения. Концентрация NO может находится в диапазоне от 10 ppm до 1000 ppm; концентрация СО может находится в диапазоне от 1 ppm до 1000 ppm. Концентрация H2S в газовой среде культивирования эквивалентна той, что образуется в закрытом объеме при добавлении в водную среду NaHS (водный раствор, содержащий NaHS находится в замкнутом объеме, где проходит культивирование клеток, но не смешивается со средой культивирования) в концентрации от 0,1 μМ до 1 mM.
Содержание окиси углерода предпочтительно составляет по меньшей мере около 0,001 масс. %, например, по меньшей мере около 0,005, 0,01, 0,02, 0,025, 0,03, 0,04, 0,05, 0,06, 0,08, 0,10, 0,15, 0,20, 0,22, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, или 1 масс. %. Предпочтительные диапазоны окиси углерода включают в себя примерно от 0,001 до 0,25 масс. %.
Газообразные составы для культивирования МСК в соответствии с настоящим изобретением, как правило, содержат 70-94 масс. % азота, примерно от 1 до 21 масс. % кислорода, углекислого газа от 4 до 6 масс. % и примерно от 1 ppm до 1000 ppm СО (окиси углерода).
В одном варианте, газовый состав включает содержание азота около 74 масс. %, содержание кислорода составляет около 21 масс. %, содержание углекислого газа около 5%, а содержание окиси углерода составляет примерно от 0,0001 до 0,25 масс. %.
В другом варианте, содержание азота в газообразной композиции составляет около 80 масс. %, содержание кислорода составляет около 15 масс. %, содержание углекислого газа около 5 масс %, а содержание окиси углерода составляет примерно от 1 ppm до 1000 ppm.
Гипоксические условия могут создаваться и поддерживаться с помощью культурального аппарата, который позволяет контролировать концентрации окружающего газа.
В настоящем изобретении способ поддержания или культивирования МСК in vitro можно осуществить в любой камере или в пространстве, пригодных для создания газовой среды, которая включает в себя соответствующий уровень газа окись углерода. Такие камеры содержат, например, инкубаторы, баллоны для смешивания, или любую емкость, пригодную для культивирования или содержания клеток, бутыли, содержимое которых перемешивается при их вращении, колбы для культивирования клеток, чашки Петри и пробирки. Например, можно использовать СО2-инкубатор, в который газ окись углерода поставляется непрерывной струей из емкости, которая содержит этот газ. В качестве другого примера, можно использовать бутыль, содержимое которой перемешивается при ее вращении и в которую включена окись углерода, для создания внутри перемешивающей бутыли соответствующей газовой среды.
Культуры выдерживают в инкубаторе для поддержания подходящих условий -контролируемой температуры, влажности и газообразной атмосферы для культуры клеток. Предпочтительные условия включают температуру от приблизительно 34°С до приблизительно 38°С, более предпочтительно 37±1°С. Специалисту очевидно, что температурные условия культивирования можно выбрать и/или изменить в зависимости от типа культивируемой клетки.
Кондиционирование означает синтез и секрецию клетками биологически активных соединений (цитокинов, белков и компонентов внеклеточного матрикса) в свежую среду при контактировании, выдерживании, обмене и взаимодействии между клетками и средой.
В соответствии с аспектами настоящего изобретения период кондиционирования может изменяться, предпочтительно в течение от 2 ч до 7 суток, более предпочтительно от 60 ч до 84 часов.
Затем кондиционированную среду отделяют от клеточной системы, содержащей клетки в культуре, и собирают полностью в отдельную емкость.
Культивированные клетки используют для получения клеточного лизата.
Клеточный лизат культивированных МСК получают путем разрушения клеток с использованием физических (ультразвук, электрический разряд, замораживание оттаивание), химических (ферменты, химические реагенты), механических (растирание) и других факторов, а также их комбинации. В процессе разрушения культивируемых клеток возможно, но не обязательно, использовать физические (снижение температуры, использование инертных газов), химические (ингибиторы протеолитических ферментов) и другие факторы, а также их комбинацию для снижения скорости процесса разрушения клеточных метаболитов протеолитическими ферментами.
Полученная комбинация подвергается стерилизации.
Стерилизация, преимущественно осуществляется методом фильтрации через фильтры с диаметром пор от 0,2 мкм до 0,5 мкм, но не ограничивается данным методом. Стерилизация с помощью фильтра обеспечивает сохранение нужной биологической активности.
Кондиционированная среда, богатая биологически активными соединениями, может быть подвергнута концентрированию с использованием известной специалисту технологии. Способ концентрации предполагает использование конкретной молекулярной массы отсечки для того, чтобы сохранить все необходимые биологически активные факторы, которые стимулируют рост волос в соответствии с настоящим изобретением.
Например, данная среда может быть подвергнута 10-20-кратному концентрированию с использованием концентрирующего устройства, работающего при избыточном давлении и имеющего фильтр с отсечкой 10000 мол. масс.(Amicon, Beverly).
Кроме того, кондиционированная среда может быть также обработана для выделения и очистки продукта. Используемые методы выделения и очистки продукта, которые позволяют сохранить оптимальную активность, хорошо известны специалистам. Такими методами являются, но не ограничиваются ими, гель-хроматография (с использованием матриц, таких как сефадекс), ионообменная хроматография, аффинная хроматография на хелате металла с нерастворимой матрицей, такой как перекрестно-сшитая агароза, ВЭЖХ-очистка и гидрофобная хроматография кондиционированной среды.
Кондиционированная среда может быть лиофилизирована и восстановлена известными специалисту методами в данной области техники. Восстановленная кондиционированная среда имеет коэффициент концентрации в диапазоне от 1 до 100.
Способ получения заявленной композиции включает объединение композиции с по меньшей мере одним фармацевтически приемлемым веществом, где в качестве фармацевтически приемлемого вещества может выступать фармацевтически приемлемый носитель.
Настоящее изобретение может быть использовано для профилактического или терапевтического лечения состояний, связанных с изменением количества волос, включающий местное применение индивидууму композиции в эффективном количестве.
Эффективное количество - это то количество композиции, содержащей кондиционированную среду и лизат МСК, как предложено в данной заявке, требуемое для обеспечения клинически значимого снижения заболевания, связанного с изменением количества волос. Результатом может быть снижение и/или облегчение признаков, симптомов или причин заболевания. Например, терапевтически эффективное количество может обладать, по меньшей мере, 1,2-кратным, 1,5-кратным, 2-кратным, 5-кратным или более эффектом сравнительно с контролем. Подходящее "эффективное" количество в любом отдельном случае может быть определено с помощью методов, таких как исследование с увеличением дозы.
В качестве 1 дозы принимали количество белка, полученное при разрушении 106 клеток культивированных МСК в 5 мл культуральной среды, а также белок, содержащийся в культуральной среде, в которой клетки культивировались в среднем в течение 3-5 дней.
Способ применяют при состояниях, связанных со снижением количества волос на голове, бровей, ресниц.
Способ включает стимулирование роста волос, включает, по меньшей мере, стимулирование роста волос и/или предотвращение выпадения волос на голове, бровей, ресниц.
Способ применяют при всех типах алопеции, включая выпадение волос вследствие химиотерапии и/или воздействия химических веществ или радиации, для лечения алопеции, включая телогеновую алопецию, гнездной алопеции, рубцовой алопеции, андрогенной алопеции, самопроизвольного выпадения волос, врожденного гипотрихоза, выпадения волос из-за инфекционных агентов или болезни, дефектов волосяных стержней, склеродермии, опоясывающего лишая, полной плешивости, универсальной плешивости, травматической алопеции, тракционной алопеции, выпадения волос вследствие гормональных изменений, выпадения волос вследствие гипер- или гипотиреоза, муцинозной алопеции, выпадения волос из-за инфекции кожи головы, волчанки или дефицита железа.
Стимулирование роста волос включает стимулирование увеличения общей массы и/или длины волос. Указанное увеличение включает увеличение длины и/или скорости роста волосяных стрежней (т.е. фолликулов), увеличение количества волосков и/или увеличение толщины волос. Некоторые или все из указанных выше конечных результатов могут быть достигнуты пролонгированием или активацией анагена, фазы роста волосяного цикла, или укорочением или задержкой фаз катагена и телогена.
В обычном варианте осуществления настоящего изобретения композицию применяют местно для стимулирования роста волос. Композицию наносят непосредственно на волосистую часть головы, особенно на те области, на которых волосы отсутствуют или истончены.
Как правило, композиция неоднократно применяется в течение длительного периода времени местно на часть тела, которая будет лечиться, например, веки, брови, кожа или кожа головы.
Инъекции осуществляют внутрикожно и/или подкожно, причем при инъекциях вводят не более 0,3 мл композиции в каждой инъекции, а при подкожных - по 0,5-1,5 мл.
Инъекции осуществляют радиально по расходящимся от центральной точки лучам или в шахматном порядке с расстоянием между уколами 0,5-1,5 см.
Для уменьшения болевых ощущений композицию разводят в физрастворе с добавлением анестетика (например, лидокаина/новокаина) или перед инъекциями обрабатывают поверхность кожи мазью или спреем с анестетиком.
Предпочтительный режим дозирования обычно включает регулярное, такое как ежедневное, применение для периода лечения; по меньшей мере, один раз в неделю; по меньшей мере, один раз в две недели; по меньшей мере, один раз в три недели; по меньшей мере один раз в месяц. Наиболее предпочтительным является использование один раз в две недели.
Дополнительно, для увеличения проницаемости композиции по настоящему изобретению можно использовать физические методы, которые, по меньшей мере, включают ионофорез, ультразвук, электропорацию, микронидлинг или абразивы, удаляющие верхний слой кожи.
В одном из вариантов осуществления способ стимулирования волос включает микронидлинг.Это косметическая процедура, направленная на улучшение состояния кожи и заключающаяся в нанесении множественных уколов тонкими иглами в верхние слои эпидермиса, благодаря чему в кожу активно проникают лечебные препараты.
Микронидлинг выполняется при помощи мезороллера- устройства, содержащего 200 тончайших игл. Перед проведением процедуры кожа тщательно очищается антисептического раствором. Проблемные участки кожи аккуратно обрабатываются роллером. При появлении первых капель крови (когда становится ясно, что защита верхнего слоя эпидермиса преодолена), на кожу наносится композиция.
Проведение микронидлинга осуществляют до и/или после местного применения композиции в области лечения.
ПРИМЕРЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
ПРИМЕР 1. ПОЛУЧЕНИЕ КОНДИЦИОНИРОВАННОЙ СРЕДЫ.
Способ получения кондиционированной среды, включает:
(1) получение мезенхимальных стволовых клеток для культивирования;
(2) культивирование мезензимальных стволовых клеток в питательной среде, необходимой для роста клеток in vitro в гипоксических условиях в присутствии монооксида углерода;
(2) удаление кондиционированной среды;
(4) получение лизата культивируемых МСК;
(5) объединение кондиционированной среды с лизатом культивируемых МСК;
(6) стерилизация полученной кондиционированной среды.
Этап 1. Получение МСК для культивирования на примере костного могза.
Костный мозг мыши получали при пункции бедренных костей известными специалисту способами в данной области [Javazon Е.Н. et al. // Stem Cells., 2001, Vol. 19, N 3, Р. 219-225].
Этап 2. Культивирование МСК.
После получения первичной культуры МСК костного мозга клетки высевали в культуральные матрасы (Costar или Corning) в количестве 10*103/см2, добавляли свежую культуральную среду DMEM (Gibco, Thermo Fisher Scientific) с содержанием 10% эмбриональной телячьей сыворотки (ES Cell-Qualified Gibco, Thermo Fisher Scientific) в количестве 0,15 мл/см2, а затем культивировали в условиях СОг инкубатора при 37±1°С в среде с 5%-ном содержанием CO2, 15% O2, 79,975% N2 и 250 ppm СО, относительной влажности >95% в течение 3-х суток.
Свойства мезенхимальных стволовых клеток было подтверждено следующим образом:
Во-первых, клетки обладали способностью адгезии к пластику; во-вторых, они экспрессировали CD105, CD73 (L-VAP-2) и CD90 (Thy-1); и в-третьих, для подтверждения, что используемые клетки обладают свойствами МСК, была проведена их остеогенная, хондрогенная и адипогенная дифференцировка по стандартной методике. Остеогенная дифференцировка (с добавлением 10% эмбриональной телячьей сыворотки, 100 мкМ дексаметазона, 0,1 мМ аскорбиновой кислоты и 10 нМ β-глицерофосфата), была подтверждена наличием щелочной фосфатазы в культуре клеток с использованием стандартных реактивов (Sigma-Aldrich, USA). Хондрогенная дифференцировка (с добавлением 10% эмбриональной телячьей сыворотки, 100 мкМ дексаметазона и 0,1 мкг/мл TGF-β), была подтверждена с использованием окраски альциановым голубым. Адипогенная дифференцировка (с добавлением 10% эмбриональной телячьей сыворотки, 10 мкМ дексаметазон, 10 мкг/мл инсулина, и 100 мкг/мл IBMX) была подтверждена окрашиванием с использованием Oil Red-O.
Проведение иммунофенотипической характеристики культур, находившихся в нормо- и гипоксических условиях, показало, что гипоксия не изменяет значительно экспрессию поверхностных маркеров, характерных для МСК.
МТТ-тест
Для оценки влияния условий газового состава при культивировании на жизнеспособность и пролиферативную активность культивированных клеток проводили МТТ тест. Клетки культивировали 24, 48, 72 и 96 часов. Эксперименты повторялись не менее 3 раз для обеспечения надежности полученных результатов. По окончании времени культивирования в культуральную среду добавляли раствор МТТ (5 мг/мл) до конечной концентрации 1 мг/мл, и продолжали культивирование в течение 4 дополнительных часов. Затем супернатант отбрасывали, клетки промывали раствором Хенкса и гранулы формазана, которые образовывались в цитоплазме клеток растворяли в ДМСО и полученный раствор переносили в 96-луночный планшет в количестве 200 мкл/лунку и измеряли поглощение при 570 нм с использованием с планшетного спектрофотометра (ELISA). Проведенный МТТ-анализ показал, что при изменении газовой среды культивирования стволовых клеток, путем добавления в его состав СО в сочетании с нормальным (21%) или пониженным (<21%) уровнем сохраняется жизнеспособность и пролиферативную активность культивированных клеток.
Осуществляют культивирование указанных клеток, где культивируемые клетки секретируют желаемый уровень внеклеточных продуктов, так что образуется кондиционированная среда.
Этап 3. Получение лизата МСК
Проводят удаление кондиционированной среды: кондиционированная среда (объемом 25 мл) собирается полностью в отдельную емкость. Монослой клеток на чашке Петри заливается стерильной дистиллированной водой при температуре 4°С объемом 10 мл. Разрушение мембран клеток контролируется под микроскопом. После разрушения мембран остатки клеток снимаются механическим скребком. Полученная суспензия обрабатывается ультразвуком в течение 20 секунд и затем центрифугируется при 1500 об/мин 5 минут.
Этап 4. Объединение кондиционированной среды с лизатом МСК.
Полученный супернатант (объемом 10 мл) объединяют с кондиционированной средой (25 мл) и стерилизуют фильтруя через фильтр с диаметром пор 0,22 мкм. Таким образом, в данном примере соотношение кондиционированная среда: лизат культивированных клеток составляет 2,5:1.
Этап 5. Стерилизация кондиционированной среды. Стерилизацию осуществляли методом фильтрации через фильтры с диаметром пор от 0,22 мкм.
ПРИМЕР 2. ПОЛУЧЕНИЕ КОНДИЦИОНИРОВАННОЙ СРЕДЫ, АДСОРБИРОВАННОЙ НА ПОВЕРХНОСТИ ЧАСТИЦ.
Получение кондиционированной среды осуществляли согласно этапам 1-4, описанным в примере 1.
Этап 5. Адсорбция кондиционированной среды на поверхности частиц фторуглеродной эмульсии, стабилизированной проксанолом.
Частицы фторуглеродной эмульсии получали, смешивая водно-солевую среду, 5 об % перфтордекалин (ПФД), 5 об % перфторметилциклогексилпиперидин (ПФМЦП), 3 об % проксанола 268 и 1 об % Pluronic 10R5. Полученный состав частицгомогенизировали под давлением не менее 100 атм с использованием аппарата «Донор-1».
Кондиционированная среда смешивалась с частицами фторуглеродной эмульсии, стабилизированной проксанолом 268 и Pluronic 10R5, в соотношении 10:1. Инкубировали при постоянном помешивании в течение 30 минут.
Этап 6. Стерилизация кондиционированной среды. Стерилизацию осуществляли методом фильтрации через фильтры с диаметром пор от 0,22 мкм.
ПРИМЕР 3. ПОЛУЧЕНИЕ КОНДИЦИОНИРОВАННОЙ СРЕДЫ С ТКАНЕСПЕЦИФИЧЕСКИМ АНТИГЕНОМ.
Этап 1. Получение тканеспецифического антигена.
Тканеспецифический антиген (ТСА), используемый для получения кондиционированной среды, направленной для усиления роста волос, был получен следующим образом:
1.1. Пункционный биоптат кожи механически растирали в стеклянной ступке до получения гомогенной суспензии с размером частиц до 0,001 мм.
1.2. Полученный гомегенат заливали стерильным раствором 0.01 М Tris НС1 буфера с рН 8.0 и инкубировали в течение 3 часов.
1.3. После инкубации суспензию центрифугировали при 1500 об/мин в течение 5 минут.
1.4. Полученный супернатант отбирали в отдельную пробирку и доводили рН до 7,3.
1.5. Полученный раствор стерилизовали методом фильтрации через фильтр с диаметром пор 0,22 мкм.
Этап 2. Культивирование МСК с тканеспецифическим антигеном.
2.1. Костный мозг мыши получали при пункции бедренных костей известными специалисту способами в данной области. После получения первичной культуры МСК костного мозга клетки высевали в культуральные матрасы (Costar или Corning) в количестве 10*103/см2 добавляли свежую культуральную среду DMEM (Gibco, Thermo Fisher Scientific) с добавлением 10% эмбриональной телячьей сыворотки (ES Cell-Qualified Gibco, Thermo Fisher Scientific) в количестве 0,15 мл/см2. Далее супернатант тканеспецифического антигена добавлялся в культуральную среду в соотношении в среднем 1:30.
2.2 .Затем культивировали в условиях CO2 инкубатора при 37±1°С в среде с 5%-ном содержанием CO2, 15% O2, 79,975% N2 и 250 ppm СО, относительной влажности >95% в течение 3-х суток.
Этап 3. Получение лизата МСК и объединение его с кондиционированной средой.
Получали лизат МСК (согласно примеру 1) и объединяли с кондиционированной средой, полученной на предьщущем этапе.
Этап 4. Стерилизация кондиционированной среды. Стерилизацию осуществляли методом фильтрации через фильтры с диаметром пор от 0,22 мкм.
ПРИМЕР 4. ПОЛУЧЕНИЕ ЛИОФИЛИЗИРОВАННОЙ
КОНДИЦИОНИРОВАННОЙ СРЕДЫ.
Полученную композицию (полученную согласно примерам 1-3) разливали по 50 мл в стерильные ПЭТ-флаконы емкостью 250 мл. Помещали в холодильник, где замораживали и охлаждали до -70 С. Флаконы укупоривали пробками для лиофилизации. Затем флаконы помещали в лиофильную сушку PL 9000 (Thermo Fischer Scientific). Процесс лиофилизации проводили согласно инструкции фирмы изготовителя.
Порошок, полученный после лиофилизации, восстанавливали добавляя стерильную деионизированную воду из расчета 8,5 мг порошка на 1 мл воды.
ПРИМЕР 5. ПОЛУЧЕНИЕ КОМПОЗИЦИИ, СОДЕРЖАЩЕЙ
КОНДИЦИОНИРОВАННУЮ СРЕДУ ВИДЕ ГЕЛЯ.
Этап 1. Кондиционированную среду, которая обогащена биологически активными соединениями, получали согласно примеру 1.
Этап 2. Объединение кондиционированной среды с приемлемым носителем для образования композиции.
В стерильных условиях стерильную метилцеллюлозу смешивали с расчетным количеством стерильной воды, нагретой до температуры 80-90°С и перемешивали до образования прозрачного геля. После охлаждения до температуры 30-35°С к полученному гелю при постоянном перемешивании добавляли композицию, содержащую кондиционированную среду и лизат клеток. Конечная концентрация метилцеллюлозного геля составила 3%. 3% метилцеллюлозный гель содержит композицию: 5 мг белка в 1 мл геля.
Кроме того, биологически активные факторы композиции являются относительно стабильными, и их содержание было стабильным после хранения в течение 21 дня при 37°С и при рН 7,4 и после хранения в течение трех лет при 4°С и при рН 7,4.
ПРИМЕР 6. ОПРЕДЕЛЕНИЕ В КОНЦИДИОНИРОВАННОЙ СРЕДЕ ФАКТОРОВ РОСТА И ЦИТОКИНОВ, СТИМУЛИРУЮЩИХ РОСТ ВОЛОС.
Культивируемые мезенхимальные стволовые клетки образуют желаемый уровень внеклеточных продуктов, так что образуется кондиционированная среда. Содержание секретируемых факторов анализировали с использованием метода ELISA и масс-спектроскопического анализа.
В таблице 1 (см. ниже) проиллюстрировано влияние изменение состава газовой среды на продукцию ростовых факторов культивируемыми клетками. Следует отметить, что нижеследующий список, представленный в таблице не является полным перечнем факторов и приводится лишь для дополнительной характеристики кондиционированной среды в отношении концентрации некоторых из биологически активных факторов, присутствующих в среде настоящего изобретения.
Данные представленные в таблице 1 приводятся в соотношении концентрации ростового фактора полученного при изучаемых гипоксических условиях газовой среды деленное на концентрацию ростового фактора, полученного при культивировании идентичной клеточной культуры в условиях нормоксии (5% CO2, 21% O2, 74% N2).
Как видно из представленных данных, добавление в газовую среду СО или NO или H2S приводит к изменению, а именно к повышению продукции изучаемых факторов, независимо от того, в каких условиях нормоксии (5% CO2, 21% О2, 74% N2), или гипоксии (О2<21%) культивировались клетки. Следует отметить, что культивирование в условиях 1% О2 снижало уровень продукции ряда ростовых факторов и вызывало угнетение в пролиферации стволовых клеток. Наиболее оптимальным условием для повышения уровня цитокинов было культивирование с уровнем кислорода от 5% до 15%.
Так при снижении уровня кислорода до 15% и добавлении 250 ppm СО было зафиксировано резкое, по меньшей мере в 15 раз, повышение уровня галектина-1 по сравнению с кондиционированной средой, культивируемой в условиях нормоксии и без добавления СО. Кроме повышения уровня галектина-1 было отмечено резкое увеличение концентрации тиоредоксина, по меньшей мере, в 9,5 раз, который снижает уровень окислительного стресса в коже при гипоксии и последующей реперфузии.
Следует отметить, что даже изолированное добавление 250 ppm СО даже на фоне 21% O2 приводит к увеличению концентрации галектина-1 и тиоредоксина, однако уровень повышения данных факторов ниже почти в два раза по сравнению с уровнем, когда O2 составил 15%.
Добавление 250 ppm СО на фоне 1% O2 приводит к незначительному повышению концентрации галектина-1 и тиоредоксина, что возможно, связано со снижением уровня кислорода ниже физиологической для стволовых клеток нормы, однако при данном сочетании газов отмечается повышение в два раза уровня фактора VEGF и ИЛ-8, что, возможно, связано с адаптивной реакцией клеток на критичный уровень гипоксии. Увеличение концентрации факторов носило экспоненциальный характер.
Культивирование клеток в условиях 1% O2 снижало уровень продукции ряда ростовых факторов и по данным МТТ теста вызывало угнетение в пролиферации стволовых клеток при сохранении их жизнеспособности. Таким образом, максимальная концентрация физиологически значимых для роста волос ростовых факторов (галектин-1, тиоредоксин) была получена при добавлении в газовую среду СО и снижении уровня О2 ниже 21%. Таким образом, наиболее оптимальным условием культивирования для стволовых клеток, приводящее к максимальному повышения уровня ростовых факторов, является использовании СО в сочетании в пониженным уровнем О2 от 5% до 15%.
Анализируя данные по изменению концентрации других факторов роста, представленных в таблице 1: IL-6; IL-8; Insulin-like growth factor-binding protein 4; Macrophage migration inhibitory factor; Cellular retinoic acid-binding protein 1 можно сделать вывод, что использование СО дает максимальный прирост концентрации эти факторов именно при концентрации О2 в диапазоне от 5% до 15%. Повышение кислорода до 21% вызывает окислительный стресс для клеток, а снижение до 1% является уровнем критической гипоксии для клеточной культуры.
Добавление в газовую среду для культивирования NO также приводит к метаболической перестройки и повышению продукции изучаемых биологически активных соединений. Если сравнить влияние уровня кислорода (5% или 21%) при добавленном NO, то следует отметить, что при 5% содержании кислорода отмечается более высокие уровни Galectina-1, VEGF, IL-6; IL-8, Insulin-like growth factor-binding protein 4. При 21% O2 наблюдается более высокие уровни тиоредоксина и Macrophage migration inhibitory factor, что, возможно, связано с адаптацией клетки к окислительному стрессу.
Использование H2S в качестве добавки к нормоксической среде повышает уровень продукции всех изучаемых факторов. Учитывая имеющиеся научные данные можно сделать вывод, что H2S защищает клетки от ишемически-реперфузионного повреждения, которое возникает при выделении клеток из тканей организма (5% O2) и начало культивирования при 21% кислорода. Кроме того, следует отметить, что при использовании H2S максимальный прирост среди изучаемых цитокинов приходится на фактор роста сосудов (VEGF) и тиоредоксина, в отличие от использования СО и NO, что можно объяснить взаимодействием молекулы H2S с белками митохондрий.
Также было изучено влияние комбинация СО и NO на продукцию ростовых факторов мезенхимальными стволовыми клетками (табл. 2). Следует отметить, что только при комбинации СО и NO наблюдается повышение концентрации 7 ростовых факторов (Galectin-1, VEGF, Cystatin -b, Insulin-like growth factor-binding protein 4, Thioredoxin, Cellular retinoic acid-binding protein 1) более чем в 7 раз. При культивировании клеток в аналогичной газовой среде (с добавлением только СО), но без добавления NO повышение концентрации в 7 раз наблюдается только у 4-х факторов (Galectin-1, VEGF, Macrophage migration inhibitory factor, Thioredoxin) (табл. 1).
Таким образом, изменение условий культивирования МСК, а именно в присутствии монооксида углерода СО и/или монооксида азота NO и/или H2S в газовой среде, а также в сочетании с гипоксическими условиями позволяет получить новый спектр синтезируемых белков и увеличить их количественный состав по сравнению с культивированием в нормальных условиях.
Данный способ получения композиции позволяет получить кондиционированную среду, обогащенную Galectin-1 (галектин-1), Thioredoxin (тиоредоксин), VEGF, Cystatin -b, IGFBP (Insulin-like growth factor-binding protein 4), MMIF (Macrophage migration inhibitory factor), CRABP1 (Cellular retinoic acid-binding protein 1), IL-6, IL-8 на уровне, по меньшей мере, в 1,5-15 раз выше по сравнению с культивированием в нормальных условиях. Кроме того, неожиданно было обнаружено, что повышение уровня указанных в таблице 1 биологически активных соединений носит не линейный характер, а их концентрация возрастает экспоненциально.
ПРИМЕР 7. ПРИМЕНЕНИЕ КОМПОЗИЦИИ ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ НА МЫШАХ.
В эксперименте были использованы мыши линии BalbC. Животные содержались в условиях вивария при свободном доступе к воде и пищи.
Сравнивались и оценивались эффекты стимулирования роста волос в эксперименте на животных с использованием композиции, содержащей кондиционированную среду, полученную при культивировании МСК в гипоксических условиях в присутствии СО и лизатом МСК (согласно примеру 1). Под анестезией (общим наркозом, в/м Золетил и Рометар) спинки животных брились и депилировались. 3% метилцеллюлозный гель, содержащий композицию (5 мг белка в 1 мл геля), полученную по настоящему изобретению, наносили на выбритую кожу однократно.
Для создания условий проникновения факторов в глубокие слои дермы кожу обрабатывали роликом для мезотерапии с титановыми иглами длиной 3,5 мм. В качестве контроля использовали композицию, содержащую кондиционированную среду, полученную при культивировании МСК в условиях в условия нормоксии (5% CO2, 21% O2, 74% N2) с лизатом МСК. Образцы кожи на гистологию забирали на 10 день после нанесения геля.
Результаты. У животных опытной и контрольной группы не наблюдалось каких-либо общих или местных побочных реакций после проведенной процедуры в течение всего срока наблюдения.
На Фиг 1. (Фиг. 1А и Фиг. 1Б, А - Увеличение ×200; Б - Увеличение ×100) приведены данные гистологии кожи мышей контрольной группы, которым наносили гель, содержащий композицию, полученную в условиях культивирования стволовых клеток (5% CO2, 21% O2, 74% N2). На гистологических срезах видно, что слои кожи не нарушены, признаков отека, воспалительной инфильтрации нет.Количество волосяных фолликул, их строение, а также фаза роста волос не отличается от зоны кожи, которая не подвергалась обработке.
На Фиг. 2 (Фиг. 2А и Фиг. 2Б; А - Увеличение ×100; Б - Увеличение ×200) представлены данные гистологических исследований препаратов кожи мышей опытной группы, которым наносили гель, содержащий композицию, полученную в условиях гипоксии в присутствии СО (5% CO2, 15% O2, 80% N2, 250 ppm СО). Как видно из представленных данных, в зоне обработанной гелем наблюдается увеличение толщины подкожно-жировой клетчатки за счет образования волосяных фолликул (Фиг. 2А). В фолликулах отмечена активная пролиферация клеток (Фиг. 2Б).
Следует отметить, что у животных опытной группе можно выделить фолликулы, формирующиеся непосредственно около старого волоса, т.е. в ассоциации с имеющимися фолликулами (указано стрелкой на фиг. 3А и фиг. 3Б, А - Увеличение ×100; Б - Увеличение ×200), а также образование множества крупных волосяных фолликулов de novo в коже и подкожно-жировой клетчатке (Фиг. 4А и Фиг. 4Б; А - Увеличение ×200; Б - Увеличение ×200).
В результате было подтверждено, что кондиционированная среда, обогащенная Galectin-1 (галектин-1), Thioredoxin (тиоредоксин), VEGF, Cystatin -b, IGFBP (Insulin-like growth factor-binding protein 4), MMIF (Macrophage migration inhibitory factor), CRABP1 (Cellular retinoic acid-binding protein 1), IL-6, IL-8 проявляет более выраженный эффект роста волос, по сравнению с контрольной средой. Эффект достигается за счет индукции стволовых клетк волосяных фолликулов, которые входят в фазу анагена, что проявляется в повышении количества волосяных фолликул на единицу площади.
ПРИМЕР 8. ПРИМЕНЕНИЕ КОМПОЗИЦИИ ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ НА МЫШАХ (ВАРИАНТ).
В эксперименте были использованы мыши линии BalbC. Животные содержались в условиях вивария при свободном доступе к воде и пищи.
Для оценки эффективности стимулирования роста волос в эксперименте животных распределяли на 2 группы: 1 группа (опытная) - использовали композицию, содержащую кондиционированную среду, полученную при культивировании МСК с тканеспецифическим антигеном (полученную согласно примеру 3) и 2 группа (контрольная) - применяли композицию, содержащую кондиционированную среду, полученную при культивировании МСК в условиях: 5% CO2, 15% O2, 79,975% N2, 250 ppm СО (полученная по примеру 1).
На Фиг. 5. представлена кожа мыши через 14 дней после нанесения композиции, содержащей кондиционированную среду, обогащенную биологически активными соединениями, полученными в результате культивирования МСК с тканеспецифическим антигеном в присутствии СО (гель наносился радиально по расходящимся от центральной точки лучам). В зоне нанесения геля наблюдался интенсивный рост волос.
При анализе гистологических результатов проводили морфометрию и учитывали количество волосяных фолликул на 1 мм2 гистологического среза.
В ходе анализа данных морфометрии было показано, что в опытной группе более чем в 4,5 раза увеличение количества волосяных фолликул по сравнению с контрольной группой (Фиг. 6. Гистология кожи мыши. Окраска гемотоксилин-эозином. А - контрольная группа животных (условия культивирования 5% CO2, 15% O2, 79,975% N2, 250 ppm СО (полученная по примеру 1)), увеличение ×100; Б - опытная группа животных (условия культивирования 5%CO2, 15%O2, 79,975%N2, 250 ppm СО и добавление тканеспецифического антигена (полученная по примеру 3)., увеличение ×100).
ВЫВОДЫ: Проведенные эксперименты продемонстрировали, что композиция содержащая кондиционированную среду, которая обогащена биологически активными соединениями, секретируемыми при культивировании мезенхимальных стволовых клеток нормоксических или гипоксических условиях в присутствии СО и/или NO и/или H2S, по меньшей мере, Galectin-1, Thioredoxin, VEGF, Cystatin-b, IGFBP, MMIF, CRABP1, IL-6, IL-8, и содержит лизат культивируемых МСК, позволяет решить ряд комплексным проблем, возникающих при алопеции. Поскольку в исследованиях in vitro было установлено повышенную экспрессию вышеуказанных биологически активных факторов, продуцированных мезенхимальными стволовыми клетками, которые важны для регуляции цикла и индукции роста волос.
Мезенхимальные стволовые клетки, культивированные в нормоксических или гипоксических условиях в присутствии СО и/или NO и/или H2S, демонстрируют повышенный уровень экспрессии VEGF, вызывая ангиогенез, влияя на кератиноциты волоса, повышая его толщину и плотность. В волосяных фолликулах VEGF ускоряет пролиферацию стромальных клеток и эндотелоцитов сосудов, что стимулирует образование межклеточного вещества и поддерживает волосяной фолликул в фазе анагена.
Тиоредоксин, являясь мощным антиоксидантом, поддерживает функциональную активность клеток фолликула, обладая антиапоптотическим и антифиброзным эффектом и защищая клетки волосяной луковицы от действия гипоксии, возникающей при нарушении васкуляризации. Наличие в кондиционированной среде галектина-1 вызывает иммуносупрессию за счет подавления активации Т-клеточного звена иммунной системы и тем самым снижает выраженность алопеции, вызванной иммуновоспалительными процессами. ИЛ-6 стимулирует пролиферацию кератиноцитов, накопление коллагена, активацию фибробластов кожи. ИЛ-6 обладает антивозрастным эффектом, за счет увеличения поверхностного слоя эпидермиса без развития какой-либо воспалительной реакции в коже. Инсулин-подобный ростовой фактор связывающий протеин-4 экспрессируется в анагенных волосяных фолликулах и преимущественно в дермальном слое, который окружает фолликул, тем самым участвует в поддержании биохимического гомеостаза волоса.
Проведенные в процессе создания композиции экспериментальные исследования позволили установить оптимальное содержание биологически активных соединений, входящих в состав композиции и обеспечивающих максимальную эффективность ее действия.
Таким образом, получена кондиционированная среда, которая отличается по спектру синтезируемых белков и количественному составу по сравнению с культивированием в нормальных условиях. Данный способ получения композиции позволяет получить кондиционированную среду, обогащенную Galectin-1 (галектин-1), Thioredoxin (тиоредоксин), VEGF, Cystatin-b, IGFBP (Insulin-like growth factor-binding protein 4), MMIF (Macrophage migration inhibitory factor), CRABP1 (Cellular retinoic acid-binding protein 1), IL-6, IL-8 на уровне, по меньшей мере, в 1,5-15 раз выше по сравнению с культивированием в нормальных условиях. Кроме того, неожиданно было обнаружено, что повышение уровня указанных факторов носит не линейный характер, а возрастает экспоненциально.
Полученное оптимальное количественное сочетание в кондиционированной среде биологически активных факторов Galectin-1, Thioredoxin, VEGF, Cystatin-b, IGFBP, MMIF, CRABP1, IL-6, IL-8, секретированных МСК в нормоксических или гипоксических условиях в присутствии СО и/или NO и/или H2S оказывает выраженный стимулирующий эффект роста волос, за счет регуляции цикла роста волос: продуцирования дермальных сосочковых клеток, увеличения количества и размера фолликулов, в том числе за счет стимуляции васкуляризации.
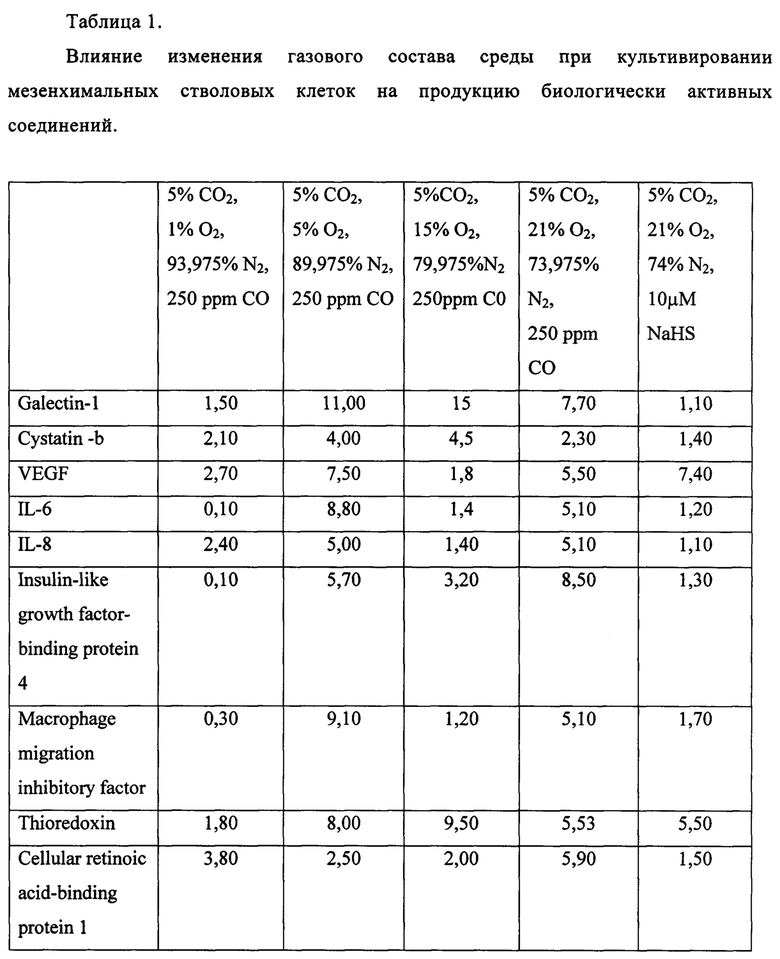
В таблице приведены соотношения концентрации биологически активного фактора в кондиционированной среде при культивировании МСК в нормоксических или гипоксических условиях с различным газовым составом (СО или H2S или NO) к концентрации этого фактора при культивировании в среде с нормоксией (5% CO2, 21% O2, 74% N2).
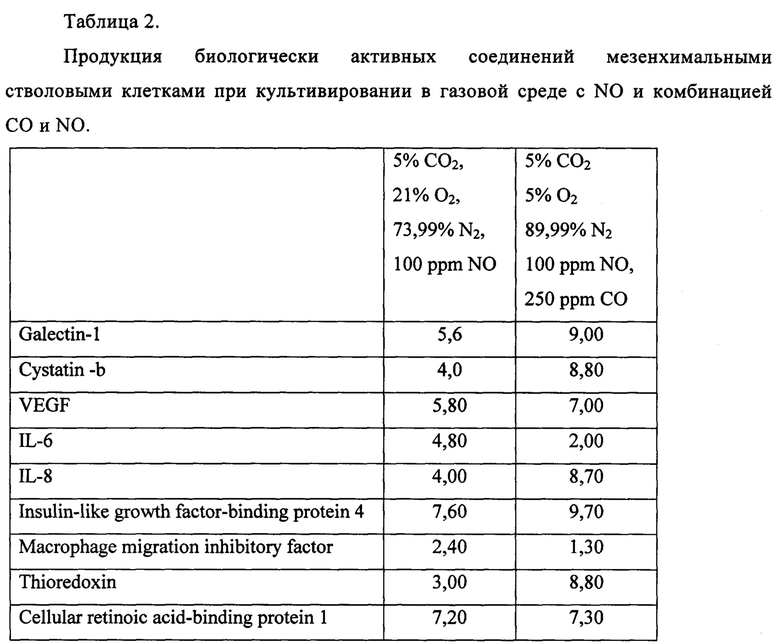
В таблице приведены соотношения концентрации биологически активного фактора в кондиционированной среде при культивировании МСК в нормоксических или гипоксических условиях с различным газовым составом (NO и/или СО) к концентрации этого фактора при культивировании в среде с нормоксией (5% CO2, 21% O2, 74% N2).
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ АЛОПЕЦИИ | 2004 |
|
RU2271819C1 |
| КОМПОЗИЦИЯ ДЛЯ СТИМУЛИРОВАНИЯ РОСТА И РЕГЕНЕРАЦИИ КЛЕТОК, А ТАКЖЕ СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ | 2006 |
|
RU2341270C2 |
| СПОСОБ СТИМУЛЯЦИИ ЭМБРИОНАЛЬНОГО И ПОСТЭМБРИОНАЛЬНОГО РАЗВИТИЯ СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПТИЦЫ | 2021 |
|
RU2787185C1 |
| МАТЕРИАЛ СТВОЛОВЫХ КЛЕТОК И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2785588C2 |
| КОМПОЗИЦИЯ ДЛЯ СТИМУЛИРОВАНИЯ РОСТА И РЕГЕНЕРАЦИИ КЛЕТОК, (ВАРИАНТЫ), А ТАКЖЕ СПОСОБ ЕЕ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2008 |
|
RU2391990C1 |
| Способ профилактики помутнения и васкуляризации трансплантата роговицы у животных после сквозной кератопластики на фоне предсуществующего васкуляризированного бельма роговицы вследствие ожоговой травмы глаза | 2024 |
|
RU2828627C1 |
| СПОСОБ СТИМУЛЯЦИИ РОСТА И ПОВЫШЕНИЯ РЕЗИСТЕНТНОСТИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ | 2012 |
|
RU2495565C1 |
| КОНДИЦИОНИРОВАННАЯ СРЕДА И КОМПОЗИЦИИ НА ОСНОВЕ ВНЕКЛЕТОЧНОГО МАТРИКСА ИЗ КЛЕТОК, КУЛЬТИВИРОВАННЫХ В ГИПОКСИЧЕСКИХ УСЛОВИЯХ | 2010 |
|
RU2631488C2 |
| СПОСОБ ЛЕЧЕНИЯ НЕРУБЦОВОЙ АЛОПЕЦИИ | 2018 |
|
RU2695364C1 |
| ДИКЕТОНЫ И ГИДРОКСИКЕТОНЫ В КАЧЕСТВЕ АКТИВАТОРА СИГНАЛЬНОГО ПУТИ КАТЕНИНА | 2011 |
|
RU2592694C2 |
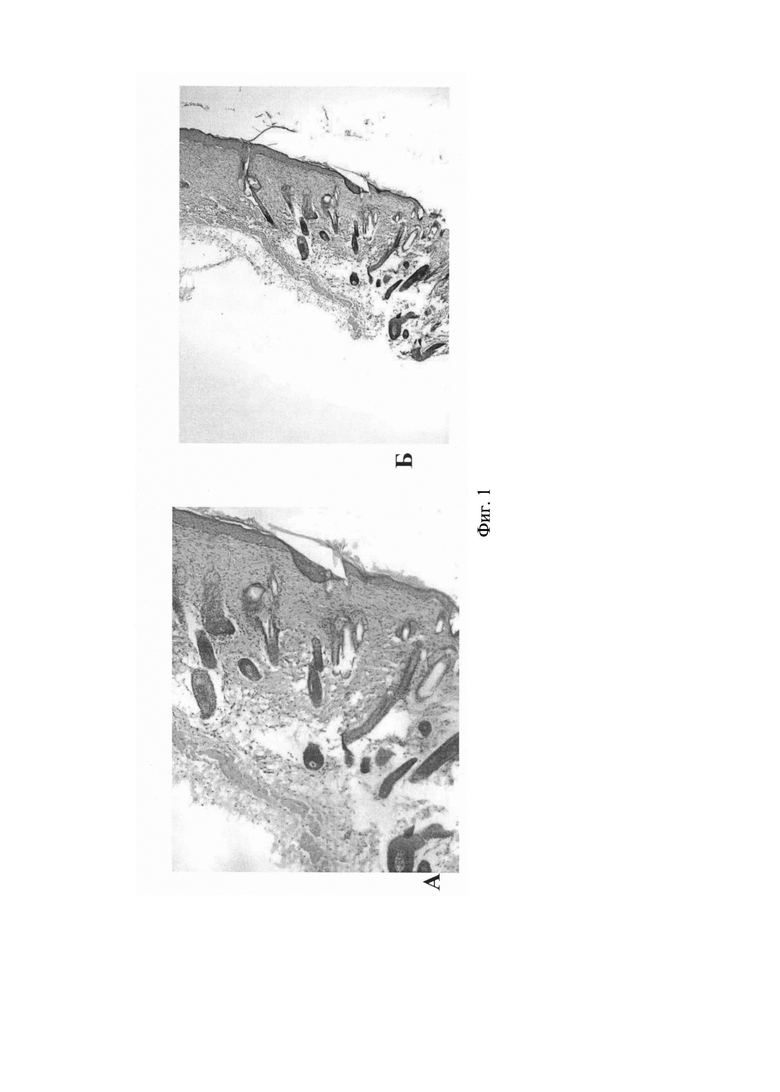
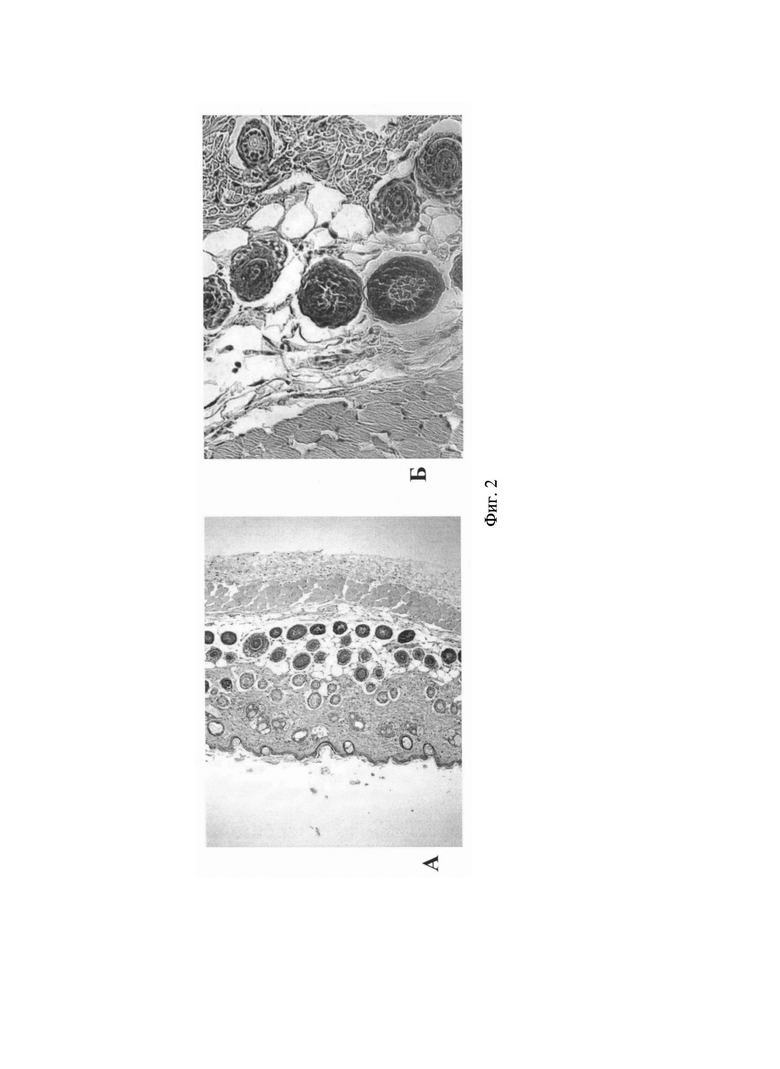
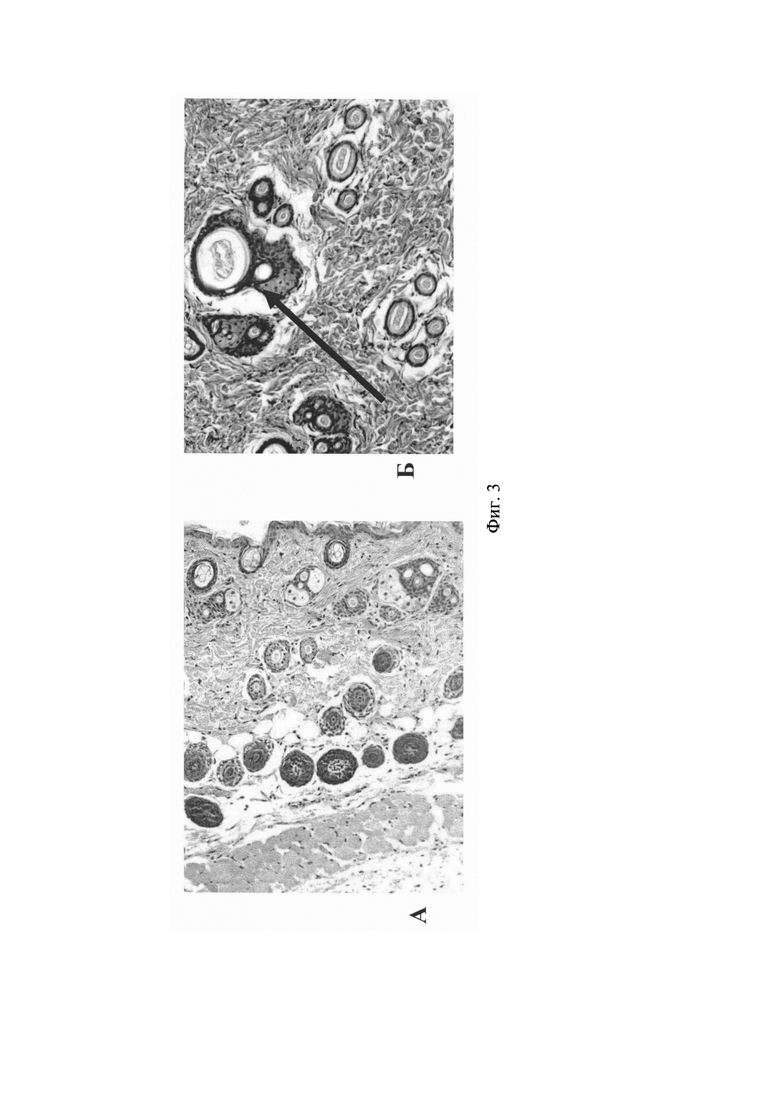
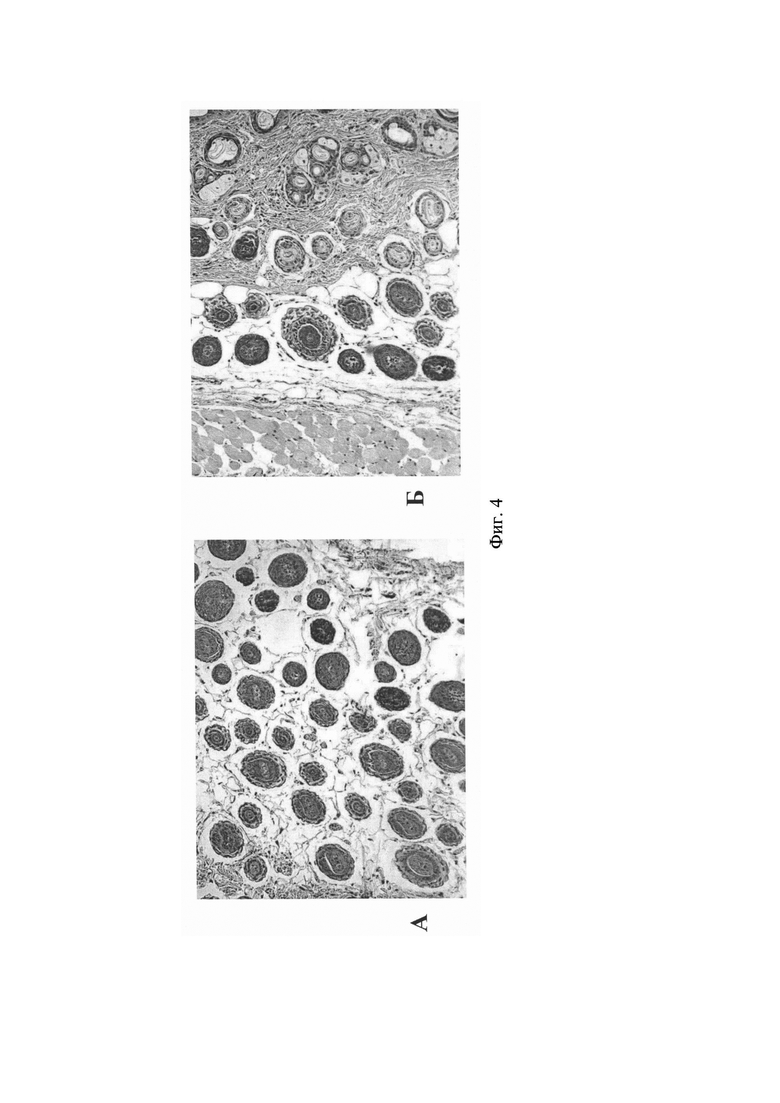
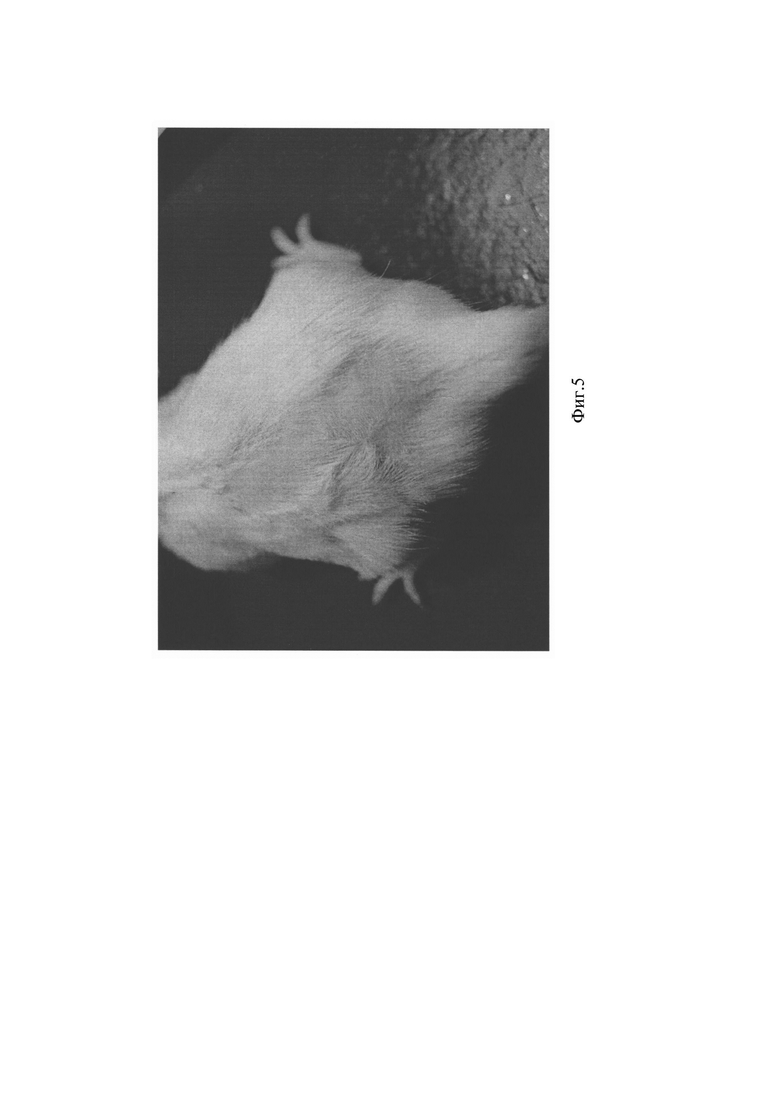
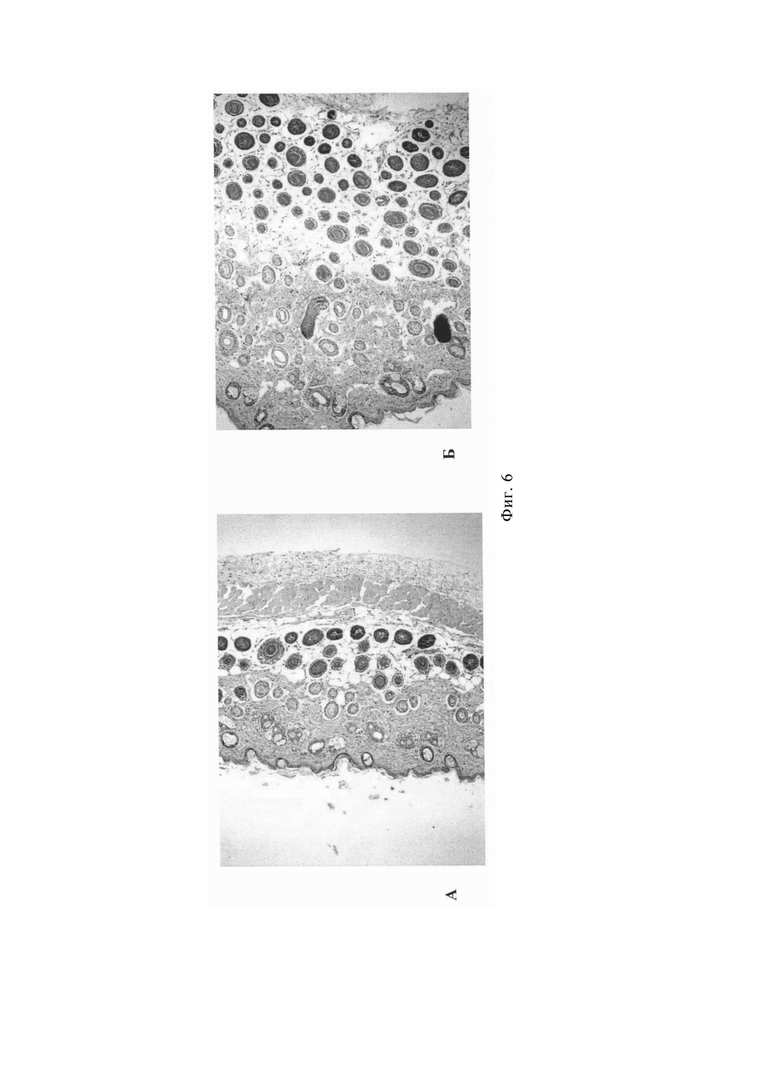
Группа изобретений относится к медицине, а именно к дерматологии, и касается композиции для профилактического или терапевтического лечения состояний, связанных с изменением количества волос. Композиция включает: (а) кондиционированную среду, обогащенную биологически активными соединениями, полученными в результате культивирования мезенхимальных стволовых клеток (МСК) в присутствии монооксида углерода СО и/или монооксида азота NO и/или H2S в газовой среде; (b) лизат культивируемых МСК. Группа изобретений также относится к способу получения указанной композиции и к способу профилактического или терапевтического лечения состояний, связанных с изменением количества волос, включающий местное применение композиции. Группа изобретений обеспечивает достоверно более выраженный результат, индуцируя стволовые клетки волосяных фолликулов для вхождения в фазу анагена, что проявляется в повышении количества волосяных фолликул на единицу площади, за счет кондиционированной среды, обогащенной биологически активными соединениями: Galectin-1, Thioredoxin, VEGF, Cystatin-b, IGFBP, MMIF, CRABP1, IL-6, IL-8. 3 н. и 34 з.п. ф-лы, 6 ил., 2 табл., 8 пр.
1. Композиция для профилактического или терапевтического лечения состояний, связанных с изменением количества волос, включающая: (а) кондиционированную среду, обогащенную биологически активными соединениями, полученными в результате культивирования мезенхимальных стволовых клеток (МСК) в присутствии монооксида углерода СО и/или монооксида азота NO и/или H2S в газовой среде; (b) лизат культивируемых МСК.
2. Композиция по п. 1, отличающаяся тем, что кондиционированную среду, обогащенную биологически активными соединениями, получают в результате культивирования мезенхимальных стволовых клеток (МСК) в гипоксических условиях в присутствии монооксида углерода СО и/или монооксида азота NO и/или H2S в газовой среде.
3. Композиция по п. 2, отличающаяся тем, что при гипоксических условиях культивирования концентрация кислорода составляет от 1% до 20%.
4. Композиция по п. 1, отличающаяся тем, что кондиционированная среда обогащена биологически активными соединениями, по меньшей мере, Galectin-1, Thioredoxin, VEGF, Cystatin-b, IGFBP, MMIF, CRABP1, IL-6, IL-8.
5. Композиция по п. 1, отличающаяся тем, что композиция адсорбирована на поверхности частиц перфторуглеродной эмульсии, стабилизированной плюроником.
6. Композиция по п. 1, отличающаяся тем, что мезенхимальные стволовые клетки получены из костного мозга, жировой ткани, слизистой оболочки десны, пульпы зуба, пуповины, плаценты, пуповинной крови.
7. Композиция по п. 1, отличающаяся тем, что кондиционированная среда может быть лиофилизирована и восстановлена, и восстановленная кондиционированная среда имеет коэффициент концентрации в диапазоне от 1 до 100.
8. Композиция по пп. 1-7, отличающаяся тем, что в общее количество кондиционированной среды в композиции может изменяться от 0,1 до 99,9% по объему.
9. Композиция по п. 1, отличающаяся тем, что кондиционированная среда, обогащенная биологически активными соединениями, получена в результате культивирования мезенхимальных стволовых клеток (МСК), по меньшей мере, с одним тканеспецифическим антигеном в присутствии СО и/или NO и/или H2S в газовой среде.
10. Композиция по п. 9, отличающаяся тем, что в качестве источника тканеспецифического антигена могут быть, по меньшей мере, клеточные популяции: фибробласты соединительнотканной оболочки, кератиноциты, эпидеральные клетки волосяной матрицы, меланоциты или их лизат.
11. Композиция по п. 1, отличающаяся тем, что дополнительно содержит, по меньшей мере, одно фармацевтически приемлемое вещество.
12. Композиция по п. 11, отличающаяся тем, что в качестве фармацевтически приемлемого вещества может выступать фармацевтически приемлемый носитель.
13. Композиция по п. 12, отличающаяся тем, что в качестве фармацевтически приемлемого носителя может быть дерматологически приемлемый носитель.
14. Композиция по п. 11, отличающаяся тем, что в качестве фармацевтически приемлемого вещества может быть наполнитель, выбранный из группы, включающей добавку, носитель, гранулирующие агенты, связующие агенты, смазывающие агенты, агенты, способствующие распаду, подсластители, глиданты, антиадгезивы, антистатики, поверхностно-активные вещества, антиоксиданты, камеди, покрывающие агенты, окрашивающие агенты, ароматизирующие агенты, покрывающие агенты, пластификаторы, консерванты, суспендирующие агенты, эмульгирующие агенты, растительный целлюлозный материал и агенты сфероидизации или любые их комбинации.
15. Композиция по п. 1, отличающаяся тем, что дополнительно содержит антибиотик, противовоспалительный агент, противовирусный агент, противогрибковый агент, гормон, противоопухолевый агент, анальгетик, анестезирующее средство или любую их комбинацию.
16. Композиция по п. 1, отличающаяся тем, что представляет собой композицию, вводимую парентерально или местно.
17. Композиция по п. 16, отличающаяся тем, что композиция, вводимая парентерально, вводится внутримышечно, внутривенно, подкожно.
18. Композиция по п. 1, отличающаяся тем, что композицию приготавливают в виде дозированных форм, выбранных из группы, содержащей масляные суспензии, гидрогели, мази, гели, лосьоны, сыворотки, эмульсии, кремы, спреи, капли или любые их комбинации.
19. Композиция по п. 1, отличающаяся тем, что ее применяют для стимулирования роста волос.
20. Композиция по п. 19, отличающаяся тем, что ее применяют при всех типах алопеции, включая выпадение волос вследствие химиотерапии и/или воздействия химических веществ или радиации, для лечения алопеции, включая телогеновую алопецию, гнездной алопеции, рубцовой алопеции, андрогенной алопеции, самопроизвольного выпадения волос, врожденного гипотрихоза, выпадения волос из-за инфекционных агентов или болезни, дефектов волосяных стержней, склеродермии, опоясывающего лишая, полной плешивости, универсальной плешивости, травматической алопеции, тракционной алопеции, выпадения волос вследствие гормональных изменений, выпадения волос вследствие гипер- или гипотиреоза, муцинозной алопеции, выпадения волос из-за инфекции кожи головы, волчанки или дефицита железа.
21. Способ получения композиции для профилактического или терапевтического лечения состояний, связанных с изменением количества волос по п. 1, включающий:
(1) культивирование мезенхимальных стволовых клеток в присутствии СО и/или NO и/или H2S в газовой среде на подходящей культуральной среде, с получением кондиционированной среды, обогащенной биологически активными соединениями;
(2) удаление кондиционированной среды;
(3) получение лизата культивируемых МСК;
(4) объединение кондиционированной среды с лизатом культивируемых МСК;
(5) стерилизация полученной кондиционированной среды.
22. Способ получения композиции по п. 21, отличающийся тем, что кондиционированную среду, обогащенную биологически активными соединениями, получают в результате культивирования мезенхимальных стволовых клеток (МСК) в гипоксических условиях в присутствии монооксида углерода СО и/или монооксида азота NO и/или H2S в газовой среде.
23. Способ получения композиции по п. 22, отличающийся тем, что при гипоксических условиях культивирования концентрация кислорода составляет от 1% до 20%.
24. Способ получения композиции по п. 21, отличающийся тем, что кондиционированная среда обогащена биологически активными соединениями, по меньшей мере, Galectin-1, Thioredoxin, VEGF, Cystatin-b, IGFBP, MMIF, CRABP1, IL-6, IL-8.
25. Способ получения композиции по п. 21, отличающийся тем, что композиция адсорбирована на поверхности частиц перфторуглеродной эмульсии, стабилизированной плюроником.
26. Способ получения композиции по п. 21, отличающийся тем, что мезенхимальные стволовые клетки получены из костного мозга, жировой ткани, слизистой оболочки десны, пульпы зуба, пуповины, плаценты, пуповинной крови.
27. Способ получения композиции по п. 21, отличающийся тем, что кондиционированная среда может быть лиофилизирована и восстановлена, и восстановленная кондиционированная среда имеет коэффициент концентрации в диапазоне от 1 до 100.
28. Способ получения композиции по п. 21, отличающийся тем, что общее количество кондиционированной среды в композиции может изменяться от 0,1 до 99,9% по объему.
29. Способ получения композиции по п. 21, отличающийся тем, что кондиционированная среда, обогащенная биологически активными соединениями, получена в результате культивирования мезенхимальных стволовых клеток (МСК), по меньшей мере, с одним тканеспецифическим антигеном в присутствии СО и/или NO и/или H2S в газовой среде.
30. Способ получения композиции по п. 29, отличающийся тем, что в качестве источника тканеспецифического антигена могут быть, по меньшей мере, клеточные популяции: фибробласты соединительнотканной оболочки, кератиноциты, эпидеральные клетки волосяной матрицы, меланоциты или их лизат.
31. Способ получения композиции по п. 21, отличающийся тем, что дополнительно содержит, по меньшей мере, одно фармацевтически приемлемое вещество.
32. Способ получения композиции по п. 31, отличающийся тем, что в качестве фармацевтически приемлемого вещества может выступать фармацевтически приемлемый носитель.
33. Способ получения композиции по п. 31, отличающийся тем, что в качестве фармацевтически приемлемого вещества может быть наполнитель, выбранный из группы, включающей добавку, носитель, гранулирующие агенты, связующие агенты, смазывающие агенты, агенты, способствующие распаду, подсластители, глиданты, антиадгезивы, антистатики, поверхностно-активные вещества, антиоксиданты, камеди, покрывающие агенты, окрашивающие агенты, ароматизирующие агенты, покрывающие агенты, пластификаторы, консерванты, суспендирующие агенты, эмульгирующие агенты, растительный целлюлозный материал и агенты сфероидизации или любые их комбинации.
34. Способ профилактического или терапевтического лечения состояний, связанных с изменением количества волос, включающий местное применение индивидууму композиции по любому из пп. 1-20 в эффективном количестве.
35. Способ по п. 34, отличающийся тем, что дополнительно используют физические методы стимуляции, которые включают, по меньшей мере, ионофорез, ультразвук, электропорацию, микронидлинг, или абразивы, удаляющие верхний слой кожи.
36. Способ по п. 34, отличающийся тем, что применяют при всех типах алопеции, включая выпадение волос вследствие химиотерапии и/или воздействия химических веществ или радиации, для лечения алопеции, включая телогеновую алопецию, гнездной алопеции, рубцовой алопеции, андрогенной алопеции, самопроизвольного выпадения волос, врожденного гипотрихоза, выпадения волос из-за инфекционных агентов или болезни, дефектов волосяных стержней, склеродермии, опоясывающего лишая, полной плешивости, универсальной плешивости, травматической алопеции, тракционной алопеции, выпадения волос вследствие гормональных изменений, выпадения волос вследствие гипер- или гипотиреоза, муцинозной алопеции, выпадения волос из-за инфекции кожи головы, волчанки или дефицита железа.
37. Способ по п. 34, отличающийся тем, что применяют при состояниях, связанных со снижением количества волос на голове, бровей, ресниц.
| JIANG J | |||
| et al | |||
| Hydrogen sulfide—mechanisms of toxicity and development of an antidote //Scientific reports | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| - Т | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| - С | |||
| Указатель стоимости взвешенного товара к циферблатным весам | 1929 |
|
SU20831A1 |
| WO 00/69449 A2, 23.11.2000 | |||
| YANO K | |||
| et al | |||
| Control of hair growth and follicle size by VEGF-mediated angiogenesis //The Journal of clinical investigation | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| - Т | |||
| Счетный сектор | 1919 |
|
SU107A1 |
| - No | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| - С | |||
| Способ модулирования для радиотелефонии | 1923 |
|
SU409A1 |
Авторы
Даты
2020-03-06—Публикация
2018-03-06—Подача