Настоящее изобретение относится к органическим соединениям, полезным для лечения или профилактики заболеваний у млекопитающего, в частности к ингибиторам альдостеронсинтазы для лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертензии, первичного альдостеронизма и синдрома Кушинга.
Настоящее изобретение предлагает новые соединения формулы (I)
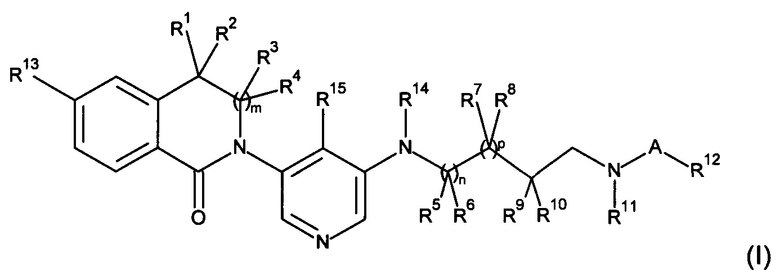
где
R1, R2, R3 и R4 независимо выбраны из Н, алкила и циклоалкила;
R5, R7 и R9 независимо выбраны из Н и алкила;
R8 и R11 вместе образуют -СН2-СН2-;
R10 представляет собой Н, или R10 и R11 вместе образуют -(CH2)w-;
или R6 и R9 вместе образуют -СН2-, R8 представляет собой Н, и R10 и R11 вместе образуют -СН2-;
А представляет собой -С(O)- или -S(O)2-;
R12 представляет собой алкил;
R13 представляет собой галоген или циано;
R14 представляет собой Н, алкил или циклоалкил;
R15 представляет собой Н, алкил, циклоалкил или галоген;
m, n и p независимо выбраны из 0 и 1;
w представляет собой 1, 2 или 3;
и их фармацевтически приемлемые соли.
В этом документе описаны ингибиторы альдостеронсинтазы, которые имеют способность защищать орган/ткань от повреждений, вызванных абсолютным или относительным избытком альдостерона. Гипертензии подвержено около 20% взрослого населения в развитых странах. У лиц 60 лет и старше этот процент увеличивается до 60% и выше. Гипертоники подвержены повышенному риску других физиологических осложнений, включающих инсульт, инфаркт миокарда, мерцательную аритмию, сердечную недостаточность, заболевания периферических сосудов и почек. Ренин-ангиотензин-альдостероновая система представляет собой каскад реакций, которые связаны с гипертензией, объемом и солевым балансом, и в последнее время было установлено, что она непосредственно вносит вклад в конечное повреждение органов на поздних стадиях сердечной недостаточности или при заболевании почек. Ингибиторы АПФ (ангиотензинпревращающего фермента) и блокаторы рецепторов ангиотензина (БРА) успешно используются для улучшения качества и продолжительности жизни больных. Эти лекарства не обеспечивают максимальную защиту. У относительно большого числа пациентов АПФ и БРА приводят к так называемому прорыву альдостерона, явлению, когда уровень альдостерона после первого начального спада возвращается до патологических уровней. Было показано, что вредные последствия неадекватно повышенных уровней альдостерона (в отношении уровней потребления соли) можно свести к минимуму путем блокады альдостерона антагонистами минералокортикоидных рецепторов. Ожидают, что прямое ингибирование синтеза альдостерона обеспечит еще лучшую защиту, поскольку это будет также уменьшать негеномные эффекты альдостерона.
Влияние альдостерона на транспорт Na/K приводит к увеличению реабсорбции натрия и воды, и секреции калия в почках. В целом, это приводит к увеличению объема крови и, следовательно, к повышению артериального давления. Кроме его роли в регуляции реабсорбции натрия в почках альдостерон может оказывать вредное воздействие на почки, сердце и сосудистую систему, особенно в контексте «высокого натрия». Было показано, что при таких условиях альдостерон приводит к повышению окислительного стресса, что в конечном итоге может способствовать повреждению органа. Инфузия альдостерона крысам с нарушением функции почек (которая обусловлена либо обработкой высоким уровнем соли, либо односторонней нефроэктомией) индуцирует широкий спектр повреждений почки, включая расширение клубочковых капилляров, повреждение подоцитов, интерстициальное воспаление, пролиферацию мезангиальных клеток и фиброз, связанный с протеинурией. Более конкретно, было показано, что альдостерон повышает экспрессию молекулы клеточной адгезии ICAM-1 в почках. ICAM-1 принимает критическое участие в воспалении клубочков. Аналогичным образом, было показано, что альдостерон повышает экспрессию воспалительных цитокинов, таких как интерлейкины IL-1b и IL-6, МСР-1 и остеопонтин. На клеточном уровне было показано, что альдостерон повышает в фибробластах сосудов экспрессию мРНК коллагена I типа, медиатора фиброза. Альдостерон также стимулирует накопление коллагена IV типа в мезангиальных клетках крыс и индуцирует экспрессию ингибитора активатора плазминогена-1 (PAI-1) в клетках гладкой мускулатуры. В итоге показано, что альдостерон является ключевым гормоном, вовлеченным в повреждение почек. Альдостерон играет столь же важную роль в развитии риска сердечно-сосудистых заболеваний.
Существует достаточно доклинических доказательств того, что антагонисты минералокортикоидных рецепторов (МР) (спиронолактон и эплеренон) улучшают кровяное давление, сердечную и почечную функцию в различных доклинических моделях.
Совсем недавно доклинические исследования продемонстрировали важный вклад CYP11B2 в заболеваемость и смертность от сердечно-сосудистых заболеваний и заболеваний почек. Ингибитор CYP11B2 FAD286 и антагонист МР спиронолактон исследовали на крысиной модели хронического заболевания почек (высокая экспозиция ангиотензина II, высокий уровень соли и односторонняя нефрэктомия). Ангиотензин II и обработка высоким уровнем соли вызывают альбуминурию, азотемию, реноваскулярную гипертрофию, повреждение клубочков, увеличение PAI-1 и экспрессию мРНК остеопонтина, а также тубулоинтерстициальный фиброз. Оба эти лекарства предотвращали эти почечные эффекты и ослабляли медиальную гипертрофию сердца и аорты. Через 4 недели лечения с помощью FAD286 альдостерон в плазме был снижен, в то время как спиронолактон повысил альдостерон за 4 и 8 недель лечения. Также только спиронолактон, а не FAD286, повышал экспрессию ангиотензина II и мРНК PAI-1, симулированную солью, в аорте и сердце. В других исследованиях ингибитор CYP11B2 FAD286 улучшал артериальное давление, а также функцию и структуру сердечно-сосудистой системы у крыс с экспериментальной сердечной недостаточностью. В тех же исследованиях было показано, что FAD286 улучшает функцию и морфологию почек.
Введение перорально активного ингибитора CYP11В2 ЖХ1699 пациентам с первичным альдостеронизмом приводит к выводу, что он эффективно ингибирует CYP11B2 у пациентов с первичным альдостеронизмом, обеспечивая значительно более низкие уровни альдостерона в крови, и что он корректирует гипокалиемию и мягко снижает артериальное давление. Эффекты на глюкокортикоидную ось согласовывались со слабой селективностью соединения и латентным ингибированием синтеза кортизола. Взятые вместе, эти данные поддерживают концепцию, что ингибитор CYP11B2 может понизить несоответственно высокие уровни альдостерона. Достижение хорошей селективности в отношении CYP11В1 является важным для устранения нежелательных побочных эффектов на гипоталамо-гипофизарно-надпочечниковую (НРА) систему и будет дифференцировать различные ингибиторы CYP11В2.
Соединения настоящего изобретения формулы (I) являются сильными ингибиторами CYPB11B2 и проявляют улучшенную селективность в отношении CYP11B2 по сравнению с CYP11В1, в сочетании с улучшенной метаболической стабильностью.
Объектами настоящего изобретения являются соединения формулы (I) и их вышеупомянутые соли и сложные эфиры, и их применение в качестве терапевтически активных веществ, способ получения указанных соединений, промежуточные соединения, фармацевтические композиции, лекарственные средства, содержащие указанные соединения, их фармацевтически приемлемые соли или сложные эфиры, применение указанных соединений, солей или сложных эфиров для лечения или профилактики заболеваний, особенно для лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертензии, первичного альдостеронизма и синдрома Кушинга, и применение указанных соединений, солей или сложных эфиров для изготовления лекарственных средств для лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертензии, первичного альдостеронизма и синдрома Кушинга.
Термин "алкил" означает одновалентную линейную или разветвленную насыщенную углеводородную группу, содержащую от 1 до 12 атомов углерода. В конкретных вариантах осуществления изобретения алкил имеет от 1 до 7 атомов углерода, и в более конкретных вариантах осуществления изобретения - от 1 до 4 атомов углерода. Примеры алкила включают метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил. Конкретные алкильные группы включают метил, этил, пропил и изопропил.
Термин "циклоалкил" означает насыщенную одновалентную моноциклическую углеводородную группу, содержащую от 3 до 10 кольцевых атомов углерода. В конкретных вариантах осуществления изобретения циклоалкил означает одновалентную насыщенную моноциклическую углеводородную группу, содержащую от 3 до 8 кольцевых атомов углерода. Примеры циклоалкила включают циклопропил, циклобутанил, циклопентил, циклогексил или циклогептил. Конкретной циклоалкильной группой является циклопропил.
Термин "галоген" и "гало" используются здесь взаимозаменяемо и означают фтор, хлор, бром или иод. Конкретными галогенами являются хлор и фтор. Конкретным галогеном является хлор.
Термин "гидрокси" означает группу -ОН.
Термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются биологически или иным образом нежелательными. Соли образованы с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, в частности соляная кислота, и с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота, N-ацетилцистеин и тому подобное. Кроме того, эти соли могут быть получены добавлением неорганического основания или органического основания к свободной кислоте. Соли, полученные с неорганическими основаниями, включают, но не ограничиваются этим, натриевые, калиевые, литиевые, аммониевые, кальциевые, магниевые соли и тому подобное. Соли, полученные с органическими основаниями, включают, но не ограничиваются этим, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полииминовые смолы и тому подобное. Конкретными фармацевтически приемлемыми солями соединений формулы (I) являются гидрохлориды, соли метансульфоновой кислоты и соли лимонной кислоты.
Термин "фармацевтически приемлемые сложные эфиры" означает, что из соединений общей формулы (I) могут быть получены производные по функциональным группам, которые способны превращаться в исходные соединения in vivo. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные эфирные производные, такие как метоксиметиловые эфиры, метилтиометиловые эфиры и пивалоилоксиметиловые эфиры. Кроме того, любые физиологически приемлемые эквиваленты соединений общей формулы (I), аналогичные метаболически лабильным эфирам, которые способны превращаться в исходные соединения общей формулы (I) in vivo, также находятся в рамках этого изобретения.
Термин "защитная группа" (PG) означает группу, которая селективно блокирует реакционноспособные группы в соединении с множеством функциональных групп так, что химическая реакция может быть осуществлена селективно с другой незащищенной реакционноспособной группой, в смысле, который традиционно связан с этим термином в химии синтеза. Защитные группы могут быть удалены в подходящий момент. Примерами защитных групп являются амино-защитные группы, карбокси-защитные группы или гидрокси-защитные группы. Конкретными защитными группами являются трет-бутоксикарбонил (Boc), бензилоксикарбонил (Cbz), флуоренилметоксикарбонил (Fmoc) и бензил (Bn). Дополнительными конкретными защитными группами являются трет-бутоксикарбонил (Boc) и флуоренилметоксикарбонил (Fmoc). Более конкретной защитной группой является трет-бутоксикарбонил (Boc).
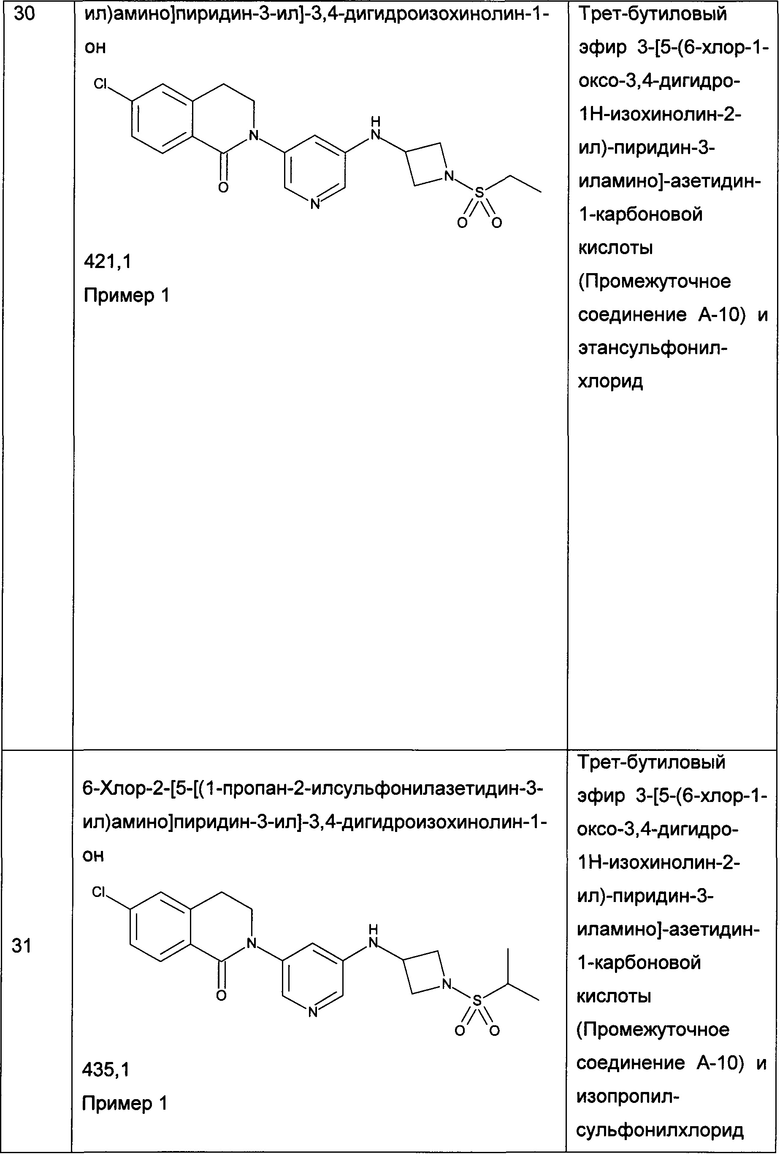
Сокращение uM означает микромоль и эквивалентно символу мкМ.
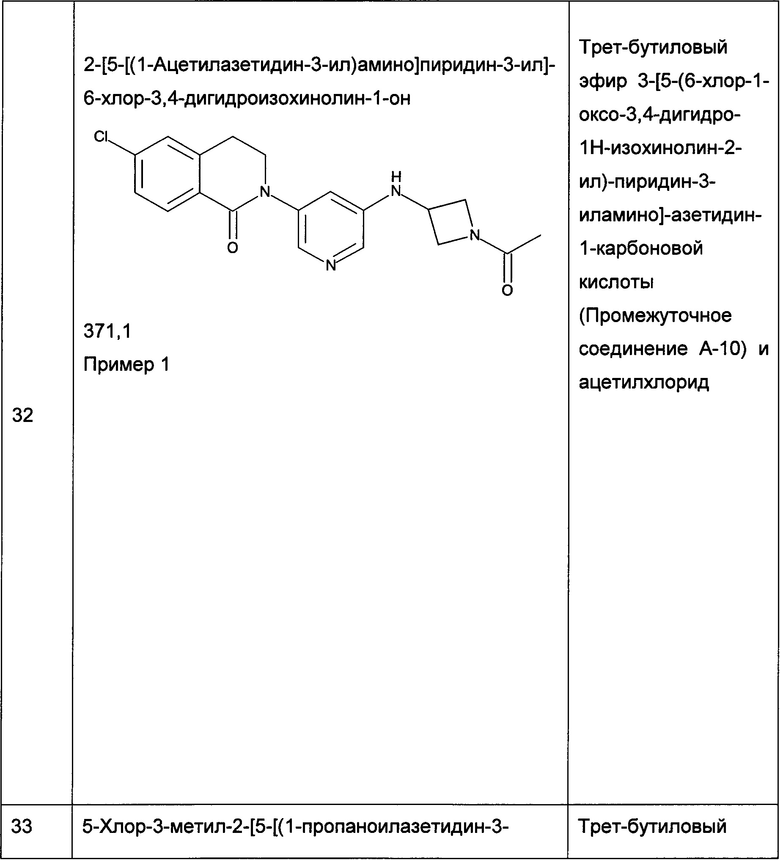
Соединения согласно настоящему изобретению также могут содержать неприродные пропорции атомных изотопов одного или более атомов, которые составляют такие соединения. Например, настоящее изобретение также охватывает меченные изотопами варианты осуществления настоящего изобретения, которые идентичны тем, которые приведены в настоящем описании, но за исключением того, что один или более атомов заменены атомами, имеющими атомную массу или массовое число, отличное от преобладающей атомной массы или массового числа, которые, как правило, встречаются природном атоме. Все изотопы любого указанного конкретного атома или элемента подпадают в объем соединений согласно изобретению и их применения. Примеры изотопов, которые могут быть включены в соединения согласно изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода, такие как 2H ("D"), 3H ("Т"), 11С, 13С, 14С, 13N, 15N, 15O, 17O, 18O, 32Р, 33Р, 35S, 18F, 36Cl, 123I и 125I. Некоторые меченные изотопами соединения согласно настоящему изобретению (например, меченные 3H или 14С) полезны для анализа распределения в тканях соединения и/или субстрата. Изотопы тритий (3H) и углерод 14 (14С) можно использовать из-за легкости их получения и детектирования. Дополнительное замещение более тяжелыми изотопами, такими как дейтерий (т.е. 2H), может давать определенные терапевтические преимущества, происходящие из их большей метаболической стабильности (например, повышенный in vivo период полураспада или более низкие требуемые дозы), и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Позитрон-излучающие изотопы, такие как 15О, 13N, 11С, и 18F, полезны для исследований позитронно-эмиссионной томографии (ПЭТ) для изучения занятости рецептора субстратом. Меченные изотопами соединения согласно настоящему изобретению, как правило, могут быть получены способами, аналогичными тем, что раскрыты на схемах и/или в примерах, представленных ниже, путем замены немеченого изотопом реагента на меченный изотопом реагент. В частности, соединения формулы (I), где один или более атомов Н были заменены атомом 2H, также являются вариантом осуществления данного изобретения.
Соединения формулы (I) могут содержать несколько асимметрических центров и могут присутствовать в форме оптически чистых энантиомеров, смесей энантиомеров, таких как, например, рацематы, оптически чистые диастереоизомеры, смеси диастереоизомеров, рацематы диастереоизомеров или смеси рацематов диастереоизомеров.
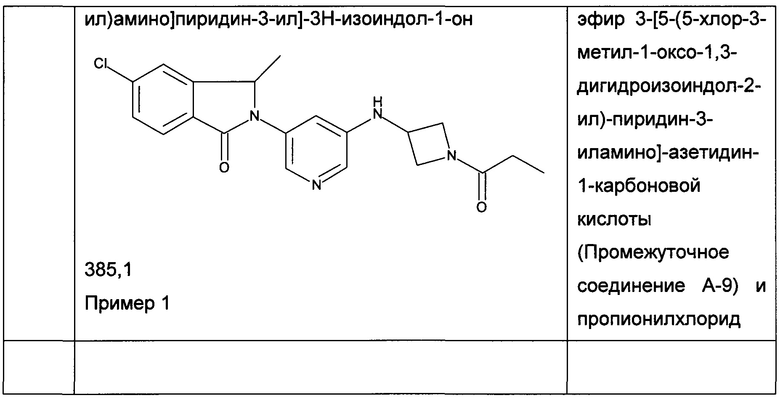
Согласно Конвенции Кана-Ингольда-Прелога асимметрический атом углерода может находиться в конфигурации "R" или "S".
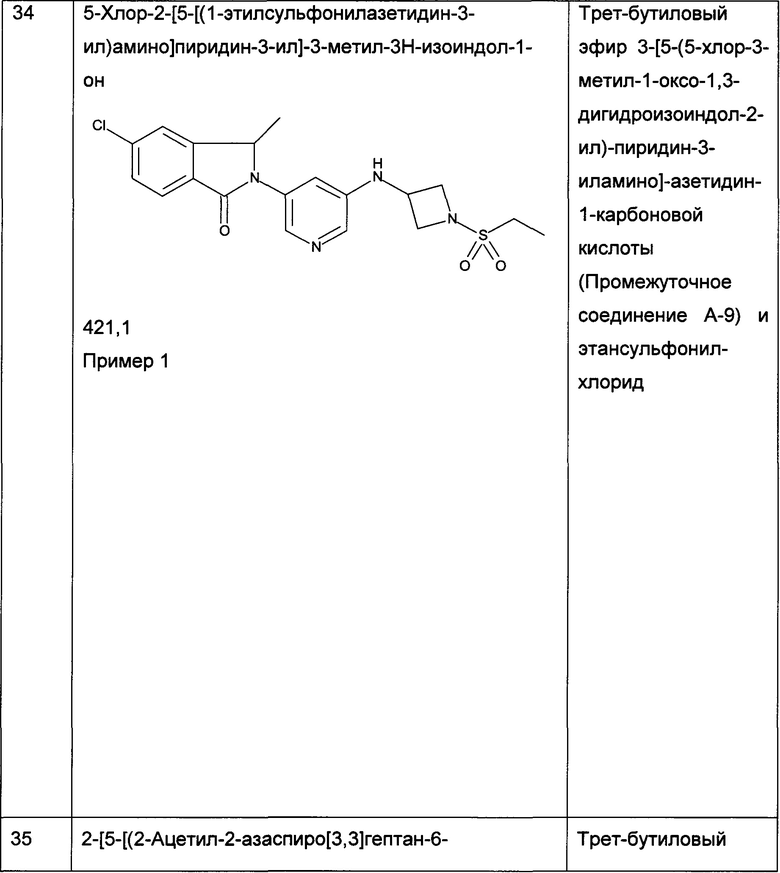
Кроме того, вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, и их фармацевтически приемлемые соли или сложные эфиры, в частности соединения формулы (I), как описано здесь, и их фармацевтически приемлемые соли, более конкретно соединения формулы (I), как описано здесь.
Настоящее изобретение также относится к соединениям формулы (I), как описано здесь, где
R1, R2, R3 и R4 независимо выбраны из Н, алкила и циклоалкила;
R5, R7 и R9 независимо выбраны из Н и алкила,
R8 и R11 вместе образуют -СН2-СН2-;
R10 представляет собой Н, или R10 и R11 вместе образуют -(CH2)w-;
или R6 и R9 вместе образуют -CH2-, R8 представляет собой Н, и R10 и R11 вместе образуют -СН2-;
А представляет собой -С(O)- или -S(O)2-;
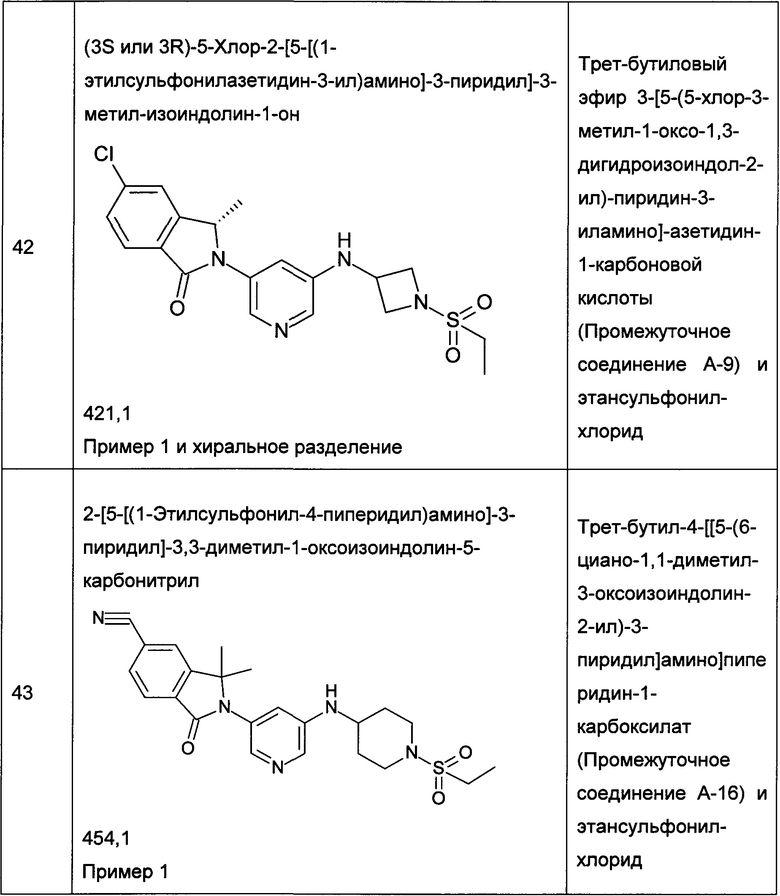
R12 представляет собой алкил;
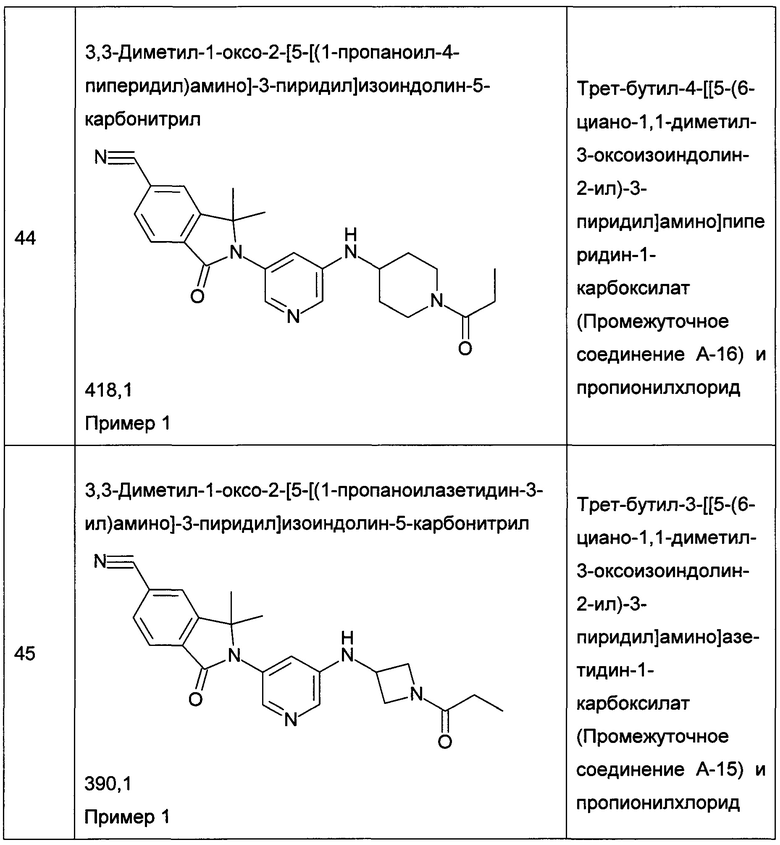
R13 представляет собой галоген;
R14 представляет собой Н, алкил или циклоалкил;
R15 представляет собой Н, алкил, циклоалкил или галоген;
m, n и p независимо выбраны из 0 и 1;
w представляет собой 1, 2 или 3;
и их фармацевтически приемлемым солям.
Также конкретным вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где А представляет собой -S(O)2-.
Другим вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где R1 и R2 независимо выбраны из Н и алкила.
Другим конкретным вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где R1 и R2 представляют собой алкил.
Другим конкретным вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где R1 и R2 представляют собой метил.
Другим вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где m и n представляют собой (I).
Другим вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где p представляет собой 1.
Другим вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где w представляет собой 1 или 2.
Другим конкретным вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где R5, R7 и R9 представляют собой Н.
Конкретным вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где R9 представляет собой Н.
Другим вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где R12 представляет собой метил, этил, пропил или изопропил.
Также конкретным вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где R12 представляет собой этил, пропил или изопропил.
Другим конкретным вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где R12 представляет собой этил.
Конкретным вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где R13 представляет собой хлор.
Другим конкретным вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где R15 представляет собой Н.
Также вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где
R1 и R2 представляют собой алкил;
R7 и R9 представляют собой Н;
R8 и R11 вместе образуют -СН2-СН2-;
R10 представляет собой Н или R10 и R11 вместе образуют -(CH2)w-;
А представляет собой -С(O)- или -S(O)2-;
R12 представляет собой алкил;
R13 представляет собой галоген;
R14 представляет собой Н или алкил;
R15 представляет собой Н;
m и n представляют собой 0;
p представляет собой 0 или 1;
w представляет собой 1 или 2;
и их фармацевтически приемлемые соли.
Конкретным вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где
R1 и R2 представляют собой алкил;
R7 и R9 представляют собой Н;
R8 и R11 вместе образуют -СН2-СН2-;
R10 представляет собой Н, или R10 и R11 вместе образуют -(СН2)w-;
А представляет собой -S(O)2-;
R12 представляет собой алкил;
R13 представляет собой галоген;
R14 представляет собой Н или алкил;
R15 представляет собой Н
m и n представляют собой 0;
p представляет собой 0 или 1;
w представляет собой 1 или 2;
и их фармацевтически приемлемые соли.
Другим конкретным вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где
R1 и R2 представляют собой алкил;
R7 и R9 представляют собой Н;
R8 и R11 вместе образуют -СН2-СН2-;
R10 представляет собой Н;
А представляет собой -S(O)2-;
R12 представляет собой алкил;
R13 представляет собой хлор;
R14 представляет собой Н;
R15 представляет собой Н
m и n представляют собой 0;
p представляет собой 1;
и их фармацевтически приемлемые соли.
Другим конкретным вариантом осуществления настоящего изобретения являются соединения формулы (I), как описано здесь, где
R1 и R2 представляют собой метил;
R7 и R9 представляют собой Н;
R8 и R11 вместе образуют -СН2-СН2-;
R10 представляет собой Н;
А представляет собой -S(O)2-;
R12 представляет собой этил;
R13 представляет собой хлор;
R14 представляет собой Н или алкил;
R15 представляет собой Н
m и n представляют собой 0;
p представляет собой 1;
и их фармацевтически приемлемые соли.
Конкретные примеры соединений формулы (I), как описано здесь, выбраны из
2-[5-[(1-Ацетилазетидин-3-ил)амино]пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-она;
2-[5-[(1-Ацетилазетидин-3-ил)-метиламино]пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-она;
5-Хлор-2-[5-[[(3R или 3S)-1-этилсульфонилпирролидин-3-ил]-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-Хлор-2-[5-[[(3S или 3R)-1-этилсульфонилпирролидин-3-ил]-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
2-[5-[(1-Ацетилпиперидин-4-ил)амино]пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-она;
5-Хлор-2-[5-[(1-этилсульфонилпиперидин-4-ил)амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-Хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[(1-метилсульфонилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[(1-пропаноилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-(1-метилсульфонилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-(1-пропаноилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-(1-пропан-2-илсульфонилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-(1-пропилсульфонилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-[(3S или 3R)-1-пропан-2-илсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-[(3R или 3S)-1-пропан-2-илсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-[(3S или 3R)-1-пропилсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-[(3R или 3S)-1-пропилсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-(1-пропаноилпиперидин-4-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-2-[5-[(1-этилсульфонилпиперидин-4-ил)-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-(1-метилсульфонилпиперидин-4-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[[(3R или 3S)-1-метилсульфонилпиперидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[[(3S или 3R)-1-метилсульфонилпиперидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-2-[5-[[(3R или 3S)-1-этилсульфонилпиперидин-3-ил]амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-Хлор-2-[5-[[(3S или 3R)-1-этилсульфонилпиперидин-3-ил]амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[[(3R или 3S)-1-пропан-2-илсульфонилпиперидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[[(3S или 3R)-1-пропан-2-илсульфонилпиперидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-2-[5-[(1-пропаноилазетидин-3-ил)амино]пиридин-3-ил]-3Н-изоиндол-1-она;
6-Хлор-2-[5-[(1-пропаноилазетидин-3-ил)амино]пиридин-3-ил]-3,4-дигидроизохинолин-1-она;
6-Хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)амино]пиридин-3-ил]-3,4-дигидроизохинолин-1-она;
6-Хлор-2-[5-[(1-пропан-2-илсульфонилазетидин-3-ил)амино]пиридин-3-ил]-3,4-дигидроизохинолин-1-она;
2-[5-[(1-Ацетилазетидин-3-ил)амино]пиридин-3-ил]-6-хлор-3,4-дигидроизохинолин-1-она;
5-Хлор-3-метил-2-[5-[(1-пропаноилазетидин-3-ил)амино]пиридин-3-ил]-3Н-изоиндол-1-она;
5-Хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)амино]пиридин-3-ил]-3-метил-3Н-изоиндол-1-она;
2-[5-[(2-Ацетил-2-азаспиро[3,3]гептан-6-ил)амино]пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[(2-пропаноил-2-азаспиро[3,3]гептан-6-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-2-[5-[(2-этилсульфонил-2-азаспиро[3,3]гептан-6-ил)амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[(2-пропан-2-илсульфонил-2-азаспиро[3,3]гептан-6-ил)амино]пиридин-3-ил]изоиндол-1-она;
(3R или 3S)-5-Хлор-3-метил-2-[5-[(1-пропаноилазетидин-3-ил)амино]-3-пиридил]изоиндолин-1-она;
(3S или 3R)-5-Хлор-3-метил-2-[5-[(1-пропаноилазетидин-3-ил)амино]-3-пиридил]изоиндолин-1-она;
(3R или 3S)-5-Хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)амино]-3-пиридил]-3-метил-изоиндолин-1-она;
(3S или 3R)-5-Хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)амино]-3-пиридил]-3-метил-изоиндолин-1-она;
2-[5-[(1-Этилсульфонил-4-пиперидил)амино]-3-пиридил]-3,3-диметил-1-оксоизоиндолин-5-карбонитрила;
3,3-Диметил-1-оксо-2-[5-[(1-пропаноил-4-пиперидил)амино]-3-пиридил]изоиндолин-5-карбонитрила;
3,3-Диметил-1-оксо-2-[5-[(1-пропаноилазетидин-3-ил)амино]-3-пиридил]изоиндолин-5-карбонитрила;
и их фармацевтически приемлемых солей.
Другие конкретные примеры соединений формулы (I), как описано здесь, выбраны из
5-Хлор-2-[5-[(1-этилсульфонилпиперидин-4-ил)амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-Хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[(1-пропаноилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-[(3S или 3R)-1-пропан-2-илсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-[(3R или 3S)-1-пропан-2-илсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-Хлор-3,3-диметил-2-[5-[метил-[(3R или 3S)-1-пропилсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
и их фармацевтически приемлемых солей.
Более конкретным примером соединения формулы (I), как описано здесь, является 5-Хлор-2-[5-[(1-этилсульфонилпиперидин-4-ил)амино]пиридин-3-ил]-3,3-диметилизоиндол-1-он и его фармацевтически приемлемые соли.
Способы получения соединений формулы (I), как описано здесь, являются предметом изобретения.
Получение соединений формулы (I) настоящего изобретения можно осуществлять последовательными или пересекающимися путями синтеза. Синтезы согласно изобретению показаны на следующих общих схемах. Навыки, необходимые для проведения реакции и очистки полученных продуктов известны специалистам в данной области. В случае если в процессе реакции образуются смеси энантиомеров или диастереомеров, эти энантиомеры или диастереомеры могут быть разделены способами, описанными здесь или известными специалисту в данной области, такими как, например, хиральная хроматография или кристаллизация. Заместители и индексы, используемые в следующем описании способов, имеют значения, указанные в данном документе.
В настоящем тексте используются следующие аббревиатуры:
АсОН = уксусная кислота, ВОС = t-бутилоксикарбонил, BuLi = бутиллитий, CDI = 1,1-карбонилдиимидазол, DCM = дихлорметан, DBU = 2,3,4,6,7,8,9,10-октагидропиримидо[1,2-а]азепин, DCE = 1,2-дихлорэтин, DIBALH = ди-изо-бутилалюминий гидрид, DCC = N,N'-дициклогексилкарбодиимид, DMA = N,N-диметилацетамид, DMAP = 4-диметиламинопиридин, DMF = N,N-диметилформамид, EDCI = N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорид, EtOAc = этилацетат, EtOH = этанол, Et2O = диэтиловый эфир, Et3N = триэтиламин, eq = эквиваленты, HATU = O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат, HPLC = высокоэффективная жидкостная хроматография, НОВТ = 1-гидроксибензотриазол, основание Хунига = iPr2NEt = N-этилдиизопропиламин, IPC = контроль в процессе обработки, LAH = литийалюминий гидрид, LDA = литийдиизопропиламид, LiBH4 = литий борогидрид, МеОН = метанол, NaBH3CN = натрия цианоборогидрид, NaBH4 = натрия борогидрид, NaI = натрия иодид, Red-Al = натрия бис(2-метоксиэтокси)-алюминийгидрид, RT = комнатная температура, TBDMSCI = трет-бутилдиметилсилилхлорид, TFA = трифторуксусная кислота, THF = тетрагидрофуран, quant = количественный.
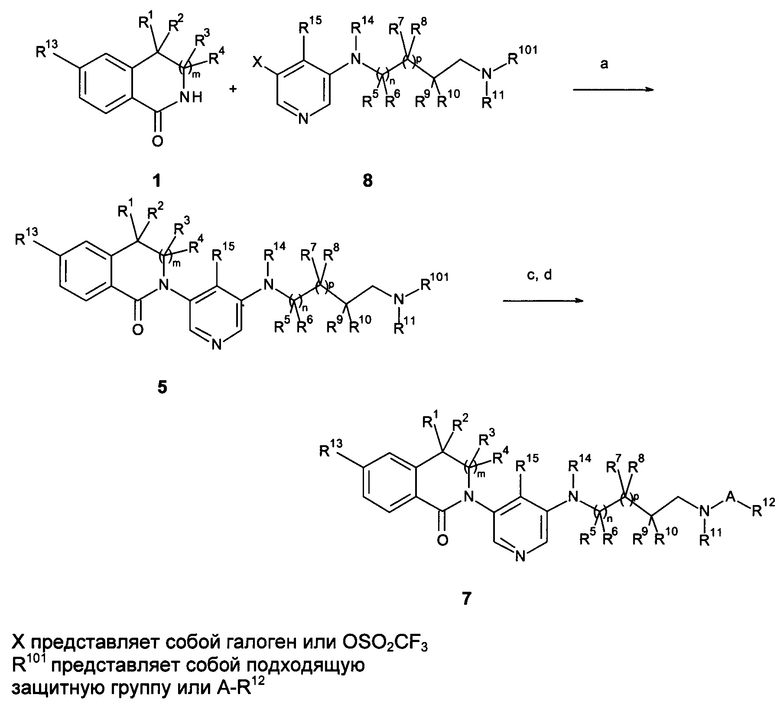
Галоген- или трифлат-замещенные, предпочтительно йодзамещенные, пиридиновые соединения 2 или 8 реагируют с ариллактамами 1 в растворителях, таких как 1,4-диоксан, в присутствии йодида меди (I), карбоната калия или цезия, хелатирующего 1,2-диамино соединения, такого как N,N'-диметилэтилендиамин или транс-1,2-диаминоциклогексан, или хелатирующего бета-кетосложноэфирного соединения, такого как 2-изобутирилциклогексанон, при повышенных температурах, предпочтительно с помощью микроволнового нагрева с образованием лактам-замещенных гетероциклических соединений 3 и 5, как описано на схемах 1а и 1b (стадия а). Аминосоединения 4 или 6 (соединения, которые известны или могут быть легко получены способами, известными в данной области техники) реагируют с замещенными пиридиновыми соединениями 3 в условиях, аналогичных используемым на стадии а (стадии b), условия предпочтительны для соединений 4 или 6 с первичными аминогруппами, или с использованием условий Бухвальда, например, с использованием катализаторов, таких как Pd(OAc)2, и хелатирующих лигандов, таких как Xanphos, в присутствии основания, такого как трет-BuONa, в растворителях, таких как диоксан, при повышенной температуре (условия предпочтительны для соединений 4 или 6 со вторичной аминогруппой), из которых получают соединения 5 или 7. Соединения 5 с R101, который является защитной группой, например, Вос-группой, могут быть превращены в соединения 7 путем удаления защитной группы R101 и реакции с соответствующим активированным карбоксильным или сульфонильным соединением (стадии с, а; Схемы 1а и 1b).
Схема 1а
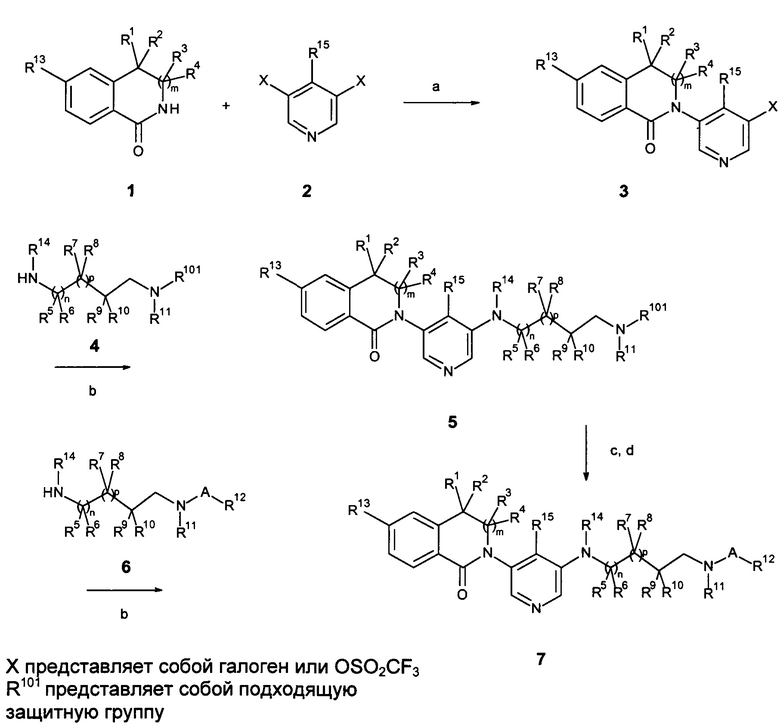
Схема 1b
Карбаматы 101 (схема 2а) реагируют с полифосфорной кислотой при повышенной температуре (например, 100-180°С) с образованием производных 3,4-дигидро-2Н-изохинолин-1-она 102 (стадия а). Трифторацетамиды 103 можно циклизовать в соединения 1-(3,4-дигидро-1Н-изохинолин-2-ил)-2,2,2-трифторэтанона 104 путем обработки параформальдегидом в смеси концентрированной серной кислоты и уксусной кислоты предпочтительно при приблизительно комнатной температуре (стадия b). Удаление трифторацетильной группы путем обработки, например, гидроксидом калия в растворителе, таком как этанол, при приблизительно комнатной температуре приводит к получению тетрагидроизохинолиновых соединений 105 (стадия c). Окисление тетрагидроизохинолиновых соединений 105, например, иодозобензолом и бромидом калия предпочтительно в воде приводит к получению соединений 3,4-дигидро-2Н-изохинолин-1-она (102 соединения, стадия d). Реакция изоиндол-1,3-дионовых соединений 106 (схема 2b) с реактивом Гриньяра R1MgX в растворителе, таком как THF, предпочтительно около 0°С приводит к получению аддуктов 107 (стадия е). Последующая обработка триэтилсиланом и эфиратом трехфтористого бора в растворителе, таком как дихлорметан, и в температурном диапазоне предпочтительно от -25°С до RT приводит к получению изоиндолоновых соединений 108 (стадия f). Введение метоксибензильной защитной группы в изоиндолоновые соединения 109 (например, путем обработки бис(триметилсилил)амидом и 1-бромметил-4-метоксибензолом в THF между 0°С и RT) приводит к получению защищенных соединений 110 (стадия g); аналогично, в соединения 108 можно ввести метоксибензильную защитную группу. Обработка соединений 108, включающих дополнительную метоксибензильную защитную группу, или соединений 110 основанием, таким как гидрид натрия, в растворителе, таком как THF, и затем алкилгалогенидом, мезилатом или тозилатом предпочтительно при температуре от комнатной до температуры кипения растворителя приводит к получению соединений 111 со структурно различными или структурно одинаковыми группами R1 и R2 (стадия h). Кроме того, обработка соединений 108, включающих дополнительную метоксибензильную защитную группу, или соединений 110 основанием, таким как NaH, LDA или LiHMDS, в растворителях, таких как DMF, тетрагидрофуран или 1,2-диметоксиэтан, и затем одним или последовательно двумя различными алкилгалогенидами, мезилатами или тозилатами предпочтительно при температуре от -78°С и до температуры кипения растворителя приводит к получению соединений 111 со структурно различными или структурно идентичными группами R1 и R2 (стадия h). Удаление защитной группы, например, путем обработки трифторуксусной кислотой при повышенной температуре приводит к получению изоиндолоновых соединений 112 (стадия i). Альтернативно (схема 2с), соединения 114, где R1 и R2 являются алкильными группами, могут быть получены из циано соединений 113 и подходящих реагентов Гриньяра, либо путем добавления двух различных реагентов последовательно или одного реактива Гриньяра в избытке (с получением соединений с одинаковыми R1 и R2), предпочтительно в присутствии тетраизопропоксида титана в растворителях, таких как THF, предпочтительно в диапазоне температур от 0°С до комнатной температуры (стадия k). Соединения 114, где R1 = Н и R2 является алкильной группой, можно получить из циано соединений 113 и подходящих реагентов Гриньяра в растворителе, таком как THF, предпочтительно в диапазоне температур от 0°С и RT (стадия k) с последующим восстановлением имина, образованного с натрийборгидридом, например, в метаноле при приблизительно RT (стадия k). Соединения 114 подвергают циклизации в реакции с катализаторами, такими как дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий (II), в растворителях, таких как DMF, в присутствии основания, такого как iPr2NEt предпочтительно в диапазоне температур приблизительно от 100°С до 150°С в автоклаве в присутствии окиси углерода (стадия I).
Схема 2а
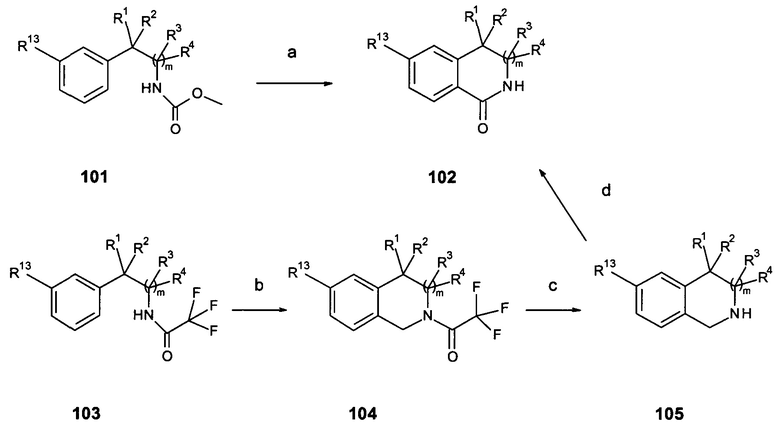
Схема 2b
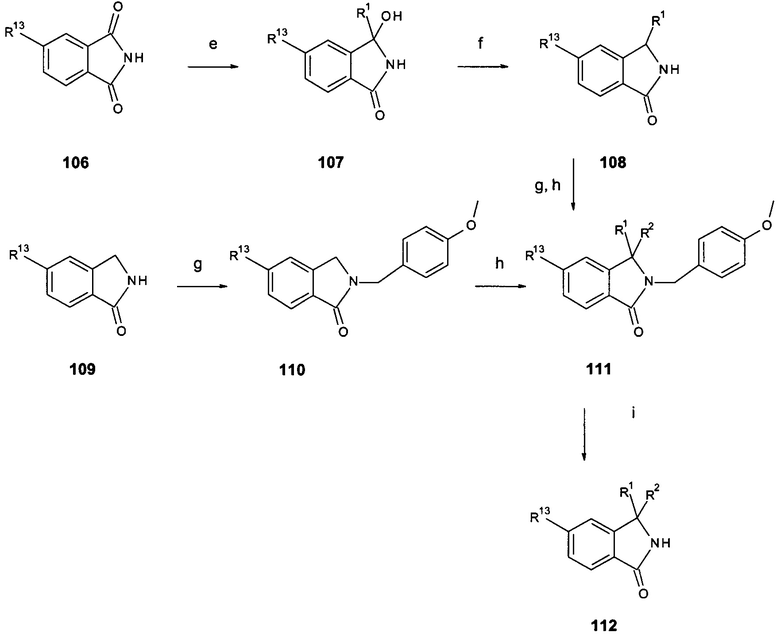
Схема 2с
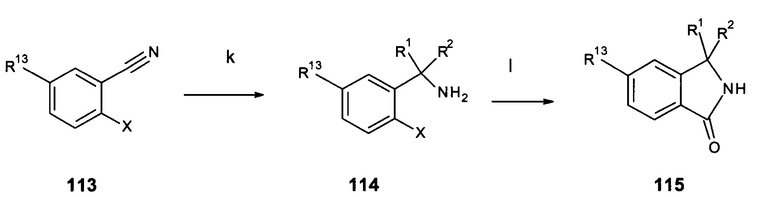
Галоген- или трифлат-замещенные соединения 8 могут быть получены с помощью реакции аминосоединений 4 с ди-галоген- или ди-трифлат-замещенными пиридинами 2 с использованием условий, как описано для схемы 1 (схемы 3) (стадия а).
Схема 3
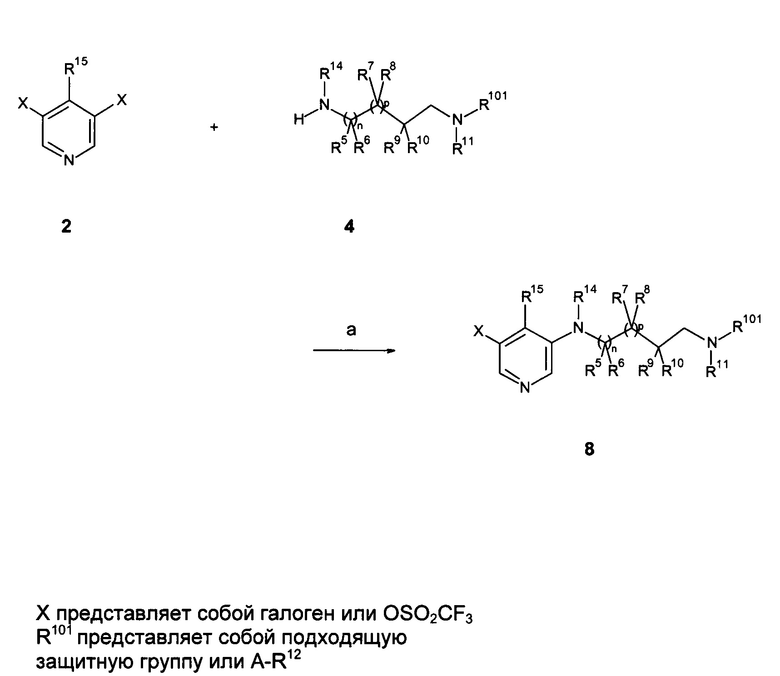
Также одним из вариантов осуществления настоящего изобретения является способ получения соединения формулы (I), как определено выше, включающий
а) осуществление взаимодействия соединения формулы (II) в присутствии соединения формулы (III);
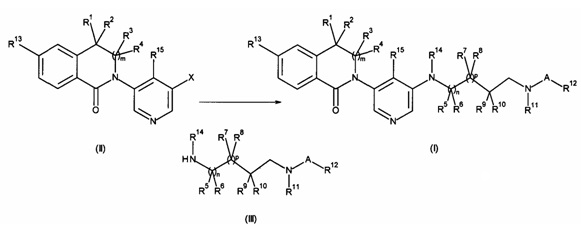
или
b) осуществление взаимодействия соединения формулы (IV) в присутствии соединения формулы (V);
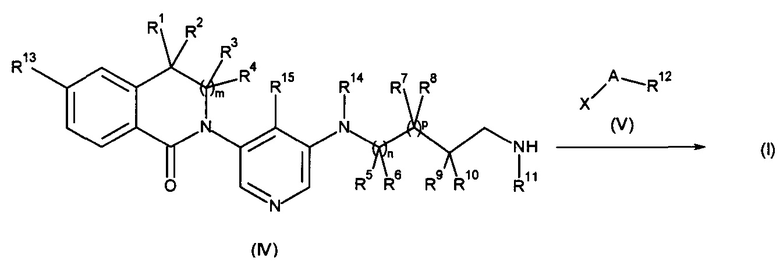
где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, A, m, n и p являются такими, как описано здесь, и Х на стадии а) представляет собой галоген или трифлат, и на стадии b) представляет собой галоген.
В частности, на стадии а), в присутствии иодида меди (I), карбоната цезия или калия, хелатирующего 1,2-диамино соединения, такого как N,N'-диметилэтилендиамин или транс-1,2-диаминоциклогексан, или хелатирующего соединения бета кетосложноэфирного соединения, такого как 2-изобутирилциклогексанон, при повышенных температурах, предпочтительно с использованием микроволнового нагревания и в растворителях, таких как 1,4-диоксан.
В частности, на стадии b), в присутствии основания, такого как триэтиламин, в растворителе, таком как дихлорметан, при температуре между -10°С и RT.
Также предметом настоящего изобретения является соединение формулы (I), как описано здесь, для применения в качестве терапевтически активного вещества.
Также предметом настоящего изобретения является фармацевтическая композиция, содержащая соединение формулы (I), как описано здесь, и терапевтически инертный носитель.
Настоящее изобретение также относится к применению соединения формулы (I), как описано здесь, для лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертензии, первичного альдостеронизма и синдрома Кушинга.
Настоящее изобретение также относится к применению соединения формулы (I), как описано здесь, для лечения или профилактики диабетической нефропатии.
Настоящее изобретение также относится к применению соединения формулы (I), как описано здесь, для лечения или профилактики фиброза почек или сердца.
Настоящее изобретение также относится к применению соединения формулы (I), как описано здесь, для лечения или профилактики хронического заболевания почек.
Настоящее изобретение также относится к применению соединения формулы (I), как описано здесь, для лечения или профилактики застойной сердечной недостаточности.
Настоящее изобретение также относится к применению соединения формулы (I), как описано здесь, для лечения или профилактики гипертензии.
Настоящее изобретение также относится к применению соединения формулы (I), как описано здесь, для лечения или профилактики первичного альдостеронизма.
Конкретным вариантом осуществления настоящего изобретения является соединение формулы (I), как описано здесь, для лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертензии, первичного альдостеронизма и синдрома Кушинга.
Также конкретным вариантом осуществления настоящего изобретения является соединение формулы (I), как описано здесь, для лечения или профилактики диабетической нефропатии.
Также конкретным вариантом осуществления настоящего изобретения является соединение формулы (I), как описано здесь, для лечения или профилактики фиброза почек и сердца.
Также конкретным вариантом осуществления настоящего изобретения является соединение формулы (I), как описано здесь, для лечения или профилактики хронического заболевания почек.
Также конкретным вариантом осуществления настоящего изобретения является соединение формулы (I), как описано здесь, для лечения или профилактики застойной сердечной недостаточности.
Также конкретным вариантом осуществления настоящего изобретения является соединение формулы (I), как описано здесь, для лечения или профилактики гипертензии.
Также конкретным вариантом осуществления настоящего изобретения является соединение формулы (I), как описано здесь, для лечения или профилактики первичного альдостеронизма.
Настоящее изобретение также относится к применению соединения формулы (I), как описано здесь, для изготовления лекарственного средства для лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертензии, первичного альдостеронизма и синдрома Кушинга.
Настоящее изобретение также относится к применению соединения формулы (I), как описано здесь, для изготовления лекарственного средства для лечения или профилактики диабетической нефропатии.
Настоящее изобретение также относится к применению соединения формулы (I), как описано здесь, для изготовления лекарственного средства для лечения или профилактики фиброза почек или сердца.
Также вариантом осуществления настоящего изобретения является применение соединения формулы (I), как описано здесь, для изготовления лекарственного средства для лечения или профилактики хронического заболевания почек.
Также вариантом осуществления настоящего изобретения является применение соединения формулы (I), как описано здесь, для изготовления лекарственного средства для лечения или профилактики застойной сердечной недостаточности.
Также вариантом осуществления настоящего изобретения является применение соединения формулы (I), как описано здесь, для изготовления лекарственного средства для лечения или профилактики гипертензии.
Также вариантом осуществления настоящего изобретения является применение соединения формулы (I), как описано здесь, для изготовления лекарственного средства для лечения или профилактики первичного альдостеронизма.
Также предметом изобретения является способ лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертензии, первичного альдостеронизма и синдрома Кушинга, включающий введение эффективного количества соединения формулы (I), как описано здесь.
Также вариантом осуществления настоящего изобретения является способ лечения или профилактики диабетической нефропатии, включающий введение эффективного количества соединения формулы (I), как описано здесь.
Также вариантом осуществления настоящего изобретения является способ лечения или профилактики фиброза почек или сердца, включающий введение эффективного количества соединения формулы (I), как описано здесь.
Также вариантом осуществления настоящего изобретения является способ лечения или профилактики хронического заболевания почек, включающий введение эффективного количества соединения формулы (I), как описано здесь.
Также вариантом осуществления настоящего изобретения является способ лечения или профилактики застойной сердечной недостаточности, включающий введение эффективного количества соединения формулы (I), как описано здесь.
Также вариантом осуществления настоящего изобретения является способ лечения или профилактики гипертензии, включающий введение эффективного количества соединения формулы (I), как описано здесь.
Также вариантом осуществления настоящего изобретения является способ лечения или профилактики первичного альдостеронизма, включающий введение эффективного количества соединения формулы (I), как описано здесь.
Другим вариантом осуществления настоящего изобретения является соединение формулы (I), как описано здесь, полученное любым из описанных способов.
Методики анализов
Клеточная линия G-402 была определена для использования в качестве клетки-хозяина, которая эктопически экспрессирует (временно или стабильно) ферменты семейства CYP11. В частности, мы разработали стабильные клетки G-402, эктопически экспрессирующие ферменты CYP11B1 человека, CYP11B2 человека, CYP11A1 человека, CYP11B1 собакоподобных обезьян или CYP11B2 собакоподобных обезьян. Важно, что определенная клеточная линия G-402 экспрессирует ко-факторы (адренодоксин и адренодоксинредуктазу), которые важны для активности семейства CYP11, и в этих клетках не была обнаружена релевантная ферментативная активность семейства CYP11 (в сравнении с клетками H295R). Таким образом, клеточная линия G-402 уникально подходит в качестве клетки-хозяина для эктопической экспрессии ферментов из семейства CYP11. Клетки G-402 могут быть получены из АТСС (CRL-1440), и имели происхождение из лейомиобластомы почек.
Плазмида экспрессии содержит открытую рамку считывания (ORF) либо для CYP11B1 человека/собакоподобных обезьян, либо для CYP11B2 под контролем подходящего промотора (CMV-промотора), и подходящий маркер устойчивости (к неомицину). С использованием стандартных методик плазмиду экспрессии трансфицируют в клетки G-402, и эти клетки затем выбирают для экспрессирования указанных маркеров устойчивости. Затем выбирают индивидуальные клеточные клоны и анализируют на предмет нужного проявления ферментативной активности, используя 11-деоксикортикостерон (CYP11B2) или 11-деоксикортизол (Cyp11В1) в качестве субстрата.
Клетки G-402, экспрессирующие конструкции CYP11, были определены, как описано выше, и выдерживались в модифицированной среде МсСоу 5а, №30-2007 по каталогу АТСС, содержащей 10% фетальной бычьей сыворотки (FCS) и 400 мкг/мл G418 (генетицина), при 37°С в атмосфере 5% CO2/95% воздуха. Анализы клеточных ферментов проводили в среде DMEM/F12, содержащей 2,5% угля, обработанного FCS, и соответствующую концентрацию субстрата (0,3-10 мкМ 11-деоксикортикостерона, 11-деоксикортизола или кортикостерона). Для количественного определения ферментативной активности клетки высевали на 96-луночные планшеты и инкубировали в течение 16 ч. Аликвоту супернатанта затем переносили и анализировали в отношении концентрации целевого продукта (альдостерона для CYP11B2; кортизола для CYP11B1). Концентрации этих стероидов можно определить с использованием анализа методом гомогенной разрешенной во времени флуоресценции (HTRF) из анализа CisBio либо альдостерона, либо кортизола.
Ингибирование высвобождения продуцируемых стероидов может быть использовано в качестве меры соответствующего ингибирования фермента тестируемыми соединениями, добавленными во время клеточного ферментативного анализа. Дозо-зависимое ингибирование ферментативной активности соединением рассчитывают из графика зависимости измеренной концентрации стероида/продукта (y-ось) от добавленной концентрации ингибитора (x-ось). Затем ингибирование рассчитывают путем подбора следующей сигмоидальной функции с 4 параметрами (модели Моргана-Мерсера-Флодина (ММФ)) по точкам данных ряда, используя метод наименьших квадратов:
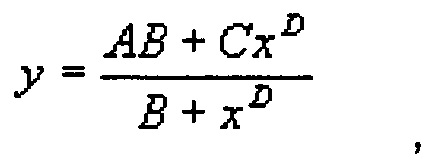
где А - максимальное значение y, В - коэффициент ЕС50, определенный с использованием XLFit, С - минимальное значение y, и D - значение наклона.
Максимальное значение А соответствует количеству стероида, продуцируемого в отсутствие ингибитора, значение С соответствует количеству стероида, определенного при полном ингибировании фермента.
Значения ЕС50 для заявленных соединений были проверены с использованием описанной аналитической системы на основе клеток G-402. Активность фермента CYP11B2 была проверена в присутствии 1 мкМ деоксикортикостерона и различных количеств ингибиторов; активность фермента CYP11B1 была проверена в присутствии 1 мкМ деоксикортизола и различных количеств ингибиторов.
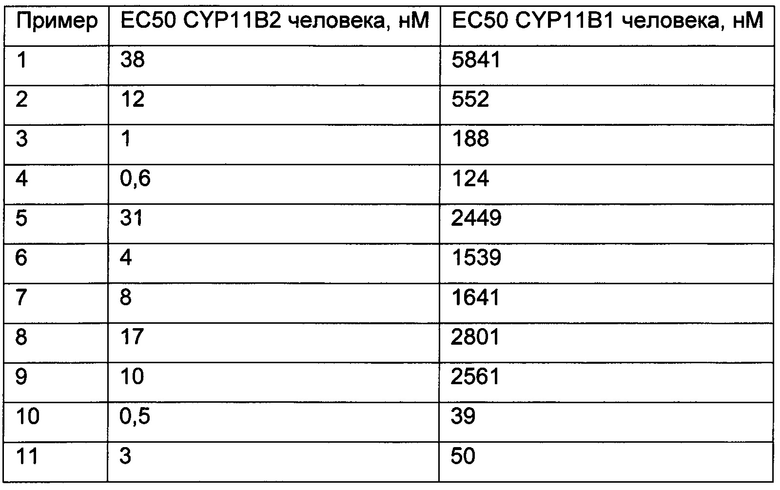
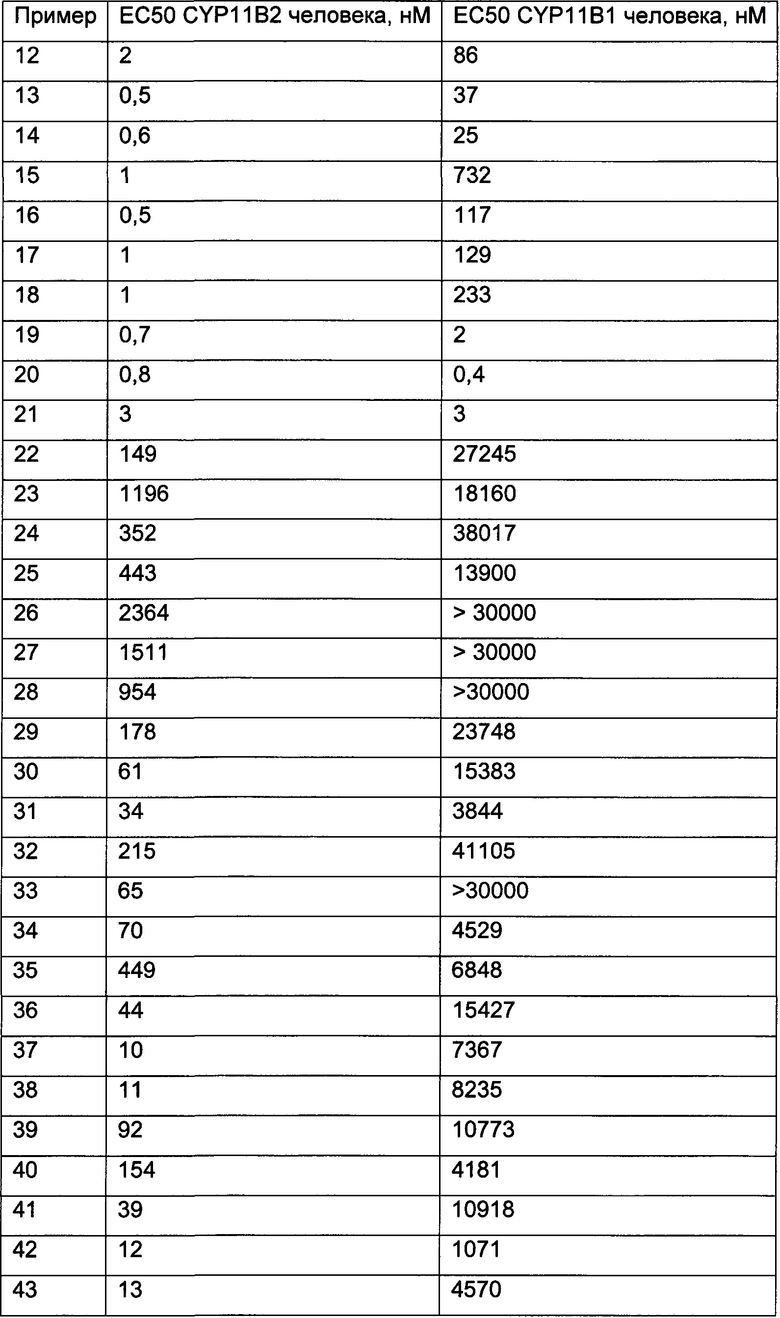

Соединения формулы (I) и их фармацевтически приемлемые соли или сложные эфиры, как описано здесь, имеют значения EC50 (CYP11B2) между 0,000001 мкМ и 1000 мкМ, конкретные соединения имеют значения ЕС50 (CYP11B2) между 0,00005 мкМ и 500 мкМ, другие конкретные соединения имеют значения ЕС50 (CYP11B2) между 0,0005 мкМ и 50 мкМ, более конкретные соединения имеют значения ЕС50 (CYP11B2) между 0,0005 мкМ и 5 мкМ. Эти результаты были получены с использованием ферментного анализа, описанного выше.
Соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы в качестве лекарственных средств (например в форме фармацевтических препаратов). Фармацевтические препараты можно вводить внутрь, например перорально (например в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий), назально (например в форме назальных спреев) или ректально (например, в форме суппозиториев). Однако введение также можно осуществлять парентерально, например внутримышечно или внутривенно (например в форме инъекционных растворов).
Соединения формулы (I) и их фармацевтически приемлемые соли можно обработать с фармацевтически инертными неорганическими или органическими адъювантами для получения таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. В качестве таких адъювантов для таблеток, драже и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли, и т.д.
Подходящими адъювантами для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые вещества и жидкие полиолы и т.п.
Подходящими адъювантами для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.п.
Подходящими адъювантами для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д.
Подходящими адъювантами для суппозиториев являются, например, природные или гидрогенизированные масла, воски, жиры, полутвердые или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, вещества, повышающие вязкость, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать другие терапевтически ценные вещества.
Дозировка может варьироваться в широких пределах и будет, конечно, приспособлена к индивидуальным требованиям в каждом конкретном случае. В общем, в случае перорального введения суточная доза, составляющая от приблизительно 0,1 мг до 20 мг на кг массы тела, предпочтительно приблизительно от 0,5 мг до 4 мг на кг массы тела (например, приблизительно 300 мг на человека), и предпочтительно разделенная на 1-3 индивидуальные дозы, которые могут состоять, например, из тех же количеств, должна быть подходящей. Однако должно быть ясно, что указанный здесь верхний предел может быть выше, если указано, что это показано.
В соответствии с изобретением соединения формулы (I) или их фармацевтически приемлемые соли и сложные эфиры могут быть использованы для лечения или профилактики заболеваний, опосредованных альдостероном.
Соединения формулы (I) или их фармацевтически приемлемые соли и сложные эфиры являются ингибиторами CYP11B2. Соединения формулы (I) или их фармацевтически приемлемые соли и сложные эфиры проявляют также различное ингибирование CYP11B1, но имеют улучшенную селективность в отношении CYP11B2 по сравнению с CYP11B1. Такие соединения можно использовать для лечения или профилактики состояний, где проявляются избыточная продукция/концентрация кортизола, или как избыточная концентрация кортизола, так и избыточная концентрация альдостерона (например, синдрома Кушинга, пациентов с ожоговой травмой, депрессии, посттравматических стрессовых расстройств, хронического стресса, кортикотропных аденом, болезни Кушинга).
В соответствии с настоящим изобретением соединения формулы (I) или их фармацевтически приемлемые соли и сложные эфиры могут быть использованы для лечения или профилактики сердечно-сосудистых заболеваний (в том числе гипертензии и сердечной недостаточности), заболеваний сосудов, эндотелиальной дисфункции, дисфункции барорецепторов, заболеваний почек, заболеваний печени, фиброзных заболеваний, воспалительных заболеваний, ретинопатии, невропатии (например, периферической невропатии), боли, инсулинопатии, отека, отечных состояний, депрессии и тому подобного.
Сердечно-сосудистые заболевания включают застойную сердечную недостаточность, ишемическую болезнь сердца, аритмию, артериальную фибрилляцию, поражения сердца, снижение фракции выброса, диастолическую и систолическую дисфункцию сердца, фибриноидный некроз коронарных артерий, фиброз сердца, гипертрофическую кардиомиопатию, нарушенную податливость сосудистой стенки, нарушение диастолического наполнения, ишемию, гипертрофию левого желудочка, фиброз миокарда и сосудов, инфаркт миокарда, некротические поражения миокарда, сердечные аритмии, предотвращение внезапной сердечной смерти, повторный стеноз, инсульт, поражение сосудов.
Заболевания почек включают острую и хроническую почечную недостаточность, нефропатию, терминальную стадию заболевания почек, диабетическую нефропатию, снижение клиренса креатинина, снижение скорости клубочковой фильтрации, расширение сетчатой мезангиальной матрицы с или без значительного повышенного содержания паренхиматозных клеток, фокальный тромбоз капилляров клубочков, глобальный фибриноидный некроз, гломерулосклероз, ишемические поражения, злокачественный нефросклероз, (такой как ишемическая ретракция, микроальбуминурия, протеинурия, снижение почечного кровотока, почечная артериопатия, отек и пролиферация интракапиллярных (эндотелиальных и мезангиальных) и/или экстракапиллярных клеток (серповидных клеток).
Заболевания почек также включают гломерулонефрит (например, диффузный пролиферативный, фокальный пролиферативный, мезангиальный пролиферативный, мембранопролиферативный, мембранный гломерулонефрит с минимальными изменениями), волчаночный нефрит, неиммунные аномалии базальной мембраны (например, синдром Альпорта), фиброз почек и гломерулосклероз (например, узловой или глобальный, и фокальный сегментарный гломерулосклероз).
Заболевания печени включают, но не ограничиваются этим, стеатоз печени, неалкогольный стеатогепатит, цирроз печени, асцит печени, застой печени и тому подобное.
Заболевания сосудов включают, но не ограничиваются этим, тромботическую болезнь сосудов (например, пристеночный фибриноидный некроз, кровоизлияние и фрагментацию эритроцитов, и просветный и/или пристеночный тромбоз), пролиферативную артериопатию (например, отечные миоинтимальные клетки, окруженные муцинозным внеклеточным матриксом и узелковым утолщением), атеросклероз, сниженную податливость сосудов (например, жесткость, снижение податливости желудочка и снижение податливости сосудов), эндотелиальную дисфункцию и тому подобное.
Воспалительные заболевания включают, но не ограничиваются этим, артрит (например, остеоартрит), воспалительные заболевания дыхательных путей, (например, хроническую обструктивную болезнь легких (ХОБЛ)) и тому подобное.
Боль включает, но не ограничивается этим, острую боль, хроническую боль (например, боль в суставах), и тому подобное.
Отек включает, но не ограничивается этим, отек периферической ткани, отек печени, асциты печени, отек селезенки, отек дыхательных путей и легких, и тому подобное.
Инсулинопатии включают, но не ограничиваются этим, резистентность к инсулину, сахарный диабет 1 типа, сахарный диабет 2 типа, чувствительность к глюкозе, преддиабетическое состояние, преддиабет, синдром Х и тому подобное.
Фиброзные заболевания включают, но не ограничиваются этим, фиброз миокарда и внутрипочечный фиброз, интерстициальный фиброз почек и фиброз печени.
Кроме того, соединения формулы (I) или их фармацевтически приемлемые соли и сложные эфиры, как описано здесь, могут также быть использованы для лечения или профилактики сердечно-сосудистого заболевания, выбранного из группы, состоящей из гипертензии, сердечной недостаточности (в частности сердечной недостаточности после инфаркта миокарда), гипертрофии левого желудочка и инсульта.
В другом варианте осуществления сердечно-сосудистое заболевание представляет собой гипертензию.
В особом варианте осуществления сердечно-сосудистое заболевание представляет собой гипертензию, устойчивую к лечению.
В другом варианте осуществления сердечно-сосудистое заболевание представляет собой сердечную недостаточность.
В другом варианте осуществления сердечно-сосудистое заболевание представляет собой гипертрофию левого желудочка.
В другом варианте осуществления сердечно-сосудистое заболевание представляет собой застойную сердечную недостаточность, особенно у пациентов с сохраненной фракцией выброса левого желудочка.
В другом варианте осуществления сердечно-сосудистое заболевание представляет собой инсульт.
В другом вариантом осуществления соединения формулы (I) или их фармацевтически приемлемые соли и сложные эфиры могут быть использованы для лечения или профилактики заболевания почек.
В другом варианте осуществления заболевание почек представляет собой нефропатию.
В другом варианте осуществления заболевание почек представляет собой аутоиммунный глоумерулонефрит.
В другом варианте осуществления хроническое заболевание почек представляет собой диабетическую нефропатию.
В другом варианте осуществления фиброзное заболевание представляет собой фиброз почек или сердца.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли и эфиры могут быть использованы для лечения или профилактики сахарного диабета 2 типа.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли и эфиры могут быть использованы для лечения или профилактики сахарного диабета 1 типа.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли и эфиры могут быть использованы для лечения или профилактики диабетической ретинопатии.
Изобретение далее проиллюстрировано с помощью Примеров, которые не имеют ограничительного характера.
Если в примерах получают вещество в виде смеси энантиомеров, чистые энантиомеры можно разделить с помощью описанных здесь способов или с помощью способов, известных специалисту в данной области, таких как, например, хиральная хроматография или кристаллизация.
Примеры
Все примеры и промежуточные соединения получают в атмосфере аргона, если не указано иное.
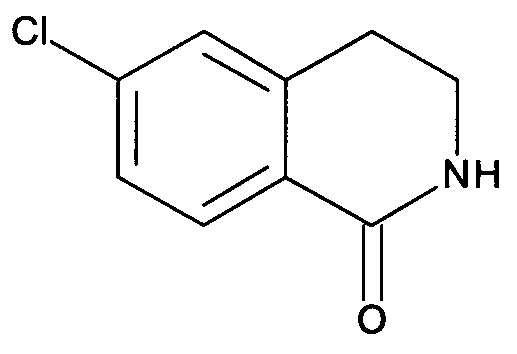
Промежуточное соединение А-1
6-Хлор-3,4-дигидро-2H-изохинолин-1-он
[А] Метиловый эфир [2-(3-Хлорфенил)-этил]-карбаминовой кислоты
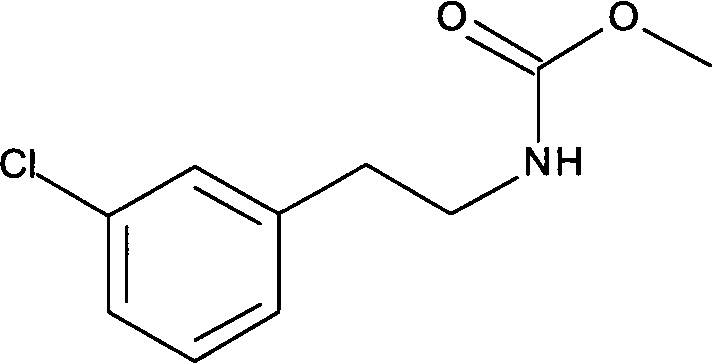
Метилхлорформиат (4,6 г, 48 ммоль) добавляли по каплям к раствору 2-(3-хлорфенил)-этиламина (5,0 г, 32 ммоль) и Еt3N (6,4 г, 64 ммоль) в DCM (100 мл) при 0°С. После этого смесь перемешивали при комнатной температуре в течение 0,5 часов. Органический слой промывали водой (3×30 мл), 1н HCl (20 мл) и солевым раствором (30 мл), сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. После вакуумной сушки указанное в заголовке соединение было получено (6,49 г, 95%) в виде белого твердого вещества. MS: 214,1 (M+H+).
[В] 6-Хлор-3,4-дигидро-2H-изохинолин-1-он
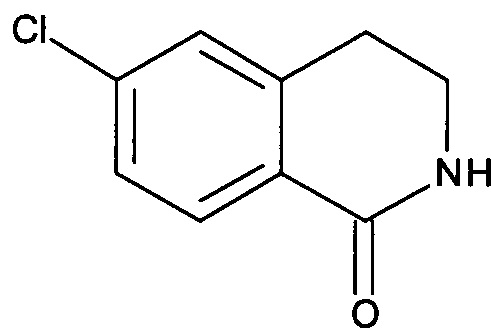
Под защитой N2 смесь метилового эфира [2-(3-хлорфенил)-этил]-карбаминовой кислоты (5,0 г, 23,4 ммоль) и РРА (полифосфорной кислоты) (20 г) в круглодонной колбе на 250 мл энергично перемешивали при 120°С в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь обрабатывали ледяной водой и водным раствором аммиака, чтобы довести рН до 8. Затем смесь экстрагировали EtOAc, и органический слой промывали насыщенным раствором соли, сушили над безводным Na2SO4 и фильтровали. После удаления растворителя при пониженном давлении полученный сырой продукт дополнительно промывали этиловым эфиром с получением указанного в заголовке соединения (1,66 г, 39%) в виде белого твердого вещества. MS: 182,0 (M+H+).
Промежуточное соединение А-2
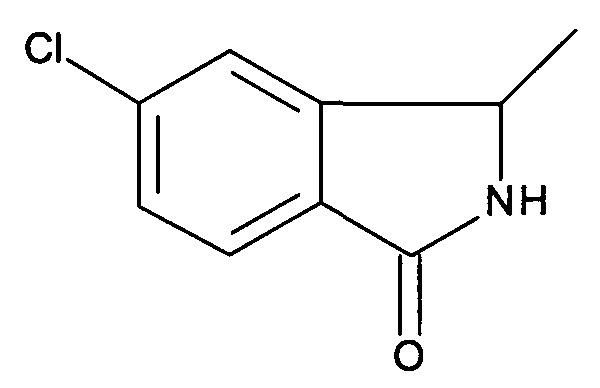
5-Хлор-3-метил-2,3-дигидроизоиндол-1-он
[А] 1-(2-Бром-5-хлорфенил)-этиламин
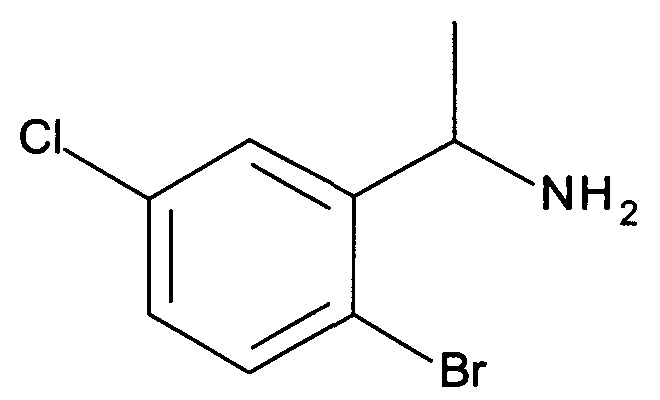
К перемешиваемому раствору 2-бром-6-хлорбензонитрила (80 г, 370 ммоль) в THF (1000 мл) при 0°С добавляли по каплям EtMgBr (370 мл, 1110 ммоль). Реакционную смесь перемешивали при 0-5°С в течение 5 часов, затем добавляли по каплям МеОН (500 мл). После того, как раствор перемешивали в течение еще 15 мин, осторожно добавляли NaBH4 (28 г, 740 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор затем выливали в воду и экстрагировали этилацетатом (3×200 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме с получением неочищенного продукта, который очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 3:1) с получением указанного в заголовке соединения (30 г, 34,6%) в виде желтоватого масла. MS: 235,5 [M+H+].
[B] 5-Хлор-3-метил-2,3-дигидроизоиндол-1-он
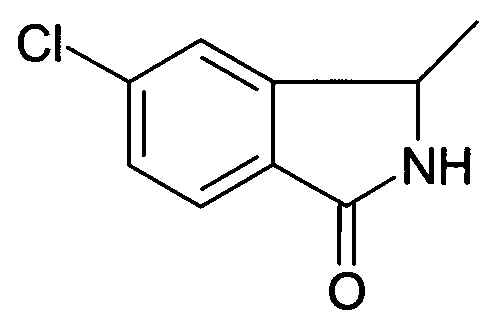
Смесь 1-(2-бром-5-хлорфенил)-этиламина (30 г, 127,9 ммоль), Pd(dppf)Cl2 (3,2 г, 12,79 ммоль), и DIPEA (49,5 г, 383,7 ммоль) в DMF (1,2 л) перемешивали в автоклаве при давлении СО 2 МПа при 130°С в течение 24 часов. После охлаждения реакционной смеси до комнатной температуры ее разбавляли EtOAc (500 мл). Органический слой промывали солевым раствором, фильтровали и концентрировали в вакууме с получением неочищенного продукта, который очищали с помощью хроматографии (РЕ : этилацетат = 3:1) с получением указанного в заголовке соединения (5,2 г, 22,5%) в виде коричневого твердого вещества. MS: 181,7 [М+H+].
Промежуточное соединение А-3
5-Хлор-3,3-диметил-2,3-дигидроизоиндол-1-он
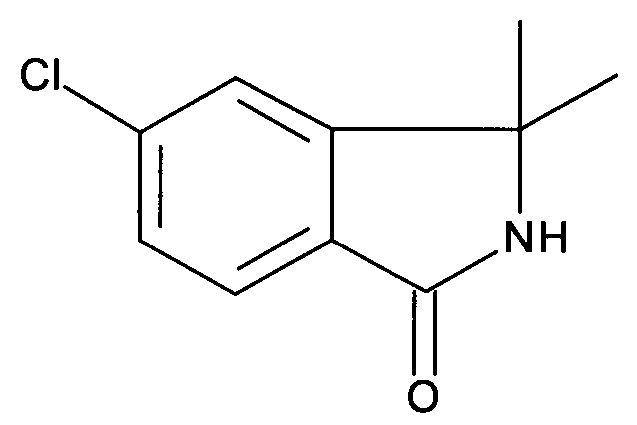
[А] 1-(2-Бром-5-хлорфенил)-1-метилэтиламин
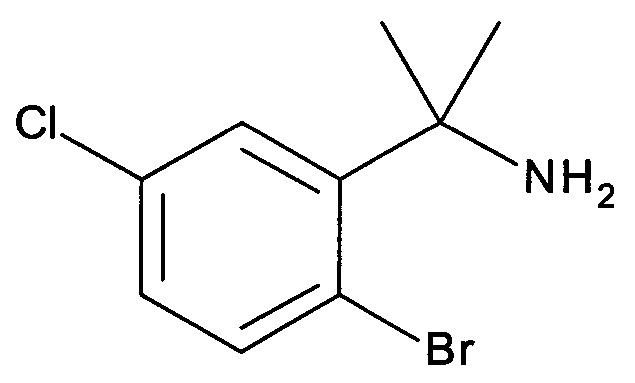
К перемешиваемому раствору 2-бром-5-хлорбензонитрила (10 г, 46 ммоль) в THF (200 мл) при 0°С, добавляли по каплям MeMgBr (77 мл, 230 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 2 часов. Добавляли Ti(Oi-Pr)4 (13 г, 46 ммоль), и раствор перемешивали еще в течение 16 часов, затем гасили водным раствором HCl и промывали EtOAc. рН водной фазы доводили до ~ 10 водным раствором NaOH и экстрагировали этилацетатом (3×100 мл). Объединенные органические слои концентрировали с получением неочищенного указанного в заголовке продукта (3,8 г, выход 33%) в виде масла, которое использовали непосредственно на следующей стадии без дополнительной очистки. MS: 249,30 (М+Н+)
[В] 5-Хлор-3,3-диметил-2,3-дигидроизоиндол-1-он
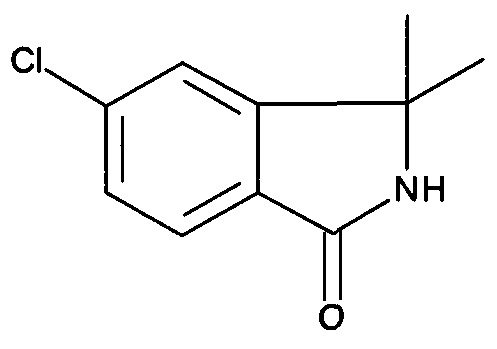
Смесь 1-(2-бром-5-хлорфенил)-1-метилэтиламина (3,8 г, 15,3 ммоль), Pd(dppf)Cl2 (0,4 г, 0,55 ммоль) и DIPEA (6 г, 45,9 ммоль) в DMF (20 мл) перемешивали в автоклаве под давлением СО 2 МПа при 130°С в течение 16 часов. Затем смесь охлаждали до комнатной температуры и разбавляли EtOAc (300 мл). Органический слой промывали солевым раствором (2×80 мл), фильтровали и концентрировали в вакууме с получением неочищенного продукта, который очищали хроматографией с получением указанного в заголовке соединения (1,13 г, 38%) в виде твердого вещества коричневого цвета. MS: 195,70 (M+H+)
Промежуточное соединение А-4
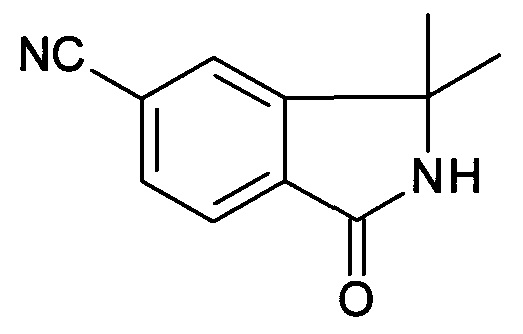
3,3-Диметил-1-оксо-2,3-дигидро-1Н-изоиндол-5-карбонитрил
[А] Метиловый эфир 4-бром-2-метилбензойной кислоты
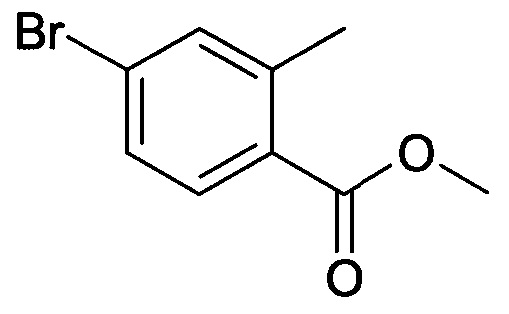
К раствору 4-бром-2-метилбензойной кислоты (30,0 г, 0,14 моль) в 115 мл метанола медленно добавляли тионилхлорид (20,25 мл, 0,28 моль), и реакционную смесь перемешивали при 70°С в течение 2 часов, затем концентрировали с получением сырого продукта, который затем очищали колоночной хроматографией с получением указанного в заголовке соединения (30,03 г, 93,6%) в виде твердого вещества.
[B] Метиловый эфир 4-циано-2-метилбензойной кислоты
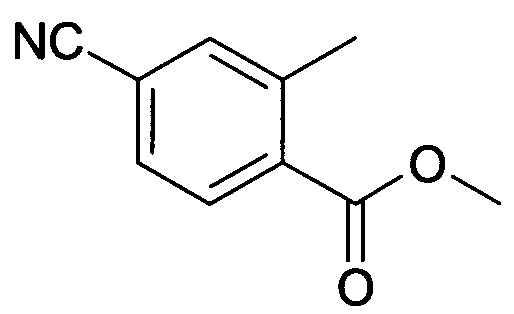
Смесь метилового эфира 4-бром-2-метилбензойной кислоты (26,0 г, 113,5 ммоль) и CuCN (12,48 г,140,7 ммоль) нагревали при 180°С в течение 5 часов, затем выливали в ледяную воду. Твердый осадок собирали вакуумной фильтрацией с получением сырого продукта, который затем очищали колоночной хроматографией с получением указанного в заголовке соединения (12,53 г, 63%) в виде твердого вещества.
[С] Метиловый эфир 2-бромметил-4-циано-бензойной кислоты
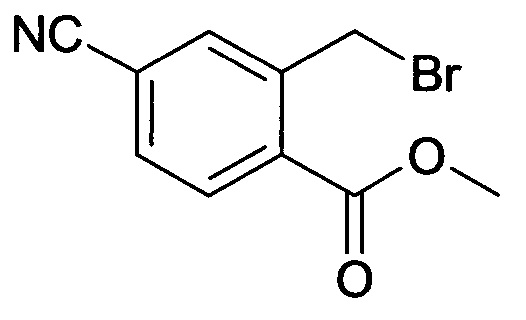
Смесь метилового эфира 4-циано-2-метилбензойной кислоты (12,5 г, 71,35 ммоль), NBS (12,7 г, 71,35 ммоль) и дибензоилпероксида (ВРО) (0,8 г, 3,28 ммоль) в CCl4 (200 мл) нагревали до температуры кипения в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь фильтровали. Фильтрат концентрировали в вакууме с получением сырого продукта (18,2 г), который использовали на следующей стадии реакции без дополнительной очистки.
[D] 2-(4-Метоксибензил)-1-оксо-2,3-дигидро-1H-изоиндол-5-карбонитрил
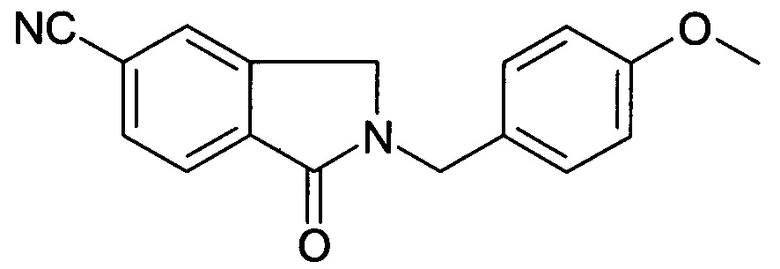
К раствору метилового эфира 2-бромметил-4-циано-бензойной кислоты (18,1 г, 71,24 ммоль) в THF (300 мл) добавляли PMBNH2 (23,4 г, 178,1 ммоль) при 0°С, и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. После вакуумной фильтрации фильтрат концентрировали в вакууме. Полученный осадок повторно растворяли с EtOAc и промывали водой и солевым раствором. Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме с получением сырого продукта, который очищали колоночной хроматографией с получением указанного в заголовке соединения в виде твердого вещества (11,69 г, 56,0%).
[Е] 2-(4-Метоксибензил)-3,3-диметил-1-оксо-2,3-дигидро-1H-изоиндол-5-карбонитрил
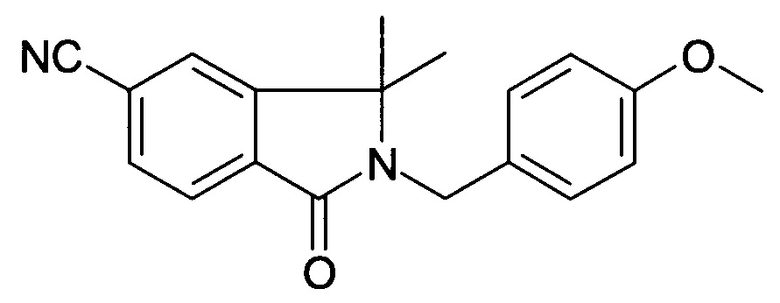
К раствору 2-(4-метоксибензил)-1-оксо-2,3-дигидро-1H/-изоиндол-5-карбонитрила (11,6 г,41,7 ммоль) в THF (300 мл) добавляли NaH (8,34 г, 208,4 ммоль, 60% в минеральном масле), и реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем добавляли иодометан (35,5 г, 250,1 ммоль). После добавления реакционную смесь перемешивали при 70°С в течение 2 часов до тех пор, пока не было израсходовано все исходное вещество. После охлаждения до комнатной температуры добавляли насыщенный водный раствор NH4Cl, и смесь экстрагировали EtOAc (200 мл ×3). Объединенные органические слои сушили над безводным MgSO4, фильтровали, и концентрировали при пониженном давлении с получением сырого продукта, который очищали колоночной хроматографией с получением указанного в заголовке соединения (7,22 г, 56,5%) в виде твердого вещества.
[F] 3,3-Диметил-1-оксо-2,3-дигидро-1Н-изоиндол-5-карбонитрил
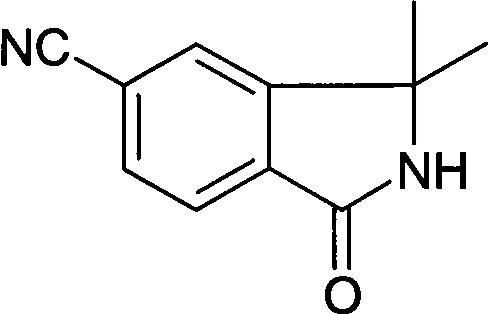
К раствору 2-(4-метоксибензил)-3,3-диметил-1-оксо-2,3-дигидро-1Н-изоиндол-5-карбонитрила (3,5 г, 11,42 ммоль) в MeCN (70 мл) добавляли CAN (18,79 г, 34,27 ммоль) в 30 мл воды при 0°С. Полученную реакционную смесь перемешивали при 0°С в течение 1 часа до тех пор, пока не было израсходовано все исходное вещество. Реакционную смесь экстрагировали между водой и EtOAc, и объединенные органические слои сушили над безводным MgSO4, фильтровали и концентрировали при пониженном давлении с получением сырого продукта, который очищали колоночной хроматографией с получением указанного в заголовке соединения (1,06 г, 49,8%) в виде твердого вещества.
Промежуточное соединение А-5
3,5-Дииодопиридин
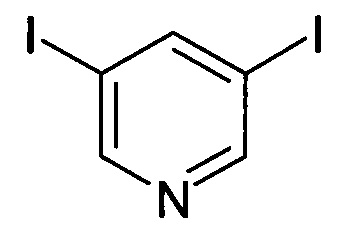
Смесь 3,5-дибромпиридина (20 г, 84 ммоль), CuI (4,76 г, 25 ммоль), KI (83,7 г, 504 ммоль) и N1,N2-диметилэтан-1,2-диамина (4,4 г, 50,4 ммоль) в диоксане (400 мл) перемешивали при 110°С в течение 16 часов. В течение этого времени ход реакции проверяли с помощью ЖХ/MS. Реакционную смесь фильтровали, и фильтрат концентрировали при пониженном давлении с получением твердого вещества, которое затем промывали EtOAc (100 мл) и DCM (100 мл) с получением указанного в заголовке сырого соединения в виде серого твердого вещества (13 г, 47%). MS: 331,50 (M+H+). Его использовали на следующей стадии без дополнительной очистки.
Промежуточное соединение А-6
3,5-Дииодо-4-метилпиридин
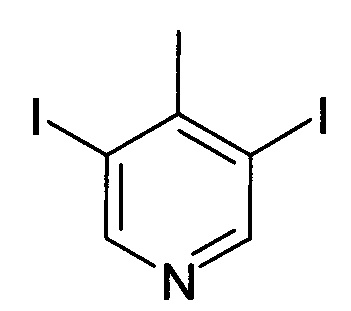
Смесь 3,5-дибром-4-метилпиридина (20 г, 80 ммоль), KI (79,7 г, 480 ммоль), CuI (4,57 г, 24 ммоль) и N1,N2-диметилэтан-1,2-диамина (4,23 г, 48 ммоль) в диоксане (400 мл) нагревали при 110°С в течение 16 часов. Реакционную смесь фильтровали, и фильтрат концентрировали в вакууме с получением сырого твердого вещества, которое промывали DCM и EtOAc с получением сырого продукта (18 г, 65%) в виде белого твердого вещества. MS: 345,5 [М+Н+]. Его использовали на следующей стадии без дополнительной очистки.
Промежуточное соединение А-7
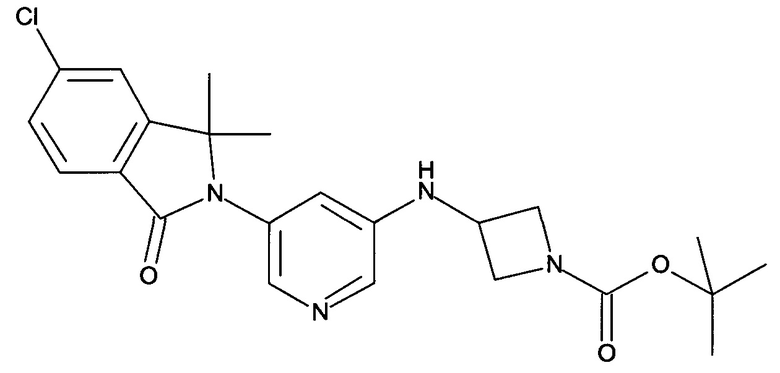
трет-Бутиловый эфир 3-[5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидроизоиндол-2-ил)-пиридин-3-иламино]-азетидин-1-карбоновой кислоты
[А] 5-Хлор-2-(5-иодопиридин-3-ил)-3,3-диметил-2,3-дигидроизоиндол-1-он
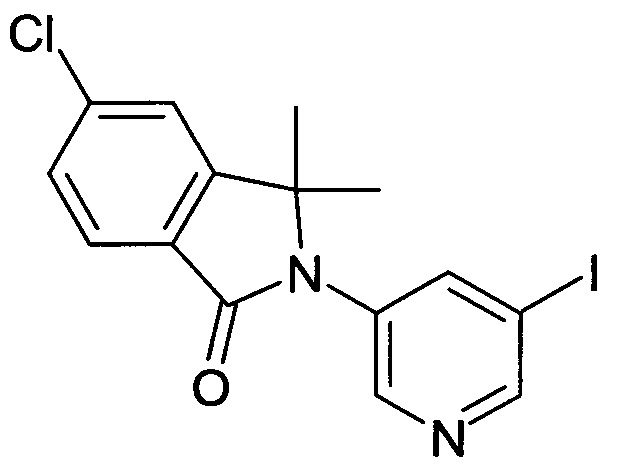
В запаянной пробирке на 75 мл растворяли 3,5-дииодопиридин (промежуточное соединение А-5, 6,6 г, 20 ммоль), 5-хлор-3,3-диметил-2,3-дигидроизоиндол-1-он (промежуточное соединение А-3, 1,95 г, 10 ммоль), CuI (571 мг, 3 ммоль), K3PO4 (4,24 г, 20 ммоль) и (+)-(S,S)-1,2-диаминоциклогексан (0,7 мл, 6 ммоль) в 20 мл диоксана. Полученную реакционную смесь нагревали при 120°С в течение 3 часов, затем выливали в воду (50 мл) и экстрагировали EtOAc (2×125 мл). Объединенные органические слои промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме с получением сырого продукта, который очищали флэш-хроматографией на силикагеле (градиент 0-30% EtOAc-гексан) с получением указанного в заголовке соединения (1,8 г, 45%) в виде светло-желтого твердого вещества. MS: 399,2 (M+H+).
[В] трет-Бутиловый эфир 3-[5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидроизоиндол-2-ил)-пиридин-3-иламино]-азетидин-1-карбоновой кислоты
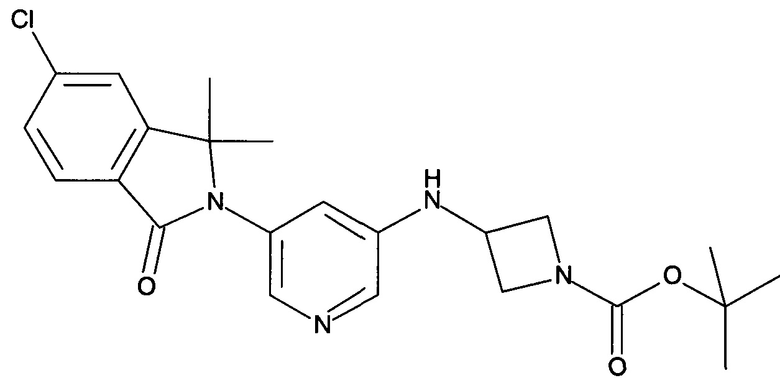
Смесь 5-хлор-2-(5-иодопиридин-3-ил)-3,3-диметил-2,3-дигидроизоиндол-1-она (2,16 г, 5,4 ммоль), трет-бутилового эфира 3-амино-азетидин-1-карбоновой кислоты (1,8 г, 10,8 ммоль), CuI (103 мг, 0,54 ммоль), Cs2CO3 (3,5 г, 10,8 ммоль) и 2-изобутирил-циклогексанона (0,36 мл, 2,16 ммоль) в DMF (12 мл) перемешивали при 100°С в течение 12 часов. После охлаждения до комнатной температуры реакционную смесь выливали в воду (20 мл) и экстрагировали EtOAc (2×100 мл). Объединенные органические слои промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме с получением сырого продукта, который очищали флэш-хроматографией на силикагеле (градиент 30-100% EtOAc-гексан) с получением указанного в заголовке соединения (1,1 г, 48%) в виде светло-желтой пены. MS: 443,2 (M+H+).
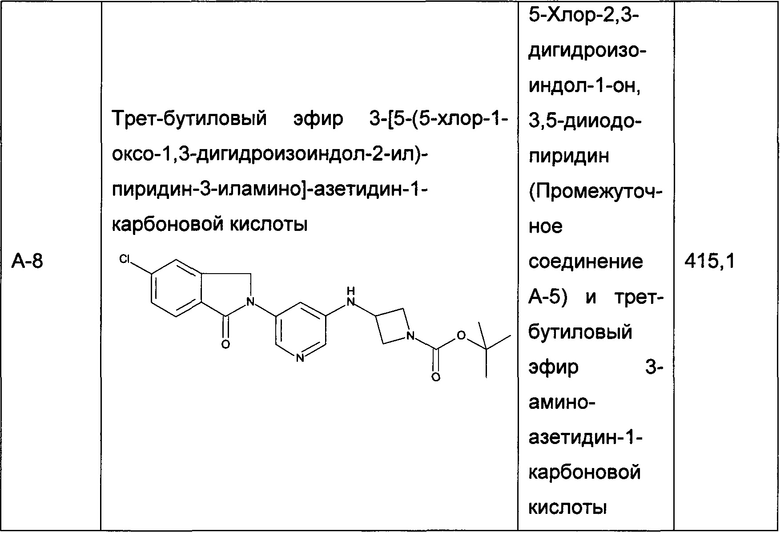
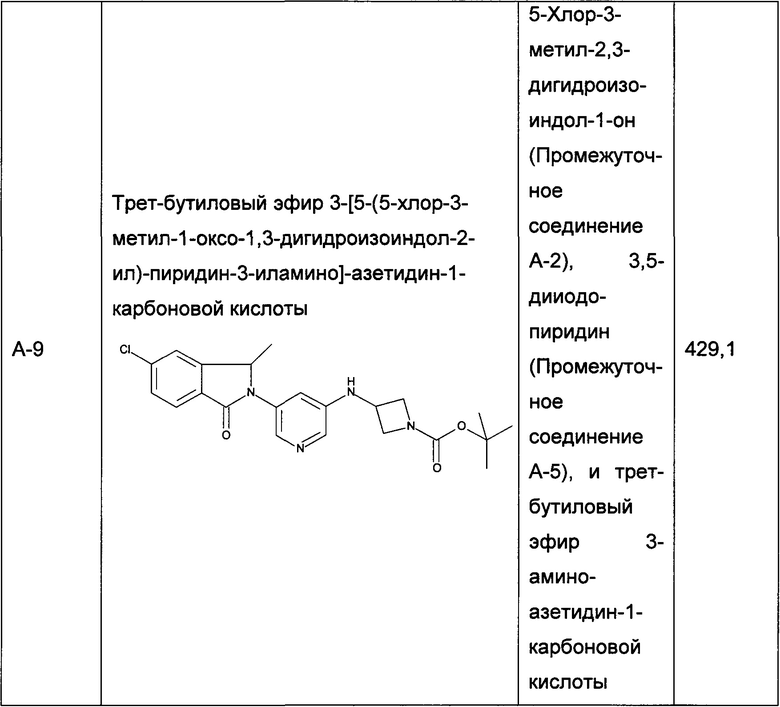
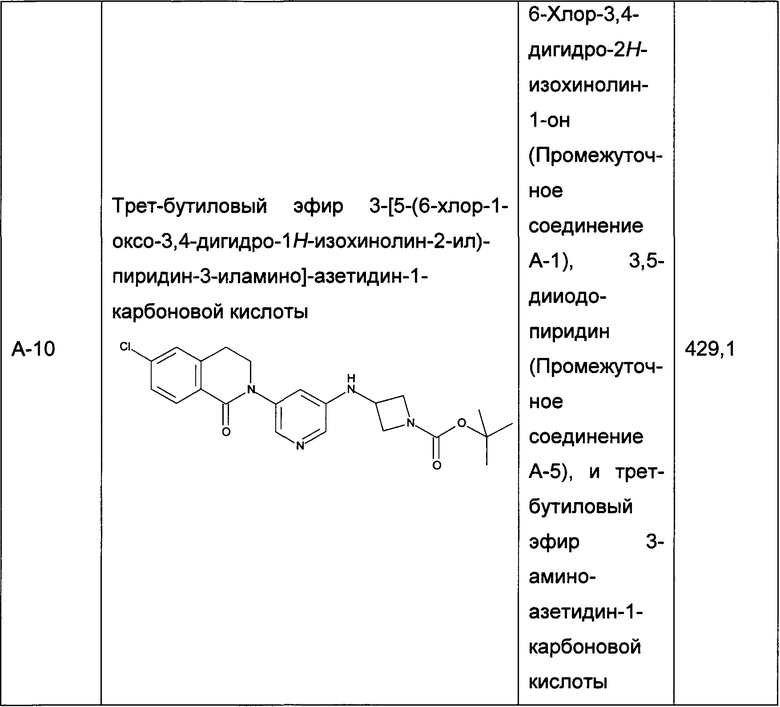
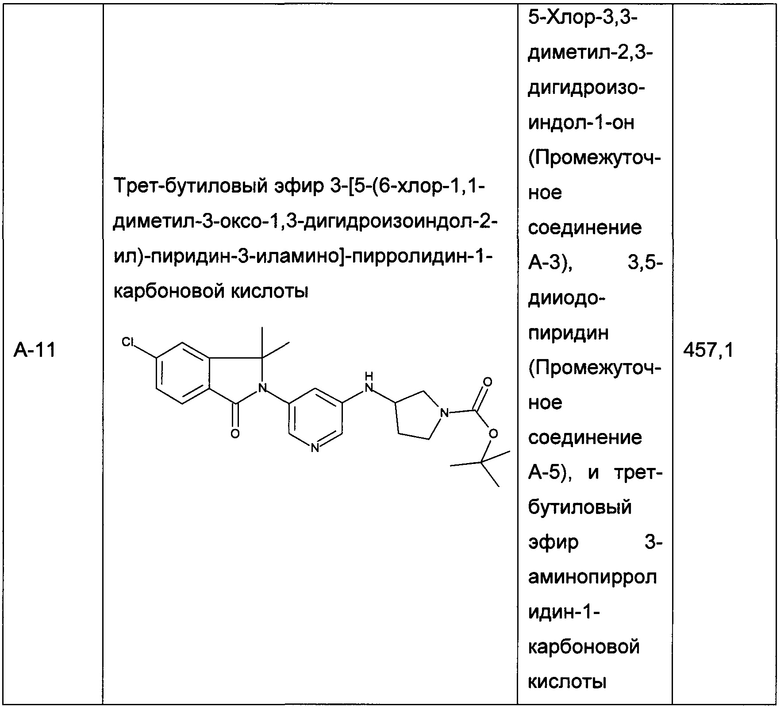
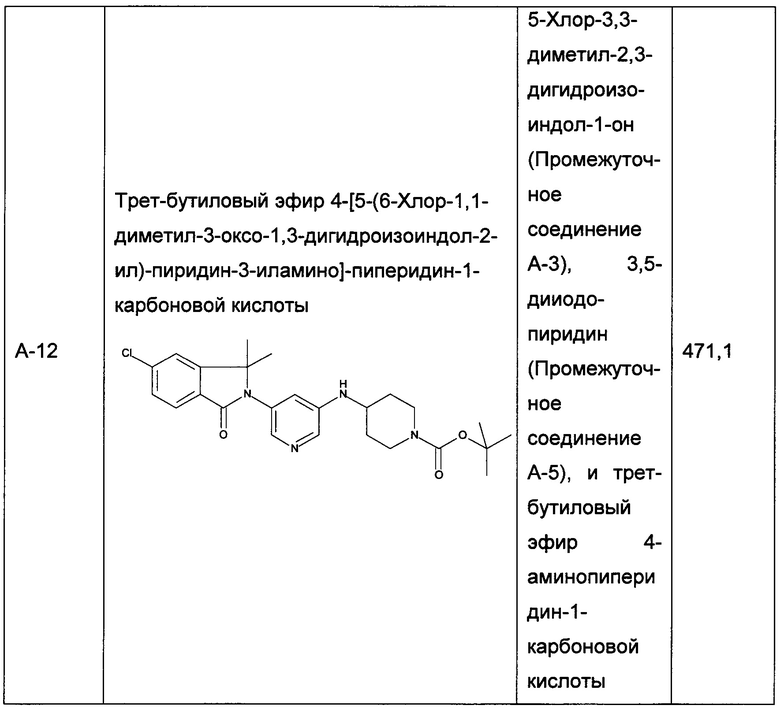
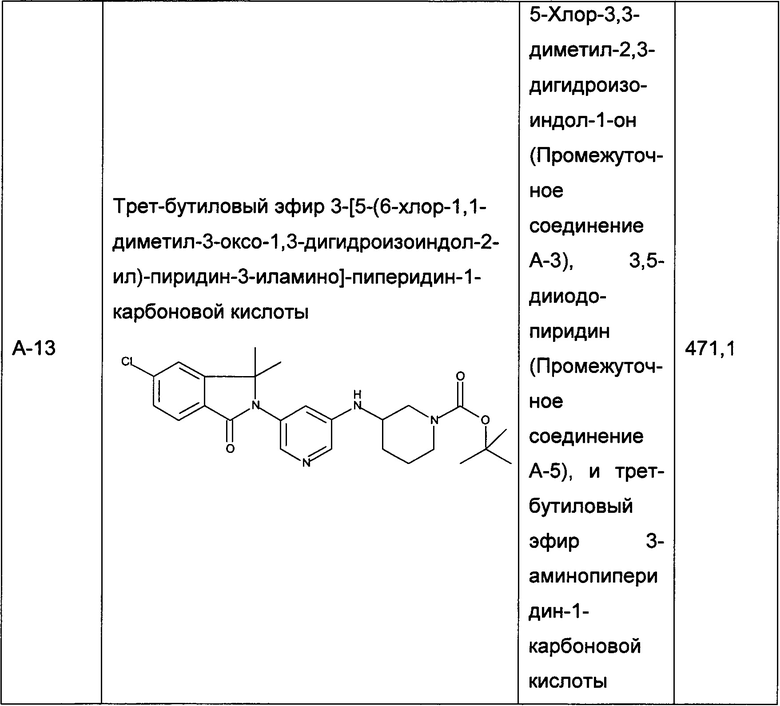
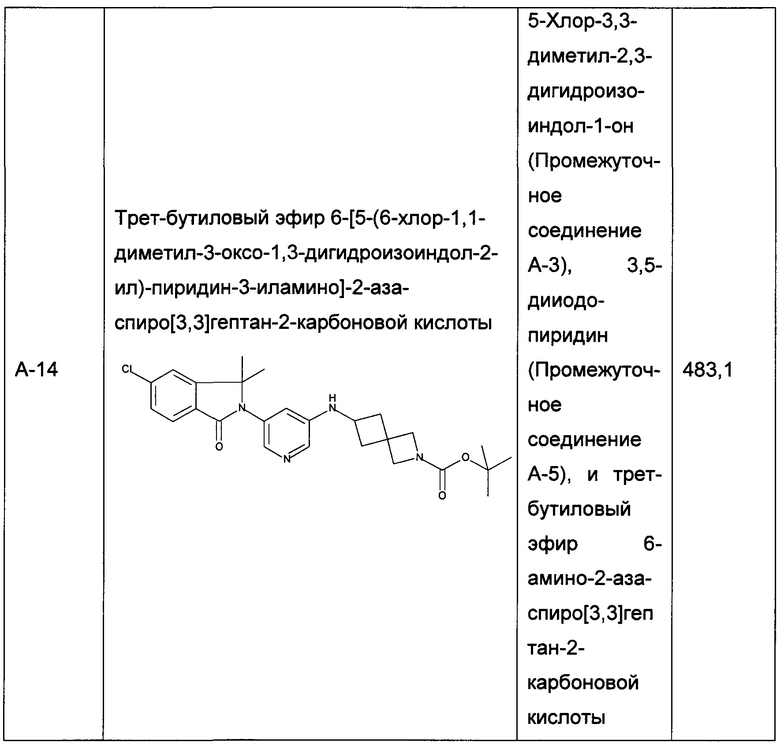
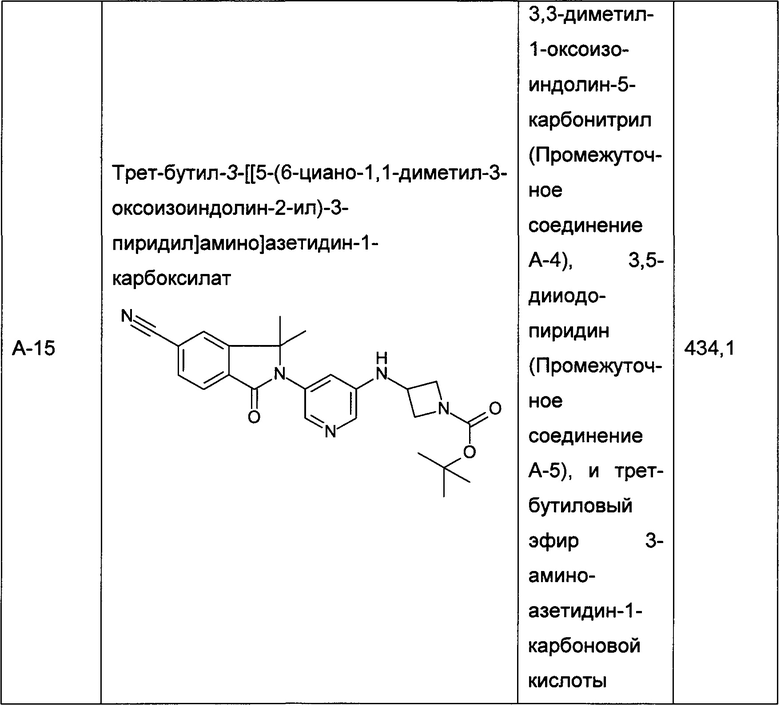
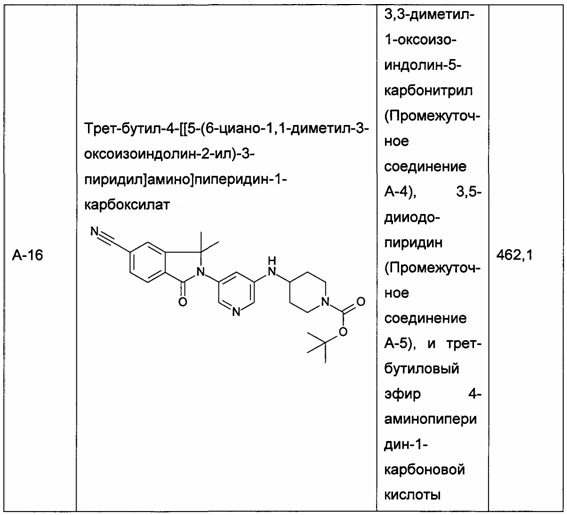
Следующие промежуточные соединения, приведенные в таблице 1, были получены по аналогии со способами, описанным для получения промежуточного соединения А-6, с использованием соответствующих реагентов:
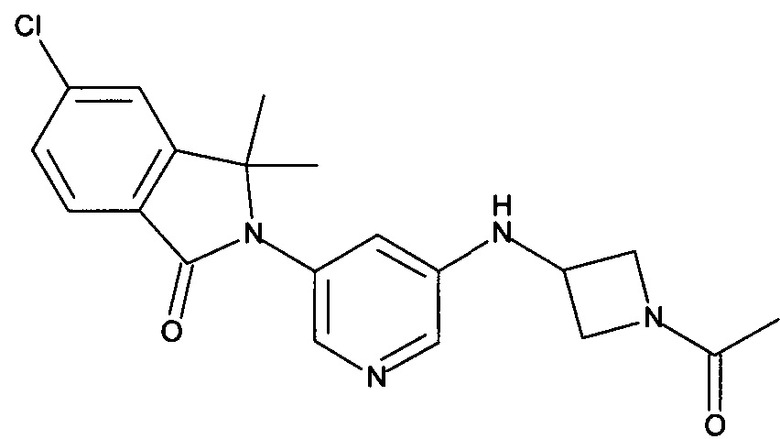
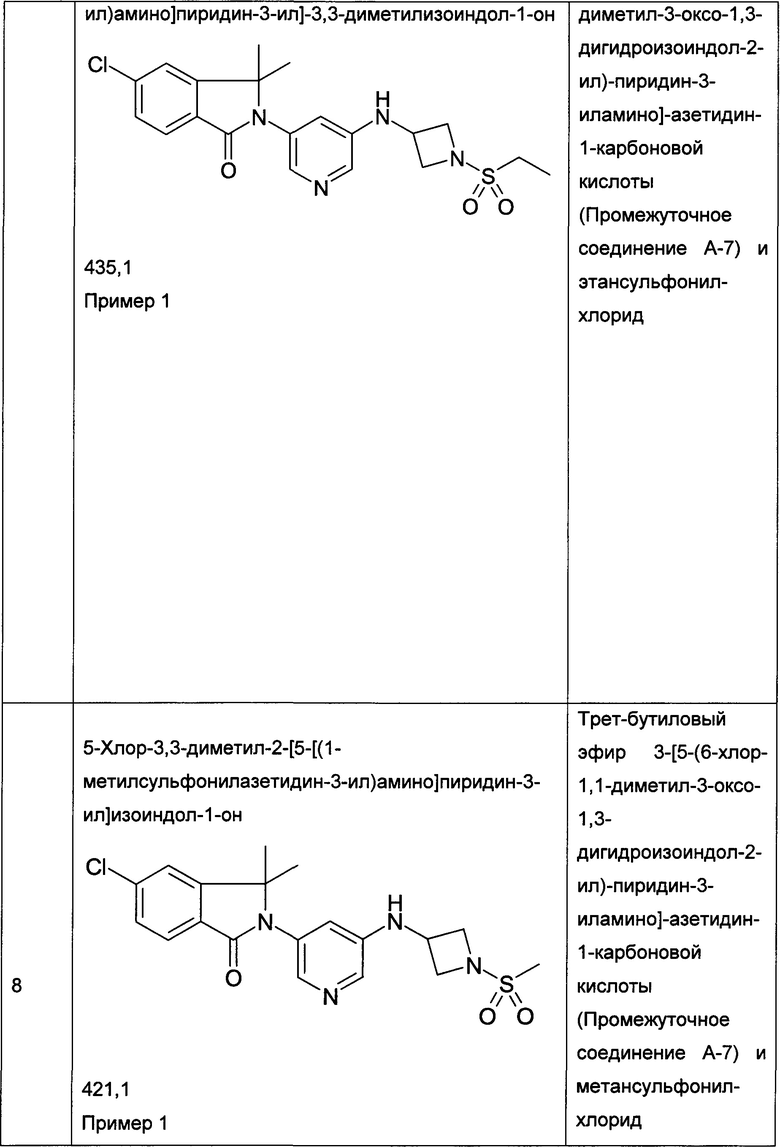
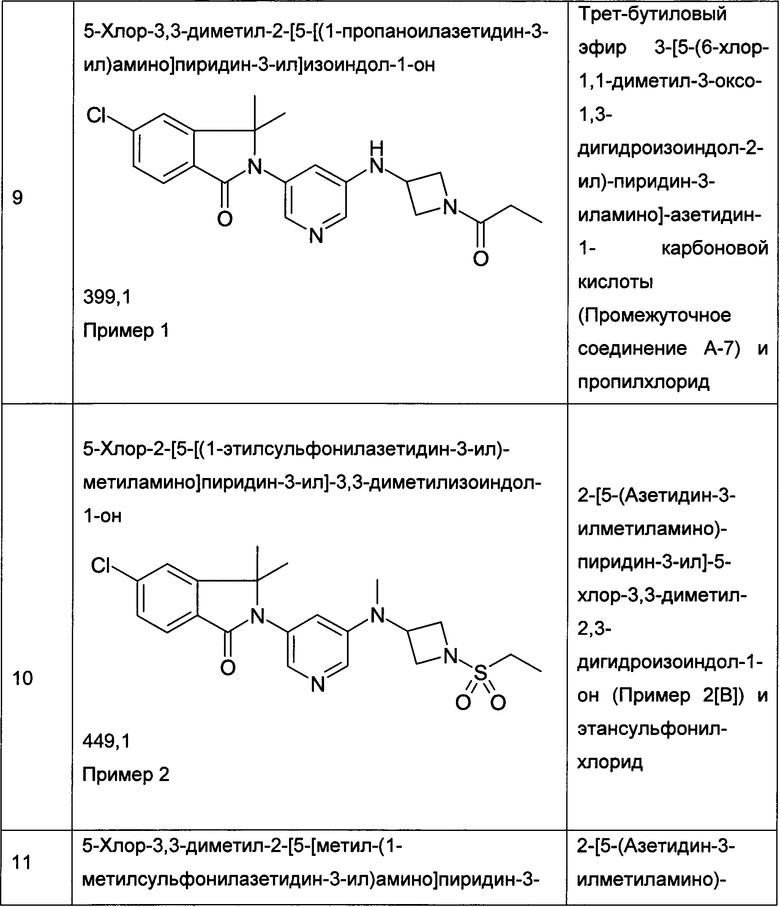
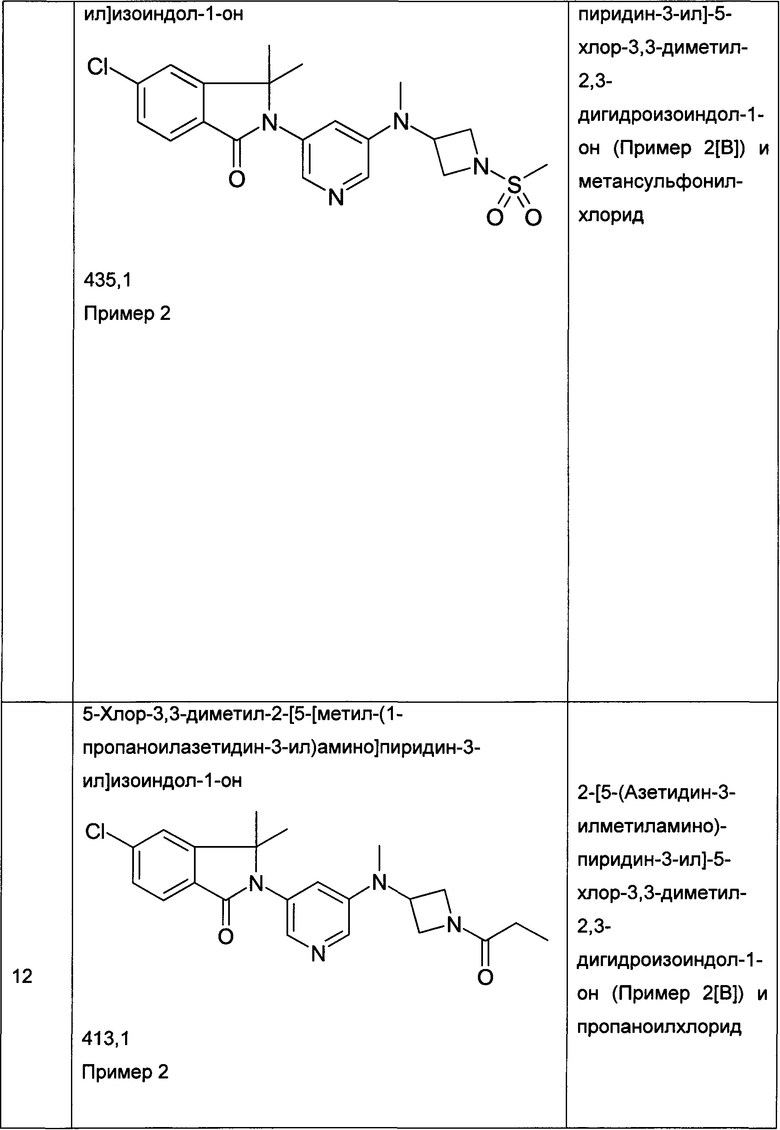
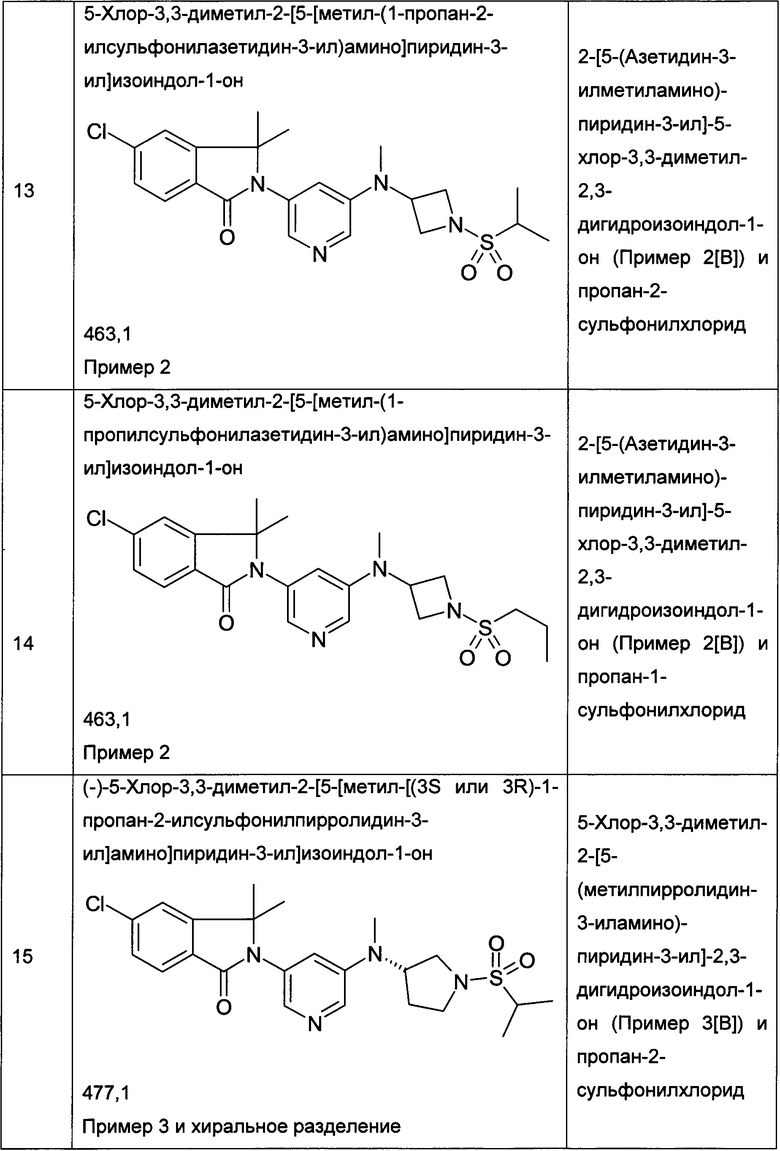
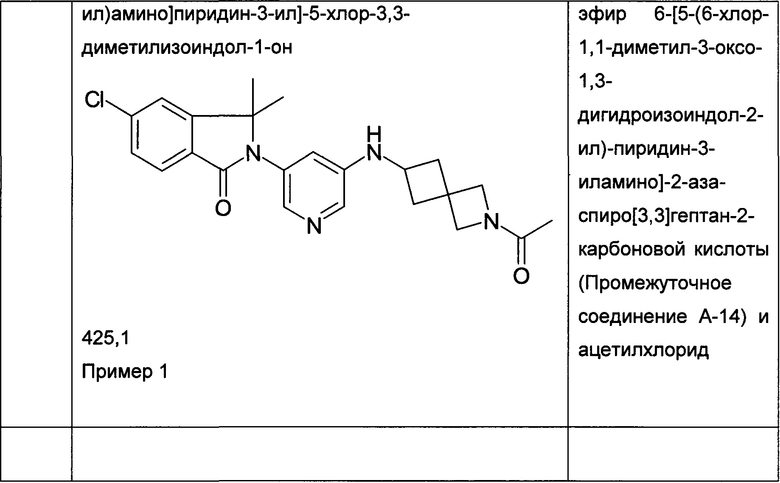
Пример 1
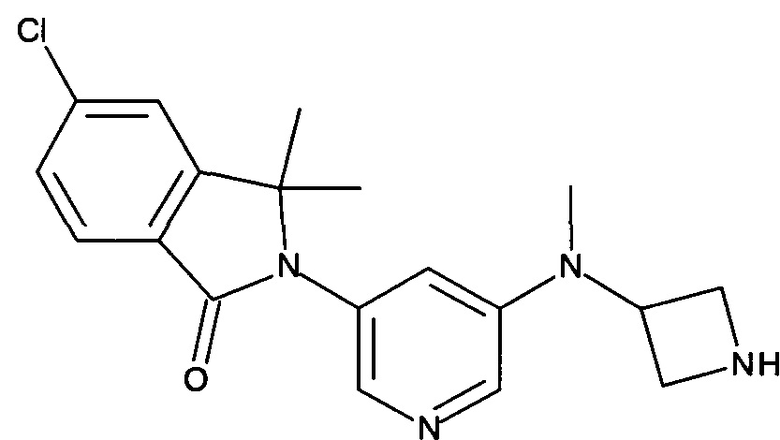
2-[5-[(1-Ацетилазетидин-3-ил)амино]пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-он
[A] 2-[5-(Азетидин-3-иламино)-пиридин-3-ил]-5-хлор-3,3-диметил-2,3-дигидроизоиндол-1-он
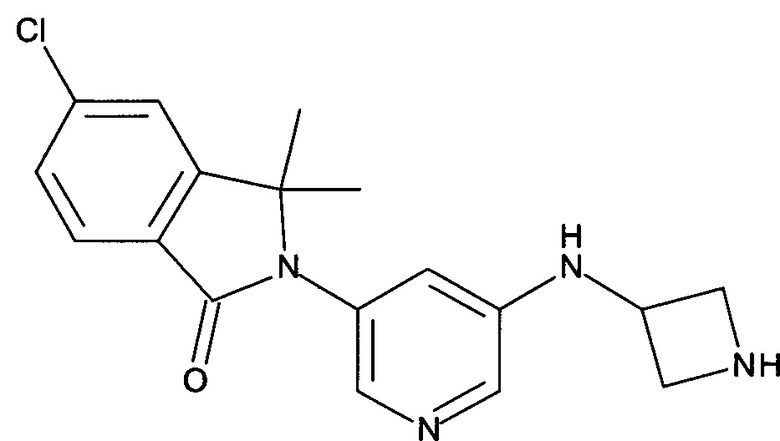
Смесь трет-бутилового эфира 3-[5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидроизоиндол-2-ил)-пиридин-3-иламино]-азетидин-1-карбоновой кислоты (Промежуточное соединение А-7, 360 мг, 0,812 ммоль), ацетилхлорида (0,56 мл) в метаноле (12 мл) перемешивали при комнатной температуре в течение 2 часов. После концентрирования при пониженном давлении получили сырой продукт в виде светло-желтой пены, который использовали на следующей стадии без дополнительной очистки. MS: 343,2 (M+H+).
[В] 2-[5-[(1-Ацетилазетидин-3-ил)амино]пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-он
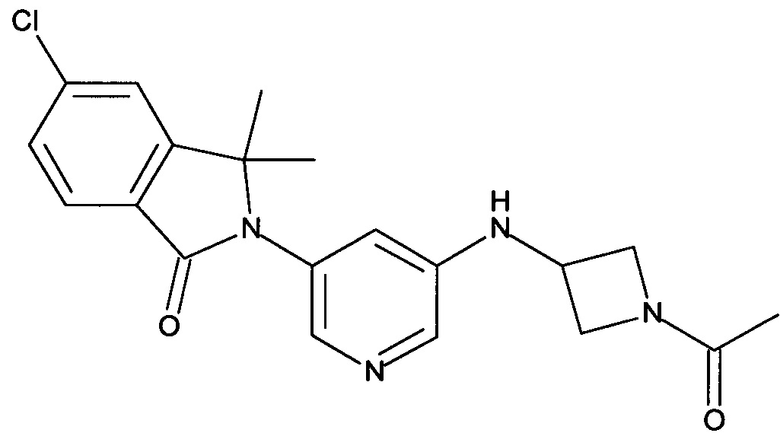
К перемешиваемому раствору 2-[5-(азетидин-3-иламино)-пиридин-3-ил]-5-хлор-3,3-диметил-2,3-дигидроизоиндол-1-она (56 мг, 0,163 ммоль) и Et3N (0,5 мл) в DCM (5 мл) добавляли ацетилхлорид (0,012 мл, 0,163 ммоль) при 0°С, и перемешивание при 0°С продолжали в течение 1 часа. Полученную реакционную смесь экстрагировали EtOAc (2×100 мл), и объединенные органические слои промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме с получением сырого продукта, который очищали препаративной ВЭЖХ с получением указанного в заголовке соединения (20 мг, 32%) в виде белой пены. MS: 385,1 (M+H+).
Пример 2
2-[5-[(1-Ацетилазетидин-3-ил)-метиламино]пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-он
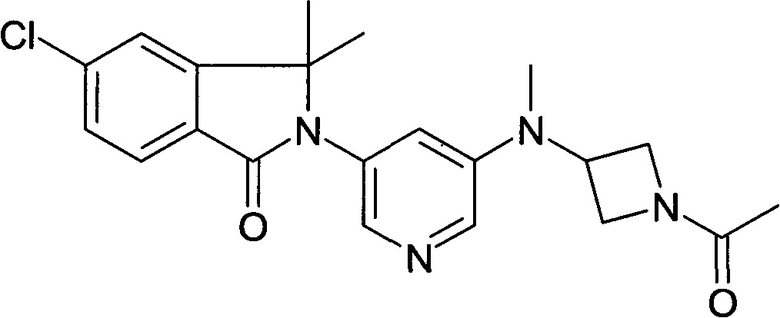
[А] трет-Бутиловый эфир 3-{[5-(6-Хлор-1,1-диметил-3-оксо-1,3-дигидроизоиндол-2-ил)-пиридин-3-ил]-метиламино}-азетидин-1-карбоновой кислоты
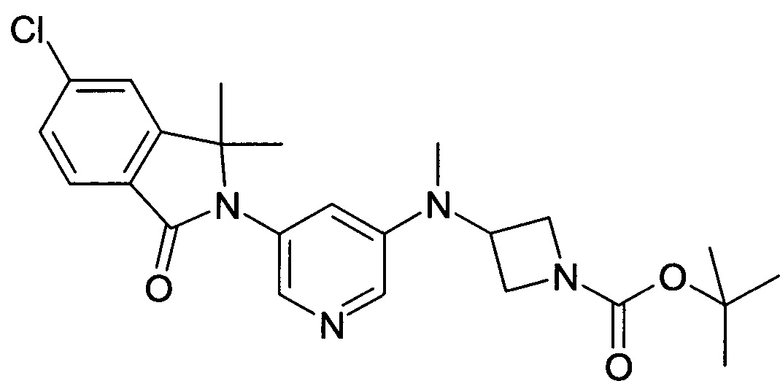
Смесь 5-хлор-2-(5-иодопиридин-3-ил)-3,3-диметил-2,3-дигидроизоиндол-1-она (398 мг, 1 ммоль, промежуточное соединение А-7[А]), трет-бутилового эфира 3-метиламино-азетидин-1-карбоновой кислоты (250 мг, 1,3 ммоль), Pd(OAc)2 (35 мг, 10 масс. %), Xanphos (70 мг, 20 масс. %) и t-BuONa (192 мг, 2 ммоль) в диоксане (6 мл) перемешивали при 115°С в течение 2 часов. После охлаждения до комнатной температуры, реакционную смесь выливали в воду (20 мл) и экстрагировали EtOAc (2×100 мл). Объединенные органические слои промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме с получением сырого продукта, который очищали флэш-хроматографией на силикагеле (градиент 40-100% EtOAc-гексан) с получением указанного в заголовке соединения (196 мг, 43%) в виде светло-желтой пены. MS: 457,1 (М+Н+).
[В] 2-[5-(Азетидин-3-илметиламино)-пиридин-3-ил]-5-хлор-3,3-диметил-2,3-дигидроизоиндол-1-он
Смесь трет-бутилового эфира 3-{[5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидроизоиндол-2-ил)-пиридин-3-ил]-метиламино}-азетидин-1-карбоновой кислоты (196 мг, 0,43 ммоль), ацетилхлорида (0,56 мл) в метаноле (12 мл) перемешивали при комнатной температуре в течение 2 часов. Затем ее концентрировали в вакууме с получением сырого продукта в виде светло-желтой пены. Его использовали на следующей стадии реакции без дополнительной очистки. MS: 357,2 (M+H+).
[С] 2-[5-[(1-Ацетилазетидин-3-ил)-метиламино]пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-он
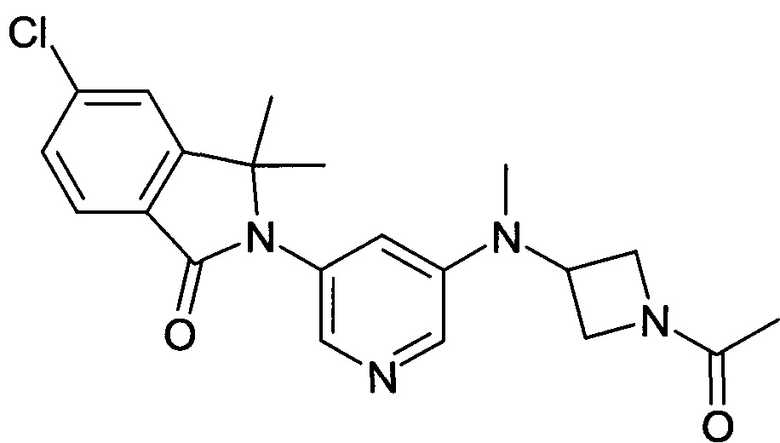
К перемешиваемому раствору 2-[5-(азетидин-3-илметиламино)-пиридин-3-ил]-5-хлор-3,3-диметил-2,3-дигидроизоиндол-1-она (60 мг, 0,17 ммоль) и Et3N (0,50 мл) в DCM (5 мл) добавляли ацетилхлорид (0,012 мл, 0,17 ммоль) при 0°С, и перемешивание продолжали при 0°С в течение 1 часа. Полученную смесь экстрагировали EtOAc (2×100 мл), и объединенные органические слои промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме с получением сырого продукта, который очищали препаративной ВЭЖХ с получением указанного в заголовке соединения (19 мг, 28%) в виде белой пены. MS: 399,1 (M+H+).
Пример 3 и Пример 4
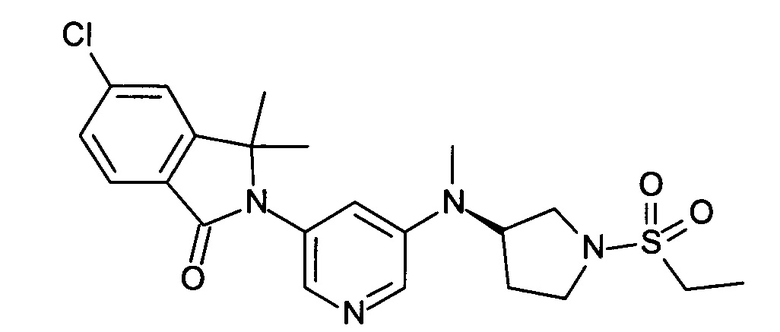
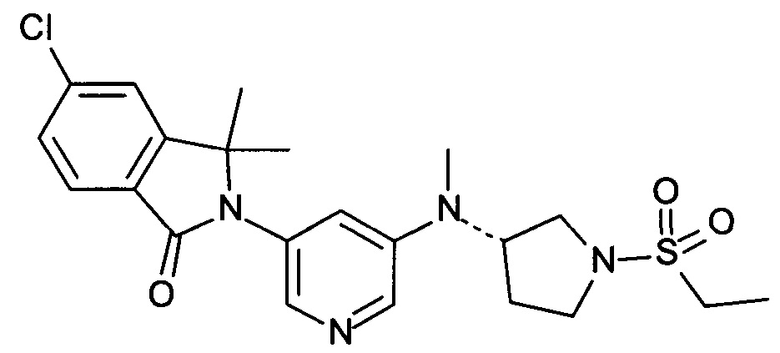
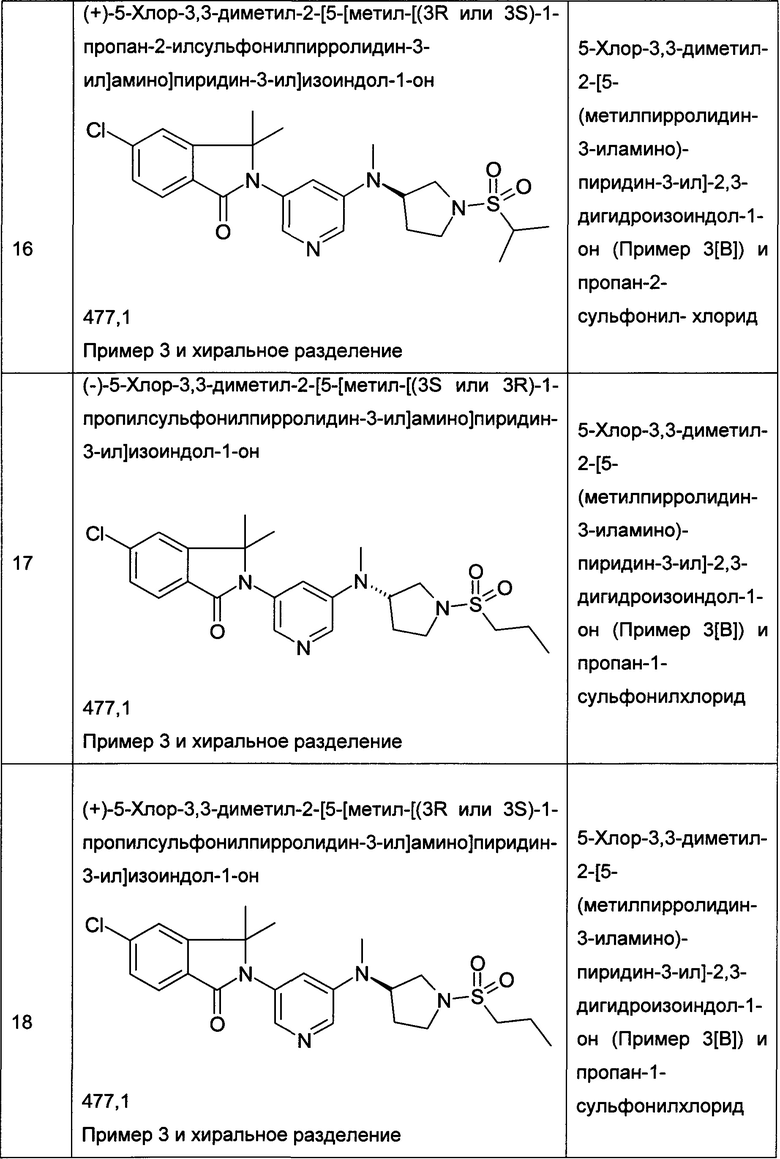
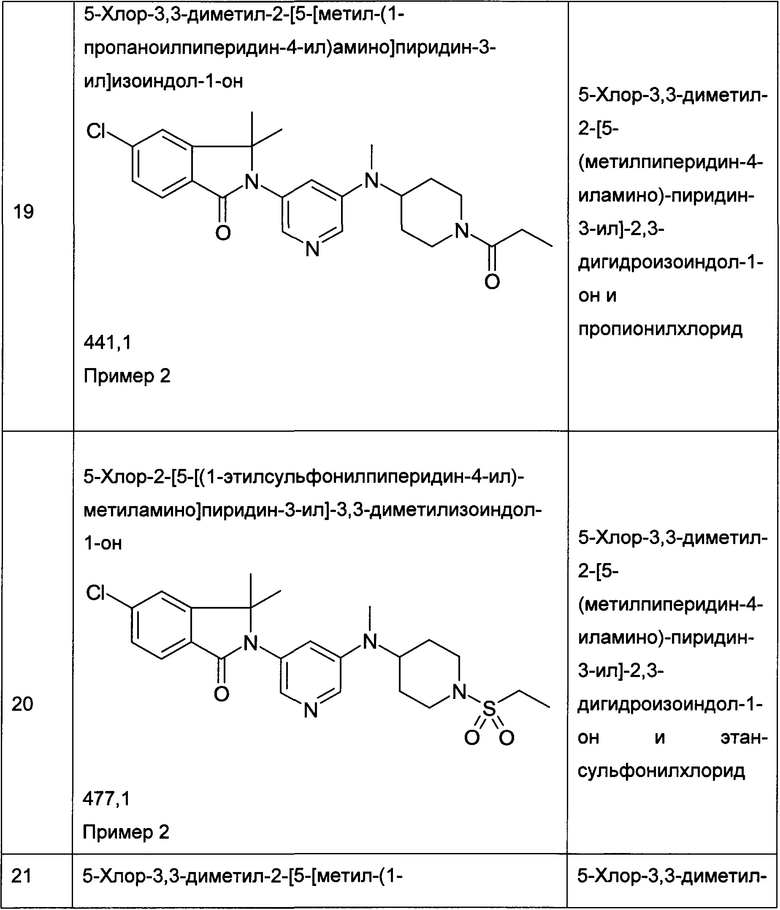
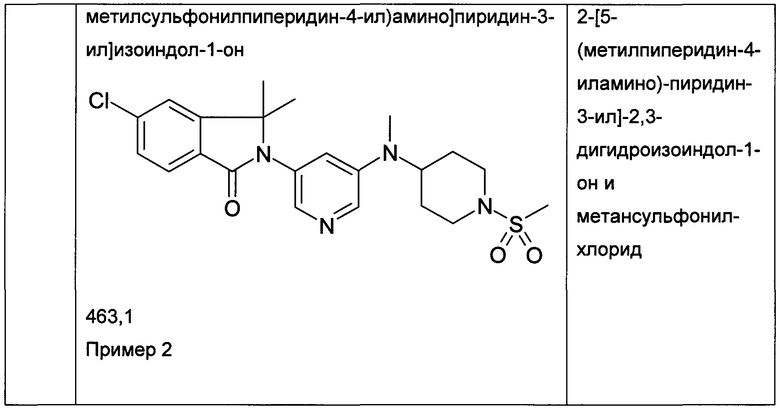
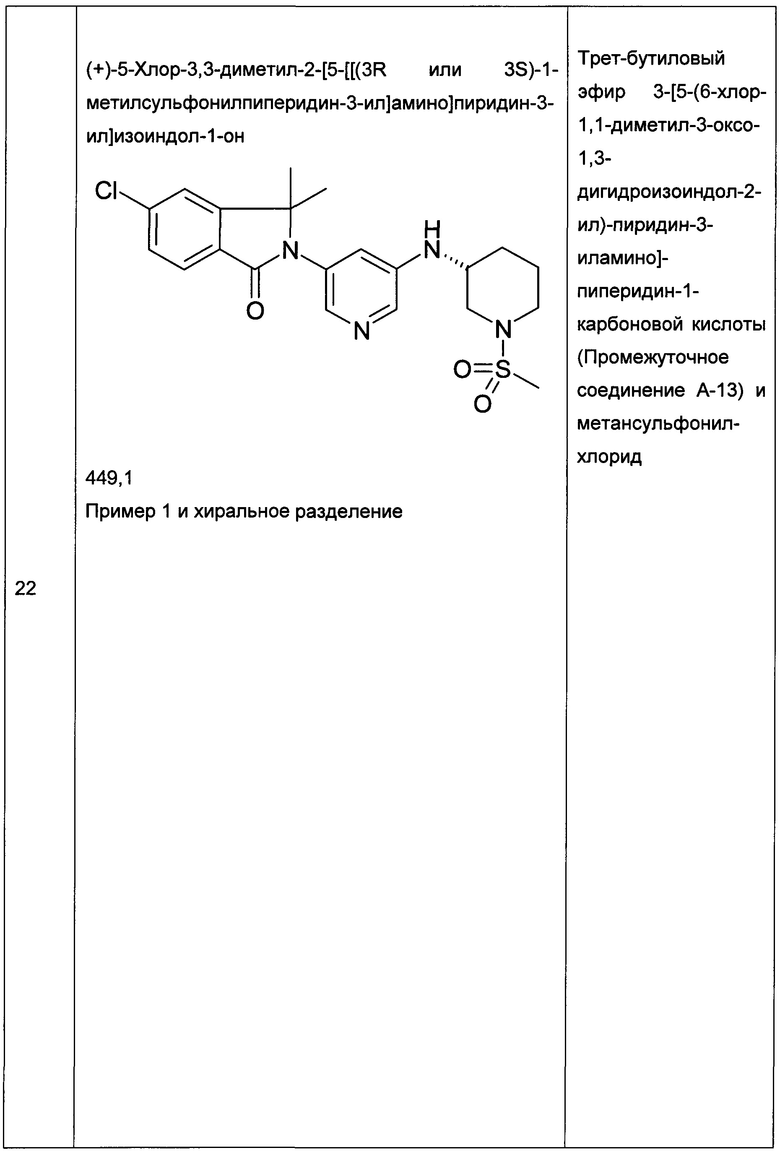
(+)-5-Хлор-2-[5-[[(3R или 3S)-1-этилcyльфoнилпиppoлидин-3-ил]-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-он и (-)-5-хлор-2-[5-[[(3S или 3R)-1-этилсульфонилпирролидин-3-ил]-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-он
 Пример 3, (+)-(R или S)
Пример 3, (+)-(R или S)
 Пример 4, (-)-(S или R)
Пример 4, (-)-(S или R)
[А] трет-Бутиловый эфир 3-{[5-(6-Хлор-1,1-диметил-3-оксо-1,3-дигидроизоиндол-2-ил)-пиридин-3-ил]-метиламино}-пирролидин-1-карбоновой кислоты
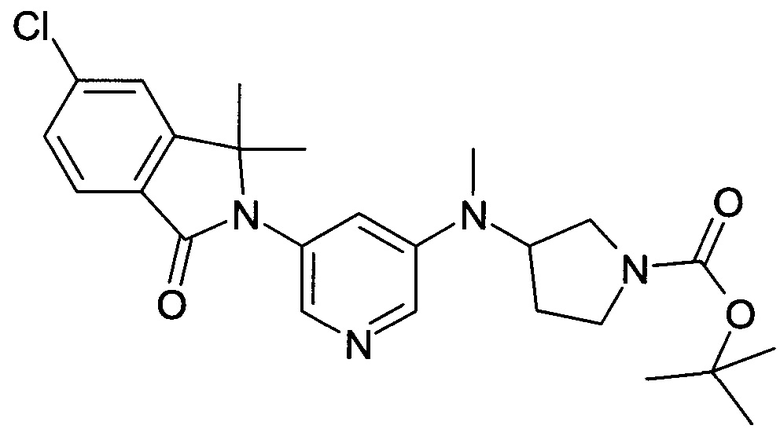
По аналогии со способом, описанным для получения соединения Примера 2[А], использовали трет-бутиловый эфир 3-метиламинопирролидин-1-карбоновой кислоты с получением указанного в заголовке соединения в виде светло-желтой пены (47%). MS: 471,1 (М+Н+).
[В] 5-Хлор-3,3-диметил-2-[5-(метилпирролидин-3-иламино)-пиридин-3-ил]-2,3-дигидроизондол-1-он
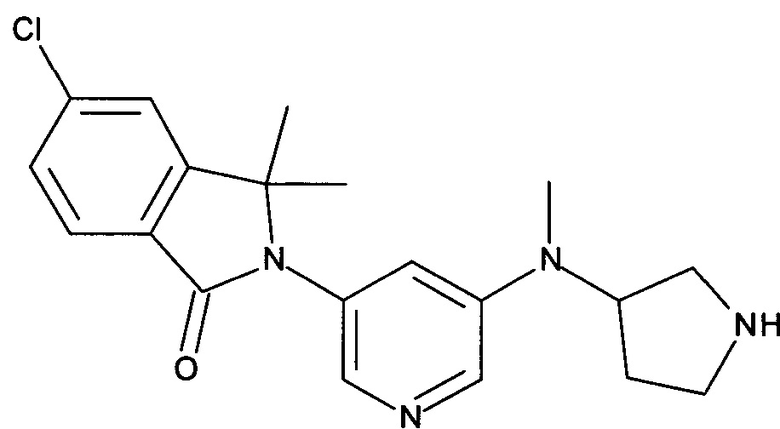
По аналогии со способом, описанным для получения соединения Примера 2[В], указанное в заголовке соединение в виде светло-желтой пены было получено в виде сырого продукта. Его использовали на следующей стадии без дополнительной очистки. MS: 371,2 (M+H+).
[С] 5-Хлор-2-{5-[(1-этансульфонилпирролидин-3-ил)-метиламино]-пиридин-3-ил}-3,3-диметил-2,3-дигидроизоиндол-1-он
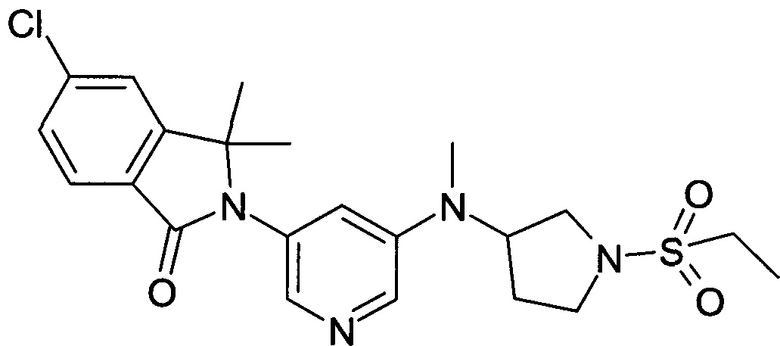
По аналогии со способом, описанным для получения соединения Примера 2[С], использовали этансульфонилхлорид с получением указанного в заголовке соединения (40%) в виде белой пены. MS: 463,1 (M+H+)
[D] (+)-5-Хлор-2-[5-[[(3R или 3S)-1-этилcульфoнилпиppoлидин-3-ил]-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-он (Пример 3) и (-)-5-хлор-2-[5-[[(3S или 3R)-1-этилсульфонилпирролидин-3-ил]-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-он (Пример 4)
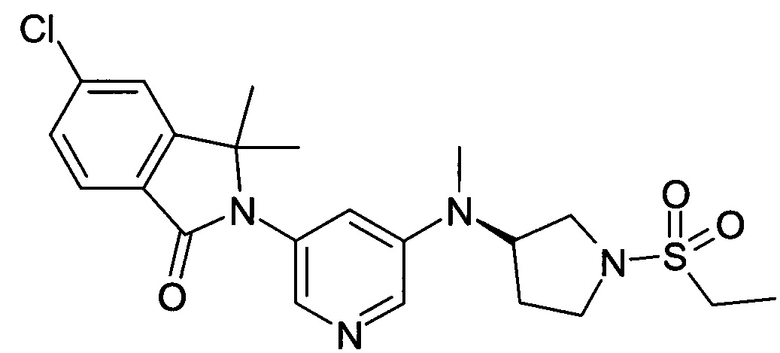 Пример 3, (+)-(R или S)
Пример 3, (+)-(R или S)
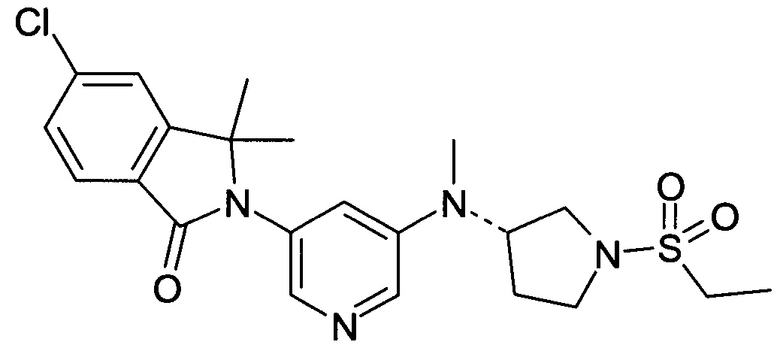 Пример 4, (-)-(S или R)
Пример 4, (-)-(S или R)
Указанные в заголовке соединения были получены путем хирального разделения (рац)-5-хлор-2-{5-[(1-циклопропилсульфонил-пирролидин-3-ил)-метиламино]-пиридин-3-ил}-3,3-диметил-2,3-дигидроизоиндол-1-она на колонке Chiralpak IA (10% ацетонитрила (ACN) в этаноле) с получением (+)-5-хлор-2-[5-[[(3R или 3S)-1-этилсульфонилпирролидин-3-ил]-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-она (Пример 3, 10 мг, 20%), MS: 463,1 (M+H+) и (-)-5-хлор-2-[5-[[(3S или 3R)-1-этилсульфонилпирролидин-3-ил]-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-она (Пример 4, 12,5 мг, 25%) в виде не совсем белой пены. MS: 463,1 (M+H+).
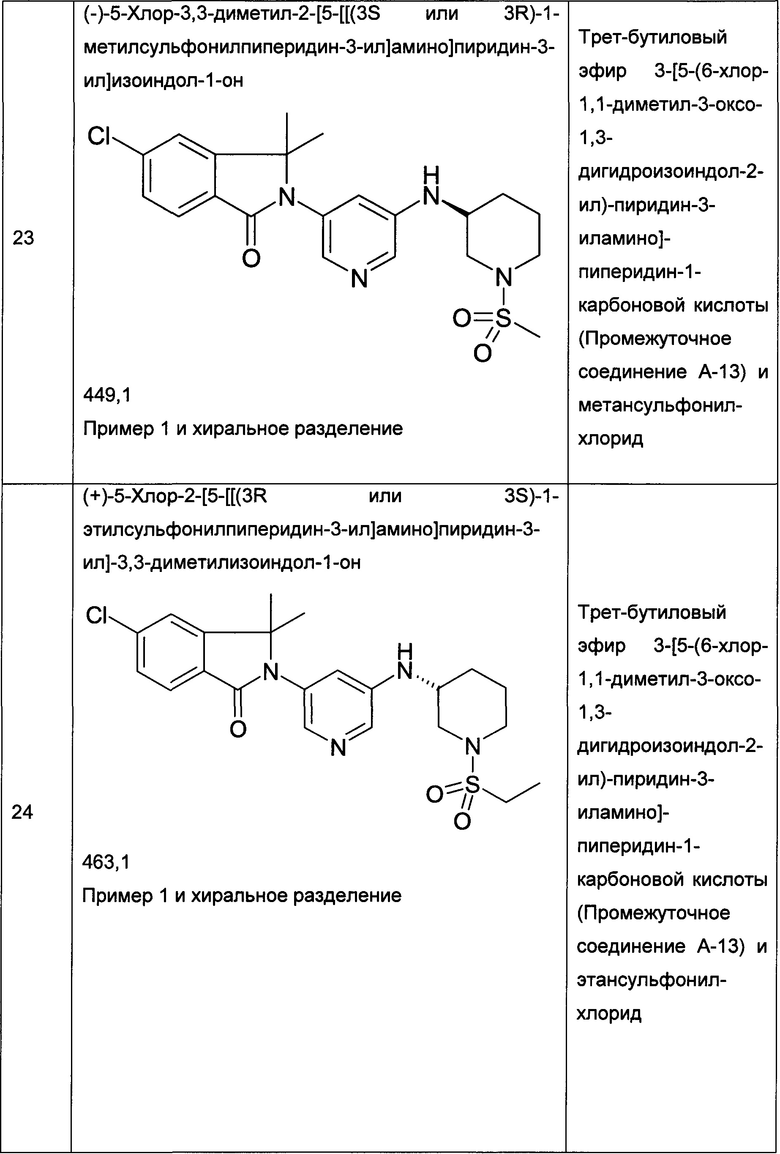
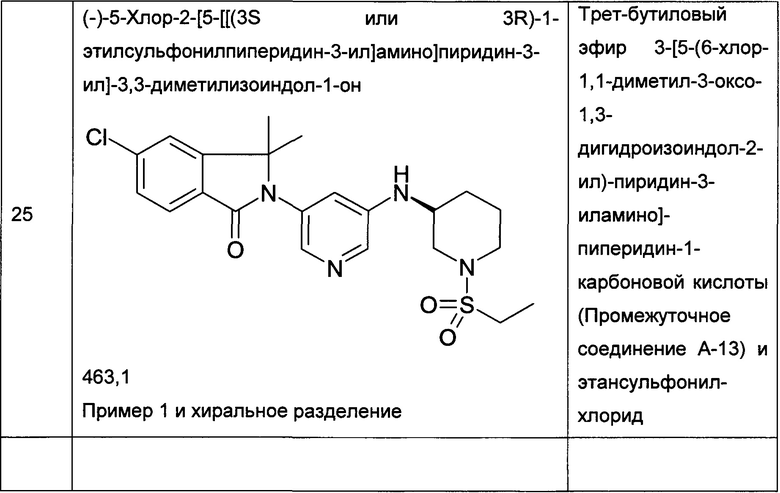
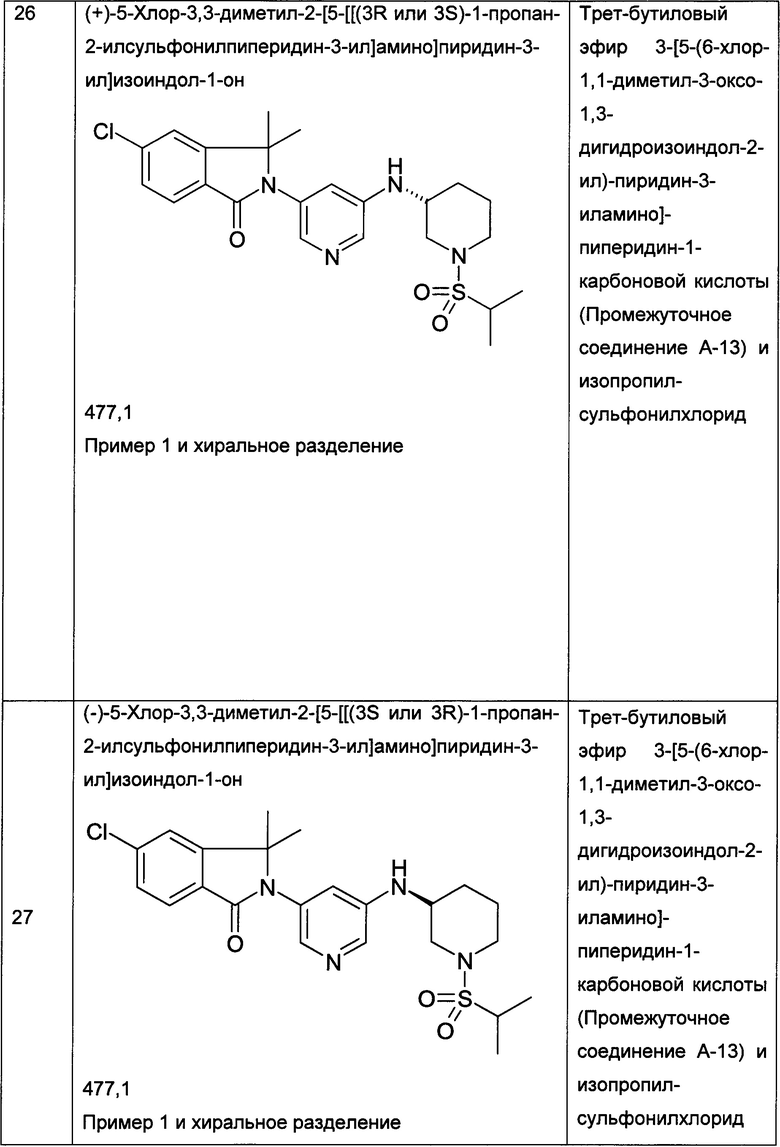
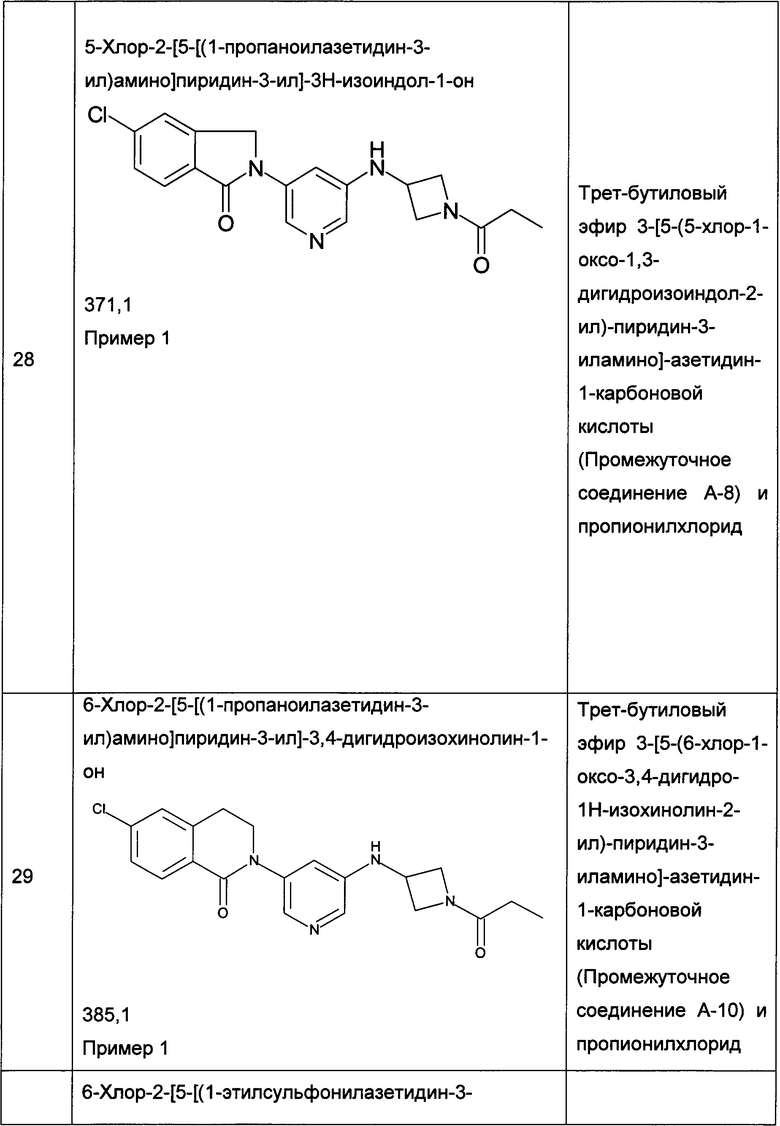
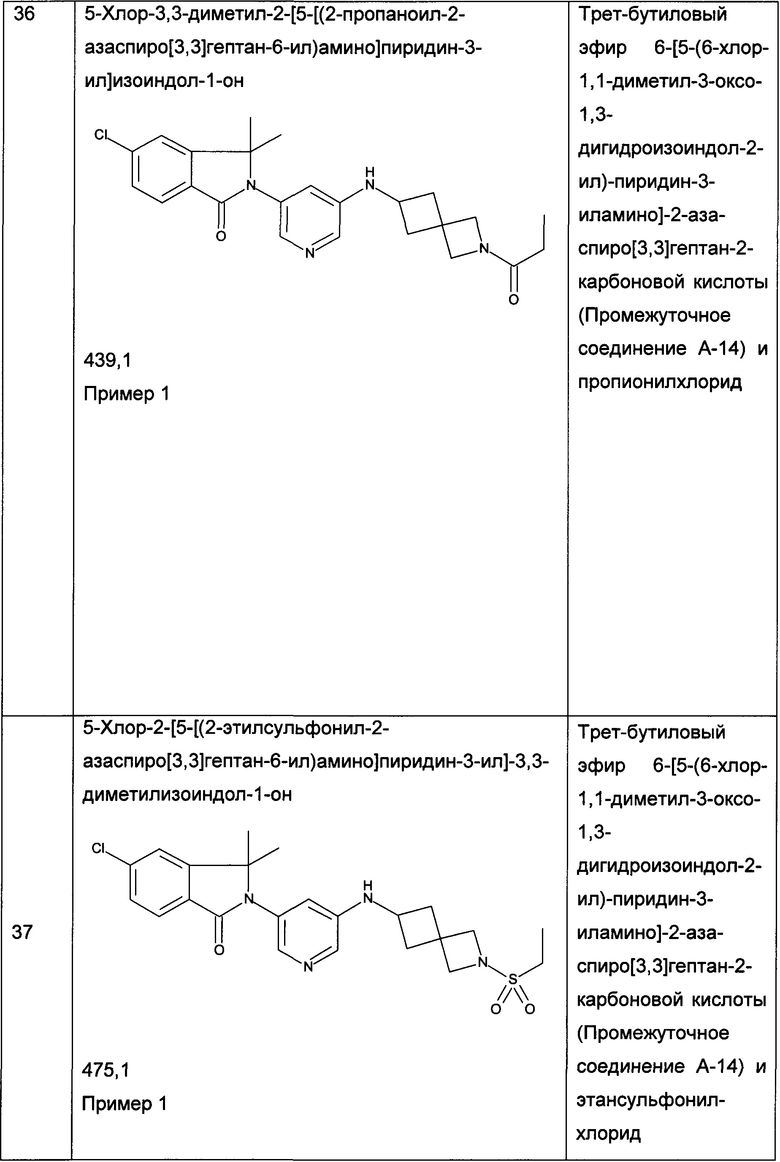
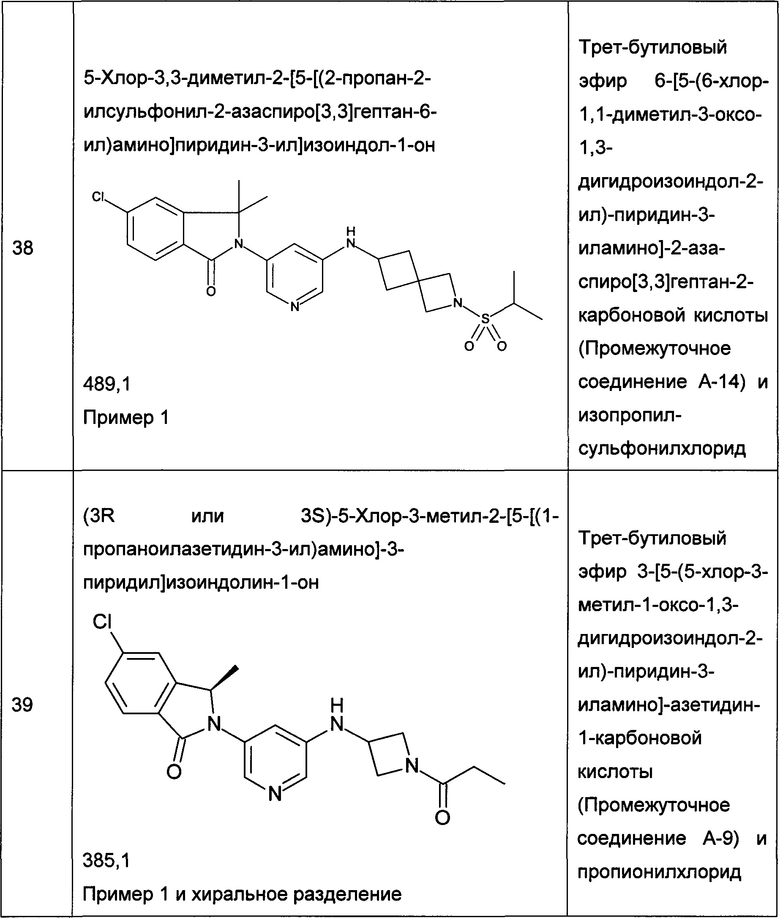
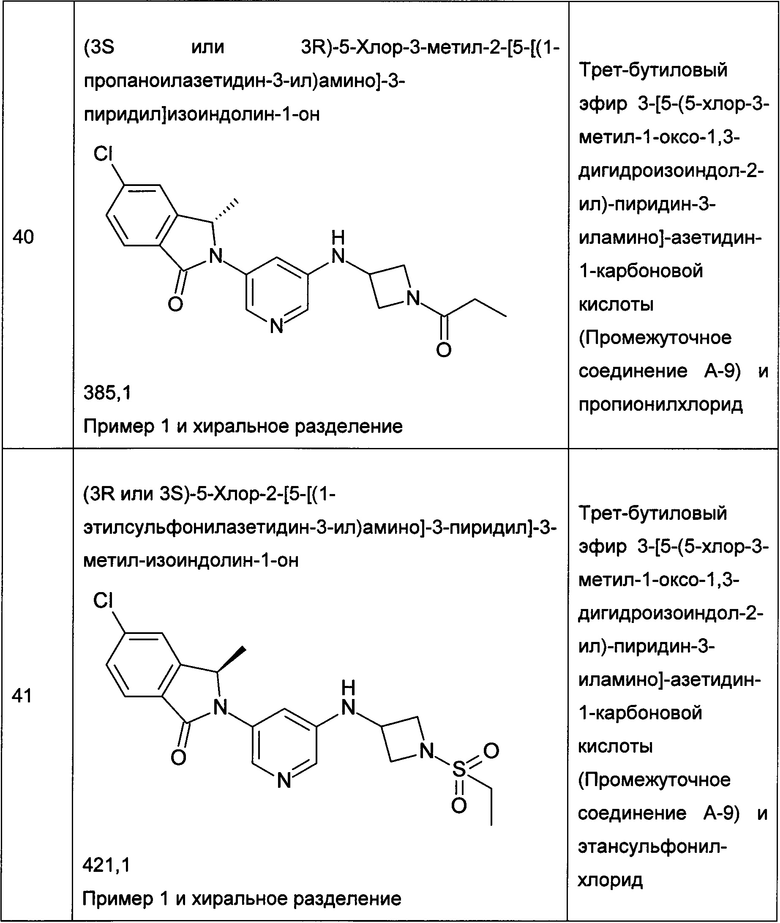
Следующие примеры, приведенные в таблице 2, были получены по аналогии с методиками, описанными для получения соединений примеров 1, 2, 3 или 4 с использованием соответствующих исходных материалов:
Пример А
Соединение формулы (I) можно использовать известным образом в качестве активного ингредиента для изготовления таблеток, имеющих следующий состав:
На таблетку
Пример В
Соединение формулы (I) можно использовать известным образом в качестве активного ингредиента для изготовления капсул, имеющих следующий состав:
На капсулу
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ СОЕДИНЕНИЯ 3,4-ДИГИДРО-2Н-ИЗОХИНОЛИН-1-ОНА И 2,3-ДИГИДРОИЗОИНДОЛ-1-ОНА | 2014 |
|
RU2693698C2 |
| НОВЫЕ 3,4-ДИГИДРО-2Н-ИЗОХИНОЛИН-1-ОНЫ И 2,3-ДИГИДРО-ИЗОИНДОЛ-1-ОНЫ | 2014 |
|
RU2689421C2 |
| АРОИЛАМИНО- И ГЕТЕРОАРОИЛАМИНО-ЗАМЕЩЕННЫЕ ПИПЕРИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ GLYT-1 | 2010 |
|
RU2517701C2 |
| ИМИДАЗО[1,2-а]ПИРАЗИН-1-ИЛ-БЕНЗАМИДЫ ДЛЯ ЛЕЧЕНИЯ СПИНАЛЬНОЙ МЫШЕЧНОЙ АТРОФИИ | 2015 |
|
RU2725979C2 |
| Ингибиторы альдостеронсинтазы (CYP11B2) человека | 2022 |
|
RU2811745C1 |
| Ингибиторы цитохрома 11В2 человека | 2022 |
|
RU2789610C1 |
| Ингибиторы цитохрома 11В2 человека | 2022 |
|
RU2800378C1 |
| СОЕДИНЕНИЯ ПИРРОЛИДИНИЛМОЧЕВИНЫ И ПИРРОЛИДИНИЛТИОМОЧЕВИНЫ КАК ИНГИБИТОРЫ КИНАЗЫ TrkA | 2012 |
|
RU2606131C2 |
| ПРОИЗВОДНЫЕ [1,2,3]ТРИАЗОЛО[4,5-D]ПИРИМИДИНА С АФФИННОСТЬЮ К КАННАБИНОИДНЫМ РЕЦЕПТОРАМ ТИПА 2 | 2017 |
|
RU2741597C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ЗАМЕЩЕННЫЕ ФЕНИЛМЕТАНОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ПЕРЕНОСЧИКА ГЛИЦИНА 1 | 2006 |
|
RU2405771C2 |
Изобретение относится к области органической химии, а именно к гетероциклическому соединению формулы (I) и к его фармацевтически приемлемой соли, где R1, R2, R3 и R4 независимо выбраны из H и С1-С4-алкила; R5, R7 и R9 независимо выбраны из Н и С1-С4-алкила; R8 и R11 вместе образуют -СН2-СН2-; R10 представляет собой Н, или R10 и R11 вместе образуют -(CH2)w-; или R6 и R9 вместе образуют -СН2-, R8 представляет собой Н, и R10 и R11 вместе образуют -СН2-; А представляет собой -С(О)- или -S(O)2-; R12 представляет собой С1-С4-алкил; R13 представляет собой галоген или циано; R14 представляет собой Н или С1-С4-алкил; R15 представляет собой Н или С1-С4-алкил; m, n и p независимо выбраны из 0 и 1; w представляет собой 1, 2 или 3. Также изобретение относится к фармацевтической композиции на основе соединения формулы (I), применению соединения формулы (I) и способу лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертензии, первичного альдостеронизма и синдрома Кушинга. Технический результат: получены новые гетероциклические соединения, обладающие ингибирующей активностью альдостеронсинтазы. 5 н. и 23 з.п. ф-лы, 2 табл., 47 пр.
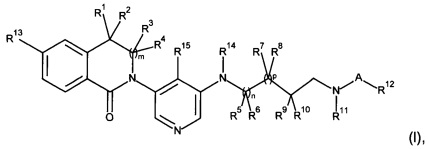
1. Соединения формулы (I)
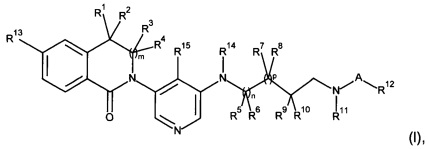
где
R1, R2, R3 и R4 независимо выбраны из H и С1-С4-алкила;
R5, R7 и R9 независимо выбраны из Н и С1-С4-алкила;
R8 и R11 вместе образуют -СН2-СН2-;
R10 представляет собой Н, или R10 и R11 вместе образуют -(CH2)w-;
или R6 и R9 вместе образуют -СН2-, R8 представляет собой Н, и R10 и R11 вместе образуют -СН2-;
А представляет собой -С(О)- или -S(O)2-;
R12 представляет собой С1-С4-алкил;
R13 представляет собой галоген или циано;
R14 представляет собой Н или С1-С4-алкил;
R15 представляет собой Н или С1-С4-алкил;
m, n и p независимо выбраны из 0 и 1;
w представляет собой 1, 2 или 3;
и их фармацевтически приемлемые соли.
2. Соединение по п.1, где
R1 и R2 представляют собой С1-С4-алкил;
R7 и R9 представляют собой Н;
R8 и R11 вместе образуют -СН2-СН2-;
R10 представляет собой Н, или R10 и R11 вместе образуют -(CH2)w-;
А представляет собой -С(О)- или -S(O)2-;
R12 представляет собой С1-С4-алкил;
R13 представляет собой галоген;
R14 представляет собой Н или С1-С4-алкил;
R15 представляет собой Н;
m и n представляют собой 0;
p представляет собой 0 или 1;
w представляет собой 1 или 2;
и его фармацевтически приемлемые соли.
3. Соединение по п.1, где
R1 и R2 представляют собой С1-С4-алкил;
R7 и R9 представляют собой Н;
R8 и R11 вместе образуют -СН2-СН2-;
R10 представляет собой Н, или R10 и R11 вместе образуют -(CH2)w-;
А представляет собой -S(O)2-;
R12 представляет собой С1-С4-алкил;
R13 представляет собой галоген;
R14 представляет собой Н или С1-С4-алкил;
R15 представляет собой Н;
m и n представляют собой 0;
р представляет собой 0 или 1;
w представляет собой 1 или 2;
и его фармацевтически приемлемые соли.
4. Соединение по п.1, где
R1 и R2 представляют собой С1-С4-алкил;
R7 и R9 представляют собой Н;
R8 и R11 вместе образуют -СН2-СН2-;
R10 представляет собой Н;
А представляет собой -S(O)2-;
R12 представляет собой С1-С4-алкил;
R13 представляет собой хлор;
R14 представляет собой Н;
R15 представляет собой Н;
m и n представляют собой 0;
p представляет собой 1;
и его фармацевтически приемлемые соли.
5. Соединение по п.1, где
R1 и R2 представляют собой метил;
R7 и R9 представляют собой Н;
R8 и R11 вместе образуют -СН2-СН2-;
R10 представляет собой Н;
А представляет собой -S(O)2-;
R12 представляет собой этил;
R13 представляет собой хлор;
R14 представляет собой Н или С1-С4-алкил;
R15 представляет собой Н;
m и n представляют собой 0;
p представляет собой 1;
и его фармацевтически приемлемые соли.
6. Соединение по п.1, где А представляет собой -S(O)2-.
7. Соединение по п.1, где R1 и R2 независимо выбраны из Н и С1-С4-алкила.
8. Соединение по п.1, где R1 и R2 представляют собой С1-С4-алкил.
9. Соединение по п.1, где R1 и R2 представляют собой метил.
10. Соединение по п.1, где m и n представляют собой 0.
11. Соединение по п.1, где p представляет собой 1.
12. Соединение по п.1, где w представляет собой 1 или 2.
13. Соединение по п.1, где R5, R7 и R9 представляют собой Н.
14. Соединение по п.1, где R9 представляет собой Н.
15. Соединение по п.1, где R12 представляет собой метил, этил, пропил или изопропил.
16. Соединение по п.1, где R12 представляет собой этил, пропил или изопропил.
17. Соединение по п.1, где R12 представляет собой этил.
18. Соединение по п.1, где R13 представляет собой хлор.
19. Соединение по п.1, где R15 представляет собой Н.
20. Соединение по п.1, выбранное из
2-[5-[(1-ацетилазетидин-3-ил)амино]пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-она;
2-[5-[(1-ацетилазетидин-3-ил)-метиламино]пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-она;
5-хлор-2-[5-[[(3R или 3S)-1-этилсульфонилпирролидин-3-ил]-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-хлор-2-[5-[[(3S или 3R)-1-этилсульфонилпирролидин-3-ил]-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
2-[5-[(1-ацетилпиперидин-4-ил)амино]пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-она;
5-хлор-2-[5-[(1-этилсульфонилпиперидин-4-ил)амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[(1-метилсульфонилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[(1-пропаноилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-(1-метилсульфонилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-(1-пропаноилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-(1-пропан-2-илсульфонилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-(1-пропилсульфонилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-[(3S или 3R)-1-пропан-2-илсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-[(3R или 3S)-1-пропан-2-илсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-[(3S или 3R)-1-пропилсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-[(3R или 3S)-1-пропилсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-(1-пропаноилпиперидин-4-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-2-[5-[(1-этилсульфонилпиперидин-4-ил)-метиламино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-(1-метилсульфонилпиперидин-4-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[[(3R или 3S)-1-метилсульфонилпиперидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[[(3S или 3R)-1-метилсульфонилпиперидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-2-[5-[[(3R или 3S)-1-этилсульфонилпиперидин-3-ил]амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-хлор-2-[5-[[(3S или 3R)-1-этилсульфонилпиперидин-3-ил]амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[[(3R или 3S)-1-пропан-2-илсульфонилпиперидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[[(3S или 3R)-1-пропан-2-илсульфонилпиперидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-2-[5-[(1-пропаноилазетидин-3-ил)амино]пиридин-3-ил]-3H-изоиндол-1-она;
6-хлор-2-[5-[(1-пропаноилазетидин-3-ил)амино]пиридин-3-ил]-3,4-дигидроизохинолин-1-она;
6-хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)амино]пиридин-3-ил]-3,4-дигидроизохинолин-1-она;
6-хлор-2-[5-[(1-пропан-2-илсульфонилазетидин-3-ил)амино]пиридин-3-ил]-3,4-дигидроизохинолин-1-она;
2-[5-[(1-ацетилазетидин-3-ил)амино]пиридин-3-ил]-6-хлор-3,4-дигидроизохинолин-1-она;
5-хлор-3-метил-2-[5-[(1-пропаноилазетидин-3-ил)амино]пиридин-3-ил]-3H-изоиндол-1-она;
5-хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)амино]пиридин-3-ил]-3-метил-3H-изоиндол-1-она;
2-[5-[(2-ацетил-2-азаспиро[3,3]гептан-6-ил)амино]пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[(2-пропаноил-2-азаспиро[3,3]гептан-6-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-2-[5-[(2-этилсульфонил-2-азаспиро[3,3]гептан-6-ил)амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[(2-пропан-2-илсульфонил-2-азаспиро[3,3]гептан-6-ил)амино]пиридин-3-ил]изоиндол-1-она;
(3R или 3S)-5-хлор-3-метил-2-[5-[(1-пропаноилазетидин-3-ил)амино]-3-пиридил]изоиндолин-1-она;
(3S или 3R)-5-хлор-3-метил-2-[5-[(1-пропаноилазетидин-3-ил)амино]-3-пиридил]изоиндолин-1-она;
(3R или 3S)-5-хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)амино]-3-пиридил]-3-метилизоиндолин-1-она;
(3S или 3R)-5-хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)амино]-3-пиридил]-3-метилизоиндолин-1-она;
2-[5-[(1-этилсульфонил-4-пиперидил)амино]-3-пиридил]-3,3-диметил-1-оксоизоиндолин-5-карбонитрила;
3,3-диметил-1-оксо-2-[5-[(1-пропаноил-4-пиперидил)амино]-3-пиридил]изоиндолин-5-карбонитрила;
3,3-диметил-1-оксо-2-[5-[(1-пропаноилазетидин-3-ил)амино]-3-пиридил]изоиндолин-5-карбонитрила;
и их фармацевтически приемлемые соли.
21. Соединение по п. 1, выбранное из
5-хлор-2-[5-[(1-этилсульфонилпиперидин-4-ил)амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-хлор-2-[5-[(1-этилсульфонилазетидин-3-ил)амино]пиридин-3-ил]-3,3-диметилизоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[(1-пропаноилазетидин-3-ил)амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-[(3S или 3R)-1-пропан-2-илсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-[(3R или 3S)-1-пропан-2-илсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
5-хлор-3,3-диметил-2-[5-[метил-[(3R или 3S)-1-пропилсульфонилпирролидин-3-ил]амино]пиридин-3-ил]изоиндол-1-она;
и их фармацевтически приемлемых солей.
22. Соединение по п.1, которое представляет собой 5-хлор-2-[5-[(1-этилсульфонилпиперидин-4-ил)амино]пиридин-3-ил]-3,3-диметилизоиндол-1-он или его фармацевтически приемлемую соль.
23. Соединение по любому из пп.1-22 для применения в качестве терапевтически активного вещества, являющегося ингибитором альдостеронсинтазы.
24. Фармацевтическая композиция, ингибирующая активность альдостеронсинтазы, содержащая соединение по любому из пп.1-22 в эффективном количестве и терапевтически инертный носитель.
25. Применение соединения по любому из пп.1-22 для лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертензии, первичного альдостеронизма и синдрома Кушинга.
26. Соединение по любому из пп.1-22 для лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертензии, первичного альдостеронизма и синдрома Кушинга.
27. Применение соединения по любому из пп.1-22 для изготовления лекарственного средства для лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертензии, первичного альдостеронизма и синдрома Кушинга.
28. Способ лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертензии, первичного альдостеронизма и синдрома Кушинга, включающий введение эффективного количества соединения по любому из пп.1-22.
| Питательное приспособление к трепальным машинам для лубовых растений | 1922 |
|
SU201A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Способ получения хинолоновых производных или их фармацевтически приемлемых аддитивных солей | 1984 |
|
SU1407397A3 |
Авторы
Даты
2019-07-23—Публикация
2014-05-26—Подача