Ссылки на родственные заявки
В данной заявке испрашивается приоритет на основании 35 U.S.C § 119(e) по предварительным заявкам на патент США с порядковыми номерами 62/724,412 (подана 29 августа 2018) и 62/771,853 (подана 27 ноября 2018), раскрытие каждой из которых полностью включено в данный документ путем отсылки.
Заявление относительно прав на изобретение, сделанное на основе финансируемых из федерального бюджета исследований и разработок
Не применимо
Ссылка на «перечень последовательностей», таблицу или приложение с компьютерной программой, представленные на компакт-диске
Не применимо
Предпосылки создания изобретения
Злокачественные новообразования представляют собой группу болезней, при которых группа клеток демонстрирует неконтролируемое размножение и рост. Актуальные модели злокачественных новообразований включают в себя иммунную систему, включая хоминг клеток и иммунные контрольные точки, при развитии и прогрессировании рака. Хотя в понимании биологической основы злокачественных новообразований были сделаны большие успехи, эта болезнь остается самой распространенной причиной смерти.
CC хемокиновый рецептор 4, CCR(4), впервые идентифицированный Power et al. (Power et al. (1995) J. Biol. Chem. 270:19495-19500), является сопряженным с G-белком рецептором, который связывается с хемокинами, включая CCL22, также известный, как макрофагальный хемокин (MDC; CC хемокин, который, как сообщается, является хемоаттрактантом для Th2 субпопуляции периферических T-клеток крови, дендритных клеток и клеток натуральных киллеров (NK)), и CCL17, также известный как TARC (хемокин, регулируемый тимусом и активацией), который также продуцируется моноцитами и дендритными клетками.
CCR(4) участвует в иммунорегуляторных процессах, таких как хоминг клеток в специфичные ткани, включая хоминг T-лимфоцитов в кожу и легкие (смотри, например, Campbell et al. (1999) Nature 400:776-780, Gonzalo et al. (1999) J. Immunol. 163:403- 5 411, Lloyd et al. (2000) J. Exp. Med. 191:265-273, Kawasaki et al. (2001) J. Immunol. 166:2055-2062). Модуляторы активности CCR4 описаны, например, в WO2013/082490.
Как предполагается, антиген цитотоксического T-лимфоцита 4 (CTLA-4) является ключевым регулятором адаптивных иммунных ответов. В частности, считается, что CLTA-4 играет центральную роль в поддержании и разнообразии возникающих T-клеточных ответов. В связи с этим CTLA-4 считается возможной терапевтической мишенью для лечения злокачественных новообразований и воспаления в качестве ингибитора контрольной точки иммунитета. CLTA-4 модуляторы описаны, например, в WO 2018/035710.
Белок 1 запрограммированной смерти клетки (PD-1) является трансмембранным рецепторным белком, который отрицательно регулирует функцию T-клеток посредством взаимодействия с его двумя нативными лигандами - PD-L1 и PD-L2. Подобно CTLA4, PD-1 также является центральным регулятором иммунной системы и также считается ингибитором контрольных точек иммунитета. PD-1/PD-L1 модуляторы описаны, например, в WO 2018/005374.
С учетом роли клеточного хоминга и путей контрольных точек иммунитета в развитии и прогрессировании злокачественных новообразований, существует необходимость в разработке комбинированной терапии, которая может повысить эффективность лечения злокачественных новообразований.
Краткое раскрытие изобретения
Настоящее раскрытие имеет отношение к комбинированной терапии антагонистом C-C хемокинового рецептора 4 (CCR4) и одним или более ингибиторами контрольных точек при лечении злокачественных новообразований.
В некоторых вариантах осуществления антагонист CCR4 рецептора имеет формулу I
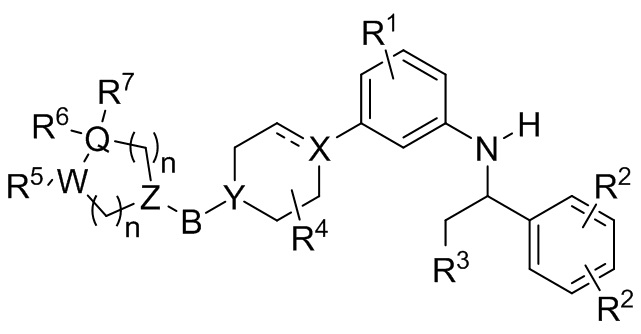 (I),
(I),
где каждая переменная описана ниже.
В некоторых вариантах осуществления CCR4 антагонист имеет формулу

или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления CCR4 антагонист имеет формулу
 (Соединение 2)
(Соединение 2)
или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления CCR4 антагонист имеет формулу
 (Соединение 3)
(Соединение 3)
или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления CCR4 антагонист имеет формулу
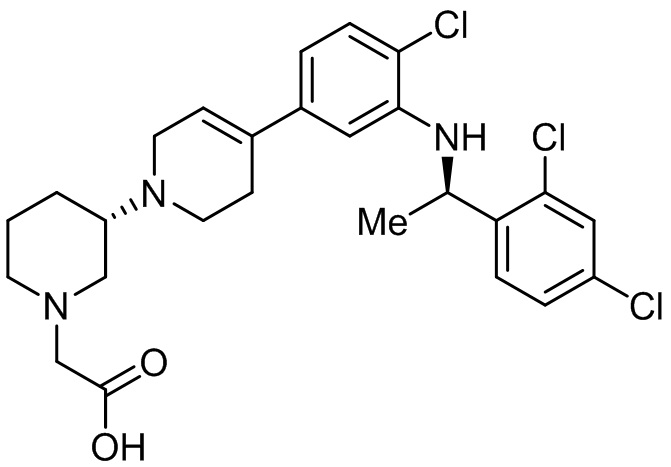 (Соединение 4)
(Соединение 4)
или его фармацевтически приемлемой соли.
Краткое описание чертежей
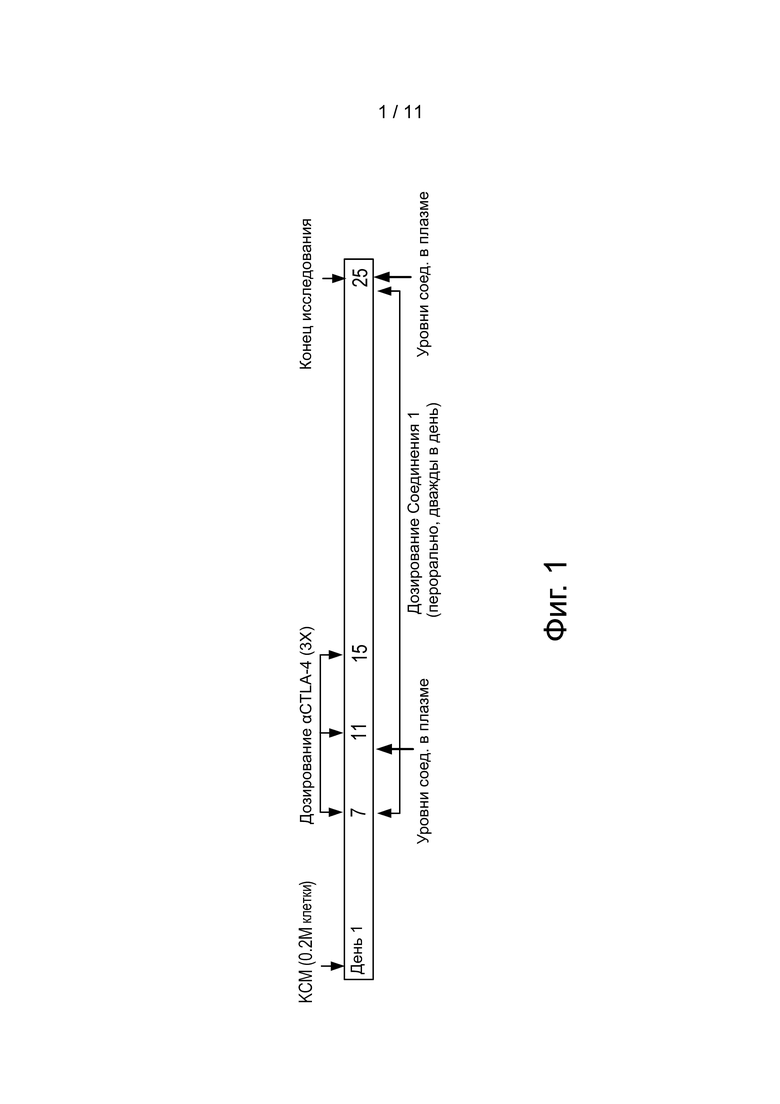
Фиг. 1 иллюстрирует дизайн исследования, использованного для KCM ортотопической модели опухоли поджелудочной железы.
Фиг. 2A-C показывает массу первичной опухоли + поджелудочной железы (Панель A), массу всех опухолей + поджелудочной железы (Панель B) и массу селезенки (Панель C) для каждой протестированной когорты. Комбинированная терапия анти-CTLA-4 антителом и Соединением 1 уменьшала массу опухолей по сравнению с антителом или Соединением 1 по отдельности.
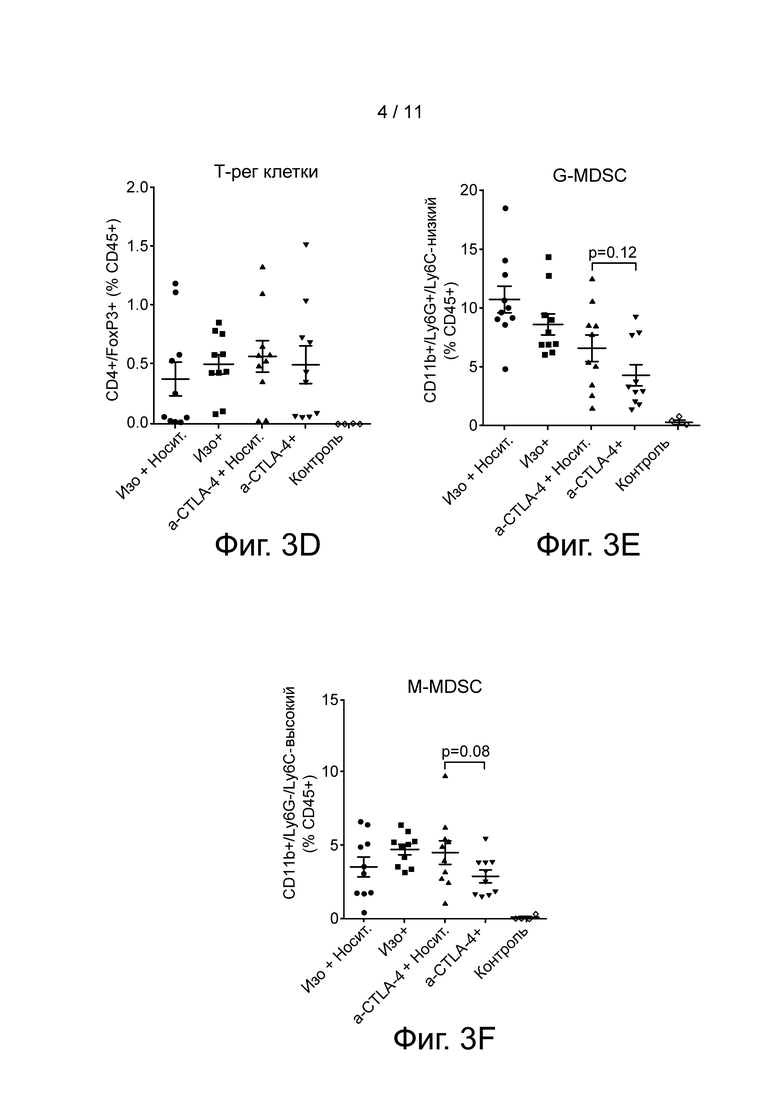
Фиг. 3A-F сообщает относительные количества популяций супрессорных иммунных клеток в каждой протестированной когорте. Панели A-C представляют количество клеток на грамм ткани, тогда как Панели D-F предоставляют процент CD45+ клеток. Панели A и D показывают T-рег клетки; панели B и E показывают G-MDSC клетки; и панели C и F показывают M-MDSC клетки.
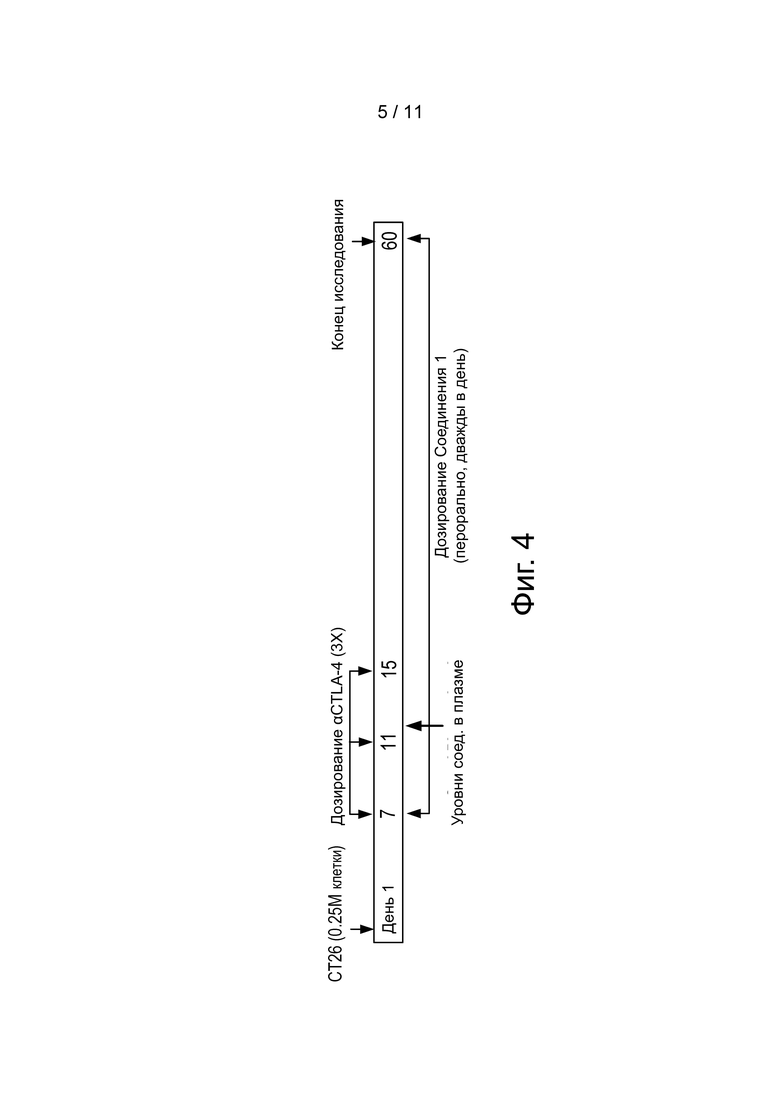
Фиг. 4 иллюстрирует дизайн исследования, использованный для опухолевой модели CT26 рака толстого кишечника.
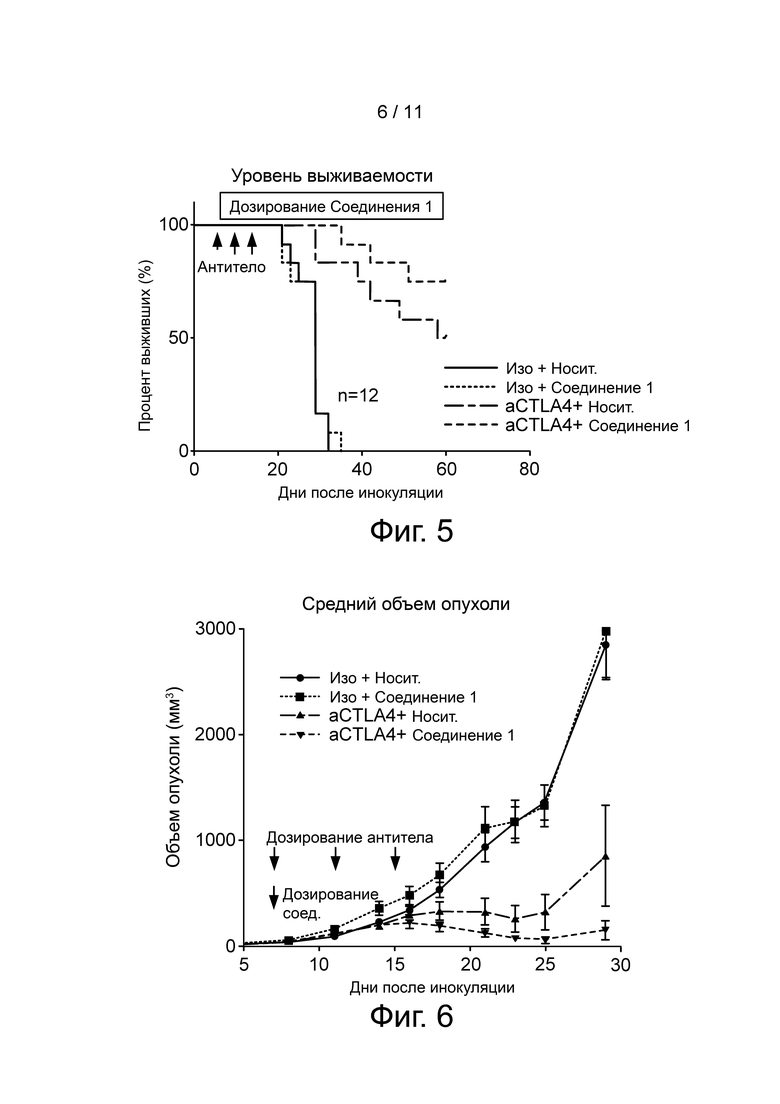
Фиг. 5 представляет графически уровень выживаемости в ходе исследования мышей из каждой когорты, протестированной с использованием CT26 опухолевой модели.
Фиг. 6 представляет графически средний объем опухоли у мышей из каждой протестированной когорты.
Фиг. 7A-D представляют графически индивидуальный объем опухоли у мышей из каждой протестированной когорты. Панель A описывает группу изотип антитела и носитель; Панель B описывает группу изотип антитела и Соединение 1; Панель C описывает группу анти-CTLA-4 антитело и носитель; и Панель D показывает группу анти-CTLA-4 антитело и Соединение 1.
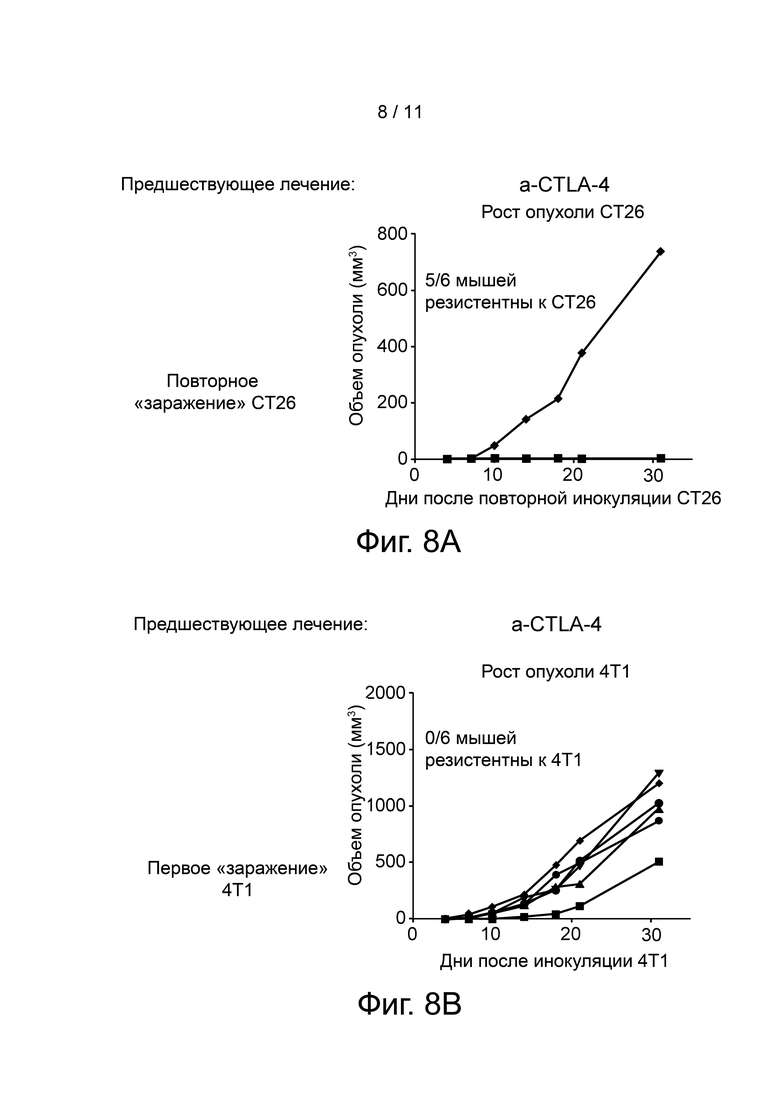
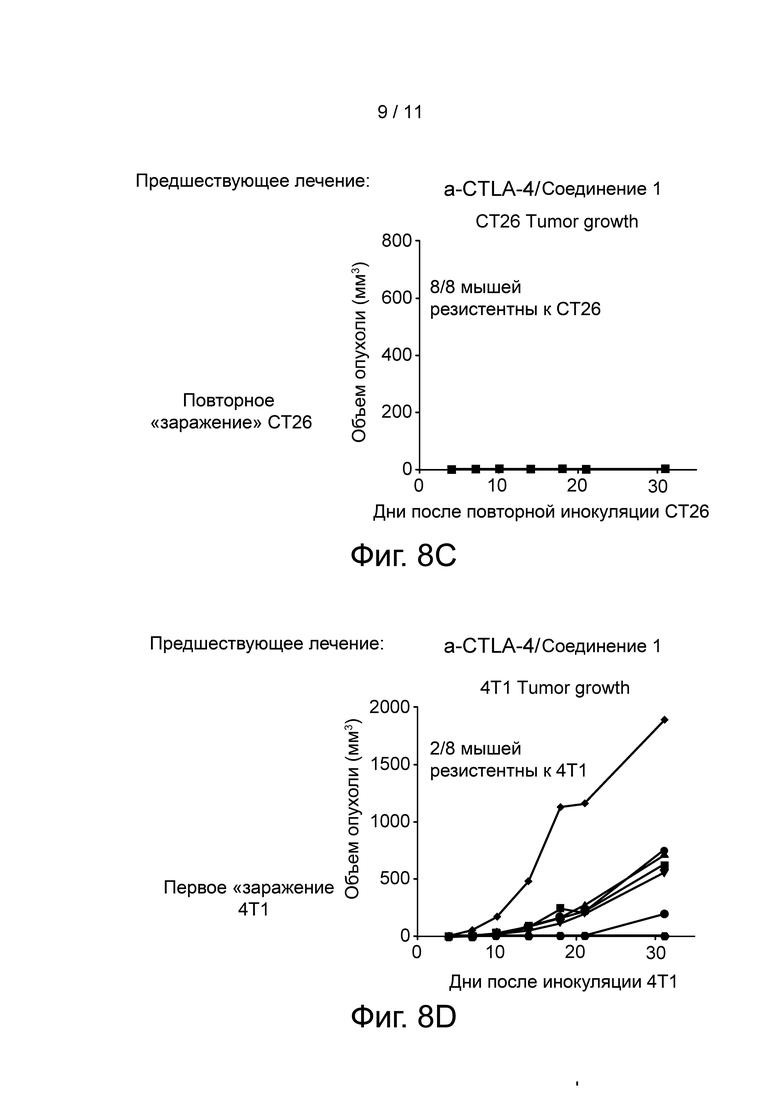
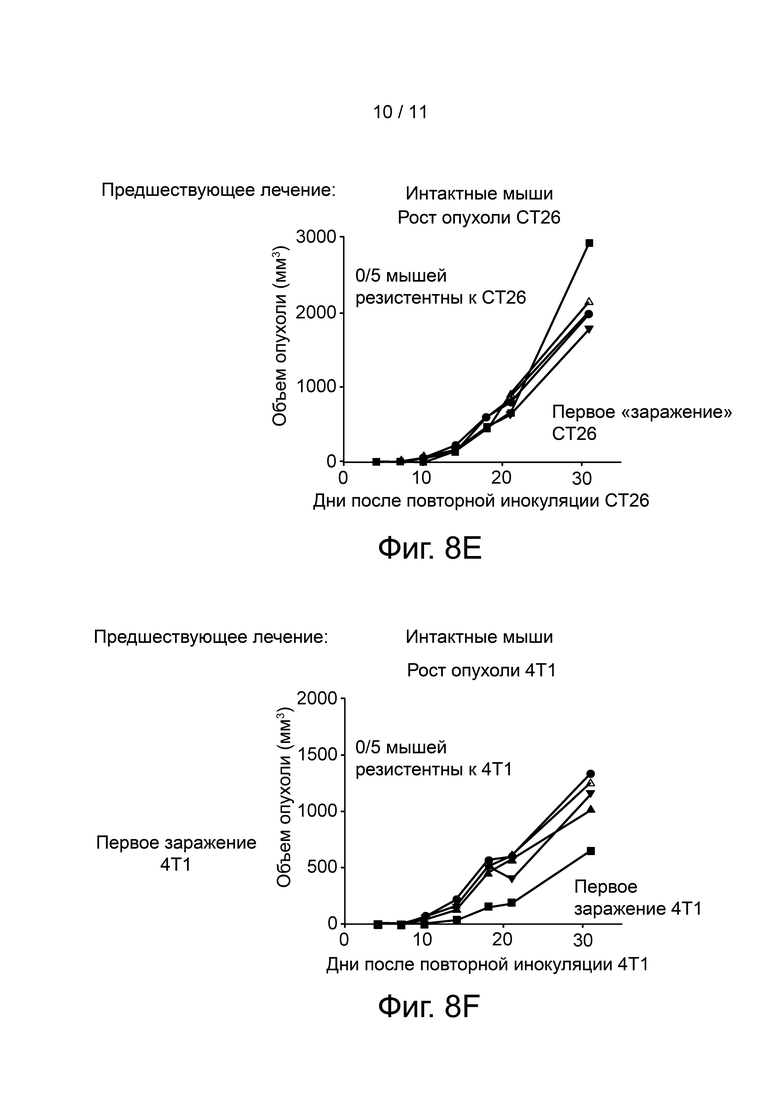
Фиг. 8A-F представляют графически объем опухоли у повторно заболевших и интактных (naïve) мышей при использовании клеток рака толстого кишечника CT26 и клеток рака молочной железы 4T1. Повторно заболевшими являются мыши с полной регрессией опухоли, которых ранее лечили анти-CTLA-4 (6 мышей) или анти-CTLA-4 и Соединением 1 (8 мышей). Интактными мышами являются мыши, которым ранее были введены клетки рака толстого кишечника CT26. Панель A показывает, что 5/6 мышей из лечебной группы анти-CTLA-4 были резистентны к повторному введению CT26 опухоли; Панель B показывает, что ни одна из мышей из анти-CTLA-4 лечебной группы не была резистентна к 4T1 опухолевым клеткам; Панель C показывает, что 8/8 мышей из лечебной группы анти-CTLA-4/Соединение 1 были резистентны к повторному введению CT26 опухоли; Панель D показывает, что 2 из 8 мышей из терапевтической группы анти-CTLA-4/Соединение 1 были устойчивы к 4T1 опухолевым клеткам; Панель E показывает, что у всех интактных мышей наблюдался рост опухоли при первом заражении CT26 клетками; и Панель F показывает, что ни одна из интактных мышей не была резистентна к 4T1 опухолевым клеткам.
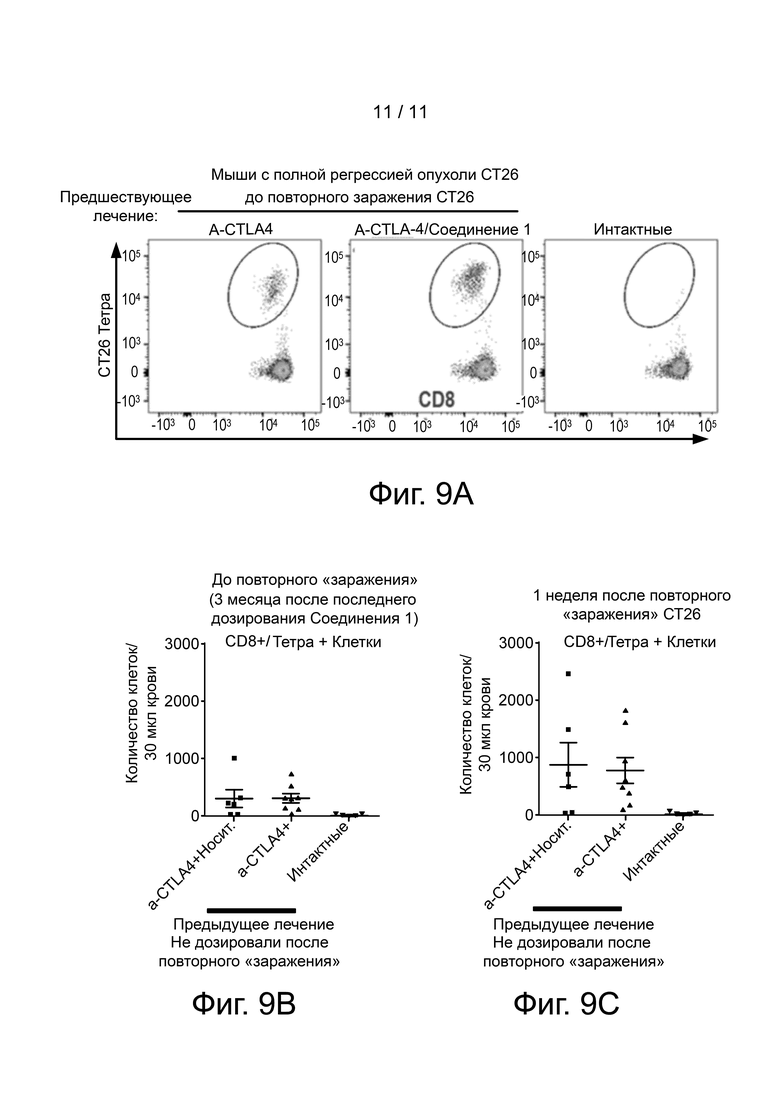
Фиг. 9A-C графически представляют результаты проточной цитометрии образцов крови, полученных от мышей, протестированных на фиг. 8. Панель A показывает, что перед повторным «заражением» у мышей, ранее подвергнутых обработке CT26 клетками (и леченых CTLA-4 или анти-CTLA-4 и Соединением 1), имелись цитотоксические T-клетки против CT26 опухолевых клеток, тогда как у интактных мышей таких клеток не было. Панели B и C показывают число цитотоксических T-клеток, реагирующих в отношении CT26 опухолевых клеток, до повторного «заражения» и через 1 неделю после повторного «заражения».
Подробное описание изобретения
Общие сведения
Настоящее раскрытие имеет отношение к тому удивительному и неожиданному факту, что комбинированная терапия с использованием CCR4 антагониста и одного или более ингибиторов иммунных контрольных точек значительно повышает эффективность лечения злокачественных новообразований по сравнению с одним или более ингибиторами контрольных точек, используемыми отдельно.
Аббревиатуры и определения
Термин «алкил», сам по себе или как часть другого заместителя, означает, если не указано иное, углеводородный радикал с прямой или разветвленной цепью, имеющий указанное число атомов углерода (т.е. C1-8 означает от одного до восьми атомов углерода). Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, трет-пентил, н-гексил, н-гептил, н-октил и тому подобное. Термин «алкенил» относится к ненасыщенной алкильной группе, имеющей одну или более двойных связей. Аналогичным образом, термин «алкинил» относится к ненасыщенной алкильной группе, имеющей одну или более тройных связей. Примеры таких ненасыщенных алкильных групп включают винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и высшие гомологи и изомеры. Термин «циклоалкил» имеет отношение к углеводородным кольцам, имеющим указанное число атомов в кольце (например, C3-6 циклоалкил) и являющимся полностью насыщенными или имеющим не более одной двойной связи между вершинами кольца. «Циклоалкил» также относится к бициклическим и полициклическим углеводородным кольцам таким как, например, бицикло[2.2.1]гептан, бицикло[2.2.2]октан и т.д. Термин «гетероциклоалкил» относится к циклоалкильной группе, содержащей от одного до пяти гетероатомов, выбранных из N, O и S, при этом атомы азота и серы необязательно являются окисленными, и атом(ы) азота необязательно являются кватернизованными. Гетероциклоалкил может быть моноциклической, бициклической или полициклической кольцевой системой. Неограничивающие примеры гетероциклоалкильных групп включают пирролидин, имидазолидин, пиразолидин, бутиролактам, валеролактам, имидазолидинон, гидантоин, диоксолан, фталимид, пиперидин, 1,4-диоксан, морфолин, тиоморфолин, тиоморфолин-S-оксид, тиоморфолин-S,S-оксид, пиперазин, пиран, пиридон, 3-пирролин, тиопиран, пирон, тетрагидрофуран, тетрагидротиофен, хинуклидин и тому подобное. Гетероциклоалкильная группа может быть присоединена к остальной части молекулы через атом углерода в кольце или гетероатом. Для таких терминов, как циклоалкилалкил и гетероциклоалкилалкил, подразумевается, что циклоалкильная или гетероциклоалкильная группа присоединяется к остальной части молекулы через алкильный или алкиленовый линкер. Например, циклобутилметил является циклобутильным кольцом, которое присоединяется с помощью метиленового линкера к остальной части молекулы.
Термин «алкилен», сам по себе или как часть другого заместителя, обозначает двухвалентный радикал, являющийся производным алкана, примером является -CH2CH2CH2CH2-. Как правило, алкильная (или алкиленовая) группа будет иметь от 1 до 24 атомов углерода, при этом группы, имеющие 10 или меньшее количество атомов углерода, являются предпочтительными в настоящем раскрытии. «Низший алкил» или «низший алкилен» является алкильной или алкиленовой группой с более короткой цепью, в большинстве случаев имеющей четыре или меньшее количество атомов углерода. Аналогичным образом, «алкенилен» и «алкинилен» относятся к ненасыщенным формам «алкилена», имеющим двойные или тройные связи, соответственно.
Термин «гетероалкил», сам по себе или в сочетании с другим термином, означает, если не указано иное, устойчивую прямую или разветвленную цепь, или циклический углеводородный радикал, или их комбинацию, состоящую из указанного числа атомов углерода и из от одного до трех гетероатомов, выбранных из группы, состоящей из O, N, Si и S, причем атомы азота и серы необязательно могут быть окисленными, и гетероатом азота необязательно может быть кватернизованным. Гетероатом(ы) O, N и S могут располагаться в любом внутреннем положении гетероалкильной группы. Гетероатом Si может располагаться в любом положении гетероалкильной группы, включая положение, в котором алкильная группа присоединяется к остальной части молекулы. Примеры включают -CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2,-S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=Н-OCH3 и -CH=CH-N(CH3)-CH3. Не более двух гетероатомов может располагаться друг за другом, например так, как в -CH2-NH-OCH3 и -CH2-O-Si(CH3)3. Аналогичным образом, термины «гетероалкенил» и «гетероалкинил», сами по себе или в сочетании с другим термином, означают, если не указано иное, алкенильную группу или алкинильную группу, соответственно, которая содержит установленное число атомов углерода и имеет от одного до трех гетероатомов, выбранных из группы, состоящей из O, N, Si и S, и при этом атомы азота и серы необязательно могут быть окисленными, и гетероатом азота необязательно может быть кватернизованным. Гетероатом(ы) O, N и S могут размещаться в любом внутреннем положении гетероалкильной группы.
Термин «гетероалкилен», сам по себе или как часть другого заместителя, обозначает двухвалентный радикал, насыщенный или ненасыщенный, или полиненасыщенный, происходящий из гетероалкила, примером является -CH2-CH2-S-CH2CH2- и -CH2-S-CH2-CH2-NH-CH2-, -O-CH2-CH=CH-, -CH2-CH=C(H)CH2-O-CH2- и -S-CH2-C≡C-. Что касается гетероалкиленовых групп, гетероатомы могут также занимать любой или оба конца цепи (например, алкиленокси, алкилендиокси, алкиленамино, алкилендиамино и тому подобное).
Термины «алкокси», «алкиламино» и «алкилтио» (или тиоалкокси) используются в их традиционном смысле и относятся к таким алкильным группам, которые присоединены к остальной части молекулы через атом кислорода, аминогруппу или атом серы, соответственно. В дополнение к этому, относительно диалкиламиногрупп, алкильные части могут быть одинаковыми или разными и также могут объединяться с образованием 3-7- членного кольца с атомом азота, к которому каждая из них присоединяется. Соответственно, группа, представленная как -NRaRb, предназначается для включения пиперидинила, пирролидинила, морфолинила, азетидинила и тому подобного.
Термины «гало» или «галоген» сами по себе или как часть другого заместителя, означают, если не указано иное, атом фтора, брома или иода. В дополнение к этому, такие термины как «галоалкил» предназначаются для включения моногалоалкила и полигалоалкила. Например, термин «C1-4 галоалкил» включает трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и тому подобное.
Термин «арил» означает, если не указано иное, полиненасыщенную, как правило, ароматическую, углеводородную группу, которая может быть из одного или нескольких колец (до трех колец), которые конденсированы друг с другом или ковалентно связаны. Термин «гетероарил» относится к арильным группам (или кольцам), содержащим от одного до пяти гетероатомов, выбранных из N, O, и S, где атомы азота и серы необязательно окислены, и атом(ы) азота необязательно кватернизованы. Гетероарильная группа может быть присоединена к остальной части молекулы через гетероатом. Неограничивающие примеры арильных групп включают фенил, нафтил и бифенил, тогда как неограничивающие примеры гетероарильных групп включают пиридил, пиридазинил, пиразинил, пиримидинил, триазинил, хинолинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, бензотриазинил, пуринил, бензимидазолил, бензопиразолил, бензотриазолил, бензизоксазолил, изобензофурил, изоиндолил, индолизинил, бензотриазинил, тиенопиридинил, тиенопиримидинил, пиразолопиримидинил, имидазопиридинил, бензотиазолил, бензофуранил, бензотиенил, индолил, хинолил, изохинолил, изотиазолил, пиразолил, индазолил, птеридинил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, тиадиазолил, пирролил, тиазолил, фурил, тиенил и тому подобное. Заместители для каждой из приведенных выше арильных и гетероарильных кольцевых систем выбираются из группы подходящих заместителей, описанных ниже.
Для краткости термин «арил» при его использовании в сочетании с другими терминами (например, арилокси, арилтиокси, арилалкил) включает как арильные, так и гетероарильные кольца, как определено выше. Таким образом, «арилалкил» подразумевает включение таких радикалов, в которых арильная группа присоединяется к алкильной группе, которая присоединяется к остальной части молекулы (например, бензил, фенэтил, пиридилметил и тому подобное).
Вышеприведенные термины (например, «алкил», «арил» и «гетероарил») в некоторых вариантах осуществления будут включать и замещенные и незамещенные формы указанных радикалов. Предпочтительные заместители для каждого типа радикала представлены ниже. Для краткости, термины арил и гетероарил будут относиться и к замещенным, и к незамещенным вариантам, как указано ниже, в то время как термин «алкил» и родственные алифатические радикалы предназначены для обозначения незамещенного варианта, если не оговорено иное.
Заместителями для алкильных радикалов (включая группы, часто упоминаемые как алкилен, алкенил, алкинил и циклоалкил) могут быть различные группы, выбранные из галогена, -OR’, -NR’R”, -SR’, -SiR’R”R”’, -OC(O)R’, -C(O)R’, -CO2R’, -CONR’R”, -OC(O)NR’R”, -NR”C(O)R’, -NR’-C(O)NR”R”’, -NR”C(O)2R’, -NH-C(NH2)=NH, -NR’C(NH2)=NH, -NH-C(NH2)=NR’, -S(O)R’, -S(O)2R’, -S(O)2NR’R”, -NR’S(O)2R”, -CN и -NO2 в количестве, начиная от нуля до (2m’+1), где m’ представляет собой общее число атомов углерода в таком радикале. R’, R” и R”’ каждый независимо относится к водороду, незамещенному C1-8 алкилу, незамещенному гетероалкилу, незамещенному арилу, арилу, замещенному 1-3 галогенами, незамещенному C1-8 алкилу, C1-8 алкокси или C1-8 тиоалкокси группам, или незамещенным арил-C1-4 алкильным группам. Когда R’ и R” присоединяются к одному и тому же атому азота, они могут объединяться с этим атомом азота с образованием 3-, 4-, 5-, 6- или 7-членного кольца. Например, подразумевается, что -NR’R” охватывает 1-пирролидинил и 4-морфолинил. Термин “ацил” сам по себе или как часть другой группы относится к алкильному радикалу, в котором два заместителя на атоме углерода, который является ближайшим к точке прикрепления радикала, замещены заместителем =O (например, -C(O)CH3, -C(O)CH2CH2OR’ и тому подобные).
Аналогичным образом, заместители для арильных и гетероарильных групп разнообразны и, как правило, их выбирают из галогена, -OR’, -OC(O)R’, -NR’R”, -SR’, -R’, -CN, -NO2, -CO2R’, -CONR’R”, -C(O)R’, -OC(O)NR’R”, -NR”C(O)R’, -NR”C(O)2R’, -NR’-C(O)NR”R”’, -NH-C(NH2)=NH, -NR’C(NH2)=NH, -NH-C(NH2)=NR’, -S(O)R’, -S(O)2R’, -S(O)2NR’R”, -NR’S(O)2R”, -N3, перфтор(C1-C4)алкокси и перфтор(C1-C4)алкила, в количестве, начиная от нуля до общего числа открытых валентностей на ароматической кольцевой системе; и где R’, R” и R”’ независимо выбирают из водорода, C1-8 алкила, C3-6 циклоалкила, C2-8 алкенила, C2-8 алкинила, незамещенного арила и гетероарила, (незамещенного арил)-C1-4 алкила и незамещенного арилокси-C1-4 алкила. Другие подходящие заместители включают каждый из вышеуказанных арильных заместителей, присоединенных к кольцевому атому с помощью алкиленовой нити, имеющей от 1-4 атомов углерода.
Два из заместителей на соседних атомах арильного или гетероарильного кольца необязательно могут быть замещены заместителем формулы -T-C(O)-(CH2)q-U-, где T и U независимо являются -NH-, -O-, -CH2- или одинарной связью, и q является целым числом от 1 до 2. В альтернативном варианте два из заместителей на соседних атомах арильного или гетероарильного кольца необязательно могут быть замещены заместителем формулы -A-(CH2)r-B-, где A и B независимо являются -CH2-, -O-, -NH-, -S-, -S(O)-, -S(O)2-, -S(O)2NR’- или одинарной связью, и r является целым числом от 1 до 3. Одна из простых связей нового кольца, сформированного таким образом, может быть необязательно заменена двойной связью. В альтернативном варианте два из заместителей на соседних атомах арильного или гетероарильного кольца необязательно могут быть заменены заместителем формулы -(CH2)s-X-(CH2)t-, где s и t являются независимо целым числом от 1 до 3, и X является -O-, -NR’-, -S-, -S(O)-, -S(O)2- или -S(O)2NR’-. Заместитель R’ в -NR’- и -S(O)2NR’- выбирают из водорода или незамещенного C1-6 алкила.
Использованный в описании термин «гетероатом» включает кислород (O), азот (N), серу (S) и кремний (Si).
Для представленных в настоящем документе соединений связь, которая проходит от заместителя (как правило, R группы) к центру ароматического кольца (например, бензольного, пиридинового и тому подобного), следует понимать как связь, обеспечивающую соединение с любой из доступных вершин ароматического кольца. В некоторых вариантах осуществления описание будет также включать присоединение к кольцу, которое конденсировано с ароматическим кольцом. Например, связь, проходящая к центру бензольного участка индола, будет означать связь с любой доступной вершиной шести- или пятичленных кольцевых участков индола.
Термин «фармацевтически приемлемые соли» включает соли активных соединений, которые получаются при использовании относительно нетоксичных кислот или оснований, в зависимости от конкретных заместителей, обнаруживаемых в описанных в настоящем документе соединениях. Когда соединения по настоящему изобретению имеют относительно кислотные функциональные группы, могут быть получены соли присоединения основания путем контактирования нейтральной формы таких соединений с достаточным количеством желательного основания или в чистом виде беспримесном, или подходящем инертном растворителе. Примеры солей, полученных из фармацевтически приемлемых неорганических оснований, включают соли алюминия, аммония, кальция, меди, железные и железистые соли, соли лития, соли марганца, магния, марганцоватистые соли, соли натрия, цинка и тому подобные. Соли, полученные из фармацевтически приемлемых органических оснований, включают соли первичных, вторичных и третичных аминов, включая замещенные амины, циклические амины, природные амины и тому подобное, например аргинин, бетаин, кофеин, холин, N,N’-дибензилэтилендиамин, диэтиламин, 2-диэтиламинэтанол, 2-диметиламинэтанол, этаноламин, этилендиамин, н-этилморфолин, н-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперадин, полиаминные смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и тому подобное. Когда соединения по настоящему изобретению имеют относительно основные функциональные группы, соли присоединения кислоты могут быть получены путем контактирования нейтральной формы таких соединений с достаточным количеством желательной кислоты, или в чистом виде, или в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения кислоты включают соли, полученные из неорганических кислот, например хлористоводородной, бромистоводородной, азотной, угольной, моногидрогенугольной, фосфорной, моногидрогенфосфорной, дигидрогенфосфорной кислоты, серной, моногидрогенсерной, йодистоводородной или фосфористой кислоты и тому подобного, а также соли, полученные из относительно нетоксичных органических кислот, таких как уксусная, пропионовая, изомасляная, малоновая, бензойная, янтарная, пробковая, фумаровая, миндальная, фталевая, бензолсульфоновая, п-толуолсульфоновая, лимонная, виннокаменная, метансульфоновая и тому подобных. Также включены соли аминокислот, такие как аргинат и тому подобные, и соли органических кислот, например глюкуроновой или галактуроновой кислот и тому подобные (смотри, например, Berge, S.M., et al., “Pharmaceutical Salts”, Journal of Pharmaceutical Science, 1977, 66, 1-19). Некоторые отдельные соединения по настоящему изобретению имеют и основные, и кислотные функциональные группы, что позволяет соединению превращаться в соли присоединения основания или соли присоединения кислоты.
Нейтральные формы соединения могут быть восстановлены путем контактирования соли с основанием или кислотой и выделения исходного соединения обычными способами. Исходная форма соединения отличается от различных солевых форм определенными физическими свойствами, такими, как растворимость в полярных растворителях, а в остальном соли равноценны исходной форме соединения для целей настоящего изобретения.
В дополнение к солевым формам, настоящее раскрытие представляет соединения, которые находятся в форме пролекарств. Пролекарства соединений, описанных в этом документе, - это такие соединения, которые легко подвергаются химическим изменениям при физиологических условиях с высвобождением соединений по настоящему изобретению. В дополнение к этому, пролекарства могут превращаться в соединения по настоящему изобретению при помощи химических или биохимических методов в окружающей обстановке ex vivo. Например, пролекарства могут медленно превращаться в соединения по настоящему изобретению при помещении в резервуар трансдермального пластыря вместе с подходящим ферментом или химическим реагентом.
Некоторые соединения по настоящему изобретению могут существовать как в несольватированных формах, так и в сольватированных формах, включая гидратированные формы. В общем, сольватированные формы эквивалентны несольватированным формам и включены в объем настоящего изобретения. Некоторые соединения по настоящему изобретению могут существовать во множестве кристаллических или аморфных форм. В общем, все физические формы эквивалентны для вариантов применения, рассматриваемых в настоящем раскрытии, и включены в объем настоящего изобретения.
Некоторые соединения по настоящему изобретению обладают асимметричными атомами углерода (оптическими центрами) или двойными связями; рацематы, диастереомеры, геометрические изомеры, региоизомеры и оригинальные изомеры (например, разделенные энантиомеры) - все включены в объем настоящего изобретения. В том случае, когда соединения представлены в настоящем документе с установленной стереохимией (указанной как R или S, или со связью, обозначенной пунктиром или клином), такие соединения, как понятно специалисту в данной области техники, практически свободны от других изомеров (например, по меньшей мере, на 80%, 90%, 95%, 98%, 99% и вплоть до 100% не содержат другого изомера).
Соединения по настоящему изобретению также могут содержать необычные содержания атомных изотопов в одном или более атомов, которые образуют такие соединения. Несвойственные содержания изотопа могут находиться в пределах от количества, обнаруживаемого в природе, до количества, составляющего 100% атомов, о которых идет речь. Например, соединения могут включать радиоактивные изотопы, такие, как, например, тритий (3H), йод-125 (125I) или углерод-14 (14C), или нерадиоактивные изотопы, такие как дейтерий (2H) или углерод-13 (13C). Такие изотопные отклонения могут обеспечить дополнительную пользу к уже описанной в другом месте полезности в пределах данной заявки. Например, изотопные варианты соединений по изобретению могут иметь дополнительную область применения, включая, но не ограничиваясь этим, применение в качестве диагностических и/или визуализирующих реагентов, или в качестве цитотоксичных/радиотоксичных терапевтических средств. Кроме того, изотопные варианты соединений по данному раскрытию могут иметь модифицированные фармакокинетические и фармакодинамические характеристики, которые могут способствовать повышенной безопасности, переносимости или эффективности в ходе лечения. Все изотопные варианты соединений по настоящему изобретению, радиоактивные или нет, включены в объем настоящего изобретения.
Использованный в описании термин «селективный CCR4 антагонист» относится к высоко избирательному соединению, которое ингибирует активность CCR4 с небольшой перекрестной реактивностью в отношении нецелевых белков, таких как CCR1, CCR2, CCR3, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10, CCR12, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6 и/или CXCR7, или вовсе без нее. В некоторых вариантах осуществления «селективные CCR4 антагонисты» имеют значение IC50, которое по меньшей мере в 10; 100; 500; 1,000; 2,000; 5,000; или более раз ниже, чем аналогичное значение для таких белков, как CCR1, CCR2, CCR3, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10, CCR12, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6 и/или CXCR7 при измерении с помощью методов анализа, использованных в Примере 3 этой заявки. В некоторых вариантах осуществления «селективные CCR4 антагонисты» не ингибируют активность CCR1, CCR2, CCR3, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10, CCR12, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6 и/или CXCR7 при концентрациях 1 мкM или ниже согласно методам анализа, использованным в Примере 2 этой заявки. Вышеупомянутые белки считаются «неингибированными», когда они сохраняют 100%, 99%, 95%, 90% или 85% от активности в эталонных условиях с селективным CCR4 антагонистом.
Комбинированная терапия с использованием CCR4 антагонистов и одного или более ингибиторов иммунных контрольных точек
В настоящем документе представлены способы, композиции и наборы, которые используют преимущество синергетического действия CCR4 антагонистов и ингибиторов иммунных контрольных точек при лечении злокачественных новообразований. Комбинированное лечение, включающее и CCR4 антагонист, и один или более ингибиторов иммунных контрольных точек, более эффективно при лечении злокачественных новообразований по сравнению с каждым из этих видов лечения в отдельности.
В общем смысле злокачественные новообразования (рак) включают любые из различных злокачественных новообразований, характеризующихся пролиферацией анапластических клеток, которые проявляют тенденцию к проникновению в окружающую ткань и метастазированию в новые участки организма. Неограничивающие примеры различных типов злокачественных новообразований, подходящих для лечения с использованием композиций по настоящему изобретению, включают рак яичника, рак молочной железы, рак легких (такой как, немелкоклеточная карцинома легких), рак мочевого пузыря, рак щитовидной железы, рак легкого, рак плевры, рак поджелудочной железы, рак шейки матки, рак предстательной железы, рак яичка, рак толстого кишечника, рак анального канала, колоректальный рак, рак желчных протоков, гастроинтестинальные карциноидные опухоли, рак пищевода, рак желчного пузыря, рак прямой кишки, рак слепой кишки, рак тонкой кишки, рак желудка, рак почки (т.е. почечно-клеточную карциному), рак центральной нервной системы, рак кожи, хориокарциному, раки головы и шеи, рак кости, остеогенную саркому, фибросаркому, нейробластому, глиому, меланому, лейкемию (например, острый лимфоцитарный лейкоз, хронический лимфоцитарный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз или волосатоклеточный лейкоз), лимфому (например, неходжкинскую лимфому, лимфому Ходжкина, B-клеточную лимфому или лимфому Беркитта) и множественную миелому.
В некоторых вариантах осуществления злокачественное новообразование является раком легких (например, немелкоклеточной карциномой легких), меланомой, эпителиальным раком (например, раком предстательной железы, раком яичника, раком молочной железы) или раком крови (например, лейкемией, лимфомой, множественной миеломой).
В некоторых вариантах осуществления злокачественное новообразование является солидным раком. В некоторых вариантах осуществления злокачественное новообразование является раком поджелудочной железы. В некоторых вариантах осуществления злокачественное новообразование является раком толстого кишечника.
А. CCR4 Антагонисты
CCR4 антагонисты являются соединениями, снижающими или ингибирующими CCR4 активность. Существует целый ряд таких соединений, известных в данной области техники. В некоторых вариантах осуществления CCR4 антагонисты по настоящему изобретению являются селективными CCR4 антагонистами.
В некоторых вариантах осуществления CCR4 антагонист является низкомолекулярным CCR4-ингибитором, имеющим Формулу (I):
 (I)
(I)
и его фармацевтически приемлемой солью, где
R1 выбирают из водорода, C1-8 алкила, C1-8 галоалкила, C1-8 гидроксиалкила, C3-8 циклоалкила, галогена, -CN, -SO2Me и -C(O)NH2;
каждый R2 выбирают из C1-8 алкила, C1-8 галоалкила, галогена, -CN и C1-8 алкокси; или две R2 группы, связанные с соседними атомами углерода, необязательно объединяются с образованием 5 или 6-членного кольца (алифатического или ароматического, циклоалкильного или гетероциклоалкильного);
R3 выбирают из водорода, метила и C1-4 галоалкила;
R4 выбирают из водорода, C1-8 алкила, C1-8 галоалкила и C1-8 гидроксиалкила;
каждый из нижних индексов n независимо является целым числом от 0 до 3;
B является связью или C(O);
Q выбирают из C, CH, N, O, S, S(O) и SO2;
W, X, Y, и Z независимо выбирают из C, CH и N, но Q и W одновременно не являются N;
R5 и R6 отсутствуют или их независимо выбирают из H, -OH, C1-8 алкила, C1-8 гидроксиалкила, C1-4 алкокси-C1-4 алкила, -C(O)NRaRb, C1-8 алкилен-C(O)NRaRb, -NH-C1-4 алкилен-C(O)NRaRb, -C(O)-C1-4 алкилен-NRaRb, -CO2H и изостеров кислоты, C1-8 алкилен-CO2H и изостеров кислоты, -N(Ra)C(O)NRaRb, C1-8 алкилен-N(Ra)C(O)NRaRb, -NRaRb, C1-8 алкилен-NRaRb, C1-8 алкокси, -C(O)ORa, C1-8 алкилен-C(O)ORa, -CN, -C(O)Ra, -SO2Ra и -N(Ra)C(O)Rb;
где
каждый Ra и Rb независимо выбирают из водорода, C1-8 алкила, C1-8 гидроксиалкила, C1-8 галоалкила и C1-8 алкокси; и
R7 отсутствует или его выбирают из H, C1-8 алкила и C1-8 галоалкила.
В одной группе вариантов осуществления представленные в настоящем документе соединения являются такими соединениями, в которых X и Y одновременно не являются N. В другой группе вариантов осуществления R3 представляет собой H, и каждый R2 независимо выбирают из C1-8 алкила, C1-8 галоалкила, галогена и -CN.
В другой группе вариантов осуществления представленные в настоящем документе соединения имеют Формулу (Ia):
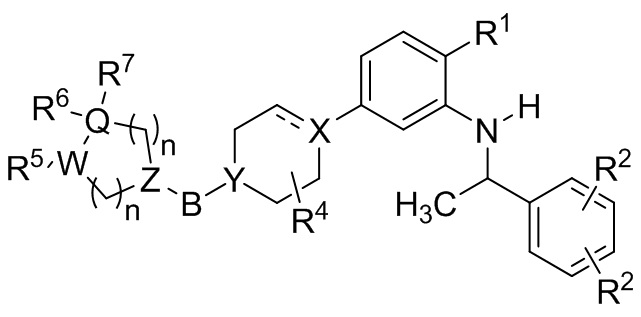 (Ia)
(Ia)
где каждый из R1, R2, R4, R5, R6, R7, X, Y, Z, W, Q, B и нижних индексов n представляет собой то, что описано для Формулы I. В выбранных вариантах осуществления X представляет собой C или CH.
В другой группе вариантов осуществления предоставленные в настоящем документе соединения имеют Формулу (Ib):
 (Ib)
(Ib)
где каждый R2 выбирают из C1-8 алкила, C1-8 галоалкила, галогена и –CN, и каждый из R1, R4, R5, R6, R7, X, Z, W, Q, B и нижних индексов n представляет собой то, что описано для Формулы I.
В другой группе вариантов осуществления представленные в настоящем документе соединения имеют Формулу (Ic):
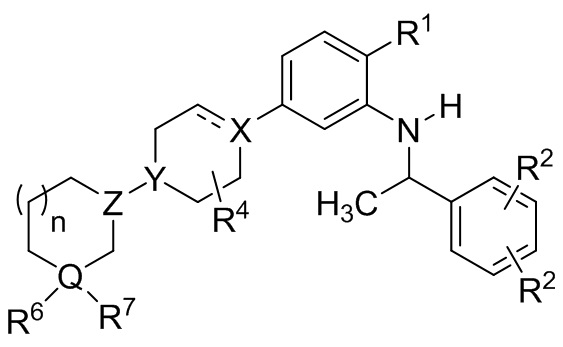 (Ic)
(Ic)
где каждый R2 выбирают из C1-8 алкила, C1-8 галоалкила, галогена и –CN; нижний индекс n представляет собой 0 или 1; и каждый из R1, R4, R6, R7, X, Y, Z и Q, представляет собой то, что описано для Формулы I. В выбранных вариантах осуществления n является 1, и R4 является водородом или метилом.
В другой группе вариантов осуществления представленные в настоящем документе соединения имеют Формулу (Id):
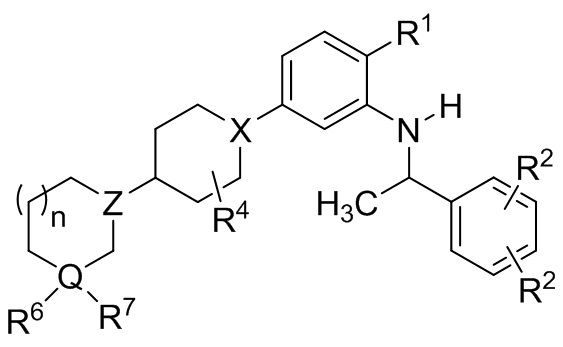 (Id)
(Id)
где каждый R2 является членом, выбранным из C1-8 алкила, C1-8 галоалкила, галогена и –CN; нижний индекс n представляет собой 0 или 1, и каждый из R1, R4, R6, R7, X, Z и Q являются такими, как описано для Формулы I. В некоторых выбранных вариантах осуществления n является 1, и R4 является водородом или метилом.
В другой группе вариантов осуществления представленные в настоящем документе соединения имеют Формулу (Ie):
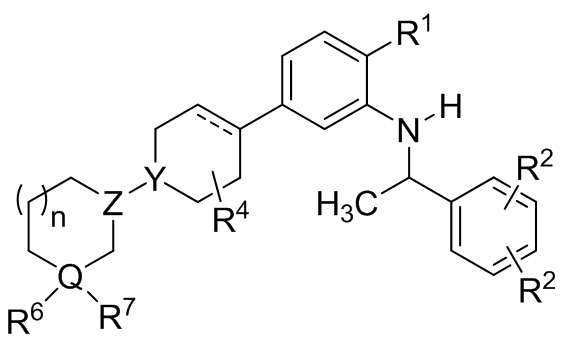 (Ie)
(Ie)
где каждый R2 выбирают из C1-8 алкила, C1-8 галоалкила, галогена и –CN; нижний индекс n представляет собой 0 или 1; и каждый из R1, R4, R6, R7, Y, Z, и Q являются таким, как описано для Формулы I. В некоторых выбранных вариантах осуществления n является 1, и R4 является водородом или метилом.
В другой группе вариантов осуществления представленные в настоящем документе соединения имеют Формулу (If):
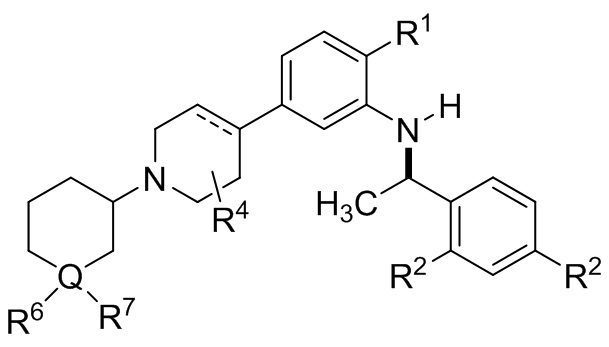 (If)
(If)
где каждый R2 выбирают из C1-8 алкила, C1-8 галоалкила, галогена и –CN; и каждый из R1, R4, R6, R7 и Q являются такими, как описано для Формулы I. В некоторых выбранных вариантах осуществления R4 является водородом или метилом.
В еще одних вариантах осуществления представлены соединения, имеющие Формулы (I), (Ia) и (Ib), включая отдельные варианты осуществления, представленные выше, где B является C(O). Более того, представлены соединения, в которых кольцо, имеющее Z в качестве вершины кольца, выбирают из пирролидина и пиперидина. В некоторых выбранных вариантах осуществления представлены соединения, в которых кольцо, имеющее Z в качестве вершины кольца, выбирают из пирролидин-2-ила и пиперидин-2-ила, и по меньшей мере один из R5, R6 и R7 не является водородом.
В других вариантах осуществления представлены соединения, имеющие Формулы (I), (Ia) и (Ib), включая отдельные варианты осуществления, представленные выше, где B является связью. В родственных вариантах осуществления B является связью, и кольцо, имеющее Z в качестве вершины кольца, выбирают из пирролидина, пиперидина и циклогексана. В отдельных вариантах осуществления B является связью, и кольцо, имеющее Z в качестве вершины кольца, выбирают из пирролидин-1-ила, пирролидин-2-ила, пиперидин-1-ила, пиперидин-2-ила, пиперидин-3-ила и циклогексана. В следующих вариантах осуществления B является связью, и кольцо, имеющее Z в качестве вершины кольца, выбирают из группы, состоящей из пирролидин-1-ила, пирролидин-2-ила, пиперидин-1-ила, пиперидин-2-ила, пиперидин-3-ила и циклогексана; и по меньшей мере один из R5, R6 и R7 не является водородом.
В одной группе вариантов осуществления Z представляет собой CH или N.
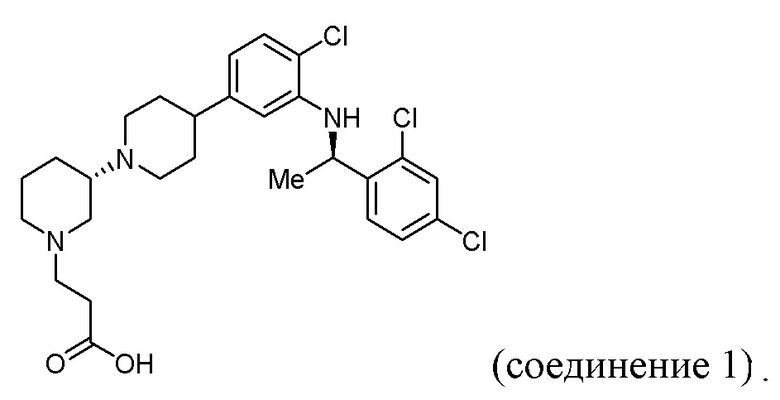
В некоторых вариантах осуществления CCR4 антагонист имеет формулу
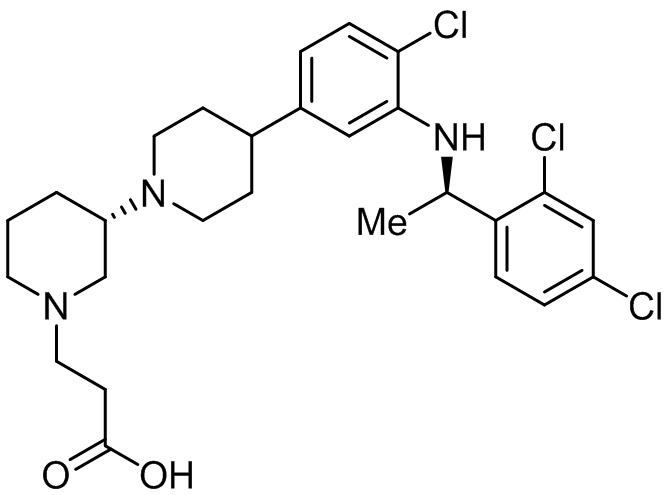 (Соединение 1)
(Соединение 1)
или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления CCR4 антагонист имеет формулу
 (Соединение 2)
(Соединение 2)
или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления CCR4 антагонист имеет формулу
 (Соединение 3)
(Соединение 3)
или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления CCR4 антагонист имеет формулу
 (Соединение 4)
(Соединение 4)
или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления CCR4 антагонист выбирают из соединения или фармацевтических композиций, раскрытых в WO 2013/082490 на имя ChemoCentryx, содержание которого включено в данное описание для любых целей.
В. Ингибиторы контрольных точек иммунитета
Иммунные контрольные точки являются сигнальными белками, которые стимулируют или ингибируют иммунный ответ. Композиции, нацеленные на иммунные контрольные точки, модулируют эти белки, чтобы изменить естественный иммунный ответ индивидуумов. Этот таргетированный подход является полезным, поскольку отдельные раковые клетки могут «обходить» эти контрольные точки, чтобы вообще ускользнуть от естественного иммунного ответа. Две конкретные иммунные контрольные точки представляют собой белок-1 запрограммированной смерти клеток (PD-1) и цитотоксический T-лимфоцит-ассоциированный белок 4 (CTLA-4).
PD-1 ингибиторы
Белок-1 запрограммированной смерти клеток (PD-1) является белком иммунной контрольной точки, чаще всего обнаруживаемым на T-клетках. В обычных условиях PD-1 связывается с его естественными лигандами PD-L1 и PD-L2, экспрессированными на поверхности разных клеток. В том случае, когда T-клетки находятся в связанном с лигандами состоянии, считается, они находятся в положении “выключено”. Примечательно, что число раковых клеток, экспрессирующих необычно высокие уровни PD-L1, означает, что T-клеточная активность и связанный с ней противораковый иммунный ответ является аномально подавленным. Крайне важно, что использование PD-1 ингибиторов, которые блокируют его взаимодействие с естественными лигандами, стимулирует иммунный ответ с целью оказания содействия в борьбе со злокачественным новообразованием.
PD-1 ингибиторы по настоящему изобретению включают малые молекулы и антитела.
В некоторых вариантах осуществления PD-1 ингибитор является низкомолекулярным PD-1/PD-L1 ингибитором.
В некоторых вариантах осуществления низкомолекулярный ингибитор PD-1/PD-L1 имеет Формулу:
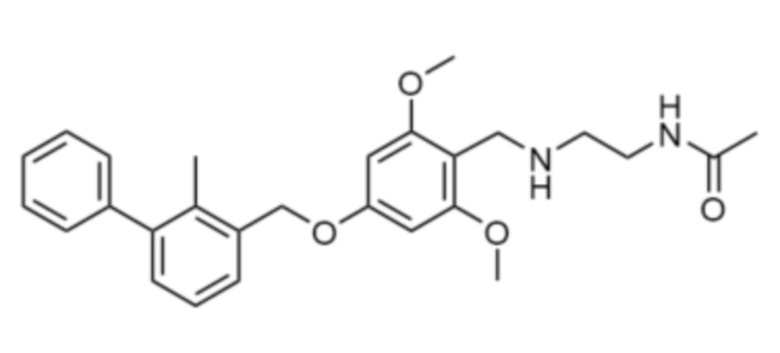 или
или 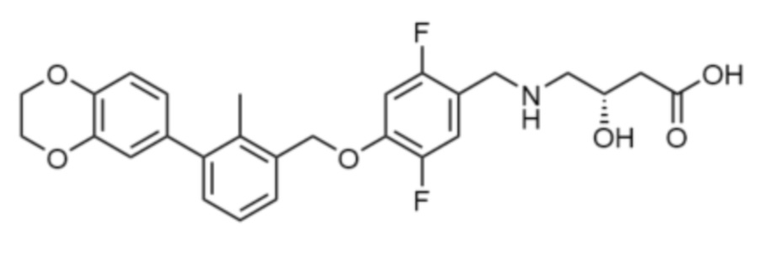 .
.
В некоторых вариантах осуществления низкомолекулярный ингибитор PD-1/PD-L1 представляет собой соединение, имеющее Формулу (II)
 (II),
(II),
или его фармацевтически приемлемую соль; при этом:
R1 выбирают из группы, состоящей из галогена, C5-8 циклоалкила, C6-10 арила и тиенила, где C6-10 арил и тиенил являются необязательно замещенными от 1 до 5 Rx заместителями;
каждый Rx независимо выбран из группы, состоящей из галогена, -CN, -Rc, -CO2Ra, -CONRaRb, -C(O)Ra, -OC(O)NRaRb, -NRbC(O)Ra, -NRbC(O)2Rc, -NRa-C(O)NRaRb, -NRaRb, -ORa, -O-X1-ORa, -O-X1-CO2Ra, -O-X1-CONRaRb, -X1-ORa, -X1-NRaRb, - X1-CO2Ra, -X1-CONRaRb, -SF5 и -S(O)2NRaRb, где каждый X1 является C1-4 алкиленом; каждый Ra и Rb независимо выбирают из водорода, C1-8 алкила и C1-8 галоалкила, или при присоединении к одному и тому же атому азота они могут объединяться с этим атомом азота с образованием пяти или шести-членного кольца, имеющего от 0 до 2 дополнительных гетероатомов, в качестве членов кольца, выбранных из N, O или S, при этом пяти- или шести-членное кольцо необязательно замещено оксогруппой; каждый Rc независимо выбран из группы, состоящей из C1-8 алкила, C2-8 алкенила, C2-8 алкинила и C1-8 галоалкила; и необязательно, когда два Rx заместителя находятся на соседних атомах, они объединены с образованием конденсированного пяти-, шести- или семи-членного карбоциклического или гетероциклического кольца, необязательно замещенного от 1 до 3 заместителями, выбранными из гало, оксогруппы, C1-8 галоалкила и C1-8 алкила;
каждый R2a, R2b и R2c независимо выбран из группы, состоящей из H, галогена, -CN, -Rd, -CO2Re, -CONReRf, -C(O)Re, -OC(O)NReRf, -NRfC(O)Re, -NRfC(O)2Rd, -NRe-C(O)NReRf, -NReRf, -ORe, -O-X2-ORe, -O-X2-NReRf, -O-X2-CO2Re, -O-X2-CONReRf, -X2-ORe, -X2-NReRf, -X2-CO2Re, -X2-CONReRf, -SF5, -S(O)2NReRf, C6-10 арила и C5-10 гетероарила, где каждый X2 является C1-4 алкиленом; каждый Re и Rf независимо выбирают из водорода, C1-8 алкила и C1-8 галоалкила, или при присоединении к одному и тому же атому азота они могут объединяться с этим атомом азота с образованием пяти- или шести-членного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O и S, и необязательно замещенных оксогруппой; каждый Rd независимо выбран из группы, состоящей из C1-8 алкила, C2-8 алкенила и C1-8 галоалкила;
R3 выбирают из группы, состоящей из -NRgRh и C4-12 гетероциклила, где C4-12 гетероциклил необязательно замещен 1-6 Ry;
каждый Ry независимо выбран из группы, состоящей из галогена, -CN, -Ri, -CO2Rj, -CONRjRk, -CONHC1-6 алкил-OH, -C(O)Rj, -OC(O)NRjRk, -NRjC(O)Rk, -NRjC(O)2Rk, CONOH, PO3H2, -NRj-C1-6 алкил-C(O)2Rk, -NRjC(O)NRjRk, -NRjRk, -ORj, -S(O)2NRjRk, -O-C1-6алкил-ORj, -O-C1-6 алкил-NRjRk, -O-C1-6 алкил-CO2Rj, -O-C1-6 алкил-CONRjRk, -C1-6 алкил-ORj, - C1-6 алкил-NRjRk, -C1-6 алкил-CO2Rj, -C1-6 алкил-CONRjRk и SF5,
где C1-6 алкильный участок Ry необязательно дополнительно замещен OH, SO2NH2, CONH2, CONOH, PO3H2, COO-C1-8алкилом или CO2H, где каждый Rj и Rk независимо выбран из водорода, C1-8 алкила, необязательно замещенного 1 - 2 заместителями, выбранными из OH, SO2NH2, CONH2, CONOH, PO3H2, COO-C1-8алкила или CO2H, и C1-8 галоалкила, необязательно замещенного 1-2 заместителями, выбранными из OH, SO2NH2, CONH2, CONOH, PO3H2, COO-C1-8алкила или CO2H, или при присоединении к одному и тому же атому азота Rj и Rk могут быть объединены с этим атомом азота с образованием пяти- или шести-членного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O или S, и необязательно замещенного оксогруппой; каждый Ri независимо выбран из группы, состоящей из –OH, C1-8 алкила, C2-8 алкенила и C1-8 галоалкила, каждый из которых необязательно может быть замещен OH, SO2NH2, CONH2, CONOH, PO3H2, COO-C1-8алкилом или CO2H;
Rg выбирают из группы, состоящей из H, C1-8 галоалкила и C1-8 алкила;
Rh выбирают из -C1-8 алкила, C1-8 галоалкила, C1-8 алкил-COOH, C1-8 алкил-OH, C1-8 алкил-CONH2, C1-8 алкил-SO2NH2, C1-8 алкил-PO3H2, C1-8 алкил-CONOH, C1-8 алкил-NRh1Rh2, -C(O)-C1-8алкил, -C(O)-C1-8алкил-OH, -C(O)-C1-8алкил-COOH, C3-10 циклоалкила, -C3-10 циклоалкил-COOH, -C3-10 циклоалкил-OH, C4-8 гетероциклила, -C4-8 гетероциклил-COOH, -C4-8 гетероциклил-OH, -C1-8 алкил-C4-8 гетероциклила, -C1-8 алкил-C3-10 циклоалкила, C5-10 гетероарила, -C1-8алкил-C5-10 гетероарила, C10 карбоциклила, -C1-8 алкил-C6-10 арила, -C1-8 алкил-(C=O)-C6-10 арила, -C1-8 алкил-NH(C=O)-C1-8 алкенила, -C1-8 алкил-NH(C=O)-C1-8 алкила, -C1-8 алкил-NH(C=O)-C1-8 алкинила, -C1-8 алкил-(C=O)-NH-C1-8 алкил-COOH и -C1-8 алкил-(C=O)-NH-C1-8 алкил-OH, необязательно замещенного CO2H; или
Rh, объединенный с N, к которому он присоединяется, является моно-, ди- или трипептидом, содержащим 1-3 природных аминокислоты и 0-2 неприродных аминокислоты, при этом
неприродные аминокислоты имеют альфа углеродный заместитель, выбранный из группы, состоящей из C2-4 гидроксиалкила, C1-3 алкил-гуанидинила и C1-4 алкил-гетероарила,
альфа-углерод каждой природной или неприродной аминокислоты необязательно дополнительно замещен метильной группой, и
концевой фрагмент моно-, ди- или трипептида выбирают из группы, состоящей из C(O)OH, C(O)O-C1-6 алкила и PO3H2, где
Rh1 и Rh2 каждый независимо выбран из группы, состоящей из H, C1-6 алкила и C1-4 гидроксиалкила;
C1-8 алкильные участки Rh необязательно дополнительно замещены 1-3 заместителями, независимо выбранными из OH, COOH, SO2NH2, CONH2, CONOH, COO-C1-8 алкила, PO3H2 и C5-6 гетероарила, необязательно замещенного 1 - 2 C1-3 алкильными заместителями.
C10 карбоциклильные, C5-10 гетероарильные и C6-10 арильные участки Rh необязательно замещены 1-3 заместителями, независимо выбранными из OH, B(OH)2, COOH, SO2NH2, CONH2, CONOH, PO3H2, COO-C1-8алкила, C1-4алкила, C1-4алкил-OH, C1-4алкил-SO2NH2, C1-4алкил CONH2, C1-4алкил-CONOH, C1-4алкил- PO3H2, C1-4алкил-COOH и фенила, и
C4-8 гетероциклильные и C3-10 циклоалкильные участки Rh необязательно замещены 1 - 4 Rw заместителями;
каждый Rw заместитель независимо выбран из C1-4 алкила, C1-4 алкил-OH, C1-4 алкил-COOH, C1-4 алкил-SO2NH2, C1-4 алкил CONH2, C1-4 алкил-CONOH, C1-4 алкил-PO3H, OH, COO-C1-8 алкила, COOH, SO2NH2, CONH2, CONOH, PO3H2 и оксогруппы;
R4 выбирают из группы, состоящей из O-C1-8 алкила, O-C1-8 галоалкила, O-C1-8 алкил-Rz, C6-10 арила, C5-10 гетероарила, -O-C1-4 алкил-C6-10арила и -O-C1-4 алкил-C5-10 гетероарила, где C6-10 арил и C5-10 гетероарил необязательно замещен 1 - 5 Rz;
каждый Rz независимо выбран из группы, состоящей из галогена, -CN, -Rm, -CO2Rn, -CONRnRp, -C(O)Rn, -OC(O)NRnRp, -NRnC(O)Rp, -NRnC(O)2Rm, -NRн-C(O)NRnRp, -NRnRp, -ORn, -O-X3-ORn, -O-X3-NRnRp, -O-X3-CO2Rn, -O-X3-CONRnRp, -X3-ORn, -X3-NRnRp, - X3-CO2Rn, -X3-CONRnRp, -SF5, -S(O)2RnRp, -S(O)2NRnRp и 3-7-членного карбоциклического или 4-7-членного гетероциклического кольца, при этом 3-7-членное карбоциклическое или 4-7-членное гетероциклическое кольцо необязательно замещены 1 - 5 Rt, где каждый Rt независимо выбран из группы, состоящей из C1-8 алкила, C1-8галоалкила, -CO2Rn, -CONRnRp, -C(O)Rn, -OC(O)NRnRp, -NRnC(O)Rp, -NRnC(O)2Rm, -NRн-C(O)NRnRp, -NRnRp, -ORn, -O-X3-ORn, -O-X3-NRnRp, -O-X3-CO2Rn, -O-X3-CONRnRp, -X3-ORn, -X3-NRnRp,- X3-CO2Rn, -X3-CONRnRp, -SF5 и -S(O)2NRnRp;
где каждый X3 является C1-4 алкиленом; каждый Rn и Rp независимо выбран из водорода, C1-8 алкила и C1-8 галоалкила, или при присоединении к одному и тому же атому азота может объединяться с атомом азота с образованием пяти- или шести-членного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O или S, и необязательно замещенного оксогруппой; каждый Rm независимо выбран из группы, состоящей из C1-8 алкила, C2-8 алкенила и C1-8 галоалкила; и необязательно когда два Rz заместителя находятся на соседних атомах, они могут объединяться с образованием конденсированного пяти- или шести-членного карбоциклического или гетероциклического кольца, необязательно замещенного оксогруппой;
n представляет собой 0, 1, 2 или 3;
каждый R5 независимо выбран из группы, состоящей из галогена, -CN, -Rq, -CO2Rr, -CONRrRs, -C(O)Rr, -OC(O)NRrRs, -NRrC(O)Rs, -NRrC(O)2Rq, -NRr-C(O)NRrRs,
-NRrRs, -ORr, -O-X4-ORr, -O-X4-NRrRs, -O-X4-CO2Rr, -O-X4-CONRrRs, -X4-ORr,
-X4-NRrRs, -X4-CO2Rr, -X4-CONRrRs, -SF5, -S(O)2NRrRs, где каждый X4 является C1-4 алкиленом; каждый Rr и Rs независимо выбран из водорода, C1-8 алкила и C1-8 галоалкила, или при присоединении к одному и тому же атому азота они могут объединяться с этим атомом азота с образованием пяти- или шести-членного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O или S, и необязательно замещенного оксогруппой; каждый Rq независимо выбран из группы, состоящей из C1-8 алкила и C1-8 галоалкила;
R6a выбирают из группы, состоящей из H, C1-4 алкила и C1-4 галоалкила;
каждый R6b независимо выбран из группы, состоящей из F, C1-4 алкила, O-Ru, C1-4 галоалкила, NRuRv, где каждый Ru и Rv независимо выбран из водорода, C1-8 алкила и C1-8 галоалкила, или при присоединении к одному и тому же атому азота может объединяться с атомом азота с образованием пяти- или шестичленного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O или S, и необязательно замещенного оксогруппой; и
m представляет собой 0, 1, 2, 3 или 4.
В некоторых вариантах осуществления соединение или его фармацевтически приемлемая соль имеет Формулу (IIa)
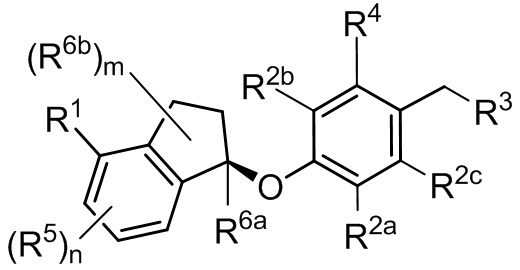 (IIa).
(IIa).
В некоторых вариантах осуществления соединение или его фармацевтически приемлемая соль имеет Формулу (IIb)
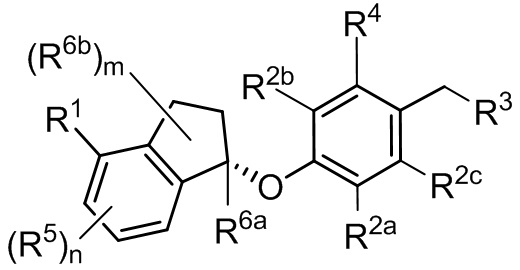 (IIb).
(IIb).
В некоторых вариантах осуществления R1 выбирают из группы, состоящей из фенила и тиенила, где фенил и тиенил необязательно замещены 1 - 5 Rx заместителями. В некоторых вариантах осуществления R1 является фенилом, необязательно замещенным 1 или 2 Rx, где каждый Rx независимо выбран из галогена, C1-8 алкила, O-C1-8 алкила, O-C1-8 галоалкила, -NRaRb и CN, и необязательно, когда два Rx заместителя находятся на соседних атомах, они объединяются с образованием конденсированного шестичленного гетероциклического кольца, необязательно замещенного 1-3 заместителями, независимо выбранными из оксогруппы, C1-8 галоалкила и C1-8 алкила. В некоторых вариантах осуществления R1 является фенилом, необязательно замещенным F. В некоторых вариантах осуществления R1 выбирают из группы, состоящей из:
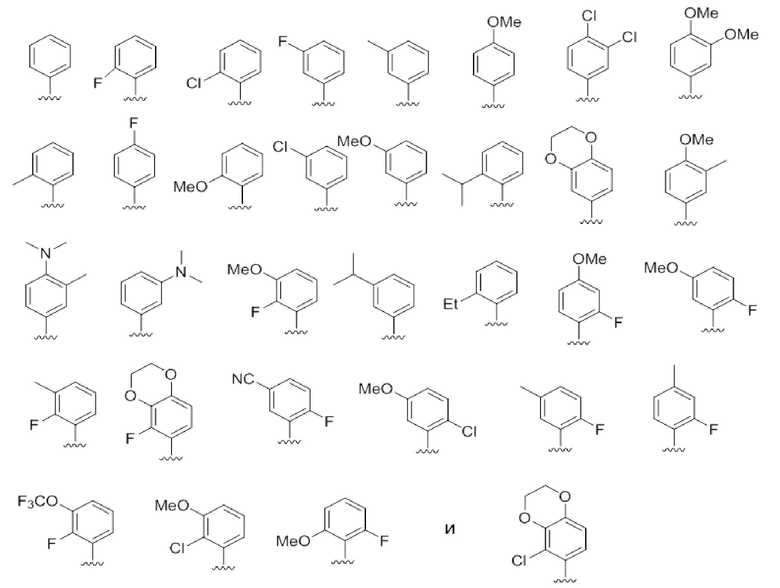
В некоторых вариантах осуществления каждый R2a, R2b и R2c независимо выбран из группы, состоящей из H, галогена, -CN, -Rd, -NReRf, -ORe, -X2-ORe, -X2-NReRf, где X2 является C1-4 алкиленом; каждый Re и Rf независимо выбран из водорода, C1-8 алкила и C1-8 галоалкила, или при присоединении к одному и тому же атому азота могут объединяться с этим атомом азота с образованием пяти- или шести-членного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O или S, и необязательно замещенного оксогруппой; каждый Rd независимо выбран из группы, состоящей из C1-8 алкила, C2-8 алкенила и C1-8 галоалкила. В некоторых вариантах осуществления R2b и R2c оба являются H, и R2a выбирают из группы, состоящей из галогена, C1-4 алкила, C2-4 алкенила, C1-3 галоалкила, -CN, -OMe и OEt. В некоторых вариантах осуществления R2b и R2c оба являются H, и R2a является галогеном. В некоторых вариантах осуществления R2b и R2c оба являются H, и R2a является Cl.
В некоторых вариантах осуществления n представляет собой 0, 1 или 2, и каждый R5 независимо выбран из группы, состоящей из галогена, -CN, -Rq, -NRrRs и -ORr, где каждый Rr и Rs независимо выбран из водорода, C1-8 алкила и C1-8 галоалкила и каждый Rq независимо выбран из группы, состоящей из C1-8 алкила и C1-8 галоалкила. В некоторых вариантах осуществления n является 0.
В некоторых вариантах осуществления R6a является H. В некоторых вариантах осуществления m является 0. В некоторых вариантах осуществления m является 1, и R6b выбирают из группы, состоящей из F, C1-4 алкила, O-Ru, C1-4 галоалкила и NRuRv, где каждый Ru и Rv независимо выбран из водорода, C1-8 алкила и C1-8 галоалкила. В некоторых вариантах осуществления m является 1, и R6b является F.
В некоторых вариантах осуществления  является
является  или
или  .
.
В некоторых вариантах осуществления  является
является 
В некоторых вариантах осуществления R4 выбирают из группы, состоящей из O-C1-4 алкила, O-C1-6 алкил-Rz, C6-10 арила, C5-10 гетероарила, -O-C1-4 алкил-C6-10арила и -O-C1-4 алкил-C5-10 гетероарила, где C6-10 арил и C5-10 гетероарил необязательно замещены 1 - 2 Rz, где каждый Rz независимо выбран из группы, состоящей из галогена, -CN, -Rm, -CO2Rn, -CONRnRp, -C(O)Rn, -OC(O)NRnRp, -NRnC(O)Rp, -NRnC(O)2Rm, -NRn-C(O)NRnRp, -NRnRp, -ORn, -S(O)2NRnRp, 3-7-членного карбоциклического кольца и 4-7-членного гетероциклического кольца, где 3-7-членное карбоциклическое или 4-7-членное гетероциклическое кольцо необязательно замещены 1-2 Rt, где каждый Rt независимо выбран из группы, состоящей из C1-8 алкила, C1-8галоалкила, -CO2Rn, -CONRnRp, -C(O)Rn, -OC(O)NRnRp, -NRnC(O)Rp, -NRnC(O)2Rm, -NRн-C(O)NRnRp, -NRnRp, -ORn и -S(O)2NRnRp. В некоторых вариантах осуществления R4 выбирают из группы, состоящей из O-C1-4 алкила, O-C1-6 алкил-CN, фенила, пиридинила, -O-C1-2 алкил-пиридинила, -O-C1-2 алкил-пиримидинила, -O-C1-2 алкил-пиридазинила и -O-C1-2 алкил-фенила, где пиридинил, фенил, пиримидинил и пиридазинил необязательно замещен 1 - 2 Rz, где каждый Rz независимо выбран из группы, состоящей из галогена, -CN, -CO2Rn, -NRnRp, -ORn и пиперидинила, необязательно замещенного OH.
В некоторых вариантах осуществления R4 выбирают из группы, состоящей из
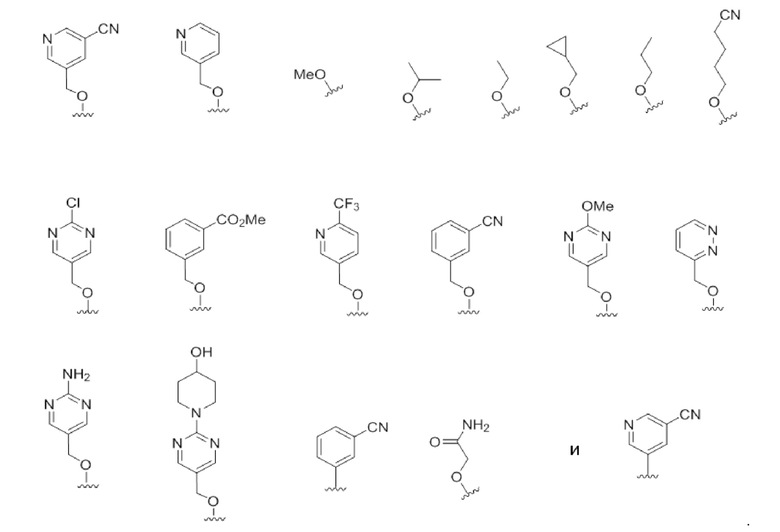
В некоторых вариантах осуществления R4 является 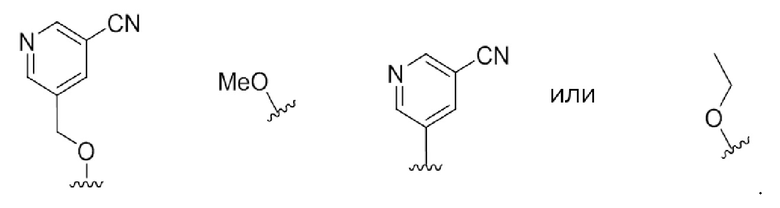
В некоторых вариантах осуществления R3 выбирают из группы, состоящей из NRgRh и C4-6гетероциклила, где C4-6 гетероциклил необязательно замещен 1 - 3 Ry, где Rg выбирают из группы, состоящей из H, C1-8 галоалкила и C1-8 алкила, и где Rh является -C1-8 алкилом, замещенным 1 - 3 заместителями, независимо выбранными из OH, COOH, SO2NH2, CONH2, CONOH, COO-C1-8 алкила, C5-6 гетероарила, C5-6 гетероциклила и PO3H2, где C5-6 гетероарил и C5-6 гетероциклил необязательно замещены 1 - 3 заместителями, независимо выбранными из OH, B(OH)2, COOH, SO2NH2, CONH2, CONOH, PO3H2, COO-C1-8алкила, C1-4алкила, C1-4алкил-OH, C1-4алкил-SO2NH2, C1-4алкил CONH2, C1-4алкил-CONOH, C1-4алкил-PO3H2 и C1-4алкил-COOH, и где C5-6 гетероциклил необязательно дополнительно замещен оксогруппой. В некоторых вариантах осуществления R3 выбирают из группы, состоящей из азетидинила, пирролидинила и пиперидинила, где азетидинил, пирролидинил или пиперидинил присоединен через атом азота, и где азетидинил, пирролидинил или пиперидинил необязательно замещен 1 - 3 Ry, где каждый Ry независимо выбран из группы, состоящей из -CO2H, CONOH, PO3H2, OH, SO2NH2, CONH2 и COO-C1-8алкила. В некоторых вариантах осуществления R3 является NHRh, где Rh является -C1-8 алкилом, замещенным 1 - 2 заместителями, независимо выбранными из OH, COOH, CONH2, PO3H2, тетразолила, тетразолонила и пиразолила. В некоторых вариантах осуществления R3 выбирают из группы, состоящей из
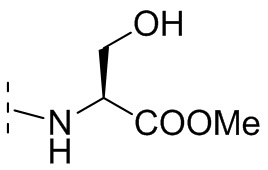

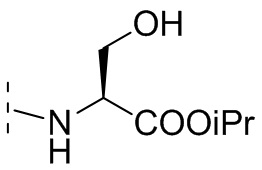


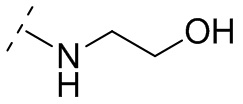


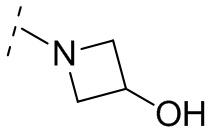
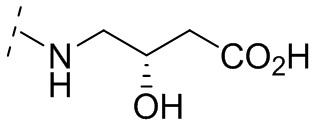

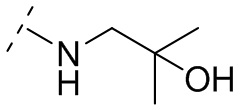
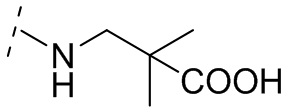
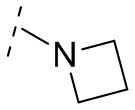


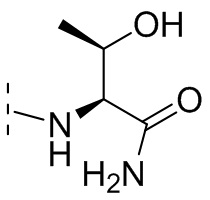

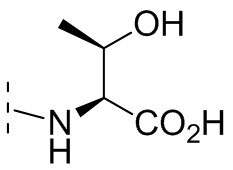
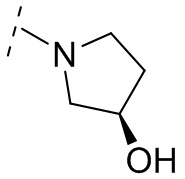


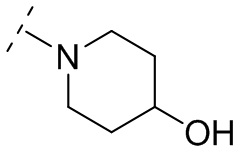
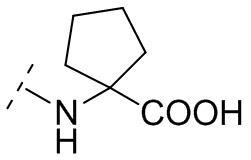
 и
и 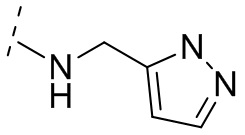
В некоторых вариантах осуществления R3 является -NRgRh. В некоторых вариантах осуществления Rh, объединенный с N, к которому он присоединен, является моно-, ди- или трипептидом, содержащим 1-3 природных аминокислот и 0-2 неприродных аминокислот, где
неприродные аминокислоты имеют альфа углеродный заместитель, выбранный из группы, состоящей из C2-4 гидроксиалкила, C1-3 алкил-гуанидинила и C1-4 алкил-гетероарила,
альфа углерод каждой природной или неприродной аминокислоты необязательно дополнительно замещен метильной группой, и
концевой фрагмент моно-, ди- или трипептида выбирают из группы, состоящей из C(O)OH, C(O)O-C1-6 алкила и PO3H2.
В некоторых вариантах осуществления каждая природная аминокислота Rh независимо выбрана из группы, состоящей из серина, аланина, глицина, лизина, аргинина, треонина, фенилаланина, тирозина, аспартата, аспарагина, гистидина и лейцина.
В некоторых вариантах осуществления R1 является фенилом, необязательно замещенным 1 - 3 Rx, R6a является H, R4 выбирают из группы, состоящей из O-C1-4 алкила, O-C1-6 алкил-CN, фенила, пиридинила, -O-C1-2 алкил-пиридинила, -O-C1-2 алкил-пиримидинила, -O-C1-2 алкил- пиридазинила и -O-C1-2 алкил-фенила, где пиридинил, фенил, пиримидинил и пиридазинил необязательно замещены 1 - 2 Rz, где каждый Rz независимо выбран из группы, состоящей из галогена, -CN, -CO2Rn,-NRnRp, -ORn и пиперидинила, необязательно замещенного OH, и R3 выбирают из группы, состоящей из NRgRh и C4-6гетероциклила, где C4-6 гетероциклил является необязательно замещенным 1 - 3 Ry, где Rg выбирают из группы, состоящей из H, C1-8 галоалкила и C1-8 алкила, и где Rh является -C1-8 алкилом, замещенным 1 - 3 заместителями, независимо выбранными из OH, COOH, SO2NH2, CONH2, CONOH, COO-C1-8 алкила, C5-6 гетероарила, C5-6 гетероциклила и PO3H2, где C5-6 гетероарил и C5-6 гетероциклил необязательно замещены 1 - 3 заместителями, независимо выбранными из OH, B(OH)2, COOH, SO2NH2, CONH2, CONOH, PO3H2, COO-C1-8алкила, C1-4алкила, C1-4алкил-OH, C1-4алкил-SO2NH2, C1-4алкил CONH2, C1-4алкил-CONOH, C1-4алкил-PO3H2 и C1-4алкил-COOH, и где C5-6 гетероциклил является дополнительно необязательно замещенным оксогруппой.
В некоторых вариантах осуществления R1 является фенилом, необязательно замещенным 1 или 2 Rx, где каждый Rx независимо выбран из галогена, C1-8 алкила, O-C1-8 алкила, O-C1-8 галоалкила, -NRaRb и CN, где R2b и R2c являются оба H, R2a выбирают из группы, состоящей из галогена, C1-4 алкила, C1-3 галоалкила, -CN, -OMe и OEt, R6a является H, m является 0, n является 0, R4 является  и R3 выбирают из группы, состоящей из NHRh, азетидинила, пирролидинила и пиперидинила, где азетидинил, пирролидинил или пиперидинил присоединен через атом азота, и где азетидинил, пирролидинил или пиперидинил необязательно замещен 1 - 3 Ry, где каждый Ry независимо выбран из группы, состоящей из CO2H, CONOH, PO3H2, OH, SO2NH2, CONH2 и COO-C1-8алкила, и где Rh является C1-8 алкилом, замещенным 1 - 2 заместителями, независимо выбранными из OH, COOH, CONH2, PO3H2, тетразолила, тетразолонила и пиразолила. В одном варианте осуществления R2a является галогеном.
и R3 выбирают из группы, состоящей из NHRh, азетидинила, пирролидинила и пиперидинила, где азетидинил, пирролидинил или пиперидинил присоединен через атом азота, и где азетидинил, пирролидинил или пиперидинил необязательно замещен 1 - 3 Ry, где каждый Ry независимо выбран из группы, состоящей из CO2H, CONOH, PO3H2, OH, SO2NH2, CONH2 и COO-C1-8алкила, и где Rh является C1-8 алкилом, замещенным 1 - 2 заместителями, независимо выбранными из OH, COOH, CONH2, PO3H2, тетразолила, тетразолонила и пиразолила. В одном варианте осуществления R2a является галогеном.
В некоторых вариантах осуществления низкомолекулярный PD-1/PD-L1 ингибитор выбирают из соединения или фармацевтических композиций, раскрытых в WO 2018/005374, поданном от имени ChemoCentryx 26 июня 2017, содержание которого полностью включается в описание для любых целей.
В некоторых вариантах осуществления PD-1 ингибитор является антителом. В некоторых вариантах осуществления PD-1 ингибирующее антитело выбирают из Ниволумаба, Пембролизумаба и Пидилизумаба. В некоторых вариантах осуществления PD-1 ингибирующее антитело представляет собой Ниволумаб. В некоторых вариантах осуществления PD-1 ингибирующее антитело представляет собой Пембролизумаб. В некоторых вариантах осуществления PD-1 ингибирующее антитело представляет собой Пидилизумаб.
PD-1 ингибиторы по настоящему изобретению можно получить с использованием известных в данной области техники способов. Например, человеческие моноклональные антитела согласно раскрытию можно получить, используя мышей SCID, в которых были восстановлены иммунные клетки человека, так что после иммунизации может быть индуцировано образование человеческих антител. Такие мыши описаны, например, в патентах США № 5,476,996 и 5,698,767 на имя Wilson et al. PD-1 ингибиторы по настоящему изобретению могут быть созданы с целью задержать разложение соединения или антитела или с целью минимизировать иммуногенность этого антитела. Для достижения этих целей в данной области техники существует целый ряд методов.
CTLA-4 ингибиторы
Цитотоксический T-лимфоцит-ассоциированный белок 4 (CTLA-4) представляет собой белок иммунной контрольной точки, чаще всего экспрессируемый активированными T-клетками. Подобно PD-1, CTLA-4 действует как негативный регулятор T-клеточной иммунной функции. В присутствии ингибиторов CTLA-4 негативная регуляция уменьшается, при этом противоопухолевая активность T-клеток увеличивается.
В некоторых вариантах осуществления CTLA-4 ингибитор является антителом. В некоторых вариантах осуществления CLTA-4 ингибиторное антитело имеет аффинность связывания около 108 M−1 или больше. В некоторых вариантах осуществления CLTA-4 ингибиторное антитело имеет аффинность связывания около 109 M−1 или больше. В некоторых вариантах осуществления CTLA-4 ингибиторное антитело ингибирует связывание человеческого CTLA-4 с B7-1 или с B7-2.
В некоторых вариантах осуществления CTLA-4 ингибиторное антитело выбирают из Ипилимумаба, Тремелимумаба, AGEN1884 и AGEN2041. В некоторых вариантах осуществления CTLA-4 ингибирующее антитело представляет собой Ипилимумаб. В некоторых вариантах осуществления CTLA-4 ингибирующее антитело представляет собой Тремелимумаб. В некоторых вариантах осуществления CTLA-4 ингибирующее антитело представляет собой AGEN1884. В некоторых вариантах осуществления CTLA-4 ингибирующее антитело представляет собой AGEN2041.
В некоторых вариантах осуществления CTLA-4 ингибитор выбирают из соединения или фармацевтической композиции, раскрытых в WO/2009/100140 или WO 2017/194265, содержание которых полностью включается в настоящий документ для любых целей.
CTLA-4 ингибиторы по настоящему изобретению могут быть получены с использованием методов, известных в данной области техники. Например, человеческие моноклональные антитела согласно данному раскрытию можно получить, используя мышей SCID, в которых были введены иммунные клетки человека, так что после иммунизации может быть индуцировано образование человеческих антител. Такие мыши описаны, например, в патентах США № 5,476,996 и 5,698,767 на имя Wilson et al. CTLA-4 ингибиторы по настоящему изобретению могут быть созданы с целью задержки разложения соединения или антитела или с целью минимизировать иммуногенность этого антитела. Для достижения этих целей в данной области техники существует целый ряд методов.
Способы введения комбинированной терапии
В другом аспекте настоящее раскрытие предлагает комбинированную терапию для лечения злокачественного новообразования. Такая комбинированная терапия включает терапевтически эффективное количество CCR4 антагониста и терапевтически эффективное количество одного или более ингибиторов иммунных контрольных точек. В некоторых вариантах осуществления один или более ингибиторов иммунных контрольных точек представляют собой PD-1 ингибитор. В некоторых вариантах осуществления один или более ингибиторов иммунных контрольных точек представляют собой CTLA-4 ингибитор. В некоторых вариантах осуществления один или более ингибиторов иммунных контрольных точек представляют собой PD-1 ингибитор и CTLA-4 ингибитор. Комбинация терапевтических средств действует синергетически, приводя к эффекту лечения или предотвращения злокачественного новообразования.
Термин «терапевтически эффективное количество» означает такое количество обсуждаемого соединения, которое будет вызывать биологический или медицинский ответ клетки, ткани, системы или животного, например человека, ожидаемый исследователей, ветеринаром, врачом или другим провайдером лечения.
В зависимости от статуса заболевания и состояния субъекта, соединения, антитела и композиции по настоящему изобретению могут вводиться пероральным, парентеральным путем (например, с помощью внутримышечной, внутрибрюшинной, внутривенной, интрацеребровентрикулярной (ICV), интрацистернальной инъекции или инфузии, подкожной инъекции или подкожного имплантата), ингаляционным, назальным, вагинальным, ректальным, подъязычным или местным способами введения. В дополнение к этому, соединения и антитела могут быть включены в состав (по отдельности или вместе) подходящих стандартных лекарственных форм, содержащих общепринятые нетоксичные фармацевтически приемлемые носители, адъюванты и носители, соответствующие каждому способу введения. Настоящее раскрытие также предусматривает введение соединений и антител по настоящему изобретению в виде композиций с пролонгированным действием.
Понятно, что конкретный уровень дозировки и частота дозирования для любого отдельного пациента могут варьироваться и будут зависеть от целого ряда факторов, включая активность конкретного применяемого соединения, метаболическую стабильность и продолжительность действия такого соединения, возраст, масса тела, наследственные характеристики, общее состояние здоровья, пол, диету, способ и время введения, скорость выведения, комбинацию лекарственных средств, тяжесть определенного состояния и проводимую терапию.
Комбинированная терапия включает совместное введение CCR4 антагониста и одного или более ингибиторов иммунных контрольных точек, последовательное введение CCR4 антагониста и одного или более ингибиторов иммунных контрольных точек, введение композиции, содержащей CCR4 антагонист и один или более ингибиторов иммунных контрольных точек, или одновременное введение отдельных композиций, так что одна композиция содержит CCR4 антагонист, и одна или более композиций содержат один или более ингибиторов контрольных иммунных точек. Следует понимать, что в вариантах осуществления, где вводятся два ингибитора контрольных иммунных точек, каждый ингибитор контрольных иммунных точек может входить в состав отдельной композиции или может быть создан в виде единичной стандартной лекарственной формы.
Совместное введение включает введение CCR4 антагониста по настоящему изобретению в пределах 0,5, 1, 2, 4, 6, 8, 10, 12, 16, 20 или 24 часов после введения одного или более ингибиторов иммунных контрольных точек по настоящему изобретению. Совместное введение также включает введение одновременно, приблизительно одновременно (например, в течение примерно 1, 5, 10, 15, 20 или 30 минут друг за другом) или последовательно в любом порядке. Более того, каждый CCR4 антагонист и один или более ингибиторов иммунных контрольных точек может вводиться один раз в день или два, три или больше раз в день, для того чтобы обеспечить предпочтительный уровень дозирования в день.
Наборы
В некоторых аспектах в настоящем документы предлагаются наборы, содержащие CCR4 антагонист и один или более ингибиторов иммунных контрольных точек, которые являются полезными для лечения злокачественного новообразования. Набор может содержать фармацевтическую композицию, содержащую соединение-антагонист CCR4, например, низкомолекулярный ингибитор CCR4, и одну или более фармацевтических композиций, содержащих ингибиторы иммунных контрольных точек, например анти-PD-1 ингибитор и/или анти-CTLA-4 ингибитор. В некоторых случаях набор включает текстовые материалы, например, инструкции по использованию соединения, антитела или их фармацевтической композиции. Без ограничения, набор может содержать буферы, разбавители, фильтры, иглы, шприцы и листки-вкладыши с инструкциями в отношении осуществления любых способов, раскрытых в настоящем документе.
Примеры
Пример 1. Антагонизм C-C Хемокинового рецептора 4 (CCR4) повышает эффективность ингибирования контрольных точек на мышиных опухолевых моделях (краткое описание)
Хемокины и их рецепторы влияют на многие значимые процессы при злокачественных новообразованиях: они действуют не только на инфильтрацию лейкоцитов, но также на фибробласты, эндотелиальные клетки и непосредственно на некоторые типы опухолевых клеток. Было обнаружено, что C-C хемокиновый рецептор 4 (CCR4) и его лиганды сильно экспрессированы во многих типах опухолей человека и ассоциируются с плохим прогнозом. Было продемонстрировано, что CCR4 антагонизм уменьшает рост опухоли на многих мышиных моделях опухолей. В данной работе мы оцениваем низкомолекулярное ингибирование CCR4 в качестве терапевтического средства для усиления эффектов ингибиторов контрольных точек на опухолевых моделях CT26 и KCM.
Методы
Подкожную модель рака толстого кишечника CT26 и ортотопическую модель KCM рака поджелудочной железы использовали для оценки эффектов CCR4 ингибитора, Соединения 1, в комбинации с анти-CTLA-4 антителом (BioXcell: анти-мышиный CTLA-4 (клон: 9H10), индуцированные в сирийском хомячке и очищенные с помощью G белка). Клетки CT26 имплантировали в бок самкам мышей Balb/c 9-недельного возраста. Мышей разбивали на исследуемые группы, исходя из размера опухоли на 6 день, и вводили дозы Соединения 1 и анти-CTLA-4, начиная с 7 Дня. Что касается ортотопической модели рака поджелудочной железы, KCM клетки имплантировали непосредственно в поджелудочную железу, и дозирование Соединения 1 и анти-CTLA-4 также начинали на День 7. Соединение 1 вводили перорально два раза в день в дозе 30мг/кг, и анти-CTLA-4 дозировали внутрибрюшинно (IP) в Дни 7, 11 и 15 в дозе 100мкг/мышь.
Результаты
Блокада CCR4 существенно увеличивала терапевтические эффекты анти-CTLA-4 на обеих моделях. Комбинированный анти-CTLA-4/CCR4 ингибитор значительно уменьшал размер опухоли и увеличивал долю «долгожителей» на модели CT26. Противоопухолевый ответ был CT26-специфическим; выжившие в течение долгого периода времени особи были резистентны к повторной инокуляции CT26 клеток (без дополнительного дозирования какого-либо лекарственного средства), однако 4T1 опухоли молочной железы значительно вырастали в ходе испытания на мышах, переживших CT26. Мыши с регрессией опухолей демонстрировали большой процент CD8 T-клеток, которые распознавали CT26-специфический неоантиген, что проиллюстрировано с помощью окрашивания AH1 пептид-MHC тетрамером.
Несмотря на то, что длительная выживаемость еще не исследовалась на KCM модели, Соединение 1, использованное индивидуально, значительно уменьшало массу опухоли в 3 независимых исследованиях. Анти-CTLA-4, используемые индивидуально, обеспечивали существенное ингибирование роста опухоли на этой модели, которое дополнительно усиливалось Соединением 1.
Пример 2. Соединение 1 является высокоактивным и высокоспецифичным CCR4 ингибитором
Селективность Соединения 1 была протестирована путем определения значения IC50 в отношении разнообразной панели рецепторов, ферментов и ионных каналов. Было обнаружено, что Соединение 1 является высокоспецифичным для CCR4. Смотри, Таблицу 1.
Таблица 1. Селективность Соединения 1
Активность связывания Соединения 1 у людей и мышей представлена в таблице 2.
Таблица 2. Межвидовая активность
(нM)
(нM)
Пример 3. Комбинированная терапия с использованием KCM ортотопической модели опухоли поджелудочной железы
Как коротко описано в Примере 1 выше, KCM модель рака поджелудочной железы использовали для оценки эффективности CCR4 ингибитора в комбинации с анти-CTLA-4 антителом. Дизайн исследования показан на фиг. 1. Мышей разбили на 4 группы (n = 12 в каждой группе): изотипическое антитело + носитель; изотипическое антитело + Соединение 1; анти-CTLA-4 + носитель; анти-CTLA-4 + Соединение 1. Использовали самок мышей C57BL/6 7-8-недельного возраста. Анти-CTLA-4 (BioXcell: анти-мышиный CTLA-4 (Clone: 9H10), индуцированные в сирийском хомячке, очищенные с помощью G белка) и изотипически сходное контрольное антитело инъецировали внутрибрюшинно в дозе 100 мкг/мышь в Дни 7, 11 и 16. Соединение 1 (40 мг/кг) и носитель дозировали после инъекции (p.i.) два раза в день. Клетки KCM в матригеле инъецировали в поджелудочную железу.
После завершения исследования измеряли массу опухоли/поджелудочной железы в каждой группе. Результаты показаны на фиг. A-C. Как видно на этих фигурах, Соединение 1 в отдельности или в комбинации с анти-CTLA-4 уменьшало массу опухоли на опухолевой модели KCM. На этой модели у большинства мышей развилась вторичная опухоль на брюшной стенке около места надреза. Эти вторичные опухоли были иссечены, а масса этих опухолей была включена в общую массу опухолей плюс массу поджелудочной железы. Первичные опухоли взвешивали вместе с поджелудочной железой, поскольку их невозможно было разделить хирургическим путем. Масса селезенки также уменьшалась при воздействии Соединением 1. Соответствующие уровни соединения были подтверждены путем измерения концентраций соединения в плазме на День 12.
Изменения в популяциях супрессорных иммунных клеток также были измерены при завершении этого исследования. На 25 день после инокуляции KCM клеток первичную опухоль (вместе с поджелудочной железой) и вторичную опухоль извлекали, измельчали и расщепляли с помощью коллагеназы D для анализа иммунных клеток с использованием проточной цитометрии. Поджелудочные железы от ложнооперированных мышей были обработаны и проанализированы. Результаты, с точки зрения изменений в T-регуляторных клетках, G-MDSC и M-MDSC из обрабатываемого материала, показаны на фиг. 3A-F. Эти клеточные популяции показаны как количество клеток на грамм ткани (Панели A-C) или как процент CD45+ клеток (Панели D-F). Хотя изменений на T-регуляторных (CD4+/FoxP3+) клетках и не наблюдалось, как моноцитарные, так и гранулоцитарные миелоидные супрессорные клетки (mMDSC - CD11b+/Ly6G-/Ly6C-высокий, gMDSC - CD11b+/Ly6G+/Ly6C-низкий) продемонстрировали тенденцию к уменьшению при лечении a-CTLA-4/Соединением 1 в сравнении с a-CTLA-4 лечением в отдельности.
Пример 4. Комбинированная терапия с использованием CT26 модели рака толстого кишечника.
Как кратко описано в Примере 1 выше, CT26 модель рака толстого кишечника использовали для оценки эффективности CCR4 ингибитора в комбинации с анти-CTLA-4 антителом. Дизайн исследования представлен на фиг. 4. Мышей разделили на 4 группы (n = 12 в каждой группе): изотипическое антитело + носитель; изотипическое антитело + Соединение 1; анти-CTLA-4 + носитель; анти-CTLA-4 + Соединение 1. Использовали самок мышей C57BL/6 7-8-недельного возраста. Анти-CTLA-4 (BioXcell: анти-мышиный CTLA-4 (клон: 9H10), индуцированные в сирийском хомячке и очищенные с помощью G белка), и изотипически сходное контрольное антитело инъецировали внутрибрюшинно в дозе 100 мкг/мышь на день 7, 11 и 16. Соединение 1 (40мг/кг) и носитель дозировали после инъекции (p.i.) два раза в день. В начале исследования CT25 клетки инъецировали подкожно (s.c.).
Объем опухолей и процент выживаемости контролировали на всем протяжении исследования. Уровень выживаемости представлен в виде графика на фиг. 5, и средний объем опухоли представлен на графике на фиг. 6. Как можно видеть на фиг. 6, комбинация Соединения 1 с анти-CTLA-4 уменьшала рост опухоли и повышала выживаемость. Индивидуальные размеры опухолей каждой лечебной группы показаны на фиг. 7 A-D. Отметим, что отдельные мыши в группе aCTLA-4 + носитель (Панель C) имеют опухоли, которые полностью невосприимчивы к лечению aCTLA-4, в то время как все опухоли были чувствительны к комбинации aCTLA+Соединение 1 (Панель D).
Через три месяца после последнего дозирования мышам с полной регрессией опухоли, которых ранее лечили a-CTLA-4 (6 мышей) или a-CTLA-4/Соединением 1 (8 мышей), повторно инокулировали CT26 опухолевые клетки подкожно в левый бок, и этим мышам также были введены 4T1 клетки рака молочной железы мыши подкожно в правый бок. Результаты показаны на фиг. 8 A-F. Как можно видеть на этой фигуре, у 1 из 6 мышей, которых ранее лечили a-CTLA-4 (Панель A), развились CT26 опухоли (Панель B), тогда как ни у одной из 8 мышей, ранее леченных a-CTLA-4/Соединением 1, не наблюдалось развития опухоли. У всех 6 мышей, которых ранее лечили a-CTLA-4, развились 4T1 опухоли (Панель D), тогда как у 2 из 8 мышей, ранее леченных a-CTLA-4/Соединением 1, не наблюдалось развития 4T1 опухоли (Панель E). У всех 5 интактных мышей развились и CT26, и 4T1 опухоли (Панели C и F).
Клетки крови мышей, показанных на фиг. 8, окрашивали флуоресцентно-меченым AH1 пептидом до и через 7 дней после повторного введения CT26. AH1 является иммунодоминантным пептидом в случае ответа цитотоксических Т-клеток против CT26 опухолевых клеток, причем он метит CT26 антиген-реактивные CD8+ T-клетки. Анализ с помощью проточной цитометрии этих образцов показан на фиг. 9 A-C. Эти CT26 антиген-реактивные CD8+ T-клетки в основном отсутствуют в периферической крови интактных мышей, но присутствуют в большом количестве у большинства выживших CT26 мышей даже через 3 месяца после последнего дозирования (Панель A и B). Повторное введение CT26 клеток дополнительно повышало количество этих клеток у выживших мышей от предыдущего лечения, однако оказывало минимальное воздействие на интактных мышей (Панель C).
Хотя вышеизложенное изобретение описано довольно подробно путем приведения иллюстраций и Примеров с целью лучшего понимания, специалисту в данной области техники будет понятно, что на практике в пределах прилагаемых пунктов формулы изобретения могут быть сделаны некоторые изменения и модификации. Кроме того, каждая ссылка, представленная в настоящем документе, полностью включена в описание путем отсылки в той мере, как если бы каждая такая ссылка была индивидуально включена посредством отсылки. В том случае, когда имеется конфликт между настоящей заявкой и представленной в описании ссылкой, приоритет будет иметь настоящая заявка.



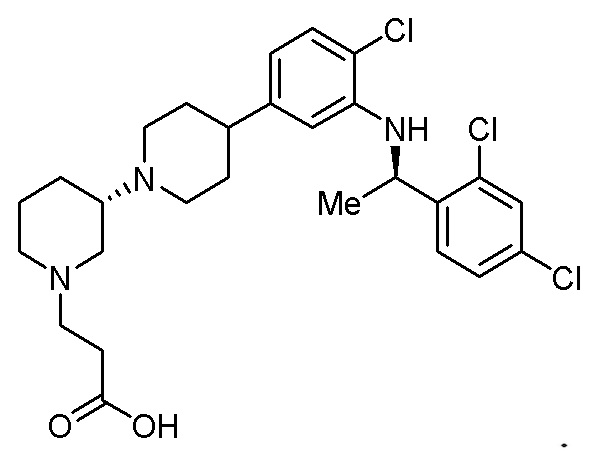
Группа изобретений относится к фармацевтической промышленности, а именно к способу лечения злокачественного новообразования у млекопитающего, включающему введение эффективного количества антагониста C-C хемокинового рецептора 4 (CCR4 антагонист) и антитела к цитотоксическому T-лимфоцит-ассоциированному белку 4 (анти-CTLA-4 антитело); а также к применению комбинации CCR4 антагониста и анти-CTLA-4 антитела в качестве терапевтических средств в указанном способе лечения. При этом в предложенных способе и применении CCR4 антагонист представляет собой соединение 1
Группа изобретений обеспечивает повышение эффективности лечения злокачественных новообразований по сравнению с одним или более ингибиторами контрольных точек, используемыми отдельно. 2 н. и 9 з.п. ф-лы, 26 ил., 2 табл., 4 пр.
1. Способ лечения злокачественного новообразования у млекопитающего, включающий введение эффективного количества антагониста C-C хемокинового рецептора 4 (CCR4) и антитела к цитотоксическому T-лимфоцит-ассоциированному белку 4 (CTLA-4), где CCR4 антагонист представляет собой соединение 1
2. Способ по п. 1, в котором указанное анти-CTLA-4 антитело выбрано из группы, состоящей из Ипилимумаба, Тремелимумаба, AGEN1884, и AGEN2041.
3. Способ по п. 1, в котором указанное анти-CTLA-4 антитело представляет собой Ипилимумаб.
4. Способ по п. 1, в котором указанное анти-CTLA-4 антитело представляет собой Тремелимумаб.
5. Способ по п. 1, в котором указанное анти-CTLA-4 антитело представляет собой AGEN1884.
6. Способ по п. 1, в котором указанное анти-CTLA-4 антитело представляет собой AGEN2041.
7. Способ по любому из пп. 1-6, в котором указанное злокачественное новообразование является солидным раком.
8. Способ по п. 7, в котором указанный рак является раком толстой кишки.
9. Способ по п. 7, в котором указанный рак является раком поджелудочной железы.
10. Способ по любому из пп. 1-9, в котором указанное млекопитающее является человеком.
11. Применение комбинации антагониста C-C хемокинового рецептора 4 (CCR4) и антитела к цитотоксическому T-лимфоцит-ассоциированному белку 4 (CTLA-4) в качестве терапевтических средств в способе лечения злокачественного новообразования у млекопитающего согласно любому из пп. 1-10.
| WO 2018101448 A1, 07.06.2018 | |||
| RU 2014128513 A, 10.02.2016 | |||
| SATO T | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| Держатель для поленьев при винтовом колуне | 1920 |
|
SU305A1 |
| US 20180072740 A1, 15.03.2018 | |||
| US 20180162846 A1, 14.06.2018. | |||
Авторы
Даты
2023-12-28—Публикация
2019-08-28—Подача