Изобретение относится к медицине и может быть использовано при направленной регенерации тканей для лечения костного дефекта в эксперименте.
В основе метода направленной регенерации тканей лежит принцип оптимизации формирования свободного пространства между поверхностью кости в области имплантата или костного дефекта и мягкими тканями над ними [Gottlow J, Nyman S, Lindhe J, Karring T, Wennstrom J. New attachment formation in the human periodontium by guided tissue regeneration. Case reports. J Clin Periodontol, 1986; 13:604-16] путем физического отделения анатомических образований (части десны от кости или имплантата) друг от друга мембранным материалом.
Известен способ, заключающийся в том, что материал в виде тефлоновой пластины помещали между мягкими тканями и костным дефектом и через несколько месяцев после операции авторы наблюдали замещение костного дефекта новой костной тканью. Авторы способа выдвинули идею, согласно которой новая костная ткань будет успешно восстанавливаться (направляться), если костный дефект изолируется от мягкой соединительной ткани каким-либо материалом [Gottlow J, Nyman S, Lindhe J, Karring T, Wennstrom J. New attachment formation in the human periodontium by guided tissue regeneration. Case reports. J Clin Periodontol, 1986; 13:604-16].
При восстановлении костных дефектов пародонтальной ткани наибольшее распространение получили резорбируемые мембраны на основе коллагена.
К резорбируемым мембранам относят мембраны на основе биоматериалов и некоторых полимеров (например, полимеров молочной кислоты).
Однако основным недостатком тефлоновой мембраны, как и других мембран, выполненных из полимерных нерассасывающихся материалов, является необходимость их удаления через определенный промежуток времени, что требует повторного оперативного вмешательства и может привести к осложнениям [Cortellini Р, Pini Prato GP, Baldi С, Clauser С.Guided tissue regeneration with different materials. International Journal of Periodontics and Restorative Dentistry 1990; 10:137-51].
Известен способ хирургического лечения костной атрофии альвеолярного отростка. Способ заключается в следующем; под местной анестезией (например Sol Tiocaini 2%) производят разрез слизистой оболочки по межзубным промежуткам и формируют слизисто-надкостный лоскут, деэпителизируют разрез, из костных карманов удаляют грануляции и вводят искусственную мембрану на основе гидроксиапатита. При вертикальной и горизонтальной атрофии на 1-2 межзубных промежутка мембрану укладывают с вестибулярной и оральной сторон. Мембрану фиксируют швами к слизисто-надкостничному лоскуту. Лоскут укладывают на место. Рану ушивают. В качестве мембраны используют композицию, содержащую карбоксиметилцеллюлозу, гидроксиапатит и дистиллированную воду [Патент RU №2124321, 1999 г.].
Недостатками данного способа является то, что матрица мембраны выполнена перфорированной, что снижает ее барьерную функцию.
В качестве прототипа по наиболее близкой технической сущности нами выбран способ замещения костных дефектов челюстей, заключающийся в том, что на всю область костного дефекта, а также на его вестибулярную, внутриротовую и проксимальные поверхности накладывают резорбируемую синтетическую мембрану, выполненную в виде пленки «Диплен», содержащую гидроксиапатит, путем введения в пленку композиционной структуры, состоящей из 60 мас. % гидроксиапатита и 40 мас. % бета-трикальцийфосфата.
Пленка должна перекрывать область костного дефекта на 3 мм по всему периметру. При области костного дефекта, превышающего по площади 30 мм2, дополнительно в полость костного дефекта вводят остеопластический материал. При деструктивных воспалительных процессах в периапикальных тканях в композиционную структуру мембраны может быть дополнительно включено до 0,05 мг/см2 противовоспалительных средств [Патент RU 2276587, 2006 г.]. Способ, выбранный в качестве прототипа, обеспечивает ускорение процесса регенерации костной ткани, а также возможность замещения костных дефектов различной площади.
Недостатками способа, выбранного нами в качестве прототипа, являются: недостаточно эффективная фиксация мембраны к костным краям дефекта, а также затрудненность прорастания сосудистой ткани во второй стадии репаративного остеогенеза, что затрудняет полноценное созревание костного регенерата кортикальной пластинки. Противопоказанием к введению данной мембраны является частая непереносимость антибактериальных компонентов мембраны.
Техническим результатом изобретения является повышение эффективности фиксации мембраны к костным краям дефекта, а также эффективности прорастания сосудистой ткани во второй стадии репаративного остеогенеза, что позволит повысить качество созревания костного регенерата, а также расширение контингента пациентов за счет гипоаллергенности резорбируемой синтетической мембраны, выполненной в виде пленки.
Технический результат изобретения достигается тем, что резорбируемая синтетическая мембрана, выполненная в виде пленки, используемая в способе лечения костного дефекта в эксперименте, выполнена на основе композиции поливиниловых спиртов разной степени омыления с добавлением фуллерренов С60 в следующем соотношении, мас. %:
Перед наложением вышеуказанной пленки на костный дефект на ее поверхность, соприкасающуюся с костным дефектом, наносят гель, выполненный на основе композиции поливиниловых спиртов разной степени омыления с добавлением фуллерренов С60 в следующем соотношении, мас. %:
причем по всей поверхности вышеуказанной пленки выполняют перфорированные отверстия, и после ее наложения на костный дефект, на гель, выступивший из перфорированных отверстий в вышеуказанной пленке, и по ее краям наносят загуститель до образования пластилинообразной массы геля, причем загуститель представляет собой порошкообразный 100% недоомыленный поливиниловый спирт.
Способ осуществляется следующим образом:
Для наложения на костный дефект резорбируемой синтетической мембраны, выполненной в виде перфорированной пленки на основе поливинилового спирта (ПВС) с добавлением фуллеренов С60, выполняют критический пропил в бедре крысы 2×15 мм (ГОСТ ISO 10993-6-2011-6). На поверхность вышеуказанной перфорированной пленки, соприкасающейся с костным дефектом, превышающей размер дефекта на 1-2 мм, наносят гель и распределяют равномерно на толщину 2-3 мм. После этого перфорированную пленку укладывают на дефект гелем вниз. После этого на гель, выступивший из перфорированных отверстий в вышеуказанной пленке, и по ее краям наносят загуститель до образования пластилинообразной массы геля. Гель, сохраняя пластичность, приобретает консистенцию пластилина. Рану ушивают послойно. Животных выводят из опыта на 42-е сутки. Фрагменты бедренной кости отправляют на морфологическое исследование.
Резорбируемая синтетическая мембрана, выполненная в виде пленки на основе поливинилового спирта (ПВС) с добавлением фуллеренов С60, имеет состав, мас. %:
Гель имеет состав, мас. %:
Загуститель представляет собой порошкообразный 100% недоомыленный поливиниловый спирт.
Причинно-следственная связь между существенными отличительными признаками и достигаемым техническим результатом:
- Резорбируемая синтетическая мембрана выполнена в виде пленки, основой которой является композиция поливиниловых спиртов разной степени омыления с добавлением фуллерренов С60 в следующем соотношении, мас. %:
Из всех водорастворимых (а потому и растворимых в биологически активных водных средах) синтетических полимеров, по своей химической природе нетоксичными и обладающими управляемостью целевых потребительских свойств посредством регулирования их физико-химических параметров, лишь поливиниловый спирт (ПВС) соответствуют вышеуказанным свойствам. При этом в отношении ПВС существует определенная настороженность, т.к. водные растворы полимера обладают ярко выраженной нестабильностью в связи с морфологическими изменениями макромолекул, стремящихся к кристаллизации. Скорость процесса сближения фрагментов макромолекул увеличивается благодаря водородным связям между гидроксильными группами самих молекул и их же с гидроксилами воды. Однако именно эти «негативное свойство» ПВС мы и использовали, чтобы управлять скоростью растворения, и, главное, получать нестареющие растворы.
ПВС получают из его аналога - поливинилацетата (ПВА). Поэтому при синтезе (гидролизе ПВА - омылении) можно создать условия, в которых часть ацетатных групп ПВА окажутся негидролизированными, и такой ПВС утратит способность кристаллизоваться. При этом полимер с остаточными ацетатными группами, в отличие от глубоко гидролизированного, улучшает и ускоряет свою растворимость в воде. Смешением двух типов ПВС в водных растворов нам удалось получить композицию, регулируемую по скорости растворения в водных средах [Патент РФ №2 574 257, 2016]. Установлено, что практически можно достигнуть неограниченной совместимости двух видов ПВС (в разумных концентрационных пределах - суммарно порядка 15 мас %) введением в систему углеродных нанотел - фуллеренов С60 [Зыбина О.А., Варламов А. В., Мнацаканов С.С. Проблемы технологии коксообразующих огнезащитных покрытий. Санкт-Петербургский государственный университет кино и телевидения. Санкт-Петербург. Венгерович Н.Г. Патогенетическое обоснование применения биоактивных наноматериалов при раневом процессе. Диссертация на соискание ученой степени кандидата медицинских наук. Санкт-Петербург 2011: Раневой процесс: нанобиотехнологии оптимизации. Под ред. Д.м.н., профессора В.А. Попова. СпецЛит 2013].
Соотношение компонентов пленки подобрано экспериментально.
- По всей поверхности пленки выполняют перфорированные отверстия.
Пластина к 3-4 неделе становится проницаемой для прорастающих сосудов, благодаря выполненной в ней перфорации, что обеспечивает полноценный остеогенез.
- Перед наложением пленки на костный дефект на ее поверхность, соприкасающуюся с костным дефектом, наносят гель, выполненный на основе композиции поливиниловых спиртов разной степени омыления с добавлением фуллерренов С60 в следующем соотношении, мас. %:
Соотношение компонентов геля также способствует стабильности его во времени и последующей биорезорбции. Соотношение его компонентов подобрано экспериментально. К 2-4 неделе происходит биодеградация геля.
Резорбция пленки и геля осуществляется в разные сроки. В первой стадии репаративного остеогенеза перфорации в пленке заполнены гелем, что обеспечивает надлежащее выполнение барьерной функции самой пластины. Гель по краям пластины обеспечивает ее плотное прилегание к костным краям, что также способствует выполнение барьерной функции самой пластины.
Высокое сродство ПВС и костной ткани обусловлено безукоризненной возможностью образования при их контакте сильных межмолекулярных взаимодействий типа водородных связей между функциональными группами коллагена - более всего пептидными (амидными), т.е. их фрагментами: карбонильными(-С=0), аминными (-NH) и гидроксильными (-ОН) ПВС:
 и
и 
Таким образом, осуществляется адгезия геля к костным краям.
- После наложения резорбируемой синтетической мембраны на костный дефект на гель, выступивший из перфорированных в вышеуказанной мембране отверстий, по ее краям наносят загуститель до образования пластилинообразной массы геля. Загуститель, представляет собой порошкообразный 100% недоомыленный поливиниловый спирт.
Загуститель позволяет установить прочную связь между перфорированной пластиной и самим гелям, который становится похож на пластилин и в последующем образует желеобразную массу.
Общеизвестно, что репаратиный остеогенез имеет следующие стадии:
Первая фаза - происходят процессы заполнения костного дефекта фибриноэпителиальным пробкой и фибриноваскулярной тканью. Это является фазой формирования первичной костной мозоли и процесс идет в течение 7-14 дней.
Вторая фаза-процесс ремоделирования (обновления), который длится от 2 до 4 недель. Он сопровождается резорбцией костной ткани клетками остеоцитами и образованием новой костной ткани остеобластами (моделирование) в течение 4 месяцев.
Третья фаза-остеорепарации. Это процесс минерализация, коллагенного матрикса. Длительность которого в течение нескольких месяцев.
Процесс остеорепарации заканчивается ремоделированием через 1-1,5 года.
Очень важно, что на первой стадии резорбируемая составная мембрана, выполненная в виде пленки, герметично за счет геля «закупоривает» дефект, выполняя барьерную фукцию. Высокое сродство ПВС и костной ткани обусловлено безукоризненной возможностью образования при их контакте сильных межмолекулярных взаимодействий типа водородных связей между функциональными группами коллагена - более всего пептидными (амидными), т.е. их фрагментами: карбонильными(-С=0), аминными (-NH) и гидроксильными (-ОН) ПВС:
 и
и
Через 2-2.5 недели гель большей частью резорбируется. При этом перфорированная пластина помогает сохранить форму альвеолярного отростка, не препятствуя врастанию вновь образуемых сосудов в костный регенерат. Ко времени 3-4 стадии происходит резорбция составной мембраны.
Это позволяет обеспечить физиологические условия для направленного роста костной ткани и преодолеть недостатки прототипа. В первой стадии препятствовать опережающему росту эпителия, а в последующем способствовать полноценной регенерации кости.
Совокупность существенных отличительных признаков является новой и повышает эффективность фиксации мембраны к костным краям дефекта, а также эффективность прорастания сосудистой ткани во второй стадии репаративного остеогенеза, что повышает качество созревания костного регенерата. При дальнейшем предполагаемом использовании в клинической практике возможно расширение контингента пациентов за счет гипоаллергенности резорбируемой синтетической мембраны, выполненной в виде пленки.
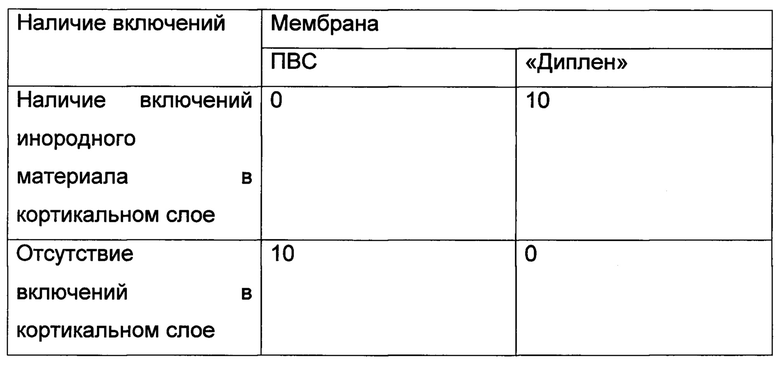
Полученные результаты, приведенные в таблице 1 (достигнутый уровень односторонней значимости 0,000<0,005) доказывают, что на уровне значимости 0,005 нулевая гипотеза отвергается. Таким образом, можно считать, что частота встречаемости инородного материала в кортикальном слое статистически значимо выше для мембраны «Диплен», чем для мембраны «Муплен» (различия выходят за границы случайности).
Таблица 1. Сравнение вновь образованного кортикального слоя при использовании резорбируемой мембраны на основе ПВС и резорбируемой мембраны на основе пленки «Диплен»
Таким образом, совокупность существенных отличительных признаков является новой и повышает эффективность фиксации мембраны к костным краям дефекта, а также эффективность прорастания сосудистой ткани во второй стадии репаративного остеогенеза, что повышает качество созревания костного регенерата. При дальнейшем предполагаемом использовании в клинической практике возможно расширение контингента пациентов за счет гипоаллергенности резорбируемой синтетической мембраны, выполненной в виде пленки.
Пример конкретного выполнения способа: Пример 1. Крыса №67, самка вес 190 гр, под наркозом Ketamini 50 mg на критичный распил 2×15 мм в левое бедро по заявляемому способу введена резорбируемая мембрана в виде пленки на основе ПВС, в правое - резорбируемая мембрана в виде пленки «Диплен» по прототипу. На 42 день животное выведено из опыта путем передозировки Теобромата натрия. Участки бедренных костей отправлены на гистологическое исследование.
Исследование проводилось на 10 крысах линии Вистер (Таблица 1) в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных целей (Council of the Europian Communities Directive 86/609/EES) (Страсбург, 1986) и требованиями «Правил проведения работ с использованием экспериментальных животных» М3 РФ ГОСТ ISO 10993-6-2011-6. Животные были здоровы, имели ветеринарный сертификат качества и состояния здоровья и находились в идентичных условиях кормления и содержания. Крыс содержали в клетках по 7-8 особей в условиях искусственного освещения (по 12 часов светлого и темного времени), принудительной 12-кратной в час вентиляции, при температуре 18-20°С и относительной влажности 50-65%, на подстилке из древесных стружек, простерилизованных в сухожаровом шкафу. Животные имели свободный доступ к корму (использовался стандартный брикетированный корм) и питьевой воде.
Таким образом, заявляемый способ лечения костного дефекта в эксперименте повышает эффективность фиксации мембраны к костным краям дефекта, а также эффективность прорастания сосудистой ткани во второй стадии репаративного остеогенеза, что повышает качество созревания костного регенерата. При дальнейшем предполагаемом использовании в клинической практике возможно расширение контингента пациентов за счет гипоаллергенности резорбируемой синтетической мембраны, выполненной в виде пленки.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения композиции на основе смеси водорастворимых полимеров | 2016 |
|
RU2660033C2 |
| Способ восстановления диафизов длинных трубчатых костей с применением клеточных технологий | 2020 |
|
RU2750021C1 |
| БИОСОВМЕСТИМАЯ КОМПОЗИЦИЯ ДЛЯ ВОСПОЛНЕНИЯ (ЛЕЧЕНИЯ) ЧАСТИЧНЫХ И ПОЛНЫХ ДЕФЕКТОВ ХРЯЩЕВОЙ И КОСТНОЙ ТКАНИ И СПОСОБ ПОЛУЧЕНИЯ БИОСОВМЕСТИМОЙ КОМПОЗИЦИИ ДЛЯ ВОСПОЛНЕНИЯ (ЛЕЧЕНИЯ) ЧАСТИЧНЫХ И ПОЛНЫХ ДЕФЕКТОВ ХРЯЩЕВОЙ И КОСТНОЙ ТКАНИ | 2008 |
|
RU2385727C1 |
| Способ регенерации костной ткани челюстей | 2019 |
|
RU2709723C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИФФУЗИОННЫХ ФУЛЛЕРЕНОЛСОДЕРЖАЩИХ МЕМБРАН | 2012 |
|
RU2501597C1 |
| Способ направленной регенерации костной ткани, применяемый при хирургии дефектов сложной конфигурации | 2020 |
|
RU2748959C1 |
| КОМПОЗИЦИЯ - ОСТЕОИНДУКТОР И ОСТЕОКОНДУКТОР, ПРИ ЛЕЧЕНИИ КОСТНОЙ ПАТОЛОГИИ В СТОМАТОЛОГИИ И ЧЕЛЮСТНО-ЛИЦЕВОЙ ХИРУРГИИ, И СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ - ОСТЕОИНДУКТОРА И ОСТЕОКОНДУКТОРА, ПРИ ЛЕЧЕНИИ КОСТНОЙ ПАТОЛОГИИ В СТОМАТОЛОГИИ И ЧЕЛЮСТНО-ЛИЦЕВОЙ ХИРУРГИИ | 2008 |
|
RU2383564C1 |
| СПОСОБ АДРЕСНОЙ ДОСТАВКИ ОСТЕОПЛАСТИЧЕСКИХ МАТЕРИАЛОВ, СОДЕРЖАЩИХ ФАКТОРЫ РОСТА И РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ, В ОБЛАСТЬ ДЕФЕКТА АЛЬВЕОЛЯРНОЙ КОСТИ | 2011 |
|
RU2469676C1 |
| Устройство, комплект и способ для введения трансплантата в костный регенерат | 2020 |
|
RU2741206C1 |
| ТРАНСПЛАНТАЦИОННАЯ СМЕСЬ | 2005 |
|
RU2301684C1 |
Изобретение относится к экспериментальной медицине и может быть использовано для лечения костного дефекта в эксперименте. Для этого на костный дефект накладывают резорбируемую синтетическую мембрану, выполненную в виде пленки. Основой пленки является композиция поливиниловых спиртов разной степени омыления с добавлением фуллерренов С60 в следующем соотношении, мас. %: поливиниловый спирт недоомыленный - 38,9-39,1; поливиниловый спирт глубокой степени омыления 57,9-58,1; винилин - 2,9-3,1; фуллерены С60 – 0,02-0,001. По всей поверхности пленки выполняют перфорированные отверстия. Перед наложением пленки на костный дефект на ее поверхность, соприкасающуюся с костным дефектом, наносят гель, выполненный на основе композиции поливиниловых спиртов разной степени омыления с добавлением фуллерренов С60 в следующем соотношении, мас. %: поливиниловый спирт недоомыленный - 4,9-5,1; поливиниловый спирт глубокой степени омыления 9,9,-10,1; винилин - 2,9,-3,1; фуллерены С60 – 0,02-0,001; дистиллированная вода – остальное. После наложения пленки на костный дефект на гель, выступивший из перфорированных отверстий в пленке, и по ее краям наносят загуститель до образования пластилинообразной массы геля. Загуститель представляет собой порошкообразный 100% недоомыленный поливиниловый спирт. Способ обеспечивает повышение эффективности прорастания сосудистой ткани, что повысит качество созревания костного регенерата. Это достигается тем, что основа резорбируемой синтетической мембраны, выполненной в виде пленки, - композиция поливиниловых спиртов разной степени омыления с добавлением фуллерренов С60. Перед наложением пленки на костный дефект на ее поверхность, соприкасающуюся с костным дефектом, наносят гель, выполненный на основе композиции поливиниловых спиртов разной степени омыления с добавлением фуллерренов С60. Причем по всей поверхности вышеуказанной пленки выполняют перфорированные отверстия, а после ее наложения на костный дефект на гель, выступивший из перфорированных отверстий в вышеуказанной пленке, и по ее краям наносят загуститель до образования пластилинообразной массы геля, причем загуститель представляет собой порошкообразный 100% недоомыленный поливиниловый спирт. Способ обеспечивает повышение качества созревания костного регенерата за счёт повышения эффективности фиксации мембраны к костным краям дефекта и эффективности прорастания сосудистой ткани во второй стадии репаративного остеогенеза. 1 табл., 1 пр.
Способ лечения костного дефекта в эксперименте путем наложения на него резорбируемой синтетической мембраны, выполненной в виде пленки, отличающийся тем, что
основой пленки является композиция поливиниловых спиртов разной степени омыления с добавлением фуллерренов С60 в следующем соотношении, мас. %:
перед наложением вышеуказанной пленки на костный дефект на ее поверхность, соприкасающуюся с костным дефектом, наносят гель, выполненный на основе композиции поливиниловых спиртов разной степени омыления с добавлением фуллерренов С60 в следующем соотношении, мас. %:
причем по всей поверхности вышеуказанной пленки выполняют перфорированные отверстия, а после ее наложения на костный дефект на гель, выступивший из перфорированных отверстий в вышеуказанной пленке, и по ее краям наносят загуститель до образования пластилинообразной массы геля, причем загуститель представляет собой порошкообразный 100% недоомыленный поливиниловый спирт.
| КАБАНЬКОВ А.В | |||
| и др | |||
| "Экспериментальное обоснование применения направленной костной аугментации альвеолярных отростков челюстей тентовых конструкций из поливинилового спирта" // "Актуальные проблемы и достижения в медицине | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| RU 2016119483 A, 23.11.2017 | |||
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ПОЛИВИНИЛОВОГО СПИРТА ДЛЯ ИЗГОТОВЛЕНИЯ ПЛЕНОЧНЫХ МАТЕРИАЛОВ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ | 2011 |
|
RU2499012C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ВОДОРАСТВОРИМЫХ ПОЛИМЕРОВ | 2014 |
|
RU2574257C1 |
| ИМИДИРОВАННЫЙ БИОПОЛИМЕРНЫЙ АДГЕЗИВ И ГИДРОГЕЛЬ | 2007 |
|
RU2486907C2 |
| ГИДРОФИЛЬНЫЙ ГЕЛЬ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ), РАНЕВОЕ ПОКРЫТИЕ И ПЕРЕВЯЗОЧНОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 2009 |
|
RU2422133C1 |
| Приспособление к железнодорожному электрическому централизационному аппарату системы Сименса и Гальске для указания положения стрелочной рукоятки | 1926 |
|
SU6754A1 |
| Прибор для направления распространения через почву колебаний | 1929 |
|
SU17769A1 |
| JPS 57134407 A, 19.08.1982 | |||
| КАБАНЬКОВ А.В | |||
| и др | |||
| "Обоснование применения тентовых конструкций из поливинилового спирта в направленном росте костной ткани" // "Медицина и фармакология: от вопросов к решениям", выпуск I - сборник научных трудов по итогам международной научно-практической конференции (25 октября 2016 г.), г | |||
| Томск, 2016, стр.25-32 // помещено на сайт в Интернет: http://evansys.com/articles/meditsina-i-farmakologiya-ot-voprosov-k-resheniyam-sbornik-nauchnykh-trudov-po-itogam-mezhdunarodnoy/ 24 марта 2017 года; дата размещения подтверждена по адресу Интернет-архива: https://web.archive.org/web/20170324092137/http://evansys.com/articles/meditsina-i-farmakologiya-ot-voprosov-k-resheniyam-sbornik-nauchnykh-trudov-po-itogam-mezhdunarodnoy/ | |||
| КАБАНЬКОВ А.В | |||
| и др | |||
| Способ получения молочной кислоты | 1922 |
|
SU60A1 |
| Аммосова", Якутск, 2016, стр.138-147 | |||
| HULSART-BILLSTROM G et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| J Tissue Eng Regen Med | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2019-07-31—Публикация
2018-06-26—Подача