Область техники, к которой относится изобретение
Настоящее изобретение относится к биотехнологии, аналитической химии и касается способа определения содержания β-казеина А1 и/или А2 групп в молоке, молочных продуктах, молочных составных продуктах, молокосодержащих продуктах КРС.
Уровень техники
МОЛОКО - полноценный и полезный продукт питания. Оно содержит все необходимые для жизни питательные вещества, нужные для построения организма. Питательность 1 л молока составляет 685 ккал. Калорийность зависит, главным образом, от содержания жира, белка. Благодаря содержанию в молоке важнейших питательных веществ, главным образом белка, углеводов, витаминов, минеральных веществ, оно является и защитным фактором.
С химической точки зрения молоко представляет собой очень сложное соединение. Упрощенно молоко можно рассматривать как эмульсию жиров в водном растворе, содержащую различные компоненты. Основными белками молока являются казеин и сывороточные белки - альбумин и глобулин. Казеин [NH2R(COOH)4(COO)2Ca] находится в молоке в виде коллоидного раствора комплексного соединения казеината кальция в количестве 2,7%. В зависимости от содержания фосфора, кальция, серы и способности свертываться под влиянием сычужного фермента казеин подразделяют на альфа- (α), бета- (β), гамма- (γ) и каппа- ( ) формы. Влияние каппа-казеина на сыропригодность молока хорошо изучено и известно широкому кругу специалистов. Кроме того, различные аллельные варианты каппа-казеина имеют связь с белковомолочностью скота и жирномолочностью. Однако в последнее время все чаще стали обращать внимание на β-казеин, роль которого гораздо менее известна. β-казеин может составлять до 45% от общего содержания казеина в молоке или более 30% от общего белка. Бета-форма казеина содержит почти половину, а гамма-форма в 10 раз меньше фосфора в сравнении с альфа-формой. Изоэлектрическая точка казеина находится в пределах рН 4,6-4,7. На настоящий момент выявлено 12 аллельных вариантов (групп) β-казеина, среди которых вариант А1 и А2 наиболее часто встречается. Отличаются варианты А1 и А2 бета-казеина заменой в гене, благодаря которой А1 содержит аминокислоту гистидин в 67-й позиции аминокислотной последовательности, тогда как А2 содержит пролин. По современным данным, к семейству А1 относятся аллели А1, В, С, F, G; к семейству А2 - А2, A3, D, Е, H1, Н2, I (Farrell Н.М. et al. Nomenclature of the proteins of cows' milk - Sixth Revision // Journal of Dairy Science. 2004. Vol. 87. №6. P. 1641-1674).
) формы. Влияние каппа-казеина на сыропригодность молока хорошо изучено и известно широкому кругу специалистов. Кроме того, различные аллельные варианты каппа-казеина имеют связь с белковомолочностью скота и жирномолочностью. Однако в последнее время все чаще стали обращать внимание на β-казеин, роль которого гораздо менее известна. β-казеин может составлять до 45% от общего содержания казеина в молоке или более 30% от общего белка. Бета-форма казеина содержит почти половину, а гамма-форма в 10 раз меньше фосфора в сравнении с альфа-формой. Изоэлектрическая точка казеина находится в пределах рН 4,6-4,7. На настоящий момент выявлено 12 аллельных вариантов (групп) β-казеина, среди которых вариант А1 и А2 наиболее часто встречается. Отличаются варианты А1 и А2 бета-казеина заменой в гене, благодаря которой А1 содержит аминокислоту гистидин в 67-й позиции аминокислотной последовательности, тогда как А2 содержит пролин. По современным данным, к семейству А1 относятся аллели А1, В, С, F, G; к семейству А2 - А2, A3, D, Е, H1, Н2, I (Farrell Н.М. et al. Nomenclature of the proteins of cows' milk - Sixth Revision // Journal of Dairy Science. 2004. Vol. 87. №6. P. 1641-1674).
A1 вариант β-казеина образовался из А2 в результате мутации у европейского скота, то есть исходным вариантом белка в молоке является А2. У азиатского и индийского скота (буйволы, зебу, местный скот азиатского региона) мутация А1 изначально отсутствовала и все продуцируемое молоко содержало только А2 β-казеин. В связи с использованием семени быков-производителей европейских пород по всему миру А1 мутация β-казеина постепенно распространилась на все регионы и сейчас обнаруживается у животных практически всех культурных пород крупного рогатого скота (КРС).
Из-за разной первичной структуры белка при употреблении в пищу коровьего молока А1 и А2 β-казеины расщепляются в ЖКТ с образованием различающихся веществ. При наличии замены пролина на гистидин происходит расщепление цепи по 67-й аминокислоте, в результате чего образуется пептид, состоящий из семи аминокислотных остатков (с 60 по 66), который называется бычий казоморфин-7 или БКМ-7 (ВСМ-7 в англоязычной литературе).
Казоморфины относятся к группе опиоидных пептидов пищевого происхождения (экзорфинов). Основными свойствами опиоидов являются снижение болевой чувствительности, контроль функций центральной и периферической нервных систем, в том числе врожденных поведенческих реакций и обучения, влияние на перистальтику ЖКТ. У крыс после скармливания рациона с казеинами отмечалось существенное замедление перистальтики (Daniel Н., Vohwinkel М., Rehner G. Effect of casein and beta-casomrphins on gastrointestinal motility in rats. // J. Nutr. 1990. Vol. 120. №3. P. 252-257). В 1985 г экспериментально было подтверждено наличие БКМ-7 в кишечнике взрослых людей после употребления молока (Svedberg A., De Haas J., Leimenstoll G., Paul F., Teschemacher H. Demonstration of beta-casomorphin immunoreactive materials in in vitro digests of bovine milk and in small intestine contents after bovine milk ingestion in adult humans. // Peptides. 1985. Vol. 6. №5. P. 825-830). В ряде исследований показано, что у людей, употреблявших молоко с β-казеином А2 отмечалось меньше случаев расстройства кишечника, чем у людей, употреблявших молоко с β-казеином A1 (Pal S. et al. Milk Intolerance, Beta-Casein and Lactose // Nutrients. 2015. №7. P. 7285-7297, Jianqin Sun, Leiming Xu, Lu Xia, Yelland G.W., Ni J., Clarke A.J. Effects of milk containing only A2 beta casein versus milk containing both A1 and A2 beta casein proteins on gastrointestinal physiology, symptoms of discomfort, and cognitive behavior of people with self-reported intolerance to traditional cows' milk. // Nutrition Journal, 2016, https://nutritionj.biomedcentral.com/articles/10.1186/s12937-016-0147-z).
Таким образом, определение генотипа белка β-казеина является актуальной задачей. В связи с этим встает задача разработки метода определения генотипа казеина, содержащегося в молоке КРС.
Наиболее близким к заявляемому является способ определения наличия β-казеина аллелей А1 и/или А2 в молоке КРС, заключающийся в извлечении белков из молока путем добавления двухкратного объема водного денатурирующего раствора, содержащего мочевину 8 М, 165 мМ Трис, 44 мМ цитрата натрия и 0,3 об. % меркаптоэтанола, с последующим фильтрованием, предложенный Nadia Sargaeva at all (https://www.perkinelmer.com/lab-solutions/resources/docs/APP_CaseinProteinsinMilk.pdf). После экстракции белки разделяют методом ВЭЖХ и детектируют с помощью масс-спектрометра AxION® 2 TOF с ионной оптикой, настроенной для оптимизации передачи диапазона масс m/z 1000-2000. Высокое разрешение и высокая точность масс TOF MS позволяют измерять среднюю массу белка в пределах 1 Да от расчетной массы.
Данный способ характеризуется использованием высокоточных масс-спектрометров, которые являются сложными в эксплуатации, требующими специальной подготовки персонала, а также особых условий при проведении масс-спектрометрии, связанных с высокой чистотой помещений, в которых проводится измерение. Кроме того, время, затрачиваемое на проведение теста указанным способом составляет минимум 5 часов.
Раскрытие изобретения
Задачей настоящего изобретения является создание способа определения содержания аллели А1 и/или А2 β-казеина в пробе молока или молокосодержащего продукта.
Техническим результатом изобретения является возможность определения содержания аллели А1 и/или А2 β-казеина в пробе за период времени не превышающий 4 часов при упрощении технологии за счет возможности использования широкого спектра измерительных приборов для проведения хроматографического анализа пробы. Заявляемый способ характеризуется совокупностью существенных признаков, представленных в независимом пункте формулы изобретения, обеспечивающий оптимизацию всего процесса проведения теста и возможностью использования хроматографических приборов, оснащенных только сисемой UV-детектирования с длиной волны 280 нм
Указанный технический результат достигается заявляемым способом определения наличия β-казеина А1 группы и/или β-казеина А2 группы в молоке или молокосодержащих продуктах, включающим следующие стадии:
a. концентрирование β-казеина в исследуемой пробе до его содержания в пробе не менее 80 мас. % относительно содержания других белков (обогащение пробы β-казеином),
b. ферментативный гидролиз полученного концентрата,
c. хромотографический анализ полученного гидролизата,
d. анализ хромотограммы.
Концентрирование (а) может быть реализовано в четыре стадии, на первой из которых осуществляют обезжиривание пробы центрифугированием, на второй стадии осуществляют выделение казеинсодержащей фракции подкислением, на третьей удаляют альфа-казеин подкислением в присутствии хаотропов, на четвертой - удаляют каппа-казеин при нормальном рН с понижением концентрации хаотропов, после чего полученный β-казеин переносят в буфер, пригодный для гидролиза.
Ферментативный гидролиз полученного на этапе (а) β-казеина осуществляют с использованием в качестве фермента ТРСК-обработанного трипсина с получением, по меньшей мере, двух специфичных пептидов, один из которых характеризует общее содержания β-казеина в гидролизате, а второй характеризует содержание казеина А2 и/или А1 группы в гидролизате.
Хроматографический анализ может быть проведен с использованием обращенно-фазовой хроматографии, предпочтительно ВЭЖХ, с проведением предварительной калибровки прибора для определения содержания в пробе β-казеина А1 группы и/или вариант А2 β-казеина.
В процессе хроматографического анализа выявляют пики на хроматограмме, соответствующие специфичным пептидам и выводы о наличии β-казеина А1 группы и/или β-казеина А2 группы в пробе делают по итогам выявления данных пиков, а вывод о количественном содержании А1 группы и/или А2 группы β-казеина в пробе делают по сравнению интенсивностей этих пиков поглощения на характеристической для пептидов длине волны (при длине волны 280 нм).
При этом обезжиривание пробы осуществляют центрифугированием в течение 8-12 мин с силой 15000-20000g (RCF) с последующим удалением образовавшегося верхнего слоя, а выделение казеинсодержащей фракции осуществляют посредством снижения рН до 4,4-4,6. Предпочтительно снижение рН осуществлять одно молярным раствором ацетата аммония.
Удаление альфа-казеина подкислением в присутствии хаотропного агента может быть осуществлено следующим образом: осадок казеиновой фракции растворяют в воде с содержанием хаотропных агентов с последующим добавлением к раствору сильной минеральной кислоты и разбавлением водой в 3-4 раза (по объему), после чего полученный раствор выдерживают до прекращения формирования осадка (при температуре 30-35°С), удаляют супенатант центрифугированием.
Удаление каппа-казеина в образовавшемся осадке осуществляют при нормальном рН с понижением концентрации хаотропного агента следующим образом: осадок казеиновой фракции растворяют в воде с содержанием хаотропных агентов, с последующим добавлением к раствору 1-2 кратного объема 0,5-1 М раствора ацетата аммония, после чего смесь перемешивают с последующим центрифугированием полученной смеси с отделением осадка от супернатанта.
Для перенесения выделенного β-казеина в буфер, пригодный для гидролиза, полученный супернатант разбавляют в 8-10 раз водой (по объему), полученный осадок β-казеина отделяют центрифугированием и растворяют в подходящем для гидролиза буфере. При этом в качестве буфера предпочтительно использовать 50 мМ раствора ТРИС-HCl с рН 8,5.
При проведении реакции ферментативного гидролиза к раствору концентрированного β-казеина, полученного на этапе (а) добавляют раствор ТРСК-обработанного трипсина, который берется из расчета 1-10 г трипсина на 100 г белка. Полученную смесь выдерживают при 37°С в течение не менее 30 мин, для остановки реакции приливают концентрированную муравьиную кислоту в количестве достаточном для остановки трипсинолиза.
Хроматографический анализ может быть проведен методом ВЭЖХ на колонке с обращенной фазой С18 с шириной пор от 200 до 400А в системе вода-ацетонитрил, 0,1% трифторуксусной кислоты в градиенте от 20 до 55% ацетонитрила, при этом количественное определение А1 группы и/или А2 группы β-казеина в образце производят по поглощению в ультрафиолетовом диапазоне при длине волны 280 нм.
В качестве хаотропного агента в качестве которых могут быть использованы растворы мочевины, тиомочевины, фенола, хлорида магния, лаурилсульфата натрия, ацетата или перхлората лития, гуанидина хлорида, гуанидина изотиоционата, изопропиловый, бутиловый или этиловый спирты.
Краткое описание чертежей
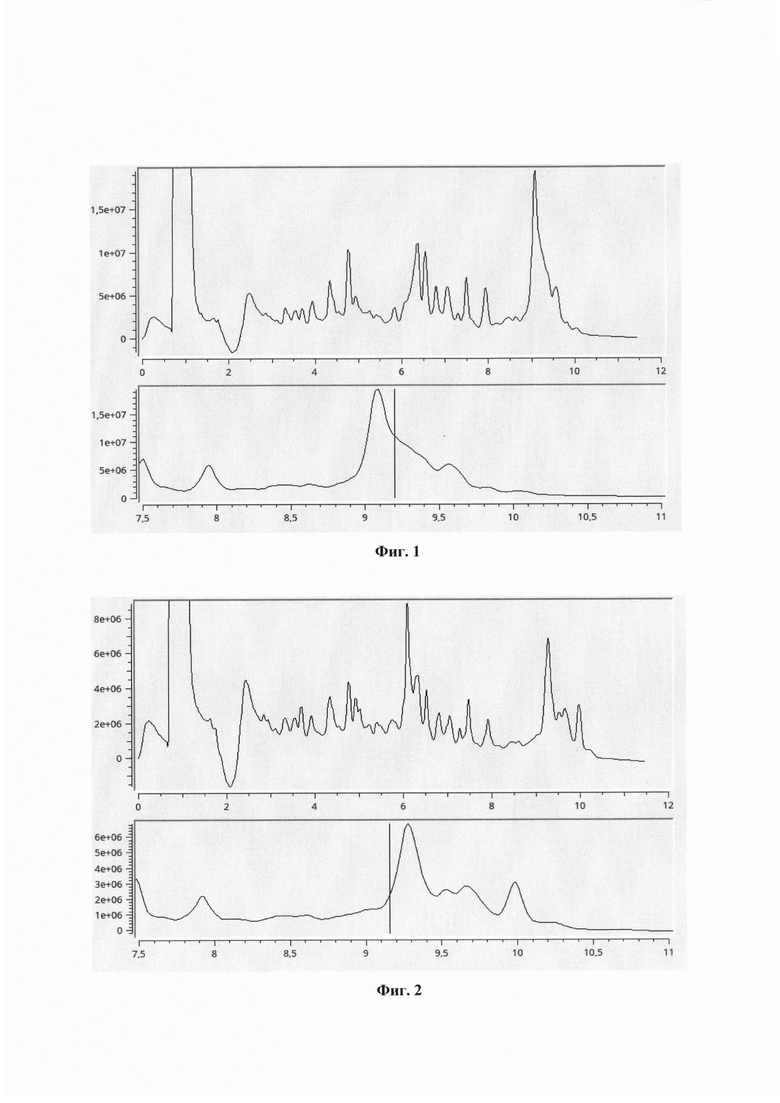
Изобретение поясняется чертежами, где на фиг. 1 представлена хроматограмма образца по примеру 1, характеризующаяся присутствием β-казеина А1 группы в молоке. На фиг. 2 представлена хроматограмма образца по примеру 2, демонстрирующая присутствие в исследуемом образце молока β-казеина группы (варианта) А2.
Осуществление изобретения
Ниже представлено подробное описание изобретения, которое не ограничивает объем притязаний заявляемого изобретения, а демонстрирует возможность осуществления изобретения с достижением технического результата.
Заявляемый способ может быть использован для определения содержания β-казеина А1 и/или А2 групп в молоке, молочных продуктах, молочных составных продуктах, молокосодержащих продуктах КРС.
В рамках настоящего изобретения использованы следующие термины и определения, используемые при описании осуществления изобретения.
Молочный продукт - пищевой продукт, который произведен из молока и его составных частей (или только из составных частей молока) без использования растительного жира и белка. В составе молочного продукта могут содержаться компоненты, которые необходимы для его переработки. К молочным продуктам относятся молоко питьевое, кефир, йогурт, простокваша, варенец, сливки, творог, сыр, масло, мороженое и многие другие продукты, не содержащие каких-либо других пищевых продуктов.
Молочный составной продукт - пищевой продукт, произведенный из молока или молочных продуктов. В молочный составной продукт могут добавляться побочные продукты переработки молока. Составных частей молока должно быть более 50%, в мороженом и сладких продуктах переработки молока - более 50%. К молочным составным продуктам относятся молочные продукты, в состав которых внесены фрукты, овощи, пряности, мясные изделия, кофе или какао, изюм, орехи или шоколад. В качестве примера можно привести йогурт с кусочками фруктов, творожная масса с изюмом, сыр с ветчиной, сгущенное молоко с кофе.
Молокосодержащий продукт - пищевой продукт, произведенный из молока или молочных продуктов, или побочных продуктов переработки молока. Главным отличием молокосодержащих продуктов от всех остальных - является наличие немолочных компонентов, которыми заменяется молочный жир. Молокосодержащие продукты могут содержать молочный жир и заменитель молочного жира в разных пропорциях и могут иметь в своем составе разнообразные пищевые продукты.
Все компоненты, необходимые для осуществления способа являются коммерчески доступными. Метод ВЭЖХ (HPLC) автоматизирован и включает в себя внутренний стандарт для калибровки.
Для определения искомых белков подходит как свежее, так и скисшее или обезжиренное пастеризованное молоко. При определении аллелей в скисшем молоке его предварительно тщательно перемешивают до получения визуально гомогенной фракции, после чего отбирают пробу.
На первом этапе заявляемого способа осуществляют концентрирование β-казеина в исследуемой пробе исследуемого продукта (молока, молочных продуктов, молочных составных продуктов, молокосодержащих продуктов), которое может быть реализовано, например, фракционированием в растворе мочевины согласно методике, описанной в статье Fox, P.F., & Guiney, J. (1972). A procedure for the partial fractionation of aScasein complex. Journal of Dairy Science, 39(1), 49-53.
В заявляемом способе этап концентрирования β-казеина может быть реализован по оригинальной методике, в соответствии с которой получают содержание β-казеина не менее 80 мас. % относительно содержания других белков, что составляет содержание β-казеина от 3 до 20 г/л в исследуемой пробе. Для этого исследуемую пробу помещают в центрифужную пробирку, центрифугируют для отделения жирной фракции, для этого осуществляют центрифугирование в течение 8-10 мин на приборе с силой 15000-20000g, образовавшийся верхний слой аккуратно и начисто удаляют. Затем для выделения казеинсодержащей фракции оставшийся раствор подкисляют до рН 4,4-4,6. Подкислить раствор до указанных значений рН возможно любой органической или неорганической кислотой, ее раствором или солью. Предпочтительно использовать ледяную уксусную кислоту, лимонную, азотную кислоту или ее соли (нитраты калия, натрия, кальция и аммония). Получившийся на этой стадии осадок отделяют центрифугированием.
Далее осуществляют удаление α-казеина путем подкисления раствора в присутствии хаотропного агента. Для этого образовавшийся осадок растворяют в растворе хаотропного агента, а затем добавляют сильную минеральную кислоту. В качестве хаотропного агента можно использовать раствор мочевины, тиомочевины, фенола, хлорида магния, лаурилсульфата натрия, ацетата или перхлората лития, гуанидин хлорида, изопропиловый, бутиловый или этиловый спирты. Количество и концентрацию хаотропного агента подбирают на основании хроматографического или электрофоретического контроля смеси, так, например, предпочтительно использовать 6,6 М раствор мочевины. В качестве сильной минеральной кислоты предпочтительно использовать концентрированную серную кислоту, из расчета 2,5 мкм серной кислоты на 0,5 мл исходного продукта. Полученный раствор выдерживают в термостате при температуре 30-35°С в течении времени, достаточном для прекращения образования осадка. Как правило, образование осадка прекращается через 60 мин.
Далее удаляют каппа-казеин при нормальном рН с понижением концентрации хаотропов, для этого полученный осадок растворяют в воде, содержащей хаотропный агент. В качестве хаотропного агента на данном этапе способа также могут быть использованы вещества, перечисленные выше, и их количество определено по аналогичной методике. Затем к полученному раствору добавляют 1-2-кратный объем подкисливающего агента (например, ацетата аммония) до рН=4,5-5,2. Полученную смесь перемешивают и центрифугируют для удаления осадка. Для переведения/перенесения β-казеина в буфер, пригодный для гидролиза, полученный супернатант разбавляют водой до образования осадка. Полученный осадок отделяют центрифугированием и растворяют в буфере, подходящем для гидролиза клеточных белков (буфер протеолиза). В качестве буфера, подходящего для гидролиза предпочтительно использовать трис-ацетатный буфер или буфер, указанный изготовителем гидролизирующего фермента. Полученный раствор может храниться при -20°С в течение 1 месяца.
Для гидролиза β-казеина к полученному раствору казеина приливают раствор для денатурации, в качестве которого используют ТРСК-обработанный трипсин. Количество добавляемого трипсина рассчитывают в соответствии с методикой производителя, для последующего определения, по меньшей мере, двух специфичных пептидов, один из которых (опорный) характеризует общее содержание β-казеина в гидролизате, а второй (характеристический) - содержание β-казеина А1 и/или А2 группы. С этой целью для каждой партии ТРСК-обработанного трипсина строят калибровочные кривые, используя в качестве стандартного образца выделенный и очищенный А1 и А2 казеин.
Полученную смесь помещают в термостат и выдерживают до момента денатурации белка. Далее отбирают пробу, к которой добавляют буфер для гидролиза из расчета от 1:2 до 1:5 трипсина (расчетное количество, которого берут из соотношения трипсин: β-казеин варьироваться от 1:10 до 1:100) с получением триптического гидролизата. Для прохождения реакции гидролиза полученную смесь помещают в термостат и выдерживают в условиях, рекомендованных производителем трипсина. Далее для остановки реакции приливают концентрированную муравьиную кислоту в количестве, достаточном для остановки трипсинолиза, например, на объем пробы берут от 1/50 до 1/6 объема кислоты.
Полученный гидролизат может храниться при температуре +4°С не более суток. Полученный гидролизат анализируют методом ВЭЖХ (HPLC). При этом вывод о наличии β-казеина А1 группы и/или β-казеина А2 делают при выявлении пиков на полученной при длине волны 280 нм хроматограмме, соответствующих искомым пептидам, а вывод об их количественном содержании делают на основании сравнения интенсивностей пиков поглощения.
Для выявления характеристических пиков берут стандартные растворы 10 г/л А1 и А2 казеина, хроматографически очишенного из молока гомозиготных коров. Проводят трипсинолиз и хроматографирование лизата. Сравнением двух хроматограмм выявляют по пику, время удерживания которых отличается в зависимости от образца. Эти пики считают характеристическими. Интегрируют их и записывают количество mAu*ul для каждого образца на 10ug исходно белка. Вычисляют их удельное соотношение для гипотетической смеси 50:50. Рядом с ними выбирают пик, идентичный для обоих образцов. Он считается количественным, его интегрируют и также записывают количество mAu*ul на 10ug белка. Для определения количественного содержания казеинов в исследуемом образце после хроматографирования интегрируют характеристические пики и по их соотношению, сравнивая их с соотношением в гипотетической смеси, делают выводы о количественном соотношении. Для внутренней валидации эксперимента определяют соотношение суммарного содержания казеина, полученное интегрированием количественного писка и суммарным интегрированием характеристических пиков. Это отношение должно быть в пределе (0.75-1.25):1.
Ниже приведены примеры конкретного выполнения способа.
Пример 1.
Для анализа 0.5 мл коровьего молока помещали в 2 мл центрифужную пробирку, центрифугировали 10 минут на центрифуге Eppendorf minispin с силой 15000g (RCF, g 15000). Затем пипеткой отбирали образовавшийся верхний слой сливок начисто. К полученному раствору добавляли 50 мкл 1М раствора ацетата аммония и центрифугировали 4 минуты. Образовавшийся осадок растворяли в 500 мкл 6.6 М растворе мочевины, добавляли 2.5 мкл концентрированной серной кислоты и 1300 мкл воды. Помещали полученный раствор в термостат и выдерживали при температуре 30°С до прекращения образования осадка, приблизительно в течение 1 часа. Образовавшийся осадок отделяли центрифугированием в течение 10 минут и растворяли в 100 мкл 6.6 М растворе мочевины, добавили 75 мкл 1М раствора ацетата аммония и 75 мкл воды, перемешивали на вортексе 5 минут. Полученный раствор центрифугировали 10 минут, аккуратно отбирали в пробирку на 2 мл полученный супернатант. К полученному супернатанту добавляли 1200 мкл воды и центрифуговали в течение 10 минут, отбирали супернатант пипеткой, а полученный осадок растворяли в 200 мкл буфера протеолиза (50 mM Tris рН 8.5).
25 мкл полученного раствора помещали в 1.5 мл пробирку и добавляли 75 мкл (8 М Urea, 50 mM Tris рН 8.5, 10 mM DTT). Полученную смесь помещали в термостат при 99°С на 20 минут. Затем отбирали 10 мкл раствора денатурированного белка в пробирку 0.5 мл и добавляли 30 мкл буфера (Tris рН 8.5, 50 mM) и 1 мкл трипсина, обработанного ТРСК (полученного из поджелудочной железы крупного рогатого скота, фирмы Sigma /Сент-Луис, Миссури, США), смесь помещали в термостат и выдерживали при 37°С в течение 30 мин, затем добавляли 5 мкл муравьиной кислоты.
По 30 мкл раствора гидролитического лизата казеина помещали в пробирки для хроматографирования. Образцы для анализа размещали в штативе хроматографа, начиная с гнезда номер 1.
Гидролизат разделяли методом HPLC в линейном градиенте ацетонитрилла 2055% за 2500 мкл со скоростью 200 мкл/мин на колонке ProntoSIL 1205С 18 AQ с уф-детектированием. Хроматограмма обрабатывалась программой и наличие пептидов, характерных для А1 группы β-казеина, определялось по наличию пика поглощения на длине волны 280 нм раньше 10 минуты.
В программе МультиХром Спектр записывали время удерживания пиков в районе 8.6 минут и в районе 9.9 минут (фиг. 1). В анализируемом образце не обнаружено примеси белка А2. Время, затраченное на проведение теста по определению наличия β-казеина варианта (группы) А1 в исследуемой пробе составило 2 часа 50 мин.
Пример 2.
Для анализа 2 мл коровьего молока помещали в 2 мл центрифужную пробирку, центрифугировали 10 минут на центрифуге Eppendorf minispin с силой 15000g. Затем пипеткой отбирали 300 мкл нижнего слоя жидкости, проткнув носиком верхнюю фазу. К полученному раствору добавляли 25 мкл 1.5 М раствора ацетата калия, доведенного до рН 4.5 ледяной уксусной кислотой, и центрифугировали 10 минут. Далее готовили раствор для протеолиза как в примере 1.
25 мкл полученного раствора помещали в 1.5 мл пробирку и добавляли 75 мкл (2.5 М Гуанидин-хлорида, 50 mM Tris рН 8.5, 20 mM DTT). Полученную смесь помещали в термостат при 99°С на 10 минут. Затем отбирали 10 мкл раствора денатурированного белка в пробирку 0.5 мл и добавляли 30 мкл буфера (Tris рН 8.5, 50 mM) и 4 мкл трипсина, обработанного ТРСК, из поджелудочной железы крупного рогатого скота был получен от фирмы Sigma /Сент-Луис, Миссури, США/, поместили в термостат и выдерживали при 37°С в течение 5 мин, затем добавляли 5 мкл муравьиной кислоты.
Хроматографический анализ проводили аналогично примеру 1 (фиг. 2). В анализируемом образце не обнаружено примеси белка А1. Время, затраченное на проведение анализа, составило 3 часа.
Пример 3.
Для анализа 300 мг творога помещали в 1.5 мл центрифужную пробирку, 2 раза промывали смесью 300 мкл воды и 25 мкл 1.5 М раствора ацетата калия, доведенного до рН 4.5 ледяной уксусной кислотой, и центрифугировали 10 минут на центрифуге Eppendorf minispin с силой 15000g. Далее действовали как в примере 1.
В анализируемом образце не обнаружено примеси белка А1. Время, затраченное на проведение анализа, составило 3 часа 10 минут.
Разработанный способ позволяет достоверно определять примесь менее 15% β-казеина группы А1 в образце. Пастеризация, скисание и ненадлежащее хранение молока в течение двух недель не сказывается на результатах анализа. Проведение исследования не требует высокой квалификации оператора, имеет низкую себестоимость, может быть произведено за 3-4 часа. Изобретение может быть использовано в пищевой и молочной промышленности при определении А1 и/или А2 групп β-казеина.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОБНАРУЖЕНИЕ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ПРОТЕОЗОПЕПТОНОВ И/ИЛИ СОДЕРЖАНИЯ БЕТА-КАЗЕИНА И ПИТАТЕЛЬНАЯ КОМПОЗИЦИЯ СО СНИЖЕННЫМ СОДЕРЖАНИЕМ ПОЛУЧЕННЫХ ИЗ БЕТА-КАЗЕИНА ПРОТЕОЗОПЕПТОНОВ | 2019 |
|
RU2820927C2 |
| АНАЛИЗ БЕТА-КАЗЕИНА МОЛОКА И МОЛОЧНЫХ ПРОДУКТОВ | 2019 |
|
RU2830136C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТАТИВНОГО ГИДРОЛИЗАТА СЫВОРОТОЧНЫХ БЕЛКОВ СО СРЕДНЕЙ СТЕПЕНЬЮ ГИДРОЛИЗА | 2008 |
|
RU2375910C1 |
| СПОСОБ ПРОИЗВОДСТВА КОМБИНИРОВАННЫХ СЫЧУЖНЫХ СЫРОВ ИЛИ СЫРНЫХ ПРОДУКТОВ С ПРИМЕНЕНИЕМ ФОСФОЛИПАЗЫ А1 ИЛИ А2 ПО ТЕХНОЛОГИИ С РАЗДЕЛЬНОЙ ПАСТЕРИЗАЦИЕЙ МОЛОЧНОЙ СМЕСИ | 2015 |
|
RU2577109C1 |
| ОБОГАЩЕННЫЕ АНГИОГЕНИНОМ ФРАКЦИИ МОЛОКА | 2009 |
|
RU2538654C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНОЙ ИНФЕКЦИИ | 2007 |
|
RU2469735C2 |
| ТРАНСФОРМИРОВАННЫЕ МОЛОЧНО-КИСЛЫЕ БАКТЕРИИ, СНИЖАЮЩИЕ СКЛОННОСТЬ К ПРОЯВЛЕНИЮ АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ, И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2294366C2 |
| СПОСОБ ГИДРОЛИЗА МОЛОЧНЫХ БЕЛКОВ | 2002 |
|
RU2292155C2 |
| ВНОВЬ ИДЕНТИФИЦИРОВАННЫЕ ПЕПТИДЫ ДЛЯ ПРИМЕНЕНИЯ ПРИ ИНДУКЦИИ ТОЛЕРАНТНОСТИ ПРИ ПЕРОРАЛЬНОМ ВВЕДЕНИИ У МОЛОДЫХ МЛЕКОПИТАЮЩИХ | 2013 |
|
RU2668155C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОЛИЗАТА СЫВОРОТОЧНЫХ БЕЛКОВ С ВЫСОКОЙ СТЕПЕНЬЮ ГИДРОЛИЗА И ГИДРОЛИЗАТ СЫВОРОТОЧНЫХ БЕЛКОВ С ВЫСОКОЙ СТЕПЕНЬЮ ГИДРОЛИЗА | 2010 |
|
RU2428047C1 |
Изобретение относится к биотехнологии, аналитической химии и касается способа определения содержания β-казеина А1 и/или А2 групп в молоке, молочных продуктах, молочных составных продуктах, молокосодержащих продуктах. Способ включает концентрирование β-казеина в исследуемой пробе до достижения содержания β-казеина в пробе не менее 80 мас.% относительно содержания других белков, ферментативный гидролиз полученного концентрата, хроматографический анализ полученного гидролизата и анализ хроматограммы. При этом ферментативный гидролиз полученного на этапе (а) β-казеина осуществляют с использованием в качестве ферментов ТРСК-обработанного трипсина в количестве, обеспечивающем реакцию гидролиза. При хроматографическом анализе полученного гидролизата выявляют пики на хроматограмме, соответствующие специфическим пептидам, характеризующим общее содержания β-казеина в гидролизате и содержание β-казеина А1 и/или А2 группы, на основании которых определяют группы в пробе. Специфические пептиды определяют с учетом хроматограмм, полученных для гидролизатов образцов β-казеина А1 группы и/или β-казеина А2 группы, причем хроматографический анализ проводят при длине волны 280 нм. Достигается возможность определить содержание А1 и/или А2 β-казеина в пробе за период времени, не превышающий 4 часов при упрощении методики определения. 13 з.п. ф-лы, 3 пр., 2 ил.
1. Способ определения β-казеина А1 группы и/или β-казеина А2 группы в пробе молока или молокосодержащего продукта, включающий:
a) концентрирование β-казеина в исследуемой пробе до достижения содержания β-казеина в пробе не менее 80 мас.% относительно содержания других белков,
b) ферментативный гидролиз полученного концентрата,
c) хроматографический анализ полученного гидролизата,
d) анализ хроматограммы,
при этом ферментативный гидролиз полученного на этапе (а) β-казеина осуществляют с использованием в качестве ферментов ТРСК-обработанного трипсина в количестве, обеспечивающем реакцию гидролиза,
при хроматографическом анализе полученного гидролизата выявляют пики на хроматограмме, соответствующие специфическим пептидам, характеризующим общее содержания β-казеина в гидролизате и содержание β-казеина А1 и/или А2 группы, на основании которых определяют группы в пробе,
при этом специфические пептиды определяют с учетом хроматограмм, полученных для гидролизатов образцов β-казеина А1 группы и/или β-казеина А2 группы, причем хроматографический анализ проводят при длине волны 280 нм.
2. Способ по п. 1, характеризующийся тем, что концентрирование (а) осуществляют в четыре стадии, на первой из которых осуществляют обезжиривание пробы центрифугированием, на второй стадии осуществляют выделение казеинсодержащей фракции подкислением, на третьей удаляют альфа-казеина подкислением в присутствии хаотропных агентов, на четвертой удаляют каппа-казеин при нормальном рН с понижением концентрации хаотропных агентов, после чего полученный β-казеин переносят в буфер, пригодный для гидролиза.
3. Способ по п. 2, характеризующийся тем, что обезжиривание пробы осуществляют центрифугированием в течение 8-12 мин с силой 15000-20000 g с последующим удалением образовавшегося верхнего слоя продукта.
4. Способ по п. 2, характеризующийся тем, что выделение казеинсодержащей фракции осуществляют посредством снижения рН раствора до 4,4-4,6.
5. Способ по п. 4, характеризующийся тем, что снижение рН раствора осуществляют 1 М раствором ацетата аммония.
6. Способ по п. 2, характеризующийся тем, что удаление альфа-казеина подкислением в присутствии хаотропного агента осуществляют следующим образом: осадок казеиновой фракции растворяют в воде с содержанием хаотропных агентов с последующим добавлением к раствору сильной минеральной кислоты и разбавлением водой 3-4 раза (по объему), выдерживают полученный раствор при температуре 30-35°С до прекращения формирования осадка, удаляют супернатант центрифугированием.
7. Способ по п. 6, характеризующийся тем, что в качестве сильной минеральной кислоты используют серную кислоту.
8. Способ по п. 7, характеризующийся тем, что серную кислоту используют в количестве из расчета 2,5 мкм на 0,5 мл исходного продукта/пробы для достижения рН 1,5-2.
9. Способ по п. 2, характеризующийся тем, что удаление каппа-казеина при нормальном рН с понижением концентрации хаотропного агента осуществляют следующим образом: осадок казеиновой фракции растворяют в воде с содержанием хаотропного агента с последующим добавлением к раствору 1-2 кратного объема 0,5-1 М раствора ацетата аммония, после чего смесь перемешивают с последующим центрифугированием полученной смеси для удаления осадка от супернатанта.
10. Способ по п. 2, характеризующийся тем, что в качестве хаотропного агента используют растворы мочевины, гуанидин хлорид, гуанидин изотиоционат.
11. Способ по п. 1, характеризующийся тем, что для перенесения β-казеин в буфер, пригодный для гидролиза, полученный супернатант разбавляют в 8-10 раз водой (по объему), полученный осадок β-казеина отделают центрифугированием и растворяют в подходящем для гидролиза буфере.
12. Способ по п. 11, характеризующийся тем, что в качестве буфера, подходящего для гидролиза, используют 50 мМ раствора ТРИС-HCl с рН 8,5.
13. Способ по п. 1, характеризующийся тем, что хроматографический анализ проводят на колонке с обращенной фазой С18 с шириной пор от 200 до 400 А в системе вода - ацетонитрил, 0,1% трифторуксусной кислоты в градиенте от 20 до 55% ацетонитрила.
14. Способ по п. 1, характеризующийся тем, что выводы о количественном содержании β-казеина А1 группы и/или β-казеина А2 группы в пробе делают на основании сравнения интенсивностей поглощения этих пиков поглощения на характеристической для пептидов длине волны.
| Способ биохимического определения активности протеолитических ферментов в крови | 2016 |
|
RU2623875C1 |
| Грузоподъемная траверса | 1989 |
|
SU1669850A1 |
| CN 103529138 A, 22.01.2014 | |||
| CN 103529138 A, 05.03.2014 | |||
| CN 105548531 A, 04.05.2016 | |||
| CN 103760246 A, 30.04.2014. | |||
Авторы
Даты
2019-08-13—Публикация
2017-11-27—Подача