Область техники
Данное изобретение относится к способам получения обогащенного ангиогенином продукта из пробы молока и применению такого продукта в качестве пищевой добавки, нутрицевтического, фармацевтического или ветеринарного продукта или для приготовления терапевтической композиции.
Уровень техники
Ангиогенин является негликозилированным полипептидом 14 кДа, который продуцируется несколькими растущими типами клеток, включающими эндотелиальные клетки сосудов, клетки гладких мышц аорты, фибробласты и некоторые опухоли, такие как карциномы ободочной кишки, карциномы яичника и раковые опухоли молочной железы. Ангиогенин был выделен из ряда источников, включающих нормальную плазму человека, плазму коровы, коровье молоко и сыворотки мыши, кролика и свиньи. В каждом из этих источников ангиогенин присутствует при низких уровнях (менее 12 мг/л в коровьем молоке и менее 150 мкг/л в плазме человека).
Было показано, что, кроме того, он является сильным стимулятором ангиогенеза, ангиогенин имеет ряд других активностей. Они включают способность удалять дефекты кожи, такие как пигментированные пятна, модуляция иммунных реакций, защиту полиморфно-ядерных лейкоцитов от самопроизвольной деградации и микробицидную активность против системных бактериальных и грибковых патогенов. На основе этих известных физиологических функций этого белка могут быть предсказаны различные применения ангиогенина в медицине, диетических пищевых добавках и косметике.
Применение ангиогенина в таких приложениях требует эффективного способа для получения этого белка в коммерческом масштабе из подходящего источника. Целью предпочтительного варианта данного изобретения является обеспечение такого способа.
Сущность изобретения
Хотя коровье молоко легко доступно, его применение в качестве источника ангиогенина не является предпочтительным, так как ангиогенин присутствует в коровьем молоке только при низком уровне, и лактоферрин и лактопероксидаза, присутствующие в молоке, маскируют ангиогенин, затрудняя его очистку. Авторы этого изобретения нашли несколько способов для обогащения фракции молока ангиогенином, как описано в первом-пятом аспектах ниже и в их заявке, опубликованной как WO 2008/055310, причем каждый из этих способов способен продуцировать обогащенный ангиогенином продукт из молока.
Первый аспект обеспечивает способ получения обогащенного ангиогенином продукта из пробы молока, предусматривающий:
(a) контактирование этой пробы молока с захватывающим агентом, который взаимодействует с ангиогенином, так что ангиогенин, присутствующий в этой пробе молока, взаимодействует с этим захватывающим агентом с образованием комплекса ангиогенин-захватывающий агент;
(b) выделение этого комплекса из пробы молока;
(c) освобождение ангиогенина от захватывающего агента в этом комплексе и
(d) сбор этого ангиогенина из стадии (с) с получением посредством этого обогащенного ангиогенином продукта.
В одном варианте осуществления этот захватывающий агент иммобилизован на носителе.
В следующем варианте осуществления этим захватывающим агентом является антитело.
Второй аспект обеспечивает способ получения обогащенного ангиогенином продукта из пробы молока, предусматривающий:
(а) добавление этой пробы молока к носителю, на. котором иммобилизовано антитело, которое взаимодействует с ангиогенином, где ангиогенин, присутствующий в пробе молока, взаимодействует с антителом на носителе с образованием комплекса ангиогенин-антитело;
(b) отмывание компонентов, присутствующих в этой пробе молока, которые не взаимодействуют с этим антителом, из этого носителя для отделения этого комплекса от пробы молока;
(с) освобождение ангиогенина. от антитела в этом комплексе и
(d) сбор ангиогенина из стадии (с) с получением посредством этого обогащенного ангиогенином продукта.
В одном варианте первого или второго аспекта этот способ включает иммуноаффинную хроматографию.
Третий аспект обеспечивает способ получения обогащенного ангиогенином; продукта из пробы молока, предусматривающий::
(а) добавление пробы молока жидкой фазы ко второй фазе, причем указанная вторая фаза позволяет разделять компоненты пробы молока на основе размера этих компонентов; и
(b) сбор ангиогенина, который отделен от других компонентов этой пробы молока, с получением посредством этого обогащенного ангиогенином продукта, причем перед стадией (а) пробу молока не подвергают сычужному свертыванию или осаждению кислотой, или альтернативно эта проба молока не является молочной сывороткой или фракцией молочной сыворотки.
В одном варианте этого третьего аспекта эта вторая фаза является полупроницаемой фазой.
В следующих вариантах третьего аспекта эта полупроницаемая фаза позволяет компонентам, меньшим чем 20 кДа по размеру, или даже меньшим, чем 50 кДа по размеру, проходить через эту полупроницаемую фазу в виде пермеата. В предпочтительном варианте осуществления, эта полупроницаемая фаза позволяет компонентам, меньшим, чем 30 кДа по размеру, проходить через эту полупроницаемую фазу в виде пермеата. В таких вариантах осуществления, ангиогенин проходит через эту полупроницаемую фазу в виде пермеата.
Еще в одном варианте третьего аспекта эта полупроницаемая фаза позволяет компонентам, меньшим, чем 10 кДа по размеру, проходить через эту полупроницаемую фазу в виде пермеата. В одном таком варианте ангиогенин удерживается полупроницаемой фазой в качестве ретентата.
Еще в одном варианте третьего аспекта эту пробу молока заставляют протекать через полупроницаемую фазу.
В одном варианте третьего аспекта эту пробу молока заставляют проходить через полупроницаемую фазу посредством силы, прилагаемой с использованием шприца, сжатого газа, насоса, центрифужной силы или их комбинации.
В одном варианте третьего аспекта, второй фазой является полупроницаемая мембрана.
В следующем варианте третьего аспекта этот способ включает ультрафильтрацию.
Четвертый аспект обеспечивает способ получения обогащенного ангиогенином; продукта из пробы молока, предусматривающий:
(а) добавление пробы молока жидкой фазы ко второй фазе, причем указанная вторая фаза позволяет разделять компоненты пробы молока на основе размера этих компонентов;
(b) идентификацию фракций, содержащих ангиогенин, и сбор указанных фракций с получением обогащенного ангиогенином продукта.
В одном варианте этого четвертого аспекта этот способ включает эксклюзионную хроматографию по размерам (гель-фильтрацию).
В следующем варианте четвертого аспекта эта вторая фаза является смолой для эксклюзионной хроматографии по размерам.
В одном варианте четвертого аспекта эта смола разделяет белки с молекулярной массой в диапазоне приблизительно 10-20 кДа.
Пятый аспект обеспечивает способ получения обогащенного ангиогенином продукта из пробы молока, предусматривающий:
(a) приложение электрического поля к протекающей водной пробе молока в направлении, поперечном относительно потока этого молока;
(b) извлечение фракций потока молока, к которому было приложено электрическое поле; и
(c) идентификацию фракций, обогащенных ангиогенином, и сбор указанных фракций с получением обогащенного ангиогенином продукта.
В одном варианте пятого аспекта этот способ включает свободный электрофорез (электрофорез со свободным потоком (без носителя)). Этот свободный электрофорез может быть выбран из группы, состоящей из изоэлектрического фокусирования, зонального электрофореза, изотахофореза, ступенчатого электрофореза в электрическом поле и проточного фракционирования в электрическом поле. Кроме того, электрофорез со свободным потоком может быть непрерывным свободным электрофорезом или свободным электрофорезом с интервалами.
В одном дополнительном варианте осуществления этот способ проводят при денатурирующих условиях.
В следующем варианте пятого аспекта протекание водного молока проводят в: буферной среде, которая обеспечивает градиент рН. В одном варианте этот градиент является градиентом рН 8-11.
В следующем варианте одного из первого-пятого или более аспектов обогащенный ангиогенином продукт подвергают одной или нескольким дополнительным стадиям обогащения ангиогенином. Эти одна или несколько стадий обогащения ангиогенином могут быть выбраны из группы, состоящей из катионообменной хроматографии, электрофореза, в том числе свободного электрофореза, эксклюзионной хроматографии на основе размеров и ультрафильтрации. Это происходит, в частности, если важной является чистота фракции ангиогенина, например, для фармацевтического применения ангиогенина. Однако ожидается, что способ первого или второго аспектов способен обеспечивать обогащенный ангиогенином продукт высокой чистоты, в зависимости от специфичности захватывающего агента. Более высокая чистота ожидается, когда этим захватывающим агентом является антитело, специфическое в отношении ангиогенина.
Шестой аспект обеспечивает обогащенный ангиогенином продукт при получении способом по любому из первого-пятого аспектов.
Седьмой аспект обеспечивает применение обогащенного ангиогенином продукта по шестому аспекту этого изобретения в приготовлении пищевого продукта, нутрицевтического, фармацевтического или ветеринарного продукта.
Восьмой аспект обеспечивает пищевой продукт, нутрацевтический, фармацевтический или ветеринарный продукт, содержащий обогащенный ангиогенином продукт по шестому аспекту.
В варианте шестого или восьмого аспектов этот пищевой продукт является применяемой в спорте питательной или пищевой добавкой, в частности, пищевой добавкой для младенцев, атлетов, в частности участвующих в соревнованиях спортсменов, пожилых людей или немощных (слабых) людей.
Девятый аспект обеспечивает фармацевтическую композицию или ветеринарную композицию, содержащую обогащенный ангиогенином продукт по шестому аспекту.
Десятый аспект обеспечивает применение обогащенного ангиогенином продукта по шестому аспекту в приготовлении лекарственного средства для лечения и/или предупреждения нарушений, вызываемых вирусами, бактериями или грибками и их токсинами, или заболеваний, в которых требуется стимуляция ангиогенеза.
Одиннадцатый аспект обеспечивает применение обогащенного ангиогенином продукта, который может поражать патогены, которые вызывают инфекции поверхностей слизистых оболочек.
Двенадцатый аспект обеспечивает способ поражения патогенов, которые вызывают инфекции поверхностей слизистых оболочек, предусматривающий стадию введения субъекту эффективного количества нутрицевтического, фармацевтического или ветеринарного продукта по восьмому аспекту этого изобретения или композиции по девятому аспекту.
В одном варианте одиннадцатого или двенадцатого аспекта этого изобретения поверхности слизистых оболочек могут включать поверхности слизистых оболочек носа, глаз, ушей, легких, молочной железы и вагины.
Тринадцатый аспект обеспечивает способ лечения и/или предупреждения заболеваний, обусловленных вирусами, бактериями или грибками и их токсинами, или заболеваниями, в которых требуется стимуляция ангиогенеза, предусматривающий стадию введения субъекту эффективного количества нутрицевтического, фармацевтического или ветеринарного продукта по восьмому аспекту или композиции по девятому аспекту.
Краткое описание чертежей
Фигура 1 показывает одномерный ДСН-полиакриламидный гель, окрашенный Sypro Ruby (Molecular Probes) и визуализированный с использованием 5-секундной экспозиции на системе формирования изображений ProXpress (Perkin Elmer). Дорожки 1, 2 и 3 представляют 1) стандарт молекулярных масс, 2) полученную из молока фракцию и 3) элюат из меченых гранул анти-ангиогенин-IgG Protein G Dynabeads после инкубации с полученной из молока фракцией.
Фигура 2 показывает Вестерн-блот-анализ ангиогенина после иммуноаффинной очистки. Ангиогенин детектировали с использованием 0,5 мкг моноклональных мышиных антител против IgG коровы (клона 1B14D4), вторичным антителом было козье антитело против мышиного IgG IRDye 800CW (Licor), и изображение получали на устройстве для формирования изображения Odyssey infrared (Licor). Дорожки представляют 1) стандарт молекулярных масс, 2) полученную из молока фракцию и 3) элюат из меченых анти-ангиогенин-IgG Protein G Dynabeads после инкубации с полученной из молока фракцией.
Фигура 3 показывает электрофоретические разделения, сравнивающие истощенный в отношении ангиогенина ретентат и обогащенный ангиогенином пермеат, полученные посредством ультрафильтрации через мембрану 30 кДа. Содержимое дорожек: 1, стандарты молекулярных масс; 2, анализ 20-электрофореза ретентата в ДСН-ПААГ PAGE; 3, анализ lD-электрофореза пермеата в ДСН-ПААГ; 4, анализ 1D-электрофореза в ДСН-ПААГ обогащенного ангиогенином пермеата; 5, стандарты молекулярных масс; 6, анализ 2 В-электрофореза в ДСН-ПААГ обогащенного ангиогенином пермеата. Местоположение ангиогенина указано кружками.
Фигура 4 показывает электрофорез в ПААГ в смеси Трис-трицин, показывающий разделение WGFE и фракций, полученных УФ-разделением WGFE или индуцируемым нагреванием осаждением WGFE (содержимое дорожек: 1, стандарты молекулярных масс; 2, нагретый WGFE; 3, нагретый WGFE; 4, пустой; 5, пермеат 100 кДа; 6, пермеат 50 кДа; 7, пермеат 30 кДа; 8, пермеат 10 кДа; 9, пустой; 10, нефракционированный WGFE). Местоположение ангиогенина указано  .
.
Фигура 5 показывает разделение WGFE на Sephacryl S-100HR для выделения ангиогенина (сигнал оптической плотности при 280 нм, сигнал коллектора фракций, начало/конец пула).
Фигура 6 показывает разделение WGFE на Sephacryl S-300HR для выделения ангиогенина (сигнал оптической плотности при 280 нм, сигнал коллектора фракций, начало/конец пула).
Фигура 7 показывает разделение WGFE Superose 12 для выделения ангиогенина (сигнал оптической плотности при 280 нм, сигнал коллектора фракций, начало/конец пула).
Фигура 8 показывает электрофорез в ПААГ в смеси Трис-трицин, показывающий разделение WGFE и фракций, полученных SEC-разделением WGFE (содержимое дорожек: 1, нефракционированный WGFE; 2, пустой; 3, пул A S-100HR; 4, пул В S-100HR; 5, пул С S-100HR; 6, пул D S-100HR; 7, пустой; 8, пул Е S-100HR; 9, пустой; 10, стандарты молекулярных масс). Местоположение ангиогенина указано  .
.
Фигура 9 показывает электрофорез в ПААГ в смеси Трис-трицин, показывающий разделение WGFE и фракций, полученных SEC-разделением WGFE (содержимое дорожек: 1, пустой; 2, пул А S-300HR; 3, пул С S-300HR; 5, пустой; 6, пул A Superose 12; 7, пул В Superose 12; 8, пустой; 9, нефракционированный WGFE; 10, стандарты молекулярных масс). Местоположение ангиогенина указано  .
.
Фигура 10 показывает анализ с использованием двухмерного электрофореза разделения белков в экспериментах изоэлектрического фокусирования в растворе, где раствор полученного из молока белка фракционировали во фракции рН 3-5, рН 5-6,5, рН 6,5-8 и рН 8-11. Приблизительно 80% белка во фракции рН 8-11 идентифицируются как ангиогенин.
Подробное описание изобретения
Авторы этого изобретения осознали необходимость способов, которые делают возможным обогащение и выделение ангиогенина эффективным образом из легко доступного исходного материала, молока, в частности коровьего молока. Некоторые из этих способов обеспечивают высокоочищенную фракцию ангиогенина в масштабе, приемлемом для исследований, а другие способы обеспечивают коммерчески жизнеспособные способы обогащения фракций ангиогенином.
Первый и второй аспекты обеспечивают способ, в котором белок ангиогенин, присутствующий в пробе молока, отделяют от других белков и материала, присутствующего в этой пробе, с использованием захватывающего агента, который взаимодействует с белком ангиогенином.
В следующем варианте первого или второго аспекта, перед контактированием этой пробы молока с указанным контактирующим агентом, эту пробу молока добавляют к предварительному и особому носителю в отсутствие захватывающего агента или антитела, где материал, присутствующий в этой пробе молока, который взаимодействует неспецифически с этим носителем, удаляется из этой пробы молока.
В одном варианте первого или второго аспекта этот носитель является носителем на основе полимера или агарозы. Например, этим носителем может быть Белок G Dynabeads.
В следующем варианте первого или второго аспекта это антитело является поликлональным антителом или моноклональным антителом. Предпочтительно это антитело является моноклональным. Одним подходящим антителом против коровьего ангиогенина является моноклональное антитело с номером клона 1B14D4, полученное из Department of Biochemistry, Chungbuk National University, Cheongj'u, Chungbuk, Korea.
В следующем варианте первого или второго аспекта захватывающий агент или антитело иммобилизованы на носителе ковалентным присоединением к нему.
В данном контексте термин "захватывающий агент" относится к материалу, который способен "взаимодействовать" с белком ангиогенином с образованием комплекса ангиогенинзахватывающий агент. Предпочтительно, это взаимодействие делает белок ангиогенин иммобилизованным. В идеале этот захватывающий агент является специфическим только в отношении белка ангиогенина, присутствующего в пробе молока; однако квалифицированному в данной области специалисту должно быть понятно, что другие компоненты в этой пробе молока могут также взаимодействовать неспецифически с этим захватывающим агентом. Таким образом, предпочтительным захватывающим агентом является захватывающий агент, который проявляет минимальное неспецифическое связывание.
Подходящие захватывающие агенты могут включать, но не ограничиваются ими, антитела к ангиогенину, пептиды или белки (в том числе пептиды и белки, которые связывают ангиогенин, например фоллистатин), химические частицы, рецепторы, лиганды, аптамеры, полисахариды, липиды, гормоны или т.п. Предпочтительно, захватывающими агентами являются антитела или их функциональные фрагменты.
В одном варианте захватывающий агент способен различать между РНКазой 4 и ангиогенином, несмотря на 30%-ную идентичность их последовательностей.
Взаимодействие между захватывающим агентом и ангиогенином должно быть обратимым, так что ангиогенин может быть в конечном счете отделен от захватывающего агента. Это взаимодействие может быть прямым или может быть непрямым, так что взаимодействие захватывающего агента с ангиогенином опосредуется третьим (или более) агентом, например линкерной молекулой, пептидом или т.п., которые сводят захватывающий агент и ангиогенин вместе.
В одном варианте захватывающий агент соединен или "иммобилизован" с носителем. Термин "носитель" относится в этом контексте к материалу, на котором присоединены захватывающие агенты. Этот носитель может быть твердым носителем. Примеры подходящих носителей включают матриксные носители на основе полимеров или агарозы, такие как Сефароза, нитроцеллюлоза, найлон, поливинилидендифторид (PVDF), стекло, пластик, гели, золи, керамика, металлы и производные любых из них.
Захватывающие агенты могут быть присоединены к носителю прямо или опосредованно. Захватывающие агенты могут быть прямо или опосредованно депонированы при высокой плотности на этом носителе. Например, Белок А или белок G могут быть иммобилизованы на носителе. Затем захватывающие агенты, такие как антитела к ангиогенину, могут быть связаны с носителем посредством их взаимодействия с Белком А или G. Преимущество этого способа заключается в том, что посредством связывания константных областей антител с Белком А или G вариабельные районы этих антител будут полностью экспонированы для взаимодействия с ангиогенином.
Захватывающие агенты могут быть также присоединены к носителю, который является мембраной, изготовленной из полимерного, эластомерного или другого подходящего мембранного материала. Примеры таких материалов включают, но не ограничиваются ими, PVDF, нитроцеллюлозу, найлон или их модифицированные варианты. Это изобретение рассматривает применение любого такого материала, например, известного квалифицированным в данной области специалистам, для использования в Нозерн-, Саузерн- или Вестерн-блоттинге. Конкретные аспекты мембран, которые желательны для цели этого изобретения, включают способность связывания больших количеств белка ангиогенина, способность связывания белка ангиогенина с минимальной денатурацией и способность минимизации связывания не являющихся ангиогенином компонентов, присутствующих в пробе молока.
Первый и второй аспекты основываются на обратимом аффинном взаимодействии между ангиогенином и антителом к ангиогенину, которое действует в качестве захватывающего агента.
Способ этого изобретения, который использует антитела таким образом, обычно называют иммуноаффинной хроматографией. В этом отношении антитело, специфическое в отношении ангиогенина, иммобилизуют на носителе с получением активного иммуносорбента. Затем этот активный иммуносорбент упаковывают в колонку, готовую для получения подлежащей очистке пробы гетерогенного белка. К этому иммуносорбенту добавляют пробу молока, содержащую комплексную смесь белков, или пропускают эту смесь через иммуносорбент, посредством чего этот белок ангиогенин, присутствующий в этой пробе, взаимодействует с этим антителом с образованием комплекса ангиогенин-антитело, а другие белки и материал, присутствующие в этой пробе, вымываются в виде проходящей через колонку фракции. Затем это обратимое взаимодействие между антителом и ангиогенином разрушается с образованием высокоочищенного продукта в виде элюата из этой колонки, который обогащен ангиогенином.
В данном контексте термины "антитело к ангиогенину" или "антитело" включают типы поликлональных и моноклональных антител. Кроме того, термин "антитело" обозначает интактные молекулы иммуноглобулина, химерные молекулы иммуноглобулина или фрагменты Fab или F(ab')2. Антитела, определенные здесь, включают также одноцепочечные антитела (ScFv), которые содержат связанные домены vh и vl и которые сохраняют конформацию и удельную связывающую активность нативного идиотопа этого антитела. Такие одноцепочечные антитела хорошо известны в данной области и могут быть получены стандартными способами. Эти антитела могут быть антителами любого изотипа, IgG, IgA, IgD, IgE и IgM. Будет хорошо понятно, что эти антитела или их фрагменты включают антитела или фрагменты, известные в настоящее время, или антитела, которые могут стать известными в будущем.
Поликлональные антитела к ангиогенину могут быть получены способами, известными в данной области. Например, поликлональные антитела к ангиогенину могут быть получены иммунизацией кролика или козы и очисткой фракции иммуноглобулина из полученной сыворотки. Полученные антитела представляют собой смесь антител с различными специфичностями, способных связываться с различными частями белка ангиогенина, который использовался в качестве иммуногена.
Поликлональные антитела к ангиогенину могут быть также приобретены коммерчески (например, из Calbiochem, USA; Lifespan Biosciences, USA; R&D Systems, USA).
Хотя поликлональные антитела могут быть легко получены, они страдают от нескольких недостатков для использования в иммуноаффинной хроматографии. Например, они являются гетерогенными в отношении специфичности эпитопа и связывающих свойств, и должен использоваться антиген, который является совершенно чистым, во избежание возникновения нежелательных антител к минорным примесям в препарате белка. Кроме того, препарат антитела не является полностью воспроизводимым от одного иммунизированного животного к другому, затрудняя получение больших количеств согласующегося материала. Таким образом, хотя поликлональные антитела к ангиогенину могут быть использованы в способах этого изобретения, они не являются предпочтительными антителами.
Могут быть использованы моноклональные антитела к ангиогенину. Моноклональные антитела к ангиогенину могут быть получены с использованием любого способа, который обеспечивает получение молекул антител непрерывными клеточными линиями в культуре. Они включают, но не ограничиваются ими, гибридомные способы, способ В-клеточной гибридомы человека и способ EBV-гибридомы, как будет известно квалифицированному в данной области специалисту. Моноклональные антитела к ангиогенину могут быть также приобретены коммерчески (например, Abeam, UK; GeneTex, USA; BACHEM, USA).
Моноклональные антитела могут быть получены с использованием меньших количеств ангиогенина в качестве иммуногена, причем ангиогенин не должен быть чистым. Сразу после установления линии гибридомных клеток эта линия может быть использована для получения потенциально неограниченного запаса антитела с воспроизводимыми свойствами. Кроме того, моноклональное антитело будет связываться с единственным эпитопом и будет иметь гомогенные свойства связывания и элюции.
Производительность иммуносорбента зависит от характера носителя, к которому иммобилизовано это антитело. Лицу, квалифицированному в данной области, будет понятно, что эффективные иммуносорбенты должны в идеале иметь механическую и физическую стабильность, подходящие свойства текучести, приемлемый перепад давления, минимальное неспецифическое связывание, большую площадь поверхности для взаимодействия белок-антитело и химическую стабильность.
В этом отношении обычно используют матриксные носители на основе полимеров и/или агарозы, такие как Сефароза, и они являются коммерчески доступными. Примеры подходящих матриксов для носителя, который может быть использован в способе иммуноаффинной хроматографии этого изобретения, включают CNBr-активированную Сефарозу (GE Healthcare), Етрпа2е™-активированную хроматографическую смолу (Pierce Chemical), гель CM Bio-Gel A (Bio-Rad), ЕСН Сефарозу 4B (GE Healthcare), Reacti-Gel 6X (Pierce Chemical), гранулы Белок А и G Сефарозы CL 4B (Pierce Chemical), HiTrap NHS-активированный (GE Healthcare) и AffiPrep 10 (Bio-Rad).
Эффективное функционирование иммуносорбентной колонки зависит от способа химической активации, используемого для связывания антитела с матриксом, с иммобилизацией посредством этого антитела. Обычно используют ковалентное связывание. Как должно быть известно квалифицированному в данной области специалисту, имеется ряд различных протоколов для ковалентного связывания антител с твердофазным матриксом; однако самым легким является связывание антител с гранулами Белка А или Белка G. Матриксы Белок А или Белок G связываются специфически с Fc-доменом антител. После связывания этого антитела это взаимодействие стабилизируют ковалентным сшиванием этого антитела с Белком А или Белком G с бифункциональным связующим реагентом.
Другим способом является связывание этого антитела с гранулами матрикса, которые были химически модифицированы для содержания активной группы. Этот способ предоставляет преимущества над применением матриксов Белка А или Белка G, заключающиеся в том, что эти гранулы могут быть активированы в гораздо более жестких условиях, чем условия, которые могут выдерживать белки, что позволяет использовать диапазон протоколов активации, которые известны в данной области (см. также Porath and Axen, 1976, Methods Enzymol. 44: 19 to 45; Scouten WH, 1987, Methods Enzymol. 135: 30 to 65). Дополнительные преимущества этого подхода включают широкий диапазон активированных гранул, которые являются коммерчески доступными, как было показано выше, и тот факт, что многие из этих способов связывания дает связь, которая является стабильной в отношении широкого диапазона денатурирующих условий.
Химическая модификация гранул этого матрикса для генерирования активных групп может быть достигнута рядом способов, включающих обработку карбонилдиимидозолом, цианогенбромидом, N-гидроксисукцинимидом, (NHS), иодацетил- и тресилхлоридом.
Связывание между активированными гранулами и антителом к ангиогенину преимущественно опосредовано через первичные аминогруппы или сульфгидрильные группы, присутствующие на этом антителе. В качестве примера, связывание антитела (через аминогруппы) с NHS-активированным матриксом, таким как AffiPrep, для генерирования функционирующего иммуносорбента может быть достигнуто следующим образом. Подходящее количество активированного матрикса AffiPrep matrix, поставляемого в виде суспензии гранул, суспендированных в этаноле (50% о/о), выливают на воронку из спекшегося стекла и эту жидкость аспирируют посредством слабого вакуума. Оставшуюся суспензию перемешивают стеклянной палочкой и хранят во влажном виде в любое время. Эти активированные гранулы промывают охлажденной на льду дистиллированной водой для гарантии удаления всего этанола. Воду дренируют из этих гранул слабым вакуумом и эти влажные гранулы переносят в колбу, содержащую 3-5 мг/мл раствора антитела ангиогенина в буфере для связывания (0,1 М 4-морфолинпропанолсульфоновой кислоты (MOPS), 0,1 М Nad, pH 7,2). Затем содержимое этой колбы смешивают при низкой скорости в течение ночи в холодной камере или в течение 4 часов при комнатной температуре. Связывание включает реакцию между активированным эфиром на этих гранулах и реакционно-способным амином на этом антителе, которая в конечном счете приводит к образованию стабильной амидной (ковалентной) связи. После завершения этой стадии связывания гранулам дают осадиться при комнатной температуре и затем супернатант удаляют аспирацией или декантированием. Затем к этому иммуносорбенту добавляют блокирующий раствор (1 М этаноламин, рН 8,0) и перемешивают при низкой скорости в течение 1 часа при комнатной температуре. После завершения стадии блокирования этим гранулам опять дают осадиться и супернатант удаляют. Для гарантии полного блокирования неиспользованных активированных сайтов эту блокирующую стадию повторяют дополнительно два раза.
Затем к связанным с антителом гранулам добавляют лигандсвязывающий буфер (10 мМ Трис-HCl, 50 мМ NaCl, рН 6,8) и содержимое смешивают при низкой скорости в течение 1 часа при комнатной температуре. Эту стадию предпочтительно повторяют еще четыре-пять или более раз для гарантии, что весь блокирующий раствор удален из этих гранул. Затем этот иммуносорбент ресуспендируют в подходящем количестве лигандсвязывающего буфера и хранят при 4°С до использования. После этого иммуносорбент является готовым для использования и может быть упакован в колонках под действием силы тяжести для связывания ангиогенина.
Перед добавлением пробы молока в колонку приготовленных гранул, эта колонка может быть "уравновешена" подходящим промывочным буфером. Примеры подходящих промывочных буферов включают, но не ограничиваются ими, буферы, содержащие 10 мМ Трис-НСl и 50 мМ NaCl при рН 7,0, буферы, содержащие 10 мМ Трис-HCl, 140 мМ NaCl, 0,5% Тритон Х-100 и 0,5% деоксихолат натрия при рН 8,0, буферы, содержащие 10 мМ Трис-HCl, 140 мМ NaCl и 0,5% Тритон Х-100 при рН 8,0, буферы, содержащие 10 мМ Трис-HCl, 140 мМ NaCl и 0,5% Тритон Х-100 при рН 9,0, и буферы, содержащие 150 мМ NaCl, 0,1% Тритон Х-100 и 50 мМ триэтаноламин. Эта колонка может быть уравновешена одним или несколькими из перечисленных выше буферов.
Обычной, но необязательной практикой является то, что перед добавлением пробы молока на содержащую уравновешенный иммуносорбент (антителосодержащую) колонку пробу сначала пропускают через предварительную и отдельную "пре-колонку"; которая содержит тот же самый носитель, что и иммуносорбентная колонка, но которая не имеет антитела, связанного с этим носителем. Это делается для того, чтобы эта проба очищалась от материала, который, возможно, связывается неспецифически с иммуносорбентной колонкой. Эту пре-колонку уравновешивают перед добавлением пробы молока таким же образом, что и иммуносорбентную колонку, с использованием промывочных буферов, описанных выше.
Кроме того, предпочтительно, перед добавлением этой пробы молока к уравновешенной иммуносорбентной колонке и пре-колонке (если она используется) из этой пробы молока удаляют жир (что часто называют делипидированием). Однако это не является обязательным. Жир может быть удален любыми подходящими способами, известными в данной области, включающими низкоскоростное центрифугирование, разделение или микрофильтрацию. Необязательно перед способом иммуноаффинной хроматографии могут быть также удалены казеины, например микрофильтрацией через 1 мкм-мембрану, сычужным свертыванием молока или осаждением кислотой. При выборе микрофильтрации казеины будут удерживаться на этой мембране, а белки молочной сыворотки, в том числе ангиогенин, будут перемещаться в пермеат.
При удалении казеинов микрофильтрацией или другим мембранным процессом этот пермеат наносят непосредственно на уравновешенную иммуносорбентную колонку и пре-колонку (если она используется), или, необязательно, этот пермеат может быть сконцентрирован перед нанесением. Подходящие способы концентрирования включают фильтрование (например, ультрафильтрацию с мембраной 0,5-10 кДа, нанофильтрацию с мембраной 150-500 Да или обратный осмос, позволяющий только воде проникать через эту мембрану) или лиофилизацию с последующим ресуспедированием в промывочном буфере, как описано выше.
Пробу молока (неочищенную или предварительно кондиционированную) обычно добавляют в пре-колонку и/или загрунтованную иммуносорбентную колонку (т.е. твердый носитель) при скорости потока 0,2-2 колоночных объемов в час. Однако скорость потока до 5 колоночных объемов в час также является подходящей. Сразу же после добавления всей пробы следует ряд промывочных стадий с использованием любого одного или нескольких промывочных буферов, описанных выше. Эти промывочные буферы наносят до тех пор, пока промывка, которая проходит через колонку, не будет находиться при оптической плотности фона при 280 нм. Это указывает на то, что нет дополнительного несвязанного белка, который подлежит вымыванию из колонки.
Выделение ангиогенина, который связан с твердым носителем через антиген (захватывающий агент), может достигаться различными путями в зависимости от природы используемого твердого носителя. Важно избежать условий выделения, которые могут денатурировать ангиогенин. Как будет понятно квалифицированному в данной области специалисту, при выборе подходящего протокола выделения может быть рассмотрен некоторый диапазон доступных протоколов выделения. Эти протоколы могут включать кислотное выделение, основное выделение и применение хаотропных агентов.
Кислотное выделение является наиболее широко распространенным способом и обычно является очень эффективным. Обычно используемые кислоты включают глицин-НСl, рН 2,5, 0,02 М НСl и цитрат натрий, рН 2,5. Однако, во избежание индуцируемой кислотой денатурации, после выделения рН выделенной пробы должен быть быстро нейтрализован до рН 7,0 2 М Трисом-основанием, рН 8,5. Основное выделение обычно основано на отделяющих агентах, состоящих из 1 М NH4ОН, 50 мМ диэтиламина, рН 11,5, или 50 мМ раствора триэтаноламина, содержащего 150 мМ NaCl и 0,1% Тритон Х-100.
Хаотропные агенты разрушают третичную структуру белков и, следовательно, могут быть использованы для разрушения комплекса ангиогенин-антитело. Применимы хаотропные соли, так как они разрушают взаимодействия ионов, образование водородных связей и иногда гидрофильные взаимодействия. Эффективные хаотропные анионы включают SCN-, ClO4 -, I-, Br- и Сl-. Эффективные хаотропные катионы включают Mg, К и Na. Отделяющие агенты (сепаранты), такие как 8 М мочевина, 6 М гуанидин-НСl и 4 М NaSCN, являются эффективными в разрушении большинства взаимодействий антитело-ангиогенин. Однако для минимизации индуцируемой хаотропной солью денатурации белка рекомендуется быстрое обессоливание или диализ этого отделяющего агента.
Пробу, отделенную от твердого носителя, собирают и анализируют на присутствие ангиогенина и для определения степени обогащения ангиогенином. Подходящие стадии анализа включают денситометрический анализ окрашенного электрофореза в ДСН-ПААГ для сравнения относительного содержания специфической полосы белка ангиогенина с любым присутствующим загрязняющим белком, масс-спектрометрию, такую как MALDI-TOF/TOF MS, иммуноаффинное детектирование, такое как Вестерн-блоттинг или ELISA, аминокислотный анализ и секвенирование, катионообменную хроматографию и обращеннофазовую хроматографию. Каждый из этих способов будет известен квалифицированному в данной области специалисту.
Третий аспект обеспечивает способ, в котором компоненты (в том числе ангиогенин) пробы молока (обеспеченной в жидкой фазе) добавляют ко второй фазе, которая способна отделять эти компоненты пробы молока один от другого на основе размера этих компонентов. Затем отделенный ангиогенин собирают, по существу обеспечивая продукт, обогащенный ангиогенином.
В использовании здесь ссылка на "размер" в контексте компонента молока, в том числе ангиогенина, должна также пониматься как ссылка на "гидродинамический диаметр" или "гидродинамический объем" этого компонента. "Гидродинамический диаметр" или "гидродинамический объем" компонента относится к диаметру или объему этого компонента при его перемещении в жидкой форме.
"Вторая фаза" в контексте данного изобретения означает любой механизм, при помощи которого индивидуальные компоненты пробы молока могут быть разделены на основе размера каждого компонента.
В одном варианте этой второй фазой является полупроницаемая фаза. Под "полупроницаемой фазой" имеют в виду неводную фазу, с которой компоненты молока могут взаимодействовать и либо пересекать ее, либо удерживаться этой фазой.
Термин "проникают" относится к компонентам пробы молока, которые прошли через вторую фазу или проникли через вторую фазу.
Термин "ретентат" относится к компонентам пробы молока, которые удерживались второй фазой.
Например, этой полупроницаемой фазой может быть мембрана или фильтр, или т.п., которые действуют как молекулярное сито, разделяя компоненты молока согласно размеру на основе относительной пористости этой фазы.
В контексте данного изобретения компонент, который "удержан" второй фазой, является по существу захваченным и не может проходить через эту вторую фазу. Компонент, который удержан второй фазой, будет частью ретентата, которая может быть удалена из второй фазы, именно она не может проходить через эту вторую фазу. Компонент, который проходит через вторую фазу, собирают в виде пермеата.
В одном варианте этой второй фазой является полупроницаемая мембрана. В контексте данного изобретения термин "мембрана" является синонимом терминов "сетка" и "фильтр" и т.п. Эта мембрана может быть изготовлена из любого материала, который делает эту мембрану полупроницаемой или "пористой", т.е. способной позволять или предотвращать прохождение молекул через этот материал, на основе размера пор, отверстий или т.п., в этой мембране. Например, подходящие материалы включают, но не ограничиваются ими, термопластики, такие как полисульфон PSU), полиэфирсульфон (PES), ацетат целлюлозы, найлон, поливинилиденфторид (PVDF), политетрафторэтилен (PTFE), поликарбонат, полиэфиримид и полиакрилонитрил. Такие мембраны могут быть приобретены коммерческим путем из таких источников, как Millipore, Sartorius, GE Healthcare (Osmonics), Koch Membrane Systems.
Что касается способа третьего аспекта, может быть выбрана вторая фаза, которая позволяет ангиогенину проходить через вторую фазу, но препятствует прохождению молекул, больших чем ангиогенин. Например, любая вторая фаза с пределом молекулярной массы 20 кДа - 50 кДа могла бы быть приемлемой.
Термин "предел молекулярной массы" указывает максимальный молекулярный размер компонента, который способен проходить через вторую фазу. В предпочтительном варианте оптимальной второй фазой могла бы быть вторая фаза с пределом молекулярной массы 30 кДа.
Должно быть понятным, что с использованием способов данного изобретения могут быть использованы один или несколько дополнительных раундов очистки. Целью этих одного или нескольких раундов очистки является дополнительное концентрирование ангиогенина, полученного из начальной очистки, и снижение концентрации нежелательных загрязнителей. В этой связи эти дополнительные один или несколько раундов очистки могут использовать вторую фазу, которая имеет предел молекулярной массы, меньший, чем размер ангиогенина, например, может быть выбрана вторая фаза с молекулярной массой 5 кДа или 10 кДа. Таким путем может быть предотвращено прохождение ангиогенина через вторую фазу, и он будет удерживаться этой второй фазой. Затем этот очищенный ангиогенин, удерживаемый второй фазой, может быть высушен, если желательно, с использованием таких способов, как лиофилизация или распылительная сушка.
После добавления пробы молока ко второй фазе к ней может быть приложено давление, так что проба по существу нагнетается для прохождения через вторую фазу. Эта нагнетающая сила может быть применена при помощи любого механизма, который обеспечивает давление, не большее чем 290 фунтов на квадратный дюйм (20 бар), более предпочтительно 218 фунтов на квадратный дюйм (15 бар) и даже более предпочтительно 145 фунтов на квадратный дюйм (10 бар).
Например, эта сила может быть приложена с использованием шприца, сжатого газа (т.е. ячейки с мешалкой), насоса, центрифуги или их любой практичной комбинации. В идеале эту силу применяют с использованием цилиндра со сжатым азотом при давлении 70 фунтов на квадратный дюйм (5 бар).
Вариации способа третьего аспекта могут использовать связывающий агент, который является специфическим в отношении белка ангиогенина. Принципом этих вариаций является то, что комбинация ангиогенина и связывающего агента будет делать комбинацию, большей по размеру, чем один ангиогенин. Таким образом, ангиогенин, при образовании комплекса со связывающим агентом, может быть отделен от компонентов молока, которые имеют сходный размер, с использованием способов третьего аспекта. В этой связи следует выбирать вторую фазу, которая удерживает комплекс ангиогенин-связывающий агент и позволяет другим компонентам пробы молока, которые меньше по размеру, чем этот комплекс, проходить через вторую фазу.
Взаимодействие между связывающим агентом и ангиогенином должно быть обратимым, так чтобы ангиогенин мог быть в конечном счете отделен от этого связывающего агента с использованием способов этого изобретения. В этом случае должна быть выбрана вторая фаза, которая позволяет это отделение с учетом относительного размера связывающего агента и ангиогенина. Таким образом, ангиогенин может удерживаться второй фазой или позволять проходить через вторую фазу, и наоборот, для связывающего агента.
: Предполагается, что любые другие комбинации способа третьего: аспекта находятся в объеме этого изобретения. Например, способ по третьему аспекту может быть использован в начале, когда связывающий агент не присутствует.Однако, продукт, который содержит ангиогенин, может быть объединен со связывающим агентом, так что образуются комплексы ангиогенин-связывающий агент. Затем этот продукт может быть добавлен к дополнительной второй фазе для удаления не являющихся ангиогенином компонентов, присутствующих в этом продукте. После этого взаимодействие между связывающим агентом и ангиогенином может быть обращено, и эти компоненты разделяются применением к дополнительной второй фазе.
В данном контексте, в отношении третьего аспекта, термин "связывающий агент" обозначает частицу, которая способна взаимодействовать с белком ангиогенином или образовывать комплекс с белком ангиогенином и удерживать белок ангиогенин. Термины "удерживать" или "удерживание" обозначает в этом аспекте удерживание или связывание белка ангиогенина. В идеале связывающий агент является специфическим только для белка ангиогенина, присутствующего в пробе молока; однако квалифицированному в данной области специалисту будет ясно, что другие компоненты в пробе молока могут также взаимодействовать неспецифически с этим связывающим агентом. Таким образом, предпочтительным связывающим агентом является связывающий агент, который проявляет минимальное неспецифическое связывание.
Подходящие связывающие агенты могут включать, но не ограничиваются ими, антитела к ангиогенину, пептиды или белки (в том числе пептиды или белки, которые связывают ангиогенин, например фоллистатин), химические частицы, рецепторы, лиганды, полисахариды, липиды, полимеры, такие как ДЭАЭ-декстран, гормоны или т.п. Предпочтительно, этим связывающим агентом является антитело или его функциональный фрагмент.
Это взаимодействие может быть прямым или может быть непрямым, так что взаимодействие захватывающего агента с ангиогенином опосредовано третьим (или более) агентом, например линкерной молекулой, пептидом или т.п., который сводит захватывающий агент и ангиогенин вместе.
Термины "антитела к ангиогенину" или "антитело" включают поликлональные и моноклинальные типы антител, имеющих то же самое значение в отношении третьего аспекта, которое они имели в отношении первого и второго аспектов, описанных выше.
Пермеат или ретентат, собранные после стадии разделения этого способа третьего аспекта, могут быть анализированы на присутствие ангиогенина или для определения степени обогащения ангиогенином.
Четвертый аспект обеспечивает другой способ, в котором компоненты (в то числе ангиогенин) пробы молока отделяют один от каждого другого на основе их размеров. Способ, описанный в связи с этим четвертым аспектом, обычно называют эксклюзионной хроматографией размеров (или по размеру).
В контексте этого четвертого аспекта термин "размер" имеет значение, описанное выше в отношении третьего аспекта.
Термин "эксклюзионная хроматография на основе размеров" включает способы, называемые проникновением в гель, гельпроникающей хроматографией, гель-фильтрацией или гель-фильтрационной хроматографией. Таким образом, любая ссылка на "эксклюзионную хроматографию на основе размеров" должна пониматься как включающая любой из указанных выше терминов, или любой другой подобный хроматографический процесс для разделения белов от других белков или других биомолекул на основе их размера.
Принципом этого способа четвертого аспекта является то, что он обеспечивает процесс, в котором компонентам в растворах проб молока позволяют приходить в контакт со второй фазой, где эта вторая фаза влияет на скорость потока компонентов этого продукта, когда они взаимодействуют со второй фазой и/или проходят через вторую фазу на основе размера этих компонентов. Эти компоненты данного продукта становятся разделенными, так как перемещение различных компонентов, присутствующих в этой пробе, замедляется вследствие того, что эти компоненты становятся "захваченными" этой второй фазой и затем высвобождаемыми из этой второй фазы.
"Вторая фаза" в контексте данного изобретения понимается как обозначение любого механизма, при помощи которого может манипулироваться перемещение индивидуальных компонентов пробы молока на основе размера каждого компонента.
Что касается этого четвертого аспекта, эта вторая фаза может быть твердой фазой. Под "твердой фазой" имеется в виду неводный матрикс, с которым компоненты пробы молока могут взаимодействовать и/или через который они могут проходить. Твердой фазой может быть колонка для очистки, непрерывная фаза дискретных частиц, смола, мембрана или фильтр и т.д. Примеры материалов для образования этой твердой фазы включают полисахариды (такие, как агароза и целлюлоза) и другие механически стабильные матриксы, такие как диоксид кремния (например, контролируемое пористое стекло), поли(стиролдивинил)бензол, полиакриламид, керамические частицы и производные любых из описанных выше.:
В одном варианте четвертого аспекта второй фазой является смола, которая может быть упакована в хроматографическую колонку. В этом отношении этот захват может проводиться компонентами, входящими в поры, присутствующие в этой смоле. Молекулы, большие, чем диаметр пор, не могут входить в эти поры и появляться быстро из этой колонки, тогда как меньшие молекулы входят в поры этой смолы и дольше перемещаются через эту колонку. Степени захвата и последующего высвобождения варьируются от компонента к компоненту, что приводит, следовательно, к возникновению феномена разделения эксклюзией размеров.
Если эта вторая фаза состоит из пористой смолы, в идеале эта пористая структура должна быть хорошо определена и воспроизводима от партии к партии, и распределение размеров и форм пор должно быть, насколько это возможно, узким. Кроме того, отношение общего объема пор к объему пустот колонки, которая содержит эту смолу, должно быть высоким, насколько это возможно, для расширения окна, доступного для разделения, и, следовательно, улучшения максимальной эффективности. Эффективность разделения может быть дополнительно повышена, если размер смолы является малым (например, 5 мкм или менее) и регулярным. Наконец, колонка со смолой должна в идеале иметь диаметр, больший чем 5 мм, она должна быть длинной (любой длины, большей чем 100 мм) и должна быть плотно упакована смолой.
Эта смола может состоять из полиакриламида, декстрана, агарозы, диоксида кремния или сшитого полистирола. Примеры смол, подходящих для эксклюзионной хроматографии на основе размеров, могут включать, но не ограничиваются ими, Суперозу (GE Healthcare), Сефадекс (GE Healthcare), Сефакрил (GE Healthcare), TSK-GEL® hhr (Tosoh Biosciences), Toyopearl HW (Tosoh Biosciences) и TSK-GEL PW (Tosoh Biosciences), Ultrogel® AcA (IBF Biotechnics, Inc) и Bio-Gel A (Bio-Rad). Наиболее подходящие смолы могут быть смолами, дающими хорошее разделение белков с молекулярной массой 10 кДа - 20 кДа. Примеры подходящих смол включают Superose 12, Sephadex 75, Sephacryl S-100HR, Toyopearl HW-50, TSK-GEL PW-50, Ultrogel® AcA 54 и Bio-Gel A 1,5 M. Наиболее предпочтительно этой смолой может быть Sephacryl S-100HR.
Что касается приготовления ("уравновешивания") смолы для разделения, и самого процесса разделения, идеальный буфер для использования должен быть буфером низкой осмолярности и иметь нейтральный рН. В идеале подходящие буферы включают воду, фосфатный буфер, забуференный фосфатом солевой раствор, но могут быть также использованы и другие буферы со сходными свойствами.
Однако, поскольку ангиогенин является очень стабильным белком и может повторно укладываться после денатурации, подходящий буфер мог бы также иметь либо очень низкий, либо очень высокий рН, иметь высокую осмолярность или содержать денатурирующие агенты (например, додецилсульфат натрия, мочевину или гуанидин), которые могут быть удалены позднее без влияния на биоактивность ангиогенина.
Хроматографическую колонку, в идеале, уравновешивают пропусканием более 2 колоночных объемов (CV) буфера через эту колонку перед нанесением пробы молока. Скорость потока во время уравновешивания будет находиться в диапазоне 0,1-3 CV/ч. Предпочтительно скорость потока будет равна 0,66 CV/ч, хотя могла бы быть приемлемой скорость потока 1 CV/ч, если это давление не превышает давление, переносимое этой смолой. Скорость потока во время разделения будет также находиться в диапазоне 0,1-3 CV/ч. Предпочтительно скорость потока будет равна 0,375 CV/ч, хотя приемлемые разделения могут быть получены с потоками до 0,66 CV/ч.
Объем пробы, наносимой на эту уравновешенную колонку, может быть в диапазоне от 0,005 до 0,2 CV, в идеале от 0,015 CV до 0,05 CV. Количество белка, присутствующее в наносимой пробе, может находиться в диапазоне от 0,001 до 0,2 г белка/мл CV, в идеале от 0,0016 г белка/мл CV до 0,05 г белка/мл CV.
Разделение обычно имеет место на протяжении приблизительно 1-2 часов при вышеописанных условиях. В идеале разделенные фракции пробы, которые выходят из колонки, подвергают мониторингу при помощи УФ-спектрофотометра при 280 нм. Ангиогенин элюируется после иммуноглобулинов, лактоферрина и лактопероксидазы, но перед большинством факторов роста. Фракции должны быть собраны для гарантии, что ангиогенин является захваченным. Перекрывание пиков лактоферрина и лактопероксидазы будет видимым в виде зеленовато-коричневой полосы и сбор не нужно начинать, пока не выйдет эта зеленовато-коричневая полоса. Если весь β-лактоферрин был удален этой колонкой, то следующим пиком будет ангиогенин.
Пятый аспект обеспечивает способ обеспечения продукта, обогащенного ангиогенином, из молока, причем в этом способе белок ангиогенин, присутствующий в пробе молока, отделяют или фракционируют из других белков, присутствующих в этой пробе, в соответствии с зарядом и электрофоретической подвижностью ангиогенина при протекании пробы молока через электрическое поле. Таким образом, проба молока обеспечена в виде "потока водного молока".
Фракции потока молока, к которым было приложено электрическое поле, извлекали и идентифицировали фракции, обогащенные ангиогенином.
Этот способ по пятому аспекту основан на применении электрического поля для разделения гетерогенной популяции белков по их электрофоретическим подвижностям или изоэлектрическим точкам. Этот способ дополнительно основан на разделении этих белков в среде без носителя, т.е. жидкой (водной) среде в отсутствие стационарной фазы (или материала твердого носителя) для минимизации потери пробы вследствие адсорбции. Такой способ обычно называют электрофорезом в свободном потоке (свободным электрофорезом).
Способ этого пятого аспекта может выполняться в электрофоретической камере, которая образуется двумя пластинами с узким расстоянием между ними, параллельными одна другой. Эти пластины фланкированы двумя электродами (анодом и катодом), которые генерируют электрическое поле высокого напряжения между этими пластинами. Буферная среда, обычно называемая "буфером разделения", протекает через эту камеру при постоянной скорости, где это электрическое поле прилагается в направлении, поперечном относительно потока как буферной среды, так и пробы молока, подлежащей очистке.
В контексте этого пятого аспекта "поперечно" относится к приложению электрического тока к буферной среде и потоку пробы молока под углом (т.е. не параллельно) или в другой плоскости к нему.
Подлежащую анализу пробу вносят в заряженное поле и при ламинарном потоке эта проба транспортируется в буферной среде между этими двумя пластинами. Заряженные частицы отклоняются в зависимости от свойств их зарядов, делая возможным последующее разделение. Поскольку каждый белок имеет разное количество заряда, его электрофоретическая подвижность является также различной в электрическом поле. Таким образом, каждый белок отклоняется и отделяется при его протекании через эту электрофоретическую камеру в буфере для разделения вместе со скоростью течения буфера для разделения. Этот способ может быть использован для непрерывного разделения белков и, следовательно, является эффективным для выделения и очистки ангиогенина в промышленном масштабе.
В данной области известны ряд способов электрофореза в свободном потоке, каждый из которых отличается от других его способом разделения молекулярных частиц. Например, молекулярные частицы могут разделяться в соответствии с их р1 (изоэлектрическое фокусирование), общей плотностью заряда (зональный электрофорез) и электрофоретической подвижностью (изотахофорез, электрофорез со ступенчатым полем и фракционирование в свободном потоке).
Способы электрофореза в свободном потоке могут выполняться в различных режимах, включающих, например, непрерывный или транзиторно останавливаемый (с интервалами) режимы. В применениях непрерывного режима пробу молока наносят непрерывно в эту камеру, посредством чего ангиогенин отделяется от других компонентов этой пробы при непрерывном потоке буферной среды (буфера для разделения) и непрерываемом приложении электрического поля во время всего процесса разделения. В режиме с интервалами, пробу молока и буфер для разделения вводят в отдельное пространство или "зону" этой камеры, с последующим процессом разделения, где общий поток среды, включающий пробу, останавливают при приложении электрического поля для достижения разделения. После разделения/фракционирования этой пробы электрическое поле отключают или уменьшают до его неэффективности и затем общий поток опять поворачивают таким образом, что фракционированная проба прогоняется через эту камеру и затем собирается.
Способы электрофореза в свободном потоке могут также выполняться при денатурирующих условиях, например, добавлением мочевины или подходящих детергентов, известных в данной области. Квалифицированному в данной области специалисту будет понятно, что р1 ангиогенина будет одинаковым с р1 в его нативном состоянии.
Способ пятого аспекта может включать каждый из вышеупомянутых способов электрофореза в свободном потоке. Предпочтительно, ангиогенин выделяют из пробы молока в соответствии с его р1 в непрерывном режиме.
В этом отношении, как будет понятно квалифицированному в данной области специалисту, подходящая буферная среда, т.е. буфер для разделения, может включать, но не ограничивается ими, бинарные буферные системы (А/В-среды), коммерческие амфолиты, такие как Servalyt® (Serva, Germany), комплементарные мультипарные буферные системы, такие как буферы разделения Prolyte I и II (Becton Dickinson Diagnostics, Germany), и летучие буферные системы. Кроме того, перечень сред для разделения, подходящих для электрофореза в свободном потоке, обеспечен в книге "Электрофорез в свободном потоке", опубликованной К. Hanning and К. Н. Heidrich (ISBN 3-921956-88-9).
Для разделения ангиогенина в соответствии с его р1 выбранная буферная среда будет подходящей для образования градиента рН в разделительном пространстве этой камеры. В этом отношении предпочтительными являются буферы I и II Prolyte. Буфер для разделения I содержит 29% IEF буфера 2 Prolyte, а буфер для разделения II содержит 17% буфера 2 Prolyte, 50 мМ HEPES и 42 мМ 6-аминогексановую кислоту.
Термин "градиент рН" имеет в виду, что не существуют резкие границы в отношении рН. При этом определении график градиента рН в устройстве изоэлектрического фокусирования может быть показан относительно гладкой кривой без острых переходов в отношении представляющих интерес частей. Для выделения ангиогенина этот градиент предпочтительно находится в диапазоне рН 8-11.
Способ в соответствии с пятым аспектом может быть улучшен включением стабилизационной среды и противоточной среды. Например, противоточная среда может быть введена в разделительное пространство против направления непрерывного потока общего буфера для разделения и пробы, которая перемещается между электродами.
Стабилизирующие среды могут быть использованы для условий в разделительном пространстве, образованных, например, подходящими бинарными буферными системами. Таким образом, подходящая стабилизирующая среда действует также в качестве "резервуара", подающего или заменяющего ионы в зоне разделения.
Термин "стабилизирующая среда" относится в данном контексте к среде, состоящей из двух компонентов. Первым компонентом является катодная среда стабилизации, а вторым компонентом является анодная среда стабилизации. Эта катодная или анодная среда стабилизации может содержать однопротонную кислоту и/или одноосновное основание. Квалифицированному в данной области специалисту будет понятно, что ионы, образованные в этих средах стабилизации, должны иметь достаточно низкие электрофоретические подвижности.
Для эффективного выделения и эффективной очистки ангиогенина подходящая анодная среда стабилизации состоит из 100 мМ серной кислоты, 50 мМ уксусной кислоты, 100 мМ DL-2-аминомасляной кислоты и 30 мМ глицилглицина, а подходящая катодная среда стабилизации состоит из 100 мМ гидроксида натрия, 30 мМ этаноламина и 300 мМ β-аланина.
Подходящее устройство для проведения способов электрофореза в свободном потоке данного изобретения является коммерчески доступным, например, Dickinson FPE System (BD Diagnostics, Germany).
Предпочтительно, перед добавлением пробы молока в это электрическое поле, из этой пробы молока удаляют жир (что часто называют делипидированием), хотя это не является обязательным. Способы делипидирования известны в данной области и примеры таких способов описаны ниже. Необязательно, казеины могут быть также удалены перед способом электрофореза в свободном потоке, с использованием способов, известных в данной области, причем примеры таких способов также обеспечены ниже.
При удалении казеинов микрофильтрацией или другим мембранным процессом пермеат наносят непосредственно в прибор для электрофореза в свободном потоке или, необязательно, этот пермеат может быть сконцентрирован перед нанесением. Подходящие способы концентрирования включают фильтрацию (например, ультрафильтрацию с мембраной 0,5-10 кДа, нанофильтрацию с мембраной 150-500 Да или обратный осмос, позволяющий только воде проникать через эту мембрану), или лиофилизацию с последующим ресуспендированием в буфере, совместимом с электрофорезом в свободном потоке.
Предпочтительно, перед проведением способов третьего, четвертого или пятого аспектов, из этой пробы молока удаляют жир (что часто называют делипидированием). Однако это не является обязательным. Жир может быть удален любым из общепринятых способов, известных в данной области, включающих низкоскоростное центрифугирование, сепарирование или микрофильтрацию.
Эта обезжиренная проба молока может быть необязательно подвергнута стадии дополнительного "кондиционирования" перед проведением способов третьего, четвертого или пятого аспектов. Такая стадия может включать прохождение пробы через анионообменную колонку. Такие способы известны в данной области. Например, анионообменная колонка может быть наполнена смолой с такими функциональными группами, как DEAE (диэтиламиноэтил), Q (четвертичный аммоний), QAE (диэтил-(2-гидроксипропил)аминоэтил), присоединенные к подходящему носителю, такому как целлюлоза, полиакриламид, декстран, агароза, диоксид кремния или сшитый полистирол. Эта обезжиренная проба молока может проходить через колонку при скорости потока 10 CV/ч (хотя может быть использована скорость потока до 1000 CV/ч), пока не будет нанесено 10 CV обезжиренного молока (хотя могут быть использованы 0,1 CV - 50 CV). Ожидается, что могли бы быть удалены такие белки, как р-лактоглобулин, α-лактальбумин и бычий сывороточный альбумин. Белками, остающимися в этой хроматографируемой пробе, могли бы быть прежде всего лактоферрин (LF), лактопероксидаза (LP) и иммуноглобулины; однако ангиогенин мог бы также присутствовать в концентрации <1% м/м белка и он мог бы быть очищен дополнительно.
В другом варианте каждого из первого-пятого аспектов пробу молока нагревают перед проведением этого способа. Нагревание пробы молока может уменьшать количество лактопероксидазы и других белков, которые денатурируются при более низкой температуре, чем ангиогенин, в этой пробе, и, следовательно, улучшает количество ангиогенина.
Фракции, полученные из способов первого-пятого аспектов, могут быть анализированы на присутствие ангиогенина и для определения степени обогащения
26 ангиогенином. Подходящие стадии анализа включают денситометрический анализ окрашенного электрофореза в ДСН-ПААГ для сравнения относительного содержания специфической полосы белка ангиогенина с любым присутствующим загрязняющим белком, масс-спектрометрию, такую как MALDI-TOF/TOF MS, иммуноаффинное детектирование, такое как Вестерн-блоттинг или EL1SA, аминокислотный анализ и секвенирование, катионообменную хроматографию и обращеннофазовую хроматографию.
Каждый из этих способов будет известен квалифицированному в данной: области специалисту.
Способы по любому из первого-пятого аспектов могут выполняться по отдельности для получения обогащенного ангиогенином продукта или могут быть включены в качестве части интегрированного процесса фракционирования, в котором фракционируют другие желательные компоненты молочного продукта.
Обогащенный ангиогенином продукт, полученный способами любого из первого-пятого аспектов, может быть дополнительно обработан для удаления остаточных не являющихся ангиогенином белков и/или для удаления соли. Это может считаться важным для производства стандартизированных пищевых веществ или нутрицевтических веществ и для производства ангиогенина фармацевтической категории. Такие стадии могут быть достигнуты катионообменной хроматографией, одной или несколькими стадиями электрофореза в свободном потоке, иммуноаффинной хроматографией, мембранной фильтрацией, в идеале, ультрафильтрацией, или эквивалентным способом, который мог бы быть известным в данной области, например диализом, электродиализом, эксклюзионной хроматографией на основе размера, твердофазной экстракцией, нанофильтрацией или другими известными способами. Квалифицированному в данной области специалисту будет понятно, что при использовании ангиогенина для получения пищевого продукта или нутрицевтика его чистота не должна быть такой высокой, как чистота, требуемая для производства фармацевтической или ветеринарной композиции.
Например, приемлемым может считаться ангиогенин, очищенный до уровня 60%.
Поскольку ангиогенин участвует в ряде физиологических функций, обогащение этого белка с использованием способа по этому изобретению обеспечивает идеальный и экономичный источник этого белка, который может быть затем направлен на эти функции. Например, этот очищенный белок может быть использован в приготовлении пищевого продукта, нутрицевтического, фармацевтического или ветеринарного продукта.
Еще в одном варианте любого из первого-пятого аспектов до или во время этого способа казеины удаляют из пробы молока. Белки в пробе молока могут быть также сконцентрированы до или во время этого способа.
Подходящая проба молока может включать цельное молоко, обезжиренное молоко, пахту, молочную сыворотку (например, кислую или подсырную/полученную сычужным свертыванием сыворотку или пермеат из микрофильтрации молока или обезжиренного молока) или фракцию молочной сыворотки (например, концентрат белка молочной сыворотки или проходящую фракцию изолята белка молочной сыворотки) или молозиво.
Квалифицированному в данной области специалисту будет понятно, что проба молока может быть получена из любого имеющего лактацию животного, например из жвачных, таких как коровы, овцы, буйволы, козы, яки и олени, нежвачных животных, включающих лошадей и ослов, приматов, например человека, и моногастрических животных, таких как свиньи. Это животное может быть трансгенным животным, в частности животным, модифицированным для экспрессии большего количества ангиогенина в его молоке, чем в молоке эквивалентного животного дикого типа.
Предпочтительно в качестве пробы молока в любом из способов первого-пятого аспектов используют обезжиренное молоко, которое получают из цельного молока коровы, необязательно из трансгенной коровы, сверхэкспрессирующей ангиогенин в ее молоке.
Кроме того, было показано, что в коровьем молоке ангиогенин присутствует в наиболее высоком или наиболее концентрированном количестве (до 12 мг/л) в пределах первых 1-14 дней лактации. После этого эта концентрация падает до уровня фона приблизительно 1-2 мг/литр. Таким образом, в способе данного изобретения предпочтительно использовать в качестве источника ангиогенина коровье молоко, которое получают в пределах первых 14 дней лактации. При условии остаточных уровней ангиогенина в коровьем молоке из более поздней лактации его все еще можно использовать в качестве источника для способов этого изобретения.
Термин "обогащенный ангиогенином продукт" обозначает, что отношение белок ангиогенин: общий белок, присутствующий в этом продукте, является увеличенным относительно этого отношения, присутствующего в этой пробе молока перед выполнением этого способа. Для продукта, рассматриваемого как продукт, обогащенный ангиогенином, содержание ангиогенина должно быть равно по меньшей мере 2% w/w, no меньшей мере 10% w/w, по меньшей мере 20% w/w, по меньшей мере 30% w/w, по меньшей мере 40% w/w, по меньшей мере 50% w/w, по меньшей мере 60% w/w, по меньшей мере 70% w/w, по меньшей мере 80% w/w, по меньшей мере 90% w/w, по меньшей мере 95% w/w или по меньшей мере 99% w/w.
Термин "продукт" в контексте способов первого-пятого аспектов не предназначен для ограничения этого изобретения получением обогащенных ангиогенином конечных продуктов. Обогащенный ангиогенином продукт, получаемый способами этого изобретения, может быть использован в качестве исходного или промежуточного продукта в получении других продуктов.
В данном контексте термин "фракция" относится к частично очищенной части пробы молока.
Применение термина "эффективный и коммерчески жизнеспособный" обозначает недорогой и быстрый способ в сравнении со способами, используемыми в настоящее время для обогащения ангиогенином.
Типичные пищевые вещества, которые могли бы выиграть от присутствия ангиогенина, все применяемые в спорте питательные добавки, пищевые добавки для младенцев или пищевые добавки для слабых, больных или пожилых людей.
Термин "нутрицевтический" относится в данном контексте к годному в пищу продукту, выделенному или очищенному из пищевого продукта, в этом случае молочного продукта, который, как демонстрируется, имеет физиологическую пользу или обеспечивает защиту от острого или хронического заболевания или повреждения или ослабление острого или хронического заболевания или повреждения, при пероральном введении. Таким образом, этот нутрицевтический продукт может предоставляться в форме диетического препарата или добавки, либо отдельно, либо в смеси с годными в пищу пищевыми продуктами или напитками.
Эта пищевая или нутрицевтическая композиция может быть в форме растворимого порошка, жидкости или готовой для питья формой. Альтернативно, эта пищевая или нутрицевтическая композиция может находиться в форме твердого вещества в виде продукта питания, например в форме готовой для еды плитки (брикета) или зернового завтрака. Могут также присутствовать различные улучшающие вкус и запах агенты, волокна, подслащиватели и другие добавки.
Этот пищевой или нутрицевтический продукт имеет предпочтительно приемлемые сенсорные свойства (такие, как приемлемые запах, привкус и вкусовые качества) и может дополнительно содержать витамины и/или минеральные вещества, выбранные по меньшей мере из витаминов А, В1, В2, В3, В5, В6, B11, B12, биотина, С, D, Е, Н и К и кальция, магния, калия, цинка и железа.
Эта пищевая или нутрицевтическая композиция может быть получена общепринятым образом, например, эта композиция может быть получена смешиванием вместе белка и других добавок. При использовании эмульгатора, он может быть включен в эту смесь. Дополнительные витамины и минеральные вещества могут быть добавлены в этот момент, но обычно их добавляют позднее во избежание термической деградации.
Если желательным является получение порошкообразной пищевой или нутрицевтической композиции, этот белок может быть смешан с дополнительными. компонентами в порошкообразной форме. Этот порошок должен иметь содержание влаги, меньшее приблизительно 5 масс.%. Может быть также примешана вода, предпочтительно вода, которая была подвергнута обратному осмосу, для образования жидкой смеси.
Если эта пищевая или нутрицевтическая композиция должна быть обеспечена в готовой для употребления жидкой форме, она может быть нагрета для уменьшения бактериальной нагрузки. Если желательно получить жидкую пищевую или нутрицевтическую композицию, эту жидкую смесь предпочтительно асептически вводят в подходящие контейнеры. Асептическое наполнение этих контейнеров может проводиться с использованием способов, обычно доступных в данной области. Подходящий аппарат для асептического наполнения такого характера является коммерчески доступным.
Продукт, обогащенный ангиогенином, полученный способом данного изобретения, может быть также приготовлен в виде фармацевтической композиции или ветеринарной композиции, пригодной для введения субъекту.
Предпочтительно, эта композиция содержит также один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. Такие композиции могут содержать буферы, такие как нейтральный забуференный солевой раствор, забуференный фосфатом солевой раствор и т.п.; углеводы, такие как глюкоза, манноза, сахароза или декстраны; маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатообразующие агенты, такие как ЭДТА; адъюванты и консерванты. Композиции данного изобретения могут быть также приготовлены для внутривенного введения, местного применения или перорального потребления.
Термин "субъект" относится в данном контексте к любому животному, имеющему нарушение, которое требует лечения или профилактики фармацевтически активным агентом. Этим субъектом может быть млекопитающее, предпочтительно человек, или им может быть примат, не являющийся человеком, или животное, не являющее приматом, таким как животные, используемые в тестировании на моделях животных.
Хотя предполагается, в частности, что обогащенный ангиогенином продукт пригоден для применения в консервативном лечении людей, он применим также для ветеринарного лечения, включающего лечение животных-любимцев, таких как собаки и кошки, и сельскохозяйственных животных, таких как лошади, пони, ослы, мулы, ламы, альпаки, свиньи, крупный рогатый скот и овцы, или животные зоопарков, например приматы (не человек), кошачьи, собачьи, бычьи (коровьи) и копытные животные.
Обогащенный ангиогенином продукт может вводиться субъекту способом, подходящим для подлежащего лечению и/или предупреждению заболевания. Количество и частота введения будет определяться такими факторами, как состояние субъекта и тип и/или тяжесть заболевания этого субъекта. Подходящие дозы могут быть также определены при помощи клинических испытаний. Эффективное количество этой композиции может быть определено лечащим врачом с учетом индивидуальных различий в возрасте, массе, тяжести заболевания, состояний субъекта, способа введения и любых других факторов, релевантных для лечения этого субъекта. По существу, "эффективным количеством" этой композиции является количество, которое является достаточным для достижения желаемого терапевтического эффекта.
В другом аспекте данное изобретение обеспечивает способы лечения и/или предупреждения заболеваний. Такие способы лечения предусматривают введение субъекту эффективного количества нутрицевтической, фармацевтической композиции или ветеринарной композиции, как описано выше. Предпочтительно, такие заболевания включают заболевания, вызываемые вирусами, бактериями или грибками и их токсинами. Однако, поскольку ангиогенин играет роль в ангиогенезе, заболевания, в которых требуется стимуляция ангиогенеза, могут также лечиться с использованием ангиогенинсодержащей композиции этого изобретения. Эти заболевания включают заболевание коронарной артерии, инсульт, ишемическое заболевание конечностей и замедленное заживление ран.
Термины "лечение" и "обработка", используемые здесь, относятся к уменьшению тяжести и/или частоты симптомов, элиминации симптомов и/или лежащей в основе нарушения причины, предупреждению возникновения симптомов (профилактике) и/или лежащей в их основе причины и улучшению или излечению повреждения. Так, например, данный способ "лечения" нарушения включает как предупреждение этого нарушения в предрасположенном индивидууме, так и лечение этого нарушения в клинически симптоматическом индивидууме.
"Лечение" включает, в данном контексте, любую обработку или предупреждение состояния в позвоночном, млекопитающем, в частности человеке, и включает:
ингибирование этого состояния, т.е. остановку его развития; или облегчение или ослабление эффектов этого состояния, т.е. вызывание регресса эффектов этого состояния. "Профилактика" или "профилактическая" или "превентивная" терапия включает в данном контексте предотвращение возникновения состояния или ослабление последующего прогрессирования этого состояния в субъекте, который может быть предрасположен к этому состоянию, но еще не диагностирован как имеющий его.
Во всем этом описании, за исключением случаев, когда контекст диктует другое, слово "содержат" или его вариации, такие как "содержит" или "содержащий", будут пониматься в смысле включения указанного элемента или целого числа или группы элементов или целых чисел, но не для исключения любого другого элемента или целого числа или группы элементов или целых чисел.
Следует также отметить, что единственные формы "a", "and" и "the" включают множественные аспекты, если контекст не указывает явно обратное.
Квалифицированному в данной области специалисту будет понятно, что, хотя это изобретение было описано в некоторых деталях для целей ясности и понимания, могут быть произведены различные модификации и изменения описанных здесь вариантов и способов без отклонения от объема идеи изобретения, раскрытой в этой заявке.
Сведения, подтверждающие возможность осуществления изобретения
Теперь это изобретение будет дополнительно описано подробно посредством ссылки на следующий пример. Этот пример обеспечен только для целей иллюстрации и не предназначен для ограничения, если нет другого указания. Таким образом, это изобретение включает любые и все вариации, которые будут очевидными в качестве результата обеспеченного здесь описания.
Пример 1. Способ получения обогащенного ангиогенином продукта из обезжиренного молока с использованием способа по первому и второму аспектам (иммуноаффинной хроматографии)
Способ иммуноаффинной хроматографии был широко описан ранее, но не в контексте очистки ангиогенина (см., например, Subramanian A, 2002, Molecular Biotechnology, 20: 41-47).
Авторы данного изобретения показали, что ангиогенин может быть теперь экстрагирован из пробы молока с использованием описанных здесь способов.
Способ иммуноаффинной хроматографии, используемый в этом примере, выполняют с использованием моноклональных антител к ангиогенину, полученному из подходящего источника, например, Monash Antibody Technology Facility, Australia.
Глубокую колонку 10 см заполняли SP Сефарозой с большими гранулами (GE Healthcare), так что общий объем слоя колонки составлял 29,7 литров. На эту колонку наносили поток обезжиренного коровьего молока при линейной скорости потока 331 см/ч (34 литра обезжиренного молока на литр смолы в час) в течение 2 часов, пока объем нанесенного обезжиренного молока не становился равным 68 колоночным объемам смолы, упакованной в эту колонку.
Молоко, остающееся в этой колонке, удаляли добавлением 2,5 колоночных объемов (CV) воды при линейной скорости потока 147 см/ч (15 литров буфера на литр смолы в час) или 0,25 CV/мин, в течение 10 минут.
Способ иммуноаффинной хроматографии, используемый в этом примере, выполняют с использованием моноклональных антител к ангиогенину. Антителом против коровьего ангиогенина, используемым здесь, был клон с номером 1B14D4 моноклонального антитела, полученный из Department of Biochemistry, Chungbuk National University, Cheongju, Chungbuk, Korea. Антителом против ангиогенина человека, используемым здесь, был клон с номером 14017 моноклонального антитела (R&D systems. Incorporated).
Твердым носителем был Белок G-Dynabeads (Invitrogen). Антитело к ангиогенину связывали ковалентно с этими гранулами с использованием следующего протокола. Белок G-Dynabeads готовили для аффинной очистки кратковременным встряхиванием на вортексе в течение 20 секунд. После встряхивания на вортексе 50 мкл ресуспендированных IgG-Dynabeads переносили из раствора хранения (Invitrogen). С использованием магнитной установки Белок G-Dynabeads осаждали в течение 1 минуты. Супернатант удаляли и затем Белок G-Dynabeads промывали в 200 мкл W&В-буфера (0,1 М натрий-фосфатный буфер, содержащий 0,01% Твин 20, рН 8,2). Этот процесс повторяли. W&В-буфер (200 мкл), содержащий приблизительно 5 мкг мышиных антител против коровьего или человеческого ангиогенина, добавляли к Белку G-Dynabeads. Этот раствор инкубировали при комнатной температуре в течение 10 минут с вращением: Белок G-Dynabeads осаждали и супернатант удаляли. Меченные IgG Белок G-Dynabeads промывали 200 мкл W&B-6уфера. Эти меченные IgG Белок G-Dynabeads осаждали и промывочный буфер супернатанта удаляли. Эту стадию промывки повторяли. Для элюции коровьего ангиогенина использовали денатурирующие условия. Коровий ангиогенин, абсорбированный IgG-мечеными Белок G-Dynabeads, ресуспендировали в 20 мкл буфера для пробы lx NuPAGE LDS (Invitrogen, содержащего 2% додецилсульфат лития и 2-меркаптоэтанол) и нагревали в течение 10 минут при 70°С. Эти Dyriabeads помещали на магнит и эту пробу удаляли и наносили на l-D-гель для окрашивания белка (фигура 1) и Вестерн-блот-анализа (фигура 2).
Пример 2а. Способ получения обогащенного ангиогенином продукта из обезжиренного молока с использованием способа по третьему аспекту (ультрафильтрации)
Коровье обезжиренное молоко наносили на колонку, упакованную SP (сульфопропил) Сефарозой, пока объем нанесенного молока не становился равным 70 колоночным объемам смолы, упакованной в эту колонку (можно вносить до 1000 CV).
Молоко, остающееся в колонке, удаляли 5 колоночными объемами воды (буфером низкой ионной силы, <0,008 М NaCl или эквивалентом) в течение 10 минут. Фракцию, содержащую факторы роста молочной сыворотки, элюировали из этой колонки 6 колоночными объемами буфера, содержащего ионы натрия, эквивалентные 0,4-0,5 М NaCl (хотя могут быть подходящими и другие катионы), наиболее предпочтительно 0,4 М NaCl. рН в диапазоне 5,5-7,5 обеспечивает наивысшие уровни WGFE. WGFE обессоливали посредством диафильтрации в ультрафильтрационной установке, снабженной мембранами 5 кДа, и сушили лиофилизацией.
WGFE (1 г) растворяли в 50 мл воды, содержащей 0,2% Тритон Х-100. Этот раствор наносили на мембрану с пределом молекулярной массы 30 кДа (Viva Spin) и центрифугировали при 8000xg в течение 1,5 ч при 20°С.
Концентрацию белка в пермеате и ретентате определяли с использованием набора 2D-Quant (GE Healthcare). Белок осаждали из 5 объемов охлажденного на льду ацетона и осадок для пермеата и ретентата собирали центрифугированием при 10000xg в течение 20 минут. Этот осадок ресуспендировали в буфере для 2 В-электрофореза, содержащем 7 М мочевину, 2 М тиомочевину, 1,2% CHAPS, 0,4% ASB-14, 10 мМ Трис-HCl и 0,05% амфолиты-носители. Белки восстанавливали с использованием трибутилфосфина и алкилировали мономерами акриламида. Белок (100 мкг) наносили на полоски нелинейного IPG с длиной 24 см и рН 3-11 (GE Healthcare) и повторно гидратировали в течение ночи.
Изоэлектрическое фокусирование использовало 100 В в течение 2 часов, 500 В в течение 2 часов, 1000 В в течение 2 часов, с линейным увеличением до 8000 В на протяжении 4 часов и, наконец, 8000 В в течение 8 часов. IPG-полоски уравновешивали в течение 15 минут в буфере для уравновешивания, содержащем 8 М мочевину, 2% ДСН, перед проведением электрофореза в ДСН-ПААГ в течение 1 часа с последующими 150 В в течение 12 часов. Гели фиксировали в смеси уксусная кислота/метанол/вода (1:3:6) и окрашивали Sypro Ruby (Invitrogen) в течение ночи. Изображения получали с использованием системы для формирования изображений ProXpress (Perkiri Elmer) (фигура 3). Наблюдали, что пермеат был обогащен ангиогенином, как показано полосами, очерченными кружками, на фигуре 3, и значимо более низким содержанием загрязняющих белков.
Пример 2b. Способ получения обогащенного ангиогенином продукта из обезжиренного молока с использованием способа по третьему аспекту (ультрафильтрации)
Фракцию молочной сыворотки, содержащую факторы роста, получали так же, как и в примере 2а.
Эту фракцию молочной сыворотки, содержащую факторы роста (2,5 г), добавляли к 95 г воды и встряхивали при 250 об/мин в течение 30 минут с получением 2,5% (м/м) раствора. Этот раствор (15 г) помещали в четыре запускаемых центрифугой ультрафильтрационные устройства Vivaspin 20 (GE Healthcare) (10 кДа, 30 кДа, 50 кДа и 100 кДа). Эти пробирки центрифугировали при 4000xg в течение 10 минут, что приводило к приблизительно 2 мл пермеата, проходящего через эту мембрану.
Этот раствор и пермеат ультрафильтрации анализировали электрофорезом в ДСН-ПААГ. Каждую пробу (100 мкл) смешивали с 100 мкл Трис-трицин-буфера для проб (NuSep, Frenchs Forest, Australia). Белок (10 мкл) из каждой пробы наносили на гель электрофореза в Трис-трицин-ПААГ (15% акриламид, NuSep), разделяли при 150 В в течение 90 минут и окрашивали Кумасси синим (NuSep). Результаты показаны на фигуре 4. Ранее было показано, что пик 14 кДа, присутствующий в нефракционированном WGPE, является ангиогенином (PCT/AU2007/001719 Process for the Preparation of Angiogenin', фигура 2). Было обнаружено что полосы идентичного размера с ангиогенином представляют основные белки, присутствующие в пермеате 50 кДа и пермеате 100 кДа. Ангиогенин не присутствовал в пермеате 10 кДа и 30 кДа. Ранее было показано, что ангиогенин проникает через мембрану 30 кДа, так что этот результат является неожиданным и, возможно аномальным.
Пример 3. Способ получения обогащенного ангиогенином продукта из обезжиренного молока с использованием способа по четвертому аспекту (эксклюзионной хроматографии на основе размеров)
Фракцию молочной сыворотки, содержащую факторы роста, готовили так же, как в примере 2а.
Факторы роста сыворотки (5 г) добавляли к 45 г воды и встряхивали при 250 об/мин в течение 30 минут с получением 10% (м/м) раствора. Этот раствор WGFE осветляли центрифугированием (15000×g в течение 6 минут) и фильтрованием (0,45 мкм фильтр, регулируемый шприцом). Три колонки для эксклюзионной хроматографии на основе размеров (Sephacryl S-100HR 26/60, Sephacryl S-300HR 26/GO и Superose 12 26 мм D (диаметр) × 600 мм L (длина) [все изготовленные GE Healthcare]) уравновешивали 50 мМ Na2НРO4 (рН 7,0) при скорости потока 3,5 мл/мин. Раствор белка помещали в 50 мл Superloop (GE Healthcare) и затем 5 мл раствора WGFE подавали насосом на каждую колонку. Раствор WGFE разделяли подачей насосом 50 мМ Na2НРO4 (рН 7,0) через колонку при скорости потока 3,5 мл/мин. Элюат подвергали мониторингу при 280 нм (синяя линия) и собирали фракции по 10 мл (серая линия указывает старт каждой фракции), как показано на фигурах 5-7.
Пробы одинакового белка объединяли и концентрацию белка определяли ВСА-анализом (Pierce, Rockford, IL). Пробы с недостаточной концентрацией белка (<1 мг/мл) концентрировали в запускаемых центрифугой ультрафильтрационных устройствах 5 кДа Vivaspin 20 (GE Healthcare), пока концентрация белка не становилась большей, чем 1 мг/мл. Каждую пробу (100 мкл) смешивали с 100 мкл Трис-трицин-буфера для проб (NuSep). Белок (0,02 мг) из каждой пробы наносили на гель электрофореза в Трис-трицин-ПААГ (16% акриламид, NuSep), разделяли при 150 В в течение 90 минут и окрашивали Кумасси синим (NuSep). Ранее было показано, что пик 14 кДа, присутствующий в нефракционированном WGFE, является ангиогенином (PCT/AU2007/001719 'Process for the Preparation of Angiogenin', фигура 2). Пики идентичного размера с ангиогенином были обнаружены в пуле D S-100HR (фигура 8), пуле С S-300HR и пуле В Superose 12 (фигура 9).
Пробы анализировали также катионообменной ВЖХ. Пробы (100 мкл) наносили на колонку Mono S 5/50GL column (GE Healthcare), которая была уравновешена буфером А (50 мМ NaH2PO4-H2O и 5% [о/о] ацетонитрилом [рН 7,0]). Затем эту пробу элюировали увеличивающимися количествами буфера В (50 мМ NaH2PO4-H2O и 2 М NaCI [рН 7,0]) (таблица 1). Элюат подвергали мониторингу при 220 нм, 280 нм и 450 нм. Ранее было показано при помощи ВЖХ и последующей масс-спектрометрии, что ангиогенин имеет время удерживания 5,8±0,1 мин при анализе этим способом, и пики с идентичным временем удерживания были предположительно ангиогенином, и их определяли количественно.
Схема подачи насосом ВЖХ для катионообменной ВЖХ
Чистота ангиогенина в виде процента белка, определяемого катионообменной ВЖХ
Эксклюзионная хроматография размеров была показана как подходящий способ для выделения ангиогенина из экстракта факторов роста молочной сыворотки. Было показано, что Сефакрил S-100HR, Сефакрил S-300HR и Супероза 12 являются подходящими. Обогащенные ангиогенином фракции, содержащие более 55% ангиогенина, могут быть получены при помощи SEC. Эта степень чистоты может быть дополнительно улучшена дополнительными стадиями очистки.
Пример 4. Способ получения обогащенного ангиогенином продукта из обезжиренного молока с использованием способа по пятому аспекту (изоэлектрического фокусирования в растворе)
Способ изоэлектрического фокусирования в растворе был широко описан ранее, но не в контексте очистки ангиогенина (см., например, Michel P et al., 2003, Electrophoresis; 24,3-11).
Авторы этого изобретения показали, что ангиогенин может теперь экстрагироваться из пробы молока с использованием описанных здесь способов.
Способ изоэлектрического фокусирования в растворе (ISIEF), используемый в этом примере, выполняется с использованием Isoelecti-IQ2 (Proteome Systems Limited, Australia). Фракционирование выполняют при нативных (водных) или денатурирующих условиях (включающих денатурирующие агенты (денатуранты), такие как мочевина).
Prolyte (BD Diagnostics, Germany) или другие электролиты (кислые или основные) также добавляют для создания градиентов рН. Один пример градиента разделения является следующим:
Раствор для солюбилизации пробы (SSS): 7 М мочевина, 2 М тиомочевина и 1% сульфонат3-(4-гептил)фенил-3-гидроксипропилдиметиламмониопропана(С7ВzО).
Непосредственно перед разделением ISIEF белки молока разводили в 10 объемах SSS и добавляли 5 мМ трибутилфосфин и 5 мМ этилендиаминтетрауксусную кислоту. С использованием мембран с рН 3,0, 5,0, 6,5, 8,0 и 11,0 (Proteome Systems Limited, Australia) камеры для разделения проб создавали следующим образом, рН 3,0-5,0, рН 5,0-6,5, рН 6,5-8,0 и рН 8,0-11. Электродный раствор (5 мл, обеспечиваемый поставщиком) применяли на анодном и катодном концах и добавляли 5 мл белка молока, ресуспендированного в SSS, в камеру с рН 5,0-6,5. В другие камеры добавляли SSS (5 мл). Электрофорез выполняли при 14°С при постоянном напряжении 100 В в течение 2 часов, с градиентом до 1500 В на протяжении 2 часов с последующим постоянным напряжением 1500 В в течение 8 часов. Раствор в каждой камере собирали. Фракцию, обогащенную ангиогенином, собирали из катодного конца этих разделительных камер (рН 8,0-11).
Присутствие ангиогенина подтверждали двухмерным электрофорезом в ДСН-ПААГ и окрашиванием SYPRO Ruby в соответствии с инструкциями изготовителя.
Например, аликвоту, эквивалентную 40 мкг каждой белковой фракции, разводили до 128 мкл дополнительным SSS. Раствор амфолита (0,6 мкл с рН 3-11) и раствор DeStreak (GE Healthcare) добавляли к каждой пробе. Разведенные пробы пипетировали под полоски IPG NL рН 3-11 7 см (GE Healthcare) и этим полоскам IPG давали повторно гидратироваться в течение ночи. Изоэлектрическое фокусирование использует протокол 500 В в течение 1 часа, 1000 В в течение 1 часа, градиент до 5000 В на протяжении 1 часа и 5000 В в течение 2 часов. Полоски IPG вынимали из прибора для изоэлектрического фокусирования и инкубировали в течение 15 минут в буфере для уравновешивания (ЕВ; 6 М мочевина, 2% додецилсульфат натрия, 20% глицерин, 50 мМ Трис-HCL (рН 8,8), 0,01% бромфеноловый синий), содержащем 100 мг дитиотреитола на 10 мл ЕВ, с последующим вторым 15-минутным инкубированием в ЕВ, содержащем 250 мг иодацетамида на 10 мл ЕВ. Восстановленные и алкилированные полоски IPG наносили на гели электрофореза в ДСН-ПААГ (могут быть обеспечены поставщиком; например, заранее приготовленные Трис-НСl гели Invitrogen Novex) и эту полоску IPG прикрепляли к гелю покрыванием горячим рабочим буфером (Трис-основание 3,03 г/л, глицин 14,4 г/л и ДСН 1,0 г/л), содержащим 1,0% агарозу, которому затем давали остыть. Этот гель помещали в прибор для электрофореза в ДСН-ПААГ и рабочий буфер помещали в нижней и верхней ячейках этого прибора. Электрофорез проводили при 200 В в течение 1 часа. После электрофореза белки фиксировали в этом геле с использованием фиксирующего/обесцвечивающего раствора (10% метанола и 7% уксусной кислоты) перед окрашиванием в течение по меньшей мере 1 часа красителем Sypro Ruby (Invitrogen). Гели отмывали от красителя в течение по меньшей мере 1 часа в фиксирующем/обесцвечивающем растворе перед получением изображения на гель-сканирующей системе. Чистоту фракций определяли визуальным анализом этих изображений, посредством которого оценивали интенсивность и объем каждого пятна в этой фракции.
Фигура 10 показывает, что фракции рН 8-11 содержат низкомолекулярный (приблизительно 15 кДа) основный белок (приблизительно р1 10,0). Этот белок представляет приблизительно 80% общего белка этой фракции и этот белок был идентифицирован ранее как ангиогенин (PCT/AU2007/001719 'Process for the Preparation ofAngiogenin', фигура 2). Фигура 10 показывает отделение основных белков во фракции рН 8-11 от других белков в этой фракции молока.
Пример 5. Действие нагревания на способы получения обогащенного ангиогенином продукта
Фракцию молочной сыворотки, содержащую факторы роста, получали так же, как в примере 2а.
Эту фракцию молочной сыворотки, содержащую факторы роста (2,5 г), добавляли к 95 г воды и встряхивали при 250 об/мин в течение 30 минут с получением 2,5% м/м раствора. Этот раствор (10 г) помещали в стеклянную тест-пробирку на 15 мл и помещали на водяную баню, нагретую до 80°С. Температуру жидкости внутри этой тест-пробирки подвергали мониторингу при помощи датчика температуры. Этот раствор быстро достигал 70°С, и ему давали оставаться на водяной бане еще в течение одной минуты (максимальная температура 75°С). Эту тест-пробирку вынимали из бани с горячей водой и охлаждали в лабораторном стакане с водопроводной водой.
Этот раствор переносили в центрифужную пробирку на 10 мл, центрифугировали при 3000×g в течение 7 минут и супернатант фильтровали (0,45 мкм). Этот фильтрат анализировали электрофорезом в ДСН-ПААГ. Белок (0,001 мг WGFE, фильтрат с меньшим на 0,025 мг осаждением при нагревании) из каждой пробы наносили на Трис-трицин-гель для электрофореза в ДСН-ПААГ (16% акриламид, NuSep), разделяли при 150 В в течение 90 минут и окрашивали Кумасси синим (NuSep). Ранее было показано, что пик 14 кДа, присутствующий в нефракционированном WGFE, является ангиогенином (PCT/AU 2007/001719 'Process for the Preparation of Angiogenin', фигура 2). Было обнаружено, что полоса идентичного размера с ангиогенином присутствует в фильтрате нагретого WGFE. Нагревание обогащало фильтрат ангиогенином. В WGFE (дорожка 10) лактопероксидаза является основным белком, тогда как нагревание WGFE приводит к пробе, в которой ангиогенин и лактопероксидаза присутствуют в равных долях (дорожки 2 и 3), см. фигуру 4. Квалифицированным в данной области специалистам будет понятно, что стадия нагревания перед проведением любого из способов первого-пятого аспектов и особенно третьего-пятого аспектов должна увеличивать чистоту ангиогенина в обогащенном продукте.
Квалифицированному в данной области специалисту будет понятно, что способы получения ангиогенина, описанные в каждом из этих примеров, могут проводиться в масштабе коммерческих целей и могут комбинироваться с дополнительными стадиями очистки до или после проведения способов любого из первого-пятого аспектов для получения ангиогенина при чистоте фармацевтической категории.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ АНГИОГЕНИНА ИЛИ АГОНИСТОВ АНГИОГЕНИНА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ И НАРУШЕНИЙ | 2009 |
|
RU2519645C2 |
| Применение проточной фильтрующей центрифуги для извлечения лактоферрина из молочного сырья | 2021 |
|
RU2780347C1 |
| ОЧИЩЕННЫЕ БЕЛКИ ВИРУСА ПАПИЛЛОМЫ | 1995 |
|
RU2161651C2 |
| СПОСОБ ПОЛУЧЕНИЯ БАД "Л-ПФИ" ИЗ ВТОРИЧНОГО МОЛОЧНОГО СЫРЬЯ И ПОЛУЧЕННАЯ ЭТИМ СПОСОБОМ БАД "Л-ПФИ" | 2009 |
|
RU2400106C1 |
| УСОВЕРШЕНСТВОВАННЫЙ СПОСОБ ОЧИСТКИ ЛАКТОФЕРРИНА МОЛОКА И ЕГО ПРОДУКТЫ | 2013 |
|
RU2683228C2 |
| СПОСОБ ПОЛУЧЕНИЯ БАД ИЗ НИЗКОМОЛЕКУЛЯРНЫХ КАТИОННЫХ БЕЛКОВ МОЛОКА И ПОЛУЧЕННАЯ ЭТИМ СПОСОБОМ БАД | 2006 |
|
RU2318406C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОЙ ДОБАВКИ "МОБЕЛИЗ" И ПОЛУЧЕННАЯ ЭТИМ СПОСОБОМ БАД "МОБЕЛИЗ" | 2008 |
|
RU2366294C1 |
| НОВАЯ АЛЬДОЛАЗА И СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ АКТИВНЫХ IHOG И МОНАТИНА | 2005 |
|
RU2313579C2 |
| БЕЛКОВЫЙ КОМПЛЕКС, ПОЛУЧЕННЫЙ С ИСПОЛЬЗОВАНИЕМ ФРАГМЕНТА ИММУНОГЛОБУЛИНА, И СПОСОБ ПОЛУЧЕНИЯ ТАКОГО КОМПЛЕКСА | 2004 |
|
RU2356909C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОЙ ДОБАВКИ "МИЛКАНГ" И ПОЛУЧЕННАЯ ЭТИМ СПОСОБОМ БАД "МИЛКАНГ" | 2000 |
|
RU2183935C2 |




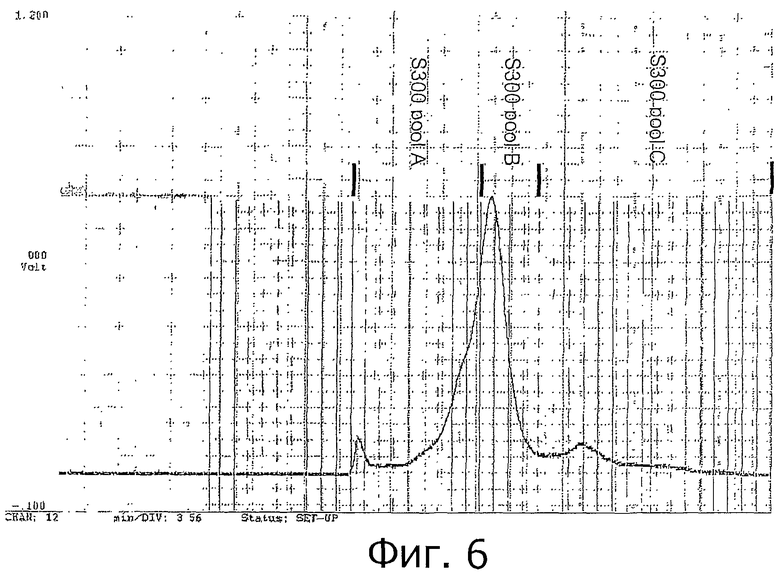

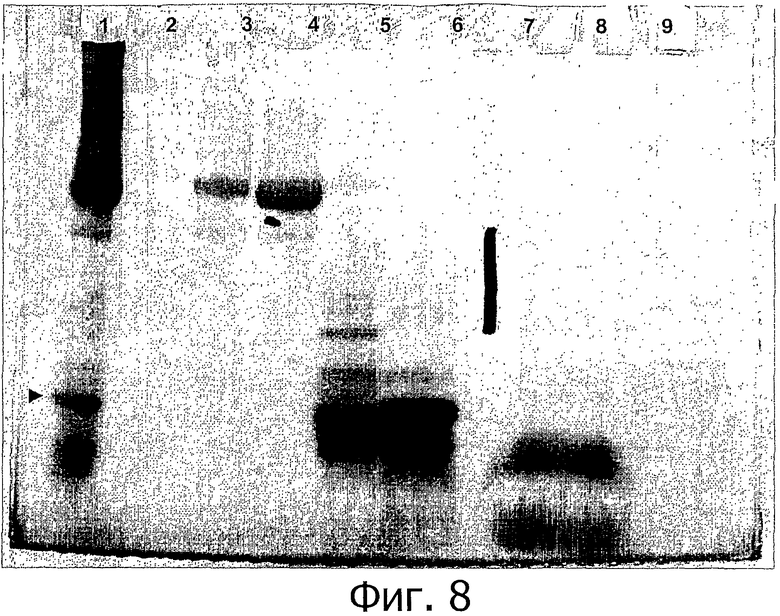

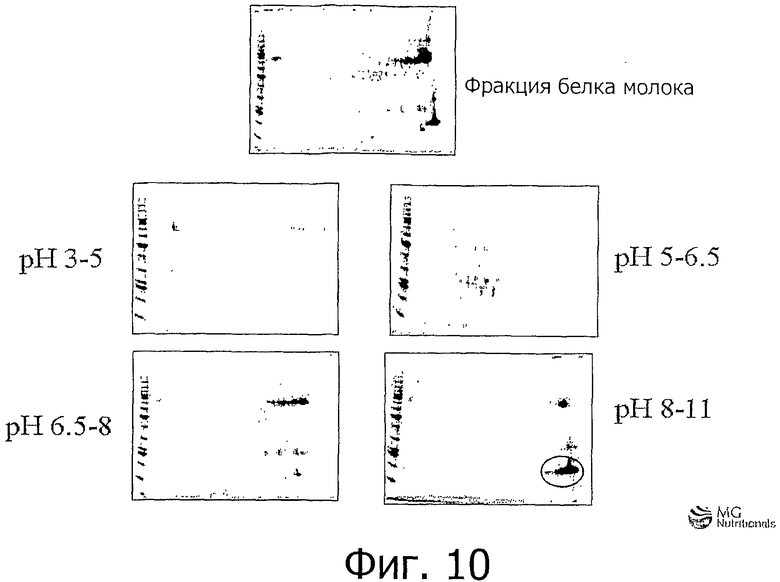
Изобретение относится к области биохимии, в частности к способу получения обогащенного ангиогенином продукта из пробы молока. Способ предусматривает нагрев пробы молока до более 70ºC, максимум до 75ºC, в течение, по меньшей мере, одной минуты, разделение фракций молока по их размеру, заряду или иммуноаффинности, выделение фракции, содержащей ангиогенин, с последующим получением обогащенного ангиогенином продукта. Изобретение позволяет увеличить чистоту ангиогенина в обогащенном продукте. 7 з.п. ф-лы, 10 ил., 2 табл., 5 пр. 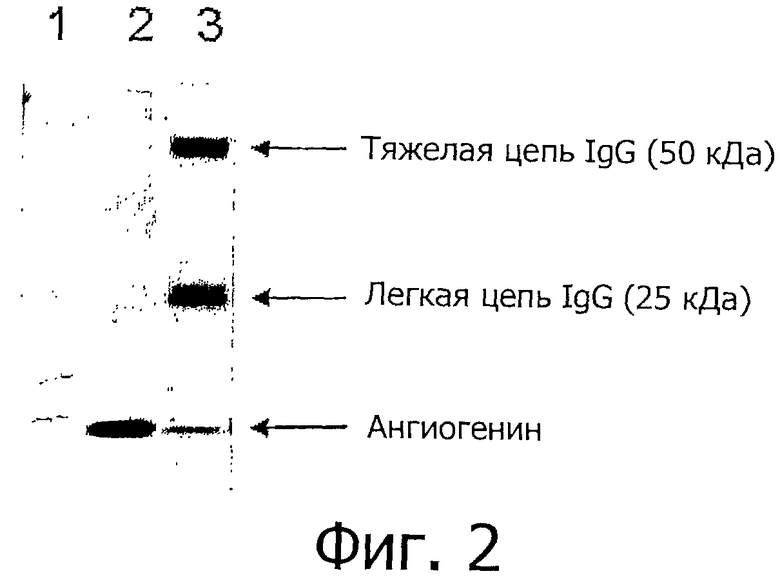
1. Способ получения обогащенного ангиогенином продукта из пробы молока, предусматривающий:
(I)
(a) добавление пробы молока к носителю, на который иммобилизовано антитело, которое взаимодействует с ангиогенином, причем ангиогенин, присутствующий в пробе молока, взаимодействует с антителом на носителе с образованием комплекса ангиогенин-антитело;
(b) вымывание компонентов, присутствующих в пробе молока, которые не взаимодействуют с антителом, из носителя для отделения комплекса от пробы молока;
(c) освобождение ангиогенина от антитела в комплексе; и
(d) сбор ангиогенина из стадии (с) с получением посредством этого продукта, обогащенного ангиогенином; или
(II)
(a) контакт пробы молока с антителом против ангиогенина, так что ангиогенин, присутствующий в пробе молока, взаимодействует с антителом с образованием комплекса ангиогенин-антитело;
(b) выделение комплекса из пробы молока;
(c) освобождение ангиогенина от антитела в комплексе; и
(d) сбор ангиогенина из стадии (с) с получением посредством этого продукта, обогащенного ангиогенином; или
(III)
(а) нанесение пробы молока в жидкой фазе, которая не является молочной сывороткой или фракцией молочной сыворотки, или которая не была подвергнута обработке сычужными ферментами или кислотной преципитации, на мембрану, которая позволяет ангиогенину и компонентам пробы молока, которые меньше, чем ангиогенин, проходить через мембрану в пермеат, но удерживать компоненты пробы молока, которые больше ангиогенина, в ретентате; и
(b) сбор пермеата с получением посредством этого продукта, обогащенного ангиогенином; или
(IV)
(a) применение эксклюзионной хроматографии к пробе молока в жидкой фазе и разделение компонентов пробы молока на фракции на основании их размера;
(b) идентификацию фракций, содержащих ангиогенин, на основании размера и сбор указанных фракций с получением обогащенного ангиогенином продукта; или
(V)
(a) приложение электрического поля к протекающей пробе молока в жидкой фазе в направлении, поперечном относительно потока молока;
(b) извлечение фракций потока молока, к которому было приложено электрическое поле; и
(c) идентификацию фракций, обогащенных ангиогенином, и сбор указанных фракций с получением посредством этого продукта, обогащенного ангиогенином;
в котором в каждом из (I)-(V) пробу молока нагревают до более 70°C и максимум до 75°C в течение, по меньшей мере, одной минуты перед стадией (а) для снижения количества лактопероксидазы и других белков, которые денатируются при температуре более низкой, чем ангиогенин в препарате.
2. Способ по п.1, который является вариантом (II), а антитело иммобилизовано на носителе.
3. Способ по п.1, который является вариантом III, а пробу молока заставляют проходить через мембрану посредством силы, прилагаемой с использованием шприца, сжатого газа, насоса, центрифуги или их комбинации.
4. Способ по п.1, который является вариантом (IV), а эксклюзионная хроматография включает гель-проникающую хроматографию или гель-фильтрацию.
5. Способ по п.1, который является вариантом (V), осуществляют при денатурирующих условиях и/или осуществляют протекание пробы молока в жидкой фазе в буферной среде, которая обеспечивает градиент pH.
6. Способ по п.5, в котором градиент находится в диапазоне pH 8-11.
7. Способ по п.1, дополнительно включающий подвергание продукта, обогащенного ангиогенином, одной или большему количеству дополнительных стадий обогащения ангиогенина, выбранных из группы, состоящей из катионобменной хроматографии, электрофореза, эксклюзионной хроматографии и ультрафильтрации.
8. Способ по любому из предыдущих пунктов, в котором проба молока выбрана из группы, состоящей из цельного молока, обезжиренного молока, пахты, молочной сыворотки, фракции молочной сыворотки и молозива.
| СПОСОБ ВЫДЕЛЕНИЯ БЕЛКОВОЙ ФРАКЦИИ, ОБОГАЩЕННОЙ АНГИОГЕНИНОМ | 2000 |
|
RU2175195C1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| СПОСОБ ВЫДЕЛЕНИЯ АНГИОГЕНИНА | 1996 |
|
RU2109748C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО БЕЛКОВОГО КОНЦЕНТРАТА, ОБОГАЩЕННОГО ПАНКРЕАТИЧЕСКОЙ РИБОНУКЛЕАЗОЙ А, АНГИОГЕНИНОМ И ЛИЗОЦИМОМ, ИЗ МОЛОЧНОГО УЛЬТРАФИЛЬТРАТА | 2001 |
|
RU2204262C2 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОЙ ДОБАВКИ "МИЛКАНГ" И ПОЛУЧЕННАЯ ЭТИМ СПОСОБОМ БАД "МИЛКАНГ" | 2000 |
|
RU2183935C2 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| ФЕДОРОВА Т.В | |||
| и др., Панкреатические рибонуклеазы молочного пермеата, Биотехнология, 2000, N6, стр | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
2015-01-10—Публикация
2009-05-14—Подача