Изобретение относится к способу получения диастереомерно чистых диалкилзамещенных первичных спиртов, конкретно, к способу получения 2-н-алкил-4-метил(этил)- замещенных 1-алканолов общей формулы (1а-с, 2а-с):
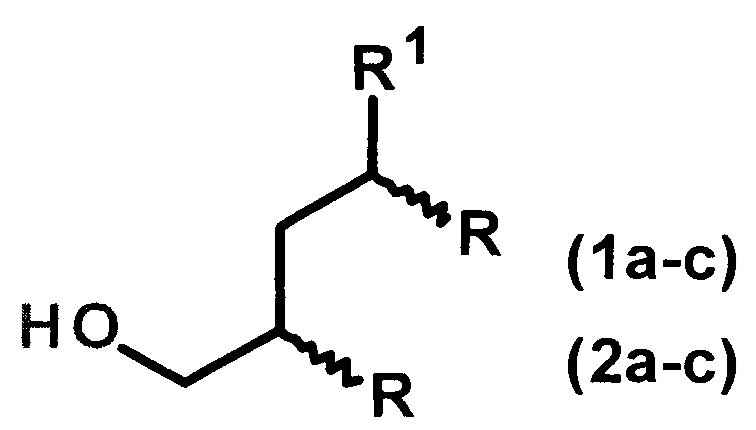
1: R1=Me, R=н-С4Н9(а), н-С6Н13(b), н-С8Н17(с);
2: R1=Et, R=н-С4Н9(а), н-С6Н13(b), н-С8Н17(с).
Разработанный способ открывает новый путь к получению практически важных диастереомерно чистых соединений, востребованных в качестве структурных блоков биологически активных молекул, инициаторов полимеризации, мономерных строительных блоков для новых привитых сополимеров, прекурсоров для получения душистых веществ, адгезивов, хиральных 2D и 3D нанообъектов ([1] Janiak Ch. Coord. Chem. Rev., 2006, V. 250, Is. 1-2, 66-94; [2] Ikai T. et al, Polymer, 2015, V. 56, 171-177; [3] Ma W. et al, Chem. Rev. 2017, 117, 8041-8093).
Известен способ ([4] Slaugh L.H., Schoenthal G.W. US 4658078 (1987)) получения винилиденовых олефинов из α-олефинов (пропена, бутена-1, гексена-1, октена-1, 3-метилбутена-1, 3,3-диметилбутена-1) под действием каталитической системы, состоящей из комплексов Cp2ZrY2 (Y=Н, Me, Cl) и алюмоксанов, полученных в реакции AlR3 (R=Me, Et, Bui) с кристаллогидратом CuSO4⋅5H2O, при соотношении [Zr] : [Al] = 1:(8-600) в интервале температур 0-150°С. Данный способ не позволяет получать диастереомерно чистые 2-н-алкил-4-метил(этил)- замещенные 1-алканолы.
Известен способ ([5] Christoffers J. et al, J. Am. Chem. Soc. 1996, V. 118, 4715-4716; [6] Christoffers J. et al, Inorg. Chim. Acta, 1998, V. 270, 20-27) получения димеров терминальных алкенов с помощью каталитической системы, состоящей из цирконоцендихлорида (Cp2ZrCl2) и метилалюмоксана (МАО). Показано, что в присутствии 0,1-1,0 мол. % Cp2ZrCl2 при соотношении [Zr] : [Al] : [алкен-1] = 1:1:(90-500) селективно проходит димеризация α-олефинов с образованием продуктов, содержащих винилиденовый фрагмент, по схеме:
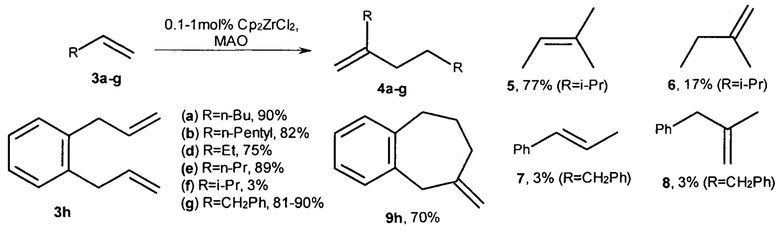
Данный способ не позволяет получать диастереомерно чистые 2-н-алкил-4-метил(этил)- замещенные 1-алканолы.
Известен способ ([7] Wahner U.M. et al., Angew. Makromol. Chem., 1999, V. 270, 49-55) получения димеров пентена-1 под действием Cp2ZrCl2 в присутствии МАО. Показано, что при проведении реакции в толуоле при 60°С в течение 24 ч и соотношении реагентов пентен-1/МАО/металлоцен 30000:1000:1 выход олигомерных продуктов составляет 35%, среди которых содержание димера - 2-н-пропил-гептена-1 (4е) находится на уровне 25%. Данный способ не позволяет получать диастереомерно чистые 2-н-алкил-4-метил(этил)- замещенные 1-алканолы.
Известен способ ([8]  R., et al., Macromol. Symp., 2001, V. 165, 11-18) получения димеров пентена-1 под действием катализаторов Cp2ZrCl2 Cp2ZrCl{O(Me)CW-(CO)5} и Cp2ZrCl(OMe) в присутствии МАО. В ходе проведения реакции при 20-150°С и соотношении реагентов пентен-1/МАО/металлоцен 30000:(1000-8000):1 образуются низкомолекулярные олигомерные продукты, в том числе димер - 2-н-пропил-гептен-1, выход которого в значительной степени зависит от условий проведения реакции и не превышает 15%. Данный способ не позволяет получать диастереомерно чистые 2-н-алкил-4-метил(этил)- замещенные 1-алканолы.
R., et al., Macromol. Symp., 2001, V. 165, 11-18) получения димеров пентена-1 под действием катализаторов Cp2ZrCl2 Cp2ZrCl{O(Me)CW-(CO)5} и Cp2ZrCl(OMe) в присутствии МАО. В ходе проведения реакции при 20-150°С и соотношении реагентов пентен-1/МАО/металлоцен 30000:(1000-8000):1 образуются низкомолекулярные олигомерные продукты, в том числе димер - 2-н-пропил-гептен-1, выход которого в значительной степени зависит от условий проведения реакции и не превышает 15%. Данный способ не позволяет получать диастереомерно чистые 2-н-алкил-4-метил(этил)- замещенные 1-алканолы.
Известен способ ([9] Boccia А.С. et al., Macromol. Chem. Phys., 2005, V. 205, 1320-1326) димеризации γ-разветвленных α-олефинов под действием катализаторов Cp2MCl2 (М=Ti, Zr, Hf), Me2SiCp2ZrCl2 и МАО (условия: 8,6⋅10-6 моль катализатора, 5,0⋅10-3 моль МАО и 1 мл мономера при 20°С, растворитель - толуол). В присутствии катализатора Me2SiCp2ZrCl2 выходы димеров 3-метил-1-бутена (3i), 3-метил-1-пентена (3j), 3,7-диметил-1-октена (3k), винилциклопентана (3l), 3-этил-1-пентена (3m), винилциклогексана (3n), составили 11, 19, 100, 100, 100, 100%, соответственно.
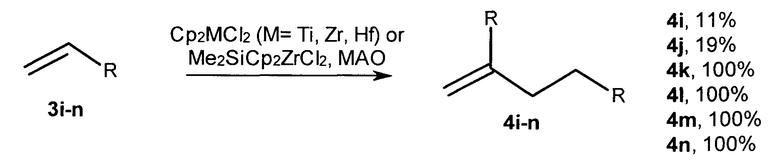
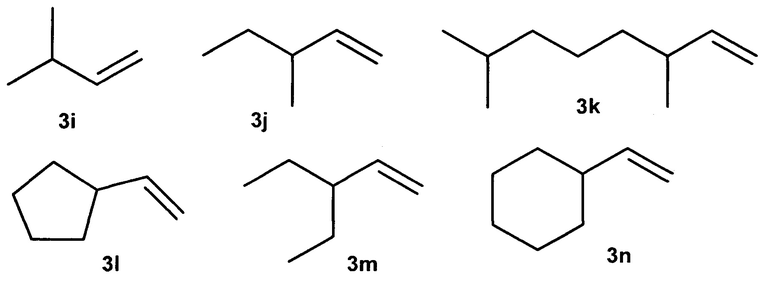
Данный способ не позволяет получать диастереомерно чистые 2-н-алкил-4-метил(этил)- замещенные 1-алканолы.
Известен способ ([10] Kretschmer W.P. et al, Organometallics, 1998, V. 17, 284-286) региоселективной гомодимеризации гексена-1 (продукт-5-метиленундекан, выход 80%), 3-метил-1-бутена (продукт-2,6-диметил-3-метиленгептан, выход 90%), триметилвинилсилан (продукты (Е)-1,4-бис(триметилсилил)бут-1-ен, 48%, (Z) - 24%, (Е)-1,4-бис(триметилсилил)бут-2-ен, 26%), стирола (продукты (Е)-1,4-дифенилбут-1-ен, 87%, (Z) - 5% (Е)-1,3-дифенилбут-1-ен, 6%) под действием катализатора {(2,4,7-Me3-Ind)2Y(μ-Н)}2 в бензоле при 80-100°С и 20-50-кратном мольном избытке α-олефинов. Данный способ не позволяет получать диастереомерно чистые 2-н-алкил-4-метил(этил)- замещенные 1-алканолы.
Известен способ ([11]  I.E. et al., Cat. Comm., 2016, V. 79, 6-10) получения димера гексена-1-2-н-бутил-1-октена под действием катализаторов - цирконоценов различной структуры, триизобутилалюминия, Et2AlCl и МАО. Показано, что в присутствии катализатора [OSiMe2Cp2]ZrCl2 при соотношении реагентов AlBui3 : MAO : Et2AlCl : [Zr] = 20:10:2:1 конверсия алкена и выход продукта составляет 100% и 94%, соответственно. Данный способ не позволяет получать диастереомерно чистые 2-н-алкил-4-метил(этил)- замещенные 1-алканолы.
I.E. et al., Cat. Comm., 2016, V. 79, 6-10) получения димера гексена-1-2-н-бутил-1-октена под действием катализаторов - цирконоценов различной структуры, триизобутилалюминия, Et2AlCl и МАО. Показано, что в присутствии катализатора [OSiMe2Cp2]ZrCl2 при соотношении реагентов AlBui3 : MAO : Et2AlCl : [Zr] = 20:10:2:1 конверсия алкена и выход продукта составляет 100% и 94%, соответственно. Данный способ не позволяет получать диастереомерно чистые 2-н-алкил-4-метил(этил)- замещенные 1-алканолы.
Известен способ ([12]  I.E. et al., Applied Catalysis A, General, 2018, V. 549, 40-50) получения олигомеров 1-гексена, 1-октена и 1-децена под действием катализаторов - цирконоценов различной структуры. В составе продуктов реакции присутствуют димеры, содержащие винилиденовый фрагмент. Реакцию проводят при соотношении реагентов α-олефин : L2ZrCl2 : AlBui3 : МАО = 200:1:20:10 без растворителя или в среде гептана при 60°С. Данный способ не позволяет получать диастереомерно чистые 2-н-алкил-4-метил(этил)- замещенные 1-алканолы.
I.E. et al., Applied Catalysis A, General, 2018, V. 549, 40-50) получения олигомеров 1-гексена, 1-октена и 1-децена под действием катализаторов - цирконоценов различной структуры. В составе продуктов реакции присутствуют димеры, содержащие винилиденовый фрагмент. Реакцию проводят при соотношении реагентов α-олефин : L2ZrCl2 : AlBui3 : МАО = 200:1:20:10 без растворителя или в среде гептана при 60°С. Данный способ не позволяет получать диастереомерно чистые 2-н-алкил-4-метил(этил)- замещенные 1-алканолы.
Известен способ ([13] Ковязин П.В. и др., Вестник Башкирского университета, 2016, Т. 21, №4, 906-911) получения диастереомерно чистых функционально замещенных димеров и олигомеров алкенов (гексена-1, октена-1) в реакции с триалкилаланами AlR3 (R=Me, Et) в присутствии анса-цирконоценов rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, С2Н4) и МАО при температуре 20-60°С и соотношении реагентов [Zr] : алкен : AlR3 : МАО = 1:200:(50-800):(40-250) в толуоле. Полученные ди- и олигомеры представляют собой как функционально замещенные алюминийорганические соединения, так и высшие разветвленные олефины с метиленовой двойной связью. Данный способ не позволяет получать диастереомерно чистые 2-н-алкил-4-метил(этил)- замещенные 1-алканолы.
Наиболее близким к изобретению является способ ([14] Parfenova L.V. et al., Dalton Trans., 2016, V. 45, 12814-12826) получения диастереомерно чистого 4-метил-2-н-гексил-1-деканола (1с) с выходом 29% в реакции октена-1 с AlMe3 в присутствии катализатора rac-[Me2Si(η5-C9H10)2]ZrCl2 и МАО, взятых в мольном соотношении [Zr] : алкен : AlMe3 : МАО = 1:50:200:50, за 120 ч при комнатной температуре с последующим окислением реакционной массы сухим O2 и гидролизом водным раствором HCl. В этой же работе описан синтез диастереомера 2-н-бутил-4-этил-1-октанола с выходом 7% в реакции гексена-1 с AlEt3, катализируемой комплексами rac-[Y(η5-C9H10)2]ZrX2 (Y=SiMe2, С2Н4; X = S-бинафтолат), взятых в мольном соотношении [Zr] : алкен : AlEt3 = 1:50:60, в среде CH2Cl2 за 72 ч при температуре 20°C с последующим окислением реакционной массы сухим O2 и гидролизом водным раствором HCl.
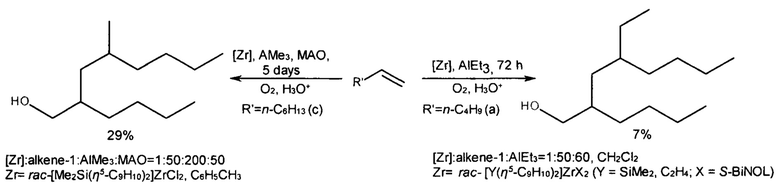
Известный способ не позволяет получать 2-н-алкил-4-метил(этил)- замещенные 1-алканолы с достаточным выходом.
Таким образом, приведенный в литературе метод синтеза 2-н-алкил-4-метил(этил)- замещенных 1-алканолов из линейных терминальных алкенов приводит к низкому выходу целевых продуктов.
Задачей изобретения является разработка однореакторного способа получения диастереомерно чистых 2-н-алкил-4-метил(этил)- замещенных 1-алканолов (1а-с, 2а-с) в реакции линейных терминальных алкенов с триалкилалюминием (AlR13, R1=Me, Et) в присутствии катализаторов rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, C2H4) с последующим окислением реакционной массы сухим O2 и гидролизом с помощью HCl.
Сущность способа заключается во взаимодействии линейных терминальных алкенов (гексена-1, гептена-1, октена-1) с триалкилалюминием (AlR13, R1=Me, Et) в присутствии катализаторов rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, С2Н4) и метилалюмоксана, взятых в мольном соотношении [Zr] : [алкен] : [AlR13] : [МАО] = 1:200:(200-240):40, в атмосфере аргона при комнатной температуре (~22°С) и атмосферном давлении в толуоле или хлористом метилене в течение 72 ч с последующим окислением сухим O2 и гидролизом с помощью 10% раствора HCl. Выход целевых продуктов (1а-с, 2а-с) составляет 22-54%. Реакция проходит по схеме:
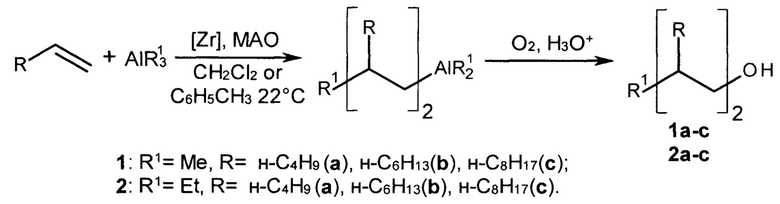
2-н-алкил-4-метил(этил)-замещенные 1-алканолы (1а-с, 2а-с) образуются в результате двухстадийного синтеза без выделения промежуточных продуктов. На первой стадии используются терминальные линейные алкены, AlR13 (R1=Me, Et) и rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, C2H4) в качестве катализаторов. На второй стадии применяется газообразный кислород. В присутствии других алюминийорганических соединений (например, AlBui3, Et2AlCl) целевые продукты (1а-с, 2а-с) не образуются. Использование других комплексов переходных металлов в качестве катализаторов, например, ZrCl4, Zr(acac)4, Cp2TiCl2, Cp2ZrCl2 приводит к снижению хемо- и диастереоселективности реакции. Повышение температуры реакции до 40°С приводит к увеличению выхода побочных продуктов, содержащих винилиденовые двойные связи.
Реакцию проводили при перемешивании на магнитной мешалке, при температуре ~22°С. При температуре выше 40°С возрастает скорость протекания побочных реакций. Понижение температуры снижает выход (1а-с, 2а-с), а также увеличивает время реакции.
Проведение реакции в присутствии катализаторов rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, C2H4) больше 4 мол. % по отношению к олефину не приводит к существенному увеличению выхода целевого продукта (1а-с, 2а-с). Уменьшение концентрации катализатора менее 1 мол. % вызывает снижение скорости реакции и выхода спиртов (1а-с, 2а-с).
Изменение соотношения исходных реагентов в сторону уменьшения исходной концентрации AlR13 приводит к снижению скорости реакции и выхода целевого продукта (1а-с). Увеличение исходной концентрации AlR13 не приводит к значительному увеличению выхода (1а-с). Уменьшение концентрации МАО (до 10 экв.) или увеличение концентрации комплекса (до 1 мол. %) в каталитической системе приводит к увеличению выхода низкомолекулярных продуктов карбо- и гидроалноминирования олефинов. Большой избыток МАО (200-250 экв.), как и повышение температуры до 60°С приводит к образованию олигомеров с винилиденовой двойной связью (58-92%).
Существенные отличия предлагаемого способа:
1. В предлагаемом способе используется мольное соотношение исходных реагентов алкен : МАО : AlR13 : [Zr] = 200:40:200:1, тогда как в известных способах соотношение алкен : МАО : AlR13 : [Zr] составляет 50:(0-50):(60-200):1.
Предлагаемый способ обладает следующими преимуществами:
1. Способ обеспечивает получение целевых продуктов - 2-н-алкил-4-метил(этил)- замещенных 1-алканолов (1а-с, 2а-с) с выходом 22-54%.
Способ поясняется следующими примерами:
Общая методика. В стеклянный реактор объемом 100 мл, установленный на магнитной мешалке, заполненный аргоном, загружали 1 ммоль катализатора rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, С2Н4), 15 мл C6H5CH3 или CH2Cl2, 200 ммоль AlR13 40 ммоль МАО и 200 ммоль олефина. Реакцию проводили при температуре 20°С при непрерывном перемешивании в течение 24-72 часов. По окончании реакции часть реакционной массы разлагали 10% DCl при 0°С. Продукты экстрагировали бензолом, фильтровали, органический слой сушили над Na2SO4. Выход продуктов реакции определяли с помощью анализа продуктов дейтеролиза методом ГЖХ и хроматомасс- спектрометрии.
Оставшуюся реакционную массу охлаждали до 0°С и окисляли барботированием O2 в течение 2 ч., затем выдерживали в атмосфере кислорода еще в течение 24 часов. Продукты разлагали HCl и экстрагировали диэтиловым эфиром, органический слой сушили над Na2SO4, фильтровали и упаривали. Функционально замещенные олигомеры (1а-с, 2а-с) были выделены колоночной хроматографией на силикагеле с помощью системы гексан: диэтиловый эфир 7:1.
Пример 1. В стеклянный реактор объемом 100 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 18 мг (0.04 ммоль) катализатора rac-[Me2Si(η5-C9H10)2]ZrCl2, 0.8 мл AlMe3 (98%, 8 ммоль), 0,71 мл МАО (7% Al раствор в толуоле, 1,6 ммоль) и 1 мл гексена-1 (8 ммоль). Реакцию проводят при температуре 20-22°С при непрерывном перемешивании в течение 72 часов. По окончании реакции часть реакционной массы разлагали 10% DCl при 0°С. Продукты экстрагировали бензолом, фильтровали, органический слой сушили над Na2SO4. Выход продуктов реакции определяли с помощью анализа продуктов дейтеролиза методом ГЖХ и хроматомасс-спектрометрии. Оставшуюся реакционную массу охлаждают до 0°С и барботируют сухим O2 в течение 2 ч. Реакционную массу затем перемешивают в атмосфере кислорода еще в течение 24 ч. Полученную смесь гидролизуют 10%-ым раствором HCl. Продукт экстрагируют диэтиловым эфиром. Органический слой сушат над Na2SO4. Продукт выделяют при помощи колоночной хроматографии на силикагеле. Получают спирт 1а с выходом 33% (Табл. 1, №3).
Пример 2. В стеклянный реактор объемом 100 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 17 мг (0.04 ммоль) катализатора rac-[H4C2(η5-C9H10)2]ZrCl2, 0,8 мл AlMe3 (98%, 8 ммоль), 0,71 мл МАО (7% Al раствор в толуоле, 1,6 ммоль) и 1 мл гексена-1 (8 ммоль). Реакцию проводят при температуре 20-22°С при непрерывном перемешивании в течение 24-72 часов. По окончании реакции часть реакционной массы разлагали 10% DCl при 0°С. Продукты экстрагировали бензолом, фильтровали, органический слой сушили над Na2SO4. Выход продуктов реакции определяли с помощью анализа продуктов дейтеролиза методом ГЖХ и хроматомасс-спектрометрии. Оставшуюся реакционную массу охлаждают до 0°С и барботируют сухим O2 в течение 2 ч. Реакционную массу затем перемешивают в атмосфере кислорода еще в течение 24 ч. Полученную смесь гидролизуют 10%-ым раствором HCl. Продукт экстрагируют диэтиловым эфиром. Органический слой сушат над Na2SO4. Продукт выделяют при помощи колоночной хроматографии на силикагеле. Получают спирт 1а с выходом 22% (Табл. 1, №1).
Пример 3. В стеклянный реактор объемом 100 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 18 мг (0.04 ммоль) катализатора rac-[Me2Si(η5-C9H10)2]ZrCl2, 1,1 мл AlEt3 (98%, 8 ммоль), 0,71 мл МАО (7% Al раствор в толуоле, 1,6 ммоль) и 1 мл гексена-1 (8 ммоль). Реакцию проводят при температуре 20-22°С при непрерывном перемешивании в течение 24-72 часов. По окончании реакции часть реакционной массы разлагали 10% DCl при 0°С. Продукты экстрагировали бензолом, фильтровали, органический слой сушили над Na2SO4. Выход продуктов реакции определяли с помощью анализа продуктов дейтеролиза методом ГЖХ и хроматомасс-спектрометрии. Оставшуюся реакционную массу охлаждают до 0°С и барботируют сухим O2 в течение 2 ч. Реакционную массу затем перемешивают в атмосфере кислорода еще в течение 24 ч. Полученную смесь гидролизуют 10%-ым раствором HCl. Продукт экстрагируют диэтиловым эфиром. Органический слой сушат над Na2SO4. Продукт выделяют при помощи колоночной хроматографии на силикагеле. Получают спирт 2а с выходом 54% (Табл. 1, №4).
Пример 4. В стеклянный реактор объемом 100 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 17 мг (0.04 ммоль) катализатора rac-[H4C2(η5-C9H10)2]ZrCl2, 1,1 мл AlEt3 (98%, 8 ммоль), 0,71 мл МАО (7% Al раствор в толуоле, 1,6 ммоль) и 1 мл гексена-1 (8 ммоль). Реакцию проводят при температуре 20-22°С при непрерывном перемешивании в течение 24-72 часов. По окончании реакции часть реакционной массы разлагали 10% DCl при 0°С. Продукты экстрагировали бензолом, фильтровали, органический слой сушили над Na2SO4. Выход продуктов реакции определяли с помощью анализа продуктов дейтеролиза методом ГЖХ и хроматомасс-спектрометрии. Оставшуюся реакционную массу охлаждают до 0°С и барботируют сухим O2 в течение 2 ч. Реакционную массу затем перемешивают в атмосфере кислорода еще в течение 24 ч. Полученную смесь гидролизуют 10%-ым раствором HCl. Продукт экстрагируют диэтиловым эфиром. Органический слой сушат над Na2SO4. Продукт выделяют при помощи колоночной хроматографии на силикагеле. Получают спирт 2а с выходом 23% (Табл. 1, №2).
Примеры 5, 6, 7, 8, 9, 10, 11 и 12 для октена-1, децена-1 в присутствии разных AlR13 (R1=Me, Et) и катализаторов rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, C2H4) выполнены аналогично примерам 1-4. Результаты приведены в таблице 1.
Спектральные характеристики 1а-с, 2а-с.
4-Метил-2-н-бутил-1-октанол (1a). 1Н NMR (CDCl3) δ 0.846-0.911 (м, 3Н, CH3CH), 0.873-0.954 (м, 6Н, CH3CH2), 0.992-1.090 (м, 1Н, CHCHHCH), 1.232-1.332 (м, 1Н, CHCHHCH), 1.1963-1.3125 (м, 1Н, CHHCHCH2OH), 1.3621-1.4537 (м, 1Н, CHHCHCH2OH), 1.057-1.170 (м, 1Н, CHHCHCH2), 1.2594-1.3384 (м, 1Н, CHHCHCH2), 1.1799-1.3798 (м, 8Н, CH2), 1.450-1.538 (м, 1Н, CH3CHCH2), 1.517-1.613 (м, 1Н, CHCH2OH). 13С ЯМР (CDCl3) δ 14.11, 14.15 (СН3СН2), 20.00 (СН3СН), 23.11, 23.03 (СН3СН2), 29.09, 29.26 (СН2СН2СН2), 30.25 (СН3СН), 31.44 (СН2СН2СН), 37.19 (СН2СНСН3), 37.87 (CHCH2OH), 38.84 (СНСН2СН), 65.68 (СН2ОН). m/z (EI) (%): 182.10 [М-H2O] (1.00), 154.10 (1.5), 143.10 (1.3), 140.10 (4.8), 127.10 (1.43), 126.10 (5.3), 125.10 (30.7), 124.10 (3.8), 113.15 (4.9), 112.10 (5.7), 111.1 (9.7), 110.15 (1.1), 100.1 (1.8), 99.1 (21.4), 98.1 (20.5), 97.05 (10.9), 96.1 (2.5), 95.0 (1.2), 86.1 (2.4), 85.1 (38.5), 84.0 (23.6), 83.0 (24.2), 82.0 (5.8), 81.0 (2.6), 72.0 (2.1), 71.0 (44.5), 70.0 (41.5), 69.0 (48.8), 68.1 (2.8), 67.0 (3.9), 59.0 (1.2), 58.0 (4.8), 57.0 (100), 56.0 (45.6), 55.0 (46.4), 54.0 (2.2), 53.0 (2.6), 45.0 (1.6), 44.0 (3.1), 42.0 (7.5), 41.0 (36.2), 40.0(1.2).
4-Метил-2-н-гексил-1-деканол (1b). 1Н NMR (CDCl3) δ 0.825-0.912 (м, 3Н, CH3CH), 0.861-0.962 (м, 6Н, CH3CH2), 0.9865-1.0932 (м, 1Н, CHCHHCH), 1.2386-1.3376 (м, 1Н, CHCHHCH), 1.0447-1.1707 (м, 1Н, CHHCHCH3), 1.2505-1.3474 (м, 1Н, CHHCHCH3), 1.1789-1.3385 (м, 1Н, CHHCHCH2OH), 1.3668-1.4511 (м, 1Н, CHHCHCH2OH), 1.2088-1.4026 (м, 8Н, CH2), 1.4272-1.548 (CHCH3), 1.5043-1.6153 (м, 1Н, CHCH2OH), 3.4776-3.6213 (м, 2Н, CH2OH). 13С NMR (CDCl3) δ 14.11 (CH3CH2), 20.01 (CH3CH), 22.69 (СН3СН2), 26.81, 26.99 (СН2СН2СН), 29.67, 29.73 (СН2СН2СН2СН), 30.27 (СНСН3), 31.89, 31.94 (СН3СН2СН2), 31.73 (СН2СНСН2ОН), 37.49 (СН2СНСН3), 37.89 (СНСН2ОН), 38.86 (СНСН2СН), 65.70 (СН2ОН). m/z (EI) (%): 238.95 [М-H2O] (6.9), 236.2 (3.8), 234.7 (4.8), 224.1 (20.9), 222.1 (3.0), 220.9 (3.9), 214.9 (1.4), 214.0 (2.5), 207.8 (4.3), 189.0 (10.4), 185.1 (5.2), 182.2 (4.6), 171.0 (5.6), 170.0 (6.9), 167.1 (5.7), 155.5 (4.9), 153.1 (6.2), 152.1 (5.0), 141.0 (10.9), 127.1 (10.7), 126.1 (17.4), 125.1 (13.6), 112.1 (30.8), 111.1 (70.5), 99.1 (18.4), 98.1 (21.5), 97.0 (35.6), 96.0 (10.8), 95.0 (11.6), 85.1 (69.3), 84.1 (7.4), 83.0 (54.9), 82.0 (21.3), 81.0 (19.3), 71.1 (43.9), 70.0 (35.6), 69.0 (56.2), 58.0 (11.1), 57.0 (100.0), 56.0 (37.9), 44.0 (13.9), 43.0 (55.5), 41.0 (30.9).
4-Метил-2-н-октил-1-додеканол (1c). 1Н NMR (CDCl3) δ 0.88 (д, 3Н, J=7.3 Гц, СН3СН), 0.904 (т, 6Н, J=7.3 Гц, CH3CH2), 0.997-1.082 (м, 1Н, CHCHHCH), 1.247-1.329 (м, 1Н, CHCHHCH), 1.053-1.445 (м, 1Н, CHHCHCH3), 1.240-1.331 (м, 1Н, CHHCHCH3), 1.161-1.474 (м, 26Н, CH2), 1.440-1.523 (м, 1Н, CHCH3), 1.503-1.596 (м, 1Н, CHCH2OH), 3.466-3.597 (м, 2Н, CH2OH). 13C NMR (CDCl3) δ 14.09 (СН3СН2), 19.98 (СН3СН), 22.68 (СН3СН2), 26.86, 27.07, 26.98, 26.66, 29.4, 29.64, 29.69, 30.02, 30.09, 30.86, 31.95 (СН2), 30.30 (СНСН3), 31.73 (СН2СНСН2ОН), 37.48 (СН2СНСН3), 37.89, 37.92 (СНСН2ОН), 38.87 (СНСН2СН), 65.68, 66.22 (СН2ОН). m/z (EI) (%): 294.3 [М-H2O] (1.40), 279.15 (1.04), 252.30 (1.44), 223.10 (1.10), 210.20 (1.09), 197.20 (2.83), 181.20 (16.14), 169.20 (4.14), 155.15 (6.83), 140.15 (15.18), 139.15 (7.87), 138.20 (7.08), 126.20 (6.54), 112.20 (13.43), 99.15 (21.53), 97.15 (37.74), 85.10 (68.44), 69.05 (66.57), 57.05 (100), 55.0 (56.36), 56.00 (44).
4-Этил-2-н-бутил-октанол-1 (2а). ЯМР 1Н (CDCl3) δ 0.86 (м, 3Н, J=7.2 Гц, CH3CH2CH), 0.88-0.97 (м, 6Н, CH3CH2), 1.11-1.17 (м, 1Н, CHHCH2CH2OH), 1.20-1.26 (м, 1Н, CHHCH2CH2OH), 1.22-1.29 (м, 2Н, CH2CHCH2), 1.22-1.37 (м, 8Н, CH3CH2CH2CH), 1.25-1.34 (м, 2Н, CH3CH2CH), 1.27-1.36 (м, 1Н, CH2CHCH2), 1.27-1.40 (м, 2Н, CHCH2), 1.49-1.59 (м, 1Н, CHCH2OH), 3.49-3.61 (м, 2Н, CH2OH). 13С ЯМР (CDCl3) δ 10.67 (СН3СН2СН), 14.10, 14.16 (СН3СН2), 23.17 (СН3СН2СН2), 26.09, 28.74, 28.99 (СН2), 31.03 (СН2СНСН2СН2), 33.09 (СН2СНСН2), 35.35 (СНСН2СН), 36.23 (СН2СНСН2), 37.99 (СНСН2ОН), 66.07 (СН2ОН). m/z (%): 196 [М-H2O]+ (0.3), 185 (0.3), 167 (2.1), 154 (1.2), 139 (6.9), 125 (5.7), 112 (14.3), 97 (20.23), 83 (36.7), 70 (51.2), 57.05 (100).
4-Этил-2-н-гексил-деканол-1 (2с) 1Н ЯМР (CDCl3) δ 0.86 (т, 3Н, J=7.3 Гц, CH3CH2CH), 0.91 (т, 6Н, J=7.1 Гц, CH3CH2CH2), 1.09-1.24 (м, 2Н, CHCH2CH), 1.20-1.47 (м, 12Н, CH2), 1.27-1.36 (м, 1Н, CH3CH2CHCH2), 1.491-1.62 (м, 1Н, CHCH2OH), 3.48-3.62 (м, 2Н, CH2OH). 13С ЯМР (CDCl3) δ 10.68 (СН3СН2СН), 14.09 (СН3СН2), 22.67 (СН3СН2), 26.43 (СН3СН2СН), 26.13, 26.71, 29.75, 29.8, 31.87, 31.94 (СН2), 31.35 (СН2СН2СНСН2ОН), 33.42 (СН2СНСН2), 35.34 (СНСН2СН), 36.3 (СНСН2СН3), 38.0 (СНСН2ОН), 66.09 (СН2ОН). m/z (EI) (%): 252 [М-H2O] (1.6), 241 (1.6), 224 (2.2), 223 (8.8), 185 (2.1), 183 (1.7), 182 (2.5), 168.1 (2.9), 167.1 (11.6), 166.1 (2), 152 (2.1), 141 (7.7), 140.1 (10.8), 139.1 (4.2), 127.1 (6.8), 126 (17.8), 125 (15.6), 124 (3.7), 113 (7.5), 112.1 (14.9), 111.1 (68.3), 110.1 (13.6), 99 (14.6), 98 (12.8), 97.1 (55), 85 (46), 84 (15), 83 (48.7), 72 (4.6), 71 (83.8), 70 (63), 69 (64.6), 57 (100), 56 (17.7), 55 (62.3).
4-Этил-2-н-октил-додеканол-1 (2d) 1Н ЯМР (CDCl3) δ 0.86-0.935 (м, 3Н, CH3CH2CH), 0.813-1.00 (м, 6Н, CH3CH2CH2), 1.19-1.41 (м, 16Н, CH2), 1.29-1.37 (м, 1Н, CH3CH2CHCH2), 1.08-1.22 (м, 2Н, CHCH2CH), 1.49-1.59 (м, 1Н, CH2CHCH2OH), 3.45-3.62 (м, 2Н, CH2OH). 13С ЯМР (CDCl3) δ 10.69 (СН3СН2СН), 14.11 (СН3СН2), 22.68 (СН3СН2СН2), 26.46 (СН3СН2СН), 26.11, 26.75, 29.35, 29.37, 29.63, 29.69, 30.11, 30.16, 31.32, 31.91, 33.40 (СН2), 35.31 (СНСН2СН), 36.27 (СН2СНСН2), 38.0 (СНСН2ОН), 66.07 (СН2ОН). m/z (EI) (%): 308 [М-H2O] (2.6), 298 (1.5), 280 (3), 279 (10), 278 (1.5), 266 (1), 211 (3), 210 (4), 209 (1), 197 (2), 196 (5), 195 (18), 194 (3), 183 (2), 182 (4), 181 (12), 180 (3), 170 (1), 169 (9), 168 (11), 167 (3), 155 (6), 154 (17), 153 (10), 152 (3), 141 (5), 140 (13), 139 (46), 138 (9), 127 (7), 126 (6), 125 (23), 124 (2), 123 (1), 114 (1), 113 (15), 112 (10), 111 (48), 110 (5), 109 (3), 100 (2), 99 (26), 98 (19), 97 (75), 96 (10), 95 (7), 86 (4), 85 (56), 84 (16), 83 (70), 82 (9), 81 (10), 72 (5), 71 (100), 70 (83), 69 (77), 68 (7), 67 (12).
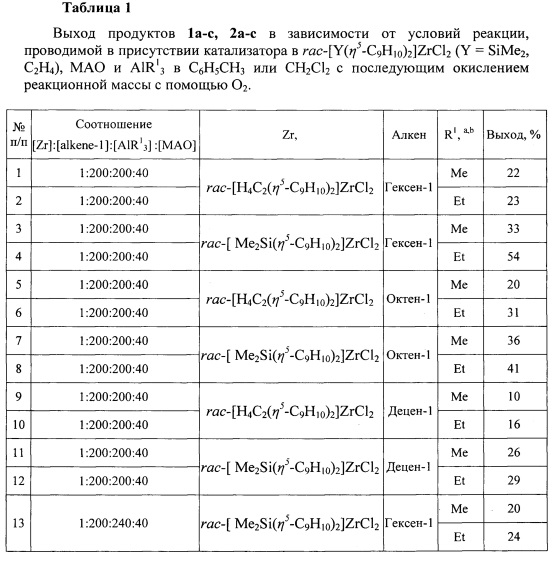
a - R1=Me, время реакции 72 часа; b - R1=Et, время реакции 24 часа.
| название | год | авторы | номер документа |
|---|---|---|---|
| Однореакторный способ получения диастереомерно чистых функционально замещенных олигомеров пропена | 2018 |
|
RU2697657C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВИНИЛИДЕНОВЫХ ДИМЕРОВ ТЕРМИНАЛЬНЫХ АЛКЕНОВ | 2021 |
|
RU2770834C1 |
| МЕТАЛЛООРГАНИЧЕСКОЕ СОЕДИНЕНИЕ ПЕРЕХОДНОГО МЕТАЛЛА, БИСЦИКЛОПЕНТАДИЕНИЛЬНАЯ ЛИГАНДНАЯ СИСТЕМА, КАТАЛИТИЧЕСКАЯ СИСТЕМА И ПОЛУЧЕНИЕ ПОЛИОЛЕФИНОВ | 2004 |
|
RU2362779C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРНО ОБОГАЩЕННОГО 1-ЭТИЛ-(3S)-ЦИКЛОГЕКСИЛАЛЮМИНАЦИКЛОПЕНТАНА | 2012 |
|
RU2536170C2 |
| АНСА-ЦИРКОНОЦЕНЫ, ФУНКЦИОНАЛИЗИРОВАННЫЕ ПО ЦИКЛОСИЛАНОВОМУ МОСТИКУ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1999 |
|
RU2160277C1 |
| Пропиленовая композиция для вспенивания с улучшенными механическими свойствами | 2020 |
|
RU2806522C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛОЦЕНОВ С МОСТИКОВЫМИ СВЯЗЯМИ | 1995 |
|
RU2161621C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРНЫХ ПРОИЗВОДНЫХ ЛАКТОНА КОРИ | 2011 |
|
RU2501793C2 |
| ПОЛУЧЕНИЕ ПОЛИОЛЕФИНОВЫХ ПРОДУКТОВ | 2015 |
|
RU2725653C1 |
| КОМПЛЕКСЫ ПЕРЕХОДНЫХ МЕТАЛЛОВ, КАТАЛИТИЧЕСКАЯ СИСТЕМА, СОДЕРЖАЩАЯ ИХ, СПОСОБ ПОЛУЧЕНИЯ ПОЛИОЛЕФИНОВ И ПОЛИОЛЕФИНОВАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2142953C1 |
Предложен способ получения диастереомерно чистых диалкилзамещенных первичных спиртов 4-метил(этил)-2-н-алкил-замещенных 1-алканолов общей формулы (1а-с, 2а-с):
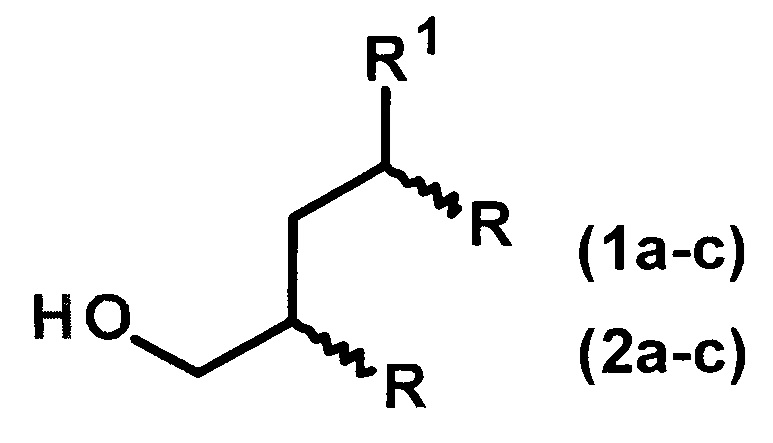
1: R1=Me, R=н-С4Н9(а), н-С6Н13(b), н-С8Н17(с);
2: R1=Et, R=н-С4Н9(а), н-С6Н13(b), н-С8Н17(с),
взаимодействием терминальных линейных алкенов с алкилирующим агентом AlR13 в присутствии катализаторов rac-[Y(η5-C9H10)2]ZrCl2 и метилалюмоксана с последующим окислением и гидролизом, согласно изобретению в качестве алкенов используют  (где R=н-C4H9, н-С6Н13, н-C8H17), в качестве алкилирующего агента используют AlR13 (где R1=Me, Et), в качестве катализаторов используют rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, C2H4), реакцию проводят при мольном соотношении [Zr] : [алкен] : [AlR13] : [MAO] = 1:200:(200-240):40, температуре 22°С и атмосферном давлении в течение 72 часов в толуоле, последующее окисление проводят сухим О2 в течение 2 ч, гидролиз осуществляют с помощью 10% раствора HCl. Технический результат - разработка однореакторного способа получения диастереомерно чистых 2-н-алкил-4-метил(этил)- замещенных 1-алканолов (1а-с, 2а-с) в реакции линейных терминальных алкенов с триалкилалюминием (AlR13, R1=Me, Et) в присутствии катализаторов rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, C2H4) с последующим окислением реакционной массы сухим O2 и гидролизом с помощью HCl. 1 табл., 12 пр.
(где R=н-C4H9, н-С6Н13, н-C8H17), в качестве алкилирующего агента используют AlR13 (где R1=Me, Et), в качестве катализаторов используют rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, C2H4), реакцию проводят при мольном соотношении [Zr] : [алкен] : [AlR13] : [MAO] = 1:200:(200-240):40, температуре 22°С и атмосферном давлении в течение 72 часов в толуоле, последующее окисление проводят сухим О2 в течение 2 ч, гидролиз осуществляют с помощью 10% раствора HCl. Технический результат - разработка однореакторного способа получения диастереомерно чистых 2-н-алкил-4-метил(этил)- замещенных 1-алканолов (1а-с, 2а-с) в реакции линейных терминальных алкенов с триалкилалюминием (AlR13, R1=Me, Et) в присутствии катализаторов rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, C2H4) с последующим окислением реакционной массы сухим O2 и гидролизом с помощью HCl. 1 табл., 12 пр.
Способ получения диастереомерно чистых диалкилзамещенных первичных спиртов 4-метил(этил)-2-н-алкил-замещенных 1-алканолов общей формулы (1а-с, 2а-с):
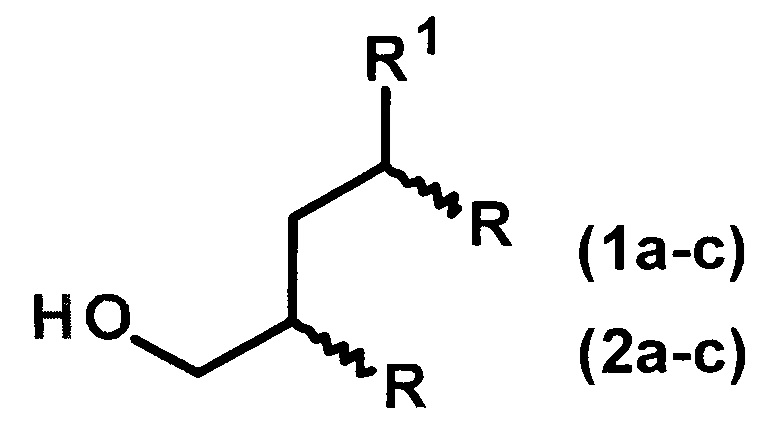
1: R1=Me, R=н-С4Н9(а), н-С6Н13(b), н-С8Н17(с);
2: R1=Et, R=н-С4Н9(а), н-С6Н13(b), н-С8Н17(с),
взаимодействием терминальных линейных алкенов с алкилирующим агентом AlR13 в присутствии катализаторов rac-[Y(η5-C9H10)2]ZrCl2 и метилалюмоксана с последующим окислением и гидролизом, отличающийся тем, что в качестве алкенов используют  (где R=н-C4H9, н-С6Н13, н-C8H17), в качестве алкилирующего агента используют AlR13 (где R1=Me, Et), в качестве катализаторов используют rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, C2H4), реакцию проводят при мольном соотношении [Zr] : [алкен] : [AlR13] : [MAO] = 1:200:(200-240):40, температуре 22°С и атмосферном давлении в течение 72 часов в толуоле, последующее окисление проводят сухим О2 в течение 2 ч, гидролиз осуществляют с помощью 10% раствора HCl.
(где R=н-C4H9, н-С6Н13, н-C8H17), в качестве алкилирующего агента используют AlR13 (где R1=Me, Et), в качестве катализаторов используют rac-[Y(η5-C9H10)2]ZrCl2 (Y=SiMe2, C2H4), реакцию проводят при мольном соотношении [Zr] : [алкен] : [AlR13] : [MAO] = 1:200:(200-240):40, температуре 22°С и атмосферном давлении в течение 72 часов в толуоле, последующее окисление проводят сухим О2 в течение 2 ч, гидролиз осуществляют с помощью 10% раствора HCl.
| СПОСОБ ПОЛУЧЕНИЯ 1-ДИЭТИЛАЛЮМИНА-2-ЭТИЛАЛКАНОВ | 2008 |
|
RU2440358C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЮМОКСАНОВ | 2014 |
|
RU2668553C2 |
| Dalton Trans., Lyudmila V | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2019-08-16—Публикация
2018-08-20—Подача