Изобретение относится к медицине и может найти применение в медицинской практике в качестве лекарственного средства, обладающего пролонгированным действием и пригодного для коррекции нарушений ритма сердечной деятельности, в том числе и ишемической природы.
2-(Диэтиламино)-N-(2,6-диметилфенил)ацетамида L-глутаминат, обладающий пролонгированной противоаритмической активностью (соединение 1), фармацевтическая композиция.
Уровень техники
Проблема профилактики и лечения аритмии и ишемической болезни сердца весьма актуальна, поскольку смертность больных от заболеваний сердечнососудистой системы, занимает первое место в мире среди летальных исходов от других болезней.
Широко применяемый в медицине противоаритмический препарат лидокаин, находится в Перечне жизненно необходимых и важнейших лекарственных средств РФ (утвержден распоряжением Правительства Российской Федерации от 7 декабря 2017 г. на 2018 г. ).
Однако известно, что лидокаин обладает существенными недостатками: короткая продолжительность действия, вызывает судороги, снижение артериального давления, кардиогенный шок, брадикардию, угнетает дыхание и др. (Энциклопедия лекарств РЛС 2017 г.; М.Д. Машковский, Лекарственные средства, М., ООО "Новая волна", 2013, с. 311-312).
Ближайшим аналогом заявляемого соединения 1 является фармацевтическая композиция с пролонгированной антиаритмической активностью, содержащая бис[2-(диэтиламино)]-N-(2,6-диметилфенил)ацетамида L-глутаминат, L-глутаминовую кислоту, 2-аминоэтансульфокислоту и вспомогательные вещества. Технический результат обеспечивает пролонгированное антиаритмическое действие и стабильность лекарственной формы (таблеток, капсул для перорального применения или раствора для инъекций), патент РФ 2538674.
Заявляемая фармацевтическая композиция на основе соединения 1 (2-(диэтиламино)-N-(2,6-диметилфенил)ацетамида L-глутаминат) отличается от аналога как фармацевтической субстанцией, так и составом вспомогательных веществ, обеспечивающих возможность промышленного производства лекарственного средства, стабильность фармацевтической композиции и физиологическую совместимость с биологическими средами.
Раскрытие изобретения.
Целью изобретения является создание пролонгированного антиаритмического средства в виде фармацевтической композиции, содержащей соединение 1 (2-(диэтиламино)-N-(2,6-диметилфенил)ацетамида L-глутаминат).
Технический результат достигается разработкой синтеза соединения 1 (фармацевтическая субстанция), выявленными новыми свойствами, а именно пролонгированным действием, увеличением широты терапевтического действия, снижением острой токсичности, созданием на основе этого соединения фармацевтической композиции и лекарственного средства.
Нами усовершенствован метод очистки 2-(диэтиламино)-N-(2,6-диметилфенил) ацетамида, при котором целевой продукт не содержит
примесь высокотоксичного 2,6-диметиланилина.
Нами предложена фармацевтическая композиция; лекарственная форма в виде раствора для инъекций.
С учетом физико-химических свойств субстанции проведены исследования по выбору вспомогательных веществ, обеспечивающих создание раствора для инъекций.
Лекарственная форма для инъекций, как правило, представляет собой водные растворы активного вещества с добавлением определенных количеств вспомогательных веществ, обеспечивающих стабильность лекарственной формы при хранении.
Общим требованием ко всем лекарственным средствам для инъекций являются:
- высокая чистота и апирогенность используемых растворителей и других жидких сред;
- высокое качество применяемых фармакопейных субстанций и вспомогательных веществ;
- стерильность;
- стабильность;
- отсутствие механических примесей.
Все лекарственные субстанции и вспомогательные вещества должны быть разрешены к медицинскому применению и удовлетворять требованиям НД.
Кислоты янтарная и гидроксиянтарная обладают антиоксидантными свойствами и способствуют стабилизации активной фармацевтической субстанции (ФС).
Магния сульфат и натрия хлорид являются электролитами и выбраны в качестве веществ для осмоляльности растворов.
Антиаритмическое действие Mg2+ обусловлено снижением возбудимости кардиомиоцитов, восстановлением ионного равновесия, стабилизацией клеточных мембран, нарушением тока Na+, медленного входящего тока Са2+ и одностороннего тока K+.
2 (Диметиламино)этанол и натрия бикарбонат обладают основными свойствами и используются для доведения рН до необходимого значения.
Пример 1
1. Очистка 2-диэтиламино-N-(2,6-диметилфенил) ацетамида (ФАД)
В трехгорлую колбу, снабженную мешалкой, термометром и обратным холодильником загружают 33,5 мл воды очищенной, добавляют 10% раствор гидроокиси натрия до рН 9. Массу перемешивают 3-5 минут и прибавляют постепенно при перемешивании 10,0 г ФАД, тщательно перемешивают при температуре 20-25°С в течение 1,5-2 часов, постоянно контролируя рН.
Осадок ФАД отфильтровывают и промывают на фильтре водой очищенной до рН промывных вод 5.0-6,0.
Осадок ФАД сушат в вакууме 30-40 мм рт.ст. при температуре 25-30°С до постоянного веса.
Очищенный ФАД анализируют на % содержание и содержание посторонних примесей, в том числе 2,6-диметиланилина.
Получают 9,46 г очищенного ФАД. Выход на стадии составляет 94,6%.
2. Синтез 2-(диэтиламино)-N-(2,6-диметилфенил)ацетамида L-глутамината (ФС)
В трехгорлую колбу, снабженную мешалкой, термометром и обратным холодильником загружают 94,6 мл воды очищенной, 9,46 г (0,0404 м) 2-(диэтиламино)-N-(2,6-диметилфенил) ацетамида и 5,945 г (0,0404 м) L-глутаминовой кислоты. Массу нагревают на водяной бане до температуры 55-60°С и перемешивают при указанной температуре в течение 30-40 мин. Водный раствор субстанции ФС фильтруют, упаривают в вакууме (30-40 мм рт.ст.) при температуре 30-35°С.
Осадок ФС сушат в вакууме 30-40 мм рт.ст. при температуре 30-35°С до постоянного веса.
Получают 13,852 г 2-(диэтиламино)-N-(2,6-диметилфенил)ацетамида L-глутамината (соединение 1). Белый или почти белый мелкокристаллический порошок без запаха. Гигроскопичен. Тпл. 179-182°С (с разложением).
Найдено, %: С 59,68; Н 8,24; N 10,78 C19H31N3O5, м.м. 381,46
Ввчислено, %: С 59,82; Н 8,19; N 11,02
ИК-спектр, ∨см-1 3260(NH), 2490(N+), 1675С=O), 1600(С=С)
ТСХ, примесь 2,6-диметиланилина отсутствует
Полученный продукт соответствует требованиям качества на фармакопейные субстанции
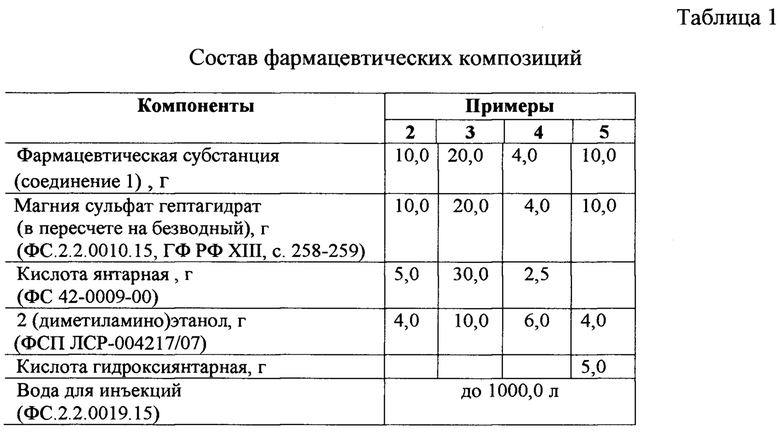
Пример 2
Получение фармацевтической композиции
В простерилизованный реактор вместимостью 1,0 л через микропористые мембраны подают воду для инъекций в количестве 800,0 мл. Затем последовательно при включенной мешалке и барботаже аргона загружают 5,0 г кислоты янтарной, 19,54 г магния сульфата гептагидрата (10,0 г безводного). Затем после полного растворения компонентов загружают 10,0 г соединения 1. Массу перемешивают в течение 10-15 мин до полного растворения субстанции. К полученному раствору при перемешивании приливают около 7,0 г 2-(диметиламино)этанола до рН 6,0.
Доводят объем полученного раствора до 1000,0 мл водой для инъекций. Раствор тщательно перемешивают в течение 5-10 минут. Отбирают пробу для определения рН и концентрации активной фармацевтической субстанции (соединения 1). Значение рН должно быть в пределах от 5,5 до 6,5, содержание соединения 1 должно быть в пределах от 9,5 мг до 10,5 мг в 1 мл раствора.
Раствор представляет собой прозрачную бесцветную жидкость, значение рН от 5,5 до 6,5, содержание соединения 1 в 1 мл препарата должно быть от 9,5 до 10,5 мг.
После стерилизующей фильтрации получают 930 мл готовой лекарственной формы.
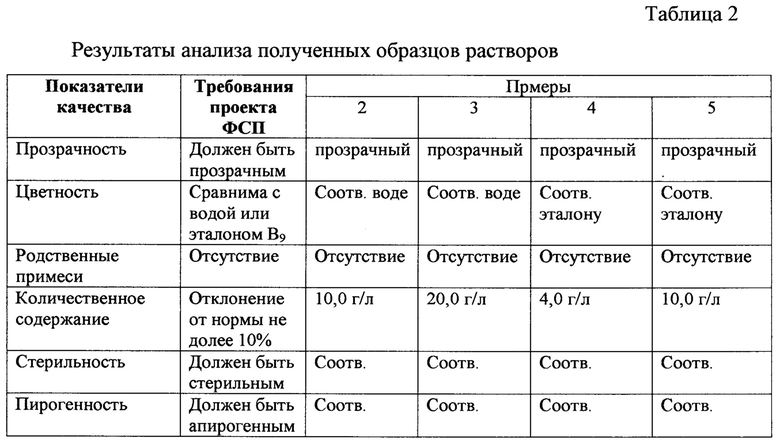
Полученный раствор по всем показателя качества соответствует требованиям ОФС «Парентеральные лекарственные средства» и ОФС «Стерильность» Госфармакопеи XIII изд.
Пример 3
Аналогично примеру 2 из 5,0 г кислоты янтарной, 20,0 г безводного магния сульфата гептагидрата, 20,0 г соединения 1, 10,0 г 2-(диметиламино)этанола и воды для инъекций получают прозрачный бесцветный раствор, значение рН от 5,5 до 6,5.
Содержание соединения 1 в 1 мл препарата должно быть от 19,0 до 21,0 мг.
Полученный раствор по всем показателя качества соответствует требованиям ОФС «Парентеральные лекарственные средства» и ОФС «Стерильность» Госфармакопеи XIII изд.
Пример 4
Аналогично примеру 2 из 2,5 г кислоты янтарной, 4,0 г безводного магния сульфата гептагидрата, 4,0 г соединения 1, 6,0 г 2-(диметиламино)этанола и воды для инъекций получают прозрачный бесцветный раствор, значение рН от 5,5 до 6,5.
Содержание соединения 1 в 1 мл препарата должно быть от 3,8 до 4,2 мг.
Полученный раствор по всем показателя качества соответствует требованиям ОФС «Парентеральные лекарственные средства» и ОФС «Стерильность» Госфармакопеи XIII изд.
Пример 5
Аналогично примеру 2 из 5,0 г кислоты гидроксиянтарной, 10,0 г безводного магния сульфата гептагидрата, 10,0 г соединения 1, 4,0 г 2-(диметиламино)этанола и воды для инъекций получают прозрачный бесцветный раствор, значение рН от 5,5 до 6,5.
Содержание соединения 1 в 1 мл препарата должно быть от 9,5 до 10,5 мг.
Полученный раствор по всем показателя качества соответствует требованиям ОФС «Парентеральные лекарственные средства» и ОФС «Стерильность» Госфармакопеи XIII изд.
Исследования фармакологической активности фармацевтической композиции общей формулы (1) представлены в нижеследующих примерах.
Пример 6.
Антиаритмическая активность соединения 1 и прототипа на модели трепетания предсердий у собак
Антиаритмическая активность соединения 1 при трепетании предсердий изучена в опытах на беспородных собаках (10 особей обоего пола весом 10-15 кг, полученных из питомника филиала «Столбовая» ФГБУН НЦБМТ ФМБА России) при внутривенном капельном введении жидкой лекарственной формы соединения 1 в общем объеме 45-50 мл со скоростью 0,015 мг/кг в минуту. Общая продолжительность инфузии не превышала 100 мин.
Нарушение ритма сердца воспроизводили у собак электроимпульсной стимуляцией миокарда предсердий прямоугольными импульсами с частотой 15-20 Гц и длительностью 5-6 мс, вызывающей формирование устойчивой фибрилляции или трепетания предсердий, по методу (Rosenblueth, A. Studies of flutter and of fibrillation. The influence of artificial obstacles on experimental auricular flutter / A. Rosenblueth, G. Ramos // A.M. Heart. J. - 1947. - Vol. 33, No 5. - P. 677-682).
Результаты исследования фармацевтических композиций на основе соединения 1, а также прототипа лидокаина гидрохлорида, представлены в табл. 3.
Из предлагаемых в таблице данных хорошо видно, что в среднем через 69 мин после начала введения фармацевтических композиций на основе соединения 1 происходило подавление частоты эктопических сокращений более, чем на 50%. Накопленная доза фармацевтических композиций на основе соединения 1 таким образом составила в среднем 1,3 мг/кг или 69,3% от высшей терапевтической дозы для собак. Средняя продолжительность действия фармацевтических композиций на основе соединения 1 составила не менее 57 мин.
Таким образом, на модели трепетания предсердий у собак фармацевтические композиции на основе соединения 1 превосходили как по силе, так и по продолжительности действия лидокаина гидрохлорид.
Пример 7
Антиаритмическая активность фармацевтических композиций на основе соединения 1 на модели желудочковой аритмии, возникающей в позднюю стадию инфаркта миокарда у собак
Антиаритмическая активность фармацевтических композиций на основе соединения 1 на модели желудочковой аритмии изучена в опытах на беспородных бодрствующих собаках (10 особей обоего пола весом 10-15 кг, полученных из питомника филиала «Столбовая» ФГБУН НЦБМТ ФМБА России) на вторые сутки после проведения операции по воспроизведению аритмии при внутривенном капельном введении жидкой лекарственной формы фармацевтических композиций на основе соединения 1 в общем объеме 45-50 мл со скоростью 0,015 мг/кг в минуту. Общая продолжительность инфузии не превышала 100 мин.
Нарушение ритма сердца воспроизводили у наркотизированных тиопентал-натрием внутриплеврально (40-45 мг/кг) собак одномоментной перевязкой нисходящей ветви левой коронарной артерии, по методу (Harris A.S. Delayed development of ventricular ectopic rhythms following experimental coronary occlusion / A.S. Harris // Circulation. - 1950. - Vol. 1, No 6. - P. 1318).
Результаты исследования фармацевтических композиций на основе соединения 1, а также прототипа лидокаина гидрохлорида, представлены в табл. 4.
Из предлагаемых в таблице данных хорошо видно, что полное прекращение аритмии и восстановление синусового ритма наблюдалось у всех животных в группе через 64 мин после начала инфузионного капельного введения фармацевтических композиций 5 собакам со скоростью введения 0,015 мг/кг в мин. Накопленная доза фармацевтических композиций на основе соединения 1 составила в среднем 1,0 мг/кг или не менее 65,3% от высшей терапевтической дозы. Длительность полного антиаритмического эффекта равнялась в среднем 124 мин.
Таким образом, накопленная эффективная доза фармацевтических композиций на основе соединения 1 была большей, чем у прототипа. В отличие от прототипа лидокаина гидрохлорида введение фармацевтических композиций на основе соединения 1 вызывало формирование более длительного эффекта.
Пример 8.
Антифибрилляторная активность фармацевтических композиций на основе соединения 1 на модели реперфузионной фибрилляции предсердий у крыс
Антифибрилляторную активность фармацевтических композиций на основе соединения 1 изучена в опытах на 30 белых нелинейных лабораторных крысах-самцах исходным весом 180-220 г, полученных из питомника лабораторных животных «Андреевка» ФГБУН НЦБМТ ФМБА России при внутривенном струйном введении жидкой лекарственной формы соединения 1 в дозах 0,9 и 4,2 мг/кг, общим объемом 0,8-1,0 мл.
Антифибрилляторную активность изучали у наркотизированных (тиопентал-натрия 45-50 мг/кг внутривенно) и переведенных на искусственную легочную вентиляцию крыс путем регистрации ЭКГ во втором стандартном отведении. Фибрилляцию желудочков вызывали ослаблением лигатуры, наложенной на левую коронарную артерию по методу, описанному в (Методические рекомендации по доклиническому изучению антиаритмических лекарственных средств П.А. Галенко-Ярошевский, Н.В. Каверина, А.Г. Камкин, А.И. Турилова, С.К. Богус, Ю.Р. Шейх-заде. - Руководство по доклиническому изучению лекарственных средств. Под ред. А.Н. Миронова. - М.: Гриф и К, 2012. - С. 385-417).
Результаты исследования представлены в таблице 5.
Введение фармацевтических композиций на основе соединения 1 в дозе 0,9 мг/кг сопровождалось возникновением эктопической активности у 3 животных из 6, составлявших опытную группу. Ни у одного животного не развилась фибрилляция желудочков. Во второй серии опытов доза фармацевтических композиций на основе соединения 1 составила 4,2 мг/кг (высшая терапевтическая доза для крыс). Ни у одной из 6 подопытных крыс не развилась желудочковая экстрасистолия, ни в одном случае фибрилляцию желудочков не регистрировалась.
Таким образом, оптимальной вводимой дозой фармацевтических композиций на основе соединения 1 можно считать 4,2 мг/кг, в которой лекарственное средство показало полный антиаритмический и антифибрилляторный эффект. В указанной дозе фармацевтические композиции на основе соединение 1 превосходят по силе эффекта прототип лидокаина гидрохлорид.
Исследования проведены в соответствии с этическими требованиями к работе с экспериментальными животными («Правила проведения работ с использованием экспериментальных животных» (приказ МЗ СССР №755 от 12.08.1987 г.), Федеральный закон «О защите животных от жестокого обращения» от 01.01.1997 г., Приказ Министерства здравоохранения Российской Федерации от 01.04.2016 г. №199н «Об утверждении правил надлежащей лабораторной практики», ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами» (введен в действие 01.07.2016 г.) и одобрены Биоэтической комиссией.
По сравнению с известным решением применение фармацевтических композиций на основе соединения 1 позволяет увеличить силу антиаритмического и антифибрилляторного эффекта при формировании ишемических, реперфузионных и электроимпульсных нарушений ритма у собак и крыс, а также повысить продолжительность фармакологического действия.
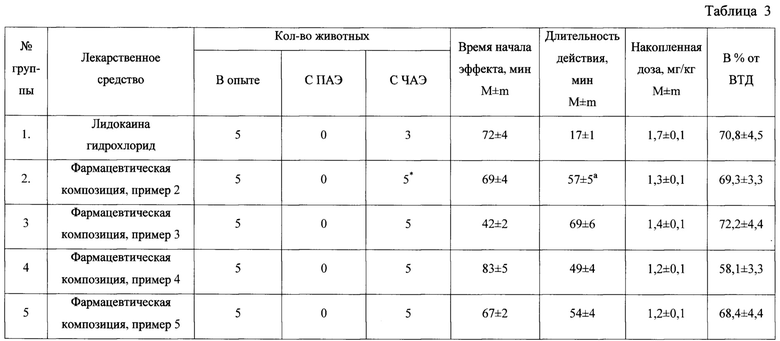
Примечание: * - различия при сравнении с группой «Лидокаина гидрохлорид» статистически значимы при р<0,05 (точный критерий Фишера); а - различия при сравнении с группой «Лидокаина гидрохлорид» статистически значимы при р<0,05 (одномерный дисперсионный анализ, критерий Даннета); ПАЭ - полный антиаритмический эффект; ЧАЭ - частичный антиаритмический эффект; ВТД - высшая терапевтическая доза
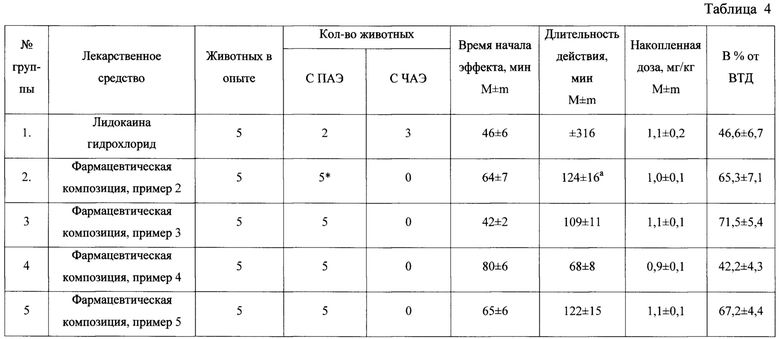
Примечание: * - различия при сравнении с группой «Лидокаина гидрохлорид» статистически значимы при р<0,05 (точный критерий Фишера); а - различия при сравнении с группой «Лидокаина гидрохлорид» статистически значимы при р<0,05 (одномерный дисперсионный анализ, критерий Даннета); ПАЭ - полный антиаритмический эффект; ЧАЭ - частичный антиаритмический эффект; ВТД - высшая терапевтическая доза
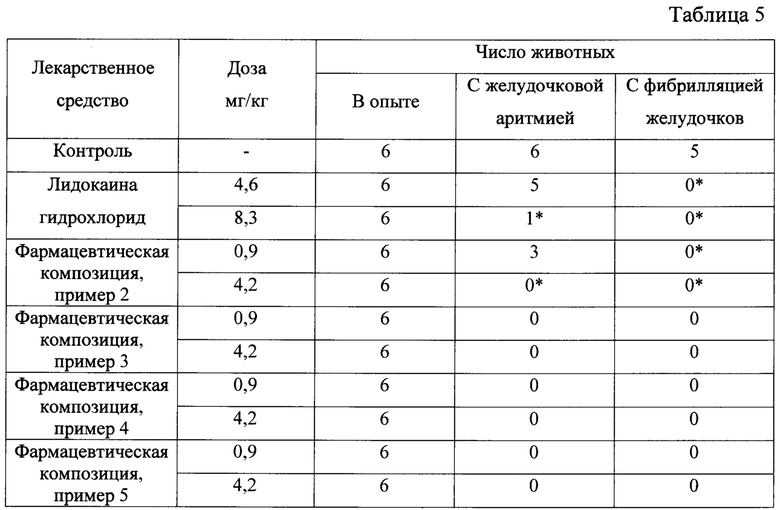
Примечание: * - различия при сравнении с контролем достоверны при р<0,05 (точный критерий Фишера)
| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтическая композиция, обладающая антиаритмической активностью различной этиологии | 2021 |
|
RU2783944C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОЛОНГИРОВАННОЙ ПРОТИВОАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2538674C2 |
| Способ получения производного 2,6-диметилфенилацетамида, обладающего церебропротекторной активностью | 2018 |
|
RU2690506C1 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНОГО ЛИДОКАИНА, ОБЛАДАЮЩЕГО МЕСТНОАНЕСТЕЗИРУЮЩЕЙ АКТИВНОСТЬЮ, ДЛЯ ТЕРМИНАЛЬНОЙ АНЕСТЕЗИИ | 2016 |
|
RU2628811C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАРИТМИЧЕСКИМ, АНТИФИБРИЛЛЯТОРНЫМ, ПРОТИВОИШЕМИЧЕСКИМ ДЕЙСТВИЕМ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2011 |
|
RU2477130C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАРИТМИЧЕСКИМ ДЕЙСТВИЕМ | 2019 |
|
RU2700263C1 |
| Производные 2-аминохроменов проявляющие противоопухолевую активность. Фармацевтические композиции | 2018 |
|
RU2704262C1 |
| ДИЦИКЛОГЕКСИЛАМИДЫ N-ЗАМЕЩЕННЫХ α-АМИНОКАРБОНОВЫХ КИСЛОТ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКОЙ И АНТИФИБРИЛЛЯТОРНОЙ АКТИВНОСТЬЮ | 1994 |
|
RU2114821C1 |
| ГИДРОХЛОРИД N-1-[(4-ФТОРФЕНИЛ)-2-(1-ЭТИЛ-4-ПИПЕРИДИЛ)-ЭТИЛ]-4-НИТРОБЕНЗАМИД, ПРОЯВЛЯЮЩИЙ АНТИАРИТМИЧЕСКУЮ И АНТИФИБРИЛЛЯТОРНУЮ АКТИВНОСТЬ | 2009 |
|
RU2415128C2 |
| ВВОДИМЫЕ ВАГИНАЛЬНО АНТИАРИТМИЧЕСКИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ТАЗОВОЙ БОЛИ | 2002 |
|
RU2345758C2 |
Изобретение относится к медицине и касается фармацевтической композиции на основе 2-(диэтиламино)-N-(2,6-диметилфенил)ацетамида L-глутамината, обладающая пролонгированной противоаритмической активностью. Фармацевтическая композиция содержит в качестве вспомогательных веществ магния сульфат, кислоту янтарную или гидроксиянтарную, 2-(диметиламино)этанол и воду. Изобретение позволяет увеличить силу антиаритмического и антифибрилляторного эффекта при формировании ишемических, реперфузионных и электроимпульсных нарушений ритма у собак и крыс, а также повысить продолжительность фармакологического действия. 5 табл., 8 пр.
Фармацевтическая композиция на основе 2-(диэтиламино)-N-(2,6-диметилфенил)ацетамида L-глутамината, обладающая пролонгированной противоаритмической активностью, содержащая в качестве вспомогательных веществ магния сульфат, кислоту янтарную или гидроксиянтарную, 2-(диметиламино)этанол и воду.
| ПРОИЗВОДНЫЕ 2-ДИЭТИЛАМИНО-2',6'-ДИМЕТИЛФЕНИЛАЦЕТАМИДА, ПРОЯВЛЯЮЩИЕ АНТИАРИТМИЧЕСКУЮ АКТИВНОСТЬ | 2002 |
|
RU2223263C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОЛОНГИРОВАННОЙ ПРОТИВОАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2538674C2 |
| WO 2012085683 A1, 28.06.2012 | |||
| М.Д | |||
| МАШКОВСКИЙ | |||
| Лекарственные средства | |||
| В двух частях | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| М., Медицина, 1993, с.376-379. | |||
Авторы
Даты
2019-08-19—Публикация
2018-05-23—Подача