Изобретение относится к области медицины, где может найти применение в медицинской практике для местной анестезии, в том числе терминальной анестезии в офтальмологической практике, и может быть использовано для создания перспективного лекарственного средства для терминальной местной анестезии.
Известно соединение 2-(диэтиламино)-N-(2,6-диметилфенил) ацетамид под названием лидокаин, проявляющий местноанестезирующее действие при терминальной и проводниковой анестезии (Strother A., Soong S.L., Dev V., Sadri М. Structure activity relationship of lidocaine type local anesthetics // Life Sciences. - 1977. - Vol. 21. - Issue 1. - P. 71-81).
Недостатками известного решения являются его высокая токсичность, небольшая продолжительность действия и сравнительно низкая эффективность, а также малая широта терапевтического действия лидокаина.
Технический результат заключается в уменьшении острой токсичности, увеличении широты терапевтического действия, а также увеличении глубины и продолжительности терминальной местной анестезии при применении производного лидокаина - N-ацетил-L-глутамината 2-диэтиламино-21,61-диметилфенилацетамида.
Сущность изобретения заключается в применении производного лидокаина - N-ацетил-L-глутамината 2-диэтиламино-21,61-диметилфенилацетамида общей формулы (1)
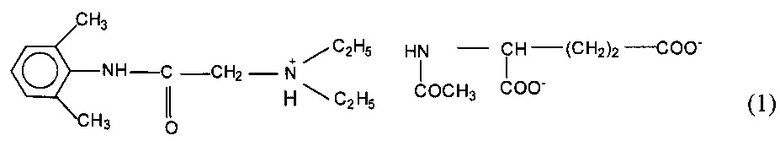
обладающего местноанестезирующей активностью, для терминальной анестезии.
В литературе не описаны фармацевтические композиции, готовые лекарственные формы, содержащие производное лидокаина общей формулы (1).
Способ получения производного лидокаина общей формулы (1) заключается в следующем. Осуществляют модификацию лидокаина путем замещения анионного фрагмента остатком N-ацетил-L-глутаминовой кислоты.
Исследования фармакологической активности производного лидокаина общей формулы (1) представлены в нижеследующих примерах.
Пример 1. Острая токсичность производного лидокаина общей формулы (1)
Острая токсичность производного лидокаина общей формулы (1) изучена в опытах на белых беспородных мышах (200 особей обоего пола весом 19-22 г, полученных из питомника филиала «Столбовая» ФГБУН НЦБМТ ФМБА) при подкожном введении водных растворов производного лидокаина общей формулы (1) и лидокаина (прототип) в объеме 0,8-1,0 мл в возрастающих концентрациях.
Показатель среднелетальной дозы (ЛД50) рассчитывали методом Личфилда-Уилкоксона (Арзамасцев Е.В., Березовская И.В., Верстакова О.В. и др. Методические рекомендации по изучению общетоксического действия лекарственных средств. / Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. - М.: Гриф и К, 2012. - С. 25-35).
Результаты исследования острой токсичности при подкожном введении мышам представлены в табл. 1. Из представленных в табл. 1 данных хорошо видно, что предлагаемое соединение менее токсично, нежели лидокаин (прототип), при подкожном введении.
Таким образом, в отличие от прототипа, производное лидокаина общей формулы (1) отличается меньшей токсичностью при подкожном способе введения мышам.
Пример 2. Местноанестезирующая активность производного лидокаина общей формулы (1) на модели терминальной анестезии роговицы глаза кролика
Экспериментальная модель воспроизводилась у ненаркотизированных половозрелых кроликов-самцов массой 2,0-3,4 кг (24 особи), полученных из питомника филиала «Электрогорский» ФГБУН НЦБМТ ФМБА. Изучение местноанестезирующей активности производного лидокаина общей формулы (1) и лидокаина (прототип) у животных проводили по методу Regnier (Игнатов Ю.И., Волчков В.А., Галенко-Ярошевский П.А. и др. Методические рекомендации по изучению местноанестезирующей активности лекарственных средств. / Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. - М.: Гриф и К, 2012. - С. 334-363).
Результаты исследования местноанестезирующей активности приведены в табл. 2.
Введение производного лидокаина общей формулы (1) в конъюнктивальный мешок глаза кролика в растворе в концентрациях 0,5-1,0-2,0% позволило подавить болевую чувствительность в среднем на 29,6-50,1-57,1 мин соответственно. Глубина местноанестезирующего эффекта, измеряемая по величине индекса Ренье, превышала соответствующий показатель прототипа во всех опытных группах.
Данная модель позволяет судить о широте терапевтического действия (ШТД) производного лидокаина общей формулы (1). О ШТД судили по величине индекса, определяемого как отношение ЛД50 при подкожном способе введения к 30%-ной эффективной концентрации (ЭК30) на модели анестезии. ЭК30 рассчитывали при анализе кривых линейной регрессии, построенных по значениям концентраций и индексов Ренье (Гланц С. Медико-биологическая статистика. - М.: Практика, 1998. - С. 221-227). Как видно из табл. 2, показатель ШТД производного лидокаина общей формулы (1) превышает соответствующий показатель прототипа.
Таким образом, по глубине и длительности местноанестезирующего эффекта, а также по широте терапевтического действия производное лидокаина общей формулы (1) превосходит прототип.
Пример 3. Местнораздражающий эффект производного лидокаина общей формулы (1)
Местнораздражающее действие определяли по методу Setnicar (Ю.И. Игнатов Ю.И., Волчков В.А., Галенко-Ярошевский П.А. и др. Методические рекомендации по изучению местноанестезирующей активности лекарственных средств. / Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. - М.: Гриф и К, 2012. - С. 334-363). Опыты ставили на половозрелых ненаркотизированных кроликах-самцах массой 2,0-3,4 кг (24 особи), полученных из питомника филиала «Электрогорский» ФГБУН НЦБМТ ФМБА. В конъюнктивальный мешок закапывали 2-3 капли раствора производного лидокаина общей формулы (1) или прототипа в концентрациях 0,5% - 1,0% - 2,0%.
Результаты исследований, фиксируемые в баллах, на модели по Setnicar, представлены в табл. 3.
Проведенный эксперимент показывает, что производное лидокаина общей формулы (1), подобно прототипу, не вызывает местного раздражающего действия на мягкие ткани глаза кролика при введении в диапазоне концентраций от 0,5 до 2,0%, следовательно, производное лидокаина общей формулы (1) не оказывает местнораздражающего действия.
Исследования проведены в соответствии с этическими требованиями к работе с экспериментальными животными («Правила проведения работ с использованием экспериментальных животных» (приказ МЗ СССР №755 от 12.08.1987 г.), Федеральный закон «О защите животных от жестокого обращения» от 01.01.1997 г., «Об утверждении правил лабораторной практики» (приказ МЗ РФ от 19.06.2003 г. №267)) и одобрены локальным этическим комитетом.
По сравнению с известным решением применение производного лидокаина - N-ацетил-L-глутамината 2-диэтиламино-21,61-диметилфенилацетамида позволяет уменьшить острую токсичность, увеличить широту терапевтического действия, а также увеличить глубину и продолжительность терминальной местной анестезии, не оказывая при этом местнораздражающего действия.

Примечание: * - различия статистически достоверны (р=0,018, одномерный дисперсионный анализ, критерий t Стьюдента).
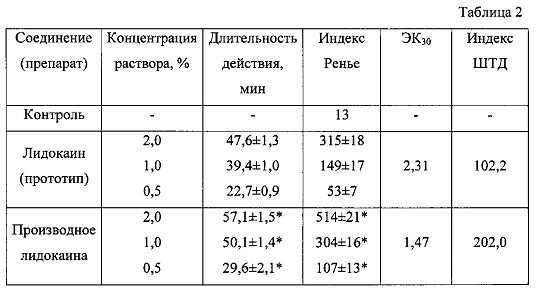
Примечание: * - различия при сравнении с лидокаином в сопоставимых концентрациях достоверны при р<0,05 (одномерный дисперсионный анализ, критерий Тьюки).
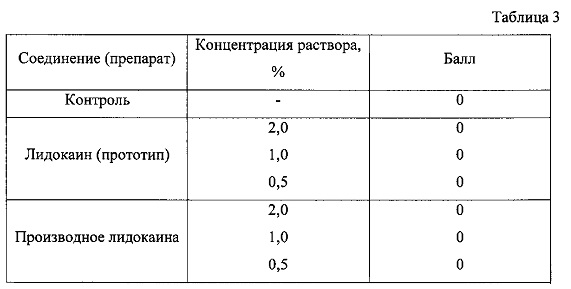
Примечание: 0 баллов - нет видимых изменений; 1 балл - гиперемия конъюнктивы и края век, мигательной перепонки в пределах 30 мин, смыкание век не более чем на 5-10 мин после введения вещества; 2 балла - гиперемия конъюнктивы век, мигательной перепонки, каря век, склеры и инфильтрация (уплотнение) тканей век в течение 30-300 мин; 3 балла - гиперемия конъюнктивы век, мигательной перепонки края век, склеры и инфильтрация, длящиеся более 300 мин.
| название | год | авторы | номер документа |
|---|---|---|---|
| Применение производного 2,6-диметилфенилацетамида, обладающего местноанестезирующей активностью, для инфильтрационной и проводниковой анестезии | 2017 |
|
RU2657613C1 |
| Способ получения производного 2,6-диметилфенилацетамида, обладающего церебропротекторной активностью | 2018 |
|
RU2690506C1 |
| Фармацевтическая композиция, обладающая антиаритмической активностью различной этиологии | 2021 |
|
RU2783944C1 |
| 2-(Диэтиламино)-N-(2,6-диметилфенил)ацетамида L-глутаминат, обладающий пролонгированной противоаритмической активностью, фармацевтическая композиция | 2018 |
|
RU2697717C1 |
| ДИГИДРОХЛОРИД 1-(2-ТРЕТ-БУТИЛАМИНОЭТИЛ)-2-ТРЕТ-БУТИЛИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160263C1 |
| БРОМИСТОВОДОРОДНАЯ СОЛЬ 4-ОКСИ-3[N-(ФЕНАЦИЛ)БЕНЗИЛАМИНО- N - БЕНЗИЛБУТАНАМИДА, ПРОЯВЛЯЮЩАЯ МЕСТНО-АНЕСТЕЗИРУЮЩУЮ АКТИВНОСТЬ | 1989 |
|
SU1713242A1 |
| ГЕМИГЛУТАРАТ 3-БЕНЗИЛАМИНО-4-ОКСИ-N-БЕНЗИЛБУТАНАМИДА, ПРОЯВЛЯЮЩИЙ МЕСТНО-АНЕСТЕЗИРУЮЩУЮ АКТИВНОСТЬ | 1989 |
|
SU1663928A1 |
| ПРОИЗВОДНЫЕ 2-ДИЭТИЛАМИНО-2',6'-ДИМЕТИЛФЕНИЛАЦЕТАМИДА, ПРОЯВЛЯЮЩИЕ АНТИАРИТМИЧЕСКУЮ АКТИВНОСТЬ | 2002 |
|
RU2223263C1 |
| ДИГИДРОХЛОРИД 2-ТРЕТБУТИЛ-1-(3-ДИЭТИЛАМИНОПРОПИЛ)ИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ И АНТИАРИТМИЧЕСКИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160262C1 |
| ДИГИДРОХЛОРИД 1-(2-ДИЭТИЛАМИНОЭТИЛ)-2-ФЕНИЛИМИДАЗО[1,2-А]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2006 |
|
RU2314312C1 |
Изобретение относится к медицине и может быть использовано для применения производного лидокаина - N-ацетил-L-глутамината 2-диэтиламино-21,61-диметилфенилацетамида общей формулы (1)
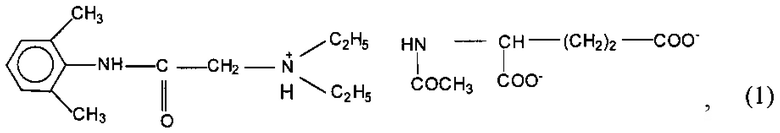
обладающего местноанестезирующей активностью, для терминальной анестезии. Изобретение позволяет уменьшить острую токсичность, увеличить широту терапевтического действия, увеличить глубину и продолжительность терминальной местной анестезии без местнораздражающего действия по сравнению с лидокаином. 3 табл., 3 пр.
Применение производного лидокаина - N-ацетил-L-глутамината 2-диэтиламино-21,61-диметилфенилацетамида общей формулы (1)
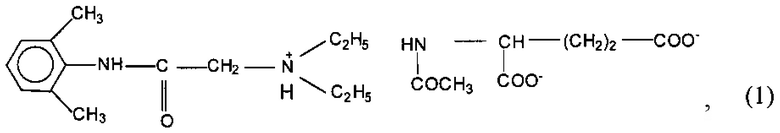
обладающего местноанестезирующей активностью, для терминальной анестезии.
| ПРОИЗВОДНЫЕ 2-ДИЭТИЛАМИНО-2',6'-ДИМЕТИЛФЕНИЛАЦЕТАМИДА, ПРОЯВЛЯЮЩИЕ АНТИАРИТМИЧЕСКУЮ АКТИВНОСТЬ | 2002 |
|
RU2223263C1 |
| WO 2009054916 A2, 30.04.2009 | |||
| КОРЯЧКИН В.А.и др., Местная анестезия, Санкт-Петербург, Издательство СПбГМУ, 2008, С.1-12 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ВЫШКОВСКИЙ Г.Л | |||
| под ред., Регистр лекарственных средств, 16-й выпуск, М., "РЛС-2008", 2007, С.494-495. | |||
Авторы
Даты
2017-08-22—Публикация
2016-08-01—Подача