Вспомогательный плазмидный лентивирусный экспрессионный вектор для получения высоких титров Vpx-содержащих вирусных частиц, обеспечивающий эффективное заражение моноцитов и дендритных клеток человека
Изобретение относится к области биотехнологии и может быть использовано в терапии онкологических заболеваний.
Дендритные клетки играют ключевую роль в регуляции приобретенного иммунитета, обеспечивая эффективную защиту организма против множества инфекций и различных патологий. Основная функция дендритных клеток заключается в поглощении чужеродных антигенов, их процессирование и презентация антигенных детерминант эффекторным клеткам иммунной системы. В контексте онкологических заболеваний дендритные клетки являются крайне перспективными терапевтическими агентами, благодаря возможности презентации специфических опухолевых антигенов и активации противоопухолевого ответа в организме пациента.
В виду низкого содержания дендритных клеток в крови человека, стандартная схема приготовления дендритно-клеточных вакцин предполагает дифференцировку моноцитов периферической крови пациента в дендритные клетки под воздействием набора цитокинов. В дальнейшем полученные подобным образом дендритные клетки нагружаются очищенным препаратом специфического опухолевого антигена или тотальным лизатом опухолевых клеток. Наиболее оптимальным способом загрузки опухолевых антигенов является трансдукция дендритных клеток антиген-содержащими вирусными векторами, обеспечивающими высокоэффективную презентацию антигенов молекулами главного комплекса гистосовместимости первого класса (MHCI). Как правило, для трансдукции используют лентивирусные векторы на основе вируса иммунодефицита человека 1 типа HIV1, которые позволяют интегрировать целевую последовательность в геномную ДНК клетки, тем самым обеспечивая постоянный и стабильный уровень экспрессии антигена.
В уровне техники раскрыты различные конструкции лентивирусных векторов.
Известен рекомбинантный лентивирусный вектор, содержащий: (а) экспрессионную кассету, содержащую трансген, расположенный под контролем промотора, который обладает активностью в отношении стимуляции выявляемой транскрипции трансгена в человеческих клетках человека; и (b) центральный полипуриновый тракт (сРРТ), расположенный выше экспрессирующей кассеты. Элементом посттранскрипционной регуляции является элемент посттранскрипционной регуляции вируса гепатита североамериканского лесного сурка (WRPE) или элемент посттранскрипционной регуляции вируса гепатита В (HPRE). Промотор может представлять собой EF1-α. Трансген например представляет собой gp91-phox, gp47-phox, эритропоэтин, интерлейкин, колониестимулирующий фактор, интегрин α11bβ, ген множественной лекарственной резистентности, противовирусный ген, ген, кодирующий фактор свертывания крови VIII, ген, кодирующий фактор свертывания крови IX, Т-клеточный рецептор антигена, В-клеточный рецептор антигена, одноцепочечное антитело (ScFv), TNF, гамма-интерферон, CTLA4, В4, Melana, MAGE, маркерный ген, люциферазу или GFP (патент RU 2305708).
Известен способ индуцирования иммунного ответа против антигена у субъекта путем введения субъекту, терапевтически эффективного количества дендритной клетки или ее предшественника, который трансдуцируется псевдотипированным лентивирусным вектором, содержащим нуклеиновую кислоту, кодирующую полипептид, который экспрессируется в указанной дендритной клетке и представлен на поверхности дендритной клетки, так что после введения субъекту иммунный ответ индуцируется против антигена у субъекта. Описан вектор, который содержит белок оболочки из вируса, отличный от лентивируса, и геном лентивируса, кодирующий продукты гена env и nef; и, по меньшей мере, три вспомогательных белковых генных продукта, например, нефункциональные vif, vpr и vpu (международная заявка WO 0116342 (А1)).
Однако применение лентивирусных векторов для создания дендритно-клеточных вакцин ограничено низкой эффективностью трансдукции дендритных клеток. Низкая эффективность трансдукции обусловлена экспрессией в дендритных клетках белка SAMHD1, специфической фосфогидролазы, которая расщепляет нуклеотиды (dNTPs) до неорганического фосфата и нуклеозида, снижая тем самым пул dNTPs и препятствуя обратной транскрипции вирусного генома. Кроме того, SAMHD1 обладает нуклеазной активностью и приводит к деградации вирусной РНК, снижая вероятность интеграции целевой последовательности до минимума. Для многократного увеличения уровня трансдукции дендритных клеток может быть использован метод создания лентивирусных вирионов, ассоциированных с белком Vpx. Vpx - вирион - ассоциированный белок - характерен для вируса иммунодефицита человека 2 типа (HIV-2) и большинства вирусов иммунодефицита обезьян (SIV), однако отсутствует в HIV-1. Попадая в клетку, Vpx взаимодействует с SAMHD1 и направляет его на путь протеасомной деградации, тем самым позволяя вирусу реплицироваться и встраиваться в геном клетки-хозяина.
В уровне техники имеется ряд решений, где используется последовательность Vpx.
Известна композиция, содержащая псевдотипированные лентивирусные векторные частицы, содержащие (а) белок Vpx или Vpr-белок, который сохраняет активность, ингибирующую SAMHDI, (b) экзогенный полинуклеотид, кодирующий антиген, и (с) множество гликопротеинов оболочки, которые предпочтительно связывают клетки, экспрессирующие DC-SIGN, где ген лентивирусного вектора получен из ВИЧ-1. Ген лентивирусного вектора имеет инактивированный 3'-длинный концевой повтор (LTR) или самоиннактивирующий 3'-длинный концевой повтор (LTR), элемент U3, в котором отсутствует, по меньшей мере, одна из энхансерной последовательности, блок TATA, сайт Spl, сайт NK-kappa В или полипуриновый тракт (РРТ), нуклеотидную последовательность SEQ ID NO: 21, 22 или 23. Дополнительно может содержаться нуклеотидная последовательность, кодирующая дендритную клетку (заявка ЕА 201491813 (А1)).
В качестве наиболее близкого аналога (прототипа) может быть указан лентивирусный вектор который может быть использован для получения вирионов/вирусов, которые проявляют повышенную инфекционность по отношению к макрофагам, полученным из моноцитов (MDM) и дендритным клеткам (MDDC). Лентивирус сконструирован с р6 химерными пакетами gag-pol Vpx и заражает MDDC. (US 9149519 (В2), опубл. 2015-10-06).
Технической задачей изобретения является создание вспомогательного лентивирусного вектора, позволяющего получать вирусные частицы с высоким содержанием молекул белка Vpx.
Задача решается разработанным универсальным плазмидным экспрессионным лентивирусным вектором, кодирующим последовательность гена Vpx, содержащую С-концевой HIV-1 gag/pol мотив и FLAG последовательность, и объединенную с последовательностью гена трансактиваторного белка Rev через специфическую последовательность Т2А, обеспечивающую расщепление слитых белков во время процесса трансляции мРНК трансгена; также включающим ряд регуляторных элементов: RSV промотор/энхансер (rous sarcoma virus), NES (nuclear export signal)-сигнал экспорта из ядра в цитоплазму, MCS (multiple cloning site).
Изобретение иллюстрируют следующие графические материалы:
Фиг. 1. Схема основных элементов коммерческой лентивирусной плазмиды pRSV-Rev.
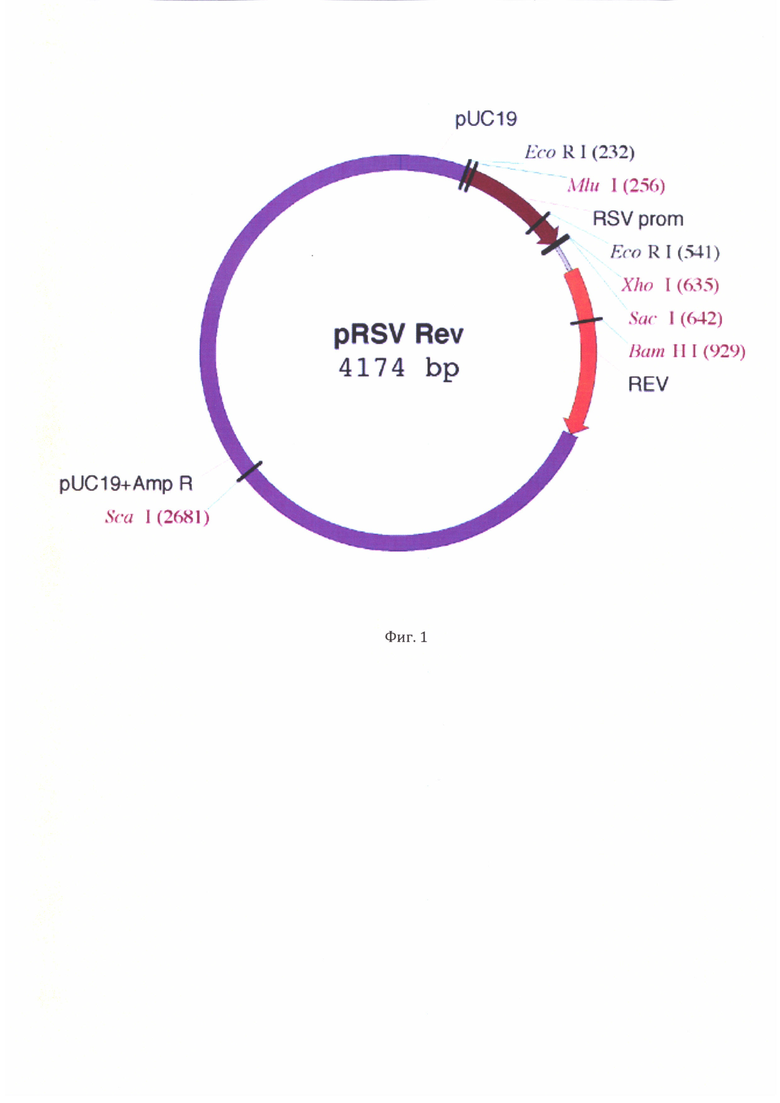
Фиг. 2. Карта вспомогательного вектора pRSV-Rev-T2A-Vpx, кодирующего белок Vpx.
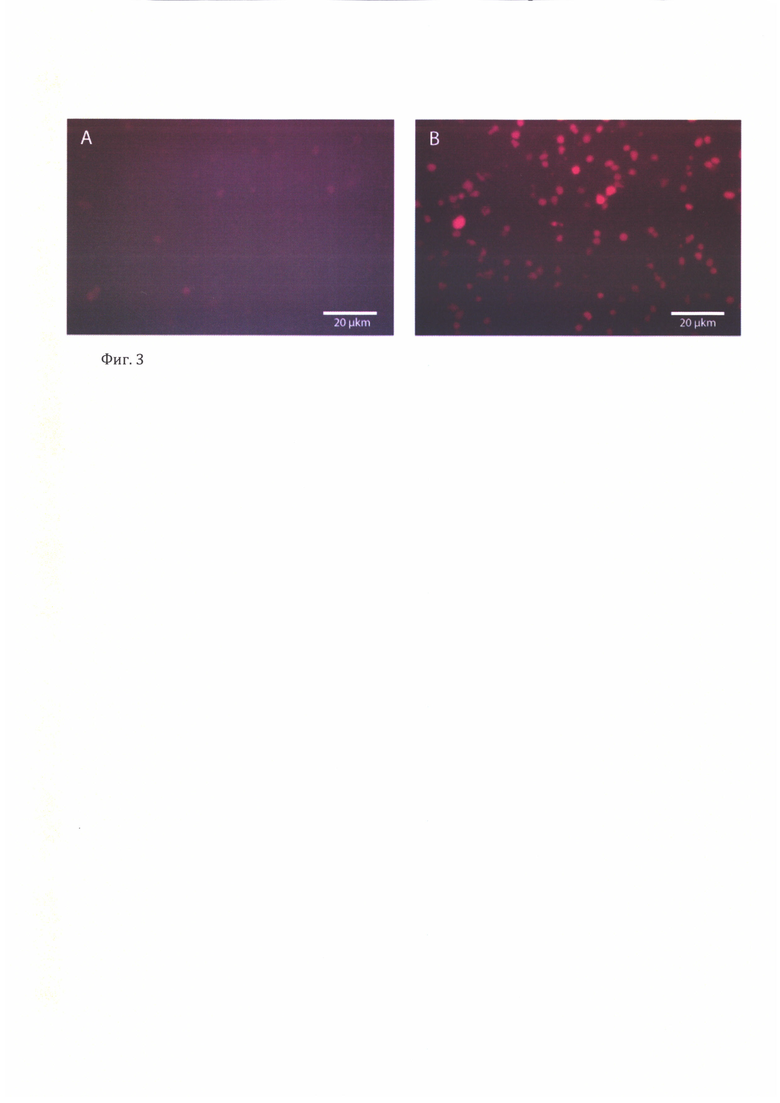
Фиг. 3. Микрофотография дендритных клеток, зараженных вирусом EF1alpha-tagRFP-NP-puro.
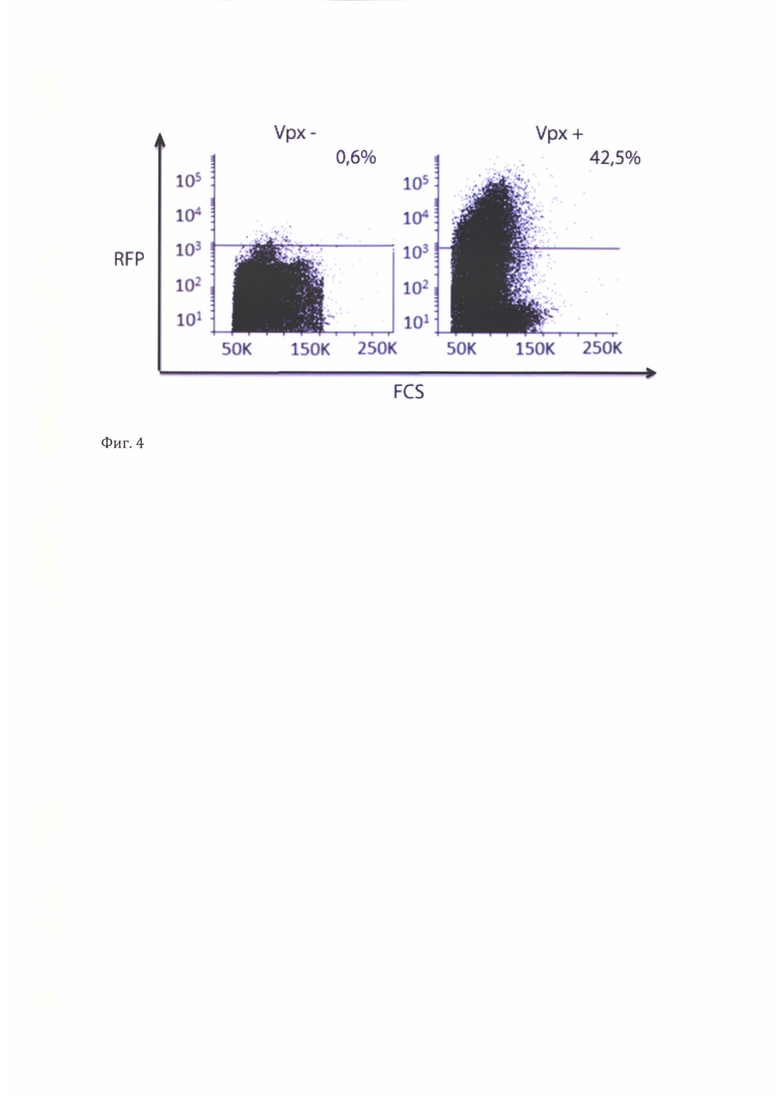
Фиг. 4. Цитометрический анализ количества дендритных клеток, экспрессирующих последовательность гена RFP в составе вируса.
Технический результат, обеспечиваемый изобретением: многократное повышение эффективности трансдукции стабильной экспрессии последовательности целевого антигена в дендритных клетках человека, способных экспрессировать различные генетические конструкции. Изобретение иллюстрируют следующие примеры:
Пример 1. Получение вспомогательного лентивирусного вектора, кодирующего последовательность гена Vpx.
При создании заявленной конструкции производят модификацию коммерческой лентивирусной упаковочной плазмиды pRSV-Rev (Addgene), исходная структура которой приведена на фиг. 1.
Модификация заключается в переклонировании последовательности трансактиваторного белка Rev таким образом, чтобы С-концевой регион данного белка содержал последовательность "self cleaving" Т2А пептида и дополнительный рестрикционный сайт XbaI. Для этого сначала производят амплификацию последовательности Rev с праймерами Rev (прямой праймер) и Rev-T2A (обратный 1]. В качестве матрицы используют коммерческую плазмиду pRSV-Rev. Затем с амплифицированного фрагмента снова производят амплификацию Rev, но в последовательность праймера ранее закладывают последовательности Т2А и сайтов рестрикции XbaI и BglII. Далее производят рестрикцию коммерческой плазмиды pRSV-Rev и конечного амплифицированного фрагмента по сайтам XhoI и BglII. Рестрицированный вектор и фрагмент лигируют.
Последовательность гена Vpx амплифицируют и клонируют по сайтам BglII и XbaI в модифицированную плазмиду pRSV-Rev. Для увеличения эффективности упаковки белка Vpx в капсид вируса в последовательность прямого праймера вводят последовательность HIV-1 gag/pol упаковочного мотива. Кроме того, для идентификации упаковки белка Vpx в капсид лентивирусных частиц, в С-концевую область амплифицированной последовательности Vpx помещают последовательность FLAG эпитопа.

Нуклеотидные последовательности элементов, встроенных в pRSV-Rev:
- Последовательность Т2А пептида 5'-ATGGCCTTACCAGTGACCGCCTTGCTCCTGCCGCTGGCCTTGCTGCTCCACGCCGCCAGGCCG-3' SEQ ID №1
- Последовательность рестрикционного сайта XbaI 5'-TCTAGA-3'
SEQ ID №2
- Последовательность Vpx
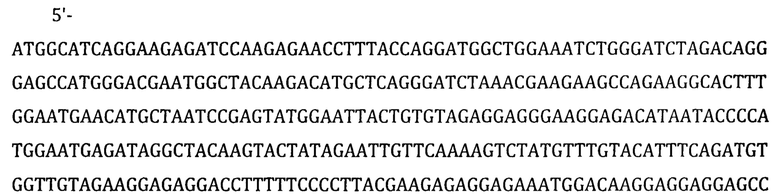
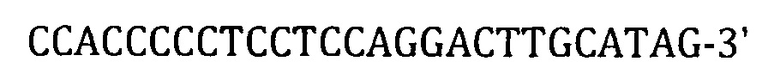
SEQ ID №3
- Последовательность FLAG 5'-GACTACAAAGACGATGACGACAAG-3' SEQ ID №4
Нуклеотидную последовательность созданной генетической конструкции верифицируют методом секвенирования по Сэнгеру. Итогом работы стала генетическая конструкция pRSV-Rev-T2A-Vpx, структура которой представлена на фиг. 2.
Пример 2. Структура вспомогательного лентивирусного вектора, кодирующего последовательность гена Vpx.
В состав заявленного вектора входит ряд базовых и регуляторных элементов, обеспечивающих полноценное функционирование вектора:
- RSV промотор/энхансер (rous sarcoma virus) - последовательность, обеспечивающая стабильную экспрессию во многих эукариотических клетках.
- NES (nuclear export signal) - короткая последовательность, способствующая экспорту белка из клеточного ядра в цитоплазму через ядерный поровый комплекс.
- Rev - регуляторная последовательность, обеспечивающая транспортировку молекулы вирусной мРНК из ядра в цитоплазму, где происходит ее экспрессия.
- Т2А - последовательность, обеспечивающая расщепление слитых белков во время процесса трансляции мРНК трансгена. В заявленной генетической конструкции обеспечивает расщепление белков Rev и Vpx.
- HIV-1 gag/pol - последовательность, способствующая интеграции белка в состав вирусной частицы. В описываемой конструкции обеспечивает интеграцию белка Vpx.
- FLAG - последовательность, позволяющая идентифицировать белок, с которым она конъюгирована. В заявленном векторе FLAG слит с Vpx.
- Vpx - вирион - ассоциированный белок, характерный для вируса иммунодефицита человека 2 типа (HIV-2) и большинства вирусов иммунодефицита обезьян (SIV). Направляет белок SAMHD1 на путь протеасомной деградации, повышая таким образом эффективность репликации вирусов в дендритных клетках.
Пример 3. Анализ эффективности наработки вирусных частиц в дендритных клетках человека, трансфицированных лентивирусом, содержащим белок Vpx.
Для анализа эффективности трансдукции дендритных клеток Vpx-содержащим вирусом клеточная линия НЕК293Т котрансфецируют лентивирусным вектором pLenti-EF1alpha-tagRFP-NP-puro и упаковочными вспомогательными плазмидами pVSV-G, pMDLg/pRRE, pRSV-Rev-T2A-Vpx. В результате получают лентивирусный препарат, содержащий белок Vpx, инфекционный титр которого оценивался путем подсчета количества инфицированных (трансдуцированных) вирусным вектором клеток в популяции при использовании фиксированного объема вирусного препарата. Для сравнительной оценки получают вирусные частицы, в составе которых Vpx отсутствует. Содержание белка Vpx в составе вирионов верифицируют методом вестерн-блота окраской на FLAG пептид, который слит с С-концевым доменом Vpx.
Дендритные клетки, полученные в результате дифференцировки моноцитов, разделяют на 2 группы и инфицируют Vpx+ (содержащими Vpx) или Vpx- (не содержащими Vpx) вирусными частицами. Анализ экспрессии флуоресцентного белка RFP (red fluorescent protein) в составе вирусной кассеты проводят через 48 часов после инфекции методом проточной цитометрии и флуоресцентной микроскопии (фиг. 3, 4). В результате инфекции, 42,5% популяции дендритных клеток, зараженных Vpx+ лентивирусными частицами, экспрессировали флуоресцентный белок RFP (фиг. 4), в то время как для Vpx- дендритных клеток процент трансдукции составил всего 0.6. БОльшая эффективность трансдукции целевой клеточной культуры, выражающаяся в большем проценте трансдуцированных клеток, указывает на повышенный инфекционный титр лентивирусного препарата (при прочих равных условиях).
Полученные результаты свидетельствуют о высокой эффективности трансдукции дендритных клеток вирусными частицами, содержащими в своем составе Vpx белок, интегрированный в генетический материал вируса при помощи разработанного вспомогательного лентивирусного вектора pRSV-Rev-T2A-Vpx. Данный вектор может использоваться для получения дендритных клеток, способных экспрессировать различные генетические конструкции, что является важным условием для усиления иммунотерапевтического потенциала дендритно-клеточных вакцин.
Изобретение относится к области биотехнологии и может быть использовано в терапии онкологических заболеваний. Описан универсальный вспомогательный плазмидный экспрессионный лентивирусный вектор для получения высоких титров вирусных частиц, содержащих ген Vpx, включающий в качестве базовых элементов, обеспечивающих функционирование вектора, последовательность вирион-ассоциированного белка Vpx, содержащую С-концевой HIV-1 gag/pol мотив и FLAG последовательность и объединенную с последовательностью гена трансактиваторного белка Rev через специфическую последовательность Т2А, обеспечивающую расщепление слитых белков во время процесса трансляции мРНК трансгена; в качестве регуляторных элементов- RSVпромотор/энхансер [rous sarcoma virus) и NES (nuclear export signal)- сигнал экспорта из ядра в цитоплазму. 4 ил., 1 табл., 3 пр.
Вспомогательный плазмидный лентивирусный экспрессионный вектор, предназначенный для эффективного заражения моноцитов и дендритных клеток человека, кодирующий последовательность гена Vpx, включающий в качестве базовых элементов, обеспечивающих функционирование вектора, последовательность вирион-ассоциированного белка Vpx, содержащую С-концевой HIV-1 gag/pol мотив и FLAG последовательность и объединенный с последовательностью гена трансактиваторного белка Rev через специфическую последовательность Т2А, обеспечивающую расщепление слитых белков во время процесса трансляции мРНК трансгена; в качестве регуляторных элементов - RSV промотор/энхансер (rous sarcoma virus) и NES (nuclear export signal) - сигнал экспорта из ядра в цитоплазму.
| Thomas D | |||
| Norton and Elizabeth A | |||
| Miller, Recent Advances in Lentiviral vaccines for Hiv-1 infection.Frontiers in Immunology, Volume 7, Article 243, 21 June 2016.doi: 10.3389/fimmu.2016.00243 | |||
| Сорокин А.В | |||
| и др | |||
| Ядерно-цитоплазматический транспорт белков | |||
| Успехи биологической химии, т.47, 2007, с.89-128 | |||
| Trichas G | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Иванов А.С | |||
| и др | |||
| Технологии белковой интерактомики.; НИИ биомедицинской химии им | |||
| В.Н | |||
| Ореховича РАМН, 2011 г | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
Авторы
Даты
2019-08-19—Публикация
2017-12-28—Подача